Виды, Составы и Как приготовить
Без электролитов невозможна работа перезаряжаемых источников электроэнергии. Существует несколько основных типов таких веществ, которые наиболее часто используются в современных устройствах этого типа. О том, какие существуют виды электролитов, а также каким образом можно приготовить смесь для заливки в аккумуляторную батарею, будет подробно рассказано в этой статье.
Содрежание
- Что такое электролит и для чего он нужен
- Виды электролита
- Кислотный электролит
- Щелочной электролит
- Корректирующий электролит
- Какой электролит в какой аккумулятор заливается
Что такое электролит и для чего он нужен
Электролит представляет собой кислотный или щелочной раствор, который принимает участие в химической реакции. Во время зарядки батареи, плотность токопроводящей жидкости повышается, поэтому по этому параметру можно довольно точно судить о степени заряженности аккумулятора.
Важно не только наличие токопроводящей жидкости в батарее, но также и качество смеси. Если приготовление раствора серной кислоты или щёлочи с водой производилось с нарушением технологии, то аккумулятор будет работать нестабильно либо полностью выйдет из строя в течение непродолжительного времени.
Если приготовление раствора серной кислоты или щёлочи с водой производилось с нарушением технологии, то аккумулятор будет работать нестабильно либо полностью выйдет из строя в течение непродолжительного времени.
Виды электролита
Электролиты бывают двух основных видов:
- Кислотный.
- Щелочной.
Кислотные смеси с дистиллированной водой применяются в основном в аккумуляторах, применяемых для запуска двигателя автомобиля. Такие вещества можно приобрести в специализированных магазинах либо приготовить самостоятельно. На заводе такие смеси делают по ГОСТу, в домашних условиях также можно довольно точно соблюсти необходимые пропорции при смешивании кислоты с водой.
Щелочная смесь может быть приготовлена с использованием различных активных веществ, но наиболее часто применяется кальциево-литиевая основа, которая разводится необходимым количеством дистиллированной воды.
Кислотный электролит
Кислотную токопроводящую жидкость можно готовить самому из концентрированной серной кислоты.
Состав. В состав кислотного электролита входят два вещества:
- Кислота.
- Дистиллированная вода.
В качестве основного вещества чаще используется серная кислота, которая практически не имеет запаха, не испаряется при комнатной температуре. По электропроводимости и другим важнейшим характеристикам этот элемент также наиболее подходит для заливки в свинцовые аккумуляторные батареи.
Особенности химических свойств. Основной характеристикой кислотного аккумулятора является его плотность. Этот параметр может существенно отличаться в зависимости от степени заряженности батареи, но не должен быть ниже 1,26 и выше 1,30 г/мм3.
Температура замерзания аккумуляторной жидкости напрямую зависит от её плотности, но если этот показатель опустится ниже минус 75 градусов Цельсия, то токопроводящая жидкость даже в полностью заряженном аккумуляторе превратится в лёд.
Серная кислота является едким веществом, поэтому при работе с этим веществом, следует использовать индивидуальные средства защиты.
Применение. Кислотный электролит применяется, в основном, в свинцовых аккумуляторах. Такие источники тока используются в качестве стартерных батарей в легковом и грузовом транспорте.
Как приготовить. Чтобы приготовить самостоятельно потребуется следующие материалы и инструменты:
- Устойчивую к воздействую кислоты посуду и лопатку для помешивания раствора.
- Дистиллированную воду.
- Аккумуляторную серную кислоту.
Перед выполнением работы следует позаботиться о безопасности. Чтобы защититься от возможного негативного воздействия необходимо подготовить:
- Защитные очки.
- Устойчивый к кислоте фартук.
- Резиновые перчатки.
- Соду для нейтрализации действия кислоты.
Процесс приготовления осуществляется в такой последовательности:
- В ёмкость наливают необходимое количество воды.
- Тонкой струйкой добавляют концентрированную кислоту.
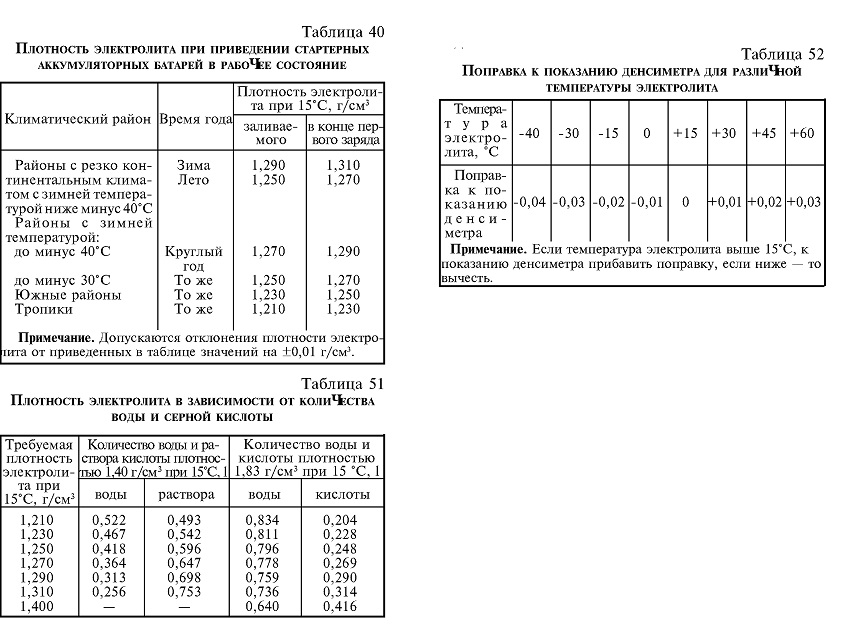
- Перемешать стеклянной или пластиковой лопаткой получившийся раствор.
- Дать отстояться смеси в течение 12 часов.
Для приготовления 1 литра смеси необходимой плотности потребуется 0,781 л воды и 0,285 л серной кислоты.
Щелочной электролит
Щелочной электролит имеет свои преимущества и недостатки, но такой состав также широко используется в качестве токопроводящей жидкости в портативных источниках питания.
Состав. В состав аккумуляторного электролита щелочного типа могут использоваться едкий калий или едкий натрий. Для улучшения эксплуатационных характеристик к щелочной основе добавляют также литиевые соединения. Для придания смеси текучести её разбавляют дистиллированной водой.
Особенности химических свойств. Все щелочные аккумуляторные жидкости – это сильные основания, которые активны по отношению к многим металлам и кислотам.
В результате химических реакций с кислотами образуются соль и вода. Растворы щелочей также подвергаются гидролизу. Перечисленные химические свойства позволяют использовать этот тип электропроводящей жидкости для накопления электроэнергии в аккумуляторе.
Растворы щелочей также подвергаются гидролизу. Перечисленные химические свойства позволяют использовать этот тип электропроводящей жидкости для накопления электроэнергии в аккумуляторе.
Применение. Применение щелочных растворов сводится в основном к заправке аккумуляторных батарей. Такие источники электрического тока используются в различных приборах, электропогрузчиках, а также в качестве стартерных батарей для военных машин.
Как приготовить. Чтобы приготовить следует придерживаться определённых правил. Прежде всего, необходима вместительная посуда, изготовленная из устойчивого к щелочи материала. Процесс приготовления следующий:
- В ёмкость заливается необходимое количество дистиллированной воды.
- В жидкость аккуратно всыпается сухая щёлочь. Затем смесь помешивают с помощью пластмассовой лопатки.
- Производится анализ плотности. При необходимости добавить сухую смесь или воду.
- Отстаивается раствор в течение 3 часов.

- Переливается электролит в другую ёмкость, стараясь не допустить поднятия осадка со дна ёмкости.
Если вся работа была произведена по инструкции, то можно получить качественный электролит, который заливают затем в аккумуляторы подходящего типа.
Корректирующий электролит
В процессе эксплуатации обслуживаемых аккумуляторов в банки может быть случайно добавлено слишком большое количество дистиллированной воды, что приведёт к падению плотности токопроводящей жидкости ниже допустимого уровня.
Решается эта проблема приготовлением и заливкой корректирующего электролита повышенной плотности.
Состав. Состав корректирующего раствора не отличается от основного электролита. Например, дли свинцово кислотных АКБ необходимо также развести серную кислоту в дистиллированной воде, но пропорции будет немного отличаться (для получения 1 литра электролита необходимо придерживаться соотношения 0,650 л воды и 0,423 кислоты).
Особенности химических свойств. Химические свойства корректирующего электролита практически не отличаются от основной токопроводящей жидкости. Физические параметры могут незначительно отличаться (более низкая температура замерзания).
Химические свойства корректирующего электролита практически не отличаются от основной токопроводящей жидкости. Физические параметры могут незначительно отличаться (более низкая температура замерзания).
Применение. Единственное применение корректирующего электролита – это восстановление оптимальной концентрации кислоты или щёлочи внутри банок аккумулятора.
Как приготовить. Для приготовления корректирующего состава необходимо разбавить чистое основное вещество в дистиллированной воде, но добавлять его необходимо немного больше, чем при производстве обычного электролита.
Последовательность операции также не отличается от стандартной схемы работы с едкими веществами для приготовления токопроводящей жидкости для аккумулятора.
Какой электролит в какой аккумулятор заливается
Если залить в аккумулятор неподходящий электролит, то АКБ будет полностью выведена из строя. Тип аккумулятора, как правило, указан на корпусе изделия, поэтому совершенно несложно установить принадлежность источника питания к определённой категории.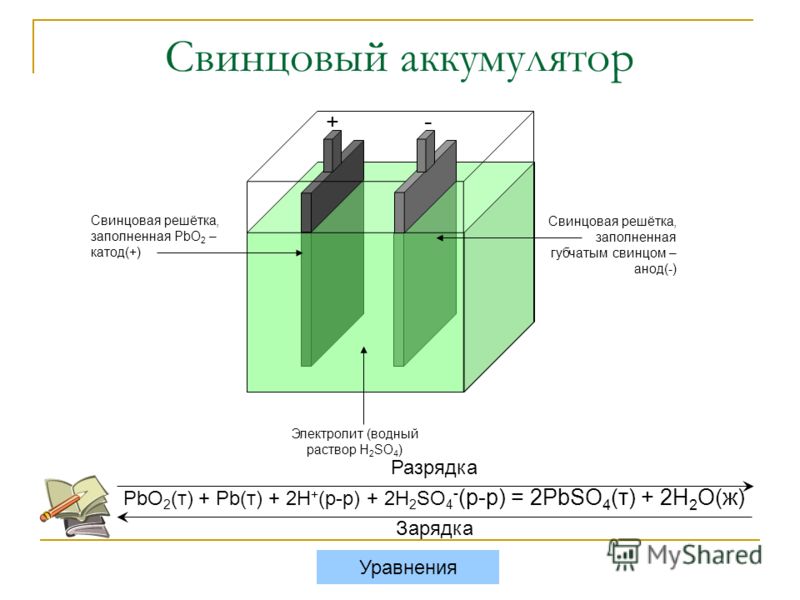
Если этикетка отсутствует, то можно взять небольшое количество электролита и с помощью тестов определить его состав. В свинцово-кислотные аккумуляторы заливаются электролиты на основе серной кислоты. Для щелочных источников питания можно использовать растворы KOH и NaOH.
При добавлении электролита в щелочные устройства следует также точно определить химическую формулу применяемого основания. Отличить одну щёлочь от другой можно по цвету пламени. Если добавить в костёр KOH то цвет огня изменится на красно-фиолетовый, NaOH – горит жёлтым свечением.
Остались вопросы или есть что добавить? Тогда напишите нам об этом в комментариях, это позволит сделает материал более полным и точным.
что это такое, химический состав, как приготовить
Время на чтение: 3 мин
3136
Электролит – это специальная смесь, которая заливается в аккумуляторы. Это один из необходимых компонентов для работы батареи.
О существующих видах химического раствора и о способе приготовления этой жидкости мы расскажем вам здесь.
Что из себя представляет электролит и зачем его использовать
Это жидкость на основе кислоты или щелочи. Работает она как проводник тока. При повышении уровня заряда АКБ плотность жидкости повышается.
Химический раствор должен быть качественным, сделанным без отступлений от технологии изготовления. В противном случае заряд аккумулятора не произойдет.
Какие виды химической жидкости существуют
Поскольку электролит – это смесь либо на основе кислоты либо щелочи, то видов этой смеси два: щелочная и кислотная.
Кислотная – симбиоз кислоты и дистиллированной воды. Аккумуляторы с этим типом электролита нужны, чтобы запустить двигатель.
В щелочном типе жидкости применяется смесь кальциево-литиевой основы и дистиллированной воды.
Такие смеси служат для накапливания электричества в АКБ. Область применения этих батарей – электроприборы, автопогрузчики, военная автотехника.
Способ приготовления кислотного раствора
Потребуется следующее:
- Емкость и шпатель для смешивания, способные противостоять к разъеданию кислотами.

- Очищенная (дистиллированная) вода.
- Серная кислота для аккумулятора.
- Защитная одежда (фартук, очки, перчатки).
- Сода (нейтрализатор кислоты).
Как готовим:
- В посуду наливаем нужное количество воды и аккуратно и медленно вливаем в воду кислоту.
- Перемешиваем шпателем.
- Оставляем на отстаивание не менее полусуток. На литр смеси берем 0,75 воды и 0,285 кислоты.
Готовим щелочной раствор
Нам понадобится посуда, устойчивая к химическим щелочным реакциям, щелочь (едкий калий или едкий натрий), можно добавлять литиевые вещества для улучшения качества раствора, вода.
Важно! Воду добавляем полностью очищенную, т.е. дистиллированную!
Способ приготовления:
- В посуду наливаем дистиллированную воду.
- Высыпаем щелочь и тщательно размешиваем. Если плотность неудовлетворительная, то добавляем щелочь или жидкость.
- Настаиваем три часа.

- Переливаем полученную жидкость в другой сосуд, не поднимая осадка.
Электролит с повышенной плотностью
Он может понадобиться нам для коррекции плотности находящегося в аккумуляторе. В случае если вы добавили в банки батареи много воды и плотность химической смеси упала, можно откорректировать ее с помощью электролита с большей плотностью.
Для приготовления немного меняем пропорции щелочи (кислоты) и воды (0,423 к-ты на 0,650 воды). Очередность действий такая же, как и при изготовлении основного раствора.
Химические свойства электролита такие же, но температура замерзания ниже. Смесь используется только для корректировки основного электролита.
Для каких аккумуляторов используют разные типы химической жидкости?
Чтобы не ошибиться, следует изучить этикетку на аккумуляторе. Если батарея свинцово-кислотного типа, то используем кислотную смесь.
Если батарея свинцово-кислотного типа, то используем кислотную смесь.
В щелочные батареи наливаем раствор на основе калиевого или натриевого вещества. Тип щелочи можно узнать по горению. Калий горит фиолетово-красным, а натрий — желтым огнем.
Итак, если вдруг возникнет необходимость самостоятельно приготовить электролит для аккумулятора, то, в принципе, это возможно. Следует соблюдать технику безопасности и быть внимательным к пропорциям веществ — и все обязательно получится.
Идентификация компонентов межфазного слоя твердого электролита в литий-ионных батареях
Винтер, М., Барнетт, Б. и Сюй, К. Перед ионно-литиевыми батареями. Хим. Ред. 118 , 11433–11456 (2018 г.).
Артикул КАС Google ученый
Язами Р. и Тузен П. Реверсивный графит-литиевый отрицательный электрод для электрохимических генераторов. Дж. Источники питания 9 , 365–371 (1983).
Источники питания 9 , 365–371 (1983).
Артикул КАС Google ученый
Перссон, К. и др. Диффузия лития в графитовом углероде. J. Phys. хим. лат.
1 , 1176–1180 (2010).Артикул КАС Google ученый
Перссон, К., Хинума, Ю., Менг, Ю.С., Ван дер Вен, А. и Седер, Г. Термодинамические и кинетические свойства литий-графитовой системы на основе расчетов из первых принципов. Физ. B 82 , 125416 (2010).
Артикул Google ученый
Гуденаф, Дж. Б. и Ким, Ю. Проблемы литиевых перезаряжаемых аккумуляторов. Хим. Матер. 22 , 587–603 (2010).
Артикул КАС Google ученый
Сюй, К. Электролиты и промежуточные фазы в литий-ионных батареях и не только. Хим. Откр. 114 , 11503–11618 (2014).
Хим. Откр. 114 , 11503–11618 (2014).
Артикул КАС Google ученый
Верма, П., Мэйр, П. и Новак, П. Обзор особенностей и анализ межфазной фазы твердого электролита в литий-ионных батареях. Электрохим. Acta 55 , 6332–6341 (2010).
Артикул КАС Google ученый
Дан, Дж. Р., Чжэн, Т., Лю, Ю. и Сюэ, Дж. Механизмы введения лития в углеродистые материалы. Наука 270 , 590 (1995).
Артикул КАС Google ученый
Леви, М. Д. и Аурбах, Д. Механизм интеркаляции лития в графитовые пленочные электроды в апротонной среде. Часть 1. Циклические вольтамперометрические исследования и моделирование с медленным сканированием высокого разрешения. Дж. Электроанал. хим. 421 , 79–88 (1997).
Артикул КАС Google ученый
Аурбах Д., Марковский Б., Шехтер А., Эйн-Эли Ю. и Коэн Х. Сравнительное исследование электродов из синтетического графита и лития в растворах электролитов на основе смесей этиленкарбонат-диметилкарбонат . Дж. Электрохим. соц. 143 , 3809–3820 (1996).
Артикул КАС Google ученый
Чжан Х., Костецкий Р., Ричардсон Т.Дж., Пью Дж.К. и Росс П.Н. Электрохимические и инфракрасные исследования восстановления органических карбонатов. Дж. Электрохим. соц. 148 , A1341–A1345 (2001 г.).
Артикул КАС Google ученый
Пелед Э. Электрохимическое поведение щелочных и щелочноземельных металлов в неводных аккумуляторных системах — межфазная модель твердого электролита.
 Электрохим. соц. 126 , 2047–2051 (1979).
Электрохим. соц. 126 , 2047–2051 (1979).Артикул КАС Google ученый
Фонг Р., Фон Сакен У. и Дан Дж. Р. Исследования интеркаляции лития в углерод с использованием неводных электрохимических элементов. Дж. Электрохим. соц. 137 , 2009–2013 (1990).
Артикул КАС Google ученый
Ни, М. и др. Граница твердого электролита графита литий-ионного аккумулятора, выявленная микроскопией и спектроскопией. J. Phys. хим. C 117 , 1257–1267 (2013).
Артикул КАС Google ученый
Аурбах, Д. и др. Исследование растворов электролитов на основе этилен- и диэтилкарбонатов для литиевых аккумуляторов. II. Графитовые электроды. Дж. Электрохим. соц. 142 , 2882–2890 (1995).
Артикул КАС Google ученый
Винтер, М., Новак, П. и Моннье, А. Графиты для литий-ионных элементов: корреляция потери заряда в первом цикле с площадью поверхности Брунауэра-Эммета-Теллера. Дж. Электрохим. соц. 145 , 428–436 (1998).
Артикул КАС Google ученый
Винтер, М. Межфазная фаза твердого электролита — наиболее важный и наименее изученный твердый электролит в перезаряжаемых литиевых батареях. З. Физ. хим. 223 , 1395–1406 (2009).
Артикул КАС Google ученый
Эдстрем, К., Херстедт, М. и Абрахам, Д. П. Новый взгляд на межфазный слой твердого электролита на графитовых анодах в литий-ионных батареях. J. Power Sources 153 , 380–384 (2006).
Артикул Google ученый
Yoshida, T. et al. Механизм деградации и прогнозирование срока службы литий-ионных аккумуляторов. Дж. Электрохим. соц. 153 , А576–А582 (2006 г.).
Дж. Электрохим. соц. 153 , А576–А582 (2006 г.).
Артикул КАС Google ученый
Мальмгрен, С. и др. Сравнение состава и морфологии поверхности раздела электрод/электролит анода и катода с использованием фотоэлектронной спектроскопии мягкого и жесткого рентгеновского излучения. Электрохим. Acta 97 , 23–32 (2013).
Артикул КАС Google ученый
Лу, П., Ли, К., Шнайдер, Э. У. и Харрис, С. Дж. Химия, импеданс и эволюция морфологии в межфазных пленках твердого электролита при формировании в литий-ионных батареях. J. Phys. хим. C 118 , 896–903 (2014).
Артикул КАС Google ученый
Zhuo, Z. et al. Дыхание и колебательный рост межфазной границы твердое тело–электролит при электрохимическом циклировании. Хим. коммун. 54 , 814–817 (2018).
Хим. коммун. 54 , 814–817 (2018).
Артикул КАС Google ученый
Ши, С. и др. Прямой расчет транспорта ионов лития в межфазной среде твердого электролита. Дж. Ам. хим. соц. 134 , 15476–15487 (2012).
Артикул КАС Google ученый
Чжуан Г. В. и Росс П. Н. Анализ химического состава пассивной пленки на анодах литий-ионных аккумуляторов с использованием инфракрасной спектроскопии нарушенного полного отражения. Электрохим. Твердотельное письмо. 6 , А136–А139 (2003 г.).
Артикул КАС Google ученый
Мейер, Б. М., Лейфер, Н., Сакамото, С., Гринбаум, С. Г. и Грей, С. П. Исследование многоядерного ЯМР в сильном поле слоя SEI в литиевых перезаряжаемых батареях. Электрохим. Твердотельное письмо. 8 , А145–А148 (2005 г.).
8 , А145–А148 (2005 г.).
Артикул КАС Google ученый
Аурбах Д. и Гофер Ю. Поведение литиевых электродов в смесях алкилкарбонатов и эфиров. Дж. Электрохим. соц. 138 , 3529–3536 (1991).
Артикул КАС Google ученый
Augustsson, A. et al. Исследование межфазного слоя твердого электролита на графитовых анодах литий-ионных аккумуляторов методом мягкой рентгеновской спектроскопии. Физ. хим. хим. физ. 6 , 4185–4189 (2004).
Артикул КАС Google ученый
Zhuang, G.V., Xu, K., Yang, H., Jow, T.R. & Ross, P.N. Литий-этилендикарбонат, идентифицированный как первичный продукт химического и электрохимического восстановления EC в 1,2 M LiPF 6 /EC: Электролит ЭМС. J. Phys. хим. B 109 , 17567–17573 (2005 г.).
хим. B 109 , 17567–17573 (2005 г.).
Артикул КАС Google ученый
Чжуан, Г. В., Ян, Х., Близанак, Б. и Росс, П. Н. Исследование электрохимического восстановления этиленовых и пропиленкарбонатных электролитов на графите с использованием НПВО-ИК-спектроскопии. Электрохим. Твердотельное письмо. 8 , А441–А445 (2005 г.).
Артикул КАС Google ученый
Шкроб И. А., Чжу Ю., Марин Т. В. и Абрахам Д. Восстановление карбонатных электролитов и формирование границы твердого электролита (SEI) в литий-ионных батареях. 2. Радиолитически индуцированная полимеризация этиленкарбоната. J. Phys. хим. C 117 , 19270–19279 (2013 г.).
Артикул КАС Google ученый
Tsubouchi, S. et al. Спектроскопическая характеристика поверхностных пленок, сформированных на графите с плоской кромкой в электролитах на основе этиленкарбоната, содержащих пленкообразующие добавки. Дж. Электрохим. соц. 159 , A1786–A1790 (2012 г.).
Дж. Электрохим. соц. 159 , A1786–A1790 (2012 г.).
Артикул КАС Google ученый
Ота Х., Саката Ю., Ван Х., Сасахара Дж. и Ясукава Э. Характеристика литиевого электрода в имидах лития/этиленкарбонате и электролитах на основе циклического эфира II. Химия поверхности. Дж. Электрохим. соц. 151 , А437–А446 (2004 г.).
Артикул КАС Google ученый
Кан, С.-Х., Абрахам, Д., Сяо, А. и Лучт, Б. Исследование межфазной фазы твердого электролита с использованием графитовых электродов без связующего вещества. J. Power Sources 175 , 526–532 (2008).
Артикул КАС Google ученый
Лю, П. и Ву, Х. Создание и разрушение пассивирующего слоя на Li x C 6 в органических электролитах: исследование импеданса. J. Power Sources 56 , 81–85 (1995).
J. Power Sources 56 , 81–85 (1995).
Артикул КАС Google ученый
Xu, K. & von Wald Cresce, A. Li + -сольватация/десольватация диктует межфазные процессы на графитовом аноде в ионно-литиевых элементах. Дж. Матер. Рез. 27 , 2327–2341 (2012).
Артикул КАС Google ученый
фон Вальд Креше, А., Бородин, О. и Сюй, К. Корреляция структуры сольватной оболочки Li + с межфазной химией на графите. J. Phys. хим. С 116 , 26111–26117 (2012).
Артикул Google ученый
Аурбах Д., Дару М., Фаги П. и Йегер Э. Идентификация поверхностных пленок, образованных на литии в растворах пропиленкарбоната. Дж. Электрохим. соц. 134 , 1611–1620 (1987).
Артикул КАС Google ученый
Ши, Ф. и др. Каталитический путь восстановления электролита в литий-ионных элементах, обнаруженный in situ с помощью инфракрасной спектроскопии с ослабленным полным отражением и Фурье-преобразованием. Дж. Ам. хим. соц. 137 , 3181–3184 (2015).
Артикул КАС Google ученый
Жиро Л., Гружон С., Ларуэль С., Пилар С. и Тараскон Ж.-М. Идентификация продуктов разложения электролита литиевой батареи путем прямого синтеза и определения характеристик алкилкарбонатных солей. Дж. Электрохим. соц. 152 , А850–А857 (2005 г.).
Артикул КАС Google ученый
Мичан, А. Л., Лескес, М. и Грей, С. П. Зависимое от напряжения межфазное образование твердого электролита в кремниевых электродах: мониторинг образования продуктов органического разложения. Хим. Матер. 28 , 385–398 (2015).
Артикул Google ученый
Сюй, К. и др. Синтез и характеристика алкилмоно- и дикарбонатов лития как компонентов поверхностных пленок литий-ионных аккумуляторов. J. Phys. хим. B 110 , 7708–7719 (2006 г.).
Артикул КАС Google ученый
Сео, Д. М. и др. Реакции восстановления карбонатных растворителей для литий-ионных аккумуляторов. ЭКС Электрохим. лат. 3 , А91–А93 (2014).
Артикул КАС Google ученый
Камая Н. и др. Литиевый суперионный проводник. Нац. Матер. 10 , 682 (2011).
Артикул КАС Google ученый
Хань Ф., Гао Т., Чжу Ю., Гаскелл К. Дж. и Ван К. Аккумулятор из одного материала. Доп. Матер. 27 , 3473–3483 (2015).
Доп. Матер. 27 , 3473–3483 (2015).
Артикул КАС Google ученый
Кнаут, П. Неорганические твердые литий-ионные проводники: обзор. Твердотельный ион. 180 , 911–916 (2009).
Артикул КАС Google ученый
Гурусиддаппа Дж., Мадхури В., Суварна Р.П. и Дасан К.П. Исследования морфологии и проводимости ПЭО/LiClO 4 . Матер. Сегодня проц. 3 , 1451–1459 (2016).
Артикул Google ученый
Schafzahl, L. et al. Длинноцепочечные алкилкарбонаты Li и Na как межфазные компоненты твердого электролита: структура, ионный транспорт и механические свойства. Хим. Матер. 30 , 3338–3345 (2018).
Артикул КАС Google ученый
Zhuang, G.V., Yang, H., Ross, P.N., Xu, K. & Jow, T.R. Метилкарбонат лития как продукт реакции металлического лития и диметилкарбоната. Электрохим. Твердотельное письмо. 9 , A64–A68 (2006 г.).
Артикул КАС Google ученый
Пикард, С. Дж. и Маури, Ф. Всеэлектронный магнитный отклик с псевдопотенциалами: химические сдвиги ЯМР. Физ. Ред. B 63 , 245101 (2001 г.).
Артикул Google ученый
Йейтс Дж. Р., Пикард С. Дж. и Маури Ф. Расчет химических сдвигов ЯМР для расширенных систем с использованием сверхмягких псевдопотенциалов. Физ. Ред. B 76 , 024401 (2007 г.).
Артикул Google ученый
Гашо, Г. и др. Расшифровка многоступенчатых механизмов деградации карбонатного электролита в литиевых батареях. J. Источники питания 178 , 409–421 (2008).
J. Источники питания 178 , 409–421 (2008).
Артикул КАС Google ученый
Сюй, К. Отличаются ли ЭК и ПК межфазной химией на графитовом аноде и чем. Дж. Электрохим. соц. 156 , А751–А755 (2009 г.).
Артикул КАС Google ученый
Литий-ионные аккумуляторы — Curious
Эксперты-рецензенты
Доктор Ананд Бхатт
Руководитель исследовательской группы, Advanced Energy Storage Technologies
CSIRO
Профессор Рэй Уизерс FAA
Химическая исследовательская школа
Австралийский национальный университет
Профессор Госю Ван
Директор Центра экологически чистых энергетических технологий
Технологический университет Сиднея
Основы
- Литий-ионные аккумуляторы повсеместно используются в нашей повседневной жизни — большинство из нас носит их с собой в телефоне.
- Существует несколько типов литий-ионных аккумуляторов. Основное различие между ними заключается в химическом составе катода.
- Разные типы литий-ионных аккумуляторов предлагают разные функции с компромиссом между стоимостью, эффективностью и безопасностью.
Наш лучший друг в наши дни — литий-ионный аккумулятор. Это тот, который питает наши мобильные телефоны и ноутбуки, устройства, которые внесли огромный вклад в изменение того, как мы работаем и взаимодействуем с нашими друзьями, коллегами, продавцами и даже незнакомцами. Потребляемая мощность наших смартфонов способна разрядить никель-кадмиевую или никель-металлгидридную батарею менее чем за час, но благодаря эффективности литий-ионной химии мы можем общаться с мамой, смотреть видео, отправлять сообщения друзьям, слушать музыку. под музыку, купить пару обуви в Интернете, получить инструкции по навигации и делать бесчисленное количество фотографий в течение всего дня.
под музыку, купить пару обуви в Интернете, получить инструкции по навигации и делать бесчисленное количество фотографий в течение всего дня.
Так что же такого особенного в литий-ионных батареях? Их главная фишка — плотность энергии — она примерно вдвое больше, чем у никель-кадмиевой батареи, а это означает, что батарея вдвое меньшего размера будет давать такое же количество энергии. Они легкие и компактные, а это значит, что они лучше подходят для таких вещей, как портативная электроника, чем тяжелые свинцово-кислотные батареи, которые заводят наши бензиновые автомобили. Литий-ионные аккумуляторы
питают сегодня большинство портативных электронных устройств. Источник изображения: Edvvc/Flickr.Так что же такого в химическом составе литий-ионного элемента, что дает ему преимущество перед конкурентами?
Химия литий-ионных аккумуляторов
Как следует из названия, ионы лития (Li + ) участвуют в реакциях, приводящих в действие аккумулятор. Оба электрода в литий-ионном элементе изготовлены из материалов, которые могут интеркалировать или «поглощать» ионы лития (немного похоже на гидрид-ионы в NiMH батареях). Интеркаляция — это когда заряженные ионы элемента могут «удерживаться» внутри структуры материала-хозяина, не нарушая ее существенно. В случае литий-ионной батареи ионы лития «привязаны» к электрону внутри структуры анода. Когда батарея разряжается, интеркалированные ионы лития высвобождаются из анода, а затем проходят через раствор электролита, чтобы поглощаться (интеркалироваться) катодом.
Интеркаляция — это когда заряженные ионы элемента могут «удерживаться» внутри структуры материала-хозяина, не нарушая ее существенно. В случае литий-ионной батареи ионы лития «привязаны» к электрону внутри структуры анода. Когда батарея разряжается, интеркалированные ионы лития высвобождаются из анода, а затем проходят через раствор электролита, чтобы поглощаться (интеркалироваться) катодом.
Литий-ионный аккумулятор начинает свою жизнь в состоянии полного разряда: все его ионы лития интеркалированы внутри катода, а его химический состав еще не способен производить электричество. Прежде чем вы сможете использовать аккумулятор, его необходимо зарядить. Когда аккумулятор заряжается, на катоде происходит реакция окисления, а это означает, что он теряет часть отрицательно заряженных электронов. Для поддержания баланса зарядов на катоде в раствор электролита растворяют равное количество положительно заряженных интеркалированных ионов лития. Они перемещаются к аноду, где внедряются в графит. Эта реакция интеркаляции также откладывает электроны в графитовый анод, чтобы «связать» ион лития.
Эта реакция интеркаляции также откладывает электроны в графитовый анод, чтобы «связать» ион лития.
Показывать метки во время анимации Начать анимацию
Во время разряда ионы лития деинтеркалируются с анода и возвращаются через электролит к катоду. Это также высвобождает электроны, которые привязывали их к аноду, и они текут по внешнему проводу, обеспечивая электрический ток, который мы использовали для выполнения работы. Именно соединение внешнего провода позволяет протекать реакции — когда электроны могут свободно перемещаться, то и положительно заряженные ионы лития уравновешивают движение своего отрицательного заряда.
Когда катод заполняется ионами лития, реакция прекращается и батарея разряжается. Затем мы снова перезаряжаем наши литий-ионные батареи, и внешний электрический заряд, который мы прикладываем, выталкивает ионы лития обратно в анод от катода.
Показывать метки во время анимации Начать анимацию
Электролит в литий-ионном элементе обычно представляет собой раствор солей лития в смеси растворителей (таких как диметилкарбонат или диэтилкарбонат), разработанный для улучшения характеристик аккумулятора. Наличие солей лития, растворенных в электролите, означает, что раствор содержит ионы лития. Это означает, что отдельные ионы лития не должны совершать полный путь от анода к катоду, чтобы замкнуть цепь. По мере того как ионы выбиваются из анода, другие, которые уже находятся в электролите, вблизи поверхности электрода, могут легко поглощаться (интеркалироваться) катодом. Обратное происходит во время перезарядки.
Наличие солей лития, растворенных в электролите, означает, что раствор содержит ионы лития. Это означает, что отдельные ионы лития не должны совершать полный путь от анода к катоду, чтобы замкнуть цепь. По мере того как ионы выбиваются из анода, другие, которые уже находятся в электролите, вблизи поверхности электрода, могут легко поглощаться (интеркалироваться) катодом. Обратное происходит во время перезарядки.
Будучи маленьким и легким, большое количество лития может храниться (интеркалироваться) в обоих электродах. Именно это придает литий-ионным батареям высокую плотность энергии. Например, один ион лития может храниться на каждые шесть атомов углерода в графите, и чем больше ионов лития участвует в путешествии от анода к катоду (и обратно во время циклов перезарядки), тем больше электронов остается на пути. уравновешивают их движение и обеспечивают электрический ток.
Перенос ионов лития между электродами происходит при гораздо более высоком напряжении, чем в других типах аккумуляторов, и, поскольку они должны быть уравновешены равным количеством электронов, один литий-ионный элемент может производить напряжение 3,6 вольта или выше. , в зависимости от материалов катода. Типичный щелочной элемент выдает всего около 1,5 вольт. Для стандартного свинцово-кислотного автомобильного аккумулятора требуется шесть 2-вольтовых элементов, соединенных вместе, чтобы получить 12 вольт.
, в зависимости от материалов катода. Типичный щелочной элемент выдает всего около 1,5 вольт. Для стандартного свинцово-кислотного автомобильного аккумулятора требуется шесть 2-вольтовых элементов, соединенных вместе, чтобы получить 12 вольт.
Из-за их высокой плотности энергии и относительной легкости установка большого количества литий-ионных элементов вместе в одном месте позволяет получить аккумуляторный блок, который намного легче и компактнее, чем стек из других типов аккумуляторов. Если мы сложим вместе достаточное количество литий-ионных элементов, мы сможем достичь довольно высокого напряжения, например, необходимого для запуска электромобиля. Конечно, во всех наших автомобилях уже есть аккумуляторы, но они нужны только для того, чтобы запустить бензиновый или дизельный двигатель, тогда всю работу делает топливо. Аккумулятор электромобиля — это его источник энергии и то, что дает ему возможность подняться на крутой холм. Таким образом, он обычно будет иметь 96 вольт или даже больше, что даже при высоком напряжении литий-ионного элемента требует довольно много элементов, сложенных вместе.
Анод обычно графитовый. Однако многократное введение ионов лития в стандартную графитовую структуру типичной литий-ионной батареи в конечном итоге разрушает графит. Это снижает производительность батареи, и графитовый анод в конечном итоге сломается, и батарея перестанет работать. Исследователи работают над разработкой вариантов использования графена (листов углерода толщиной в один атом) вместо графита. Вы узнаете больше о графене и о том, чем он хорош, в следующей теме Nova.
Что касается материала, из которого изготавливается катод, существует довольно много вариаций — обычно из комбинации лития, кислорода и какого-либо металла.
Катоды, используемые в литий-ионных батареях
Оксид лития-кобальта (LiCoO
2 ) Наиболее распространенные литий-ионные элементы имеют анод из углерода (C) и катод из оксида лития-кобальта (LiCoO 2 ). Фактически, литий-кобальт-оксидный аккумулятор был первым литий-ионным аккумулятором, который был разработан на основе новаторских работ Р. Язами и Дж. Гуденафа и продан Sony в 1919 г.91. Кобальт и кислород соединяются вместе, образуя слои октаэдрических структур оксида кобальта, разделенные листами лития. Важно, что эта структура позволяет ионам кобальта менять свои валентные состояния между Co +3 и Co +4 (терять и приобретать отрицательно заряженный электрон) при зарядке и разрядке.
Фактически, литий-кобальт-оксидный аккумулятор был первым литий-ионным аккумулятором, который был разработан на основе новаторских работ Р. Язами и Дж. Гуденафа и продан Sony в 1919 г.91. Кобальт и кислород соединяются вместе, образуя слои октаэдрических структур оксида кобальта, разделенные листами лития. Важно, что эта структура позволяет ионам кобальта менять свои валентные состояния между Co +3 и Co +4 (терять и приобретать отрицательно заряженный электрон) при зарядке и разрядке.
Из всех различных литий-ионных аккумуляторов эти ребята имеют наибольшую плотность энергии, поэтому в настоящее время они используются в наших телефонах, цифровых камерах и ноутбуках. Их недостатком является термическая нестабильность. Их аноды могут перегреваться, а при высоких температурах катод из оксида кобальта может разлагаться с образованием кислорода. Если вы объедините кислород и тепло, у вас есть довольно хорошие шансы начать пожар, и, поскольку химические вещества, иногда используемые в растворе электролита, такие как диэтилкарбонат, легко воспламеняются, с этой батареей могут возникнуть некоторые проблемы с безопасностью.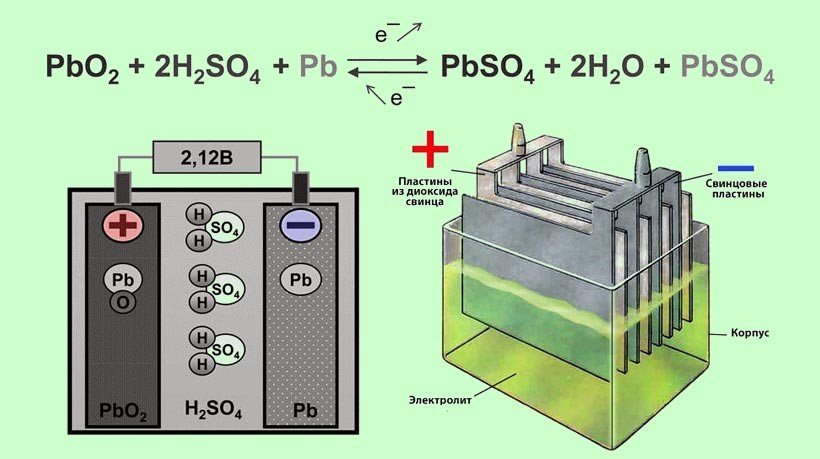
Литий-ионные аккумуляторы имеют встроенную защиту для предотвращения перегрева и полного разряда аккумулятора, что также может привести к повреждению. Кроме того, эти схемы защиты иногда можно использовать для предотвращения перезарядки литий-ионных аккумуляторов, что может иметь серьезные последствия. Литий-ионные батареи бывают самых разных форм и размеров, а некоторые из них содержат встроенные защитные устройства, такие как вентиляционные крышки, для повышения безопасности.
Фосфат лития-железа (LiFePO
4 ) Этот элемент имеет высокую скорость разряда, а поскольку фосфат (PO 4 ) может выдерживать высокие температуры, батарея обладает хорошей термической стабильностью, что повышает ее безопасность. Это делает его хорошим выбором для таких вещей, как электромобили и электроинструменты, а также для хранения энергии на электростанциях. Он также имеет длительный срок службы, что означает, что его можно разряжать и заряжать много раз. Однако он имеет более низкую плотность энергии, чем элемент из оксида лития-кобальта, и более высокую скорость саморазряда.
Элемент литий-железо-фосфатной батареи похож на элемент из оксида лития-кобальта. Анод по-прежнему графитовый, и электролит почти такой же. Разница в том, что катод из диоксида лития-кобальта был заменен более стабильным фосфатом лития-железа. Фактически, в катоде из фосфата железа (FePO4) полностью заряженного элемента не остается ионов лития или железа. Ионы лития могут внедряться в катодный материал или из него через четко определенные туннели в его структуре без значительного изменения каркаса из фосфата железа.
Катод этого типа элементов изготовлен из отрицательно заряженного фосфата
анионы ГЛОССАРИЙ анионы Отрицательно заряженные ионы, особенно ионы, которые мигрируют к аноду при электролизе , связанный с положительно заряженным железом
катионы ГЛОССАРИЙ катионы Положительно заряженные ионы, то есть те, которые будут притягиваться к катоду при электролизе в структуре, способной хранить ионы лития в молекулах фосфата железа. Расположение связей в этой структуре означает, что атомы кислорода прочно связаны в структуру, что придает катоду его химическую стабильность.
Расположение связей в этой структуре означает, что атомы кислорода прочно связаны в структуру, что придает катоду его химическую стабильность.
Lithium manganese oxide (LiMn
2 O 4 )This type of lithium battery uses a cathode made from lithium-manganese spinel (Li + Mn 3+ Mn 4+ O 4 ). Шпинель представляет собой тип минерала с характерной структурой AB 2 O 4 . Структура шпинели обладает очень хорошей термической стабильностью, повышая безопасность батареи. Это также способствует ионному потоку внутри электролита и уменьшает внутреннее сопротивление, которое со временем способствует потере мощности батареи.
Несмотря на то, что этот тип литиевых батарей обеспечивает высокую скорость разрядки и перезарядки (в том числе из-за шпинельной структуры катода), он имеет меньшую емкость и более короткий срок службы.
Оксид лития, никеля, марганца и кобальта (LiNiMnCoO
2 или NMC) Добавление никеля и кобальта обратно в смесь снова немного меняет ситуацию. Никель обеспечивает высокую удельную энергию и при добавлении к стабильной структуре марганцевой шпинели также приводит к получению батареи с преимуществами структуры марганцевой шпинели (низкое внутреннее сопротивление, высокая скорость зарядки, хорошая стабильность и безопасность).
Никель обеспечивает высокую удельную энергию и при добавлении к стабильной структуре марганцевой шпинели также приводит к получению батареи с преимуществами структуры марганцевой шпинели (низкое внутреннее сопротивление, высокая скорость зарядки, хорошая стабильность и безопасность).
Катод этих батарей обычно состоит из одной трети никеля, одной трети марганца и одной трети кобальта, но соотношение может варьироваться в зависимости от секретных формул производителей. Эти аккумуляторы используются в электроинструментах, электромобилях и медицинских приборах.
Литий-марганцевые батареи часто сочетаются с литий-никель-марганцево-кобальтовыми батареями, образуя комбинацию, которая используется во многих электромобилях. Высокие всплески энергии (для быстрого ускорения) обеспечиваются литий-марганцевым компонентом, а большой запас хода обеспечивается компонентом литий-никель-марганец-кобальт.
Литий-полимерный
Замена жидкого электролита в литий-ионном аккумуляторе твердым электролитом повышает безопасность аккумулятора и делает его легче.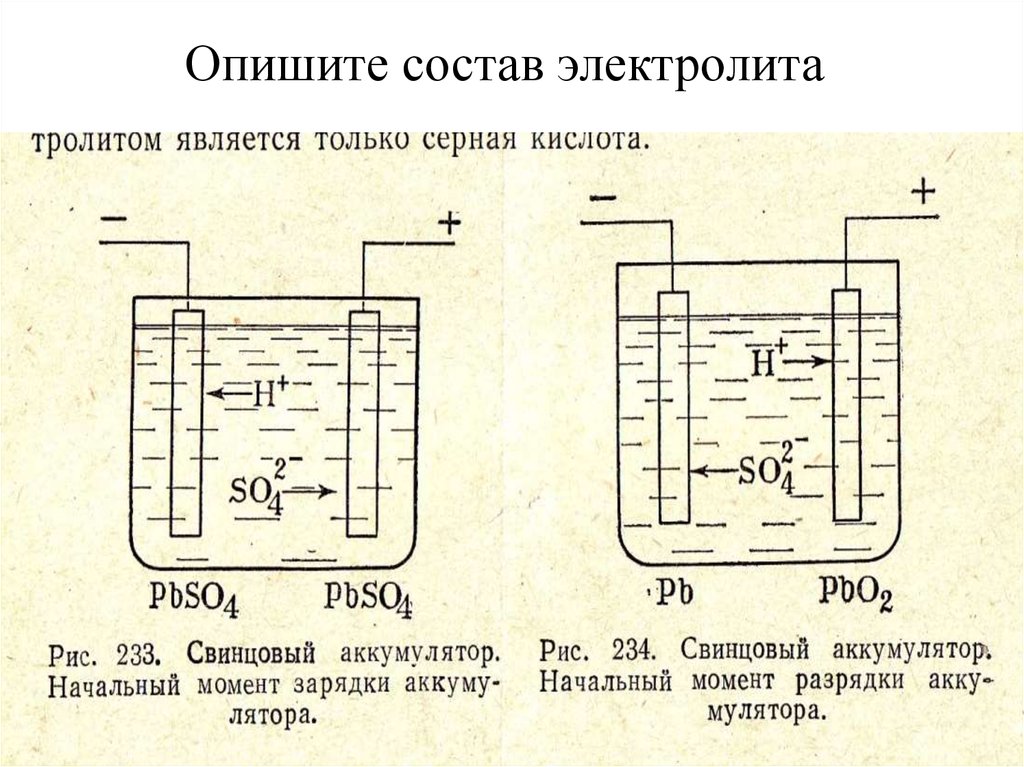 Поскольку сам полимер очень тонкий, он также обеспечивает большую гибкость с точки зрения формы и дизайна — его не нужно помещать в жесткий корпус, и его можно сделать чрезвычайно компактным.
Поскольку сам полимер очень тонкий, он также обеспечивает большую гибкость с точки зрения формы и дизайна — его не нужно помещать в жесткий корпус, и его можно сделать чрезвычайно компактным.
Полимерный электролит представляет собой непроводящий материал, который, тем не менее, допускает ионный обмен. В ранних конструкциях полимер был настолько плохим проводником, что не мог способствовать ионному обмену, если только не был нагрет примерно до 60 градусов по Цельсию, поэтому теперь добавляют небольшое количество геля, чтобы избежать этой проблемы.
Литий-полимерный аккумулятор может использовать любую комбинацию электродов, используемую в литий-ионных аккумуляторах; отличается просто электролит.
Литий-ионные батареи бывают разных форм, размеров и химического состава, как и батареи. Их различные химические вещества и структуры предлагают различные функции, часто с компромиссом между эффективностью, стоимостью и безопасностью.
Литий-ионные аккумуляторы необходимы нам в повседневной жизни.
