Как правильно заряжать аккумулятор? Зарядка аккумулятора | Заряд аккумуляторной батареи герметичной необслуживаемой
Правильная зарядка аккумулятора
Одним из наиболее важных условий корректной работы, хорошей отдачи и длительного срока службы аккумуляторной батареи является её правильный заряд. Это касается абсолютно всех аккумуляторов: будь то мощные промышленные большой емкости, либо же крошечные батарейки в Ваших мобильных. К сожалению, далеко не все пользователи знают, что есть правильная зарядка аккумулятора. Данная статья призвана помочь людям в этом вопросе и быть «руководством пользователя» при столкновении с задачей должным образом зарядить АКБ (аккумуляторную батарею).
Существует множество различных видов электрических аккумуляторов – для каждого из них характерны свои правила и особенности заряда. Все они подробно описаны в инструкциях по эксплуатации, обязательным образом поставляемых продавцом (по крайней мере мы так делаем всегда) вместе с аккумуляторной продукцией.
Как заряжать аккумулятор?
Итак, давайте разберемся, что представляет из себя правильный заряд аккумуляторной батареи. Для начала хотим обратить внимание на одно общее правило, касающееся ВСЕХ БЕЗ ИСКЛЮЧЕНИЯ видов аккумуляторов, известных науке: чем меньше раз разряжается аккумулятор и чем менее глубоким является каждый отдельно взятый его разряд, тем большим будет срок его службы
. Все мифы о том, что аккумулятор (какой бы он ни был!), нужно каждый раз полностью разряжать, а затем полностью заряжать, и только так он прослужит максимально долго, а также утверждения «знатоков», что, мол, надо обязательно периодически разряжать аккумулятор, иначе он испортится – полная чушь! Если Вам предлагают купить аккумулятор и при этом рассказывают подобные «истории» – держитесь от таких продавцов и их продукции подальше. Для низкокачественных батарей, производимых из «грязного» вторсырья, отсутствие периодической «встряски» в виде разряда-заряда может действительно быть причиной быстрого выхода из строя (из-за того, что пластины данных АКБ чрезмерно загрязнены, и без «встрясок» данная «грязь» быстро обволакивает поверхность пластин и мешает нормальному прохождению процесса электролиза). Но для качественных аккумуляторов наиболее излюбленным является именно режим постоянного (буферного) подзаряда, при котором практически отсутствуют разряды, а сама АКБ постоянно пребывает под правильным напряжением.
Все мифы о том, что аккумулятор (какой бы он ни был!), нужно каждый раз полностью разряжать, а затем полностью заряжать, и только так он прослужит максимально долго, а также утверждения «знатоков», что, мол, надо обязательно периодически разряжать аккумулятор, иначе он испортится – полная чушь! Если Вам предлагают купить аккумулятор и при этом рассказывают подобные «истории» – держитесь от таких продавцов и их продукции подальше. Для низкокачественных батарей, производимых из «грязного» вторсырья, отсутствие периодической «встряски» в виде разряда-заряда может действительно быть причиной быстрого выхода из строя (из-за того, что пластины данных АКБ чрезмерно загрязнены, и без «встрясок» данная «грязь» быстро обволакивает поверхность пластин и мешает нормальному прохождению процесса электролиза). Но для качественных аккумуляторов наиболее излюбленным является именно режим постоянного (буферного) подзаряда, при котором практически отсутствуют разряды, а сама АКБ постоянно пребывает под правильным напряжением.
Здесь надо учитывать также эффект памяти некоторых аккумуляторных батарей — в настоящий момент под эффектом памяти понимается обратимая потеря ёмкости, имеющая место в некоторых типах электрических аккумуляторов при нарушении рекомендованного режима зарядки, в частности, при подзарядке не полностью разрядившегося аккумулятора. Название связано с внешним проявлением эффекта: аккумулятор как будто «помнит», что в предыдущие циклы работы его ёмкость не была использована полностью, и при разряде отдаёт ток только до «запомненной границы». Никель-металл-гидридный (Ni-MH), Никель-кадмиевый (NiCd), Серебряно-цинковый аккумулятор.
Переходим ближе к делу. Чтобы правильно заряжать аккумулятор
нужно понимать, в каком режиме он у Вас эксплуатируется.Что такое буферный режим работы
Самый яркий пример буферного режима работы аккумулятора – ИБП (источник бесперебойного питания, он же UPS). В ИБП аккумуляторная батарея находится на постоянной подзарядке и отдает энергию лишь тогда, когда пропадает электричество в сети, а как только оно появляется, аккумулятор тут же подзаряжается. Это самый щадящий режим работы и именно в буферном режиме, как мы уже говорили, аккумуляторы служат дольше всего (например, наши батареи EverExceed серии ST, производимые по технологии AGM нового поколения, имеют срок службы в буферном режиме при Т=20оС – 12 лет).
Это самый щадящий режим работы и именно в буферном режиме, как мы уже говорили, аккумуляторы служат дольше всего (например, наши батареи EverExceed серии ST, производимые по технологии AGM нового поколения, имеют срок службы в буферном режиме при Т=20оС – 12 лет).
Что такое циклический режим работы
Пример циклического режима использования АКБ – поломоечная машина, детский электромобиль в парке аттракционов, либо же система автономного электропитания с использованием альтернативных источников энергии (солнечных батарей, ветряков и т.д.). Аккумуляторы в этих приложениях разряжают-заряжают как минимум 1 раз в сутки. Такой режим является наиболее суровым, и срок службы АКБ тут уже исчисляется не годами, а количеством циклов разряд-заряда (ну и их глубины, естественно). Упомянутые ранее аккумуляторы EverExceed серии ST могут обеспечить до 600 циклов глубокого 100% разряда (обычные же AGM-аккумуляторы – не более 280). Всегда очень удивляет, когда в приложениях с явно циклическим характером работы (те же системы электропитания на солнечных батареях, либо мобильные кофемашины) некоторые «умельцы» предлагают использование стартерных автомобильных аккумуляторов (аргумент – их дешевизна!).
Как правильно заряжать аккумулятор в буферном режиме:
Всем известно, что номинальное напряжение одного элемента в свинцово-кислотных АКБ = 2 Вольта (отметим, что на практике оно обычно никогда не равняется строго 2 В, но для простоты применяется именно такое число). В быту наиболее часто используются аккумуляторные батареи напряжением 6 Вольт (3 элемента) и 12 Вольт (6 элементов).
В буферном режиме напряжение заряда следует выставить на уровне 2,27 – 2,30 Вольт на элемент (то есть для 12-вольтового аккумулятора это 13,6 – 13,8 В, а для 6-вольтового – 6,8 – 6,9 В). Это подходит как для AGM, так и для гелевых батарей.
Ток заряда должен быть ограничен в величину, равную 30% от номинальной 10-часовой емкости аккумулятора, выраженную в Амперах (для гелевых аккумуляторов – 20%). Например, для батареи с емкостью С
Как правильно заряжать аккумулятор в циклическом режиме:
Напряжение заряда:
2,4 – 2,45 В/эл. (14,4 – 14,7 В на 12-вольтовую батарею или 7,2 – 7,35 В на 6-вольтовую) – для AGM-аккумуляторов;
2,35 В/эл (14,1 В на 12-вольтовую батарею или 7,05 В на 6-вольтовую) – для гелевых аккумуляторов.
Ток заряда:
20% от С10 (для батареи емкостью 100 Ач – это 20 А).
Сколько должен длиться заряд батареи
Продолжительность заряда зависит от изначальной заряженности (разряженности) батареи. Поначалу идет быстрый заряд (бустерный), но по мере насыщения потребляемый ток снижается, доходя до минимума при достижении полной заряженности АКБ. Критерий полной заряженности – падение тока, который принимает аккумулятор, до 2 – 3 мА на каждый Ач емкости батареи (при буферном заряде). Например, для той же С 10=100 Ач батареи падение тока зарядки до 200 – 300 мА будет означать, что батарея почти полностью заряжена. Чтобы довести уровень заряда АКБ до 100%, следует продолжать зарядку таким милли-током еще около 1 часа. Обычно, полностью разряженная батарея заряжается за 10 часов в циклическом режиме или за 30-48 часов в буферном.
Критерий полной заряженности – падение тока, который принимает аккумулятор, до 2 – 3 мА на каждый Ач емкости батареи (при буферном заряде). Например, для той же С 10=100 Ач батареи падение тока зарядки до 200 – 300 мА будет означать, что батарея почти полностью заряжена. Чтобы довести уровень заряда АКБ до 100%, следует продолжать зарядку таким милли-током еще около 1 часа. Обычно, полностью разряженная батарея заряжается за 10 часов в циклическом режиме или за 30-48 часов в буферном.
Следует учесть, что для полной зарядки аккумуляторной батареи ей следует сообщить примерно на 20% энергии больше, чем следует из понятия “номинальная емкость”. Это, как говорится, законы природы, и они едины для всех свинцово-кислотных да и других батарей, независимо от вида и производителя. Образно говоря, если батарею не «перенасытить», в ней не завершатся должные электрохимические процессы и дальнейшая отдача будет меньше.
Производить зарядку аккумуляторных батарей желательно при температуре окружающей среды 20 – 25оС.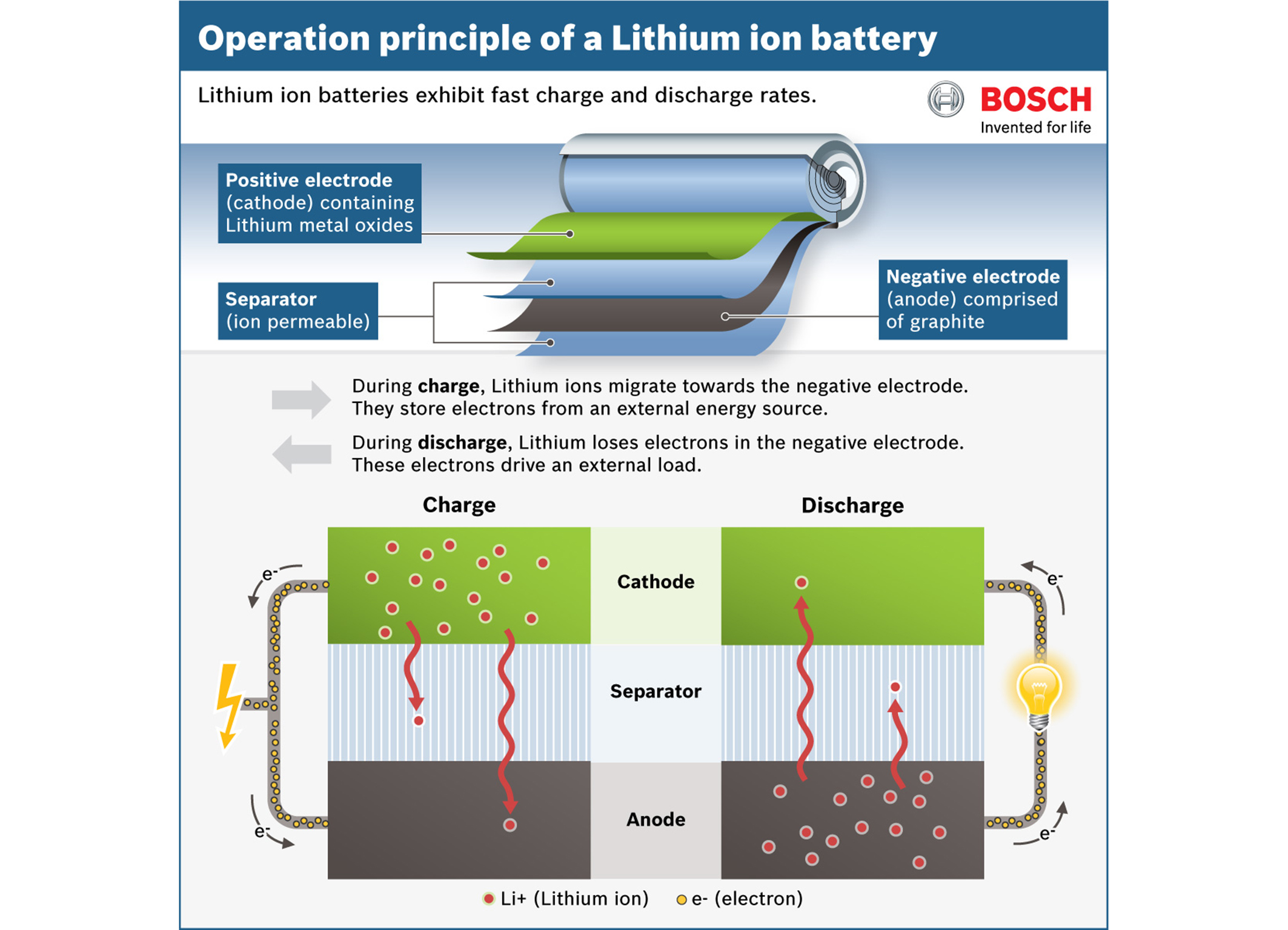
При меньшей температуре заряжать необходимо более длительное время. Зарядка аккумулятора при температуре менее 0оС становится крайне нежелательной (ибо почти безрезультатна). Желательно также наличие функции термокомпенсации (изменения напряжения заряда в зависимости от температуры окружающей среды) на Вашем зарядном устройстве.
Таблица с основными параметрами правильной зарядки аккумуляторной батареи
| БУФЕРНЫЙ РЕЖИМ | ЦИКЛИЧЕСКИЙ РЕЖИМ |
Напряжение заряда | Для 12-в АКБ: 13,6-13,8 В Для 6-в АКБ: 6,8-6,9 В | Для 12-в АКБ: 14,4-14,7 В Для 6-в АКБ: 7,2-7,35 В |
Ток заряда (не более!) | 30% от емкости C10 (для гелевых АКБ – 20%) | 20% от емкости C10 |
Предположительность заряда | 30-48 часов | 10-12 часов |
Критерий заряженности | Падение потребляемого тока до 2-3 мА/Ач + еще 1 час заряда таким током. | Падение потребляемого тока до 8-10 мА/Ач + еще 1 час заряда таким током |
Также даем ответ на вопрос пользователья по поводу режимов заряда «BULK», «ABSORBTION» и «FLOAT«, присутствующих в некоторых ЗУ с интеллектуальной системой заряда:
- В режиме BULK идет зарядка постоянным током, при этом напряжение на аккумуляторе постоянно растет до значения 2,4-2,45 В/эл;
- В режиме ABSORPTION достигается максимальное напряжение, которое поддерживается постоянным, в то время как ток зарядки падает;
- В режиме FLOAT напряжение плавно снижается до буферного (2,27В/эл.), ток остается минимальным. Это есть режим СОДЕРЖАНИЯ аккумулятора.
Выравнивающий заряд применяется, когда есть значительный разброс по напряжению на аккумуляторах (элементах или моноблоках) – более +/- 1%. Но такое бывает редко, по крайней мере для приличных АКБ. Кроме того, если батарея хоть изредка включается на разряд, а потом на заряд, то разброс в какой-то степени сглаживается. Если разброса нету – то и выравнивающий заряд производить нет смысла.
Если разброса нету – то и выравнивающий заряд производить нет смысла.
Более подробная информация по правильному заряду конкретных видов аккумуляторных батарей содержится в инструкциях по эксплуатации.
Пульсар Лимитед – Энергия для Лучшей Жизни!
что нужно делать, а что категорически нельзя
Тяговые аккумуляторы — это основной элемент электрической складской техники, такой как самоходные штабелеры, электропогрузчики и тележки. Задача АКБ заключается в обеспечении непрерывной работы этой техники. Но для того, чтобы аккумулятор работал долго и продуктивно, нужно придерживаться ряда правил, будь то ежедневные или ежегодные задачи.
Разделение операций: день, неделя, месяц, год
Примерное расписание того, что нужно делать, если у вас на складе работает электрическая техника с тяговыми аккумуляторами.
Каждый день — заряжать АКБ после разряда, проверять уровень электролита и доливать, если это необходимо.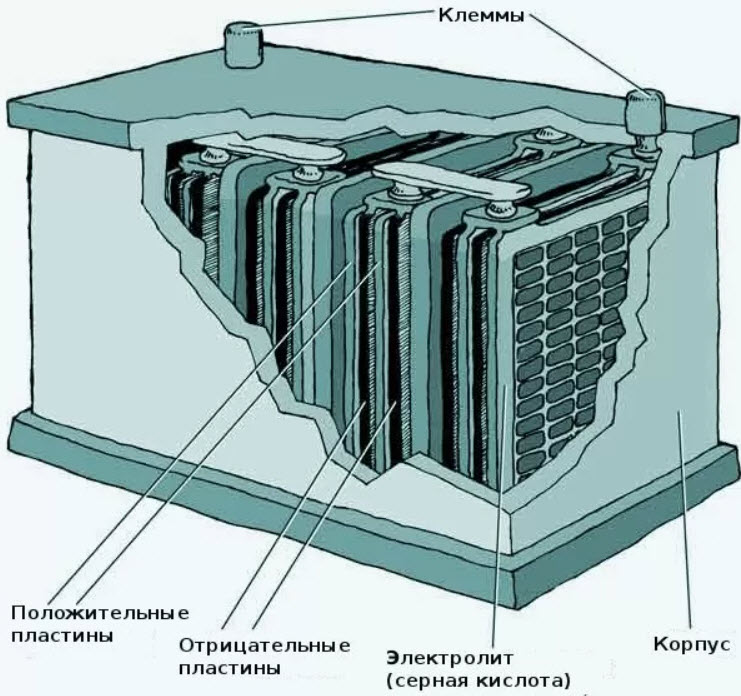
Каждую неделю — осматривать батарею на предмет визуальных отклонений от нормы, чистить АКБ от грязи и желательно проводить выравнивающий заряд.
Каждый месяц — вести журнал на предмет плотности электролита и значение напряжений в банках, проверять исправность зарядного устройства.
Каждый год — измерять сопротивление изоляции между корпусом техники и АКБ. Этот показатель не должен быть меньше чем 50 Ом на один вольт номинального напряжения.
Про электролит
Электролит заливают только один раз — на заводе. Во многом именно от его качества зависит насколько стабильно и долго будет работать батарея. Когда идет зарядка вода распадается на кислород и водород, что приводит визуальному «кипению» электролита и снижения его уровня в ячейке. Из-за этого в ячейки следует доливать дистиллированную воду, чтобы восстановить уровень электролита.
Долив дистиллированной воды в ячейки АКБ
Главные правила эксплуатации тягового аккумулятора
Нельзя
Оставлять батарею в разряженном состоянии надолго.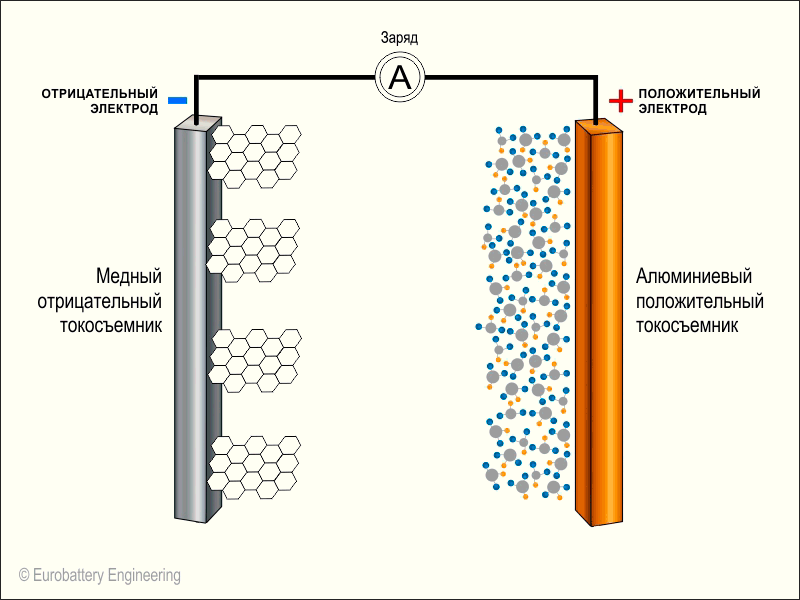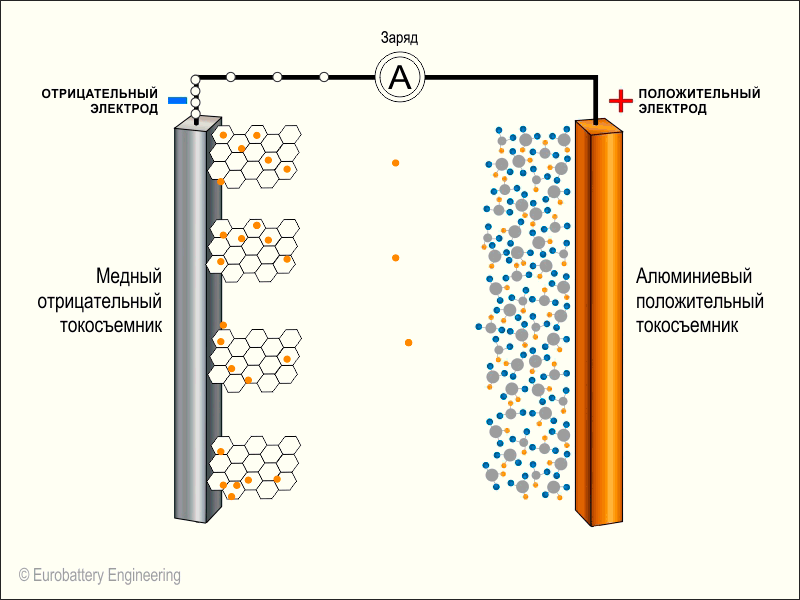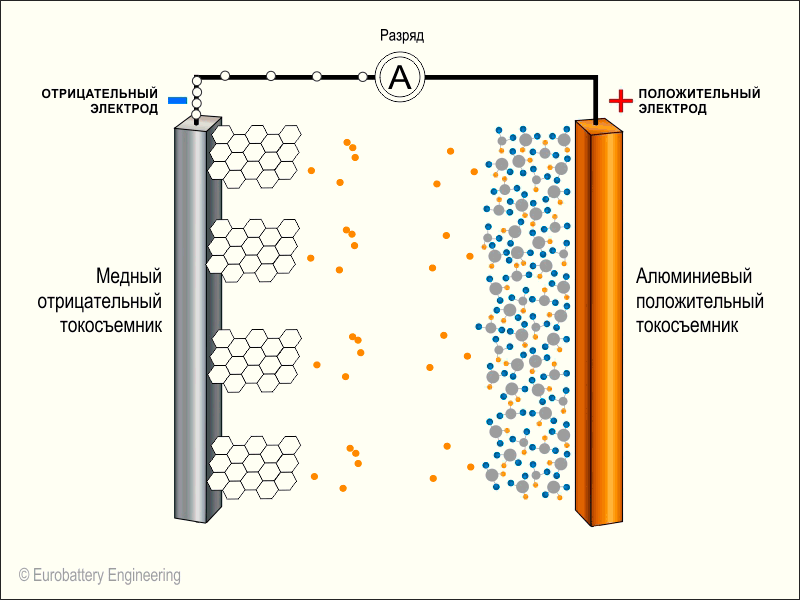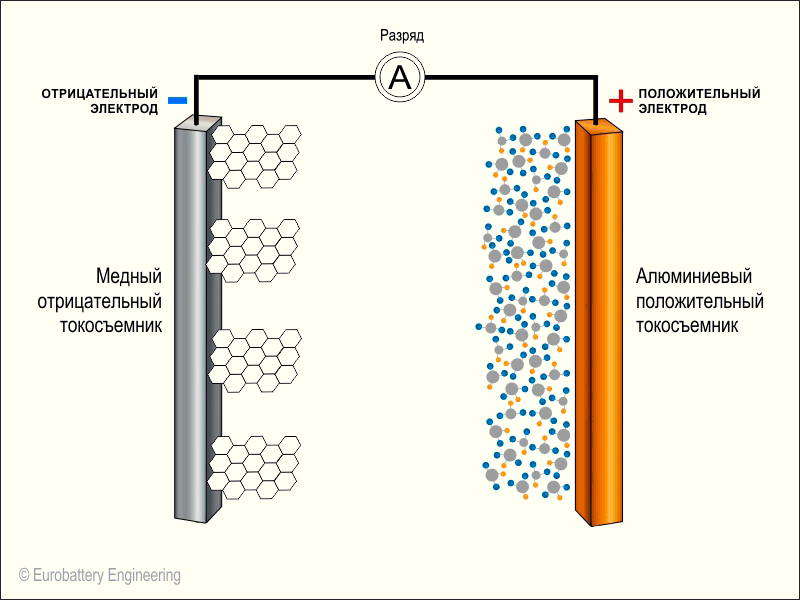 Из-за этого происходит сульфатизация пластин, что снижает емкость батареи и ее рабочий ресурс.
Из-за этого происходит сульфатизация пластин, что снижает емкость батареи и ее рабочий ресурс.
Разряжать АКБ более чем на 80%, для гелевых — 60%. Помимо сульфатизации пластин, это еще приводит к увеличению времени, необходимого для полной зарядки аккумулятора и его перегреву. Итог — ощутимое снижение рабочего ресурса.
Доливать обычную воду или электролит. Обычная вода содержит в своем составе много примесей, которые негативно влияют на аккумулятор. Долив электролита не приведет к приросту емкости, а только — к коррозии пластин.
Нужно
После разряда батареи поставить ее на подзарядку и проследить, чтобы она корректно зарядилась. Обязательно должно быть отдельное помещение, одведенное только под зарядку АКБ.
Контролировать уровень заряда батареи в процессе работы. Для этого в машине, обычно, предусмотрен соответствующий датчик. Проконтролируйте, чтобы он был исправен и показывал корректные данные.
Доливать дистиллированную воду. При чем нужно постоянно следить за уровнем электролита и осуществлять своевременный долив. Некоторые тяговые АКБ оснащают автоматизированной системой долива. Как правило, они служат дольше.
Очистка аккумулятора
В процессе зарядки АКБ немного электролита выступает из батареи, при достижении достаточного напряжении. Из-за этого на крышках банок образуется токопроводящий слой и появляются так называемые блуждающие токи. Они увеличивают показатель саморазряда аккумулятора, даже при простое. Поэтому чистить аккумулятор нужно регулярно.
Обслуживать АКБ стоит химзащите: фартуке, перчатках и маске (лучше с респиратором)
Журналы контроля аккумуляторов
На примере парка электропогрузчиков, ведение журнала выглядит следующим образом:
Для каждого погрузчика используют одну-две батареи, которые нумеруют 1а, 1б. То есть, для погрузчика 1, батареи а и б.
Ведение такого простого журнала позволяет избежать эксплуатации недозаряженных аккумуляторов и спрогнозировать время для замены АКБ до того как она полностью выйдет из строя.
Есть еще журнал для сервисной службы, ведение которого — обязательное условие для гарантийного обслуживания. Выглядит он примерно так:
Обычно для ведения журналов, приема-выдачи аккумуляторов, их зарядки и долива воды нанимают отдельного человека или двух (в зависимости от количества рабочих смен на предприятии).
Что делать со старым тяговым аккумулятором
Старичок отработался
Согласно закону Украины «Про хімічні джерела струму», любой кислотный аккумулятор нужно обязательно утилизировать должным образом. Этим занимаются специальные компании по переработке. Но не спешите отдавать им свою отработанную тяговую батарею. Вы еще можете получить с нее выгоду! Когда решите покупать новую батарею, обращайтесь к нам. Мы можем предложить вам 2 интересных решения.
Выкуп отработанного аккумулятора
Мы выкупим у вас старую батарею и предложим новую со скидкой. При этом мы берем на себя обязанности по утилизации старого аккумулятора. Какая нам с этого выгода? После утилизации АКБ, все вредные вещества нейтрализуются, а вторичное сырье можно использовать повторно. За счет этого и формируется наша выгода и ваша скидка.
Какая нам с этого выгода? После утилизации АКБ, все вредные вещества нейтрализуются, а вторичное сырье можно использовать повторно. За счет этого и формируется наша выгода и ваша скидка.
Подробнее про процесс утилизации мы писали — в этом материале
Перепаковка аккумулятора
Что это такое
Это замена аккумуляторных элементов на новые. При этом сам ящик остается старый. Его очищают и окрашивают. Главное, чтобы у ящика не было повреждений: трещин, вмятин, дыр или непоправимых следов сильного окисления.
Почему это выгодно
Тогда вы можете неплохо сэкономить на новой АКБ. Дело в том, что перепакованная батарея по своей производительности не уступает новой, а стоимость услуги вместе с новыми банками примерно на 10% ниже, покупки нового аккумулятора. Мы предоставляем такую услугу:
Читайте подробнееПро типы аккумуляторных батарей
Сейчас пока еще самые распространенные и востребованные аккумуляторы — свинцово-кислотные. Все эти советы и правила работают как раз с ними. Но на рынке уже есть новый игрок — литий-ионные батареи. Они очень сильно обгоняют своих предшественников по всем параметрам, начиная от срока службы, заканчивая простотой в обслуживании.
Но на рынке уже есть новый игрок — литий-ионные батареи. Они очень сильно обгоняют своих предшественников по всем параметрам, начиная от срока службы, заканчивая простотой в обслуживании.
Литий-ионный тяговый аккумулятор
Единственный их существенных недостаток — цена. Мало кто может себе позволить такой вклад в далекую перспективу (а именно так они себя окупят).
Ознакомиться с каталогом тяговых аккумуляторов вы можете кнопке ниже:
Перейти в каталог тяговых аккумуляторов
Как устроен литий-ионный аккумулятор | Полезная информация | Cписок категорий | Блог
Берем два длинных листка: из графита и из оксида лития с кобальтом (LiCoO2). Смазываем их электролитом, прокладываем между ними тонкую перфорированную пластиковую пленку и сворачиваем рулончиком. Литий-ионный аккумулятор готов.Когда мы подаем на пластинки напряжение — на графит минус, а на оксид лития плюс — от молекул оксида отцепляются положительно заряженные ионы лития и перепрыгивают на углеродную пластинку. Так происходит зарядка аккумулятора.
Первый в мире серийный электрический спорткар Tesla Roadster, питается как раз от литий-ионных аккумуляторов. Принципиально они не отличаются от аккумулятора для шуруповерта, ноутбука или телефона.
Когда аккумулятор заряжен и вы решаете им воспользоваться, то все происходит наоборот: положительно заряженные ионы лития перепрыгивают обратно на оксид лития, в свое нормальное состояние. В полученной батарейке графитовая пластинка становится минусом, а оксид лития — плюсом.
Такие аккумуляторы обладают большой емкостью, у них нет эффекта памяти, они легкие и компактные.
Эффект памяти аккумулятора — в настоящий момент под эффектом памяти понимается обратимая потеря ёмкости, имеющая место в некоторых типах электрических аккумуляторов при нарушении рекомендованного режима зарядки, в частности, при подзарядке не полностью разрядившегося аккумулятора. Название связано с внешним проявлением эффекта: аккумулятор как будто «помнит», что в предыдущие циклы работы его ёмкость не была использована полностью, и при разряде отдаёт ток до «запомненной границы».
Но при неправильном использовании у них есть и минусы:
- При сильном нагревании аккумулятор может загореться.
- Если аккумулятор сядет ниже определенного критического уровня, то его больше никогда нельзя будет зарядить.
Поэтому такие аккумуляторы объединяют в батареи со встроенной электроникой, которая следит за температурой и режимами зарядки каждого отдельного аккумулятора.
Аккумуляторы нового поколения создаются в Европе
В новом гигантском НПО Battery Industrialization Centre в британском г. Ковентри. Jason Alden / BloombergАккумуляторные батареи используются повсюду − в наших телефонах, ноутбуках и автомобилях, но недорогими и высокопроизводительными источниками энергии будущего они до сих пор не стали. Целый ряд европейских и швейцарских научно-производственных инициатив пытается сейчас нащупать пути к инновационному прорыву в этой перспективной области.
Этот контент был опубликован 17 сентября 2021 года — 07:00 Саймон БредлиУроженец Лондона, Саймон – мультимедийный журналист, работающий в SWI swissinfo.ch с 2006 года. Он говорит на французском, немецком и испанском языках, освещает работу ООН и других международных организаций со штаб-квартирами в Женеве, а кроме того, и целый ряд других тем, главным образом во франкоязычной части Швейцарии.
Больше материалов этого / этой автора | Англоязычная редакция
Доступно на 9 других языкахРедактор русскоязычной версии Надежда Капоне.
«Благодаря применению аккумуляторов можно сократить на 30% углеродные выбросы в транспортном и энергетическом секторах, обеспечить электричеством дополнительно 600 млн человек, а также создать по всему миру 10 млн долговременных и экологически устойчивых рабочих мест», — сказано в недавно опубликованном ежегодном докладе Всемирного экономического форума в Давосе, штаб-квартира которого расположена в местечке Колоньи в пригороде Женевы. Пока доминирующую роль на рынке батарей и аккумуляторов играет Азия, причем более 90% их производства приходится на Китай, Ю. Корею и Японию.
Но Европа намерена уже в скором времени сократить свое отставание. Европейский союз, уступая требования местных гигантов автомобилестроения, намерен скоро запустить массовое производство аккумуляторных батарей и ячеек (модульных элементов перезаряжаемых батарей), с тем чтобы положить конец технологической зависимости от зарубежных производителей. «В настоящее время мы просто пытаемся наверстать упущенное, но основная идея ЕС заключается в том, чтобы создать собственную производственно-инновационную базу для разработок в сфере производства аккумуляторов».
Об этом мы беседуем с Корсин Баттальей (Corsin BattagliaВнешняя ссылка), экспертом Швейцарских федеральных лабораторий материаловедения и технологий (Eidgenössische Materialprüfungs- und Forschungsanstalt EmpaВнешняя ссылка). Швейцария не входит в Евросоюз, но принимает активное участие в европейских научных проектах по разработке аккумуляторов нового поколения. Четыре года назад с целью наращивания производственных мощностей и развития научно-исследовательского потенциала в данной сфере по инициативе Еврокомиссии был создан Европейский аккумуляторный альянс (European Battery Alliance).
По данным НКО Transport & Environment, в рамках этой инициативы по всей Европе запланировано построить почти 40 заводов по производству батарей, так называемых «гигафабрик». Если все они в самом деле заработают, то к 2025 году старый свет сможет обеспечить себе долю мирового рынка аккумуляторов в 20%, что в годовом выражении составит торгово-промышленный оборот на ровне в 250 млрд евро или 270 млрд швейцарских франков. Одним из первых полностью европейских предприятий по производству экологически чистых аккумуляторов станет гигафабрика Northvolt EttВнешняя ссылка на севере Швеции в городе Шеллефтео.
Площадь огромного завода по производству литий-ионных батарей достигает 500 000 квадратных метров или 70 футбольных полей. Фабрика Northvolt заявляет, что сможет выпускать батареи в количестве, необходимом для производства одного миллиона электромобилей в год. В настоящее время создание гигафабрик в Швейцарии не планируется, но страна и ее огромный научный потенциал тесно связаны с европейскими усилиями по разработке модели аккумулятора будущего.
Огромный завод по производству литий-ионных аккумуляторов Northvolt Ett на севере Швеции будет занимать площадь более 500 000 квадратных метров или 70 футбольных полей. William Steel (Northvolt)«Идет ли речь о сырье и материалах, о сборке аккумуляторных ячеек в единую батарею, о системах менеджмента, о переработке, утилизации или о системах хранения энергии − в Швейцарии есть большое число компаний, активно работающих в области производства аккумуляторов, а некоторые даже являются мировыми лидерами этой отрасли», — говорит Корсин Батталья.
Самовосстанавливающиеся батареи
На протяжении последних десятков лет доминирующей технологией хранения электроэнергии были литий-ионные батареи, и ожидается, что спрос на них вырастет в течение следующего десятилетия в десять раз. За последние 30 лет стоимость литиевых батарей упала почти на 100%, но наука в направлении совершенствования таких батарей практически никак не продвинулась. Для удовлетворения будущего спроса на такие аккумуляторы нам потребуются альтернативные технологии, обеспечивающие повышенные сроки службы их элементов и повышение общей емкости данных батарей.
Именно этим и занимается European Battery 2030+, европейская инициатива в области исследований и разработок аккумуляторных батарей с общим бюджетом в 40 млн евро. Инициатива был запущена в прошлом 2020 году, в нее входят семь крупных исследовательских проектов, реализуемых при поддержке девяти европейских стран, включая Швейцарию. Один из проектов называется HIDDEN, и он ставит перед собой задачу увеличить средний срок службы литий-ионных аккумуляторов и их удельную энергоемкость по меньшей мере на 50%.
Корсин Батталья (справа) и исследователь Мари-Клод Бэй из Швейцарской федеральной лаборатории материаловедения и технологий (Empa), активно участвующей в европейских исследованиях параметров аккумуляторных батарей. Empa«Реальную проблему для долговечности литий-металлических батарей представляет постепенный рост внутри них так называемых дендритов, крошечных жестких древовидных структур. Их игольчатые выступы называются усы, — объясняет Аксель Фюрст (Axel FuerstВнешняя ссылка), руководитель проекта HIDDEN при Бернской высшей школе прикладных наук (Berner FachhochschuleВнешняя ссылка). — Металлический литий имеет очень высокую энергетическую плотность и поэтому его можно использовать для производства все более легких и энергоемких батарей. Но дендриты растут очень быстро, из-за чего срок жизни таких аккумуляторов в среднем невелик», — говорит он.
Чтобы решить эту проблему, его группа занимается изучением процесса самовосстановления батареи. Они надеются, что специально разработанные термотропные (то есть образующиеся в результате нагревания твёрдого вещества и существующие в определённом интервале температур и давлений) жидкокристаллические ионные электролиты вместе с добавками и пьезоэлектрическим сепаратором, создающим электрическое поле, смогут остановить процесс роста коварных дендритов. Первую концептуальную модель такого аккумулятора тут надеются представить к 2023 году в надежде, что потом она получит широкое распространение и будет востребована на рынке.
Меньше редких металлов
Тем временем Корсин Батталья и его коллеги из Empa координируют европейский исследовательский проект SENSE, целью которого является создание так называемого литий-ионного аккумулятора «поколения 3b» с композитным анодом из кремния и графита и монокристаллическим катодом NMC, содержащим соединения никеля, марганца и кобальта. Целью исследования является повышение удельной энергоемкости батареи, что позволит увеличить дальность пробега транспортных средств, усовершенствовать технологии быстрой зарядки аккумуляторов и сократить объемы использования редких металлов.
«Мы хотим сократить содержание кобальта и повысить содержание никеля», — говорит исследователь из Empa. Кобальт — один из самых дорогих материалов в батарее. Производители стараются сократить его использование, так как его поставки могут в будущем быть связанными со значительными политическими и социальными издержками и рисками. Напомним, что около 70% мировых объемов кобальта поступает на рынок из ДР Конго, а там работа шахтеров сопряжена с опасностью и вредными условиями труда. Основные же мощности по обогащению кобальтовой руды расположены в Китае. «Создание идеальной батареи — задача не из легких, зачастую требующая компромиссного подхода, от чего-то приходится отказываться, чтобы получить на выходе желаемый инженерный результат», — объясняет Корсин Батталья.
Дело в том, что никель, обычно добавляемый в состав батареи, увеличивает мощность аккумулятора и он относительно дешев, но при этом никель приводит к быстрому износу батареи. Ученые в Швейцарии поэтому проводят сейчас эксперименты, добавляя в графитовый анод кремний. Этот материал представляет собой особый интерес для исследователей, поскольку он способен сохранять примерно в 10 раз больше энергии, чем графит. Но во время циклов заряда и разряда кремний подвержен расширению, что ведет к разрушению структуры анода и быстрой потере производительности. Эксперты Empa также занимаются сейчас разработкой новых датчиков быстрой зарядки для установки их на литий-ионные батареи, с тем чтобы аккумуляторы можно было заряжать быстрее и эффективнее. «Чтобы ускорить процесс зарядки нам нужно получить данные о локальной температуре и ресурсе аккумуляторной батареи, а также быстрее делать замеры внутри её ячеистых элементов», — говорит К. Батталья.
Твердотельные аккумуляторы
Еще одним претендентом на звание аккумулятора будущего является твердотельный аккумулятор с твердым электролитом, которым уже сейчас можно заменять вместо легковоспламеняющихся жидкие электролиты, используемые в обычных литий-ионных аккумуляторах. Такие батареи считаются более экономичными, безопасными, они требуют меньше сырья для их производства. Новейшие прототипы позволяют предположить, что твердотельные батареи смогут в будущем хранить на 80% больше энергии, чем нынешние литий-ионные аккумуляторы того же веса и объема.
Монтаж аккумулятрной батареи на фабрике Leclanche в городе Ивердон-ле-Бен на западе Швейцарии, май 2020 года. Компания Leclanche SA является ведущим мировым поставщиком высококачественных накопителей энергии на основе литий-ионных технологий. Keystone / Laurent GillieronКорсин Батталья говорит, что такие прорывные технологии сулят нам множество преимуществ, но воспользоваться ими в полном объеме пока не получается, соответствующие разработки пока не готовы покинуть пределы исследовательских лабораторий. По его словам, разработать твердотельную батарею с большой емкостью и длительным сроком службы оказалось не так-то просто. «Сделать такой аккумулятор с удвоенной энергоемкостью не проблема, но, скорее всего, после 20 циклов перезарядки такая батарея выйдет из строя», — объясняет он. Остается обычная батарея. Ее энергоемкость можно удвоить, заменив графит металлическим литием, но слишком быстрая зарядка батареи с большим содержанием лития приводит опять же к образованию дендритов, которые срок службы батареи резко сокращают.
Хотя батареи можно увеличить вдвое, заменив графит (материал анода литий-ионной батареи) на металлический литий, но слишком быстрая зарядка литий-металлической батареи вызовет образование дендритов, сокращающих срок ее службы. А ведь сумей твердотельные литиевые батареи решить все свои проблемы, с их помощью технологии, лежащие в основе мобильных источников энергии, смогли бы сделать огромный шаг вперед в плане и энергоемкости, и долговечности. В рамках проекта SOLIDIFY, направленного на разработку производственных процессов для так называемых аккумуляторов «поколения 4b», твердотельных аккумуляторов, которые могут быть готовы к выходу на рынок через десять лет, швейцарская структура Empa уже плотно сотрудничает с десятком своих европейских партнеров.
Эффективные системы хранения энергии
В ближайшие десятилетия значительный рост степени востребованности также ожидает стационарные системы хранения энергии. Литий-ионные аккумуляторы и батареи с монокристаллическим катодом NMC, содержащим соединения никеля, марганца и кобальта, уже используются для хранения солнечной и ветровой энергии, получаемой в условиях домашних хозяйств. Ученые сейчас занимаются поиском альтернатив таким литий-ионным батареям, пытаясь усовершенствовать, например цинковые, натрий-ионные и ванадиевые аккумуляторы, которые, как оказалось, хорошо подходят для стационарного хранения энергии.
Однако для того, чтобы удовлетворить растущий спрос на такие хранилища и обеспечить их ценовую конкурентоспособность, необходимо еще приложить значительные усилия. Швейцарское ведомство Empa является одним из двенадцати партнеров, которые как раз и занимаются активизацией таких усилий в рамках европейского аккумуляторного проекта SOLSTICE, в котором также участвуют швейцарские фирмы FZSONICK и Quantis. Их цель заключается в разработке никель-солевых термальных аккумуляторных батарей на основе жидких натрия и цинка, которые работают только при высоких температурах и которые можно использовать для стационарного хранения энергии.
По словам К. Баттальи, по мере быстрого увеличения в ближайшие десятилетия спроса на стационарные накопительные системы и в связи с ростом числа электромобилей на дорогах спрос на инновационные аккумуляторы также будет возрастать, а это значит, что многие швейцарские фирмы, помимо уже имеющихся игроков, также смогут получить свою долю прибыли. «Ко мне часто обращаются швейцарские компании, которые не связаны напрямую с аккумуляторной отраслью, но, имея за плечами знания и опыт в сфере производства и интеграции (разных производственных процессов в единую систему), они все чаще рассматривают эту отрасль в качестве направления на рынке, перспективного и для них тоже».
Сотрудничество компаний Lonza и Natron Energy
Еще один крупный проект в области технологий хранения энергии реализуется сейчас в Швейцарии в рамках сотрудничества между биохимической компанией Lonza, расположенной в кантоне Вале, и американской компанией Natron Energy. В апреле 2021 года они объявили о достижении стратегического соглашения с целью поставки порошка берлинской лазури (синий пигмент/железисто-синеродистая соль окиси железа), необходимого для производства натриево-ионных аккумуляторов.
Один из бизнесов компании Lonza, компания Lonza Specialty Ingredients, будет производить порошок берлинской лазури для Natron Energy на своем предприятии в городе Фисп (Visp, кантон Вале). С конца следующего 2022 года этот пигмент будут использовать на производстве аккумуляторных электродов на новом предприятии этой компании, рассчитанном на примерно 100 сотрудников и расположенном недалеко от г. Сьон. Оттуда электроды швейцарского производства будут экспортироваться в США для использования в накопителях энергии от компании Natron.
Статья в этом материале
Ключевые слова:Атомные батарейки и зарядка по Wi-Fi: будущее рынка сохранения энергии
Ученые и компании ищут новые решения для хранения энергии. РБК Тренды разобрались, чем уже скоро станут привычные нам аккумуляторы
⏰ Время на чтение: 10–12 минут
Согласно отчету Verified Market Research, мировой рынок аккумуляторов по итогам 2019 года оценивался в $36,35 млрд. К 2027 году он может вырасти до $116 млрд. При этом объем российского сегмента рынка систем накопления энергии к 2025 году может составить $1,5-3 млрд в год. Минэнерго в своей концепции 2017 года заявляло о $8 млрд к 2025 году.
Наиболее популярными хранилищами энергии остаются литий-ионные аккумуляторы. Однако компании и исследователи находятся в поиске новых решений, которые станут более энергоемкими, дешевыми и экологичными.
Электротранспорт и бытовая техника
Продвинутый Li-Ion
В 2019 году Tesla объявила о разработке батарей, способных выдержать 1 млн миль (свыше 1,6 млн км) пути без необходимости замены. Текущие аккумуляторы нужно менять после 300 — 500 тыс. миль проделанного пути.
Новая батарейка Tesla (Фото: electrek.co)
Речь идет о литий-ионных батареях с катодом следующего поколения и новым электролитом. Даже при температуре в 40 °C они выдерживают 4 000 циклов заряда-разряда, а с активной системой охлаждения аккумуляторы смогут выдерживать до 6 000 циклов. Пока вышли первые протестированные образцы.
Графит
В 2020 году Mercedes-Benz объявил о планах по созданию органического аккумулятора. Основой технологии станет графит с электролитом на водяном растворе. Это позволит исключить использование тяжелых и токсичных металлов, а утилизировать батареи можно будет путем компостирования. Однако в Mercedes отмечают, что начало массового производства таких аккумуляторов начнется не раньше, чем через 15 лет.
Углеродные волокна
В 2021 году группа ученых из технологического университета Чалмерса в Швеции представила аккумулятор для автомобиля из углеродного волокна. Ученым удалось добиться номинального напряжения 2,8 В, а батареи имели удельную емкость 8,55 А·ч/кг, плотность энергии 23,6 Вт·ч/кг (при 0,05 °C), удельную мощность 9,56 Вт/кг (при 3 °C) и толщину 0,27 мм. Это примерно 4 680 ячеек, которые Tesla помещает в электрокары, чтобы иметь плотность энергии 380 Вт·ч/кг.
Пластина аккумулятора из углеродного волокна (Фото: Advanced Energy and Sustainability Research)
Батарея из углеродного волокна в виде крышки багажника (Фото: Advanced Energy and Sustainability Research)
В будущем такие аккумуляторы из композитных материалов можно будет использовать как в автомобилях, так и в самолетах, чтобы сделать их легче и экологичнее. Пока ведутся испытания прототипов разных форм-факторов.
Без кобальта
В конце 2019 года IBM представила образец аккумулятора без никеля и кобальта, из материалов, которые могут быть получены из морской воды. Он включает комбинацию катодного материала без тяжелых металлов и безопасного жидкого электролита с высокой температурой горения. Специалисты уже подсчитали, что эти материалы могут сделать аккумуляторы дешевле существующих литий-ионных и при этом будут иметь более высокие характеристики скорости зарядки и энергетической плотности, а также будут менее огнеопасными.
Авторы разработки считают, что у нее есть потенциал для внедрения в отрасль электромобилей. Для достижения заряда на уровне 80% батарее требуется менее пяти минут, она имеет энергоэффективность более 90%, а ее мощность превышает 10 000 Вт/л, что больше показателей самых мощных литий-ионных батарей. Кроме того, тесты показали, что батарея способна прослужить достаточно долго, чтобы ее можно было использовать в интеллектуальных электросетях и новой энергетической инфраструктуре.
Для будущего производства аккумуляторов IBM уже заключила коммерческое соглашение с Mercedes-Benz, поставщиком электролита Central Glass и производителем батарей Sidus.
Полимеры
В 2017 году стартап Ionic Materials презентовал полимерный аккумулятор, который в перспективе сможет заменить литий-ионные. Компания заявила, что полимерные литий-металлические аккумуляторы будут безопаснее, долговечнее и экономически выгоднее, так как процесс их производства похож на производство пластиковой упаковки.
Аккумулятор Ionic Materials (Фото: ionicmaterials.com)
Разработка имеет высокое относительно литий-ионных аккумуляторов напряжение (5 В). Прототип, как заявляет производитель, выдерживает до 400 циклов заряда-разряда. Компания работает над тем, чтобы увеличить этот показатель втрое.
Полимер для аккумуляторов получили из алюминия и других распространенных материалов.
На цинке
EnZinc, стартап по производству цинковых батарей, заявил в 2021 году, что нашел способ для замены лития на нетоксичный и дешевый цинк в аккумуляторах. До этого на рынке существовали только неперезаряжаемые цинковые батареи.
Уже появились первые цинковые батареи, которые можно быстро заряжать и разряжать, и которые имеют высокую емкость, 460 Вт·ч/кг (по сравнению со 120 Вт·ч/кг для больших литиевых аккумуляторов). Они выдерживают несколько тысяч циклов зарядки и разрядки. Ведутся испытания образцов.
Такие батареи могут стоить $100 за кВт·ч, что вдвое дешевле самых простых литий-ионных версий. Их можно будет масштабировать для мобильных телефонов и до транспортных систем, а также для нужд электроэнергетики.
«Вечная атомная батарейка»
В 2020 году американский стартап Nano Diamond Battery представил прототип бета-гальванической батареи, которая потенциально может проработать тысячи лет. Разработка имеет специальный корпус из синтетических алмазов, внутрь которого помещен радиоактивный центр, работающий на переработанных ядерных отходах углерода-14. Бета-излучение изотопов преобразуется в электрический ток.
Испытания батарейки показали, что радиационный фон остается в норме, а сама она не выделяет углекислый газ. При этом ее стержень «фонит» до 28 тыс. лет, и именно столько может работать батарейка.
Nano Diamond Battery уже предложила разные форм-факторы, в том числе широко распространенные АА, AAA, 18650, CR2032 и другие.
Разные форм-факторы атомных батереек (Фото: ndb.technology)
Пока разработку будут тестировать предприятия, которые производят, обслуживают и утилизируют продукты ядерного топлива, а также компании аэрокосмической, оборонной и охранной продукции.
Над похожей батарейкой работали и специалисты из НИТУ «МИСиС». Их конструкция работает на никелевом бета-гальваническом элементе, который служит около 20 лет.
Батарейка НИТУ «МИСиС» (Фото: misis.ru)
Кроме того, в МИСиС разработали термохимические ячейки, которые превращают тепло в электрическую энергию. Эти элементы можно размещать на одежде и использовать их энергию для зарядки мобильных устройств.
Термохимические ячейки (Фото: misis.ru)
Альтернативная энергетика
Солнечная энергия
В мае 2012 года международная группа ученых разработала новые ультратонкие металлические электроды на золоте, которые позволят создавать прозрачные солнечные панели. Эти панели можно будет устанавливать в окнах домов и офисов. Они будут аккумулировать энергию солнечного света в течение дня.
А в 2020 году Tesla презентовала собственный инвертор солнечной энергии, который дополнит линейку домашних солнечных батарей компании. Он будет преобразовывать солнечную энергию в энергию постоянного тока, а затем — в энергию переменного тока для бытового потребления. Устройство сможет работать при температурах от минус 30 °C до 45 °C. В зависимости от числа трекеров точки максимальной мощности, оно сможет выдавать от 3,8 кВт до 7,6 кВт мощности.
Инвертор Tesla (Фото: electrek.co)
Геотермальная энергия
Американский стартап UC Won в 2020 году предложил концепцию геотермального накопителя GeoTES (Geological Thermal Energy Storage) для круглосуточного использования солнечной энергии. Система объединит солнечные тепловые коллекторы с параболическими зеркалами (фокусируют лучи в одной точке), подземное хранилище тепла в осадочных породах (образуются при низких температурах и давлении) и электрогенерирующее оборудование на пару в виде трубок и турбины. При нагревании солнцем вода в трубках будет испаряться, а пар будет входить в турбину и одновременно закачиваться под землю, разогревая осадочную породу. Ночью вода под землей будет испаряться уже под воздействием разогретой породы. Получаемый пар используют для выработки электроэнергии.
Схема работы системы GeoTES (Фото: renewgeo.com)
Криосистемы
Стартап из Великобритании Highview Power начал работы в Манчестере по строительству комплекса CRYOBattery мощностью 50 МВт и емкостью 250 МВт·ч. Система CRYOBattery будет захватывать воздух из атмосферы в специальную емкость и сжимать его при сверхнизких температурах (минус 196 °C), чтобы превратить в жидкость. Эту жидкость поместят в баки с теплоизоляцией и низким давлением. Нагревание вернет воздух в газообразное состояние, а газ приведет в действие турбины генераторов, которые будут вырабатывать электричество.
Схема работы CRYOBattery
В мае 2021 года международная группа ученых представила новые ультратонкие металлические электроды из золота, которые можно будет применять для разработки прозрачных солнечных панелей. Потенциально такие панели можно будет встраивать в окна домов и офисов, чтобы аккумулировать энергию.
Гравитация и другие необычные решения
Шотландский стартап Gravitricity в 2021 году объявил о начале пилотного проекта гравитационного накопителя энергии в Эдинбурге, крупнейшем закрытом глубоководном порту.
Демонстрационный образец накопителя энергии Gravitricity мощностью 250 кВт (Фото: gravitricity.com)
Будущие системы Gravitricity будут устанавливаться над 150-1500-метровыми заброшенными шахтами. Масса грузов при этом может варьироваться от 500 т до 5 тыс. т. При спуске груза будет происходить выработка электроэнергии. Она будет возвращаться в сеть в моменты пикового потребления. Приводом лебедки груза будет служить электрическая машина, способная поглощать или вырабатывать электрическую энергию при подъеме или опускании груза. Такая система позволит обеспечить 4 МВт мощности и может проработать 50 лет без потери производительности. Gravitricity собирается внедрять свою технологию в вышедших из эксплуатации шахтах по всему миру.
А ученые Массачусетского технологического института разработали батарею, которая будет питаться углекислым газом из любого источника. Она может поглощать потоки как из выхлопной трубы автомобиля, так и собирать углекислый газ из атмосферы.
Батарея состоит из ряда последовательных камер, в которых находятся электрохимические ячейки, пропускающие поток. Когда она заряжается, на поверхности электродов протекает электрохимическая реакция, а затем батарее требуется разрядка для очистки электродов. Чистый газ при этом откачивается в отдельную камеру.
Cистема может выдерживать не менее 7 тыс. циклов зарядки-разрядки с 30% потерей эффективности за это время. В будущем этот показатель может вырасти до 20–50 тыс. циклов.
Демонстрация работы батареи на углекислом газе
Между тем исследовательская группа из Национального университета Сингапура (NUS) и японского Университета Тохоку (TU) разработала технологию, которая с помощью крошечных интеллектуальных устройств позволит преобразовывать беспроводные радиочастоты в энергию. Таким образом, в будущем микроэлектронику можно будет запитывать с помощью сигналов Wi-Fi.
Unite Руководство пользователя | Аккумулятор
Polar Unite Руководство пользователя:
По окончании срока службы продукта компания Polar рекомендует следовать местным правилам утилизации отходов и, по возможности, сдавать его в пункты утилизации электронных устройств, чтобы минимизировать возможное воздействие отходов на окружающую среду и здоровье человека. Не выбрасывайте этот продукт в несортированные бытовые отходы.
Срок службы и время работы аккумулятора
Часы Polar Unite работают от встроенного перезаряжаемого аккумулятора. Перезаряжаемые аккумуляторы имеют ограниченное число циклов зарядки. Вы можете заряжать и разряжать аккумулятор более 500 раз до того, как заметите ощутимую потерю производительности. Число циклов зарядки зависит от особенностей и условий эксплуатации.
Время работы аккумулятора:
- До 50 часов в режиме тренировки с подключенным GPS и оптическим отслеживанием ЧСС.
- До 4 дней в режиме часов с непрерывным отслеживанием ЧСС.
Время работы аккумулятора зависит от множества факторов, таких как температура окружающей среды, используемые функции и датчики, а также износ аккумулятора. Уведомления с телефона и частая синхронизация с приложением Polar Flow также уменьшают срок службы аккумулятора. Время работы существенно сокращается при температурах значительно ниже нуля. При низкой температуре воздуха прячьте часы под верхней одеждой. Это позволит их согреть и продлить время работы.
На часах Polar Unite функция непрерывного отслеживания ЧСС включена по умолчанию. Обратите внимание, что при постоянно включенной функции непрерывного отслеживания ЧСС аккумулятор часов садится быстрее. Ночной режим продлит срок службы аккумулятора. Для включения/выключения непрерывного отслеживания ЧСС или переключения в ночной режим перейдите на часах в раздел Настройки > Общие настройки > Непрерывное отслеживание ЧСС.
Подсветка всегда включена во время тренировки: при постоянно включенной подсветке экран подсвечивается на протяжении всей тренировки. После завершения тренировки настройка подсветки по умолчанию переходит в автоматический режим. Обратите внимание, что при всегда включенной подсветке аккумулятор садится намного быстрее.
Зарядка аккумулятора
Перед зарядкой убедитесь в отсутствии влаги, пыли и других загрязнений на контактах зарядных коннекторов часов и USB-адаптера для зарядки. Протрите загрязненный или влажный участок. Не заряжайте часы, если они влажные.
Не заряжайте аккумулятор при температуре ниже 0 °C / +32 °F или выше +40 °C / +104 °F или если USB-порт влажный.
Подсоединяйте USB-адаптер для зарядки к часам перед подключением адаптера к источнику питания.
Не оставляйте USB-адаптер для зарядки подключенным к источнику питания, если он не подсоединен к часам.
Для зарядки устройства через USB-порт компьютера в комплект входит USB-адаптер. Кроме того, можно заряжать аккумулятор с помощью розетки. При зарядке через розетку используйте адаптер питания USB (не входит в комплект).
Аккумулятор можно заряжать от сетевой розетки. Для зарядки от сетевой розетки вам потребуется USB-адаптер (в комплект не входит). Если вы используете адаптер питания USB, убедитесь, что на адаптере есть отметка «output 5Vdc», и что он обеспечивает минимальную силу тока 500 мА. Используйте только утвержденный адаптер питания USB (с отметкой «LPS», «Limited Power Supply», «UL listed» или «CE»).
Не заряжайте изделия Polar зарядным устройством на 9 Вольт. Использование зарядного устройства на 9 Вольт может повредить ваше изделие Polar.
Чтобы зарядить аккумулятор с помощью компьютера, просто подключите часы к компьютеру. Одновременно с зарядкой вы можете синхронизировать часы с FlowSync.
- Чтобы зарядить часы, подключите их к питаемому USB-порту или зарядному устройству USB с помощью USB-адаптера для зарядки, который входит в комплект. Совместите контакты USB-адаптера для зарядки с контактами на часах и вставьте адаптер на место. Убедитесь, что вы правильно подключаете USB-адаптер для зарядки: четыре контакта USB-адаптера Polar Unite должны быть обращены к четырем контактам USB-порта компьютера или зарядного устройства USB.
- На дисплее появится надпись «Идет зарядка».
- Как только значок аккумулятора заполнится, часы полностью заряжены.
Не оставляйте аккумулятор разряженным длительное время и не держите его все время полностью заряженным, иначе срок службы аккумулятора сократится.
Статус аккумулятора и уведомления
Значок статуса аккумулятора
Значок статуса аккумулятора появляется, когда вы поворачиваете свое запястье, чтобы посмотреть на часы, или возвращаетесь в режим отображения времени из меню. Значок статус аккумулятора также есть в Меню быстрых настроек, где отображается оставшийся уровень заряда аккумулятора в процентах.
Уведомления аккумулятора
- При низком уровне заряда аккумулятора в режиме времени отображается сообщение «Низкий заряд аккумулятора. Зарядите». Рекомендуется зарядить часы.
- Если заряда аккумулятора недостаточно для записи тренировочных данных, появляется сообщение «Зарядите устройство перед тренировкой».
Индикатор низкого заряда аккумулятора во время тренировки:
- Низкий заряд аккумулятора отображается, когда заряд аккумулятора становится низким. Уведомление повторяется, если уровень заряда становится слишком низким для измерения ЧСС и данных GPS, и если функции измерения ЧСС и GPS отключены.
- Когда уровень заряда аккумулятора критически низок, появляется уведомление «Запись завершена». Часы прекращают запись тренировочных данных и сохраняют их.
Когда на дисплее нет никаких данных, это означает, что аккумулятор разряжен, и часы перешли в спящий режим. Зарядите часы. Если аккумулятор полностью разряжен, для повторного включения дисплея может потребоваться некоторое время.
Время работы аккумулятора зависит от множества факторов, таких как температура окружающей среды, используемые функции и датчики, а также износ аккумулятора. Частая синхронизация с приложением Flow также уменьшает время работы аккумулятора. Время работы существенно сокращается при температурах значительно ниже нуля. При низкой температуре воздуха прячьте часы под верхней одеждой. Это позволит их согреть и продлить время работы.
Обслуживание лодочных аккумуляторов | ЭлектроФорс
Аккумулятор для запуска двигателя на катере должен быть всегда полностью заряжен. Это вопрос безопасности, им пренебрегать не стоит. Гарантированно запустить двигатель позволят два попеременно используемых АКБ. Или независимые стартовый и сервисный аккумуляторы.
Содержание статьи
Как выбрать аккумуляторы
Вы используете аккумуляторную батарею, пока двигатель не работает? Если нет, вам нужен стартовый аккумулятор. Выбрать стартовый аккумулятор. Если используете, следуйте следующим рекомендациям:
- Разделите цепи запуска двигателя и бортового оборудования. Выберите для каждой из них подходящую аккумуляторную батарею
- Подберите аккумулятор для запуска двигателя исходя из тока холодного пуска (ССА), рекомендуемого производителем двигателя
- Выберите сервисный аккумулятор таким образом, чтобы его емкость в 2-4 раза превышала потребляемое количество ампер-часов между зарядками.
- Объедините все сервисные аккумуляторы в одну батарею, вместо того, чтобы использовать два аккумулятора попеременно. Вне зависимости от схемы подключения всегда держите в резерве заряженный аккумулятор для запуска двигателя
- В правильно настроенной системе стартовый аккумулятор заряжается напрямую от генератора, а дополнительный в собственном режиме через зарядное устройство
Схема подключения аккумуляторов
Четырехпозиционный переключатель аккумуляторов. Подключает один из аккумуляторов ко всей нагрузке. Или соединяет аккумуляторы между собой и подключает их к нагрузке. Чаще всего используется с двумя аккумуляторами глубокого разряда. В этом случае ток холодного пуска каждого аккумулятора должен превышать пусковой ток двигателяСрок службы аккумуляторной батареи зависит от уровня разряда. Чем глубже аккумулятор разряжается в каждом цикле, тем короче его жизнь. Поэтому два соединенных аккумулятора служат дольше, чем, используемые попеременно.
Blue Sea 6006
1 аккумулятор
2 положения
Не объединяет аккумуляторы
- 900 Ампер     
Максимальный ток в одной цепи в течении 30 сек
- 300 Ампер     
Длительный непрерывный ток в одной цепи
- 48 Вольт     
Максимальное напряжение в цепи
Blue Sea 6007
2 аккумулятора
4 положения
Объединяет аккумуляторы
- 900 Ампер     
Максимальный ток в одной цепи в течении 30 сек
- 300 Ампер     
Длительный непрерывный ток в одной цепи
- 32 Вольта
Максимальное напряжение в цепи
Blue Sea 6011
2 аккумулятора
3 положения
Объединяет аккумуляторы
- 675 Ампер     
Максимальный ток в одной цепи в течении 30 сек
- 300 Ампер     
Длительный непрерывный ток в одной цепи
- 32 Вольта     
Максимальное напряжение в цепи
Когда к аккумулятору подключается нагрузка, его напряжение слегка падает, а затем плавно снижается, а на определенном уровне резко падает и аккумулятор перестает давать ток. Падение напряжения в начале работы, скорость его снижения и порог отключения зависят от потребляемого тока и емкости аккумулятора. Чем меньше их отношение, тем слабее падает напряжение в начале работы и медленнее снижается в дальнейшем.
Батарея из двух аккумуляторов, обеспечивает более стабильное напряжение, чем два аккумулятора, используемые попеременно.
Чем больше емкость аккумуляторной батареи, тем большим током ее можно заряжать. Значит время зарядки будет меньше
Для единственной аккумуляторной батареи легче настроить оптимальный режим зарядки. Если же используются два аккумулятора, то как правило они разного типа, возраста и емкости. Их режим зарядки всегда далек от идеального.
Батарейные переключатели Blue Sea 5511 или 6011 подключают нагрузку к двум независимым аккумуляторным батареям и соединять их между собой в случае необходимости.
Сервисный и стартовый – это два различных по назначению аккумулятора, поэтому их всегда используют совместно. К сервисному подключают инвертор, обогреватель, помпу и другое бортовое оборудование. Стартовым запускают двигатель. Между аккумуляторами устанавливают трехпозиционный переключатель. В одном из положений переключатель соединяет обе группы аккумуляторов параллельно, поэтому дополнительный аккумулятор можно использовать для подзарядки стартового или для запуска двигателя.
Во время движения стартовый аккумулятор заряжают напрямую от генератора двигателя, для зарядки сервисного устанавливают DC-DC зарядное устройство. Схема подключения аккумуляторов Скачать
5 ошибок при зарядке АКБ
- Аккумулятор оставлен в разряженном состоянии на длительное время. Возникает сульфатация, из-за которой уменьшается емкость аккумулятора. Установите бортовое зарядное устройство и заряжайте аккумулятор, если использовали его более 30 минут
- Низкое напряжение зарядки. Внутренние области толстых пластин остаются недозаряженными. Аккумулятор заряжается не на 100%. Время работы оборудования меньше, чем могло быть. Возникает сульфатация и потеря емкости. Используйте зарядное устройство у которого есть режим для вашего типа АКБ. Чем выше напряжение зарядки, тем больше энергии сохраняет аккумулятор. Проводите десульфатацию аккумуляторов
- Перезарядка аккумулятора. Электролит выделяет газ, аккумулятор теряет воду и пластины высыхают. Опасно для GEL и AGM аккумуляторов. Используйте автоматическое зарядное устройство с алгоритмом для вашего типа АКБ.
- Зарядка чрезмерно высоким током. Аккумулятор нагревается, пластины коробятся, между ними происходит замыкание и аккумулятор выходит из строя. Используйте зарядное устройство с температурной компенсацией. Датчик температуры должен быть установлен на аккумуляторе. Зарядное устройство уменьшает напряжение, если температура АКБ повышается
- Неправильный режим хранения. Во время хранения аккумуляторы разряжаются и начинается сульфатация. Опаснее всего для АКБ с жидким электролитом. Установите бортовое зарядное устройство с режимом поддерживающей зарядки. Оставляйте зарядное включенным при длительном хранении аккумуляторов
Почему не держат АКБ на катере
Когда батарея перестает держать нагрузку, нормальная реакция – это винить аккумуляторы. Однако часто проблема заключается в другом. В первую очередь проверьте нет ли утечек тока. Они могут возникнуть из-за следующих причин:
- Грязь и влага на верхней крышке аккумулятора
- Одно или несколько устройств, например, навигационные огни, оставлены включенными
- Суммарная нагрузка от светодиодов на приборной панели, переключателях и измерительных приборах слишком большая и они разряжают аккумуляторы
- Сигнализация, подключенная напрямую к аккумуляторной батарее или другие устройства периодически обновляют программное обеспечение или состояние памяти
- Существуют утечки на землю в цепях постоянного тока
Возможно аккумуляторы заряжаются не полностью. Как правило первоначально аккумуляторы на судне заряжены на 100%. Но каждый день из-за неправильной зарядки аккумуляторы получают чуть меньше чем расходуют и количество хранимой ими электрической энергии уменьшается. Когда в один прекрасный момент аккумуляторы не справятся с нагрузкой владелец посчитает, что аккумуляторы вышли из строя. Однако реальная причина неприятностей – неправильная зарядка.
Аккумуляторы заменяют часто и без необходимости, особенно если используется не подходящее зарядное устройство или зарядка идет от генератора с регулятором напряжения автомобильного типа.
Зарядные устройства, которые правильно заряжают любые типы тяговых аккумуляторов
Ultra Light
зарядное устройство30 Ампер
Зарядные профили для Gel, AGM, жидко-кислотных и LiFePO4 аккумуляторов. Режим блока питания и половинной мощности. Вход для BMS
- Два выхода     
Каждый выход зарядного устройства способен нести максимальный ток. Суммарный ток не превышает 30 А
Ultra
зарядное устройство60 Ампер
Морское зарядное устройство. КПД > 90%. Три выхода. 12 зарядных профилей. Gel, AGM, жидкий-электролит, LiFePO4.
- Температурный датчик в комплекте     
Устройство уменьшает зарядное напряжение, если температура аккумулятора превышает 20 С
PS1255
зарядное устройство10 Ампер
Водонепроницаемое зарядное устройство. Два выхода. Ток 10 А
- Подходит для одного двух независимых или последовательно соединенных аккумуляторов     
Зарядный ток изменяется от 0 до 10 А на канал
Признаки проблемных аккумуляторов
Все раньше или позже выходят из строя. Следующие симптомы сигнализируют о проблемах свинцово-кислотных аккумуляторов:
Без нагрузки у аккумулятора нормальное напряжение, однако под нагрузкой оно резко снижается. Емкость аккумулятора меньше номинальной. Если во время зарядки напряжение аккумулятора быстро возрастает, значит в аккумуляторных пластинах осталось лишь небольшое количество активного материала, способного воспринимать зарядку. Это могло произойти из-за сульфатации или выпадения активного материала из решёток. В любом случае аккумулятор в ближайшее время выйдет из строя, поскольку у него работает лишь небольшая часть пластин. В некоторых случаях сульфатированный активный материал можно вернуть к жизни. Но если он осыпался, то это непоправимо.
В аккумулятор с жидким электролитом не приходится доливать воду. Этот аккумулятор регулярно недозаряжается. Недозарядка ведет к сульфатации и преждевременному выходу из строя. Аккумуляторы с жидким электролитом, работающие в циклическом режиме (глубокий разряд – зарядка) требуют около одной чашки воды на ячейку в месяц.
В аккумулятор с жидким электролитом необходимо часто доливать воду. Этот аккумулятор перезаряжается. Потери воды у аккумуляторов должны составлять не более 60 мл на ячейку (360 мл на аккумулятор) в течении 30-50 часов зарядки. Если вода расходуется только в одной ячейке, скорее всего в ней короткое замыкание.
Во всех ячейках плотность электролита остается постоянно низкой. Аккумулятор необходимо перезарядить. Если полностью зарядить его не удается (это можно определить по плотности электролита) аккумулятор умер. Если разница между наибольшей и наименьшей плотностью электролита равна 0,03, то скорее всего ячейка с наименьшей плотностью умерла. Если после зарядки разница остается больше 0,03, эта ячейка умерла точно (замкнута накоротко). Если электролит мутный или темный, скорее всего пластины сломаны.
В течении 2-3 недель напряжение на неиспользуемом или изолированном аккумуляторе заметно падает (от полной зарядки до 75% и меньше). В аккумуляторе короткое замыкание. Возможно выпавший активный материал замкнул между собой положительные и отрицательные пластины. Исправить это нельзя.
Белый налет вокруг клапанов у гелевого или AGM аккумулятора. Аккумулятор был перезаряжен, клапана открылись и газ вышел наружу. Аккумулятор поврежден. В некоторых случаях, если открыть клапана и добавить дистиллированной воды, аккумулятор можно на некоторое время вернуть в работу. Однако после того как герметичность клапанов нарушена, он долго не проживет. Не делайте этого, если не уверены, что вы действительно сильно перезарядили аккумулятор. После того как вы намеренно открыли клапана, аккумулятор необходимо считать обслуживаемым и относится к нему также до тех пор, пока вы не замените его.
Клеммы у гелевого или AGM аккумулятора черного цвета. Скорее всего нарушена герметичность вокруг клемм. Если это так, то рано или поздно произойдет выброс электролита и аккумулятор выйдет из строя. Чтобы проверить герметичность, отсоедините кабель от аккумулятора и почистите раствором соды крышку вокруг его клемм. Затем надавите на корпус в этом месте. Если раствор соды пузырится, корпус потерял герметичность.
Как работают батареи? | Полное руководство по хранению энергии
Батареи — неотъемлемая часть современного мира. Они позволяют нам переносить энергию с собой и питать наши устройства без необходимости подключения к розетке или шнуру. Однако потребность в накопителях энергии и батареях, которые служат дольше и питают более энергоемкие устройства, настолько возрастает, что в их будущем могут возникнуть проблемы.
Присоединяйтесь к нам, и мы расскажем, как работают аккумуляторы, из чего сделаны разные типы, а также возможные проблемы с безопасностью и производительностью.
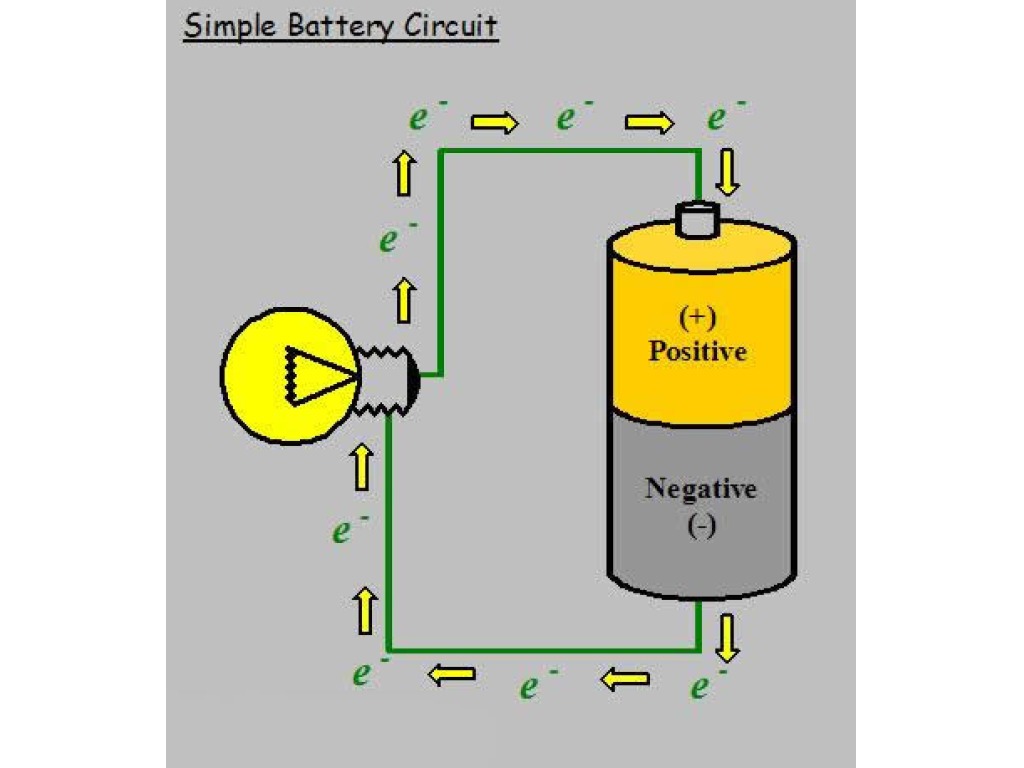
Как работают батареи?Батареи — это устройства, используемые для хранения химической энергии, которая может быть преобразована в полезную портативную электрическую энергию. Они обеспечивают свободный поток электронов в виде электрического тока, который может использоваться для питания устройств, подключенных к источнику питания батареи. Батареи уравновешивают этот поток электронов с помощью раствора электролита, который контактирует с электродами на положительном и отрицательном концах — маленькие знаки «плюс» и «отрицательный», которые вы видите на всех батареях.
Хотя это общий метод работы батарей, существует несколько различных способов их работы. К ним относятся электрохимические, которые производят электричество с использованием электролита и двух разных металлов, взвешенных внутри, позволяя электронам течь от отрицательного конца к положительному, создавая ток.
Из чего сделаны батареи?Типичная батарея состоит из стального корпуса и смеси цинка с марганцем и калием или графитом.Кроме того, остальные компоненты сделаны из пластика и бумаги снаружи. Это относится к обычным бытовым батареям, таким как щелочные AA, AAA, C, D и 9-вольтовые версии, а также к батареям в корпусе, например, в вашем телефоне или автомобиле.
Как делаются аккумуляторы?Стальной контейнер образует кожух батареи, в котором находятся электроды, анод (отрицательная клемма) и катод (положительная клемма). Положительная сторона батареи сделана из колец диоксида марганца и графита.Отрицательная сторона сделана из цинковой пасты, расположенной внутри разделителя, который предотвращает соприкосновение электродов друг с другом. Это единственное, что предотвращает короткое замыкание внутри батареи.
Когда были изобретены батарейки?Первый экземпляр «настоящей» батареи был создан итальянским физиком Алессандро Вольта в 1800 году. Вольта использовал медь и цинк, укладывая их в столбики, разделенные кусками ткани, пропитанной рассолом (соленой водой). Затем он подключил провода к обоим концам колонн, которые производили стабильный и непрерывный ток.
Что касается современных батарей, первая свинцово-кислотная батарея была создана в 1859 году. Эти батареи до сих пор используются почти во всех транспортных средствах с двигателями внутреннего сгорания. Они также положили начало тенденции к перезаряжаемым батареям.
Сегодня аккумуляторы невероятно разнообразны. Они варьируются по размеру от достаточно больших, чтобы хранить энергию от солнечных ферм, до достаточно маленьких, чтобы поместиться в электронных часах — и многие батареи теперь являются перезаряжаемыми.
Какие бывают типы батарей?источник
Есть две основные категории батарей: аккумуляторные, как в телефонах и ноутбуках, и неперезаряжаемые, как, например, обычные батарейки в пультах дистанционного управления телевизора.Однако в каждой из этих категорий есть несколько типов батарей, которые сделаны из разных материалов и имеют разные свойства.
Неперезаряжаемые батареиСуществует три основных типа неперезаряжаемых батарей: угольно-цинковые, щелочные и литиевые. Щелочные батареи являются наиболее популярным типом, в то время как литиевые батареи также распространены, хотя обычно предпочтительны близкие к ним литий-ионные батареи из-за их перезаряжаемой природы. Углеродно-цинковые батареи проще всего построить, но они не подходят для современных устройств.
Цинк-угольные батареиЭто были первые коммерческие «сухие» батареи, в которых все находилось в кожухе и не было влажных частей, о которых нужно было беспокоиться. Они используются в фонариках и других устройствах почти 150 лет.
Щелочные батареиЭто типичный аккумулятор, который вы найдете у себя дома, например, в пульте дистанционного управления от телевизора или настенных часах. Они бывают стандартными AA, AAA, C, D и 9-вольтовыми.
АккумуляторыПерезаряжаемые батареи раньше выглядели так же, как неперезаряжаемые батареи, и их обычно вынимали для установки в зарядное устройство. Сегодня почти все аккумуляторные батареи остаются подключенными к электронным устройствам во время зарядки через кабель, как и в случае с любым телефоном, ноутбуком или беспроводными наушниками.
Литий-ионные батареи— это популярный выбор для устройств, которым необходимо длительное время сохранять заряд, но они также подвержены взрыву, так как их содержимое легко воспламеняется.Таким образом, никелевые батареи являются более безопасным выбором, даже если они не обеспечивают такой же выходной мощности. Свинцово-кислотные батареи также очень полезны для более крупных устройств или машин, таких как транспортные средства или портативные устройства хранения электроэнергии.
Никель-кадмиевые батареиНикель-кадмиевые (NiCd) батареи в заряженном состоянии содержат гидроксид никеля в положительном электроде и кадмий в отрицательном электроде. Эти батареи вырабатывают очень большие токи и могут быстро перезаряжаться.
Никель-металлогидридные батареиНикель-металлогидридные (NiMH) батареи в заряженном состоянии содержат гидроксид никеля в положительном электроде и металлический сплав в отрицательном электроде. Это довольно стабильный и надежный аккумулятор.
Литий-ионные батареи Литий-ионные батареисодержат анод (отрицательный электрод) и катод (положительный электрод), каждый из которых служит хозяином для ионов лития, которые обеспечивают длительную энергию.
Свинцово-кислотные батареиСвинцово-кислотные батареи — самая старая форма аккумуляторных батарей. Чаще всего они используются в автомобильных двигателях и больших портативных зарядных устройствах.
Батареи переменного или постоянного тока?Батареи используют электричество постоянного тока, как и все электронные устройства, которые они питают. Даже если подается переменный ток, он преобразуется в постоянный, как только входит в устройство. Обычные бытовые аккумуляторы подают на устройства около 1,5 вольт постоянного тока.
Батареи конденсаторы?Батареи и конденсаторы различаются одним главным образом: батареи накапливают заряд химически, а конденсаторы — электрически. Это хранилище является важным отличием, поскольку химические реакции могут накапливать больше энергии, что делает батареи более полезными в повседневных ситуациях.
Конденсаторы — это пассивные компоненты схемы, а не активные, и они имеют более низкую плотность энергии, чем батареи. Из-за этого скорость заряда и разряда конденсаторов выше — они мгновенно разряжаются при понижении напряжения, в то время как батареи могут работать в течение длительного периода с постоянным напряжением.
Могут ли батареи намокнуть?источник
Батареи не должны намокать или даже подвергаться воздействию воды. Как только вода попадает в батарею, ее чрезвычайно сложно вывести из-за предохранительного вентиляционного отверстия, которое есть в типичных батареях. Это сделано для предотвращения утечки жидких химикатов, из которых состоит батарея.
Автомобильные аккумуляторы, с другой стороны, обычно легко намокают. Это потому, что они специально разработаны, чтобы не допустить попадания воды внутрь — они защищены прочным водонепроницаемым кожухом.
Можно ли перерабатывать батареи?Вообще говоря, большинство типов батарей можно легко утилизировать. Тем не менее, некоторые батареи утилизируются легче, чем другие. Сюда входят свинцово-кислотные автомобильные аккумуляторы, которые перерабатываются почти 90% времени. Есть несколько способов утилизации батарей — обязательно посетите Earth 911, чтобы найти одобренные пункты утилизации рядом с вами, и веб-сайт EPA для получения информации о том, как утилизировать бытовые батареи.
Какие проблемы с аккумуляторами?Помимо потенциального воздействия на окружающую среду свинца и других химикатов, содержащихся в батареях, эти же материалы могут вызвать ожоги и иным образом повредить кожу и глаза.Кроме того, токсичные металлы, содержащиеся во многих батареях, например содержащие никель и кадмий, являются известными канцерогенами для человека. Вдобавок к этому, одни из самых тяжелых воздействий на окружающую среду, связанных с аккумуляторными батареями, возникают на стадии производства во время горнодобывающей и нефтеперерабатывающей промышленности.
Могут ли батареи взорваться?Да, когда батареи оставляют рядом с постоянным источником тепла, они могут взорваться. Это справедливо в основном для щелочных батарей и свинцово-кислотных батарей. Это может случиться даже с литий-ионными батареями в сотовых телефонах, которые взорвались во время зарядки и стали слишком горячими.
Могут ли батареи замерзнуть?Батареи могут замерзнуть, но их точка замерзания намного ниже, чем у воды. Полностью заряженный аккумулятор не замерзнет примерно до -92 ° F (-69 ° C). Однако, когда зарядка составляет всего 40%, батареи замерзают при температуре примерно -16 ° F (-27 ° C). Важно, чтобы батареи были сильно заряжены, чтобы предотвратить нежелательное замерзание.
Можно ли брать батареи в самолет?Батареи разрешены в самолетах, но это зависит от того, как вы их упаковываете, а также от типа батареи.Обычные сухие батареи, такие как типичные бытовые батареи (AA, AAA, C, D или 9-вольтные), разрешается упаковывать как в ручную кладь, так и в зарегистрированные сумки. Однако, согласно TSA, запасные неустановленные литиевые батареи не разрешены в самолетах. Они разрешены только в том случае, если они установлены на рабочих устройствах, таких как ноутбуки или телефоны.
Какой аккумулятор самый опасный?По большому счету, литий-ионные аккумуляторы являются наиболее опасными типами аккумуляторов. Во многом это связано с тем, что единственное, что предотвращает короткое замыкание, — это тонкая полоска полипропилена (разновидность пластика).Это проскальзывание предотвращает соприкосновение каждого электрода с другим, а если он сломан, электроды соприкасаются, что создает много тепла. Добавьте к этому тот факт, что эти батареи заполнены легковоспламеняющимся раствором электролита, и это верный путь к опасности. Это может привести к взрывам, которые повредят ваши устройства или, что еще хуже, вашу кожу.
Вредны ли батареи для окружающей среды?источник
Батареи имеют сложную взаимосвязь с окружающей средой.По мере того, как мы движемся к замене ископаемого топлива чистой энергией, батареи являются неотъемлемой частью этого процесса. Однако воздействие добычи лития на окружающую среду само по себе становится серьезной проблемой.
Важно уменьшить воздействие на окружающую среду, которое в конечном итоге вызвано спросом на все больше и больше энергии. Тот факт, что мы переходим на ископаемое топливо, не решает проблему сразу — нам нужно убедиться, что мы не создаем те же проблемы в связи с растущим кризисом минеральных ресурсов, связанным с производством аккумуляторов.
Такие компании, как Tara Energy, находятся в авангарде ответственного энергоснабжения, уравновешивающего воздействие на окружающую среду по всем направлениям. Энергия ветра может храниться в батареях, но если батареи сводят на нет положительное воздействие на окружающую среду от источников ветра, это не настоящее достижение. Помня об этом, мы должны продолжать удовлетворять потребность в батареях.
Получено от taranergy.com
Все изображения лицензированы Adobe Stock.
Главное изображение
Как работают батареи? | Ваше подробное руководство
Алессандро Вольта случайно создал первую батарею в 1800 году.Он пытался доказать своему коллеге-ученому, что нет необходимости использовать ткани животных для выработки электрического тока. Вольте удалось выиграть в своих дебатах, а затем и в некоторых. Непредвиденное изобретение электрохимической ячейки принесло Вольте много почестей. Тем не менее, он оставался очень скромным человеком.
После его кончины лицо Вольта появилось на марках, а также на банкноте в 10 000 итальянских лир, которая вышла из обращения в 2002 году. Имя Вольта живет, поскольку другие отмечали его работу, называя вольт в его честь, единицей измерения, которую мы используем для измерения силы воздействия. электрические токи.
Но что же из того, что обнаружил Вольта, заставило батарею работать? В этой статье мы подробно ответим на часто задаваемые вопросы, в том числе: как работают батареи, из чего они сделаны, какие типы батарей существуют сегодня и какие проблемы у нас возникают с батареями?
Как работают батареи?Батареи — одна из тех вещей, которые большинство из нас принимает как должное. Они просто обычная часть повседневной жизни, которая по большей части остается незамеченной, пока они накапливают энергию и совершают свои магические действия.Вспомните фонарики, сотовые телефоны, пульты дистанционного управления, слуховые аппараты, автомобильные аккумуляторы и даже электромобили.
Но вы когда-нибудь останавливались, чтобы по-настоящему попытаться понять, как на самом деле работают эти незаменимые продукты, которые обеспечивают нас портативной мгновенной энергией? Батареи — это автономные блоки питания, которые накапливают химическую энергию и преобразуют ее в электрическую. Этот процесс известен как электрохимия. Чтобы более подробно объяснить процесс работы батарей, давайте подробно рассмотрим, из чего они сделаны.
Из чего сделаны батареи?источник
Батарея обычно состоит из группы электрохимических ячеек. Есть два разных типа: гальванический (также называемый гальваническим) и электролитический.
- Гальванические или гальванические элементы: Они получают энергию от спонтанных окислительно-восстановительных реакций. В этих клетках химическая энергия превращается в электрическую.
- Электролитические ячейки: Они получают энергию от внешнего источника электронов, такого как источник переменного тока (AC) или постоянного тока (DC).С помощью этих клеток электрическая энергия превращается в химическую энергию.
Давайте посмотрим на пример двух типов ячеек. Когда что-то с перезаряжаемой батареей — например, ваш мобильный телефон или планшет — находится на зарядном устройстве, батарея работает как электролитическая ячейка. Однако пока вы используете свое электронное устройство, аккумулятор работает как гальванический элемент.
Для производства электроэнергии стандартному элементу батареи необходимы следующие три элемента:
- Анод : это отрицательный электрод или отрицательная клемма аккумулятора и место окисления.Это также положительный электрод в электролитической ячейке. Мы обычно используем металлы, такие как литий и цинк, в качестве анода в виде пасты, находящейся внутри детали, называемой сепаратором. Мы используем разделитель для предотвращения коротких замыканий, разделяя отрицательный и положительный электроды.
- Катод : это положительный электрод или положительный вывод батареи. Это также отрицательный электрод в электролитической ячейке. Катод состоит из серебристо-матовых колец из оксидов металлов, таких как графит и диоксид марганца.
- Электролит : это химическое вещество, разделяющее анод и катод. Это химический катализатор в виде липкой пасты или жидкости, который используется между электродами, чтобы сделать батарею проводящей. Это достигается за счет обеспечения механизма переноса ионов между анодом и катодом ячейки. Здесь химическая энергия аккумулятора преобразуется в электрическую. Гидроксид калия, натрий и хлорид являются основными электролитами.
Два разных металла (анод и катод) прикреплены к батарее на противоположных концах друг от друга. Это позволяет протекать химической реакции между электролитом и металлами, позволяя большему количеству электронов проходить через один металл, чем через другой.
Положительный заряд возникает в металле, который принимает более значительное количество электронов. Затем на противоположной стороне образуется отрицательный заряд. Затем, когда провод или внешняя цепь соединяет два конца батареи друг с другом, поток электронов движется по проводу, уравновешивая электрический заряд и производя электрический ток.
Последний шаг — ввести то, что мы называем электрической нагрузкой. Это все, что требует электричества для работы. Возьмем для примера фонарик. Когда вы вставляете батарейки в фонарик и включаете выключатель, вы создаете цепь. Эта схема соединяет свою лампочку с проводом, позволяя электрической энергии течь через провод и лампочку, когда электроны проходят через отрицательный конец батареи, через провод, лампочку и обратно к положительному концу батареи.
Батареи конденсаторы?источник
Накопители энергии прошли долгий путь за эти годы. Сегодня два основных места, где мы храним энергию, — это батареи и конденсаторы. И хотя они очень похожи, это не одно и то же. Давайте посмотрим на сходства и различия между ними.
В чем сходство между батареями и конденсаторами?Вот основные сходства между батареями и конденсаторами:
- Накопленная энергия создает электрический потенциал, обычно известный как напряжение.
- Электрический потенциал генерирует поток электронов, называемый электрическим током.
- Электрический ток может создавать электрическую энергию для питания компонентов в цепи.
Инженеры будут выбирать, использовать ли в своем продукте аккумулятор или конденсатор, в зависимости от конструкции схемы и ее функции. Иногда они сочетаются с обоими. Однако это не означает, что они полностью взаимозаменяемы.
В чем разница между батареями и конденсаторами?Вот основные отличия аккумуляторов от конденсаторов:
- При сравнении батареи и конденсатора одинакового объема, батарея имеет в тысячи раз большую емкость для хранения энергии, чем конденсатор.
- Батареи надежны, они поставляют энергию постоянным потоком.
- Конденсаторы часто могут обеспечивать выбросы энергии быстрее, чем батареи.
- Конденсаторы накапливают электрическое поле энергии, что делает их перезаряжаемыми. Напротив, батареи хранят свою энергию в химическом поле, которое часто не может перезарядиться.
- Батареи имеют тенденцию терять способность удерживать заряд, но этого не происходит с конденсаторами.
- Простые конденсаторы обычно изготавливаются из нетоксичных материалов, поэтому их можно безопасно утилизировать.
Переменный ток (AC) — это поток электронов, который регулярно меняет направление, много раз в секунду. Большинство наших бытовых приборов работает от сети переменного тока. Например, большинство наших микроволновых печей, кофейников, посудомоечных машин, телевизоров и даже наших систем отопления, вентиляции и кондиционирования воздуха работают от переменного тока. Однако, поскольку электроны батареи текут только в одном направлении, батареи генерируют постоянный ток (DC).Многие портативные устройства, такие как фонарики, сотовые телефоны и mp3-плееры, работают от постоянного тока, обеспечиваемого батареями.
Какие бывают типы батарей?источник
Не все батареи одинаковы. Батареи разных типов состоят из других химикатов и работают с различными химическими реакциями. Давайте взглянем на семь наиболее распространенных типов батарей.
1. Щелочная батареяDuracell® и Energizer® — две популярные марки, производящие щелочные батареи.Это наши стандартные батареи AA, AAA, C, D и 9 В. Электроды в этих батареях — оксид марганца и цинк. Электролит представляет собой щелочную пасту гидроксида калия или натрия.
2. Свинцово-кислотная батареяСвинцово-кислотные батареи — это то, что мы используем для автомобильных аккумуляторов и фотоэлектрических солнечных систем. Электроды в этих батареях — свинец и оксид свинца, а электролит — сильная кислота.
3. Литиевая батарея В камерахс лампами-вспышками используются литиевые батареи, но в остальном большинство литиевых батарей, с которыми вы сталкиваетесь, имеют форму монет или таблеток для таких вещей, как часы и другие небольшие маломощные устройства.Хотя они не дают большой мощности, вы можете складывать литиевые батареи, чтобы получить более высокое напряжение. Все литиевые батареи используют металлический литий в качестве анода и не подлежат перезарядке. По этой причине их также называют первичными литий-металлическими батареями. Катод может быть разным, но в наиболее распространенных литий-металлических батареях обычно используется диоксид марганца.
4. Литий-ионный аккумуляторСотовые телефоны и другое портативное электронное оборудование обычно работают от литий-ионной батареи, которая является перезаряжаемой.Кроме того, литий-ионные батареи стали популярными для использования в электромобилях и крупных интеллектуальных сетях. В качестве анода в литий-ионных батареях используются литий-углеродные соединения. В катоде используются оксиды лития-металла.
5. Никель-кадмиевый или никель-кадмиевый аккумуляторМы находим никель-кадмиевые батареи, которые представляют собой перезаряжаемые батареи, в электроинструментах, а также во многих наших небольших бытовых приборах. Электроды в этих батареях — гидроксид никеля и кадмия, а электролит — гидроксид калия.
6. Никель-металлогидридный аккумулятор (NIMH)Никель-металлогидридные батареи также являются перезаряжаемыми батареями, которые используются в устройствах с высоким коэффициентом разряда, таких как цифровые камеры и игровые контроллеры. Эти батареи используют положительные электроды из оксигидроксида никеля, а отрицательные электроды — из сплава, поглощающего водород.
7. Цинк-угольные сухие элементы или стандартные угольные батареиЕсли вы покупаете продукт с «батареями в комплекте», велика вероятность, что в нем есть угольно-цинковые батареи из-за их низкой стоимости.Обычно в электродах используется металлический цинк и углеродный стержень, окруженный диоксидом марганца. Электролит состоит из пасты хлорида аммония.
Какие проблемы с аккумуляторами?источник
Нет идеальных продуктов. Всегда будут случайные бракованные изделия. Однако у некоторых продуктов больше проблем, чем у других. Вот некоторые из основных проблем, с которыми потребители обычно сталкиваются с батареями:
- Батареи могут загореться или даже взорваться : Хотя это случается нечасто, если батарея неисправна и электроды соприкасаются друг с другом, может произойти короткое замыкание батареи, что приведет к сильному нагреву, пожару или взрыву.
- Батареи не могут намокать : После того, как вода попала в батарею, ее практически невозможно вытащить, поскольку предохранительное отверстие батареи предотвращает вытекание жидкости из батарей. Попадание воды в аккумулятор может привести к его неисправности. Быстро и правильно утилизируйте намокшие батареи.
- Батареи могут замерзнуть : На улице должно быть чертовски холодно, но если вы живете в районе с суровыми и холодными зимами, будьте осторожны.Батарея может замерзнуть при температуре около 10 градусов по Фаренгейту, если она заряжена наполовину.
- Батареи вредны для окружающей среды : Батареи, которые не утилизируются должным образом, могут накапливаться и подвергаться коррозии, в результате чего их химические вещества загрязняют нашу землю и воду. Эти химические вещества для аккумуляторов вредны не только для наших экосистем, но также попадают в нашу питьевую воду и воздух, которым мы дышим. Не говоря уже о том, что литиевые батареи потенциально могут вызывать пожары на свалках и способствовать глобальному потеплению.Хорошая новость в том, что батареи можно перерабатывать. И это очень просто. У Energizer® есть сайт, который поможет вам найти поблизости места для утилизации батарей. Вы также можете попробовать один из этих веб-сайтов:
Теперь, когда мы ответили на большой вопрос «как работают батареи», пришло время немного развлечься с вашими новообретенными знаниями. Попробуйте прогуляться по дому, чтобы узнать, сколько разных типов батарей вы используете. Затем, чтобы узнать больше о часто используемых товарах для дома, ознакомьтесь с нашей статьей о лампочках, чтобы узнать, как можно сэкономить большие деньги.
Принесено вам justenergy.com
Все изображения лицензированы Adobe Stock.
Рекомендуемое изображение:
Батареи, схемы и трансформаторы — Управление энергетической информации США (EIA)
Батареи производят электроэнергию
Электрохимическая батарея вырабатывает электричество из двух разных металлов в химическом веществе, называемом электролитом . Один конец батареи прикреплен к одному из металлов, а другой конец — к другому металлу.Химическая реакция между металлами и электролитом освобождает больше электронов в одном металле, чем в другом.
Источник: адаптировано из Национального проекта развития энергетического образования (общественное достояние)
Металл, который высвобождает больше электронов, приобретает положительный заряд, а другой металл — отрицательный. Если электрический провод или провод соединяет один конец батареи с другим, электроны проходят через провод, чтобы сбалансировать электрический заряд.
Электрическая нагрузка — это устройство, которое использует электричество для выполнения работы или выполнения работы. Если электрическая нагрузка — например, лампа накаливания — размещена вдоль провода, электричество может работать, поскольку оно течет через провод и лампочку. Электроны текут от отрицательного конца батареи через провод и лампочку и обратно к положительному концу батареи.
Электроэнергия передается по цепям
Электричество должно пройти полный путь, или электрическая цепь , , прежде чем электроны смогут двигаться.Выключатель или кнопка включения-выключения на всех электрических устройствах замыкает (включает) или размыкает (выключает) электрическую цепь в устройстве. Выключение или выключение света размыкает цепь, и электроны не могут проходить через свет. Включение света замыкает цепь, что позволяет электричеству течь от одного электрического провода через лампочку, а затем через другой провод.
Лампа накаливания излучает свет, когда электричество проходит через крошечный провод в лампочке, который становится очень горячим и светится.Лампа накаливания перегорает, когда крошечный провод внутри лампы обрывается, что приводит к размыканию цепи.
Источник: адаптировано из Национального проекта развития энергетического образования (общественное достояние)
Трансформаторы помогают эффективно перемещать электроэнергию на большие расстояния
Чтобы решить проблему отправки электричества на большие расстояния, Уильям Стэнли разработал устройство под названием трансформатор .Трансформатор изменяет электрическое напряжение в проводнике или линии электропередачи. Линии передачи высокого напряжения, например, те, которые проходят между высокими металлическими башнями, переносят электричество на большие расстояния туда, где это необходимо. Электроэнергия более высокого напряжения более эффективна и менее дорога для передачи электроэнергии на большие расстояния. Электричество более низкого напряжения безопаснее для использования в домах и на предприятиях. Трансформаторы повышают (повышают) или снижают (понижают) напряжение по мере того, как электричество перемещается от электростанций в дома и на предприятия.
Последнее обновление: 8 января 2020 г.
Что такое батареи и как они работают?
Автор: Министерство энергетики США. 9 мая 2021 г.
Батареи и аналогичные устройства принимают, хранят и отпускают электроэнергию по запросу. В батареях используется химия в форме химического потенциала для хранения энергии, как и во многих других повседневных источниках энергии. Например, бревна хранят энергию в своих химических связях, пока при горении энергия не преобразуется в тепло.
Бензин — это запасенная химическая потенциальная энергия, пока она не преобразуется в механическую энергию в двигателе автомобиля. Точно так же, чтобы батареи работали, электричество должно быть преобразовано в форму химического потенциала, прежде чем оно может быть легко сохранено.
Батареи состоят из двух электрических клемм, называемых катодом и анодом, разделенных химическим материалом, называемым электролитом. Чтобы принимать и высвобождать энергию, батарея подключается к внешней цепи. Электроны движутся по цепи, в то время как одновременно ионы (атомы или молекулы с электрическим зарядом) движутся через электролит.
В перезаряжаемой батарее электроны и ионы могут перемещаться в любом направлении через цепь и электролит. Когда электроны движутся от катода к аноду, они увеличивают химическую потенциальную энергию, заряжая таким образом аккумулятор; когда они движутся в другом направлении, они преобразуют эту химическую потенциальную энергию в электрическую цепь и разряжают батарею. Во время зарядки или разрядки противоположно заряженные ионы перемещаются внутри батареи через электролит, чтобы уравновесить заряд электронов, проходящих через внешнюю цепь, и создать устойчивую перезаряжаемую систему.После зарядки аккумулятор может быть отключен от цепи для хранения химической потенциальной энергии для последующего использования в качестве электричества.
Батареи были изобретены в 1800 году, но их химические процессы сложны. Ученые используют новые инструменты, чтобы лучше понять электрические и химические процессы в батареях, чтобы создать новое поколение высокоэффективных аккумуляторов электроэнергии. Например, они разрабатывают улучшенные материалы для анодов, катодов и электролитов в батареях.Ученые изучают процессы в аккумуляторных батареях, потому что они не полностью меняются, когда батарея заряжается и разряжается. Со временем отсутствие полной замены может изменить химический состав и структуру материалов батареи, что может снизить производительность и безопасность батареи.
Факты о хранении электрической энергии
- Нобелевская премия по химии 2019 года была присуждена совместно Джону Б. Гуденафу, М. Стэнли Уиттингему и Акире Йошино «за разработку литий-ионных батарей.”
- Электролитный геном в JCESR создал вычислительную базу данных с более чем 26 000 молекул, которую можно использовать для расчета ключевых свойств электролита для новых, усовершенствованных аккумуляторов.
Департамент науки и хранения электроэнергии Министерства энергетики США
Исследования, проведенные при поддержке Управления науки Министерства энергетики США и Управления фундаментальных энергетических наук (BES), привели к значительным улучшениям в хранении электроэнергии. Но мы все еще далеки от комплексных решений для хранения энергии следующего поколения с использованием совершенно новых материалов, которые могут значительно увеличить количество энергии, которое может хранить батарея.Это хранилище имеет решающее значение для интеграции возобновляемых источников энергии в нашу систему электроснабжения. Поскольку усовершенствование аккумуляторных технологий имеет важное значение для повсеместного использования подключаемых к электросети электромобилей, хранение также является ключом к уменьшению нашей зависимости от нефти при транспортировке.
BES поддерживает исследования отдельных ученых и в многопрофильных центрах. Самый крупный центр — Объединенный центр исследований в области накопления энергии (JCESR), центр энергетических инноваций Министерства энергетики США. Этот центр изучает электрохимические материалы и явления на атомном и молекулярном уровне и использует компьютеры для разработки новых материалов.Эти новые знания позволят ученым разработать более безопасные накопители энергии, которые служат дольше, заряжаются быстрее и обладают большей емкостью. По мере того как ученые, поддерживаемые программой BES, достигают новых успехов в науке об аккумуляторах, эти достижения используются прикладными исследователями и промышленностью для продвижения приложений в области транспорта, электросетей, связи и безопасности.
Как работают (аккумуляторные) батареи?
Хотя аккумуляторные батареи были изобретены более ста лет назад, их применения не было так давно.Сегодня аккумуляторные батареи неразрывно связаны с нашей повседневной жизнью: портативные устройства и бытовая техника стали чрезвычайно популярными. А вот как работают аккумуляторы ? А что делает зарядное устройство? В этой статье мы рассмотрим основы работы (перезаряжаемой) батареи.
Немного химии
Как и все остальное, батарея состоит из атомов. Один атом состоит из трех типов частиц:
- протонов (положительных)
- электронов (отрицательные)
- нейтрона
В идеале этот заряд выравнивается: количество отрицательных и положительных частиц одинаково.Удаление одного электрона (т.е.отрицательной частицы) приводит к тому, что атом становится положительным, и наоборот. Поскольку атомы предпочитают оставаться нейтральными, они будут искать другие атомы для обмена электронами, чтобы восстановить свой баланс. Этот обмен или «поток» электронов создает электрический ток.
Анод, электролит и катод
Процесс обмена электронами также происходит в батареях. Каждая батарея состоит из трех частей: анода, электролита и катода. Однако разные типы батарей используют разные химические вещества для создания этих деталей.
В полностью заряженной батарее анод отрицательный, а катод положительный. Почему? Анод содержит избыток (отрицательных) электронов, тогда как катод не содержит электронов. Естественно, анод хотел бы потерять часть своих электронов, передав лишние электроны на катод.
Добавив третий элемент, сепаратор с электролитом, вы можете контролировать поток и создавать батарею. Сепаратор действует как барьер внутри ячейки между анодом и катодом. Это позволяет электрическому току течь только тогда, когда батарея подключена к устройству.
Как работают аккумуляторы
Все батареи работают следующим образом: электроны перемещаются от анода к катоду, пока на аноде не закончатся электроны. Таким образом, аккумулятор считается разряженным или «мертвым».
С первичными батареями это конец. С вторичными или перезаряжаемыми батареями зарядное устройство может обратить поток электронов в обратном направлении и, таким образом, восстановить первоначальный избыток электронов на аноде, создавая тем самым то, что мы называем заряженной батареей.
Можно ли обратить эту реакцию вспять, зависит от химических веществ, используемых в батарее.Например, щелочные батареи не предназначены для обратного потока. Это может быть потенциально опасно.
NiMH (никель-металл-гибридный) аккумулятор обеспечивает принудительный обратный поток сотни, а иногда и тысячи раз. Однако процесс со временем вызывает повреждение химикатов. Следовательно, вы не можете бесконечно заряжать и разряжать батареи: в какой-то момент химические вещества разложатся слишком сильно, чтобы по-прежнему удерживать заряд.
Дополнительная литература
Тогда как же аккумуляторные батареи работают раз за разом? Срок службы перезаряжаемой батареи зависит от производителя, типа батареи и условий, в которых она используется.Чтобы узнать больше о том, как производятся NiMH аккумуляторы, обратитесь к одной из наших предыдущих статей здесь.
Как работает аккумулятор?
Энергия не может быть создана или уничтожена, но может быть сохранена в различных формах. Один из способов его хранения — использование в батарее химической энергии. При включении в цепь батарея может вырабатывать электричество.
Батареи преобразуют химическую энергию в электрическую |
Батарея имеет два конца — положительный полюс (катод) и отрицательный полюс (анод).Если соединить две клеммы проводом, образуется цепь. Электроны будут течь по проводу, и будет производиться электрический ток. Внутри батареи происходит реакция между химическими веществами. Но реакция происходит только при наличии потока электронов. Батареи могут храниться в течение длительного времени и при этом работать, потому что химический процесс не начинается до тех пор, пока электроны не потекут с отрицательной клеммы на положительную по цепи.
В батарее происходит химическая реакция
Простой пример — лимонная батарея
Начнем с очень простой батареи, в которой используется лимон, в который вставлены два разных металлических предмета, например гальванизированный гвоздь и медная монета или проволока.Медь служит положительным электродом или катодом, а гальванизированный (оцинкованный) гвоздь — отрицательным электродом или анодом, производящим электроны. Эти два объекта работают как электроды, вызывая электрохимическую реакцию, которая генерирует небольшую разность потенциалов.
Поскольку атомы меди (Cu) притягивают электроны больше, чем атомы цинка (Zn), если вы поместите кусок меди и кусок цинка в контакт друг с другом, электроны перейдут от цинка к меди. Когда электроны концентрируются на меди, они отталкиваются друг от друга и останавливают поток электронов от цинка к меди.С другой стороны, если вы поместите полоски цинка и меди в проводящий раствор и соедините их снаружи проводом, реакции между электродами и раствором позволят электронам непрерывно течь через провод.
ЛИМОННАЯ БАТАРЕЯ | Как работает лимонная батарейка? Лимонная батарея состоит из лимона и двух металлических электродов из разных металлов, таких как медный пенни или проволока и гальванизированный (оцинкованный) гвоздь. Энергия для батареи исходит не от лимона, а от химического превращения цинка (или другого металла). Цинк окисляется внутри лимона, обмениваясь некоторыми из его электронов, чтобы достичь более низкого энергетического состояния, и высвобождаемая энергия обеспечивает энергию. Лимон просто создает среду, в которой это может произойти, но они не расходуются в процессе. Если предположить, что используются цинковые и медные электроды (например, медная монета и оцинкованный гвоздь), то один лимон может произвести приблизительно 0.9 Вольт. Слева последовательная цепь лимонов показывает, что вырабатывается напряжение 3,41 вольт. ПРИМЕЧАНИЕ: Можно использовать картофель, яблоки, квашеную капусту или любые другие фрукты или овощи, содержащие кислоту или другой электролит, но лимоны предпочтительнее из-за их более высокой кислотности. Например, в картофеле электролитом является фосфорная кислота, а в лимонах — лимонная кислота. |
В лимонной батарее происходит как окисление (потеря электронов), так и восстановление (увеличение количества электронов).Эта батарея похожа на оригинальные «простые гальванические элементы», изобретенные Алессандро Вольта (см. Ниже). На аноде металлический цинк окисляется и попадает в кислый раствор в виде ионов Zn2 +:
Zn -> Zn2 + + 2 е-
На медном катоде ионы водорода (сольватированные протоны из кислого раствора в лимоне) восстанавливаются с образованием молекулярного водорода:
2H ++ 2e- -> h3
Что заставляет электроны двигаться?
Когда вы отпускаете мяч, который вы держите, он падает на землю, потому что гравитационное поле Земли тянет мяч вниз.Точно так же заряженным частицам, таким как электроны, необходимо проделать работу, чтобы переместить их из одной точки в другую. Количество работы на единицу заряда называется разностью электрических потенциалов между двумя точками. Единица измерения разности потенциалов называется вольт.
Разность потенциалов между катодом и анодом возникает в результате химической реакции. Внутри батареи электроны подталкиваются химической реакцией к положительному концу, создавая разность потенциалов.
Именно эта разность потенциалов движет электроны по проводу.
Разница потенциалов может быть положительной или отрицательной, подобной гравитационной энергии при движении вверх или вниз по холму. В батарее поток электронов идет вниз … электроны могут течь вверх, как в случае зарядного устройства.
Почему электроны просто не перемещаются от анода к катоду внутри батареи?
Электролит в батарее не дает одиночным электронам идти прямо от анода к катоду внутри батареи.Когда клеммы соединены проводящим проводом, электроны могут легко перетекать от анода к катоду.
В каком направлении движутся электроны в проводе?
Электроны заряжены отрицательно, поэтому они будут притягиваться к положительному концу батареи и отталкиваться отрицательным концом. Когда батарея подключена к устройству, которое позволяет электронам проходить через нее, они текут от отрицательного (анода) к положительному (катодному) выводу.
Кто изобрел электрохимический элемент (батарею)?
ПЕРВАЯ БАТАРЕЯ VOLTA | Аккумулятор Volta считается первым электрохимическим элементом. Он состоит из двух электродов: один из цинка, другой из меди. Электролит — серная кислота или смесь соли и воды. Электролит существует в форме 2H + и SO42-.Цинк, содержание которого в электрохимическом ряду выше, чем у меди и водорода, вступает в реакцию с отрицательно заряженным сульфатом SO42-. Положительно заряженные ионы водорода (протоны) захватывают электроны из меди, образуя пузырьки газообразного водорода h3. Это делает цинковый стержень отрицательным электродом, а медный стержень — положительным электродом. Теперь у нас есть две клеммы, и ток будет течь, если мы их соединим. Реакции в этой ячейке следующие: цинк Zn -> Zn2 + + 2e- серная кислота 2H + + 2e- -> h3 Медь не вступает в реакцию, действуя как электрод для химической реакции. |
Как работает современный аккумулятор (угольно-цинковый аккумулятор)?
Сухой цинк-угольный элемент или батарея упакованы в цинковую банку, которая служит одновременно контейнером и отрицательной клеммой (анодом). Положительный вывод представляет собой углеродный стержень, окруженный смесью диоксида марганца и углеродного порошка. Используемый электролит представляет собой пасту из хлорида цинка и хлорида аммония, растворенных в воде.Углеродный (графитовый) стержень — это то, что собирает электроны, выходящие из анодной части батареи, чтобы вернуться к катодной части батареи. Углерод является единственным практичным проводящим материалом, потому что любой обычный металл быстро разъедает положительный электрод в солевом электролите. Цинк окисляется в соответствии со следующим полууравнением. Диоксид марганца смешивают с углеродным порошком для увеличения электропроводности.Реакция протекает следующим образом: 2MnO2 (s) + 2 e- + 2Nh5Cl (водн.) -> и CL сочетается с Zn2 +. В этой полуреакции марганец восстанавливается со степени окисления (+4) до (+3). Возможны и другие побочные реакции, но общую реакцию в углеродно-цинковом элементе можно представить как: Zn (тв) + 2MnO2 (тв) + 2Nh5Cl (водный раствор) —> Mn2O3 (тв) + Zn (Nh4) 2Cl2 (водный раствор) + h3O (l) Батарея имеет эл.м.ф. около 1,5 В. |
Какие бывают типы батарей?
В разных типах батарей используются различные химические вещества и химические реакции. Вот некоторые из наиболее распространенных типов батарей:
Щелочная батарея | Используется в Duracell® и Energizer® и других щелочных батареях.Электроды из цинка и оксида марганца. Электролит представляет собой щелочную пасту. |
Свинцово-кислотный аккумулятор | Они используются в автомобилях. Электроды изготовлены из свинца и оксида свинца с сильной кислотой в качестве электролита. |
Литиевая батарея | Эти батарейки используются в фотоаппаратах для лампы-вспышки.Они сделаны из лития, иодида лития и иодида свинца. Они могут подавать скачки электричества для вспышки. |
| Литиевая батарея | Эти батарейки используются в фотоаппаратах для лампы-вспышки. Они сделаны из лития, иодида лития и иодида свинца. Они могут подавать скачки электричества для вспышки. |
| Литий-ионный аккумулятор | Эти батареи используются в портативных компьютерах, сотовых телефонах и другом портативном оборудовании с высокой нагрузкой. |
| Никель-кадмиевый или никель-кадмиевый аккумулятор | Электроды из гидроксида никеля и кадмия. Электролит — гидроксид калия. |
| Угольно-цинковая батарея или стандартная угольная батарея — | Цинк и углерод используются во всех обычных или стандартных сухих батареях AA, C и D. Электроды изготовлены из цинка и углерода, между которыми находится паста из кислотных материалов, служащая электролитом. |
ССЫЛКИ И ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Potato Power: Руководство для учителя
История батареи
Электрохимические реакции
Углеродно-цинковая батарея
Углеродно-цинковая батарея — Как они работают?
Как работают батареи Анимированное руководство по науке об аккумуляторах
Оценка Вопросы:
M последний Вопросы на выбор
Батареи: Электричество через химические реакции
Батареи состоят из одной или нескольких электрохимических ячеек, в которых накапливается химическая энергия для последующего преобразования в электрическую энергию.Батареи используются во многих повседневных устройствах, таких как сотовые телефоны, портативные компьютеры, часы и автомобили. Батареи состоят по крайней мере из одного электрохимического элемента, который используется для хранения и выработки электроэнергии. Хотя существует множество электрохимических элементов, батареи обычно состоят, по крайней мере, из одного гальванического элемента. Гальванические элементы также иногда называют гальваническими элементами. Химические реакции и генерация электрической энергии происходят самопроизвольно внутри гальванического элемента, в отличие от реакций электролитических элементов и топливных элементов.
Введение
Именно во время проведения экспериментов с электричеством в 1749 году Бенджамин Франклин впервые ввел термин «батарея» для описания связанных конденсаторов. Однако его батарея была не первой батареей, а просто первой, которую так называли. Скорее всего, считается, что багдадские батареи, обнаруженные в 1936 году и возрастом более 2000 лет, были одними из первых в истории батарей, хотя их точное назначение до сих пор обсуждается.
Луиджи Гальвани (в честь которого назван гальванический элемент) впервые описал «животное электричество» в 1780 году, когда он создал электрический ток через лягушку.Хотя в то время он не знал об этом, это была форма батареи. Его современник Алессандро Вольта (в честь которого названы гальваническая ячейка и гальваническая батарея) был убежден, что «животное электричество» исходит не от лягушки, а от чего-то совершенно другого. В 1800 году он произвел первую настоящую батарею: гальваническую батарею.
В 1836 году Джон Фредерик Даниэлл создал ячейку Даниэля, исследуя способы преодоления некоторых проблем, связанных с гальванической батареей Вольта. За этим открытием последовали разработки ячейки Гроув Уильямом Робертом Гроувом в 1844 году; первая аккумуляторная батарея, сделанная из свинцово-кислотного элемента в 1859 году Гастоном Планте; гравитационная ячейка Калло в 1860-х годах; и ячейка Лекланша Жоржа Лекланша в 1866 году.
До этого момента все батареи были влажными. Затем в 1887 году Карл Гасснер создал первую сухую батарею, состоящую из угольно-цинкового элемента. Никель-кадмиевый аккумулятор был представлен в 1899 году Вальдмаром Юнгнером вместе с никель-железным аккумулятором. Однако Юнгнеру не удалось запатентовать никель-железную батарею, и в 1903 году Томас Эдисон запатентовал для себя слегка измененную конструкцию.
Главный прорыв произошел в 1955 году, когда Льюис Урри, сотрудник компании, ныне известной как Energizer, представил обычную щелочную батарею.1970-е годы привели к созданию никель-водородных батарей, а 1980-е — к никель-металлогидридным батареям.
Литиевые батареибыли впервые созданы еще в 1912 году, однако самый успешный тип — литий-ионные полимерные батареи, используемые сегодня в большинстве портативных электронных устройств, — не был выпущен до 1996 года.
Гальванические элементы
Гальванические элементы состоят из двух полуэлементных реакций (окисление-восстановление), связанных между собой через полупроницаемую мембрану (обычно соляную ванну) и проволоку (рис. 1).На каждой стороне ячейки находится металл, который действует как электрод. Один из электродов называется катодом, а другой — анодом. Сторона ячейки, содержащая катод, уменьшена, что означает, что она получает электроны и действует как окислитель для анода. Сторона ячейки, содержащая анод, — это место, где происходит окисление, что означает, что он теряет электроны и действует как восстановитель для катода. Каждый из двух электродов погружен в электролит — соединение, состоящее из ионов.Этот электролит действует как градиент концентрации для обеих сторон полуреакции, облегчая процесс переноса электронов через провод. Это движение электронов производит энергию и используется для питания батареи.
Клетка разделена на два отсека, поскольку химическая реакция протекает самопроизвольно. Если бы реакция происходила без этого разделения, выделялась бы энергия в виде тепла, и батарея не работала бы.
Рисунок 1: Цинк-медный гальванический элемент.Гальванический элемент вырабатывает электричество, необходимое для питания лампочки.
Типы аккумуляторов
Рисунок 2: Первичные и вторичные батареи. Первичные батареи (слева) одноразовые и одноразовые. Вторичные батареи (справа) перезаряжаемые, как и этот аккумулятор сотового телефона.
Первичные батареи
Первичные батареи одноразовые и одноразовые. Электрохимические реакции в этих батареях необратимы.Материалы электродов полностью утилизированы и поэтому не могут регенерировать электричество. Первичные батареи часто используются, когда требуются длительные периоды хранения, поскольку они имеют гораздо меньшую скорость разряда, чем вторичные батареи.
Примером использования первичных батарей являются детекторы дыма, фонарики и большинство пультов дистанционного управления.
Аккумуляторы вторичные
Вторичные батареи перезаряжаемые. Эти батареи подвергаются электрохимическим реакциям, которые можно легко обратить.Химические реакции, которые происходят во вторичных батареях, обратимы, потому что компоненты, которые вступают в реакцию, не полностью израсходованы. Перезаряжаемые батареи нуждаются в внешнем источнике электроэнергии, чтобы заряжать их после того, как они израсходовали свою энергию.
Примером использования аккумуляторных батарей являются автомобильные аккумуляторы и портативные электронные устройства.
Типы аккумуляторных элементов
Влажные камеры
Аккумуляторы с жидким электролитом содержат жидкий электролит. Они могут быть как первичными, так и вторичными.Из-за жидкой природы влажных ячеек для разделения анода и катода используются изолирующие листы. Типы влажных клеток включают клетки Даниэля, клетки Лекланша (первоначально использовавшиеся в сухих клетках), клетки Бунзена, клетки Вестона, клетки хромовой кислоты и клетки Гроув. Свинцово-кислотные элементы в автомобильных батареях представляют собой влажные элементы.
Рисунок 3: Свинцово-кислотный аккумулятор в автомобиле.
Сухие камеры
В сухих батареях свободной жидкости нет.Вместо этого электролит представляет собой пасту, достаточно влажную, чтобы пропускать ток. Это позволяет эксплуатировать сухую батарею в любом положении, не беспокоясь о том, что ее содержимое разольется. Вот почему сухие батареи обычно используются в изделиях, которые часто перемещают и переворачивают, например, в портативных электронных устройствах. Батареи с сухими элементами могут быть как первичными, так и вторичными. Самая распространенная батарея с сухими элементами — это элемент Лекланша.
Производительность батареи
Емкость аккумулятора напрямую зависит от количества материала электрода и электролита внутри элемента.Первичные батареи могут терять от 8% до 20% своего заряда в течение года без какого-либо использования. Это вызвано побочными химическими реакциями, которые не вызывают ток. Скорость побочных реакций можно снизить, снизив температуру. Более высокие температуры также могут снизить производительность батареи из-за ускорения побочных химических реакций. Первичные батареи при использовании становятся поляризованными. Это когда водород накапливается на катоде, снижая эффективность батареи. k} \]
, где I — ток, k — константа около 1.3, t — это время, в течение которого аккумулятор может выдерживать ток, а Q p — это емкость при разряде со скоростью 1 ампер.
Ток, напряжение и стандартный понижающий потенциал
Существует значительная корреляция между током и напряжением ячейки. Ток, как следует из названия, представляет собой поток электрического заряда. Напряжение — это то, сколько тока потенциально может протекать через систему. На рисунке 4 показана разница между током и напряжением.
Рисунок 4: Разница между напряжением и током.
Вода течет из шланга на водяное колесо, вращая его. Ток можно представить как количество воды, протекающей по шлангу. Напряжение можно представить как давление или силу воды, протекающей по шлангу. По первому шлангу не проходит много воды, а также отсутствует давление, и, следовательно, он не может эффективно вращать водяное колесо.По второму шлангу проходит значительное количество воды, поэтому в нем большое количество тока. По третьему шлангу протекает не так много воды, но есть что-то, что блокирует большую часть шланга. Это увеличивает давление воды, вытекающей из шланга, придавая ей большое напряжение и позволяя воде ударяться о водяное колесо с большей силой, чем в первом шланге.
Стандартный понижающий потенциал, E o , представляет собой измерение напряжения. Стандартный восстановительный потенциал можно рассчитать, зная, что это разница энергетических потенциалов между катодом и анодом : E o ячейка = E o катод — E o анод .Для стандартных условий электродные потенциалы для полуэлементов могут быть определены с помощью таблицы стандартных электродных потенциалов.
В нестандартных условиях определить электродный потенциал для катода и анода не так просто, как взглянуть на таблицу. Вместо этого необходимо использовать уравнение Нернста для определения E o для каждой половины ячейки. Уравнение Нернста представлено как, где R — универсальная газовая постоянная (8,314 JK -1 моль -1 ), T — температура в Кельвинах, n — количество моль перенесенных электронов. в полуреакции F — постоянная Фарадея (9.648 x 10 4 C моль -1 ), а Q — коэффициент реакции.
Аккумуляторы разных размеров и некоторые дополнительные факты
Батареи различаются по размеру и напряжению в зависимости от химических свойств и содержимого элемента. Однако батареи разных размеров могут иметь одинаковое напряжение. Причина этого явления в том, что стандартный потенциал ячейки зависит не от размера батареи, а от ее внутреннего содержимого. Следовательно, батареи разных размеров могут иметь одинаковое напряжение (Рисунок 5).Кроме того, есть способы, которыми аккумуляторы могут увеличивать свое напряжение и ток. Когда батареи выстраиваются в ряд рядов, это увеличивает их напряжение, а когда батареи выстраиваются в ряд столбцов, это может увеличить их ток.
Рисунок 5: Четыре батареи разного размера, все 1,5 напряжения
Опасности
Батареи могут взорваться в результате неправильного использования или неисправности. При попытке перезарядить аккумулятор или зарядить его с чрезмерной скоростью в аккумуляторе могут накапливаться газы и потенциально вызвать разрыв.Короткое замыкание также может привести к взрыву. Батарея, помещенная в огонь, также может привести к взрыву, поскольку внутри батареи накапливается пар. Утечка также вызывает беспокойство, потому что химические вещества внутри батарей могут быть опасными и опасными. Утечка, исходящая из батарей, может повредить устройство, в котором они находятся, и с ней опасно обращаться. Широкое использование батарей вызывает множество экологических проблем. Производство аккумуляторов требует много ресурсов и требует обращения со многими опасными химическими веществами.Использованные батареи часто утилизируются ненадлежащим образом и являются электронным мусором. Материалы внутри батарей потенциально могут быть токсичными загрязнителями, что делает неправильную утилизацию особенно опасной. Благодаря программам утилизации электроники токсичные металлы, такие как свинец и ртуть, не попадают в окружающую среду и не наносят ей вреда. Разрядка батареек опасна и может привести к смерти.
Самодельные батареи
Любой жидкий или влажный объект, который имеет достаточно ионов, чтобы быть электропроводным, может быть использован для изготовления батареи.Можно даже генерировать небольшое количество электричества, вставляя электроды из разных металлов в картофель, лимоны, бананы или газированную колу. Гальваническую кучу можно создать, используя две монеты и бумагу, смоченную в соленой воде. Сложение нескольких монет в серию может привести к увеличению тока.
Практические задачи
Проблемы
1. Да / Нет
- Будет ли добавление батарей, выстроенных в ряд, увеличивать общее напряжение батарей?
- Происходят ли в электролитических ячейках несамопроизвольные химические реакции?
- Перезаряжаемые батареи также называют одноразовыми?
- Могут ли батареи разных размеров иметь одинаковое напряжение?
2.Т / Ф
- В первичных ячейках почти всегда полностью используются все компоненты электродов.
- Первичные и вторичные элементы различаются по своим катодным и анодным свойствам.
- Редокс-реакции играют решающую роль в элементах батарей.
- Катод в гальванической ячейке получает электроны.
3. Определите стандартный электродный потенциал гальванической ячейки в ячейке Лекланша (сухой) с половинным напряжением ячейки.875 В на графитовом катоде и 0,253 В на цинковом аноде.
4. Определите стандартный потенциал электрода с заданными значениями половинного напряжения ячейки: 0,987 В на катоде и 0,632 В на аноде.
5. Объясните, почему аккумуляторные батареи могут быть лучше одноразовых.
Решения
1. Да / Нет
- Есть
- Есть
- №
- Есть
2. Т / Ф
- Истинно
- Ложь
- Истинно
- Истинно
3.E 0 элемент = E 0 (катод) -E 0 (анод)
E 0 ячейка l = 0,875 В — 0,253 В = 0,622 В
4. E 0 элемент = E 0 (катод) -E 0 (анод)
E 0 ячейка = 0,987 В -0,632 В = 0,355 В
5. Хотя одноразовые батареи изначально дешевле и их проще изготавливать, более длительный срок службы аккумуляторных батарей часто бывает более эффективным и полезным.Перезаряжаемые батареи означают меньше отходов, так как меньше батарей нужно производить и меньше утилизировать на свалках или в рамках программ утилизации. Перезаряжаемые батареи также более удобны, поскольку их замена больше не требуется. Это особенно полезно для портативных электронных устройств. Кроме того, поскольку компоненты вторичного элемента являются многоразовыми, перезаряжаемые батареи обычно будут стоить меньше, чем одноразовые батареи в долгосрочной перспективе.

