Какая кислота применяется в аккумуляторах автомобиля — название жидкости, используемой в АКБ, соляная кислота в аккумуляторе
Многих пользователей интернета интересует, какая кислота в аккумуляторе автомобиля используется и каковы ее свойства? Вопрос на самом деле очень интересный, потому что ответ связан с особенностями химического процесса, который непрерывно протекает в батарее. Рассмотрим строение и особенности химических реакций, также обсудим, как на них можно повлиять, чтобы улучшить эффективность работы АКБ.
Использование кислоты и ее типы
Независимо от типа источника питания, в аккумуляторе в любом случае используется серная кислота. Притом, она там находится не в виде концентрата, а в растворе, то есть в разбавленном состоянии. Концентрация серной кислоты по отношению к воде составляет 1:2,5. То есть, 35% от всего объема занимает кислота и 65% — дистиллированная вода. Именно такой состав используется во всех распространенных батареях для автомобиля.
Все автомобильные аккумуляторы можно разделить на 2 типа по виду электролита: кислотные и щелочные. К первым относится абсолютное большинство, и они также существуют нескольких видов:
К первым относится абсолютное большинство, и они также существуют нескольких видов:
- свинцово-сурьмянистые классические;
- кальций-сурьмянистые или кальций-кальциевые;
- AGM с абсорбером в виде стекловолоконного наполнителя;
- гелевые Gel.
В батареях AGM содержится та же серная кислота, только ей пропитан специальный волокнистый наполнитель. Это дает возможность обеспечивать надежный контакт с пластинами в любом пространственном положении. Данное свойство сделало возможным их применение в речном транспорте, который подвержен качке. В гелевых электролит связан и не растекается, за счет чего пластины всегда контактируют с диэлектриком. Состав электролита и концентрация остаются прежними. В нем содержится 35% серной кислоты h3SO4, что является наиболее оптимальным соотношением для нормальной работы источника постоянного тока в любых условиях.
Область применения серной кислоты
Серная кислота является универсальным химикатом, используемым во множестве отраслей. Но основное ее предназначение — травление металла. Существуют технологии выполнения таким способом на стальных изделиях рисунков и нанесения фирменных знаков. Существенная ее доля применяется в производстве свинцово-кислотных аккумуляторов в разбавленном с дистиллированной водой виде.
Но основное ее предназначение — травление металла. Существуют технологии выполнения таким способом на стальных изделиях рисунков и нанесения фирменных знаков. Существенная ее доля применяется в производстве свинцово-кислотных аккумуляторов в разбавленном с дистиллированной водой виде.
- Нитрозная. Ее концентрация составляет не более 75%, плотность не превышает 1,67г/см3. Название связано с технологией производства в башнях нитрозным методом.
- Контактная. Ее концентрация составляет 92,5-98%, плотность вещества выше нитрозной и составляет 1,837 г/см3.
- Аккумуляторная. Ее концентрация составляет 92-94 %, плотность вещества — 1,835 г в см куб. Это специальная кислота для производства АКБ, но разбавляется в разной концентрации и, как правило, в 2 этапа. Сразу в большей, для хранения между производственными операциями, а затем в нормированной ГОСТами.
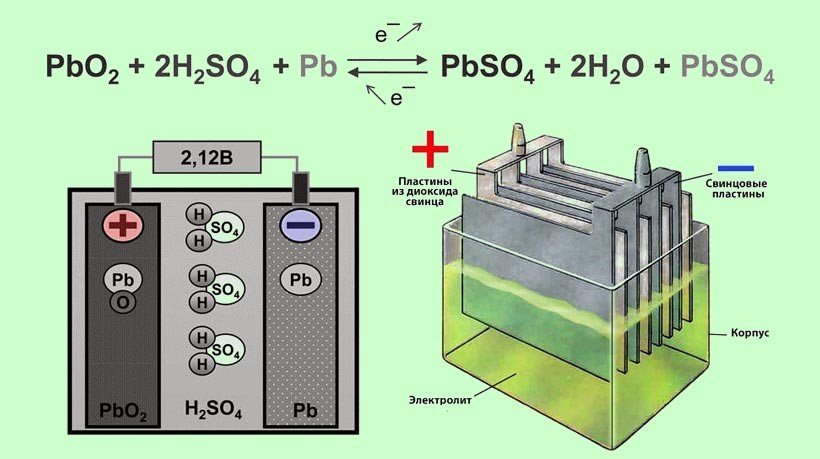
Химические реакции в автомобильном аккумуляторе
Выбирая электролит в автомобильный аккумулятор, следует понимать, какие химические реакции в нем протекают. Это даст общее понятие о количестве активного вещества, которое нужно добавить в жидкость.
Аккумулятор состоит из парных пластин, которые погружены в водный раствор серной кислоты. Пластины заполнены диоксидом свинца, представляющим собой пористый материал, зафиксированный в решетках. Электроды изготовлены не из чистого свинца, а из сплава. Добавляемым компонентом может быть сурьма или кальций в зависимости от типа батареи.
В состоянии покоя электроны сконцентрированы возле положительного вывода и там наблюдается их избыток. На отрицательном электроде их недостаточно. Когда замыкается цепь, они начинают перемещаться по пути наименьшего сопротивления от плюса к минусу. Внутри происходит реакция разложения серной кислоты и соединение ее продуктов со свинцом с образованием воды и сульфата свинца. Он представляет собой белый налет на пластинах, который частично осыпается на дно банок. На отрицательном электроде также наблюдается реакция соединения свинца и сульфида с образованием сульфата.
На отрицательном электроде также наблюдается реакция соединения свинца и сульфида с образованием сульфата.
В процессе зарядки происходит гидролиз и электрохимическая реакция восстановления серной кислоты, металлического свинца и диоксида свинца до исходного состояния. Электроны вновь концентрируются вблизи положительного вывода.
Особенности восстановления электродов
К особенностям работы свинцово-кислотной батареи относится то, что электроды восстанавливаются не полностью. Всегда какие-то микрочастицы оседают на дно емкости, где накапливаются, а толщина контактного элемента уменьшается. В результате этого процесса неизбежно:
- уменьшается плотность электролита в аккумуляторе;
- сокращается величина отдаваемого максимального тока из-за разрушения электродов и обсыпания активной пасты;
- увеличивается время зарядки, так как раствор засоряется и интенсивность зарядки сильно падает;
- уменьшается внутреннее сопротивление из-за увеличения проводимости диэлектрика.

В процессе заряда/разряда постоянно меняется плотность жидкости в аккумуляторе. В новых необслуживаемых моделях гибридного типа имеется специальный индикатор. По сути, встроенный ареометр, по которому можно проконтролировать состояние зарядки или разрядки, а также уровень электролита.
В нормальном состоянии, при температуре окружающей среды 25 градусов, плотность составляет 1,23-1,28 г/см 3. По мере разрядки она снижается до 1,19 г/см3. Если разрядка батареи продолжится, то к плотности 1,15 на пластинах будет сформирован толстый слой сульфата свинца.
Если аккумулятора\ авто оказался в глубоком разряде впервые или второй раз, количество сульфата не блокирует работу источника тока. Его еще можно восстановить, применив комбинированный метод. Сначала на выводы подается обратное напряжение, а затем прямое с малым током. Электрический стресс должен способствовать стряхиванию частиц сульфата в раствор, где они должны вступить в реакцию восстановления металлического свинца и диоксида свинца.
Зависимость плотности батареи от температуры
Напомним, что емкость в аккумуляторе сильно зависит от температуры. В таблице представлены данные исследований.
|
Плотность, г/см3 |
Напряжение без нагрузки, В |
Напряжение с нагрузкой (100А), В |
Состояние заряда, % |
Температура, оС |
|
1,11 |
11,7 |
8,4 |
0 |
-7 |
|
1,15 |
11,94 |
9 |
25 |
-13 |
|
1,21 |
12,3 |
9,9 |
62,5 |
-32 |
|
1,27 |
12,66 |
10,8 |
100 |
-60 |
Сразу после снятия батареи с зарядного устройства на его вводах регистрируется напряжение до 15 В, но даже без нагрузки в течение нескольких минут оно опускается до номинального 12,6В. Даже за такое короткое время на пластинах уже начинает образовываться слой сульфата свинца. Именно по этой причине крайне нежелательно регулярно заряжать АКБ от внешнего устройства без активного контроля. Это, как ни странно, после его отключения способно быстро привести к состоянию разряда из-за сформированного слоя сульфата. Следует применять заводские приборы, способные контролировать процесс и отключать зарядку при достижении заданной емкости и величины тока.
Даже за такое короткое время на пластинах уже начинает образовываться слой сульфата свинца. Именно по этой причине крайне нежелательно регулярно заряжать АКБ от внешнего устройства без активного контроля. Это, как ни странно, после его отключения способно быстро привести к состоянию разряда из-за сформированного слоя сульфата. Следует применять заводские приборы, способные контролировать процесс и отключать зарядку при достижении заданной емкости и величины тока.
Обслуживание аккумулятора
Каждый аккумулятор нуждается в проведении регулярной диагностики его электрических и физических параметров. Пользователи старых кислотных батарей с этим процессом хорошо знакомы. В еще более ранних моделях доливать воду требовалось еще чаще, из-за несовершенства технологии производства. Современные модели, даже самые дешевые, нуждаются в этом крайне редко. Необходимость выполнить доливку может возникать только на 4-5 году эксплуатации для продления работы батареи не более, чем на 1 год.
Причины доливки электролита:
- Длительный срок службы батареи, так как в процессе работы жидкость постепенно испаряется, точнее, испаряется в ней вода, так как кислота не способна на это из-за отсутствия в ней летучего водорода.
- Закипание из-за нарушения режима зарядки аккумулятора. Перезарядка и длительное воздействие большим током приводит именно к таким результатам.
- Течь электролита из поврежденного корпуса. Утечку нужно быстро обнаружить и устранить, потому что электролит очень опасен для кожи любой органики в целом. Даже при попадании серной кислоты на руки, их срочно нужно тщательно вымыть, пока не образовался серьезный ожог. Выполнять доливку и измерения данного химиката нужно в защитной экипировке.
Проверка уровня электролита
Если на корпусе нет индикатора состояния заряда батареи, но это обслуживаемая модель источника тока, то проверить уровень электролита можно через пробку. Для этого установите батарею на горизонтальную поверхность и открутите пробки со всех 6-ти банок. Затем возьмите прозрачную трубку, а если такой нет, то можно воспользоваться корпусом от старой шариковой ручки. Важно, чтобы пластмасса была наполовину прозрачной, и через нее можно было определить фактический уровень вещества. Итак, вы нашли трубку. Опустите ее в каждую банку по очереди и упретесь в пластины. Зажмите отверстие сверху и поднимите трубку. Уровень электролита в ней должен составлять 10-12 мм. Это важно, так как именно при таком значении обеспечивается оптимальная эффективность работы источника питания и обеспечено его сбалансированное химическое количество.
Итак, вы нашли трубку. Опустите ее в каждую банку по очереди и упретесь в пластины. Зажмите отверстие сверху и поднимите трубку. Уровень электролита в ней должен составлять 10-12 мм. Это важно, так как именно при таком значении обеспечивается оптимальная эффективность работы источника питания и обеспечено его сбалансированное химическое количество.
Если уровень меньше, что очевидно, так как в нутрии протекает необратимый химический процесс, связанный с постоянным убавлением электролита, то его нужно добавлять. Для этого приобретите дистиллированную воду и долейте в каждую банку ровно столько, сколько необходимо.
Измерение плотности электролита
Чтобы объективно оценить состояние аккумулятора, необходимо также измерить его плотность. Это важная процедура, которая может сказать, стоит ли что-то делать с батареей или ее лучше утилизировать и заменить на новую. Процесс заключается в применении ареометра. Это специальный прибор, с помощью которого определяется химическое количество активного вещества.
Ареометр представляет собой стеклянную трубку, внутри которой находится ртуть. Также есть модели с дробью, они показывают значение не хуже ртутных устройств. На верхней части прибора расположена шкала. На нее нанесен ограниченный диапазон измерений в пределах от 1,1 до 1,3 г на см куб. Устройство находится внутри стеклянной колбы, на верхушке которой располагается груша. Для определения плотности электролита необходимо выполнить следующие действия:
- Опустить нижнюю часть колбы в банку и надавить на грушу.
- Затем нужно отпустить грушу, тем самым, набрав электролита.
- Далее нужно вынуть прибор и определить по шкале значение.
Существуют модели ареометров, в которых вместо шкалы используются надписи: «Полный заряд», «Половина» и «Разряжен». Суть из-за смены градуировки не меняется, и принцип измерения плотности остается прежним.
В случае заниженного значения плотности, нужно произвести ее поднятие. В данном случае добавление воды нецелесообразно.
Для поднятия плотности необходимо:
- Из каждой банки откачать половину объема старого электролита.
- Восполнить его новым химикатом с плотностью не менее 1,275 г/см3.
- Для эффективного перемешивания жидкости в банках проще подключить небольшую нагрузку к выводам батареи, например, лампочку и подождать некоторое время. Химическая реакция начнется и электролит перемешается.
- Нужно еще раз измерить плотность тем же способом. В случае ее недостатка, химикат нужно долить еще.
- Повторяйте процедуры, пока плотность жидкости не поднимется до нормального уровня.
Как вы видите, восстановить работу АКБ своими силами можно в домашних условиях при наличии ареометра. Он стоит недорого, также его можно попросить у аккумуляторщиков. Электролит можно купить в готовом виде, поэтому самостоятельно ничего разводить не нужно.
Он стоит недорого, также его можно попросить у аккумуляторщиков. Электролит можно купить в готовом виде, поэтому самостоятельно ничего разводить не нужно.
Статью подготовил:
Интернет-магазин AKBMOSCOW
Какая кислота в аккумуляторе автомобиля
Практически все владельцы личного транспортного средства прекрасно знают о том, что в аккумуляторах есть кислота. Даже новички, которые только начинают постигать азы вождения, и то осведомлены касательно этого вопроса.
Многие из них слышали о кислотно-свинцовых аккумуляторах, но на деле так и не имеют представления, как именно работает это устройство. А между тем здесь протекают определенные химические реакции.
Содрежание
Какая кислота в аккумуляторе и для чего нужна
Большинство автомобилистов прекрасно знают, какая кислота залита в аккумуляторе. Но находятся и те, кто считают, что внутри аккумулятора ничего кроме дистиллированной воды (или дистиллята) нет. Другие же придерживаются мнения в пользу соляной кислоты, которое также неверно.
В любой автомобильной батарее содержится серная кислота — H2SO4. Если быть точнее, то речь идет о растворе серной кислоты с дистиллированной водой. Такая жидкость имеет общее название – электролит. Так какова роль серной кислоты?
Это основной компонент для работы АКБ. В отсутствие кислоты невозможен процесс заряда и разряда батареи. Это одна из самых активных разновидностей, которая способна вступать во взаимодействие практически с любым металлом, включая их оксиды. К тому же кислота может вступать в реакции обмена, а ее активность зависит от содержания воды.
Когда происходит заряд кислотного аккумулятора, пластины из чистого свинца (отрицательные) начинаются выделять электроны, которые принимаются решетками из оксида свинца (положительные). При разряде батареи происходит в точности до наоборот. Иными словами, когда пластины отдают электроны, они как бы «разрушаются» – происходит заряд, а при разряде они возвращаются обратно, что именуется «восстановлением».
И вот как раз для такого процесса разрушения – восстановления и нужна агрессивная среда в виде разбавленной серной кислоты. И без нее эффективность автомобильных батарей была бы на очень низком уровне.
Состав электролита и как правильно сделать
Серная кислота широко используется в современной промышленности для получения электрической энергии (аккумуляторы, батареи, электрические конденсаторы). Что касается состава электролита в АКБ, то соотношение между серной кислотой и дистиллированной водой следующее:
- сама кислота – 30%;
- дистиллированная вода – 70%.
Именно такая субстанция эффективным образом взаимодействует со свинцовыми пластинами. При этом особого внимания заслуживает плотность электролита, на что непосредственным образом оказывает влияние серная кислота. У концентрированной она достигает показателя в 1,83 г/см3. Добавлением дистиллированной воды обеспечивается понижение плотности до нужных пределов – обычно это диапазон 1,23-1,27 г/см3.
| Плотность электролита (г/см3) | Напряжение без нагрузки (В) | Напряжение с нагрузкой (В) | Степень заряженности (%) | Замерзание электролита (С) |
|---|---|---|---|---|
| 1,27 | 12,66 | 10,8 | 100 | -60 |
| 1,26 | 12,6 | 10,66 | 94 | -55 |
| 1,25 | 12,54 | 10,5 | 87,5 | -50 |
| 1,24 | 12,48 | 10,34 | 81 | -46 |
| 1,23 | 12,42 | 10,2 | 75 | -42 |
| 1,22 | 12,36 | 10,06 | 69 | -37 |
| 1,21 | 12,3 | 9,9 | 62,5 | -32 |
| 1,2 | 12,24 | 9,74 | 56 | -27 |
| 1,19 | 12,18 | 9,6 | 50 | -24 |
| 1,18 | 12,12 | 9,46 | 44 | -18 |
| 1,17 | 12,06 | 9,3 | 37,5 | -16 |
| 1,16 | 12 | 9,14 | 31 | -14 |
| 1,15 | 11,94 | 9 | 25 | -13 |
| 1,14 | 11,88 | 8,84 | 19 | -11 |
| 1,13 | 11,82 | 8,68 | 12,56 | -9 |
| 1,12 | 11,76 | 8,54 | 6 | -8 |
| 1,11 | 11,7 | 8,4 | 0,0 | -7 |
Знать этот параметр необходимо для понимания порога замерзания электролита. При плотности в 1,11 г/см3 субстанция замерзает уже под воздействием относительно небольшого холод: -7 °C. У рекомендованных значений порог этот существенно отличен – от -58 °C до -64 °C. А можно ли самому сделать электролит?
При плотности в 1,11 г/см3 субстанция замерзает уже под воздействием относительно небольшого холод: -7 °C. У рекомендованных значений порог этот существенно отличен – от -58 °C до -64 °C. А можно ли самому сделать электролит?
Да, это действительно возможно, только действовать необходимо с предельной осторожностью. И поскольку предстоит иметь дело с серной кислотой высокой концентрации, то такая работа представляет определенную опасность. Необходимо позаботиться о защите рук, тела, органов дыхания.
Собственно в том, чтобы самостоятельно приготовить электролит для АКБ, нет ничего сложного – смешать серную кислоту с дистиллированной водой, соблюдая пропорцию. Стоит заметить, что обычна вода из-под крана для таких целей не подходит, поскольку содержит большое количество разных примесей, которые негативным образом воздействуют на свинцовые пластины.
Собственно сами ингредиенты:
- Серная кислота (плотность должна быть 1,83 г/см3 или более, но не менее).

- Дистиллированная вода.
- Любая фарфоровая посуда.
Пропорции кислоты и воды нам известны – 30% и 70% соответственно. При этом важен характер подхода к производству – оптимально кислоту добавлять в воду, а не наоборот. Также стоит учесть, что при их смешивании будет выделяться очень много тепловой энергии и по этой причине недопустимо использовать стеклянную посуду – она просто лопается. Когда температура электролита упадет, его можно перелить в стеклянную емкость или тару из пластика.
После того как жидкости будут соединены, следует замерить плотность ареометром. Если показатели соответствуют допустимому пределу, электролит готов к эксплуатации. Но такое приспособление имеется далеко не у каждого водителя, а поэтому пригодится следующая подсказка плотности электролита (из расчета на 1 литр дистиллированной воды):
- при 1,23г/см3 – 280г;
- при 1,25г/см3 – 310г;
- при 1,27г/см3 – 345 г;
- при 1,29г/см3 – 385 г.

Собственно на этом работа и заканчивается. Тем, кто проживает в средней полосе России, следует придерживаться плотности – 1,27 г/см3. При этом для зон с холодным климатом (до -30 °С) допустимый показатель составляет 1,26-1,28 г/см3, а жарких субтропических районов – 1,24-1,26 г/см3. Пределы плотности от 1,27 г/см3 до 1,29 г/см3 актуальны для тех регионов, где зима свирепствует до -50 °С.
К чему приведет нарушение рецептуры
Показатель в 1,29 г/см3 является не самым высоким – встречается концентрат электролита с плотностью 1,33 г/см3 (применяется для корректировки), ранее можно было найти даже с плотность 1,4 г/см3, но сейчас он снят с продажи. Однако его все же следует также разбавить водой и только после этого заливать внутрь АКБ. Почему же нельзя лить сильно концентрированный электролит?
Ничего хорошо уж точно не произойдет! Из-за высокой концентрации страдают пластины аккумулятора – их просто разъедает со временем. Это происходит медленно, но верно! Поэтому, если залить высокий концентрат, не следует удивляться тому, что АКБ в скором времени вышла из строя.
Это происходит медленно, но верно! Поэтому, если залить высокий концентрат, не следует удивляться тому, что АКБ в скором времени вышла из строя.
Низкая плотность электролита приводит к такому явлению, которое называется сульфатацией. Об этом процессе известно многим опытным водителям. В результате на пластинах оседают кристаллы сульфита свинца, из-за чего металл утрачивает способность к накоплению заряда.
К тому же, как выше уже было упомянуто, из-за слишком низких показателей плотности электролит замерзает, обращаясь в лед. Чем это грозит, каждому уже понятно – повреждения пластин не избежать.
Как корректировать плотность жидкости
Владельцам автомобилей необходимо контролировать уровень электролита и его плотность. Из-за гидролиза и нагрева АКБ в подкапотном пространстве содержание субстанции понижается, а плотность наоборот растет. По этой причине возникает необходимость доливать дистиллированную воду. Но иногда показатели плотности электролита могут стать меньше нормы. Тогда следует поднять концентрацию кислоты.
Тогда следует поднять концентрацию кислоты.
Существуют несколько способов как это можно сделать, исходя из степени понижения плотности электролита. Для этого следует замерить его концентрацию в каждой банке по отдельности. Если густота электролита получена от 1,18 г/см3 до 1,20 г/см3, то оптимальное решение – замена части электролита в банке на новый с плотностью 1,27 г/см3. Иными словами делается повышение плотности электролита.
Только предварительно стоит убедиться в том, что АКБ заряжена, иначе батарею следует подзарядить. При низком заряде аккумулятора к такой процедуре нельзя приступать. Иначе концентрация H2SO4 резко поднимется, что приведет только к разрушению пластин.
Сама же процедура выполняется в следующем порядке:
- Резиновой грушей откачивает как можно больше жидкости из банки. При этом замерить объем.
- Добавляют новый корректирующую жидкость с плотностью 1,27-1,29 гр/см3 в количестве равном половине изъятого объема.

- Пусть все перемешается между собой – для этого можно дать нагрузку на выводы, просто подождать некоторое время или потрясти АКБ.
- Замеряют плотность. Если показатели по-прежнему не достигли допустимых пределов доливку электролита стоит продолжать до достижения нужных параметров.
- Когда предел установлен, банки закрывают, а сам аккумулятор ставится на зарядку.
В том случае, когда плотность электролита снижена ниже уровня в 1,2 гр/см3, тогда необходимо менять его полностью – сливать старый, заливать новый.
Уголок вопроса: Аккумуляторная кислота — Индус
Почему в батареях используется только серная кислота? Почему не соляная кислота или азотная кислота?
ПРИЯНУЙ
Хокраджар, Ассам
Электрохимические реакции составляют основу преобразования химической энергии в электрическую в батареях. Электрохимическая реакция — это окислительно-восстановительная реакция, в которой участвующие электроны ловко направляются через внешнюю цепь, где они выполняют полезную работу.
Во время разрядки аккумулятора электроны, высвобождаемые на отрицательном электроде (катоде), проходят через внешнюю цепь и достигают положительного электрода (анода). Нейтральность заряда внутри батареи устанавливается движением ионов в электролите.
Таким образом, электролит должен быть хорошим проводником ионов. Электролит в батарее может участвовать или не участвовать в реакциях, происходящих на электродах, но должен поддерживать реакции. Например, в никель-кадмиевых и литий-ионных аккумуляторах электролит не участвует в реакциях элементов.
В случае сухих элементов на основе диоксида цинка-марганца можно использовать различные нейтральные/щелочные электролиты, такие как хлорид аммония, хлорид цинка и гидроксид калия.
В зависимости от используемых химикатов элемент из диоксида цинка-марганца с электролитом из гидроксида калия может быть первичным или вторичным элементом.
Работа свинцово-кислотной батареи (обычно используемой для пуска-зажигания-зажигания в автомобилях) включает образование сульфата свинца путем окисления свинца на аноде и восстановления двуокиси свинца на катоде.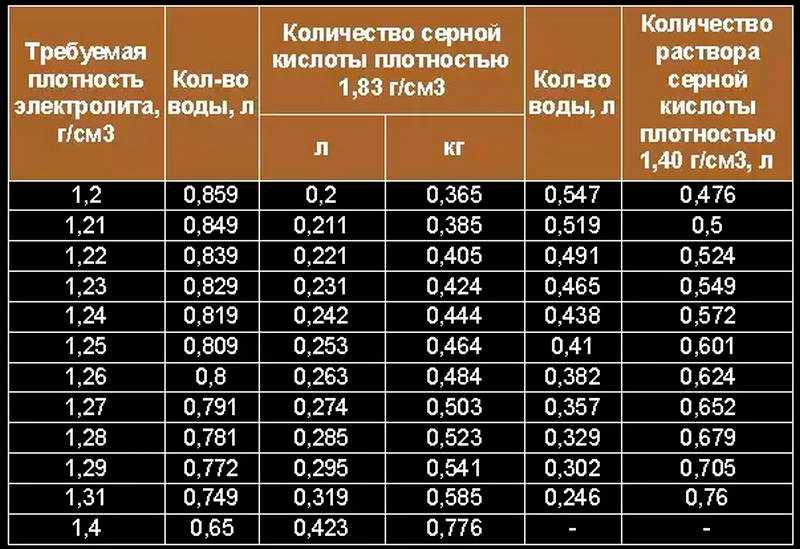
Поскольку продуктом разрядки аккумулятора является сульфат свинца на обоих электродах, общую реакцию элемента иногда называют реакцией двойного сульфата.
В образовании продуктов сульфата свинца участвует серная кислота, которая является электролитом, используемым в этих батареях. Во время зарядки аккумулятора сульфат свинца снова превращается в свинец и диоксид свинца, высвобождая серную кислоту в электролит.
Поскольку серная кислота расходуется в процессе разрядки и высвобождается в процессе зарядки, удельный вес электролита изменяется во время использования и зарядки батареи.
Поэтому удельный вес электролита используется в качестве индикатора состояния заряда свинцово-кислотных аккумуляторов. Поскольку основные реакции в батарее включают поглощение и высвобождение молекул серной кислоты, в этих батареях используется электролит из серной кислоты.
Однако возможно использование других электролитов с парой свинец-диоксид свинца. К ним относятся хлорная кислота, борфтористоводородная кислота, кремнефтористоводородная кислота и др. Но проблемы с их использованием ограничивают их применение в качестве электролитов. Например, хлорная кислота является потенциальным взрывчатым веществом при контакте с органическими веществами.
Но проблемы с их использованием ограничивают их применение в качестве электролитов. Например, хлорная кислота является потенциальным взрывчатым веществом при контакте с органическими веществами.
T. SRI DEVI KUMARI
CSIR-Старший научный сотрудник
Отдел функциональных материалов
CSIR-Центральный электрохимический научно-исследовательский институт 0 5 Karadiku mil Nadu
(копия исправлена фактическая ошибка)
Что такое свинцово-кислотная батарея? – Аксессуары для аккумуляторов
Свинцово-кислотный аккумулятор — это перезаряжаемый аккумулятор, в котором для работы используются свинец и серная кислота. Свинец погружают в серную кислоту, чтобы обеспечить контролируемую химическую реакцию.
Эта химическая реакция заставляет батарею производить электричество. Затем эта реакция меняется на обратную для перезарядки батареи.
МАТЕРИАЛЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯ СВИНЦОВО-КИСЛОТНЫХ АККУМУЛЯТОРОВ
Основными активными материалами, необходимыми для создания свинцово-кислотных аккумуляторов, являются:
- Перекись свинца (PbO2): Темно-коричневое, твердое и хрупкое вещество для формирования положительной пластины.

- Губчатый свинец (Pb): Чистый свинец в условиях мягкой губки создает отрицательную пластину.
- Разбавленная серная кислота (h3SO4): сильная кислота и хороший электролит. Он сильно ионизирован, и большая часть тепла, выделяемого при разбавлении, происходит за счет гидратации ионов водорода. Используется для свинцово-кислотных аккумуляторов с соотношением вода:кислота = 3:1.
КАК РАБОТАЕТ СВИНЦОВО-КИСЛОТНЫЙ АККУМУЛЯТОР?
Свинцово-кислотная аккумуляторная батарея изготавливается путем погружения пластины пероксида свинца и пластины губчатого свинца в разбавленную серную кислоту. Электрический ток подключается снаружи между этими пластинами. В разбавленной серной кислоте молекулы кислоты расщепляются на положительные ионы водорода (H+) и отрицательные сульфат-ионы (SO4—). Достигнув пластины PbO2, ионы водорода получают от нее электроны и становятся атомом водорода, который снова атакует PbO2 и образует PbO и h3O (воду). Этот PbO реагирует с h3SO4 и образует PbSO4 и h3O (воду).
Этот PbO реагирует с h3SO4 и образует PbSO4 и h3O (воду).
Ионы SO4- — (анионы) движутся к электроду (аноду), соединенному с положительной клеммой источника постоянного тока, где они отдают свои лишние электроны и становятся радикалом SO4. Этот радикал SO4 не может существовать один; следовательно, реагирует с PbSO4 анода и образует перекись свинца (PbO2) и серную кислоту (h3SO4).
ПРИ ЗАРЯДКЕ АККУМУЛЯТОРНОЙ БАТАРЕИ
Зарядка — это процесс, направленный на обратную электрохимическую реакцию. Он преобразует электрическую энергию от зарядного устройства в химическую энергию в аккумуляторе. Однако батарея не хранит электричество; он сохраняет химическую энергию, необходимую для производства электричества.
Зарядное устройство меняет направление тока при условии, что зарядное устройство имеет большее напряжение, чем аккумулятор. Зарядное устройство создает избыток электронов на отрицательных пластинах, и положительные ионы водорода притягиваются к ним. Водород реагирует с сульфатом свинца с образованием серной кислоты и свинца, и когда большая часть сульфата уходит, водород поднимается с отрицательных пластин. Кислород в воде вступает в реакцию с сульфатом свинца на положительных пластинах, снова превращая их в двуокись свинца, и, когда реакция почти завершена, из положительных пластин поднимаются пузырьки кислорода. Это называется газированием.
Водород реагирует с сульфатом свинца с образованием серной кислоты и свинца, и когда большая часть сульфата уходит, водород поднимается с отрицательных пластин. Кислород в воде вступает в реакцию с сульфатом свинца на положительных пластинах, снова превращая их в двуокись свинца, и, когда реакция почти завершена, из положительных пластин поднимаются пузырьки кислорода. Это называется газированием.
САМОРАЗРЯД
Одной из неприятных особенностей свинцово-кислотных аккумуляторов является то, что они разряжаются сами по себе, даже если не используются. Общее эмпирическое правило — скорость саморазряда составляет один процент в день. Эта скорость увеличивается при высоких температурах и уменьшается при более низких температурах.
ЗАМЕНА ЭЛЕКТРОЛИТА СВИНЦОВО-КИСЛОТНОЙ АККУМУЛЯТОРНОЙ БАТАРЕИ ПОСЛЕ ЗАРЯДКИ И РАЗРЯДКИ
При разрядке свинцовой аккумуляторной батареи содержание серной кислоты в электролите постоянно уменьшается, воды постепенно увеличивается, а удельный вес раствора падает.
