23.Понятия:катализатор,ингибитор,промотор,фермент.
Катализаторы, уменьшающие скорость реакции, называются –ингибиторами . Вещества, не расходующиеся в результате протекания реакции, но влияющие на её скорость, называются – катализаторами.
Промотор- вещество,усиливающее действие катализатора.
Ферме́нты
или энзи́мы (от лат. fermentum, греч. ζύμη,
ἔνζυμον — закваска) — обычно белковые
молекулы или молекулы РНК (рибозимы)
или их комплексы, ускоряющие
(катализирующие) химические реакции в
живых системах. Реагенты в реакции,
катализируемой ферментами, называются
субстратами, а получающиеся вещества
— продуктами. Ферменты специфичны к
субстратам (АТФаза катализирует
расщепление только АТФ, а киназа
фосфорилазы фосфорилирует только
фосфорилазу). Ферментативная активность
может регулироваться активаторами и
ингибиторами (активаторы — повышают,
ингибиторы — понижают). Белковые
ферменты синтезируются на рибосомах,
а РНК — в ядре.
22.Катализ (гомогенный, гетерогенный, ферментативный). Понятия о механизме каталитических процессов.
Катализ.. Явление изменения скорости реакции под действием таких веществ называется -катализом. Реакции, протекающие под действием катализаторов, называются – каталитическими. Различают гомогенный и гетерогенный катализ. В случае гомогенного катализа катализатор и реагирующие вещества образуют одну фазу (газ или раствор). В случае гетерогенного катализа катализатор находится в системе в виде самостоятельной фазы. Бывают катализаторы как ускоряющие протекание реакции, так и замедляющие её. В первом случае катализ называется положительным, а во втором отрицательным.
Очень
большую роль играет катализ в биологических
системах. Большинство химических
реакций, протекающих в пищеварительной
системе, в крови и в клетках животных
и человека, являются каталитическими
реакциями. Катализаторы, называемые в
этом случае ферментами, представляют
собой простые и сложные белки. Так,
слюна содержит фермент птиалин, который
катализирует превращение крахмала в
сахар. Фермент, имеющий в желудке,-
пепсин- катализирует расщеплением
белков. В организме человека находится
около 3000 различных ферментов; каждый
из них служит эффективным катализатором
соответствующей реакции.
Так,
слюна содержит фермент птиалин, который
катализирует превращение крахмала в
сахар. Фермент, имеющий в желудке,-
пепсин- катализирует расщеплением
белков. В организме человека находится
около 3000 различных ферментов; каждый
из них служит эффективным катализатором
соответствующей реакции.
Так же сущность заключается в том, что в присутствии катализатора изменится путь, по которому проходит суммарная реакция, образуются другие переходные состояния с иными энергиями активации, а поэтому изменяется и скорость химической реакции.
Пример гомогенного катализа является разложение пероксида водорода в присутствии ионов йода, реакция протекает в две стадии : 1)H2О2 + I → H2О + IO
2)H2О2 + IO → H2О + О2 + I
Механизм
гетерогенного катализа сложнее, чем у
гомогенного. Механизм гетерогенного
катализа включает пять стадий, причем
все они обратимы.
1.Диффузия реагирующих веществ к поверхности твердого вещества
2.Физическая адсорбция на активных центрах поверхности твердого вещества реагирующих молекул и затем хемосорбция их
3.Химическая реакция между реагирующими молекулами
4.Десорбция продуктов с поверхности катализатора
5.Диффузия продукта с поверхности катализатора в общий поток
Ката́лиз — избирательное ускорение одного из возможных термодинамически разрешенных направлений химической реакции под действием катализатора(ов), который многократно вступает в промежуточное химическое взаимодействие с участниками реакции и восстанавливает свой химический состав после каждого цикла промежуточных химических взаимодействий.
21. Энергия активации. Влияние температуры на скорость химических реакций. Уравнение Аррениуса.
Энергия активации- избыточная энергия, которой должны обладать молекулы для того что бы их столкновение могло привести к образованию нового вещества!
Обозначают-
(Еа),выражают в кДж/моль, молекулы
обладающие такой энергией, называются
активными молекулами. Энергия активации
различных реакций различна. Её величина
является тем фактором, посредствам
которого сказывается влияние природы
реагирующих веществ на скорость реакции.
Для некоторых реакций энергия активации
мала, для некоторых велика! Если энергия
активации очень мала, то это означает
что значительная часть столкновений
между частицами реагирующих веществ
приводит к реакции. Скорость такой
реакции велика. Примером реакций,
энергия активации которых ничтожно
мала, могут служить ионные реакции в
растворах.
Энергия активации
различных реакций различна. Её величина
является тем фактором, посредствам
которого сказывается влияние природы
реагирующих веществ на скорость реакции.
Для некоторых реакций энергия активации
мала, для некоторых велика! Если энергия
активации очень мала, то это означает
что значительная часть столкновений
между частицами реагирующих веществ
приводит к реакции. Скорость такой
реакции велика. Примером реакций,
энергия активации которых ничтожно
мала, могут служить ионные реакции в
растворах.
И напротив, если энергия активации реакции очень велика ,то это значит что лишь очень малая часть столкновений взаимодействующих частиц приводит к протеканию химической реакции. Скорость подобной реакции очень мала.
Пример: N2+3H2=2NH3
С
ростом температуры число активных
молекул возрастает. Отсюда следует,
что и скорость химической реакции
должна увеличиться с повышением
температуры. Действительно, при
возрастании температуры химические
реакции протекают быстрее!
Действительно, при
возрастании температуры химические
реакции протекают быстрее!
И наоборот ,С понижением температуры число активных молекул убывает. Отсюда следует ,что и скорость химической реакции должна уменьшиться с понижением температуры. При убывании температуры химические реакции протекают медленнее!
Более строго зависимость скорости реакции от температуры описывается уравнение Аррениуса, связывающим константу скорости химической реакции с энергией активации:
k=A*exp(-Ea/RT), где А- предэкспоненциальный множитель, по физическому смыслу отражающий вероятность благоприятных для осуществления реакции взаимных ориентаций активных молекул при соударении; остальные величины определены ранее.
Катализаторы, ингибиторы, катализ
При попытке поджечь сахар он будет плавиться и обугливатьсяПоложите на сахар горку пепла, который будет служить катализаторомС пеплом сахар загорится! Сахар горит, если на него посыпать пеплом! При отсутствии пепла (катализатора) — сахар только обугливаетсяОкисление спирта в присутствии медного катализатора
Вы когда-нибудь пробовали поджечь сахар? Казалось бы, сильно экзотермическая реакция С12Н22О11+12О2 →12СО2+11Н2О должна идти легко.
Химические реакции, которые «не желают» протекать сами по себе или идут с очень малой скоростью и требуют дополнительного «стимула» — присутствия веществ, которые в результате реакции остаются неизменными, — происходят повсеместно. Это, во-первых, абсолютно все химические процессы, лежащие в основе жизнедеятельности клеток. Они протекают только в присутствии ферментов, а отсутствие в организме хотя бы одного из них нарушает обмен веществ и чревато тяжёлой болезнью или же просто несовместимо с жизнью.
Кроме того, к таким реакциям относится большинство крупнотоннажных процессов, используемых в химической промышленности.
Катализаторы позволяют проводить химические процессы при гораздо более мягких условиях. А кроме того, в присутствии катализаторов идут реакции, которые вообще невозможны без их участия ни в каких условиях.
При этом количество катализатора, необходимое для превращения огромной массы реагентов в продукты реакции, несоизмеримо мало. Одна молекула фермента катализирует разложение 5 млн. молекул сахара за 1 с!
Катализ и его секреты
Но в чём скрыта тайна веществ — катализаторов? Давайте разберёмся, почему сахар и другие органические вещества самопроизвольно не превращаются в углекислый газ и воду — гораздо более энергетически выгодные (говорят ещё «термодинамически устойчивые») соединения. Разве это не удивительно? Ведь если положить, скажем, шарик на вершину горки, он тут же займёт более энергетически выгодное положение — скатится вниз. Если же его оградить барьером, он скатиться не сможет. Чтобы оказаться внизу и тем самым уменьшить свою потенциальную энергию, шарику нужно преодолеть барьер, а для этого ему нужно подвести дополнительную энергию.
Разве это не удивительно? Ведь если положить, скажем, шарик на вершину горки, он тут же займёт более энергетически выгодное положение — скатится вниз. Если же его оградить барьером, он скатиться не сможет. Чтобы оказаться внизу и тем самым уменьшить свою потенциальную энергию, шарику нужно преодолеть барьер, а для этого ему нужно подвести дополнительную энергию.
Все существующие химические вещества, даже весьма термодинамически неустойчивые, окружены на своих энергетических «вершинах» подобными барьерами. Порой энергия, необходимая для их преодоления, сравнима с кинетической энергией теплового движения молекул. Тогда достаточно простого смешения реагентов — и реакция происходит при комнатной температуре. Нагревая реакционную смесь, можно преодолеть барьер чуть повыше. Но иногда он слишком высок, и в этом случае придётся или искать способы доставки необходимой энергии молекулам реагентов, или попытаться обойти энергетический барьер.
Как это сделать? Оказывается, катализатор может, подобно опытному проводнику, хорошо знающему местность, повести реакцию по совершенно иному пути. При этом её механизм претерпевает сильные изменения. Существует масса способов обойти энергетическую «гору». Каждый катализатор, работающий в конкретной реакции, выбирает для процесса свой путь. При этом новый маршрут может быть гораздо длиннее изначального: число промежуточных стадий и продуктов реакции иногда возрастает в несколько раз. Но зато количество энергии, требуемое на каждой стадии, оказывается существенно меньше, чем в отсутствие «проводника». В итоге, пройдя более длинный путь при помощи катализатора, реакция даёт желаемый результат значительно быстрее.
При этом её механизм претерпевает сильные изменения. Существует масса способов обойти энергетическую «гору». Каждый катализатор, работающий в конкретной реакции, выбирает для процесса свой путь. При этом новый маршрут может быть гораздо длиннее изначального: число промежуточных стадий и продуктов реакции иногда возрастает в несколько раз. Но зато количество энергии, требуемое на каждой стадии, оказывается существенно меньше, чем в отсутствие «проводника». В итоге, пройдя более длинный путь при помощи катализатора, реакция даёт желаемый результат значительно быстрее.
Однако «постороннее вещество» может воздействовать на ход реакции и противоположным образом: привести её к труднопреодолимому энергетическому барьеру. Тогда процесс замедляется. Такой «отрицательный» катализ называется ингибированием (от лат. inhibeo — «останавливаю», «сдерживаю»), а «катализаторы, действующие наоборот» — ингибиторами.
Зачем нужно замедлять скорость реакции? Существуют процессы, которые необходимы человеку, а также существуют такие процессы, проведение которых может пагубно сказаться как на человека, так и на предметах его обихода и окружающей среде. например появление ржавчины — коррозия металлов, гниение продуктов питания. Такими реакциями могут быть взрывы различных химических веществ, которые чувствительны к движению или сотрясению. Нужно учитывать, что химические реакции, в результате которых образуется лишь одно вещество — достаточно редкие. В основном при реакциях образуется более одного вещества. Особенно ярко такое явление наблюдается в органической химии.
например появление ржавчины — коррозия металлов, гниение продуктов питания. Такими реакциями могут быть взрывы различных химических веществ, которые чувствительны к движению или сотрясению. Нужно учитывать, что химические реакции, в результате которых образуется лишь одно вещество — достаточно редкие. В основном при реакциях образуется более одного вещества. Особенно ярко такое явление наблюдается в органической химии.
В организмах живых существ и множестве других процессах, протекающих в нашей среде обитания часто необходимо, чтобы в процессе реакции получалось только одно нужное нам вещество или продукт реакции. Именно в этом случае применяется катализ. Грамотный подбор катализатора позволяет проводить химические процессы только в нужном для нас направлении и с получением требуемого нам вещества, при этом исключая выход других побочных эффектов реакции.
В нашем организме имеются ферменты — катализаторы, которые работают точно таким же образом. Именно по аналогии с ферментами наука приобрела возможность получения каталитических реакции.
Именно по аналогии с ферментами наука приобрела возможность получения каталитических реакции.
Несмотря на аналогию и полученные знания, тайны катализа остаются полностью не раскрытыми.
Виды катализаторов
Что использовать в качестве катализатора!?
Какие виды катализаторов бывают?! В их качестве могут выступать самые разнообразные вещества: газы, ионы и различные комплексы; металлы и оксиды; простые органические соединения и сложнейшие природные и синтетические полимеры; даже… обычные вода, песок, глина!
Но самым важным фактором является агрегатное состояние катализатора и вступающих во взаимодействие веществ.
Когда катализатор, реагенты и продукты реакции находятся в одной фазе (например, жидкость, газ), где нет границ раздела, реагентам гораздо проще вступить в контакт с катализатором. При этом катализатор находится в виде молекул или ионов. Такой катализ называют гомогенным (от греч. «гомогенес» — «однородный»). В случае гетерогенного катализа (от греч. «гетерогенес» — «разнородный»), особенно если катализатор — твёрдое тело, на ход реакции воздействует не отдельная его молекула, а целый участок поверхности и подповерхностных слоёв. Это взаимодействие реагентов сразу со многими атомами или молекулами катализатора, к тому же выстроенными определённым образом, усиливает каталитическое влияние. Реакции между твёрдыми веществами всегда гетерогенны.
«гомогенес» — «однородный»). В случае гетерогенного катализа (от греч. «гетерогенес» — «разнородный»), особенно если катализатор — твёрдое тело, на ход реакции воздействует не отдельная его молекула, а целый участок поверхности и подповерхностных слоёв. Это взаимодействие реагентов сразу со многими атомами или молекулами катализатора, к тому же выстроенными определённым образом, усиливает каталитическое влияние. Реакции между твёрдыми веществами всегда гетерогенны.
Гомогенный катализ и гетерогенный катализ существенно различаются по своему механизму. Вероятно, с этим связана тенденция теорий катализа к «однобокости» — преимущественному объяснению либо гомогенного, либо гетерогенного катализа.
С помощью катализаторов в мире ежегодно производятся миллиарды тонн химической продукции. Около 90 % промышленных химических процессов — каталитические процессы.
Раньше всего, в начале XIX в., обнаружили каталитические свойства благородных металлов: платины, палладия и др. До сих пор эти металлы применяются, например, в катализаторах дожигания выхлопных газов автомобилей (они переводят ядовитый угарный газ СO, образующийся при неполном окислении топлива, в углекислый газ СО2.,), при окислении аммиака NH3, в других процессах. Конечно, учёные работают над заменой дорогих металлов более дешёвыми.
До сих пор эти металлы применяются, например, в катализаторах дожигания выхлопных газов автомобилей (они переводят ядовитый угарный газ СO, образующийся при неполном окислении топлива, в углекислый газ СО2.,), при окислении аммиака NH3, в других процессах. Конечно, учёные работают над заменой дорогих металлов более дешёвыми.
Из гомогенных каталитических реакций наиболее известны катализ кислотами и основаниями, а также солями и комплексами металлов. Самый простой кислотный катализатор — ион водорода. Он одновременно и самый маленький. В числе первых изученных каталитических реакций был гидролиз крахмала («разваливание» его на молекулы сахаров) в кислой среде. Сейчас кислотный катализ очень распространён в органической химии: ионы водорода хорошо ускоряют различные реакции спиртов, альдегидов, жирных кислот и других веществ.
Однако технологи на химических производствах больше любят гетерогенный катализ. Скажем, реакция идёт в газовой фазе, а катализатор твёрдый (пористое железо в синтезе аммиака). Так как катализатор находится в другой фазе, продукты реакции легко от него отделить. Примечательно, что тот же кислотно-основной катализ можно сделать гетерогенным: различные алюмосиликаты и оксиды металлов в зависимости от вида их обработки и состава проявляют свойства кислоты или основания
Скажем, реакция идёт в газовой фазе, а катализатор твёрдый (пористое железо в синтезе аммиака). Так как катализатор находится в другой фазе, продукты реакции легко от него отделить. Примечательно, что тот же кислотно-основной катализ можно сделать гетерогенным: различные алюмосиликаты и оксиды металлов в зависимости от вида их обработки и состава проявляют свойства кислоты или основания
Катализаторы — ингибиторы или яды?
Химия поверхности — одна из важнейших тем по химии. Такие понятия, как адсорбция, дисперсия, десорбция, абсорбент и адсорбент или окклюзия, являются ключевыми аспектами химии поверхности. Одной из наиболее острых тем среди них является катализ. Чтобы понять катализ, необходимо понять, что такое катализатор и что такое каталитические яды или ингибиторы. Не менее важно знать, как функционируют ингибиторы, типы ингибиторов и разницу между ингибиторами и ядами.
Согласно научному определению, катализатор – это постороннее вещество, добавляемое в реакцию для ускорения или замедления скорости реакции. Отрицательный катализатор замедляет химическую реакцию, а положительный ускоряет ее. Гомогенные, гетерогенные, положительные, отрицательные, автокатализаторы и индуцированные катализаторы представляют собой несколько типов катализаторов.
Отрицательный катализатор замедляет химическую реакцию, а положительный ускоряет ее. Гомогенные, гетерогенные, положительные, отрицательные, автокатализаторы и индуцированные катализаторы представляют собой несколько типов катализаторов.
Катализатор сохраняет свою массу и состав до завершения химической реакции и не может инициировать реакцию или изменить положение равновесия. Катализаторы специфичны по своей природе.
Каталитический ингибитор — это химическое вещество, которое влияет на эффективность катализатора, замедляя его. Проще говоря, это вещество, разрушающее своим присутствием активность катализатора.
Как каталитические ингибиторы снижают эффективность катализатора Мы знаем, что на поверхности катализатора есть несколько активных центров. Активный центр представляет собой специфическую область фермента, где связываются субстрат или реагенты, и происходит процесс катализа или химическая реакция.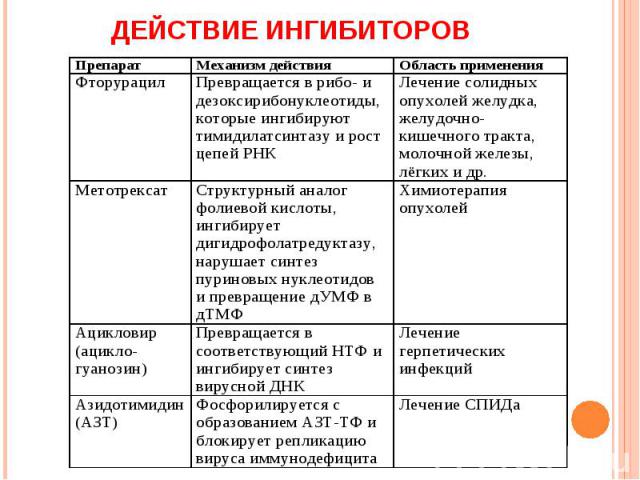 Ингибитор влияет на эффективность катализатора, связываясь с активными центрами на его поверхности.
Ингибитор влияет на эффективность катализатора, связываясь с активными центрами на его поверхности.
Действие большинства каталитических ингибиторов заключается в предотвращении сближения реагентов друг с другом путем постоянного или временного связывания с одним из реагентов. Они могут координировать свои действия с активными центрами, чтобы замедлить процесс реакции.
Примером каталитического ингибитора является метотрексат – химиотерапевтический препарат, который действует как конкурентный ингибитор.
Ведущими причинами ингибирования являются уменьшение концентрации одного из реагентов в химической реакции, уменьшение концентрации активного катализатора или обрыв цепной реакции.
типа каталитических ингибиторов
Химические каталитические ингибиторы широко разделены на два типа
- Обратный каталитический ингибитор
- Необратимый каталитический каталитический ингибитор
9003 Обращаемая каталитическая ингибитор
9007 Определимый каталитический ингибитор
9007 Определимый каталитический ингибитор
9007 Определимый каталитический ингибитор
9007 Определимый каталитический ингибитор
9007 Определимый каталитический ингибитор
9007 Определимый каталитический ингибитор
9007.
 Попрощаем. процесс реакции. После удаления такого рода ингибитора пораженные ферменты снова начинают работать. По существу, они не оказывают постоянного влияния на химическую реакцию. Обратимые ингибиторы подразделяются на конкурентные, неконкурентные и неконкурентные ингибиторы. Необратимый каталитический ингибитор
Попрощаем. процесс реакции. После удаления такого рода ингибитора пораженные ферменты снова начинают работать. По существу, они не оказывают постоянного влияния на химическую реакцию. Обратимые ингибиторы подразделяются на конкурентные, неконкурентные и неконкурентные ингибиторы. Необратимый каталитический ингибитор Ингибиторы, останавливающие возникновение нежелательных реакций в первичной реакции, являются необратимыми каталитическими ингибиторами. Они просто дезактивируют фермент, связываясь с активными центрами. Опять же, существует три типа необратимых ингибиторов: групповые реагенты, реактивные аналоги субстрата и суицидальные ингибиторы.
Каталитические яды Вещества, разрушающие активность катализатора своим присутствием, известны как каталитические яды. Отравление катализатора происходит за счет преимущественной адсорбции яда на его поверхности, что уменьшает пространство, доступное для адсорбции реагирующих молекул. Простыми словами, каталитические яды — это вещества, меняющие состав реакции.
Простыми словами, каталитические яды — это вещества, меняющие состав реакции.
Некоторыми примерами каталитических ядов являются окись углерода, галогениды, сульфиды, сульфиты, фосфаты, фосфиты и органические молекулы, такие как нитрилы, нитросоединения, оксимы и гетероциклы азота.
ЗаключениеКатализатор – это постороннее химическое вещество, которое помогает изменить или изменить скорость химической реакции. Обычно катализатор используется в химической реакции для увеличения скорости химической реакции. Шесть распространенных катализаторов: гомогенные, гетерогенные, индуцированные, автокатализаторы, отрицательные и положительные. С другой стороны, каталитические ингибиторы влияют на активность катализатора в химической реакции, а каталитические яды останавливают нежелательную реакцию в первичной химической реакции.
Основное различие между каталитическим ингибитором и каталитическим ядом заключается в том, что ингибитор замедляет каталитическую реакцию, влияя на активность катализатора. С другой стороны, яды напрямую предотвращают возникновение нежелательных реакций.
С другой стороны, яды напрямую предотвращают возникновение нежелательных реакций.
Страница не найдена — Micromeritics
Перейти к содержимому
Поиск по всему нашему веб-сайту нижеОбщие фильтры
Только точные совпадения
Перейти к началуИмя*
Фамилия*
Приветствие — Пожалуйста, выберите вариант — MrMrsMsDrProfPhD
Номер телефона*
Электронная почта*
Название компании*
Почтовый адрес*
Почтовый адрес Строка 2
Country*Please SelectAfghanistanAlbaniaAlgeriaAmerican SamoaAndorraAngolaAnguillaAntarcticaAntigua and BarbudaArgentinaArmeniaArubaAustraliaAustriaAzerbaijanBahamasBahrainBangladeshBarbadosBelarusBelgiumBelizeBeninBermudaBhutanBolivia, Plurinational State ofBonaire, Sint Eustatius and SabaBosnia and HerzegovinaBotswanaBouvet IslandBrazilBritish Indian Ocean TerritoryBrunei DarussalamBulgariaBurkina FasoBurundiCambodiaCameroonCanadaCape VerdeCayman IslandsCentral African RepublicChadChileChinaChristmas IslandCocos (Keeling) IslandsColombiaComorosCongoCongo, the Democratic Republic of theCook IslandsCosta RicaCroatiaCubaCuraçaoCyprusCzech RepublicCôte d’IvoireDenmarkDjiboutiDominicaDominican RepublicEcuadorEgyptEl SalvadorEquatorial GuineaEritreaEstoniaEthiopiaFalkland Islands (Мальвинские острова)Фарерские островаФиджиФинляндияФранцияФранцузская ГвианаФранцузская ПолинезияФранцузские южные территорииГабонГамбияГрузияГерманияГанаГибралтарГрецияГренландияГренадаГваделупаГуамГватемалаГернсиГвинеяГвинея-Бисау GuyanaHaitiHeard Island and McDonald IslandsHoly See (Vatican City State)HondurasHong KongHungaryIcelandIndiaIndonesiaIran, Islamic Republic ofIraqIrelandIsle of ManIsraelItalyJamaicaJapanJerseyJordanKazakhstanKenyaKiribatiKorea, Democratic People’s Republic ofKorea, Republic ofKuwaitKyrgyzstanLao People’s Democratic RepublicLatviaLebanonLesothoLiberiaLibyaLiechtensteinLithuaniaLuxembourgMacaoMacedonia, the former Yugoslav Republic ofMadagascarMalawiMalaysiaMaldivesMaliMaltaMarshall IslandsMartiniqueMauritaniaMauritiusMayotteMexicoMicronesia, Federated States ofMoldova, Republic ofMonacoMongoliaMontenegroMontserratMoroccoMozambiqueMyanmarNamibiaNauruNepalNetherlandsNew CaledoniaNew ZealandNicaraguaNigerNigeriaNiueNorfolk IslandNorthern Mariana IslandsNorwayOmanPakistanPalauPalestine, Государство ПанамаПапуа-Новая ГвинеяПарагвайПеруФилиппиныПиткэрнПольшаПортугалияПуэрто-РикоКатарРумынияРоссийская ФедерацияРуандаРеюньонСен-БартельмиСент-Хелена, Вознесение и Тристан-да-КуньяСент-Китс и NevisSaint LuciaSaint Martin (French part)Saint Pierre and MiquelonSaint Vincent and the GrenadinesSamoaSan MarinoSao Tome and PrincipeSaudi ArabiaSenegalSerbiaSeychellesSierra LeoneSingaporeSint Maarten (Dutch part)SlovakiaSloveniaSolomon IslandsSomaliaSouth AfricaSouth Georgia and the South Sandwich IslandsSouth SudanSpainSri LankaSudanSurinameSvalbard and Jan MayenSwazilandSwedenSwitzerlandSyrian Arab RepublicTaiwan, Province of ChinaTajikistanTanzania, United Republic ofThailandTimor -ЛестеТогоТокелауТонгаТринидад и ТобагоТунисТурцияТуркменистанОстрова Теркс и КайкосТувалуУгандаУкраинаОбъединенные Арабские ЭмиратыВеликобританияСоединенные ШтатыОтдаленные малые острова СШАУругвайУзбекистанВануатуВенесуэла, Боливарианская РеспубликаВьетнамВиргинские острова, Британские Виргинские острова, СШАУоллис и ФутунаЗамбияЗамбияЗамбияЗамбияЗамбияЗамбияЗамбия
Город*
Почтовый индекс/индекс*
Модель прибора*
Серийный номер прибора*
Пожалуйста, предоставьте подробную информацию об аксессуарах, которые вы хотите приобрести, включая все номера деталей*
Чтобы убедиться, что мы соблюдаем ваши предпочтения, нам необходимо подтвердить разрешение на отправку вам сообщений по электронной почте.
