Поиск и устранение неисправности электрооборудования в Екатеринбурге
Наиболее сложным при ремонте электрооборудования является процесс поиска неисправностей, так как современные электрические схемы представляют собой сложную систему. Задача осложняется еще тем, что большинство неисправностей носят скрытый характер и не могут быть обнаружены внешним осмотром. Процесс поиска неисправности представляет собой последовательность тестовых экспериментов и принятия диагностического промежуточного или конечного решения.
Одним из путей уменьшения времени поиска неисправностей и требований к квалификации обслуживающего персонала является применение автоматического поиска неисправностей, основанного на алгоритмизации процедур поиска. Для поиска неисправностей в системе электрооборудования, как показывает опыт эксплуатации, возможно применение следующих методов:
- Внешний осмотр. Наибольший эффект дает внешний осмотр включенного электрооборудования при отсутствии аварийных признаков отказа и соблюдения правил безопасности труда.

- Метод замены. Если после замены исчезают неисправности, то был заменен действительно поврежденный элемент.
- Метод вносимой неисправности. В этом случае в проверяемый блок вносятся искусственные повреждения, вызывающие определенные логические взаимодействия элементов. Контроль за параметрами схемы и анализ их изменений позволяют определить или локализовать неисправность.
- Метод половинного разбиения. Этот метод успешно может быть применен в том случае, если показатели надежности отдельных узлов и блоков схем электрооборудования одинаковы. Для поиска неисправности можно проверить один узел, например, по напряжению, а затем по току. Деление может быть выполнено и внутри блока или узла, что позволяет оперативно локализовать, а затем и обнаружить неисправность.

- Метод контрольного сигнала. Использование подобного метода обусловлено широким распространением логических элементов и микросхем в системах регулирования и управления. Для обнаружения неисправности с помощью контрольного сигнала целесообразно представить контрольную цепь диаграммой прохождения сигнала через исправную систему. Контрольному сигналу заданной формы будет соответствовать определенная реакция, анализируя которую, можно выявить работоспособность проверяемого узла или электрической цепи.
- Метод промежуточных измерений. Метод предусматривает осциллографирование характерных процессов, измерение напряжений на контрольных точках, контроль сопротивления отдельных элементов и электрических цепей и другие контрольно-диагностические действия, позволяющие определить место неисправности в электрооборудовании или обнаружить неисправный элемент.
- Метод сравнения с неисправным объектом. Метод сравнения заключается в том, что сигналы неисправности узла или блока схемы сравнивают с сигналами другого исправного или неисправного узла или блока.

К нашей компании Авангард-Сети есть специалисты-электронщики, у которых имеется большой опыт за плечами в области поиска неисправностей и пуско-наладочных работах.
Причины и устранение неисправности в электропроводке
Качественная электропроводка в помещении – залог нормального функционирования электроприборов и осветительных приборов. Как правило, медные силовые кабели и провода имеют большой срок службы и сами по себе не замыкают и не обрываются.
Неисправности электросети обнаруживаются обычно в местах соединения проводов, которые изначально были смонтированы неправильно, а именно в распячных коробках, в электрощитах, в местах присоединения вводных проводов в выключателях, внутри розеток. Такие места, как правило, наиболее аварийно опасны и требуют особого внимания при их монтаже.
Примерно в 20 % случаев всех аварийных ситуаций неисправность возникает при замыкании или обрыве проводов внутри стены. Такая ситуация возможна при механическом воздействии на проводку (сверление, долбление и т.п.) или же зачастую при значительном превышении нагрузки на сеть.
Такая ситуация возможна при механическом воздействии на проводку (сверление, долбление и т.п.) или же зачастую при значительном превышении нагрузки на сеть.
Если в помещении установлено УЗО или автоматические выключатели, то они выступают ограничителями нагрузки сети и производят выключение при перегрузке электролинии.
Неисправности в электропроводке могут быть связаны и с естественным старением электрического кабеля. При использовании алюминиевого кабеля, к примеру, проводка выходит из строя при движениях или избытке влаги после потопа. Порча проводки возникает и при изначально неграмотном монтаже и применении некачественных материалов. В случае если недобросовестные электрики проложили бракованный, поддельный или же повреждённый провод, а соединения были выполнены не по правилам, скорее всего проводка очень быстро придёт в непригодное для использования состояние.
Поэтому очень важно купить силовой кабель должного качества и отследить весь процесс построения проводки в помещении.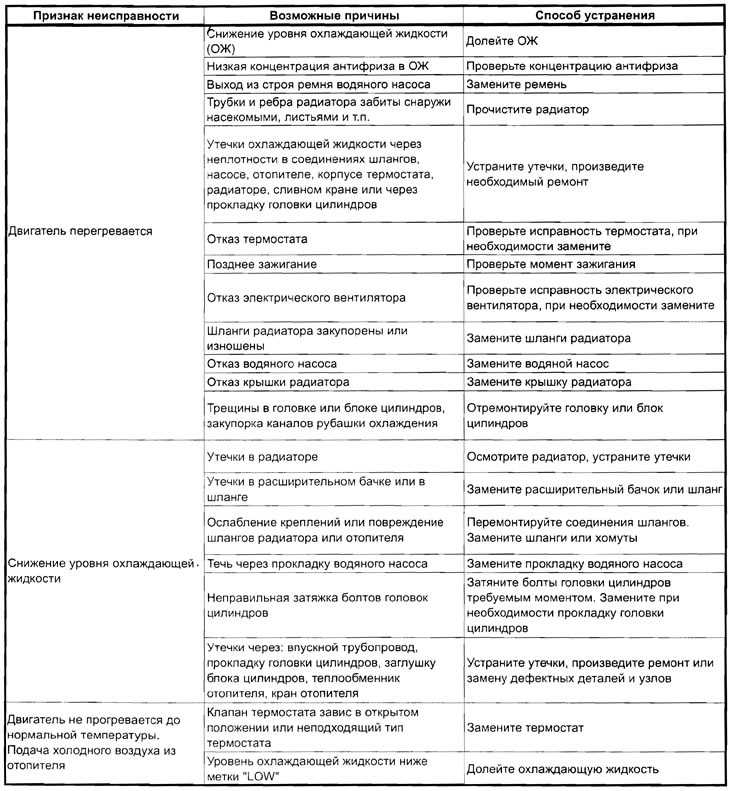
Причиной неисправности на линии может быть выход из строя электротехники. Если обнаружена неисправность именно в электроприборе, то необходимо незамедлительно отключить его от сети. Иначе может произойти удар током и последующее возгорание.
Для того чтобы в последствии не пришлось устранять неисправности проводки или тем более последствия возгорания и пожара в помещении, здании, квартире, необходимо производить работы по монтажу электропроводки грамотно, соблюдая все необходимые меры безопасности.
Наиболее действенный метод – установка в щитке специальных защитных устройств, таких как УЗО, которые позволяют вовремя и максимально точно обнаружить и предотвратить утечку тока, а также автоматический выключатель, выявляющий короткое замыкание и перенапряжение в сети.
Одной из мер предотвращения повреждений электропроводки является своевременное выполнение ревизии электропроводки с целью обнаружения неполадок и их устранения до того, как состояние повреждённого элемента становится критичным.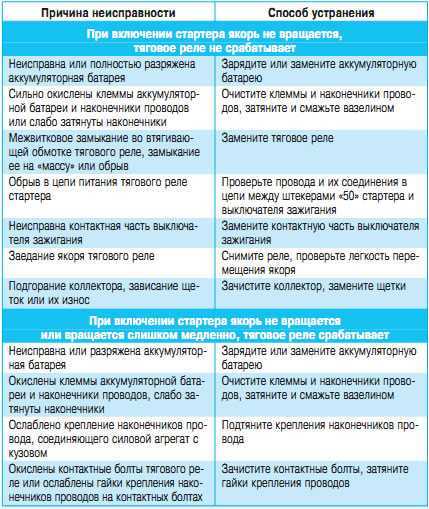
Главное, что убережёт проводку от повреждения и возгорания – это грамотная эксплуатация и соблюдение техники безопасности!
Если же всё-таки возникают какие-то неисправности, то их необходимо незамедлительно решать. Сначала делают визуальный осмотр с акцентом на места с характерными повреждениями по типу потемнений и нагара в выключателях, розетках и световых приборах. Далее обследуют элементы электрощитка. Индикатором фазы или измерительным тестером проверяют наличие напряжения в электрощите. Далее выполняют измерения приходящего и уходящего от автомата напряжения. При этом если обнаруживается неисправность, то следует сделать замену неисправного элемента при предварительно выключенном вводном устройстве.
Если в доме нет света, а в электрическом щитке неисправности не обнаружено, то необходимо проверить первую от щитка распределительную коробку и выяснить приходит ли на неё напряжение и в зависимости от результата искать оборванный провод.
В случае если освещения нет только в одном помещении, то необходимо проверить проводку именно там, а также обследовать выключатели и светильники в обесточенном месте.
Зачастую поломка обнаруживается в розетках. Действия по обнаружению и устранению неполадок в таком случае выполняются по тому же принципу, что и с освещением.
Для того чтобы проводка в вашей квартире или каком-либо другом помещении исправно функционировала и не давала сбоя, необходимо купить качественный силовой кабель и воспользоваться услугами квалифицированного электрика для монтажа всей электросистемы. При эксплуатации важно не перегружать сеть и следить за исправностью работы электроприборов. Элементарное соблюдение техники безопасности позволит не доводить дело до порчи кабельных линий и необходимости устранения неисправностей в электропроводке.
5 Распространенные неисправности электродвигателей
Электрические двигатели — это удивительные устройства, которые используются по-разному, упрощая нашу повседневную жизнь, а также широкий спектр промышленных приложений. Но когда эти устройства выходят из строя, работа, как правило, останавливается до тех пор, пока они не восстановятся и не заработают, а объяснения поломки электродвигателя могут варьироваться от обычных до совершенно странных.
Хотя список возможных причин можно продолжать бесконечно, мы подробнее рассмотрим некоторые из наиболее распространенных причин неисправности электродвигателей.
Распространенные причины отказов электродвигателей
Чтобы помочь вам разобраться и понять наиболее распространенные отказы электродвигателей, мы составили список повседневных причин, с которыми лучше всего обращаться, проконсультировавшись с квалифицированным специалистом.
- Высокие температуры и перегрев
Большинство отказов и износа двигателя могут быть связаны с воздействием сильной жары. Ваша первая забота должна заключаться в том, чтобы убедиться, что ваш двигатель работает при оптимальной температуре.
В большинстве случаев отказ электродвигателя приводит к чрезмерному выделению тепла. Изоляция обмоток двигателя прослужит вдвое меньше, если они будут подвергаться дополнительному нагреву на 10°C. Даже небольшое увеличение может со временем вызвать проблемы.
- Скопление пыли и мусора
Для защиты электродвигателей от пыли и загрязняющих веществ обычно используются кожухи. Однако, если корпуса не защищены от проникновения соответствующего уровня, крошечные частицы все равно могут попасть внутрь них.
Как и в случае с любой другой машиной, это воздействие может привести к повреждению деталей электродвигателя
- Внезапные скачки напряжения
Электродвигателям, как и всему другому электрическому оборудованию, для эффективной работы требуется определенное количество электроэнергии. Вполне вероятно, что устройство может выйти из строя, если количество накапливаемой им энергии превышает предел, установленный данным устройством или двигателем. Вот почему во многих отраслях промышленности установлены приводы с регулируемой скоростью, чтобы уменьшить воздействие любых непредвиденных скачков напряжения. Подумайте о том, чтобы обратиться к специалисту, если в вашем электродвигателе отсутствуют приводы с регулируемой скоростью.
Вот почему во многих отраслях промышленности установлены приводы с регулируемой скоростью, чтобы уменьшить воздействие любых непредвиденных скачков напряжения. Подумайте о том, чтобы обратиться к специалисту, если в вашем электродвигателе отсутствуют приводы с регулируемой скоростью.
- Износ и повреждение подшипника с течением времени
Подшипники необходимы для работы электродвигателя, но ими часто пренебрегают. Перегрев, плохая смазка и чрезмерное сопротивление — вот лишь некоторые из проблем, которые могут возникнуть, если один из этих крошечных подшипников сломается. Проблемы с подшипниками могут быть вызваны различными факторами, наиболее распространенными из которых являются дисбаланс двигателя, управление экстремальными нагрузками и неправильная установка.
Еще интересует: Профилактическое обслуживание
Подшипник электродвигателя может выйти из строя в 13% случаев. Вы можете обнаружить преждевременный износ подшипников или признаки неисправности, наблюдая за вибрацией двигателя. Это хороший метод, чтобы выяснить, повреждены ли подшипники вашего электродвигателя, прежде чем это станет серьезной проблемой.
Вы можете обнаружить преждевременный износ подшипников или признаки неисправности, наблюдая за вибрацией двигателя. Это хороший метод, чтобы выяснить, повреждены ли подшипники вашего электродвигателя, прежде чем это станет серьезной проблемой.
- Влажность и влажность
Электрическое оборудование и влага несовместимы. В результате практически невозможно сохранить рабочее место сухим и свободным от влаги и влажности. Изоляция вашего электродвигателя может быть повреждена водой (и более сильным воздействием воды), что, в свою очередь, влияет на общий срок службы двигателя и даже подвергает опасности вашу жизнь.
По этой причине важно выбрать место, где ваш мотор можно будет безопасно и надежно хранить. Кроме того, постарайтесь установить устройства контроля и мониторинга влажности.
Существует несколько переменных и возможных причин, которые могут привести к поломке внутри электродвигателя и ухудшить его работу в долгосрочной перспективе. Ключом к тому, чтобы ваше оборудование продолжало работать с максимальной производительностью как можно дольше, является обеспечение долгосрочного профилактического обслуживания, а также профилактического обслуживания.
Ключом к тому, чтобы ваше оборудование продолжало работать с максимальной производительностью как можно дольше, является обеспечение долгосрочного профилактического обслуживания, а также профилактического обслуживания.
Если у вас возникла серьезная проблема с двигателем, немедленно обратитесь к специалисту или свяжитесь с нами, если у вас есть какие-либо вопросы.
Производители медицинского оборудования сообщают о неисправностях и травмах пациентов в базе данных FDA, скрытой от общественности. использование хирургических степлеров 7 октября 2021 г., а также переклассифицировали устройства для усиления контроля. Вскоре после того, как эта история вышла в свет, FDA начало проверку безопасности хирургических степлеров. Кроме того, в июне 2019 г., Управление по санитарному надзору за качеством пищевых продуктов и медикаментов выпустило 5,7 миллиона ранее скрытых отчетов о неисправностях и травмах.
Доктор Дуглас Квазнески помогал питтсбургскому хирургу удалить аппендикс, когда случилось что-то неприятное. Хирургический степлер, предназначенный для разрезания и герметизации ткани вокруг аппендикса, заперт.
Хирургический степлер, предназначенный для разрезания и герметизации ткани вокруг аппендикса, заперт.
Квазнески позже обратился к общедоступной базе данных Управления по санитарному надзору за качеством пищевых продуктов и медикаментов, которая отслеживает отказы медицинских устройств, и «ничего не было», сказал он. Тем не менее, когда он опрашивал ведущих хирургов по этому вопросу, он обнаружил, что более двух третей сталкивались с неисправностью степлера или знали коллег, у которых это произошло. Такие сбои могут иметь смертельные последствия.
Квазнески понятия не имел, что Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) незаметно предоставило производителям хирургических сшивающих аппаратов специальное «исключение», позволяющее им хранить отчеты о неисправностях в базе данных, скрытой от врачей и от всеобщего обозрения.
«Я не хочу показаться слишком драматичным, но это было похоже на прикрытие», — сказал Квазнески, который практиковал в округе Паско, штат Флорида, с 2016 по начало этого года.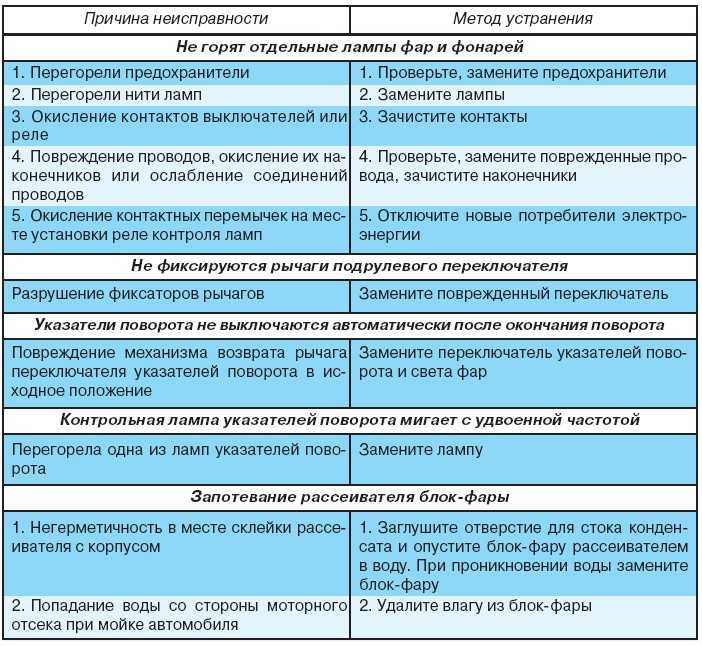
После того, как доктор Дуглас Квазнески стал свидетелем неисправности хирургического степлера, он опросил ведущих хирургов и обнаружил, что более двух третей сталкивались с неисправностью степлера или знали коллег, которые сталкивались с этим. (Кендра Стэнли-Миллс для KHN)
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) создало и расширило обширное и скрытое хранилище отчетов о травмах и неисправностях, связанных с устройствами, как показывает расследование Kaiser Health News. С 2016 года по меньшей мере 1,1 миллиона инцидентов попали во внутренний репозиторий «альтернативных сводных отчетов», вместо того, чтобы описываться по отдельности в широко изучаемой общедоступной базе данных, известной как MAUDE, которой медицинские эксперты доверяют для выявления проблем, которые могут подвергнуть пациентов опасности.
О смертях необходимо сообщать в MAUDE. Но скрытая база данных включает отчеты о серьезных травмах и неисправностях примерно 100 медицинских устройств, по данным FDA, многие из которых были имплантированы пациентам или использовались в бесчисленных операциях. Они включали хирургические степлеры, баллонные насосы, вставленные в сосуды для улучшения кровообращения, и механические дыхательные аппараты.
Они включали хирургические степлеры, баллонные насосы, вставленные в сосуды для улучшения кровообращения, и механические дыхательные аппараты.
Представитель FDA сообщил, что программа предназначена для решения проблем, которые «хорошо известны и хорошо задокументированы FDA», и что она была реформирована в 2017 году, когда была введена новая добровольная программа сводной отчетности для 5600 устройств.
Тем не менее, программа во всех ее итерациях была настолько малоизвестной, что неизвестна многим врачам и инженерам, занимающимся повышением безопасности устройств. Даже бывший комиссар FDA сказал, что ничего не знает об этой программе.
KHN изучил огромное количество публичных записей в поисках косвенных ссылок на отчетные исключения.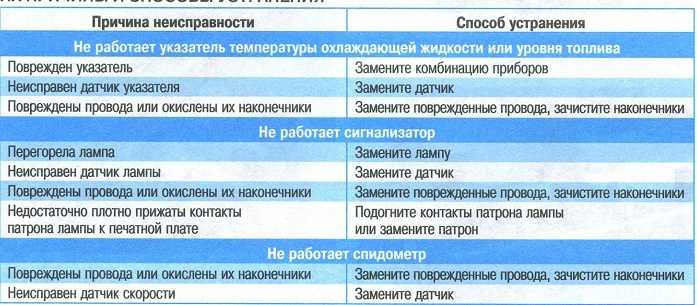 После нескольких месяцев вопросов в FDA агентство подтвердило существование программ освобождения от отчетности и тысяч ранее не подтвержденных случаев сбоев в работе или причинения вреда.
После нескольких месяцев вопросов в FDA агентство подтвердило существование программ освобождения от отчетности и тысяч ранее не подтвержденных случаев сбоев в работе или причинения вреда.
На фоне отсутствия информации о рисках, связанных с устройством, пациенты получали травмы, в некоторых случаях сотни раз, как показывают судебные процессы и записи FDA.
«Общественность имеет право знать об этом», — сказала доктор С. Лори Браун, бывший сотрудник FDA, получившая доступ к данным для своего исследования. Она сказала, что врачи, полагаясь только на публичные отчеты и не зная, что многие инциденты могут быть опущены, могут легко прийти к неправильному выводу о показателях безопасности конкретного устройства.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) также открыло дополнительные — и столь же неясные — пути для производителей устройств, чтобы сообщать о тысячах травм, выявленных в результате судебных процессов, или даже о смертях, которые появляются в частных реестрах, которые медицинские общества используют для отслеживания пациентов.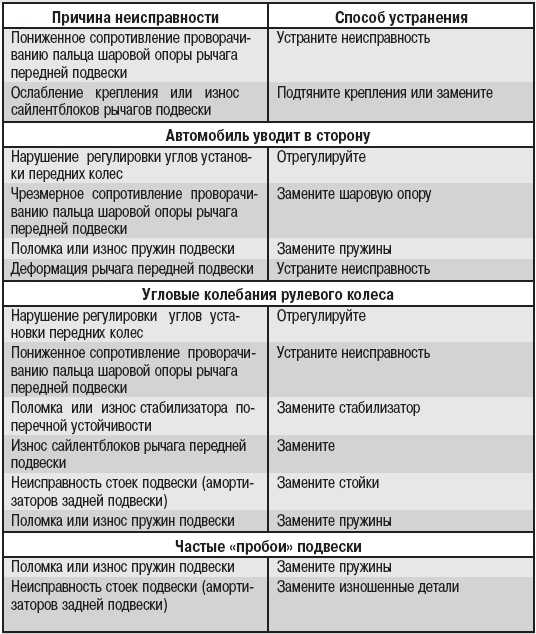 Эти исключения применяются к рискованным и спорным продуктам, включая тазовую сетку и устройства, имплантированные в сердце.
Эти исключения применяются к рискованным и спорным продуктам, включая тазовую сетку и устройства, имплантированные в сердце.
Представитель FDA Дебора Котц подтвердила, что «исключение из реестра» было создано без какого-либо публичного уведомления или правил. «Любой производитель устройств может запросить освобождение от своих требований к отчетности», — сказала она в электронном письме.
Не хочу показаться слишком драматичным, но это похоже на прикрытие.
Доктор Дуглас Квазнески, хирург
Документы агентства, предоставленные KHN, показывают, что только в 2017 году через альтернативную программу сводных отчетов было зарегистрировано более 480 000 травм или неисправностей.
Элисон Хант, другой представитель FDA, заявила, что большинство «исключений» производителей устройств были отменены в том году, когда сформировалась программа, требующая публичного представления сводного отчета.
Более миллиона сообщений о неисправностях или повреждениях за последние 15 лет остаются в базе данных, доступной только FDA. Но с новым толчком агентства к прозрачности общественность может найти публичный отчет и подать запрос в соответствии с Законом о свободе информации, чтобы получить информацию об инцидентах. Ответ может занять до двух лет.
Но с новым толчком агентства к прозрачности общественность может найти публичный отчет и подать запрос в соответствии с Законом о свободе информации, чтобы получить информацию об инцидентах. Ответ может занять до двух лет.
Давняя программа освобождения «позволила FDA более эффективно анализировать нежелательные явления… и принимать меры, когда это оправдано, не жертвуя качеством нашего обзора или информации, которую мы получаем», — сказал Хант в электронном письме.
Мадрис Томес (любезно предоставлено Мадрис Томес)
Тем не менее, тех, кто не связан с агентством, беспокоят исключения из правил отчетности. Они наносят удар по Мадрису Томесу, бывшему менеджеру FDA, поскольку агентство отказывается от некоторых из самых сильных полномочий по надзору и обеспечению прозрачности, которыми оно обладает.
«Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) фактически отказывается от своей власти над производителями устройств, — сказал Томес, который в настоящее время управляет веб-сайтом Device Events, который упрощает использование данных устройств FDA.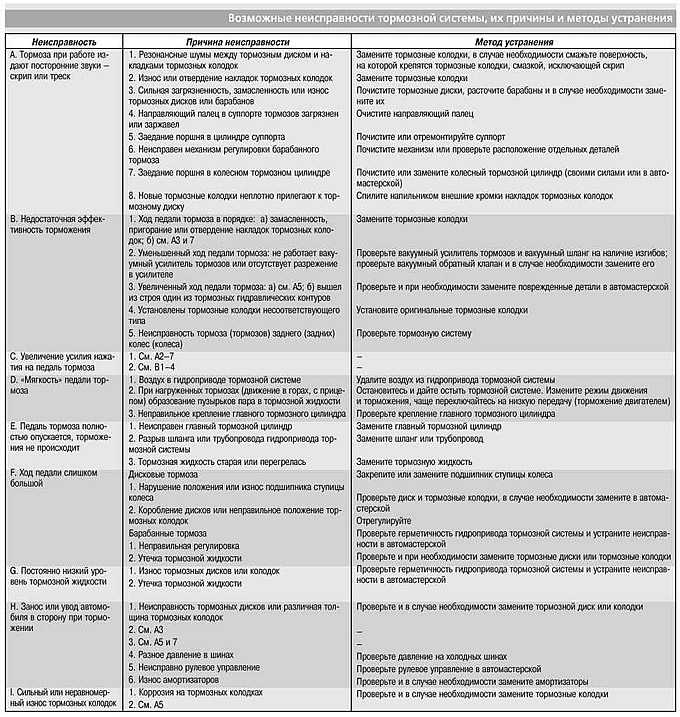 «Если они отказались от этого, они передали свою способность контролировать безопасность и эффективность этих устройств».
«Если они отказались от этого, они передали свою способность контролировать безопасность и эффективность этих устройств».
Врачи, такие как Квазнески, которые обратились к общедоступным данным, чтобы оценить риски хирургических степлеров, мало что видели. Он написал о «непризнанной» проблеме сбоев в работе степлера в статье 2013 года в журнале Surgical Endoscopy. По данным FDA, в 2016 году, хотя отчеты о 84 повреждениях или неисправностях степлера были отправлены открыто, около 10 000 отчетов о неисправностях были включены в скрытую базу данных.
Производитель устройств Medtronic, которому принадлежит производитель степлеров Covidien, считается лидером рынка хирургических степлеров. Представитель компании сказал, что до июля 2017 года фирма использовала освобождение от отчетности для подачи отчетов, связанных со степлером. Ethicon, другой крупный производитель степлеров, заявил, что это не так.
Общедоступная база данных показывает, что Medtronic сообщила о более чем 250 смертельных случаях, связанных со степлером или скобами с 2001 года.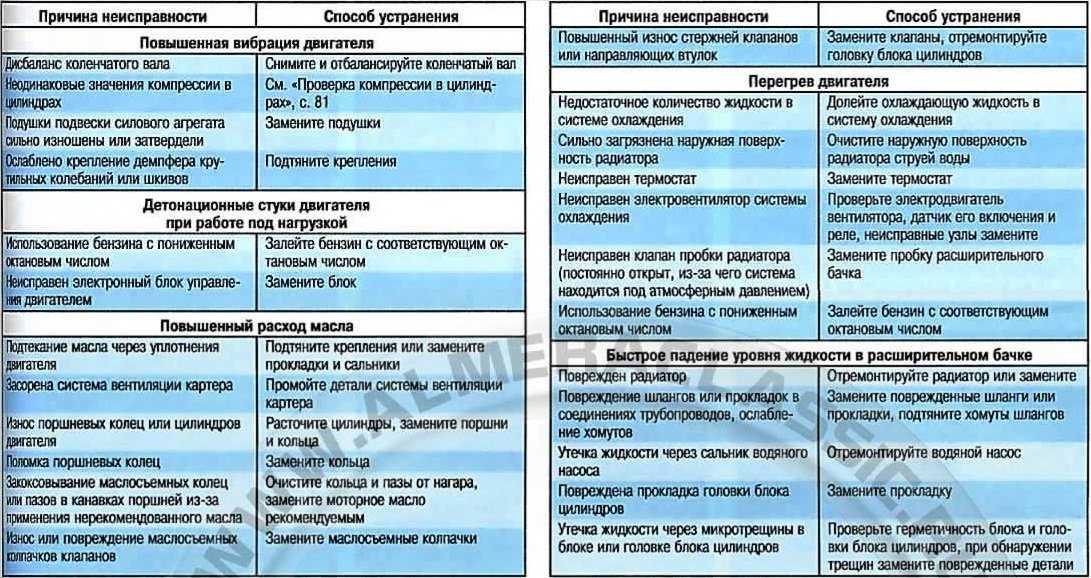
Марк Леверинг, 62 года, чуть не погиб из-за неисправности степлера в начале прошлого года, согласно иску, поданному его семьей. Его хирург показал, что хирургический степлер дал осечку во время операции на печени в больнице ProMedica Toledo Hospital в Огайо.
Персонал в течение 22 минут проводил сердечно-легочную реанимацию, в то время как хирурги торопились наложить швы на разорванную вену. Он вышел из комы, не в состоянии ходить и постоянно узнавать жену и сына. Хирург, больница и производитель устройств Covidien отвергли обвинения в правонарушениях в рамках продолжающегося судебного дела.
Когда его жена, Дорис Леверинг, узнала об «исключении» для хирургических степлеров, она не поверила.
«Почему бы эту информацию не сделать доступной для врачей? Правдивая информация — я имею в виду реальные цифры…», — сказала она. «На карту поставлены жизни людей. Жизнь Марка никогда не будет прежней».
Дорис Леверинг говорит, что ее муж Марк перенес операцию по удалению абсцесса из печени и в итоге несколько недель находился в коме. (Хайди де Марко/KHN)
(Хайди де Марко/KHN)
Фил Леверинг (слева) говорит, что его отец, Марк Леверинг, раньше вел себя спокойно, но теперь проявляет признаки агрессии из-за черепно-мозговой травмы, которую он получил после неудачной операции. (Хайди де Марко/KHN)
Дорис Леверинг держит фотографию ее и ее мужа до операции. Леверинг говорит, что очевидно, что человек, который раньше ухаживал за бездомными кошками и наслаждался ужином со своей семьей, ушел. «На карту поставлены жизни людей. Жизнь Марка уже никогда не будет прежней», — говорит она. (Хайди де Марко/KHN)
Проблема со степлером
По словам Ларри Кесслера, бывшего сотрудника Управления по санитарному надзору за качеством пищевых продуктов и медикаментов, а ныне сотрудника Вашингтонского университета, из-за огромного количества неисправностей хирургические степлеры стали легкой добычей для новой альтернативной программы составления сводных отчетов с момента ее создания почти 20 лет назад. профессор службы здравоохранения.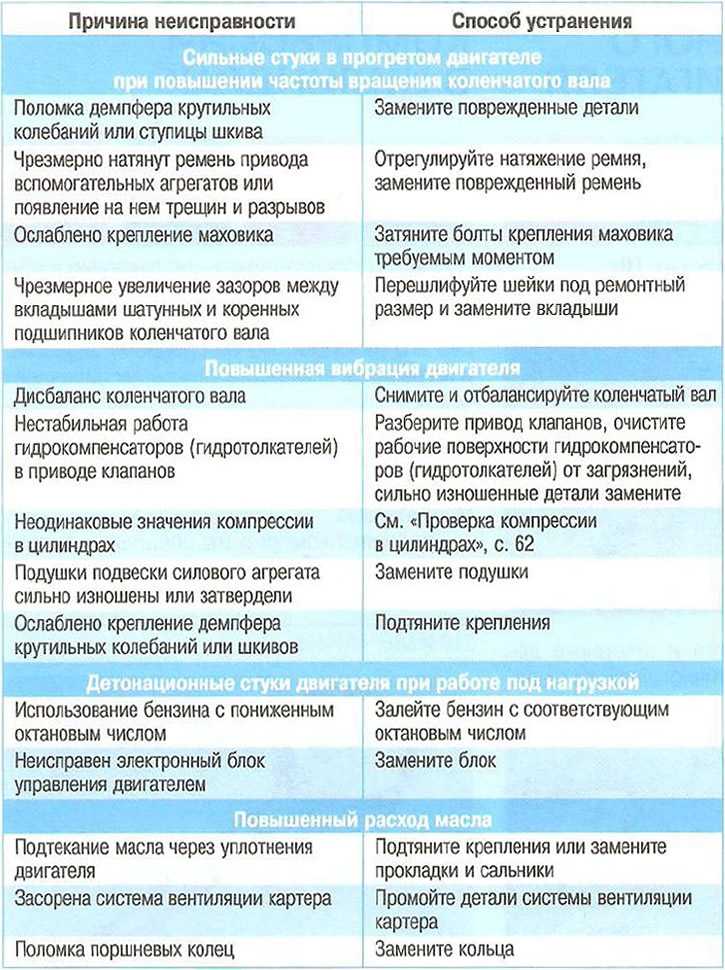
Хирургические степлеры обладают уникальной способностью помогать — или вредить — пациентам. Устройство предназначено для быстрого рассечения и герметизации тканей или сосудов, часто во время малоинвазивных операций. Когда не удается закрыть крупный кровеносный сосуд, медицинский персонал может быстро переключиться в режим «синий код», чтобы спасти пациента от кровотечения до смерти.
Серьезность некоторых травм привлекла внимание бывшего сотрудника FDA Брауна в первые годы после освобождения от отчетности. Ее статья 2004 года о неудачах со степлером, опубликованная в Журнале Американского колледжа хирургов, является одним из немногих мест в публичных записях, где орган FDA упоминает программу «альтернативного резюме». Она обнаружила, что за первые 28 месяцев регистрации в скрытой базе данных производители степлеров подали более 5100 отчетов о неисправностях или травмах.
Марк Леверинг, которому сейчас 62 года, находился в медикаментозной коме и перенес несколько операций после того, как хирургический степлер вышел из строя во время операции на печени 17 февраля 2018 года. Его жена, Дорис Леверинг, заявила в показаниях, что он не открывал глаза после первоначальной операции до 13 марта. (Любезно предоставлено Дорис Леверинг)
Его жена, Дорис Леверинг, заявила в показаниях, что он не открывал глаза после первоначальной операции до 13 марта. (Любезно предоставлено Дорис Леверинг)
Она также отметила, что публично зарегистрированные 112 смертей, связанных со степлером, среди пациентов в возрасте от 22 до 91 года с 1994 по 2001 год были «поводом для беспокойства».
Судя по общедоступным данным, опубликованным с тех пор, степлеры редко дают осечку. В 2011 году было опубликовано только 18 сообщений о травмах или неисправностях. В прошлом году их было 79..
Судебные процессы подробно описывают, как быстро отказ степлера может превратить гладкую операцию в катастрофу.
В Мичигане хирург Юджина Снука удалял часть его легкого, когда он разрезал, но не смог закрыть крупный сосуд из-за «неисправности степлера», заявил хирург в суде под присягой. У Снука, которому тогда было 59 лет, во время операции в 2012 году артериальное давление отсутствовало в течение четырех минут.
Повреждение артерии Снука было настолько велико, что его хирург решил полностью удалить легкое, говорится в медицинской документации, поданной в суд. Снук подал в суд на производителя степлера Covidien, который в судебных протоколах заявил, что нет доказательств того, что степлер был небезопасен, когда он вышел из-под контроля Covidien, а также что хирург использовал его ненадлежащим образом. Дело достигло конфиденциального урегулирования в 2017 году9.0003
Снук подал в суд на производителя степлера Covidien, который в судебных протоколах заявил, что нет доказательств того, что степлер был небезопасен, когда он вышел из-под контроля Covidien, а также что хирург использовал его ненадлежащим образом. Дело достигло конфиденциального урегулирования в 2017 году9.0003
Другой хирург, пытавшийся удалить доброкачественную опухоль печени у 33-летней Эйприл Стрэндж в 2013 году, показал, что неисправность степлера привела к смерти женщины от кровотечения. Стрэндж из центрального Иллинойса, оставил мужа и двух дочерей, затем 6 и 8 лет.
Степлер был выброшен после операции, говорится в судебных протоколах. Covidien утверждал в судебных протоколах, что Райан Стрэндж не смог доказать, что у степлера был определенный дефект.
Компания Covidien достигла соглашения об урегулировании требований семьи на сумму 250 000 долларов США, что является частью более крупного соглашения по делу.
Сначала врачи думали, что у Марка Леверинг рак печени. Поэтому, когда в феврале прошлого года ему снова поставили диагноз «абсцесс, который нужно было удалить хирургическим путем», его жена Дорис почувствовала облегчение.
Поэтому, когда в феврале прошлого года ему снова поставили диагноз «абсцесс, который нужно было удалить хирургическим путем», его жена Дорис почувствовала облегчение.
Это облегчение превратилось в ужас дня операции. По ее словам, процедура должна была длиться два часа. Но операция натолкнулась на препятствие, когда степлер дал осечку, по словам хирурга, вызвав такое сильное кровотечение, что минимально инвазивная процедура была преобразована в открытую, чтобы врач мог наложить швы на вену.
Леверинг подвергался сердечно-легочной реанимации в течение 22 минут. Был вызван синий код, свидетельствовала медсестра. Леверинг потерял 3 литра крови — примерно половину крови в его организме. Его подключили к аппарату жизнеобеспечения, и он оставался в коме несколько недель.
После того, как Леверинг снова открыл глаза, стало ясно, что человек, который раньше ухаживал за бездомными кошками и наслаждался ужином с семьей, ушел. Леверинг больше не мог ходить, расчесывать волосы и узнавать буквы алфавита.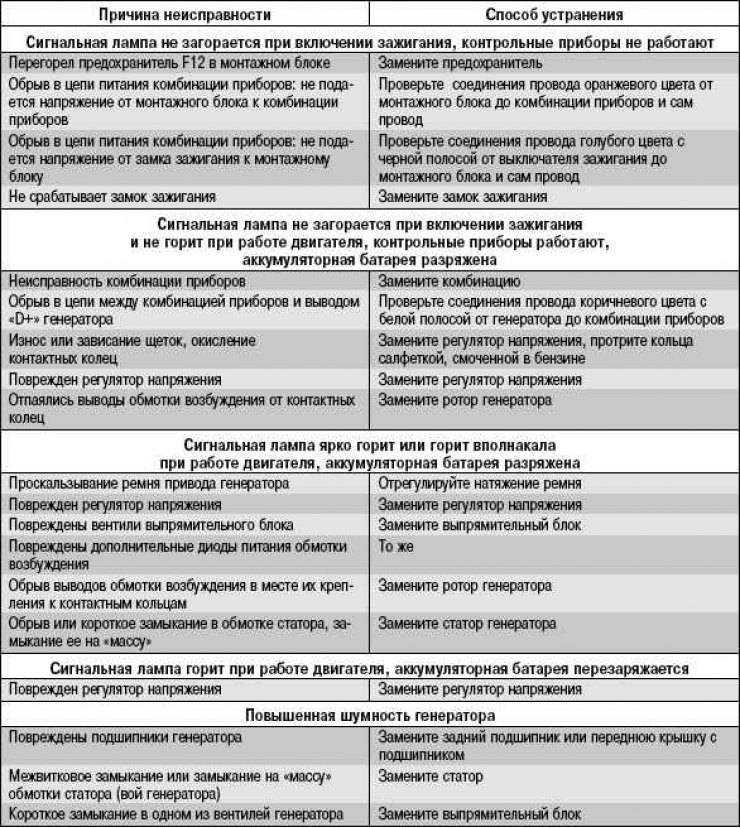
Дорис и Марк Леверинг подали в суд на врача, больницу и производителя хирургических степлеров, утверждая, что устройство вызвало кровотечение у Марка и травму головного мозга. Хирург признал в показаниях под присягой, что степлер неисправен, но отрицал другие правонарушения. Больница заявила в юридическом документе, что ее действия были «благоразумными, надлежащими» и «законными».
Covidien отрицает какой-либо дефект степлера или то, что он нанес Леверингу травмы. Представитель материнской компании Medtronic отказался комментировать какие-либо иски, но сказал, что «мы всегда делаем безопасность пациентов нашим главным приоритетом» и что компания соблюдает требования FDA.
Количество сообщений компании о проблемах со степлером в общедоступной базе данных остается относительно низким. Но в 2018 году, когда освобождение от отчетности было отменено, появился всплеск отчетов о продуктах Covidien 9.0202 — не путать со степлером. В то время как в 2015 году компания Medtronic сообщила о 1000 сбоях или травмах основных продуктов, в 2018 году их число выросло до 11 000.
Развертывание программы документы, по словам чиновников, которые были в FDA в то время.
Кесслер, бывший чиновник FDA, сказал, что программа была сформирована после того, как скандалы из-за занижения сообщений о проблемах с устройствами привели к изменениям, предусматривающим уголовную ответственность против производителей устройств.
Вскоре в агентство ежемесячно поступали тысячи отчетов о травмах и неисправностях, и около 15 сотрудников занимались их рассмотрением, сказал Кесслер. Многие отчеты были настолько похожи, что рассматривать их по отдельности было «отупением». Кесслер обратился в юридический отдел FDA и к производителям устройств, чтобы предложить решение.
Производители устройств смогут получить специальное «исключение», чтобы не сообщать об определенных сложностях в общедоступной базе данных. Вместо этого производители будут отправлять в FDA таблицу травм или неисправностей каждый квартал, полгода или год.
Таким образом, сказал Кесслер, рецензенты могут быстро найти новые проблемы или всплески известных проблем. По словам Кесслера, когда программа была запущена в 2000 году, список исключенных устройств был обнародован, и в нем участвовало лишь несколько устройств.
«Я не знаю, почему это не [опубликовано] сейчас», — сказал он. «Я удивлен этим».
Начиная с сентября, KHN подала запросы в соответствии с Законом о свободе информации на соглашения об «исключении» и отчеты для нескольких медицинских устройств.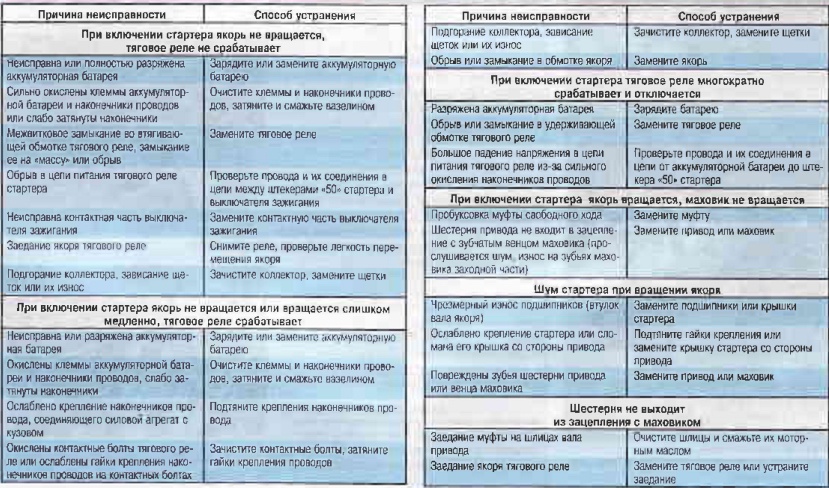 Должностные лица здравоохранения и социальных служб отклонили призыв быстро предоставить некоторые записи, заключив, что в спешке нет «острой необходимости». Предполагалось, что по одному запросу записи поступят через 22 месяца.
Должностные лица здравоохранения и социальных служб отклонили призыв быстро предоставить некоторые записи, заключив, что в спешке нет «острой необходимости». Предполагалось, что по одному запросу записи поступят через 22 месяца.
FDA предоставило некоторые данные верхнего уровня. Это показывает, что с 2014 по 2017 год общее количество альтернативных сводных отчетов, поданных производителями устройств, выросло с 431 000 до 481 000.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США отказалось предоставить полный список «примерно 100» устройств, на которые за прошедшие годы было предоставлено освобождение от отчетности, но подтвердило, что исключения использовались для механических дыхательных аппаратов и баллонных насосов, известных как внутриаортальные баллонные насосы. , вставленный в сосуды людям с проблемами кровообращения.
Представитель FDA заявила, что «альтернативные исключения» остаются в силе для электродов кардиостимуляторов и имплантируемых дефибрилляторов.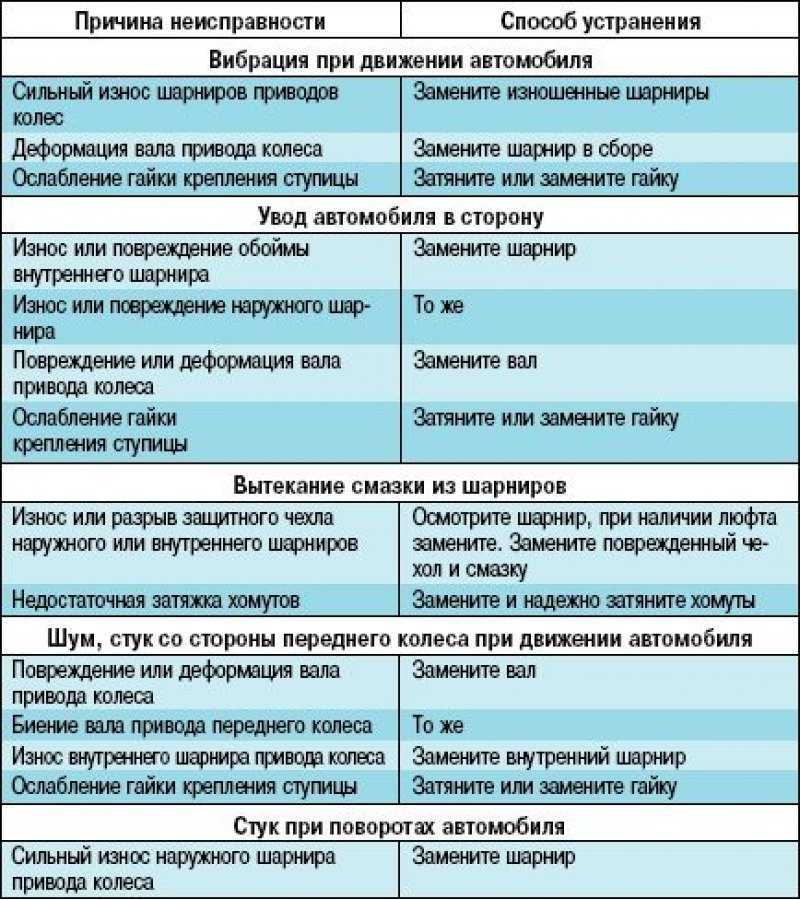
Мэтью Баретич, инженер-биомедик из Денвера, сказал, что помогает системам здравоохранения нескольких районов анализировать травмы пациентов, связанные с использованием устройств, и принимать решения о покупке оборудования.
Он сказал, что регулярно просматривает общедоступные отчеты FDA о повреждениях устройств. На вопрос об «альтернативных сводных отчетах» он сказал: «Должен вам сказать, это новый для меня термин».
Брюс Баркалоу, президент мичиганской биомедицинской инженерной фирмы, сказал, что ему звонят правительственные чиновники, адвокаты или производители устройств, если кто-то через три дня после установки кардиостимулятора умирает в душе.
В интервью он сказал, что тоже ничего не знает об этих сообщениях. Он сказал, что они могут показаться FDA «пустым бургером», но данные будут иметь значение для его судебно-медицинских исследований.
Институт ECRI, некоммерческий лидер в области безопасности медицинских устройств, отказался предоставить инженера для интервью.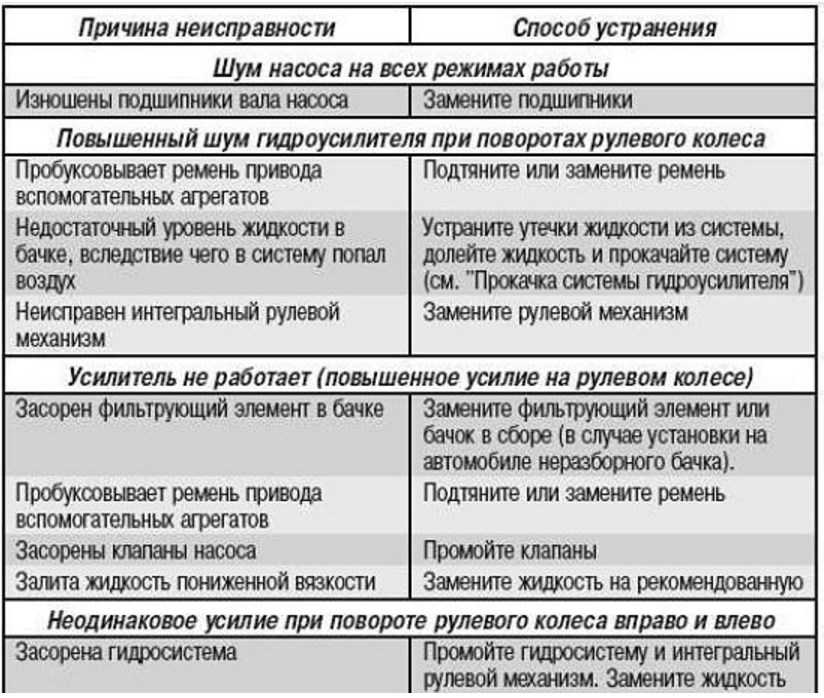 Обучая руководителей больниц и поставщиков медицинских услуг, институт ежегодно выпускает «10 лучших» опасностей, связанных с медицинскими технологиями. Его слоган: «Отделение фактов от вымысла в здравоохранении».
Обучая руководителей больниц и поставщиков медицинских услуг, институт ежегодно выпускает «10 лучших» опасностей, связанных с медицинскими технологиями. Его слоган: «Отделение фактов от вымысла в здравоохранении».
Среди «ведущих экспертов в области медицинских устройств», пресс-секретарь Лори Меньо сообщила в электронном письме, «никто из них не был знаком с программой альтернативной сводной отчетности FDA».
Даже доктор Роберт Калифф, бывший заместитель комиссара FDA и комиссар с 2015 по 2017 год, сказал в интервью, что не знал о программе. «Никогда ничего об этом не слышал», — сказал он. «Это интересно.»
Компании, которые получают исключения, как правило, очень «молчат» о них, говорит Кристин Посин, бывший менеджер фирмы по производству устройств и консультант компаний по производству устройств.
Относительная секретность вокруг программы может дать им преимущество, сказала она. Например, торговые представители могут распечатывать только общедоступные отчеты о проблемах с устройствами, игнорируя то, что скрыто где-то еще.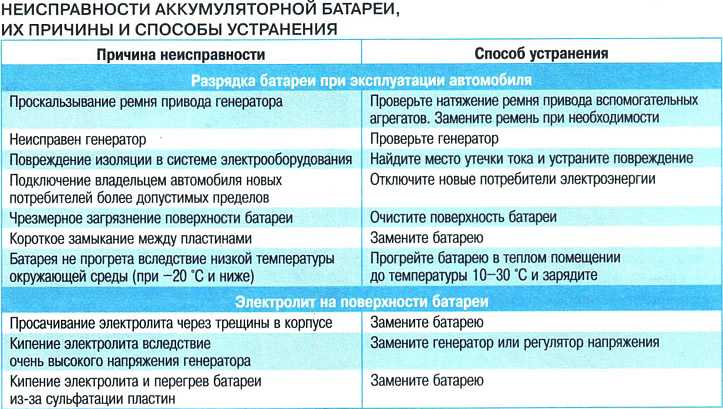
Это создает деловую возможность убедить врача попробовать другое устройство. «У нас есть хороший продукт, который делает то же самое», — сказал Посин, торговый представитель может сказать врачу.
Умножение исключений
В последние годы FDA потратило миллионы, созвало экспертов и обязалось улучшить свою работу в области безопасности устройств. В то же время он незаметно открыл новые возможности для производителей неоднозначных и рискованных устройств, чтобы подавать отчеты о травмах и даже смертях с небольшим общественным мнением.
Тазовая сетка является одним из примеров. Устройство, похожее на ткань, уже давно используется для удержания органов малого таза у женщин, страдающих пролапсом органов. В 2011 году FDA выпустило «сообщение о безопасности», в котором говорилось, что «серьезные осложнения», такие как боль или инфекция, «нередки».
Агентство вскоре реклассифицировало устройство, заказало исследования безопасности и увидело, что большинство производителей сетки удалили устройство с рынка.
Тем не менее, за закрытыми дверями агентство с тех пор предоставило производителям тазовых сеток особое освобождение от сообщения общественности о травмах, согласно FDA и производителям сеток, которых спросили о практике.
В соответствии с тем, что FDA называет «исключением для сводной отчетности по судебным жалобам», производители устройств могут подать один отчет о «травме». В приложении к сводному отчету производители устройств отправили в FDA электронную таблицу с 1175 сообщениями о травмах пациентов, основанными на обвинениях в судебных процессах.
Для того, кто подсчитывает общее количество травм, связанных с тазовой сеткой, отчет будет выглядеть как одна травма. Потребуется острый глаз, чтобы найти краткий отчет и специальный запрос — на заполнение которого может уйти до двух лет — для получения подробной информации о 1175 случаях, представленных непосредственно в FDA.
По данным FDA, только в 2017 году восемь производителей сеток использовали свои исключения, чтобы отправить в FDA почти 12 000 отчетов о травмах.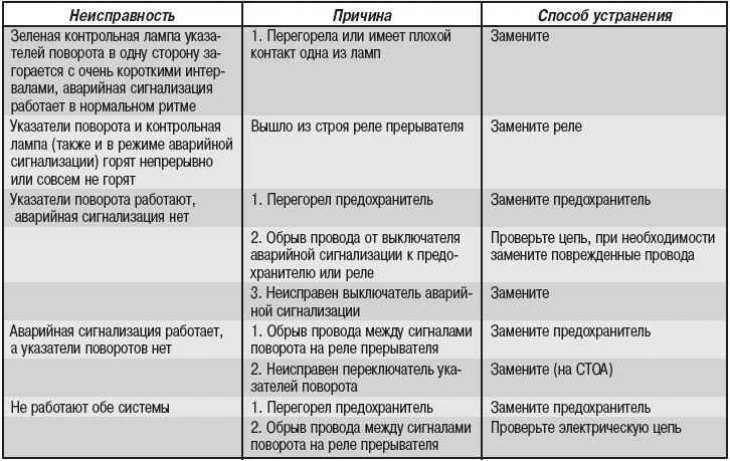
FDA фактически отказывается от своей власти над производителями устройств. Если они отказались от этого, они передали свою способность контролировать безопасность и эффективность этих устройств.
Мадрис Томес, бывший менеджер FDA
Доктор М. Том Марголис, урогинеколог из района залива Сан-Франциско и медицинский свидетель-эксперт тех, кто подает в суд на производителей сеток, заявил о программе, которая может помешать врачам полагаться на открытые данные FDA для оценки риски сетки «ужасны» и «неэтичны».
«Нам нужно знать, что хорошо, а что плохо», — сказал Марголис, лечащий пациентов в своей урогинекологической практике. — Если ты пытаешься скрыть от меня осложнения, то это… неправильно, Боже мой, это отвратительно.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) предоставило такое же исключение производителям хирургических роботов «да Винчи» через несколько месяцев после того, как исследователи из Медицинской школы Университета Джона Хопкинса указали, что компания размещала очень мало отчетов о травмах в общедоступной базе данных.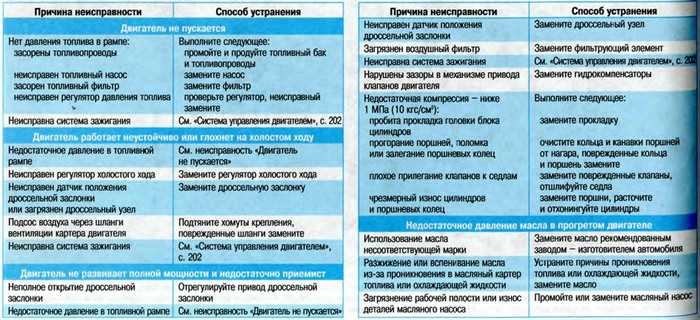 Профессор Университета Джона Хопкинса доктор Марти Макари отметил в 2013 году, что несколько отчетов, отправленных в то время в FDA, были признаками «случайной» системы, которая «не является независимой и непрозрачной».
Профессор Университета Джона Хопкинса доктор Марти Макари отметил в 2013 году, что несколько отчетов, отправленных в то время в FDA, были признаками «случайной» системы, которая «не является независимой и непрозрачной».
В течение нескольких месяцев FDA разрешило производителям роботов подать единый отчет, отметив, что электронная таблица, отправленная прямо в FDA, суммирует около 1400 травм, заявленных в судебных процессах, причем некоторые травмы относятся к 2004 году. С тех пор производитель устройств сообщали о меньших партиях из 99 и 130 травм за раз.
Хома Алемзаде (любезно предоставлено Хома Алемзаде)
«Это очень расстраивает», — сказал Хома Алемзаде, доцент компьютерной инженерии в Университете Вирджинии, который работает с данными MAUDE для создания программного обеспечения для выявления ошибок в режиме реального времени или до того, как они произойдут в операциях, выполняемых роботами. Она сказала, что не знала об освобождении от отчетности.
В соответствии с другим исключением для отчетности FDA позволяет производителям устройств сообщать о сотнях случаев смерти в электронных таблицах, отправляемых непосредственно в агентство.
В соответствии с «исключением из реестра» производители устройств могут обобщать то, что они узнают из реестров, которые, как правило, ведутся специализированными медицинскими обществами, и отслеживать использование определенного типа устройств, по словам представителя FDA Коц.
Котц сказал, что данные в реестрах часто не соответствуют уровню детализации, который FDA ищет для более подробных отчетов о смерти, которые должны подавать производители устройств.
Среди производителей устройств, подающих такие отчеты, есть компания Edwards Lifesciences, которая производит клапан Sapien 3, который проходит через сосуд и имплантируется в сердце. Некоторые приветствуют это устройство как прорыв в спасении пациентов от травм, связанных с операцией на открытом сердце по замене клапана. Другие выражают обеспокоенность по поводу ограниченных данных, показывающих, как долго клапан прослужит в организме.
Сводные отчеты предлагают потенциальным пациентам несколько ответов. Такие отчеты документируют до 297 смертей или 1800 ранений в одном файле, и практически нет подробностей, доступных для общественности. В целом, с 2016 года Эдвардс зарегистрировал более 1800 смертей пациентов с клапаном Sapien 3 в виде сводок.0003
Такие отчеты документируют до 297 смертей или 1800 ранений в одном файле, и практически нет подробностей, доступных для общественности. В целом, с 2016 года Эдвардс зарегистрировал более 1800 смертей пациентов с клапаном Sapien 3 в виде сводок.0003
Пресс-секретарь Edwards Сара Хуо сообщила в электронном письме, что FDA обязало отслеживать каждого пациента, у которого есть клапан в реестре, чтобы предоставить «всесторонние доказательства безопасности устройства».
«Утверждение альтернативной отчетности защищает от дублирования отчетов, поступающих из нескольких источников», — сказал Хуо.
Другое устройство, MitraClip, используется для прикрепления двух лоскутов к сердцу, позволяющих крови течь в обратном направлении. Устройство вызвало споры: некоторые ученые говорят, что оно имеет решающее значение для определенной группы пациентов, а другие указывают на вред, который оно может нанести сердцу.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) разрешило компании Abbott Vascular, производящей MitraClip, сообщать о 347 смертельных случаях или 1000 травмах в одном файле, а также отправлять данные непосредственно в агентство, как показывают записи FDA.
Представитель Abbott сообщил в электронном письме, что компания провела клинические испытания с тысячами пациентов, чтобы установить безопасность MitraClip. Он сказал, что освобождение было предоставлено, потому что данные в реестре были лишены идентификаторов пациентов, что затрудняло определение того, будет ли компания подавать избыточные отчеты в FDA.
Нам нужно знать, что хорошо, а что плохо. Если ты пытаешься скрыть от меня осложнения, то это… неправильно, Боже мой, это отвратительно.
Доктор М. Том Марголис, урогинеколог и эксперт-медицинский свидетель
В прошлом году FDA завершило разработку правил еще одной программы сводных отчетов. В соответствии с новейшей системой производителям устройств не нужно искать исключения или уведомлять FDA о том, что они будут подавать публичный сводный отчет в MAUDE.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов признало производителей более 5600 типов устройств правомочными подавать «добровольные сводные отчеты о неисправностях». Среди них некоторые из самых рискованных устройств, за которыми наблюдает агентство, в том числе сердечные стенты, безвыводные кардиостимуляторы и механические сердечные клапаны.
Среди них некоторые из самых рискованных устройств, за которыми наблюдает агентство, в том числе сердечные стенты, безвыводные кардиостимуляторы и механические сердечные клапаны.
Растущее количество исключений из правил сообщения о травмах и смертях поражает доктора Майкла Кароме, директора Общественной исследовательской группы по вопросам здоровья граждан, как отступление FDA от предоставления важной информации исследователям и пациентам.
«Это просто еще один пример несовершенной системы надзора, — сказал он, — направленной на облегчение работы промышленности, а не на то, чтобы сделать защиту здоровья населения основной целью».
Репортер и продюсер California Healthline Хайди де Марко внесла свой вклад в этот отчет.
[Исправление: предыдущая версия этой истории неверно описала пресс-секретаря FDA Элисон Хант описание отчетов, которые входят в новую программу освобождения FDA. Он был пересмотрен, чтобы исключить термин «заполнитель».]
Серия KHN «Скрытый вред» о секретной базе данных FDA о неисправных медицинских устройствах была отмечена 2 октября 2019 г.

