Первый закон термодинамики
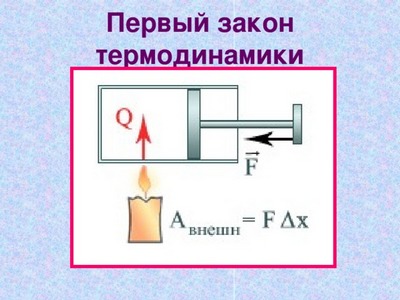
На рисунке 3.9.1 условно проиллюстрированы энергетические потоки между выделенной термодинамической системой и окружающими телами. В случае, если тепловой поток направлен к термодинамической системе, то некоторая величина Q>0, если же система совершает положительную работу над окружающими ее объектами, то справедливо неравенство A>0.

Рисунок 3.9.1. Обмен энергией между термодинамической системой и окружающими телами в результате теплообмена и совершаемой работы.
Состояние системы меняется, когда происходит процесс ее обмена теплом с окружающими объектами, и она совершает положительную или отрицательную работу. Изменяются макроскопические параметры системы, такие как температура, объем и давление. По причине того, что внутренняя энергия U всецело определяется макроскопическими параметрами, которые характеризуют состояние системы, процессы совершения работы и теплообмена провоцируют изменения внутренней энергии данной системы ΔU.
Определение 1-го закона термодинамики
Первый закон термодинамики представляет собой некое обобщение закона сохранения и превращения энергии для термодинамической системы, и формулируется следующим образом:
∆U=Q-A.
Определение 1Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами.
Формула первого закона термодинамики, зачастую записывается в ином виде:
Q=∆U+A.
Определение 2Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
Первый закон термодинамики представляет из себя, по сути, обобщение опытных фактов. Если руководствоваться им, то можно заявить, что энергия не возникает и не исчезает бесследно, а передается от одной системы к друго
zaochnik.com
Первый закон термодинамики простыми словами
Содержание:
Определение первого закона термодинамики
Простая формулировка первого закона термодинамики может звучать примерно так: изменение внутренней энергии той или иной системы возможно исключительно при внешнем воздействии. То есть другими словами, чтобы в системе произошли какие-то изменения необходимо приложить определенные усилия извне. В народной мудрости своеобразным выражением первого закона термодинамики могут служить пословицы – «под лежачий камень вода не течет», «без труда не вытащишь рыбку из пруда» и прочая. То есть на примере пословицы про рыбку и труд, можно представить, что рыбка и есть наша условно закрытая система, в ней не произойдет никаких изменений (рыбка сама себя не вытащит из пруда) без нашего внешнего воздействия и участия (труда).
Интересный факт: именно первый закон термодинамики устанавливает, почему потерпели неудачу все многочисленные попытки ученых, исследователей, изобретателей изобрести «вечный двигатель», ведь его существование является абсолютно невозможным согласно этому самому закону, почему, смотрите абзац выше.
В начале нашей статьи было максимального простое определение первого закона термодинамики, в действительности в академической науке существует целых четыре формулировки сути данного закона:
- Энергия ни откуда не появляется и ни куда не пропадает, она лишь переходит из одного вида в другой (закон сохранения энергии).
- Количество теплоты, полученной системой, идет на совершение ее работы против внешних сил и изменение внутренней энергии.
- Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданной системе, и не зависит от способа, которым осуществляется этот переход.
- Изменение внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты, переданной системе, и работой, совершенной системой над внешними силами.
Формула первого закона термодинамики
Формулу первого закона термодинамики можно записать таким образом:
Q = ΔU + A
Количество теплоты Q, передаваемое системе равно суме изменения ее внутренней энергии ΔU и работы A.
Процессы первого закона термодинамики
Также первый закон термодинамики имеет свои нюансы в зависимости от проходящих термодинамических процессов, которые могут быть изохронными и изобарными, и ниже мы детально опишем о каждом из них.
Первый закон термодинамики для изохорного процесса
Изохорным процессом в термодинамике называют процесс, происходящий при постоянном объеме. То есть, если будь-то в газе или жидкости нагреть вещество в сосуде, произойдет изохорный процесс, так как объем вещества останется неизменным. Это условие имеет влияние и на первый закон термодинамики, проходящий при изохорном процессе.
В изохорном процессе объем V является константой, следовательно, газ работы не совершает A = 0
Из этого выходит следующая формула:
Q = ΔU = U (T2) – U (T1).
Здесь U (T1) и U (T2) – внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит только от температуры (закон Джоуля). При изохорном нагревании тепло поглощается газом (Q > 0), и его внутренняя энергия увеличивается. При охлаждении тепло отдается внешним телам (Q < 0).
Первый закон термодинамики для изобарного процесса
Аналогично изобарным процессом называется термодинамический процесс, происходящий в системе при постоянном давлении и массе газа. Следовательно, в изобарном процессе (p = const) работа, совершаемая газом, выражается следующим уравнением первого закона термодинамики:
A = p (V2 – V1) = p ΔV.
Изобарный первый закон термодинамики дает:
Q = U (T2) – U (T1) + p (V2 – V1) = ΔU + p ΔV. При изобарном расширении Q > 0 – тепло поглощается газом, и газ совершает положительную работу. При изобарном сжатии Q < 0 – тепло отдается внешним телам. В этом случае A < 0. Температура газа при изобарном сжатии уменьшается, T2 < T1; внутренняя энергия убывает, ΔU < 0.
Применение первого закона термодинамики
Первый закон термодинамике имеет практическое применение к различным процессам в физике, например, позволяет вычислить идеальные параметры газа при разнообразных тепловых и механических процессах. Помимо сугубо практичного применение можно этому закону найти применение и философское ведь что ни говорите, но первый закон термодинамики является выражением одного из самых общих законов природы – закона сохранения энергии. Еще Еклезиаст писал, что ничто ни откуда не появляется и никуда не уходит, все пребывает вечно, постоянно трансформируясь, в этом и кроется вся суть первого закона термодинамики.
Первый закон термодинамики, видео
И в завершение нашей статьи вашему вниманию образовательное видео о первом законе термодинамике и внутренней энергии.
Эта статья доступна на английском – First Law of Thermodynamics.
www.poznavayka.org
Первый закон термодинамики
Определение первого закона термодинамики (4 формулировки):
Энергия не может быть создана или уничтожена (закон сохранения энергии), она лишь переходит из одного вида в другой в различных физических процессах. Отсюда следует, что внутренняя энергия изолированной системы остается неизменной.
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы против внешних сил.
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданной системе и не зависит от способа, которым осуществляется этот переход.
Изменение внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты, переданной системе, и работой, совершенной системой над внешними силами.
Первый закон термодинамики в математическом виде:
\[ \Delta Q=\Delta U+A\ \qquad (1), \]
где \( \Delta Q \) – количество теплоты, которое получает термодинамическая система; \( \Delta U \) – изменение внутренней энергии рассматриваемой системы; A – работа, которую выполняет система над внешними телами (против внешних сил).
Первый закон термодинамики в дифференциальном виде:
\[ \delta Q=dU+\delta A\ \qquad (2), \]
где \( \delta Q \) – элемент количества теплоты, который получает система; \( \delta A \) – бесконечно малая работа, которую выполняет термодинамическая система; dU – элементарное изменение внутренней энергии, рассматриваемой системы. Следует обратить внимание на то, что в формуле (2) dU – элементарное изменение внутренней энергии является полным дифференциалом, в отличие от \( \delta Q \) и \( \delta A \).
Количество теплоты считают положительным, если система тепло получает и отрицательным, если тепло отводится от термодинамической системы. Работа будет больше нуля, если ее совершает система, и работа будет считаться отрицательной, если она совершается над системой внешними силами.
В то случае, если система вернулась в первоначальное состояние, то изменение ее внутренней энергии будет равно нулю:
\[\Delta U=0\ \qquad (3)\]
В таком случае в соответствии с первым законом термодинамики мы имеем:
\[\Delta Q=A\ \qquad (4)\]
Выражение (4) означает, что невозможен вечный двигатель первого рода. То есть, принципиально нельзя создать периодически действующую систему (тепловой двигатель), совершающую работу, которая была бы больше, чем количество теплоты, полученное системой извне. Положение о невозможности вечного двигателя первого рода, также является одним из вариантов формулировки первого закона термодинамики.
Первый закон термодинами гласит, что энергия не может быть создана или уничтожена. Таким образом, энергия системы (замкнутой) — постоянна. Тем не менее, энергия может быть передана от одного элемента системы другому. Рассмотрим замкнутую систему, изолированную от остальных.
Передача энергии между различными подсистемами в ней может быть описана как :
E1 = E2
где: E1 = начальная энергия, E2 = конечная энергия
Внутрення энергия включает :
- Кинетическую энергию движения атомов
- Потенциальную энергию хранящуюся в химических связях
- Гравитационную энергию системы
Первый закон является основой для термодинамической науки и инженерного анализа.
Базируется на возможных типах обмена (энергии), ниже приведены 3 типа систем:
- пред — изолированные системы (isolated systems): отсутствует обмен элементами системы или энергией
- закрытые системы (closed systems): отсутствует обмен элементами системы, но присутствует некоторый обмен энергией
- открытые системы (open systems): возможен обмен как элементами системы, так и энергией
Первый закон термодинамики помогает использовать ключевые концепции внутренней энергии (internal energy), тепла (heat), и работы системы (system work). которые широко используются в описании тепловых систем (heat engines).
- Внутренняя энергия ( Internal Energy) — Внутренняя энергия определяется как энергия случайных, находящихся в неупорядченном движении молекул. Энергия молекул находится в диапазоне от высокой, необходимой для движения, до заметной лишь с помощью микроскопа энергии на молекулярном или атомном уровне. Например, у стакана с водой комнатной температы, стоящего на столе нет, на первый взгляд, никакой энергии: ни кинетической, ни потенциальной относительно стола. Но, с помощью микроскопа становится заметна «бурлящая» масса быстро двигающихся молекул. Если выплеснуть воду из стакана, эта микроскопическая энергия не обязательно заметно изменится, когда мы усредним добавленную кинетическую энергию на все молекулы воды.
- Тепло — Тепло может быть определено, как энергия, передаваемая от объекта с более высокой температурой к объекту с менее высокой температурой. Сам по себе объект не обладает «теплом»; соответствующий термин для микроскопической энергии объекта — внутренняя энергия. Внутренняя энергия может увеличиваться путем переноса энергии к объекту от объекта, имеющего температуру выше — этот процесс называется нагревом.
- Работа — Когда работа совершается термодинамической системой (чаще всего это газ, который совершает работу), то работа совершенная газом при постоянном давлении определяется как : W = p dV, где W — работа, p — давление, а dV -изменение объема.
В случаях когда давление не является постоянным, работа может быть представлена интегральным образом, как площадь поверхности под кривой в координатах давление, объем, которые представляют происходящий процесс.
Изменение внутренней энергии системы равно теплу (добавленному системе) минус работа, совершенная системой
dE = Q — W
где: dE — изменение внутренней энергии, Q — добавленное тепло, W — работа системы
1й закон не дает информации о характере процесса и не определяет конечного состояния равновесия. Интуитивно мы понимаем, что энергия переходит от объекта с более высокой температурой к объекту с менее высокой температурой. Таким образом, 2й закон нам нужен для получения информации о характере процесса.
Энтальпия
Энтальпия это термодинамический потенциал, используемый в химической термодинамике реакций и не циклических процессов, однозначная функция состояния термодинамической системы при независимых параметрах энтропии и давления, связана с внутренней энергией соотношением, приведенным ниже. Это свойство вещества, указывающее количество энергии, которую можно преобразовать в теплоту.
Энтальпия определяется как:
H = U + PV
где: H — энтальпия, U — внутренняя энергия, P — давление, V — объем системы
При постоянном давлении изменение энтальпии равно количеству теплоты, подведенной к системе, поэтому энтальпию часто называют тепловой функцией или теплосодержанием. В состоянии термодинамического равновесия энтальпия системы минимальна.
Энтальпия является точно измеряемым параметром, когда определены способы выражения трех других поддающихся точному определению параметров формулы выше.
Энтропия
Термин «энтропия» — величина, характеризующая степень неопределенности системы.
Однако, в термодинамике это понятие используется для определения связанной энергии системы. Энтропия определяет способность одной системы влиять на другую. Когда объекты пересекают нижнюю границу энергетического уровня необходимого для воздействия на окружающую среду, энтропия возрастает.Энтропия связана со вторым законом термодинамики.
Энтропия (обычно обозначается S), функция состояния термодинамической системы, изменение которой dS в равновесном процессе равно отношению количества теплоты dQ, сообщенного системе или отведенного от нее, к термодинамической температуре Т системы.
в символьном виде записывается, как
dS=(dQ)/T
где: dS — изменение термодинамической системы, dQ — количество теплоты, сообщенное системе, T — термодинамическая температура системы
Неравновесные процессы в изолированной системе сопровождаются ростом энтропии, они приближают систему к состоянию равновесия, в котором S максимальна (закон неубывания энтропии).
Для вселенной в целом энтропия возрастает.
В вашем браузере отключен Javascript.Чтобы произвести расчеты, необходимо разрешить элементы ActiveX!
calcsbox.com
Первый закон термодинамики, теория и примеры
Существует две формы передачи энергии от одних тел к другим — это совершение работы одних тел над другими и передача теплоты. Энергия механического движения может переходить в энергию теплового движения и наоборот. В таких переходах энергии выполняется закон сохранения энергии. В применении к процессам, рассматриваемым в термодинамике, закон сохранения энергии именуется первым законом (или первым началом) термодинамики. Этот закон является обобщением эмпирических данных.
Формулировка первого закона термодинамики
Первый закон термодинамики формулируют следующим образом:
Количество теплоты, которое подводится к системе, расходуется на совершение данной системой работы (против внешних сил) и изменение ее внутренней энергии. В математическом виде первый закон термодинамики можно записать в интегральном виде:
где – количество теплоты, которое получает термодинамическая система; – изменение внутренней энергии рассматриваемой системы; A – работа, которую выполняет система над внешними телами (против внешних сил).
В дифференциальном виде первый закон термодинамики записывают как:
где – элемент количества теплоты, который получает система; – бесконечно малая работа, которую выполняет термодинамическая система; – элементарное изменение внутренней энергии, рассматриваемой системы. Следует обратить внимание на то, что в формуле (2) – элементарное изменение внутренней энергии является полным дифференциалом, в отличие от и .
Количество теплоты считают положительным, если система тепло получает и отрицательным, если тепло отводится от термодинамической системы. Работа будет больше нуля, если ее совершает система, и работа будет считаться отрицательной, если она совершается над системой внешними силами.
В то случае, если система вернулась в первоначальное состояние, то изменение ее внутренней энергии будет равно нулю:
В таком случае в соответствии с первым законом термодинамики мы имеем:
Выражение (4) означает, что невозможен вечный двигатель первого рода. То есть, принципиально нельзя создать периодически действующую систему (тепловой двигатель), совершающую работу, которая была бы больше, чем количество теплоты, полученное системой извне. Положение о невозможности вечного двигателя первого рода, также является одним из вариантов формулировки первого закона термодинамики.
Примеры решения задач
ru.solverbook.com
Первое начало термодинамики — это… Что такое Первое начало термодинамики?
Первое начало термодинамики — один из трёх основных законов термодинамики, представляет собой закон сохранения энергии для термодинамических систем.
Первое начало термодинамики было сформулировано в середине XIX века в результате работ немецкого учёного Ю. Р. Майера, английского физика Дж. П. Джоуля и немецкого физика Г. Гельмгольца[1]. Согласно первому началу термодинамики, термодинамическая система может совершать работу только за счёт своей внутренней энергии или каких-либо внешних источников энергии. Первое начало термодинамики часто формулируют как невозможность существования вечного двигателя первого рода, который совершал бы работу, не черпая энергию из какого-либо источника.
Формулировка
Существует несколько эквивалентных формулировок первого начала термодинамики
В любой изолированной системе запас энергии остаётся постоянным.[2] Это — формулировка Дж. П. Джоуля (1842 г.).
Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил
Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе, то есть, оно зависит только от начального и конечного состояния системы и не зависит от способа, которым осуществляется этот переход. Это определение особенно важно для химической термодинамики[2] (ввиду сложности рассматриваемых процессов). Иными словами, внутренняя энергия является функцией состояния. В циклическом процессе внутренняя энергия не изменяется.
Изменение полной энергии системы в квазистатическом процессе равно количеству теплоты , сообщённому системе, в сумме с изменением энергии, связанной с количеством вещества при химическом потенциале , и работы [3], совершённой над системой внешними силами и полями, за вычетом работы , совершённой самой системой против внешних сил
.
Для элементарного количества теплоты , элементарной работы и малого приращения внутренней энергии первый закон термодинамики имеет вид:
.Разделение работы на две части, одна из которых описывает работу, совершённую над системой, а вторая — работу, совершённую самой системой, подчёркивает, что эти работы могут быть совершены силами разной природы вследствие разных источников сил.
Важно заметить, что и являются полными дифференциалами, а и — нет.
Частные случаи
Рассмотрим несколько частных случаев:
- Если , то это означает, что тепло к системе подводится.
- Если , аналогично — тепло отводится.
- Если , то система не обменивается теплом с окружающей средой и называется адиабатически изолированной.
Обобщая: в конечном процессе элементарные количества теплоты могут быть любого знака. Общее количество теплоты, которое мы назвали просто — это алгебраическая сумма количеств теплоты, сообщаемых на всех участках этого процесса. В ходе процесса теплота может поступать в систему или уходить из неё разными способами.
При отсутствии работы над системой и потоков энергии-вещества, когда , , , выполнение системой работы приводит к тому, что , и энергия системы убывает. Поскольку запас внутренней энергии ограничен, то процесс, в котором система бесконечно долгое время выполняет работу без подвода энергии извне, невозможен, что запрещает существование вечных двигателей первого рода.
Первое начало термодинамики:
- при изобарном процессе
- при изохорном процессе ()
- при изотермическом процессе
Здесь — масса газа, — молярная масса газа, — молярная теплоёмкость при постоянном объёме, — давление, объём и температура газа соответственно, причём последнее равенство верно только для идеального газа.
См. также
Примечания
- ↑ Льоцци М. История физики. — М.: Мир, 1970. С. 231—235.
- ↑ 1 2 Стромберг А. Г., Семченко Д. П. Физическая химия: Учеб. для хим.-тех. спец. вузов/Под ред. А. Г. Стромберга. — 2-е изд., перераб. и доп. Москва: Высшая школа, 1988г.— 496 с.— с.62
- ↑ В соответствии с рекомендациями ИЮПАК работу в химической термодинамике следует обозначать как W — см. англ. E.R. Cohen, T. Cvitas, J.G. Frey, B. Holmström, K. Kuchitsu, R. Marquardt, I. Mills, F. Pavese, M. Quack, J. Stohner, H.L. Strauss, M. Takami, and A.J. Thor, «Quantities, Units and Symbols in Physical Chemistry», IUPAC Green Book, 3rd Edition, 2nd Printing, IUPAC & RSC Publishing, Cambridge (2008) — p. 56.
Ссылки
partners.academic.ru
Первый закон термодинамики. Просто!
В данной статье мы разберемся с первым законом термодинамики. Объясним на простых и понятных примерах, как работает первый закон термодинамики.
Первый закон термодинамики является базовым. Его еще называют первым началом термодинамики. Правильное его понимание позволяет решать множество задач.
Первый закон термодинамики гласит:
Изменение внутренней энергии системы происходит за счет работы и теплоты, переданной системы.
Формулу первого закона термодинамики в большинстве источников записывают так:
ΔU = A + Q
, где ΔU — изменение внутренней энергии.
А — работа
Q – теплота
Данная формулировка для многих не совсем понятна, поэтому давайте рассмотрим более простой для восприятия вариант первого закона термодинамики.
По сути, тот же самый закон можно записать:
Q = ΔU + A
Сам закон в данном случае будет гласить:
Если мы подводим к телу теплоту, то она может тратиться на изменение его внутренней энергии(нагрев) и на совершение работы данным телом(за счет изменения его объема).
Эта самая простая формулировка для восприятия, на наш взгляд.
Чтобы стало еще понятнее, рассмотрим данный закон на простом примере.
У нас есть обычная пустая банка, закрытая пластиковой крышкой.
Если мы подведем к банке тепло, то она начнет нагреваться. В тоже время воздух находящийся в ней при нагревании начнет расширяться и откроет крышку, совершив при этом работу.
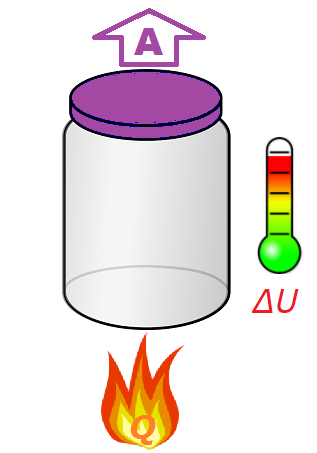
Таким образом, то тепло, которое мы подвели к банке, потратиться на изменение её внутренней энергии (банка и воздух в ней нагреются) и совершение работы (откроется крышка).
Как видите, понять первый закон термодинамики достаточно несложно. Если основной физический смысл в том, что энергия не берется из ниоткуда и не исчезает в никуда. Именно поэтому не существует и не может существовать вечного двигателя. Такого двигателя, который смог совершать работу постоянно, не черпая при этом энергию извне.
Для правильного интуитивного восприятия давайте рассмотрим еще одну интересную аналогию.
Возьмем вас, как тело, совершающее работу, в виде какого-либо физического труда.
Когда вы совершаете работу, вы расходуете внутреннюю энергию и при этом согреваетесь (повышается температура вашего тела).
То и для вас применима формула ΔU = A + Q,
То есть, за счет того, что вы тратите энергию, которую получили из пищи, вы двигаетесь, совершая работу, и при этом вы также согреваетесь и отдаете тепло своего тела окружающей среде.
Интересный случай первого закона термодинамики — работа холодильника.

Ранее, рассматривая ситуацию с нагреванием банки, мы затрагивали совершение работы при расширении газа. Интересно, что, если за счет нагрева газ расширяется и совершает работу, то совершив работу по сжатию газа, мы получим обратную реакцию — охлаждение.
Цикл работы холодильника таков. По замкнутой системе циркулирует хладагент (специальный газ), циркуляция и давление для сжатия обеспечивается за счет работы компрессора. В месте, где нам нужно получить охлаждение меняется диаметр трубок, по которым циркулирует газ. За счет того, что газ расширяется, не совершая при этом работы, он забирает тепло из пространства внутри холодильника и далее переносит это тепло в окружающую среду. Отдав тепло окружающей среде, он снова сжимается компрессором, гонится по кругу и цикл повторяется.
Работа двигателя внутреннего сгорания автомобиля также описывается первым законом термодинамики. За счет сгорания топлива в цилиндрах, совершается работа по перемещению поршней и движение автомобиля в конечном итоге.
Также, при работе двигатель нагревается, отдавая тепло окружающей среде. К слову сказать, основная задача многих конструкторов сократить тепловые потери, тем самым увеличив так называемый коэффициент полезного действия. На нем мы подробно останавливаться не будем и оставим тему КПД для будущих статей.
Подводя итог, хочется сказать о важности знания и понимания первого начала термодинамики.
Именно первый закон термодинамики является основополагающим в решение многих задач физики.
Очень надеемся, что данный материал оказался для вас интересным и полезным.
Пишите свои вопросы в комментариях, если они у вас остались.
И удачи в учебе!
Если материал был полезен, вы можете отправить донат или поделиться данным материалом в социальных сетях:
reshit.ru
Первый закон термодинамики для обычного человека :: SYL.ru
Вся деятельность человека основывается на потреблении энергии. Без энергии сложно представить себе активность организма, функционирование всех благ для людей. Она важна как внутри человека, так и для его внешнего существования. Различные отрасли производства не могут сами по себе работать, ведь они требуют энергии. Перевозка товаров, отопление помещений, синтез новых веществ в клетках организма — все это происходит благодаря способности производить работу.
Место энергии в термодинамике
Для того чтобы определить, какое место занимает энергия в этой отрасли науки, следует узнать, что конкретно подразумевает термин «термодинамика». Это область физики, в которой углубленно изучаются процессы превращения энергии. Всем известен тот факт, что энергия представлена в нескольких формах: она может быть химической, электрической, тепловой, механической и световой. В данной отрасли науки даже есть свои законы и принципы, например первый закон термодинамики, а также некоторые другие. Исходя из этого, можно сказать, что не существовало бы этой области знаний, если бы не было известно свойств вышеописанной физической величины.
Каким образом происходит превращение энергии?

Многим непонятен факт перехода энергии из одного состояния в другое. Но мы в повседневной жизни настолько часто пользуемся переходящей энергией, что уже не отдаем отчета себе в том, откуда она берется. Так, например, ежедневно садясь в автомобиль, мы не думаем о том, что в момент езды химическая энергия переходит в электрическую. В электромоторе начальная электрическая энергия переходит в механическую, а в паровой турбине тепло преобразуется в механическую физическую величину. При всем этом есть определенные количественные соотношения разных форм энергии. Но при преобразовании происходят процессы с некоторыми количественными потерями: потребление полезной энергии всегда выше, чем ее вырабатывание. Это явление легко объясняется: преобразование не обходится без трения, во время него часть энергии становится теплом и рассеивается в пространстве. Получается, что эта часть уже не может быть использована как полезная величина. Таким образом, любое преобразование не проходит без потерь.
Первый закон термодинамики
Изучая процесс преобразования энергии, ученые открыли два фундаментальных закона. Эта статья будет посвящена первому из них. Этот закон термодинамики гласит: при любом изменении — химическом или физическом — количество энергии остается постоянным. По-другому, он еще называется законом сохранения энергии. Из этого определения следует, что энергия внезапно не появляется и просто так не исчезает. Если в процессе какой-либо деятельности она переходит в разные формы, из одной в другую, то ее общее количество не меняется. Иными словами, энергия не создается и не уничтожается, что отображает первый закон термодинамики. Определение в разных источниках может изменяться, но суть остается неизменной.

История открытия этого закона
Начало свое закон берет еще с середины XIX века. Немецкий врач Майер, наблюдая за тем, как в тропиках изменяется цвет крови человека, задумался о взаимосвязи таких физических понятий, как тепло и энергия. В свою очередь, известный ученый Джоуль обратил внимание на разработки Майера, что-то дополнил со своей стороны. Все данные по этому закону объединил еще один немецкий врач, Гельмгольц, когда изучал физические основы органов восприятия — слуха и зрения человека. Именно он сформулировал закон в таком виде, каким его на сегодняшний день знает весь мир.
Типы обмена энергии
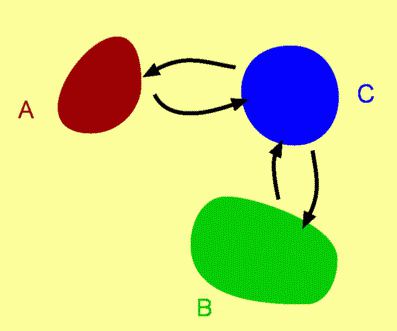
Теплота, которая возникает при переходе одного вида энергии в другой, влияет на изменение внутренней энергии предмета. Когда она меняется, появляется противодействие работе внешних сил, которые влияют на этот предмет. Внутренняя энергия может быть кинетической (это движение атомов предмета), потенциальной (она хранится в химических связях между атомами), гравитационной энергией всей системы (т. е. влияние на предмет гравитационных сил, которые проявляются и внутри). Исходя из этих видов, ученые выделили определенные типы обмена энергии.
- Под первым из них принято понимать предизолированные системы — здесь отсутствует обмен энергией и другими элементами определенной системы.
- Второй тип — закрытые системы, характеризуется отсутствием обмена элементов систем, но в незначительной степени происходит обмен энергией.
- Открытые системы (третий тип обмена) характеризуются обменом и энергией, и их элементами.
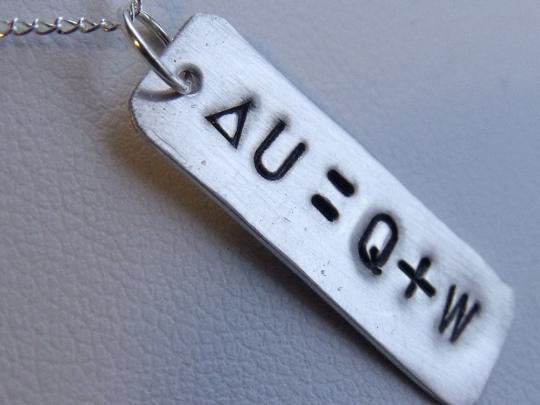
Внутренняя энергия предмета или системы в термодинамике играет почти ключевую роль. На самом деле это сложное объединение нескольких потоков активности молекул и атомов. Она слагается из таких видов, как энергия вращательного и поступательного движения молекул, энергия движений атомов и групп атомов, которая находится внутри молекул и излучается при колебании этих частиц. Еще к внутренней энергии предмета относят ядерную энергию атомов и энергию взаимодействия между собой молекул. Uвн зависит от начального состояния предмета и конечных показателей его состояния. Эта энергия непрерывна, как и обозначает ее первый закон термодинамики. Ее можно легко рассчитать по следующей формуле: тепло, добавленное системе, минус совершенная этой системой работа. Здесь речь идет не о характере процесса изменения внутренней энергии, даже не о конечном состоянии равновесия, так как это определяет уже второй закон термодинамики.
Взаимосвязь тепла и внутренней энергии
Эти понятия очень тесно связаны между собой. Допускается, что тепло является частью внутренней энергии системы. Разберемся, что же собой представляет тепло. Сам предмет не обладает таковым в обычном понимании этого слова. Можно сказать, что тепло — это энергия, которая переходит от объекта, имеющего высокую температуру, к объекту с температурой меньшей, чем у первого.

Иначе говоря, это часть внутренней энергии предмета, которая переносится от него, так как он имеет показатели температуры выше. Такой перенос в физике и химии называется нагревом.
Первый закон термодинамики, химия
Этот закон имеет фундаментальное значение не только для физических опытов, изучения явлений и открытия протекания новых процессов, но и для другой науки — химии — и смежных ее отраслей. При изучении существования и перехода энергии в разные формы в ракурсе химических реакций организма или предмета открывается горизонт интересных исследований и закономерностей в плоскости биоэнергетики.

У многих может возникнуть ощущение, что первый закон термодинамики отдален от жизни обычного человека, что молекулы и атомы для понимания подвластны только малому количеству посвященных людей. Но это далеко не так. В основе жизни каждого живого организма лежит обмен веществ, который не может происходить без превращения энергии. Поэтому особый интерес не только для ученых-физиков, но и для врачей-диетологов, спортивных инструкторов представляют химические процессы превращения энергии в организме человека. Ведь зная все особенности этого процесса, можно успешно помогать людям избавляться от лишних килограммов, а также следить за собой с помощью правильно составленного меню, состоящего из здоровой пищи.
www.syl.ru
