Продукты горения (сгорания): состав, вещества, классификация
Продукты горения – это вещества (газообразные, жидкие или твердые вещества) и соединения, образующиеся в результате сложного физико-химического процесса горения веществ (материалов).
Под продуктами горения чаще всего понимают дым, токсичные продукты горения, сажу и другие.
Продукты горения сухой травы
Знание свойств и количества продуктов горения необходимо для расчета теплоты сгорания, температуры горения и других показателей, используемых для оценки пожаровзрывоопасности веществ (материалов), объектов с наличием этих веществ (материалов).
Состав
Состав их зависит от состава горящего вещества и условий его горения. В условиях пожара чаще всего горят органические вещества (древесина, ткани, бензин, керосин, резина и др.), в состав которых входят главным образом углерод, водород, кислород и азот. При горении их в достаточном количестве воздуха и при высокой температуре образуются продукты полного сгорания: СО2, Н2О, N2. При горении в недостаточном количестве воздуха или при низкой температуре кроме продуктов полного сгорания образуются продукты неполного сгорания: СО, С (сажа).
При горении в недостаточном количестве воздуха или при низкой температуре кроме продуктов полного сгорания образуются продукты неполного сгорания: СО, С (сажа).
Продукты сгорания называют влажными, если при расчете их состава учитывают содержание паров воды, и сухими, если содержание паров воды не входит в расчетные формулы.
Реже во время пожара горят неорганические вещества, такие как сера, фосфор, натрий, калий, кальций, алюминий, титан, магний и др. Продуктами сгорания их в большинстве случаев являются твердые вещества, например Р2О5, Na2O2, CaO, MgO. Образуются они в дисперсном состоянии, поэтому поднимаются в воздух в виде плотного дыма. Продукты сгорания алюминия, титана и других металлов в процессе горения находятся в расплавленном состоянии.
При неполном сгорании органических веществ в условиях низких температур и недостатка воздуха образуются более разнообразные продукты – окись углерода, спирты, кетоны, альдегиды, кислоты и другие сложные химические соединения. Они получаются при частичном окислении как самого горючего, так и продуктов его сухой перегонки (пиролиза). Эти продукты образуют едкий и ядовитый дым. Кроме того, продукты неполного горения сами способны гореть и образовывать с воздухом взрывчатые смеси. Такие взрывы бывают при тушении пожаров в подвалах, сушилках и в закрытых помещениях с большим количеством горючего материала. Рассмотрим кратко свойства основных продуктов горения.
Они получаются при частичном окислении как самого горючего, так и продуктов его сухой перегонки (пиролиза). Эти продукты образуют едкий и ядовитый дым. Кроме того, продукты неполного горения сами способны гореть и образовывать с воздухом взрывчатые смеси. Такие взрывы бывают при тушении пожаров в подвалах, сушилках и в закрытых помещениях с большим количеством горючего материала. Рассмотрим кратко свойства основных продуктов горения.
Углекислый газ
Углекислый газ или двуокись углерода (СО2) – продукт полного горения углерода. Не имеет запаха и цвета. Плотность его по отношению к воздуху равна 1,52. Плотность углекислого газа при температуре Т = 0 °С и при нормальном давлении р = 760 миллиметров ртутного столба (мм Hg) равна 1,96 кг/м3 (плотность воздуха при этих же условиях равна ρ = 1,29 кг/м3). Углекислый газ хорошо растворим в воде (при Т = 15 °С в одном литре воды растворяется один литр газа). Углекислый газ не поддерживает горение веществ, за исключением щелочных и щелочно-земельных металлов. Горение магния, например, происходит в атмосфере углекислого газа по уравнению:
Углекислый газ не поддерживает горение веществ, за исключением щелочных и щелочно-земельных металлов. Горение магния, например, происходит в атмосфере углекислого газа по уравнению:
CO2 +2 Mg = C + 2 MgO.
Токсичность углекислого газа незначительна. Концентрация углекислого газа в воздухе 1,5 % безвредна для человека длительное время. При концентрации углекислого газа в воздухе, превышающей 3-4,5 %, нахождение в помещении и вдыхание газа в течение получаса опасно для жизни. При температуре Т = 0 °С и давлении р = 3,6 МПа углекислый газпереходит в жидкое состояние. Температура кипения жидкой углекислоты составляет Т = –78 °С. При быстром испарении жидкой углекислоты газ охлаждается и переходит в твердое состояние. Как в жидком, так и твердом состоянии, капли и порошки углекислоты применяются для тушения пожаров.
Оксид углерода
Оксид углерода или угарный газ (СО) – продукт неполного сгорания углерода. Этот газ не имеет запаха и цвета, поэтому особо опасен. Относительная плотность равна 0,97. Плотность угарного газа при Т = 0 °С и р = 760 мм Hg составляет 1,25 кг/м3. Этот газ легче воздуха и скапливается в верхней части помещения при пожарах. В воде оксид углерода почти не растворяется. Способен гореть и с воздухом образует взрывчатые смеси. Угарный газ при горении дает пламя синего цвета. Угарный газ является очень токсичным. Вдыхание воздуха с концентрацией угарного газа 0,4 % смертельно для человека. Стандартные противогазы от угарного газа не защищают, поэтому при пожарах применяются специальные фильтры или кислородные изолирующие приборы.
Этот газ не имеет запаха и цвета, поэтому особо опасен. Относительная плотность равна 0,97. Плотность угарного газа при Т = 0 °С и р = 760 мм Hg составляет 1,25 кг/м3. Этот газ легче воздуха и скапливается в верхней части помещения при пожарах. В воде оксид углерода почти не растворяется. Способен гореть и с воздухом образует взрывчатые смеси. Угарный газ при горении дает пламя синего цвета. Угарный газ является очень токсичным. Вдыхание воздуха с концентрацией угарного газа 0,4 % смертельно для человека. Стандартные противогазы от угарного газа не защищают, поэтому при пожарах применяются специальные фильтры или кислородные изолирующие приборы.
Вода
Всем известная вода – Н2О – также выделяется во время горения виде газа – как пар. Вода является продуктом горения газа метана – СН4. Вообще, вода и углекислота в основном выделяются при полном сгорании всех органических веществ.
Цианистый водород
Цианистый калий – сильнейший яд – соль синильной кислоты, также известной как цианистый водород – HCN. Это бесцветная жидкость, но очень летучая (легко переходящая в газообразное состояние). То есть при горении она тоже будет выделяться в атмосферу в виде газа. Синильная кислота очень ядовита, даже небольшая – 0,01 процент – концентрация в воздухе приводит к летальному исходу. Отличительной чертой кислоты является характерный запах горького миндаля. Но синильной кислоте присуща одна «изюминка» – отравиться ей можно, не только вдыхая непосредственно органами дыхания, но и через кожу. Так что защититься только средствами индивидуальной защиты органов дыхания и зрения не получится.
Это бесцветная жидкость, но очень летучая (легко переходящая в газообразное состояние). То есть при горении она тоже будет выделяться в атмосферу в виде газа. Синильная кислота очень ядовита, даже небольшая – 0,01 процент – концентрация в воздухе приводит к летальному исходу. Отличительной чертой кислоты является характерный запах горького миндаля. Но синильной кислоте присуща одна «изюминка» – отравиться ей можно, не только вдыхая непосредственно органами дыхания, но и через кожу. Так что защититься только средствами индивидуальной защиты органов дыхания и зрения не получится.
Акролеин
Пропеналь, акролеин, акрилальдегид – все это названия одного вещества, ненасыщенного альдегида акриловой кислоты: СН2=СН-СНО. Этот альдегид тоже является сильно летучей жидкостью. Акролеин бесцветен, с резким запахом, очень ядовит. При попадании жидкости или ее паров на слизистые, особенно в глаза, вызывает сильное раздражение. Пропеналь является высокореакционным соединением, и это объясняет его высокую токсичность.
Формальдегид
Подобно акролеину, формальдегид принадлежит к классу альдегидов и является альдегидом муравьиной кислоты. Также это соединение известно как метаналь. Это токсичный, бесцветный газ с резким запахом.
Азотсодержащие вещества
Чаще всего во время горения веществ, содержащих азот, выделяется чистый азот – N2. Этот газ и так содержится в атмосфере в большом количестве. Азот может быть примером продукта горения аминов. Но при термическом разложении, к примеру, солей аммония, а в некоторых случаях и при самом горении, в атмосферу выбрасываются и его оксиды, со степенью окисления азота в них плюс один, два, три, четыре, пять. Оксиды – газы, имеют бурый цвет и чрезвычайно токсичны.
Сернистый газ
Сернистый газ (SO2) – продукт горения серы и сернистых соединений. Бесцветный газ с характерным резким запахом. Относительная плотность сернистого газа равна 2,25. Плотность этого газа при Т = 0 °С и р = 760 мм Hg составляет 2,9 кг/м3, то есть он намного тяжелее воздуха. Сернистый газ хорошо растворяется в воде, например, при температуре Т = 0 °С в одном литре воды растворяется восемьдесят литров SO2, а при Т = 20 °С – сорок литров. Сернистый газ горение не поддерживает. Действует раздражающим образом на слизистые оболочки дыхательных путей, вследствие чего является очень токсичным.
Сернистый газ хорошо растворяется в воде, например, при температуре Т = 0 °С в одном литре воды растворяется восемьдесят литров SO2, а при Т = 20 °С – сорок литров. Сернистый газ горение не поддерживает. Действует раздражающим образом на слизистые оболочки дыхательных путей, вследствие чего является очень токсичным.
Дым
При горении многих веществ, кроме рассмотренных выше продуктов сгорания выделяется дым – дисперсная система, состоящая из мельчайших твердых частиц, находящихся во взвешенном состоянии в каком-либо газе. Диаметр частиц дыма составляет от 10−4 до 10−6 см (от 1 до 0,01 мкм). Отметим, что 1 мкм (микрон) равен 10−6 м или 10−4 см. Более крупные твердые частицы, образующиеся при горении, быстро оседают в виде копоти и сажи. При горении органических веществ дым содержит твердые частицы сажи, взвешенные в CO2, CO, N2, SO2 и других газах. В зависимости от состава и условий горения вещества получаются различные по составу и по цвету дымы. При горении дерева, например, образуется серовато-черный дым, ткани – бурый дым, нефтепродуктов – черный дым, фосфора – белый дым, бумаги, соломы – беловато-желтый дым.
В зависимости от состава и условий горения вещества получаются различные по составу и по цвету дымы. При горении дерева, например, образуется серовато-черный дым, ткани – бурый дым, нефтепродуктов – черный дым, фосфора – белый дым, бумаги, соломы – беловато-желтый дым.
В составе дыма, образующегося на пожарах при горении органических веществ, кроме продуктов полного и неполного сгорания, содержатся продукты термоокислительного разложения горючих веществ. Образуются они при нагреве еще негорящих горючих веществ, находящихся в среде воздуха или дыма, содержащего кислород. Обычно это происходит перед факелом пламени или в верхних частях помещений, где находятся нагретые продукты сгорания.
Состав продуктов термоокислительного разложения зависит от природы горючих веществ, температуры и условий контакта с окислителем. Так, исследования показывают, что при термоокислительном разложении горючих веществ, в молекулах которых содержатся гидроксильные группы, всегда образуется вода. Если в составе горючих веществ находятся углерод, водород и кислород, продуктами термоокислительного разложения чаще всего являются углеводороды, спирты, альдегиды, кетоны и органические кислоты. Если в составе горючих веществ, кроме перечисленных элементов, есть хлор или азот, то в дыме находятся также хлористый и цианистый водород, оксиды азота и другие соединения. Так, в дыме при горении капрона содержится цианистый водород, при горении линолеума «Релин» – сероводород, диоксид серы, при горении органического стекла – оксиды азота. Продукты неполного сгорания и термоокислительного разложения в большинстве случаев являются токсичными веществами, поэтому тушение пожаров в помещениях производят только в кислородных изолирующих противогазах.
Если в составе горючих веществ, кроме перечисленных элементов, есть хлор или азот, то в дыме находятся также хлористый и цианистый водород, оксиды азота и другие соединения. Так, в дыме при горении капрона содержится цианистый водород, при горении линолеума «Релин» – сероводород, диоксид серы, при горении органического стекла – оксиды азота. Продукты неполного сгорания и термоокислительного разложения в большинстве случаев являются токсичными веществами, поэтому тушение пожаров в помещениях производят только в кислородных изолирующих противогазах.
Пепел, зола, копоть, сажа, уголь
Копоть, или сажа – остатки углерода, который не вступил в реакцию, по разным причинам. Сажу называют также амфотерным углеродом. Зола, или пепел – мелкие частицы неорганических солей, не сгоревших или не разложившихся при температуре горения. При выгорании топлива эти микросоединения переходят во взвешенное состояние или скапливаются внизу. А уголь – это продукт неполного сгорания дерева, то есть не сгоревшие его остатки, но при этом еще способные гореть. Конечно, это далеко не все соединения, которые выделятся при сгорании тех или иных веществ. Перечислить их всех нереально, да и не нужно, потому что другие вещества выделяются в ничтожно малых количествах, и только при окислении определенных соединений.
Конечно, это далеко не все соединения, которые выделятся при сгорании тех или иных веществ. Перечислить их всех нереально, да и не нужно, потому что другие вещества выделяются в ничтожно малых количествах, и только при окислении определенных соединений.
Классификация
Большинство продуктов горения являются отравляющими веществами. Поэтому, говоря об их классификации, будет правильным ознакомить вас со следующим термином:
Классификация опасности веществ по степени воздействия на организм – это установление (ранжирование) уровней опасности веществ по их поражающему и повреждающему воздействию на организм человека и (или) животного. Более подробно о данной классификации читайте в материале по ссылке >>
Также ознакомьтесь с познавательным материалом по теме:
Токсичность продуктов горения
Показатель токсичности продуктов горения
Формулы для расчета объема
Вид формулы для расчета объема продуктов полного сгорания при теоретически необходимом количестве воздуха зависит от состава горючего вещества.
Индивидуальное химическое соединение
В этом случае расчет ведут, исходя из уравнения реакции горения. Объем влажных продуктов сгорания единицы массы (кг) горючего вещества при нормальных условиях рассчитывают по формуле:
где:
Vп.с. – объем влажных продуктов сгорания, м3/кг; – число киломолей диоксида углерода, паров воды, азота и горючего вещества в уравнении реакции горения; М – масса горючего вещества, численно равная молекулярной массе, кг.
Например, чтобы определить объем сухих продуктов сгорания 1 кг ацетона при нормальных условиях, составляем уравнение реакции горения ацетона в воздухе:
CH3COCH3 + 4O2 + 4·3,76N2 = 3CO2 + 3H2O + 4·3,76N2
Определяем объем сухих продуктов сгорания ацетона:
Объем влажных продуктов сгорания 1 м3 горючего вещества (газа) можно рассчитать по формуле:
где:
Vп. с. – объем влажных продуктов сгорания 1 м3горючего газа, м3/м3; – число молей диоксида углерода, паров воды, азота и горючего вещества (газа).
с. – объем влажных продуктов сгорания 1 м3горючего газа, м3/м3; – число молей диоксида углерода, паров воды, азота и горючего вещества (газа).
Сложная смесь химических соединений
Если известен элементный состав сложного горючего вещества, то состав и количество продуктов сгорания 1 кг вещества можно определить по уравнению реакции горения отдельных элементов. Для этого составляют уравнения реакции горения углерода, водорода, серы и определяют объем продуктов сгорания, приходящийся на 1 кг горючего вещества. Уравнение реакции горения имеет вид:
С + О2+ 3,76N2 = СО2 + 3,76N2
При сгорании 1 кг углерода получается 22,4 / 12 = 1,86 м3 СО2 и 22,4 × 3,76/12 = 7,0 м3 N2.
Аналогично определяют объем (в м3) продуктов сгорания 1 кг серы и водорода. Полученные данные приведены ниже:
| СО2 | N2 | Н2О | SO2 | |
| Углерод | 1,86 | 7,00 | – | – |
| Водород | – | 21,00 | 11,2 | – |
| Сера | – | 2,63 | – | 0,7 |
При горении углерода, водорода и серы кислород поступает из воздуха. Однако в состав горючего вещества может входить кислород, который также принимает участие в горении. В этом случае воздуха на горение вещества расходуется соответственно меньше.
Однако в состав горючего вещества может входить кислород, который также принимает участие в горении. В этом случае воздуха на горение вещества расходуется соответственно меньше.
В составе горючего вещества могут находиться азот и влага, которые в процессе горения переходят в продукты сгорания. Для их учета необходимо знать объем 1 кг азота и паров воды при нормальных условиях.
Объем 1 кг азота равен 0,8 м3, а паров воды 1,24 м3. В воздухе при 0 °С и давлении 101325 Па на 1 кг кислорода приходится 3,76 × 22,4 / 32 = 2,63 м3 азота.
На основании приведенных данных определяют состав и объем продуктов сгорания 1 кг горючего вещества.
Например, чтобы определить объем и состав влажных продуктов сгорания 1 кг каменного угля, состоящего из 75,8 % С, 3,8 % Н, 2,8 % О, 1,1 % N, 2,5 % S, W = 3,8 %, A = 11,0 %.Объем продуктов сгорания будет следующий, м3:
| Состав продуктов сгорания | СО2 | Н2О | N2 | SO2 |
| Углерод | 1,86 × 0,758 = 1,4 | – | 7 × 0,758 = 5,306 | – |
| Водород | – | 11,2 × 0,038 = 0,425 | 21 × 0,038 = 0,798 | – |
| Сера | – | – | 2,63 × 0,025 = 0,658 | 0,7 × 0,025 = 0,017 |
| Азот в горючем веществе | – | – | – | |
| Влага в горючем веществе | – | 1,24 × 0,03 = 0,037 | – | – |
| Сумма | 1,4 | 0,462 | 6,7708 – 0,0736 = 6,6972 | 0,017 |
Из общего объема азота вычитают объем азота, приходящийся на кислород в составе каменного угля 0,028 × 2,63 = 0,0736 м3. Итог указывает состав продуктов сгорания каменного угля: объем влажных продуктов сгорания 1 кг каменного угля равен:
Итог указывает состав продуктов сгорания каменного угля: объем влажных продуктов сгорания 1 кг каменного угля равен:
Vп.с. = 1,4 + 0,462 + 6,6972 + 0,017 = 8,576 м3/кг.
Смесь газов
Количество и состав продуктов сгорания для смеси газов определяют по уравнению реакции горения компонентов, составляющих смесь. Например, горение метана протекает по следующему уравнению:
СН4 + 2О2 + 2 × 3,76N2 = СО2 + 2Н2О + 7,52N2
Согласно этому уравнению, при сгорании 1 м3 метана получается 1 м3 диоксида углерода, 2 м3 паров воды и 7,52 м3 азота. Аналогично определяют объем (в м3) продуктов сгорания 1 м3 различных газов:
| СО2 | Н2О | N2 | SO2 | |
| Водород | – | 1,0 | 1,88 | – |
| Окись углерода | 1,0 | – | 1,88 | – |
| Сероводород | – | 1,0 | 5,64 | 1,0 |
| Метан | 1,0 | 2,0 | 7,52 | – |
| Ацетилен | 2,0 | 1,0 | 9,54 | – |
| Этилен | 2,0 | 2,0 | 11,28 | – |
На основании приведенных цифр определяют состав и количество продуктов сгорания смеси газов.
Анализ продуктов сгорания, взятых на пожарах в различных помещениях, показывает, что в них всегда содержится значительное количество кислорода. Если пожар возникает в помещении с закрытыми оконными и дверными проемами, то пожар при наличии горючего может продолжаться до тех пор, пока содержание кислорода в смеси воздуха с продуктами сгорания в помещении не снизится до 14-16 % (об.). Следовательно, на пожарах в закрытых помещениях содержание кислорода в продуктах сгорания может быть в пределах от 21 до 14 % (об.). Состав продуктов сгорания во время пожаров в помещениях с открытыми проемами (подвал, чердак) показывает, что содержание в них кислорода может быть ниже 14 % (об.):
| СО | СО2 | О2 | |
| В подвалах | 0,15-0,5 | 0,8-8,5 | 10,6-19 |
| На чердаках | 0,1-0,6 | 0,3-4,0 | 16,0-20,2 |
По содержанию кислорода в продуктах сгорания на пожарах можно судить о коэффициенте избытка воздуха, при котором происходило горение.
Действие на организм человека
Степень токсичности веществ связана с их физической и химической природой. Взаимодействуя с организмом, продукты горения вызывают патологические синдромы.
Международная классификация болезней десятого пересмотра МКБ-10 определяет отравление продуктами горения кодом Т59 – «Токсическое действие других газов, дымов и паров».
По механизму действия на человека отравляющие компоненты в составе дыма делятся на пять групп.
- Вещества, которые вызывают поражение кожного покрова и слизистой оболочки. Симптомы такого отравления продуктами горения – зуд, жжение кожи и её воспаление, боль в области глаз, век, слезотечение, кашель. Примеры – пары дёгтя, сернистый газ, формальдегид.
- Продукты горения, которые вызывают острые ингаляционные отравления. Пострадавшие жалуются на одышку, кашель. При осмотре обращает на себя внимание частое дыхание, синюшность. При высокой концентрации токсичного газа может произойти остановка дыхания.
 Так, признаки отравления продуктами горения ПВХ могут проявиться через несколько часов. Ингаляционные отравления вызывает хлор, аммиак, оксид азота.
Так, признаки отравления продуктами горения ПВХ могут проявиться через несколько часов. Ингаляционные отравления вызывает хлор, аммиак, оксид азота. - Продукты горения с образованием токсичных веществ, которых называют «ядами крови». Связывая гемоглобин, они нарушают доступ кислорода к тканям и запускают патологические реакции, охватывающие весь организм. Примеры – угарный газ, диоксид азота.
- Продукты горения, для которых органом-мишенью является нервная система. Это бензол, сероводород.
- Ферментные яды, которые воздействуют на тканевое дыхание, блокируя процессы активации кислорода. Это сероводород, синильная кислота.
Многие токсины, образующие в продуктах горения «универсальны», так как вызывают поражение сразу нескольких систем организма.
Первая помощь при отравлении
Симптомы интоксикации разными веществами могут отличаться, но принципы оказания первой помощи всегда одинаковые.
Большинство ядов поступает через дыхательные пути. Первое, что необходимо сделать при отравлении – прекратить поступление продуктов горения в организм. Для этого необходимо:
Первое, что необходимо сделать при отравлении – прекратить поступление продуктов горения в организм. Для этого необходимо:
- соблюдая безопасность и если имеется такая возможность прекратить поступление токсичного вещества – газа, дыма;
- проветрить помещение или иной объем где находится пострадавший;
- снять загрязнённую одежду;
- при отсутствии противопоказаний перенести пострадавшего в безопасное место.
Острая интоксикация требуют оказания экстренной помощи. Действия при отравлении продуктами горения, следующие:
- вызвать «скорую помощь»;
- при задымлении предусмотреть способы защиты органов дыхания от продуктов горения;
- если есть симптомы раздражения – промыть глаза, полость рта, носа;
- при отсутствии сознания придать пострадавшему горизонтальное положение и обеспечить проходимость дыхательных путей;
- до приезда медицинских специалистов наблюдать за сознанием, дыханием, частотой сердечных сокращений, артериальным давлением;
- если есть признаки терминального состояния, то приступить к сердечно-лёгочной реанимации.
Некоторые ингаляционные отравления продуктами горения имеют период мнимого благополучия. Даже при отсутствии патологических симптомов, стоит внимательно следить за состоянием тех, кто может быть отравлен. При первых же признаках неблагополучия необходимо вызывать соответствующих специалистов.
Отравление продуктами горения у детей развивается быстрее, чем у взрослых. Это объясняется более высоким уровнем кислородного обмена. У малышей появляются жалобы на головную боль, сонливость, слезотечение, тошноту. При осмотре заметны изменения цвета кожи, учащение и затруднение дыхания, нарушения координации. Принципы оказания первой помощи для детей те же, что и для взрослых. При отсутствии специализированной медицинской помощи, пострадавшему ребенку угрожают необратимые изменения центральной нервной системы.
Источник: Пожаровзрывобезопасность веществ и материалов и средства их тушения: Справочник. Баратов А.Н., Корольченко А.Я. –М., 1990.
полное сгорание
Полное сгорание топлива обеспечивается при коэффициенте избытка воздуха 1,02— 1,03, что позволяет повысить КПД теплоагрегата дополнительно на 2 %. [ …]
[ …]
При полном сгорании ,в основном образуются С02 и Н20, а при неполном — НД НСИ, МН3, СоС13 и др. Оптимальную температуру процесса, при которой обнаруживается минимальное количество загрязняющих веществ, определяют практическим путем.[ …]
Для полного сгорания газа очень важно конструктивное оформление факельного устройства. В настоящее время разработано несколько конструкций бездымного факела, обеспечивающих достаточно полное сжигание газа. Наилучшим из них является факел, оборудованный горелкой «Индер».[ …]
После полного сгорания спирта в лампе дополнительно сжигают 2 мл чистого спирта. Через несколько минут после того как горение прекратится, кран к насосу закрывают и раствор переносят в цилиндр. Поглотители и ламповое стекло промывают раствором хлората калия и объем доводят до 20 мл.[ …]
Процесс сгорания полностью заканчивается в пределах вентиляционной шахты, представляющей собой своеобразную топку. Продукты полного сгорания выбрасываются в атмосферу. [ …]
[ …]
Допуская полное сгорание токсичных органических веществ, температура газов за топкой принимается равной 850°—950° С. При составе золы из легкоплавких солей (NasSOi, NaCl2, СаСЬ и т. д.) необходимо выводить ее из топки в расплавленном состоянии. Температура отходящих газов в этом случае принимается на 50—100 град выше температуры плавления золы.[ …]
В ОГ после сгорания «бедных» смесей (а > 1,0), кроме азота М2 и продуктов полного сгорания С02 и Н20, присутствует свободный кислород.[ …]
В результате полного сгорания топлива потребляется 1,5—7,9 кг кислорода воздуха, а выделение СОг (для используемых в настоящее время топлив) составляет порядка 3 кг, воды — 0,8—2,3 кг, азота — 10,4—13,3 кг.[ …]
Для достижения полного сгорания летучих в зону высокой турбулентности подается вторичный воздух (на рисунке не показан). Здесь он интенсивно смешивается с горючими газами, что способствует их дожиганию в расположенном выше реакционном пространстве с температурой 850°С. Продолжительность пребывания газа в печи составляет 5 с (Термические…).[ …]
Продолжительность пребывания газа в печи составляет 5 с (Термические…).[ …]
Важное условие полного сгорания органических отходов в печи — подача достаточного количества воздуха. При его недостатке в атмосферу могут попадать значительные количества оксида углерода. Для обеспечения полной окислительной деструкции большинства органических отходов требуется 5—10% избытка воздуха (1—2% 02).[ …]
Таким образом при сгорании в условиях недостатка кислорода может выделяться большое количество оксида углерода, при этом по сравнению с полным сгоранием уменьшается количество выделяющегося тепла.[ …]
В целях обеспечения полного сгорания продуктов разработанная конструкция установке снабжена автоиоиишн вентиляторами для подачи воздуха непосредственно в аоку горения.[ …]
Двигатель внутреннего сгорания представляет собой пульсирующий химический реактор, предназначенный для преобразования тепловой энергии химической реакции в механическую. Максимальное количество тепла выделяется при полном сгорании топлива. [ …]
[ …]
| З. Зависимость времени полного сгорания коксовых частиц от диаметра и содержания кислорода в реакционной газе. |
Первый выжег не обеспечивает полного сгорания на подсеке всего палового материала. За ним следует второй и т. д., пока не сгорит целиком весь заготовленный для пожога запас. В. Я.), пришед, крестьянин с семейной помощью лес оный зажигает, а потом, перегодя несколько, приходит опять семьянистее, сносит головни в кучи, перерубает и дожигает; и сия черная работа называется прятание новины» . Эта часть работ лосит обычное название «прятания новин»2. «Толстые обгорелые деревья стягиваются в одно место — валы, прячутся, и высевается рожь» 3. П. Н. Третьяков предлагает такое определение «опрятывания»: «Следующим этапом работы является «опрятывание»… «огнища». Неперегорелый материал собирается на «.плешины», складывается в кучи и сжигается» 4.[ …]
В печи при 1000—1200 °С происходит полное сгорание органической части нефтешлама. Если количество нефтепродуктов в нефтешламе менее 20%, то возможно нарушение режима горения, т. е. печь может остановиться. При подаче нефтешлама в остановившуюся печь, температура которой остается еще высокой, может создаться взрывоопасная концентрация испарившихся нефтепродуктов. Для предотвращения возможности взрыва печь оборудуют дежурной форсункой. Форсунка должна быть оборудована автоматическим устройством, увеличивающим расход топлива при падении температуры в печи ниже 750— 800 °С и автоматически прекращающим подачу избыточного топлива, как только температура в печи достигает 900—950 °С.[ …]
Если количество нефтепродуктов в нефтешламе менее 20%, то возможно нарушение режима горения, т. е. печь может остановиться. При подаче нефтешлама в остановившуюся печь, температура которой остается еще высокой, может создаться взрывоопасная концентрация испарившихся нефтепродуктов. Для предотвращения возможности взрыва печь оборудуют дежурной форсункой. Форсунка должна быть оборудована автоматическим устройством, увеличивающим расход топлива при падении температуры в печи ниже 750— 800 °С и автоматически прекращающим подачу избыточного топлива, как только температура в печи достигает 900—950 °С.[ …]
Если вследствие низкой теплоты сгорания отходов или неполного сгорания температура в барабане понижается, то через расположенную сбоку горелку подается дополнительное топливо, что способствует повышению температуры и полному сгоранию отходов.[ …]
При высоких температурах в камерах сгорания процесс са-жеобразования идет настолько быстро, что его невозможно отделить от процесса прогрева газа. В работе В. Ф. Суровкина и П. А. Теснера [68], проведенной с подачей жидких углеводородов в турбулентный поток продуктов полного сгорания, было получено, что время образования сажистых частиц составляет 50 мс. Расчеты, проведенные В. А. Кривандиным [30], показали, что время образования сажистых частиц составляет 7—8 % от времени протекания полного процесса разложения метана.[ …]
В работе В. Ф. Суровкина и П. А. Теснера [68], проведенной с подачей жидких углеводородов в турбулентный поток продуктов полного сгорания, было получено, что время образования сажистых частиц составляет 50 мс. Расчеты, проведенные В. А. Кривандиным [30], показали, что время образования сажистых частиц составляет 7—8 % от времени протекания полного процесса разложения метана.[ …]
В течение всех плавок обеспечивается полное сгорание конвертерных газов. Максимальное содержание окиси углерода в горизонтальном (переходном) газоходе обычно не превышает 0,2—0,5 % об. Эффективность острого дутья оценивается по снижению температуры продуктов сгорания в горизонтальном газоходе на 50—100°С.[ …]
Основными параметрами процесса сгорания являются теплосодержание и теплотворная способность. Наивысшая теплотворная способность — это тепло, высвобожденное при полном сгорании материала. Тепло конденсации паров воды, образующееся при сгорании, включено в значение теплотворной способности. Данные о наивысшей теплотворной способности некоторых компонентов отходов представлены в табл. 2.44 (см. также табл. 2.29).[ …]
2.44 (см. также табл. 2.29).[ …]
В циклонных горелках горючая смесь подается в камеру сгорания тангенциально. Вследствие этого увеличивается время пребывания смеси в камере, что обеспечивает более полное сгорание смеси в более короткой камере. Погружные горелки циклонного типа хорошо зарекомендовали себя в выпарных аппаратах, предназначенных для выпаривания солевых растворов. Получили распространение горелки циклонного типа конструкций ВНИИГа.[ …]
Образование С02, кроме того, возможно за счет окисления СО или полного сгорания СН3ОН и НСОН до С02 и Н2. Содержание в газах С02 в количестве 3,5—4,5% является хорошим показателем хода реакции.[ …]
Исследованы условия сжигания коксовой пыли, рассчитано время полного сгорания пыли в условиях камер дожита, исследована окисляемое ть коксов и температуры их возгорания.[ …]
Осадок из бункера 1 питателем 2 по загрузочной трубе 3 поступает в камеру сгорания 12, в нижней части которой расположена решетка 11. Под действием воздуха, подаваемого из воздухонагревателя 4 по трубе 8, инертный материал, в основном зола, применяемая для передачи тепла сжигаемому материалу, переходит в псевдо-ожиженное состояние. Осадок сточных вод тогда вводится в слой инертного материала. Поступление первичного воздуха в нижнюю часть печи осуществляется через специальное отверстие 10. Для полного сгорания органических продуктов под слой подается по трубе 7 вторичный воздух.[ …]
Осадок сточных вод тогда вводится в слой инертного материала. Поступление первичного воздуха в нижнюю часть печи осуществляется через специальное отверстие 10. Для полного сгорания органических продуктов под слой подается по трубе 7 вторичный воздух.[ …]
Замена природного газа газовоздушной смесью создает благоприятные условия для более полного сгорания газа. Экономия газа при продувке факелов газовоздушной смесью ГПЗ мощностью 15 млрд м3/год составит около 20 млн м’/год.[ …]
Жаропроизводительностью обычно называется максимальная температура горения, развиваемая при полном сгорании топлива без избытка воздуха, т. е. в условиях, когда все выделяющееся при сгорании тепло полностью расходуется на нагрев образующихся продуктов сгорания.[ …]
Газообразное топливо представляет собой наиболее «чистое» органическое топливо, так как при его полном сгорании из токсичных веществ образуются только оксиды азота.[ …]
Абсолютною теплоплопроизводитслъностью топлива называется то количесп теплоты, которое получается при полном сгорании топлива. [ …]
[ …]
При взаимодействии компонентов жидкого ракетного топлива образуются фотохимически малоактивные продукты полного сгорания — диоксид углерода, вода, молекулярный азот и небольшое количество свободных атомов (Н, О, Ы) и радикала гидроксила (ОН), появляющихся вследствие быстрого охлаждения («замораживания») равновесного состава продуктов сгорания при высокой температуре. В выбросах появляются также продукты неполного сгорания — оксид углерода и молекулярный водород. Определить содержание этих продуктов, как и свободных атомов водорода и азота, можно путем термохимических расчетов.[ …]
Отсутствие в печи избытка свободного кислорода достигается подачей воздуха в количестве, недостаточном для полного сгорания топлива; в результате в печи создается восстановительная атмосфера, т. е. образующиеся дымовые газы содержат некоторое количество углеводородов и несгоревших частиц углерода (сажу) и не содержат свободного кислорода.[ …]
Озоноактивными компонентами выхлопных газов являются оксиды азота и в меньшей степени оксид углерода. Продукты полного сгорания — диоксид углерода и вода — являются парниковыми газами.[ …]
Продукты полного сгорания — диоксид углерода и вода — являются парниковыми газами.[ …]
Рабочая масса органического топлива состоит из углерода, водорода, кислорода, азота, серы, влаги и золы. В результате полного сгорания топлива образуются углекислый газ, водяные пары, оксиды серы (сернистый газ, серный ангидрид) и зола. Из перечисленных составляющих к числу токсичных относятся оксиды серы и зола. При высоких температурах в ядре факела топочных камер котлов большой мощности происходит частичное окисление азота воздуха и топлива с образованием оксидов азота (оксид и диоксид азота).[ …]
Самый крупный источник оксида углерода в городах — автотранспорт. В большинстве городов свыше 90% СО попадает в воздух вследствие неполного сгорания углерода в моторном топливе по реакции: 2С + 02 = 2СО. Полное сгорание дает в качестве конечного продукта диоксид углерода: С + 02 = С02.[ …]
Сера питателем 1 подается в печь 6. За счет горячего воздуха, подаваемого под решетку, сера испаряется и сгорает до сернистого газа. Для более полного сгорания над слоем установлена отражательная решетка 4 и дополнительно подается воздух, используемый для охлаждения корпуса печи 6. Донная часть печи имеет конусообразную форму, которая обеспечивает хорошее распределение подводимого воздуха по сечению печи и хорошее периодическое удаление шлама при уменьшении дутья.[ …]
Для более полного сгорания над слоем установлена отражательная решетка 4 и дополнительно подается воздух, используемый для охлаждения корпуса печи 6. Донная часть печи имеет конусообразную форму, которая обеспечивает хорошее распределение подводимого воздуха по сечению печи и хорошее периодическое удаление шлама при уменьшении дутья.[ …]
Для этой цели содержимое перегонной колбы переносят в стакан или коническую колбу, выпаривают до появления паров серной кислоты, добавляют малыми порциями азотную кислоту до полного сгорания обуглившихся частичек фильтра и затем в растворе определяют содержание железа колориметрическим методом.[ …]
Выполнение всех этих мероприятий позволило: обеспечить надежную подачу кубовых отходов; достигнуть качественного и надежного их распыла; стабилизировать топочный процесс при сжигании кубовых отходов отдельно от абгазов; достигнуть полного сгорания на выходе из печи; увеличить производительность печи до 200 кг/час кубовых отходов.[ …]
В последнее время все большее применение для сжигания осадков производственных сточных вод находят печи с псевдоожиженным слоем. Такие печи обладают по сравнению с другими печами рядом конструктивных и эксплуатационных достоинств. Температура газов, отходяших из камеры сгорания эти:-: печей, значительно выше (760-815,б°С), что обеспечивает более быстрое и полное сгорание.[ …]
Такие печи обладают по сравнению с другими печами рядом конструктивных и эксплуатационных достоинств. Температура газов, отходяших из камеры сгорания эти:-: печей, значительно выше (760-815,б°С), что обеспечивает более быстрое и полное сгорание.[ …]
Термическое сжигание. Термическое сжигание применяют для уничтожения высококонцентрированных сточных вод, содержащих минеральные или органические элементы. По этому методу сточные воды вводят в печь сжигания и испаряют при 900—1000 °С. Органические примеси сгорают до продуктов полного сгорания С02, Н20, N02.[ …]
Топливо (мазут) сжигается в газомазутной горелке РГМГ-7, состоящей из ротационной форсунки, вентилятора высокого давления для подачи воздуха и мазутного насоса. Для снижения расхода электроэнергии на распыление мазута вентилятор горелки подает лишь часть воздуха, необходимого для полного сгорания топлива, а остальную часть подает вентилятор низкого давления (дутьевой вентилятор). Продукты сгорания (топочные газы) поступают в смесительную камеру через решетку из шамотного кирпича, улучшающую полноту сгорания топлива и предотвращающую вынос пламени в смесительную камеру. Между наружным и внутренним кожухами топки имеется кольцевой зазор, через который проходит часть воздуха в камеру смешивания вследствие разрежения, создаваемого дымососом (вентилятором), установленным за сушильным барабаном.[ …]
Между наружным и внутренним кожухами топки имеется кольцевой зазор, через который проходит часть воздуха в камеру смешивания вследствие разрежения, создаваемого дымососом (вентилятором), установленным за сушильным барабаном.[ …]
Другим наиболее опасным загрязнителем является оксид углерода — газ, не имеющий цвета и запаха (наши органы чувств не в состоянии его обнаружить). Ранее указывалось, что самым крупным источником оксида углерода является автотранспорт. В большинстве городов свыше 90% оксида углерода в воздух попадает вследствие неполного сгорания углерода в топливе. Если при неполном сгорании углерода образуется оксид углерода, то полное сгорание дает конечный продукт в виде диоксида углерода С02. Большое содержание оксида углерода в атмосфере может привести к смерти от удушья (асфиксии).[ …]
В позднейшее время была предложена новая теория образования сажи. Согласно этой теории, выделение сажи является следствием не избирательного окисления, а разложения газообразных продуктов с выделением угелорода. Такое разложение, по данным этой теории, происходит в результате значительного повышения температуры в зоне горения за счет полного сгорания части газообразных продуктов.[ …]
Такое разложение, по данным этой теории, происходит в результате значительного повышения температуры в зоне горения за счет полного сгорания части газообразных продуктов.[ …]
В Англии запатентован способ использования паров воды для уменьшения токсичности отработанных газов. Вода доводится до кипения в специальном резервуаре с помощью теплообменника, собранного из трубок малого диаметра, присоединенных к выпускному трубопроводу. Образовавшийся пар подается во впускной патрубок карбюратора. Горячие водяные пары способствуют более полному сгоранию топлива и тем самым уменьшают количество углеводорода в отработанных газах. Испытания показали, что присадка водяных паров помогает бороться с детонацией и позволяет даже в двигателях с высокой степенью сжатия успешно использовать низкооктановый неэтилированный бензин без потери мощности.[ …]
По этой и многим другим причинам эксплуатационного характера инжекционные односопловые горелки на многих объектах стали заменяться диффузионными щелевыми горелками, располагаемыми на поду топки, с принудительной подачей воздуха от дутьевого вентилятора. При налаженном топочном режиме , коэффициенте избытка воздуха в топке 1,15—1,20 дутьевые подовые горелки обеспечивали полное сгорание газа и работу котлов с КПД (брутто) 85—87 %. В эксплуатационных условиях потери теплоты [ …]
При налаженном топочном режиме , коэффициенте избытка воздуха в топке 1,15—1,20 дутьевые подовые горелки обеспечивали полное сгорание газа и работу котлов с КПД (брутто) 85—87 %. В эксплуатационных условиях потери теплоты [ …]
Эффективность внедрения методов совместного сжигания газообразного и жидкого топлива в трубчатых печах нефтеперерабатывающей, нефтехимической и газовой промышленности зависит от типа печей, горелочных устройств, их компоновки и условий топливоснабжения. Для современных мощных трубчатых печей с многоярусной компоновкой газомазутных горелок и верхним (или нижним) отводом продуктов сгорания эффект применения совместного сжигания обоих видов топлива путем подачи мазута в горелки нижних ярусов, а газа — в горелки верхних ярусов (или последовательного их чередования) аналогичен эффекту, полученному в котлах при таких же условиях. В этом случае хвостовые части факелов перемешиваются между собой и продукты полного сгорания топливного газа «дожигают» продукты неполного сгорания мазута. В таких печах с увеличением доли топливного газа сокращается значение минимального коэффициента избытка воздуха, обеспечивающего полное выгорание горючих компонентов топлива и максимальное значение КПД агрегата.[ …]
В таких печах с увеличением доли топливного газа сокращается значение минимального коэффициента избытка воздуха, обеспечивающего полное выгорание горючих компонентов топлива и максимальное значение КПД агрегата.[ …]
Метод неотехиометрического сжигания состоит в том, что традиционному равномерному распределению топлива и воздуха по всем горелкам искусственно создается б одних горелках недостаток, а в других избыток воздуха. Единственным развитием этого метода является двухступенчатое сжигание, когда через все горелки подают топливо с недостатком воздуха ([ …]
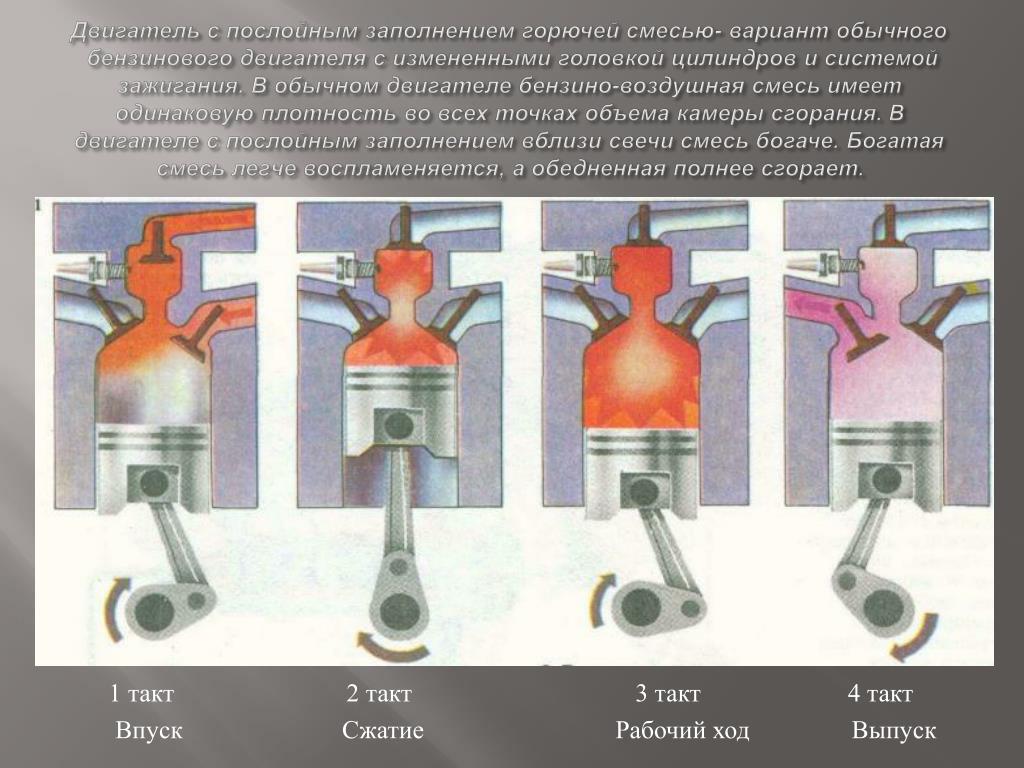
В некоторых двигателях с нижним расположением клапанов интенсификация искрового разряда достигается применением двух свечей зажигания. Одна свеча (передняя) расположена по оси цилиндра, а другая (задняя) — над клапаном; обе свечи работают последовательно, одна за другой. В конце такта сжатия искрообразование происходит сначала в передней свече, мимо которой движется турбулентный поток горючей смеси, перетекающий из цилиндра в камеру сгорания над клапанами. После воспламенения турбулентное движение смеси усиливается вокруг задней свечи, повышается температура в камере сгорания. В этот момент происходит искрообразование в задней свече, расположенной над клапанами, а затем воспламенение несгоревшей части смеси и полнее сгорание. Усовершенствование процесса воспламенения рабочей смеси возможно путем применения многоэлектродных свечей зажигания. Преимуществом такой системы воспламенения является возможность улучшения топливной экономичности и исключения перебоев в воспламенении смеси при разлитых условиях эксплуатации двигателя, а частности при малых нагрузках и на холостом ходу, в случае применения частичной рециркуляции отработавших газов и др.[ …]
После воспламенения турбулентное движение смеси усиливается вокруг задней свечи, повышается температура в камере сгорания. В этот момент происходит искрообразование в задней свече, расположенной над клапанами, а затем воспламенение несгоревшей части смеси и полнее сгорание. Усовершенствование процесса воспламенения рабочей смеси возможно путем применения многоэлектродных свечей зажигания. Преимуществом такой системы воспламенения является возможность улучшения топливной экономичности и исключения перебоев в воспламенении смеси при разлитых условиях эксплуатации двигателя, а частности при малых нагрузках и на холостом ходу, в случае применения частичной рециркуляции отработавших газов и др.[ …]
Существенной составляющей загрязнения воздушной среды городов, особенно крупных, являются выхлопные газы автотранспорта, которые в ряде столиц мира, административных центрах России и стран СНГ, городах-курортах составляют 60-80% от общих выбросов. Многие страны, в том числе и Россия, принимают различные меры по снижению токсичности выбросов, путем лучшей очистки бензина, замены его на более чистые источники энергии (газовое топливо, этанол, электричество), снижения свинца в добавках к бензину. Проектируются более экономичные двигатели с более полным сгоранием горючего, создание в городах зон с ограниченным движением автомобилей и др. Несмотря на принимаемые меры, из года в год растет число автомобилей и загрязнение воздуха не снижается.[ …]
Проектируются более экономичные двигатели с более полным сгоранием горючего, создание в городах зон с ограниченным движением автомобилей и др. Несмотря на принимаемые меры, из года в год растет число автомобилей и загрязнение воздуха не снижается.[ …]
Установки огневого обезвреживания отходов, применяющиеся в химической промышленности, различаются, е освовном, устройством аппарата ожигания. Конструкция этих аппаратов определяется прежде всего агрегатным состоянием отходов. Для ожигания газообразных выбросов часто используются наиболее простые устройства — вертикальные факельные трубы. В верхней части факельной трубы постоянно поддерживается очаг горения благодаря небольшой форсунке, куда специально подается топливо. Газовые отходы ого-, раит над верхней частью фекальной ттубн непосредственно в атмосфере. Для лучшего перемешивания и полного сгорания подается водяной пар. Факельные тюбы проектируются о большим запасом производительности и, как правило, используются дяя ликвидации аварийных выбросов. В таких случаях производительность их достигает огромных величин. Так, на пиролизных установках 31-300 аварийный оброс составляет до 1,5 тыс.т в час и высота факела может достигать 60 №. Во избежание аварии нельзя допускать подсоо воздуха в трубу в попадание жидкого горючего продукта. Недостатками факельных устройств являйся неполнота горения, особенно при максимальных пров знодитеявностях, в невозможность обезвреживания газовых отходов, содержащих в значительных количествах гете-роетомвые соединения.[ …]
В таких случаях производительность их достигает огромных величин. Так, на пиролизных установках 31-300 аварийный оброс составляет до 1,5 тыс.т в час и высота факела может достигать 60 №. Во избежание аварии нельзя допускать подсоо воздуха в трубу в попадание жидкого горючего продукта. Недостатками факельных устройств являйся неполнота горения, особенно при максимальных пров знодитеявностях, в невозможность обезвреживания газовых отходов, содержащих в значительных количествах гете-роетомвые соединения.[ …]
При разработке мер по сокращению отдельных выбросов на практике часто прибегают к их сжиганию. На НПЗ, например, сжигают отходящие газы, неорганизованные выбросы паров углеводородов, дурнопахнущие вещества, окисленный воздух от битумных установок, сероводород. При сжигании вместо одних загрязнителей появляются другие, которые могут оказаться более токсичными. Например, при сжигании углеводородов выделяются непредельные углеводороды, оксид углерода, оксиды азота, технический углерод, диоксид серы, сероводород, сероуглерод, синильная кислота и др. Следовательно, сжигать выбросы необходимо только в том случае, когда вновь образующиеся вещества менее токсичны и загрязняют атмосферный воздух меньше, чем исходные. При сжигании топлив необходимо использовать высокоэффективное оборудование, спроектированное с учетом современной теории горения топлив, которая за последние годы получила новое развитие в работах советских и зарубежных исследователей. Однако на многих НПЗ до сих пор для этих целей используют примитивные факельные устройства и печи, не обеспечивающие полного сгорания и минимального содержания вредных примесей в отходящих дымовых газах.[ …]
Следовательно, сжигать выбросы необходимо только в том случае, когда вновь образующиеся вещества менее токсичны и загрязняют атмосферный воздух меньше, чем исходные. При сжигании топлив необходимо использовать высокоэффективное оборудование, спроектированное с учетом современной теории горения топлив, которая за последние годы получила новое развитие в работах советских и зарубежных исследователей. Однако на многих НПЗ до сих пор для этих целей используют примитивные факельные устройства и печи, не обеспечивающие полного сгорания и минимального содержания вредных примесей в отходящих дымовых газах.[ …]
Горение — Энциклопедия Нового Света
Реакция горения, происходящая при поджигании спички.
Горение, или горение, представляет собой сложную последовательность экзотермических химических реакций между топливом и окислителем, сопровождающихся выделением тепла или одновременно тепла и света в форме свечения или пламени.
В реакции полного сгорания соединение реагирует с окисляющим элементом, таким как кислород или фтор, и продукты реакции представляют собой соединения каждого элемента в топливе с окисляющим элементом. Например:
- CH 4 + 2O 2 → CO 2 + 2H 2 O + тепло
- CH 2 S + 6F 2 → CF 4 + 2HF + SF 6 + heat
Более простой пример можно увидеть в сгорании водорода и кислорода, которое обычно используется в ракетных двигателях:
- 2H 2 + O 2 → 2H 2 O + heat
The result is simply water vapor.
В подавляющем большинстве случаев сжигания в реальном мире окислитель кислород (O 2 ) получают из окружающего воздуха, а образующиеся в результате сжигания дымовые газы содержат азот:
- СН 4 + 2O 2 + 7.52N 2 → CO 2 + 2H 2 O + 7.52N 2 + heat
Как можно видеть, когда воздух является источником кислорода, азот составляет большую часть образующихся дымовых газов.
Содержимое
- 1 Типы
- 1.1 Рапид
- 1.
 2 Медленно
2 Медленно - 1.3 Полный
- 1,4 турбулентный
- 1.5 Неполный
- 1,6 Тлеющий
- 2 Сжигание с другими окислителями
- 3 Химическое уравнение
- 4 Топливо
- 4.1 Жидкое топливо
- 4.2 Твердое топливо
- 5 Температура
- 6 Анализ
- 7 Нестабильность
- 8 Каталожные номера
- 9 кредитов
На самом деле процессы горения никогда не бывают совершенными или полными. В дымовых газах от сжигания углерода (например, при сжигании угля) или соединений углерода (например, при сжигании углеводородов, древесины и т. д.) будет присутствовать как несгоревший углерод (в виде сажи), так и соединения углерода (CO и другие). Кроме того, когда воздух является окислителем, некоторое количество азота будет окисляться до различных, в основном вредных, оксидов азота (NO х ).
Типы
Быстрое
Быстрое горение – это форма горения, при которой выделяется большое количество тепловой и световой энергии, что часто приводит к пожару. Это используется в таких машинах, как двигатели внутреннего сгорания и в термобарическом оружии.
Это используется в таких машинах, как двигатели внутреннего сгорания и в термобарическом оружии.
Горение – реакция двойного замещения. С другой стороны, химическая реакция — это реакция одиночного замещения.
Медленное
Медленное горение – это форма горения, происходящая при низких температурах. Дыхание является примером медленного горения.
Complete
При полном сгорании реагент сгорает в кислороде с образованием ограниченного количества продуктов. Когда углеводород сгорает в кислороде, в результате реакции образуются только углекислый газ и вода. При горении углеводорода или любого другого топлива на воздухе в состав продуктов сгорания также будет входить азот. При сжигании таких элементов, как углерод, азот, сера и железо, образуются наиболее распространенные оксиды. Углерод даст углекислый газ. Азот даст диоксид азота. Сера даст диоксид серы. Железо даст оксид железа (III). Следует отметить, что полного сгорания добиться практически невозможно. В действительности, когда фактические реакции горения приходят в равновесие, будет присутствовать широкий спектр основных и второстепенных частиц. Например, при сгорании метана в воздухе помимо основных продуктов, таких как двуокись углерода и вода, образуются второстепенные продукты, в том числе окись углерода, гидроксил, оксиды азота, одноатомный водород и одноатомный кислород.
В действительности, когда фактические реакции горения приходят в равновесие, будет присутствовать широкий спектр основных и второстепенных частиц. Например, при сгорании метана в воздухе помимо основных продуктов, таких как двуокись углерода и вода, образуются второстепенные продукты, в том числе окись углерода, гидроксил, оксиды азота, одноатомный водород и одноатомный кислород.
Турбулентное
Турбулентное горение – это горение, характеризующееся турбулентными потоками. Он чаще всего используется в промышленности (например, в газовых турбинах, дизельных двигателях и т. д.), поскольку турбулентность способствует процессу смешивания топлива и окислителя.
Неполное
Неполное сгорание происходит, когда кислорода недостаточно, чтобы позволить топливу (обычно углеводороду) полностью прореагировать с кислородом с образованием углекислого газа и воды, а также когда сгорание гасится теплоотводом, таким как твердая поверхность или пламегаситель. Когда углеводород горит на воздухе, в результате реакции образуется двуокись углерода, вода, окись углерода, чистый углерод (сажа или зола) и различные другие соединения, такие как оксиды азота. Неполное сгорание встречается гораздо чаще и приводит к образованию большого количества побочных продуктов, а в случае сжигания топлива в автомобилях эти побочные продукты могут быть весьма вредными для здоровья и наносить ущерб окружающей среде.
Неполное сгорание встречается гораздо чаще и приводит к образованию большого количества побочных продуктов, а в случае сжигания топлива в автомобилях эти побочные продукты могут быть весьма вредными для здоровья и наносить ущерб окружающей среде.
Качество сгорания можно улучшить за счет конструкции устройств сгорания, таких как горелки и двигатели внутреннего сгорания. Дальнейшие улучшения достигаются за счет каталитических устройств дожигания (таких как каталитические нейтрализаторы). Такие устройства требуются в соответствии с природоохранным законодательством для автомобилей в большинстве стран и могут быть необходимы в крупных устройствах сгорания, таких как тепловые электростанции, для достижения установленных норм выбросов.
Тление
Тление – это беспламенная форма горения, получающая тепло от гетерогенных реакций, происходящих на поверхности твердого топлива при нагревании в
0005 окислительная среда . Принципиальное различие между тлением и пламенным горением заключается в том, что при тлении окисление реагентов происходит на поверхности твердого тела, а не в газовой фазе. Характерная температура и тепло, выделяющееся при тлении, малы по сравнению с таковыми при пламенном горении твердого тела. Типичные значения при тлении составляют около 600°C для пиковой температуры и 5 кДж/г-O 2 для выделяемого тепла; типичные значения во время горения составляют около 1500°C и 13 кДж/г-O 2 соответственно. Эти характеристики приводят к тому, что тление распространяется с низкой скоростью, обычно около 0,1 мм/с, что примерно на два порядка ниже скорости распространения пламени по твердому телу. Несмотря на слабые характеристики горения, тление представляет значительную пожароопасность.
Характерная температура и тепло, выделяющееся при тлении, малы по сравнению с таковыми при пламенном горении твердого тела. Типичные значения при тлении составляют около 600°C для пиковой температуры и 5 кДж/г-O 2 для выделяемого тепла; типичные значения во время горения составляют около 1500°C и 13 кДж/г-O 2 соответственно. Эти характеристики приводят к тому, что тление распространяется с низкой скоростью, обычно около 0,1 мм/с, что примерно на два порядка ниже скорости распространения пламени по твердому телу. Несмотря на слабые характеристики горения, тление представляет значительную пожароопасность.
Горение с другими окислителями
В качестве окислителя можно предположить кислород, когда речь идет о горении, но существуют и другие окислители. Закись азота используется в ракетах и в автоспорте; он производит кислород при температуре более 1300 ° C. Фтор, еще один окисляющий элемент, может вызывать реакцию горения с образованием фторированных продуктов (а не оксидов). Например, смеси газообразного фтора и метана взрывоопасны, как и смеси кислорода и метана. Трифторид хлора является сильным фторирующим агентом, который воспламеняет топливо быстрее, чем кислород.
Например, смеси газообразного фтора и метана взрывоопасны, как и смеси кислорода и метана. Трифторид хлора является сильным фторирующим агентом, который воспламеняет топливо быстрее, чем кислород.
Химическое уравнение
Обычно химическое уравнение стехиометрического сжигания углеводорода в кислороде выглядит следующим образом:
- CxHy+(x+y4)O2→xCO2+(y2)h3O{\displaystyle C_{x}H_{y}+\left(x+{\frac {y}{4}}\right)O_{2}\ rightarrow \;xCO_{2}+\left({\frac {y}{2}}\right)H_{2}O}
Например, сжигание пропана:
- C3H8+5O2→3CO2+4h3O{\displaystyle C_{3}H_{8}+5O_{2}\rightarrow \;3CO_{2}+4H_{2}O}
Уравнение простого слова для горение углеводорода в кислороде это:
- Топливо + Кислород → Тепло + Вода + Углерод \ диоксид углерода {\ displaystyle {\ textrm {Fuel}} + {\ textrm {Oxygen}} \ rightarrow \; {\ textrm {Heat}} + {\ textrm {Water} }+{\textrm {Углерод\двуокись}}}
Если горение происходит с использованием воздуха в качестве источника кислорода, соответствующие уравнения выглядят так:
- CxHy + (x + y4) O2 + 3,76 (x + y4) N2 → xCO2 + (y2) h3O + 3,76 (x + y4) N2 {\ displaystyle C_ {x} H_ {y} + \ left (x + {\ frac {y}{4}}\right)O_{2}+3,76\left(x+{\frac {y}{4}}\right)N_{2}\rightarrow \;xCO_{2}+\left( {\ frac {y} {2}} \ right) H_ {2} O + 3,76 \ left (x + {\ frac {y} {4}} \ right) N_ {2}}
Например, сжигание пропана:
- C3H8 + 5O2 + 18,8N2 → 3CO2 + 4h3O + 18,8N2 {\ displaystyle C_ {3} H_ {8} + 5O_ {2} + 18,8 N_ {2} \ rightarrow \; 3CO_ {2} + 4H_ {2 }O+18.
 8N_{2}}
8N_{2}}
Уравнение простого слова для горения углеводорода в воздухе:
- Топливо + Воздух → Тепло + Вода + Углерод \ диоксид + Азот {\ displaystyle {\ textrm {Fuel}} + {\ textrm {Air}} \ rightarrow \; {\ textrm {Heat}} + {\ textrm { Вода}}+{\textrm {Углерод \ диоксид}}+{\textrm {Азот}}}
Топливо
Жидкое топливо
Горение жидкого топлива в окислительной атмосфере фактически происходит в газовой фазе. Горит пар, а не жидкость. Следовательно, жидкость обычно загорается только при температуре выше определенной температуры, точки воспламенения. Температура вспышки жидкого топлива – это самая низкая температура, при которой оно может образовать горючую смесь с воздухом. Это также минимальная температура, при которой в воздухе достаточно испарившегося топлива для начала горения.
Твердое топливо
Акт горения состоит из трех относительно различных, но перекрывающихся фаз:
- Фаза предварительного нагрева, , когда несгоревшее топливо нагревается до температуры вспышки, а затем до точки воспламенения.
 Горючие газы начинают выделяться в процессе, аналогичном сухой перегонке.
Горючие газы начинают выделяться в процессе, аналогичном сухой перегонке. - Фаза перегонки или газообразная фаза, при воспламенении смеси выделяющихся горючих газов с кислородом. Энергия производится в виде тепла и света. Пламя часто видно. Теплопередача от горения к твердому телу поддерживает выделение легковоспламеняющихся паров.
- Древесно-угольная фаза или твердая фаза, когда выход горючих газов из материала слишком низок для постоянного присутствия пламени и обугленное топливо больше не горит быстро, а только тлеет, а затем только тлеет.
Температура
Предполагая идеальные условия сгорания, такие как полное сгорание в адиабатических условиях (т. е. без потери или притока тепла), можно определить адиабатическую температуру сгорания. Формула, которая дает эту температуру, основана на первом законе термодинамики и учитывает тот факт, что теплота сгорания полностью используется для нагревания топлива, воздуха для горения или кислорода и газов продуктов сгорания (обычно называемых дымовые газы ).
В случае сжигания ископаемого топлива на воздухе температура горения зависит от
- Теплота сгорания
- Стехиометрическое соотношение воздуха и топлива λ{\displaystyle {\lambda}}
- Теплоемкость топлива и воздуха
- Температура воздуха и топлива на входе
Адиабатическая температура горения (также известная как адиабатическая температура пламени ) увеличивается при более высоких значениях теплотворной способности и температуре воздуха на входе и топлива, а также при приближении стехиометрического соотношения воздуха к единице.
Чаще всего адиабатические температуры горения угля составляют около 2200°C (для воздуха и топлива на входе при температуре окружающей среды и для λ=1,0{\displaystyle \lambda =1,0}), около 2150°C для нефти и 2000°C для природного газа.
В промышленных нагревателях, парогенераторах электростанций и крупных газовых турбинах более распространенным способом выражения использования воздуха для горения сверх стехиометрического является -процентный избыток воздуха для горения . Например, 15-процентный избыток воздуха для горения означает, что используется на 15 процентов больше требуемого стехиометрического количества воздуха.
Например, 15-процентный избыток воздуха для горения означает, что используется на 15 процентов больше требуемого стехиометрического количества воздуха.
Анализ
В этом разделе представлен анализ горения для нескольких типичных видов топлива (углерод, водород, сера, уголь, нефть и газ), когда топливо взаимодействует с воздухом при стехиометрических условиях.
В представленном анализе горения и топливо, и воздух находятся при условиях горения на входе 298 K и абсолютном давлении 1 атм. Кроме того, сгорание происходит полностью и без потерь тепла.
При сгорании большое количество химической энергии реагентов выделяется в виде тепловой энергии.
Энтальпия сгорания (HHV или более высокая теплотворная способность) представляет собой разницу между значением энтальпии реагентов и значением энтальпии продуктов сгорания при эталонной температуре, которая составляет 298 K.
При равенстве значения энтальпии реагентов значению энтальпии продуктов сгорания можно рассчитать адиабатическую температуру пламени продуктов сгорания.
График на рисунке 1 показывает изменение значения энтальпии реагентов и продуктов сгорания при повышении температуры.
Физические свойства как реагентов, так и продуктов сгорания очень важны, и их необходимо знать для проведения успешных расчетов сгорания.
График на рис. 2 показывает, как значения энтальпии реагентов и продуктов сгорания изменяются в зависимости от температуры. Физические свойства, представленные на этом графике, взяты из таблиц JANAF Thermochemical Data-Tables, 1970.
Рисунок 2: Реагенты и продукты сгорания энтальпия в зависимости от температуры
Интересно отметить, что значение энтальпии для основных элементов горения, таких как углерод (C), водород (H), сера (S), кислород (O) и азот (N), равно нулю при условиях горения 298 К и 1 атм.
Также следует отметить, что для идеального газа значение энтальпии зависит только от температуры.
В дополнение к знанию физических свойств реагентов и продуктов сгорания, для любого анализа и расчетов горения важно знать составы топлива и окислителя.
Для твердого и жидкого топлива топливные композиции даны в пересчете на единицу массы. В этом анализе CH 4 является единственным рассматриваемым газовым топливом. Для того чтобы сделать анализ горения простым и понятным, состав CH 4 указан в пересчете на массу. Состав окислителя обычно указывается в моль/объем.
В таблице 1 представлены некоторые составы топлива:
| Топливо | С | Ч | С | с.ш. | О | Н 2 О | CH 4 |
|---|---|---|---|---|---|---|---|
| Углерод | 1.000 | 0,000 | 0,000 | 0,000 | 0,000 | 0,000 | — |
| Водород | 0,000 | 1.000 | 0,000 | 0,000 | 0,000 | 0,000 | — |
| Сера | 0,000 | 0,000 | 1. 000 000 | 0,000 | 0,000 | 0,000 | — |
| Уголь | 0,780 | 0,050 | 0,030 | 0,040 | 0,080 | 0,020 | — |
| Масло | 0,860 | 0,140 | 0,000 | 0,000 | 0,000 | 0,000 | — |
| Топливный газ | — | — | — | — | — | — | 1.000 |
В таблице 2 указан состав воздуха:
| Окислитель | Н кг/кг | О кг/кг | Н 2 моль/моль | О 2 моль/моль |
|---|---|---|---|---|
| Воздух | 0,767 | 0,233 | 0,790 | 0,210 |
Опять же, в этом анализе горения анализируется только стехиометрическое горение. Приведены результаты такого анализа, в том числе состав продуктов сгорания по массе и моль/объем, адиабатическая температура пламени, стехиометрическое соотношение и высшая теплотворная способность топлива (ВТТ).
Приведены результаты такого анализа, в том числе состав продуктов сгорания по массе и моль/объем, адиабатическая температура пламени, стехиометрическое соотношение и высшая теплотворная способность топлива (ВТТ).
В таблице 3 представлен весовой состав продуктов сгорания:
| Топливо | СО 2 | Н 2 О | SO 2 | Н 2 | O 2 |
|---|---|---|---|---|---|
| Углерод | 0,295 | 0,000 | 0,000 | 0,705 | 0,000 |
| Водород | 0,000 | 0,255 | 0,000 | 0,745 | 0,000 |
| Сера | 0,000 | 0,000 | 0,378 | 0,622 | 0,000 |
| Уголь | 0,249 | 0,041 | 0,005 | 0,705 | 0,000 |
| Масло | 0,203 | 0,079 | 0,000 | 0,718 | 0,000 |
| Топливный газ | 0,151 | 0,124 | 0,000 | 0,725 | 0,000 |
В таблице 4 представлен состав продуктов сгорания в объемном или мольном выражении:
| Топливо | СО 2 | Н 2 О | SO 2 | Н 2 | О 2 |
|---|---|---|---|---|---|
| Углерод | 0,210 | 0,000 | 0,000 | 0,790 | 0,000 |
| Водород | 0,000 | 0,347 | 0,000 | 0,653 | 0,000 |
| Сера | 0,000 | 0,000 | 0,210 | 0,789 | 0,000 |
| Уголь | 0,170 | 0,068 | 0,002 | 0,759 | 0,000 |
| Масло | 0,133 | 0,127 | 0,000 | 0,740 | 0,000 |
| Топливный газ | 0,095 | 0,190 | 0,000 | 0,715 | 0,000 |
При рассмотрении угля, нефти и газа в качестве топлива уголь имеет наибольшее количество CO 2 в продуктах сгорания как по весу, так и по молям.
В таблице 5 приведены адиабатическая температура пламени горения, стехиометрическое соотношение и высшая теплотворная способность топлива:
| Топливо | Адиабатический Температура пламени (K) | Стехиометрическое соотношение (см. примечание ниже) | ВТС (кДж/кг) |
|---|---|---|---|
| Углерод | 2 460 | 11.444 | 32 779,8 |
| Водород | 2 525 | 34.333 | 141 866,8 |
| Сера | 1 972 | 4,292 | 9 261,3 |
| Уголь | 2 484 | 10.487 | 32 937,9 |
| Масло | 2 484 | 14.580 | 47 630,0 |
| Топливный газ | 2 327 | 17.167 | 50 151,2 |
Примечание: Стехиометрическое соотношение – это масса воздуха, необходимая для полного сгорания единицы массы топлива. Таким образом, для полного идеального сгорания 1 кг углеродного топлива требуется 11,444 кг воздуха. Таким образом, для полного идеального сгорания 1 кг углеродного топлива требуется 11,444 кг воздуха. | |||
Сегодня глобальное потепление становится все более очевидным, и говорят, что оно в первую очередь вызвано выбросами CO 2 . Детальный анализ сгорания, как он представлен здесь, может быть очень полезен при определении различных сценариев топлива и технологий, которые приведут к сокращению текущих выбросов CO 2 .
Нестабильности
Нестабильности горения обычно представляют собой резкие колебания давления в камере сгорания. Эти колебания давления могут достигать 180 дБ, а длительное воздействие этих циклических давлений и тепловых нагрузок сокращает срок службы компонентов двигателя. В ракетах, таких как F1, используемых в программе Saturn V, нестабильность приводила к массивным повреждениям камеры сгорания и окружающих компонентов. Эта проблема была решена путем изменения конструкции топливной форсунки. В жидкостных реактивных двигателях размер и распределение капель можно использовать для ослабления нестабильности. Нестабильность горения является серьезной проблемой в наземных газотурбинных двигателях из-за выбросов NOx. Тенденция состоит в том, чтобы работать на обедненной смеси с коэффициентом эквивалентности менее 1, чтобы снизить температуру сгорания и, таким образом, уменьшить выбросы NOx; однако работа камеры сгорания на обедненной смеси делает ее очень восприимчивой к нестабильности сгорания.
Нестабильность горения является серьезной проблемой в наземных газотурбинных двигателях из-за выбросов NOx. Тенденция состоит в том, чтобы работать на обедненной смеси с коэффициентом эквивалентности менее 1, чтобы снизить температуру сгорания и, таким образом, уменьшить выбросы NOx; однако работа камеры сгорания на обедненной смеси делает ее очень восприимчивой к нестабильности сгорания.
Критерий Рэлея является основой для анализа термоакустической нестабильности горения и оценивается с использованием индекса Рэлея в течение одного цикла нестабильности.
- G (x) = 1T ∫ Tq ‘(x, t) p’ (x, t) dt {\ displaystyle G (x) = {\ frac {1} {T}} \ int _ {T} q ‘(x,t)p'(x,t)dt}
Когда колебания тепловыделения совпадают по фазе с колебаниями давления, индекс Рэлея положителен и величина термоакустической неустойчивости увеличивается. Соответственно, если индекс Рэлея отрицателен, возникает термоакустическое демпфирование. Критерий Рэлея подразумевает, что термоакустической нестабильностью можно оптимально управлять, если колебания тепловыделения на 180 градусов не совпадают по фазе с колебаниями давления на той же частоте. Это минимизирует индекс Рэлея.
Это минимизирует индекс Рэлея.
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Чанг, Рэймонд. 2006. Химия . Нью-Йорк: Макгроу-Хилл. ISBN 0073221031
- Коттон, Ф. Альберт и Джеффри Уилкинсон. 1988. Высшая неорганическая химия . Нью-Йорк: Уайли. ISBN 0471849979
- Куо, Кеннет Куан-юн. 2005. Принципы сжигания . Хобокен, Нью-Джерси: Джон Уайли. ISBN 0471046892
- Turns, Stephen R. 2000. An Introduction to Combustion . Нью-Йорк: Макгроу-Хилл. ISBN 0071169105
- Варнац, Дж., У. Маас и Р. В. Диббл. 2006. Горение: физико-химические основы, моделирование и симуляция, эксперименты, образование загрязняющих веществ. Берлин: Springer. ISBN 3540259929
Авторы
Энциклопедия Нового Света авторы и редакторы переписали и дополнили статью в Википедии в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3. 0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Кредит должен соответствовать условиям этой лицензии, которая может ссылаться как на New World Encyclopedia участников и самоотверженных добровольных участников Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Кредит должен соответствовать условиям этой лицензии, которая может ссылаться как на New World Encyclopedia участников и самоотверженных добровольных участников Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
- Возгорание история
История этой статьи с момента ее импорта в New World Encyclopedia :
- История «Горения»
Примечание. На использование отдельных изображений, которые лицензируются отдельно, могут распространяться некоторые ограничения.
Пропан неполное + полное сгорание
- администратор
- Последнее обновление: 14 октября 2022 г.
Полное сгорание пропана (СНГ) имеет важное значение. Полное сгорание сжиженного нефтяного газа экономит ваши деньги на газе.

Уравнение пропана для полного сгорания пропана включает пропан и кислород в качестве входного топлива, а также двуокись углерода, воду, тепло и, возможно, монооксид углерода в качестве выходов. Полное сгорание сжиженного нефтяного газа – пропана – дает около 25 МДж/л или 49МДж/кг тепла.
Неполное сгорание приводит к образованию угарного газа, который является ядовитым газом.
Узнайте, что вам нужно сделать…
При сжигании сжиженного нефтяного газа образуется угарный газ – Выделяется ли сжиженный нефтяной газ угарный газ
Приборы, работающие на природном газе или пропане (СНГ), могут выделять угарный газ при сгорании с неполным сгоранием. Правильно работающие газовые приборы производят мало угарного газа, если вообще производят его.
Неполное и полное сгорание пропана
Пропан – сжиженный нефтяной газ – горит в пределах своей воспламеняемости.
Нижний и верхний пределы воспламеняемости – это процентное содержание СНГ в смеси СНГ/воздух.
Это означает, что от 2,15% до 9,6% от общего количества смеси LPG/воздух должен составлять LPG, чтобы смесь была горючей.
Однако оптимальной смесью является 4% LPG/воздух.
Итак, 4 части сжиженного нефтяного газа (пропана) на 96 частей воздуха.
При полном сгорании пропана горелка дает голубое пламя мощностью около 25 МДж/л или 49МДж/кг тепла.
Таким образом, более богатые смеси, близкие к 9,6%, скорее всего, будут страдать от неполного сгорания.
Желтое пламя, сажа и чрезмерная конденсация являются тремя физическими признаками неполного сгорания.
Природный газ – метан – пределы воспламенения разные, от 5,4% до 17%.
Оптимальная горючая смесь для метана тоже другая, примерно 10,42%.
Уравнение полного сгорания пропана – формула сгорания для сжиженного нефтяного газа
При полном сгорании пропана в присутствии достаточного количества кислорода пропан сгорает с образованием водяного пара и двуокиси углерода, а также с выделением около 25 МДж/л или 49 МДж/кг тепла. Итак, это уравнение полного сгорания пропана как в словах, так и в химических формулах:
Итак, это уравнение полного сгорания пропана как в словах, так и в химических формулах:
Пропан + Кислород → Углекислый газ + Вода + Теплота (около 25 МДж/л или 49 МДж/кг)
C 3 H8 + 5 O 2 → 3 CO 2 + 4 H 2 O + Нагрев
Уравнение неполного сгорания пропана-СНГ
Уравнение неполного сгорания пропана: 2 C3H8 + 9 O2 → 4 CO2 + 2 CO + 8 h3O + Тепло.
Если кислорода недостаточно для полного сгорания, происходит неполное сгорание.
Результатом неполного сгорания снова являются водяной пар, углекислый газ и тепло.
Но он также производит окись углерода.
Уравнение неполного сгорания пропан-СНГ словами и символами
Газ + Кислород = Вода + Двуокись углерода + Окись углерода + Тепло
2 C 3 H 8 + 9 O 2 → 4 CO 2 + 2 CO + 14 01 H 900
При неполном сгорании образуется угарный газ
Угарный газ – CO – является токсичным газом.
Приборы, работающие на природном или пропановом (СНГ), могут выделять угарный газ с неполным сгоранием.
Правильно функционирующие газовые приборы производят мало угарного газа, если вообще производят его.
Горение и угарный газ (СО) – продукты, образующиеся при сжигании СНГ
Продукты, образующиеся при сжигании СНГ в газовых приборах, бытовых и промышленных, представляют собой водяной пар, двуокись углерода и тепло, а также обычно очень небольшие количества Монооксид углерода.
При правильной установке и обслуживании работа газового прибора обеспечивает быстрое и эффективное отопление, приготовление пищи, горячую воду и многое другое, а продукты горения не создают опасных ситуаций.
Если прибор неправильно установлен и не обслуживается или был модифицирован, продукты сгорания могут измениться и стать опасными для людей, находящихся рядом с прибором.
Такая простая вещь, как изменение вентиляции (подача свежего воздуха в прибор для поддержания полного сгорания), может привести к неисправности газового прибора и создать опасную ситуацию для окружающих.
Иногда неисправность газового прибора очевидна.
Копоть, красное или желтое пламя или плохая работа являются индикаторами, но иногда индикаторы отсутствуют.
Если угарный газ (CO) образуется и попадает из прибора в окружающий воздух, это не будет заметно (без запаха и вкуса), но будет очень опасным.
Очень важно, чтобы газовые приборы правильно устанавливались и обслуживались каждые два года, чтобы обеспечить хорошее сгорание и безопасную и эффективную работу.
А как насчет этилмеркаптана?
Этилмеркаптан — отдушка, добавляемая в сжиженный нефтяной газ в целях безопасности.
При сгорании этилмеркаптана на воздухе образуются CO 2 , H 2 0 и SO 2 .
SO 2 является раздражающим соединением, неприятным в большинстве концентраций. Это часть городского смога.
Образование других сульфидов маловероятно.
Незначительные количества этилмеркаптана присутствуют в парах сжиженного нефтяного газа при сгорании.
Таким образом, количество образующихся продуктов ничтожно мало по сравнению с общим количеством продуктов сгорания.
Техническое обслуживание газовых приборов
Надлежащее техническое обслуживание помогает обеспечить надлежащее сгорание и минимальное образование CO.
Большинство производителей газового оборудования рекомендуют плановое техническое обслуживание каждые 12 или 24 месяца.
Зависит от производителя и модели устройства.
Важно, чтобы ваши газовые приборы обслуживались только квалифицированными специалистами.
В большинстве случаев это лицензированный газовщик или заводской техник.
Основными предупреждающими знаками того, что вашему газовому прибору требуется обслуживание, являются желтое или красное пламя, пламя с желтым горящим кончиком.
Желтая/коричневая сажа, перегорание контрольных ламп, едкий запах и раздражение глаз также являются признаками.
Исключение составляют газовые камины и дровяные камины с желтым пламенем.
Вышеуказанные признаки могут свидетельствовать о неполном сгорании.
В результате вы можете тратить газ и/или производить окись углерода.
Последнее представляет собой серьезную проблему безопасности, если это происходит с бытовым прибором.
Если вы наблюдаете какие-либо из этих предупреждающих знаков, вам следует как можно скорее запланировать обслуживание.
Использование одобренных приборов и газовых установщиков
В Австралии действуют одни из самых строгих стандартов в отношении выбросов при сжигании газовых приборов.
Это делает наши внутренние газовые обогреватели очень безопасными в использовании.
Основными опасными газами являются CO (моноксид углерода) и NO X (оксид азота и диоксид азота).
Эти газы могут образовываться при сгорании.
Внутренние газовые обогреватели должны соответствовать или превосходить эти строгие стандарты для сертификации в Австралии.
Покупайте или используйте только проверенные, сертифицированные и маркированные в Австралии газовые приборы.
Другие страны имеют свои собственные системы сертификации.
Убедитесь, что лицензированный газовый установщик устанавливает ваши газовые приборы и что у вас есть надлежащая вентиляция.
Наконец, при использовании газовых приборов всегда читайте инструкции производителя и следуйте им.
Не используйте наружные газовые обогреватели в помещении
Те же требования не применяются к наружным обогревателям и бытовым приборам.
Предназначены для использования вне помещений при неограниченной вентиляции. Таким образом, они не обязаны соответствовать стандартам выбросов внутренних обогревателей.
Сюда входят обогреватели, барбекю, печи для пиццы и все другие бытовые приборы.
Если газовый прибор помечен только для использования вне помещений, не используйте его в помещении. Сюда входят полузакрытые помещения без надлежащей вентиляции.
Никогда не используйте открытый газовый прибор в помещении.
Обнаружение угарного газа
Угарный газ не имеет цвета, запаха и вкуса.
CO немного менее плотный, чем воздух, поэтому он поднимается вверх.
Он токсичен при концентрации выше примерно 35 частей на миллион.
Смертельно через 30 минут при 4000 частей на миллион. Оно падает до 5 минут при 5000 ppm.
Симптомы отравления угарным газом включают:
- Головные боли
- Тошнота
- Головокружение
- Одышка
- Головокружение и потеря сознания
Немедленно прекратите использование газового прибора при появлении любого из этих симптомов.
Переместитесь в место, где вы можете дышать свежим воздухом и обратиться за медицинской помощью.
Если вы чувствуете запах газа, это не угарный газ, а одорант, добавленный в природный газ или сжиженный нефтяной газ.
Вам следует немедленно разобраться с утечкой газа.
Выключите газ и проветрите комнату, если это безопасно.
Лучший способ обнаружения угарного газа – это детектор CO.
Вы можете купить их в хозяйственных магазинах, а также в интернет-магазинах.
