1.1 Условия работы аккумуляторной батареи на электропоезде. Проектирование участка ТР-2 мотор-вагонного депо
Похожие главы из других работ:
Горизонтальный шламовый насос
1.5 .Предельные условия работы
Можно указать некоторые конструкции сальников, которые могут эффективно использоваться в максимально тяжелых условиях без значительной переделки насоса…
Изготовления чашки дифференциала левая автомобиля ЗИЛ 5301
1.1 Условия работы детали
Чашка дифференциала левая автомобиля ЗИЛ 5301 — корпусная деталь, входящая в состав дифференциала заднего моста. Выполняет функции буфера, предотвращающие проскальзывание колес автомобиля при повороте…
Модернизация привода сталкивателя блюмов
4.15 Условия работы
Температура наружного воздуха: Минимальная рабочая температура = -10 °С, максимальная рабочая температура = 50 °С…
Приводы путевых машин
2.
 2.1 Условия работы СУ
2.1 Условия работы СУПри разработке СУ необходимо обеспечить: — последовательность начала и окончания работы механизмов: выдвижение — опускание — установка в рабочее положение — включение/выключение РО — выдвижение плит из под шпал — подъем — перевод в транспортное…
Проектирование маршрутного технологического процесса сборки изделия
1.2 Служебное назначение изделия, принцип работы узла и условия обеспечения нормальной работы
Механический клапан предназначен для автоматических установок, распыляющих смазочно-охлаждающие жидкости. Принцип работы. Клапан состоит из корпуса, разделенного на две полости, в одну из которых подается сжатый воздух…
Проектирование предварительно напряженной панели перекрытия
1.3 Условия работы
Сборный железобетонный резервуар можно применять на всей территории России, в районах с температурой наружного воздуха не ниже минус 40°С и расчетной сейсмичностью не выше 7 баллов. Строительство возможно на площадках, как с сухими грунтами. ..
..
Проектирование участка ТР-2 мотор-вагонного депо
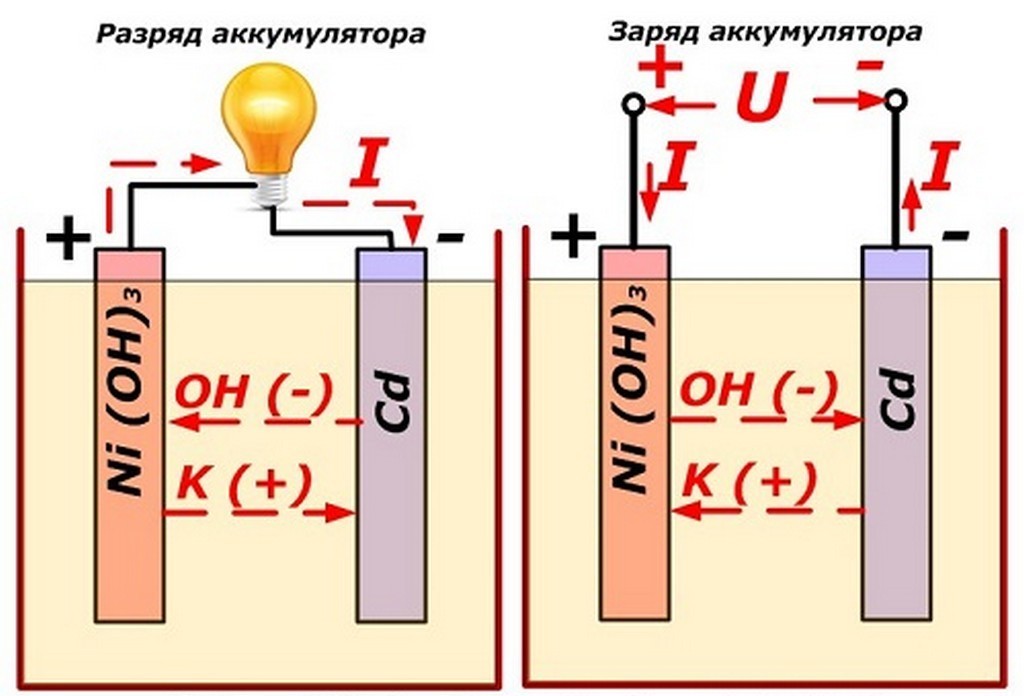
1.2 Основные неисправности аккумуляторной батареи электропоезда, их причина и способы предупреждения
При правильной эксплуатации и тщательном уходе щелочные аккумуляторы работают длительное время без снижения емкости. Чаще всего неисправность щелочных аккумуляторов связана с потерей емкости…
Проектирование участка ТР-2 мотор-вагонного депо
1.3 Общие требования к объему работ по ремонту аккумуляторной батареи 42НК-125
Согласно правилам ремонта ЭПС текущий ремонт ТР-2 аккумуляторной батареи 42НК-125 выполняется в следующей последовательности и с выполнением соответствующих правил и требований: — аккумуляторные батареи снять с электровоза для ремонта; -…
Проектирование участка ТР-2 мотор-вагонного депо
1.4 Ведомость объема работ по ремонту деталей аккумуляторной батареи
Объем работ по ремонту деталей аккумуляторной батареи представлен в таблице 2.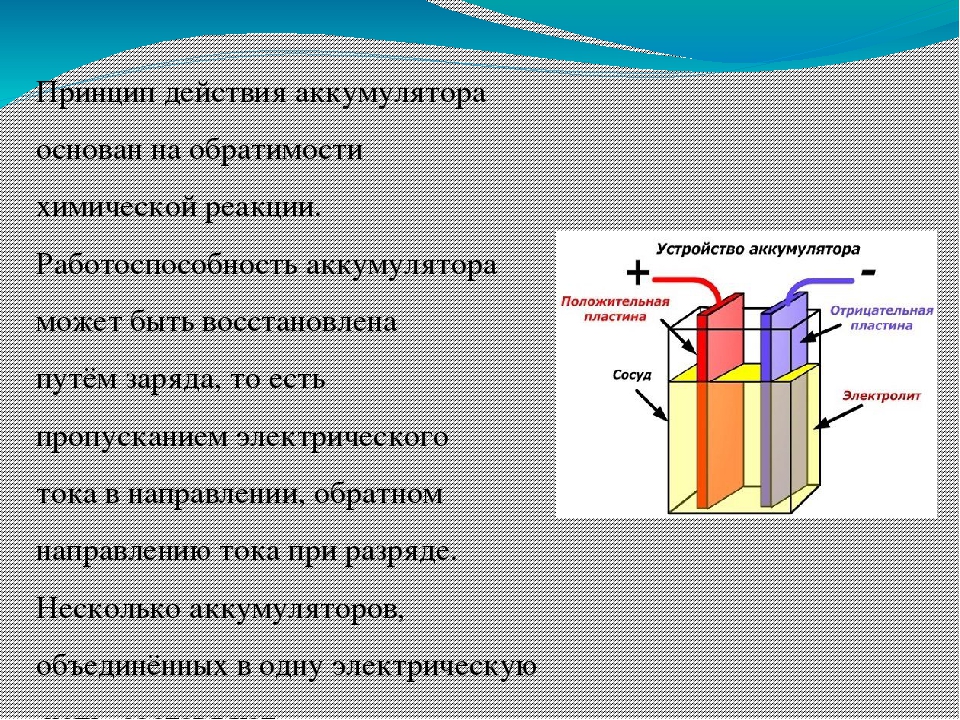 ..
..
Проектирование участка ТР-2 мотор-вагонного депо
1.7 Организация рабочего места и техника безопасности при ремонте аккумуляторной батареи
В настоящее время все виды текущего ремонта локомотивов производятся в депо. Для этого в депо организованы соответствующие отделения. Помещение для приготовления электролитов должно состоять из двух самостоятельных…
Разработка технологического процесса детали «Шатун»
1.2 Условия работы
При работе шатуны подвержены действию значительных знакопеременных рабочих нагрузок и сил инерции. Для этого шатун должен обладать достаточной прочностью и жесткостью при наименьшей возможной массе…
Схема управления лебёдкой левого зонда
2. УСЛОВИЯ РАБОТЫ УСТАНОВКИ
В системе загрузки доменной печи большое количество механизмов связано между собой условиями технологического процесса. Автоматическая система загрузки должна обеспечивать работу этих механизмов в строго определенной последовательности. ..
..
Технология изготовления сварного узла строительной фермы
1.2 Условия работы конструкции
стропильный ферма сварочный электродуговой Нагрузка на ферму передается, как правило, через узлы, благодаря чему уголки фермы подвергаются только осевым воздействиям, что позволяет более полно использовать материал…
Технология струйной цементации грунтов
3.1 Назначение и условия его работы
Гидрофицированный буровой станок для вращательного и ударно-вращательного бурения предназначен для проведения вертикальных и наклонных скважин, при усилении и реконструкции фундаментов зданий, сооружение свайных фундаментов, опор и др…
Узел компрессора ТРДД для пассажирского самолета
2.2 Условия работы лопаток
При работе газотурбинного двигателя на рабочие лопатки действуют статические, динамические и температурные нагрузки, вызывая сложную картину напряжений. Расчет на прочность пера лопатки выполняем.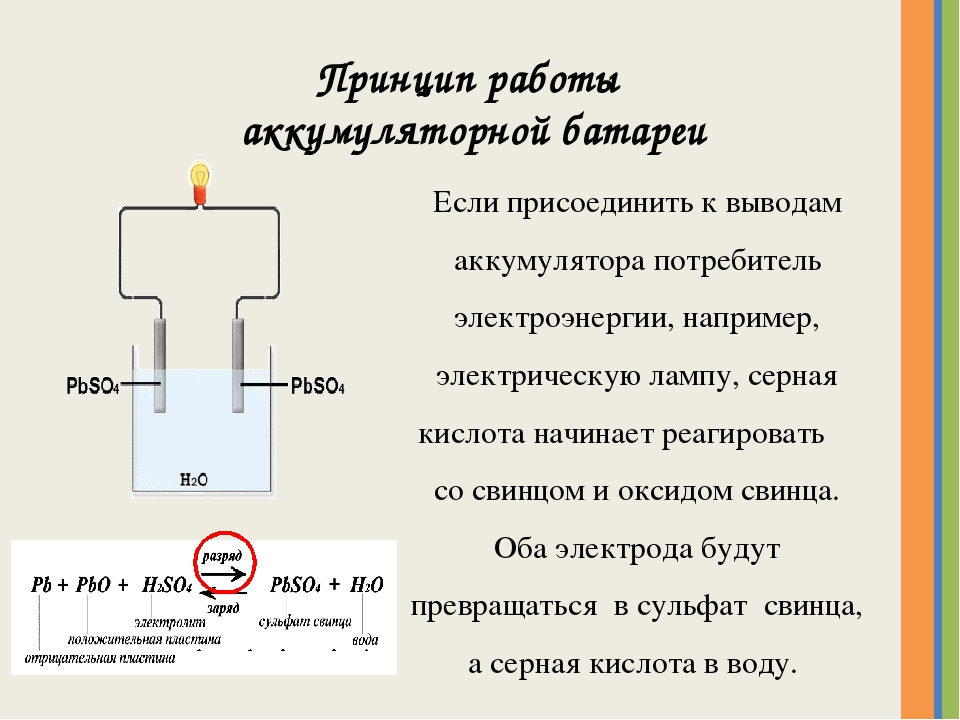 ..
..
Устройство автомобильного аккумулятора. Характеристики и принцип работы.
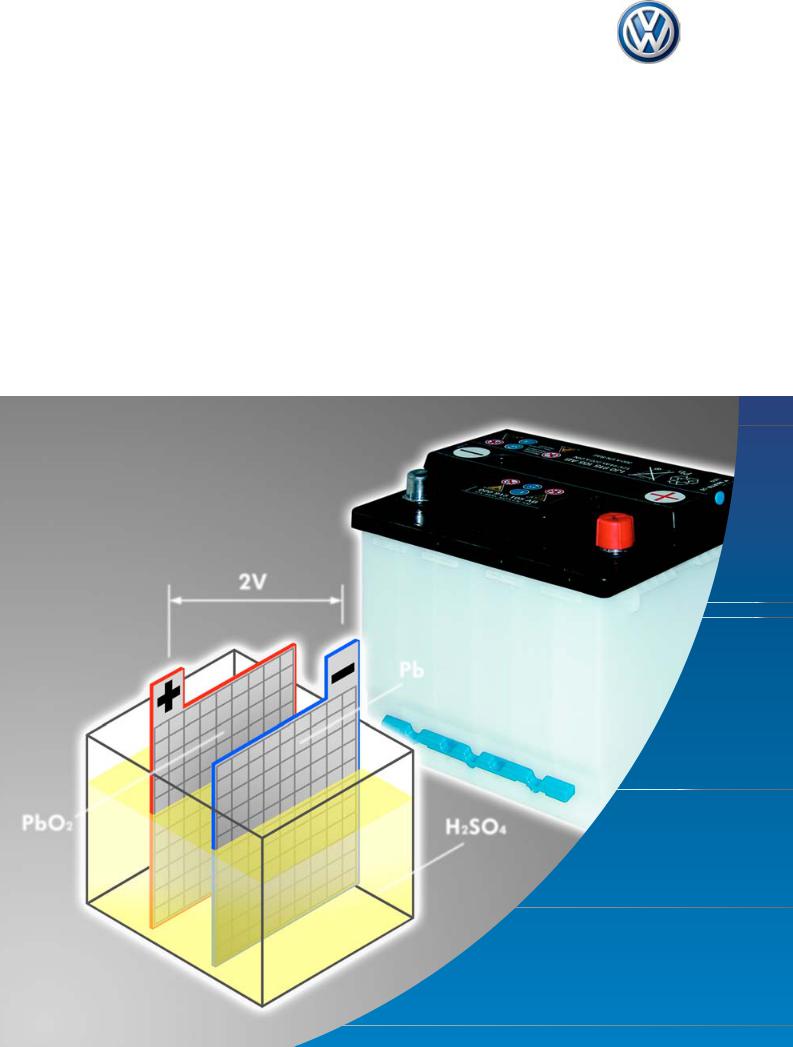
Стандартный автомобильный аккумулятор состоит из шести 2-вольтовых элементов, что дает на выходе 12 вольт. Каждый элемент состоит из свинцовых решетчатых пластин, покрытых активным веществом и погруженных в электролит. Отрицательные пластины покрыты мелкопористым свинцом, а положительные двуокисью свинца.
Когда к АКБ подключают нагрузку, активное вещество вступает в химическую реакцию с сернокислотным электролитом, вырабатывая электрический ток. На пластинах при этом осаждается сульфат свинца, и электролит, соответственно, истощается. При зарядке эта реакция проходит в обратном направлении, и способность аккумулятора давать ток восстанавливается. То есть принцип работы аккумуляторных батарей основывается на химических реакциях между свинцом и диоксидом свинца в сернокислотной среде, в результате которых вырабатывается электричество.
Показатели АКБ
Наиболее существенными у автомобильных аккумуляторов являются четыре следующих показателя:
- Емкость, выраженная в ампер-часах.
 Она характеризует способность АКБ давать определенный ток в течение некоторого времени. Например, ёмкость 40 ампер-час означает, что аккумулятор может давать ток в 1 ампер в течение 40 часов (или в 2 ампера в течение 20 часов и т.д.).
Она характеризует способность АКБ давать определенный ток в течение некоторого времени. Например, ёмкость 40 ампер-час означает, что аккумулятор может давать ток в 1 ампер в течение 40 часов (или в 2 ампера в течение 20 часов и т.д.). - Характеристики стартовых токов, что наиболее востребовано у европейских марок автомобилей и позволяет завести машину при любых погодных условиях (высокие показатели тока холодной прокрутки).
- Резервная емкость. Этот параметр показывает интервал времени (в минутах), в течение которого аккумулятор способен давать ток 25 А (т.е. в течение какого времени он сможет подменять собой вышедший из строя генератор).
- Габаритные размеры, полярность. Для определения полярности на выводных клеммах аккумулятора проставляют знаки «+» и «-». При установке аккумуляторной батареи на автомобиль отрицательную клемму присоединяют к «массе», а положительную — в цепь.
Свинцово-кислотный аккумулятор, кроме видимой части, а это корпус аккумулятора, крышка, клеммы, индикатор заряда, имеет сложную внутреннюю конструкцию.
Сепараторы предохраняют пластины (решётки) от соприкосновения друг с другом. Если будет соприкосновение разноименных пластин, произойдет короткое замыкание и аккумулятор не будет действовать. Сепараторы, не допуская короткого замыкания, в тоже время должны пропускать ток через электролит. Материалом для сепараторов служит, как правило, микропористая пластмасса.
Электроды погружены в химическое вещество электролит, состоящий из разбавленной дистиллированной водой серной кислоты (h3SO4). При разряжении аккумулятора активно расходуется серная кислота, в результате чего образуется вода. С образованием воды, общая плотность электролита снижается.
При зарядке аккумуляторной батареи, все происходит в обратном порядке. Вода «используется» на создание серной кислоты, соответственно общая плотность электролита повышается.
Электроды или решетки, изготавливаются из свинцовых сплавов. Эти сплавы содержат в себе такие компоненты, как сурьма, кальций, олово, наделяющие сплав определенными свойствами, и защищающие свинец от коррозии. Состав сплава свинца, а также форма решетки электрода, значительно влияют на характеристику батареи, например, мощность кислотно-свинцового аккумулятора или пусковой ток аккумулятора. Решетка заполнена активной пастой, которую изготавливают из свинцово-оксидного порошка. Состав свинцово-оксидного порошка и свойства пасты влияют на свойства аккумулятора
Корпус аккумулятора обычно изготавливают из ударопрочного, термостойкого пропилена.
Режимы работы аккумуляторных батарей: буферный и циклический
Режимы работы аккумуляторных батарей: буферный и циклический
Качественная и долговечная работа аккумуляторной батареи это не только положительный экономический эффект для владельца, но и приятная составляющая эксплуатации. Согласитесь, отказ в работе аккумуляторной батареи в первые 2-3 года эксплуатации и отказ работы батареи на 7-10 году эксплуатации вызывают противоположные эмоции.
Согласитесь, отказ в работе аккумуляторной батареи в первые 2-3 года эксплуатации и отказ работы батареи на 7-10 году эксплуатации вызывают противоположные эмоции.
Важными эксплуатационными характеристиками являются: температурный режим работы (+10..+25 град.Цельсия) и правильно выбранный режим эксплуатации и подобранный под этот режим работы метод заряда. Стоит отметить, что мы разберем варианты и режимы работы аккумуляторных батарей, которые применяются в ИБП, а в следующей статье разберем как правильно зарядить аккумуляторы в ИБП. Аккумуляторы для ИБП это, как правило, свинцово- кислотные необслуживаемые и герметичные, производятся по основным двум технологиям: AGM и GEL (гелевый аккумулятор для ИБП).
Чем определяется долговечность работы аккумуляторной батареи?
Общеизвестным фактом и логичным подтверждением является следующее: срок службы аккумулятора в основном определяется количеством процедур заряд-разряд и его глубина разряда. Другими словами: чем реже мы проводим процедуру разряда аккумулятора и чем менее глубоким этот разряд является – тем дольше прослужит аккумулятор.
Среди утвердившихся у пользователей мифов встречается такой: необходимо периодически разряжать аккумулятор «до нуля» и зарядить его до 100%, в противном случае он испортится. Для аккумуляторных батарей среднего и высшего класса – это останется мифом, а для аккумуляторов низкого качества – этот миф станет инструкцией по эксплуатации. В низкокачественных аккумуляторах отсутствие встряски в виде глубокого разряда и полной зарядки – действительно может повлиять на ресурс его работы. В дешевых аккумуляторах применяются материалы низкого качества (например, свинец-вторсырье) и возникающие в аккумуляторе, из-за этого, внутренние окисления (налет) необходимо каким-то образом убирать. В противовес дешевым, — качественные аккумуляторы нуждаются в постоянном подзаряде (буферный заряд) при котором почти отсутствуют глубокие разряды.
Мы не можем обойти тему «эффекта памяти» в аккумуляторных батареях. Суть эффекта памяти состоит в уменьшении емкости аккумулятора. Потеря емкости в таких аккумуляторах происходит вследствие неполного разряда и последующей зарядки до 100% — аккумулятор «запоминает» уровень неполного разряда и ниже этого «не хочет» разряжаться .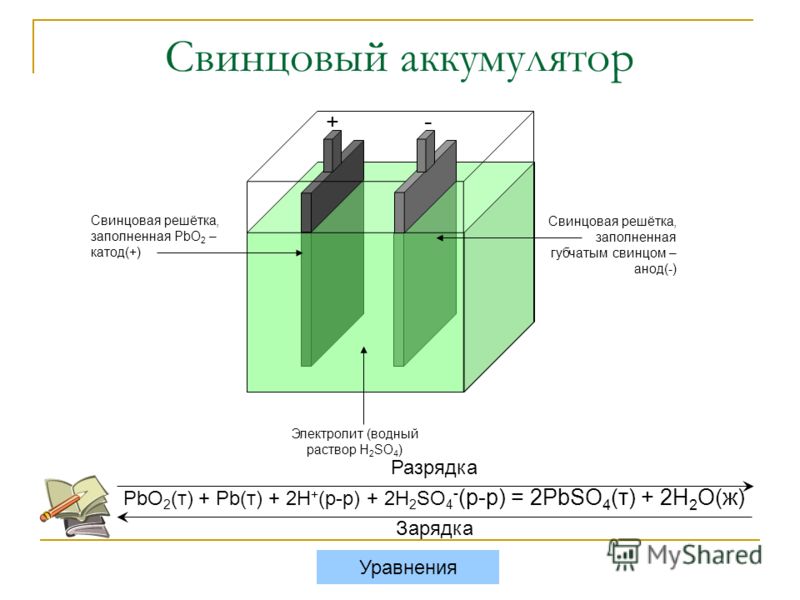 Считается, что если «потренировать» аккумулятор методом глубокой разрядки и полной зарядки – емкость частично можно восстановить. Этот эффект может возникать в аккумуляторах изготовленных по нескольким технологиям и полностью отсутствует в аккумуляторных батареях, которые применяются в ИБП. Эффект памяти свойственен аккумуляторам производимым по технологии Никель-металл-гидридный (Ni-MH), Никель-кадмиевый (NiCd), Серебряно-цинковый аккумулятор.
Считается, что если «потренировать» аккумулятор методом глубокой разрядки и полной зарядки – емкость частично можно восстановить. Этот эффект может возникать в аккумуляторах изготовленных по нескольким технологиям и полностью отсутствует в аккумуляторных батареях, которые применяются в ИБП. Эффект памяти свойственен аккумуляторам производимым по технологии Никель-металл-гидридный (Ni-MH), Никель-кадмиевый (NiCd), Серебряно-цинковый аккумулятор.
Теперь рассмотрим два режима работы аккумуляторов – буферный и циклический, а также как правильно осуществлять зарядку аккумуляторов в этих режимах.
Работа аккумуляторных батарей в буферном режиме
Буферный режим работы аккумуляторной батареи подразумевает периодический несистемный характер использования. Другими словами – в этом режиме аккумуляторы применяются в аварийных случаях, например в ИБП. В буферном режиме аккумуляторная батарея постоянно подзаряжается специально установленным зарядным напряжением и током и в таком режиме эксплуатации может проработать весь заявленный производителем срок, а иногда и больше. Для буферного режима работы подходят аккумуляторы с небольшим параметром цикличности заряд-разряд, и эти аккумуляторы немного дешевле чем высокоцикличные .
Для буферного режима работы подходят аккумуляторы с небольшим параметром цикличности заряд-разряд, и эти аккумуляторы немного дешевле чем высокоцикличные .
Циклический режим работы аккумуляторной батареи
Циклический режим работы – режим, когда с четкой периодичностью аккумулятор подвергается полному заряду и полному разряду. Примерами такого режима работы являются: электротранспорт, поломоечные машины, электропогрузчики, альтернативная энергетика – все те отрасли, где аккумуляторные батареи имеют постоянную периодичность использования. Циклический режим использования аккумуляторных батарей является для них самым жестким испытанием на прочность. Поэтому перед тем как купить аккумуляторную батарею желательно узнать режим ее работы.
© Материал подготовлен специалистами компании НТС-групп (ТМ Электрокапризам-НЕТ!), 2019год
| Об аккумуляторной батарее “InfoLITHIUM”
Об аккумуляторной батарее “InfoLITHIUM”
Эта видеокамера работает только с аккумуляторными батареями “InfoLITHIUM” серии V.
Что представляет собой аккумуляторная батарея “InfoLITHIUM”?
-
Аккумуляторная батарея “InfoLITHIUM” – это литиево-ионная аккумуляторная батарея с функциями передачи данных, относящихся к условиям эксплуатации, между видеокамерой и адаптером переменного тока/зарядным устройством (продается отдельно).
-
Потребление энергии аккумуляторной батареи “InfoLITHIUM” рассчитывается с учетом условий эксплуатации видеокамеры; оставшееся время работы от батареи отображается в минутах.
Зарядка аккумуляторной батареи
-
Рекомендуется выполнять зарядку аккумуляторной батареи при температуре окружающей среды от 10 ˚C до 30 ˚C, пока не погаснет индикатор POWER/CHG (зарядка). При температуре, выходящей за пределы указанного диапазона, зарядка аккумуляторной батареи может выполняться неэффективно.
Эффективное использование аккумуляторной батареи
-
При температуре окружающей среды 10 ˚C и ниже рабочие характеристики аккумуляторной батареи ухудшаются, что приводит к сокращению времени работы от аккумуляторной батареи.
 Если это происходит, для более длительного использования аккумуляторной батареи рекомендуется выполнить следующие действия:
Если это происходит, для более длительного использования аккумуляторной батареи рекомендуется выполнить следующие действия:
-
Нагрейте аккумуляторную батарею, положив ее в карман, и установите ее на видеокамеру непосредственно перед началом съемки.
-
Частое использование экрана LCD или функций воспроизведения, быстрого перемещения вперед или назад приводит к ускорению разрядки аккумуляторной батареи.
-
Если видеокамера не используется для записи или воспроизведения, закрывайте экран LCD. Аккумуляторная батарея также разряжается, если видеокамера находится в режиме ожидания записи или если установлена пауза воспроизведения.
-
Держите при себе запасные заряженные аккумуляторные батареи, обеспечивающие время записи, в 2 или 3 раза превышающее ожидаемое время записи, и перед началом реальной записи выполняйте пробную запись.
Об индикаторе оставшегося времени работы от батареи
-
Если питание отключается несмотря на то, что индикатор оставшегося времени работы аккумуляторной батареи показывает достаточный уровень заряда для работы видеокамеры, снова полностью зарядите аккумуляторную батарею.
 Оставшееся время работы от батареи будет отображаться правильно. Однако правильная индикация заряда батареи может не восстановиться в случае длительной работы видеокамеры от аккумуляторной батареи при высокой температуре, длительного хранения аккумуляторной батареи в полностью заряженном состоянии, частого использования аккумуляторной батареи. Индикатор оставшегося время работы от батареи обеспечивает только приблизительную оценку.
Оставшееся время работы от батареи будет отображаться правильно. Однако правильная индикация заряда батареи может не восстановиться в случае длительной работы видеокамеры от аккумуляторной батареи при высокой температуре, длительного хранения аккумуляторной батареи в полностью заряженном состоянии, частого использования аккумуляторной батареи. Индикатор оставшегося время работы от батареи обеспечивает только приблизительную оценку.
-
В зависимости от условий эксплуатации или окружающей температуры значок , который показывает низкий заряд батареи, может начать вспыхивать даже если остается заряд на 20 минут работы.
О хранении аккумуляторной батареи
-
Если аккумуляторная батарея не используется в течение длительного времени, один раз в год полностью заряжайте ее и используйте в видеокамере для поддержания ее нормальной работы. Храните аккумуляторную батарею отключенной от видеокамеры в сухом прохладном месте.
О сроке службы батареи
-
С течением времени и в процессе эксплуатации емкость аккумуляторной батареи постепенно снижается. Если интервал времени между зарядками становится коротким, возможно, аккумуляторная батарея нуждается в замене.
-
Срок службы аккумуляторной батареи зависит от условий ее хранения, эксплуатации, а также от условий окружающей среды.
«Аккумуляторная компания» — Автомобильные аккумуляторы в Новосибирске оптом и в розницу
Здравствуйте!
Мы рады приветствовать Вас на сайте ООО «Аккумуляторная компания» и выражаем Вам глубокую благодарность за посещение нашего сайта.
В нашей компании Вы можете найти большой выбор аккумуляторных батарей отечественных и зарубежных производителей для автомобилей (стартерные аккумуляторные батареи), мотоциклов, электро-погрузчиков (тяговые аккумуляторные батареи), тепловозов и другой техники.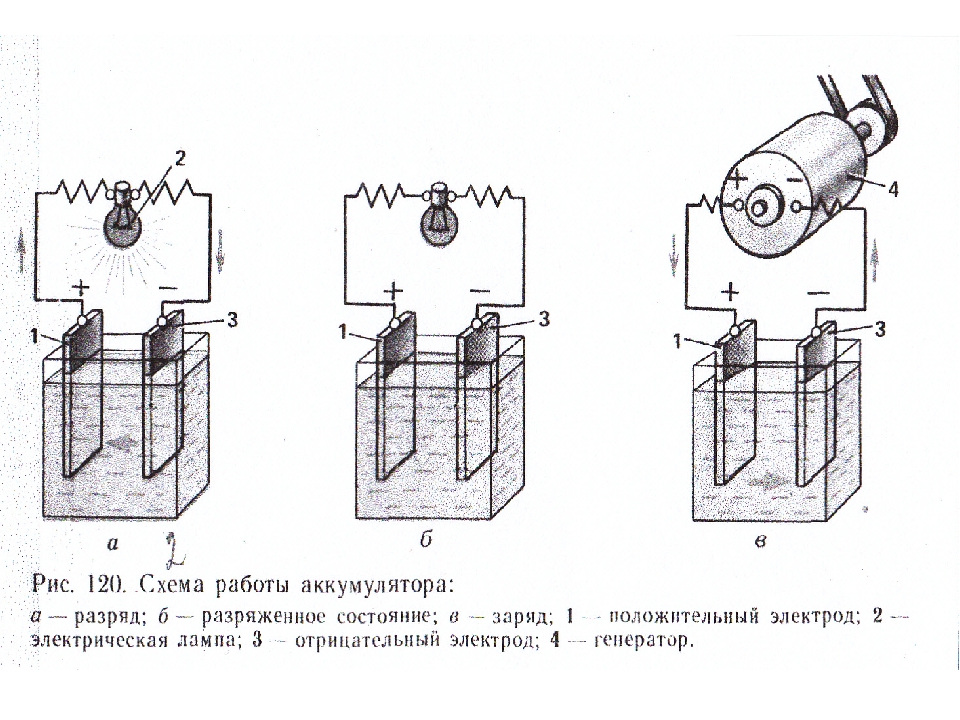
Мы предлагаем Вам аккумуляторные батареи только официальных брендов заводов-производителей как из недорогого сегмента, так и аккумуляторы премиум класса. Мы вместе с производителем отвечаем за качество нашего товара. Мы не продаем частные марки. Наша цель не «впарить» аккумулятор, не заработать на нем как можно больше. Наша цель — помочь Вам правильно подобрать батарею для Вашего автомобиля, помочь решить возникающие в процессе эксплуатации аккумулятора проблемы.
У нас Вы можете приобрести аккумуляторные батареи следующих марок:
TUYMEN BATTERY (ОАО «Тюменский Аккумуляторный Завод»), «Эльф», Start Plus (ЗАО «Эльф» г. Тюмень), TUBOR (ООО «TUBOR», г. Нижний Новгород), Solite (Ю.Корея),TAB (Словения), Mutlu (Турция), AFA, Varta (компания CLARIOS) и др.
Наши сотрудники готовы оказать Вам высококвалифицированную помощь в подборе аккумуляторной батареи для Вашего автомобиля.
Приобретая аккумуляторную батарею в «Аккумуляторной компании», Вы получите бесплатное гарантийное обслуживание аккумулятора в нашей компании и гарантию на любой аккумулятор 12 месяцев.
Старый аккумулятор Вы можете сдать нам (причем в любом количестве) и получить за него приятную скидку при покупке нового аккумулятора.
ООО «Аккумуляторная компания» работает и с оптовыми покупателями, и с корпоративными клиентами. К каждому партнеру у нас индивидуальный подход, доступные и конкурентоспособные цены.
Добро пожаловать к нам за качеством аккумуляторных батарей, приятными ценами и хорошим настроением!
Давайте работать вместе!
Работа — аккумуляторная батарея — Большая Энциклопедия Нефти и Газа, статья, страница 2
Работа — аккумуляторная батарея
Cтраница 2
При работе аккумуляторной батареи в режиме постоянного подзаряда и напряжении подзаряда ( 2 20 0 05) В на элемент при исправных аккумуляторах теоретически не должно быть газовыделения. Но так как практически в батарее всегда есть элементы с той или иной степенью сульфатации ( в особенности концевые элементы), то даже при правильном поддержании уровня напряжения подзаряда имеется слабое газовыделение. При слишком высоком напряжении подзаряда, а также при загрязнении электролита некоторыми примесями газовыделение усиливается. Поэтому вентиляция должна периодически включаться для удаления газов и кислотных паров.
[16]
При слишком высоком напряжении подзаряда, а также при загрязнении электролита некоторыми примесями газовыделение усиливается. Поэтому вентиляция должна периодически включаться для удаления газов и кислотных паров.
[16]
При работе аккумуляторной батареи с коммутатором к концу ее разрядки не все аккумуляторы окажутся одинаково разряженными, причем слабее разрядятся элементы, вводимые в работу последними — к концу разрядки. Поэтому эти крайние элементы кажутся при зарядке быстрее заряженными, что потребует для продолжения зарядки всей батареи их отключения при помощи элементного коммутатора. [17]
При работе аккумуляторной батареи с коммутатором к концу ее разрядки не все аккумуляторы окажутся одинаково разряженными, причем слабее разрядятся элементы, вводимые в работу последними — к концу разрядки. Поэтому эти крайние элементы окажутся при зарядке быстрее заряженными, что потребует для продолжения зарядки всей батареи их отключения при помощи элементного коммутатора. [18]
[18]
Важной особенностью работы аккумуляторной батареи зимой является то, что с понижением температуры электролита уменьшается емкость батареи и падает напряжение на ее клеммах. Это объясняется увеличением вязкости электролита, в результате чего замедляются электрохимические процессы, происходящие в аккумуляторе, возрастает удельное электрическое сопротивление электролита и ухудшается проникновение его в поры активной массы пластин. [19]
Рассмотренные режимы работы аккумуляторной батареи и генератора являются наиболее важными, так как только при них производится зарядка частично или полностью разряженной батареи. Эти режимы являются определяющими и при выборе мощности генератора, при расчете зарядного баланса и при определении регулировочных параметров реле-регулятора. В процессе движения автомобиля полученное батареей во время зарядки количество электричества должно полностью компенсировать количество электричества, которое израсходовано для пуска двигателя, питания потребителей на малых частотах вращения коленчатого вала двигателя и при кратковременном включении потребителей большой мощности. [20]
[20]
Важной особенностью работы аккумуляторной батареи зимой является то, что с понижением температуры электролита уменьшается емкость батареи и падает напряжение на ее клеммах. Для устранения этого аккумуляторную батарею помещают в специальные утепленные ящики. [21]
Существенно ухудшаются условия работы аккумуляторной батареи зимой. При низких температурах окружающей среды снижаются не только характеристики батареи в разрядных режимах, но и значительно снижается интенсивность ее подзаряда. [22]
Для повседневного контроля работы аккумуляторной батареи ведется журнал. [23]
Если по условиям работы аккумуляторной батареи она будет постоянно или периодически разряжаться токами большой величины, то выбранный тип аккумулятора необходимо проверить на максимальный допустимый разрядный ток.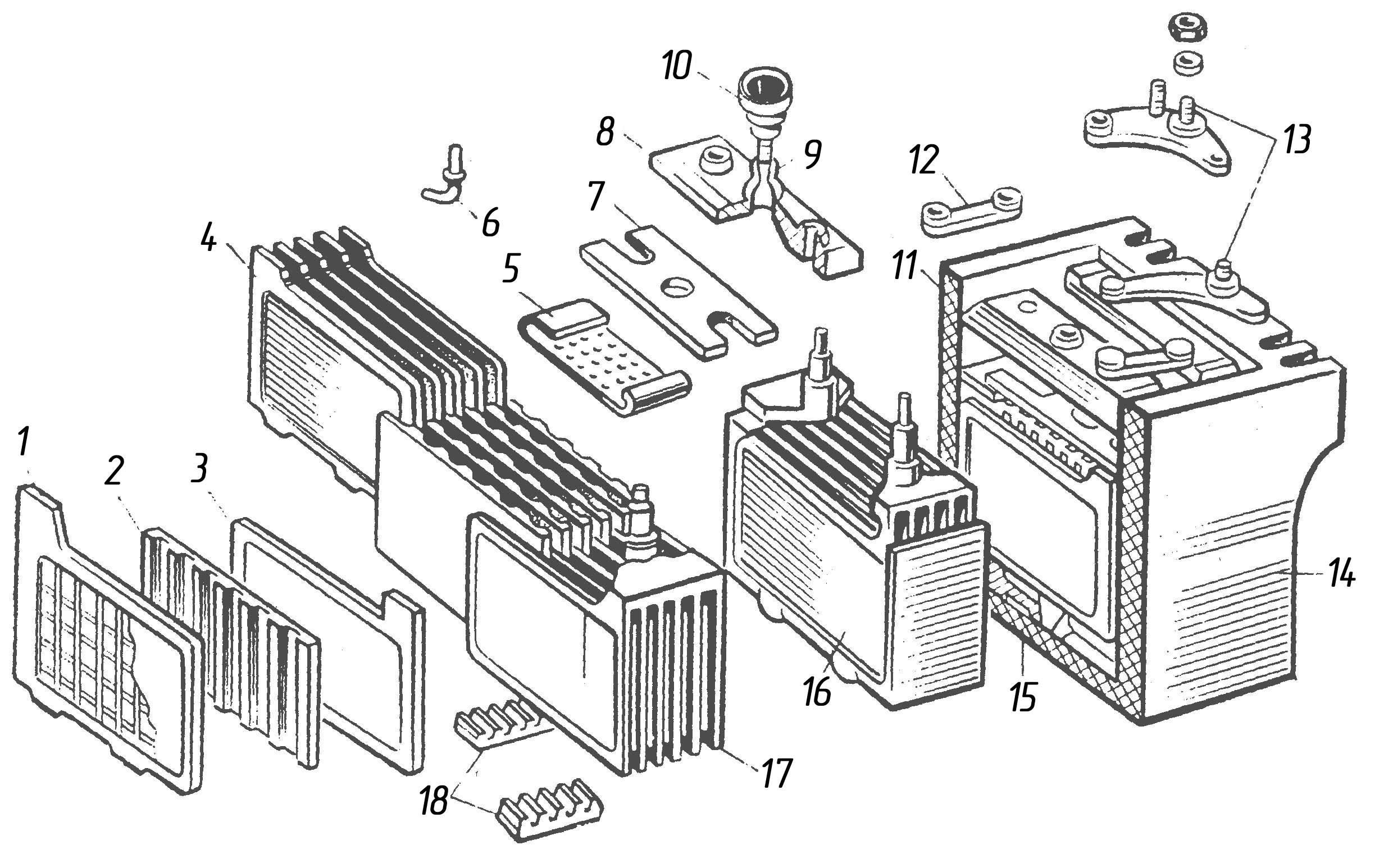 Для аккумуляторов типа С величина этого тока составляет 9п ампер, для аккумуляторов типа СК — 18 5я ампер, где п — индекс аккумулятора.
[24]
Для аккумуляторов типа С величина этого тока составляет 9п ампер, для аккумуляторов типа СК — 18 5я ампер, где п — индекс аккумулятора.
[24]
Чему равен гарантийный срок работы аккумуляторной батареи с сепараторами из мипласта или минора при условии соблюдения правил эксплуатации. [25]
Режим постоянного подзаряда является нормальным режимом работы станционной аккумуляторной батареи. При этом обеспечиваются максимальная надежность и экономичность ее работы. [27]
Предотвращают повышение давления внутри бака при работе аккумуляторной батареи. [29]
На современных крупных станциях наибольшее применение получил режим работы аккумуляторной батареи по методу постоянного подзаряда, потому что при эксплуатации может быть авария, когда батарея близка к разряженному состоянию.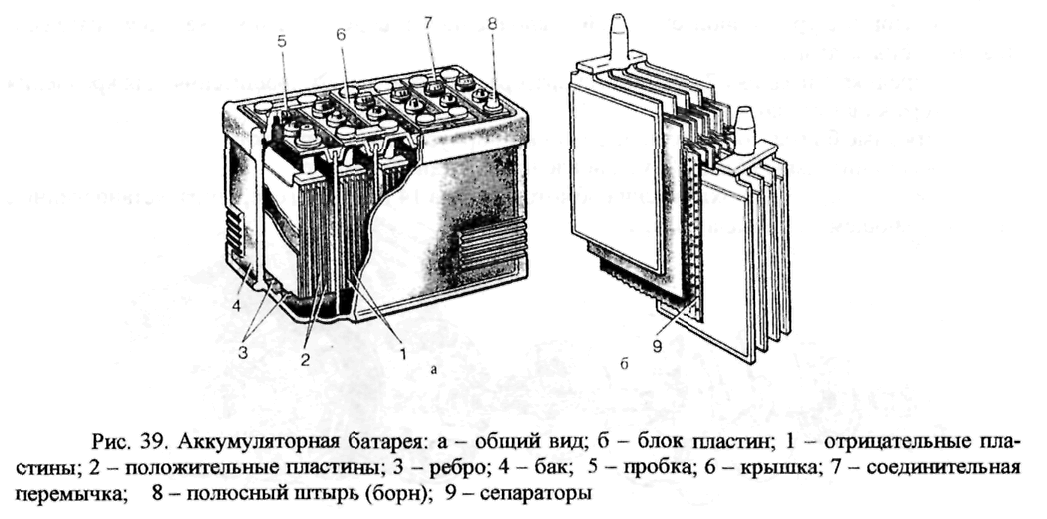 В системе постоянного под-заряда батарея все время работает параллельно с зарядным генератором, который берется с более падающей внешней характеристикой, чем батарея.
[30]
В системе постоянного под-заряда батарея все время работает параллельно с зарядным генератором, который берется с более падающей внешней характеристикой, чем батарея.
[30]
Страницы: 1 2 3 4 5
B22 5.2 Аккумуляторная батарея 22 В — Аккумуляторы для электроинструментов
B22 5.2 Аккумуляторная батарея 22 В — Аккумуляторы для электроинструментов — Hilti Россия Skip to main content HiltiНаведите курсор на картинку для увеличения.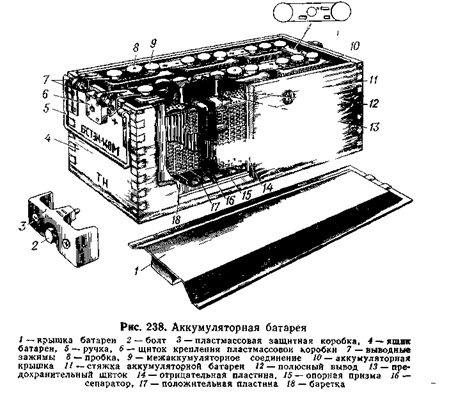
Кликните на картинку для увеличения.
Кликните на картинку для увеличения.
New productАртикул #r6227236
Мощная литий-ионная батарея 22 В с емкостью 5,2 А ч для более длительной работы
Review
Клиенты также искали аккумулятор, аккумулятор для инструмента, аккумулятор Hilti или батарея 22В
Преимущества и применения
Преимущества и применения
Преимущества
- Высокопроизводительная батарея, обеспечивающая большее время работы для всех электроинструментов Hilti на платформе 22 В
- Технология Cordless Power Care (CPC) обеспечивает интеллектуальный контроль каждой ячейки батареи для ее неизменно высокой выходной мощности и точного отображения состояния заряда
- Полная герметичность электроники для высокого уровня защиты от пыли и влаги
- Прорезиненный корпус из стеклопластика – до четырех раз лучше защита от повреждений в случае падения и вдвое большая устойчивость к воздействию экстремальных температур по сравнению со стандартным пластиком ABS
- Корпус специальной конструкции для охлаждения батареи до оптимальной температуры для более быстрой зарядки и уменьшения нагрузки во время работы
Применения
- Совместимость со всей линейкой аккумуляторных инструментов Hilti на платформе 22 В
- Совместимость со всей линейкой аккумуляторных инструментов Hilti на платформе 18 В и 22 В
- Совместимость со всеми зарядными устройствами для литий-ионных аккумуляторных батарей Hilti C4/36
- Возможность эксплуатации при температуре от -17 °C до +60 °C
- Возможность эксплуатации в сложных температурных условиях – от -20 °C до +60 °C
Услуги
- Решение всех вопросов по одному клику или звонку
- Бесплатное обслуживание до 2-х лет, включая замену изношенных деталей, приёмку инструмента в сервис и его доставку
- Гарантия качества деталей и отсутствия производственного брака в течение всего срока службы инструмента
- Отдельная маркировка и возможность отслеживания в режиме онлайн обеспечивают прозрачность контроля всего ассортимента инструментов.

- Ежемесячный платеж за использование покрывает все расходы, связанные с эксплуатацией, обслуживанием и ремонтом инструментов, что помогает обеспечить полный контроль расходов.
- Высокоэффективные инструменты и последние технологические разработки помогают повысить производительность на рабочей площадке.
- Подменный инструмент на время ремонта для уменьшения простоев.
- Краткосрочная аренда инструмента на время пиковых нагрузок или для выполнения специальных задач помогает сократить финансовые расходы.
Техническая информация
Документы и видео
Консультация и поддержка
Оценки и отзывы
Зарегистрироваться
Регистрация позволяет получить доступ к ценам с учетом персональной скидки.
Не получается войти или забыли пароль?
Пожалуйста, введите свой e-mail адрес ниже. Вы получите письмо с инструкцией по созданию нового пароля.
Нужна помощь? КонтактыВойдите, чтобы продолжить
Зарегистрироваться
Регистрация позволяет получить доступ к ценам с учетом персональной скидки.
Выберите следующий шаг, чтобы продолжить
Ошибка входа
К сожалению, вы не можете войти в систему.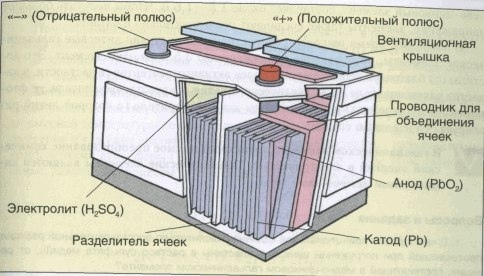
Email адрес, который вы используете, не зарегистрирован на {0}, но он был зарегистрирован на другом сайте Hilti.
Количество обновлено
Обратите внимание: количество автоматически округлено в соответствии с кратностью упаковки.
Обратите внимание: количество автоматически округлено до в соответствии с кратностью упаковки.
Базовая работа от батарей | PVEducation
В основе работы от батареи лежит обмен электронами между двумя химическими реакциями, реакцией окисления и реакцией восстановления. Ключевым аспектом батареи, который отличает ее от других реакций окисления / восстановления (таких как процессы ржавления и т. Д.), Является то, что реакции окисления и восстановления физически разделены. Когда реакции физически разделены, между двумя реакциями может быть вставлена нагрузка. Электрохимическая разность потенциалов между двумя батареями соответствует напряжению батареи, которая приводит в действие нагрузку, а обмен электронами между двумя реакциями соответствует току, который проходит через нагрузку.Компоненты батареи, показанные на рисунке ниже, состоят из электрода и электролита как для реакции восстановления, так и для реакции окисления, средства для переноса электронов между реакцией восстановления и окисления (обычно это достигается с помощью провода, подключенного к каждый электрод) и средства обмена заряженными ионами между двумя реакциями.
Д.), Является то, что реакции окисления и восстановления физически разделены. Когда реакции физически разделены, между двумя реакциями может быть вставлена нагрузка. Электрохимическая разность потенциалов между двумя батареями соответствует напряжению батареи, которая приводит в действие нагрузку, а обмен электронами между двумя реакциями соответствует току, который проходит через нагрузку.Компоненты батареи, показанные на рисунке ниже, состоят из электрода и электролита как для реакции восстановления, так и для реакции окисления, средства для переноса электронов между реакцией восстановления и окисления (обычно это достигается с помощью провода, подключенного к каждый электрод) и средства обмена заряженными ионами между двумя реакциями.
Схема батареи, в которой (а) электролит реакции восстановления и окисления различается и (б) электролит одинаковый для обеих реакций.
Ключевыми компонентами, которые определяют многие из основных свойств батареи, являются материалы, используемые для электрода и электролита как для реакций окисления, так и для реакций восстановления.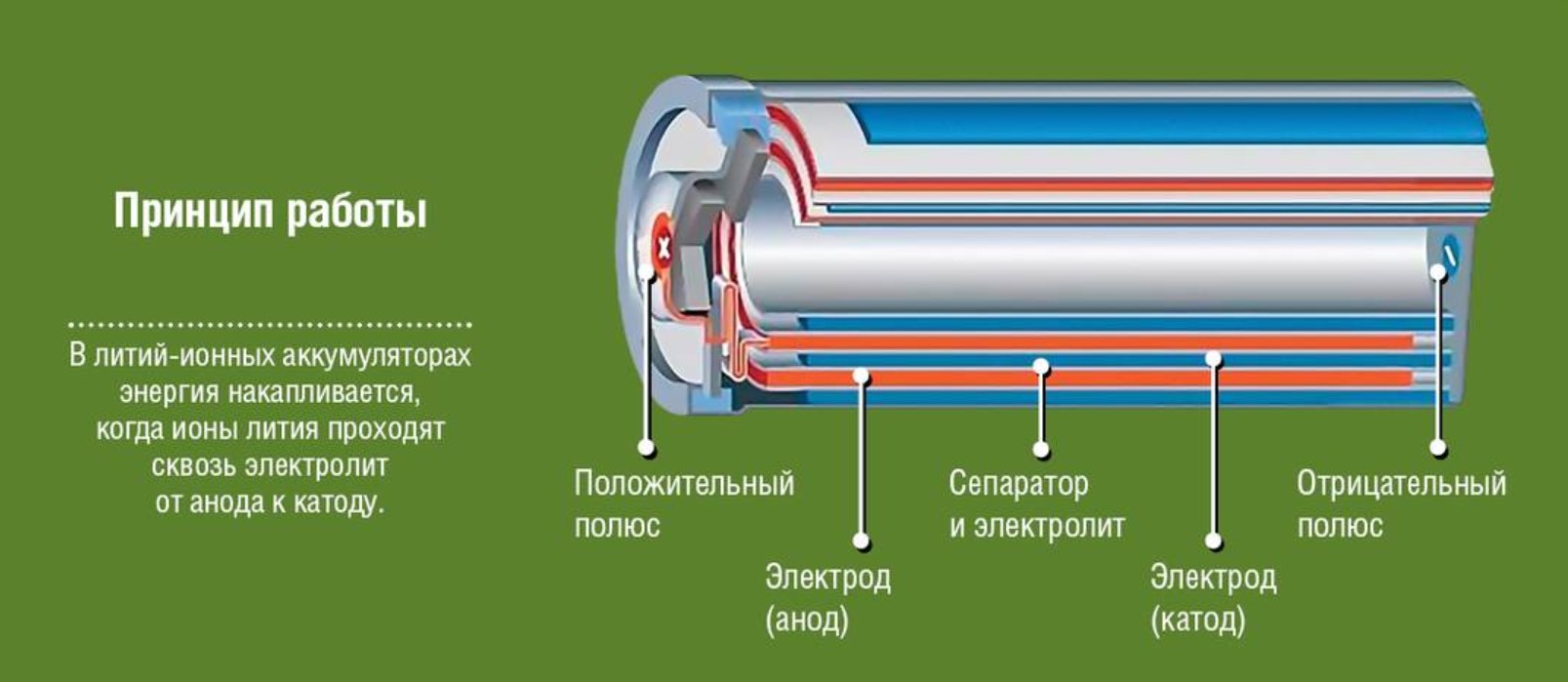 Электрод — это физическое место, где происходит ядро окислительно-восстановительной реакции — перенос электронов. Во многих аккумуляторных системах, включая свинцово-кислотные и щелочные батареи, электрод — это не только место, где происходит перенос электронов, но также компонент химической реакции, которая либо использует, либо производит электроны.Однако в других аккумуляторных системах (таких как топливные элементы) материал электрода сам по себе инертен и является лишь местом переноса электронов от одного реагента к другому. Для разряженной батареи электрод, на котором происходит реакция окисления, называется анодом и по определению имеет положительное напряжение, а электрод, на котором происходит реакция восстановления, является катодом и находится под отрицательным напряжением.
Электрод — это физическое место, где происходит ядро окислительно-восстановительной реакции — перенос электронов. Во многих аккумуляторных системах, включая свинцово-кислотные и щелочные батареи, электрод — это не только место, где происходит перенос электронов, но также компонент химической реакции, которая либо использует, либо производит электроны.Однако в других аккумуляторных системах (таких как топливные элементы) материал электрода сам по себе инертен и является лишь местом переноса электронов от одного реагента к другому. Для разряженной батареи электрод, на котором происходит реакция окисления, называется анодом и по определению имеет положительное напряжение, а электрод, на котором происходит реакция восстановления, является катодом и находится под отрицательным напряжением.
Одного электрода недостаточно для протекания окислительно-восстановительной реакции, поскольку окислительно-восстановительная реакция включает взаимодействие более чем одного компонента.Остальные химические компоненты реакции содержатся в электролите. Для многих практических аккумуляторных систем электролит представляет собой водный раствор. Одна из причин наличия водного раствора заключается в том, что окисленная или восстановленная форма электрода существует в водном растворе. Кроме того, важно, чтобы химические частицы в электролите были мобильными, чтобы они могли перемещаться к участку на электроде, где происходит химическая реакция, а также чтобы частицы ионов могли перемещаться от одного электрода к другому.
Для многих практических аккумуляторных систем электролит представляет собой водный раствор. Одна из причин наличия водного раствора заключается в том, что окисленная или восстановленная форма электрода существует в водном растворе. Кроме того, важно, чтобы химические частицы в электролите были мобильными, чтобы они могли перемещаться к участку на электроде, где происходит химическая реакция, а также чтобы частицы ионов могли перемещаться от одного электрода к другому.
Ток в батарее возникает в результате переноса электронов от одного электрода к другому. Во время разряда реакция окисления на аноде генерирует электроны, а реакция восстановления на катоде использует эти электроны, и, следовательно, во время разряда электроны текут от анода к катоду. Электроны, генерируемые или используемые в окислительно-восстановительной реакции, могут легко переноситься между электродами через обычное электрическое соединение, такое как провод, прикрепленный к аноду и катоду.Однако, в отличие от обычной электрической цепи, электроны — не единственный носитель заряда в цепи. Электроны перемещаются от анода к катоду, но не возвращаются от катода к аноду. Вместо этого электрическая нейтральность поддерживается движением ионов в электролите. Если в каждой окислительно-восстановительной реакции используется другой электролит, солевой мост соединяет два раствора электролита. Направление движения ионов предотвращает накопление заряда либо на аноде, либо на катоде.В большинстве практических аккумуляторных систем один и тот же электролит используется как для анода, так и для катода, и перенос ионов может происходить через сам электролит, что устраняет необходимость в солевом мостике. Однако в этом случае между анодом и катодом также вставлен разделитель. Сепаратор предотвращает физическое соприкосновение анода и катода друг с другом, поскольку они обычно находятся в очень непосредственной физической близости друг к другу, и если бы они соприкоснулись, это привело бы к короткому замыканию батареи, поскольку электроны могут передаваться напрямую, не проходя через внешнюю цепь.
Электроны перемещаются от анода к катоду, но не возвращаются от катода к аноду. Вместо этого электрическая нейтральность поддерживается движением ионов в электролите. Если в каждой окислительно-восстановительной реакции используется другой электролит, солевой мост соединяет два раствора электролита. Направление движения ионов предотвращает накопление заряда либо на аноде, либо на катоде.В большинстве практических аккумуляторных систем один и тот же электролит используется как для анода, так и для катода, и перенос ионов может происходить через сам электролит, что устраняет необходимость в солевом мостике. Однако в этом случае между анодом и катодом также вставлен разделитель. Сепаратор предотвращает физическое соприкосновение анода и катода друг с другом, поскольку они обычно находятся в очень непосредственной физической близости друг к другу, и если бы они соприкоснулись, это привело бы к короткому замыканию батареи, поскольку электроны могут передаваться напрямую, не проходя через внешнюю цепь. и загрузить.
и загрузить.
Окислительно-восстановительные реакции, составляющие конкретную аккумуляторную систему, определяют многие фундаментальные параметры аккумуляторной системы. Другие ключевые свойства батареи, в том числе емкость батареи, характеристики зарядки / разрядки и другие практические соображения, также зависят от физической конфигурации батареи, например количества материала в батарее или геометрии электродов. На следующих страницах описывается, как характеристики батареи — поведение напряжения, эффективность батареи, неидеальность батареи (саморазряд, снижение емкости батареи и т. Д.) — зависят от протекания окислительно-восстановительных реакций и конфигурации батареи.
Как работают батарейки?
Как работают батарейки?Как работают батарейки?
Электричество, как вы, наверное, уже знаете, это поток электронов. через токопроводящую дорожку, как провод. Этот путь называется цепью .
Батареи состоят из трех частей: анода (-), катода (+),
и электролит .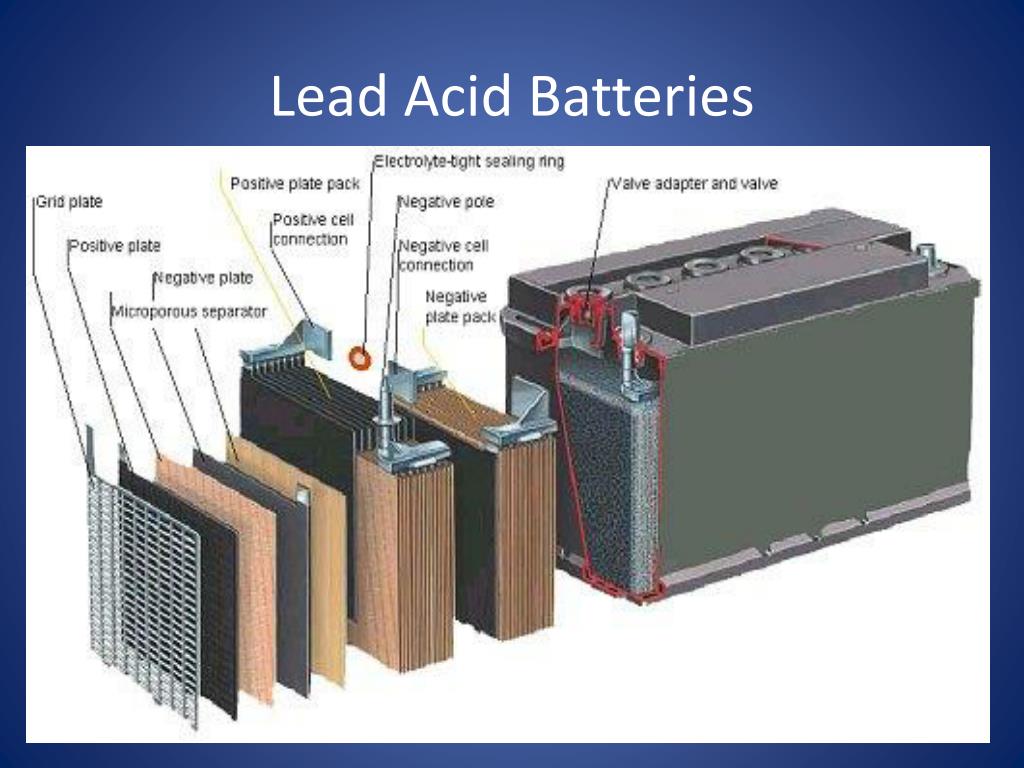 Катод и анод (положительный и отрицательный
стороны на обоих концах традиционной батареи) подключены к электрическому
схема.
Катод и анод (положительный и отрицательный
стороны на обоих концах традиционной батареи) подключены к электрическому
схема.
Химические реакции в батарее вызывают накопление электронов. на аноде. Это приводит к электрической разнице между анодом и катод. Вы можете думать об этой разнице как о нестабильном накоплении электроны. Электроны хотят перестроиться, чтобы избавиться от этой разницы. Но они делают это определенным образом. Электроны отталкиваются и пытаются уйти в место с меньшим количеством электронов.
В батарее единственное место, куда можно подойти, — это катод.Но
электролит не позволяет электронам идти прямо от анода к катоду
внутри батареи. Когда цепь замкнута (провод соединяет катод
и анод) электроны смогут попасть на катод. На картинке
выше электроны проходят по проводу, зажигая лампочку вдоль
способ. Это один из способов описания того, как электрический потенциал вызывает появление электронов. протекать по контуру.
протекать по контуру.
Однако эти электрохимические процессы изменяют химические вещества. в аноде и катоде, чтобы они перестали подавать электроны.Итак, есть ограниченное количество энергии, доступной в батарее.
Когда вы заряжаете аккумулятор, вы меняете направление потока электронов с помощью другого источника энергии, например солнечных батарей. В электрохимические процессы происходят в обратном порядке, и анод и катод восстанавливаются в исходное состояние и снова может обеспечить полную мощность.
Что есть батареи?
Что это энергия?
Что такое схема?
Что такое электрон?
Что такое поток электронов?
Что такое DS1 срок службы батареи?
Что значит электрически заряженный?
Как атомы заряжены?
Где энергия приходит и уходит?
Что такое аккумулятор? — учить.
 sparkfun.com Добавлено в избранное
Любимый
22
sparkfun.com Добавлено в избранное
Любимый
22Введение
Батареи представляют собой совокупность одной или нескольких ячеек, химические реакции которых создают поток электронов в цепи. Все батареи состоят из трех основных компонентов: анода (сторона «-»), катода (сторона «+») и какого-то электролита (вещество, которое химически реагирует с анодом и катодом).
Когда анод и катод батареи подключены к цепи, между анодом и электролитом происходит химическая реакция.Эта реакция заставляет электроны проходить через цепь и возвращаться к катоду, где происходит другая химическая реакция. Когда материал катода или анода расходуется или больше не может быть использован в реакции, батарея не может производить электричество. В этот момент ваша батарея «разряжена».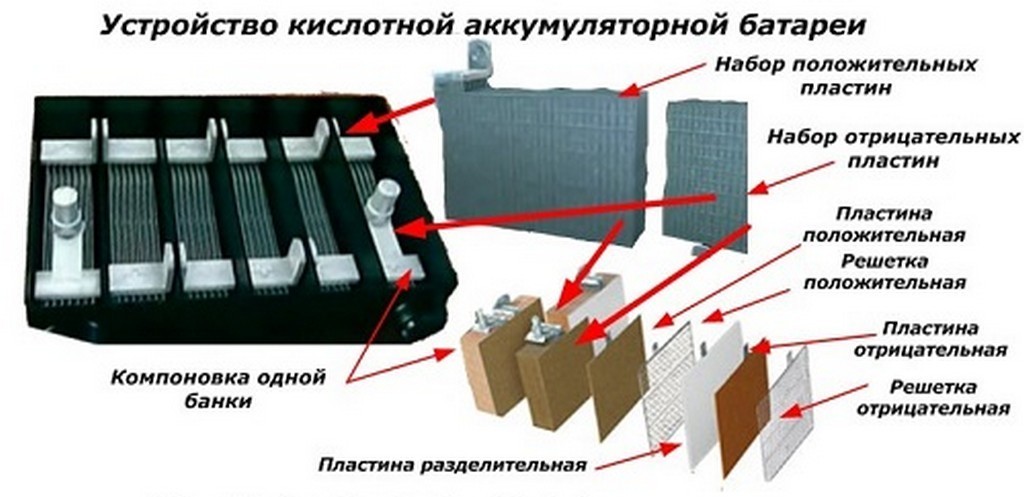
Батареи, которые необходимо выбросить после использования, известны как первичные батареи . Батареи, которые можно перезаряжать, называются вторичными батареями .
Литий-полимерные батареи, например, заряжаемые
Без батарей ваш квадрокоптер пришлось бы привязать к стене, вам пришлось бы вручную заводить машину, а ваш контроллер Xbox должен был бы быть постоянно подключен к розетке (как в старые добрые времена).Батареи позволяют хранить потенциальную электрическую энергию в переносном контейнере.
Батареи бывают разных форм, размеров и химического состава.
Изобретение современной батареи часто приписывают Алессандро Вольта. На самом деле все началось с удивительной аварии, связанной с рассечением лягушки.
Что вы узнаете
В этом руководстве будут подробно рассмотрены следующие темы:
- Как были изобретены батарейки
- Из каких частей состоит аккумулятор
- Как работает аккумулятор
- Общие термины, используемые для описания батарей
- Различные способы использования батарей в схемах
Рекомендуемая литература
Есть несколько концепций, с которыми вы, возможно, захотите ознакомиться перед тем, как начать читать это руководство:
Хотите изучить различные батареи?
Мы вас прикрыли!
Щелочная батарея 9 В
В наличии PRT-10218 Это ваши стандартные щелочные батарейки на 9 вольт от Rayovac. Даже не думайте пытаться перезарядить их. Используйте их с…
Даже не думайте пытаться перезарядить их. Используйте их с…
История
Термин Батарея
Исторически слово «батарея» использовалось для описания «серии подобных объектов, сгруппированных вместе для выполнения определенной функции», как в артиллерийской батарее. В 1749 году Бенджамин Франклин впервые использовал этот термин для описания серии конденсаторов, которые он соединил вместе для своих экспериментов с электричеством.Позже этот термин будет использоваться для любых электрохимических ячеек, связанных вместе с целью обеспечения электроэнергии.
Батарея «конденсаторов» Лейденской банки, соединенная вместе(Изображение любезно предоставлено Альвинруном из Wikimedia Commons)
Изобретение батареи
В один роковой день 1780 года итальянский физик, врач, биолог и философ Луиджи Гальвани рассекал лягушку, прикрепленную к медному крючку. Когда он коснулся лягушачьей лапы железным отростком, нога дернулась.Гальвани предположил, что энергия исходит от самой ноги, но его коллега-ученый Алессандро Вольта считал иначе.
Когда он коснулся лягушачьей лапы железным отростком, нога дернулась.Гальвани предположил, что энергия исходит от самой ноги, но его коллега-ученый Алессандро Вольта считал иначе.
Вольта выдвинул гипотезу, что импульсы лягушачьей лапки на самом деле вызываются разными металлами, пропитанными жидкостью. Он повторил эксперимент, используя ткань, пропитанную рассолом, вместо трупа лягушки, что привело к аналогичному напряжению. Вольта опубликовал свои открытия в 1791 году, а позже создал первую батарею, гальваническую батарею, в 1800 году.
Гальваническая свая состояла из пакета цинковых и медных пластин, разделенных тканью, пропитанной рассолом
СтопкаVolta страдала от двух основных проблем: из-за ее веса электролит вытек из ткани, а особые химические свойства компонентов привели к очень короткому сроку службы (около часа).Следующие двести лет уйдут на совершенствование конструкции Вольты и решение этих проблем.
Исправления к гальванической свае
Уильям Круикшанк из Шотландии решил проблему утечки, положив гальваническую батарею на бок, чтобы сформировать «желобную батарею».
Лотковая батарея решила проблему утечки гальванической сваи
Вторая проблема, короткий срок службы, была вызвана разложением цинка из-за примесей и скоплением пузырьков водорода на меди.В 1835 году Уильям Стерджен обнаружил, что обработка цинка ртутью предотвратит разложение.
Британский химик Джон Фредерик Дэниелл использовал второй электролит, который вступал в реакцию с водородом, предотвращая накопление на медном катоде. Батарея Даниэля с двумя электролитами, известная как «ячейка Даниэля», станет очень популярным решением для обеспечения энергией зарождающихся телеграфных сетей.
Коллекция клеток Даниэля из 1836 г.
Первая аккумуляторная батарея
В 1859 году французский физик Гастон Планте создал батарею из двух прокатанных листов свинца, погруженных в серную кислоту.Путем реверсирования электрического тока через батарею химия вернется в исходное состояние, создав первую перезаряжаемую батарею.
Позже, в 1881 году, Камилла Альфонс Фор улучшила конструкцию Планте, превратив листы свинца в пластины. Эта новая конструкция упростила производство аккумуляторов, и свинцово-кислотные аккумуляторы получили широкое распространение в автомобилях.
-> Дизайн обычного «автомобильного аккумулятора» существует уже более 100 лет
(Изображение любезно предоставлено Эмилианом Робертом Виколом из Wikimedia Commons) <-
Сухая камера
Вплоть до конца 1800-х годов электролит в батареях был в жидком состоянии.Это сделало транспортировку аккумуляторов очень осторожным делом, и большинство аккумуляторов никогда не предназначались для перемещения после подключения к цепи.
В 1866 году Жорж Лекланше создал батарею с цинковым анодом, катодом из диоксида марганца и раствором хлорида аммония в качестве электролита. Хотя электролит в элементе Лекланше был все еще жидким, химический состав батареи оказался важным шагом для изобретения сухого элемента.
Карл Гасснер придумал, как создать электролитную пасту из хлорида аммония и гипса.Он запатентовал новую батарею с «сухими элементами» в 1886 году в Германии.
Эти новые сухие элементы, обычно называемые «угольно-цинковыми батареями», производились массово и пользовались огромной популярностью до конца 1950-х годов. Хотя углерод не используется в химической реакции, он играет важную роль в качестве электрического проводника в углеродно-цинковой батарее.
-> Угольно-цинковая батарея 3 В 1960-х годов
(Изображение любезно предоставлено PhFabre из Wikimedia Commons) <-
В 1950-х годах Льюис Урри, Пол Марсал и Карл Кордеш из компании Union Carbide (позже известной как «Eveready», а затем «Energizer») заменили электролит хлористого аммония щелочным веществом на основе химического состава батареи, сформулированного Вальдемаром. Юнгнер в 1899 году.Щелочные батареи с сухими элементами могут содержать больше энергии, чем угольно-цинковые батареи того же размера, и имеют более длительный срок хранения.
Щелочные батареи приобрели популярность в 1960-х годах, обогнали угольно-цинковые батареи и с тех пор стали стандартными первичными элементами для потребительского использования.
-> Щелочные батареи бывают разных форм и размеров
(Изображение любезно предоставлено Aney ~ commonswiki из Wikimedia Commons) <-
Аккумуляторы 20-го века
В 1970-х годах компания COMSAT разработала никель-водородную батарею для использования в спутниках связи.Эти батареи хранят водород в газообразной форме под давлением. Многие искусственные спутники, такие как Международная космическая станция, по-прежнему используют никель-водородные батареи.
Исследования нескольких компаний с конца 1960-х годов привели к созданию никель-металлгидридных (NiMH) аккумуляторов. NiMH батареи были выпущены на потребительский рынок в 1989 году и стали более дешевой альтернативой никель-водородным аккумуляторным элементам меньшего размера.
Компания Asahi Chemical из Японии построила первую литий-ионную батарею в 1985 году, а Sony создала первую коммерческую литий-ионную батарею в 1991 году.В конце 1990-х годов был создан мягкий гибкий корпус для литий-ионных аккумуляторов, из которого возникли «литий-полимерные» или «LiPo» аккумуляторы.
Химические реакции в литий-полимерной батарее практически такие же, как и в литий-ионной батарее
Очевидно, что было изобретено, произведено и устарело гораздо больше химикатов батарей. Если вы хотите узнать больше о современных и популярных технологиях аккумуляторов, ознакомьтесь с нашим руководством по технологиям аккумуляторов.
Компоненты
Батареисостоят из трех основных компонентов: анода , катода и электролита . Сепаратор часто используется для предотвращения соприкосновения анода и катода, если электролита недостаточно. Для хранения этих компонентов аккумуляторы обычно имеют какой-то кожух .
Хорошо, большинство батарей на самом деле не разделены на три равные части, но идею вы поняли.Лучшее поперечное сечение щелочной ячейки можно найти в Википедии.И анод, и катод относятся к типу электродов . Электроды — это проводники, через которые электричество входит или выходит из компонента в цепи.
Анод
Электроны выходят из анода в устройстве, подключенном к цепи. Это означает, что обычный «ток» течет в анод.
На аккумуляторах анод обозначен как отрицательная (-) клемма
В батарее химическая реакция между анодом и электролитом вызывает накопление электронов на аноде.Эти электроны хотят перейти к катоду, но не могут пройти через электролит или сепаратор.
Катод
Электроны текут в катод в устройстве, подключенном к цепи. Это означает, что обычный «ток» течет из катода.
На батареях катод помечен как положительный (+) вывод
В батареях в химической реакции внутри катода или вокруг него используются электроны, образующиеся на аноде.Электроны могут попасть на катод только через цепь, внешнюю по отношению к батарее.
Электролит
Электролит — это вещество, часто жидкость или гель, которое способно переносить ионы между химическими реакциями, происходящими на аноде и катоде. Электролит также препятствует потоку электронов между анодом и катодом, так что электроны легче проходят через внешнюю цепь, чем через электролит.
-> В щелочных батареях может протекать электролит, гидроксид калия, если они подвергаются воздействию высоких температур или обратного напряжения
(Изображение любезно предоставлено Вильямом Дэвисом из Wikimedia Commons) <-
Электролит имеет решающее значение в работе аккумулятора.Поскольку электроны не могут проходить через него, они вынуждены проходить через электрические проводники в виде цепи, соединяющей анод с катодом.
Разделитель
Сепараторы представляют собой пористые материалы, которые предотвращают соприкосновение анода и катода, что может вызвать короткое замыкание в батарее. Сепараторы могут быть изготовлены из различных материалов, включая хлопок, нейлон, полиэстер, картон и синтетические полимерные пленки. Сепараторы не вступают в химическую реакцию ни с анодом, ни с катодом, ни с электролитом.
В гальванической куче использовалась ткань или картон (разделитель), пропитанные солевым раствором (электролитом) для разделения электродов
Ионы в электролите могут быть положительно заряженными, отрицательно заряженными и иметь различные размеры. Могут быть изготовлены специальные сепараторы, которые пропускают одни ионы, но не пропускают другие.
Кожух
Большинству аккумуляторов требуется способ удерживать их химические компоненты. Кожухи, также известные как «кожухи» или «оболочки», представляют собой просто механические конструкции, предназначенные для удержания внутренних компонентов батареи.
Свинцово-кислотный аккумулятор в пластиковом корпусе
Корпуса батареймогут быть изготовлены практически из чего угодно: из пластика, стали, пакетов из мягкого полимерного ламината и так далее. В некоторых батареях используется токопроводящий стальной кожух, который электрически соединен с одним из электродов. В случае обычного щелочного элемента AA стальной корпус соединен с катодом.
Эксплуатация
Батареи обычно требуют нескольких химических реакций для работы.По крайней мере, одна реакция происходит внутри или вокруг анода, и одна или несколько реакций происходят внутри или вокруг катода. Во всех случаях реакция на аноде дает дополнительные электроны в процессе, называемом окислением , а реакция на катоде использует дополнительные электроны во время процесса, известного как восстановление .
Когда переключатель замкнут, цепь замыкается, и электроны могут течь от анода к катоду. Эти электроны активируют химические реакции на аноде и катоде.
По сути, мы разделяем определенный вид химической реакции, реакцию окисления-восстановления или окислительно-восстановительную реакцию, на две отдельные части. При переносе электронов между химическими веществами происходят окислительно-восстановительные реакции. Мы можем использовать движение электронов в этой реакции, чтобы они выходили за пределы батареи и питали нашу цепь.
Анодное окисление
Эта первая часть окислительно-восстановительной реакции, окисление, происходит между анодом и электролитом и производит электроны (обозначены как e — ).
В некоторых реакциях окисления образуются ионы, например, в литий-ионной батарее. В других химических реакциях расходуются ионы, как в обычных щелочных батареях. В любом случае ионы могут свободно проходить через электролит, а электроны — нет.
Катодное восстановление
Другая половина окислительно-восстановительной реакции, восстановление, происходит в катоде или рядом с ним. Электроны, образующиеся в результате реакции окисления, расходуются во время восстановления.
В некоторых случаях, например, в литий-ионных батареях, положительно заряженные ионы лития, образующиеся во время реакции окисления, расходуются во время восстановления.В других случаях, например, в щелочных батареях, во время восстановления образуются отрицательно заряженные ионы.
Электронный поток
В большинстве батарей некоторые или все химические реакции могут происходить, даже если батарея не подключена к цепи. Эти реакции могут повлиять на срок годности батареи.
По большей части, реакции будут происходить с полной силой только тогда, когда между анодом и катодом замыкается электрически проводящая цепь. Чем меньше сопротивление между анодом и катодом, тем больше электронов может течь и тем быстрее протекают химические реакции.
Короткое замыкание в аккумуляторе (в данном случае даже случайное) может быть опасным. Известно, что литий-ионные батареи перегреваются и даже задыхаются или загораются при коротком замыкании.
Мы можем пропускать эти движущиеся электроны через различные электрические компоненты, известные как «нагрузка», для выполнения чего-то полезного. В анимационном ролике в начале этого раздела мы зажигаем виртуальную лампочку движущимися электронами.
Батарея разряжена
Химические вещества в батарее в конечном итоге достигают состояния равновесия. В этом состоянии химические вещества больше не будут реагировать, и в результате аккумулятор больше не будет генерировать электрический ток. На данный момент аккумулятор считается «мертвым».
Первичные элементы необходимо утилизировать, когда батарея разряжена. Вторичные элементы можно перезаряжать, и это достигается путем подачи через батарею обратного электрического тока.Перезарядка происходит, когда химические вещества выполняют еще одну серию реакций, чтобы вернуть их в исходное состояние.
Терминология
Люди часто используют общий набор терминов, говоря о напряжении батареи, емкости, возможности источника тока и так далее.
Ячейка
Элемент относится к одному аноду и катоду, разделенным электролитом, используемым для выработки напряжения и тока. Батарея может состоять из одной или нескольких ячеек.Например, одна батарея AA — это одна ячейка. Автомобильные аккумуляторы содержат шесть ячеек по 2,1 В.
Обычная 9-вольтовая батарея содержит шесть щелочных элементов по 1,5 В, установленных друг над другом
Первичный
Первичные клетки содержат химический состав, который нельзя обратить вспять. В результате аккумулятор необходимо выбрасывать после того, как он разрядился.
Среднее
Вторичные элементы можно перезаряжать, и их химический состав возвращается в исходное состояние.Эти элементы, также известные как «перезаряжаемые батареи», можно использовать много раз.
Номинальное напряжение
Номинальное напряжение аккумулятора — это напряжение, указанное производителем.
Например, щелочные батареи типа AA указаны как имеющие напряжение 1,5 В. В этой статье Mad Scientist Hut показано, что их испытанные щелочные батареи начинаются с напряжения около 1,55 В, а затем медленно теряют напряжение по мере разряда. В этом примере номинальное напряжение «1,5 В» относится к максимальному или пусковому напряжению батареи.
Этот аккумулятор Storm для квадрокоптеров показывает кривую разряда для их LiPo-элементов, начиная с 4,2 В и снижаясь до 2,8 В по мере разряда. Номинальное напряжение, указанное для большинства литий-ионных и LiPo элементов, составляет 3,7 В. В этом случае номинальное напряжение «3,7 В» относится к среднему напряжению аккумулятора в течение его цикла разряда.
Вместимость
Емкость аккумулятора — это величина электрического заряда, который он может доставить при определенном напряжении. Большинство аккумуляторов рассчитаны на ампер-часы (Ач) или миллиампер-часы (мАч).
Этот LiPo аккумулятор рассчитан на 1000 мАч, что означает, что он может обеспечить 1 ампер в течение 1 часа, прежде чем он будет считаться разряженным.
Большинство графиков разряда батареи показывают зависимость напряжения батареи от емкости, например, эти тесты батареи AA, проведенные PowerStream. Чтобы выяснить, достаточно ли емкости аккумулятора для питания вашей схемы, найдите самое низкое допустимое напряжение и найдите соответствующий номинал мАч или Ач.
C-Rate
Многие батареи, особенно мощные литий-ионные, обозначают ток разряда как «C-Rate», чтобы более четко определить характеристики батареи.C-Rate — это скорость разряда относительно максимальной емкости аккумулятора.
1С — это сила тока, необходимая для разрядки аккумулятора за 1 час. Например, аккумулятор емкостью 400 мАч, обеспечивающий ток 1С, будет обеспечивать 400 мА. 5C для той же батареи будет 2 A.
Большинство батарей теряют емкость при более высоком потреблении тока. Например, этот график информации о продукте от Chargery показывает, что их LiPo-элемент имеет меньше мАч при более высоких показателях C-Rates.
ПРИМЕЧАНИЕ: Общий совет гласит, что вы должны заряжать LiPo батареи при 1С или меньше.
MIT предлагает фантастическое руководство по спецификациям и терминологии аккумуляторов, которое идет намного дальше этого обзора.
Использование
Однокамерный
Некоторые схемы могут питаться от одного элемента, но убедитесь, что батарея может обеспечивать достаточное напряжение и ток.
Этот Photon Battery Shield питается от одного элемента LiPoЕсли напряжение слишком высокое или слишком низкое для вашей схемы, вам, вероятно, понадобится преобразователь постоянного тока в постоянный.
серии
Чтобы увеличить напряжение между выводами батареи, вы можете расположить элементы последовательно. Последовательность означает штабелирование ячеек встык, соединение анода одного с катодом следующего.
Последовательно соединяя батареи, вы увеличиваете общее напряжение. Сложите напряжение всех ячеек, чтобы определить рабочее напряжение. Емкость остается прежней.
В этом примере четыре ячейки 1,5 В подключены последовательно.Напряжение на нагрузке составляет 6 В, а общий набор аккумуляторов имеет емкость 2000 мАч.
В большинстве бытовых электронных устройств, в которых используются щелочные батареи, батареи устанавливаются последовательно. Например, этот держатель батареек 2x AA может поднять номинальное напряжение до 3 В для проекта.
ПРИМЕЧАНИЕ : При последовательной зарядке литий-ионных или LiPo аккумуляторов необходимо обязательно использовать специальную схему, известную как «балансир», чтобы гарантировать равномерное напряжение между элементами.Некоторые зарядные устройства, такие как это, имеют балансиры для безопасной зарядки.Параллельный
Если напряжение одного элемента соответствует нагрузке, вы можете добавить батареи параллельно, чтобы увеличить емкость. Обратите внимание, что это также означает увеличение доступного тока (C-Rate).
Будьте осторожны при параллельном подключении аккумуляторов! Все элементы должны иметь одинаковое номинальное напряжение и одинаковый уровень заряда. Если есть какие-либо различия в напряжении, может произойти короткое замыкание, что приведет к перегреву и, возможно, возгоранию.
В этом примере четыре ячейки 1,5 В подключены параллельно. Напряжение на нагрузке остается на уровне 1,5 В, но общая емкость увеличивается до 8000 мАч.
Последовательный и параллельный
Если вы хотите увеличить напряжение и емкость, вы можете комбинировать последовательные и параллельные батареи. Еще раз убедитесь, что уровень напряжения одинаков для батарей, включенных параллельно, так как может произойти короткое замыкание.
В этом примере полное напряжение на нагрузке составляет 3 В, а общая емкость аккумуляторов составляет 4000 мАч.
В больших аккумуляторных блоках, особенно литий-ионных, вы часто видите конфигурацию, указанную с использованием «S» и «P» для последовательного и параллельного подключения. Конфигурация схемы выше — 2S2P. В качестве практического примера современные электромобили используют массивные массивы батарей, соединенных последовательно и параллельно.
Ресурсы и дальнейшее развитие
К настоящему времени вы должны понимать, как были изобретены батареи и как они работают. Батареи — это один из способов обеспечения вашего проекта электроэнергией, и они могут быть невероятно полезны, если вам нужен портативный источник питания.
Если вы хотите больше узнать о батареях, вот еще несколько уроков:
Хотите увидеть аккумуляторы в действии? Взгляните на эти проекты, в которых используются разные батареи в разных конфигурациях:
Simon Splosion Wireless
Это учебное пособие, демонстрирующее один из многих методов «взлома» Саймона Сэйса. Мы выделим технику, чтобы взять ваш Simon Says Wireless.
Работа от автомобильного аккумулятора | Электрооборудование A2Z
Автомобильные аккумуляторы вырабатывают постоянный ток.Они могут производить огромное количество тока для своего размера. Автомобильные аккумуляторы очень надежны и обычно обеспечивают безотказную работу в течение нескольких лет.
Разрядка и зарядка
Когда электроны выходят из батареи, батарея высвобождает накопленную энергию, как показано на Рис. 1A .
Рисунок 1 .
A —Когда электроны выходят из батареи для питания электрического устройства, химические вещества в батарее истощаются.
B —Когда генератор работает, внешнее напряжение немного выше, чем напряжение батареи, и электроны текут обратно через батарею, чтобы пополнить запас химикатов.
Этот процесс называется разряд батареи . Разряд происходит, когда батарея преобразует химическую энергию в электрическую для работы электрического устройства. Для зарядки разряженной батареи внешнее напряжение, немного превышающее напряжение батареи, должно быть приложено к положительной клемме батареи.Это заставляет электроны возвращаться через батарею, восстанавливая химические вещества в батарее, чтобы восстановить ее. Этот процесс зарядки позволяет аккумулятору накапливать химическую энергию, которая при необходимости может быть преобразована обратно в электрическую. См. Рисунок 1B .
Работа аккумуляторной батареиНа рисунке 2 показана химическая реакция внутри аккумуляторного элемента. Когда батарея разряжается, кислород в положительной пластине соединяется с водородом в серной кислоте с образованием воды, а на пластинах образуется сульфат свинца.По мере того, как аккумулятор продолжает разряжаться, большая часть кислоты превращается в воду, и заряд на пластинах становится более похожим. При достаточном разряде кислота становится слабой, и обе пластины содержат сульфат свинца. Батарея разряжается настолько, что не может обеспечить энергию, необходимую для нормальной работы.
Рисунок 2. Химические реакции, происходящие в автомобильном аккумуляторе.
A —При разрядке аккумулятора серная кислота превращается в воду, а сульфат свинца (PbSO4) откладывается на электродах.Когда вся серная кислота заменена на воду, дальнейшая химическая реакция не может происходить, и батарея разряжена.
B —Зарядка обращает химическую реакцию, которая происходит во время разряда. Вода превращается обратно в серную кислоту, а сульфат свинца удаляется с пластин.
Для зарядки аккумулятора электроны возвращаются обратно в аккумулятор от генератора или зарядного устройства. Чтобы электроны попали в батарею, внешнее напряжение должно быть немного выше, чем общее напряжение ячейки.
Во время зарядки происходит обратная химическая реакция. Сульфат на пластинах возвращается в электролит. Вода в электролите расщепляется на водород и кислород. Эта химическая реакция возвращает перекись свинца на положительную пластину и приводит к отрицательной пластине. При достаточной подзарядке кислота и пластины возвращаются в исходное состояние.
Напряжение аккумулятора
Напряжение ячейки разомкнутой цепи (без нагрузки) составляет 2,1 В, часто округляется до 2 В.Поскольку элементы в автомобильной батарее соединены последовательно, напряжение батареи зависит от количества ячеек.
12-вольтовая батарея состоит из шести ячеек, которые создают напряжение холостого хода 12,6 вольт (обычно округляется до 12 вольт). Сегодня в большинстве автомобилей используются 12-вольтовые аккумуляторные батареи и 12-вольтная электрическая система. См. Рисунок 3 .
Рисунок 3 . Автомобильные батареи, используемые в автомобилях последних моделей, состоят из шести ячеек. Каждая ячейка вырабатывает 2,1 вольта, поэтому батарея генерирует в общей сложности 12.6 вольт
Высокая степень сжатия дизельного двигателя затрудняет запуск двигателя для запуска двигателя. На некоторых автомобилях с дизельными двигателями могут использоваться две батареи для обеспечения высокого тока пускового двигателя. Две батареи подключены параллельно, поэтому на выходе остается 12 вольт (фактически 12,6 вольт). См. Рисунок 4 .
Рис. 4. Две батареи могут быть подключены параллельно для запуска двигателя с воспламенением от сжатия или дизельного двигателя.
Температура и эффективность батареи
По мере того, как температура автомобильного аккумулятора падает, мощность аккумулятора уменьшается. При низких температурах химическая реакция внутри батареи замедляется, и батарея не может производить такой же ток, как когда она теплая. Это влияет на способность аккумулятора запускать двигатель в очень холодную погоду. См. Рисунок 5 .
Рис. 5. Автомобильный аккумулятор Мощность аккумулятора уменьшается при понижении температуры.Это одна из причин, почему в холодную погоду двигатели начинают медленно проворачиваться.
Кроме того, при холодном двигателе моторное масло в поддоне становится очень густым. Масло трудно прокачивать через двигатель, и трение деталей увеличивается. Это увеличивает количество тока, необходимого для запуска двигателя с помощью пускового двигателя.
Как работают батареи? | Живая наука
Батарейки везде. Современный мир зависит от этих портативных источников энергии, которые можно найти во всем: от мобильных устройств до слуховых аппаратов и автомобилей.
Но, несмотря на то, что они широко используются в повседневной жизни людей, батареям часто не уделяют должного внимания. Подумайте об этом: вы действительно знаете, как работает аккумулятор? Не могли бы вы объяснить это кому-нибудь другому?
Вот краткое изложение научных данных об источниках энергии для смартфонов, электромобилей, кардиостимуляторов и многого другого. [Тест: электрические и газовые автомобили]
Анатомия аккумулятора
Большинство аккумуляторов состоят из трех основных частей: электродов, электролита и сепаратора, по словам Энн Мари Састри, соучредителя и генерального директора Sakti3, базирующейся в Мичигане. запуск аккумуляторных технологий.
В каждой батарее по два электрода. Оба изготовлены из токопроводящих материалов, но выполняют разные функции. Один электрод, известный как катод, подключается к положительному концу батареи и является местом, где электрический ток выходит (или электроны входят) в батарею во время разряда, когда батарея используется для питания чего-либо. Другой электрод, известный как анод, подключается к отрицательному полюсу батареи и является местом, где электрический ток входит (или электроны покидают) батарею во время разряда.
Между этими электродами, а также внутри них находится электролит. Это жидкое или гелеобразное вещество, содержащее электрически заряженные частицы или ионы. Ионы соединяются с материалами, из которых состоят электроды, производя химические реакции, которые позволяют батарее генерировать электрический ток. [Взгляд изнутри на работу батарей (инфографика)]
Типичные батареи питаются за счет химической реакции. [См. Полную инфографику] (Изображение предоставлено Карлом Тейтом, художником по инфографике)Последняя часть батареи, разделитель, довольно проста.Роль сепаратора состоит в том, чтобы удерживать анод и катод отдельно друг от друга внутри батареи. По словам Састри, без разделителя два электрода соприкоснутся, что приведет к короткому замыканию и нарушит нормальную работу батареи.
Как это работает
Чтобы представить себе, как работает батарейка, представьте, как вы вставляете щелочные батарейки, такие как двойные AA, в фонарик. Когда вы вставляете эти батарейки в фонарик, а затем включаете его, на самом деле вы замыкаете цепь.Сохраненная в батарее химическая энергия преобразуется в электрическую, которая выходит из батареи в основание лампы фонарика, заставляя ее загораться. Затем электрический ток снова входит в батарею, но на противоположном конце от того места, где он выходил изначально.
Все части батареи работают вместе, чтобы фонарик загорелся. Электроды в батарее содержат атомы определенных проводящих материалов. Например, в щелочной батарее анод обычно изготавливается из цинка, а диоксид марганца действует как катод.Электролит между этими электродами и внутри них содержит ионы. Когда эти ионы встречаются с атомами электродов, между ионами и атомами электродов происходят определенные электрохимические реакции.
Серия химических реакций, протекающих в электродах, вместе известна как окислительно-восстановительные (окислительно-восстановительные) реакции. В батарее катод известен как окислитель, потому что он принимает электроны от анода. Анод известен как восстановитель, потому что он теряет электроны.
В конечном итоге эти реакции приводят к потоку ионов между анодом и катодом, а также к освобождению электронов от атомов электрода, — сказал Састри.
Эти свободные электроны собираются внутри анода (нижняя плоская часть щелочной батареи). В результате два электрода имеют разные заряды: анод становится отрицательно заряженным, когда высвобождаются электроны, а катод становится положительно заряженным, поскольку электроны (которые заряжены отрицательно) потребляются.Эта разница в заряде заставляет электроны двигаться к положительно заряженному катоду. Однако у них нет возможности попасть внутрь батареи, потому что разделитель не позволяет им сделать это.
Когда вы щелкаете выключателем на фонарике, все меняется. У электронов теперь есть путь к катоду. Но сначала они должны пройти через основание лампы фонарика. Схема замыкается, когда электрический ток снова входит в батарею через верхнюю часть батареи у катода.
Перезаряжаемые и неперезаряжаемые
Для первичных батарей, таких как батареи фонарика, реакции, питающие батарею, в конечном итоге прекратятся, а это означает, что электроны, обеспечивающие батарею ее зарядом, больше не будут создавать электрический ток. Когда это происходит, аккумулятор разряжен или «мертв», — сказал Састри.
Вы должны выбросить такие батареи, потому что электрохимические процессы, которые заставили батарею производить энергию, не могут быть обращены вспять, объяснил Састри.Однако электрохимические процессы, происходящие во вторичных или перезаряжаемых батареях, можно обратить вспять, подав в батарею электрическую энергию. Например, это происходит, когда вы подключаете аккумулятор мобильного телефона к зарядному устройству, подключенному к источнику питания.
Некоторые из наиболее распространенных используемых сегодня вторичных батарей — это литий-ионные (литий-ионные) батареи, от которых питается большинство бытовых электронных устройств. Эти батареи обычно содержат угольный анод, катод из диоксида лития-кобальта и электролит, содержащий соль лития в органическом растворителе.Другие перезаряжаемые батареи включают никель-кадмиевые (NiCd) и никель-металлогидридные (NiMH) батареи, которые можно использовать в таких вещах, как электромобили и беспроводные электроинструменты. Свинцово-кислотные (Pb-кислотные) батареи обычно используются в автомобилях и других транспортных средствах для запуска, освещения и зажигания.
По словам Састри, все эти аккумуляторные батареи работают по одному и тому же принципу: когда вы подключаете батарею к источнику питания, поток электронов меняет направление, и анод и катод возвращаются в исходное состояние.[10 лучших подрывных технологий]
Battery lingo
Хотя все батареи работают более или менее одинаково, разные типы батарей имеют разные характеристики. Вот несколько терминов, которые часто встречаются при любом обсуждении батарей:
Напряжение : Когда дело доходит до батарей, напряжение — также известное как номинальное напряжение ячейки — описывает величину электрической силы или давления, при которой свободные электроны — переходите от положительного полюса батареи к отрицательному, — пояснил Састри.В батареях с более низким напряжением ток выходит из батареи медленнее (с меньшей электрической силой), чем в батареях с более высоким напряжением (с большей электрической силой). Батареи в фонарике обычно имеют напряжение 1,5 В. Однако, если фонарик использует две батареи последовательно, эти батареи или элементы имеют общее напряжение 3 вольта.
Свинцово-кислотные батареи, подобные тем, которые используются в большинстве неэлектрических автомобилей, обычно имеют напряжение 2,0 вольт. Но обычно в автомобильном аккумуляторе последовательно соединено шесть таких элементов, поэтому вы, вероятно, слышали, что такие аккумуляторы называются 12-вольтовыми батареями.
Литий-кобальтооксидные батареи — наиболее распространенный тип литий-ионных батарей, используемых в бытовой электронике — имеют номинальное напряжение около 3,7 вольт, сказал Састри.
Ампер : Ампер или ампер — это мера электрического тока или количества электронов, которые проходят через цепь в течение определенного периода времени.
Емкость : Емкость, или емкость элемента, измеряется в ампер-часах, то есть количество часов, в течение которых батарея может подавать определенное количество электрического тока, прежде чем ее напряжение упадет ниже определенного порога, согласно сообщению Райса. Кафедра электротехники и вычислительной техники университета.
9-вольтовая щелочная батарея, используемая в портативных радиоприемниках, рассчитана на 1 ампер-час, что означает, что эта батарея может непрерывно обеспечивать один ампер тока в течение 1 часа, прежде чем она достигнет порогового значения напряжения и будет считаться разряженной.
Плотность мощности : Плотность мощности описывает количество энергии, которое батарея может выдать на единицу веса, сказал Састри. По словам Састри, для электромобилей важна плотность мощности, потому что она показывает, насколько быстро автомобиль может разогнаться от 0 до 60 миль в час (97 км / ч).Инженеры постоянно пытаются найти способы уменьшить размеры батарей без уменьшения их удельной мощности.
Плотность энергии : Плотность энергии описывает, сколько энергии способна отдавать батарея, деленное на ее объем или массу, сказал Састри. Это число соответствует вещам, которые имеют большое влияние на пользователей, например, сколько времени вам нужно пройти перед зарядкой мобильного телефона или как далеко вы можете проехать на электромобиле, прежде чем остановиться, чтобы подключить его.
Follow Elizabeth Palermo @ techEpalermo .Следите за Live Science @livescience , Facebook и Google+ .
Дополнительные ресурсы
Взгляд изнутри работающей батареи
Химики разрабатывают новую технику наблюдения за химическими процессами во время работы от батарей.
Изображение предоставлено: Бастиан Крюгер
Батареи произвели революцию в хранении энергии, превратив химическую энергию в электрическую, которая используется для питания беспроводного мира.Но что именно происходит внутри батареи на микроскопическом уровне?
Мы, конечно, знаем, что заряженные частицы движутся от положительно заряженного электрода, называемого катодом, и направляются к отрицательному аноду, создавая электрический ток. Интересно, что в большинстве литий-ионных батарей ультратонкий слой, называемый межфазной фазой твердого электролита (SEI), образуется на аноде во время первых нескольких циклов зарядки. Этот слой важен для сохранения долговечности батареи, поскольку он защищает реактивный анод, а также электролит батареи от разрушения.
Изучение образования SEI, его состава и роли при зарядке и разрядке аккумулятора обычно проводится вне аккумулятора. Но непосредственное наблюдение за изменениями, происходящими в этих сложных слоях, толщина которых составляет микрометры, предоставит ученым более точную картину, чтобы понять их и разработать лучшие материалы для более эффективных, экологически чистых и долговечных батарей.
С этой целью группа ученых во главе с профессором Гюнтером Виттстоком из Ольденбургского университета недавно представила новую технику для живого наблюдения за процессами, которые до сих пор практически не наблюдались в работающей батарее.
Согласно исследованию, которое недавно было опубликовано в журнале ChemElectroChem , команда наблюдала в режиме реального времени защитные свойства ультратонкого слоя SEI с помощью метода визуализации, называемого сканирующей электрохимической микроскопией (SECM), который используется для измерения локальное электрохимическое поведение границ раздела жидкость / твердое тело, жидкость / газ и жидкость / жидкость.
Чтобы заглянуть внутрь работающей батареи, команда создала «измерительную ячейку», которая была построена с использованием 3D-принтеров и микрофрезерных станков с ЧПУ и использовалась для имитации условий реальной батареи.Ячейка содержала рабочий и противоэлектродный электрод, и для проведения измерений SECM было создано центральное отверстие, в которое был вставлен измерительный зонд с микроэлектродом SECM рядом с рабочим литиевым электродом для контроля условий.
Затем группа периодически сканировала поверхность измерительного зонда с интервалом всего в несколько микрометров для сбора химической информации о формирующемся слое. «Повторяя этот процесс несколько раз, мы можем отслеживать изменения на поверхности образца, как в флипбуке», — пояснил Виттсток.
Новая методика работы команды на месте позволила им с невероятной точностью наблюдать процессы на литиевом аноде, такие как отложение жидкости на аноде и образование дендритов — разветвленных, жестких структур, которые могут повредить батарею и ограничить их долговечность.
«Прорыв в нашем исследовании заключается в том, что мы впервые смогли проводить такие процессы при реалистичных плотностях тока непосредственно в измерительном устройстве и визуально контролировать их воздействие», — подчеркнул Виттсток.Он добавил, что эту технику можно также использовать на других типах электродов, пояснив, что долгосрочная цель заключалась в изучении того, как различные этапы предварительной обработки влияют на формирование защитного пограничного слоя на электродах.
Ссылка: Bastian Krueger, et al. «Межфазная эволюция твердого электролита на литий-металлических электродах с последующей сканирующей электрохимической микроскопией при реалистичных циклических плотностях тока батареи» ChemElectroChem (2020). DOI: 10.1002 / celc.202000441
Цитаты из оригинального пресс-релиза, предоставленного Ольденбургским университетом
границ | Модельно-ориентированный анализ интегрированной системы цинково-воздушной батареи / цинкового электролизера
Введение
В настоящее время возобновляемые источники энергии привлекли общественный интерес и широко изучаются в связи с увеличением спроса на энергию и жесткими целями изменения климата (Li and Dai, 2014; Jing et al., 2017).Таким образом, возобновляемые источники энергии, такие как солнце и ветер, обладают большим потенциалом для удовлетворения этой потребности. Тем не менее их практическое применение ограничено их изменчивостью и прерывистым характером. Таким образом, для эффективного использования возобновляемых источников энергии требуется надежная и экономичная система хранения энергии (ESS) (Zhang, 2013). Кроме того, ESS может играть важную роль в повышении стабильности и гибкости энергосистемы как в отношении спроса, так и предложения (Dunn et al., 2011).
Воздушно-цинковые батареи являются многообещающим ESS из-за их высокой практической удельной энергии, до 700 Втч / кг (Li et al., 2013). Цинк (Zn) также является привлекательным анодным активным материалом, поскольку он нетоксичен, безопасен, доступен в большом количестве и дешев (Lao-atiman et al., 2017). Кроме того, Zn демонстрирует высокую стабильность и обратимость во время цикла заряда-разряда (Zhu et al., 2016). Zn-воздушные батареи вырабатывают электричество в результате электрохимической реакции Zn и кислорода. Во время разряда батареи анод из цинка окисляется и образует цинкат, а затем превращается в оксид цинка, в то время как на катоде кислород из атмосферы подвергается восстановлению.Поскольку активный катодный материал не заключен в элемент, Zn-воздушные батареи демонстрируют очень высокую плотность энергии. Воздушно-цинковые батареи изготавливаются в различных формах и формах, например, гибкие батареи (Fu et al., 2016; Suren, Kheawhom, 2016; Wang et al., 2017), кабельные батареи (Park et al., 2015 ) и проточные батареи (Bockelmann et al., 2016; Hosseini et al., 2018; Wang et al., 2018). Аккумуляторы Flow имеют широкий диапазон мощностей и гораздо более высокие номиналы емкости. Кроме того, они могут независимо масштабировать мощность и емкость, храня активные материалы вне ячейки.Другими словами, проточные батареи позволяют независимо наращивать характеристики мощности и емкости (Escalante Soberanis et al., 2018). Таким образом, что касается стоимости, гибкости системы, быстрого реагирования и соображений безопасности для крупномасштабных приложений, проточные батареи демонстрируют значительные преимущества по сравнению с другими типами батарей.
БатареиZn-air можно заряжать двумя способами: электрическая подзарядка и механическая подзарядка (Xu et al., 2015; Mainar et al., 2018). Электрически перезаряжаемый Zn-воздушный аккумулятор заряжается путем подачи электричества непосредственно в элемент.Во время перезарядки кислород генерируется на воздушном электроде, в то время как металлический Zn электрохимически регенерируется на цинковом электроде. Существенной проблемой Zn-электрода является образование дендритного Zn во время перезарядки. Более того, во время перезарядки воздушный электрод быстро портится из-за роста пузырьков кислорода и коррозии воздушного электрода (Pei et al., 2014). Эти проблемы являются критическим фактором, ограничивающим жизненный цикл перезаряжаемых Zn-воздушных батарей. Этих проблем можно избежать, используя подход механической подзарядки.Механически перезаряжаемый Zn-воздушный аккумулятор (также известный как Zn-воздушный топливный элемент) можно перезаряжать, напрямую заправляя активный Zn-анод в элемент. Zn, служащий топливом, хранится в резервуаре для хранения и подается в электролизер. В этой конфигурации предотвращается образование дендритного Zn внутри элемента, поскольку Zn регенерируется в других местах, например в электролизере. Кроме того, воздушный электрод батареи не подвержен эрозии пузырьков кислорода и углеродной коррозии. Поскольку Zn регенерируется вне элемента, механически перезаряжаемая Zn-воздушная батарея обычно изготавливается как проточная батарея, так что продукт разряда может циркулировать из элемента.
Zn можно регенерировать различными способами. Тем не менее, наиболее подходящей процедурой для использования с воздушно-цинковыми батареями является электрохимическая регенерация или электролиз. Продукт разряда аккумуляторов можно непосредственно использовать в качестве реагента электролизера или электролизера. Выходящий поток проточной батареи, содержащей цинкат и оксид цинка, подается в электролизер для регенерации Zn. Затем регенерированный Zn заправляется обратно в аккумулятор. Цинково-воздушная батарея, интегрированная с электролизером, может работать как ESS.Постепенно развиваются технологии, основанные на механически перезаряжаемых Zn-воздушных батареях и регенерации Zn. Смедли и Чжан (2007) предложили интегрированную систему из цинково-воздушных топливных элементов и электролизеров, которая была спроектирована для использования в качестве источника аварийной системы резервного питания. Система из 12 ячеек могла обеспечить выходную мощность 1,8 кВт в течение 12 часов. Недавно Amunátegui et al. Разработали ESS на основе батарей Zn-air flow. (2018). Была продемонстрирована пилотная установка с воздушно-воздушно-цинковой батареей мощностью 1 кВт и 4 кВт, имеющая КПД в оба конца 40% и 2000 циклов, соответственно.Было замечено, что кулоновский КПД снизился на 18% из-за явления шунтирующего тока.
Ранее были предложены математические модели для различных типов Zn-воздушных батарей для изучения влияния различных параметров. Мао и Уайт (1992) разработали модель первичной Zn-воздушной батареи, чтобы исследовать поведение батареи в отношении нескольких конструктивных параметров. Их результаты показали, что использование Zn ограничивается истощением гидроксид-иона (OH — ) и существенно зависит от содержания цинка в электроде.Deiss et al. (2002) предложили одномерную математическую модель перезаряжаемой Zn-воздушной батареи и указали, что перераспределение и изменение формы Zn и ZnO приводит к неоднородному Zn-электроду. Изменение формы происходило по мере продвижения цикла батареи. Тем не менее скорость перераспределения замедлялась с увеличением количества циклов. Шредер и Кревер (2014) представили математическую модель вторичной Zn-воздушной батареи для изучения влияния состава воздуха при изотермической работе.
Значительные оценки эффективности электролиза Zn включают морфологию Zn и кулоновскую эффективность процесса (Savaskan et al., 1992; Simičić et al., 2000; Lee et al., 2006; Sharifi et al., 2009; Gavrilović- Wohlmuther et al., 2015). Wang et al. (2015a) также предложили модель электрохимического фазового поля для моделирования роста дендритов Zn. Результаты показали, что рост дендритов можно контролировать, манипулируя градиентом концентрации иона Zn. Более того, рост дендритов может быть подавлен зарядкой импульсным током и протеканием электролита (Garcia et al., 2017). Кроме того, был изучен рост пузырьков кислорода при перезарядке Zn-воздушной батареи. Было обнаружено, что коалесценция пузырьков кислорода может подавляться текущим электролитом.
БатареиZn-air предпочтительно работают с щелочным электролитом. Одной из важных проблем, возникающих в щелочных Zn-воздушных элементах, является коррозия Zn-анода из-за реакции выделения водорода (HER). Это известно как самокоррозия цинкового анода (Wongrujipairoj et al., 2017). Кроме того, в этой реакции расходуется электролит и снижается эффективность использования Zn.Другими словами, выделение водорода способствует потере кулоновской эффективности как во время зарядки, так и в процессе разрядки. Салех и др. (1997) разработали модель щелочного электровыделения Zn с учетом HER для изучения влияния различных рабочих параметров. Кроме того, Dundálek et al. (2017) предложили модель электроосаждения Zn из проточного щелочного электролита с учетом HER и предельной плотности тока восстановления Zn. Модель была использована для изучения взаимосвязи между HER и морфологией осажденного Zn.Тем не менее, HER ранее не рассматривался в математической модели Zn-воздушно-проточной батареи.
Целью данной работы является разработка математической модели воздушно-цинковой батареи, интегрированной с электролизером. В модели также рассматривается реакция выделения водорода как паразитная. Разработанная модель была реализована в MATLAB и проверена на экспериментальных данных. Затем было выполнено моделирование для изучения динамического поведения аккумуляторной системы. Исследование состоит из следующего: (1) краткий обзор Zn-воздушной батареи и Zn-электролизера (2) экспериментальная установка системы для проверки модели (3) разработка модели и проверка модели (4) моделирование система и влияние различных параметров (5) окончательное резюме.
Цинк-воздушный аккумулятор и цинковый электролизер
Zn-воздушная батарея (ZAFB) состоит из двух электродов: Zn-анода и воздушного катода, как показано на Рисунке 1A. Анод и катод разделены разделителем, позволяющим ионам переноситься через ячейку. Водный раствор гидроксида калия (КОН) используется в качестве электролита. На аноде (отрицательном электроде) Zn реагирует с гидроксид-ионами (OH — ) и образует ионы цинката (Zn (OH) 42-), как показано на R1. Когда концентрация цинкат-иона достигает предела растворимости, протекает реакция осаждения оксида цинка (ZnO), как показано в R2.Реакция выделения водорода (HER) также считается паразитной реакцией на цинковом электроде. Вода получает электроны и преобразуется в водород (H 2 ) и ионы гидроксида, как показано на R3. HER в сочетании с реакцией растворения Zn приводит к коррозии цинка, как показано на R4. На катоде (положительный электрод) реакция восстановления кислорода (ORR) потребляет кислород (O 2 ) и воду и производит ионы гидроксида, как описано в R5. Когда батарея разряжается, электроны высвобождаются из реакции R1 и принимаются реакцией R5.Обе реакции протекают и генерируют электричество.
Zn электрод: Zn + 4 OH − ↔rZn Zn (OH) 4 2− + 2e− (R1) Zn (OH) 4 2 − ↔rZnOZnO + 2 OH− + h3O (R2) Паразитарная реакция: 2h3O + 2e− → h3 + 2OH− (R3) Zn + 2OH− + 2h3O → Zn (OH) 4 2− + h3 (R4) Воздушный электрод: 12O2 + h3O + 2 e − ↔rair2 OH− (R5)Рисунок 1 . Принципиальная схема цинково-воздушной батареи и цинкового электролизера: цинково-воздушная батарея (A) и цинковый электролизер (B) .
Zn-электролизер, как показано на рисунке 1B, состоит из электрода регенерации Zn (отрицательный электрод) и воздушного электрода (положительный электрод).Зарядный ток подается в электролизер, вызывая протекание обратных реакций ZAFB: ионы цинката в качестве реагента превращаются обратно в Zn, а гидроксид-ионы на отрицательном электроде (реверсирование R1). HER (R3) также значительно влияет на производительность электролизера, поскольку вода в электролите может получать электроны непосредственно от тока заряда. На положительном электроде реакция выделения кислорода (OER; реверсирование R5) превращает ионы гидроксида в кислород и воду.
ZAFB, интегрированный с Zn-электролизером, может использоваться в качестве системы хранения энергии. На рисунке 2 проиллюстрирована интегрированная система соединения ZAFB с Zn-электролизером. Электролит циркулирует между аккумулятором и электролизером. Во время разряда ZAFB потребляет Zn и производит ион цинката. Стоки из ZAFB, содержащие высокую концентрацию иона цинката, подают в электролизер. Электролизер потребляет электроэнергию для регенерации Zn. Затем ионы цинката превращаются в Zn.Для сравнения, сток из электролизера, содержащий более низкую концентрацию цинкат-иона, подается в ZAFB. Кроме того, Zn, регенерированный из электролизера, механически переносится в ZAFB.
Рисунок 2 . Принципиальная схема воздушно-цинковой батареи, интегрированной с цинковым электролизером.
Экспериментальная установка
Модель, разработанная в этой работе, была проверена на экспериментальных данных, полученных от Zn-воздушной батареи и Zn электролизера.Экспериментальная установка батареи включала пакетную схему с анодной пластиной из Zn, сепаратором и воздушным катодом. Анод Zn состоял из 10 г гранул Zn со средним диаметром 0,8 мм, загруженных внутрь мешочка из нержавеющей стали размером 100 меш, функционирующего как токоприемник. Площадь токоприемника 10 см 2 . Сепаратор был приготовлен путем наливания 2 г 24 мас.% Водного раствора поли (винилацетата) (PVAc) на обе стороны фильтровальной бумаги и затем высушивания в печи при 55 ° C в течение 10 минут.Пластина с воздушным катодом состояла из трех слоев: газодиффузионного слоя, катодного токоприемника и слоя катализатора. Пеноникелевый пенопласт (толщиной 0,5 мм, 100 PPI) использовался в качестве катодного токоприемника. Газодиффузионный слой изготавливали путем заливки суспензии смеси из 4 г углеродной сажи, 4 г порошка ПТФЭ и 2 г глюкозы в 50 мл этанола на одну сторону пены никеля. Пеноникелевый слой с покрытием затем подвергали термическому прессованию при 350 ° C в течение 15 мин с использованием ручного пресса для горячего прессования. Затем слой катализатора был изготовлен на другой стороне пены никеля путем добавления суспензионной смеси из 3 г MnO 2 и 7 г углеродной сажи в растворенном связующем растворителе.Растворитель получали растворением 1 г сополимера полистирола и бутадиена (4% бутадиена, Sigma Aldrich) в качестве связующего в 50 мл толуола. Катод, покрытый катализатором, затем отжигали при 110 ° C в печи. Газодиффузионный слой обладает хорошей гидрофобностью. Гидрофобность газодиффузионного слоя предотвращает утечку электролита и затопление катода водой. Этот слой также позволяет газу кислорода из атмосферы проникать через ячейку. Активная площадь катода составляла 10 см 2 .В качестве электролита использовали водный раствор КОН (7 М). Электролит общим объемом 150 мл подавался через ячейку со скоростью циркуляции 50 мл / мин с помощью перистальтического насоса.
Экспериментальная установка электролизера аналогична аккумуляторной. Электролизер состоял из стопки с катодной пластиной, сепаратором и анодом. Катодная пластина изготовлена из нержавеющей стали с активной площадью 10 см 2 . Сепаратор был приготовлен заливкой 2 г 24 мас.% Водного раствора ПВА с обеих сторон фильтровальной бумаги, а затем сушили в печи при 55 ° C в течение 10 мин. Анод был изготовлен из пеноникеля (толщиной 0,5 мм, 100 PPI) площадью 10 см 2 .
Для проверки математических моделей ZAFB и Zn-электролизера была исследована поляризационная характеристика ZAFB. Напряжение и ток ячейки измерялись анализатором батарей BA500 с использованием программного обеспечения BA500WIN. Токовый вход можно отрегулировать вручную, и напряжение ячейки постоянно измеряется при выбранном токе.Данные напряжения ячейки собирались каждую секунду. Для одного значения тока данные напряжения собирались в течение 10 с, и 10 значений напряжения использовались для расчета среднего напряжения ячейки. После этого текущее значение было изменено на следующее значение. Для измерения перенапряжения электродов в качестве электрода сравнения использовался электрод из ртути / оксида ртути. Перенапряжение рассчитывалось по разности потенциалов между электродом сравнения и равновесным потенциалом каждого электрода.
Математические модели
В этом разделе описаны математические модели ZAFB и Zn электролизера. Модели были разработаны на основе следующих предположений:
• Температурные колебания незначительны: предполагается изотермический режим при 298,15 К. Как ZAFB, так и Zn-электролизер работают при комнатной температуре.
• Нульмерное пространство: все переменные и параметры внутри ячейки не зависят от местоположения.Градиент концентрации внутри ячейки очень мал, и им можно пренебречь. Это предположение верно, потому что реакции достаточно медленные; скорость реакции электрода относительно ниже, чем скорость массопереноса. Следовательно, предполагаются однородные концентрации в каждой ячейке. В предыдущей литературе также рассматривалось подобное предположение. Например, Шредер и Кревер (2014) предложили нульмерную модель воздушно-цинковой батареи, которая использовалась для исследования влияния состава воздуха на характеристики элемента.Dundálek et al. (2017) опубликовали нульмерную модель электроосаждения цинка с проточным электролитом.
• Незначительное расстояние между ячейками: сток электролизера немедленно влияет на ZAFB. Таким же образом стоки ZAFB мгновенно воздействуют на электролизер.
• Постоянные физические свойства, площадь и толщина электродов: предполагается, что свойства материала постоянны, поскольку состояние температуры и давления постоянное. Площадь и толщина электрода также предполагались постоянными в соответствии с конструкцией ячейки.
• Окисление / восстановление Zn на цинковом электроде и ORR / OER на воздушном электроде: за пределами зоны реакции реакция не происходила.
• Емкостные эффекты незначительны: предполагается, что система находится в состоянии квазиэлектронейтральности.
• Идеальное поведение газа: применяется закон идеального газа, когда система работает при атмосферном давлении.
• Двоичная массовая диффузия: скорость диффузии определяется законом Фика.
Остатки видов
Баланс молярных концентраций частиц k , включая OH — , Zn (OH) 42- и H 2 O, выражается уравнением (1).Верхний индекс j представляет электрод или положение относительно Zn электрода ( j = цинк) и воздушного электрода ( j = воздух):
dCkjdt = 1Velectrolytej · [Fk, in − Fk, out + Jk + ∑ivk, i · ri −CkjdVelectrolytejdt] (1), где C k — концентрация частиц k, V электролит — объем электролита, F k — молярный расход частиц k , v k, i — стехиометрический коэффициент компонента k в реакции i, r i — скорость реакции i (моль / с). Дж k — пересечение молярной скорости переноса между Zn и воздушными электродами вида k , включая диффузию (diff), миграцию (mig) и конвекцию (conv), и может быть рассчитана как в уравнении (2):
Jk = Jkdiff + Jkmig + Jkconv, где: Jkdiff = Dk · (Ckair − Ckzinc) δsep · εsep · Asep Jkmig = tkzk ± F · icell · εsep · Asep Jkconv = Fconv · Ckzinc (2), где D k — коэффициент диффузии частиц k , ε sep — пористость сепаратора, A sep — площадь сепаратора, δ sep — толщина сепаратора, t k — число переноса иона k , zk ± — число разновидностей иона k, F — постоянная Фарадея, i cell — плотность тока, F conv — конвективный объемный поток переход между цинковыми и воздушными электродами.
Fconv = ∑kJk · V¯k (3)Исходя из предположения о нулевом пространстве, молярный расход на выходе для частиц k ( F k , out ) можно рассчитать, как в уравнении (4). Условия электронейтральности применяются к зарядовому балансу ионных частиц, как показано в уравнении (5):
Fk, out = Ckzinc · Вэлектролитцинк · SV (4), где SV — пространственная скорость.
Накопление ZnO выражается молярным балансом реакции R2.Твердый Zn рассчитывается аналогично реакции R1:
. dNZnOdt = vZnO, 2 · rZnO (6) dNZndt = vZn, 1 · rZn (7), где N ZnO — моль ZnO, N Zn — моль Zn.
Скорость реакций
Скорости реакции R1, R3 и R5 моделируются методом реакции Фарадея, выраженным в уравнениях (8–10), соответственно:
rZn = iZn · AzincneF (8) rH = iH · AzincneF (9) rair = iair · AairneF (10), где r Zn , r H и r воздух — скорости реакции R1, R3 и R5 соответственно. i Zn , i H и i air — плотность тока, связанная с реакцией R1, R3 и R5 соответственно. n e — количество обменных электронов, участвующих в реакции.
Для реакции осаждения ZnO (уравнение R2) скорость реакции выражается методом насыщения (Sunu and Bennion, 1980):
rZnO = ks (CZn (OH) 42 −− CZn (OH) 42 − sat) (11), где r ZnO — скорость реакции R2, k с — константа скорости реакции R2, а CZn (OH) 42-sat — предельная концентрация насыщения Zn (OH) 42-.
Изменение объема
Изменение объема твердого электрода можно выразить следующим образом:
dVsolidzincdt = dNZndt · V¯Zn + dNZnOdt · V¯ZnO (12)Изменение объема электролита можно рассчитать соответственно:
dVelectrolytezincdt = ∑k (Velectrolytezinc · dCkzincdt + Ckzinc · dVelectrolytezincdt) · V¯k (13) dVelectrolyteairdt = −Fconv + rair∑kvk, air · V¯k (14) ε = 1 − VsolidzincδzincAelecZn (15), где V̄k — удельный молярный объем частиц k , ε — пористость цинкового электрода, Vsolidzinc — объем твердого цинкового электрода, δ цинк — толщина цинкового электрода и A elecZn — площадь поверхности Zn электрод.
Потенциал ячейки
Потенциал ячейки ( E, , , ячейка ) может быть вычислен из потенциала Нернста ( E 0, ячейка ) минус с перенапряжениями, как выражено в уравнении (16). Включенные перенапряжения включают перенапряжение активации Zn (ηactzinc), перенапряжение активации воздухом (ηactair) и омическое перенапряжение (η омическое сопротивление ):
Ecell = E0, cell − ηactzinc − ηactair − ηohmic (16) E0, ячейка = Eair − Ezinc (17), где E воздух — потенциал воздушного электрода, а E цинк — потенциал цинкового электрода.
Eair = E0air + RTne · Fln ((PO2 / Pref) 0,5 (COH-air / Cref) 2) (18) Ezinc = E0zinc + RTne · Fln ((CZn (OH) 42-цинк / Cref) (COH-цинк / Cref) 4) (19), где E0air — стандартный электродный потенциал воздушного электрода, E0zinc — стандартный электродный потенциал цинкового электрода, P O 2 — парциальное давление кислорода, P ref — давление в исходном состоянии и C ref — концентрация в эталонном состоянии.
Потеря активации
Потери активации цинкового электрода (ηactzinc) могут быть рассчитаны из общего тока на цинковом электроде, включая растворение или регенерацию Zn ( i Zn ) и HER ( i H ), как описано в уравнениях (20 –25):
dηactzincdt · CDLzinc = icell− (iZn + iH) iZn = i0zinc · [exp (αzincneFRTηactzinc) — (CZn (OH) 42−, sCZn (OH) 42−, b) (20) exp (- (1 − αzinc) neFRTηactzinc)] (21) iH = i0H · [exp (αHne, HFRTηH) −exp (- (1 − αH) ne, HFRTηH)] (22)где CDLzinc — емкость двойного слоя цинкового электрода, i0zinc — плотность тока обмена цинкового электрода, i0H — плотность тока обмена HER, α — коэффициент переноса заряда, CZn (OH) 42-, s — концентрация цинкат-иона при на поверхности электрода, CZn (OH) 42-, b — концентрация цинкат-иона в объеме электролита, а η H — перенапряжение HER на цинковом электроде, которое можно рассчитать по уравнениям (23–25).
ηH = ηactzinc + △ EZH (23) △ EZH = Ezinc − EH (24) EH = E0H − RTne.Fln (COH-цинкCref) (25), где E ZH — разность потенциалов между реакцией электрода Zn и HER, E H — потенциал электрода HER, E0H — стандартный потенциал электрода HER. Плотность обменного тока (i0zinc) цинкового электрода можно рассчитать по уравнениям (26–29). Эталонная плотность обменного тока (i0Zn, ref) может быть рассчитана из корреляции между плотностью обменного тока и концентрацией OH —, согласованной с экспериментальными данными Дирксе и Хэмпсона (1972), как определено в уравнении (26):
i0Zn, ref = 0.0281 + 0,0613COH −− 0,0041COH− 2 (26) Xzinc = Vsolid, Zn 2 / 3Vsolid, Zn 2/3 + Vsolid, ZnO 2/3 (27) при = a0 (1 − ε1 − ε0) 2/3 (28) i0zinc = i0ref, zincasXzinc (29), где X цинк — доля активной поверхности Zn в твердой фазе, V твердое тело, k — объем твердых частиц k, a s — площадь поверхности раздела твердого раствора на единицы объема, a 0 — начальная площадь поверхности раздела твердый раствор на единицу объема, а ε 0 — начальная пористость Zn-электрода.Уравнение (21) выражает ток цинкового электрода, включая окисление и восстановление. Для электролизера термин (CZn (OH) 42-, sCZn (OH) 42-, b) относится к пределу диффузии цинкат-иона в реакции восстановления Zn (Ito et al., 2012; Dundálek et al., 2017). Концентрация цинкат-иона на поверхности электрода (CZn (OH) 42-, s) и в объеме электролита (CZn (OH) 42-, b) может быть описана как в уравнениях (30) и (31):
dCZn (OH) 42−, sdt = 1V Электролит [rZn − DZn (OH) 42−, elec × (CZn (OH) 42−, s − CZn (OH) 42−, b) δZn (OH) 42−, diffAelecZn + CZn (OH) 42-, sdVelectrolytedt] (30) dCZn (OH) 42−, bdt = 1V Электролит [FZn (OH) 42−, in − FZn (OH) 42−, out − rZnO + DZn (OH) 42−, elec (CZn (OH) 42−, s − CZn) (OH) 42−, б) δZn (OH) 42−, diffAelecZn + CZn (OH) 42−, sdVelectrolytedt] (31), где DZn (OH) 42-, — коэффициент диффузии цинкат-иона в электролите.Толщина слоя диффузии ионов цинката (δZn (OH) 42-, diff) может быть рассчитана по формулам (32–35):
δZn (OH) 42−, diff = dhSh (32) Sh = 1,85 (dhLReSc) 1╱ 3 (33) Re = dhvρelecμ (34) Sc = μDZn (OH) 42−, эл. (35)где DZn (OH) 42-, elec — коэффициент диффузии цинката в электролите, CZn (OH) 42-, b — концентрация цинката в объеме электролита, δZn (OH) 42-, diff — толщина диффузии цинкат-иона. слоя, d h — гидравлический диаметр, Sh — число Шервуда, Re — число Рейнольдса, Sc — число Шмидта, ν — скорость электролита, μ — вязкость электролита, а ρ elec — плотность электролита.
Потери активации воздушного электрода (ηactair) могут быть рассчитаны соответственно:
dηactairdt.CDLair = icell − iair iair = i0air. [(CO2, sCO2, атм) exp (αairneFRTηactair) (36) −exp (- (1 − αair) neFRTηactair)] (37), где CDLair — емкость двойного слоя воздушного электрода, i air — плотность тока относительно реакции воздушного электрода, C O 2 , атм — концентрация кислорода в атмосфере.Плотность обменного тока воздушного электрода (i0air) выражается в уравнении (38). Концентрация кислорода на поверхности катализатора ( C O 2 , s ) может быть рассчитана с использованием баланса молярной концентрации, как описано в уравнении (39).
i0air = i0air, refacδactive (38) dCO2, sdt = 1V электролит. [- 0,5 rair − DO2, air (CO2, s − CO2, atm) δGDLAair + CO2, sdVelectrolyteairdt] (39), где D O 2 , воздух — коэффициент диффузии кислорода в воздушном электроде, δ GDL — толщина газодиффузионного слоя воздушного электрода, а A воздух — активная площадь поверхности воздушного электрода.
Омическая потеря
Омические потери (η омические ) выражаются законом Ома. Общее омическое сопротивление ( R омическое ) рассчитывается на основе проводимости и удельного сопротивления соответствующих химических веществ и компонентов клетки. Электропроводность анода учитывается проводимостью твердых частиц и мольной долей в твердом электроде.
ηohmic = icell · Acell · Rohmic (40) Rohmic = δzincσanodeAzinc + δэлектролитσэлектролитAэлектролит + δairσcathodeAair + RcompδcompAcell (41) σанод = (NZnNZn + NZnOσZn + NZnONZn + NZnOσZnO) (1 − ε) + σэлектролитыε (42), где δ цинк , δ электролит и δ воздух — толщина цинкового электрода, канала электролита и воздушного электрода, соответственно.σ анод , σ электролит и σ катод — это проводимость цинкового электрода, канала электролита и воздушного электрода, соответственно. R comp и δ comp — удельное сопротивление и равновесная толщина других компонентов ячейки. σ Zn и σ ZnO — проводимость Zn и оксида цинка соответственно.
Разработанная модель была реализована и смоделирована в MATLAB. Расчетные параметры и условия эксплуатации приведены в таблице S1 дополнительных материалов.Начальные условия при t = 0 с перечислены в таблице S2 в дополнительных материалах.
Результаты и обсуждение
Проверка модели
Что касается валидации ZAFB и модели электролизера, два параметра, включая толщину активного воздушного электрода (δ активный ) и сопротивление других компонентов ячейки ( R comp ), были скорректированы вручную для соответствия прогноз модели с экспериментальными данными. Подгоняемые значения δ active и R comp составляли 30 мкм и 5 Ом.см соответственно. На рисунке 3А показано сравнение поляризационной кривой между данными моделирования и экспериментальными данными ZAFB. Было замечено хорошее согласие между предсказанием модели и экспериментальными данными. Сравнение общего перенапряжения электродов между прогнозом модели и экспериментальными данными показано на рисунке 3B. Перенапряжение каждого электрода представляет собой комбинацию перенапряжения активации электрода и омических потерь. Предполагалось, что омические потери на катоде составляют половину общих омических потерь ячейки.Омические потери на аноде также составляют половину общих омических потерь ячейки. Сравнение было приемлемым для Zn перенапряжения. В случае воздушного электрода наблюдалось небольшое смещение. Это смещение могло возникнуть из-за омических потерь, которые произвольно увеличивают перенапряжение активации. Измеренное перенапряжение электродов в ходе эксперимента включало некоторую часть омического перенапряжения, которую нельзя отличить от перенапряжения активации. Модель смоделировала активационное перенапряжение и омическое перенапряжение отдельно.Таким образом, было обнаружено, что измеренные перенапряжения отличаются от смоделированных перенапряжений. Кроме того, сообщалось о дифференциации воздушного электрода (Schröder et al., 2016). Однако эта дифференциация не была включена в модель здесь. Что касается Zn-электролизера, то на рисунках 3C, D показано сравнение потенциала ячейки и абсолютного перенапряжения электродов между моделированием и экспериментом. Наблюдалась приемлемая достоверность результатов моделирования и экспериментальных данных.Небольшое смещение все еще проявлялось в перенапряжении воздушного электрода. При зарядке было отмечено, что рост пузырьков кислорода на воздушном электроде может влиять на поведение воздушного электрода (Wang et al., 2015b). Тем не менее в этой модели не учитывается влияние пузырьков кислорода.
Рисунок 3 . Валидация предложенных моделей: (A) поляризационная характеристика ZAFB (B) анодная и катодная перенапряжение ZAFB (C) поляризационная характеристика Zn-электролизера и (D) анодно-катодная перенапряжение Zn-электролизера.
Производительность батареи
ZAFB с 10 г исходного Zn (0,1538 моль Zn) был смоделирован для анализа производительности в зависимости от объемной скорости, концентрации КОН и начальной концентрации цинкат-иона. Плотность разрядного тока составляла 100 мА / см 2 . Моделирование проводилось до исчерпания Zn. Производительность ZAFB оценивалась по его эффективности по току и энергии разряда в конце моделирования. Выход по току ZAFB определяется как отношение полного разрядного тока к электрохимическому эквивалентному току Zn-электрода.В этом случае КПД по току был рассчитан следующим образом:
КПД по току ZAFB = icellAelecZntf2F (NZn, 0 − NZn, f) (43), а энергия разряда определяется по формуле:
Энергия разряда (Вт · ч) = ∑t = 0tf (Ecell) (icellAelecZntf) 3600 (44), где t f — общее время работы в секундах, N Zn, 0 — начальный моль Zn и N Zn, f — конечный моль Zn.
Как показано на рисунке 4, эффективность тока и энергия разряда ZAFB были исследованы как функции концентрации КОН и объемной скорости.Рисунок 4A показывает, что более высокая концентрация КОН обеспечивает более низкую эффективность, чем более низкая концентрация КОН. Это указывает на то, что коррозия цинкового электрода увеличивается при увеличении концентрации КОН. Коррозия была больше при более высокой концентрации КОН, поскольку обратимая разность потенциалов между реакцией на цинковом электроде и HER (Δ E ZH ) была отрицательно больше при более высокой концентрации КОН, как показано на рисунке 5. Δ E ZH вносит вклад в перенапряжение HER (η H ) и управляет током HER, как показано в уравнениях (22, 23) соответственно.Влияние концентрации КОН на коррозию цинка также исследовалось другими исследователями с использованием различных методов (Muralidharan and Rajagopalan, 1978; Ravindran and Muralidharan, 1995; El-Sayed et al., 2012). Муралидхаран и Раджагопалан (1978) изучали коррозию цинка в растворе гидроксида натрия с помощью стационарной и переходной экстраполяции тафеля. Равиндран и Муралидхаран (1995) определили скорость выделения водорода газометрическим методом и исследовали поведение цинка в щелочном электролите.Эль-Сайед и др. (2012) предложили исследование коррозии Zn в щелочном растворе с помощью тафелевого графика и спектроскопии электрохимического импеданса (EIS). Исследования, упомянутые выше, полностью согласуются с результатами, касающимися влияния концентрации КОН на выделение водорода. Однако, когда концентрация КОН увеличилась, это оказало другое влияние на энергию разряда, как показано на рисунке 4B. Следовательно, когда концентрация КОН достигала около 6 М, это обеспечивало максимальную плотность обменного тока растворения Zn и максимальную ионную проводимость.Использование КОН в концентрации более или менее 6 М уменьшало расход энергии ZAFB. Таким образом, при концентрации 6 М КОН была достигнута максимальная эффективность ZAFB.
Рисунок 4 . Влияние концентрации КОН на ZAFB с использованием начальной концентрации цинкат-иона 0,2 M и плотности тока разряда 100 мА / см 2 : (A) КПД по току как функция объемной скорости и (B) энергия разряда как функция космической скорости.
Рисунок 5 .Влияние начальной концентрации цинкат-иона на Δ E ZH в зависимости от концентрации КОН.
Что касается влияния расхода, увеличение объемной скорости электролита обеспечивало более низкий выход по току, поскольку более высокий расход электролита поддерживал более высокую концентрацию КОН, что способствовало более высокой коррозии. Однако скорость потока оказывала меньшее влияние при более низкой концентрации КОН.
На рис. 6 показано влияние концентрации ионов цинка на производительность ZAFB.Результаты показали, что увеличение концентрации цинкат-иона приводит к увеличению выхода по току и энергии разряда батареи. Это произошло потому, что на выделение водорода влияла концентрация цинкат-иона. Ранее на рисунке 5 показана зависимость между Δ E ZH и концентрацией иона цинката. Когда концентрация цинкат-иона увеличивается, Δ E ZH уменьшается из-за уменьшения обратимого потенциала цинкового электрода ( E цинк ).Согласно предыдущей работе Shivkumar et al. (1995) сообщалось, что добавление ZnO снижает выделение водорода и растворение Zn. Предыдущая работа пришла к такому же выводу, что и приведенный здесь результат.
Рисунок 6 . Влияние начальной концентрации цинкат-иона на ZAFB с использованием 8 M КОН при плотности тока разряда 100 мА / см 2 : (A) КПД по току как функция объемной скорости и (B) энергия разряда как функция космическая скорость.
Характеристики электролизера
В случае электролизера моделирование было выполнено для изучения эффектов объемной скорости, концентрации КОН и концентрации ионов цинка с использованием плотности тока заряда 100 мА / см 2 . Целевое количество регенерированного Zn составляло 10 г. Моделирование было прекращено, когда было достигнуто целевое количество Zn. Токовая эффективность электролизера — это отношение эквивалентного тока для регенерации Zn к общему приложенному току.Эффективность тока и энергия заряда электролизера выражаются как:
КПД электролизера по току = 2F (NZn, f − NZn, 0) icellAelecZntf (45) Энергия заряда (Вт · ч) = ∑t = 0tf (Ecell) (- icellAelecZntf) 3600 (46)Производительность Zn-электролизера оценивалась по выходному току и энергии заряда, как показано на рисунке 7. Было обнаружено, что поток электролита оказывает значительное влияние на производительность электролизера. Увеличение объемной скорости увеличивало КПД по току, но уменьшало энергию заряда.Высокая скорость потока была предпочтительной, потому что увеличение скорости потока уменьшало толщину диффузионной пленки иона цинката. Следовательно, восстановление Zn стимулировалось, а HER подавлялось. Что касается влияния концентрации цинкат-иона, то при увеличении концентрации цинкат-иона повышается выход по току и уменьшается энергия заряда. Более высокая концентрация цинкат-иона обеспечивает большую движущую силу диффузии и, таким образом, усиливает реакцию восстановления Zn. Увеличение концентрации цинкат-иона также уменьшало Δ E ZH HER, что также подавляло коррозию цинкового электрода.Многие предыдущие работы пришли к такому же выводу о влиянии цинкат-иона на электроосаждение Zn, как и в результате, представленном здесь (Einerhand et al., 1988; Sharifi et al., 2009; Dundálek et al., 2017). Einerhand et al. (1988) сообщили, что высокая концентрация иона цинката способствует образованию слоя ZnO на поверхности Zn-электрода, который защищает Zn от коррозии. Dundálek et al. (2017) также подчеркнули связь между морфологией осаждения Zn, состоянием электролита и HER и пришли к выводу, что для электроосаждения Zn с низким HER предпочтительны высокие скорость потока и концентрация ионов цинка.
Рисунок 7 . Влияние начальной концентрации цинкат-иона на цинковый электролизер с использованием 8 M KOH при плотности тока заряда 100 мА / см 2 : (A) КПД по току как функция пространственной скорости и (B) Энергия заряда как функция космической скорости.
Что касается влияния концентрации КОН, как показано на Рисунке 8, было замечено, что концентрация КОН оказывала сложное влияние на выход по току и энергию заряда.Концентрация КОН была связана с пределом насыщения цинкат-иона. Когда ион цинката не был насыщен, концентрация КОН мало влияла на выход по току в области с низким расходом. Однако другая тенденция наблюдалась в области высоких расходов (объемная скорость более 1 в секунду). В области высоких расходов увеличение концентрации КОН обеспечивает более низкий выход по току из-за увеличения Δ E ZH . Что касается влияния на энергию заряда, более высокая концентрация КОН требовала более высокой энергии заряда из-за более высокого потенциала Нернста ( E 0, ячейка ).Sharifi et al. (2009) также изучали электролиз цинка с использованием различных концентраций КОН и пришли к такому же выводу. Когда ион цинката был насыщен, влияние на выход по току и энергию заряда отличалось от влияния ненасыщенного иона цинката. Концентрация КОН имела меньшее влияние в области высокого расхода, но имела прямое влияние в области низкого расхода. Когда концентрация КОН увеличивалась, эффективность имела тенденцию к увеличению из-за предела насыщения цинкат-иона. Предел насыщения увеличился из-за увеличения концентрации КОН.Влияние предела насыщения показало аналогичную тенденцию с эффектом концентрации ионов цинката, как на рисунке 7. Более высокий предел насыщения обеспечивает более высокую эффективность.
Рисунок 8 . Влияние концентрации КОН с использованием различных исходных концентраций цинкат-иона [0,2 M (пунктирная линия) и насыщенного цинкат-иона (сплошная линия)] при плотности тока разряда 100 мА / см 2 : (A) Эффективность тока в зависимости от объемная скорость и энергия заряда (B) как функция объемной скорости.
Интегрированная система
Была смоделирована операция с одинаковой плотностью тока заряда-разряда 100 мА / см 2 . Исходный Zn в ZAFB составлял 10 г (0,1538 моль Zn). Истощение Zn в ZAFB было критерием прекращения. Текущий КПД интегрированной системы определяется как отношение общего количества регенерированного Zn к общему количеству использованного Zn, как в уравнении (47). Другой оценкой производительности является энергоэффективность, которая выражается как отношение энергии разряда к энергии заряда, как описано в уравнении (48):
КПД интегрированной системы по току = NZn, электролизер − NZn, 0 электролизер-NZn, 0 аккумулятор − NZn, f аккумулятор (47) Энергоэффективность = Энергия разряда (Втч) Энергия заряда (Втч) (48)Затем производительность интегрированной системы была исследована с учетом различных рабочих параметров i.е., объемная скорость, концентрация КОН и концентрация цинкат-иона.
Текущий КПД и энергоэффективность интегрированной системы показаны на рисунке 9. Было замечено, что тенденции эффективности интегрированной системы были сопоставимы с тенденциями эффективности заряда электролизера, как показано на рисунках 9A – C. Можно сделать вывод, что эффективность интегрированной системы во многом зависит от электролизера. Результаты показали, что увеличение расхода увеличивает выход по току, за исключением низкой концентрации ионов цинката.При низкой концентрации цинката точка перегиба наступала в диапазоне объемной скорости 0,1–1 с –1 и особенно при концентрации цинката 0,2 М. Состояние внизу кривой — это такое состояние, при котором общее количество иона цинката, переносимого на поверхность электрода, является минимальным по сравнению с соседним состоянием. Увеличение расхода положительно сказалось на энергоэффективности системы. В случае сравнения влияния концентрации цинкат-иона более высокая концентрация цинкат-иона обеспечивает лучшие характеристики во всем диапазоне объемной скорости.Увеличение концентрации цинкат-иона позволило подавить HER и повысить эффективность тока как для разряда, так и для зарядки. При объемной скорости, приблизительно меньшей 0,1 с -1 , увеличение концентрации ионов цинката улучшало энергоэффективность. Напротив, при объемной скорости более 1 с -1 увеличение концентрации цинкат-иона оказывало неблагоприятное влияние на энергоэффективность.
Рисунок 9 . Влияние начальной концентрации цинкат-иона с использованием 8 M KOH при плотности тока заряда и разряда 100 мА / см 2 : (A) КПД по току как функция пространственной скорости (B) Эффективность разряда как функция пространства скорость (C) Эффективность заряда как функция объемной скорости и эффективность (D) как функция объемной скорости.
На Рисунке 10 была исследована производительность интегрированной системы: а именно, от 2 до 10 M КОН. Было замечено, что кривая эффективности может быть разделена на 2 области: область до и после точки перегиба. Для области перед точкой перегиба эффективность возрастала с увеличением концентрации КОН. Ион цинката был здесь насыщенным. Впоследствии, когда концентрация КОН увеличилась, предел насыщения иона цинката увеличился. Следовательно, диффузия ионов цинката также улучшилась.С другой стороны, эффективность снижалась по мере увеличения концентрации КОН для области после точки перегиба. Ион цинката в этой области не был насыщен. Таким образом, концентрация цинкат-иона не сильно различалась между различными концентрациями КОН. Однако HER все еще усиливался по мере увеличения концентрации КОН. Видно, что концентрация 8 М КОН обеспечивала максимальную энергоэффективность. Затем следовало концентрирование 6 М КОН. Энергоэффективность определялась производительностью процесса разряда, на которую в основном влияла оптимальная концентрация КОН.Как упоминалось ранее в разделе о характеристиках батареи, концентрация примерно от 6 до 7 М КОН обеспечивала максимальную плотность тока обмена при реакции цинкового электрода и максимальную ионную проводимость. Следовательно, в случае интегрированной системы концентрации КОН в 6 и 8 М показали оптимальные характеристики.
Рисунок 10 . Влияние концентрации КОН с использованием начальной концентрации цинкат-иона 0,2 M при плотности тока заряда и разряда 100 мА / см 2 : (A) КПД по току как функция объемной скорости (B) Эффективность разряда как функция объемная скорость (C) эффективность заряда как функция объемной скорости и (D) энергоэффективность как функция объемной скорости.
Заключение
В этой работе математическая модель Zn-воздушной батареи, интегрированной с Zn-электролизером, включая модель HER, была разработана для оценки производительности системы. При этом были исследованы следующие параметры: расход электролита, концентрация гидроксида калия (КОН) и начальная концентрация цинкат-иона. Кроме того, было исследовано влияние реакции выделения водорода (HER) на работу системы накопления энергии Zn-воздух. При исследовании было обнаружено, что концентрация КОН оказывает значительное влияние на характеристики батареи.Кроме того, было отмечено, что увеличение концентрации КОН увеличивает HER и снижает выход по току. Однако оптимальная концентрация КОН, составляющая около 6–7 М, обеспечивала максимальную энергию разряда. Повышение начальной концентрации цинкат-иона позволило подавить HER и повысить эффективность тока батареи из-за уменьшения обратимой разности потенциалов между реакцией Zn-электрода и HER. Что касается электролизера, результаты показали, что производительность электролизера определяется начальной концентрацией цинкат-иона и расходом электролита.Когда начальная концентрация цинкат-иона увеличивалась вместе с расходом, выход по току значительно увеличивался. Кроме того, энергия заряда была уменьшена из-за увеличения диффузии ионов цинката к поверхности электрода. Тем не менее, увеличение концентрации КОН не улучшило напрямую рабочие характеристики электролизера, но способствовало увеличению предела насыщения цинкат-иона, что улучшило рабочие характеристики электролизера. Для всей интегрированной системы было замечено, что КПД интегрированной системы по току определялся электролизером.Следовательно, увеличение начальной концентрации цинкат-иона и расхода электролита положительно сказалось на эффективности тока интегрированной системы. С другой стороны, на энергоэффективность интегрированной системы существенно повлияла разрядная ячейка. Максимальная энергоэффективность была получена за счет оптимальной концентрации КОН, аналогичной энергии разряда проточной батареи. Результаты этой работы описали роль, которую HER внесла в работу интегрированной системы Zn-воздушной батареи и Zn-электролизера.В целом было обнаружено, что HER отрицательно влияет на производительность интегрированной системы. В заключение можно заметить, что управление рабочими условиями оказалось эффективным способом уменьшить HER и добиться оптимальной производительности интегрированной системы.
Авторские взносы
SK задумал исследовательский проект. WL провела эксперименты и выполнила моделирование. КБ проводил эксперименты в процессе доработки. Анализ данных был проведен WL при консультации со SK.Статья была написана WL и SK, и все авторы внесли свой вклад в последующие черновики. Все авторы рецензировали рукопись.
Финансирование
Исследование поддержано Чулалонгкорнским проектом по продвижению академических кругов во втором веке, Университет Чулалонгкорн. WL благодарит стипендию Дусадепипат Чулалонгкорнского университета.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Все авторы благодарны за поддержку со стороны Управления высшего образования Таиланда, Университета Чулалонгкорн и правительства Франции / Кампуса Франции в рамках Франко-тайской программы сотрудничества в области высшего образования и исследований / Франко-тайской программы мобильности / PHC SIAM. Кроме того, авторы хотели бы поблагодарить г-на Киджчай Канджанапапаркула за его самоотверженную помощь в изготовлении батарей.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https: // www.frontiersin.org/articles/10.3389/fenrg.2019.00015/full#supplementary-material
Список литературы
Амунатеги, Б., Ибаньес, А., Сьерра, М., и Перес, М. (2018). Электрохимический накопитель энергии для интеграции возобновляемых источников энергии: воздушно-цинковые батареи. J. Appl. Электрохим. 48, 627–637. DOI: 10.1007 / s10800-017-1133-7
CrossRef Полный текст | Google Scholar
Бокельманн, М., Кунц, У., и Турек, Т. (2016). Электрически перезаряжаемый цинк-кислородный проточный аккумулятор с высокой удельной мощностью. Электрохим. Comm. 69, 24–27. DOI: 10.1016 / j.elecom.2016.05.013
CrossRef Полный текст | Google Scholar
Дайсс, Э., Хольцер, Ф., и Хаас, О. (2002). Моделирование электрически перезаряжаемой Zn – воздушной щелочной батареи. Электрохим. Acta. 47, 3995–4010. DOI: 10.1016 / S0013-4686 (02) 00316-X
CrossRef Полный текст | Google Scholar
Диркс, Т. П., и Хэмпсон, Н. А. (1972). Реакция обмена Zn (II) / Zn в растворе КОН — I. обменные измерения плотности тока гальваностатическим методом. Электрохим. Акт а. 17, 135–141. DOI: 10.1016 / 0013-4686 (72) 85014-X
CrossRef Полный текст | Google Scholar
Dundálek, J., Šnajdr, I., Libánský, O., Vrána, J., Pocedič, J., Mazúr, P., et al. (2017). Электроосаждение цинка из проточных щелочных растворов цинката: роль реакции выделения водорода. J. Power Sour. 372, 221–226. DOI: 10.1016 / j.jpowsour.2017.10.077
CrossRef Полный текст | Google Scholar
Эйнерханд, Р. Э. Ф., Visscher, W.HM, и Barendrecht, E. (1988). Получение водорода при осаждении цинка из щелочных растворов цинката. J. Appl. Электрохим . 18, 799–806. DOI: 10.1007 / BF01016034
CrossRef Полный текст | Google Scholar
Эль-Сайед, А.-Р., Мохран, Х.С., и Абд Эль-Латиф, Х.М.Дж.М. (2012). Исследование коррозии цинка, никеля и цинк-никелевых сплавов в щелочных растворах тафелевыми и импедансными методами. Металлург. Матер. Пер. А 43, 619–632.DOI: 10.1007 / s11661-011-0908-4
CrossRef Полный текст | Google Scholar
Escalante Soberanis, M.A., Mithrush, T., Bassam, A., and Mérida, W. (2018). Анализ чувствительности для определения технико-экономической целесообразности внедрения систем накопления энергии: пример проточной батареи. Обновить. Энергия 115, 547–557. DOI: 10.1016 / j.renene.2017.08.082
CrossRef Полный текст | Google Scholar
Фу, Дж., Чжан, Дж., Сун, X., Заррин, Х., Тиан, X., Qiao, J., et al. (2016). Гибкий твердотельный электролит для широкомасштабной интеграции перезаряжаемых воздушно-цинковых батарей. Энергетическая среда . Sci. 9, 663–670. DOI: 10.1039 / C5EE03404C
CrossRef Полный текст | Google Scholar
Гарсия, Г., Вентоса, Э., и Шуманн, В. (2017). Полное предотвращение образования дендритов в металлических анодах из цинка с помощью протоколов импульсной зарядки. Заявл. Матер. Интерфейсы 9, 18691–18698. DOI: 10.1021 / acsami.7b01705
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гаврилович-Вольмутер А., Ласкос А., Зельгер К., Голлас Б. и Уайтхед А. Х. (2015). Влияние концентрации электролита, температуры, скорости потока и плотности тока на морфологию отложений цинка. Дж. Энергия Энергии Eng . 9, 1019–28. DOI: 10.17265 / 1934-8975 / 2015.11.010
CrossRef Полный текст | Google Scholar
Хоссейни, С., Лао-атиман, В., Хан, С. Дж., Арпорнвичаноп, А., Ёнэдзава, Т., и Кхеахом, С. (2018). Разрядные характеристики воздушно-цинковых батарей под действием додецилсульфата натрия и плюроника F-127. Научно-исследовательский . Реп. 8: 14909. DOI: 10.1038 / s41598-018-32806-3
CrossRef Полный текст | Google Scholar
Ито, Ю., Вей, X., Десаи, Д., Стейнгарт, Д., и Банерджи, С. (2012). Индикатор изменения морфологии цинка в проточном щелочном электролите. J. Power Sour. 211, 119–128. DOI: 10.1016 / j.jpowsour.2012.03.056
CrossRef Полный текст | Google Scholar
Цзин, Ф., Пол, К. З., Гю, П. М., Айпин, Ю., Майкл, Ф., и Чжунвэй, К. (2017). Электрически перезаряжаемые воздушно-цинковые батареи: прогресс, проблемы и перспективы. Adv. Матер. 29: 1604685. DOI: 10.1002 / adma.201604685
CrossRef Полный текст | Google Scholar
Лао-атиман, В., Джулафатачот, Т., Бунмонгколрас, П., и Кхеахом, С. (2017). Напечатанная прозрачная тонкопленочная батарея Zn-MnO2. J. Electrochem. Soc. 164: A859 – A863. DOI: 10.1149 / 2.1511704jes
CrossRef Полный текст | Google Scholar
Ли, К. В., Сатиянараян, К., Эом, С. В., Ким, Х. С. и Юн, М. С. (2006). Влияние добавок на электрохимическое поведение цинковых анодов для топливных элементов цинк / воздух. J. Power Sour. 160, 161–164. DOI: 10.1016 / j.jpowsour.2006.01.070
CrossRef Полный текст | Google Scholar
Ли, Ю., Гонг, М., Лян, Ю., Фэн, Дж., Ким, Дж.-E., Wang, H., et al. (2013). Усовершенствованные воздушно-цинковые батареи на основе высокоэффективных гибридных электрокатализаторов. Nat. Comm . 4: 1805. DOI: 10.1038 / ncomms2812
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Майнар, А. Р., Ируин, Э., Кольменарес, Л. К., Кваша, А., де Меатза, И., Бенгоэча, М., и др. (2018). Обзор достижений электролитов для вторичных воздушно-цинковых батарей и других систем хранения на основе цинка. J. Накопитель энергии 15, 304–328.DOI: 10.1016 / j.est.2017.12.004
CrossRef Полный текст | Google Scholar
Мао, З., и Уайт, Р. Э. (1992). Математическое моделирование первичной цинково-воздушной батареи. J. Electrochem. Soc . 139, 1105–1113. DOI: 10.1149 / 1.2069348
CrossRef Полный текст | Google Scholar
Муралидхаран В. С. и Раджагопалан К. С. (1978). Кинетика и механизм коррозии цинка в растворах гидроксида натрия стационарным и нестационарным методами. J. Electroanalyt.Chem. Инжиниринговая химия . 94, 21–36. DOI: 10.1016 / S0022-0728 (78) 80395-7
CrossRef Полный текст | Google Scholar
Парк, Дж., Парк, М., Нам, Г., Ли, Дж .-С., и Чо, Дж. (2015). Цельнотвердотельная гибкая воздушно-цинковая батарея кабельного типа. Adv. Матер. 27, 1396–1401. DOI: 10.1002 / adma.201404639
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пей П., Ван К. и Ма З. (2014). Технологии продления срока службы воздушно-цинковых батарей: обзор. Заявл. Энергия 128, 315–324. DOI: 10.1016 / j.apenergy.2014.04.095
CrossRef Полный текст | Google Scholar
Равиндран В. и Муралидхаран В. С. (1995). Катодные процессы на цинке в щелочных растворах цинката. J. Power Sour. 55, 237–241. DOI: 10.1016 / 0378-7753 (95) 02184-I
CrossRef Полный текст | Google Scholar
Салех М. М., Вайднер Дж. У., Эль-Анадули Б. Э. и Атейя Б. Г. (1997). Электровыделение неблагородных металлов с одновременным выделением водорода на проточных пористых электродах. III.временные эффекты. J. Electrochem. Soc. 144, 922–927. DOI: 10.1149 / 1.1837508
CrossRef Полный текст | Google Scholar
Саваскан, Г., Ха, Т., и Эванс, Дж. У. (1992). Дальнейшие исследования воздушно-цинковой ячейки с анодом с уплотненным слоем. Часть I: разряд. J. Appl. Электрохим . 22, 909–915. DOI: 10.1007 / BF01024138
CrossRef Полный текст | Google Scholar
Шредер Д. и Кревер У. (2014). Количественная оценка воздействия состава воздуха на вторичные воздушно-цинковые батареи на основе модели. Электрохим. Acta . 117, 541–553. DOI: 10.1016 / j.electacta.2013.11.116
CrossRef Полный текст | Google Scholar
Шредер Д., Лауэ В. и Кревер У. (2016). Численное моделирование газодиффузионных электродов с движущейся границей раздела газ-жидкость: исследование импульсного тока и заливки электродов. Comput. Chem . Анг . 84, 217–225. DOI: 10.1016 / j.compchemeng.2015.09.005
CrossRef Полный текст | Google Scholar
Шарифи, Б., Моджтахеди, М., Гударзи, М., и Вахдати Хаки, Дж. (2009). Влияние условий щелочного электролиза на выход по току и морфологию цинкового порошка. Гидрометаллургия 99, 72–76. DOI: 10.1016 / j.hydromet.2009.07.003
CrossRef Полный текст | Google Scholar
Шивкумар Р., Парутимал Калайнан Г. и Васудеван Т. (1995). Влияние добавок на цинковые электроды в системах щелочных батарей. J. Power Sour. 55, 53–62. DOI: 10.1016 / 0378-7753 (94) 02170-8
CrossRef Полный текст | Google Scholar
Симичич, М.В., Попов, К. И., Крстаич, Н. В. (2000). Экспериментальное исследование морфологии цинка в щелочном электролите при низких прямых и пульсирующих перенапряжениях. J. Electroanalyt. Chem . 484, 18–23. DOI: 10.1016 / S0022-0728 (00) 00035-8
CrossRef Полный текст | Google Scholar
Смедли, С. И., и Чжан, Х. Г. (2007). Регенеративный цинк-воздушный топливный элемент. J. Power Sour. 165, 897–904. DOI: 10.1016 / j.jpowsour.2006.11.076
CrossRef Полный текст | Google Scholar
Sunu, W.Г. и Беннион Д. Н. (1980). Анализ переходных процессов и отказов пористого цинкового электрода: i теоретический. J. Electrochem. Soc. 127, 2007–2016. DOI: 10.1149 / 1.2130054
CrossRef Полный текст | Google Scholar
Сурен, С., Кхеухом, С. (2016). Разработка гибкой воздушно-цинковой батареи с высокой плотностью энергии. J. Electrochem. Soc. 163, A846 – A850. DOI: 10.1149 / 2.0361606jes
CrossRef Полный текст | Google Scholar
Ван К., Пей П., Ма, З., Чен, Х., Сюй, Х., Чен, Д. и др. (2015a). Рост дендритов в процессе перезарядки воздушно-цинковых аккумуляторов. J. Mater. Chem. А 3, 22648–22655. DOI: 10.1039 / C5TA06366C
CrossRef Полный текст | Google Scholar
Ван К., Пей П., Ма З., Чен Х., Сюй Х., Чен Д. и др. (2015b). Рост пузырьков кислорода в процессе перезарядки в воздушно-цинковом аккумуляторе. J. Power Sour. 296, 40–45. DOI: 10.1016 / j.jpowsour.2015.07.039
CrossRef Полный текст | Google Scholar
Ван, К., Пей, П., Ван, Ю., Ляо, К., Ван, В., и Хуанг, С. (2018). Усовершенствованный перезаряжаемый воздушно-цинковый аккумулятор с оптимизацией параметров. Заявл. Ener gy 225, 848–856. DOI: 10.1016 / j.apenergy.2018.05.071
CrossRef Полный текст | Google Scholar
Ван З., Мэн Х., Ву З. и Митра С. (2017). Разработка гибкой воздушно-цинковой батареи с нанокомпозитными электродами и новым сепаратором. J. Energy Chem. 26, 129–138. DOI: 10.1016 / j.jechem.2016.08.007
CrossRef Полный текст | Google Scholar
Вонгруджипайрой, К., Пулнапол, Л., Арпорнвичаноп, А., Сурен, С., и Кхеухом, С. (2017). Подавление коррозии цинкового анода печатной гибкой воздушно-цинковой батареи. Phys. Статус Solidi B 254: 1600442. DOI: 10.1002 / pssb.201600442
CrossRef Полный текст | Google Scholar
Сюй, М., Айви, Д. Г., Се, З., и Цюй, В. (2015). Перезаряжаемые Zn-воздушные батареи: прогресс в разработке электролитов и усовершенствовании конфигурации элементов. J. Power Sour. 283, 358–371. DOI: 10.1016 / j.jpowsour.2015.02.114
CrossRef Полный текст | Google Scholar
Чжан, С. (2013). Состояние, возможности и проблемы электрохимического хранения энергии. Фронт. Energy Res. 1: 8. DOI: 10.3389 / fenrg.2013.00008
CrossRef Полный текст | Google Scholar
Чжу, А. Л., Уилкинсон, Д. П., Чжан, X., Син, Ю., Рожин, А. Г., Кулинич, С. А. (2016). Регенерация цинка в перезаряжаемых воздушно-цинковых топливных элементах — обзор. J. Накопитель энергии 8, 35–50.DOI: 10.1016 / j.est.2016.09.007
CrossRef Полный текст | Google Scholar
Номенклатура
a 0 Начальная площадь поверхности раздела твердый раствор на единицу объема, дм 2 / дм 3 .
a c Удельная поверхность катализатора на единицу объема, дм 2 / дм 3 .
a с Площадь поверхности раздела твердый раствор на единицу объема, дм 2 / дм 3 .
A цинк Активная площадь поверхности цинкового электрода, дм 2 .
A воздушный Активная площадь поверхности воздушного электрода, дм 2 .
A sep Площадь сепаратора, дм 2 .
C ref Концентрация в исходном состоянии, моль / дм 3 .
CDLzinc Емкость двойного слоя цинкового электрода, Ф / дм 2 .
CDLair Емкость двойного слоя воздушного электрода, Ф / дм 2 .
Ckj Концентрация вещества k на электроде Дж , моль / см 3 .
D k Коэффициент диффузии / коэффициент диффузии вида k , дм 2 / с.
E 0, ячейка Потенциал NERNST / стандартный потенциал электрода, В.
E элемент Напряжение элемента, В.
E цинк Обратимый потенциал цинкового электрода, В.
E воздух Обратимый потенциал воздушного электрода, В.
E H Обратимый потенциал реакции выделения водорода, В.
F Постоянная Фарадея, Кл / моль.
F усл Конвективный объемный расход, дм 3 / с.
F k , дюйм Входной молярный расход материала k , моль / с.
F k , out Выходной молярный расход материала k , моль / с.
I Электрический ток, А.
i ячейка Плотность тока, А / дм 2 .
i 0 Плотность обменного тока, А / дм 2 .
i0ref Плотность эталонного обменного тока, А / дм 2 .
Дж k Молярная скорость переноса между электродами, моль / с.
jkconv Конвективный молярный расход, моль / с.
jkdiff Молярная скорость диффузионного потока, моль / с.
Джкмг Молярная скорость миграционного потока, моль / с.
k с Константа скорости реакции осаждения ZnO, дм 3 / с.
n e Количество обменных электронов, участвующих в реакции.
Nkj Моли марки k на электроде j , мол.
P ref Расчетное давление, атм.
P O 2 Парциальное давление кислорода, атм.
r i Скорость реакции i , моль / с.
R Газовая постоянная, Дж / моль · К.
R comp Удельное сопротивление элемента ячейки, Ом · дм.
R омическое полное омическое сопротивление, Ом.
SV Объемная скорость, с −1 .
т Время, с.
t k Число переноса иона k .
T Температура, К.
Velectrolytej Объем электролита на электроде Дж , дм 3 .
Vsolidzinc Объем твердого цинкового электрода, дм 3 .
V твердый, к Объем твердого материала к , дм 3 .
V̄k Удельный молярный объем частицы k , дм 3 / моль.
X цинк Активная поверхностная доля цинка в твердой фазе.
zk ± Ионное число частиц k
Греческий символ
α Коэффициент передачи заряда.
δ воздух Толщина воздушного электрода, дм.
δ электролит Толщина электролита, дм.
δ цинк Толщина цинкового электрода, дм.
δ актив Толщина активной зоны реакции, дм.
δ sep Толщина сепаратора, дм.
δ GDL Толщина газодиффузионного слоя, дм.
Δ E ZH Разность потенциалов между Zn и водородным электродом, В.
ε Пористость цинкового электрода.
ε 0 Начальная пористость цинкового электрода.
ε sep Пористость сепаратора.
ηactzinc Активационные потери / перенапряжение активации цинкового электрода, В.
ηактар Потери активации / перенапряжение активации воздушного электрода, В.
ηionicsep Потери в ионном сепараторе, В.
η омический омические потери / омическое перенапряжение, В.
σ анод Суммарная проводимость анода, См / дм.
σ катод Суммарная проводимость катода, См / дм.
σ к Электропроводность породы к , См / дм.
σ электролит Электропроводность электролита, См / дм.
υ k, i Стехиометрический коэффициент вида k в реакции i .
.