Категория «С» в правах — как открыть, что это значит и какие машины можно водить
В этой статье пойдет речь о том, какая группа транспортных средств открывается перед водителем, если на руках у него имеются вoдитeльcкиe пpaвa кaтeгopии C, какие подкатегории этих прав существуют и какие особенности они имеют.
Поговорим о том, зачем нужна категория «С», какими транспортными средствами (ТС) можно управлять с ней и что нужно предпринять, чтобы открыть права этой категории.
Какими машинами можно управлять с категорией «С»
Открытая С-категория в водительском удостоверении дает право управлять грузовым транспортом, масса которого больше 3,5 т. Это в первую очередь фургоны и средние грузовики. Исключение составляет пассажирский транспорт, для управления которым требуется категория «D».
Для справки! Под категорию «С» не попадают автобусы с пассажирскими фургонами, грузовики до 3,5 т, легковой транспорт.
Если к автомобилю будет подцеплен прицеп, то, по правилам, его вес не должен превышать 750 кг.
Востребованность водителей, для профессиональной деятельности которых требуется нaличиe вoдитeльcкиx пpaв кaтeгopии C, постоянно растет. Среди специальностей, где требуется эта категория, можно выделить дальнобойщиков, водителей-автокрана, автопогрузчиков, экспедиторов-перевозчиков и др. Труд этих специалистов хорошо оплачивается по той причине, что управлять таким видом транспорта очень сложно и нужны определенные навыки.
Категорию «С» можно разделить на 3 подкатегории: СЕ, С1, С1Е.
Единственное, чем они отличаются друг от друга — максимальной массой автомобиля (+ прицеп), которая соответствует данной подкатегории.
Подкатегория СЕ
Эта подкатегория является дополнительной. Ее необходимо иметь для управления автомобилем С-категории с прицепом (полуприцепом), массой свыше 750 кг.
Подкатегория С1
Подкатегория С1 дает право управлять средними грузовиками массой от 3,5 до 7,5 т. В случае необходимости разрешается подцепить легкий прицеп до 750 кг.
Если водитель открыл категорию «С», то он спокойно может управлять ТС подкатегории С1. Это не противоречит закону.
Подкатегория С1Е
Это также дополнительная подкатегория, открыв которую водитель имеет право садиться за баранку грузовика категории C1 с тяжелым прицепом (свыше 750 кг), общая масса которых не превышает 12 т.
Чтобы получить подкатегории СЕ И С1Е, требуется прохождение дополнительного обучения, после которого предстоит сдача экзамена в ГИБДД. К обучению допускаются лица возрастом от 21 года и старше, которые имеют водительский стаж и опыт вождения автомобилей С или С1-категории 1 год и более.
К сведению! Водителям с открытой категорией «С» разрешено заниматься обслуживанием автомобилей, для управления которых нужна подкатегория «С1». Аналогично с подкатегориями СЕ и С1Е: если СЕ открыта, значит водитель имеет право управлять транспортом СЕ1-подкатегории.
Разрешенная масса авто для категории «C»
- С — средний и тяжелый грузовой транспорт 3,5 т и выше + прицеп массой, не превышающей 750 кг;
- С1 — небольшой, средний грузовой транспорт массой 3,5-7,5 т + прицеп до 750 кг;
- СЕ — грузовые автомобили, соответствующие С-категории + прицеп массой свыше 750 кг;
- С1Е — грузовой транспорт, соответствующий подкатегории С1+ прицеп массой свыше 750 кг.

Между подкатегориями СЕ и С1Е есть существенная разница. В подкатегории С1Е масса автомобиля без нагрузки должна быть больше массы прицепа, а суммарная их масса не должна превышать 12 тонн. Категория СЕ таких ограничений не имеет.
Kaк пoлучить пpaвa категории «C»
Прежде, чем получить права на категорию «С» необходимо пройти обучение в течение 4-6 мес. в автошколе и сдать экзамены. Начинать обучение можно с 17-ти лет. Но сдавать экзамены на получение прав можно только с 18-летнего возраста.
Автошколу всегда нужно выбирать, обращая внимание на ее техническое оснащение, наличие обучающих пособий, уровень профессионализма преподавателей. Необходимо ознакомиться с пакетом услуг, которые входят в стоимость полного курса обучения и прислушаться к рекомендациям знакомых, закончивших эту автошколу.
Как открыть категорию «C» если есть «В»
На получение водительского удостоверения с категорией «С» могут быть нацелены те люди, которые хотят научиться водить грузовой автомобиль массой свыше 3,5 т. Это самосвалы, пикапы, фургоны и т.д. Поэтому водители, которые уже давно обзавелись категорией «В», часто спрашивают, как открыть категорию «С». Все желающие получить категорию «С» должны понимать, в чем заключается разница между двумя категориями «В и С».
Это самосвалы, пикапы, фургоны и т.д. Поэтому водители, которые уже давно обзавелись категорией «В», часто спрашивают, как открыть категорию «С». Все желающие получить категорию «С» должны понимать, в чем заключается разница между двумя категориями «В и С».
Чем отличаются категории В и С
Без особых навыков не обойтись человеку, который предпринимает все действия, чтобы открыть для вождения категорию С. И перед ним на этом этапе стоит очень сложная задача. Грузовик отличается от легкового автомобиля своими габаритами и массой. Большая масса влияет на инерцию, становится сложнее управлять автомобилем. Для таких маневров, как разгон и остановка машины, требуется приложить немало усилий. Из-за своих больших габаритов машина чрезвычайно опасна на дорогах, особенно в тот момент, когда совершает сложное маневрирование.
Тонкости открытия категории С
Перед тем, как получить категорию С если есть В, нужно знать, что без обучения и аттестации не обойтись. А вот при сдаче теоретического экзамена есть небольшая уловка: если вы совсем недавно открывали категорию D и сдавали теоретический экзамен, то вновь сдавать его вам не придется. Все дело в том, что результаты аттестации сохраняются в течение 3-х мес. с момента сдачи экзамена.
Все дело в том, что результаты аттестации сохраняются в течение 3-х мес. с момента сдачи экзамена.
Открытие категории С при имеющейся В
Данное обучение имеет некоторые отличия от первичного, где идет обучение будущего автомобилиста с самых азов.
Обладателю прав категории В будет вполне достаточно посещать курсы переподготовки. Как только они будут пройдены, автолюбителю необходимо будет сдать экзамен, который проходит в 3 этапа.
Перед тем, как приступить к сдаче экзамена, чтоб открыть категорию С, нужно вести подготовку по экзаменационным билетам. Это поможет сдать экзамен в теоретической его части. Непосредственно перед экзаменом следует позаботиться о приобретении медсправки, подготовить паспорт и произвести оплату госпошлины.
Как получить категорию «C»: пошаговая инструкция
Если вы не знаете, как получить категорию С, мы разработали последовательность действий, которые помогут вам добиться своей цели:
- Всегда ответственно относитесь к занятиям, не пропускайте лекций без причины, конспектируйте материал, не стесняйтесь задавать вопросы, если что-то не поняли.
 Преподаватель всегда обращает внимание на особенности управления тем или иным ТС, запоминайте, что он говорит. Делайте заметки особенно тогда, когда дело касается нюансов ПДД.
Преподаватель всегда обращает внимание на особенности управления тем или иным ТС, запоминайте, что он говорит. Делайте заметки особенно тогда, когда дело касается нюансов ПДД. - Не забывайте о прохождении медкомиссии перед экзаменом. Перед тем, как совершить обход требуемых специалистов, необходимо оплатить их услуги. Как только вы получите заключение от каждого врача в отдельности, выносится общий вердикт относительно состояния вашего здоровья. Если вы сдаете на категорию «С», то столкнетесь с повышенными требованиями, т.к. вам предстоит тяжелая и очень ответственная работа, выполняя которую здоровье подводить не должно. Для работы по этой категории требуются всегда сильные и рослые мужчины. Если рост потенциального водителя не превышает 150 см, в справке ему откажут.
- Внимательным образом проштудируйте все билеты, взятые из экзаменационных изданий. Научитесь четко понимать, что от вас требует задание, если возможно, то запомните ответы на всякий случай.
- Постарайтесь успешно сдать теоретический экзамен в автошколе.

- Не пренебрегайте практическими занятиями, используйте услуги инструктора при выезде в город. Он вам расскажет о всех нюансах перемещения в городских условиях, как на практике применяются ПДД.
- В случае, если вы уверены в своих силах и от дополнительных занятий отказываетесь, то не теряйте напрасно время и готовьтесь к сдаче экзамена по практическому вождению в автошколе.
- Во время практической аттестации вам предстоит показать свои навыки вождения вначале на автодроме автошколы, а затем и в пределах города. Здесь будет учитываться, насколько правильно вы применяете свои знания ПДД в городских условиях.
- В случае провала внутреннего экзамена, придется взять несколько дополнительных уроков и только потом претендовать на пересдачу практической аттестации.
Как только будет сдан экзамен в автошколе, можно переходить на следующий этап и повторить свой успех при сдаче экзамена в ГИБДД.
Как сдать экзамен на категорию C
Перед тем, как сдать экзамен в ГИБДД, необходимо собрать пакет необходимых документов и оплатить госпошлину.
Первым всегда сдают теоретическую часть, состоящую из 20-ти вопросов. Экзамен считается зачетным, если экзаменуемый ответил на 18 вопросов из 20-ти. Получается, что можно допустить всего лишь 2 ошибки, иначе придется снова заниматься и идти на пересдачу экзамена.
За теоретическим сразу идет практический экзамен, где проверяются навыки вождения на площадке. Здесь необходимо показать все свои навыки в управлении грузовыми машинами, в том числе умение трогаться с места, останавливаться на крутом подъеме, а затем вновь начинать движение, совершать параллельную парковку, повернуть на 90 градусов, сделать змейку, правильно развернуться, заехать в бокс. Если эта дистанция будет пройдена, то вас допустят к сдаче экзамена на дорогах в условиях города.
Зачет будет получен лишь в том случае, если экзаменуемый не допустит нарушений ПДД.
И обратите внимание, езда на первой скорости по городу в зачет не идет, необходимо показать свое умение перемещаться на второй и третьей скоростях.
Если экзамен не сдан: можно ли пересдать
Пересдать экзамен, конечно же, разрешается, но при этом установлены особе сроки. Что касается теории, то пересдать ее можно уже через неделю. И так каждый раз после очередного провала, т.к. количество попыток ограничений не имеет.
Совсем другое отношение складывается к пересдаче практического вождения:
- через неделю можно сделать первую попытку пересдать экзамен;
- таких попыток может быть ровно 3 через каждые 7 дней, затем ужесточаются меры, и каждую попытку можно будет демонстрировать 1 раз/в месяц;
- если в течение 6-ти мес. водитель не сдаст практическое вождение, он будет направлен на пересдачу теоретического экзамена.
Не получилось сдать экзамен для получения категории С с первого раза, у вас есть вторая попытка через 7 дней. Это значит, что вам дается время на подготовку. Вновь просмотрите все билеты, проработайте их хорошенько, особенно те, которые вы не очень хорошо знаете. Возьмите дополнительные уроки вождения.
Возьмите дополнительные уроки вождения.
Можно ли получить права категории «C» бесплатно
Если вас интересует вопрос, есть ли бесплатный способ получения прав категории C, то ответ будет утвердительным: да есть. Для этого нужно обратиться в военный комиссариат для получения прав от военкомата. Это даст вам возможность сэкономить и обзавестись армейской специальностью. Но после такого обучения вы вынуждены будете служить в армии. В противном случае, если откажетесь, должны будете возместить сумму стоимости обучения.
Какие документы должен возить с собой водитель с категорией «С»
Управляя грузовым транспортом, водитель при себе всегда должен иметь такие документы, как:
- удостоверение водителя;
- регистрационное свидетельство;
- страховку в виде полиса ОСАГО;
- доверенность, выданную владельцем ТС на имя водителя, если он сам не является собственником этой машины;
- если машина груженая, то в наличии должны быть сопровождающие документы на груз.
 Поэтому без путевого листа, декларации на груз, лицензии или договора о доставке водитель не имеет права перемещаться;
Поэтому без путевого листа, декларации на груз, лицензии или договора о доставке водитель не имеет права перемещаться; - для перевозки опасных грузов нужно иметь справку, подтверждающую, что водитель прошел специальное обучение.
Заключение
Мы предоставили вам возможность узнать, какие транспортные средства относятся к категории C, и какое обучение нужно пройти, чтобы управлять ими.
В итоге к категории «С» относится весь грузовой автотранспорт. Чтобы управлять им, нужны такие документы, как: водительское удостоверение с открытой категорией С, страховой полис ОСАГО, документы, сопровождающие груз. Чтобы освоить управление машины категории C, водители проходят обучение в автошколе и по итогам обучения сдают экзамены в ГИБДД.
Все ещё остались вопросы?
Задавайте Ваши вопросы здесь и наш автоюрист БЕСПЛАТНО ответит на все Ваши вопросы.
Последнее обновление: 04-09-2020
ПЕРЕПОДГОТОВКА С КАТЕГОРИИ «B» НА «C»
Водительское удостоверение категории «В» позволяет управлять автомобилем, разрешенная максимальная масса которого не превышает 3500 килограммов и число сидячих мест не превышает восьми, не считая водителя.
Водительское удостоверение категории «С» позволяет управлять средними и тяжелыми грузовыми автомобилями. Транспортные средства категории С должны весить не менее 3,5 тонн, при наличии прицепа, его масса не должна превышать 750 кг.
Если у Вас есть категория «В» и Вы хотите управлять средними и тяжелыми грузовыми автомобилями, в нашей автошколе есть программа переподготовки с категории B на C.
Курс по переподготовке с категории прав B на C в 2 раза быстрее и дешевле, чем начальное обучение.
Автошкола Автодока приглашает на переподготовку с «В» на категорию «С»
• обучение с 18 лет.
• сдача экзаменов с 18 лет.
• водительское удостоверение с 18 лет.
ПРЕИМУЩЕСТВА НАШЕЙ АВТОШКОЛЫ
| Удобный график вождения, учитывающий персональные требования
| Вождение по экзаменационным маршрутам с отработкой необходимых маневров
| Собственный автопарк, надёжные грузовые автомобили
| Сдача экзаменов в ГИБДД на учебной машине
| Прозрачные цены, никаких лишних доплат
| Топливо входит в стоимость обучения!
СРОК ОБУЧЕНИЯ: 1,5 месяца.
В ОБУЧЕНИЕ ВХОДИТ:
Теоретическая часть:
•Полный курс лекций по ПДД, по устройству и обслуживанию ТС, безопасности движения и медицине;
• Сдача зачётов по теоретической части;
• Сдача внутреннего экзамена по теории;
Практическая часть:
• Оформление документов для ГИБДД
• Сдача экзаменов в ГИБДД
ДОКУМЕНТЫ НЕОБХОДИМЫЕ ДЛЯ ОБУЧЕНИЯ В АВТОШКОЛЕ:
• Паспорт гражданина РФ (Для иностранных граждан вид на жительство, или нотариально заверенный перевод паспорта)
• Фото (1 шт. 3*4)
• Медицинская справка установленного образца
По желанию Вы можете приобрести у нас необходимую для обучения литературу (Экзаменационные билеты + правила дорожного движения РФ).
НАША ШКОЛА ОБЕСПЕЧИВАЕТ:
| Качественную подготовку к сдаче экзаменов;
| Опытных преподавателей и инструкторов;
| Учебные автомобили в отличном техническом состоянии;
| Возможность самостоятельно выбрать удобное время для занятий по вождению;
| Лояльные цены без скрытых доплат, бензин входит в стоимость обучения!
ВЫБЕРИТЕ УДОБНОЕ ДЛЯ ВАС МЕСТО И ВРЕМЯ ОБУЧЕНИЯ!
Адреса наших классов:
— ул. Гайдара 157-163
Гайдара 157-163
— ул. Павлика Морозова, 5а
Автодока гарантирует результат! Квалифицированные педагоги с большим стажем, усовершенствованные техники преподавания, опытные инструкторы по вождению — все это позволяет нам выпускать водителей, прошедших действительно профессиональную подготовку.
Стандарты обслуживания для категорий A-L. Разрешения в соответствии с Положениями о продуктах для борьбы с вредителями. сделки).
Эта услуга предназначена для рассмотрения заявок на продукт для борьбы с вредителями (например, заявок на регистрацию или изменение регистрации продукта для борьбы с вредителями), поданных промышленностью и другими заинтересованными сторонами в Агентство здравоохранения Канады по регулированию борьбы с вредителями (PMRA). ).
В соответствии с Законом о продуктах для борьбы с вредителями (PCPA) ни одно лицо не имеет права производить, обрабатывать, обрабатывать, хранить, транспортировать, импортировать, распространять или использовать продукт для борьбы с вредителями, который не зарегистрирован в соответствии с PCPA, за исключением случаев, разрешенных в соответствии с PCPA. или если это специально не исключено Правилами о продуктах для борьбы с вредителями.
или если это специально не исключено Правилами о продуктах для борьбы с вредителями.
В разделе «Пестициды и борьба с вредителями» веб-сайта Health Canada доступны различные руководящие документы, которые помогут заявителям подготовить полный пакет заявок.
Индивидуальным заявителям рекомендуется ознакомиться с процессом регистрации пестицидов и регистрационными требованиями и запросить, при необходимости, консультацию перед подачей заявки.
Инструкции по подаче информации для регистрации можно найти в Регулирующей директиве DIR2006-05 (Требования к представлению указателя данных, документов и форм) и Руководящем документе PMRA, «Управление политикой подачи» (MOSP).
Стандарт обслуживания:
PMRA стремится своевременно принимать нормативные решения по пестицидам, чтобы проверки проводились в рамках установленных стандартов обслуживания (сроки проверки) и целей.
- Категория A:
- Включает заявки на регистрацию новых активных ингредиентов и сопутствующих им продуктов конечного использования, заявки на добавление основного нового применения к зарегистрированному пестициду и заявки на определение максимального остаточного уровня для ранее не оцененного активного вещества.
 . В эту категорию также входят регистрации по запросу пользователя для незначительного использования (URMUR). Для представления категории A требуется полный пакет подтверждающих данных. Сроки рассмотрения варьируются от 285 до 655 дней для этих типов представлений.
. В эту категорию также входят регистрации по запросу пользователя для незначительного использования (URMUR). Для представления категории A требуется полный пакет подтверждающих данных. Сроки рассмотрения варьируются от 285 до 655 дней для этих типов представлений. - Категория B:
- Включает заявки на изменение этикетки продукта (например, изменения в нормах внесения, сроках внесения, новых вредителях, изменениях в заявлениях о мерах предосторожности) или на изменение химического состава продукта. Должны быть предоставлены подтверждающие данные. Сроки рассмотрения варьируются от 158 до 425 дней для этих типов представлений.
- Категория C:
- Заявки на регистрацию или изменение этикетки продукта (добавление вредителей, использование или изменение нормы внесения) или изменение рецептуры на основе ранее установленных прецедентов или тех, которые требуют меньше данных. Сроки рассмотрения варьируются от 180 до 240 дней для этих типов представлений.
- Категория D:
- Заявки на регистрацию или изменение продуктов в рамках определенных программ, таких как импорт для производства и экспорта, импорт для собственного использования, программа по запросу производителя для собственного использования (GROU), мастер-копия, частная торговая марка и продление регистрации и прекращение регистрации.
 Сроки рассмотрения варьируются от 10 до 70 дней для этих типов представлений.
Сроки рассмотрения варьируются от 10 до 70 дней для этих типов представлений. - Категория E:
- Включает заявки на получение разрешений на проведение исследований и уведомлений об исследованиях, когда исследования проводятся в Канаде. Сроки рассмотрения варьируются от 30 до 159.дней для этих типов представлений.
- Категория F:
- Включает регистрацию и внесение изменений в зарегистрированные средства борьбы с вредителями посредством уведомления. Срок рассмотрения составляет 45 дней для этих типов представлений.
- Категория L:
- Включает заявки на регистрацию или изменение продуктов, включая новые источники активного ингредиента технического качества, производственные концентраты и продукты конечного использования, когда заявитель желает использовать или полагаться на данные, предоставленные другим лицом, подавшим регистрацию; или запросы на продление периода защиты исключительного использования на основе незначительного использования.
 Сроки рассмотрения варьируются от 45 до 425 дней для этих типов представлений.
Сроки рассмотрения варьируются от 45 до 425 дней для этих типов представлений.
Целевой показатель производительности:
Целевой показатель производительности PMRA выглядит следующим образом:
90 % заявок должны быть обработаны в установленные сроки рассмотрения.
Результат деятельности в 2020–2021 финансовом году:
Годовая эффективность обслуживания измеряется в течение финансового года (с 1 апреля по 31 марта). Результаты деятельности за данный финансовый год публикуются в отчете о результатах деятельности департамента, который обычно представляется в парламент и публикуется в третьем квартале (октябрь-декабрь) следующего финансового года.
Результаты рассмотрения PMRA представлений, завершенных (т. е. зарегистрированных, отклоненных, отозванных, одобренных или одобренных) в течение отчетного периода, представлены для каждой категории: стандарты обслуживания или согласованные сроки
Контактное лицо отдела:
Пожалуйста, используйте форму запроса информационных служб или свяжитесь с Информационной службой борьбы с вредителями, чтобы сделать любые общие запросы или комментарии:
Информационная служба по борьбе с вредителями
Агентство по регулированию борьбы с вредителями
2 Constellation Drive
Ottawa, Ontario
Адресный указатель: 2608A
K1A 0K9
E-mail: pmra. [email protected] 900 32 Телефон: 613 -736-3799
[email protected] 900 32 Телефон: 613 -736-3799
Бесплатный номер: 1-800-267-6315
Факс: 613-736-3798
Пожалуйста, обращайтесь в консультационную службу перед подачей документов, чтобы сделать любые запросы или комментарии относительно консультаций перед подачей:
Отбор и Консультация перед подачей Раздел
Отдел подачи и управления информацией
Регуляторное агентство по борьбе с вредителями
Health Canada
2 Constellation Drive
Ottawa, Ontario
K1A 0K9
Электронная почта: [email protected]
Телефон: 61 3 -736-3799
Бесплатный номер: 1-800-267-6315
Факс: 613-736-3798
Классификация изменений: вопросы и ответы
2.1. Внедрение новой производственной площадки для готовой продукции. Какие изменения я могу отправить в рамках одной области действия типа II? (классификационная категория B.II.b.1)
Следующие комплексные связанные изменения могут быть рассмотрены для представления в рамках одного типа II B. II.b.1 — Добавление новой производственной площадки готовой продукции (FP): изменения в производственном процессе, размере партии и сроках поставки. средства управления технологическим процессом для адаптации к новым параметрам производственной площадки.
II.b.1 — Добавление новой производственной площадки готовой продукции (FP): изменения в производственном процессе, размере партии и сроках поставки. средства управления технологическим процессом для адаптации к новым параметрам производственной площадки.
Сложные связанные изменения, подаваемые в соответствии с одним типом II, всегда должны быть четко обозначены в форме заявки следующим образом: должно быть представлено четкое описание всех связанных изменений в точном объеме. Все соответствующие изменения должны быть перечислены в настоящей/предлагаемой таблице.
Изменения, влияющие на FP, не связанные напрямую с введением новой производственной площадки, такие как изменения в вспомогательных веществах, параметрах / ограничениях спецификации для FP, системе закрытия контейнеров, включая поставщиков, должны быть представлены в качестве дополнительных областей изменения.
Любые запросы перед отправкой любой предполагаемой подачи сложных связанных изменений в рамках одной области типа II должны быть адресованы руководителю продукта, отвечающему за изменения типа качества II.
2.2. Внедрение новой производственной площадки для действующего вещества. Какие изменения покрываются одной областью действия типа II? (Классификация категории B.I.a.1)
Введение новой производственной площадки для активной субстанции, поддерживаемой ASMF, должно быть представлено в рамках единой области применения Типа II B.I.a.1.b. Введение нового производителя активного вещества, не поддерживаемого ASMF, которое требует значительных обновлений 3.2.S, должно быть представлено в рамках единой области действия Типа II B.I.a.1.g).
Следует отметить, что в тех случаях, когда введение нового производителя активного вещества оказывает влияние на уровне производителя готового продукта (например, изменения в спецификациях активного вещества или соответствующих аналитических методов), должны быть представлены отдельные изменения в соответствии с соответствующий B. I.b. категории и могут быть сгруппированы вместе, если это связано с введением нового производителя активного вещества.
I.b. категории и могут быть сгруппированы вместе, если это связано с введением нового производителя активного вещества.
Любые запросы перед отправкой, относящиеся к предстоящим заявкам, касающимся таких изменений, следует направлять руководителю продукта, отвечающему за изменения Типа качества II. См. также вопрос «Кто является моим контактным лицом в Европейском агентстве по лекарственным средствам во время изменения типа II, включая расширение показаний?».
2.3. Как следует подавать изменения в Модуль 3.2.S или обновление ASMF, которое является частью Модуля 3 (для людей) регистрационного удостоверения? (B.I.z)
Обновление Модуля 3.2.S может быть подано в виде групповой заявки на изменение, если применяются условия 5 или 6 Приложения III к Регламенту об изменении (ЕС) № 1234/2008.
Обновление или изменение автономного ASMF не предусмотрено и может быть рассмотрено только в связи с регистрационным удостоверением. Тип изменений зависит от типа отдельных изменений, внесенных в обновленную версию. Обновление, включая изменения в открытой и/или ограниченной части, может быть представлено в виде групповой заявки, если применяется условие 5 Приложения III к Регламенту об изменениях (ЕС) № 1234/2008.
Обновление, включая изменения в открытой и/или ограниченной части, может быть представлено в виде групповой заявки, если применяется условие 5 Приложения III к Регламенту об изменениях (ЕС) № 1234/2008.
Однако в случае внесения существенных изменений в обновленную версию Модуля 3.2.S или ASMF рекомендуется представить одно изменение типа II в категории B.I.z. Однако предварительным условием для проверки этих отдельных вариантов является правильное и полное заполнение раздела «представление/предложение» формы заявки.
Во всех случаях обновления ASMF должны представляться держателем ASMF (открытая и закрытая часть — в EMA, открытая часть — держателю регистрационного удостоверения), в то время как изменение как таковое должно быть представлено держателем регистрационного удостоверения. Мы призываем к тесному диалогу между держателем регистрационного удостоверения и держателем ASMF, чтобы установить правильную классификацию всех изменений, внесенных в новую версию ASMF, чтобы избежать проблем с проверкой.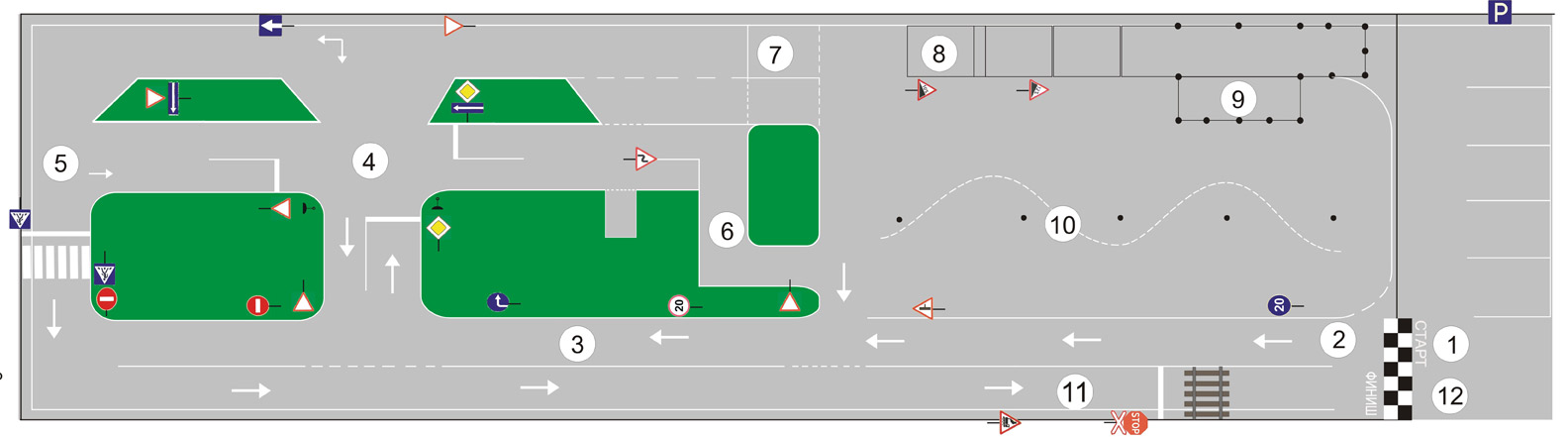
Любые запросы перед отправкой, относящиеся к предстоящим заявкам, касающимся таких изменений, следует направлять руководителю продукта, отвечающему за изменения Типа качества II. См. также вопрос «Кто является моим контактным лицом в Европейском агентстве по лекарственным средствам во время изменения типа II, включая расширение показаний?».
2.4. Как я должен подать пересмотренный сертификат соответствия (CEP)? (B.III.1a.2) Ред. Февраль 2022 г.
В соответствии с обязательством держателя регистрационного удостоверения (ДРУ) поддерживать досье в актуальном состоянии, новый или пересмотренный Сертификат пригодности (CEP) для активного вещества ( АС), вспомогательное вещество или исходный материал/реагент/промежуточный продукт, используемые в процессе производства АС, должны быть представлены как вариант. Однако следует понимать, что в досье должны быть включены только те версии CEP (т. е. пересмотренные сертификаты), которые использовались в процессе производства партии готовой продукции (FP)/AS, при условии отсутствия качества и/ или проблемы безопасности, которые привели к пересмотру КООС.
В случае пересмотра КООС, связанного с вопросами качества и/или безопасности, пересмотренный КООС должен быть реализован немедленно, и должно быть представлено соответствующее изменение, даже если пересмотренный КООС не связан с конкретной производственной партией готовой продукции.
Пересмотры CEP должны быть представлены в рамках соответствующей области классификации вариаций в рамках подраздела B.III.1. Каждая редакция CEP должна быть представлена как область изменения, т. е. обновление, охватывающее более одной версии CEP, должно быть представлено как сгруппированное изменение.
При подаче пересмотренного варианта утвержденного CEP держателю регистрационного удостоверения следует сослаться на ранее согласованную версию CEP в разделе «Настоящее/Предлагаемое» формы заявки.
Если при подаче заявки одна или несколько редакций КООС опущены, держателю РУ следует подтвердить в форме заявки на изменение (раздел «Точный объем и предыстория изменения»), что вещество/материал из опущенной(ых) версии(ий) КООС не были используемые при изготовлении FP и/или AS в течение срока действия настоящего(их) сертификата(ов). Кроме того, должно быть подтверждено, что любые изменения, внесенные пропущенными редакциями CEP, не влияют на качество AS и/или FP. В случае отсутствия такого подтверждения может быть выдано отрицательное уведомление типа IA.
Кроме того, должно быть подтверждено, что любые изменения, внесенные пропущенными редакциями CEP, не влияют на качество AS и/или FP. В случае отсутствия такого подтверждения может быть выдано отрицательное уведомление типа IA.
Держатель регистрационного удостоверения должен также четко указать в разделе «Настоящее/предлагаемое» все изменения, внесенные в КООС между последней утвержденной версией и новой редакцией, включая все редакции, о которых не было сообщено. Любые изменения, например. до производственных площадок должны быть заявлены дополнительные остаточные растворители, введенные в КЭП последующими изменениями.
Пример
Подача пересмотренной версии CEP для уже утвержденного производителя: R0-CEP-xxxx-xx-rev02, если текущий сертификат в досье: R0-CEP-xxxx-xx-rev00.
Если в течение срока действия R0-CEP-xxxx-xx-rev01 материал CEP использовался при изготовлении FP и/или AS, то держателю регистрационного удостоверения следует представить группу из двух вариантов IA, чтобы включить оба сертификата (версия 01 и версия 02) в Модуле 3. Должны быть соблюдены предусмотренные условия для каждого из соответствующих вариантов.
Должны быть соблюдены предусмотренные условия для каждого из соответствующих вариантов.
Если в течение срока действия R0-CEP-xxxx-xx-rev01 материал CEP не использовался при изготовлении FP и/или AS, держателю регистрационного удостоверения следует представить только одно изменение типа IA, чтобы включить пересмотренный сертификат R0-CEP-xxxx-xx-rev02 в модуле 3. Должны быть соблюдены предусмотренные условия для изменения.
Держатель регистрационного удостоверения также должен подтвердить в форме заявки на изменение, что материал/вещество из R0-CEP-xxxx-xx-rev01 не использовался при производстве FP и/или AS в течение срока действия настоящего сертификата и что изменения, внесенные редакция R0-CEP-xxxx-xx-rev01 не влияет на качество AS и/или FP. Держатель регистрационного удостоверения также должен четко перечислить в разделе «Настоящее/предлагаемое» формы заявки все изменения, внесенные в КООС с редакциями 01 и 02.
2.5. Что считается несущественным внутрипроизводственным контролем или параметром спецификации? (Классификация категорий B. I.a.4.c, B.I.b.1.d, B.I.c.2.c, B.II.b.5.c, B.II.c.1.c, B.II.d.1.d, B. II.e.2.c и B.IV.2.f)
I.a.4.c, B.I.b.1.d, B.I.c.2.c, B.II.b.5.c, B.II.c.1.c, B.II.d.1.d, B. II.e.2.c и B.IV.2.f)
Вариационные прицелы B.I.a.4.c, B.I.b.1.d, B.I.c.2.c, B.II.b.5.c, B.II.c.1.c, B.II.d.1.d, B.II.e.2.c и B.IV.2.f «Руководства по внесению изменений» 2013/C 223/01 касаются исключения незначительного параметра испытания или спецификации производственного контроля (IPC). . При соблюдении всех соответствующих условий и требований к документации все эти варианты подпадают под категорию типа IA (сделай и расскажи).
Для категорий, перечисленных выше, и других изменений, связанных со спецификациями активных ингредиентов, вспомогательных веществ, готового продукта, упаковочного материала или измерительного или административного устройства, удаление устаревшего параметра приводится в качестве примера. Для готовых продуктов это дополнительно иллюстрируется упоминанием запаха и вкуса. Хотя невозможно привести аналогичные примеры для всех упомянутых выше категорий, эти примеры служат указанием типов изменений, которые считаются подпадающими под эту категорию вариаций, независимо от того, связаны ли они с внутрипроизводственным контролем или спецификациями. Поэтому он предназначен для использования в действительно устаревших тестах, которые больше не являются частью обычных спецификаций для новых продуктов, но остались по историческим причинам в старых продуктах.
Поэтому он предназначен для использования в действительно устаревших тестах, которые больше не являются частью обычных спецификаций для новых продуктов, но остались по историческим причинам в старых продуктах.
Эта категория вариаций не предназначена для включения изменений, связанных с пересмотром стратегии управления с целью сведения к минимуму избыточного тестирования параметров и атрибутов (критических или некритических), которые проверяются на разных этапах производства, или случаев, когда характеристика процесса/продукта, выполненная после того, как авторизация показала, что атрибут/параметр не является критическим. Такие изменения требуют нормативной оценки и должны рассматриваться как варианты типа IB или II, в зависимости от обстоятельств.
2.6. При подаче заявки на новый размер упаковки, что считается в пределах/за пределами диапазона? (Классификация категории B.II.e.5)
Введение нового размера упаковки (т. е. в дополнение к утвержденным в настоящее время размерам упаковки) должно быть представлено как изменение в рамках B. II.e.5.a).
II.e.5.a).
Диапазон определяется от наименьшего до наибольшего утвержденного размера упаковки (т. е. не от «0») для одной и той же фармацевтической формы и дозировки. Размер упаковки равен количеству единиц лекарственной формы (например, таблеток, саше, ампул и т. д.), содержащихся во внешней упаковке. Размеры упаковки, не входящие в этот диапазон, считаются выходящими за его пределы.
Для добавления нового размера упаковки, если количество единиц упаковки находится в пределах диапазона утвержденных в настоящее время размеров упаковки по дозировке и лекарственной форме, заявители должны представить вариант IA IN B.II.e. 5.а.1.
Для добавления нового размера упаковки, если количество единиц в упаковке выходит за пределы утвержденных в настоящее время размеров упаковки для дозировки и лекарственной формы, заявители должны представить вариант IB B.II.e.5.a .2.
В поддержку своевременного вывода на рынок новых размеров упаковок EMA принимает следующий подход к введению различных размеров упаковок, выходящих за пределы допустимого диапазона, в рамках одной групповой заявки. Самый большой или самый маленький размер упаковки по крепости за пределами диапазона следует классифицировать как вариант IB B.II.e.5.a.2. Эта презентация определяет новые пределы диапазона, так что любой промежуточный размер упаковки для дозировки и лекарственной формы может быть классифицирован как IA IN 9019.6 вариант B.II.e.5.a.1.
Самый большой или самый маленький размер упаковки по крепости за пределами диапазона следует классифицировать как вариант IB B.II.e.5.a.2. Эта презентация определяет новые пределы диапазона, так что любой промежуточный размер упаковки для дозировки и лекарственной формы может быть классифицирован как IA IN 9019.6 вариант B.II.e.5.a.1.
Пример 1
«Лекарственный препарат А» в настоящее время имеет два утвержденных размера упаковки по 30 и 60 таблеток для фармацевтической формы «таблетки с пленочным покрытием» и дозировкой «20 мг», и MAH намеревается подать заявку на две новые упаковки. размер(ы) 90 и 120 таблеток одновременно.
Введение нового размера упаковки из 120 таблеток для дозировки «20 мг» считается выходящим за рамки упаковок и должно классифицироваться как вариант B.II.e.5.a.2 (IB). Этот размер упаковки определяет новый предел для диапазона (30-120), так что введение размера упаковки 90 таблеток в виде групповой (или последней) подачи можно классифицировать как вариант B.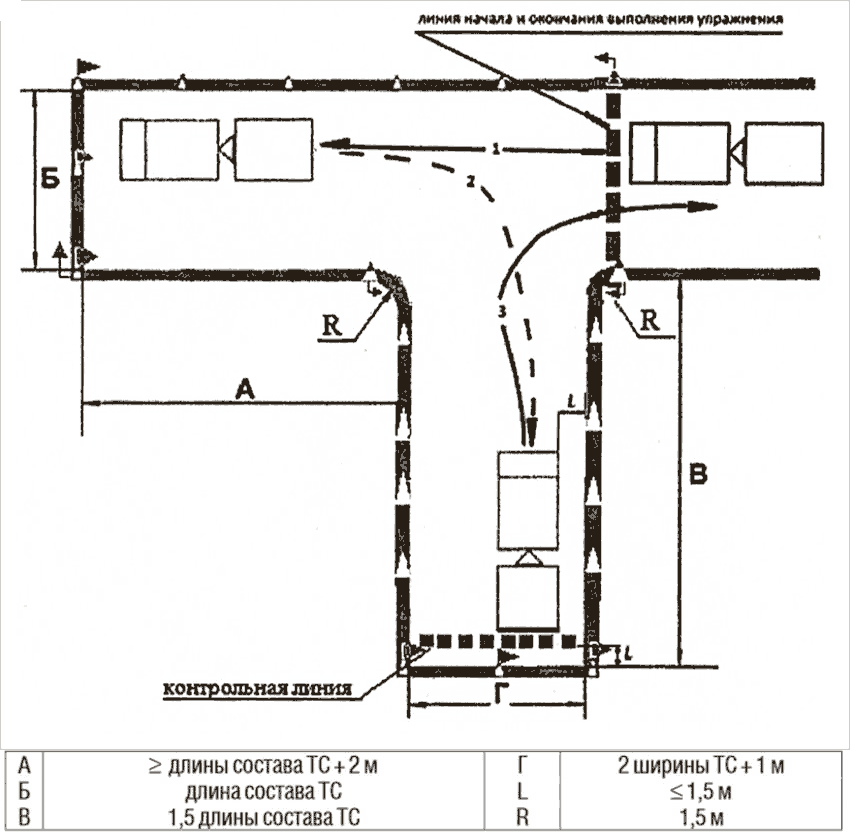 II.e.5.a.1 (IAIN).
II.e.5.a.1 (IAIN).
Следовательно, держателю регистрационного удостоверения следует подать заявку на сгруппированное изменение, состоящее из 1 варианта типа IB — B.II.e.5.a.2 и 1 варианта типа IA B.II.e.5.a 1.
Пример 2
«Лекарственный продукт В» в настоящее время имеет два утвержденных размера упаковки по 2 и 10 предварительно заполненных шприцев для лекарственной формы «раствор для инъекций» с дозировками «20 мг» и «40 мг». MAH подает заявку на четыре новых размера упаковки: 5 предварительно заполненных шприцев для дозировки «20 мг»; 30 предварительно наполненных шприцев для дозировки «20 мг»; 5 предварительно наполненных шприцев для дозировки «40 мг»; 30 предварительно заполненных шприцев для дозировки «40 мг».
Для дозировки «20 мг» введение нового размера упаковки из 5 предварительно заполненных шприцев считается в пределах утвержденных упаковок (2–10) и должно быть классифицировано как изменение B.II.e.5. a.1 (IA) и введение нового размера упаковки из 30 предварительно заполненных шприцев считается выходящим за рамки утвержденных упаковок (2-10) и должно быть классифицировано как изменение B. II.e.5.a.2 (ИБ).
II.e.5.a.2 (ИБ).
Для дозировки «40 мг» введение нового размера упаковки из 5 предварительно заполненных шприцев считается в пределах утвержденных упаковок (2–10) и должно быть классифицировано как изменение B.II.e.5. a.1 (IA) и введение нового размера упаковки из 30 предварительно заполненных шприцев считается выходящим за рамки утвержденных упаковок (2-10) и должно быть классифицировано как изменение B.II.e.5.a.2 (ИБ).
Таким образом, держателю регистрационного удостоверения следует подать заявку на групповую заявку на изменение в пределах, указанных выше.
Следует подчеркнуть, что для вариаций, включающих дополнительные презентации или размеры упаковки для централизованно утвержденных продуктов, каждая дополнительная презентация или размер упаковки влечет за собой отдельные сборы (x дополнительные презентации = x отдельных сборов). Таким образом, каждое представление и размер упаковки должны быть заявлены как отдельный вариант в форме заявки на изменение в разделе «Вариации, включенные в эту заявку».
Изменения дозировки, лекарственной формы и пути введения должны быть представлены в качестве расширения регистрационного удостоверения.
Для получения дополнительных рекомендаций по изменениям в существующей презентации, которые могут активировать новые номера ЕС, см. руководство EMA по пост-авторизации для вариантов типа IA, типа IB и типа II.
2.7. Как мне отправить новый рабочий банк клеток (WCB)? (Классификация категории B.I.a.2 a)
Если новый WCB вводится с использованием пределов/условий, указанных в утвержденном квалификационном протоколе, новый WCB распространяется на существующую систему обеспечения качества, и нет необходимости представлять изменение.
Если документация WCB в досье не включает утвержденный квалификационный протокол для внедрения новых WCB, держателю регистрационного удостоверения следует подать вариацию B.I.a.2 типа IB (поскольку условие 5 не выполняется).
Чтобы ввести квалификационный протокол для подготовки нового WCB, держателю регистрационного удостоверения следует подать изменение типа II B. I.a.2.c. Добавление нового WCB может быть охвачено как часть этой единственной вариации типа II.
I.a.2.c. Добавление нового WCB может быть охвачено как часть этой единственной вариации типа II.
Изменения к утвержденной стандартной процедуре (протоколу) должны подаваться с использованием варианта типа IB B.I.a.2.a или типа II B.I.a.2.c в зависимости от сложности изменения. Добавление нового WCB может быть охвачено как часть этого единственного варианта.
2.8. Как я должен представить новый эталонный стандарт для биологического лекарственного препарата?
Если новый эталонный стандарт вводится с использованием пределов/условий, подробно описанных в утвержденном протоколе квалификации, новый эталонный стандарт распространяется на существующую систему обеспечения качества, и нет необходимости подавать изменения.
Если квалификационный протокол не был утвержден, а старый материал все еще доступен, и держатель РУ может предоставить результаты испытаний на сопоставимость с использованием обоих эталонных стандартов, держателю РУ следует подать изменение типа IB либо в соответствии с B. I.b.2.e для активной субстанции, либо в соответствии с B.II.d.2.d для готовой продукции.
I.b.2.e для активной субстанции, либо в соответствии с B.II.d.2.d для готовой продукции.
Если квалификационный протокол не был утвержден, а старый материал больше не доступен и, следовательно, невозможно прямое сравнение нового/старого материала, держатель держателя регистрационного удостоверения должен подать изменение типа II либо по B.I.b.2.d для активной субстанции, либо по B.II. .d.2.c для готовой продукции.
Чтобы ввести квалификационный протокол для подготовки нового эталонного стандарта, держателю регистрационного удостоверения следует зарегистрировать изменение типа II либо в соответствии с B.I.b.2.d для активной субстанции, либо в соответствии с B.II.d.2.c для готового продукта. После утверждения изменения введение нового эталонного стандарта в соответствии с протоколом будет охватывать существующую систему обеспечения качества.
2.9. Какие изменения в производственных площадках, зданиях и помещениях покрываются Системой обеспечения качества компании (GMP)?
При условии, что модуль 3 не затронут, за исключением раздела 3.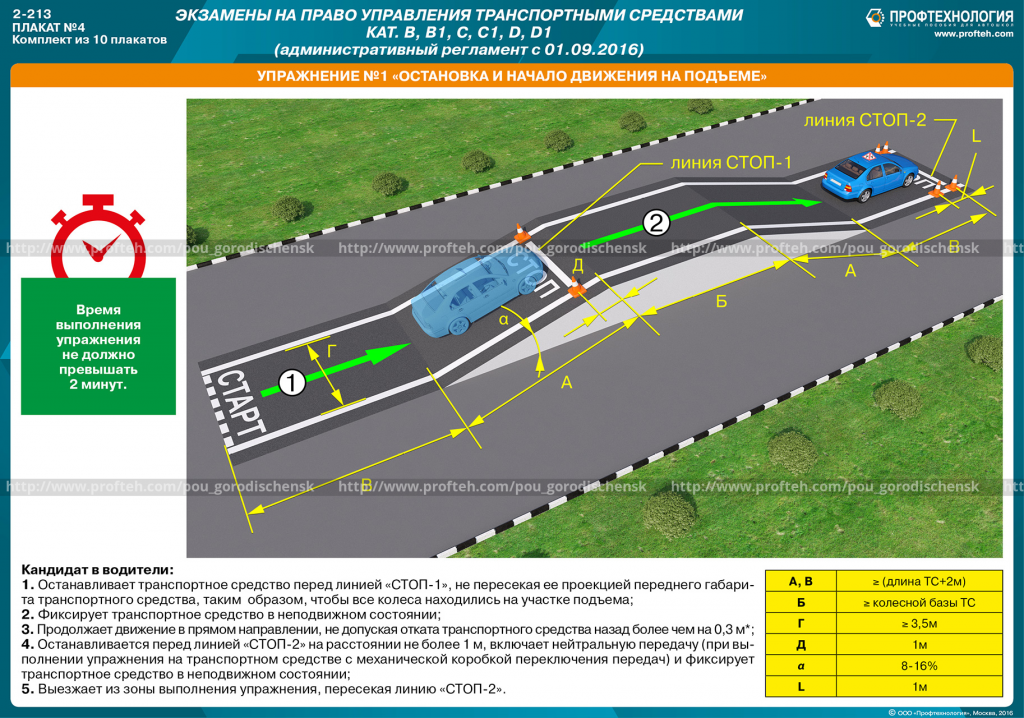 2.A.1 (для биологических лекарственных препаратов), перечисленные ниже изменения (не исчерпывающий список) подпадают под действие системы менеджмента качества компании и не требуют вариант регистрационного удостоверения:
2.A.1 (для биологических лекарственных препаратов), перечисленные ниже изменения (не исчерпывающий список) подпадают под действие системы менеджмента качества компании и не требуют вариант регистрационного удостоверения:
- Перенос производственной деятельности из одного здания в другое на том же разрешенном участке
- Перенос производственной деятельности из одного помещения в другое в том же разрешенном здании
- Перенос деятельности по контролю качества из одного здания в другое на том же разрешенном участке производственная площадка
- Новый изолятор в разрешенном здании
- Новая среда или помещение для подготовки буфера в разрешенном здании
- Изменения в планировке разрешенной производственной площадки
Если в результате каких-либо из перечисленных выше изменений в модуль 3 вносятся какие-либо поправки (за исключением раздела 3.2.A.1 для биологических лекарственных препаратов), такие как изменение сведений об адресе производственной площадки, изменения к производственному процессу, изменениям в размере партии и т. д., держателю РУ следует подать соответствующие изменения.
д., держателю РУ следует подать соответствующие изменения.
2.10. Изменения в оборудовании, используемом в производственном процессе. На какие изменения распространяется система обеспечения качества компании (GMP)?
При условии, что новое оборудование эквивалентно используемому в настоящее время и работает в утвержденном диапазоне технологических параметров, изменение подпадает под действие системы обеспечения качества предприятия.
Если внедрение нового оборудования оказывает какое-либо влияние на процессы и детали, зарегистрированные в модуле 3 (за исключением раздела 3.2.A.1 для биологических лекарственных препаратов), держателю РУ следует представить соответствующие изменения.
2.11. Как обновить раздел 3.2.A.1 для лекарственных препаратов Biotech?
Уведомление для заявителей на лекарственные средства для человека (Eudralex – Том 2B) устанавливает, что информация о средствах и оборудовании должна быть включена в Приложение 3. 2.A.1 для биотехнологических лекарственных средств.
2.A.1 для биотехнологических лекарственных средств.
Любое обновление этого раздела может быть включено как часть любого предстоящего изменения, влияющего на Модуль 3. В случае, если держатель РУ пожелает обновить этот раздел и не предвидит каких-либо предстоящих изменений, влияющих на Модуль 3 в краткосрочной/среднесрочной перспективе, держатель РУ может рассмотреть представление варианта типа IB (B.II.z).
2.12 На что мне следует обратить внимание, если после авторизации моего медицинского устройства произойдут какие-либо изменения?
Регламент Комиссии (ЕС) № 1234/2008 («Регламент об изменениях») и «Руководство Комиссии по деталям различных категорий отклонений, по применению процедур, изложенных в Главах II, IIa, III и IV Регламента Комиссии (ЕС) № 1234/2008 и о документации, которая должна быть представлена в соответствии с этими процедурами» («Руководство по внесению изменений») определяет условия и требования, которые должны быть выполнены для любого изменения (добавления, замены или исключения) к измерительное или административное устройство (классификация B. IV.1). В зависимости от изменения изменение может быть классифицировано как тип IA(IN), IB или II. Учитывая относительно короткие сроки процедуры внесения изменений, для медицинских изделий, которые не образуют единый целостный продукт на момент размещения на рынке и которые упаковываются вместе с лекарственным средством, знак СЕ должен быть представлен в составе документации на время подачи варианта во избежание каких-либо задержек. Опубликованные сроки представления и оценки соответствующего варианта будут соблюдаться.
IV.1). В зависимости от изменения изменение может быть классифицировано как тип IA(IN), IB или II. Учитывая относительно короткие сроки процедуры внесения изменений, для медицинских изделий, которые не образуют единый целостный продукт на момент размещения на рынке и которые упаковываются вместе с лекарственным средством, знак СЕ должен быть представлен в составе документации на время подачи варианта во избежание каких-либо задержек. Опубликованные сроки представления и оценки соответствующего варианта будут соблюдаться.
2.13 Как подать заявку на передачу методов испытаний лекарственных средств в новый или уже авторизованный центр испытаний? Какая категория классификации вариаций применима и какой тип сопроводительной документации ожидается? Версия, декабрь 2021 г.
Тем не менее, необходимость подачи вариации для утверждения существующего испытательного полигона контроля качества для проведения дополнительных испытаний после завершения передачи аналитических испытаний является не предусмотренные конкретно действующей Директивой ЕС по классификации вариаций представление вариации по аналогии с существующей предусмотренной категорией вариации B. I.a.1.j, B.II.b.2.b или B.II.b.2.c.3 может быть необходимо, как указано ниже в разделе ii.
I.a.1.j, B.II.b.2.b или B.II.b.2.c.3 может быть необходимо, как указано ниже в разделе ii.
- В случае переноса физических, химических и микробиологических методов испытаний на новый испытательный полигон (т. е. еще не указанный в досье) требуется представление изменения (категория B.II.b.2) .
Документация, которая должна быть представлена, определена в Директиве ЕС по классификации вариаций.
- В случае биологических, иммунологических или иммунохимических методов испытаний (например, биоанализы in vivo, биоанализы in vitro, ферментативные анализы, анализы связывания, анализы нейтрализации, иммунохимические анализы) необходимо передать в новый испытательный полигон или на уже одобренный испытательный полигон ,
необходимо представить вариант типа B.I.a.1 или B.II.b.2.
Документация должна включать, как минимум, протоколы переноса метода в соответствии со статьей 6. 39 раздела 6 раздела 4 Eudralex (которые заранее определяют критерии приемлемости) из старого места в новое место (или новую испытательную лабораторию). В зависимости от изменчивости конкретного метода и потенциального риска для качества, безопасности или эффективности продукта, связанного с предлагаемым изменением, могут потребоваться дополнительные данные, такие как сводка результатов аналитического теста переноса метода.
39 раздела 6 раздела 4 Eudralex (которые заранее определяют критерии приемлемости) из старого места в новое место (или новую испытательную лабораторию). В зависимости от изменчивости конкретного метода и потенциального риска для качества, безопасности или эффективности продукта, связанного с предлагаемым изменением, могут потребоваться дополнительные данные, такие как сводка результатов аналитического теста переноса метода.
2.14 Нужно ли указывать в досье новую производственную площадку для физического ввоза? Новый март 2021 г.
Государства-члены должны гарантировать, что импорт лекарственных средств на их территорию подлежит разрешению в соответствии со статьей 40(3) Директивы 2001/83/ЕС.
Обратите внимание, что физический импорт и сертификация партии импортируемой продукции — это разные операции, которые могут осуществляться на одних и тех же или на разных авторизованных производственных площадках, расположенных в Евросоюзе (ЕЭЗ).
Регистрировать в досье вашего регистрационного удостоверения производителя (производителей), ответственного за физический импорт готовой продукции, не требуется, следовательно, для изменения мест физического импорта не требуется никаких заявлений о внесении изменений. Владелец разрешения на производство и импорт (MIA), ответственный за сертификацию партии импортируемых лекарственных средств, должен убедиться, что место (места) физического импорта имеет надлежащее разрешение для этой операции. Физический импортер должен иметь MIA с записью в разделе 2.3.1 в соответствии с Союзным форматом для MIA. Должно быть заключено техническое соглашение между физическим импортером и местом выпуска партии. Для получения дополнительной информации о сертификации QP и о выпуске партий в ЕС, а также в отношении импорта, см. Приложение 16 GMP9.0005
Владелец разрешения на производство и импорт (MIA), ответственный за сертификацию партии импортируемых лекарственных средств, должен убедиться, что место (места) физического импорта имеет надлежащее разрешение для этой операции. Физический импортер должен иметь MIA с записью в разделе 2.3.1 в соответствии с Союзным форматом для MIA. Должно быть заключено техническое соглашение между физическим импортером и местом выпуска партии. Для получения дополнительной информации о сертификации QP и о выпуске партий в ЕС, а также в отношении импорта, см. Приложение 16 GMP9.0005
2.15 Как предоставить новую производственную площадку для сборки неотъемлемого медицинского изделия? Какая классификационная категория вариаций применима и какой тип сопроводительной документации ожидается? медицинское изделие, собираемое в первичную упаковку лекарственного средства с образованием целостного лекарственного средства, должно быть представлено как вариант типа IB, классифицируемый по категории B.II.

