Аккумуляторы NovAK OP — официальный сайт производителя NovAK
Особенности:
- Прозрачный корпус из SAN
- Доливка воды 1 раз в 1 –3 года
- Использование современных фильтр-пробок позволяет обеспечить взрывозащищённость конструкции и сократить количество доливки воды.
- В аккумуляторе серии OP производства НовАК использованы в составе положительного электрода мышьяковисто-оловянная лигатура и запатентованный состав пасты.
- Электролит представляет собой раствор серной кислоты. Плотность электролита полностью заряженного аккумулятора равна 1,240+0,010 г/см3 при температуре 20°С.
- Напряжение постоянного подзаряда составляет 2,23+0,01 В/Эл при 20 °С.
Каталог аккумуляторов серии ОР производства НовАК
| Название | Номинальная емкость | Срок службы | Габариты (ДxШxВ) |
| ОР3 | 73 Ач | 25 лет | 122x189x385 мм | Подробнее>> |
| ОР4 | 98 Ач | 25 лет | 122x189x385 мм | Подробнее>> |
| ОР5 | 122 Ач | 122x189x385 мм | Подробнее>> | |
| ОР6 | 146 Ач | 25 лет | 122x189x385 мм | Подробнее>> |
| ОР7 | 171 Ач | 25 лет | 122x189x385 мм | Подробнее>> |
| ОР8 | 195 Ач | 25 лет | 122x189x385 мм | Подробнее>> |
| ОР9 | 25 лет | 122x189x385 мм | Подробнее>> | |
| ОР10 | 244 Ач | 25 лет | 160x189x385 мм | Подробнее>> |
| ОР11 | 268 Ач | 25 лет | 160x189x385 мм | Подробнее>> |
| ОР12 | 293 Ач | 25 лет | 160x189x385 мм | Подробнее>> |
| ОР13 | 317 Ач | 25 лет | 198x189x385 мм | Подробнее>> |
| ОР14 | 342 Ач | 25 лет | 198x189x385 мм | Подробнее>> |
| ОР15 | 366 Ач | 25 лет | 198x189x385 мм | Подробнее>> |
| ОР16 | 390 Ач | 25 лет | 198x189x385 мм | Подробнее>> |
| ОР17 | 415 Ач | 25 лет | 236x189x385 мм | Подробнее>> |
| ОР18 | 439 Ач | 25 лет | 236x189x385 мм | Подробнее>> |
| ОР19 | 464 Ач | 25 лет | 236x189x385 мм | Подробнее>> |
| ОР20 | 25 лет | 236x189x385 мм | Подробнее>> | |
| ОР21 | 512 Ач | 25 лет | 274x189x385 мм | Подробнее>> |
| ОР22 | 537 Ач | 25 лет | 274x189x385 мм | Подробнее>> |
| ОР23 | 561 Ач | 25 лет | 350x189x385 мм | Подробнее>> |
| ОР24 | 586 Ач | 25 лет | 350x189x385 мм | Подробнее>> |
| ОР25 | 610 Ач | 25 лет | 350x189x385 мм | Подробнее>> |
| ОР26 | 634 Ач | 25 лет | 350x189x385 мм | Подробнее>> |
| ОР27 | 659 Ач | 25 лет | 350x189x385 мм | Подробнее>> |
| ОР28 | 683 Ач | 25 лет | 350x189x385 мм | Подробнее>> |
| ОР29 | 708 Ач | 25 лет | 350x189x385 мм | Подробнее>> |
| ОР30 | 732 Ач | 25 лет | 350x189x385 мм | Подробнее>> |
| ОР30+ | 800 Ач | 25 лет | 500x170x385 мм | Подробнее>> |
| OP32 | 850 Ач | 25 лет | 500x170x385 мм | Подробнее>> |
| OP34 | 900 Ач | 25 лет | 500x170x385 мм | Подробнее>> |
| OP36 | 950 Ач | 25 лет | 500x170x385 мм | Подробнее>> |
| OP38 | 1000 Ач | 25 лет | 500x170x385 мм | Подробнее>> |
| OP40 | 1050 Ач | 25 лет | 500x170x385 мм | Подробнее>> |
| OP42 | 1100 Ач | 25 лет | 500x170x385 мм | Подробнее>> |
| OP44 | 1150 Ач | 25 лет | 500x170x385 мм | Подробнее>> |
Конструкция аккумулятора OP
- Плоская положительная пластина с нанесением активного вещества намазным способом изготовлена из
свинцово-сурьмяного сплава с низким содержанием сурьмы (не более 1,7%).

- Плоская отрицательная пластина изготовлена из свинцово-сурьмяного сплава с нанесением активного вещества намазным способом.
- Сепаратор между положительными и отрицательными пластинами выполнен из комбинированного микропористого и гофрированного листового материала.
- Корпус элементов изготовлен из прозрачного пластика (SAN). На корпусе имеются четко обозначенные метки минимального и максимального уровня электролита.
- Пробка является пожаровзрыво-безопасной.
- Борн изготовлен из свинца и содержит латунную вставку для улучшения электропроводимости и механической прочности.
- Межэлементная перемычка изготовлена из меди и имеет гальваническое покрытие.

Внешний вид аккумуляторов OP
Особенности плоской намазной пластины
Модернизация аккумуляторных батарей OP
Для дополнительной защиты борнов аккумуляторов серий АСК и OPот коррозии ООО «НовАК» модернизировало узел сочленения борна с крышкой. Новое уплотнительное кольцо препятствует возникновению коррозии в месте выхода борна из крышки и, как следствие, исключает возможность растрескивания крышки и бака аккумулятора.
| Температура окружающей среды, °С | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 |
Фактор коррекции емкости. Длительность заряда 10-59 мин. Длительность заряда 10-59 мин.
|
0,680 | 0,770 | 0,850 | 0,940 | 1,000 | 1,035 | 1,065 | 1,090 | 1,110 |
Фактор коррекции емкости. Длительность заряда 1-24 часа Длительность заряда 1-24 часа
|
0,740 | 0,810 | 0,880 | 0,950 | 1,000 | 1,025 | 1,050 | 1,070 | 1,080 |
В случае эксплуатации при низких темпиратурах (до -40°С) могут поставляться элементы с плотностью электролита
1,300 на максимальном уровне.
Стандарты и сертификаты
- Рекомендованы заключением ПАО « Россети» для применения в электроэнергетике.
- Рекомендованы Управлением автоматики и телемеханики ОАО «РЖД» для применения на железнодорожном транспорте. Технические условия согласованы с Управлением автоматики и телемеханики ОАО РЖД.
Условия хранения
Максимальное время хранения полностью заряженного элемента при температуре 20°С составляет 6 месяцев. В случае длительного хранения желательно производить перезарядку 1 раз в 3 месяца.
Видеогалерея
Обслуживание аккумулятора
- org/ListItem»> Аккумуляторы
- Уход за аккумулятором
Очень часто аккумулятор, установленный в автомобиле, выглядит как минимум не аккуратно,
— испачкан грязью или машинным маслом, присутствуют следы влаги или электролита
на поверхности, что может привести к замыканию контактов, непроизвольному разряду
емкости, а то и к полному выходу из строя аккумулятора. Чтобы автомобильный
аккумулятор прослужил весь срок, заявленный производителем, нужно следить за
чистотой корпуса, чтобы он был сухим, клеммы и выводы полюсов должны быть
смазаны техническим вазелином или другой густой нейтральной смазкой.
Уровень и плотность электролита должны быть под постоянным контролем, поскольку
в течение эскплуатации автомобиля уровень электролита в акб снижается
вследствие испарения воды, входящей в его состав.
Вы можете самостоятельно проверить банки аккумулятора.
-Если корпус батареи полупрозрачный, уровень электролита определяем визуально –
между метками «min» и «max».
-Если корпус батареи не прозрачный, нужно
опустить стеклянную трубку в отверстие банки до упора в предохранительную сетку
и, зажав верхнее отверстие трубки пальцем, вынуть трубку. Рекомендуемый уровень
электролита ~ 10–15 мм.
В случае если уровень
электролита недостаточный,
доливаем в аккумуляторную банку дистиллированную воду (не из лужи воду,
не водопроводную и уж тем более не прочие жидкости вроде шампуня! С подобными случаями приходилось
сталкиваться нашим специалистам.)
Попутно можно проверить прозрачность электролита, мутный грязно-бурый цвет
указывает на осыпание активной массы пластин, в таком случае лучше обратиться к
специалисту.
Для замера плотности электролита вставляем ареометр в отверстие банки до упора
в предохранительную сетку и засасываем с помощью груши такое количество
электролита, чтобы всплыл поплавок ареометра. Во избежание химических ожогов и
порчи вещей, измерение плотности электролита лучше производить в рабочей
одежде, перчатках и защитных очках.
Во избежание химических ожогов и
порчи вещей, измерение плотности электролита лучше производить в рабочей
одежде, перчатках и защитных очках.
Плотность электролита должна составлять 1,28 г/см3 для умеренного климата при
температуре электролита 20°С. Если показатель плотности ниже указанной или
отличается в банках более чем на 0,02 г/см3, необходимо подзарядить
аккумулятор.
Вы должны знать, что и перезаряд, и недозаряд – одинаково плохо!
Перезаряд аккумулятора происходит в результате неисправности автомобильной
электроники, в частности, реле-регулятора. При этом аккумуляторная батарея
перегревается, электролит «кипит», его уровень падает, пластины «обнажаются». В
результате — разрушение решётки плюсовых пластин и интенсивное осыпание с них
активной массы, что равносильно смерти аккумулятора.
Недозаряд батареи в основном случается из-за ненатянутого ремня генератора,
неисправности генератора или чрезмерной нагрузки на бортовую сеть питания
автомобиля (обычно зимой). Как следствие — сульфатации пластин. В особо тяжёлых
случаях происходит смена полярности отдельных банок аккумулятора.
Как следствие — сульфатации пластин. В особо тяжёлых
случаях происходит смена полярности отдельных банок аккумулятора.
Дополнительно хотелось бы упомянуть про пуск двигателя.
Не насилуйте аккумулятор стартером. Включения стартера должны быть
кратковременными — не более 10 секунд с перерывом в 1-2мин (можно дольше). Если
4-5 попыток завести двигатель не увенчались успехом, не стоит продолжать,
только разрядите аккумулятор. Попробуйте проверить исправность топливной
системы или системы зажигания.
Не забудьте убрать любые металлические предметы, в том числе снять кольца,
браслеты и часы перед работой с системой электрооборудования автомобиля. Даже
при разъединенном аккумуляторе может произойти емкостная разрядка, если зажим
питания компонента случайно закорочен металлическим предметом. Это может
вызвать шок или сильный ожог.
Если все вышеоизложенное по какой-либо причине сложно
сделать самостоятельно, Вы всегда можете обратиться к нашим специалистам по
тел. +7 (771)
067-8677
+7 (771)
067-8677
26.05.2022 12:44:17
0
261
Комментарии:
Влияние электролита на формирование поверхности раздела электрод/электролит на электроде из InSb в Mg-ионных батареях
1. Чой Дж. В., Аурбах Д. Обещания и реальность постлитий-ионных батарей с высокой плотностью энергии. Нац. Преподобный Матер. 2016;1:16013. doi: 10.1038/natrevmats.2016.13. [CrossRef] [Google Scholar]
2. Yaksic A., Tilton J.E. Использование кумулятивной кривой доступности для оценки угрозы истощения полезных ископаемых: пример лития. Ресурс. Политика. 2009; 34: 185–194. doi: 10.1016/j.resourpol.2009.05.002. [CrossRef] [Google Scholar]. Батареи будущего: от материалов к метрикам ячеек. J. Источники энергии. 2021;482:228872. doi: 10.1016/j.jpowsour.2020.228872. [CrossRef] [Google Scholar]
4. Эллис Б.Л., Назар Л.Ф. Натриевые и натрий-ионные аккумуляторы для хранения энергии. Курс. мнение Твердотельный материал. науч. 2012;16:168–177. doi: 10.1016/j.cossms.2012.04.002. [Перекрестная ссылка] [Академия Google]
Курс. мнение Твердотельный материал. науч. 2012;16:168–177. doi: 10.1016/j.cossms.2012.04.002. [Перекрестная ссылка] [Академия Google]
5. Доминко Р., Битенц Дж., Бертло Р., Готье М., Пагот Г., Ди Ното В. Магниевые батареи: текущая картина и недостающие части головоломки. J. Источники энергии. 2020;478:229027. doi: 10.1016/j.jpowsour.2020.229027. [CrossRef] [Google Scholar]
6. Аурбах Д., Лу З., Шехтер А., Гофер Ю., Гизбар Х., Тургеман Р., Коэн Ю., Мошкович М., Леви Э. Прототипы систем для перезаряжаемых аккумуляторов Магниевые батареи. Природа. 2000;407:724–727. doi: 10.1038/35037553. [PubMed] [CrossRef] [Академия Google]
7. Гаммов Р.Дж., Вамвоунис Г., Каннан М.Б., Хе Ю. Ионно-кальциевые батареи: современное состояние и перспективы на будущее. Доп. Матер. 2018;30:e1801702. doi: 10.1002/adma.201801702. [PubMed] [CrossRef] [Google Scholar]
8. Понроуч А., Фронтера С., Барде Ф., Паласин М.Р. На пути к перезаряжаемой батарее на основе кальция. Нац. Матер. 2016;15:169–172. doi: 10.1038/nmat4462. [PubMed] [CrossRef] [Google Scholar]
doi: 10.1038/nmat4462. [PubMed] [CrossRef] [Google Scholar]
9. Wu X., Leonard D.P., Ji X. Новые неводные ионно-калийные батареи: проблемы и возможности. хим. Матер. 2017;29: 5031–5042. doi: 10.1021/acs.chemmater.7b01764. [CrossRef] [Google Scholar]
10. Эфтехари А. Калийная вторичная ячейка на основе катода берлинской лазури. J. Источники энергии. 2004; 126: 221–228. doi: 10.1016/j.jpowsour.2003.08.007. [CrossRef] [Google Scholar]
11. Lei X., Zheng Y., Zhang F., Wang Y., Tang Y. Высокостабильные двухионные батареи на основе ионов магния на основе нерастворимого низкомолекулярного органического анодного материала. . Материя накопления энергии. 2020;30:34–41. doi: 10.1016/j.ensm.2020.04.025. [Перекрестная ссылка] [Академия Google]
12. Ю Х.Д., Штеренберг И., Гофер Ю., Гершинский Г., Пур Н., Аурбах Д. Mg Аккумуляторы: постоянная задача. Энергетическая среда. науч. 2013;6:2265–2279. doi: 10.1039/c3ee40871j. [CrossRef] [Google Scholar]
13. Орикаса Ю. , Масисе Т., Кояма Ю., Мори Т., Хаттори М., Ямамото К., Окадо Т., Хуанг З.-Д., Минато Т., Тассел С. и др. Перезаряжаемая магниевая батарея с высокой плотностью энергии с использованием земных и нетоксичных элементов. науч. Отчет 2014; 4:5622. doi: 10.1038/srep05622. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Масисе Т., Кояма Ю., Мори Т., Хаттори М., Ямамото К., Окадо Т., Хуанг З.-Д., Минато Т., Тассел С. и др. Перезаряжаемая магниевая батарея с высокой плотностью энергии с использованием земных и нетоксичных элементов. науч. Отчет 2014; 4:5622. doi: 10.1038/srep05622. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
14. Лоссиус Л.П., Эмменеггер Ф. Покрытие магнием из органических растворителей. Электрохим. Акта. 1996; 41: 445–447. doi: 10.1016/0013-4686(95)00326-6. [CrossRef] [Google Scholar]
15. Лу З., Шехтер А., Мошкович М., Аурбах Д. Об электрохимическом поведении магниевых электродов в полярных растворах апротонных электролитов. Дж. Электроанал. хим. 1999; 466: 203–217. doi: 10.1016/S0022-0728(99)00146-1. [CrossRef] [Google Scholar]
16. Чжао-Каргер З., Бардаджи М.Е.Г., Фур О., Фихтнер М. Новый класс неагрессивных высокоэффективных электролитов для перезаряжаемых магниевых батарей. Дж. Матер. хим. А. 2017;5:10815–10820. дои: 10.1039/C7TA02237A. [CrossRef] [Google Scholar]
17. Мизрахи О., Амир Н., Поллак Э., Чусид О., Маркс В., Готлиб Х., Ларуш Л., Зиниград Э., Аурбах Д. Растворы электролитов с Широкое электрохимическое окно для перезаряжаемых магниевых батарей. Дж. Электрохим. соц. 2007;155:А103. doi: 10.1149/1.2806175. [CrossRef] [Google Scholar]
Мизрахи О., Амир Н., Поллак Э., Чусид О., Маркс В., Готлиб Х., Ларуш Л., Зиниград Э., Аурбах Д. Растворы электролитов с Широкое электрохимическое окно для перезаряжаемых магниевых батарей. Дж. Электрохим. соц. 2007;155:А103. doi: 10.1149/1.2806175. [CrossRef] [Google Scholar]
18. Kim H.S., Arthur T.S., Allred G.D., Zajicek J., Newman J.G., Rodnyansky A.E., Oliver A.G., Boggess W.C., Muldoon J. Структура и совместимость магниевого электролита с серным катодом . Нац. коммун. 2011;2:427. doi: 10.1038/ncomms1435. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
19. Бариле С.Дж., Спатни Р., Завадил К.Р., Гевирт А.А. Исследование обратимости образующихся in situ органогалогеналюминатов магния для осаждения и растворения магния. Дж. Физ. хим. С. 2014; 118:10694–10699. doi: 10.1021/jp503506c. [CrossRef] [Google Scholar]
20. Сон С.-Б., Гао Т., Харви С.П., Штайрер К.Х., Стоукс А., Норман А., Ван С., Креше А., Сюй К., Бан С. , Искусственная интерфаза обеспечивает обратимую химию магния в карбонатных электролитах. Нац. хим. 2018;10:532–539. doi: 10.1038/s41557-018-0019-6. [PubMed] [CrossRef] [Google Scholar]
Нац. хим. 2018;10:532–539. doi: 10.1038/s41557-018-0019-6. [PubMed] [CrossRef] [Google Scholar]
21. Сингх Н., Артур Т.С., Линг С., Мацуи М., Мизуно Ф. Оловянный анод с высокой плотностью энергии для перезаряжаемых магниево-ионных аккумуляторов. хим. коммун. 2012;49:149–151. doi: 10.1039/C2CC34673G. [PubMed] [CrossRef] [Google Scholar]
22. Артур Т.С., Сингх Н., Мацуи М. Электроосаждение Bi, Sb и Bi 1-x Sb x Сплавы в качестве анодов для Mg-Ion аккумуляторов. Электрохим. коммун. 2012;16:103–106. doi: 10.1016/j.elecom.2011.12.010. [Перекрестная ссылка] [Академия Google]
23. Мургия Ф., Велдекидан Э.Т., Стеевано Л., Монкондуит Л., Бертло Р. Первое исследование электрода на основе индия в магниевой батарее. Электрохим. коммун. 2015;60:56–59. doi: 10.1016/j.elecom.2015.08.007. [CrossRef] [Google Scholar]
24. Перияпперума К., Тран Т.Т., Перселл М.И., Обровац М.Н. Обратимое магнезиирование Pb. Электрохим. Акта. 2015; 165:162–165. doi: 10. 1016/j.electacta.2015.03.006. [CrossRef] [Google Scholar]
1016/j.electacta.2015.03.006. [CrossRef] [Google Scholar]
25. Shao Y., Gu M., Li X., Nie Z., Zuo P., Li G., Liu T., Xiao J., Cheng Y., Wang C. , и другие. Высокообратимая вставка Mg в наноструктурированный висмут для ионных батарей Mg. Нано Летт. 2014;14:255–260. doi: 10.1021/nl403874y. [PubMed] [CrossRef] [Академия Google]
26. Ню Дж., Чжан З., Аурбах Д. Анодные материалы из сплавов для перезаряжаемых магниево-ионных аккумуляторов. Доп. Энергия Матер. 2020;10:2000697. doi: 10.1002/aenm.202000697. [CrossRef] [Google Scholar]
27. Мацуи М., Кувата Х., Мори Д., Иманиши Н., Мизухата М. Дестабилизированный пассивирующий слой на интерметаллиде на основе магния как потенциальные активные анодные материалы для магниево-ионных аккумуляторов. Передний. хим. 2019;7:7. doi: 10.3389/fchem.2019.00007. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
28. Ихе А.Б., Хан С.К., Прабакар С.Дж.Р., Парк В.Б., Сон К.-С., Пьо М. 3 мг/мг 2 Sn-аноды с беспрецедентными электрохимическими характеристиками для жизнеспособных магниево-ионных аккумуляторов. Дж. Матер. хим. А. 2020; 8: 14277–14286. doi: 10.1039/D0TA05828A. [CrossRef] [Google Scholar]
Дж. Матер. хим. А. 2020; 8: 14277–14286. doi: 10.1039/D0TA05828A. [CrossRef] [Google Scholar]
29. Блондо Л., Фой Э., Ходжа Х., Готье М. Неожиданное поведение сплава InSb в Mg-ионных батареях: обнаружение обратимости Sb. Дж. Физ. хим. C. 2019; 123:1120–1126. doi: 10.1021/acs.jpcc.8b10913. [CrossRef] [Google Scholar]
30. Блондо Л., Сурбле С., Фой Э., Ходжа Х., Готье М. Электрохимическая реактивность твердого раствора In-Pb в качестве отрицательного электрода для перезаряжаемых магниево-ионных аккумуляторов. . J. Energy Chem. 2021; 55: 124–128. doi: 10.1016/j.jechem.2020.07.004. [CrossRef] [Google Scholar]
31. Heiskanen S.K., Kim J., Lucht B.L. Генерация и эволюция твердого электролитного межфазного слоя литий-ионных аккумуляторов. Джоуль. 2019;3:2322–2333. doi: 10.1016/j.joule.2019.08.018. [Перекрестная ссылка] [Академия Google]
32. Фонг Р., фон Сакен У., Дан Дж. Р. Исследования интеркаляции лития в углерод с использованием неводных электрохимических ячеек. Дж. Электрохим. соц. 1990;137:2009. doi: 10.1149/1.2086855. [CrossRef] [Google Scholar]
Дж. Электрохим. соц. 1990;137:2009. doi: 10.1149/1.2086855. [CrossRef] [Google Scholar]
33. Пелед Э., Менкин С. Обзор — SEI: прошлое, настоящее и будущее. Дж. Электрохим. соц. 2017;164:A1703. doi: 10.1149/2.1441707jes. [CrossRef] [Google Scholar]
34. An S.J., Li J., Daniel C., Mohanty D., Nagpure S., Wood D.L. Состояние понимания межфазной фазы графит-твердый электролит (SEI) литий-ионной батареи и ее взаимосвязь с цикличностью пласта. Углерод. 2016; 105:52–76. doi: 10.1016/j.carbon.2016.04.008. [Перекрестная ссылка] [Академия Google]
35. Ширли Д.А. Рентгеновский фотоэмиссионный спектр высокого разрешения валентных полос золота. физ. Преподобный Б. 1972; 5: 4709–4714. doi: 10.1103/PhysRevB.5.4709. [CrossRef] [Google Scholar]
36. Ван Л., Велборн С.С., Кумар Х., Ли М., Ван З., Шеной В.Б., Деци Э. Магниево-ионный сплав с высокой скоростью и длительным сроком службы Аккумуляторный анод, активированный за счет фазового превращения твердого тела в жидкость, вызванного (раз)магнииванием при температуре, близкой к комнатной. Доп. Энергия Матер. 2019;9:1
Доп. Энергия Матер. 2019;9:1
6. doi: 10.1002/aenm.201
6. [CrossRef] [Google Scholar]
37. Нгуен Д.-Т., Сонг С.-В. Станнид магния в качестве анода большой емкости для магниево-ионных аккумуляторов. J. Источники энергии. 2017; 368:11–17. doi: 10.1016/j.jpowsour.2017.09.054. [CrossRef] [Google Scholar]
38. Xu X., Chao D., Chen B., Liang P., Li H., Xie F., Davey K., Qiao S.-Z. Выявление механизма накопления магния в мезопористом висмуте с помощью спектроскопии и моделирования Ab-Initio. Ангью. хим. Междунар. Эд. 2020;59:21728–21735. doi: 10.1002/anie.202009528. [PubMed] [CrossRef] [Google Scholar]
39. Hong S., Jo H., Song S.-W. Диффузионная способность лития пленочных модельных электродов на основе олова для литий-ионных аккумуляторов. Дж. Электрохим. науч. Технол. 2015;6:116–120. doi: 10.33961/JECST.2015.6.4.116. [CrossRef] [Google Scholar]
40. Liu Y., Wang L., Jiang K., Yang S. Подготовка электроосаждением самостоятельных анодных электродов из сплава Cu-Sn для литий-ионных аккумуляторов. J. Alloys Compd. 2019; 775: 818–825. doi: 10.1016/j.jallcom.2018.10.207. [Перекрестная ссылка] [Академия Google]
J. Alloys Compd. 2019; 775: 818–825. doi: 10.1016/j.jallcom.2018.10.207. [Перекрестная ссылка] [Академия Google]
41. Нгуен Г.Т.Х., Нгуен Д.-Т., Сонг С.-В. Раскрытие роли процесса формирования в улучшении циклических характеристик композитного анода из станнида магния для магниево-ионных аккумуляторов. Доп. Матер. Интерфейсы. 2018;5:1801039. doi: 10.1002/admi.201801039. [CrossRef] [Google Scholar]
42. Delpuech N., Dupré N., Mazouzi D., Gaubicher J., Moreau P., Bridel J.-S., Guyomard D. Lestriez, B. Корреляция между необратимой емкостью и Разложение растворителей электролита, исследованное методом ЯМР в отрицательном электроде на основе кремния литий-ионного элемента. Электрохим. коммун. 2013; 33:72–75. doi: 10.1016/j.elecom.2013.05.001. [Перекрестная ссылка] [Академия Google]
43. Мандли А.Р., Кошик А., Патил Р.С., Наха А., Харихаран К.С., Колаке С.М., Хан С., Чой В. Анализ влияния увеличения сопротивления на уменьшение емкости литий-ионных аккумуляторов. Энергия рез. 2019;43:2044–2056. doi: 10.1002/er.4397. [CrossRef] [Google Scholar]
2019;43:2044–2056. doi: 10.1002/er.4397. [CrossRef] [Google Scholar]
44. Талайе Э., Бонник П., Сун С., Панг К., Лян С., Назар Л.Ф. Методы и протоколы исследования электрохимических материалов для хранения энергии. хим. Матер. 2017;29:90–105. doi: 10.1021/acs.chemmater.6b02726. [Перекрестная ссылка] [Академия Google]
45. Кумар Р., Токранов А., Шелдон Б.В., Сяо С., Хуанг З., Ли С., Мюллер Т. Исследования in situ и Operando механизмов разрушения межфазной фазы твердого электролита на кремниевых электродах. ACS Energy Lett. 2016; 1: 689–697. doi: 10.1021/acsenergylett.6b00284. [CrossRef] [Google Scholar]
46. Аттиас Р., Салама М., Хирш Б., Гоффер Ю., Аурбах Д. Интерфейсы анод-электролит во вторичных магниевых батареях. Джоуль. 2019;3:27–52. doi: 10.1016/j.joule.2018.10.028. [Перекрестная ссылка] [Академия Google]
47. Пантеа Д., Дармштадт Х., Калиагин С., Рой С. Электропроводность проводящих сажи: влияние химии поверхности и топологии. заявл. Серф. науч. 2003; 217:181–193. doi: 10.1016/S0169-4332(03)00550-6. [CrossRef] [Google Scholar]
doi: 10.1016/S0169-4332(03)00550-6. [CrossRef] [Google Scholar]
48. Pantea D., Darmstadt H., Kaliaguine S., Sümmchen L., Roy C. Электропроводность термических саж: влияние химии поверхности. Углерод. 2001; 39: 1147–1158. doi: 10.1016/S0008-6223(00)00239-6. [Перекрестная ссылка] [Академия Google]
49. El Ouatani L., Dedryvère R., Ledeuil J.-B., Siret C., Biensan P., Desbrières J., Gonbeau D. Формирование поверхностной пленки на углеродистом электроде: влияние химии связующего. J. Источники энергии. 2009; 189:72–80. doi: 10.1016/j.jpowsour.2008.11.031. [CrossRef] [Google Scholar]
50. Филипп Б., Дедривер Р., Аллуш Дж., Линдгрен Ф., Горгой М., Ренсмо Х., Гонбо Д., Эдстрем К. Нанокремниевые электроды для литий-ионных аккумуляторов: Межфазные механизмы, изученные методами жесткой и мягкой рентгеновской фотоэлектронной спектроскопии. хим. Матер. 2012; 24:1107–1115. дои: 10.1021/см2034195. [CrossRef] [Google Scholar]
51. Асвал Д.К., Муте К.П., Тавде С., Чодхури С. , Багкар Н., Сингх А., Гупта С.К., Яхми Дж.В. XPS и АСМ исследования модификаций поверхности, вызванных отжигом. Монокристаллы MgO. Дж. Крист. Рост. 2002; 236: 661–666. doi: 10.1016/S0022-0248(02)00852-7. [CrossRef] [Google Scholar]
, Багкар Н., Сингх А., Гупта С.К., Яхми Дж.В. XPS и АСМ исследования модификаций поверхности, вызванных отжигом. Монокристаллы MgO. Дж. Крист. Рост. 2002; 236: 661–666. doi: 10.1016/S0022-0248(02)00852-7. [CrossRef] [Google Scholar]
52. Madec L., Gachot G., Coquil G., Martinez H., Monconduit L. На пути к эффективным литий-ионным элементам при высоких температурах: пример материала TiSnSb. J. Источники энергии. 2018;391: 51–58. doi: 10.1016/j.jpowsour.2018.04.068. [CrossRef] [Google Scholar]
53. Боденес Л., Дарвич А., Монкондуит Л., Мартинес Х. Межфазная фаза твердого электролита как ключевой параметр высокой производительности Sb в натрий-ионных батареях: сравнительный рентгеновский фотоэлектронный анализ Спектроскопическое исследование Sb/Na-Ion и Sb/Li-Ion аккумуляторов. J. Источники энергии. 2015; 273:14–24. doi: 10.1016/j.jpowsour.2014.09.037. [CrossRef] [Google Scholar]
54. Li W., Liu T., Zhang J., Peng N., Zheng R., Yu H., Bai Y., Cui Y., Shu J. Коммерчески доступный InSb as высокопроизводительный анод для вторичных батарей для превосходного хранения лития. Поддерживать. Энергетическое топливо. 2019;3:2668–2674. doi: 10.1039/C9SE00429G. [CrossRef] [Google Scholar]
Поддерживать. Энергетическое топливо. 2019;3:2668–2674. doi: 10.1039/C9SE00429G. [CrossRef] [Google Scholar]
55. Мохаммад И., Блондо Л., Фой Э., Лерой Дж., Лерой Э., Ходжа Х., Готье М. Наноструктурный интерметаллический InSb как высокопроизводительный и высокопроизводительный Отрицательный электрод для натрий-ионных аккумуляторов. Поддерживать. Энергетическое топливо. 2021;5:3825–3835. doi: 10.1039/D1SE00386K. [CrossRef] [Google Scholar]
56. Тетерин Ю.А., Маслаков К.И., Муравьев Е.Н., Тетерин А.Ю., Булычев Н.А., Мешков Б.Б., Степнов Д.С. Рентгенофотоэлектронное исследование смешанных оксидов индия и олова на поверхности силикатного стекла . неорг. Матер. 2020; 56: 482–493. doi: 10.1134/S0020168520050131. [CrossRef] [Google Scholar]
57. Loh J.Y.Y., Kherani N.P. Рентгенофотоспектроскопия и электронные исследования параметров реактора фотокаталитического гидрирования диоксида углерода дефектными наностержнями гидроксида оксида индия. Молекулы. 2019;24:3818. doi: 10,3390/молекулы24213818.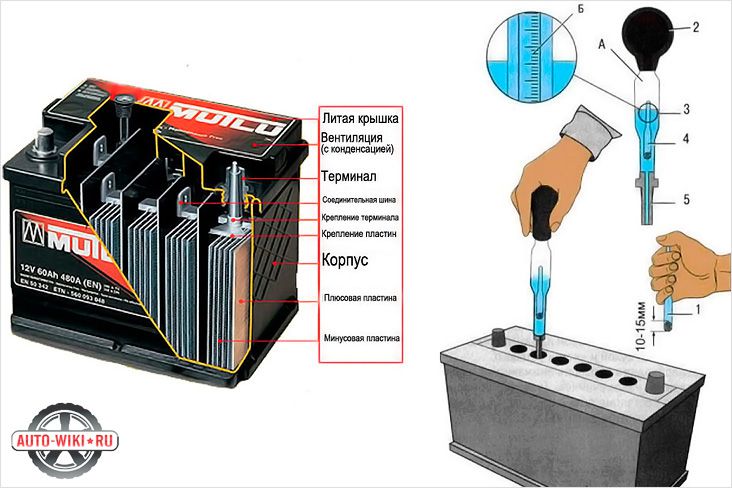 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
58. Copperthwaite R.G., Kunze O.A., Lloyd J., Neely J.A., Tuma W. Анализ поверхности InSb с помощью рентгеновской фотоэлектронной спектроскопии (XPS) Z. Нац. А. 1978;33:523–527. doi: 10.1515/зна-1978-0503. [CrossRef] [Google Scholar]
59. Саху С., Маниваннан А., Шайк Х., Мохан Рао Г. Локальная структура аморфного Ag 5 In 5 Sb 60 Te 30 и In 3 SbTe 2 Материалы с фазовым переходом, обнаруженные с помощью рентгеновских фотоэлектронных и рамановских спектроскопических исследований. Дж. Заявл. физ. 2017;122:015305. doi: 10.1063/1.4991491. [CrossRef] [Google Scholar]
60. Хиу Л.Т., Со С., Ким И.Т., Хур Дж. Высокообратимое литирование/делитирование в антимониде индия с гибридной буферной матрицей. Междунар. Дж. Энерджи Рез. 2021;45:16145–16154. doi: 10.1002/er.6848. [Перекрестная ссылка] [Академия Google]
61. Ху Ю., Чжоу Д. -Ю., Ван Б., Ван З.-К., Ляо Л.-С. Хлорированный электрод из оксида индия и олова InCl 3 Водный раствор для высокоэффективных органических светоизлучающих диодов. заявл. физ. лат. 2016;108:153303. doi: 10.1063/1.4946774. [CrossRef] [Google Scholar]
-Ю., Ван Б., Ван З.-К., Ляо Л.-С. Хлорированный электрод из оксида индия и олова InCl 3 Водный раствор для высокоэффективных органических светоизлучающих диодов. заявл. физ. лат. 2016;108:153303. doi: 10.1063/1.4946774. [CrossRef] [Google Scholar]
62. Berestok T., Guardia P., Portals J.B., Estrade S., Llorca J., Peiro J., Cabot A., Brock S.L. Химия поверхности и инженерия нано-/микроструктуры на фотокатализаторах In 2 S 3 Нанокристаллы. Ленгмюр. 2018;34:6470–6479. doi: 10.1021/acs.langmuir.8b00406. [PubMed] [CrossRef] [Google Scholar]
63. Аурбах Д., Вайсман И., Гофер Ю., Леви Э. Электрохимия неводного магния и ее применение во вторичных батареях. хим. Рек. 2003; 3: 61–73. doi: 10.1002/tcr.10051. [PubMed] [CrossRef] [Google Scholar]
64. Nguyen D.-T., Tran X.M., Kang J., Song S.-W. Хранение магния и формирование поверхностной пленки материала оловянного анода. ХимЭлектроХим. 2016;3:1813–1819. doi: 10.1002/celc.201600400. [Перекрестная ссылка] [Академия Google]
65. Wang Z., Bandyopadhyay A., Kumar H., Li M., Venkatakrishnan A., Shenoy V.B., Detsi E. Деградация анодов ионно-магниевых батарей в результате реакции гальванического замещения в полностью фенилкомплексном электролите. J. Хранение энергии. 2019;23:195–201. doi: 10.1016/j.est.2019.02.022. [CrossRef] [Google Scholar]
Wang Z., Bandyopadhyay A., Kumar H., Li M., Venkatakrishnan A., Shenoy V.B., Detsi E. Деградация анодов ионно-магниевых батарей в результате реакции гальванического замещения в полностью фенилкомплексном электролите. J. Хранение энергии. 2019;23:195–201. doi: 10.1016/j.est.2019.02.022. [CrossRef] [Google Scholar]
66. Джей Р., Томич А.В., Чжан Дж., Чжао Ю., Де Горостиза А., Лавалло В., Го Дж. Сравнительное исследование Mg(CB 11 H 12 ) 2 и Mg(TFSI) 2 на границе раздела магний/электролит. Приложение ACS Матер. Интерфейсы. 2019;11:11414–11420. doi: 10.1021/acsami.9b00037. [PubMed] [CrossRef] [Google Scholar]
Что такое электролит в батарее? (Принцип работы и типы аккумуляторов)
От высокотехнологичного электромобиля до дешевой игрушечной машинки с дистанционным управлением питание аккумуляторов стало неотъемлемой частью нашей повседневной жизни. На протяжении многих лет мир использовал дорогие источники энергии для выполнения повседневных задач.
Однако, после достаточного количества разработок, батареи оказались эффективным изобретением в качестве источника и хранения электроэнергии. Внутренний электролит в аккумуляторе является одним из основных компонентов, которые делают все волшебство.
В сегодняшнем посте мы обсудим, что такое электролит в аккумуляторе и как его сделать в домашних условиях.
Содержание
- Что такое электролит в батарее?
- Как электролиты работают в батарее?
- Из чего состоит электролит батареи?
- Распространенные типы батарей с их электролитами
- Как приготовить раствор электролита для батареи?
- Резюме
Что такое электролит в батарее?
Электролит в батарее представляет собой вещество, которое дает ионы (электрически заряженные атомы, которые приобрели или потеряли электроны) при растворении в воде или других жидкостях. Благодаря движению положительных и отрицательных ионов раствор проводит электрический ток, который течет между двумя электродами — анодом и катодом.
Электролит батареи может быть жидким или твердым, в зависимости от типа батареи. Однако потенциальными электролитами могут быть любые среды, содержащие ионы.
Электролиты можно разделить на сильные и слабые химические соединения. Сильные электролиты — это те, которые почти или полностью ионизируются в растворе, а слабые — частично.
Как электролиты работают в аккумуляторе?
Чтобы понять, как работает электролит батареи, нам сначала нужно изучить основные компоненты батареи — анод, катод и электролит (который разделяет две клеммы). Поскольку мы уже обсуждали электролит выше, давайте рассмотрим анод и катод.
Анод – это отрицательная клемма или восстановительный электрод, который окисляет и высвобождает электроны во внешнюю цепь во время электрохимической реакции.
С другой стороны, катод – это положительный вывод или окислительный электрод. Он восстанавливается в ходе электрохимической реакции, приобретая электроны, выделяемые анодом во внешнюю цепь.
Электролит обеспечивает среду для перемещения электрического заряда в виде ионов между двумя клеммами. Катионы с положительным зарядом движутся к катоду, а анионы с отрицательным зарядом — к аноду. Кроме того, электролит приводит подходящее химическое вещество, необходимое для реакции, в контакт с клеммами, что преобразует накопленную энергию в пригодную для использования электрическую энергию.
Полезная электрическая энергия встречается с подключенным устройством, будь то лампочка или пылесос, и питает его.
Из чего состоит электролит батареи?
Электролит батареи состоит из растворимых солей, кислот или оснований. Однако точный характер электролита зависит от типа батареи и требуемой величины тока.
Например, в обычных щелочных бытовых батареях используется гидроксид калия, который является сильным электролитом и поэтому обладает высокой электропроводностью. С другой стороны, свинцово-кислотный аккумулятор в автомобилях использует серную кислоту в качестве электролита и вызывает требуемую реакцию.
Давайте рассмотрим некоторые типы аккумуляторов с подходящими для них электролитами.
Распространенные типы аккумуляторов с их электролитами
1. Свинцово-кислотные
Свинцово-кислотные аккумуляторы — это перезаряжаемые аккумуляторы, в которых для химических реакций используется кислый электролит (серная кислота) и металлический свинец (Pb). Серная кислота — очень коррозионное вещество, растворимое в воде. Он бесцветный, с легким желто-зеленым оттенком. Однако он обесцвечивается до коричневатого оттенка из-за ржавчины в результате анодной коррозии, возникающей при растворении анода в электролите.
Для контролируемой химической реакции металлический свинец погружается в серную кислоту, в результате чего батарея вырабатывает электричество. Этот химический процесс извлечения тока из свинцово-кислотного аккумулятора известен как разрядка.
Кроме того, когда аккумулятору необходимо перезарядиться, реагенты (ранее использовавшиеся для выработки электроэнергии) можно регенерировать, пропуская ток через аккумулятор извне. Этот процесс известен как перезарядка.
Этот процесс известен как перезарядка.
Свинцово-кислотная батарея имеет большой вес, но вырабатывает высокое напряжение. Он оснащен ячейками 2 В, что означает, что он имеет четное количество вольт. Наиболее распространенные свинцово-кислотные батареи имеют напряжение 2 В, 6 В, 12 В и 24 В.
Поэтому он обычно используется в машинах, ИБП (источниках бесперебойного питания) и системах, которые требуют высокой мощности для работы и не имеют значения веса батареи.
2. Никель-кадмиевые (NiCd)
Электролит, используемый в никель-кадмиевых (NiCd) батареях, представляет собой тридцатипроцентный раствор гидроксида калия (КОН) в дистиллированной воде. При комнатной температуре его удельный вес остается между 1,240 и 1,300.
По сравнению со свинцово-кислотными батареями никель-кадмиевые батареи дороже, но имеют более высокую плотность энергии, что означает, что они могут хранить больше энергии на единицу веса. Он также служит дольше, чем свинцово-кислотные аккумуляторы, поскольку у него больше жизненных циклов, около 2000-2500.
3. Никель-металл-гидридный (NiMH)
Никель-металл-гидридный (NiMH) аккумулятор использует тот же электролит, что и NiCd, а именно гидроксид калия. Гидроксид калия, также известный как едкий калий, представляет собой неорганическое соединение и сильное основание, широко используемое в большинстве мягких и жидких мыл. Электролит бесцветен и имеет множество промышленных применений.
Батарея содержит электроды, изготовленные из уникальных металлов, таких как никель, кобальт, марганец и алюминий, которые также присутствуют в литий-ионных батареях. Однако батарея NiMH более хрупкая, чем литий-ионная и никель-кадмиевая.
4. Литий-ионные (Li-ion)
В литий-ионных (Li-ion) батареях используются электролиты, состоящие из солей лития, таких как гексафторфосфат лития (LiPF6) в органическом растворителе. Литий-ионные аккумуляторы работают как с гелевым или сухим полимером, так и с жидким электролитом.
Элементы литий-ионных аккумуляторов легкие и обладают высокой плотностью энергии, что дает им преимущество перед любыми аккумуляторными элементами. Они способны генерировать мощность 3,6 В, что делает их полезными в широком диапазоне приложений, таких как транспортные средства, силовое оборудование и портативные устройства, такие как ноутбуки и сотовые телефоны.
Они способны генерировать мощность 3,6 В, что делает их полезными в широком диапазоне приложений, таких как транспортные средства, силовое оборудование и портативные устройства, такие как ноутбуки и сотовые телефоны.
Как сделать раствор электролита для аккумулятора?
Когда в вашей жидкостной батарее заканчивается топливо (электролит), вы можете сделать его дома, а не покупать.
Хотя для приготовления раствора электролита требуются некоторые школьные знания химии, вы все равно можете сделать его, следуя этому руководству. Однако действовать нужно осторожно, так как процесс приготовления электролита опасен.
Прежде чем начать, решите, какой химический раствор вы хотите использовать для приготовления электролита. Обычно для аккумуляторов больше всего подходят сильные кислоты, растворенные в чистой смеси воды. Вода помогает стабилизировать активность ионов водорода. Вы можете использовать серную кислоту, если у вас есть свинцовые электроды, и азотную кислоту для никелевых электродов.
Примечание. Без состава чистой воды небольшой ток может взорвать аккумулятор.
Инструменты, которые вам понадобятся
Помимо перечисленных выше химикатов, для эффективного выполнения процесса вам потребуется следующее оборудование.
- Не менее трех толстых изолирующих контейнеров
- Кислотостойкие перчатки
- Очки
- Захват
- Мультиметр
- Ареометр
- Чертежные трубы (желательно прозрачные)
- Аптечка с пищевой содой для лечения кислотных ожогов
Шаги
Все собралось? Если да, то следуйте следующим шагам!
- Возьмите изолированный контейнер и наполните его водой. Обязательно измерьте объем, прежде чем наливать его. Вы также можете оставить немного воды в другом контейнере, если вам нужно разбавить раствор. В любом случае используйте чистую воду, чтобы исключить риск загрязнения, которое может вызвать нежелательные химические реакции.
- Затем осторожно возьмите контейнер с кислотой с помощью захвата и вылейте его в воду. Если на поверхности появляются чрезмерные пузырьки, приостановите процесс на несколько секунд и дайте им рассеяться. Вы можете вылить остальную кислоту, как только исчезнут пузырьки.
- В этот момент раствор электролита должен иметь высокую температуру. Таким образом, вы можете накрыть его, чтобы позволить любым загрязнениям иметь место. Однако убедитесь, что горячий воздух выходит.
- Когда раствор в контейнере остынет, используйте ареометр, чтобы проверить его крепость, и добавьте жидкости по мере необходимости.
- Как только вы наберете необходимую силу, осторожно залейте кислотный раствор в отсеки для батареек. Для этого вы можете использовать волочильные трубы, один конец которых находится на дне контейнера, а другой — в батарейном отсеке.
- Надев кислотостойкие перчатки, наклоните контейнер под постепенно увеличивающимся углом, чтобы кислотный раствор попал в гнездо для батареи.
 Заполните каждый аккумуляторный отсек примерно на три четверти.
Заполните каждый аккумуляторный отсек примерно на три четверти. - Когда слоты заполнены, снимите трубу и закройте слоты. Вот и все! Ваша батарея готова генерировать энергию.
Наконец, используйте мультиметр, чтобы проверить, какое напряжение выдает ваша батарея на клеммах. Будем надеяться, что батарея в порядке!
Резюме
Электролит в батарее представляет собой раствор, который позволяет заряженным ионам и току проходить через катодные и анодные клеммы. Электролит имеет определенные химические характеристики, которые реагируют с электродами, и реакция преобразует накопленную энергию в пригодную для использования электрическую энергию.
Электролиты обычно состоят из растворов сильных кислот, таких как серная и азотная кислота, но обычно электролит может состоять из растворимых солей, кислот и оснований.

