Приготовление электролита | Аккумуляторные батареи
Страница 14 из 26
4.3. Приготовление электролита для свинцовых аккумуляторов
Электролит для свинцовых аккумуляторов приготовляется путем разбавления чистой серной кислоты чистой водой. Кислота продается обычно концентрированной, удельного веса от 1,835 до 1,840. При разбавлении концентрированной кислоты раствор сильно нагревается. Во избежание опасности для лица, производящего смешивание, всегда необходимо наливать кислоту в воду, но не наоборот.
Хотя количество теплоты, развиваемой в обоих случаях, одно и то же, однако удельные теплоты воды и концентрированной кислоты совершенно различны. Струя воды, попадая в концентрированную кислоту, освобождает большое количество теплоты, которая благодаря низкой удельной теплоте кислоты вызывает сильное местное повышение температуры. Кислота, приливаемая к воде, не может вызвать столь же большого повышения температуры в силу того, что удельная теплота воды очень высока.
Для смешивания и хранения небольших количеств электролита наиболее подходят сосуды фарфоровые, гончарные или стеклянные; но так как они легко дают трещины, то им следует предпочесть чаны, выложенные свинцом, особенно для более значительных количеств.
Никакие другие металлические сосуды, кроме свинцовых, непригодны.
После разбавления кислоты, до заливки ее в батарею, необходимо подождать, пока она остынет, для того чтобы избежать повреждений пластин и сепараторов.
Охлаждение можно ускорить, пользуясь струей сжатого воздуха, но воздух при этом должен быть чистым.
Избежать сильного повышения температуры при смешивании кислоты с водой можно, применяя вместо воды лед, приготовленный из дистиллированной воды. Понижение температуры происходит вследствие того, что скрытая теплота плавления льда приблизительно равна количеству теплоты, освобождающемуся при растворении серной кислоты.
 Лед, свободный от воды, можно прибавлять к кислоте непосредственно. Избыток поглощенной теплоты показывает, что раствор должен получить температуру ниже нуля, что и наблюдалось в действительности.
Лед, свободный от воды, можно прибавлять к кислоте непосредственно. Избыток поглощенной теплоты показывает, что раствор должен получить температуру ниже нуля, что и наблюдалось в действительности. Чтобы облегчить приготовление электролитов любой требуемой концентрации, на рис. 4.1 приведены необходимые пропорции кислоты и воды. Аккумуляторные заводы обычно сообщают сведения о том, какой крепости кислоту следует применять для каждой данной батареи.
Рис. 4.1. Приготовление электролита любого удельного веса из концентрированной кислоты удельного веса 1,835.
1- содержание серной кислоты, %; 2 – требующаяся добавка воды по объему; 3 – то же по весу.
4.4. Приготовление электролита для кадмиевоникелевых и железоникелевых аккумуляторов
В зависимости от температуры окружающего воздуха в аккумуляторах (табл.
 4.1) применяется раствор соответствующей плотности (концентрации) основного компонента электролита в чистом виде или с добавкой едкого лития (LiOH).
4.1) применяется раствор соответствующей плотности (концентрации) основного компонента электролита в чистом виде или с добавкой едкого лития (LiOH). Кадмиевоникелевые аккумуляторы рассчитаны на работу на холоде при температуре до – 40°С, причем при температурах +35…– 19°С с составным электролитом, а при более низких температурах, например, – 20…– 40°С с электролитом без добавки едкого лития.
При температурах – 20…– 40°С при отсутствии чистого едкого калия допускается как исключение применять составной электролит из едкого калия и едкого лития повышенной плотности, при этом емкость аккумулятора снижается на 10 – 15%. При отсутствии составного электролита из едкого калия и едкого лития при температуре – 19…+35°С можно воспользоваться составным электролитом из едкого натрия повышенной плотности 1,17 – 1,19 г/см 3 с добавкой на 1 л раствора 20 г едкого лития, но при этом следует учесть, не гарантируется.
Таблица 4.1.
Рекомендуемые состав и плотность электролита для кадмиевоникелевых и железоникелевых аккумуляторов при различной температуре окружающего воздуха
Температура воздуха, °С | Рекомендуемый состав электролита | Плотность, г/см3 |
– 19. | Составной раствор едкого калия с добавкой на 1 л раствора 20 г едкого лития аккумуляторного (моногидрата лития) | 1,19 – 1,21 |
– 20… – 40 | Раствор едкого калия | 1,25 – 1,27 |
+10…+50 | Раствор едкого натрия с добавкой на 1 л раствора 15 – 20 г едкого лития (моногидрата лития) | 1,1 – 1,12 |
Не гарантируется также долговечность аккумуляторов при работе их с электролитом из раствора чистого едкого калия плотностью 1,19 – 1,21 г/см3, т. е. без добавки едкого лития при температуре –19… + 10°С. При работе при температуре + 10…+50°С с рекомендуемым составным электролитом плотностью 1,1–1,12 г/см3 (табл. 5.1) емкость аккумуляторов также снижается по сравнению с номинальной, а долговечность не гарантируется.
Железоникелевые аккумуляторы рассчитаны на работу в тех же условиях и с тем же электролитом, что и кадмиевоникелевые, но они более чувствительны к низким температурам, поэтому могут применяться при температурах не ниже –20° С.
Кроме того, необходимо систематически контролировать количество электролита, т. е. следить за уровнем последнего и поддерживать его в установленных пределах.
В аккумуляторах, находящихся в эксплуатации, уровень электролита постепенно снижается вследствие испарения, поэтому его необходимо периодически измерять и при необходимости дополнять до нормы дистиллированной водой. Не реже чем через 10 циклов нужно проверять плотность электролита и также доводить ее до нормы добавлением раствора плотностью 1,41 г/см

Уровень электролита в аккумуляторах должен постоянно находиться выше края пластин не менее чем на 5 мм и не более чем на 12 мм.
Снижение уровня электролита ниже верхнего края пластин или сетки, а также повышение плотности электролита при положительных температурах окружающего воздуха снижают емкость и долговечность последних. Уровень электролита необходимо проверять и доводить до указанной нормы перед каждым зарядом. Он проверяется с помощью стеклянной трубки диаметром 5 – 6 мм с метками на высоте 5 и 12 мм от конца. Для установления уровня электролита в аккумуляторе надо конец трубки с метками ввести через заливное отверстие до упора в пластины или сетку, после чего другой конец трубки закрыть пальцем. Вынув трубку из аккумулятора по высоте столбика электролита в ней, определим уровень электролита над верхним краем пластин или сетки в аккумуляторе. Для снижения уровня электролита в аккумуляторе можно пользоваться пипеткой или резиновой грушей со стеклянным или пластмассовым наконечником длиной около 100 мм.
 Доливку электролита или дистиллированной воды в аккумуляторы можно производить с помощью пипетки, резиновой груши или кружки через стеклянную воронку, размеры которых подбирают в зависимости от вместимости аккумуляторов. Проверка плотности электролита производится при помощи сифонного ареометра.
Доливку электролита или дистиллированной воды в аккумуляторы можно производить с помощью пипетки, резиновой груши или кружки через стеклянную воронку, размеры которых подбирают в зависимости от вместимости аккумуляторов. Проверка плотности электролита производится при помощи сифонного ареометра. Проверку плотности электролита необходимо производить по возможности перед каждым зарядом, в каждом аккумуляторе, хотя и допускается выборочный контроль в 2 – 3 аккумуляторах батареи. В крайнем случае проверка должна проводиться не реже чем через 10 циклов во всех аккумуляторах батареи.
Таким образом, электролит необходим не только для первой заливки аккумуляторов при формировке, но и для замены, поддержания плотности и уровня электролита в действующих аккумуляторах, поэтому его требуется приготовлять и всегда иметь запас.
а) едкий калий аккумуляторный марки А (твердый) или марки В (жидкий) и едкий литий аккумуляторный;
б) составная щелочь сорта А – готовая смесь едкого калия и едкого лития в отношении едкий литий/едкий калий = 0,04.
 ..0,045;
..0,045; в) едкий натрий аккумуляторный (сода каустическая) сорта А и едкий литий аккумуляторный;
г) составная щелочь сорта Б – готовая смесь едкого натрия и едкого лития в соотношении едкий литий/едкий натрий = 0,028…0,032.
Перед приготовлением электролита необходимо удостовериться, что имеющиеся в наличии химические ‘компоненты соответствуют приведенным выше требованиям и ГОСТам. Хранить эти материалы необходимо в герметически закрытой таре. Данные материалы могут поставляться как в жидком, так и в твердом состоянии в виде гранул, чешуек, кусков или слитка.
Приготовление электролита следует начинать с определения потребности в нем согласно норме расхода на один аккумулятор при первой заливке, указанной в табл. 4.2.
Определив требуемое количество электролита, приготовим примерно 3/4 этого объема свежей дистиллированной воды. При отсутствии последней допускается применение дождевой воды, собранной с чистой поверхности, или воды, полученной при таянии снега, а также конденсата.

Таблица 4.2
Ориентировочная норма расхода электролита на один аккумулятор при первой заливке
Тип | Норма расхода электролита при первой заливке, л | Тип | Норма расхода электролита при первой заливке, л |
АКН-2,25 | 0,04 | КН-60 | 0,75 |
Примечание. При приготовлении электролита желательно норму увеличить на 10 – 15 % для создания резерва на отход и другие непредвиденные случаи.
При приготовлении электролита желательно норму увеличить на 10 – 15 % для создания резерва на отход и другие непредвиденные случаи.
В крайнем случае можно использовать любую сырую чистую питьевую воду (кроме минеральной).
Затем, пользуясь данными табл. 5.3, определяем необходимое количество химических компонентов: едкого калия или едкого натрия, а также едкого лития для добавки. Расход дистиллированной воды на 1 кг твердой и на 1 л жидкой щелочи для приготовления электролита необходимой плотности приведен в табл. 4.3.
Таблица 4.3
Расход дистиллированной воды, необходимой для приготовления электролита для кадмиевоникелевых и железоникелевых аккумуляторов
Щелочь | Плотность, г/смз3 | Количество воды, л | |
на 1 кг твердой щелочи | на 1 кг жидкой щелочи плотностью 1,41 г/см3 | ||
Калиевая или готовая составная, т. Калиево-литиевая Натриевая или готовая составная натриево-литиевая |
1,19 – 1,21 1,25 – 1,27
1,17– 1,19 |
3 2
5 |
1 0,55
1,5 |
Для определения массы твердых щелочей, необходимой по норме, приведенной в табл. 19, достаточно разделить:
на три требуемое количество воды, если необходимо приготовить калиевый или составной калиево-литиевый раствор плотностью 1,19 – 1,21 г/см3;
на два, если необходимо приготовить калиевый электролит для работы при температуре
– 20. ..– 40° С или составной калиево-литиевый плотностью 1,25 –1,27 г/см3;
..– 40° С или составной калиево-литиевый плотностью 1,25 –1,27 г/см3;
на пять, если необходимо приготовить натриевый или составной натриево-литиевый электролит плотностью 1,17 – 1,19 г/см3.
Если составная калиево-литиевая или натриево-литиевая щелочь отсутствуют, а имеется едкий калий, едкий натрий и едкий литий, то расчет потребности в твердых щелочах производится по тому же принципу, как указано выше. Следует иметь в виду, что в частном, полученном в результате деления, учитывается и масса едкого лития.
Щелочной электролит для аккумулятора
Щелочной электролит имеет большое количество преимуществ перед другими видами токопроводящих веществ, поэтому широко используется в современных перезаряжаемых источниках питания. Об основных характеристиках, а также о свойствах и химическом составе этого вещества будет подробно рассказано далее.
Что такое щелочной электролит
Щелочной электролит представляет собой химическое соединение, принимающее активное участие при накоплении аккумулятором электроэнергии. Благодаря определённым свойствам такое вещество может многократно участвовать в восстановительно-окислительных реакциях без потери качества.
Благодаря определённым свойствам такое вещество может многократно участвовать в восстановительно-окислительных реакциях без потери качества.
В щелочных аккумуляторах используются различные химические составы, поэтому аккумуляторы этого типа могут существенно отличаться по многим показателям.
Свойства и химический состав
Наиболее часто в аккумуляторах применяются щелочные электролиты следующих составов:
- Калиево литиевый.
- Натриевый.
- Никель-кадмиевые.
- Никель-металлогидридные.
Натриевые электролиты обладают большим сроком эксплуатации, но совершенно непригодны для использования при отрицательной температуре воздуха.
Калиево-литиевые в этом отношении значительно превосходят натриево-литиевые составы по морозостойкости, но для работы в тропических условиях не подходят из-за ограничения максимальной эксплуатационной температуры на отметке 35˚С.
применяются в современной электронике, но наличие эффекта памяти налагает на использование таких изделий определённые ограничения.
лишены этого недостатка, но их стоимость довольно велика, что является серьёзным препятствием на пути широкого применения элементов этого типа в качестве портативных источников электроэнергии.
Области применения
Они могут использоваться для заправки аккумуляторных батарей различной ёмкости и вольтажа. Такие изделия широко используются в следующих областях:
- Системы сигнализации.
- В качестве стартерных батарей для военной техники.
- Резервные источники питания для пассажирских вагонов, троллейбусов и трамваев.
- В качестве тяговых устройств для мощных электроустановок.
Компактные батареи с щелочным электролитом могут применяться также в электроинструменте, различных гаджетах и детских игрушках.
Кроме применения в аккумуляторных батареях щелочной электролит может быть использован для меднения стали. Такой метод является одним из самых эффективных для покрытия медью других металлов.
Аналогичные щелочные смеси можно сделать для цинкования. Наиболее часто таким образом покрываются цинком изделия, имеющие сложные геометрические формы.
Наиболее часто таким образом покрываются цинком изделия, имеющие сложные геометрические формы.
Как заправлять аккумуляторы
Если восстановить работоспособность аккумулятора с помощью зарядки не удаётся, то возможно потребуется замена щелочного электролита. От правильного выполнения такой работы будет зависеть продолжительность эксплуатации АКБ. Рекомендуется осуществлять замену жидкости в такой последовательности:
- Отсоединить аккумулятор от потребителей электроэнергии.
- Надеть защитные очки и перчатки. Не лишним будет защитить одежду от едкого вещества с помощью прорезиненного фартука.
- Удалить пробки и вылить старую жидкость из банок.
- Произвести подготовку нового электролита.
- Залить до рекомендуемого заводом-изготовителем аккумулятора уровня.
- Установить на место пробки.
- Подключить аккумулятор к зарядному устройству.
Если причина неработоспособности аккумулятора заключалась в некачественном электролите, то после замены химического состава и полной зарядки, АКБ можно будет использовать в стандартном режиме.
Меры предосторожности
Как уже было сказано выше использование перчаток и очков является обязательным условием при выполнении работ с щелочными растворами. Игнорирование этого правила может привести к очень серьёзным последствиям. Например, можно получить серьёзные ожоги слизистой оболочки глаз или повредить кожные покровы верхних конечностей.
Если в результате выполнения работ попадания едкого вещества на кожу не удалось избежать, то поражённые участки следует немедленно промыть большим количеством воды, с добавлением уксуса или лимонной кислоты. Про попадании электролита в глаза также необходимо промыть поражённый орган зрения и немедленно обратиться за медицинской помощью.
При работе с элетролитом и зарядке батареи не рекомендуется курить или разводить открытый огонь в помещении. Несоблюдение этого требования может закончиться взрывом горючего газа, который может образоваться в процессе протекания химических реакций.
Как приготовить щелочной электролит
Его можно приобрести в специализированных магазинах, но если такой возможности нет, то жидкую смесь для заливки в аккумулятор можно приготовить своими руками. Для
Для
выполнения этой работы следует подготовить твёрдую щёлочь, дистиллированную воду и неметаллическую посуду. Приготавливается натриево или калиево-литиевый электролит в такой последовательности:
- Налить в посуду необходимое количество воды.
- В воду аккуратно всыпать заранее приготовленную порцию щёлочи.
- Медленно перемешать стеклянной или пластмассовой лопаткой смесь.
- Произвести замер плотности электролита. Если этот параметр находится на слишком низком уровне, то следует добавить сухое вещество, если слишком высокий, то добавить воды (оптимальное значение 1,2 г/мм3).
- Накрыть посуду крышкой и дать отстояться раствору в течение 3 часов.
- Аккуратно слить разбавленную щелочь таким образом, чтобы осадок остался на дне ёмкости.
Приготовленный раствор следует хранить в стеклянной таре с плотно закупоренными горлышками. В качестве крышек рекомендуется использовать резиновые заглушки либо любой материал, не реагирующий на щёлочь.
При приготовлении электролита также следует соблюдать осторожность и использовать защитные очки и перчатки.
Остались вопросы или есть что добавить? Тогда напишите нам об этом в комментариях, это позволит сделает материал более полным и точным.
Электролит щелочные — Справочник химика 21
Щелочные аккумуляторы значительно легче свинцовых, но дают более низкие напряжения. Рабочее напряжение железо-никелевого аккумулятора составляет приблизительно 1,3—1,2 В для кадмиевого аккумулятора оно несколько меньше. Для щелочного аккумулятора выходы по току меньше, чем для свинцового, а вследствие значительно большей разности между зарядным и разрядным напряжениями выход по энергии составляет только 55—66%. Но зато щелочные аккумуляторы меньше боятся механической тряски, имеют большой срок службы, могут систематически работать с перегрузкой и не выходят из строя при хранении в разряженном состоянии. Электролит щелочного аккумулятора поглощает СО 2 из атмосферы, в результате чего уменьшается его проводимость, поэтому электролит приходится время от времени обновлять. [c.18]
[c.18] Электролит щелочных аккумуляторов [c.321]
Пластины и электролит щелочных аккумуляторов помещ т в закрытый сосуд из стали. Преимущество этих аккумуляторов перед кислотными в простоте обслуживания и высокой механической прочности. Кроме того, они не требуют постоянного контроля за концентрацией электролита. Рабочее напряжение заряженных аккумуляторов 1,30 — 1,34 В (для никель-кадмиевых) и 1,37 — 1,41 В (для железо-никелевых). [c.58]
В табл. 29 приведен состав унифицированных щелочных электролитов. В их обозначении первые две буквы (ЭЩ) обозначают — электролит щелочной. Буква, стоящая после цифры, является порядковым номером разработок. [c.117]
Введение гидроокиси лития в электролит щелочного аккумулятора увеличивает емкость и срок службы аккумулятора при обычных температурах и удлиняет рабочий интервал в сторону высоких температур. Это полезное действие, однако, наблюдается лишь при умеренных концентрациях едкого лития в электролите, превышение которых, наоборот, приводит к ухудшению свойств аккумулятора. Установлено, что при большой концентрации едкого лития в электролите он может образовать с. массой положительного электрода электрохимически инертное соединение Ь ЫЮ2, от чего емкость электрода падает. [c.138]
Это полезное действие, однако, наблюдается лишь при умеренных концентрациях едкого лития в электролите, превышение которых, наоборот, приводит к ухудшению свойств аккумулятора. Установлено, что при большой концентрации едкого лития в электролите он может образовать с. массой положительного электрода электрохимически инертное соединение Ь ЫЮ2, от чего емкость электрода падает. [c.138]
Электролит ЭЩ-6 содержит 480 г/л едкого калия, 52 г/л окиси цинка и 0,45 г/л двуокиси кремния. Электролит ЭЩ-7 готовится растворением в дистиллированной воде 600 г/л едкого калия, 62 г/л окиси цинка и 0,45 г/л двуокиси кремния. Электролит ЭЩ-28 по своему составу аналогичен ЭЩ-7, но не содержит двуокиси кремния. В наименовании электролита первые две буквы обозначают электролит щелочной , последующая цифра— условный порядковый номер. Электролит ЭЩ-7 предназначается для элементов летнего типа, работающих при температурах 0 +50° С. Электролит ЭЩ-6 применяется для элементов универсального типа, работающих при температурах —30-ь — -Ь50°С. [c.292]
[c.292]
Соотношение между напряжением и концентрацией электролита. Электролит щелочного аккумулятора, рассматриваемый в целом, не претерпевает изменений при работе аккумулятора. Поэтому есть основания ожидать, что э. д. с. железо-никелевого аккумулятора не зависит от коицентрации электролита. Это очень близко к истине. Однако опытами Ферстера установлено, что реакции в железо-никелевом аккумуляторе не полностью независимы от концентрации электролита. Он нашел, что при изменении концентрации электролита в пределах более широких, чем принято в практике, напряжение аккумулятора изменялось на несколько милливольт. Этими незначительными изменениями напряжения в зависимости от концентрации электролита можно пренебречь. [c.223]
В качестве католита применяется водно-спиртовой раствор нитробензола, так как в чистой воде нитробензол почти нерастворим. Прибавка уксуснокислого натрия создает в электролите щелочную среду (раствор уксуснокислого натрия обладает щелочной реакцией).
 Это способствует процессу, так как реакция (2) в щелочной среде идет значительно быстрее. [c.120]
Это способствует процессу, так как реакция (2) в щелочной среде идет значительно быстрее. [c.120]Такой способ регулирования кислотности неоднократно предлагался и проверялся в опытных и производственных условиях. При питании электролизеров кислым рассолом наблюдалось усиленное разрушение асбестовых волокон диафраг.мы кислым анолитом, выщелачивание магния из асбеста и осаждение Мд(0Н)2 в толще диафрагмы, где электролит щелочной. Насколько нам известно, проводившиеся в этом направлении опыты пока не позволили увеличить выход по току и снизить удельный расход графита. [c.110]
На катоде металл выделяется в виде крупных блестя шдх кристаллов. Чистота металла — 99,8—99,99%. Раз мер кристаллов может быть уменьшен путем введения в электролит боратов, фосфатов, карбонатов или силикатов, однако в этом случае вольфрам получается более грязным. К загрязнению катодного осадка приводит также присутствие в электролите щелочных металлов. [c.138]
Электролитическими методами получают многие металлы и некоторые неметаллы. Кислород и водород получают электролизом воды, содержащей электролит. Щелочные металлы, щелочноземельные металлы, магний, алюминий и многие другие металлы производят для нужд промышленности или для специальных целей электрохимическим восстановлением их соединений. [c.325]
Кислород и водород получают электролизом воды, содержащей электролит. Щелочные металлы, щелочноземельные металлы, магний, алюминий и многие другие металлы производят для нужд промышленности или для специальных целей электрохимическим восстановлением их соединений. [c.325]
Совмещение операции обработки электродов щелочью с их катодной нагрузкой уменьшает потери гидроокиси, которая при простом воздействии щелочи образует значительные наросты на поверхности пластины, теряющиеся на последующих операциях. Под катодной нагрузкой происходит, кроме того, повышение концентрации щелочи в околоэлектродном слое, что ускоряет взаимодействие соли со щелочью во внутренних зонах электрода. Создание электрического поля при электролизе способствует миграции, ионов NO из электрода аноду, ускоряя тем самым их удаление из активного вещества. Ионы iNO являются одной из наиболее вредных примесей в электролите щелочных аккумуляторов подобно ионам железа в свинцовых аккумуляторах. [c. 157]
157]
ЭЛЕКТРОЛИТ, кислотный ЭЛЕКТРОЛИТ, щелочной ЭМФ [c.188]
Образуемые на поверхности катода жидкие спла
Щелочные батарейки: характеристики, применение
Для многих приборов лучше всего подходят щелочные батарейки или марганцево цинковые гальванические элементы. Они же алкалиновые или alkaline battery. Найти их можно в любой торговой точке за небольшую стоимость. Что же это такое? Что они представляют из себя? По сути это мощнейшие элементы питания, внутри которых бурно протекает химическая реакция, в результате которой образуется ток.
Основным элементом служит диоксид марганца, он является катодом. Анодом у них является цинк в виде порошка. Электролитом служит гидроксид калия, то есть это и есть щелочь за счет которой он получил свое название. Чаще всего такие батареи используют для питания игрушек, фонарей, радиоприемников и других подобных устройств.
Использовать щелочь в качестве электролита впервые независимо друг от друга предложили два ученых это Эдисон и Вальдемар Джангнер. Тогда она применялась ими в никель кадмиевых аккумуляторах. В обычных батарейках это вещество стал впервые использовать инженер Льюис Урри. Когда настал 1950 год он выпустил элементы питания с названием Eveready. В 1960 году он и его партнеры обзавелись патентом на щелочные батарейки.
Тогда она применялась ими в никель кадмиевых аккумуляторах. В обычных батарейках это вещество стал впервые использовать инженер Льюис Урри. Когда настал 1950 год он выпустил элементы питания с названием Eveready. В 1960 году он и его партнеры обзавелись патентом на щелочные батарейки.
Характеристики
Щелочные батарейки производятся разных типоразмеров в основном это АААА, ААА, АА, D, С, Крона – 6F22 и плоский монеточный вид.
Таблеточные щелочные батарейки
Они представляют собой маленький плоский диск диаметром от 4.8 до 30 мм. Напряжение равно 1.5 – 3 вольта. Их корпус полностью выполнен из металла. В связи с этим алкидные батарейки можно применять в плохих погодных условиях. Анод от катода отделен изолятором. Это предотвращает короткое замыкание и их порчу. За счет своей миниатюрности и компактности они и получили большое распространение. Без проблем вставляются в часы, калькуляторы, брелки и другие мини устройства.
Пальчиковые источники тока или АА
Являются наиболее популярными.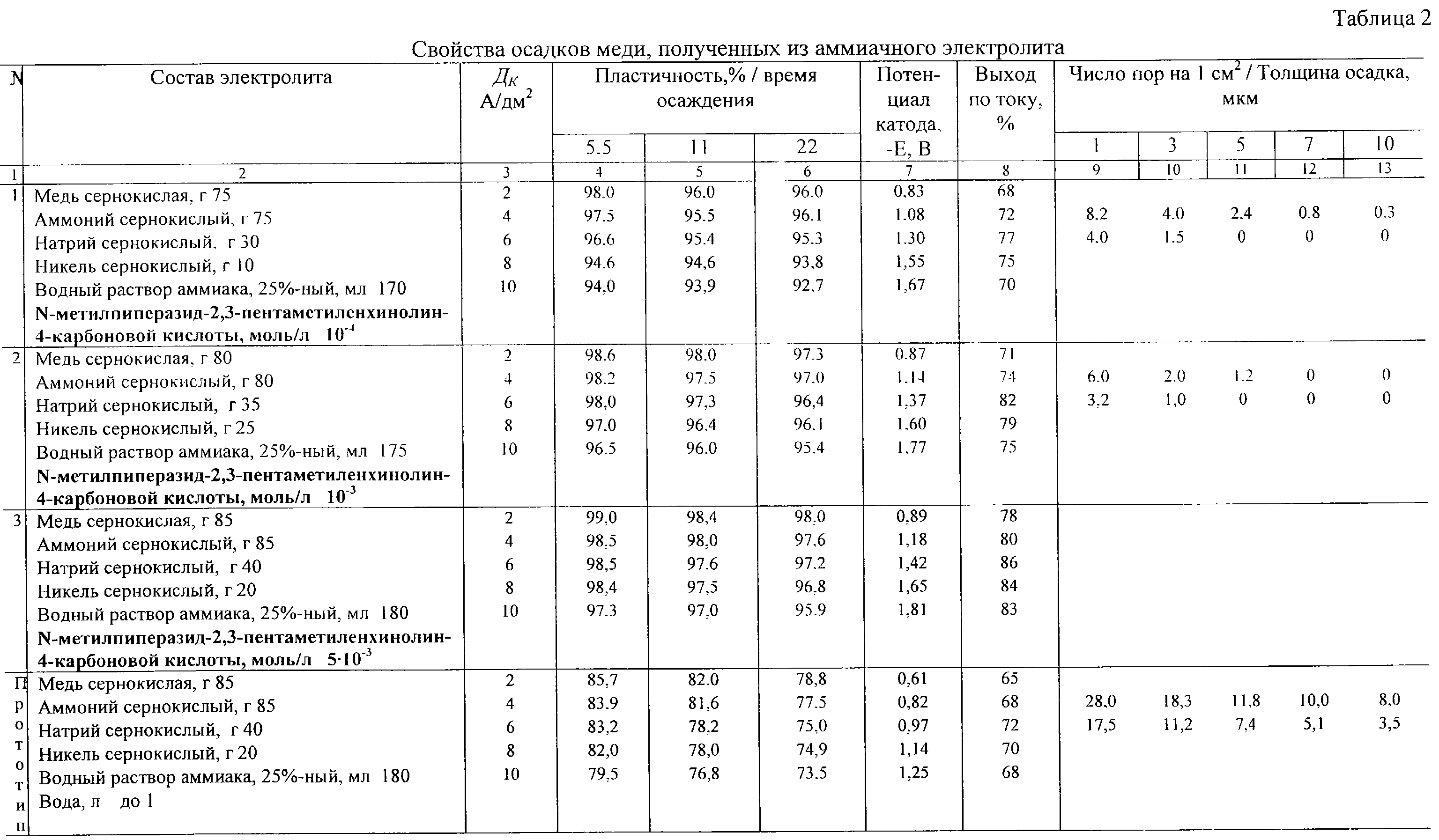 Используются там, где нужен большой разрядный ток. Их напряжение равно 1.5 вольт. Нашили свое применение в часах, игрушках, радио приемниках, фонариках, медицинском оборудовании, весах, компьютерных мышках и других электронных устройствах.
Используются там, где нужен большой разрядный ток. Их напряжение равно 1.5 вольт. Нашили свое применение в часах, игрушках, радио приемниках, фонариках, медицинском оборудовании, весах, компьютерных мышках и других электронных устройствах.
Все подробности изложены в статье пальчиковые батарейки!
Щелочные батарейки бочонки
К ним можно отнести два типа это D и C.
Позволяют обеспечить прибор электричеством без подключения его к сети на 220 вольт. Используются в магнитофонах, радиоприемниках, фонарях, игрушках. Имеют повышенную емкость. В приборе, который потребляет мало энергии проработают долго.
Если видите на корпусе надпись LR, то это 100% щелочные батарейки.
Мизинчиковые источники тока
Имеют типоразмер ААА. Производители изготавливают их в виде цилиндра диаметром 10.5 мм. В длину обычно такие типы бывают до 44,5 мм. Их масса составляет около 14 грамм. Данные могут отличаться в зависимости от компании. В устройство щелочных батареек иногда могут добавлять дополнительные элементы для защиты.
В устройство щелочных батареек иногда могут добавлять дополнительные элементы для защиты.
Используются в разных электронных приборах, например, таких как пульты для телевизора, будильники, фонарики, приемники, плееры и т.д. Узнать, что это именно щелочной элемент можно по надписи alkaline battery.
Подробнее об этих источниках тока читайте в этой статье!
Щелочной элемент Крона
Имеет нестандартную форму и используется в измерительных приборах, медицинском оборудовании, фонарях, металлоискателях. Такие алкалайн батарейки имеют напряжение 9 вольт и работают достаточно длительный срок. Плюс данного источника энергии заключается в том, что он может обеспечить прибор большим тока имея маленькие габариты.
Детальнее о кроне читайте в этой статье!
Основные параметры
На корпусе можно сразу заметить надпись alkaline battery. Такая маркировка щелочных батареек дает сразу понять, что это именно они.
Напряжение или ЭДС равно 1.5 – 9 вольт.
Емкость щелочной батарейки доходит до 3000 mAh. Это у самых крупных.
Удельная мощность 100—150 кВт/м³.
Температура, при которой источники тока могут работать от – 30 до + 55 C0.
Удельная энергия: 65—90 Вт∙ч/кг;
Производством занимаются такие страны как Россия, США, Китай, Япония.
Форма: цилиндры, прямоугольники, сплющенные диски.
Химия в щелочных батареях
Прежде всего на аноде наблюдается окислительная реакция цинка. Первым делом появляется гидроксид цинка:
Zn + 2OH− → Zn(OH)2 + 2e−
Дальше идет распад на оксид цинка и воду.
Zn(OH)2 → ZnO + h3O
Что же касается катода, то на нем идет реакция восстановления оксида марганца (IV) в оксид марганца (III):
2MnO2 + h3O + 2e− → Mn2O3 + 2OH−
Если электролитом является KOH, то уравнение будет выглядеть следующим образом:
Zn + 2KOH + 2MnO2 + 2e− → 2e− + ZnO + 2KOH + Mn2O3
Когда садиться батарейка щелочной электролит не заканчивается. Это означает что для производства потребуются небольшое его количество. В итоге в такой источник питания добавляют диоксида марганца на полтора раза больше, чем в те же солевые элементы тока.
Это означает что для производства потребуются небольшое его количество. В итоге в такой источник питания добавляют диоксида марганца на полтора раза больше, чем в те же солевые элементы тока.
Устройство щелочной батарейки
О стандартном строение источника тока можно прочесть в этой статье. Там приведено более детальное описание.
Ток получается, когда происходит реакция между катодом и анодом.
Состав катода щелочной батарейки:
- Специальные вещества для связывания – 1%.
- Ацетиленовая сажа выступает в роли графита – около 10%.
- Диоксид марганца занимает до 85%.
- Щелочной компонент калия гидроксида – до 35%.
В качестве последнего может выступать так же активные элементы лития и натрия. В процессе производства электролит делают густым для этого добавляют специальные вещества синтетического или природного происхождения с гидроксильной группой ОН.
Анод делают из очищенного цинка. Проводят процедуры, которые не дают попадать на него ржавчине. Затем подмешивают в него алюминий и висмут.
Проводят процедуры, которые не дают попадать на него ржавчине. Затем подмешивают в него алюминий и висмут.
Щелочная батарея имеет изнаночное строение если сравнивать ее с солевыми источниками тока.
- Внутрь помещена паста (3) выполненная на основе цинка. Этот металл там содержится в порошке. Такой подход позволяет ему значительно увеличить площадь взаимодействия. Поэтому емкость щелочные батарейки имеют высокую чем солевые.
- На цинке, который с помощью специального гелиевого вещества загущен, генерируется отрицательный потенциал. Он поступает на стержень (2), созданный из латуни.
- Углерод из графита, золы или сажи (5) перемешанный с диоксидом марганца отделяется от цинка с помощью специального устройства сепаратора (4).
- Плюс батарейки — это стальной стакан (1), обнесенный никелем.
- Минусовой полюс выполнен в виде тонкой дискеты из металла (9).
- Покрытие (6) изолировано от основного стаканчика. Так не возникает замка.
- Специальная прокладка (8) принимает на себя давящие газы.
 Их не много, примерно 20%.
Их не много, примерно 20%. - Встраивают в щелочную батарейку мембрану (7) и камеру для поглощения газов. При повышении давления газы прорывают мембрану, и она разрывается. В этот момент выходит электролит.
Таким образом состав щелочной батарейки выглядит так, как было описано выше.
Аналоги щелочных батареек
Заменить данные источники тока можно любыми подходящими по размеру и напряжению батарейками. Но главное, чтобы вольтаж совпадал, а дальше можно что-нибудь придумать. Например, в качестве аналогов могут выступать литиевые, солевые, ртутные, серебряные элементы питания.
Если сделать распределение по ценовой категории, то оно будет выглядеть следующим образом:
- Солевые.
- Щелочные или алкалиновые батарейки.
- Серебряные. Обычно имеют корпус в виде таблетки.
- Литиевые.
Первые это самые дешевые.
Преимущества щелочных батареек
Несмотря на дешевизну эти элементы питания имеют ряд плюсов:
- Легко заменяемые в отличие от АКБ.
 Не нужно ждать пока аккумулятор полностью зарядиться.
Не нужно ждать пока аккумулятор полностью зарядиться. - Всегда есть в продаже. Зайдите в любой магазин, хоть технический, хоть продуктовый они там есть. В каждом киоске вы их встретите.
- Служат долго. Существуют устройства с встроенным АКБ, который выходит через 2-3 года. В итоге если прибор не разборный, то приходится его выбрасывать. А вот гаджеты на батарейках всегда имеют возможность выполнить замену.
- Некоторые ЗУ для аккумуляторов очень долго выполняют зарядку, поэтому если вам дорого время можно без проблем их заменить на щелочные батарейки.
- Обладают низким саморазрядом.
- Неплохо справляются с работой при низких температурах.
- Отлично выдерживают сильные тока разряда.
- Батарея разряжается равномерно.
- Имеют высокий срок годности.
- Безопасные.
Основные минусы щелочных батареек
Теперь же расскажем о минусах.
- Иногда бывает высокая цена.
- Большая масса.
- Нет возможности использовать второй и последующие разы.

На цену можно закрыть глаза, так как щелочная батарея работает долго.
Какие батарейки лучше алкалиновые или солевые?
Порой между пользователями возникает спор о том, какой элемент питания все же лучше солевой или щелочной? Если разобраться в вопросе более детальнее, то не вооруженным взглядом видно, что alkaline батарейки имеют значительно лучший рейтинг! Если не верите проведите простой тест. Приобретите 2 элемента питания с разным электролитом. И поставьте их в два одинаковых устройства. Включите и засеките время. Какой накопитель энергии проработает дольше тот и будет лучше!
Вот в чем отличия щелочных батареек от солевых:
- Емкость выше!
- Работают в 5 раз дольше!
- Спокойно выдерживают мороз до -20 градусов Цельсия!
- Электролит из корпуса не вытекает, когда элемент сильно разряжен!
Таким образом преимущества на лицо!
Различия между солевыми и щелочными элементами питания
Отличие заключается в том, что внутрь каждой кладут разную начинку. И в них происходят отличимые химические реакции.
И в них происходят отличимые химические реакции.
У солевых используются соли хлорида, а щелочные начиняют гидратом окиси калия. За счет порошкообразного металла вторые служат дольше. В итоге уровень образуемой энергии заметно возрос. По некоторым данным он увеличился в целых 5 раз.
Другое отличие, которое имеют алкалиновые батарейки — это срок службы и условия эксплуатации. Они могут переносить мороз от -20 до +55 или даже +70 градусов Цельсия. Время хранения некоторых подобных элементов доходит до 5 лет. Ходят слухи что появились энергетические элементы, на щелочи, которые можно заряжать. Солевые же источники тока служат до 2-х лет.
Основные известные производители щелочных батареек
В действительности на рынке источников питания существует масса компаний и все они утверждают, что являются лучшими. Ниже представлены основные из них:
- Camelion – компания работает из Китая и производит щелочные батарейки высокого качества. Стабильно работают с высоким разрядом длительное время.

- Energizer – это американская компания выпускающая источники тока которые практически до самого конца держат напряжение на одном уровне.
- Panasonic – известная фирма работающая на рынке несколько десятков лет. Производит источники энергии, прекрасно работающие на морозе и стабильно отдающие напряжение устройству.
- Duracell – это самая популярная компания на рынке. Ее щелочные батарейки имеют малый саморазряд и большую емкость.
Кроме этих фирм существует множество других создающих высококачественные элементы питания.
Можно ли заряжать щелочные батарейки?
Алкалиновые батарейки заряду не подлежат. После того как элемент сядет его необходимо сдать в специальный утилизационный приемник. Подключение к ЗУ может вызвать кучу неприятностей от протечки электролита до взрыва и получения ожогов.
Разница между щелочными и литиевыми батарейками
Отличие состоит в том, что литиевые элементы питания служат в 7 раз дольше. Выдерживают морозы до -40 градусов Цельсия и могут храниться до 10 лет. По напряжению они превосходят щелочные элементы и имеют вольтаж 1.5;3;3.6;3.7 вольт. Держат уровень заряда на одном уровне, а в самом конце резко его теряют. Такие элементы питания будут легче. Их емкость в несколько раз больше. Литиевые батарейки могут взрываться при перезаряде, взаимодействии с водой, повреждении корпуса. Так же отличие имеется в строении.
Выдерживают морозы до -40 градусов Цельсия и могут храниться до 10 лет. По напряжению они превосходят щелочные элементы и имеют вольтаж 1.5;3;3.6;3.7 вольт. Держат уровень заряда на одном уровне, а в самом конце резко его теряют. Такие элементы питания будут легче. Их емкость в несколько раз больше. Литиевые батарейки могут взрываться при перезаряде, взаимодействии с водой, повреждении корпуса. Так же отличие имеется в строении.
Но если вы думаете какие батарейки лучше щелочные или литиевые, то непременно это элементы на основе лития.
Рекомендации и советы потребителям
- Перед приобретением если вы не знаете какой элемент питания вам требуется, откройте инструкцию к устройству. Производителя обычно указывают тип батареи.
- Лучше брать аккумуляторные источники тока, так как они проработают долго. Это выгодно с точки зрения экономики.
- Берите батарейки с напряжением, которое необходимо вашему устройству.
- Обращайте внимание на срок изготовления.
 Не стоит брать накопители энергии с запасом.
Не стоит брать накопители энергии с запасом. - Предпочтение лучше всего отдавать известным брендам. Но это делать не обязательно, так как неизвестные компании производят продукцию не чуть не хуже популярных. Ведь каждый хочет, чтобы его товар продавался и пользовался спросом.
- Не стоит выкидывать отработавшие свое щелочные батарейки на улицу или в мусорное ведро. Чтобы не загрязнять экологию лучше отнесите их в специальные пункты приема.
- Упаковка должна выглядеть свежо и не иметь разных вмятин.
Batareykaa.ru
Электролиты: понятие и свойства
Электролиты — растворы, содержащие большую концентрацию ионов, обеспечивающих прохождение электрического тока. Как правило, это водные растворы солей, кислот и щелочей.
Это интересно
В организме человека и животных электролиты играют важную роль: к примеру, электролиты крови с ионами железа транспортируют кислород в ткани; электролиты с ионами калия и натрия регулируют водно-солевой баланс организма, работу кишечника и сердца.
Свойства
Чистая вода, безводные соли, кислоты, щелочи ток не проводят. В растворах же вещества распадаются на ионы и проводят ток. Именно поэтому электролиты называют проводниками второго порядка (в отличие от металлов). Электролитами могут быть также расплавы и некоторые кристаллы, в частности диоксид циркония и иодид серебра.
Главное свойство электролитов — способность к электролитической диссоциации, то есть к распаду молекул при взаимодействии с молекулами воды (или других растворителей) на заряженные ионы.
По типу ионов, образующихся в растворе, различают электролит щелочной (электропроводимость обусловлена ионами металлов и ОН-), солевой и кислотный (с ионами Н+ и остатками основания кислоты).
Для количественной характеристики способности электролита к диссоциации введен параметр «степень диссоциации». Эта величина отражает процент молекул, подвергшихся распаду. Она зависит от:
• самого вещества;
• растворителя;
• концентрации вещества;
• температуры.
Электролиты делят на сильные и слабые. Чем лучше реагент растворяется (распадается на ионы), тем сильнее электролит, тем лучше он проводит ток. К сильным электролитам относятся щелочи, сильные кислоты и растворимые соли.
Для электролитов, использующихся в аккумуляторах, очень важен такой параметр, как плотность. От нее зависят условия эксплуатации аккумулятора, его емкость и срок службы. Определяют плотность с помощью ареометров.
Меры предосторожности при работе с электролитами
Самые популярные электролиты, это раствор концентрированной серной кислоты и щелочи — чаще всего гидроксиды калия, натрия, лития. Все они вызывают химические ожоги кожи и слизистых, очень опасные ожоги глаз. Именно поэтому все работы с такими электролитами нужно производить в отдельном, хорошо вентилируемом помещении, используя средства защиты: одежду, маски, очки, резиновые перчатки.
• Рядом с помещением, где проводятся работы с электролитами, должна храниться аптечка с набором нейтрализующих средств и кран с водой.
• Кислотные ожоги нейтрализуются раствором соды (1 ч.л. на 1 ст. воды).
• Ожоги щелочью нейтрализуют раствором борной кислоты (1 ч.л. на 1 ст. воды).
• Для промывания глаз нейтрализующие растворы должны быть в два раза слабее.
• Поврежденные участки кожи сначала промывают нейтрализатором, а потом мылом и водой.
• Если электролит пролили, его собирают опилками, потом промывают нейтрализатором и вытирают насухо.
При работе с электролитом следует выполнять все требования техники безопасности. Например, кислоту наливают в воду (а не наоборот!) не вручную, а с помощью приспособлений. Куски твердой щелочи в воду опускают не руками, а щипцами или ложками. Нельзя работать в одном помещении с аккумуляторами на разнотипных электролитах, и хранить их вместе тоже запрещается.
Некоторые работы требуют «кипения» электролита. При этом выделяется водород — горючий и взрывоопасный газ. В таких помещениях должна использоваться взрывобезопасная электропроводка и электроприборы, запрещается курение и любые работы с открытым огнем.
Хранят электролиты в пластиковых емкостях. Для работы подходит стеклянная, керамическая, фарфоровая посуда и инструменты.
В следующей статье расскажем подробнее о видах и применении электролита.
Приготовить щелочной электролит своими руками
Отличия электролитов для разных типов аккумуляторов
Несмотря на то что принцип работы раствора одинаков для разных источников питания, следует знать о некоторых различиях составов. В зависимости от состава принято выделять щелочной и кислотный электролиты.
Щелочные АКБ
Этот вид источников питания характеризуется наличием гидроокиси никеля, окиси бария и графита. Электролит в этом виде аккумуляторов представляет собой 20% раствор едкого калия. Традиционно используется добавка моногидрата лития, которая позволяет продлить срок эксплуатации АКБ.
Щелочные источники питания отличаются отсутствием взаимодействия калийного раствора с веществами, образуемыми во время работы аккумулятора, что способствует аксимальному уменьшению расхода.
Кислотные АКБ
Этот вид источников питания является одним из самых традиционных, поэтому и раствор в них знаком многим — смесь дистиллированной воды и серного раствора. Концентрат электролита для свинцово-кислотных аккумуляторов дешёво стоит и характеризуется способностью проводить ток большой величины. Плотность жидкости должна соответствовать климатическим показателям.
Таблица 1. Рекомендуемая плотность электролита
Особенности электролитов блестящего никелирования.
Основное назначение процесса блестящего никелирования – защитно-декоративная отделка изделий. Покрытия получаются с зеркальным блеском непосредственно за счет состава электролитов никелирования.
Из обычных электролитов, рассмотренных ранее (см. «Никелирование»), в отсутствие специальных добавок никелевые покрытия получаются матовыми, и для придания блеска приходится прибегать к трудоемкой механической операции – полировке, при которой безвозвратно теряется до 20% электроосажденного никеля (см. «Первые шаги в гальванике.Часть 2»). Поэтому вопросу получения блестящих никелевых покрытий непосредственно из электролитов никелирования уделяется много внимания.
«Первые шаги в гальванике.Часть 2»). Поэтому вопросу получения блестящих никелевых покрытий непосредственно из электролитов никелирования уделяется много внимания.
Помимо основных компонентов (сульфата никеля, борной кислоты и хлоридов), назначение которых разбиралось в статье «Электролиты никелирования. Часть1», в состав электролитов никелирования должны входить специальные добавки – блескообразователи, которые влияют на процесс осаждения, способствуя получению блестящей поверхности.
Блескообразователи по своему влиянию на течение процесса можно разделить на два класса. Блескообразователи 1-го класса позволяют получать блестящее покрытие на полированной поверхности, но сами не могут обеспечить сильный блеск. Такие вещества можно вводить в электролит никелирования в сравнительно больших концентрациях, т.к. они не снижают пластичность покрытия и прочность его сцепления с основой. В частности, к блескообразователям 1-го класса относится сахарин.
Блескообразователи 2-го класса включают несколько подклассов. Один из них – это ионы металлов (цинка, кадмия, свинца) с высоким перенапряжением водорода в кислых растворах, другой подкласс – включает органические соединения (тиомочевина, 1,4 — бутиндиол и др.).
Один из них – это ионы металлов (цинка, кадмия, свинца) с высоким перенапряжением водорода в кислых растворах, другой подкласс – включает органические соединения (тиомочевина, 1,4 — бутиндиол и др.).
Для достижения наилучшего результата – получения пластичного блестящего покрытия в электролит никелирования необходимо вводить блескообразователи и 1-го и 2-го класса. При этом основные компоненты вводятся с повышенной концентрацией, а именно содержание никеля доводят до 100 г/л, хлоридов – не менее 14 г/л, а борную кислоту до 38 г/л, что способствует получению пластичных осадков при повышенной плотности тока.
Состав электролита блестящего никелирования, г/л:
Никель сернокислый 280 – 300
Никель хлористый 50 – 60
Кислота борная 25 – 40
Сахарин 1 – 2
1,4 – бутиндиол 0,15 – 0,18
Фталимид 0,02 – 0,04
pH = 4 – 4,8; температура 50 – 60ºС; плотность тока 3 – 8 А/дм2.
В электролите блестящего никелирования используют также добавки: хлорамина Б, пропаргилового спирта, бензосульфамида и др.
Для получения блестящих покрытий необходимо интенсивное перемешивание электролита никелирования сжатым воздухом желательно в сочетании с качанием катодных штанг, а также непрерывная фильтрация электролита.
Детали, покрытые из блестящего электролита никелирования.
Важно также правильно приготовить электролит никелирования. Для этого в горячей дистиллированной воде (80 – 90ºС) растворяют при перемешивании сернокислый и хлористый никель, борную кислоту
Доведенный до рабочего объема электролит подвергают химической и селективной очистке, прорабатывая при pH 2 – 3,температуре 50 – 60ºС, перемешивании сжатым воздухом и плотности тока 0,1 – 0,3 А/дм2 в течение 24 часов. Затем pH доводят до 5 – 5,5 и вводят 30%-ный раствор перекиси водорода (2 мл/л).
Раствор перемешивают 30 минут, добавляют активированный уголь 3 г/л, еще раз перемешивают, отстаивают 7–12 часов и фильтруют. В очищенный электролит вводят блескообразователи: сахарин и 1,4 – бутиндиол непосредственно, а фталимид – предварительно растворив в небольшом количестве электролита, подогретого до 70 – 80°С.
Наиболее характерными дефектами процесса блестящего никелирования могут быть:
- Питтинг – при низкой температуре электролита или наличии примесей железа;
- Хрупкие осадки – загрязнение электролита органикой или недостаток 1,4 – бутиндиола;
- Недостаточный блеск – мала концентрация блескообразователей или не выдерживается pH.
Главное преимущество электролита блестящего никелирования в том, что получаемые покрытия обладают способностью в значительной мере сглаживать мелкие неровности на деталях, которые остаются после механической обработки и имеют хороший декоративный вид.
- «Химическое и электрохимическое полирование металлов.»
- «Осаждение сплавов никель-кобальт.»
- «Причины нарушения качества гальванических покрытий.»
Загущенный электролит
Сравнительно большой объем электролита в электрохимической ячейке увеличивает срок ее службы. Загущенный электролит, по мысли авторов прибора, должен замедлять диффузию продуктов растворения цинка к катоду. Внутри корпуса датчика размещен мост температурной компенсации, собранный на термисторах. Корпус датчика должен быть надежно герметизирован.
Внутри корпуса датчика размещен мост температурной компенсации, собранный на термисторах. Корпус датчика должен быть надежно герметизирован.
В некоторых элементах функции сепараторов выполняют загущенный электролит или пастовая диафрагма. Устойчивость загущенных электролитов и пастовых диафрагм зависит от природы и концентрации загустителей и ионов, входящих в состав электролитов, и закономерности изменения рН при разряде.
| Разрядные кривые батареи типа Крона. |
Присутствие в массе двуокиси марганца способствует каталитическому разложению образующейся на положительном электроде перекиси водорода. Применение загущенного электролита затрудняет намокание электрода.
| Зависимость полного тока ионизации кислорода на гладком платиновом электроде в расплаве карбонатных электролитов при 700 С и.| Зависимость полного тока ионизации кислорода на гладком серебряном электроде от длины непогруженной части, снятая при различных потенциалах в расплаве смеси ( 50 мол. % Na2C03 50 мол. % Ы2С03 при температуре 800 С. |
Малые значения токов, генерируемых на электродах высотой менее 7 мм в случае жидкого электролита ( 1 5 и 1 6 ма на весь электрод) свидетельствуют о появлении ( самопроизвольном) пленки электролита значительной протяженности, которая затрудняет доступ газа к поверхности металла. В случае загущенного электролита ток ионизации водорода составляет около 30 ма, и не зависит от высоты электрода / Ширина зоны реакции составляет менее одного миллиметра. Пленки электролита в зоне контакта металла с загущенным электролитом, по-видимому, очень тонкие.
| Электроды элемента № 373.| Чашечка из коробчатого картона для элемента № 373.| Пастовая диафрагма.| Гильза-футляр элемента № 373 ( гильза склеена из 3 слоев бумаги и проварена в композиции. |
Карточка сворачивается в виде цилиндра так, чтобы края ее 5 перекрывали друг друга. Такая диафрагма со слоем загущенного электролита называется пастовой диафрагмой, а слой загущенного электролита — пастой.
Компоненты перемешивают до получения однородной смеси и исчезновения комков. Образующуюся пену удаляют с поверхности загущенного электролита с помощью дуршлага.
| Схематическое устройство ОР-эле-мента ( а, их внешний вид ( б и характер зависимости емкости элементов от температуры ( в. |
В качестве электролита используется 35 — 40 % — ный раствор едкого кали ( КОН), содержащий около 5 % растворенной окиси цинка. В некоторых типах окиснортутных элементов используется загущенный электролит, приготовляемый добавкой к электролиту 1 5 — 4 % карбооксиметилцелпюлозы.
Для некоторых элементов ( например, Марс) электролит вводят в элементы в виде пастовых диафрагм. Кабельную бумагу пропитывают электролитом и на одну сторону наносят загущенный электролит — пасту. Чтобы он не густел в аппаратуре до нанесения на бумагу, электролит охлаждают до 14 — 16 С. На рис. 137 представлена схема машины для приготовления пастовых диафрагм. Самозагустевающий электролит применяют для того, чтобы слой электролита не стекал с бумаги. Слой пасты не припудривают крахмалом, а используют его липкость для приклейки к цинковым листам — отрицательным электродам. Кроме того, в галетные батареи вкладывают еще диафрагмы из фильтровального картона, пропитанного электролитом.
| Конструкция марганцево-цинко.| Положительные электроды галетных элементов. |
Этот слой обладает электронной проводимостью, непроницаем для ионов электролита и является токортводом положительного электрода соседнего элемента. Эта диафрагма имеет на поверхности, обращенной к цинку, слои загущенного электролита.
Карточка сворачивается в виде цилиндра так, чтобы края ее 5 перекрывали друг друга. Такая диафрагма со слоем загущенного электролита называется пастовой диафрагмой, а слой загущенного электролита — пастой.
Несколько слов о кислотном электролите
Кислотный электролит – это одна из составляющих частей многих аккумуляторных батарей (АКБ). Данная субстанция представляет собой смесь из двух основных элементов:
- кислоты, которой зачастую выступает серная;
- и дистиллированной воды.
В привычном для всех варианте, жидкостный электролит требует периодической заливки, ибо в процессе работы частично испаряется и уходит по газоотводным отделам аккумулятора. Также в зависимости от сезона раствор должен быть либо менее, либо более плотным. Именно правильно поддерживая количество и плотность кислотного электролита от используемой батареи можно добиться наивысшего КПД. По сути, только эти два показателя смеси кислоты и дистиллированный воды требуют должного слежения и соответствующей корректировки.
Классификация
Исходя из степени диссоциации все электролиты делятся на две группы:
- Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как HCl, HBr, HI, HNO3, H2SO4).
- Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот (слабые кислоты, такие как HF), основания p-, d- и f-элементов.
Между этими двумя группами чёткой границы нет, одно и то же вещество может в одном растворителе проявлять свойства сильного электролита, а в другом — слабого.
Требования для разных климатических зон
Перед тем как корректировать плотность электролита в аккумуляторе необходимо разобраться, для чего это делается. Зимой данный параметр необходимо повышать, чтобы АКБ не замерз при низких температурах. Летом он снижается, что продлевает срок службы батареи.
Опытным специалистам удается повысить плотность, добавляя корректирующий электролит для аккумуляторов, а в случае необходимости возможно ее понижение с помощью дистиллированной воды.
При этом автолюбители рекомендуют без крайней необходимости не пользоваться таким методом, поскольку возможен вывод из строя АКБ из-за несоблюдения правильных пропорций. Многие используют усредненную плотность, что позволяет пользоваться батареей в любое время года без лишних манипуляций. В таблицу сведены наиболее распространенные параметры плотности:
Если ожидается аномальный холод в центральном либо южном районе, то рекомендуется занести батарею в теплую комнату, проверить уровень заряда и довести его до 100% если необходимо. Полностью разряженная батарея обладает низкой плотностью (1,10 г/см 3), что способствует ее замерзанию уже при -5°C.
Порядок заливки и доливки кислотного электролита в АКБ
Из представленной выше информации понятно, что кислотный электролит любого аккумулятора важно поддерживать на должном уровне и состоянии. Использование низкокачественного или малого количества раствора является тем фактором, который может существенно снизить срок службы АКБ
В процессе эксплуатации кислотных батарей может потребоваться либо полная смена электролита, либо его доливка. Любой из данных процессов стоит проводить при появлении следующих признаков:
- аккумулятор перестал держать заряд или делает это крайне слабо;
- электроды, сепараторы и их пластины целы;
- АКБ заряжался, но результата от этого не было или он был, но крайне слабый.
Наблюдаете эти моменты конкретно в своей ситуации? Тогда смена или частичная доливка кислотного электролита просто необходима, ведь возможно именно они реанимируют аккумулятор.
Если со сменой раствора особых сложностей у автомобилистов не возникает, то вот с его доливкой многие не справляются. На самом деле в проведении этой процедуры ничего сложного нет и порядок её реализации таков:
- Снимите АКБ с автомобиля;
- Отнесите батарею в место доливки, которое обязательно должно быть защищено от сторонних лиц, тока, огня и воды;
- Приготовьте защитный костюм и некоторые инструменты для доливки электролита;
- После этого аккуратно снимите крышки сепараторов и при помощи анализатора проверьте плотность электролита, а также уровень его заливки. Плотность выше нормы – разбавьте электролит дистиллированной водой, ниже – долейте корректирующий электролит. Доливать раствор желательно до рекомендуемого производителем АКБ уровня, но лёгкое отступление от него с соблюдением нормальной плотности электролита, проверяемой анализатором, также допустимо;
- Затем остаётся лишь собрать аккумулятор в первоначальный вид и вернуть его в конструкцию автомобиля.
Отметим, что заменяя или доливая большое количество электролита, желательно дополнительно подзарядить аккумулятор. При полной замене раствора необходима полноценная зарядка батареи, при частичной доливке – треть или четверть от длительности полноценной зарядки.
Приготовления — электролит
Для приготовления электролита хлорную кислоту медленно, небольшими порциями вводят в уксусный ангидрид, непрерывно перемешивая и охлаждая смесь, чтобы ее температура не превышала 30 — 35 С.
Для приготовления электролита цианистый калий растворяют в теплой воде, затем добавляют в раствор окись кадмия, которая растворяется при помешивании. После этого добавляют другие вещества, входящие ( по рецепту) в электролит.
Для приготовления электролита, не замерзающего до — 30 С, берут обычно используемый в переносных электродах сравнения насыщенный раствор сульфата меди ( CuSO4 — 5h3O) хч или чда, добавляют к нему этиленгликоль и хорошо перемешивают. Соотношение насыщенного раствора сульфата меди и этиленгликоля должно быть 3: 2 по объему.
Для приготовления электролита составляют соль Шевреля, как это описано на стр.
Для приготовления электролита карбонат меди растворяют в борфтористоводородной кислоте, после чего добавляют борную кислоту. Кислотность электролита должна быть в пределах рН 0 8 — 1 7; температура 25 — 50 С.
Для приготовления электролита в 2 / 3 объема воды растворяют при 40 — 50 С хлориды цинка и аммония. В остывший раствор при перемешивании добавляют сначала добавку А, а затем В — постепенно, при тщательном перемешивании до полного исчезновения осадка, который выпадает при введении добавок в электролит. Полученный электролит разбавляют водой до нужного объема.
| Составы пирофосфатных электролитов цинкования и условия электролиза. |
Для приготовления электролита растворяют в половинном объеме воды, подогретой до 50 — 70 С, пирофосфат натрия, после чего добавляют раствор сернокислого цинка; при этом выпадает осадок Zn2P2O7, который растворяется в избытке пирофосфата натрия при интенсивном перемешивании с образованием комплекса. Отдельно растворяют двузамещенный фосфат аммония при комнатной температуре и декстрин при 60 — 70 С. Затем растворы смешивают, фильтруют ( если нужно) и сливают в рабочую ванну. Приготовленный электролит не требует предварительной проработки током. Аналогично готовятся и другие пирофосфатные электролиты.
| Зависимость катодных выходов меди по току от плотности тока в цианидных электролитах различного состава при 20 ( а и 40 С ( б. 1 — 3 — концентрация меди 30 г / л. 4 — 6 — то же, 60 г / л. /, 4 — концентрация НаСКсвэб 2 г / л. 2, 5 — то же, 12 г / л. 3, 6 — то же, 25 г / л. |
Для приготовления электролита следует исходить из цианида CuGN, который при взаимодействии с цианидом натрия или калия в растворе образует соответствующую комплексную соль меди.
| Вскрытие барабана со щелочью. |
Для приготовления электролита разводят готовый жидкий электролит или растворяют твердую щелочь в дистиллированной воде. Приготовление электролита происходит обыкновенно в стальных сварных баках или в чугунной посуде.
Для приготовления электролита применяют стойкую к действию серной кислоты посуду ( керамическую, эбонитовую или деревянные баки, выложенные листовым свинцом), емкость которой должна быть достаточной для заливки всей батареи с учетом доливки при формовке. Общее количество электролита для заливки батареи определяется умножением его количества, требуемого для одного элемента, на число элементов в батарее с добавлением 10 % электролита на долив при ее формовке.
До приготовления электролита для аккумуляторов ЖН получают лабораторные анализы на дистиллированную воду и щелочь. Щелочные аккумуляторы заливают составным электролитом — водным раствором едкого кали плотностью 1 19 — 1 21 г / см3 с добавкой моногидрата лития или раствором едкого натра плотностью 1 17 — 1 19 г / см3 с добавкой моногидрата лития.
Для приготовления электролита должен применяться гидрат окиси калия технический высшего сорта, поставляемый в виде чешуек в полиэтиленовых вкладышах или мешках, или жидкий марки ХЧ соответствующего ГОСТ.
Концентрация серной кислоты в АКБ
Этот показатель кислотности напрямую зависит от необходимой плотности электролита. Изначально средняя концентрация этого раствора в автомобильном аккумуляторе — около 40% в зависимости от температуры и климата, в которых используется источник питания. Во время эксплуатации концентрация кислоты падает до 10–20%, что сказывается на работоспособности АКБ.
Вместе с тем стоит понимать, что аккумуляторная серная составляющая — наичистейшая жидкость, которая на 93% состоит непосредственно из кислоты остальные 7% — примеси. На территории России производство этого химиката строго регламентировано — продукция должна соответствовать требованиям ГОСТ.
Другие виды АКБ можно ли приготовить электролит для них самостоятельно
Отдельно хотелось бы обратить внимание на современные свинцово-кислотные источники питания — гелевые и AGM. Они также могут быть заправлены собственноручно приготовленным раствором, который в них находится в специфической форме — в виде геля или внутри сепараторов
Для заправки гелевых аккумуляторов понадобится ещё один химический компонент — силикагель, который загустит кислотный раствор.
Кадмиевоникелевые и железоникелевые аккумуляторы
В отличие от свинцовых источников питания, кадмиево- и железоникелевые заливаются щелочным растовром, который является смесью дистиллированной воды и едкого калия или натрия. Гидроксид лития, входящий в состав этого раствора для определённых температурных режимов, позволяет увеличить срок службы АКБ.
Таблица 2. Состав и плотность электролита для кадмиево- и железоникелевых и аккумуляторов.
Железоникелевые источники питания рекомендуется эксплуатировать в тех же условиях, что и кадмиево-никелевые. Однако стоит отметить, что они более восприимчивы к низким температурам. Поэтому их следует использовать до минус 20 градусов.
Высаливающее действие — электролит
Высаливающее действие электролитов зависит, главным образом, от анионов. По интенсивности высаливания ионы располагаются по степени гидратации, а не по валентности, как в случае коагуляции.
Высаливающее действие электролитов и других веществ обусловлено в первую очередь тем, что они связывают молекулы вещества дисперсионной среды и тем самым изменяют растворяющую способность последней.
| Коэффициенты активности и теплоты растворения в воде для пиридина и его гомологов ( концентрация растворов 0 03 М, температура 55 С. |
Особенно заметно высаливающее действие электролитов при улавливании водой органических оснований. Это, по-видимому, объясняется тем, что при взаимодействии ионов соли с молекулами воды происходит гидратация ионов. Вследствие большей прочности образующихся гидратных комплексов по сравнению с гидратами оснований менее полярный компонент выталкивается из поля иона, становится подвижным и обогащает газовую фазу.
С) повышает высаливающее действие электролита.
Наиболее полно эффективность высаливающего действия электролитов изучена в случае нитратов, главным образом в системах на основе нитрата уранила как экстрагируемого компонента. По-видимому, впервые заметное увеличение коэффициента распределения UO2 ( NO3) 2 при экстракции его диэтиловым эфиром в присутствии больших количеств добавленного в качестве высаливате-ля в водную фазу нитрата аммония наблюдали Гехт и Грюнвальд , а также Фарман и др. ( цит.
Сопряженная растворимость может снижать высаливающее действие электролитов.
Содержание неомыленного жира в мыльном клее повышает чувствительность последнего к высаливающему действию электролитов: пережиренное мыло высаливается при концентрации электролита ниже предельной, но при этом загрязнения и красящие вещества адсорбируются ( поглощаются) образующимися мылами. Очистительный эффект высаливания не достигается.
Понижение температуры при высаливании мыльного клея ( ниже 100 С) повышает высаливающее действие электролита. При температуре более 100 С эффект высаливания электролита понижается и при очень высокой температуре мыльный клей практически не поддается высаливанию.
| Изменение защитного действия ингибиторов коррозии в сточной воде девонского типа в зависимости от их концентрации и условий ввода в среду. Добавка. |
Хотя степень дисперсности этого реагента в ряду дистиллированная, пресная и сточная воды уменьшается ( что связано, по-видимому, с высаливающим действием электролитов), однако его защитный эффект в этих средах сохраняется достаточно высоким.
Изменение же скорости адсорбции поверхностно-активных веществ при изменении концентрации электролита не укладывается в представлении об изменении поверхностной активности органической добавки, поскольку при увеличении высаливающего действия электролита происходит не ускорение адсорбции, как это следовало бы ожидать, а замедление.
| Кривые распределения водно-органических компонентов между фазами ионита и раствора. |
Из данных рис. 1 следует, что коэффициент распределения органического компонента ( характеризуемый наклоном кривой — / V0 — N0 при VQ 0), весьма мал, что объясняется сильным высаливающим действием электролита в фазе набухшего ионита. Иными словами, при больших концентрациях органического компонента эффективная сорбция воды ионитом весьма велика. Последняя измеряется числом грамм-молей воды, сорбированных таким объемом ионита, в котором содержится один грамм-моль обоих компонентов, и равна разности мольных долей воды в фазе ионита и в фазе раствора.
| Схема коагуляции ( по Г. Кройту. |
Щелочные элементы энергии — Первичные батареи общего назначения
Характеристики
Во многих типах батарей используются щелочные электролиты, но «Щелочные батареи» обычно относятся к первичным элементам из щелочного диоксида марганца , описанным ниже.
Первичный элемент 1,5 В
Самый популярный аккумулятор общего назначения премиум-класса.
В щелочном элементе электрическая энергия в основном получается за счет реакции металла с кислородом.
Батарея из щелочного диоксида марганца является вариантом элемента Лекланше. Как и в ячейке Лекланше, электроды выполнены из диоксида цинка и марганца, но электролитом является гидроксид калия (КОН).
Недавно стали доступны перезаряжаемые элементы, использующие этот химический состав.Известные как (RAM) перезаряжаемые щелочно-марганцевые батареи, они обладают всеми функциями и преимуществами щелочных первичных элементов, с дополнительным преимуществом, заключающимся в возможности перезарядки, но без недостатка «эффекта памяти».
Гидроксид калия (КОН)
Гидроксид калия — это электролит, который используется в большинстве первичных щелочных элементов и никелевых аккумуляторных элементах, таких как NiCad, NiMH и NiFe элементы.Он также является одним из основных ингредиентов бытового отбеливателя, очистителей сточных вод и мягкого мыла.
Преимущества
Подобен цинково-углеродным элементам Лекланше и взаимозаменяем с ними, но с удвоенной плотностью энергии.
В четыре раза больше, чем у аккумуляторных никель-кадмиевых или никель-металлогидридных элементов аналогичного размера.
Срок службы в четыре-девять раз больше, чем у эквивалентной ячейки Лекланше.
Постоянная производительность в широком диапазоне токов.
Подходит для приложений с высокой скоростью слива.
Хороший срок хранения
Лучшие характеристики при низких температурах, чем угольно-цинковый. Продолжайте работать при минусовых температурах.
Меньшая утечка, чем у ячеек Лекланше
Доступен в широком диапазоне размеров, включая размеры AAA, AA, C, D и 9 Вольт.
Подходит для широкого спектра потребительских приложений
Изготовлен из нетоксичных химикатов
Недостатки
Более высокая стоимость, чем у основных конкурирующих цинк-угольных элементов Leclanché
Обычно не заряжается
На 25% тяжелее элементов Leclanché
Ячейки RAMимеют ограниченный срок службы около 100 циклов и доступны только в размерах AA и AAA.
Приложения
Премиум товаров
Игрушки
Пульт дистанционного управления
Фонари
Частоты
Потребительские приложения
Ячейки RAMмогут быть заменены стандартными щелочными ячейками (но не смешаны в одном приложении).
Стоимость
Низкая стоимость, но примерно на 50% выше, чем у цинк-угля, однако эти элементы более рентабельны из-за более длительного срока службы.
Щелочные элементы в основном заменили цинк-углеродные первичные элементы.
Границы | Последние достижения в области неорганических твердых электролитов для литиевых батарей
Введение
Литиевые батареиисследуются как наиболее многообещающие аккумуляторы электроэнергии для электромобилей (ЭМ), которые имеют большие перспективы в устранении опасности при транспортировке в будущем.С другой стороны, они еще не смогли удовлетворить жесткие требования автомобилей к высокой плотности энергии, длительному сроку службы, отличной безопасности и широкому диапазону рабочих температур (G динаф и Ким, 2009; Котобуки, 2012).
Чтобы подготовить литиевые батареи к их крупномасштабному внедрению в электромобили, исследователи тщательно изучают все аспекты в элементе, который мог бы значительно повысить производительность элемента (например, новые электролиты, высокая плотность энергии и стабильные электродные материалы, высокая энергоемкость). производительность проводящих добавок / связующих / токоприемников и эффективная упаковка).Среди этих подходов электролит является ключом к успеху аккумуляторов электромобилей. Современные электролиты в основном состоят из солей лития и органических растворителей. Следовательно, они вызывают необратимые потери емкости в результате образования стабильной межфазной фазы твердого электролита (SEI), препятствуют увеличению срока службы, ограничивают температурный интервал и, не говоря уже о том, создают серьезные проблемы безопасности для литиевых батарей.
В этом отношении очень привлекательной является замена используемых в настоящее время органических жидких электролитов неорганическими твердыми электролитами (SE).Во-первых, неорганические СЭ — твердые материалы. Таким образом, они могут решить вышеупомянутые проблемы, связанные с потерями мощности, сроком службы, рабочими температурами, безопасностью и надежностью (Hayashi et al., 2012; Sahu et al., 2014). Кроме того, они обладают такими преимуществами, как простота конструкции, отсутствие утечек и загрязнения, лучшая устойчивость к ударам и вибрациям по сравнению с органическими жидкими электролитами (Thangadurai and Weppner, 2006b; Knauth, 2009; Fergus, 2010). Во-вторых, большинство неорганических СЭ являются одноионными проводниками.Литиевые одноионно-ионные проводники могут иметь передаточное число лития, равное единице. В результате внутри ячейки отсутствует градиент концентрации во время ее работы. Это очень полезно для снижения перенапряжения клеток (Quartarone and Mustarelli, 2011).
Кроме того, в связи с этими двумя важными особенностями остаются серьезные проблемы для создания высокопроизводительных SE. Один из них — как создать благоприятную границу раздела твердое тело-твердое тело между электродом и электролитом (Ohta et al., 2006, 2007; Sakuda et al., 2011). Другой — как получить высокую ионную проводимость при комнатной температуре, например, 10 −3 См см −1 .
В этом обзоре обсуждаются преимущества, а также эффективные способы решения вышеупомянутых проблем гранта. Первая часть посвящена кристаллическим электролитам, включая литий-ионные проводники типа LISICON и тио-LISICON, типа граната, типа перовскита и типа NASICON. Вторая часть посвящена электролитам на основе стекла, включая стеклообразные и стеклокерамические системы из оксидов и сульфидов.В таблице 1 перечислены важные материалы и их проводимость, а на рисунке 1 показаны графики Аррениуса для ионной проводимости некоторых выбранных SE.
Таблица 1 . Электропроводность неорганических СЭ для твердотельных литиевых батарей .
Рис. 1. Графики Аррениуса для ионной проводимости выбранных SE .
Кристаллические неорганические электролиты
LISICON и электролиты типа Thio-LISICON
СЭ типаLISICON обладают относительно низкой проводимостью при комнатной температуре (~ 10 -7 См · см -1 ), а Li 14 ZnGe 4 O 16 является его типичным представителем, впервые описанным Хонгом. (1978).Его один элемент из Li 2 + 2 x Zn 1− x GeO 4 система и может рассматриваться как Li 4 GeO 4 –Zn 2 GeO 4 твердое тело решение. На рис. 2 показана проекция структуры LISICON на плоскость a-b, каркас которой связан с кристаллической структурой γ-Li 3 PO 4 . Li 11 ZnGe 4 O 16 образует трехмерную (3D) каркасную структуру, и ионы лития в каркасе распределяются по двум узлам: 4c и 8d.Эти позиции заняты четырьмя и семью ионами Li + соответственно. Три оставшихся иона Li + расположены в интерстициальных узлах 4c и 4a, и их температурные коэффициенты аномально высоки, что указывает на их подвижность. Каждый сайт 4a связан с двумя сайтами 4c и наоборот. Узкими местами для транспортировки Li + между этими площадками являются параллелограммы, которые имеют угол наклона с плоскостью a-b. На основе расчета средний размер узких мест (4.38 Å) больше минимального размера, необходимого для транспорта Li + (2r Li + 2r o = 4,0 Å), что способствует перемещению Li + (Zheng et al., 2003).
Рис. 2. Проекция структуры LISICON на плоскость a-b . Воспроизведено с разрешения Hong (1978).
Хотя ионная проводимость Li 14 ZnGe 4 O 16 достигает 0.125 См см −1 при 300 ° C, это всего лишь 10 −7 См см −1 при комнатной температуре. Это объясняется захватом подвижных ионов Li + неподвижной подрешеткой при более низких температурах за счет образования комплексов дефектов (Robertson et al., 1997). Кроме того, Li 14 ZnGe 4 O 16 обладает высокой реакционной способностью по отношению к Li-металлу и атмосферному CO 2 , и проводимость со временем уменьшается (Thangadurai and Weppner, 2006b).
Недавние усилия по улучшению ионной проводимости СЭ типа LISICON сосредоточены на замене оксида серой в каркасе (рис. 3).Эти сульфидные SE называют тио-LISICON, который был введен Kanno et al. (2000).
Рис. 3. Структура Li 4 GeS 4 — родительская структура нового семейства тио-LISICON . Воспроизведено с разрешения Kanno et al. (2000).
Материальный дизайн неорганических СЭ основан на определенных структурных критериях: (i) подвижные ионы должны иметь достаточно большие пути проводимости в решетке, (ii) должна быть неупорядоченная подрешетка подвижных ионов и (iii) подвижные ионы с высокой поляризацией и анион подрешетки предпочтительнее (Канно, Мураяма, 2001).В свойствах ионной проводимости сильно доминируют размер и поляризуемость составляющих ионов или характер межузельной вакансии, вызванный замещениями.
Поскольку радиус S 2− больше, чем радиус O 2−, эта замена может значительно увеличить размер транспортных узких мест Li + . Кроме того, S 2- имеет лучшую поляризационную способность, чем O 2-, таким образом ослабляя взаимодействие между каркасом и ионами Li + .Следовательно, по сравнению с системами LISICON, материалы thio-LISICON могут достигать действительно высокой ионной проводимости (более 10 −4 См · см −1 при комнатной температуре). У Thio-LISICON SE также есть преимущества, такие как легкое снижение сопротивления границ зерен за счет обычного холодного прессования электролитных сил и предпочтительное применение в полностью твердотельных батареях из-за его механических свойств (Tatsumisago et al., 2013).
Впервые была синтезирована серия тио-ЛИЗИКОН и Li 3.25 Ge 0,25 P 0,75 S 4 показал высокую проводимость 2,2 × 10 −3 См · см −1 при комнатной температуре, пренебрежимо малую электронную проводимость, высокую электрохимическую стабильность и отсутствие фазового перехода вплоть до 500 ° C (Канно и Мураяма, 2001). Совсем недавно очень высокая проводимость 12 м См · см -1 (27 ° C) была достигнута с помощью Li 10 GeP 2 S 12 . Его кристаллическая структура отличалась от типичных структур тиолизикона.Как показано на рисунке 4A, он имел трехмерную каркасную структуру, состоящую из (Ge 0,5 P 0,5 ) тетраэдров S 4 , тетраэдров PS 4 , тетраэдров LiS 4 и октаэдров LiS 6 . Высокая ионная проводимость выиграла от путей трехмерной диффузии как вдоль оси c , так и в плоскости a-b (Kamaya et al., 2011).
Рисунок 4. (A) Кристаллическая структура Li 10 GeP 2 S 12 . (B) Кривые заряда-разряда твердотельной батареи с этим SE. Воспроизведено с разрешения Kamaya et al. (2011).
Кроме того, Bron et al. (2013) сообщили о синтезе Li 10 SnP 2 S 12 путем замены Ge на Sn, общая проводимость которого достигала 4 м См см -1 при комнатной температуре. Полностью твердотельный аккумулятор с Li 10 GeP 2 S 12 (катод: LiCoO 2 ; анод: металлический) продемонстрировал разрядную емкость более 120 мА (г) -1 и отличную кулоновскую эффективность около 100% после второго цикла, а также высокий потенциал разложения более 5 В (Рисунок 4B).
Электролиты гранатового типа
Литиевые одноионно-ионные проводники типа граната имеют общую формулу: Li 5 La 3 M 2 O 12 ( M = Ta, Nb). Впервые о них сообщили Тангадураи и Веппнер (2005a), а недавно они интенсивно изучались в качестве СЭ для полностью твердотельных литиевых батарей. Они обладают высокой ионной проводимостью и превосходной химической стабильностью при контакте с металлическим литием.
На рис. 5 показана кристаллическая структура Li 5 La 3 M 2 O 12 .La и M занимают восьми- и шестикоординированные позиции соответственно, а Li занимает октаэдрические позиции. Октаэдры MO 6 окружены шестью ионами лития и двумя вакансиями Li + в исходной структуре Li 5 La 3 M 2 O 12 . Следовательно, структура способствует ионной проводимости лития (Thangadurai and Weppner, 2005b).
Рис. 5. Кристаллическая структура материнского гранатоподобного Li 5 La 3 M 2 O 12 .Воспроизведено с разрешения Такады (2009 г.).
Среди исследованных материалов Li 6 BaLa 2 Ta 2 O 12 продемонстрировал высокую ионную проводимость 4 × 10 −5 См · см −1 при 22 ° C с энергией активации 38,5 кДж моль -1 . Он имел низкое сопротивление границ зерен, что означало, что общая и объемная проводимости были почти идентичными (Thangadurai and Weppner, 2005b).
Электропроводность может быть дополнительно улучшена посредством частичного замещения Y или In в позиции M в Li 5 La 3 M 2 O 12 .Например, Li 5,5 La 3 Nb 1,75 In 0,25 O 12 показал повышенную проводимость (1,8 × 10 −4 См · см −1 при 50 ° C) с низкой энергией активации. 49,1 кДж моль −1 (Thangadurai, Weppner, 2006a). Высокая проводимость 2,7 × 10 −4 См · см −1 при 25 ° C была получена для Li 5 + 2 x La 3 Nb 2− x Y x O 12 с x = 0.75 (Нараянан и др., 2012). Высокая проводимость Li + является результатом коротких расстояний Li + –Li + в октаэдрах LiO 6 с общими ребрами и высокой концентрации Li в октаэдрических узлах.
Недавно гранат типа Li 7 La 3 Zr 2 O 12 (LLZO) привлек много внимания с момента первого сообщения (Муруган и др., 2007). В структуре La расположен в центре додекаэдра с восемью координированными атомами кислорода, а Zr находится в центре октаэдра с шестикоординированными атомами кислорода (рис. 6).Ионы лития могут перемещаться внутри каркаса решетки граната с помощью механизма 3D-проводимости (Dumon et al., 2013).
Рис. 6. Кристаллографическая структура кубического LLZO . Воспроизведено с разрешения Dumon et al. (2013).
LLZO претерпевает фазовый переход от тетрагональной к кубической структуре при повышении температуры спекания, которые принадлежат пространственной группе Iad и I4 1 A / cd, соответственно.Проводимость кубической фазы (10 −4 См · см −1 , комнатная температура) примерно на два порядка выше, чем у тетрагональной фазы (Kokal et al., 2011; Tietz et al., 2013).
Таким образом, проблема заключалась в стабилизации кубической фазы, что может быть достигнуто путем легирования. Гейгер и др. (2011) впервые предположили, что Al может играть важную роль в стабилизации кубической фазы по сравнению с тетрагональной. Затем Düvel et al. (2012) подробно описали влияние включения Al на структурные и динамические свойства LLZO.Было высказано предположение, что при низких концентрациях Al ионы Al 3+ действуют как одновалентная легирующая примесь, заменяя три иона Li + . Однако с увеличением содержания Al ионы La 3+ и Zr 4+ постепенно замещались ионами Al. Замена La 3+ и Zr 4+ ионами Al 3+ стабилизировала кубическую фазу и сильно повлияла на соответствующую динамику ионов Li. Аналогичная стабилизация кубической фазы наблюдалась при замещении Ga и Ta.Аллен и др. (2012) недавно сообщили о Li 6,75 La 3 Zr 1,75 Ta 0,25 O 12 кубический гранат с относительно высокой общей проводимостью Li + (8,7 × 10 −4 См см −1 при 25 ° С).
Благодаря высокой ионной проводимости, отличной стабильности с литием и широкому диапазону электрохимических напряжений (Ishiguro et al., 2013; Jin and McGinn, 2013b), LLZO успешно использовался для производства полностью твердотельных литиевых батарей.Джин и Макгинн (2013a) сообщили о полностью твердотельном аккумуляторе Cu 0,1 V 2 O 5 / LLZO / Li, который показал начальную разрядную емкость 93 мА рт.ст. -1 при 10 мкА см −2 (при 50 ° С). Полная ячейка, состоящая из катода LiCoO 2 , Li 6,75 La 3 Zr 1,75 Nb 0,25 O 12 электролита и литий-металлического анода, показала стабильные характеристики цикла (рис. 7). Его разрядная емкость составляла 129 мА ч г -1 на 1-м цикле и 127 мА ч г -1 в 100-м цикле соответственно (Ohta et al., 2012).
Рис. 7. Кривые заряда-разряда для LiCoO 2 / Li 6,75 La 3 Zr 1,75 Nb 0,25 O 12 / Li-элемента . Воспроизведено с разрешения Ohta et al. (2012).
Электролиты перовскитного типа
Литий-лантан-титанаты, Li 3 x La (2/3) — x □ (1/3) −2 x TiO 3 (LLTO, 0 < х <0.16) со структурой перовскита (ABO 3 ), характеризуются высокой объемной проводимостью порядка 10 −3 См · см −1 при комнатной температуре (Bohnke, 2008).
LLTO состоит из смеси фаз, т. Е. Высокотемпературной фазы с кубической симметрией Pm 3 m (α-LLTO) и более низкотемпературной фазы β-LLTO с тетрагональной симметрией P 4/ мм . На рисунке 8 показана кристаллическая структура LLTO. Катионы A-узла, которые представляли собой Li + и La 3+ в кубической фазе α-LLTO, были распределены случайным образом, в то время как узлы A упорядоченного β-LLTO имели двойную структуру перовскита с чередующимся расположением Слои, богатые La и Li-вакансиями, вдоль оси c (Gao et al., 2013; Тераниши и др., 2013). Считается, что проводимость электролитов LLTO в основном определяется двумя факторами: размером узкого места и перколяцией места. Кристаллическая структура тетрагонального LLTO объясняет высокую проводимость Li + большой концентрацией вакансий в узле A, что обеспечивает движение ионов лития по вакансионному механизму и через квадратное плоское узкое место между узлами A, образованное четырьмя ионами O 2-. между двумя соседними участками A (Alonso et al., 2000).
СЭ на основеLLTO обладают множеством преимуществ, таких как литиевые одноионно-ионные проводники, незначительная электронная проводимость, высокая электрохимическая стабильность (> 8 В), стабильность в сухой и гидратированной атмосфере и стабильность в широком диапазоне температур от 4 K до 1600 K ( Бонке, 2008). Однако есть две основные проблемы для электролитов LLTO: относительно низкая проводимость границ зерен (<10 90 · 107 −5 90 · 108 См · см 90 · 107 -1 90 · 108) и нестабильность по отношению к металлическому аноду Li (Ban and Choi, 2001).
Таким образом, крайне важно повысить зернограничную проводимость LLTO-электролитов. Сообщалось, что введение диоксида кремния (Mei et al., 2010) и LLZO (Chen et al., 2012, 2013) могло изменить зернограничный слой LLTO, и общая ионная проводимость могла быть более 1 × 10 −4 и 1,2 × 10 −4 См см −1 при комнатной температуре соответственно. Высокая проводимость была также достигнута за счет легирования Al (Morata-Orrantia et al., 2003) или Nb (Teranishi et al., 2013), тогда как добавление Ag (Abhilash et al., 2013) приводило к снижению проводимости. Замена некоторого количества кислорода фтором не оказала существенного влияния на проводимость (Fergus, 2010). Кроме того, эффективное спекание для уменьшения границ зерен важно для улучшения общей проводимости (Vidal et al., 2014).
Другой проблемой, связанной с LLTO, является его нестабильность по отношению к металлическому аноду Li. Литий может быть интеркалирован в LLTO при потенциале ниже 1,7–1,8 В относительно Li (Chen and Amine, 2001), что вызывает восстановление Ti 4+ до Ti 3+ и индуцирует высокую электронную проводимость.Тем не менее, исследования химического замещения были мотивированы открытием новых применений соединений LLTO в будущих конфигурациях литий-ионных батарей: в качестве катодных покрытий (Qian et al., 2012) или сепараторов электролитов (Inaguma and Nakashima, 2013). Как показано на Рисунке 9, было подтверждено стабильное поведение разряда / заряда перезаряжаемого литиево-воздушного элемента с сепаратором LLTO.
Рис. 9. Кривая разряда литий-воздушной батареи с использованием LLTO в качестве сепаратора при различных токах .Воспроизведено с разрешения Инагумы и Накашимы (2013).
Электролиты типа NASICON
Термин NASICON, обозначающий суперионные проводники Na + , впервые был дан для фазы твердого раствора Na 1+ x Zr 2 Si x P 3− x O 12 , x = 2,0, обнаружено Хонгом (1976). Общая формула SE типа NASICON может быть описана как LiA 2 IV (PO 4 ) 3 (A IV = Ti, Zr, Ge, Hf).
В структуре октаэдры AO 6 связаны тетраэдрами PO 4 с образованием трехмерных взаимосвязанных каналов и двух типов межузельных положений (M ‘и M ″), в которых распределены подвижные катионы, как показано на рисунке 10. Подвижные катионы катионы перемещаются с одного сайта на другой через узкие места, размер которых зависит от природы скелетных ионов и от концентрации носителей в обоих типах сайтов (M ‘и M ″) (Cretin and Fabry, 1999).
Рисунок 10.Кристаллическая структура NASICON . Воспроизведено с разрешения Такады (2009 г.).
Среди LiA 2 IV (PO 4 ) 3 NASICON системы с Ti показали высокую проводимость Li + (около 10 −5 См · см −1 при комнатной температуре) ( Такада, 2009). Это можно объяснить тем, что ионный радиус Li + хорошо согласуется с размерами каркаса каркаса, который состоит из октаэдров TiO 6 .Были приложены большие усилия для максимизации ионной проводимости LiA 2 IV (PO 4 ) 3 систем, особенно LiTi 2 (PO 4 ) 3 . Увеличение проводимости наблюдалось, когда Ti 4+ был частично замещен Al 3+ в Li 1+ x Al x Ti 2- x (PO 4 ) 3 (LATP) (Key et al., 2012; Duluard et al., 2013; Morimoto et al., 2013), или когда P 5+ был заменен Si 4+ в Li 1+ x + y Al x Ti 2− x Si y P 3- y O 12 (Fu, 1997; Tan et al., 2012). Электропроводность была значительно увеличена до 3 × 10 −3 См · см −1 для Li 1,3 Al 0,3 Ti 1.7 (PO 4 ) 3 при комнатной температуре.
Благодаря отличной проводимости Li + и стабильности в воздухе и воде, SE на основе LiTi 2 (PO 4 ) 3 применялись в электрохимических энергетических устройствах, таких как твердотельные литиевые батареи. (Yada et al., 2009) и литий-воздушные вторичные батареи (Shimonishi et al., 2011). Кроме того, СЭ типа NASICON могут иметь высокое электрохимическое окислительное напряжение. Например, SE на основе LiGe 2 (PO 4 ) 3 , как сообщалось, демонстрируют высокое электрохимическое окислительное напряжение около 6 В (противLi / Li + ) (Xu et al., 2007), как показано на рисунке 11. Однако, как и в случае с LLTO, LiTi 2 (PO 4 ) 3 SE на основе нестабильны по отношению к металлическому Li, с восстановлением Ti 4+ до Ti 3+ (Hartmann et al., 2013).
Рис. 11. Циклическая вольтамперограмма LiGe 2 (PO 4 ) 3 ГЭ на основе . Воспроизведено с разрешения Xu et al. (2007).
Стеклянные неорганические электролиты
Стекловидные электролиты
Стекловидные электролиты привлекли большое внимание, главным образом, из-за их нескольких преимуществ по сравнению с кристаллическими материалами: изотропная ионная проводимость, отсутствие сопротивления границ зерен, простота изготовления пленки, широкий диапазон составов и т. Д.(Ravaine, 1980; Minami, 1987). Кроме того, ионная проводимость аморфных стекол обычно выше, чем у соответствующих кристаллических стекол из-за их так называемой открытой структуры (Tatsumisago, 2004), как показано на рисунке 12.
Рис. 12. Схема структуры стекла SiO 2 (A) и кристалла (B) .
Обычно литий-ионные проводящие стекла можно разделить на две категории: оксидные и сульфидные.Для большинства оксидных стекловидных электролитов литий-ионная проводимость при комнатной температуре слишком мала, чтобы быть практичной для высокоэнергетических батарей, обычно порядка 10 -6 ~ 10 -8 См · см -1 et al., 1987; Lee et al., 2002). В сульфидных стеклах высокая проводимость ионов лития 10 −3 ~ 10 −5 См см −1 при комнатной температуре может быть достигнута благодаря высокой поляризуемости ионов серы, таких как Li 2 S – SiS 2 и Li 2 S – P 2 S 5 (Machida and Shigematsu, 2004; Tatsumisago, 2004; Ohtomo et al., 2013c).
Однако эти электролиты из сульфидного стекла могут реагировать с окружающей влагой и выделять газ H 2 S (Knauth, 2009). Следовательно, обращение с сульфидными СЭ должно производиться в инертной атмосфере. Однако частичное замещение атомов серы на атомы кислорода в сульфидных электролитах может быть эффективным в подавлении образования газа H 2 S (Ohtomo et al., 2013b). Совсем недавно Hayashi et al. (2014) сообщили о составном электролите с 90 мол.% 75Li 2 S · 21P 2 S 5 · 4P 2 O 5 стекла и 10 мол.% ZnO путем механического измельчения.В работе частичная замена P 2 O 5 на P 2 S 5 , а также добавление ZnO снижали скорость образования H 2 S при воздействии воздуха. С другой стороны, проводимость уменьшалась при добавлении P 2 O 5 .
Для улучшения проводимости стеклообразных электролитов было предложено несколько подходов. Один из эффективных способов — смешать два разных вида анионов, так называемый «эффект смешанных анионов» или «эффект смешанных форм» (Tatsumisago et al., 1987; Raguenet et al., 2012). Например, добавление формирователя сети или модификатора SeO 2 в бинарный Li 2 O – B 2 O 3 стеклообразный электролит привело к увеличению ионной проводимости при комнатной температуре с 1,2 × 10 −8 до 8 × 10 −7 См см −1 (Lee et al., 2002). Добавление солей лития, таких как галогениды лития (Ujiie et al., 2012) и орто-оксосоли лития (Aotani et al., 1994), является еще одним эффективным способом повышения проводимости стеклообразных электролитов из-за увеличения концентрации лития и уменьшение энергии активации для проводимости.Например, литий-ионная проводимость стекла 67Li 2 S · 33P 2 S 5 при комнатной температуре может увеличиться с 10 −4 См см −1 до 10 −3 См см — 1 путем добавления 45 мол.% LiI (Mercier et al., 1981).
Однако увеличение количества модификаторов сетки с ионами лития способствует кристаллизации стекла. Таким образом, стекла с большим количеством ионов лития часто получают двухвалковой быстрой закалкой (Tatsumisago et al., 1981; Hayashi et al., 2002). Этот метод обеспечивает скорость охлаждения до 10 6 K S -1 (Tatsumisago and Hayashi, 2009) для предотвращения кристаллизации.
В полностью твердотельных батареях стекла необходимо измельчить в мелкие порошки с помощью методов механического измельчения (Morimoto et al., 1999), чтобы обеспечить хороший контакт с электродами. Механическое измельчение также является широко используемым методом для образования аморфных материалов (Hayashi et al., 2001; Ohtomo et al., 2013a, b).Он имеет два основных преимущества: процесс очень прост и синтез можно проводить при комнатной температуре.
Стеклокерамические электролиты
Стеклокерамический электролит может быть получен путем кристаллизации исходного стекла. Кристаллизация обычно снижает ионную проводимость, но осаждение суперионного проводящего кристалла из стекла-предшественника может повысить ионную проводимость. Границы зерен вокруг кристаллических доменов в стеклокерамике заполнены аморфными фазами.Таким образом, стеклокерамические электролиты обычно имеют более низкое сопротивление границ зерен, чем поликристаллические системы (Tatsumisago et al., 2013).
Как и стеклообразные электролиты, стеклокерамика также может быть разделена на оксиды и сульфиды. Для стеклокерамических оксидов наиболее изучены системы типа NASICON, такие как LATP (Fu, 1997b; Kotobuki, Koishi, 2013; Patil et al., 2013) и LAGP (Fu, 1997a; Nikolic et al., 2013). ; He et al., 2014) стеклокерамика. Их ионная проводимость при комнатной температуре может достигать 10 −3 ~ 10 −4 См см −1 .
Сульфидная стеклокерамика может иметь более высокую ионную проводимость, чем у оксидов, из-за большого ионного радиуса и большей поляризуемости ионов серы, чем у оксидных ионов. Например, проводимость стеклокерамики Li 2 S – P 2 S 5 может достигать 10 −3 См см −1 при комнатной температуре (Tatsumisago et al., 2002).
Суперионный кристалл со структурой, аналогичной структуре фаз тио-LISICON, может быть осажден механическим измельчением Li 2 S – P 2 S 5 стекол (Hayashi et al., 2003). Совсем недавно Seino et al. (2014) сообщили о стеклокерамическом проводнике Li 2 S – P 2 S 5 , который имел очень высокую ионную проводимость 1,7 × 10 –2 См см –1 при комнатной температуре за счет оптимизированного нагрева. лечение. Оптимизированные условия термообработки снизили сопротивление границ зерен и, таким образом, общая проводимость была в пять раз выше, чем сообщалось ранее для системы Li 2 S – P 2 S 5 (Mizuno et al., 2005). Как показано на рисунке 13, это предполагает, что процесс уплотнения увеличивает общую проводимость не за счет увеличения ионной проводимости в объеме, а за счет снижения сопротивления границ зерен.
Рис. 13. Температурная зависимость объемного и зернограничного сопротивлений стеклокерамического материала холодного прессования . Воспроизведено с разрешения Seino et al. (2014).
Заключительные замечания
Твердые электролиты рассматриваются как необходимый компонент для создания безопасных и высокопроизводительных литиевых батарей в будущем, что привлечет к себе пристальное внимание в этой области.Было приложено много усилий для улучшения их показателей.
Поскольку высокое сопротивление на границе раздела электрод / SE является одной из важнейших проблем при разработке мощных полностью твердотельных литиевых батарей, крайне важно создать благоприятный контакт между электродами и электролитом. Важно как достижение тесного контакта, так и увеличение площади контакта (Tatsumisago et al., 2013). Нанесение тонких пленок SE на активные материалы электродов рассматривается как эффективный способ.Например, тонкие пленки сульфидного электролита Li 2 S – GeS 2 с проводимостью 1,8 × 10 –4 См см –1 на частицах LiCoO 2 были получены методом импульсного лазерного осаждения (PLD) техники (Ito et al., 2013). На СЭМ-изображении поперечного сечения полученная тонкая пленка была плотной и прочно прикреплялась к подложке Si. Кроме того, другие методы, такие как приготовление нанокомпозитов с помощью процесса шаровой мельницы (Nagao et al., 2012) или использование переохлажденной жидкости стеклянного электролита (Kitaura et al., 2011), доказано, что они эффективны при формировании идеальной границы раздела между электродами и электролитом.
Что касается важной проводимости, системы, основанные на химическом составе серы, могут показать более высокий io
% PDF-1.7 % 1890 0 объект > endobj xref 1890 182 0000000044 00000 н. 0000005176 00000 н. 0000005507 00000 н. 0000005538 00000 п. 0000005613 00000 п. 0000006119 00000 п. 0000007583 00000 н. 0000009294 00000 н. 0000011038 00000 п. 0000011515 00000 п. 0000012034 00000 п. 0000012572 00000 п. 0000013040 00000 п. 0000014171 00000 п. 0000014494 00000 п. 0000014611 00000 п. 0000014734 00000 п. 0000015254 00000 п. 0000015395 00000 п. 0000015923 00000 п. 0000015966 00000 п. 0000036412 00000 п. 0000036543 00000 п. 0000037081 00000 п. 0000037788 00000 п. 0000038103 00000 п. 0000038231 00000 п. 0000038478 00000 п. 0000039207 00000 п. 0000039405 00000 п. 0000039702 00000 п. 0000039781 00000 п. 0000040004 00000 п. 0000040440 00000 п. 0000040878 00000 п. 0000041267 00000 п. 0000046366 00000 п. 0000047119 00000 п. 0000047682 00000 п. 0000054051 00000 п. 0000054513 00000 п. 0000054930 00000 п. 0000060550 00000 п. 0000060919 00000 п. 0000061190 00000 п. 0000062920 00000 н. 0000063092 00000 п. 0000063313 00000 п. 0000063517 00000 п. 0000099596 00000 н. 0000115467 00000 н. 0000164532 00000 н. 0000180142 00000 н. 0000187145 00000 н. 0000187239 00000 н. 0000187333 00000 н. 0000187426 00000 н. 0000187519 00000 н. 0000187611 00000 н. 0000187704 00000 н. 0000187796 00000 н. 0000187889 00000 н. 0000187981 00000 н. 0000188074 00000 н. 0000188168 00000 н. 0000188262 00000 н. 0000188354 00000 н. 0000188447 00000 н. 0000188541 00000 н. 0000188633 00000 н. 0000188726 00000 н. 0000188818 00000 н. 0000188911 00000 н. 0000189003 00000 н. 0000189096 00000 н. 0000189189 00000 н. 0000189281 00000 н. 0000189375 00000 н. 0000189468 00000 н. 0000189561 00000 н. 0000189653 00000 н. 0000189747 00000 н. 0000189840 00000 н. 0000189934 00000 н. 00001
00000 н. 0000100000 н. 00001 00000 н. 00001 00000 н. 00001 00000 н. 00001 00000 н. 00001 00000 н. 00001 00000 н. 00001 00000 н. 00001 00000 н. 00001
00000 н. 00001 00000 н. 0000191140 00000 н. 0000191233 00000 н. 0000191325 00000 н. 0000191417 00000 н. 0000191508 00000 н. 0000191601 00000 н. 0000191693 00000 н. 0000191786 00000 н. 0000191877 00000 н. 0000191969 00000 н. 0000192061 00000 н. 0000192152 00000 н. 0000192244 00000 н. 0000192335 00000 н. 0000192426 00000 н. 0000192516 00000 н. 0000192607 00000 н. 0000192698 00000 н. 0000192789 00000 н. 0000192883 00000 н. 0000192977 00000 н. 0000193071 00000 н. 0000193166 00000 н. 0000193260 00000 н. 0000193354 00000 н. 0000193449 00000 н. 0000193543 00000 н. 0000193637 00000 н. 0000193731 00000 н. 0000193825 00000 н. 0000194001 00000 н. 0000194156 00000 н. 0000194314 00000 н. 0000194473 00000 н. 0000194632 00000 н. 0000194791 00000 н. 0000194950 00000 н. 0000195165 00000 н. 0000195327 00000 н. 0000195481 00000 н. 0000195656 00000 н. 0000195835 00000 н. 0000196000 00000 н. 0000196172 00000 н. 0000196237 00000 н. 0000196492 00000 н. 0000196603 00000 н. 0000196739 00000 н. 0000196889 00000 н. 0000197075 00000 н. 0000197229 00000 н. 0000197431 00000 н. 0000197578 00000 н. 0000197713 00000 н. 0000197937 00000 н. 0000198084 00000 н. 0000198244 00000 н. 0000198408 00000 н. 0000198580 00000 н. 0000198748 00000 н. 0000198897 00000 н. 0000199192 00000 н. 0000199365 00000 н. 0000199515 00000 н. 0000199705 00000 н. 0000199832 00000 н. 0000199987 00000 н. 0000200160 00000 н. 0000200289 00000 н. 0000200461 00000 п. 0000200657 00000 н. 0000200819 00000 н. 0000200964 00000 н. 0000201107 00000 н. 0000201265 00000 н. 0000201416 00000 н. 0000201744 00000 н. 0000201865 00000 н. 0000202005 00000 н. 0000202157 00000 н. 0000202286 00000 н. 0000202618 00000 н. 0000202741 00000 н. 0000202852 00000 н. 0000203000 00000 н. 0000004000 00000 н. трейлер ] / Корень 1891 0 R >> startxref 0 %% EOF 2071 0 объект > поток x {LSWǿ`vFRl» WyK (hԨѨ˲8LFusMass — [? L [L ٹ m {- = 9; |? 6
Молекулярные выражения: электричество и магнетизм: щелочная батарея
Щелочно-марганцевая батарея
Щелочная батарея получила свое название, потому что она содержит щелочной электролит гидроксида калия.
Как показано на Рисунке 1, контейнер батареи представляет собой цилиндрический стальной корпус и служит токоприемником. Катод из диоксида марганца и углерода представляет собой полый цилиндр внутри банки, расположенный очень близко к поверхности банки. Внутри полого катода расположены разделительные кольца, расположенные послойно, а внутри разделительных колец находится анод. Батарея имеет металлическую или пластиковую оболочку, а также крышки снизу и сверху, чтобы помочь контролировать полярность в приложениях.
Общая информацияБатарея из щелочно-диоксида марганца была представлена в начале 1960-х годов и до сих пор занимает сильные позиции на рынке батарей. Теоретически элементы из щелочного диоксида марганца обладают большей емкостью, чем элементы Leclanche или углеродно-цинковые элементы аналогичного размера. Это связано с более высокой чистотой и активностью диоксида марганца, плотным катодом с небольшим количеством электролита и эффективным расположением компонентов. Напряжение для этой батареи начинается выше 1.5 вольт, которое постепенно уменьшается при разряде. Кроме того, аккумулятор может работать при температуре до 55 градусов Цельсия.
Эволюция современной щелочно-двуокиси марганца батареиЩелочная система имеет много преимуществ перед конкурирующими батареями Leclanche или угольно-цинковыми батареями. Щелочные батареи бывают двух видов: большие цилиндрические элементы или миниатюрные элементы, напоминающие кнопки. С момента своего основания щелочная система претерпела множество изменений.Во-первых, он начал использовать гелеобразный и амальгамированный анод из цинкового порошка в отсеке в его центре, в то же время применяя вентилируемые пластиковые уплотнения. Металлическая отделка стыкового шва позволила увеличить внутренний объем батареи. Кроме того, использование органических ингибиторов помогло решить проблемы вздутия и утечки, а снижение содержания ртути помогло сделать аккумулятор еще более эффективным и экологически безопасным. Сегодняшняя версия на 60% мощнее оригинальной щелочной батареи, представленной в начале 1960-х годов.
ХимияБатарея из щелочно-диоксида марганца содержит диоксид марганца и водный щелочной электролит, полученный электролитическим способом, а также металлический цинк в виде порошка. Электролитический диоксид марганца более чистый, чем диоксид марганца стандартного реагента, и имеет большую реакционную способность. Электролит едкий и, следовательно, снижает скорость выделения водорода.
Катод состоит из смеси диоксида марганца и углерода.Также могут быть добавлены связующие, а также раствор электролита или вода, чтобы помочь построить катод. Диоксид марганца вызывает окисление. Углерод используется в катоде, потому что диоксид марганца сам по себе не является хорошим проводником. Часто уголь находится в форме графитовой или ацетиленовой сажи, а анод содержит порошок цинка, который очень чистый из-за перегонки или гальваники из водного раствора. Порошок образуется распылением. Желирующие агенты обычно представляют собой крахмал, полиакрилаты или сополимеры этилен-малеинового ангидрида.Сепараторы должны обладать ионной проводимостью и в то же время изолирующими, и должны быть стабильными во время окисления и восстановления. Контейнер аккумулятора никак не способствует разрядке и обычно делается из стали.
НАЗАД В ДОМАШНЮЮ БАТАРЕЮ
Вопросы или комментарии? Отправить нам письмо.
© 1995-2019, автор — Майкл В. Дэвидсон и Государственный университет Флориды. Все права защищены.Никакие изображения, графика, программное обеспечение, сценарии или апплеты не могут быть воспроизведены или использованы каким-либо образом без разрешения правообладателей. Использование этого веб-сайта означает, что вы соглашаетесь со всеми юридическими положениями и условиями, изложенными владельцами.
Этот веб-сайт поддерживается нашим
Команда разработчиков графики и веб-программирования
в сотрудничестве с оптической микроскопией в Национальной лаборатории сильного магнитного поля
.
Последнее изменение: пятница, 13 ноября 2015 г., 13:19
Счетчик доступа с 1 июня 1999 г .: 104450
Щелочной электрод
FuelCellStore с гордостью представляет свои новейшие продукты со щелочными электродами как часть своей категории электродов.Мы выслушали ваши комментарии и запросы и, наконец, изготовили первые в своем роде электроды для ваших нужд.
Электрохимические устройства (топливные элементы, электролизеры, батареи и т. Д.) Бывают самых разных химикатов, таких как кислотные, щелочные, твердые оксиды и т. Д. Компоненты, используемые в конкретном электрохимическом устройстве, должны соответствовать этому химическому составу. Большинство щелочных электрохимических устройств (таких как топливные элементы или электролизеры с анионообменной мембраной, обычные щелочные топливные элементы или электролизеры, первичные или вторичные щелочные батареи и т. Д.)) работают на основе принципа проведения гидроксильных или карбонатных ионов (или других анионных частиц). При этом мембрана и каталитические электроды, используемые для этих применений, также должны эффективно проводить соответствующие анионные частицы. Например, если ваше приложение представляет собой приложение для топливных элементов, и анионные частицы, которые переносятся, представляют собой ионы гидроксида (ОН-) между анодным и катодным отсеками, то выбранная мембрана, анодный электрод (в частности, относится к газодиффузионному слою, нанесенному на катализатор) и катодный электрод (в частности, относящийся к газодиффузионному слою с нанесенным катализатором) в этом оборудовании топливного элемента также должен очень эффективно проводить ионы гидроксида.Этот же принцип действует для всех других электрохимических устройств. Наши щелочные электроды новейшего поколения были созданы с учетом этого научного принципа.
Ионное сопротивление на границах раздела «анодный катализатор и поверхность мембраны» и «катодный катализатор и поверхность мембраны» всегда будет приводить к более низким электрохимическим характеристикам. Несоответствие на границе раздела фаз мембраны и катализатора, например, при использовании катализированного электрода, содержащего иономер Нафион, с анионообменной мембраной, может снизить электрохимические характеристики до 90% или наоборот.Наши новейшие щелочные электроды специально разработаны для этой цели и обеспечивают отличную проводимость гидроксид-ионов для любого типа топливного элемента с анионообменной мембраной, щелочного топливного элемента или щелочных батарей. Если анион в вашей электрохимической установке отличается от гидроксида, вы все равно можете использовать эти щелочные электроды, потому что они эффективно переносят другие анионы, такие как хлорид, бромид и т. Д., И это лишь некоторые из них.
Наши щелочные электроды новейшего поколения производятся с использованием анионообменного иономера с правильным соотношением катализатор / иономер.Мы предоставляем три различных газодиффузионных слоя, которые позволят вам проводить эксперименты с жидким электролитом или без него или без него (в частности, это относится к щелочным растворам, используемым в обычных щелочных электрохимических устройствах). Если вам нужен другой газодиффузионный слой, мы будем более чем рады помочь вам и в этом. Кроме того, мы поставляем наши щелочные электроды с двумя различными материалами катализатора.
Электроды с низкой загрузкой катализатора (равные или меньшие 0.5 мг / см2) разработаны для чувствительных к стоимости приложений и подходят для электрохимических систем, требующих небольших количеств катализатора для поддержки анодных или катодных реакций.
Электроды для промежуточной загрузки катализатора (от 1 мг / см2 до 4 мг / см2) разработаны для обеспечения высокой производительности и обычно используются в приложениях, где важны производительность и эффективность. Эти щелочные электроды также обеспечивают достаточный срок службы для вашего применения.
Электроды с высокой загрузкой катализатора (более 4 мг / см2) разработаны для сверхвысокой производительности и обычно используются в приложениях, где критически важны производительность, эффективность и сверхдлительный срок службы.
Каковы основные компоненты щелочной батареи?
Для каждой батареи требуется два электрода — анод и катод — и электролит. Электроны текут между электродами вне батареи и через электролит внутри нее. Замкнутый контур, создаваемый этими двумя электронными потоками, использует химическую энергию электролита и вырабатывает электрическую энергию в процессе. Этот процесс одинаков, происходит ли он в щелочной батарее или в угольно-цинковой батарее.
Щелочные батареи.В щелочной батарее анод или отрицательный электрод батареи изготовлен из цинкового порошка. Цинк используется в виде порошка, потому что гранулы имеют большую площадь поверхности, что обеспечивает повышенную скорость реакции и более высокие потоки электронов.Иногда добавляют оксид цинка, чтобы ограничить коррозию анода.
Гидроксид калия внутри щелочных батарей может вызвать раздражение глаз.Диоксид марганца используется в качестве катода или положительного электрода.Он встречается в природе в виде минерального пиролюзита и обычно также используется в виде порошка. В катод также добавлен графит для улучшения его проводимости.
В щелочных батареях используется цинк-марганцевая формула.Гидроксид калия используется в качестве электролита в щелочной батарее, а не хлорид аммония или хлорид цинка — электролиты, обычно используемые в углеродно-цинковых батареях. Это соединение также известно как едкий калий или калийный щелок. Хотя щелочные батареи находятся внутри корпуса, они все же могут выделять гидроксид калия, который, как известно, вызывает раздражение глаз и кожи.
Дополнительно в аккумулятор входит сепаратор . Этот компонент служит для разделения электролита между положительным и отрицательным электродами.
По сравнению с угольно-цинковой батареей, ее основным конкурентом, щелочная батарея имеет более высокую плотность энергии, а также более длительный срок хранения.Однако он имеет высокое внутреннее сопротивление. Чем быстрее разрядится аккумулятор, тем меньше емкость или нагрузка, с которой он может справиться.
Существует множество подзаряжаемых щелочных батарей. По химическому составу они такие же, как и любые другие щелочные батареи, но могут удерживать заряд гораздо дольше, чем другие разновидности нещелочных перезаряжаемых батарей.Также есть утверждения, что можно заряжать обычную батарею при очень определенных условиях, но это считается опасным.
Гидроксид калия, вытекающий из щелочных батарей, может вызвать раздражение глаз. .
 .. +35
.. +35 е. с добавкой едкого лития
е. с добавкой едкого лития