Таблица удельных теплоемкостей | Calculators.vip
Удельная теплоемкость газов
| Газ | Удельная теплоемкость cp кДж/(кг*°C) | Газовая постоянная, R (кДж кг−1К−1) | Молекулярная масса, М |
|---|---|---|---|
| Воздух | 1.005 | 0.2871 | 28.96 |
| Аммиак | 2.191 | 0.528 | 15.75 |
| Аргон | 0.5234 | 0.2081 | 40 |
| Бутан | 1.68 | 0.17 | 58 |
| Углекислый газ | 0.8457 | 0.1889 | 44 |
| Окись углерода | 1.041 | 0.2968 | 28 |
| Хлор | 0.511 | 0.128 | 65 |
| Этан | 1.7668 | 0.2765 | 30 |
| Гелий | 5.234 | 2.077 | 4 |
| Водород | 14.323 | 4.124 | 2 |
| Хлористый водород | 0.813 | 0. 230 230 | 36.15 |
| Метан | 2.2316 | 0.5183 | 16 |
| Азот | 1.040 | 0.2968 | 28 |
| Закись азота | 0.928 | 0.220 | 37.8 |
| Кислород | 0.9182 | 0.2598 | 32 |
| Пропан | 1.6915 | 0.1886 | 44 |
| Диоксид серы | 0.6448 | 0.1298 | 64 |
Удельная теплоемкость твердых веществ
| Твердое состояние | Удельная теплоемкость cp кДж/(кг*°C) |
|---|---|
| Алюминий | 0.897 |
| Бронза алюминиевая | 0.420 |
| Бронза оловянистая | 0.380 |
| Вольфрам | 0.134 |
| Дюралюминий | 0.880 |
| Железо | 0.452 |
| Золото | 0.129 |
| Константан | 0. 410 410 |
| Латунь | 0.378 |
| Манганин | 0.420 |
| Медь | 0.383 |
| Никель | 0.443 |
| Нихром | 0.460 |
| Олово | 0.228 |
| Платина | 0.133 |
| Ртуть | 0.139 |
| Свинец | 0.128 |
| Серебро | 0.235 |
| Сталь стержневая арматурная | 0.482 |
| Сталь углеродистая | 0.468 |
| Сталь хромистая | 0.460 |
| Титан | 0.520 |
| Уран | 0.116 |
| Цинк | 0.385 |
| Чугун белый | 0.540 |
Удельная теплоемкость жидких веществ
| Жидкости | Удельная теплоемкость cp кДж/(кг*°C) |
|---|---|
| Ацетон | 2,22 |
| Бензин | 2,09 |
| Бензол (10°С) | 1,42 |
| Бензол (40°С) | 1,77 |
| Вода чистая (0°С) | 4,218 |
| Вода чистая (10°С) | 4,192 |
| Вода чистая (20°С) | 4,182 |
| Вода чистая (40°С) | 4,178 |
| Вода чистая (60°С) | 4,184 |
| Вода чистая (80°С) | 4,196 |
| Вода чистая (100°С) | 4,216 |
| Глицерин | 2,43 |
| Гудрон | 2,09 |
| Деготь каменноугольный | 2,09 |
| Дифенил | 2,13 |
| Довтерм | 1,55 |
| Керосин бытовой | 1,88 |
| Керосин бытовой (100°С) | 2,01 |
| Керосин тяжелый | 2,09 |
| Кислота азотная 100%-я | 3,1 |
| Кислота серная 100%-я | 1,34 |
| Кислота соляная 17%-я | 1,93 |
| Кислота угольная (-190°С) | 0,88 |
| Клей столярный | 4,19 |
| Масло минеральное | 1,67…2,01 |
| Масло смазочное | 1,67 |
| Метиленхлорид | 1,13 |
| Метил хлорид | 1,59 |
| Морская вода (18°С) | 4,1 |
| 0,5% соли | 4,1 |
| 3% соли | 3,93 |
| 6% соли | 3,78 |
| Нефть | 0,88 |
| Нитробензол | 1,47 |
| Парафин жидкий | 2,13 |
| Рассол (-10°С) | |
| 20% соли | 3,06 |
| 30% соли | 2,64…2,72 |
| Ртуть | 0,138 |
| Скипидар | 1,8 |
| Спирт метиловый (метанол) | 2,47 |
| Спирт нашатырный | 4,73 |
| Спирт этиловый (этанол) | 2,39 |
| Толуол | янв. 72 72 |
| Трихлорэтилен | 0,93 |
| Хлороформ | 1 |
| Этиленгликоль | 2,3 |
| Эфир кремниевой кислоты | 1,47 |
Теплоемкость строительных материалов
| Строительные материалы | Удельная теплоемкость cp кДж/(кг*°C) |
|---|---|
| Асфальт | 0.920 |
| Кирпич | 0.840 |
| Бетон | 0.880 |
| Стекло, кремнезем | 0.840 |
| Стекло, коронка | 0.670 |
| Стекло, кремень | 0.503 |
| Стекло боро силикатное | 0.753 |
| Гранит | 0.790 |
| Гипс | 1.090 |
| Мрамор, слюда | 0.880 |
| Песок | 0.835 |
| Почва | 0.800 |
| Дерево | 1.7 (1.2 — 2.9) |
Раздел недели: Скоропись физического, математического, химического и, в целом, научного текста, математические обозначения. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Поиск на сайте DPVA Поставщики оборудования Полезные ссылки О проекте Обратная связь Ответы на вопросы. Оглавление Таблицы DPVA.ru — Инженерный Справочник | Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация/ / Физический справочник / / Тепловые величины: теплоемкость, теплопроводность, температуры кипения, плавления, пламени. Удельные теплоты сгорания и парообразования. Термические константы. Коэффициенты теплообмнена и расширения Поделиться:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
Коды баннеров проекта DPVA. Консультации и техническая | Проект является некоммерческим. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Владельцы сайта www.dpva.ru не несут никакой ответственности за риски, связанные с использованием информации, полученной с этого интернет-ресурса. Free xml sitemap generator | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
Удельная теплоемкость обычных газов при различных температурах
Связанные ресурсы: термодинамика
Удельная теплоемкость обычных газов при различных температурах
Термодинамика Связанные ресурсы
Удельная теплоемкость – это количество тепла, необходимое для повышения температуры одного грамма масса на 1 кельвин. Теплоемкость — экстенсивное свойство материи, то есть она пропорциональна размеру системы.
Удельная теплоемкость идеальных газов различных обычных газов при различных температурах
Температура, К | с р | с в | к | с р | с | к | с р | с в | к | ||||
Воздух | Углекислый газ, CO 2 | Окись углерода, CO | |||||||||||
250 | 1,003 | 0,716 | 1. | 0,791 | 0,602 | 1.314 | 1.039 | 0,743 | 1.400 | ||||
300 | 1,005 | 0,718 | 1.400 | 0,846 | 0,657 | 1,288 | 1.040 | 0,744 | 1,399 | ||||
350 | 1,008 | 0,721 | 1,398 | 0,895 | 0,706 | 1,268 | 1,043 | 0,746 | 1,398 | ||||
400 | 1,013 | 0,726 | 1,395 | 0,939 | 0,750 | 1,252 | 1,047 | 0,751 | 1,395 | ||||
450 | 1,020 | 0,733 | 1,391 | 0,978 | 0,790 | 1,239 | 1,054 | 0,757 | 1,392 | ||||
500 | 1,029 | 0,742 | 1,387 | 1. | 0,825 | 1,229 | 1,063 | 0,767 | 1,387 | ||||
550 | 1.040 | 0,753 | 1.381 | 1,046 | 0,857 | 1.220 | 1,075 | 0,778 | 1,382 | ||||
600 | 1.051 | 0,764 | 1,376 | 1,075 | 0,886 | 1.213 | 1.087 | 0,790 | 1,376 | ||||
650 | 1,063 | 0,776 | 1. | 1.102 | 0,913 | 1.207 | 1.100 | 0,803 | 1.370 | ||||
700 | 1,075 | 0,788 | 1,364 | 1.126 | 0,937 | 1.202 | 1.113 | 0,816 | 1,364 | ||||
750 | 1.087 | 0,800 | 1,359 | 1.148 | 0,959 | 1,197 | 1.126 | 0,829 | 1,358 | ||||
800 | 1,099 | 0,812 | 1,354 | 1,169 | 0,980 | 1,193 | 1. | 0,842 | 1,353 | ||||
900 | 1,121 | 0,834 | 1,344 | 1.204 | 1,015 | 1,186 | 1,163 | 0,866 | 1,343 | ||||
1000 | 1.142 | 0,855 | 1,336 | 1,234 | 1,045 | 1.181 | 1,185 | 0,888 | 1,335 | ||||
Температура, К | Водород, H 2 | Азот, N 2 | Кислород, O 2 | ||||||||||
250 | 14. | 9,927 | 1.416 | 1,039 | 0,742 | 1.400 | 0,913 | 0,653 | 1,398 | ||||
300 | 14.307 | 10.183 | 1.405 | 1,039 | 0,743 | 1.400 | 0,918 | 0,658 | 1,395 | ||||
350 | 14.427 | 10.302 | 1.400 | 1.041 | 0,744 | 1,399 | 0,928 | 0,668 | 1,389 | ||||
400 | 14. | 10.352 | 1,398 | 1,044 | 0,747 | 1,397 | 0,941 | 0,681 | 1,382 | ||||
450 | 14.501 | 10.377 | 1,398 | 1,049 | 0,752 | 1,395 | 0,956 | 0,696 | 1,373 | ||||
500 | 14.513 | 10.389 | 1,397 | 1,056 | 0,759 | 1,391 | 0,972 | 0,712 | 1,365 | ||||
550 | 14. | 10.405 | 1,396 | 1,065 | 0,768 | 1,387 | 0,988 | 0,728 | 1,358 | ||||
600 | 14.546 | 10.422 | 1,396 | 1,075 | 0,778 | 1.382 | 1,003 | 0,743 | 1.350 | ||||
650 | 14.571 | 10.447 | 1,395 | 1.086 | 0,789 | 1,376 | 1,017 | 0,758 | 1,343 | ||||
700 | 14. | 10.480 | 1,394 | 1,098 | 0,801 | 1,371 | 1.031 | 0,771 | 1,337 | ||||
750 | 14.645 | 10.521 | 1,392 | 1.110 | 0,813 | 1,365 | 1,043 | 0,783 | 1.332 | ||||
800 | 14.695 | 10.570 | 1.390 | 1.121 | 0,825 | 1.360 | 1,054 | 0,794 | 1,327 | ||||
900 | 14. | 10.698 | 1,385 | 1,145 | 0,849 | 1,349 | 1,074 | 0,814 | 1,319 | ||||
1000 | 14,983 | 10.859 | 1.380 | 1,167 | 0,870 | 1.341 | 1.090 | 0,830 | 1.313 | ||||
Источник: Кеннет Уорк, Термодинамика, 4-е изд. (Нью-Йорк: McGraw-Hill, 1983), с. 783, Таблица А–4М.
3.3: Теплоемкость — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 41414
Обратим внимание с макроскопического на микроскопический уровень. Согласно первому закону термодинамики тепловая энергия, поглощаемая при повышении температуры вещества, не может быть уничтожена. Но куда он идет? В случае одноатомного газа, такого как неон, на этот вопрос легко ответить. Вся поглощенная энергия преобразуется в кинетическую энергию молекул (атомов) неона. В других разделах мы нашли, что кинетическая энергия молекул в образце газа дается выражением 91 to T 2 , the kinetic energy of the molecules increases from 3 / 2 nRT 1 to 3 / 2 nRT 2 , a total change of
Согласно первому закону термодинамики тепловая энергия, поглощаемая при повышении температуры вещества, не может быть уничтожена. Но куда он идет? В случае одноатомного газа, такого как неон, на этот вопрос легко ответить. Вся поглощенная энергия преобразуется в кинетическую энергию молекул (атомов) неона. В других разделах мы нашли, что кинетическая энергия молекул в образце газа дается выражением 91 to T 2 , the kinetic energy of the molecules increases from 3 / 2 nRT 1 to 3 / 2 nRT 2 , a total change of
\[\tfrac{3}{2}nR\влево( T_{2}-T_{1}\вправо) =\влево( \tfrac{3}{2}R\вправо) n\влево( T_{2} -T_{1}\справа)\номер\]
Подставляя значение R в соответствующих единицах, получаем
\begin{matrix}\frac{3}{2}\left(8.314\frac{\text{J}}{\text{K mol}}\right)n\left(T_{2}-T_{1} \right)=\left(12. 47\frac{\text{J}}{\text{K mol}}\right)n\left(T_{2}-T_{1}\right)\end{matrix}
47\frac{\text{J}}{\text{K mol}}\right)n\left(T_{2}-T_{1}\right)\end{matrix}
Это та же самая величина, которая получается путем подстановки экспериментального значения C V для неона (рассчитанного в примере 2 из теплоемкости) в уравнение. (4) от теплоемкости. Другими словами, количество теплоты, найденное экспериментально, точно соответствует увеличению кинетической энергии молекул, требуемому кинетической теорией газов.
В таблице \(\PageIndex{1}\) перечислены значения C V не только для неона, но и для некоторых других газов. Мы сразу замечаем, что только благородные газы и другие одноатомные газы, такие как Hg и Na, имеют молярную теплоемкость, равную 3 / 2 Р , или 12,47 Дж К –1 моль –1 . Все другие газы имеют более высокую молярную теплоемкость, чем этот. При этом, как видно из таблицы, чем сложнее молекула, тем выше молярная теплоемкость газа. У такого поведения есть простая причина.
| Газ | C v /J K -1 моль -1 | Газ | C v /J K -1 моль -1 |
|---|---|---|---|
| Одноатомные газы | Трехатомные газы | ||
| Не | 12.47 | СО 2 | 28,81 |
| Ар | 12. 47 47 | Н 2 О | 30,50 |
| рт.ст. | 12,47 (700К) | СО 2 | 31,56 |
| Нет данных | 12,47 (1200К) | ||
| Двухатомные газы | Алканы | ||
| Н 2 | 20,81 | СН 4 | 27.42 |
| О 2 | 21.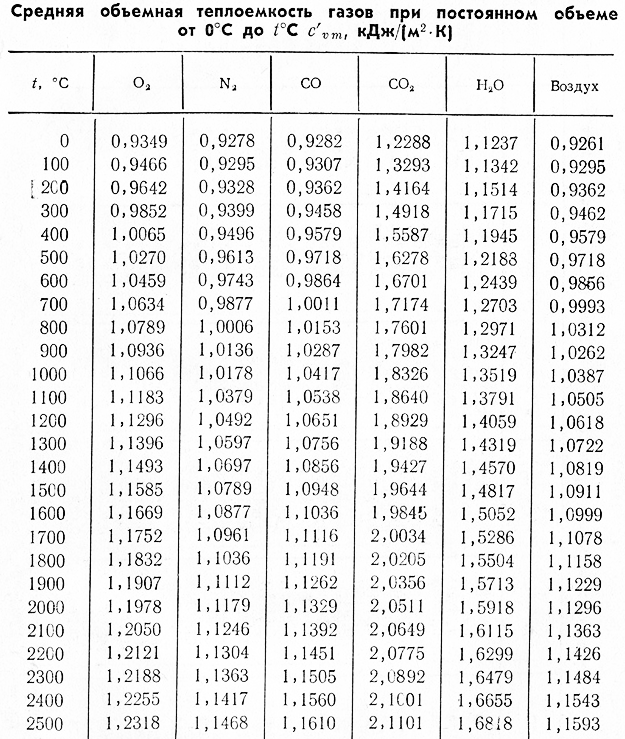 06 06 | С 2 Н 6 | 44,32 |
| Класс 2 | 25,62 | С 3 Н 8 | 65,20 |
| С 4 Н 10 | 89,94 | ||
Молекула, состоящая из двух или более атомов, не только способна перемещаться из одного места в другое ( поступательное движение ), она также может вращаться вокруг себя, а также изменять свою форму, вибрируя . Когда мы нагреваем моль молекул Cl 2 , например, нам нужно не только снабдить их достаточным количеством энергии, чтобы заставить их двигаться быстрее (увеличить их поступательную кинетическую энергию), мы также должны предоставить дополнительное количество энергии, чтобы заставить их двигаться быстрее. они вращаются и вибрируют сильнее, чем раньше. Для моля более сложных молекул, таких как n -бутан требует еще больше энергии, так как молекула способна изменять свою форму всевозможными способами. В молекуле бутана имеется три связи С—С, вокруг которых могут свободно вращаться сегменты молекулы. Все связи могут изгибаться или растягиваться, а вся молекула может вращаться. Такая молекула постоянно изгибается и корчится при комнатной температуре. Когда мы повышаем температуру, этот вид движения происходит быстрее, и для того, чтобы это стало возможным, необходимо поглощать дополнительную энергию.
они вращаются и вибрируют сильнее, чем раньше. Для моля более сложных молекул, таких как n -бутан требует еще больше энергии, так как молекула способна изменять свою форму всевозможными способами. В молекуле бутана имеется три связи С—С, вокруг которых могут свободно вращаться сегменты молекулы. Все связи могут изгибаться или растягиваться, а вся молекула может вращаться. Такая молекула постоянно изгибается и корчится при комнатной температуре. Когда мы повышаем температуру, этот вид движения происходит быстрее, и для того, чтобы это стало возможным, необходимо поглощать дополнительную энергию.
Когда мы нагреваем твердые тела и жидкости, ситуация несколько иная, чем для газов. Быстрое увеличение давления пара с температурой делает практически невозможным нагревание твердого тела или жидкости в закрытом сосуде, поэтому теплоемкость всегда измеряется при постоянном давлении, а не при постоянном объеме. В таблице \(\PageIndex{2}\) приведены некоторые значения температуры плавления для отдельных простых жидкостей и твердых тел. Как правило, теплоемкость твердых тел и жидкостей выше, чем у газов. Это происходит из-за межмолекулярных сил, действующих в твердых телах и жидкостях. Когда мы нагреваем твердые тела и жидкости, нам необходимо снабжать их потенциальной энергией, а также кинетической энергией. Среди твердых тел легче всего объяснить теплоемкость металлов, поскольку твердое тело состоит из отдельных атомов. Каждый атом может вибрировать только в трех измерениях. Согласно теории, впервые предложенной Эйнштейном, эта колебательная энергия имеет значение 3 RT , а теплоемкость 3 R = 24,9 Дж К –1 моль –1 .
Как правило, теплоемкость твердых тел и жидкостей выше, чем у газов. Это происходит из-за межмолекулярных сил, действующих в твердых телах и жидкостях. Когда мы нагреваем твердые тела и жидкости, нам необходимо снабжать их потенциальной энергией, а также кинетической энергией. Среди твердых тел легче всего объяснить теплоемкость металлов, поскольку твердое тело состоит из отдельных атомов. Каждый атом может вибрировать только в трех измерениях. Согласно теории, впервые предложенной Эйнштейном, эта колебательная энергия имеет значение 3 RT , а теплоемкость 3 R = 24,9 Дж К –1 моль –1 .
| Вещество | C p (твердый)/J K -1 моль -1 | С стр. (жидкость)/J K -1 моль -1 (жидкость)/J K -1 моль -1 |
|---|---|---|
| Одноатомные вещества | ||
| рт.ст. | 27,28 | 27,98 |
| Пб | 29.40 | 30,33 |
| Нет данных | 28.20 | 31,51 |
| Двухатомные вещества | ||
| Бр 2 | 53,8 | 75,7 |
| I 2 | 54,5 | 80,7 |
| HCl | 50,5 | 62,2 |
| Привет | 47,5 | 68,6 |
| Многоатомные вещества | ||
| Н 2 О | 37,9 | 76,0 |
| НХ 3 | 49,0 | 77,0 |
| Бензол | 129,0 | 131,0 |
| н-гептан | 146,0 | 203,1 |
Как видно из таблицы, для большинства одноатомных твердых тел значения C p несколько выше этого значения. Это связано с тем, что твердые тела слегка расширяются при нагревании. Атомы отдаляются друг от друга и, таким образом, увеличиваются как потенциал, так и колебательная энергия.
Это связано с тем, что твердые тела слегка расширяются при нагревании. Атомы отдаляются друг от друга и, таким образом, увеличиваются как потенциал, так и колебательная энергия.
Твердые тела, которые содержат молекулы, а не атомы, обладают гораздо большей теплоемкостью, чем 3 R . В дополнение к колебанию всей молекулы вокруг своего места в кристаллической решетке отдельные атомы могут также колебаться относительно друг друга. Иногда молекулы могут вращаться в кристалле, но обычно вращение возможно только при плавлении твердого тела. Как видно из значений молекулярных жидкостей в таблице \(\PageIndex{2}\), эта внезапная способность вращаться вызывает резкое увеличение теплоемкости. Для одноатомных веществ, где нет движения, соответствующего вращению атомов друг вокруг друга, теплоемкость жидкости лишь очень немного выше теплоемкости твердого тела.
3.3: Heat Capacities распространяется под лицензией CC BY-NC-SA 4.0, автором, ремиксом и/или куратором является LibreTexts.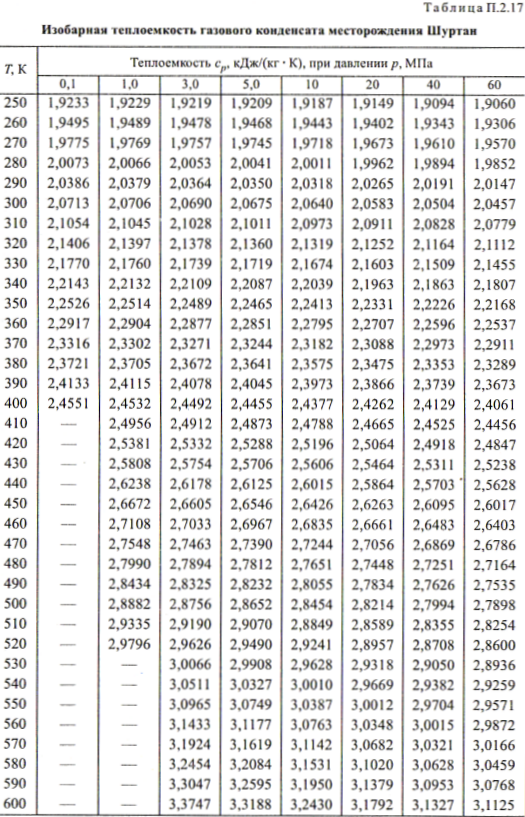

 Математический, Физический алфавит, Научный алфавит.
Математический, Физический алфавит, Научный алфавит.
 С допустимым приближением данными таблицы можно пользоваться и при давлениях порядка нескольких атм.
С допустимым приближением данными таблицы можно пользоваться и при давлениях порядка нескольких атм. ru
ru 401
401 014
014 370
370 139
139 051
051 476
476 530
530 604
604 822
822