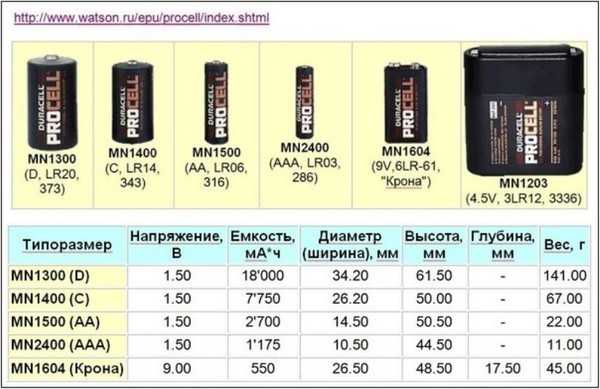
Таблица веса аккумуляторов в зависимости от мощности
Существуют разные причины и поводы поинтересоваться тем, сколько же может весить аккумуляторная батарея. Тут речь пойдёт именно о свинцово-кислотных АКБ, которые изготавливаются по различным технологиям.
Пока доминируют батареи, в которых электролит представлен в виде жидкости прозрачного цвета, состоящей из смеси серной кислоты и дистиллированной воды. Но также активно внедряются и всё чаще покупаются AGM и GEL аккумуляторы. В первом случае электролит заключён в стекловолоконные маты, а во втором он загущается, приобретая структуру геля. Но всё равно от использования дистиллята и серной кислоты производители не отказались.
АКБ выглядит довольно компактно. Но когда достаёшь её из подкапотного пространства, оказывается, что вес не такой уж и маленький.
От чего зависит и как проверить
Для определения веса автомобильных аккумуляторов нужно знать не так много.
Аккумулятор может быть легковой, либо грузовой, то есть предназначенным для работы на грузовиках, или на обычных машинах.
Есть 2 способа понять, сколько весит конкретная аккумуляторная батарея:
- посмотреть на наклейку или этикетку от производителя;
- поставить батарею на весы.
Знать массу устройства порой полезно, иногда интересно, а в некоторых случаях просто необходимо. Кто-то просто, исходя из спортивного интереса, желает узнать массу этой конструкции. Другим важно рассчитать свои силы, планируя перенести АКБ на достаточно внушительное расстояние.
Также АКБ и её весовые характеристики во многом влияют на развесовку транспортного средства. Автопроизводители не просто так выбирают те или иные участки для размещения АКБ. Кто-то ставит её под капот с левой стороны, другие справа. В некоторых случаях батарея находится под водительским сиденьем. Есть и такие машины, где для аккумулятора выделено место в подполе багажного отсека. Всё это делается, исходя из необходимости распределить нагрузку и сделать баланс оптимальным.
Даже не взвешивая АКБ, можно узнать примерный средний вес аккумулятора с теми или иными характеристиками, предназначенного для легкового или грузового автомобиля.
В среднем для легковых авто используются АКБ массой от 12 до 20 кг. Для грузовых машин это диапазон от 20 до 45 кг.
Вес зависит от производителя, модели и конкретных характеристик источника питания.
Из чего формируется масса
Каждый автомобильный аккумулятор имеет свой определённый вес, приведённый на наклейке в килограммах (кг).
Да, масса не играет столь значимой роли при выборе АКБ как ёмкость или пусковой ток, но всё же порой даже такая информация может стать решающей.
При продаже подержанных АКБ, когда основную ценность представляет свинец, многие ошибочно воспринимают полную массу как цифру для расчёта выгоды от реализации. На самом деле старые батареи принимают не по общему весу, а лишь по массе содержащегося свинца.
Есть 3 компонента, которые и формируют итоговый вес источника питания. Здесь речь идёт именно о свинцово-кислотных АКБ:
- Корпус. Или же оболочка. То есть внешняя конструкция, внутри которой располагаются основные компоненты батареи.
 Обычно корпус изготавливается на основе пластика или иных схожих материалов. Это самая незначительная по весу часть батареи. Обычно на корпус приходится буквально 5–7% от общей массы. Для стандартных АКБ для легковых машин ёмкостью 55–70 Ач предусматривается корпус весом 750–1000 грамм. Потому перекупщики принимают АКБ просто со слитым электролитом, но в корпусе. Ведь его вес особо не влияет на стоимость.
Обычно корпус изготавливается на основе пластика или иных схожих материалов. Это самая незначительная по весу часть батареи. Обычно на корпус приходится буквально 5–7% от общей массы. Для стандартных АКБ для легковых машин ёмкостью 55–70 Ач предусматривается корпус весом 750–1000 грамм. Потому перекупщики принимают АКБ просто со слитым электролитом, но в корпусе. Ведь его вес особо не влияет на стоимость. - Электролит. Это специальная электрохимическая жидкость, за счёт которой и происходит взаимодействие свинцовых пластин с разным зарядом, накапливается энергия и отдаётся для запуска двигателя. Электролит состоит из дистиллированной воды и серной кислоты. При этом в жидкостных АКБ на долю электролита обычно приходится по 15–20% от общей массы.
- Свинец. Главный компонент аккумулятора, который и формирует основной вес устройства. Суммарно корпус и электролит занимают не более 25% от массы. В итоге получается, что на долю свинца может приходиться 75–80% всего веса.
Важно понимать, что учитывается не только чистый свинец, но и разные сплавы и соединения.
Причём ценность при продаже представляет в основном чистый свинец, которого в современных батареях не так много можно получить путём обычной переработки. В основном его приходится отделять от других металлов, для чего необходимо специальное оборудование и высокотемпературная обработка. В домашних условиях удаётся выплавить обычно не более 20% от общего количества содержащегося в АКБ свинца.
Зависимость веса от мощности
Существуют специальные таблицы по весу аккумуляторов, которые дают возможность сориентироваться и примерно понять, какая масса будут характерной для АКБ с теми или иными параметрами мощности.
Чем больше в АКБ свинца и сплавов, тем выше ёмкость и мощность. Пропорционально возрастает и вес аккумулятора.
То есть зависимость между весом и мощностью самая непосредственная.
Можно привести несколько примеров, какой вес должен быть в случае того или иного аккумулятора.
- 55 Ач. Начать стоит с того, сколько должен весить самый популярный аккумулятор на 55 Ач.
 Именно его чаще всего ставят на легковые авто. Диапазон составляет от 13 до 16 кг. Если говорить о том, каким будет вес свинца в аккумуляторе при 55 Ач ёмкости, то тут достаточно вычесть 20%, которые приходятся на электролит и корпус. В среднем это около 12 кг свинца при общей массе 15 кг;
Именно его чаще всего ставят на легковые авто. Диапазон составляет от 13 до 16 кг. Если говорить о том, каким будет вес свинца в аккумуляторе при 55 Ач ёмкости, то тут достаточно вычесть 20%, которые приходятся на электролит и корпус. В среднем это около 12 кг свинца при общей массе 15 кг; - 60 Ач. Теперь про вес автомобильного стартерного аккумулятора с ёмкостью 60 Ач. Прирост составил буквально 5 Ач. Но и к весу прибавилось 10%. Тут масса варьируется от 17 до 18 кг. Вот сколько примерно весит автомобильный пусковой аккумулятор, ёмкость которого составляет скромные 60 Ач;
- 75 Ач. Несложно определить и то, сколько будут весить аккумуляторы на 75 Ач. Тут объёмы свинца и электролита увеличиваются, а вот прирост по массе оболочки незначительный. Средние цифры составят 22–24 кг;
- 90 Ач. При 90 Ач вес аккумулятора будет порядка 27–30 кг. Это уже батареи для крупных внедорожников, коммерческого транспорта, иногда даже для строительной техники;
- 100 Ач. В этом случае масса перевалит за отметку в 30 кг.
 В среднем это 29–32 кг;
В среднем это 29–32 кг; - 190 Ач. Встречаются и такие АКБ. Они считаются наиболее мощными, а потому и самыми тяжёлыми. Тут масса варьируется в пределах 43–45 кг.
Узнать точный вес можно путём простого взвешивания. Причём даже производитель указывает примерную цифру, которая может отличаться от реальных параметров на 0,2–0,5 кг.
Несоответствие фактического и паспортного веса также иногда указывает на то, что перед покупателем поддельная аккумуляторная батарея. Но это не гарантия идентификации фальшивки.
Для наглядности будет дополнительно представлена таблица.
В ней указано, какая средняя масса будет у аккумуляторной батареи при определённых параметрах ёмкости с учётом залитого электролита и без него.
| Показатель ёмкости, А*ч | Средний вес АКБ с электролитом, кг | Средний вес АКБ без электролита, кг |
| 35 | 10,2 | 8,7 |
| 40 | 10,6 | 8,8 |
| 42 | 10,7 | 9,1 |
| 45 | 12,1 | 9,9 |
| 50 | 12,9 | 11,2 |
| 55 | 14,6 | 12,1 |
| 60 | 15,4 | 13,2 |
| 62 | 15,6 | 13,7 |
| 65 | 16,7 | 14,1 |
| 66 | 16,9 | 14,3 |
| 70 | 18,2 | 14,8 |
| 75 | 19,0 | 15,5 |
| 77 | 19,1 | 16,2 |
| 90 | 23,1 | 20,5 |
| 95 | 23,5 | 20,7 |
| 100 | 24,4 | 21,8 |
| 110 | 25,9 | 25,6 |
| 135 | 37,5 | 33,6 |
| 190 | 49,1 | 47,9 |
| 225 | 61,8 | 51,2 |
Вес Акб Таблица
Покупая, продавая, транспортируя или утилизируя автомобильные аккумуляторы, многие даже и не знают вес автомобильных аккумуляторов. Порой это очень важно, а соответствующих весов «под рукой» нет или даже самих аккумуляторов нет чтобы их взвесить.
Порой это очень важно, а соответствующих весов «под рукой» нет или даже самих аккумуляторов нет чтобы их взвесить.
Вы должны понимать, что вес автомобильного аккумулятора напрямую зависит от его ёмкости. Ёмкость аккумулятора, как правило, указывается на этикетке аккумулятора. Этикетки разных производителей отличаются друг от друга дизайном, но технические характеристики такие, как ёмкость и пусковой ток должны быть указаны обязательно. Ниже на фото №1 мы приводим вам пример как на аккумуляторе указывается ёмкость. Но опять же на других аккумуляторах она будет указана может другим шрифтом или в другой цветовой гамме, но ёмкость и пусковой ток будут указаны обязательно. Если на аккумуляторе нет этикетки (сорвана или утеряна) — Вы можете определить его ёмкость исходя из его размеров.
фото №1:
Вряд ли у кого либо возникнут проблемы с определением ёмкости автомобильного аккумулятора. Зная емкость автомобильного аккумулятора Вы без проблем можете определить вес соответствующего аккумулятора по ссылкам представленным ниже:
Сколько весит аккумулятор 35 ампер
Сколько весит аккумулятор 38 ампер
Сколько весит аккумулятор 40 ампер
Сколько весит аккумулятор 41 ампер
Сколько весит аккумулятор 42 ампер
Сколько весит аккумулятор 43 ампер
Сколько весит аккумулятор 44 ампер
Сколько весит аккумулятор 45 ампер
Сколько весит аккумулятор 47 ампер
Сколько весит аккумулятор 48 ампер
Сколько весит аккумулятор 50 ампер
Сколько весит аккумулятор 52 ампер
Сколько весит аккумулятор 53 ампер
Сколько весит аккумулятор 54 ампер
Сколько весит аккумулятор 55 ампер
Сколько весит аккумулятор 56 ампер
Сколько весит аккумулятор 60 ампер
Сколько весит аккумулятор 61 ампер
Сколько весит аккумулятор 62 ампер
Сколько весит аккумулятор 63 ампер
Сколько весит аккумулятор 64 ампер
Сколько весит аккумулятор 65 ампер
Сколько весит аккумулятор 66 ампер
Сколько весит аккумулятор 70 ампер
Сколько весит аккумулятор 71 ампер
Сколько весит аккумулятор 72 ампер
Сколько весит аккумулятор 74 ампер
Сколько весит аккумулятор 75 ампер
Сколько весит аккумулятор 77 ампер
Сколько весит аккумулятор 78 ампер
Сколько весит аккумулятор 80 ампер
Сколько весит аккумулятор 82 ампер
Сколько весит аккумулятор 85 ампер
Сколько весит аккумулятор 88 ампер
Сколько весит аккумулятор 90 ампер
Сколько весит аккумулятор 92 ампер
Сколько весит аккумулятор 95 ампер
Сколько весит аккумулятор 98 ампер
Сколько весит аккумулятор 100 ампер
Сколько весит аккумулятор 102 ампер
Сколько весит аккумулятор 105 ампер
Сколько весит аккумулятор 110 ампер
Сколько весит аккумулятор 120 ампер
Сколько весит аккумулятор 125 ампер
Сколько весит аккумулятор 140 ампер
Сколько весит аккумулятор 142 ампер
Сколько весит аккумулятор 145 ампер
Сколько весит аккумулятор 180 ампер
Сколько весит аккумулятор 185 ампер
Сколько весит аккумулятор 190 ампер
Сколько весит аккумулятор 192 ампер
Сколько весит аккумулятор 200 ампер
Сколько весит аккумулятор 225 ампер
Сколько весит аккумулятор 230 ампер
Сколько весит аккумулятор 235 ампер
Вместе с «Вес Акб Таблица» часто ищут :
таблица веса аккумулятора вес аккумулятора вес акб сколько весит аккумуляторы скильки в акамулятори веса аккумулятор вес сколько весит акамулятор до зарятки вес автомобильного аккумулятора varta сколько весит аккумулятор автомобильный вес аккумулятора в тесле автомобільний акумулятор вес сколько весит акумулятор от волги масса аккумулятора на сенс вес аккумулятора для легкового авто вес автомобильных аккумуляторов вес отработанных аккумуляторов с электролитом акб вес сколько весит акамулятор ааккумулятор автомобильный вес веч аккумуляторов в тесла сколько свинца в акб вес автомобильного аккумулятора сколько весит акумулятор в авто вес аккумулятора bosch вес аккумулятора берга сколько весит аккумулятор от машины сколько должен весить аккумулятор вес свинца в аккумуляторе вес акб таблица сколько весит автомобильный аккумулятор заряженна батарея вес сколько весит акамулятор електро мобиля вес аккумуляторов вес автомобильних акумуляторов вес аккумулятора компьютерного блока питания автомобильный аккумулятор вес сколько весит батарея полімер сколько вес аккумуляторных батарей вес аккумулятора автомобиля сколько весит аккумулятор на машину
Вес аккумулятора 60 ач с элекролитом.
 Сколько весит автомобильный аккумулятор
Сколько весит автомобильный аккумуляторСодержание
- Из чего складывается вес аккумулятора
- Оболочка
- Свинец
- Электролит
- Размеры автомобильных аккумуляторов
- Европейский типоразмер
- Азиатский типоразмер
- Американский типоразмер
- Факторы, влияющие на вес АКБ
- Сравнение массы заряжаемого и сухозаряженного источника
- Масса АКБ в зависимости от типа
- Где находится информация о весе
- Таблица массы аккумуляторов в зависимости от мощности
- 60 а/ч
- Таблица с электролитом и без
- Сколько весит аккумулятор 190 ач
Из чего складывается вес аккумулятора
Стандартный аккумулятор стартерного типа представляет собой конструкцию, состоящую из пластикового моноблока, в котором располагаются свинцовые пластины и электролит.
Его масса складывается из нескольких составляющих:
- пластикового корпуса;
- объема электролита;
- количества свинцового компонента, на который приходится около 60-70% веса батареи.

Вес корпуса АКБ в большинстве случаев составляет около 0,5 кг. Объем свинца в нем — в пределах 12-13 кг в зависимости от емкости и марки. Кроме того, в его конструкцию входит электролит, состоящий из серной кислоты и дистиллированной воды. Главные составляющие любого автомобильного аккумулятора.
Оболочка
Аккумуляторный моноблок, или оболочка, — это корпус из полипропилена или эбонита, который служит резервуаром для электролитического раствора. Внутри он разделен на несколько ячеек:
- 3 — у АКБ с напряжением 6 В;
- 6 — у батарей, имеющих напряжение 12 В.
В ячейках располагаются положительные и отрицательные электроды, имеющие форму свинцовых решеток, погруженных в электролит и разделенных между собой сепараторами, предохраняющими их от соприкосновения друг с другом и возникновения короткого замыкания.
Сверху корпус аккумулятора накрывается крышкой, приваренной к его основанию, предназначенной для его защиты от механических повреждений. Такая крышка часто снабжается специальными приспособлениями для отвода газов.
Такая крышка часто снабжается специальными приспособлениями для отвода газов.
Свинец
Стартерные аккумуляторные батареи изготавливаются по различным технологиям, но наиболее распространенными являются АКБ свинцово-кислотного типа. Одним из их основных компонентов является свинец и сплавы на его основе. Этот металл подлежит вторичной переработке и применяется для изготовления пластин аккумуляторов.
Электролит
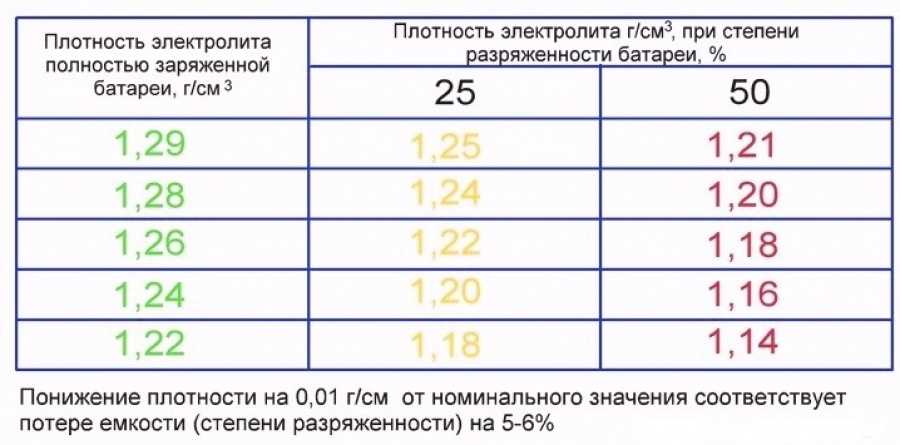
Электролитический раствор, заполняющий корпус аккумуляторной батареи, — это раствор серной кислоты, разбавленной дистиллированной водой в установленных пропорциях. В зависимости от степени ее заряженности плотность электролита может изменяться. В полностью заряженном аккумуляторе этот показатель находится в пределах 1,127-1,300 г/см³. В процессе разрядки происходит электрохимическая реакция, приводящая к расходованию серной кислоты и снижению плотности.
Плотность электролита замеряют при помощи ареометра в каждой банке батареи. Оптимально такую проверку проводить через каждые 15-20 тыс. км пробега авто.
км пробега авто.
Размеры автомобильных аккумуляторов
В отличие от веса размер автомобильного аккумулятора должен обязательно быть габаритные размеры при его покупке. Размеры аккумулятора не существуют сами по себе и не берутся производителями с потолка. Во многом они определяются основными параметрами, характеризующими работу АКБ: ёмкостью и пусковым током. Чем эти показатели больше, тем больше требуется электродов и объем активной массы. Соответственно, увеличивается размер корпуса батареи. Наверняка все обращали внимание, что аккумуляторные батареи для грузовых автомобилей с большими значениями ёмкости имеют более крупные размеры, чем у легковых. Именно потому, что они содержат больше пластин в своём составе.
Самый простой вариант при покупке АКБ выбрать с такими же размерами и показателями, как и прежний аккумулятор.
Но чтобы вы ориентировались, рассмотрим основные типоразмеры батарей на современном рынке.
Европейский типоразмер
Размеры аккумуляторов европейского стандарта подходят для использования на автомобилях европейского и отечественного производства. По внешнему виду их сразу можно отличить по выводам, утопленных в крышке аккумулятора.
Азиатский типоразмер
Размеры и внешний вид аккумулятора азиатского заметно отличаются от европейских. Выводы аккумулятора находятся вровень с плоскостью крышки, а сам корпус имеет большую высоту и меньшую длину. Обратите внимание, что на большинстве автомобилей азиатских производителей стоят именно такие АКБ. Кроме различий в размерах, эти аккумуляторы по-другому закрепляются в подкапотном пространстве. У европейского типа крепление осуществляется за выступ внизу корпуса аккумулятора, а АКБ азиатского типа прижимается планкой сверху при помощи винтовых зажимов. Поэтому нужно покупать АКБ с размерами и типом, аналогичными старому. Иначе возникнут проблемы с установкой.
Иначе возникнут проблемы с установкой.
Американский типоразмер
Североамериканский аккумулятор близок по своим размерам к европейскому типу, но имеет другие размеры. Они расположены сбоку на длинной стороне аккумулятора. Выводы имеют внутреннюю резьбу и клеммы к ним крепятся при помощи болтов. Такая конструкция используется на автомобилях, которые поставляются на североамериканский рынок. В России аккумуляторы этого типа распространены мало.
Ниже вы можете посмотреть таблицу, где собраны вы аккумуляторов с различной ёмкостью. Возможно, она поможет вам сориентироваться при выборе АКБ.
Факторы, влияющие на вес АКБ
Масса автомобильной АКБ зависит от разных показателей. Больше всего влияет на эту характеристику ёмкость. Производительным моделям требуется большее число пластин, поэтому активная масса оборудования тоже растёт.
Влияет на вес и производитель автомобильного аккумулятора. У ряда зарубежных фирм значение показателя может отличаться от усреднённых табличных данных. Хотя таблицы с информацией о весе АКБ всё равно нужны – их точность получается достаточно высокой.
Хотя таблицы с информацией о весе АКБ всё равно нужны – их точность получается достаточно высокой.
Примерную массу аккумуляторной батареи можно узнать по типу автомобиля. Для грузового транспорта и автобусов это значение находится в пределах 20–70 кг. На легковых авто и микроавтобусах обычно устанавливают батареи весом 12-20 кг. Машины премиум-класса, спортивные автомобили и внедорожники с двигателями объёмом больше 3,5 л комплектуются аккумуляторами ёмкостью до 120 А·ч, масса которых превышает 30 кг.
Сравнение массы заряжаемого и сухозаряженного источника
Сухозаряженными называют аккумуляторные батареи с отформованными на предприятии-изготовителе пластинами. После сборки такая батарея заряжается и герметично запечатывается, чтобы внутрь не попали воздух и влага. Преимуществом такого метода считается длительный эксплуатационный срок и простую транспортировку. АКБ без электролита можно хранить до 5 лет. А перевозить её допускается в любом положении.
Для определения массы источника, заполненного электролитом, требуется знать, как распределяется масса между разными частями:
- Пластик.
 Занимает не самую большую часть АКБ и немного весит. Средняя доля пластиковых комплектующих (перегородок, перемычек, деталей корпуса) не превышает 5-7% от веса. Из-за этого пластик практически не учитывается при взвешивании аккумуляторной батареи в пункте приёма металлолома, куда рекомендуется отнести отработанный источник. Выбрасывать отработанные батареи не рекомендуется из-за высокой опасности их компонентов для окружающей среды.
Занимает не самую большую часть АКБ и немного весит. Средняя доля пластиковых комплектующих (перегородок, перемычек, деталей корпуса) не превышает 5-7% от веса. Из-за этого пластик практически не учитывается при взвешивании аккумуляторной батареи в пункте приёма металлолома, куда рекомендуется отнести отработанный источник. Выбрасывать отработанные батареи не рекомендуется из-за высокой опасности их компонентов для окружающей среды. - Электролитическая жидкость. Её уровень можно определить по шкале из двух отметок (Min и Max), указанной на некоторых моделях батарей. Масса такого раствора серной кислоты в дистиллированной воде может достигать, в зависимости от заполнения аккумулятора, до 20% от веса заряженного источника. При взвешивании в пункте приёма батарея обычно остаётся заполненной электролитом, сливать который небезопасно.
- Свинец и его соединения. Самая тяжёлая и ценная часть устройства. Доля свинцовых пластин в общей массе аккумулятора может достигать 73-79% от общего веса.
С учётом этой информации можно предположить, что у сухозаряженной батареи вес пластика будет в 11-15 раз меньше, чем у самого устройства. Масса электролита, который добавляют в АКБ при установке на автомобиль, примерно равна 1/4 от общего веса. Эти значения можно сравнить с реальными цифрами. У аккумулятора 6 СТ-55, на корпусе которого указано 11 кг, пластиковая часть весит около 0,8 кг, а электролит (при максимальном уровне заполнения) – 2,5 кг. Общий вес устройства – 14,3 кг, доля пластика – 5,6%, свинца – 77%, жидкости – 17,4%.
Масса АКБ в зависимости от типа
Рассчитать примерную массу электролита, пластиковых перемычек и свинцовых деталей получится только для самого популярного вида аккумуляторов – кислотно-свинцового. Определение тех же показателей у щелочных аккумуляторных батарей представляет собой более сложную задачу. Точные значения можно узнать только из технической документации.
С другой стороны, щелочные АКБ практически не применяются на автомобилях. Хотя у них есть немало преимуществ – минимальный процент саморазряда и испарения электролитической жидкости, высокое значение пускового тока. Причинами для отказа от таких источников являются их высокая цена и большие размеры.
Хотя у них есть немало преимуществ – минимальный процент саморазряда и испарения электролитической жидкости, высокое значение пускового тока. Причинами для отказа от таких источников являются их высокая цена и большие размеры.
Вес аккумулятора не является параметром, непосредственно определяющим потребительские качества свинцово-кислотного аккумулятора, поэтому не все производители указывают его на шильдике или в сопроводительной документации на АКБ. Но некоторые все же упоминают и эту характеристику – надо поискать ее среди остальных данных.
По выбору производителя, вес может быть указан для «сухого» аккумулятора (не заправленного электролитом), а может сообщаться для полностью снаряженного – с залитым раствором серной кислоты. Стандарты это не регламентируют.
Вес батареи может быть указан на шильдике.
Если производителем весовые характеристики не предоставлены, взвешивать источник питания придется самостоятельно. Существует и другой способ – определить массу по таблицам. Это бывает необходимо для проверки соответствия заявленных характеристик реальным — недобросовестные производители могут декларировать завышенные параметры, но законы физики не обмануть. Весовые параметры должны коррелировать с электрическими. Современные технологии пока не позволяют создавать емкие и мощные батареи с небольшим весом. А значит, чем выше энергетические характеристики АКБ, тем она должна быть тяжелее.
Это бывает необходимо для проверки соответствия заявленных характеристик реальным — недобросовестные производители могут декларировать завышенные параметры, но законы физики не обмануть. Весовые параметры должны коррелировать с электрическими. Современные технологии пока не позволяют создавать емкие и мощные батареи с небольшим весом. А значит, чем выше энергетические характеристики АКБ, тем она должна быть тяжелее.
Таблица массы аккумуляторов в зависимости от мощности
В таблице приведен средний вес (точное значение определяется конструкцией аккумулятора) стартерных автомобильных батарей в зависимости от емкости в ампер*часах. Для каждого значения приведены две цифры – «сухой» вес (без жидкого реагента) и вес АКБ с электролитом. Небольшие колебания плотности раствора серной кислоты в воде в зависимости от уровня заряда никакого влияния не имеют – излишек при разряде уходит в сульфат свинца (закон сохранения массы действует неукоснительно). При испарении воды из электролита происходит увеличение плотности жидкости, но уменьшается объем реагента./Mir/29/2.jpg) На общем фоне эти колебания составляют доли процентов, поэтому на практике вряд ли понадобится их учитывать.
На общем фоне эти колебания составляют доли процентов, поэтому на практике вряд ли понадобится их учитывать.
| Мощность (Ач) | Масса без электролита (кг) | Масса заправленной (кг) |
| 35 | 8.7 | 10.2 |
| 40 | 8.8 | 10.6 |
| 42 | 9.1 | 10.7 |
| 45 | 9.9 | 12.1 |
| 50 | 11.2 | 12.9 |
| 55 | 12.1 | 14.6 |
| 60 | 13.2 | 15.4 |
| 62 | 13.7 | 15.6 |
| 65 | 14.1 | 16.7 |
| 66 | 14.3 | 16.9 |
| 70 | 14.8 | 18.2 |
| 75 | 15.5 | 19.0 |
| 77 | 16.2 | 19.1 |
| 90 | 20.5 | 23.1 |
| 95 | 20.7 | 23.5 |
| 100 | 21.8 | 24.4 |
| 110 | 25. 6 6 | 25.9 |
| 135 | 33.6 | 37.5 |
| 190 | 47.9 | 49.1 |
| 225 | 51.2 | 61.8 |
Во многом конечный вес зависит от изготовителя. В России популярны батареи 12 Вольт следующих компаний:
- Varta. Это источники питания для автомобилей с большим потреблением электроэнергии. Весят они в районе 15 кг;
- Kraft. Необслуживаемые батареи немецкого производителя, которые весят 15.6 кг;
- Topla. Их вес – 16 кг;
- Exide Premium. Производит свинцово-кислотные АКБ, масса которых достигает 14.7 кг;
- Baren (включая серию Profi). Источники питания австрийского производителя, характерные повышенной мощностью. Весят 17 кг;
- Bosch. Средняя масса – 15 кг.
Также не стоит забывать, что помимо обычных автомобилей есть гибридные модели и электромобили, которые питаются от тяговых аккумуляторов. Они в 2 – 3 раза тяжелее обычных стартовых источников питания.
Встречаются и гелевые АКБ – подвид свинцово-кислотных необслуживаемых батарей. В них вместо электролита используется гель, созданный при помощи силиконового наполнителя. Масса гелевого источника питания обычно указывается на корпусе.
Знание веса батареи поможет решить и обратную задачу – рассчитать массу аккумулятора по известной емкости. Это может пригодиться при планировании перевозок партии батарей или при складировании АКБ на стеллажах. Также важен вес источника автономного питания в вопросах охраны труда – именно он определяет, можно ли снимать и переносить батареи в одиночку или вдвоем, надо ли применять специальные приспособления и т.п.
60 а/ч
Еще одна распространенная разновидность стартерных АКБ, которые устанавливаются на автомобили с объемом двигателя 1,6-2 л. С увеличением емкости их вес увеличивается примерно на 10% и составляет от 17 до 18 кг. Средние габаритные размеры: 242×175×190 мм
Таблица с электролитом и без
Узнать массу аккумулятора можно по маркировке на корпусе.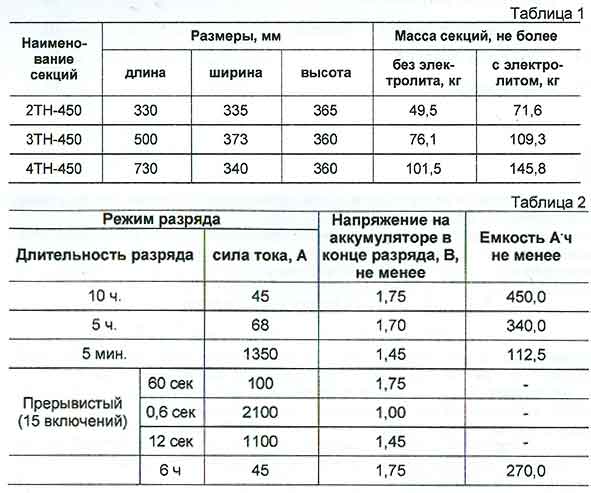 Но в большинстве случаев там указывается, сколько он весит в «сухом» состоянии, без учета электролита. Разница между этими двумя состояниями может составлять до 20%.
Но в большинстве случаев там указывается, сколько он весит в «сухом» состоянии, без учета электролита. Разница между этими двумя состояниями может составлять до 20%.
Для точного определения веса АКБ с электролитическим раствором и без него можно воспользоваться справочной таблицей:
| Емкость АКБ | Средний вес с электролитом | Средний вес без электролита |
| 35 Ah | 10,2 | 8,7 |
| 40 Ah | 10,6 | 8,8 |
| 45 Ah | 12,1 | 9,9 |
| 50 Ah | 12,9 | 11,2 |
| 55 Ah | 14,6 | 12,1 |
| 60 Ah | 15,4 | 13,2 |
| 65 Ah | 16,7 | 14,1 |
| 66 Ah | 16,9 | 14,3 |
| 70 Ah | 18,2 | 14,8 |
| 75 Ah | 19,0 | 15,5 |
| 77 Ah | 19,1 | 16,2 |
| 90 Ah | 23,1 | 20,5 |
| 95 Ah | 23,5 | 20,7 |
| 100 Ah | 24,4 | 21,8 |
| 110 Ah | 25,9 | 25,6 |
| 135 Ah | 37,5 | 33,6 |
| 190 Ah | 49,1 | 47,9 |
| 225 Ah | 61,8 | 51,2 |
Сколько весит аккумулятор 190 ач
Пластины мощного аккумулятора изготавливаются из свинца, который имеет большой удельный вес. Этот факт не может не отражаться на массе изделия. В качестве электролита в таких изделиях применяются слабый раствор серной кислоты, но эта жидкость также тяжелее воды. Пластик является самым «безобидным» в этом смысле материалом, но учитывая относительно большие габариты изделия, корпус изделия добавляет в общую копилку несколько килограммов.
Этот факт не может не отражаться на массе изделия. В качестве электролита в таких изделиях применяются слабый раствор серной кислоты, но эта жидкость также тяжелее воды. Пластик является самым «безобидным» в этом смысле материалом, но учитывая относительно большие габариты изделия, корпус изделия добавляет в общую копилку несколько килограммов.
Полностью заправленный автомобильный аккумулятор, ёмкость которого равна 190 ah будет весить не менее 47 кг, поэтому изделие оснащается удобными ручками для переноски.
Источники
- https://3batareiki.ru/akkumulyatory/avtomobilnye-akkumulyatory/skolko-vesit-akkumulyator
- https://akbinfo.ru/ustrojstvo/skolko-vesit-avtomobilnyj-akkumuljator-i-ego-razmery.html
- https://BatteryZone.ru/accumulator/ves-avtomobilnogo-akkumuljatora-srednij-ves-i-zavisimost-ot-emkosti
- https://Zapitka.ru/akkumulyatory/skolko-vesit
- https://IstochnikiPitaniy.ru/akkumulyatory/avtomobilnye/190-ach.html
Как вам статья?
Таблица веса аккумуляторов в зависимости от мощности
Среди основных характеристик автоаккумулятора покупатели, часто даже весьма опытные, обращают внимание преимущественно на стоимость и ёмкость, забывая о том, что масса устройства тоже важна. Учитывая, что вес у аккумуляторов приличный, было бы интересно узнать, как он коррелирует с другими характеристиками батареи – ёмкостью, габаритами, пусковым током.
Учитывая, что вес у аккумуляторов приличный, было бы интересно узнать, как он коррелирует с другими характеристиками батареи – ёмкостью, габаритами, пусковым током.
Содержание
- От чего зависит вес автомобильного аккумулятора
- Компоненты, из которых состоит АКБ, и их доля в общей массе
- Оболочка
- Свинец
- Электролит
- Сколько должен весить аккумулятор в зависимости от ёмкости
- 35 А/час
- 55 А/час
- 60 А/час
- 75 А/час
- 90 А/час
- 100 А/час
- 190 А/час
От чего зависит вес автомобильного аккумулятора
Факторов, определяющих вес АКБ, не так уж много. Перечислим их:
- материал изготовления пластин (или, если угодно, тип аккумулятора): свинцовые батареи, к примеру, гораздо тяжелее литиевых;
- наличие электролита, на долю которого приходится примерно 20% от веса устройства;
- мощность или ёмкость АКБ. Здесь зависимость прямая: чем больше мощность, тем крупнее и массивнее аккумулятор.
 На большинство легковушек устанавливаются батареи ёмкостью 55-60 А/час, средний вес такого аккумулятора для легкового автомобиля лежит в пределах 12-15 кг. (55-амперная батарея). Хотя это приличный вес, в принципе с его транспортировкой даже в пешем виде проблем возникнуть не должно. Что касается 60-амперного аккумулятора, то он тяжелее примерно на 10%, или, в абсолютных цифрах, его масса колеблется в диапазоне 13,5-16 кг. Отметим, что мощность батареи увеличивается двояким способом: за счёт увеличения размеров свинцовых пластин, а также при увеличении их количества в корпусе. Понятно, что в любом случае габариты источника питания увеличиваются вместе с весом.
На большинство легковушек устанавливаются батареи ёмкостью 55-60 А/час, средний вес такого аккумулятора для легкового автомобиля лежит в пределах 12-15 кг. (55-амперная батарея). Хотя это приличный вес, в принципе с его транспортировкой даже в пешем виде проблем возникнуть не должно. Что касается 60-амперного аккумулятора, то он тяжелее примерно на 10%, или, в абсолютных цифрах, его масса колеблется в диапазоне 13,5-16 кг. Отметим, что мощность батареи увеличивается двояким способом: за счёт увеличения размеров свинцовых пластин, а также при увеличении их количества в корпусе. Понятно, что в любом случае габариты источника питания увеличиваются вместе с весом.
При увеличении размеров совершенно правильным будет предположение, что в него поместится больше электролита. Так, 75-амперный аккумулятор весит в районе 15-20 кг.
Мало кто из отечественных автомобилистов знает, но на некоторые азиатские малолитражки устанавливаются АКБ ёмкостью 35 А/час, весящие в полностью заправленном состоянии порядка 12 кг. , но есть и ещё менее массивные батареи, используемые для питания мототехники. С другой стороны, не редкость и аккумуляторы весом в полцентнера, устанавливаемые на грузовики и спецтехнику. Такую АКБ и поднять-то сможет далеко не каждый.
, но есть и ещё менее массивные батареи, используемые для питания мототехники. С другой стороны, не редкость и аккумуляторы весом в полцентнера, устанавливаемые на грузовики и спецтехнику. Такую АКБ и поднять-то сможет далеко не каждый.
Компоненты, из которых состоит АКБ, и их доля в общей массе
Схематически классический стартерный автомобильный аккумулятор можно представить в виде конструкции, состоящей из пластикового корпуса-моноблока, в котором размещаются металлические пластины и заливается электролит.
Таким образом, вес автомобильного аккумулятора в килограммах можно распределить между этими тремя составляющими. В среднем на свинцовые пластины приходится до 60-70% от массы батареи, на долю электролита – около 20-25%, на долю коробки – 5-8%.
Чистый вес пластикового корпуса колеблется возле значения 500 граммов. В такой короб помещается порядка 12-13 килограммов свинца, определённое количество электролита – смеси соляной кислоты и дистиллированной воды в пропорции 35:65%.
Рассмотрим эти главные компоненты подробнее.
Оболочка
Аккумуляторный корпус, или моноблок, представляет собой короб, изготовленный из полипропилена (ранее встречались и эбонитовые корпуса), служащий ёмкостью для электрохимического раствора. Внутри моноблок разделён на секции, количество которых зависит от типа АКБ. Так, у шестивольтовых батарей таких секций 3, у 12-вольтовых автомобильных – 6.
В этих секциях размещают набор свинцовых пластин, представляющих собой чередующиеся положительные и отрицательные электроды в виде решетчатых прямоугольных конструкций. Чтобы они не соприкасались между собой, их разделяет сепаратор из диэлектрического химически стойкого материала. В каждую секцию заливается электролит, уровень которого должен перекрывать верх пластин на 10-15 мм. Наконец, сверху корпус закрывается крышкой, которая содержит выводы пластин (плюсовую и минусовую клеммы), а также может иметь пробки для долива электролита или дренажными отверстиями для отвода газов. Доля короба в весе АКБ – 5-8%.
Доля короба в весе АКБ – 5-8%.
Свинец
Батареи стартерного типа изготавливаются по разным технологиям. В настоящее время самыми распространёнными считаются свинцово-кислотные аккумуляторы, в которых основным компонентом электродов является свинец вместе с добавками (сурьма, кальций, их смесь), а также диоксид свинца. Плотность этого компонента, подлежащего вторичной переработке, достаточно велика – 11,3-11,5 г/см3, что и обуславливает его долю в общей массе батареи до 70%.
Электролит
Электрохимический раствор, который заливают в корпус аккумулятора, представляет собой водный раствор серной кислоты, причём в качестве растворителя используется очищенная дистиллированная вода, лишённая примесей.
Плотность электролита не является стабильной величиной: она меняется по мере зарядки/разрядки, то увеличиваясь (при уменьшении доли воды), то уменьшаясь (когда в растворе уменьшается количество серной кислоты, вступающей в реакцию с пластинами).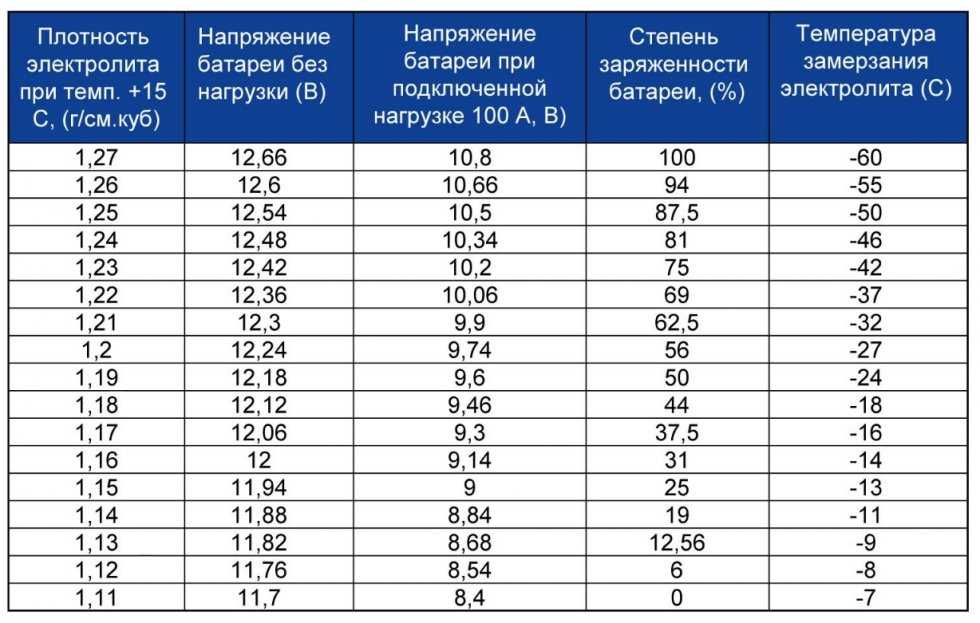
Если аккумулятор заряжен, плотность электролита, независимо от ёмкости батареи, лежит в пределах 1,128-1,300 г/см3. Плотность электролита можно измерить посредством обычного ареометра, но делать это нужно в каждой банке – они не связаны друг с другом. Такой контроль должен быть периодическим и выполняться каждые 15 000-20 000 км. пробега.
Сколько должен весить аккумулятор в зависимости от ёмкости
Вес аккумулятора не обязательно должен быть таким, как указано в паспортных данных – эти сведения приводятся для новых батарей. В процессе эксплуатации в наибольшей степени изменяется масса электролита, в определённых пределах уменьшается вес пластин.
Что касается зависимости веса от характеристик батареи, то наиболее показательной (линейной) она является в отношении ёмкости – чем она выше, тем больше масса АКБ. Впрочем, к таким утверждениям следует относиться с определёнными оговорками. Дело в том, что в процессе разрядки ёмкость электролита может существенно упасть, поэтому обычно приводятся сведения касательно полностью заряженных аккумуляторов.
35 А/час
Такие батареи применяются на малолитражных авто (с моторами не более 1,2 л.). При габаритах порядка 187-240 мм. (ширина), 192-225 мм. (длина) и 120-130 мм. (высота) они весят от 8,0 до 11,0 кг.
55 А/час
Самый распространённый типоразмер АКБ (до 70% легковых авто оснащаются ими). Аккумулятор на 55 А весит 13,0-16,0 кг. при габаритах порядка 242×175×190 мм. На долю свинца в аккумуляторе приходится 8-12 кг.
60 А/час
Вторая по распространённости разновидность батарей для легковых авто. 60-амперный аккумулятор весит 17-18 кг. и устанавливается на машины с 1,6-2,0-литровыми моторами.
75 А/час
Вам интересно знать, сколько весит 75-амперный аккумулятор? Это уже АКБ классом повыше, используемый в массивных автомобилях с богатым набором электрического оборудования, поэтому его вес составляет 22-25 кг., и переносить его не так уж легко.
90 А/час
Столь мощные батареи устанавливаются преимущественно в грузовые автомобили и дорожную/строительную спецтехнику. Вес 90-амперного аккумулятора доходит до 30 кг. Впрочем, такие устройства устанавливают и на некоторые модели джипов и пикапов.
Вес 90-амперного аккумулятора доходит до 30 кг. Впрочем, такие устройства устанавливают и на некоторые модели джипов и пикапов.
100 А/час
Вес аккумуляторов на 100 А/ч достигает 35 кг. в заправленном и заряженном состоянии. На легковые авто такие монстры не устанавливаются.
190 А/час
Один из самых мощных представителей стартовых батарей. Вес аккумулятора на 190 А достигает 45 кг., такими комплектуются тяжёлые грузовики, тягачи, спецтехника, автопоезда.
Предлагаем вашему вниманию таблицу зависимости веса аккумулятора от его мощности:
| Ёмкость, А/час | Вес в незаправленном состоянии, кг. | Вес с залитым электролитом, кг. |
| 35 | 8,2 | 10,7 |
| 45 | 9,9 | 12,2 |
| 50 | 11,2 | 12,85 |
| 55 | 12,1 | 14,5 |
| 60 | 13,2 | 15,5 |
| 66 | 14,3 | 16,9 |
| 75 | 15,5 | 19,2 |
| 90 | 20,5 | 23,3 |
| 100 | 21,7 | 24,4 |
| 110 | 25,5 | 26,9 |
| 135 | 33,5 | 37,5 |
| 190 | 47,5 | 49,0 |
| 225 | 51,1 | 61,9 |
Сколько весит автомобильный аккумулятор | 🔋⚡Автомобильные аккумуляторы
Вопросом веса аккумулятора мало кто задаётся, выбирая его для эксплуатации в автомобиле. Некоторые автовладельцы задумываются об этом, когда требуется снять АКБ для заправки или транспортировки в тёплое помещение. В основном вес аккумулятора важен тем, кто занимается тюнингом, потому что для гонок показатели массы автомобиля очень важны. Для остальных автолюбителей этот вопрос становится актуальным зачастую только при сдаче отслужившей батареи перекупщикам.
Некоторые автовладельцы задумываются об этом, когда требуется снять АКБ для заправки или транспортировки в тёплое помещение. В основном вес аккумулятора важен тем, кто занимается тюнингом, потому что для гонок показатели массы автомобиля очень важны. Для остальных автолюбителей этот вопрос становится актуальным зачастую только при сдаче отслужившей батареи перекупщикам.
Как правило, мало кто из производителей указывает массу батареи, к тому же она зависит от различных факторов. Например, пустая АКБ весит меньше, чем заправленная электролитом. По-разному будут весить литиевые и свинцовые аккумуляторы. Тогда как же точно определить вес батареи?
Содержание
- От чего зависит вес аккумулятора
- Вес автомобильного аккумулятора с электролитом
- Таблица весовых характеристик аккумуляторов
От чего зависит вес аккумулятора
При возникновении вопроса «сколько весит автомобильный аккумулятор» необходимо обращать внимание на следующие факторы:
- Материалы, из которых изготовлена АКБ.
 Свинцово-кислотные батареи априори тяжелее литиевых.
Свинцово-кислотные батареи априори тяжелее литиевых. - Наличие электролита. Заправленная электрохимической жидкостью батарея весит больше, чем пустая.
- Мощность АКБ. Следует знать, что масса аккумулятора находится в прямой зависимости от мощности. Так, самые популярные батареи устанавливаются на большинство легковых машин, и, соответственно, многих автолюбителей интересует, сколько весит аккумулятор 55 Ампер/часов. Так вот, масса данных АКБ составляет от 12 до 15 кг, и справиться с транспортировкой может любой человек. Чтобы узнать, сколько весит автомобильный аккумулятор с мощностью в 60 Ампер/часов, необходимо прибавить около 10 % веса, то есть получится от 13,5 до 16 кг в зависимости от состояния: сухая или заправленная электролитом деталь. Стоит учитывать, что большая мощность батареи достигается за счёт увеличения свинцовых пластин в размере и толщине. Так как в АКБ свинцовые пластины погружены в электрохимическую жидкость, то увеличение размера пластин влечёт за собой и увеличение объёма жидкости, в которую они погружены.
 К примеру, аккумулятор 75 А/ч весит уже от 15 до 20 кг.
К примеру, аккумулятор 75 А/ч весит уже от 15 до 20 кг.
Есть и более лёгкие автомобильные батареи. Они устанавливаются на мопеды или маломощную автотехнику, а в заправленном виде весят примерно 10 кг. Есть и такие, которые не поднять в одиночку, так как их масса составляет больше 50 кг. Настолько большие АКБ устанавливаются в тяжёлую грузовую технику и даже корабли.
Вес автомобильного аккумулятора с электролитом
Измерить вес автомобильного аккумулятора, конечно, можно, воспользовавшись специальными весами. Но опираться на эти показатели, рассчитывая сдать использованную АКБ перекупщикам, не стоит, так как последним интересны в основном свинцовые пластины. Поэтому, чтобы рассчитать приблизительную массу батареи самостоятельно, стоит вспомнить её устройство:
- Автомобильные аккумуляторы заключаются в пластиковые корпуса. Материал этот лёгкий, и доля его веса составляет не больше 5–8 % от общей массы.

- Электролит – смесь серной кислоты с водой, которой заправляют автомобильные батареи. Для заправки АКБ такой жидкости требуется немало, а значит, её вес составляет солидную долю. В среднем это от 15 до 20 % от общей массы.
- Свинцовые пластины за минусом веса корпуса и электрохимической жидкости составляют основной вес батарей – до 70–80 %.
В отдельных случаях заявленная производителем масса АКБ не соответствует действительности. К примеру, вы измерили, сколько весит аккумулятор 75 А/ч, а полученный результат не совпал со значением, указанным на этикетке детали. Пугаться такого не стоит, так как это свидетельствует лишь о том, что производитель вносил изменения в производство и увеличил толщину свинцовых пластин, вследствие чего поменялась и общая масса. Но большинство АКБ по весу укладываются в стандартные параметры.
Таблица весовых характеристик аккумуляторов
Узнать среднюю массу сухой или заправленной батареи можно из приведённой ниже таблицы.
| Мощность АКБ (А/ч) | Вес батареи без электролита (кг) | Вес заправленной батареи (кг) |
|---|---|---|
| 35 | 8,7 | 10,2 |
| 40 | 8,8 | 10,6 |
| 42 | 9,1 | 10,7 |
| 45 | 9,9 | 12,1 |
| 50 | 11,2 | 12,9 |
| 55 | 12,1 | 14,6 |
| 60 | 13,2 | 15,4 |
| 62 | 13,7 | 15,6 |
| 65 | 14,1 | 16,7 |
| 66 | 14,3 | 16,9 |
| 70 | 14,8 | 18,2 |
| 75 | 15,5 | 19,0 |
| 77 | 16,2 | 19,1 |
| 90 | 20,5 | 23,1 |
| 95 | 20,7 | 23,5 |
| 100 | 21,8 | 24,4 |
| 110 | 25,6 | 25,9 |
| 135 | 33,6 | 37,5 |
| 190 | 47,9 | 49,1 |
| 225 | 51,2 | 61,8 |
Вместе с обычными автомобилями на рынке встречаются и гибридные модели, и электромобили. Кроме того, есть определённые виды спецтехники, к примеру, погрузчики, краны и т. д. Для обладателей таких машин стандартные стартовые батареи не подходят, так как в них устанавливаются тяговые АКБ, которые в 2–3 раза тяжелее, чем привычные стартовые.
Кроме того, есть определённые виды спецтехники, к примеру, погрузчики, краны и т. д. Для обладателей таких машин стандартные стартовые батареи не подходят, так как в них устанавливаются тяговые АКБ, которые в 2–3 раза тяжелее, чем привычные стартовые.
Не менее редкими, чем тяговые, остаются стартовые гелевые аккумуляторы. Это автомобильные источники питания, в которых электрохимическая жидкость заменена гелем, созданным с помощью силиконового наполнителя. Их масса, как правило, указывается на поверхности батареи.
При выборе автомобильного аккумулятора нужно помнить, что нельзя ориентироваться только на массу и брать деталь с неподходящей мощностью.
Стартовые АКБ, устанавливаемые на машины, работают в паре с генератором, и установка батареи большей мощности приведёт к её постоянному недозаряду и, соответственно, уменьшит срок её службы. Поэтому при покупке необходимо выбирать модель с такими же параметрами, как и у старой батареи.
на 190, 60, 55, 75Ач легковых и грузовых машин
Содержание
- Какие аккумуляторы самые тяжелые
- Соотношение веса составляющих АКБ
- Где находится информация о весе
- Таблица массы аккумуляторов в зависимости от мощности
При покупке аккумуляторной батареи пользователи обращают внимание лишь на энергетические характеристики аккумулятора, а также на расположение выводов. В этом есть резон, но дополнительное знание, сколько весит автомобильный аккумулятор, и небольшой опыт помогут сделать оптимальный выбор.
В этом есть резон, но дополнительное знание, сколько весит автомобильный аккумулятор, и небольшой опыт помогут сделать оптимальный выбор.
Какие аккумуляторы самые тяжелые
Вес аккумулятора зависит от материалов, из которых он изготовлен. Так, одними из самых тяжелых являются свинцово-кислотные аккумуляторы, ведь плотность чистого свинца составляет 11,37 г/см3. Из относительно распространенных материалов тяжелее свинца являются вольфрам, золото, платина, ртуть, тантал. Часть активной массы составляет оксид свинца PbO2, его удельный вес чуть ниже (9,4 г/см3), но он составляет относительно небольшую долю по объему.
Плотность других материалов, применяемых для создания аккумуляторов:
- никель – 8,9 г/см3;
- кадмий – 8,64 г/см3;
- литий – 0,53 г/см3 (почти вдвое легче воды!)
Конечно, в аккумуляторах металлы в чистом виде не применяются. Они используются в виде соединений или с легирующими добавками.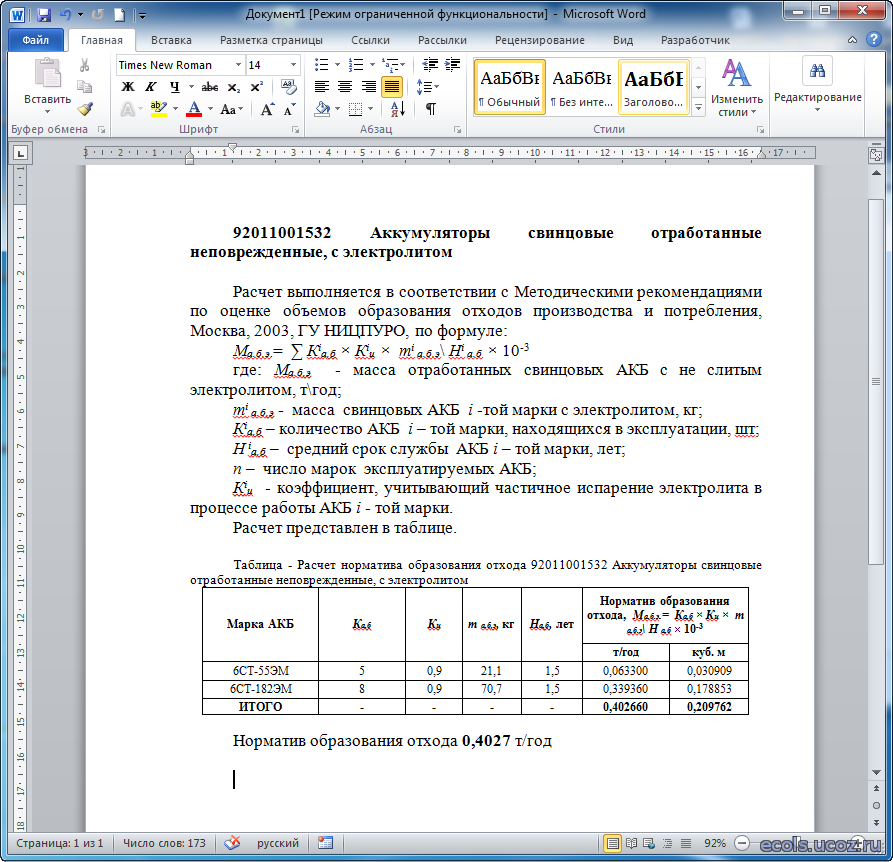 Но все равно, общее представление об относительных весах батарей, изготовленных по разным технологиям, можно получить исходя из свойств этих материалов.
Но все равно, общее представление об относительных весах батарей, изготовленных по разным технологиям, можно получить исходя из свойств этих материалов.
Почему для автомобилей применяются, в основном, свинцово-кислотные АКБ, несмотря на их большую массу? Основных причин две:
- Батареи на основе свинца больше всего приспособлены для работы в составе бортсети автомобиля (большие пусковые токи, широкий диапазон температур, относительно низкая чувствительность к перезарядам и глубоким разрядам и т.п.) и имеют относительно низкую стоимость.
- Выигрыш нескольких килограмм некритичен как для легковых, так и для грузовых автомобилей — тяга двигателя имеет запас, для которого такой небольшой излишек массы практически незаметен, и преимущества свинцовой АКБ перевешивают (и в буквальном смысле тоже).
«Камаз» — участник ралли.
Там, где масса имеет важное значение, обычно применяются литий-ионные аккумуляторы (с учетом прочих достоинств, присущим батареям этого типа). Например, в смартфонах, ноутбуках и других переносных устройствах.
Например, в смартфонах, ноутбуках и других переносных устройствах.
Весовые показатели также зависят от электрических, вернее, определяют их. Емкость батареи, ее токоотдача и другие энергетические показатели зависят, при прочих равных условиях, от площади, на которой происходят электрохимические реакции, а эта площадь зависит от размера пластин.
Свинцовые пластины аккумулятора.Чем больше пластины, тем они больше весят. И тем больше надо электролита, плотность которого, кстати, побольше, чем у воды. А еще аккумулятору нужен прочный пластиковый корпус, способный выдержать вес веществ, участвующих в реакции.
Удельный вес кислотного электролита составляет 1,27..1,28 г/см3Современные аккумуляторы также производят по технологиям AGM, EFB и GEL. У батарей AGM электролита немного меньше, зато сепараторы изготовлены из стекловолокна, которое имеет плотность примерно 2,4..2,6 г/см3, то есть, примерно в два раза больше, чем у жидкого реагента. Поэтому такие АКБ еще тяжелее. Также немного больший вес имеют и аккумуляторы EFB (за счет пакетов из того же стекловолокна), а гелевые АКБ заметно тяжелее за счет большей плотности загущенного электролита.
Также немного больший вес имеют и аккумуляторы EFB (за счет пакетов из того же стекловолокна), а гелевые АКБ заметно тяжелее за счет большей плотности загущенного электролита.
Соотношение веса составляющих АКБ
Несмотря на то, что пластины и электролит занимают по объему сравнимое пространство, наибольшая часть веса аккумулятора приходится на свинец. Это объясняется разницей плотностей – удельный вес свинца примерно в 10 раз выше, чем у раствора серной кислоты в воде. Пластины, перемычки и клеммы в общей сложности составляют около 80% массы аккумулятора. Электролит обычно занимает 17..19% (до 20%) общего веса.
Корпус изготавливается из прочного, но относительно легкого пластика. На его долю приходится 1..3% от общей массы АКБ. Зная эти цифры, можно вычислить вес полного аккумулятора, взвесив сухой, или наоборот – сколько будет весить батарея после полного слива электролита.
Устройство АКБ и ее компоненты, влияющие на весовые характеристики.Вес аккумулятора не является параметром, непосредственно определяющим потребительские качества свинцово-кислотного аккумулятора, поэтому не все производители указывают его на шильдике или в сопроводительной документации на АКБ. Но некоторые все же упоминают и эту характеристику – надо поискать ее среди остальных данных.
Но некоторые все же упоминают и эту характеристику – надо поискать ее среди остальных данных.
Вес батареи может быть указан на шильдике.
Если производителем весовые характеристики не предоставлены, взвешивать источник питания придется самостоятельно. Существует и другой способ – определить массу по таблицам. Это бывает необходимо для проверки соответствия заявленных характеристик реальным — недобросовестные производители могут декларировать завышенные параметры, но законы физики не обмануть. Весовые параметры должны коррелировать с электрическими. Современные технологии пока не позволяют создавать емкие и мощные батареи с небольшим весом. А значит, чем выше энергетические характеристики АКБ, тем она должна быть тяжелее.
Таблица массы аккумуляторов в зависимости от мощности
В таблице приведен средний вес (точное значение определяется конструкцией аккумулятора) стартерных автомобильных батарей в зависимости от емкости в ампер*часах. Для каждого значения приведены две цифры – «сухой» вес (без жидкого реагента) и вес АКБ с электролитом. Небольшие колебания плотности раствора серной кислоты в воде в зависимости от уровня заряда никакого влияния не имеют – излишек при разряде уходит в сульфат свинца (закон сохранения массы действует неукоснительно). При испарении воды из электролита происходит увеличение плотности жидкости, но уменьшается объем реагента. На общем фоне эти колебания составляют доли процентов, поэтому на практике вряд ли понадобится их учитывать.
Небольшие колебания плотности раствора серной кислоты в воде в зависимости от уровня заряда никакого влияния не имеют – излишек при разряде уходит в сульфат свинца (закон сохранения массы действует неукоснительно). При испарении воды из электролита происходит увеличение плотности жидкости, но уменьшается объем реагента. На общем фоне эти колебания составляют доли процентов, поэтому на практике вряд ли понадобится их учитывать.
| Заявленная емкость, А*ч | «Сухая» масса, кг | Масса полностью заправленной батареи, кг |
|---|---|---|
| 55 | 12,2 | 14,5 |
| 60 | 13,3 | 15,35 |
| 62 | 13,6 | 15,7 |
| 65 | 14,25 | 16,8 |
| 70 | 14,9 | 18,1 |
| 75 | 15,4 | 19,1 |
| 90 | 20,45 | 23,2 |
| 100 | 21,7 | 24,5 |
| 132 | 33,5 | 37,6 |
| 190 | 47,8 | 49,2 |
| 225 | 51,1 | 61,9 |
Знание веса батареи поможет решить и обратную задачу – рассчитать массу аккумулятора по известной емкости. Это может пригодиться при планировании перевозок партии батарей или при складировании АКБ на стеллажах. Также важен вес источника автономного питания в вопросах охраны труда – именно он определяет, можно ли снимать и переносить батареи в одиночку или вдвоем, надо ли применять специальные приспособления и т.п.
Это может пригодиться при планировании перевозок партии батарей или при складировании АКБ на стеллажах. Также важен вес источника автономного питания в вопросах охраны труда – именно он определяет, можно ли снимать и переносить батареи в одиночку или вдвоем, надо ли применять специальные приспособления и т.п.
Хотя весовые параметры и не являются характеристиками первой важности, все же знание их может оказаться полезным. Вопрос лишь в правильном использовании полученных данных.
Высоковольтный электролит для литий-ионных аккумуляторов
Guoyong Huang, Xi Dong, Jianwei Du, Xiaohua Sun, Botian Li, Haimu Ye. Высоковольтный электролит для литий-ионных аккумуляторов[J]. Прогресс в химии , 2021, 33(5): 855-867.
Литий-ионные аккумуляторы, являющиеся разновидностью перезаряжаемых аккумуляторов с высокой плотностью энергии и мощности, являются первым выбором портативных электронных устройств и постепенно применяются в области транспортных средств. Чтобы лучше соответствовать требованиям приложений, необходимо дополнительно улучшить плотность энергии современных литий-ионных аккумуляторов. В отличие от быстрого развития высоковольтных анодных материалов, традиционный электролит легко разлагается при высоком рабочем напряжении, что сильно препятствует коммерческому применению литий-ионных аккумуляторов с высокой плотностью энергии. Являясь важным компонентом литий-ионных аккумуляторов, электролит оказывает важное влияние на рабочие характеристики литий-ионных аккумуляторов во многих аспектах. Поэтому необходимо срочно улучшить рабочее напряжение электролита для решения проблемы низкой энергоемкости литий-ионных аккумуляторов. В этой статье ход исследований высоковольтного электролита в стране и за рубежом в последние годы обобщается с точки зрения двух аспектов нового органического растворителя и высоковольтной добавки, представлено влияние теоретических расчетов на конструкцию высоковольтного электролита, обобщены и спрогнозированы развитие и перспективы высоковольтного электролита.
Чтобы лучше соответствовать требованиям приложений, необходимо дополнительно улучшить плотность энергии современных литий-ионных аккумуляторов. В отличие от быстрого развития высоковольтных анодных материалов, традиционный электролит легко разлагается при высоком рабочем напряжении, что сильно препятствует коммерческому применению литий-ионных аккумуляторов с высокой плотностью энергии. Являясь важным компонентом литий-ионных аккумуляторов, электролит оказывает важное влияние на рабочие характеристики литий-ионных аккумуляторов во многих аспектах. Поэтому необходимо срочно улучшить рабочее напряжение электролита для решения проблемы низкой энергоемкости литий-ионных аккумуляторов. В этой статье ход исследований высоковольтного электролита в стране и за рубежом в последние годы обобщается с точки зрения двух аспектов нового органического растворителя и высоковольтной добавки, представлено влияние теоретических расчетов на конструкцию высоковольтного электролита, обобщены и спрогнозированы развитие и перспективы высоковольтного электролита.
Содержание
1 ВВЕДЕНИЕ
2 Новые растворители с широким электрохимическим окном
2,1 Флуорированные растворители
2,2 Нитрильные растворители
2,3 SULFONE Rolvents
2.4 Ионные жидкости 9000
3-й-цех
3.1 Фосфорные добавки
3.2 Борированные добавки
3.3 Бензол и гетероциклические добавки
3.4 Прочие
4 Влияние теоретического расчета на приготовление высоковольтного электролита
5 Заключение и прогноз
Ключевые слова: литий-ионные аккумуляторы, электролит, растворитель, добавка, теоретический расчет
Рис. 1 Молекулярная структура некоторых фторированных растворителей
Рис. 2 Молекулярная структура некоторых растворителей на основе нитрила
Рис. 3 Молекулярная структура некоторых растворителей на основе сульфонов
Рис. 4 Молекулярные структуры некоторых ионных жидкостей
Таблица 1 Свойства различных высоковольтных растворителей
| Растворитель | Компоненты | Потенциал окисления | Удерживание пропускной способности/% | ref | |||||
|---|---|---|---|---|---|---|---|---|---|
| Флуорированные | FEC | ||||||||
| Флуорированная | FEC | ||||||||
| FEC | |||||||||
. /EMC/HFPM(2∶3∶1∶4, по объему) /EMC/HFPM(2∶3∶1∶4, по объему) | 5,5 В | 82,0(0,5°С, 200 циклов) | 17 | ||||||
| ЭТФЭХ | LNMO/Li, 1 моль/л LiPF 6 — ЭТФ/ДЭК90/ЭТФЭХ(3∶6081) вес. 6,5 В | 90,5(0,2°C, 300 циклов) | 21 | ||||||
| ТТЭ | LNMO/Li,1 моль/л LiPF 6 90∶1-FEC/DMC/2∶3⇒ЭМС/ТТЭ | 5,5 В | 98,3 (1 C, 200 циклов) | 24 | |||||
| На основе нитрила | ADN | MCMB/LiCoO 2 , 1 моль/л LiTFSI+0. 1 mol/L LiBOB-ADN/EC(1∶1, by volume) | 6. 0 V 0 V | 90.0(C/12, 500 cycles) | 29 | ||||
| GLN | MCMB/LiCoO 2 , 1 моль/л LiTFSI+0,1 моль/л LiBOB-GLN/EC(1∶1, по объему) | 6,0 В | 74,0(C/12, 100 циклов) | 30 | |||||
| МГЛН | , 1 моль/л LiTFSI-MGLN | 4,6 В | 98,0 (0,5 C, 200 циклов) | 31 | |||||
| BN | NMC/графит, 1 моль/л LiPF 6 -BN/EC(9∶1, по объему) + 3% FEC | 4,9 В | 9,10082 9 циклов32 | ||||||
| на основе сульфона | EMS | LNMO/LI, 1 моль/л LIPF 6 -EM/DMC (1∶1, по весу) | 5. 9 V 9 V | 97.8.8.8 (0,2 C, 0.10081 | 5.9 V | 97.8.8.8.8.8.8.8 (1∶1, вес) | 5.9 V | 97.8 97.8.8.8.8 (1∶1, вес) , 100 циклов) | 36 |
| SL | LNMO/графит, 3,25 моль/л LiFSI-SL | 5,0 В | 70.0(0.5 C, 1000 cycles) | 41 | |||||
| MESL | NMC/Li, 1 mol/L LiTFSI-MESL | 4.9 V | 43 | ||||||
| Ionic liquids | N 1123 TFSI | LiMn 2 O 4 /Li, 0,25 моль/л LiTFSI-N 1123 TFSI/EC(8∶2, по объему) | 6,0 В | 8 циклов | 51 | ||||
| PYR 13 TFSI | LNMO/Li, 3 mol/L LiPF 6 -EC/DEC+25% PYR 13 TFSI | 5. 6 V 6 V | 97.0(1 C, 300 cycles) | 52 | |||||
| PYR 1( 2O2) TFSI | LiFePO 4 /Li, 1,0 моль/л LiTFSI-PYR 1(2O2) TFSI/DMC(8:2, по объему) | \ | 9с, цикл C )53 | ||||||
Рис. 5 Механизм формирования пленки различных добавок ячеек NMC532/AG, а также разная толщина и компоненты в соответствующем SEI на аноде[58]
Рис. 6 Молекулярная структура некоторых фосфорных добавок
Рис. 7 Молекулярные структуры некоторых борсодержащих добавок
Рис. 8 Молекулярная структура некоторых бензола и гетероциклических добавок
Рис. 9 Молекулярная структура некоторых добавок
Таблица 2 Свойства различных высоковольтных добавок
| растворитель | Компоненты | Потенциал окисления | Удерживание пропускной способности/% | ref | |||||
|---|---|---|---|---|---|---|---|---|---|
| Фосфор | |||||||||
. | 5,0 В | 80,5(0,5 С, 300 циклов) | 61 | ||||||
| ТФП | NMC532/графит, 1 моль/л LiPF 6 — 6 — WT% TPP | 6,5 В | 58,3 (1 C, 400 циклов, 55 ℃) | 62 | |||||
| TPPO | NMC811/GRAPEIT | 63 | |||||||
| ТПФФП | LLO/графит, 1 моль/л LiPF 6 -EC/EMC(3∶7, мас.%) + 0,5 мас.% TPFPP | 5,4 В | 90,6 (0,3 C, 200 циклов) | ||||||
| Борированный | TIB | NMC622/Li, 1 моль/л LiPF 6 -EC/EMC/DEC(1∶1∶1, мас.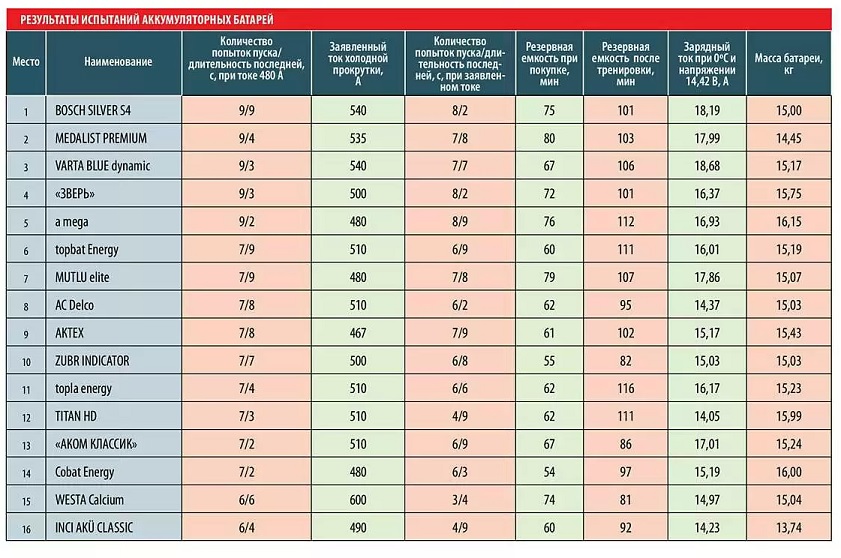 %) + 1 мас. % TIB %) + 1 мас. % TIB | >4,5 В 8 90,321 90,326 8 1 C, 300 циклов) | 68 | |||||
| ТМБ | LiCoO 2 /Li, 1 моль/л LiPF 6 -EC/DMC(1∶1, об.% ТПФ) + 29 мас.0081 | 5,5 В | 81,0(0,1 C, 100 циклов) | 69 | |||||
| TPFPB | LNMO/Li, 1 моль/л LiPF 6 — 90EM wt% TPFPB | 5.6 V | 90.0(0.5 C, 500 cycles) | 70 | |||||
| LiBOB | LNMO/Li, 1. 3 mol/L LiPF 6 -EC/EMC/DMC(3∶4∶ 3, об.%) + 1 мас.% LiBOB 3 mol/L LiPF 6 -EC/EMC/DMC(3∶4∶ 3, об.%) + 1 мас.% LiBOB | >4,6 В | 78,7(0,5 C, 80 циклов, 60 ℃) | 73 | |||||
| LiDFOB | LiCoPO 4 /Li, 1 моль/л LiPF 6 -EC/PC/EMC(1∶1∶3, об.%) + 5 мас.% LiDFOB | 4,9 В | 69,4(0,1 C, 40 cycles) | 82 | |||||
| Benzene Heterocyclic | 4-ABA | Li 1.2 Ni 0.2 Mn 0.6 O 2 /Li, 1 mol/L LiPF 6 -EC/DEC (1∶1, об. %) + 0,25 % масс. 0076 0076 | |||||||
| BzTz | LiCoO 2 /графит, 1 моль/л LiPF 6 -ЭЦ/ДМК(3∶7, об.%) + 1 мас.% BzTz | 5,6 В 7(3.6 V | 90 cycles)85 | ||||||
| 3THP | LNMO/Li, 1 mol/L LiPF 6 -EC/DMC(1∶2, vol%) + 0.25 wt% 3THP | 4.9 V | 91.0(1 C, 350 циклов) | 86 | |||||
| Прочие | VC | NMC532/графит, 1 моль/л LiPF 6 -EC/DMC/PC(1∶3∶%) +1, мас. ВК | 4,7 В | 90,7(1 Кл, 120 циклов) | 90 | ||||
| PS | Li-rich-NMC/Li, 1 моль/л LiPF 6 ⶶ-EC/EMC %) + 1 мас. % PS % PS | 4,6 В | 88,4(0,2 C, 240 циклов) | 89 | |||||
| SA | NMC811/Li, 3√1 моль/л LiPF 6(085EM08 90) 7, мас. %) + 3 мас. % SA | 5,6 В | 93,8 (1 C, 400 циклов) | 91 | |||||
| БДТТ | NMC532/графит, 19 моль/л0085 6 -EC/EMC(3∶7, об.%) + 1 мас.% VC+2 мас.% BDTT | 86,0(0,5 C, 200 циклов) | 92 | ||||||
5
5 Таблица 3 Значения ВЗМО и НСМО некоторых растворителей[21] Молекула HOMO (EV) HOMO (EV) EC -8. 47
47 -0.60 -0,60 979 97.0065 DEC -8.02 -0.42 FEC -8.97 -0.64 ETFEC -8.63 -0.48 DTFEC -9.22 -0.68
Рис. 10 (а) Расчетные значения ВЗМО растворителей и молекул добавок, а также органических молекул, сольватированных ионами Li; (б) Расчетные значения ВЗМО и НСМО различных комплексов с числом молекул растворителя, координирующих с БПКФП [9]. 6]
6]
Рис. 11 Энергии реакции в фазе растворителя (ΔG в ккал·моль-1) ТМСБ и ТМСБ+ с молекулой LiF[97]
Рис. 12 Энергии реакции ТФФ с молекулой HF в фазе растворителя[62]
Таблица 4 Преимущества и недостатки различных высоковольтных растворителей
Категория Advantage Недостаток Флуорированные Высокая стабильность окисления, неплатечная температура Высокая высокая окислитель, неустойчивый, Высокий позевой, высокий уровень Высокий визит. Широкое электрохимическое окно (>8 В), низкое давление паров, высокая температура кипения, высокая температура вспышки Высокая вязкость, плохая смачивающая способность с сепаратором и катодом На основе сульфона Высокий потенциал окисления (>5,4 В), высокая диэлектрическая проницаемость, высокая температура вспышки Высокая вязкость, низкая ионная проводимость Ионная жидкость Высокая химическая и термическая стабильность, широкое электрохимическое окно, негорючий Высокая стоимость, высокая вязкость, плохая смачивающая способность с сепаратором и катодом
[1] Нитта Н. , Ву Ф.С., Ли Дж.Т., Юшин Г. Матер. Сегодня, 2015, 18(5):252.
, Ву Ф.С., Ли Дж.Т., Юшин Г. Матер. Сегодня, 2015, 18(5):252.
doi: 10.1016/j.mattod.2014.10.040 [2] Zeng X Q, Li M, Abd El-Hady D, Alshitari W, Al-Bogami A S, Lu J, Amine K. Adv. Энергетика, 2019, 9(27):1
1.
дои: 10.1002/aenm.v9.27 [3] Pan H L, Han K S, Engelhard M H, Cao R G, Chen J Z, Zhang J G, Mueller K T, Shao Y Y, Liu J. Adv. Функц. мат., 2018, 28(38):1707234.
дои: 10.1002/adfm.v28.38 [4] Girishkumar G, McCloskey B, Luntz A C, Swanson S, Wilcke W. J. Phys. хим. Письма., 2010, 1(14):2193.
дои: 10.1021/jz1005384 [5] Tu S B, Chen X, Zhao X X, Cheng M R, Xiong P X, He Y W, Zhang Q, Xu Y H. Adv. мат., 2018, 30(45):1804581.
дои: 10.1002/adma.v30.45 [6] Чжао З. В., Хуан Дж., Пэн З. К. Анжу. хим. Междунар. ред., 2018, 57(15):3874.
В., Хуан Дж., Пэн З. К. Анжу. хим. Междунар. ред., 2018, 57(15):3874.
doi: 10.1002/anie.201710156 [7] Li J C, Ma C, Chi MF, Liang C D, Dudney N J. Adv. Энергетические мат., 2015, 5(4):1401408.
doi: 10.1002/aenm.201401408 [8] Сантанам Р., Рамбабу Б.Дж. Источники питания, 2010 г., 195(13):4313.
doi: 10.1016/j.jpowsour.2010.01.016 [9] Чжун К., Бонакдарпур А., Чжан М., Гао Ю., Дан Дж. Р. ХимИнформ, 2010, 28(20):205.
[10] Черкашинин Г., Шарат С.У., Ягерманн В. Adv. Энергетические мат., 2017, 7(13):1602321.
doi: 10.1002/aenm.201602321 [11] Yim T, Woo S G, Lim S H, Cho W, Song J H, Han Y K, Kim Y J J Mater. хим. А, 2015, 3(11):6157.
хим. А, 2015, 3(11):6157.
дои: 10.1039/C4TA06531J [12] Song Y M, Han J G, Park S, Lee K T, Choi N S. J. Mater. хим. А, 2014, 2(25):9506.
дои: 10.1039/C4TA01129E [13] Фламме Б., Родригес Гарсия Г., Вейл М., Хаддад М., Фансават П., Ратовеломанана-Видаль В., Чагнес А. Зеленая химия, 2017, 19(8): 1828.
дои: 10.1039/C7GC00252A [14] Чой Н.С., Ю К.Х., Ли К.Ю., Сун М., Ким Х., Ким С.С.Дж. Power Sources, 2006, 161(2):1254.
doi: 10.1016/j.jpowsour.2006.05.049 [15] Моги Р., Инаба М., Чон С.К., Ирияма Ю., Абэ Т., Огуми З. Дж. Электрохим. Soc., 2002, 149(12):A1578.
дои: 10.1149/1.1516770 [16] Ху Л.Б., Чжан З. С., Амин К. Электрохим. коммун., 2013, 35:76.
С., Амин К. Электрохим. коммун., 2013, 35:76.
doi: 10.1016/j.elecom.2013.08.009 [17] Xia L, Xia Y G, Wang C S, Hu H S, Lee S, Yu Q, Chen HC, Liu Z P. ChemElectroChem, 2015, 2(11):1707.
doi: 10.1002/celc.201500286 [18] Smart MC, Ratnakumar BV, Whitcanack LD, Chin KB, Surampudi S, Croft H, Tice D, Staniewicz R.J. Power Sources, 2003, 119/121:349.
дои: 10.1016/S0378-7753(03)00154-X [19] Мацуда Ю., Накадзима Т., Одзава Ю., Кох М., Ямаути А., Кагава М., Аояма Х. Дж. Fluor. хим., 2011, 132(12):1174.
doi: 10.1016/j.jfluchem.2011.07.019 [20] He M N, Hu L B, Xue Z, Su C C, Redfern P, Curtiss L A, Polzin B, von Cresce A, Xu K, Zhang Z C. J. Electrochem. соц., 2015, 162(9).):A1725.
дои: 10.1149/2.0231509jes [21] Zheng X, Liao Y, Zhang ZR, Zhu JP, Ren FC, He HJ, Xiang Y X, Zheng Y Z, Yang Y. J. Energy Chem., 2020, 42:62.
doi: 10.1016/j.jechem.2019.05.023 [22] Kim C K, Shin D S, Kim K E, Shin K, Woo J J, Kim S, Hong S Y, Choi N S. ChemElectroChem, 2016, 3(6):913.
doi: 10.1002/celc.201600025 [23] Ся Л., Ю Л. П., Ху Д., Чен З. Г. Acta Chim. Синица, 2017, 75(12):1183.
дои: 10.6023/A17060284 [24] Xia L, Lee S, Jiang Y B, Li S Q, Liu Z P, Yu LP, Hu D, Wang S H, Liu Y T, Chen G Z. ChemElectroChem, 2019, 6(14):3747.
дои: 10.1002/celc.v6.14 [25] Zhang L L, Ma Y L, Du C Y, Yin G P. Prog. хим., 2014, 26:553.
Prog. хим., 2014, 26:553.
(张玲玲, 马玉林, 杜春雨, 尹鸽平, 化学进展, 2014, 26:553.).
дои: 10.7536/PC130816 [26] Уэ М., Такеда М., Такехара М., Мори С.Дж. Электрохим. Соц., 1997, 144(8):2684.
дои: 10.1149/1.1837882 [27] Duncan H, Salem N, Abu-Lebdeh Y. J. Electrochem. Soc., 2013, 160(6):A838.
дои: 10.1149/2.088306jes [28] Rohan R, Kuo T C, Lin J H, Hsu Y C, Li C C, Lee J T. J. Phys. хим. С, 2016, 120(12):6450.
doi: 10.1021/acs.jpcc.6b00980 [29] Абу-Лебде Ю., Дэвидсон И. Дж. Электрохим. Soc., 2009, 156(1):A60.
дои: 10.1149/1.3023084 [30] Абу-Лебде Й. , Дэвидсон И. Дж. Источники питания, 2009 г., 189(1):576.
, Дэвидсон И. Дж. Источники питания, 2009 г., 189(1):576.
doi: 10.1016/j.jpowsour.2008.09.113 [31] Farhat D, Lemordant D, Jacquemin J, Ghamouss F. J. Electrochem. соц., 2019, 166(14):A3487.
дои: 10.1149/2.1261914jes [32] Хилбиг П., Ибинг Л., Винтер М., Чекич-Ласкович И. Энергии, 2019, 12(15):2869.
doi: 10.3390/en12152869 [33] Zhang W L, Lan X Y, Shi Z W, Li C L. Chem. Бюлл., 2017, 80:1021.
(张文林, 兰晓艳, 史紫薇, 李春利, 化学通报, 2017, 80:1021.).
[34] Цао G Z. Sci. China Mater., 2018, 61(10):1360.
doi: 10.1007/s40843-018-9296-y [35] Flamme B, Rodriguez Garcia G, Weil M, Haddad M, Phansavath P, Ratovelomanana-Vidal V, Chagnes A. Green Chem., 2017, 19(8):1828.
Green Chem., 2017, 19(8):1828.
дои: 10.1039/C7GC00252A [36] Сюэ Л. Г., Уэно К., Ли С. Ю., Энджелл К. А. Дж. Источники питания, 2014, 262:123.
doi: 10.1016/j.jpowsour.2014.03.099 [37] Wu F, Zhou H, Bai Y, Wang H L, Wu C. Приложение ACS. Матер. Интерфейсы, 2015, 7(27):15098.
дои: 10.1021/acsami.5b04477 [38] Hess S, Wohlfahrt-Mehrens M, Wachtler M. J. Electrochem. Соц., 2015, 162(2):A3084.
дои: 10.1149/2.0121502jes [39] Sun X G, Angell C A. Electrochem. Комм., 2005, 7(3):261.
doi: 10.1016/j.elecom.2005.01.010 [40] Левандовски А., Курц Б., Свидерска-Мочек А., Куса Н. Дж. Источники энергии, 2014, 266:132.
doi: 10.1016/j.jpowsour.2014.04.083 [41] Альварадо Дж., Шредер М.А., Чжан М.Х., Бородин О., Гоброгге Э., Ольгин М., Дин М.С., Гобет М., Гринбаум С., Мэн Ю.С., Сюй К. Матер. Сегодня, 2018, 21(4):341.
doi: 10.1016/j.mattod.2018.02.005 [42] Чжан Т., Порчер В., Пайярд Э. Дж. Источники питания, 2018 г., 395:212.
doi: 10.1016/j.jpowsour.2018.05.077 [43] Flamme B, Haddad M, Phansavath P, Ratovelomanana-Vidal V, Chagnes A. ChemElectroChem, 2018, 5(16):2279.
doi: 10.1002/celc.201701343 [44] Макфарлейн Д. Р., Тачикава Н., Форсайт М., Прингл Дж. М., Хоулетт П. К., Эллиотт Г. Д., Дэвис Дж. Х., Ватанабэ М., Саймон П., Энджелл К. А. Energy Environ. наук, 2014, 7(1):232.
дои: 10. 1039/C3EE42099J
1039/C3EE42099J [45] Ватанабэ М., Томас М.Л., Чжан С.Г., Уэно К., Ясуда Т., Докко К. Chem. Rev., 2017, 117(10):7190.
doi: 10.1021/acs.chemrev.6b00504 [46] Zhang S G, Zhang J H, Zhang Y, Deng Y Q. Chem. Rev., 2017, 117(10):6755.
doi: 10.1021/acs.chemrev.6b00509 [47] Эфтехари А., Лю Ю., Чен П. Дж. Источники питания, 2016 г., 334:221.
doi: 10.1016/j.jpowsour.2016.10.025 [48] Seki S, Kobayashi Y, Miyashiro H, Ohno Y, Mita Y, Terada N, Charest P, Guerfi A, Zaghib K. J. Phys. хим. С, 2008, 112(42):16708.
дои: 10.1021/jp805403e [49] Юэ З., Дуня Х., Мэй Х.Ю., МакГарри К., Мандал Б.К. Ионикс, 2019 г., 25(12):5979.
doi: 10.1007/s11581-019-03133-y [50] Bordes E, Douce L, Quitevis E L, Pádua A A H, Costa Gomes M. J. Chem. физ., 2018, 148(19):1
.
дои: 10.1063/1.5010604 [51] Le LTM, Vo T D, Ngo K H P, Okada S, Alloin F, Garg A, Le P M L. J. Mol. лик., 2018, 271:769.
doi: 10.1016/j.molliq.2018.09.068 [52] Wu C J, Rath PC, Patra J, Bresser D, Passerini S, Umesh B, Dong Q F, Lee TC, Chang J K. ACS Appl. Матер. Интерфейсы, 2019, 11(45):42049.
дои: 10.1021/acsami.9b12915 [53] Zhang S J, Li J H, Jiang N Y, Li X Q, Pasupath S, Fang Y X, Liu Q B, Dang D. Chem. Азиат Ж., 2019, 14(16):2810.
[54] Лян Ф. Х., Ю Дж. Л., Ван Д..jpg) , Дун Л., Ма С. С., Чен Дж. Х., Ян Б. Б., Чжу С. З., Гао Й, Ли Ч. Электрохимика Acta, 2019, 307:83.
, Дун Л., Ма С. С., Чен Дж. Х., Ян Б. Б., Чжу С. З., Гао Й, Ли Ч. Электрохимика Acta, 2019, 307:83.
doi: 10.1016/j.electacta.2019.03.110 [55] Xu K, von Cresce AJ Mater. хим., 2011, 21(27):9849.
дои: 10.1039/c0jm04309e [56] Кан Х. Хим. Rev., 2014, 114(23):11503.
дои: 10.1021/cr500003w [57] Цурумаки А., Бранчи М., Ригано А., Пояна Р., Панеро С., Наварра М. А. Electrochimica Acta, 2019, 315:17.
doi: 10.1016/j.electacta.2019.04.190 [58] Qian Y X, Hu S G, Zou X S, Deng Z H, Xu Y Q, Cao Z Z, Kang Y Y, Deng Y F, Shi Q, Xu K, Deng Y H. Материал накопления энергии, 2019 г., 20:208.
[59] Хофманн А., Хёвелинг А. , Бон Н., Мюллер М., Биндер Дж. Р., Ханеманн Т. ChemElectroChem, 2019, 6(20):5255.
, Бон Н., Мюллер М., Биндер Дж. Р., Ханеманн Т. ChemElectroChem, 2019, 6(20):5255.
дои: 10.1002/celc.v6.20 [60] Xu G J, Pang C G, Chen B B, Ma J, Wang X, Chai J C, Wang Q F, An W Z, Zhou X H, Cui GL, Chen L Q. Adv. Энергетические мат., 2018, 8(9):1870038.
дои: 10.1002/aenm.v8.9 [61] Lu D, Xu G J, Hu Z W, Cui Z L, Wang X, Li J D, Huang L, Du X F, Wang Y T, Ma J, Lu X L, Lin H J, Chen C T, Nugroho A A, Tjeng L H, Cui G L. Малые методы, 2019, 3(10):1
6.
дои: 10.1002/smtd.v3.10 [62] Чжао В.М., Чжэн Б.З., Лю Х.Д., Жэнь Ф.К., Чжу Дж.П., Чжэн Г.Р., Чен С.Дж., Лю Р., Ян Х.Р., Ян Ю. Нано Энергия, 2019, 63:103815.
doi: 10.1016/j.nanoen.2019.06.011 [63] Beltrop K, Klein S, Nölle R, Wilken A, Lee JJ, Köster TKJ, Reiter J, Tao L, Liang CD, Winter M, Qi X, Placke T. Chem. мат., 2018, 30(8):2726.
Chem. мат., 2018, 30(8):2726.
doi: 10.1021/acs.chemmater.8b00413 [64] Yue H Y, Dong Z Y, Yang Y G, Han Z L, Wang L, Zhang H S, Yin Y H, Zhang X G, Zhang Z T, Yang S T. J. Colloid Interface Sci., 2020, 559: 236.
doi: 10.1016/j.jcis.2019.10.002 [65] Zuo X X, Fan C J, Liu J S, Xiao X, Wu J H, Nan J M. J. Power Sources, 2013, 229:308.
doi: 10.1016/j.jpowsour.2012.12.056 [66] Yu Q P, Chen Z T, Xing L D, Chen D R, Rong H B, Liu Q F, Li W S. Electrochimica Acta, 2015, 176:919.
doi: 10.1016/j.electacta.2015.07.058 [67] Wang Z S, Xing L D, Li J H, Xu M Q, Li W S. J. Power Sources, 2016, 307:587.
doi: 10.1016/j.jpowsour.2015.11.091 [68] Qin Z M, Hong S, Hong B, Duan B Y, Lai Y Q, Feng JJ Electroanal. хим., 2019, 854:113506.
хим., 2019, 854:113506.
doi: 10.1016/j.jelechem.2019.113506 [69] Liu Q Y, Yang G J, Liu S, Han M, Wang Z X, Chen L Q. Приложение ACS. Матер. Интерфейсы, 2019, 11(19):17435.
дои: 10.1021/acsami.9b03417 [70] Yue H Y, Yang Y G, Xiao Y, Dong Z Y, Cheng S G, Yin Y H, Ling C, Yang W G, Yu Y H, Yang S T. J. Mater. хим. А, 2019, 7(2):594.
дои: 10.1039/C8TA09380F [71] Dong Y N, Young B T, Zhang Y Z, Yoon T, Heskett DR, Hu Y F, Lucht B L. ACS Appl. Матер. Интерфейсы, 2017, 9(24):20467.
дои: 10.1021/acsami.7b01481 [72] Шкроб И. А., Чжу Ю., Марин Т. В., Абрахам Д. П. J. Phys. хим. С, 2013, 117(45):23750.
дои: 10.1021/jp407714p [73] Ha S Y, Han J G, Song Y M, Chun M J, Han S I, Shin WC, Choi N S. Electrochimica Acta, 2013, 104:170.
Electrochimica Acta, 2013, 104:170.
doi: 10.1016/j.electacta.2013.04.082 [74] Xu M Q, Zhou L, Dong Y N, Chen Y J, Garsuch A, Lucht B L. J. Electrochem. Соц., 2013, 160(11):A2005.
дои: 10.1149/2.053311jes [75] Pieczonka N P W, Yang L, Balogh M P, Powell B R, Chemelewski K, Manthiram A, Krachkovskiy S A, Goward GR, Liu M H, Kim J H. J. Phys. хим. С, 2013, 117(44):22603.
дои: 10.1021/jp408717x [76] Ларуш-Асраф Л., Битон М., Теллер Х., Зиниград Э., Аурбах Д. Дж. Источники питания, 2007, 174(2):400.
doi: 10.1016/j.jpowsour.2007.06.171 [77] Чжан С. С. Электрохим. Общ., 2006, 8:1423.
doi: 10.1016/j.elecom.2006.06.016 [78] Чжан С.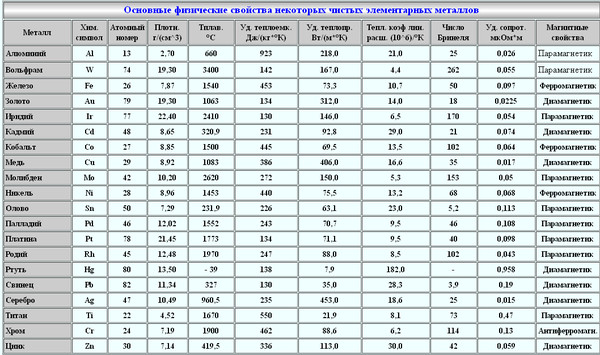 С. Дж. Источники питания, 2007 г., 163 (2): 713.
С. Дж. Источники питания, 2007 г., 163 (2): 713.
doi: 10.1016/j.jpowsour.2006.09.040 [79] Liu J, Chen ZH, Busking S, Amine K. Electrochem. Комм., 2007, 9(3):475.
doi: 10.1016/j.elecom.2006.10.022 [80] Li J, Xie K Y, Lai Y Q, Zhang Z A, Li F Q, Hao X, Chen X J, Liu Y X. J. Power Sources, 2010, 195(16):5344.
doi: 10.1016/j.jpowsour.2010.03.038 [81] Сюй М. К., Чжоу Л., Хао Л. С., Син Л. Д., Ли В. С., Лучт Б. Л. Дж. Источники питания, 2011, 196(16):6794.
doi: 10.1016/j.jpowsour.2010.10.050 [82] Hu M, Wei J P, Xing L Y, Zhou Z. J. Appl. Электрохим., 2012, 42(5):291.
doi: 10.1007/s10800-012-0398-0 [83] Ся Л. , Ли С., Цзян И. Б., Ся И. Г., Чен Г. З., Лю З. П. ACS Omega, 2017, 2(12):8741.
, Ли С., Цзян И. Б., Ся И. Г., Чен Г. З., Лю З. П. ACS Omega, 2017, 2(12):8741.
дои: 10.1021/acsomega.7b01196 [84] Zhuang Y, Lei Y Q, Guan M Y, Du F H, Cao H S, Dai H, Zhou Q, Adkins J, Zheng J W. Electrochimica Acta, 2020, 331:135465.
doi: 10.1016/j.electacta.2019.135465 [85] Хамену Л., Мадзвамусе А., Мохаммед Л., Ли Ю. М., Ко Дж. М., Бон С. И., Ким С. Дж., Чо В. И., Пэк И. Г., Парк Дж. Дж. Инд. хим., 2017, 53:241.
doi: 10.1016/j.jiec.2017.04.031 [86] Tu W Q, Xia P, Li J H, Zeng L Z, Xu M Q, Xing L D, Zhang L P, Yu L, Fan W Z, Li W S. Electrochimica Acta, 2016, 208:251.
doi: 10.1016/j.electacta.2016.05.029 [87] Xia J, Harlow J E, Petibon R, Burns J C, Chen L P, Dahn J R. J. Electrochem. Соц., 2014, 161(4):A547.
J. Electrochem. Соц., 2014, 161(4):A547.
дои: 10.1149/2.049404jes [88] Бирроцци А., Лащински Н., Хекматфар М., фон Замори Дж., Гиффин Г.А., Пассерини С.Дж. Источники энергии, 2016, 325:525.
doi: 10.1016/j.jpowsour.2016.06.054 [89] Пирес Дж., Тимперман Л., Кастетс А., Пенья Дж. С., Дюмон Э., Левассер С., Дедривер Р., Тессье С., Анути М. RSC Adv., 2015, 5(52):42088.
дои: 10.1039/C5RA05650K [90] Хекматфар М., Хаса И., Эгбал Р., Карвалью Д. В., Моретти А., Пассерини С. Adv. Матер. Интерфейсы, 2020, 7(1):1
0.
дои: 10.1002/адми.v7.1 [91] Ши С.Г., Шен С.Х., Пэн Х.С., Луо С.Х., Шен Л.Ф., Шэн В.Дж., Фан Дж.Дж., Ван Ц., Чжан С.Дж., Сюй Б.Б., Сиань Дж. Дж., Вэй Ю.М., Хуан Л., Ли Дж.Т., Сун С.Г. Нано Энергия, 2019, 65:104084.
Дж., Вэй Ю.М., Хуан Л., Ли Дж.Т., Сун С.Г. Нано Энергия, 2019, 65:104084.
doi: 10.1016/j.nanoen.2019.104084 [92] Park E J, Kwon Y G, Yoon S, Cho K Y J Power Sources, 2019, 441:126668.
doi: 10.1016/j.jpowsour.2019.05.074 [93] Сян Ф.Ю., Ван П.П., Ченг Х. Energy Technol., 2020, 8(5):1
дои: 10.1002/ente.v8.5 [94] Liu Q, Xu H L, Wu F, Mu DB, Shi L L, Wang L, Bi J Y, Wu B R. ACS Appl. Энергетические материи, 2019, 2(12):8878.
дои: 10.1021/acsaem.9б01917 [95] Wu B R, Liu Q, Mu D B, Xu H L, Wang L, Shi L L, Gai L, Wu F. RSC Adv., 2016, 6(57):51738.
дои: 10.1039/C6RA09480E [96] Yang T X, Zeng H N, Wang W L, Zhao X Y, Fan W Z, Wang C Y, Zuo X X, Zeng R H, Nan J M. J. Mater. хим. А, 2019, 7(14):8292.
J. Mater. хим. А, 2019, 7(14):8292.
дои: 10.1039/C9TA01293A [97] Хан Ю. К., Ю Дж., Йим Т. Electrochimica Acta, 2016, 215:455.
doi: 10.1016/j.electacta.2016.08.131 [98] Zhang G, Musgrave C B. J. Phys. хим. А, 2007, 111(8):1554.
пмид: 17279730
[1] Чжэн Чен, Чжэньхуа Цзян. Обсуждение некоторых химических проблем полимерного конденсированного состояния в безрастворительной технологии производства полимеров
[Дж]. Успехи химии, 2022, 34(7): 1576-1589.. [2] Ру Цзян, Чэньсюй Лю, Пин Ян, Шули Ю. Химия конденсированного состояния в асимметричном катализе и синтезе
[Дж]. Успехи химии, 2022, 34(7): 1537-1547. [3] Сюмин Ван, Шупинг Ли, Ренджи Хэ, Чуан Юй, Цзя Се, Шицзе Ченг. Квазитвердотельный механизм преобразования серных катодов
[Дж]. Успехи химии, 2022, 34(4): 909-925.
Квазитвердотельный механизм преобразования серных катодов
[Дж]. Успехи химии, 2022, 34(4): 909-925. [4] Чуан Хэ, Шуан Э, Хунхао Ян, Сяоцзе Ли. Углеродные точки в смазочных системах
[Дж]. Успехи химии, 2022, 34(2): 356-369. [5] Цайвэй Ван, Дунцзе Ян, Сюэцин Цю, Вэньли Чжан. Применение пористых углей, полученных из лигнина, для электрохимического накопления энергии
[Дж]. Успехи химии, 2022, 34(2): 285-300. [6] Лонг Чен, Шаобо Хуан, Цзинъи Цю, Хао Чжан, Гаопин Цао. Интерфейс полимерный электролит/анод в твердотельной литиевой батарее
[Дж]. Успехи химии, 2021, 33(8): 1378-1389. [7] Ян Чен, Сяоли Цуй. Анодные материалы из диоксида титана для литий-ионных аккумуляторов
[Дж]. Успехи химии, 2021, 33(8): 1249-1269. [8] Цзяшэн Лу, Цзямяо Чен, Тяньсянь Хэ, Цзинвэй Чжао, Цзюнь Лю, Яньпин Хо. Неорганические твердые электролиты для литий-ионных аккумуляторов
[Дж]. Успехи химии, 2021, 33(8): 1344-1361.
Неорганические твердые электролиты для литий-ионных аккумуляторов
[Дж]. Успехи химии, 2021, 33(8): 1344-1361. [9] Цзиньхуо Гао, Цзяфэн Жуань, Юэпэн Пан, Хао Сун, Цзюньхэ Ян, Шию Чжэн. Высокотемпературные свойства LiNi 0,5 Mn 1,5 O 4 в качестве катодных материалов для высоковольтных литий-ионных аккумуляторов
[Дж]. Успехи химии, 2021, 33(8): 1390-1403. [10] Вентао Ли, Хай Чжун, Яохуа Май. Электролиты для полимеризации на месте для литиевых аккумуляторных батарей
[Дж]. Успехи химии, 2021, 33(6): 988-997. [11] Юсен Дин, Пу Чжан, Хун Ли, Вэньхуань Чжу, Хао Вэй. Состояние исследований и перспективы Li-Se аккумуляторов
[Дж]. Успехи химии, 2021, 33(4): 610-632. [12] Ци Ян, Наньпин Дэн, Боуэн Ченг, Вэйминь Кан.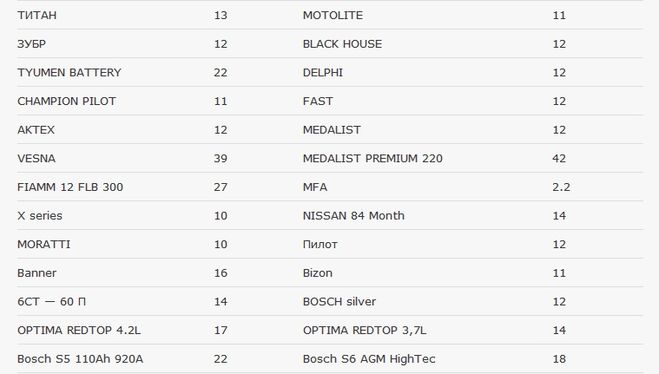 Гелевые полимерные электролиты в литиевых батареях
[Дж]. Успехи химии, 2021, 33(12): 2270-2282.
Гелевые полимерные электролиты в литиевых батареях
[Дж]. Успехи химии, 2021, 33(12): 2270-2282. [13] И Чжан, Мэн Чжан, Ифан Тонг, Хайся Цуй, Панденг Ху, Вэйвэй Хуан. Применение мультикарбонильных ковалентных органических каркасов во вторичных батареях
[Дж]. Успехи химии, 2021, 33(11): 2024-2032. [14] Ю Инь, Чуньхуэй Ма, Вэй Ли, Шоусин Лю. Система растворителей и механизм превращения препарата 5-гидроксиметилфурфурола из глюкозы
[Дж]. Прогресс в химии, 2021, 33 (10): 1856-1873. [15] Дэчао Ван, Янъян Синь, Сяоцянь Ли, Дундонг Яо, Япин Чжэн. Пористые жидкости и их применение для улавливания и разделения газов
[Дж]. Прогресс в химии, 2021, 33 (10): 1874-1886.
Просмотрено Полный текст
Аннотация
Аккумуляторы новой концепции на основе водных Li+/Na+ смешанных ионных электролитов
- Список журналов
- Научные отчеты
- PMC3672879
г.
Научная Республика, 2013 г.; 3: 1946.
Published online 2013 Jun 5. doi: 10.1038/srep01946
, 1 , 1 , a, 1 , 1 , 1 and b, 1
Информация об авторе Примечания к статье Информация об авторских правах и лицензии Отказ от ответственности
- Дополнительные материалы
Аккумуляторы, изготовленные из недорогих и распространенных материалов, работающих в безопасных водных электролитах, привлекательны для крупномасштабного хранения энергии. Натрий-ионный аккумулятор рассматривается как потенциальная альтернатива существующим литий-ионным аккумуляторам. Поскольку количество интеркаляционных соединений натрия, подходящих для водных аккумуляторов, ограничено, мы используем новую концепцию Li 9.1748 + /Na + mixed-ion electrolytes to create two batteries (LiMn 2 O 4 /Na 0.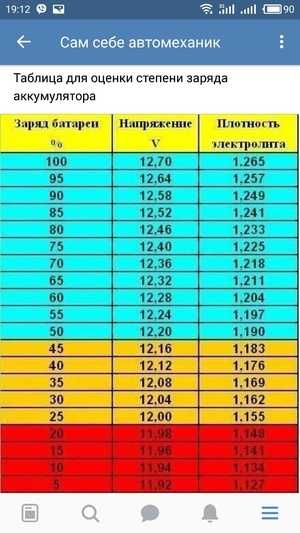 22 MnO 2 and Na 0.44 MnO 2 /TiP 2 O 7 ), основанный на двух электрохимических процессах. Один включает реакцию внедрения/экстракции Li + , а другой в основном относится к реакции экстракции/вставки Na + . Две батареи имеют удельную энергию 17 Втч кг −1 и 25 Втч кг -1 в расчете на общую массу материалов активного электрода соответственно. Кроме того, водная батарея LiMn 2 O 4 /Na 0,22 MnO 2 способна разделять Li + и Na + в отличие от традиционного литиевого «кресла-качалки» благодаря своему специфическому механизму. ионные аккумуляторы. Следовательно, смешанные батареи Li + / Na + предлагают многообещающие применения в накоплении энергии и разделении Li + / Na + .
22 MnO 2 and Na 0.44 MnO 2 /TiP 2 O 7 ), основанный на двух электрохимических процессах. Один включает реакцию внедрения/экстракции Li + , а другой в основном относится к реакции экстракции/вставки Na + . Две батареи имеют удельную энергию 17 Втч кг −1 и 25 Втч кг -1 в расчете на общую массу материалов активного электрода соответственно. Кроме того, водная батарея LiMn 2 O 4 /Na 0,22 MnO 2 способна разделять Li + и Na + в отличие от традиционного литиевого «кресла-качалки» благодаря своему специфическому механизму. ионные аккумуляторы. Следовательно, смешанные батареи Li + / Na + предлагают многообещающие применения в накоплении энергии и разделении Li + / Na + .
Растущее использование возобновляемых источников энергии, таких как солнечная и ветровая энергия, требует соразмерного увеличения емкости хранения энергии для их интеграции в энергосистему. Батареи являются хорошим средством хранения электричества в виде химической энергии. Благодаря хорошей безопасности, высокой ионной проводимости и низкой стоимости, водные перезаряжаемые батареи потенциально выгоднее своих органических аналогов для крупномасштабного хранения энергии 1 .
Батареи являются хорошим средством хранения электричества в виде химической энергии. Благодаря хорошей безопасности, высокой ионной проводимости и низкой стоимости, водные перезаряжаемые батареи потенциально выгоднее своих органических аналогов для крупномасштабного хранения энергии 1 .
Различные батареи на водной основе, такие как щелочные Zn-MnO 2 , свинцово-кислотные, никель-металлогидридные (Ni-MH) и никель-металлические (например, кадмий, железо, цинк и кобальт) имеются в продаже или находятся в стадии обширных исследований 1 ,2 ,3 ,4 ,5 ,6 . Щелочная батарея Zn/MnO 2 — основная батарея; свинцово-кислотные и никель-кадмиевые батареи имеют серьезные экологические проблемы из-за сильно отравляющих металлов свинца и кадмия; Ni-MH дорог из-за использования редкоземельных элементов; Ni-Co, Ni-Fe и Ni-Zn батареи имеют плохую циклическую стабильность. Эти недостатки вышеуказанных систем препятствуют их использованию для крупномасштабного накопления энергии. В последнее время различные металлоионные аккумуляторы на водной основе (например, Li + , Na + , K + и Zn 2+ и др.) на основе химии интеркаляции ионов металлов вызвали большой интерес , 11 , 12 , 13 , 14 , 15 , 16 , 17 , 18 9174. Литий-ионные батареи типа «кресло-качалка» на водной основе с катодными материалами, заимствованными из элементов с органическим электролитом (например, LiMn 2 O 4 /VO 2 , LiMn 2 O 4 /LiV 3 O 8 , LiMn 2 O 4 /TiP 2 O 7 , LiMn 2 O 4 /LiTi 2 (PO 4 ) 3 и LiFePO 4 /LiTi 2 (PO 4 )
В последнее время различные металлоионные аккумуляторы на водной основе (например, Li + , Na + , K + и Zn 2+ и др.) на основе химии интеркаляции ионов металлов вызвали большой интерес , 11 , 12 , 13 , 14 , 15 , 16 , 17 , 18 9174. Литий-ионные батареи типа «кресло-качалка» на водной основе с катодными материалами, заимствованными из элементов с органическим электролитом (например, LiMn 2 O 4 /VO 2 , LiMn 2 O 4 /LiV 3 O 8 , LiMn 2 O 4 /TiP 2 O 7 , LiMn 2 O 4 /LiTi 2 (PO 4 ) 3 и LiFePO 4 /LiTi 2 (PO 4 )5 в целом были разработаны 6, и т. д. срок службы 7 ,8 ,9 ,10 . Исследование, проведенное группой Ся, показало, что циклическая стабильность может быть повышена до коммерческого уровня путем исключения O9.0085 2 , контроль pH электролитов и покрытие кабоном материалов электродов 10 . Куи и др. сообщил о новой калий-ионной батарее с гибридным углеродно-полипиррольным (AC-PPy) анодом и катодом из гексацианоферрата меди (CuHCF), который обеспечивает длительный срок службы и хорошую скорость 12 . Kang et al. исследовал уникальную цинк-ионную батарею на основе Zn-анода, α-MnO 2 катода и мягких электролитов. Он продемонстрировал высокую емкость и возможность быстрой зарядки/разрядки 13 .
Исследование, проведенное группой Ся, показало, что циклическая стабильность может быть повышена до коммерческого уровня путем исключения O9.0085 2 , контроль pH электролитов и покрытие кабоном материалов электродов 10 . Куи и др. сообщил о новой калий-ионной батарее с гибридным углеродно-полипиррольным (AC-PPy) анодом и катодом из гексацианоферрата меди (CuHCF), который обеспечивает длительный срок службы и хорошую скорость 12 . Kang et al. исследовал уникальную цинк-ионную батарею на основе Zn-анода, α-MnO 2 катода и мягких электролитов. Он продемонстрировал высокую емкость и возможность быстрой зарядки/разрядки 13 .
В отличие от лития, калия и цинка, натрий наиболее распространен и экономичен. Поэтому система накопления энергии на основе натрия рассматривается как перспективная технология крупномасштабного хранения энергии. Однако сообщалось только о нескольких материалах для деинтеркаляции/интеркаляции иона натрия в водной среде , 14, , , 15, , , 16, , , 17, , , 18, , , 19, , 2074. Причина в том, что в водной среде происходит несколько побочных реакций, таких как электродные материалы, реагирующие с водой или O 2 , коинтеркаляция протонов в электродные материалы параллельно интеркаляции иона натрия, реакции эволюции H 2 / O 2 и растворение электродных материалов в воде. Уитакр и др. обнаружили, что ион натрия может быть обратимо введен в Na 0,44 MnO 2 благодаря его уникальной туннельной структуре 14 . Но он обеспечивал только удельную емкость 45 мА·ч г −1 при скорости 0,125 C. Ямаки и др. исследовал электрохимическое поведение NaTi 2 (PO 4 ) 3 в водных натриевых электролитах 15 . Его окислительно-восстановительный потенциал составляет -0,6 В по сравнению со стандартным водородным электродом, что указывает на то, что NaTi 2 (PO 4 ) 3 можно использовать в качестве анода для водной натриевой батареи.
Причина в том, что в водной среде происходит несколько побочных реакций, таких как электродные материалы, реагирующие с водой или O 2 , коинтеркаляция протонов в электродные материалы параллельно интеркаляции иона натрия, реакции эволюции H 2 / O 2 и растворение электродных материалов в воде. Уитакр и др. обнаружили, что ион натрия может быть обратимо введен в Na 0,44 MnO 2 благодаря его уникальной туннельной структуре 14 . Но он обеспечивал только удельную емкость 45 мА·ч г −1 при скорости 0,125 C. Ямаки и др. исследовал электрохимическое поведение NaTi 2 (PO 4 ) 3 в водных натриевых электролитах 15 . Его окислительно-восстановительный потенциал составляет -0,6 В по сравнению со стандартным водородным электродом, что указывает на то, что NaTi 2 (PO 4 ) 3 можно использовать в качестве анода для водной натриевой батареи. Водная натрий-ионная батарея «кресло-качалка» состояла из NaTi 2 (PO 4 ) 3 и Na 0,44 MnO 2 , о чем сообщили группы Уитакра и Чанга 161749 ,17 . Куи и др. обнаружили, что материалы с кристаллической структурой берлинской лазури (гексацианоферрат меди и никеля) содержали большие междоузлия, что позволяло вводить и извлекать Na + и/или K + (ссылка 18 , 19 ). Их емкости находились в диапазоне 50–60 мАч·г −1 . Одним словом, требуется гораздо больше работы по исследованию новых материалов с интеркалированным натрием, чтобы сделать водные натриевые батареи жизнеспособными в области крупномасштабного хранения энергии.
Водная натрий-ионная батарея «кресло-качалка» состояла из NaTi 2 (PO 4 ) 3 и Na 0,44 MnO 2 , о чем сообщили группы Уитакра и Чанга 161749 ,17 . Куи и др. обнаружили, что материалы с кристаллической структурой берлинской лазури (гексацианоферрат меди и никеля) содержали большие междоузлия, что позволяло вводить и извлекать Na + и/или K + (ссылка 18 , 19 ). Их емкости находились в диапазоне 50–60 мАч·г −1 . Одним словом, требуется гораздо больше работы по исследованию новых материалов с интеркалированным натрием, чтобы сделать водные натриевые батареи жизнеспособными в области крупномасштабного хранения энергии.
Поскольку материалы с интеркалированным натрием, подходящие для водных сред, ограничены, для создания перезаряжаемых батарей используется инновационная концепция электролитов со смешанными ионами Li + / Na + , как показано на рис. В таких батареях одна сторона связана с иммиграцией Li + между электролитами и электродом, а другая относится к обмену Na + между электродом и электролитами. При зарядке и разрядке общая концентрация Li + и Na + фиксируется для обеспечения зарядовой нейтральности электролитов, но изменяется соотношение Li + /Na + . Они отличаются от традиционных «кресел-качалок» литий-ионных аккумуляторов на основе иммиграции Li + между катодом и анодом. При этом две системы на основе смешанных электролитов Li 2 SO 4 /Na 2 SO 4 (LiMn 2 O 4 /Na 0,22 8 29080 Mn0085 0,44 MnO 2 /TiP 2 O 7 ), о которых, насколько нам известно, ранее не сообщалось. Емкость, рабочее напряжение и стабильность таких батарей зависят от электролитов. Система LiMn 2 O 4 /Na 0,22 MnO 2 для разделения Li + и Na + , основанная на уникальном механизме смешанной ионной батареи.
В таких батареях одна сторона связана с иммиграцией Li + между электролитами и электродом, а другая относится к обмену Na + между электродом и электролитами. При зарядке и разрядке общая концентрация Li + и Na + фиксируется для обеспечения зарядовой нейтральности электролитов, но изменяется соотношение Li + /Na + . Они отличаются от традиционных «кресел-качалок» литий-ионных аккумуляторов на основе иммиграции Li + между катодом и анодом. При этом две системы на основе смешанных электролитов Li 2 SO 4 /Na 2 SO 4 (LiMn 2 O 4 /Na 0,22 8 29080 Mn0085 0,44 MnO 2 /TiP 2 O 7 ), о которых, насколько нам известно, ранее не сообщалось. Емкость, рабочее напряжение и стабильность таких батарей зависят от электролитов. Система LiMn 2 O 4 /Na 0,22 MnO 2 для разделения Li + и Na + , основанная на уникальном механизме смешанной ионной батареи.
Открыть в отдельном окне
Схема смешанной ионно-ионной батареи Li + / Na + .
Интеркаляционные соединения лития и интеркаляционные соединения натрия используются для анода и катода соответственно. При зарядке (или разрядке) на аноде происходит накопление (или выделение) Li + , а на катоде — выделение (или накопление) Na + .
Характеристики Na
0,44 MnO 2, LiMn 2 O 4 и TiP 2 O 7 Подробные процедуры синтеза трех вышеуказанных материалов описаны в Методах. Оксиды марганца образуют богатое структурное семейство, включающее материалы с туннельной структурой 1D-, 2D-, 3D-типа. Среди них Na 0,44 MnO 2 принадлежит к пространственной группе Pbam с орторомбической структурой (см. Дополнительный рисунок S1). Ионы марганца находятся в двух различных средах: все ионы Mn 4+ и половина ионов Mn 9Ионы 1748 3+
находятся в октаэдрических позициях, тогда как другие ионы Mn 3+ собраны в квадратно-пирамидальном окружении. Последний образует реберные цепочки, связанные вершинами с двумя двойными и одной тройной октаэдрической цепью, что приводит к образованию двух типов туннелей (S-образный туннель и пятиугольный туннель). Площадки в S-образном туннеле заполнены примерно наполовину, а площадки в пятиугольном туннеле заняты почти полностью. Исследования Ab initio показывают, что половина ионов натрия может обратимо встраиваться в Na 0,44 MnO 2 в диапазоне -0,10–0,85 В по сравнению с насыщенным каломельным электродом (SCE), что дает теоретическую емкость 60 мА·ч г -1 (ссылка 19 ). Рентгенограмма (XRD) порошков Na 0,44 MnO 2 на дополнительном рисунке S1 показывает пять сильных пиков при 14,2 °, 16,8 °, 19,7 °, 34,2 ° и 37,6 °, отвечающих отражениям ( 130), (140), (150), (280) и (151) плоскость орторомбической структуры соответственно 21 ,22 . Кроме того, не обнаруживаются пики, относящиеся к примеси Mn 2 O 3 14 ,22 .
Последний образует реберные цепочки, связанные вершинами с двумя двойными и одной тройной октаэдрической цепью, что приводит к образованию двух типов туннелей (S-образный туннель и пятиугольный туннель). Площадки в S-образном туннеле заполнены примерно наполовину, а площадки в пятиугольном туннеле заняты почти полностью. Исследования Ab initio показывают, что половина ионов натрия может обратимо встраиваться в Na 0,44 MnO 2 в диапазоне -0,10–0,85 В по сравнению с насыщенным каломельным электродом (SCE), что дает теоретическую емкость 60 мА·ч г -1 (ссылка 19 ). Рентгенограмма (XRD) порошков Na 0,44 MnO 2 на дополнительном рисунке S1 показывает пять сильных пиков при 14,2 °, 16,8 °, 19,7 °, 34,2 ° и 37,6 °, отвечающих отражениям ( 130), (140), (150), (280) и (151) плоскость орторомбической структуры соответственно 21 ,22 . Кроме того, не обнаруживаются пики, относящиеся к примеси Mn 2 O 3 14 ,22 . Частицы также хорошо кристаллизованы и растут анизотропно, что приводит к форме наностержней. Наностержни демонстрируют превосходное упорядочение атомов и всегда демонстрируют кристаллическую плоскость (110) с межплоскостным расстоянием 0,87 нм (дополнительный рисунок S1).
Частицы также хорошо кристаллизованы и растут анизотропно, что приводит к форме наностержней. Наностержни демонстрируют превосходное упорядочение атомов и всегда демонстрируют кристаллическую плоскость (110) с межплоскостным расстоянием 0,87 нм (дополнительный рисунок S1).
Шпинель LiMn 2 O 4 имеет трехмерную туннельную структуру с пространственной группой Fd3m . Ионы Mn имеют октаэдрическую координацию с атомами кислорода, а октаэдры MnO 6 имеют общие ребра в трехмерном хозяине для гостевых ионов Li (дополнительный рисунок S2). Протон также может диффундировать в туннель из-за его малого ионного радиуса. Рентгенограмма синтезированных порошков LiMn 2 O 4 подтверждает наличие чистой фазы шпинели. Анализ с помощью сканирующей электронной микроскопии (СЭМ) показывает, что порошки состоят из микросфер (дополнительный рисунок S2).
Пирофосфат TiP 2 O 7 имеет кубическую надстройку 3 × 3 × 3 с пространственной группой Pa3 .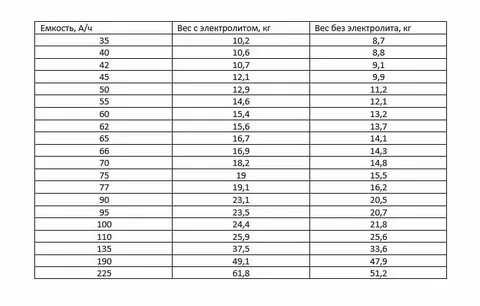 Он состоит из октаэдра TiO 6 и тетраэдра PO 4 , имеющих общие углы в трехмерной сети (дополнительный рисунок S3). Такой каркас может приспособить Li + для вставки и извлечения, что приводит к теоретической емкости 121 мАч г -1 . Покрытый углеродом TiP 2 O 7 с чистой кубической фазой синтезируется методом твердофазной реакции (см. Метод и дополнительный рисунок S3). Он демонстрирует высокодисперсную морфологию частиц. ПЭМ-изображение TiP 9 с высоким разрешениемЧастица 0085 2 O 7 показывает, что аморфный углерод со средней толщиной 7 нм равномерно покрыт на поверхности частицы (дополнительный рисунок S3). Количество углерода в материалах составляет около 16 %, что оценивается термогравиметрическим анализом.
Он состоит из октаэдра TiO 6 и тетраэдра PO 4 , имеющих общие углы в трехмерной сети (дополнительный рисунок S3). Такой каркас может приспособить Li + для вставки и извлечения, что приводит к теоретической емкости 121 мАч г -1 . Покрытый углеродом TiP 2 O 7 с чистой кубической фазой синтезируется методом твердофазной реакции (см. Метод и дополнительный рисунок S3). Он демонстрирует высокодисперсную морфологию частиц. ПЭМ-изображение TiP 9 с высоким разрешениемЧастица 0085 2 O 7 показывает, что аморфный углерод со средней толщиной 7 нм равномерно покрыт на поверхности частицы (дополнительный рисунок S3). Количество углерода в материалах составляет около 16 %, что оценивается термогравиметрическим анализом.
Selectivity of Na
0.44 MnO 2 for Na + against Li + The electrochemical properties of prepared Na 0.44 MnO 2 in different electrolytes are investigated by cyclic voltammetry (CV) and galvanostatic методы. отображает три обратимые окислительно-восстановительные пары прибл. 0,05, 0,28 и 0,46 В относительно SCE в водном растворе Na 2 SO 4 электролиты, соответствующие введению и извлечению Na + (арт. 13 и 20 ). В смешанных электролитах Li 2 SO 4 /Na 2 SO 4 эти окислительно-восстановительные пары все еще существуют, но их потенциалы отличаются от потенциалов в электролитах Na 2 SO 4 . В электролитах Li 2 SO 4 три пика необратимого окисления при 0,08 В, 0,31 В и 0,49 В, связанные с удалением Na + из Na 0,44 MnO 2 наблюдаются в первом цикле. В последующих циклах видны очень слабые пики, связанные с внедрением и экстракцией Li + . Он заключает, что только очень небольшое количество Li + может быть обратимо вставлено/отключено в/из Na 0,44 MnO 2 , несмотря на его меньший ионный радиус (76 pm) по сравнению с Na + ( 102 pm).
отображает три обратимые окислительно-восстановительные пары прибл. 0,05, 0,28 и 0,46 В относительно SCE в водном растворе Na 2 SO 4 электролиты, соответствующие введению и извлечению Na + (арт. 13 и 20 ). В смешанных электролитах Li 2 SO 4 /Na 2 SO 4 эти окислительно-восстановительные пары все еще существуют, но их потенциалы отличаются от потенциалов в электролитах Na 2 SO 4 . В электролитах Li 2 SO 4 три пика необратимого окисления при 0,08 В, 0,31 В и 0,49 В, связанные с удалением Na + из Na 0,44 MnO 2 наблюдаются в первом цикле. В последующих циклах видны очень слабые пики, связанные с внедрением и экстракцией Li + . Он заключает, что только очень небольшое количество Li + может быть обратимо вставлено/отключено в/из Na 0,44 MnO 2 , несмотря на его меньший ионный радиус (76 pm) по сравнению с Na + ( 102 pm). Более того, Na + могут быть селективно экстрагированы и вставлены из/в Na 0,44 MnO 2 в присутствии Li + и Na 0,44 MnO 2 проявляет высокую селективность Na + по отношению к Li + . От –0,1 до 0,65 В против SCE, емкость разряда Na 0,44 MNO 2 в 1 м NA 2 SO 4 , 1 M NA 2 SO 4 + 0,125 M LI 2 2 SO 4 + 0,125 M LI 2 2 SO 4 , 1 M Na 2 SO 4 + 0,25 M Li 2 SO 4 и 1 M Na 2 SO 4 + 0,5 м LI 2 SO 4 Электролиты составляют 62,1, 60,7, 60,2 и 57,9 мэх соответственно (дополнительный рис. S4). Эти значения намного больше, чем 45 мА·ч·г -1·, полученные группой Уитакра, и хорошо согласуются с теоретической емкостью 60 мА·ч·г·-1·, что указывает на то, что примерно половина ионов натрия содержится в Na 0,44 MnO 2 может быть обратимо интеркалирован в туннели Na 0,44 MnO 2 в смешанных электролитах.
Более того, Na + могут быть селективно экстрагированы и вставлены из/в Na 0,44 MnO 2 в присутствии Li + и Na 0,44 MnO 2 проявляет высокую селективность Na + по отношению к Li + . От –0,1 до 0,65 В против SCE, емкость разряда Na 0,44 MNO 2 в 1 м NA 2 SO 4 , 1 M NA 2 SO 4 + 0,125 M LI 2 2 SO 4 + 0,125 M LI 2 2 SO 4 , 1 M Na 2 SO 4 + 0,25 M Li 2 SO 4 и 1 M Na 2 SO 4 + 0,5 м LI 2 SO 4 Электролиты составляют 62,1, 60,7, 60,2 и 57,9 мэх соответственно (дополнительный рис. S4). Эти значения намного больше, чем 45 мА·ч·г -1·, полученные группой Уитакра, и хорошо согласуются с теоретической емкостью 60 мА·ч·г·-1·, что указывает на то, что примерно половина ионов натрия содержится в Na 0,44 MnO 2 может быть обратимо интеркалирован в туннели Na 0,44 MnO 2 в смешанных электролитах. Уникальная форма наностержня и хорошая кристалличность Na 0,44 MnO 2 могут объяснить его высокую емкость и хорошую обратимость. Также установлено, что емкость немного снижается с увеличением соотношения Li + /Na + .
Уникальная форма наностержня и хорошая кристалличность Na 0,44 MnO 2 могут объяснить его высокую емкость и хорошую обратимость. Также установлено, что емкость немного снижается с увеличением соотношения Li + /Na + .
Открыть в отдельном окне
Циклические вольтамперограммы в различных электролитах.
(а), для Na 0,44 MnO 2 электрод при скорости сканирования 0,5 мВс −1 . (б) для электрода LiMn 2 O 4 при скорости сканирования 0,1 мВ с -1 . (в) для покрытого углеродом электрода TiP 2 O 7 при скорости сканирования 0,3 мВ с -1 . Черная линия: в 1 M Na 2 SO 4 ; красная линия: в 1 M Na 2 SO 4 + 0,125 M Li 2 SO 4 ; зеленая линия: в 1 M Na 2 SO 4 + 0,25 M Li 2 SO 4 ; синяя линия: в 1 M Na 2 SO 4 + 0,5 M Li 2 SO 4 ; голубая линия: в 1 M Li 2 SO 4 .
Селективность LIMN
2 O 4 и TIP 2 O 7 для LI + против NA + . Описывает CV Curves of Limn 2 . 4. . В электролитах Li 2 SO 4 две пары окислительно-восстановительных пиков расположены при 0,81 В и 0,93 В (потенциал окисления в зависимости от SCE), что указывает на двухфазное поведение извлечения/введения лития, присущее шпинели LiMn 2 О 4 . В смешанных электролитах окислительно-восстановительные пики все же существуют, но их потенциалы и токи относительно ниже, чем в электролитах Li 2 SO 4 . Однако в электролитах Na 2 SO 4 наблюдаются только два пика необратимого окисления, что указывает на то, что Na + практически не может диффундировать в объем LiMn 2 O 4 . Между тем, пиковый потенциал уменьшается за счет уменьшения Li + / Na + . соотношение, как и следовало ожидать из кинетических соображений. На кинетику введения и экстракции сильно влияет концентрация лития. В ходе реакции внедрения Li + уменьшение концентрации лития приводит к уменьшению предельного диффузионного тока и, следовательно, к увеличению концентрационного перенапряжения, что приводит к отрицательному сдвигу потенциала пика. С точки зрения реакции экстракции Li + уменьшение концентрации лития приводит к более легкому удалению Li + из объемного LiMn 2 O 4 , что также смещает потенциал пика в сторону меньшего значения. Также наблюдается, что как потенциал плато заряда / разряда, так и емкость уменьшаются с уменьшением соотношения Li + / Na + (см. Дополнительный рис. S4).
соотношение, как и следовало ожидать из кинетических соображений. На кинетику введения и экстракции сильно влияет концентрация лития. В ходе реакции внедрения Li + уменьшение концентрации лития приводит к уменьшению предельного диффузионного тока и, следовательно, к увеличению концентрационного перенапряжения, что приводит к отрицательному сдвигу потенциала пика. С точки зрения реакции экстракции Li + уменьшение концентрации лития приводит к более легкому удалению Li + из объемного LiMn 2 O 4 , что также смещает потенциал пика в сторону меньшего значения. Также наблюдается, что как потенциал плато заряда / разряда, так и емкость уменьшаются с уменьшением соотношения Li + / Na + (см. Дополнительный рис. S4).
Подобное свойство ионно-литиевого сита наблюдается для TiP 2 O 7 . показаны CV-кривые TiP 2 O 7 в различных электролитах. В Ли 2 SO 4 , пара пиков интеркаляции и экстракции Li + появляется при -0,72 В и -0,60 В по сравнению с SCE 23 . В смешанных электролитах потенциал пика уменьшается с уменьшением отношения Li + /Na + . Аналогичная тенденция наблюдается и для материала LiMn 2 O 4 . В электролитах Na 2 SO 4 пиков окислительно-восстановительного потенциала не наблюдается, что означает, что TiP 2 O 7 может только накапливать и выделять Li + . Зарядно-разрядная емкость между 0 В и -0,9 В по сравнению с SCE в смешанных электролитах близка к емкости в электролитах Li 2 SO 4 , что указывает на то, что Na + не оказывает очевидного влияния на емкость TiP . 2 O 7 (дополнительный рис. S4). Кулоновская эффективность в 1 м Li 2 SO 4 , 1 M N NA 2 SO 4 + 0,5 м LI 2 SO 4 , 1 M NA 2 SO 4 + 0,25 М. Ли 2 SO 4 и 1 M Na 2 SO 4 + 0,125 M Li 2 SO 4 электролиты составляют 86,7 %, 81,3 % и 92,3 % соответственно.
В смешанных электролитах потенциал пика уменьшается с уменьшением отношения Li + /Na + . Аналогичная тенденция наблюдается и для материала LiMn 2 O 4 . В электролитах Na 2 SO 4 пиков окислительно-восстановительного потенциала не наблюдается, что означает, что TiP 2 O 7 может только накапливать и выделять Li + . Зарядно-разрядная емкость между 0 В и -0,9 В по сравнению с SCE в смешанных электролитах близка к емкости в электролитах Li 2 SO 4 , что указывает на то, что Na + не оказывает очевидного влияния на емкость TiP . 2 O 7 (дополнительный рис. S4). Кулоновская эффективность в 1 м Li 2 SO 4 , 1 M N NA 2 SO 4 + 0,5 м LI 2 SO 4 , 1 M NA 2 SO 4 + 0,25 М. Ли 2 SO 4 и 1 M Na 2 SO 4 + 0,125 M Li 2 SO 4 электролиты составляют 86,7 %, 81,3 % и 92,3 % соответственно.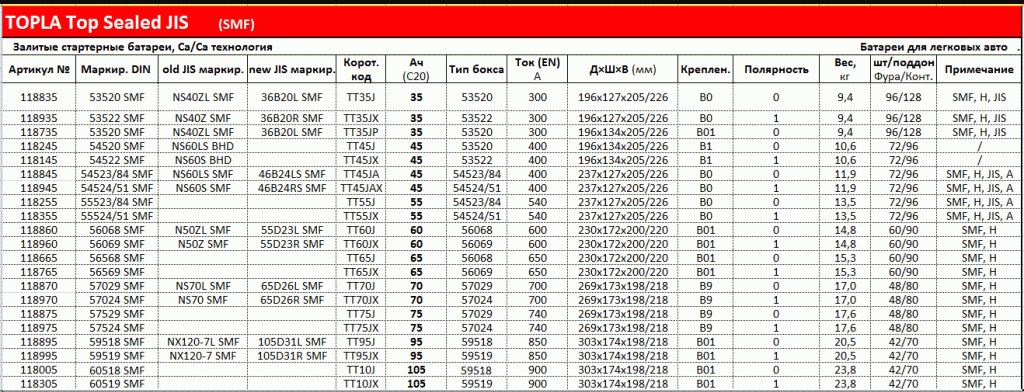 Все они намного ниже теоретического 100%. Это может быть в основном вызвано разложением воды и следов кислорода в электролитах. Согласно уравнению Нернста, теоретический эволюционный потенциал H 2 при pH = 7 находится при -0,66 В относительно SCE, так же, как и окислительно-восстановительный потенциал Ti 3+ /Ti 4+ в TiP 2 O 7 (-0,66 В против SCE). Это означает, что эволюция H 2 может быть параллельна внедрению Li + в TiP 2 O 7 при разрядке. Отрицательные электроды-кандидаты для водной литий-ионной батареи оказались чувствительными к кислороду и воде в разряженном состоянии 10 . Потенциал плато заряда/разряда уменьшается с уменьшением отношения Li + /Na + , что согласуется с явлениями, наблюдаемыми в экспериментах CV.
Все они намного ниже теоретического 100%. Это может быть в основном вызвано разложением воды и следов кислорода в электролитах. Согласно уравнению Нернста, теоретический эволюционный потенциал H 2 при pH = 7 находится при -0,66 В относительно SCE, так же, как и окислительно-восстановительный потенциал Ti 3+ /Ti 4+ в TiP 2 O 7 (-0,66 В против SCE). Это означает, что эволюция H 2 может быть параллельна внедрению Li + в TiP 2 O 7 при разрядке. Отрицательные электроды-кандидаты для водной литий-ионной батареи оказались чувствительными к кислороду и воде в разряженном состоянии 10 . Потенциал плато заряда/разряда уменьшается с уменьшением отношения Li + /Na + , что согласуется с явлениями, наблюдаемыми в экспериментах CV.
LIMN
2 O 4 /NA 0,22 MNO 2 и NA 0,44 MNO 2 /TIP 2 O 7 Battery 9000 2 .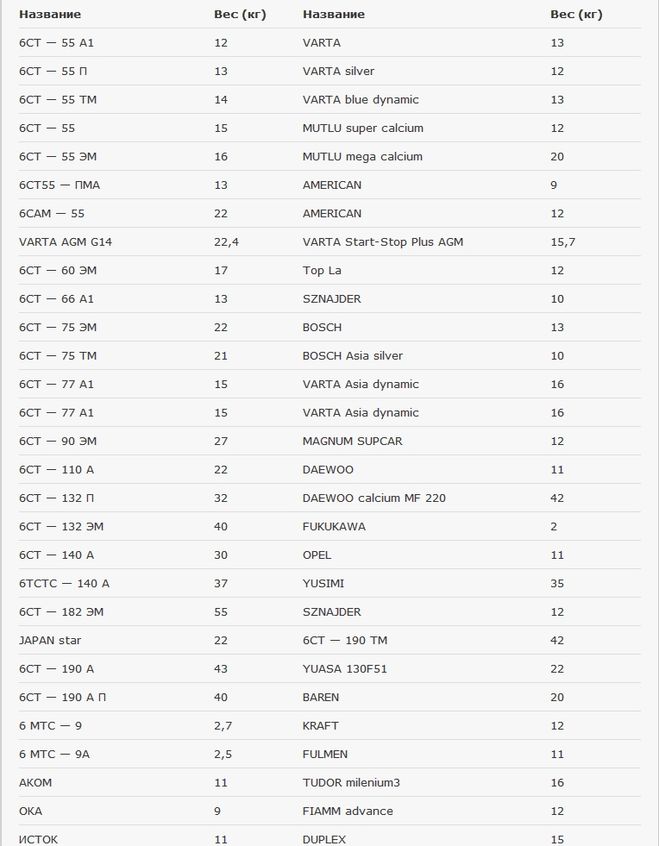 0.44 MnO 2 , LiMn 2 O 4 and TiP 2 O 7 , we assembled two practical prototypes of mixed-ion batteries (LiMn 2 O 4 /Na 0.22 MnO 2 и Na 0,44 MnO 2 /TiP 2 O 7 ). Иллюстрирует принцип LIMN 2 O 4 /NA 0,22 MNO 2 (NA 0,22 MNO 2 получена с помощью электрохимического окисления NA 0,44 MNO ). Одна сторона в основном связана с иммиграцией Na + между электролитами и Na 0,22 MnO 2 , а другая сторона связана с внедрением/экстракцией Li + в/из LiMn 2 O 4 . Типичные кривые заряда-разряда батареи LiMn 2 O 4 /Na 0,22 MnO 2 в двух разных электролитах показаны на . Такая батарея может обеспечить емкость 29 мА·ч г −1 (скорость 0,25 C) на основе общей массы активных материалов от 0,2 В до 1,05 В.
0.44 MnO 2 , LiMn 2 O 4 and TiP 2 O 7 , we assembled two practical prototypes of mixed-ion batteries (LiMn 2 O 4 /Na 0.22 MnO 2 и Na 0,44 MnO 2 /TiP 2 O 7 ). Иллюстрирует принцип LIMN 2 O 4 /NA 0,22 MNO 2 (NA 0,22 MNO 2 получена с помощью электрохимического окисления NA 0,44 MNO ). Одна сторона в основном связана с иммиграцией Na + между электролитами и Na 0,22 MnO 2 , а другая сторона связана с внедрением/экстракцией Li + в/из LiMn 2 O 4 . Типичные кривые заряда-разряда батареи LiMn 2 O 4 /Na 0,22 MnO 2 в двух разных электролитах показаны на . Такая батарея может обеспечить емкость 29 мА·ч г −1 (скорость 0,25 C) на основе общей массы активных материалов от 0,2 В до 1,05 В. Кулоновский КПД батареи после первого цикла превышает 90%, что свидетельствует о его хорошей обратимости. показывает график процента сохранения разрядной емкости в зависимости от количества циклов. В обоих электролитах скорость угасания емкости в первые 10 циклов значительно выше, чем после 10 циклов. После 45 циклов 83% исходной емкости остается в 1 M Na 2 SO 4 + 0,125 M Li 2 SO 4 . Но в 1 M Na 2 SO 4 + 0,5 M Li 2 SO 4 емкость остается только 61% от исходной. Следовательно, его стабильность при циклировании можно повысить, уменьшив соотношение Li + /Na + . Производительность батареи LiMn 2 O 4 /Na 0,22 MnO 2 в 1 M Na 2 SO 4 + 0,125 M 908 SO Li 26085 4 также проверен. Разрядная емкость 27,9, 25,5, 19,2, 11,7 и 7,7 мА·ч г -1 получена при скорости 0,5, 1, 2, 4 и 8 C соответственно (см.
Кулоновский КПД батареи после первого цикла превышает 90%, что свидетельствует о его хорошей обратимости. показывает график процента сохранения разрядной емкости в зависимости от количества циклов. В обоих электролитах скорость угасания емкости в первые 10 циклов значительно выше, чем после 10 циклов. После 45 циклов 83% исходной емкости остается в 1 M Na 2 SO 4 + 0,125 M Li 2 SO 4 . Но в 1 M Na 2 SO 4 + 0,5 M Li 2 SO 4 емкость остается только 61% от исходной. Следовательно, его стабильность при циклировании можно повысить, уменьшив соотношение Li + /Na + . Производительность батареи LiMn 2 O 4 /Na 0,22 MnO 2 в 1 M Na 2 SO 4 + 0,125 M 908 SO Li 26085 4 также проверен. Разрядная емкость 27,9, 25,5, 19,2, 11,7 и 7,7 мА·ч г -1 получена при скорости 0,5, 1, 2, 4 и 8 C соответственно (см. Дополнительный рисунок S5).
Дополнительный рисунок S5). Открыть в отдельном окне
LiMn 2 O 4 /Na 0,22 MnO 2 смешанная ионная батарея.
(а), Схема аккумулятора. (б) Кривые зарядки-разрядки при скорости 0,25 C в 1 M Na 2 SO 4 + 0,5 M Li 2 СО 4 . (c) Кривые зарядки-разрядки при скорости 0,25 C в 1 M Na 2 SO 4 + 0,125 M Li 2 SO 4 . (d) Испытания аккумулятора на цикличность при температуре 0,25 C в смешанных электролитах. (1 C = 60 мАч г -1 ).
Принцип работы смешанной ионной батареи, состоящей из анода TiP 2 O 7 и катода Na 0,44 MnO 2 , описан в . Как показано, вставка и удаление Li + происходят на аноде, а высвобождение и хранение Na + происходят на катоде. изображают профили заряда-разряда батареи Na 0,44 MnO 2 /TiP 2 O 7 в двух разных электролитах.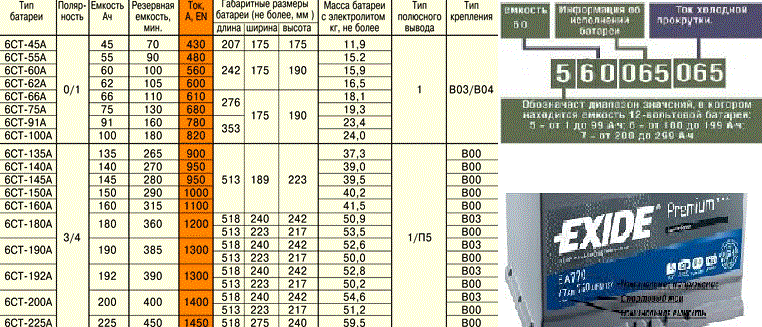 Рабочее напряжение батареи колеблется от 0,65 В до 1,3 В. А напряжение плато зарядки/разрядки в 1 M Na 2 SO 4 + 0,125 M Li 2 SO 4 составляет 30 мВ–4. выше, чем в 1 M Na 2 SO 4 + 0,25 M Li 2 SO 4 . В диапазоне от 0,65 В до 1,3 В батарея может давать обратимую емкость 23,5 мА·ч г·9.1748 -1 в 1 м NA 2 SO 4 + 0,25 м LI 2 SO 4 и 25,0 мАч G -1 в 1 M NA 2 SO 4 + 0,1255 M LI 2 SO 4 + 0,1255 M LI 2 SO 4 + 0,1255 M LI 2 . 2 SO 4 при скорости 0,4 C. При этом он показывает хороший кулоновский КПД после первого цикла (>96%) в обоих электролитах, что свидетельствует о хорошей обратимости аккумулятора. Также исследуется его циклическая устойчивость. Скорость угасания разрядной емкости намного выше в первые 10 циклов, чем после 10 циклов (см.
Рабочее напряжение батареи колеблется от 0,65 В до 1,3 В. А напряжение плато зарядки/разрядки в 1 M Na 2 SO 4 + 0,125 M Li 2 SO 4 составляет 30 мВ–4. выше, чем в 1 M Na 2 SO 4 + 0,25 M Li 2 SO 4 . В диапазоне от 0,65 В до 1,3 В батарея может давать обратимую емкость 23,5 мА·ч г·9.1748 -1 в 1 м NA 2 SO 4 + 0,25 м LI 2 SO 4 и 25,0 мАч G -1 в 1 M NA 2 SO 4 + 0,1255 M LI 2 SO 4 + 0,1255 M LI 2 SO 4 + 0,1255 M LI 2 . 2 SO 4 при скорости 0,4 C. При этом он показывает хороший кулоновский КПД после первого цикла (>96%) в обоих электролитах, что свидетельствует о хорошей обратимости аккумулятора. Также исследуется его циклическая устойчивость. Скорость угасания разрядной емкости намного выше в первые 10 циклов, чем после 10 циклов (см. ). Аналогичные явления наблюдаются и для LiMn 2 O 4 /Na 0,22 MnO 2 система. В 1 М электролитах Na 2 SO 4 + 0,125 M Li 2 SO 4 после 10 и 50 циклов сохраняется 83 % и 62 % исходной разрядной емкости соответственно. В случае 1 M Na 2 SO 4 + 0,25 M Li 2 SO 4 электролитов сохраняется только 76% и 58% исходной разрядной емкости. В результате повышение Na + /Li 9Соотношение 1748 + может улучшить циклическую стабильность батареи Na 0,44 MnO 2 /TiP 2 O 7 . Исследование возможностей сброса NA 0,44 MNO 2 /TIP 2 O 7 Батарея в 1 м NA 2 SO 4 + 0,125 м LI 2 SO 4 + 0,125 м LI 2 SO 4 IS Показывается в Попульке. Рис. S5. Разрядная емкость 23,3, 20,6, 17,7, 14,5 и 11,1 мА·ч г -1 найдена при скорости 0,5, 1, 2, 4 и 8 C соответственно.
). Аналогичные явления наблюдаются и для LiMn 2 O 4 /Na 0,22 MnO 2 система. В 1 М электролитах Na 2 SO 4 + 0,125 M Li 2 SO 4 после 10 и 50 циклов сохраняется 83 % и 62 % исходной разрядной емкости соответственно. В случае 1 M Na 2 SO 4 + 0,25 M Li 2 SO 4 электролитов сохраняется только 76% и 58% исходной разрядной емкости. В результате повышение Na + /Li 9Соотношение 1748 + может улучшить циклическую стабильность батареи Na 0,44 MnO 2 /TiP 2 O 7 . Исследование возможностей сброса NA 0,44 MNO 2 /TIP 2 O 7 Батарея в 1 м NA 2 SO 4 + 0,125 м LI 2 SO 4 + 0,125 м LI 2 SO 4 IS Показывается в Попульке. Рис. S5. Разрядная емкость 23,3, 20,6, 17,7, 14,5 и 11,1 мА·ч г -1 найдена при скорости 0,5, 1, 2, 4 и 8 C соответственно.
Открыть в отдельном окне
Na 0,44 MnO 2 /TiP 2 O 7 смешанная ионная батарея.
(а), Схема аккумулятора. (b) Кривые зарядки-разрядки при скорости 0,4 C в 1 M Na 2 SO 4 + 0,25 M Li 2 SO 4 . (c) Кривые зарядки-разрядки при скорости 0,4 C в 1 M Na 2 SO 4 + 0,125 M Li 2 SO 4 . (d) Циклические испытания батареи при температуре 0,4 C в смешанных электролитах. (1 C = 60 мА·ч·г · −1 ).
Разъяснение механизма Li
+ /Na + смешанного ионного аккумулятора Особенностью смешанного ионного аккумулятора является изменение соотношения Li + /Na + при зарядке и разрядке. Для экспериментальной демонстрации таких изменений была изготовлена микроэлектрохимическая ячейка, состоящая из анода Na 0,22 MnO 2 и катода LiMn 2 O 4 . Мы выбрали несколько электролитов для изучения (см. ). Во-первых, Na 2 SO 4 и раствор Li 2 SO 4 . Перед зарядкой в ячейку вводят первичный раствор Na 2 SO 4 с соотношением Li + /Na + 1/83. После зарядки соотношение Li + / Na + увеличивается до 1/10. Это связано с выходом Li + из катода LiMn 2 O 4 и селективным захватом Na + из электролитов катодом Na 0,22 MnO 2 анод. Напротив, раствор Li 2 SO 4 заменяет раствор Na 2 SO 4 в процессе разрядки. Соотношение Li + /Na + в электролитах падает со 144/1 до 13/1 после разрядки. Причина в том, что Li + в электролитах интеркалируется в катод, а Na + диффундирует с анода в электролиты при разряде. Аналогичные изменения наблюдаются и для растворов смешанных ионов.
Мы выбрали несколько электролитов для изучения (см. ). Во-первых, Na 2 SO 4 и раствор Li 2 SO 4 . Перед зарядкой в ячейку вводят первичный раствор Na 2 SO 4 с соотношением Li + /Na + 1/83. После зарядки соотношение Li + / Na + увеличивается до 1/10. Это связано с выходом Li + из катода LiMn 2 O 4 и селективным захватом Na + из электролитов катодом Na 0,22 MnO 2 анод. Напротив, раствор Li 2 SO 4 заменяет раствор Na 2 SO 4 в процессе разрядки. Соотношение Li + /Na + в электролитах падает со 144/1 до 13/1 после разрядки. Причина в том, что Li + в электролитах интеркалируется в катод, а Na + диффундирует с анода в электролиты при разряде. Аналогичные изменения наблюдаются и для растворов смешанных ионов. Ли 9Отношение 1748 + /Na + увеличивается после зарядки и уменьшается после разрядки. Таким образом, система LiMn 2 O 4 /Na 0,22 MnO 2 может обогащать Li + в электролитах при зарядке и обогащать Na + при разрядке.
Ли 9Отношение 1748 + /Na + увеличивается после зарядки и уменьшается после разрядки. Таким образом, система LiMn 2 O 4 /Na 0,22 MnO 2 может обогащать Li + в электролитах при зарядке и обогащать Na + при разрядке.
Таблица 1
Атомное соотношение Li + /Na + в электролитах при зарядке и разрядке
9 Electrolytes before charging after charging before discharging after discharging Na 2 SO 4 a 1∶83 1∶10 N. A.
A. N.A. LI 2 SO 4 B 9295. N.A.A.A. B 9295. N.A.A. B 9295. N.A.A. .0081 Li 2 SO 4 +Na 2 SO 4 a 100∶42 c 100∶35 N.A. N.A. 100 ∶35 d 100∶29 N. A.
A. N.A. Li 2 SO 4 + Na 2 SO 4 b N.A. N.A. 47∶ 100 с 41∶100 N.A. N.A. 41∶100 d 36∶100
Open in a separate window
Charging/discharging current density: 1 mAcm −2 . Отсечка напряжения: 0,1 В и 1,05 В.
Отсечка напряжения: 0,1 В и 1,05 В.
a Электролиты для этапа зарядки.
b Электролиты для этапа разрядки.
c Электролиты, используемые для цикла 1.
d Электролиты (полученные после цикла 1), используемые для цикла 2.
Нет данных: нет данных.
Li + /Na + смешанные ионные батареи основаны на ионной селективности материалов электродов. Как показали электрохимические данные, Na 0,44 MnO 2 , LiMn 2 O 4 и TiP 2 O 7 проявляют специфическую ионоселективность. Их ионная селективность также была подтверждена экспериментами по рентгеновской фотоэлектронной спектроскопии (см. Дополнительную таблицу S1). В Ли + /Na + смешанные растворы ионов, Na 0,44 MnO 2 проявляет специфическую ионную селективность по отношению к Na + . Причина может заключаться в том, что размеры двух туннелей в Na 0,44 MnO 2 (S-образный туннель и пятиугольный туннель) слишком велики для закрепления Li + . Несоответствие приводит к свободному перемещению Li + в туннелях. Как LiMn 2 O 4 , так и TiP 2 O 7 ведут себя как ионные сита, демонстрирующие очень высокую ионную селективность по отношению к Li + . Их специфическая селективность легко объясняется стерическим эффектом: туннели слишком малы для проникновения ионов металлов с ионными радиусами больше, чем Li + .
Несоответствие приводит к свободному перемещению Li + в туннелях. Как LiMn 2 O 4 , так и TiP 2 O 7 ведут себя как ионные сита, демонстрирующие очень высокую ионную селективность по отношению к Li + . Их специфическая селективность легко объясняется стерическим эффектом: туннели слишком малы для проникновения ионов металлов с ионными радиусами больше, чем Li + .
Теоретические способности NA 0,44 MNO 2 , LIMN 2 O 4 и наконечник 2 O 7 — 60 мАч G — 1 , 148 MAH G — 1 — 1 , 148 MAH G — 1 — 1 , 148 MAH G — 1 — 1 , 148 MAH G — 1 — 1 , 148 MAH G — 1 — 1 , 148 MAH G — 1 — 1 , 1484 MAH G — 1 — 1 , 1484 MAH. мАч·г −1 соответственно. Средние рабочие напряжения LiMn 2 O 4 /NA 0,22 MNO 2 и NA 0,44 MNO 2 /TIP 2 O 7 батареи составляют 0,6 В и 1,0 В. Если теоретические возможности NA 0,44 . LiMn 2 O 4 и TiP 2 O 7 полностью израсходованы, батареи с удельной энергией ок. Может потребоваться 21 Втч кг -1 или 40 Втч кг -1 в расчете на общий вес материалов активного электрода. Таким образом, Na 0,44 MnO 2 /TiP 2 O 7 система может превосходить CuHCF/AC-PPy и Na 0,44 MnO 2 /системы с активированным углем для крупномасштабного хранения энергии . Фактически в нашей работе получены две батареи с удельной энергией 17 Втч·кг·-1· и 25 Втч·кг·-1·. Как достичь теоретических возможностей этих соединений и длительного срока службы систем, все еще остается проблемой.
Если теоретические возможности NA 0,44 . LiMn 2 O 4 и TiP 2 O 7 полностью израсходованы, батареи с удельной энергией ок. Может потребоваться 21 Втч кг -1 или 40 Втч кг -1 в расчете на общий вес материалов активного электрода. Таким образом, Na 0,44 MnO 2 /TiP 2 O 7 система может превосходить CuHCF/AC-PPy и Na 0,44 MnO 2 /системы с активированным углем для крупномасштабного хранения энергии . Фактически в нашей работе получены две батареи с удельной энергией 17 Втч·кг·-1· и 25 Втч·кг·-1·. Как достичь теоретических возможностей этих соединений и длительного срока службы систем, все еще остается проблемой.
Все больше и больше лития необходимо для удовлетворения все более требовательного рынка электромобилей. По состоянию на 2012 год большая часть лития (примерно 83%) добывается из соляных озер и соляных ванн. Существующие методы очистки лития («поточный процесс выпаривания соды», аморфный Al 2 O 3 процесс и метод ионного обмена) являются методами влажной химии 24 ,25 . Поскольку такие методы требуют большого количества химикатов (например, Na 2 CO 3 , AlCl 3 , оксиды марганца и HCl и т. д.), они дороги, медленны и неэффективны. Поэтому необходимо исследовать новые эффективные методы извлечения лития из рассола. На основе продемонстрированного механизма Li + / Na + смешанных ионных батарей предлагается новый электрохимический метод. схематически показан принцип работы системы смешанных ионных аккумуляторов для Li 9.1748 + /Na + разделение. Батарея основана на высвобождающем катоде Li + и захватывающем аноде Na + . На первом этапе (зарядка) батарея высвобождает Li + и захватывает Na + для обогащения Li + в растворе смешанного иона I.
Существующие методы очистки лития («поточный процесс выпаривания соды», аморфный Al 2 O 3 процесс и метод ионного обмена) являются методами влажной химии 24 ,25 . Поскольку такие методы требуют большого количества химикатов (например, Na 2 CO 3 , AlCl 3 , оксиды марганца и HCl и т. д.), они дороги, медленны и неэффективны. Поэтому необходимо исследовать новые эффективные методы извлечения лития из рассола. На основе продемонстрированного механизма Li + / Na + смешанных ионных батарей предлагается новый электрохимический метод. схематически показан принцип работы системы смешанных ионных аккумуляторов для Li 9.1748 + /Na + разделение. Батарея основана на высвобождающем катоде Li + и захватывающем аноде Na + . На первом этапе (зарядка) батарея высвобождает Li + и захватывает Na + для обогащения Li + в растворе смешанного иона I. После зарядки раствор I заменяется другим раствором смешанного иона II. Затем батарея разряжается для обогащения Na + , так как Li + захватываются катодом, а Na + освобождаются от анода. На последнем этапе смешанный ионный раствор II заменяется смешанным ионным раствором I для следующего цикла. В ходе повторяющихся циклов в конечном итоге получают растворы, обогащенные Li + и Na + , соответственно. По сравнению с другими способами очистки, указанными выше, этот метод имеет следующие два очевидных преимущества. Во-первых, он двухфункциональный. Смешанная ионная батарея Li + / Na + может использоваться как для очистки лития, так и для хранения энергии. Во-вторых, этот электрохимический метод экологически чистый и энергоэффективный. В отличие от мокрых химических методов, он не требует никаких химикатов и не производит отходов для утилизации. Для проверки работоспособности метода LiMn 2 O 4 /Na 0,22 MnO 2 система выбрана.
После зарядки раствор I заменяется другим раствором смешанного иона II. Затем батарея разряжается для обогащения Na + , так как Li + захватываются катодом, а Na + освобождаются от анода. На последнем этапе смешанный ионный раствор II заменяется смешанным ионным раствором I для следующего цикла. В ходе повторяющихся циклов в конечном итоге получают растворы, обогащенные Li + и Na + , соответственно. По сравнению с другими способами очистки, указанными выше, этот метод имеет следующие два очевидных преимущества. Во-первых, он двухфункциональный. Смешанная ионная батарея Li + / Na + может использоваться как для очистки лития, так и для хранения энергии. Во-вторых, этот электрохимический метод экологически чистый и энергоэффективный. В отличие от мокрых химических методов, он не требует никаких химикатов и не производит отходов для утилизации. Для проверки работоспособности метода LiMn 2 O 4 /Na 0,22 MnO 2 система выбрана. Используются два смешанных электролита, как показано на рис. Сначала в ячейку добавляют раствор Li 2 SO 4 +Na 2 SO 4 с соотношением Li + /Na + 100/42 (раствор I). После зарядки соотношение Li + / Na + увеличивается до 100/35. Затем раствор I удаляют и заменяют другим раствором (раствором II) для следующего шага. После разрядки Li 9Соотношение 1748 + /Na + в растворе II снижается с 47/100 до 41/100. Затем батарею LiMn 2 O 4 /Na 0,22 MnO 2 подвергают второму циклу. После двух циклов соотношение Li + /Na + в растворе I увеличивается до 100/29, а соотношение Li + /Na + в растворе II падает до 36/100. Эти результаты показывают, что смешанная батарея Li + / Na + может применяться для разделения Li + и Na + .
Используются два смешанных электролита, как показано на рис. Сначала в ячейку добавляют раствор Li 2 SO 4 +Na 2 SO 4 с соотношением Li + /Na + 100/42 (раствор I). После зарядки соотношение Li + / Na + увеличивается до 100/35. Затем раствор I удаляют и заменяют другим раствором (раствором II) для следующего шага. После разрядки Li 9Соотношение 1748 + /Na + в растворе II снижается с 47/100 до 41/100. Затем батарею LiMn 2 O 4 /Na 0,22 MnO 2 подвергают второму циклу. После двух циклов соотношение Li + /Na + в растворе I увеличивается до 100/29, а соотношение Li + /Na + в растворе II падает до 36/100. Эти результаты показывают, что смешанная батарея Li + / Na + может применяться для разделения Li + и Na + .
Открыть в отдельном окне
Схематическое изображение принципа работы при разделении Li + и Na + смешанной ионной батареей.
Таким образом, уникальная стратегия «смешанных электролитов» успешно используется для создания Li + /Na + смешанных ионных батарей с катодно-анодными системами, такими как LiMn 2 O 4 / Na 0,22 MnO 2 и Na 0,44 MnO 2 /TiP 2 O 7 . Полученные батареи основаны на ионоселективных свойствах Na 0,44 MnO 2 , LiMn 2 O 4 и TiP 2 O 7 . Емкость, рабочее напряжение и стабильность обеих батарей зависят от соотношения Na + /Li + . Повышение отношения Na + /Li + благоприятно сказывается на их стабильности. Кроме того, LiMn 2 O 4 /Na 0,22 MnO 2 Система может использоваться для разделения Li + и Na + . Одним словом, смешанные аккумуляторы Li + / Na + не только прокладывают новый путь к системе накопления энергии, но и дают перспективную методику разделения Li + / Na + .
Синтез материалов
Все химические вещества были получены от Sinopharm Chemical Reagent Co., Ltd (Шанхай, Китай). Na 0,44 MnO 2 и LiMn 2 O 4 получены методом твердофазной реакции. Чтобы получить наностержни Na 0,44 MnO 2 , Na 2 CO 3 измельчали в шаровой мельнице с MnCO 3 в соотношении 0,25∶1 при 350 об/мин в течение 8 ч. Смесь прекурсоров последовательно нагревали в течение 3 ч при 300°C и в течение 9 ч при 800°C. Для сферического LiMn 2 O 4 исходные материалы MnCO 3 и Li 2 CO 3 тщательно смешивали в молярном соотношении 4∶1. Смесь измельчали вручную, гранулировали и нагревали при 800°С на воздухе в течение 12 ч. Подготовленный TiP 9Образцы 0085 2 O 7 также были синтезированы с помощью твердофазной реакции. Порошок TiO 2 высокой чистоты (до 99,9%) и NH 4 H 2 PO 4 добавляли в этанол с образованием пасты. Эту пасту измельчали в шаровой мельнице на планетарной шаровой мельнице при 400 об/мин в течение 8 ч. После измельчения в шаровой мельнице смесь сушили при 80°С для выпаривания этанола. Затем последовательно прогревали 5 ч при 300°С и 12 ч при 900°С на воздухе с промежуточными перетираниями. Полученный белый TiP 2 O 7 твердые вещества, называемые свежеприготовленными TiP 2 O 7 , гомогенизировали в ступке для дальнейшего использования. Для TiP 2 O 7 с углеродным покрытием смешивали 2,5 г свежеприготовленного TiP 2 O 7 , 2 г глюкозы и соответствующее количество этанола, а затем измельчали в шаровой мельнице в течение 4 часов. Твердые вещества получали выпариванием этанола при 80°С. После прокаливания при 700°C в течение 5 ч в Ar твердые вещества стали черными, что указывает на то, что TiP 2 O 7 были покрыты углеродом.
Эту пасту измельчали в шаровой мельнице на планетарной шаровой мельнице при 400 об/мин в течение 8 ч. После измельчения в шаровой мельнице смесь сушили при 80°С для выпаривания этанола. Затем последовательно прогревали 5 ч при 300°С и 12 ч при 900°С на воздухе с промежуточными перетираниями. Полученный белый TiP 2 O 7 твердые вещества, называемые свежеприготовленными TiP 2 O 7 , гомогенизировали в ступке для дальнейшего использования. Для TiP 2 O 7 с углеродным покрытием смешивали 2,5 г свежеприготовленного TiP 2 O 7 , 2 г глюкозы и соответствующее количество этанола, а затем измельчали в шаровой мельнице в течение 4 часов. Твердые вещества получали выпариванием этанола при 80°С. После прокаливания при 700°C в течение 5 ч в Ar твердые вещества стали черными, что указывает на то, что TiP 2 O 7 были покрыты углеродом.
Характеристика
Порошковые рентгеновские дифрактограммы были получены с использованием дифрактометра AXS D8 Advance (излучение Cu Kα, приемная щель 0,2 мм, сцинтилляционный счетчик, 40 мА, 40 кВ) от Bruker Inc. Морфология и структура образцов были проанализированы с помощью автоэмиссионного сканирующего электронного микроскопа Hitachi S-4800 и просвечивающего электронного микроскопа FEI Tecnai G2 F20 при ускоряющем напряжении 200 кВ. Термогравиметрический анализ выполняли на термогравиметрическом/дифференциальном термическом анализаторе Pyris Diamond фирмы Perkin-Elmer. Элементный анализ проводили на оптико-эмиссионном спектрометре с индуктивно-связанной плазмой (Perkin Elmer Optima 2100 DV).
Морфология и структура образцов были проанализированы с помощью автоэмиссионного сканирующего электронного микроскопа Hitachi S-4800 и просвечивающего электронного микроскопа FEI Tecnai G2 F20 при ускоряющем напряжении 200 кВ. Термогравиметрический анализ выполняли на термогравиметрическом/дифференциальном термическом анализаторе Pyris Diamond фирмы Perkin-Elmer. Элементный анализ проводили на оптико-эмиссионном спектрометре с индуктивно-связанной плазмой (Perkin Elmer Optima 2100 DV).
Электрохимические измерения
Электрохимические измерения проводились на многоканальных потенциостатах Solartron 1470E с использованием либо двухэлектродной, либо трехэлектродной ячейки. Для установки с тремя электродами насыщенный каломельный электрод (SCE) и платиновая сетка использовались в качестве электрода сравнения и противоэлектрода соответственно. И катод, и анод были приготовлены путем отливки суспензий активных материалов (75 мас.%), Super P (15 мас.%) и поливинилиденфторида (10 мас. %) в н-метил-2-пирролидиноне на стальной железной сетке и сушки на воздухе при 80°С в течение 12 ч. Для электрохимических испытаний были вырезаны диски диаметром 1,3 см. Массовые нагрузки на электроды определяли путем сравнения массы электрода с массой исходного бланка. На 0,22 MnO 2 электродов были изготовлены электрохимическим окислением электродов Na 0,44 MnO 2 (постоянный ток: 30 мАg −1 , напряжение отсечки: 0,65 V против SCE). Для электродов TiP 2 O 7 использовали деаэрированные растворы, полученные барботированием газа Ar в течение 60 мин. Соотношение масс материалов анода и катода рассчитано как 1,80 для системы LiMn 2 O 4 /Na 0,22 MnO 2 и 0,85 для Na 0,44 MNO 2 /TIP 2 O 7 , в соответствии с возможностями NA 0,44 MNO 2 , LIMN 2 O 4 и Carbon-Coated 2 O 4 и Carbon-Coated 2 O 4 и Carbon-Coated 2 O 4 и Carbon-Coated 2 O 4 и Carbon-Coated 2 O 4 и Carbon-Coated 2 .
%) в н-метил-2-пирролидиноне на стальной железной сетке и сушки на воздухе при 80°С в течение 12 ч. Для электрохимических испытаний были вырезаны диски диаметром 1,3 см. Массовые нагрузки на электроды определяли путем сравнения массы электрода с массой исходного бланка. На 0,22 MnO 2 электродов были изготовлены электрохимическим окислением электродов Na 0,44 MnO 2 (постоянный ток: 30 мАg −1 , напряжение отсечки: 0,65 V против SCE). Для электродов TiP 2 O 7 использовали деаэрированные растворы, полученные барботированием газа Ar в течение 60 мин. Соотношение масс материалов анода и катода рассчитано как 1,80 для системы LiMn 2 O 4 /Na 0,22 MnO 2 и 0,85 для Na 0,44 MNO 2 /TIP 2 O 7 , в соответствии с возможностями NA 0,44 MNO 2 , LIMN 2 O 4 и Carbon-Coated 2 O 4 и Carbon-Coated 2 O 4 и Carbon-Coated 2 O 4 и Carbon-Coated 2 O 4 и Carbon-Coated 2 O 4 и Carbon-Coated 2 . 7 . Микроэлектрохимическая ячейка, состоящая из анода Na 0,22 MnO 2 и катода LiMn 2 O 4 , была изготовлена для проверки изменения соотношения Li + / Na + во время заряда и разряда. Расстояние между двумя электродами было зафиксировано на уровне 2,2 мм. Объем электролитов составлял 1,0 мл, а общая концентрация Li + и Na + составляло около 0,35 M. Для определения соотношения Li + / Na + использовали оптическую эмиссионную спектроскопию с индуктивно связанной плазмой (ICP-OES).
7 . Микроэлектрохимическая ячейка, состоящая из анода Na 0,22 MnO 2 и катода LiMn 2 O 4 , была изготовлена для проверки изменения соотношения Li + / Na + во время заряда и разряда. Расстояние между двумя электродами было зафиксировано на уровне 2,2 мм. Объем электролитов составлял 1,0 мл, а общая концентрация Li + и Na + составляло около 0,35 M. Для определения соотношения Li + / Na + использовали оптическую эмиссионную спектроскопию с индуктивно связанной плазмой (ICP-OES).
Л.К., З.Х. и З.Л. спроектированные эксперименты. Л.К., К.Г. (совместный аспирант факультета химии и инженерии Хуайнаньского педагогического университета, КНР) и С.Л. проводил опыты. Л.К., Х.З., З.Л. и Ю.Х. внес свой вклад в анализ данных и стал соавтором статьи. З.Л. и Х.З. предложил и курировал проект.
Дополнительная информация:
Дополнительная информация
Нажмите здесь для просмотра. (672K, pdf)
(672K, pdf)
Мы признательны за финансовую поддержку Программе ключевых исследований Китайской академии наук (грант № KGZD-EW-202-4), Группе инноваций в области науки и технологий Нинбо (грант № 2012B82001) и Программа 973 (грант № 2011CB0).
- Соловейчик Г.Л.
Аккумуляторные технологии для крупных стационарных накопителей энергии. Анну. Преподобный Хим. биомол. англ.
2, 503–527 (2011). [PubMed] [Академия Google]
- Шен Ю. В. и Кордеш К.
Механизм угасания емкости перезаряжаемых щелочных элементов из диоксида марганца и цинка. J. Источники питания
87, 162–166 (2000). [Google Scholar]
- Шукла А. К., Венугопалан С. и Харипракаш Б.
Аккумуляторы на основе никеля. J. Источники питания
100, 125–148 (2001). [Google Scholar]
- Кёлер У., Антониус К. и Бойерляйн П.
Достижения в щелочных батареях. J. Источники питания
127, 45–52 (2004). [Google Scholar]
- Ван Х. Л. и др. Сверхбыстродействующая никель-железная батарея из сильно связанных гибридных материалов неорганических наночастиц и наноуглерода.
 Нац. коммун.
3, 917 (2012). [PubMed] [Google Scholar]
Нац. коммун.
3, 917 (2012). [PubMed] [Google Scholar] - Гао С. П., Яо С. М., Ян Т. Ю. и Чжоу З.
Щелочные перезаряжаемые батареи Ni/Co: гидроксиды кобальта в качестве материала отрицательного электрода. Энергетическая среда. науч.
2, 502–505 (2009). [Google Scholar]
- Ли В., Дан Дж. Р. и Уэйнрайт Д. С.
Литиевые аккумуляторы с водными электролитами. Наука
264, 1115–1118 (1994). [PubMed] [Google Scholar]
- Ван Г. Дж. и др. Водная перезаряжаемая литиевая батарея с хорошими циклическими характеристиками. Ангью. хим. Междунар. Эд.
46, 295–297 (2007). [PubMed] [Google Scholar]
- Ван Х. Б., Хуан К. Л., Цзэн Ю. К., Ян С. и Чен Л. К.
Электрохимические свойства TiP 2 O 7 и LiTi 2 (PO 4 ) 3 в качестве материала анода для литий-ионного аккумулятора с водным раствором электролита. Электрохим. Акта.
52, 3280–3285 (2007). [Академия Google]
- Луо Дж. Ю., Цуй В. Дж., Хе П. и Ся Ю. Ю.
 Повышение циклической стабильности литий-ионных аккумуляторов на водной основе за счет удаления кислорода из электролита. Нац. хим.
2, 760–765 (2010). [PubMed] [Google Scholar]
Повышение циклической стабильности литий-ионных аккумуляторов на водной основе за счет удаления кислорода из электролита. Нац. хим.
2, 760–765 (2010). [PubMed] [Google Scholar] - Wang X.J., Hou Y.Y., Zhu Y.S., Wu Y.P. и Holze R.
Водная перезаряжаемая литиевая батарея с использованием металлического лития с покрытием в качестве анода. науч. Респ.
3, 1401 (2013). [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Pasta M., Wessells C.D., Huggins R.A. & Cui Y.
Высокопроизводительная аккумуляторная батарея на водном электролите с длительным сроком службы для хранения энергии в масштабе сети. Нац. коммун.
3, 1149(2012). [PubMed] [Google Scholar]
- Xu C.J., Li B.H., Du H.D. и Kang F.Y.
Энергетическая химия ионов цинка: перезаряжаемая ионно-цинковая батарея. Ангью. хим. Междунар. Эд.
51, 933–935 (2012). [PubMed] [Google Scholar]
- Уитакр Дж. Ф., Тевар А. и Шарма С.
Na 4 Mn 9 O 18 в качестве материала положительного электрода для накопителя энергии на основе ионов натрия с водным электролитом.
 Электрохим. коммун.
12, 463–466 (2010). [Google Scholar]
Электрохим. коммун.
12, 463–466 (2010). [Google Scholar] - Пак С. И., Гочева И., Окада С. и Ямаки Дж. И.
Электрохимические свойства NaTi 2 (PO 4 ) 3 Анод для перезаряжаемых натрий-ионных аккумуляторов. Дж. Электрохим. соц.
158, А1067–А1070 (2011). [Google Scholar]
- Ву В., Мохамед А. и Уитакр Дж. Ф.
Микроволновый синтез NaTi 2 (ПО 4 ) 3 Анодные материалы для перезаряжаемой натрий-ионной аккумуляторной батареи с водным электролитом. Встретиться. Абстр.
1859 (2012). (222 nd собрание ECS, Гонолулу, Гавайи). [Google Scholar]
- Li Z., Young D., Xiang K., Caeter W. C. & Chiang Y. M.
На пути к высокомощным высокоэнергетическим водным натрий-ионным батареям: NaTi 2 (PO 4 ) 3 /Na 0,44 MnO 2 система. Доп. Энергия Матер.
3, 290–294 (2013). [Google Scholar]
- Wessells C.D., Huggins R.A. & Cui Y.
Медные аккумуляторные электроды из гексацианоферрата с длительным сроком службы и высокой мощностью.
 Нац. коммун.
2, 550 (2011). [PubMed] [Google Scholar]
Нац. коммун.
2, 550 (2011). [PubMed] [Google Scholar] - Wessells C.D., Peddada S.V., McDowell M.T., Huggins R.A. & Cui Y.
Влияние вставок на наноструктурированные аккумуляторные электроды из гексацианоферрата с открытым каркасом. Дж. Электрохим. соц.
159, А98–А103 (2012). [Google Scholar]
- У С.Ю., Цао Ю.Л., Ай С.П., Цянь Дж.Ф. и Ян Х.С.
Недорогая и экологически чистая водная перезаряжаемая натрий-ионная батарея на основе NaTi 2 (PO 4 ) 3 -Na 2 NiFe(CN) 6 интеркаляционной химии. Электрохим. коммун.
31, 145–148 (2013). [Google Scholar]
- Ким Х. и др. Ab initio исследование интеркаляции натрия и промежуточных фаз в Na 0,44 MnO 2 для натрий-ионной батареи. хим. Матер.
24, 1205–1211 (2012). [Google Scholar]
- Соваж Ф., Лаффон Л., Тараскон Дж. М. и Бодрин Э.
Изучение механизма внедрения/удаления натрия в Na 0,44 MnO 2 . неорг. хим.
 46, 3289–3294 (2007). [PubMed] [Google Scholar]
46, 3289–3294 (2007). [PubMed] [Google Scholar] - Пату С. и Маскелье С.
Внедрение лития в фосфаты, силикаты и сульфаты титана. хим. Матер.
14, 5057–5068 (2002). [Google Scholar]
- Гаррет Д. Э.
Справочник по хлоридам лития и природного кальция: их месторождения, переработка, использование и свойства. Elsevier Academic Press, Амстердам, Бостон, 2004. [Google Scholar]
- Аммундсен Б., Джонс Д. Дж., Розьер Дж. и Бернс Г. Р.
Механизм внедрения протонов и характеристика протонных позиций в шпинелях манганата лития. хим. Матер.
7, 2151–2160 (1995). [Google Scholar]
Статьи из Scientific Reports предоставлены с разрешения Nature Publishing Group
Химия аккумуляторов и элементов. Аккумуляторная грунтовка.
Примечание: Названия «Батарейки» и «Элементы» используются в этом тексте взаимозаменяемо, хотя, строго говоря, батарея состоит из группы элементов питания. Подробнее на странице для начинающих.
Подробнее на странице для начинающих.
Как работают энергетические элементы
Гальваническое или вольтовое действие
Проще говоря, энергетические элементы или батареи можно рассматривать как электронные насосы.
Внутренняя химическая реакция внутри батареи между электролитом и отрицательным металлическим электродом приводит к накоплению свободных электронов, каждый из которых имеет отрицательный заряд, на отрицательной (-) клемме батареи — аноде.
Химическая реакция между электролитом и положительным (+) электродом внутри батареи приводит к избытку положительных (+) ионов (атомов, у которых отсутствуют электроны, поэтому они имеют положительный заряд) на положительном (+) полюсе — катоде аккумулятора.
Электрическое (насосное) давление или разность потенциалов между клеммами + и — называется напряжением или электродвижущей силой (ЭДС).
Различные металлы имеют разное сродство к электронам. Когда два разнородных металла (или соединения металлов) соприкасаются или соединяются через проводящую среду, электроны имеют тенденцию переходить от металла с меньшим сродством к электронам, который становится положительно заряженным, к металлу с большим сродством, который становится положительно заряженным. становится отрицательно заряженным. Таким образом, разность потенциалов между металлами будет нарастать до тех пор, пока она не уравновесит тенденцию переноса электронов между металлами. В этот момент «равновесный потенциал» — это тот, который уравновешивает разницу между склонностью двух металлов приобретать или терять электроны.
Ток течет от положительной клеммы к отрицательной, но, как ни странно, электроны текут в противоположном направлении. Эта путаница возникает из-за того, что мы склонны предполагать, что единственными носителями тока являются электроны. На самом деле положительные ионы также являются носителями тока и текут в том же направлении, что и ток. В гальваническом элементе положительные ионы переносят ток через элемент, а электроны переносят ток во внешней цепи. Посмотрите на Бенджамина Франклина, которого ложно обвинили в неправильном названии текущего потока.
Эта путаница возникает из-за того, что мы склонны предполагать, что единственными носителями тока являются электроны. На самом деле положительные ионы также являются носителями тока и текут в том же направлении, что и ток. В гальваническом элементе положительные ионы переносят ток через элемент, а электроны переносят ток во внешней цепи. Посмотрите на Бенджамина Франклина, которого ложно обвинили в неправильном названии текущего потока.
Аккумулятор или гальванический элемент накапливают энергию в химической форме в своих активных материалах и могут при необходимости преобразовывать ее в электрическую энергию, как правило, посредством электрохимической окислительно-восстановительной, окислительно-восстановительной реакции (см. ниже).
(Примечание. Общее название «окислительно-восстановительный», по-видимому, было присвоено недавней конструкции проточной батареи, в которой используются две окислительно-восстановительные пары ванадия).
Каждый гальванический или энергетический элемент состоит как минимум из трех, а иногда и из четырех компонентов
Анод или отрицательный электрод является восстановительным или топливным электродом. Он отдает электроны во внешнюю цепь и окисляется в ходе электрохимической (разрядной) реакции. Обычно это металл или сплав, но также используется водород. Анодный процесс – окисление металлического восстановителя с образованием ионов металлов.
( LEO Потерянные электроны — Окисление )
Альтернативно
( МАСЛО — Окисление — это потеря)
- Катод или положительный электрод является окислительным электродом. Он принимает электроны из внешней цепи и восстанавливается в ходе электрохимической (разрядной) реакции.
 Обычно это оксид металла или сульфид, но также используется кислород. Катодный процесс представляет собой восстановление окислителя (оксида) до выхода металла.
Обычно это оксид металла или сульфид, но также используется кислород. Катодный процесс представляет собой восстановление окислителя (оксида) до выхода металла.
( GER Прирост электронов — Уменьшение ). Помните мнемонику рычания льва. Альтернативно
( Буровая установка — Уменьшение усиления) Альтернативная мнемоника — НЕФТЯНАЯ БУРАЯ
- Электролит (ионный проводник), который обеспечивает среду для переноса заряда в виде ионов внутри ячейки между анодом и катодом. Электролит обычно представляет собой растворитель, содержащий растворенные химические вещества, обеспечивающие ионную проводимость. Он должен быть непроводником электронов, чтобы избежать саморазряда элемента.
Ионы металлов представляют собой атомы металлов, у которых отсутствуют электроны, и поэтому они заряжены положительно. Частицы с отсутствующими электронами называются катионами , и во время разряда они движутся через электролит к положительному электроду, ошибочно называемому катодом * См. примечание ниже.
примечание ниже.
Анионы представляют собой атомы или частицы с избытком электронов и, следовательно, отрицательно заряженные. Во время разряда они притягиваются через внешнюю цепь к отрицательному электроду, называемому анодом 9.0043 * .
- Сепаратор , который электрически изолирует положительный и отрицательный электроды.
Процесс выписки
Когда аккумулятор полностью заряжен, избыток электронов на аноде дает ему отрицательный заряд, а недостаток электронов на катоде дает положительный заряд, что приводит к разности потенциалов на ячейке.
Когда цепь замыкается, избыточные электроны перетекают во внешнюю цепь от отрицательно заряженного анода, который теряет весь свой заряд, к положительно заряженному катоду, который их принимает, нейтрализуя его положительный заряд. Это действие уменьшает разность потенциалов на ячейке до нуля. Цепь замыкается или уравновешивается потоком положительных ионов в электролите от анода к катоду.
Это действие уменьшает разность потенциалов на ячейке до нуля. Цепь замыкается или уравновешивается потоком положительных ионов в электролите от анода к катоду.
Поскольку электроны заряжены отрицательно, электрический ток, который они представляют, течет в противоположном направлении, от катода (положительный вывод) к аноду (отрицательный вывод).
Анод — это электрод, через который электроны выходят из поляризованного электрического устройства (или электрод, через который поступает ток)
Мнемоника ACID = A узел C текущий I nto D устройство (во время разряда).
Две электролитные системы
Принципы работы гальванического или гальванического элемента можно продемонстрировать на примере работы элемента Даниэля, двухэлектролитной системы.
КАТОД
ДЭНИЭЛЛ СЕЛЛ
АНОД
положительный полюс батареи
отрицательный полюс аккумулятора
Цинк теряет электроны быстрее, чем медь
Принимает электроны из внешней цепи
Поставляет электроны во внешнюю цепь
Отложения металлической меди на катоде
Цинк переходит в водный раствор
Сайт Сокращение
Участок Окисление
Полуэлемент с самым высоким электродным потенциалом
Полуэлемент с самым низким электродным потенциалом
Германия
Лев
Системы с двумя электролитическими первичными элементами существуют с 1836 года, когда для решения проблемы поляризации был изобретен элемент Даниэля. Такое расположение показывает, что фактически имеется два полуклеток , в которых происходят химические действия. Каждый электрод погружен в отдельный электролит, с которым он реагирует. Потенциал электрода , положительный или отрицательный, представляет собой напряжение, развиваемое одним электродом. Электролиты отделены друг от друга солевым мостиком или пористой мембраной , которая является нейтральной и не принимает участия в реакции. В процессе осмоса он пропускает ионы сульфата, но блокирует ионы металлов.
Такое расположение показывает, что фактически имеется два полуклеток , в которых происходят химические действия. Каждый электрод погружен в отдельный электролит, с которым он реагирует. Потенциал электрода , положительный или отрицательный, представляет собой напряжение, развиваемое одним электродом. Электролиты отделены друг от друга солевым мостиком или пористой мембраной , которая является нейтральной и не принимает участия в реакции. В процессе осмоса он пропускает ионы сульфата, но блокирует ионы металлов.
Эта схема с двумя электролитами обеспечивает больше степеней свободы или контроля над химическим процессом.
Несмотря на более сложную конструкцию, эти элементы позволили создать элементы с более длительным сроком службы за счет оптимизации комбинации электролит/электрод отдельно для каждого электрода.
Совсем недавно они использовались в качестве основы для проточных батарей, в которых электролиты прокачиваются через батарею, обеспечивая почти неограниченную емкость.
Цинк является очень популярным анодным материалом, и описанное выше химическое действие приводит к его растворению в электролите.
Можно сказать, что показанная ячейка Даниэля «сжигает цинк и откладывает медь»
Окислительно-восстановительные реакции и полуэлементы
Простая ячейка с одним электролитом также может быть представлена двумя полуячейками. Это можно рассматривать как частный случай ячейки Даниэля с двумя одинаковыми электролитами.
Модель клетки как двух полуэлементов используется электрохимиками и конструкторами ячеек для расчета электродных потенциалов и характеристики химических реакций внутри клетки. В одной половине клетки происходит восстановление, а в другой — окисление. В батарее обе реакции протекают одновременно, и объединенная реакция называется окислительно-восстановительной реакцией (восстановление и окисление)
.
Напряжение ячейки или электродвижущая сила (ЭДС) для внешнего тока, полученного от ячейки, представляет собой разность стандартных электродных потенциалов двух реакций половин ячейки при стандартных условиях. Но настоящие гальванические элементы обычно отличаются от стандартных условий. Уравнение Нернста связывает фактическое напряжение химического элемента со стандартными электродными потенциалами с учетом температуры и концентраций реагентов и продуктов. ЭДС клетки будет уменьшаться по мере уменьшения концентрации активных химических веществ по мере их использования до тех пор, пока одно из химических веществ не будет полностью исчерпано.
Теоретическая энергия, доступная из ячейки, может быть рассчитана с использованием уравнения свободной энергии Гиббса для начального и конечного состояний равновесия.
К счастью, такие глубокие знания в области химии клеток и термодинамики обычно не требуются инженерам по применению батарей.
* Важное примечание: Существует много путаницы, связанной с обозначением электродов вторичных элементов как анодов или катодов. Строго говоря, обозначение зависит от направления тока. Это означает, что он меняется в зависимости от того, заряжается или разряжается элемент. Это связано с тем, что анод определяется как электрод, который производит электроны (окислительная полуреакция), а катод определяется как электрод, который получает электроны (восстановительная полуреакция). Это справедливо как для зарядки, так и для разрядки. Другими словами:
Во время разряда анод является отрицательным электродом, а катод — положительным электродом.
Во время зарядки анод является положительным электродом, а катод — отрицательным электродом.
Мнемоника ACID для «Анодный ток в устройство» связывает обозначение электрода с направлением тока.
Путаница, к сожалению, усугубляется из-за различных соглашений об именах, обычно применяемых к электродам батареи. Электроды вторичных элементов обычно называют просто анодами и катодами, которые соответствуют реакции разрядки, при вводящем в заблуждение игнорировании реверсирования, соответствующего процессу зарядки.
Другой способ взглянуть на это состоит в том, что полярность катода по отношению к аноду может быть положительной или отрицательной. Таким образом, общепринятые обозначения катода и анода не меняются в зависимости от направления тока.
Первичные ячейки
В первичных элементах эта электрохимическая реакция необратима. Во время разрядки химические соединения постоянно изменяются, и электрическая энергия высвобождается до тех пор, пока исходные соединения не будут полностью исчерпаны. Таким образом, ячейки можно использовать только один раз.
Таким образом, ячейки можно использовать только один раз.
Вторичные элементы
Во вторичных элементах эта электрохимическая реакция является обратимой, и исходные химические соединения могут быть восстановлены приложением электрического потенциала между электродами, подающими энергию в элемент. Такие элементы можно разряжать и перезаряжать много раз.
Действие аккумуляторной батареи (значительно упрощенное)
Процесс зарядки
Зарядное устройство отрывает электроны от анода, оставляя его с положительным зарядом, и направляет их на катод, придавая ему отрицательный заряд. Энергия, закачиваемая в клетку, возвращает активные химические вещества в исходное состояние.
Энергия, закачиваемая в клетку, возвращает активные химические вещества в исходное состояние.
Выбор активных химикатов
Напряжение и ток, генерируемые гальваническим элементом, напрямую связаны с типами материалов, используемых в электродах и электролите.
Склонность отдельного металла или соединения металлов приобретать или терять электроны по отношению к другому материалу известна как его электродный потенциал. Таким образом, сила окислителей и восстановителей определяется их стандартными электродными потенциалами. Соединения с потенциалом положительного электрода используются для анодов, а соединения с потенциалом отрицательного электрода — для катодов. Чем больше разница между электродными потенциалами анода и катода, тем больше ЭДС ячейки и тем большее количество энергии может производить ячейка.
Периодическая таблица
Анодные и катодные материалы выбираются с учетом их пригодности в качестве окислителей или восстановителей. Относительные восстановительные и окислительные способности элементов указаны цветной стрелкой в Периодической таблице ниже. Сильные восстановители сгруппированы слева, а сильные окислители сгруппированы справа.
Относительные восстановительные и окислительные способности элементов указаны цветной стрелкой в Периодической таблице ниже. Сильные восстановители сгруппированы слева, а сильные окислители сгруппированы справа.
- Группы
Элементы в каждой отдельной группе имеют одинаковое количество «валентных» электронов на внешней валентной оболочке. Поскольку количество валентных электронов определяет, как атом химически реагирует с другими атомами, элементы в пределах определенной группы, как правило, имеют схожие химические свойства.
Внешняя электронная оболочка может иметь до восьми электронов, но с полным набором из восьми электронов, как в благородных газах (группа 18), нет «свободных» электронов, доступных для участия в химических реакциях, поэтому благородные газы химически нереактивный или инертный. Таким образом, во внешней валентной оболочке атомов фактически имеется только семь возможных валентных электронов, и каждый элемент имеет уникальное характеристическое число электронов, определяющее его свойства. Способы взаимодействия атомов с другими атомами, другими словами их возможные химические реакции, определяются числом электронов в их валентных оболочках.
Способы взаимодействия атомов с другими атомами, другими словами их возможные химические реакции, определяются числом электронов в их валентных оболочках.
Наиболее реактивные элементы находятся в левом и правом краях таблицы. Это щелочные металлы (группа 1), атомы которых имеют только один электрон в своих валентных оболочках, и галогены (группа 17) с семью валентными электронами, у которых отсутствует только один электрон из полной оболочки.
- Периоды
Все элементы в любой период имеют одинаковое количество электронных оболочек или орбит, что соответствует количеству возможных энергетических уровней электронов в атоме. Номер периода соответствует количеству электронных оболочек.
Число, содержащееся в каждой ячейке в таблице, представляет собой атомный номер элемента, который представляет собой число протонов в ядре каждого атома. Двигаясь слева направо по таблице от группы 1 к группе 18 в каждом периоде, число протонов на атом увеличивается на один от каждого элемента к соседнему элементу.
Двигаясь слева направо по таблице от группы 1 к группе 18 в каждом периоде, число протонов на атом увеличивается на один от каждого элемента к соседнему элементу.
Восстановители (элементы) имеют избыточные электроны на своей внешней валентной оболочке, которые они отдают в окислительно-восстановительной реакции и, следовательно, окисляются. Окислители (элементы) имеют дефицит электронов в своей валентной оболочке, которая принимает электроны в окислительно-восстановительной реакции и восстанавливается.
См. также Стандартную модель физики элементарных частиц, показывающую фундаментальные частицы.
Электрохимическая серия Приведенный ниже электрохимический ряд представляет собой список или таблицу металлических элементов или ионов, расположенных в соответствии с их электродными потенциалами. Порядок показывает тенденцию одного металла восстанавливать ионы любого другого металла ниже его в ряду. Потенциалы выбраны по отношению к водороду, потенциал которого был произвольно определен как ноль, что приводит к положительным и отрицательным значениям электродного потенциала. На самом деле они следуют прогрессивной последовательности, охватывающей диапазон около 6 вольт.
Порядок показывает тенденцию одного металла восстанавливать ионы любого другого металла ниже его в ряду. Потенциалы выбраны по отношению к водороду, потенциал которого был произвольно определен как ноль, что приводит к положительным и отрицательным значениям электродного потенциала. На самом деле они следуют прогрессивной последовательности, охватывающей диапазон около 6 вольт.
Образец из таблицы стандартных потенциалов показывает экстремумы таблицы.
Прочность окислителей и восстановителей Катод (восстановление)
Полуреакция
Стандартный потенциал
Е° (вольты)
Li + (водный) + e — —> Li(s)
-3,04
K + (водный) + e — —> K(s)
-2,92
Ca 2+ (водный) + 2e — —> Ca(s)
-2,76
Na + (водный) + e — —> Na(s)
-2,71
Zn 2+ (водн. ) + 2e — —> Zn(s)
) + 2e — —> Zn(s)
-0,76
2H + + 2e — —> H 2
0
Cu 2+ (водн.) + 2e — —> Cu(s)
0,34
О 3 + (г) + 2H + (водн.) + 2e — —> O 2 (г) + H 2 O(л)
2,07
F 2 (g) + 2e — —> 2F — (aq)
2,87
Значения для записей в таблице представляют собой восстановительные потенциалы, поэтому литий в верхней части списка имеет самое отрицательное число, что указывает на то, что это самый сильный восстановитель. Самым сильным окислителем является фтор с наибольшим положительным числом для стандартного электродного потенциала.
Самым сильным окислителем является фтор с наибольшим положительным числом для стандартного электродного потенциала.
На силу восстановительной или окислительной способности соединений указывают также их характерные электродные потенциалы.
Доступная энергия
Химические элементы содержат собственный электрохимический энергетический потенциал, связанный с энергией электронов в самой внешней электронной оболочке или валентной зоне атома, а также с наличием в его текущем состоянии потенциального избытка или дефицита электронов. Эти внешние электроны, называемые валентными электронами, определяют, как атом химически реагирует с другими атомами. Атомы, у которых валентная оболочка заполнена, обычно химически инертны. Атомы с одним или двумя валентными электронами больше, чем в закрытой оболочке, обладают высокой реакционной способностью, поскольку лишние электроны легко удаляются с образованием положительных ионов (окисление). Атомы с одним или двумя валентными электронами меньше, чем у закрытой оболочки, также обладают высокой реакционной способностью из-за тенденции либо приобретать недостающие электроны и образовывать отрицательные ионы (восстановление), либо делиться электронами и образовывать ковалентные связи. Самая низкая энергия для вида наступает, когда его внешняя оболочка полностью занята электронами. Приобретение или потеря электронов изменяет энергетический уровень атома, и именно эта энергия высвобождается в виде электрической энергии во время разряда первичной или вторичной батареи или поглощается при зарядке вторичной батареи.
Атомы с одним или двумя валентными электронами меньше, чем у закрытой оболочки, также обладают высокой реакционной способностью из-за тенденции либо приобретать недостающие электроны и образовывать отрицательные ионы (восстановление), либо делиться электронами и образовывать ковалентные связи. Самая низкая энергия для вида наступает, когда его внешняя оболочка полностью занята электронами. Приобретение или потеря электронов изменяет энергетический уровень атома, и именно эта энергия высвобождается в виде электрической энергии во время разряда первичной или вторичной батареи или поглощается при зарядке вторичной батареи.
Энергия, доступная в атоме для выполнения внешней работы, называется Свободной энергией Гиббса , и показатель величины этого высвобождения потенциальной энергии определяется электродным потенциалом элемента. Для сбалансированной реакции это выражается в следующем уравнении:
ΔG = — E 0 сущ. Ф
Ф
Где
ΔG Изменение свободной энергии Гиббса в Джоулях
E 0 – стандартный электродный потенциал или ЭДС в вольтах (см. таблицу выше)
n – число молей электронов, переданных в ячейке реакции на моль реакции
F – постоянная Фарадея в кулонах на моль (величина электрического заряда на моль электронов)
Это уравнение используется для расчета энергии, получаемой в результате окислительно-восстановительных реакций, возможных с различными комбинациями активных химических веществ.
Напряжение или разность потенциалов между реакциями окисления и восстановления возникает из-за различных электрохимических потенциалов реакций восстановления и окисления в батарее. Электрохимический потенциал является мерой разницы между средней энергией самых внешних электронов молекулы или элемента в двух его валентных состояниях.
История
В приведенной ниже таблице показаны некоторые распространенные химические вещества, используемые для электродов аккумуляторов, расположенные в порядке их относительного электродного потенциала.
Анодные материалы Катодные материалы (Отрицательные клеммы)
(плюсовые клеммы)
ЛУЧШИЙ — (самый отрицательный)
ЛУЧШИЙ- (самый положительный)
Литий Феррата Магний Оксид железа Алюминий Оксид меди Цинк Йодат Хром Оксид меди Железо Оксид ртути Никель Оксид кобальта Олово Диоксид марганца Свинец Двуокись свинца Водород Оксид серебра Медь Кислород Серебро Оксигидроксид никеля Палладий Диоксид никеля Меркурий Пероксид серебра Платина Перманганат Золото Бромат ХУДШЕЕ — (наименее отрицательное)
ХУДШИЙ — (наименее положительный)
Элементы, использующие водные (содержащие воду) электролиты, ограничены по напряжению до уровня менее 2 В, поскольку кислород и водород в воде диссоциируют при наличии напряжения выше этого напряжения. Литиевые батареи (см. ниже), в которых используются неводные электролиты, не имеют этой проблемы и доступны с напряжением от 2,7 до 3,7 вольт. Однако использование неводных электролитов приводит к тому, что эти элементы имеют относительно высокий внутренний импеданс.
Литиевые батареи (см. ниже), в которых используются неводные электролиты, не имеют этой проблемы и доступны с напряжением от 2,7 до 3,7 вольт. Однако использование неводных электролитов приводит к тому, что эти элементы имеют относительно высокий внутренний импеданс.
Подробнее о выборе материалов для электродов см. на странице, посвященной новым конструкциям аккумуляторов и химическому составу.
Альтернативные химические реакции
Совсем недавно была разработана новая клеточная химия с использованием химических реакций, альтернативных традиционной окислительно-восстановительной схеме.
Металлогидридные ячейки
Химия металлогидридных ячеек зависит от способности некоторых металлов поглощать большие количества водорода. Эти металлические сплавы, называемые гидридами, могут служить хранилищем водорода, который может обратимо вступать в химические реакции в элементах аккумуляторной батареи. Такие металлы или сплавы используются для отрицательных электродов. Положительный электрод представляет собой гидроксид никеля, как в никель-кадмиевых батареях. Электролит, который также представляет собой водный раствор, поглощающий водород, такой как гидроксид калия, не принимает участия в реакции, а служит для переноса водорода между электродами.
Такие металлы или сплавы используются для отрицательных электродов. Положительный электрод представляет собой гидроксид никеля, как в никель-кадмиевых батареях. Электролит, который также представляет собой водный раствор, поглощающий водород, такой как гидроксид калия, не принимает участия в реакции, а служит для переноса водорода между электродами.
Литий-ионные элементы
В отличие от традиционного окислительно-восстановительного гальванического действия, химия литий-ионных вторичных элементов зависит от механизма «интеркаляции». Это включает внедрение ионов лития в кристаллическую решетку электрода-хозяина без изменения его кристаллической структуры. Эти электроды обладают двумя ключевыми свойствами
- Открытые кристаллические структуры, позволяющие вводить или извлекать ионы лития
- Способность одновременно принимать компенсирующие электроны
Такие электроды называются интеркаляционными хостами.
В типичном литиевом элементе анод или отрицательный электрод основан на углероде, а катод или положительный электрод изготовлен из диоксида лития-кобальта или диоксида лития-марганца. (Другие химические вещества также возможны)
Поскольку литий бурно реагирует с водой, электролит состоит из неводных органических солей лития и действует исключительно как проводящая среда и не принимает участия в химическом воздействии, а поскольку в химическом воздействии не участвует вода, выделение водорода и кислородные газы, как и во многих других батареях, также исключены.
Во время разряда ионы лития отделяются от анода, мигрируют через электролит и внедряются в кристаллическую структуру исходного соединения. В то же время компенсирующие электроны перемещаются по внешней цепи и принимаются хозяином, чтобы уравновесить реакцию.
Процесс полностью обратим. Таким образом, ионы лития проходят между электродами во время зарядки и разрядки. Это привело к названиям «Кресло-качалка», «Качели» или «Волан» для ионно-литиевых батарей.
- Поверхность раздела твердого электролита/межфаза (SEI)
Слой SEI необходим для стабильности литиевых вторичных элементов, использующих угольные аноды.
Электролит энергично реагирует с угольным анодом во время начального формирования заряда, и образуется тонкий пассивирующий слой SEI, который замедляет скорость заряда и ограничивает ток
Отложение слоя SEI является важной частью процесса формирования, когда клетки получают свой первый заряд.
НО слой SEI увеличивает внутреннее сопротивление элемента и снижает возможные скорости заряда, а также характеристики при высоких и низких температурах.
Чрезмерное тепло может привести к разрушению защитного барьерного слоя SEI, что приведет к перезапуску анодной реакции с выделением большего количества тепла, что приведет к тепловому разгону.
Толщина слоя SEI неоднородна и увеличивается с возрастом, увеличивая внутреннее сопротивление элемента, уменьшая его емкость и, следовательно, срок его службы.
Аноды из оксида титаната лития (LTO) не вступают в неблагоприятную реакцию с обычно используемыми электролитами в литий-ионных элементах, поэтому слой SEI не образуется и не требуется в элементах LTO. Это дает новые степени свободы в изменении производительности ячеек. См. Варианты литиевых элементов
Разновидности литиевой технологии также используются в первичных элементах, которые изначально были разработаны для космических и военных применений. К ним относятся литий-тионилхлорид и литий-диоксид серы, в которых используются реактивные электролиты и жидкие катоды для получения более высокой плотности энергии и мощности.
К ним относятся литий-тионилхлорид и литий-диоксид серы, в которых используются реактивные электролиты и жидкие катоды для получения более высокой плотности энергии и мощности.
Альтернативные химические вещества – специальные ароматизаторы
Разработка более качественной батареи — это не просто вопрос выбора пары элементов с большей разницей электродных потенциалов, в игру вступает множество других факторов. Это могут быть: доступность и стоимость сырья, стабильность или безопасность химической смеси, технологичность компонентов, обратимость электрохимической реакции, проводимость компонентов, диапазон рабочих температур и, вполне возможно, желание обойти патент какого-то другого производителя. . Все эти соображения приводят к использованию ограниченного набора основных химических веществ, но с более широким разнообразием запатентованных составов материалов.
За прошедшие годы был разработан широкий спектр химических веществ и добавок для оптимизации работы элементов для различных применений.
Альтернативные активные соединения могут быть заменены для увеличения плотности энергии (см. ниже), увеличения емкости по току, уменьшения внутреннего импеданса, уменьшения саморазряда, увеличения напряжения на клеммах, улучшения кулоновского КПД или снижения затрат.
Дополнительные соединения могут быть включены для изменения поведения активных соединений, чтобы увеличить срок службы, предотвратить коррозию или утечку, контролировать поляризацию или повысить безопасность. Они могут включать катализаторы, которые можно использовать для стимулирования или ускорения желаемых химических действий, таких как рекомбинация активных химических веществ в герметичных ячейках. Они могут также включать ингибиторы, которые могут быть добавлены для замедления или предотвращения нежелательных физических или химических воздействий, таких как образование дендритов.
К ассортименту доступных химических элементов добавляются элементы с различной емкостью и физической конструкцией элементов, поэтому у инженера по применению аккумуляторов есть широкий выбор вариантов для выбора.
Плотность энергии
Плотность энергии — это мера количества энергии на единицу веса или на единицу объема, которое может храниться в батарее. Таким образом, для данного веса или объема химический состав ячейки с более высокой плотностью энергии будет хранить больше энергии или, альтернативно, для данной емкости хранения ячейка с более высокой плотностью энергии будет меньше и легче. На приведенной ниже диаграмме показаны некоторые типичные примеры.
Относительная плотность энергии некоторых распространенных вторичных клеточных химических реакций
Как правило, более высокая плотность энергии достигается за счет использования более реакционноспособных химических веществ. Недостатком является то, что более химически активные химические вещества, как правило, нестабильны и могут потребовать специальных мер предосторожности. Плотность энергии также зависит от качества активных материалов, используемых в конструкции ячейки, с примесями, ограничивающими достижимую емкость ячейки. Вот почему элементы разных производителей с одинаковым химическим составом элементов и похожей конструкцией могут иметь различное энергосодержание и характеристики разряда.
Плотность энергии также зависит от качества активных материалов, используемых в конструкции ячейки, с примесями, ограничивающими достижимую емкость ячейки. Вот почему элементы разных производителей с одинаковым химическим составом элементов и похожей конструкцией могут иметь различное энергосодержание и характеристики разряда.
Обратите внимание, что часто существует разница между цилиндрическими и призматическими ячейками. Это связано с тем, что указанная плотность энергии обычно относится не только к химическим веществам, но и ко всей ячейке, принимая во внимание материалы корпуса ячейки и соединения. Таким образом, на плотность энергии влияют или ограничивают практические аспекты конструкции ячейки.
Поставка основных химических элементов
Беспокоитесь о доступности экзотических химикатов и возможном влиянии будущего спроса на цены?
На приведенной ниже диаграмме показано относительное содержание химических элементов в земной коре.
Источник — Информационный бюллетень Геологической службы США 087-02
Примечание. На приведенной выше диаграмме литий в 20-100 раз более распространен по количеству атомов, чем свинец и никель. Причина, по которой он менее распространен, заключается в том, что литий, будучи гораздо более реакционноспособным, чем любой из металлов, обычно не встречается в свободном состоянии, а сочетается с другими элементами. Напротив, свинец, будучи менее реакционноспособным, чаще встречается в свободном состоянии, и его легче извлекать и очищать. Тяжелые металлы кадмий и ртуть, использование которых в настоящее время не рекомендуется из-за их токсичности, в 1000 раз менее распространены, чем литий.
Потребление лития в батареях электромобилей и гибридных автомобилей
Содержание лития в литиевой батарее большой емкости на самом деле довольно мало.
Взяв в качестве примера литий-кобальтовый элемент, содержание лития в катодном материале LiCoO 2 составляет всего 7% по весу. Сам катодный материал составляет от 25% до 33% веса батареи, так что содержание лития в электроде в элементе составляет около 2% веса элемента. Кроме того, электролит, на долю которого приходится около 10% веса батареи, также содержит меньшее количество растворенного лития, так что общее содержание лития в высокоэнергетической батарее обычно составляет менее 3% по весу.
Литиевые батареи, используемые в электромобилях и гибридных автомобилях, весят около 7 кг на кВт·ч, поэтому содержание лития будет составлять около 0,2 кг на кВт·ч. Типичный пассажирский электромобиль может использовать аккумуляторы емкостью от 30 кВтч до 50 кВтч, так что содержание лития будет составлять от 6 до 10 кг на аккумулятор электромобиля.
Емкость аккумуляторов HEV обычно составляет менее 10 % от емкости аккумулятора EV, а вес используемого лития соответственно на 10 % меньше.
Таким образом, 1 миллион электромобилей будет потреблять менее 10 000 тонн лития (без переработки), а 1 миллион ГЭМ будет потреблять не более 1 000 тонн
Учитывая доступные запасы лития (см. следующий раздел), лития более чем достаточно для удовлетворения мирового спроса на автомобильные аккумуляторы высокой энергии.
Принадлежности для лития
Литий является 31-м наиболее распространенным элементом в земной коре с содержанием 20 частей на миллион. Это сопоставимо со свинцом (14 частей на миллион), оловом (2,3 части на миллион), кобальтом (25 частей на миллион) и никелем (84 части на миллион). Он содержится в небольших количествах почти во всех магматических породах и минеральных источниках с особенно большими месторождениями в Китае, Северной Америке, Бразилии, Чили, Аргентине, России, Испании и некоторых частях Африки.
Текущая оценка эксплуатационных запасов (не считая добычи из морской воды) оценивается в 28,4 млн тонн. Кроме того, земная 1,4 × 10 21 килограммов морской воды содержат относительно высокое содержание лития 0,17 частей на миллион, что означает, что в Мировом океане содержится более 200 миллиардов тонн лития.
Кроме того, земная 1,4 × 10 21 килограммов морской воды содержат относительно высокое содержание лития 0,17 частей на миллион, что означает, что в Мировом океане содержится более 200 миллиардов тонн лития.
Геологическая служба США сообщила, что мировое производство лития в 2006 году составило 333 000 метрических тонн, что немного меньше, чем в предыдущем году. Ожидается, что в 2010 году Китай будет производить 45 000 тонн лития в год на соляных заводах
Токсичность лития
Если вам интересно, были ли какие-либо токсические эффекты, связанные с литием, утверждается, что литий, наоборот, имеет терапевтические преимущества. Безалкогольный напиток «7Up» начал свою жизнь в 1929 году, за два месяца до краха Уолл-Стрит, с броским названием «Bib Label Lithiated Lemon-Lime Soda». «7Up» содержал цитрат лития до 1950 года, когда его формула была изменена, некоторые говорят, из-за ассоциации лития с психическими заболеваниями. С 1940-х годов литий в форме карбоната лития успешно использовался при лечении психических расстройств, особенно маниакальной депрессии. Однако, как и в случае с большинством химических веществ, небольшие дозы могут быть безопасными или терапевтическими, но слишком большие дозы могут привести к летальному исходу.
С 1940-х годов литий в форме карбоната лития успешно использовался при лечении психических расстройств, особенно маниакальной депрессии. Однако, как и в случае с большинством химических веществ, небольшие дозы могут быть безопасными или терапевтическими, но слишком большие дозы могут привести к летальному исходу.
Дополнительную информацию о токсичности см. на странице «Новые конструкции батарей и химический состав».
Сделайте свою собственную батарею дома или в школе См. «Самодельные батареи» для получения инструкций о том, как сделать батарею из простых материалов, доступных в домашних условиях.
Новый химический состав аккумуляторов
Подробнее о внедрении новой аккумуляторной технологии см. на следующей странице Новые конструкции и химический состав аккумуляторов
Конструкция батареи
Информацию о механической конструкции батарей можно найти на следующих страницах:
- Конструкция ячейки
- Конструкция аккумуляторной батареи
Практическая клеточная химия
Описаны некоторые из наиболее распространенных клеточных химических процессов и области применения, для которых они подходят, если вы перейдете по ссылкам ниже: —
Первичные ячейки
- Ячейки Лекланше
- Щелочные элементы
- Элементы из оксида серебра
- Воздушно-цинковые элементы
- Литиевые первичные элементы
- Аккумуляторы с водной активацией
- Термальные батареи
Дополнительные элементы
- Свинцово-кислотный
- Никель Железо
- Никель Кадмий
- Никель-металлогидридный
- Никель Цинк
- Никель Водород
- Батарея из жидкого металла
- Литиевые вторичные элементы
- Сера натрия
9Проточные кюветы 1736 (редокс)- Зебра Клетки
- Прочие гальванические элементы
Необычные батарейки
- Мочевая батарея — нет, это не шутка
- Ампульные батарейки
- Тонкопленочные батареи
- Домашняя батарея
Сравнительная таблица клеточной химии
Альтернативные методы производства и хранения энергии
- Конденсаторы и суперконденсаторы
- Топливные элементы
- Солнечные батареи
- Нехимические методы хранения энергии
Продление низкотемпературной работы металлических натриевых батарей, сочетающих линейные и циклические растворы электролитов на основе эфира
Abstract
Неводные натриевые батареи являются идеальными кандидатами для нового поколения электрохимических накопителей энергии. Однако, несмотря на многообещающие характеристики при температуре окружающей среды, на их работу при низких температурах (например, <0 °C) отрицательно влияет увеличение сопротивления электролита и межфазная нестабильность твердого электролита (SEI). Здесь, чтобы обойти эти проблемы, мы предлагаем специальные составы электролитов, включающие линейные и циклические растворители на основе эфира и соль трифторметансульфоната натрия, которые термически стабильны до -150 °C и позволяют формировать стабильный SEI при низких температурах. При тестировании в конфигурации батарейки типа «таблетка» Na||Na низкотемпературные электролиты допускают длительное циклирование при температурах до −80 °C. С помощью физико-химических измерений ex situ (например, рентгеновской фотоэлектронной спектроскопии, криогенной просвечивающей электронной микроскопии и атомно-силовой микроскопии) электродных измерений и расчетов теории функционала плотности мы исследуем механизмы, ответственные за эффективное низкотемпературное электрохимическое поведение.
Однако, несмотря на многообещающие характеристики при температуре окружающей среды, на их работу при низких температурах (например, <0 °C) отрицательно влияет увеличение сопротивления электролита и межфазная нестабильность твердого электролита (SEI). Здесь, чтобы обойти эти проблемы, мы предлагаем специальные составы электролитов, включающие линейные и циклические растворители на основе эфира и соль трифторметансульфоната натрия, которые термически стабильны до -150 °C и позволяют формировать стабильный SEI при низких температурах. При тестировании в конфигурации батарейки типа «таблетка» Na||Na низкотемпературные электролиты допускают длительное циклирование при температурах до −80 °C. С помощью физико-химических измерений ex situ (например, рентгеновской фотоэлектронной спектроскопии, криогенной просвечивающей электронной микроскопии и атомно-силовой микроскопии) электродных измерений и расчетов теории функционала плотности мы исследуем механизмы, ответственные за эффективное низкотемпературное электрохимическое поведение. Мы также сообщаем о сборке и испытаниях полного Na||Na 9 при температуре от −20 °C до −60 °C.0085 3 V 2 (PO 4 ) 3 ячейки для монет. Ячейка, испытанная при температуре -40 °C, показала начальную разрядную емкость 68 мАч·г·–1· с сохранением емкости примерно на 94% после 100 циклов при 22 мА g·–1·.
Мы также сообщаем о сборке и испытаниях полного Na||Na 9 при температуре от −20 °C до −60 °C.0085 3 V 2 (PO 4 ) 3 ячейки для монет. Ячейка, испытанная при температуре -40 °C, показала начальную разрядную емкость 68 мАч·г·–1· с сохранением емкости примерно на 94% после 100 циклов при 22 мА g·–1·.
Введение
Литий-ионные батареи (ЛИА) широко используются в портативной электронике и электромобилях из-за их высокой плотности энергии и длительного срока службы 1,2,3 . Тем не менее, они неизбежно страдают от серьезных потерь энергии/мощности в холодных условиях, особенно когда температура падает ниже −20 °C 4,5 . Такие плохие низкотемпературные характеристики ограничивают их применение в авиационно-космических полетах, полярных экспедициях и на многих военных и гражданских объектах в холодных регионах, где требуется рабочая температура аккумуляторов ниже −40 °C 4,6 .
Поиск системы с привлекательными свойствами электрохимического накопления энергии помимо технологий на основе лития может оказаться многообещающим для решения проблем, связанных с работой при низких температурах. Как щелочной металл, натрий (Na) выделяется тем, что он имеет много общих химических и физических свойств с литием, но в то же время значительно более распространен в природе 7,8,9 . Na имеет более низкую энергию первой ионизации, чем Li (495,8 по сравнению с 520,2 кДж моль -1 ) 10 , что может способствовать улучшению химической / электрохимической реакционной способности и облегчению электрохимических реакций в холодных условиях. Металлический натрий играет решающую роль в качестве анодного материала для натриевых аккумуляторов из-за его низкого электродного потенциала (-2,714 В по сравнению со стандартным водородным электродом) и высокой теоретической удельной емкости (1166 мАч·г −1 ) 7,8,9, 11,12,13,14 . Тем не менее исследования Na-аккумуляторов при низких температурах ограничены, и, в частности, в значительной степени отсутствует понимание поведения металлического Na в качестве электрода 15,16,17,18 .
Тем не менее исследования Na-аккумуляторов при низких температурах ограничены, и, в частности, в значительной степени отсутствует понимание поведения металлического Na в качестве электрода 15,16,17,18 .
Возможность эксплуатации аккумуляторов при низких температурах сильно зависит от природы электролита 19,20,21,22 . Стойкость к электролиту быстро возрастает при понижении температуры из-за относительно высоких температур замерзания/плавления неводных карбонатных растворителей и пониженной растворимости проводящих солей 5,19 . Кроме того, межфазная фаза твердого электролита (SEI), образованная при температуре окружающей среды, может быть не в состоянии поддерживать такие же защитные свойства в холодных условиях, чтобы обеспечить эффективное циклирование. Между тем, низкотемпературная структурная и композиционная эволюция SEI, сформированного на металлическом Na-электроде, все еще остается неясной.
Одним из эффективных решений, позволяющих обойти эти проблемы, является разработка электролитов, предназначенных для работы при низких температурах, с использованием растворителей с низкой температурой плавления и солей, способных образовывать стабильный SEI. Здесь, применяя такую стратегию электролита, мы демонстрируем, что раствор электролита, содержащий ациклический эфирный растворитель и совместимую соль Na, может увеличить рабочую температуру металлического Na до -40 °C. Обнаружено, что соль трифторметансульфоната (OTf) играет решающую роль в обеспечении образования стабильного SEI при низких температурах. Кроме того, добавление циклического эфирного растворителя для приготовления раствора электролита с бинарным растворителем может расширить температурный порог термостабильности до -150 °C. Мы демонстрируем стабильное металлическое покрытие/зачистку Na в симметричных ячейках при низких температурах до -80 °C, демонстрируя низкое перенапряжение ~150 мВ в течение более 750 ч. Эти характеристики расширяют возможности эксплуатации электродов из щелочных металлов при низких температурах в неводных растворах электролитов (см. Дополнительный рисунок 1 и Дополнительную таблицу 1 для сравнения с современным уровнем техники). Связанные экспериментальные характеристики (например, рентгеновская фотоэлектронная спектроскопия, криогенная просвечивающая электронная микроскопия и атомно-силовая микроскопия) и расчеты теории функционала плотности позволяют понять механистические особенности, которые обеспечивают эффективные низкотемпературные электрохимические характеристики.
Здесь, применяя такую стратегию электролита, мы демонстрируем, что раствор электролита, содержащий ациклический эфирный растворитель и совместимую соль Na, может увеличить рабочую температуру металлического Na до -40 °C. Обнаружено, что соль трифторметансульфоната (OTf) играет решающую роль в обеспечении образования стабильного SEI при низких температурах. Кроме того, добавление циклического эфирного растворителя для приготовления раствора электролита с бинарным растворителем может расширить температурный порог термостабильности до -150 °C. Мы демонстрируем стабильное металлическое покрытие/зачистку Na в симметричных ячейках при низких температурах до -80 °C, демонстрируя низкое перенапряжение ~150 мВ в течение более 750 ч. Эти характеристики расширяют возможности эксплуатации электродов из щелочных металлов при низких температурах в неводных растворах электролитов (см. Дополнительный рисунок 1 и Дополнительную таблицу 1 для сравнения с современным уровнем техники). Связанные экспериментальные характеристики (например, рентгеновская фотоэлектронная спектроскопия, криогенная просвечивающая электронная микроскопия и атомно-силовая микроскопия) и расчеты теории функционала плотности позволяют понять механистические особенности, которые обеспечивают эффективные низкотемпературные электрохимические характеристики. Полный Na||Na 3 V 2 (PO 4 ) 3 батарейки типа «таблетка» также собраны и испытаны при температуре от −20 °C до −60 °C. Ячейки, протестированные при -40 °C и -60 °C, показали начальную разрядную емкость ~68 и 39 мА·ч·г −1 соответственно, с сохранением емкости ~94% и 91% после 100 циклов при 22 мА g − 1 .
Полный Na||Na 3 V 2 (PO 4 ) 3 батарейки типа «таблетка» также собраны и испытаны при температуре от −20 °C до −60 °C. Ячейки, протестированные при -40 °C и -60 °C, показали начальную разрядную емкость ~68 и 39 мА·ч·г −1 соответственно, с сохранением емкости ~94% и 91% после 100 циклов при 22 мА g − 1 .
Результаты
Скрининг электролитов с одним растворителем при низких температурах
Мы провели скрининг различных растворов электролитов при -35 °C с использованием различных комбинаций соль-растворитель. В качестве растворителей-кандидатов были выбраны простые эфиры с низкими температурами плавления, включая диметиловый эфир диэтиленгликоля (DEGDME), 1,2-диметоксиэтан (DME) и 1,3-диоксолан (DOL) (дополнительная таблица 2). Различные проводящие соли, в том числе гексафторфосфат натрия (NaPF 6 ), трифторметансульфонат натрия (NaOTf), перхлорат натрия (NaClO 4 ), бис(трифторметансульфонил)имид натрия (NaTFSI) и бис(фторсульфонил)имид натрия (NaFSI) исследовали в качестве солей-кандидатов. Концентрацию соли в растворителе поддерживали на уровне 1 М для скрининга растворимости этих электролитов с одним растворителем при низких температурах. Результаты (дополнительная таблица 3) показывают, что растворимость NaPF 6 не может достигать концентрации 1 М во всех трех растворителях при температуре -35 ° C, в то время как другие четыре соли хорошо растворяются в ДЭГДМЭ. Следовательно, в то время как 1 M NaPF 6 -DEGDME оказался подходящим электролитом для металлического Na-анода в условиях окружающей среды 23 , он может не подходить для работы при низких температурах. Кроме того, DOL не может легко растворять соли Na, за исключением NaTFSI. Электролит, состоящий из 1 M NaPF 6 -DEGDME, был дополнительно исследован в диапазоне температур в симметричных ячейках Na||Na и нержавеющей стали||нержавеющей стали соответственно (дополнительный рисунок 2). Сравнение спектров электрохимической импедансной спектроскопии (ЭИС) 1 M NaPF 6 -DEGDME, испытанный в симметричных ячейках Na||Na, показывает, что сопротивление на границе раздела электрод-электролит при -20°C значительно выше, чем при 20°C (дополнительная таблица 4).
Концентрацию соли в растворителе поддерживали на уровне 1 М для скрининга растворимости этих электролитов с одним растворителем при низких температурах. Результаты (дополнительная таблица 3) показывают, что растворимость NaPF 6 не может достигать концентрации 1 М во всех трех растворителях при температуре -35 ° C, в то время как другие четыре соли хорошо растворяются в ДЭГДМЭ. Следовательно, в то время как 1 M NaPF 6 -DEGDME оказался подходящим электролитом для металлического Na-анода в условиях окружающей среды 23 , он может не подходить для работы при низких температурах. Кроме того, DOL не может легко растворять соли Na, за исключением NaTFSI. Электролит, состоящий из 1 M NaPF 6 -DEGDME, был дополнительно исследован в диапазоне температур в симметричных ячейках Na||Na и нержавеющей стали||нержавеющей стали соответственно (дополнительный рисунок 2). Сравнение спектров электрохимической импедансной спектроскопии (ЭИС) 1 M NaPF 6 -DEGDME, испытанный в симметричных ячейках Na||Na, показывает, что сопротивление на границе раздела электрод-электролит при -20°C значительно выше, чем при 20°C (дополнительная таблица 4). Между тем, общее сопротивление электролиту, измеренное в элементах из нержавеющей стали || из нержавеющей стали (конфигурация элемента показана на дополнительном рисунке 3), увеличивается с понижением температуры. Это увеличение сопротивления электролита особенно значительно при температуре ниже -20 ° C (дополнительная таблица 5), что может быть связано в основном с осаждением NaPF 6 в DEGDME при низких температурах. Таким образом, восемь из пятнадцати электролитов с одним растворителем термически стабильны при -35°C при концентрации 1M, и они были выбраны для дальнейшей электрохимической оценки с металлическим Na.
Между тем, общее сопротивление электролиту, измеренное в элементах из нержавеющей стали || из нержавеющей стали (конфигурация элемента показана на дополнительном рисунке 3), увеличивается с понижением температуры. Это увеличение сопротивления электролита особенно значительно при температуре ниже -20 ° C (дополнительная таблица 5), что может быть связано в основном с осаждением NaPF 6 в DEGDME при низких температурах. Таким образом, восемь из пятнадцати электролитов с одним растворителем термически стабильны при -35°C при концентрации 1M, и они были выбраны для дальнейшей электрохимической оценки с металлическим Na.
Электрохимическое поведение электролитов с одним растворителем
Измерения гальваностатического циклирования проводили в симметричных ячейках Na||Na при плотности тока 0,5 мА см −2 при циклической емкости 0,5 мА см −2 при −20 ° C (рис. 1a–c) и +20 ° C (дополнительные рисунки 4 и 5). Среди восьми электролитов-кандидатов ячейка с 1 M NaOTf-DEGDME демонстрирует наиболее стабильное циклирование с наименьшим средним перенапряжением (<10 мВ) в течение 600 ч (300 циклов) при +20 °C (электрохимическое поведение для разных электролитов при + 20 °C приведены в дополнительной таблице 6). Все электролиты с солью NaTFSI демонстрируют гораздо более высокие перенапряжения, чем другие электролиты. В частности, ячейка с NaTFSI-DOL демонстрирует возрастающее перенапряжение, которое быстро достигает 1 В, а ячейки с 1 М NaTFSI-DEGDME и 1 М NaTFSI-DME быстро выходят из строя, достигая защитного напряжения (5 В) через 32 и 44 ч. соответственно.
Все электролиты с солью NaTFSI демонстрируют гораздо более высокие перенапряжения, чем другие электролиты. В частности, ячейка с NaTFSI-DOL демонстрирует возрастающее перенапряжение, которое быстро достигает 1 В, а ячейки с 1 М NaTFSI-DEGDME и 1 М NaTFSI-DME быстро выходят из строя, достигая защитного напряжения (5 В) через 32 и 44 ч. соответственно.
Рис. 1: Электрохимическое циклирование электродов из металлического Na в различных составах электролита при -20 °C. a Гальваностатическое циклирование симметричных ячеек Na||Na, работающих в восьми различных составах электролитов с концентрацией соли 1 М при 0,5 мА см -2 и 0,5 мАч см -2 . b , c Соответствующие увеличенные профили напряжения на 50-м цикле и 100-м цикле для b четырех составов и c остальные четыре состава.
Изображение в полный размер
При тестировании при температуре -20 °C ячейка с 1 M NaOTf-DEGDME по-прежнему демонстрирует наивысшую стабильность с плавными и устойчивыми плато напряжения, а также самое низкое перенапряжение ~16 мВ (рис. 1a, б). Для сравнения, для других составов электролита наблюдаются нестабильные и флуктуирующие скачки напряжения (рис. 1b, c). Из-за лучшей производительности NaOTf-DEGDME как при +20 ° C, так и при -20 ° C он был выбран для дальнейшего тестирования в симметричных ячейках при -40 ° C (рис. 2a). При такой низкой температуре начальное перенапряжение 40 мВ возрастает только до 50 мВ даже после 500 ч циклирования при 0,5 мА см -2 (емкость: 1 мАч · см -2 ), что соответствует увеличению менее чем на 0,2% за цикл. Даже при плотности тока 1 мА см -2 среднее перенапряжение 100 мВ может поддерживаться в течение более 300 часов. Что касается оценки кулоновской эффективности (КЭ) (рис. 2b), низкое среднее значение КЭ при -40°С по сравнению со значением при +20°С предполагает, что значительная потеря запасов Na происходит при -40°С.
1a, б). Для сравнения, для других составов электролита наблюдаются нестабильные и флуктуирующие скачки напряжения (рис. 1b, c). Из-за лучшей производительности NaOTf-DEGDME как при +20 ° C, так и при -20 ° C он был выбран для дальнейшего тестирования в симметричных ячейках при -40 ° C (рис. 2a). При такой низкой температуре начальное перенапряжение 40 мВ возрастает только до 50 мВ даже после 500 ч циклирования при 0,5 мА см -2 (емкость: 1 мАч · см -2 ), что соответствует увеличению менее чем на 0,2% за цикл. Даже при плотности тока 1 мА см -2 среднее перенапряжение 100 мВ может поддерживаться в течение более 300 часов. Что касается оценки кулоновской эффективности (КЭ) (рис. 2b), низкое среднее значение КЭ при -40°С по сравнению со значением при +20°С предполагает, что значительная потеря запасов Na происходит при -40°С.
Рис. 2: Электрохимические и физико-химические характеристики металлических Na-электродов, подвергнутых циклированию в 1 M NaOTf-DEGDME при различных температурах.
a Гальваностатическое циклирование Na||Na симметричных ячеек при плотности тока до 1,0 мА см −2 с емкостью до 1,0 мА см −2 при −40 °C. b КЭ в зависимости от номера цикла для элементов из нержавеющей стали Na|| при 0,5 мА см −2 и 0,5 мА см −2 при +20 °C и −40 °C. c Посмертные измерения методом СЭМ ex situ металлических Na-электродов после 50 циклов при 0,5 мА см -2 и 0,5 мАч см -2 при +20 °С, -20 °С и -40 °С. d Содержание элементов (левый столбец) и неорганических компонентов (правый столбец), определенное с помощью ex situ посмертного профилирования XPS по глубине металлических Na-электродов, показанных на рис. 2c.
Увеличить
Физико-химическая характеристика электролитов с одним растворителем
Морфология поверхности металлического Na после нанесения/зачистки Na в различных электролитах была охарактеризована с помощью сканирующей электронной микроскопии (СЭМ). NaTFSI, NaClO 4 и соли NaFSI приводят к неровным поверхностям (порам и/или трещинам) осажденного Na (дополнительные рисунки 6–9).). Напротив, NaOTf-DEGDME обеспечивает относительно гладкие поверхности как при +20 °C, так и при −20 °C, где на поверхности и в поперечном сечении можно наблюдать неоднородную текстуру. Эта микроструктура становится более отчетливой при -40 °C (рис. 2в).
NaTFSI, NaClO 4 и соли NaFSI приводят к неровным поверхностям (порам и/или трещинам) осажденного Na (дополнительные рисунки 6–9).). Напротив, NaOTf-DEGDME обеспечивает относительно гладкие поверхности как при +20 °C, так и при −20 °C, где на поверхности и в поперечном сечении можно наблюдать неоднородную текстуру. Эта микроструктура становится более отчетливой при -40 °C (рис. 2в).
Химический состав SEI, образованного на металлическом электроде Na в NaOTf-DEGDME, был выявлен с помощью рентгеновской фотоэлектронной спектроскопии (XPS), как показано на дополнительном рисунке 10. Энергии связи всех элементов были откалиброваны относительно С 1 с сигнал при 284,8 эВ. На профиле C 1 s пик с энергией связи 293,4 эВ отнесен к –CF 3 , а пики при 288,7 эВ и 286,6 эВ – к O–C=O и C–O– С соответственно 24,25,26,27,28,29 . В спектре O 1 s пики при 533,3 эВ и 531,2 эВ соответствуют CH 3 –O–/–CH 2 –O– группам 30 и C–O–Na (например, RCH 2 ONa) 31 соответственно, а пик при 536,3 эВ отнесен к Na KLL. Для S 2 p , дублеты при 169,6 эВ и 167,2 эВ (на основе 2 p 3/2 ) отнесены к SO 4 2− и SO 92−915 3 9, соответственно. Для F 1 s пики при 689,3 эВ и 684,1 эВ относятся к C–F и NaF соответственно 24,25,26,27,28,29 . Эти РФЭС-спектры при разных температурах показывают сходный состав поверхности SEI, что позволяет предположить существование соединений, содержащих –CF 3 , Na 2 SO 4 , Na 2 SO 3 , Na 2 CO 3 , NaF, C–O–Na и органические остатки. Na 2 SO 3 можно обнаружить только на поверхности при +20 °C. Кроме того, Na 2 S (S 2–: 161,1 эВ) не может быть обнаружен во внутреннем SEI при –20 °C и –40 °C (дополнительные рисунки 11–13). Отсутствие частиц с более низкими степенями окисления при низких температурах свидетельствует о подавлении паразитных реакций между электролитом и металлическим Na-электродом.
Для S 2 p , дублеты при 169,6 эВ и 167,2 эВ (на основе 2 p 3/2 ) отнесены к SO 4 2− и SO 92−915 3 9, соответственно. Для F 1 s пики при 689,3 эВ и 684,1 эВ относятся к C–F и NaF соответственно 24,25,26,27,28,29 . Эти РФЭС-спектры при разных температурах показывают сходный состав поверхности SEI, что позволяет предположить существование соединений, содержащих –CF 3 , Na 2 SO 4 , Na 2 SO 3 , Na 2 CO 3 , NaF, C–O–Na и органические остатки. Na 2 SO 3 можно обнаружить только на поверхности при +20 °C. Кроме того, Na 2 S (S 2–: 161,1 эВ) не может быть обнаружен во внутреннем SEI при –20 °C и –40 °C (дополнительные рисунки 11–13). Отсутствие частиц с более низкими степенями окисления при низких температурах свидетельствует о подавлении паразитных реакций между электролитом и металлическим Na-электродом. Важно отметить, что состав SEI, образованный в NaOTf-DEGDME, демонстрирует высокую стабильность при этих температурах. Для других протестированных систем обсуждение морфологии поверхности Na (дополнительные рисунки 6–9) и химический состав SEI (дополнительные рисунки 14–22, дополнительные таблицы 7 и 8) подробно описан в дополнительных примечаниях 1 и 2 соответственно.
Важно отметить, что состав SEI, образованный в NaOTf-DEGDME, демонстрирует высокую стабильность при этих температурах. Для других протестированных систем обсуждение морфологии поверхности Na (дополнительные рисунки 6–9) и химический состав SEI (дополнительные рисунки 14–22, дополнительные таблицы 7 и 8) подробно описан в дополнительных примечаниях 1 и 2 соответственно.
Распределение химических соединений в SEI, образованном в 1 M NaOTf-DEGDME при различных температурах, было дополнительно проанализировано с помощью профилирования глубины XPS (рис. 2d). При всех температурах содержания O и C уменьшаются с увеличением глубины, показывая, что органические остатки в основном присутствуют в верхнем слое SEI. Для неорганических компонентов NaF и Na 2 SO 4 являются двумя основными видами. Соотношение NaF/Na 2 SO 4 увеличивается с увеличением глубины, что позволяет предположить, что NaF преобладает во внутренней части SEI. При -40 °C содержание Na быстро увеличивается с увеличением времени травления из-за образования более тонкого слоя SEI при более низкой температуре.
Теоретическое исследование электролитов с одним растворителем
Чтобы помочь рационализировать характеристики различных солей, мы выполнили расчеты из первых принципов в рамках теории функционала плотности (DFT) для оценки их восстановительного потенциала. На рис. 3 показаны расчетные потенциалы восстановления для различных солей и их сравнение с качеством SEI. Дополнительная таблица 9собирает рассчитанные восстановительные потенциалы солей и растворителей с катионом Na или без него. Соли, такие как NaTFSI, которые имеют низкий потенциал восстановления, близкий к потенциалу восстановления электролита, не позволяют быстро образовать SEI, богатый неорганическими соединениями, способный предотвратить разложение электролита. Это хорошо согласуется с поведением удаления/осаждения Na во всех электролитах на основе NaTFSI, которые демонстрируют высокие перенапряжения (дополнительная таблица 6). Напротив, соли с высоким восстановительным потенциалом, такие как NaFSI и NaClO 4 (2,37 В и 4,96 В по сравнению с Na/Na + соответственно) быстро реагируют с металлическим Na с образованием неорганического слоя SEI, но сильная движущая сила реакции приводит к образованию SEI с неоднородной морфологией (Дополнительные рисунки 6 и 7). NaOTf проявляет промежуточный восстановительный потенциал (1,02 В по сравнению с Na/Na + ), что приводит к образованию неорганического защитного слоя перед разложением электролита, но с умеренной движущей силой, что приводит к мягкой реакции и образованию гладкая пленка SEI (рис. 2в). Для сравнения мы также приводим результаты для NaPF 9.0085 6 , который, как известно, образует стабильный SEI при комнатной температуре 23 . NaPF 6 также демонстрирует умеренный восстановительный потенциал (0,75 В по сравнению с Na/Na + ), что подтверждает наше предположение о том, что соль с промежуточным восстановительным потенциалом способствует образованию однородного SEI на поверхности металлического Na-электрода. Обратите внимание, что NaPF 6 может не подходить для низкотемпературной соли из-за проблем с растворимостью и того факта, что характеристики NaOTf обусловлены сочетанием низкотемпературной растворимости и умеренного восстановительного потенциала.
NaOTf проявляет промежуточный восстановительный потенциал (1,02 В по сравнению с Na/Na + ), что приводит к образованию неорганического защитного слоя перед разложением электролита, но с умеренной движущей силой, что приводит к мягкой реакции и образованию гладкая пленка SEI (рис. 2в). Для сравнения мы также приводим результаты для NaPF 9.0085 6 , который, как известно, образует стабильный SEI при комнатной температуре 23 . NaPF 6 также демонстрирует умеренный восстановительный потенциал (0,75 В по сравнению с Na/Na + ), что подтверждает наше предположение о том, что соль с промежуточным восстановительным потенциалом способствует образованию однородного SEI на поверхности металлического Na-электрода. Обратите внимание, что NaPF 6 может не подходить для низкотемпературной соли из-за проблем с растворимостью и того факта, что характеристики NaOTf обусловлены сочетанием низкотемпературной растворимости и умеренного восстановительного потенциала.
Рис. 3: Схема рассчитанных восстановительных потенциалов солей (звездочки) и растворителей (точки). Зеленая и красная области показывают оптимальный и плохой потенциал снижения содержания солей для создания однородного SEI.
Изображение полного размера
Разработка электролитов на бинарных растворителях для температур ниже −40 °C
В связи с электрохимическим поведением электролита NaOTf-DEGDME при низких температурах этот раствор электролита был выбран для дальнейшей разработки электролитов, которые могут работать ниже -40 °С. DOL, который представляет собой циклический эфир с температурой плавления -95 ° C, был введен в DEGDME для производства электролитов с бинарным растворителем (дополнительный рисунок 23) для дальнейшего улучшения низкотемпературных свойств электролита. Однако сольватирующая способность Na + DOL ниже, чем у DEGDME 32 . Таким образом, объемное соотношение растворителя (DEGDME:DOL = 8:2, объемная доля 5:5 или 2:8) и концентрация соли (0,5 M или 1 M) оценивались при скрининге электролитов с бинарным растворителем (дополнительная таблица 10). .
.
Введение DOL расширяет низкотемпературный рабочий диапазон системы NaOTf-DEGDME, в котором более высокая объемная доля DOL приводит к лучшей стабильности при циклировании Na в симметричных ячейках (рис. 4a и дополнительная рис. 24). Кроме того, более низкая концентрация соли (0,5 M) может обеспечить повышенную долю DOL, что еще больше повышает эффективность клеточного цикла (рис. 4a). При -80 °C перенапряжение симметричной клетки (~35 мВ) в 0,5 M NaOTf-DEGDME/DOL (2:8) составляет менее половины (~75 мВ) в 0,5 M NaOTf-DEGDME/DOL (5:5). ) и в шесть раз меньше, чем (>200 мВ) в 1 M NaOTf-DEGDME/DOL (5:5). Таким образом, как концентрация соли NaOTf, так и объемная доля DEGDME должны быть тщательно выбраны для приготовления раствора электролита, который обеспечивает хорошие характеристики низкотемпературного электрохимического накопления энергии. Замена DEGDME на DME приводит к повышенному перенапряжению и/или асимметричному профилю напряжения (дополнительный рис. 25), что также происходит при замене NaOTf на NaClO 4 (дополнительный рис. 26).
26).
Рис. 4: Электрохимические и физико-химические характеристики различных растворов электролитов на основе NaOTf при различных температурах. a Температурно-зависимое гальваностатическое циклирование симметричных клеток Na||Na при 0,2 мА см −2 и 0,1 мА см −2 . б Изменение сопротивления растворов электролитов в интервале температур от +20 °С до −80 °С. Значения сопротивления при разных температурах нормированы на значения сопротивления при +20 °С (значение каждого раствора электролита при +20 °С указано за 1). Средние значения/отклонения рассчитывали на основе трех последовательных измерений. c Температурно-зависимая ионная проводимость растворов электролитов в диапазоне от +20 °C до −80 °C. d Термограммы ДСК от 0 °C до −150 °C. e Гальваностатическое циклирование Na||Na-симметричных клеток при 0,5 мА см −2 и 0,25 мА см −2 при −80 °C (розовая зона). Обратите внимание, что начальное ступенчатое снижение температуры (серая зона) применялось для стабилизации клеток. f Увеличенные профили напряжения на рис. 4e после стабилизации и через 500 ч при −80 °C.
Обратите внимание, что начальное ступенчатое снижение температуры (серая зона) применялось для стабилизации клеток. f Увеличенные профили напряжения на рис. 4e после стабилизации и через 500 ч при −80 °C.
Изображение полного размера
Физико-химическая и электрохимическая характеристика растворов электролитов в бинарных растворителях
Чтобы понять механизм повышения производительности при низких температурах, было исследовано сопротивление электролита при различных температурах (рис. 4b). Сопротивление раствора электролита измеряли методом ЭИС в ячейках из нержавеющей стали||нержавеющей стали (подробности см. в разделе «Методы»). Симметричная конфигурация ячейки показана на дополнительном рисунке 3, а оценка сопротивления на основе EIS показана на дополнительном рисунке 27. Сопротивление раствора электролита 0,5 М NaOTf-DEGDME / DOL (2: 8) при +20 ° C составляет 11,6 Ом, и увеличивается примерно в 3,6 раза при снижении температуры до −80 °C (дополнительная таблица 11). Эта разница почти вдвое меньше, чем для 0,5 М NaOTf-DEGDME/DOL (5:5) (в 7,0 раз от +20 °C до –80 °C) и в девятую от разницы для 1 M NaOTf-DEGDME (31,7 раза от +20 °C до –80 °C). °C до −80 °C) (дополнительные таблицы 12 и 13). Кроме того, ионная проводимость электролита может быть рассчитана на основе сопротивления раствора электролита (подробности расчета см. в разделе «Методы расчета»). На рисунке 4c показано, что 0,5 M NaOTf-DEGDME/DOL (2:8) дает самое медленное снижение ионной проводимости с температурой. При -80 °C ионная проводимость 0,5 М NaOTf-DEGDME/DOL (2:8), 0,5 M NaOTf-DEGDME/DOL (5:5) и 1 M NaOTf-DEGDME составляет 1,05 мСм см -1 , 0,44 мСм см -1 и 0,16 мСм см -1 соответственно. Ионная проводимость других четырех систем с одним растворителем показана на дополнительном рисунке 28. Небольшое изменение сопротивления электролиту и ионной проводимости NaOTf-DEGDME/DOL (2:8) может быть связано с относительно низкой динамической вязкостью растворители (дополнительный рисунок 29).
Эта разница почти вдвое меньше, чем для 0,5 М NaOTf-DEGDME/DOL (5:5) (в 7,0 раз от +20 °C до –80 °C) и в девятую от разницы для 1 M NaOTf-DEGDME (31,7 раза от +20 °C до –80 °C). °C до −80 °C) (дополнительные таблицы 12 и 13). Кроме того, ионная проводимость электролита может быть рассчитана на основе сопротивления раствора электролита (подробности расчета см. в разделе «Методы расчета»). На рисунке 4c показано, что 0,5 M NaOTf-DEGDME/DOL (2:8) дает самое медленное снижение ионной проводимости с температурой. При -80 °C ионная проводимость 0,5 М NaOTf-DEGDME/DOL (2:8), 0,5 M NaOTf-DEGDME/DOL (5:5) и 1 M NaOTf-DEGDME составляет 1,05 мСм см -1 , 0,44 мСм см -1 и 0,16 мСм см -1 соответственно. Ионная проводимость других четырех систем с одним растворителем показана на дополнительном рисунке 28. Небольшое изменение сопротивления электролиту и ионной проводимости NaOTf-DEGDME/DOL (2:8) может быть связано с относительно низкой динамической вязкостью растворители (дополнительный рисунок 29). Обратите внимание, что электролиты как с бинарным растворителем, так и с одним растворителем демонстрируют хорошую однородность без осаждения солей при разных температурах (дополнительный рисунок 30). Дифференциальная сканирующая калориметрия (ДСК) дополнительно подтверждает термическую стабильность 0,5 M NaOTf-DEGDME/DOL (2:8), не обнаруживая фазового перехода даже при температурах до −150 °C (рис. 4d) 33 . Точно так же фазовый переход не обнаружен до -140 ° C для 0,5 M NaOTf-DEGDME / DOL (5: 5). Для сравнения, 1 M NaOTf-DEGDME демонстрирует фазовый переход второго рода при −126 °C во время охлаждения и фазовый переход первого рода при −64 °C (температура плавления DEGDME) при последующем нагревании.
Обратите внимание, что электролиты как с бинарным растворителем, так и с одним растворителем демонстрируют хорошую однородность без осаждения солей при разных температурах (дополнительный рисунок 30). Дифференциальная сканирующая калориметрия (ДСК) дополнительно подтверждает термическую стабильность 0,5 M NaOTf-DEGDME/DOL (2:8), не обнаруживая фазового перехода даже при температурах до −150 °C (рис. 4d) 33 . Точно так же фазовый переход не обнаружен до -140 ° C для 0,5 M NaOTf-DEGDME / DOL (5: 5). Для сравнения, 1 M NaOTf-DEGDME демонстрирует фазовый переход второго рода при −126 °C во время охлаждения и фазовый переход первого рода при −64 °C (температура плавления DEGDME) при последующем нагревании.
Основываясь на сопротивлении и термическом поведении растворов электролитов, мы провели продолжительное симметричное циклирование ячеек Na||Na при –80 °C (рис. 4e и дополнительный рис. 31). Клетки, использующие 0,5 M NaOTf-DEGDME/DOL (2:8), демонстрируют небольшое перенапряжение ~50 мВ, которое не увеличивается в течение более 2000 ч при 0,2 мА см9. 1748 -2 с циклической емкостью 0,1 мАч см -2 (дополнительный рисунок 31). Даже при более высоком токе 0,5 мА см −2 с более высокой емкостью 0,25 мА см −2 стабильная работа в течение более 750 ч все еще может быть достигнута (рис. 4e). Увеличенный профиль напряжения (рис. 4f) также свидетельствует о том, что перенапряжение при 0,5 мА см -2 первоначально составляет 147 мВ (после процесса стабилизации) и немного увеличивается до 150 мВ через 500 ч, демонстрируя плавный профиль напряжения без каких-либо всплесков. . Для сравнения, 0,5 M NaOTf-DEGDME/DOL (5:5) показывает большие пики (>4000 мВ) и асимметричный профиль напряжения во время циклирования.
1748 -2 с циклической емкостью 0,1 мАч см -2 (дополнительный рисунок 31). Даже при более высоком токе 0,5 мА см −2 с более высокой емкостью 0,25 мА см −2 стабильная работа в течение более 750 ч все еще может быть достигнута (рис. 4e). Увеличенный профиль напряжения (рис. 4f) также свидетельствует о том, что перенапряжение при 0,5 мА см -2 первоначально составляет 147 мВ (после процесса стабилизации) и немного увеличивается до 150 мВ через 500 ч, демонстрируя плавный профиль напряжения без каких-либо всплесков. . Для сравнения, 0,5 M NaOTf-DEGDME/DOL (5:5) показывает большие пики (>4000 мВ) и асимметричный профиль напряжения во время циклирования.
Ex situ посмертная физико-химическая характеристика натриевых металлических электродов
Улучшенный КЭ со средним значением ~97,6% при -40 °C наблюдается в 0,5 M NaOTf-DEGDME/DOL (2:8) (рис. 5a) по сравнению с к случаю с одним растворителем (~ 92,2%, рис. 2b) с использованием ячеек из нержавеющей стали Na|| при 0,5 мА см -2 и 0,5 мАч см -2 . Были проведены измерения методом атомно-силовой микроскопии (АСМ) ex situ для исследования шероховатости поверхности и механических свойств SEI, сформированного на медной фольге при 0,5 мА см9.1748 -2 (0,5 мАч · см -2 ) для 1-го цикла при -40 ° C (рис. 5b, c и дополнительный рис. 32). В 0,5 М NaOTf-ДЭГДМЭ/ДОЛ (2:8) высота СЭВ, образующихся на поверхности электрода, равномерна с отклонением 50 нм (рис. 5б), а средний модуль Юнга составляет ~1,2 ГПа (рис. 5c), которые лучше, чем в 1 M NaOTf-DEGDME (отклонение по высоте: 100 нм; модуль Юнга: 0,5 ГПа), как показано на дополнительном рисунке 32. Лучшая однородность и механические свойства SEI способствуют более эффективному нанесению покрытия. / поведение полос на медной фольге (дополнительный рисунок 33) в электролите с двойным растворителем по сравнению со случаем с одним растворителем. Морфология SEI после удаления Na была исследована с помощью SEM (дополнительный рисунок 34), на котором можно отметить более гладкую поверхность при использовании 0,5 M NaOTf-DEGDME / DOL (2: 8) по сравнению с нерегулярной и пористой морфологией, полученной с использованием 1 Раствор электролита M NaOTf-DEGDME.
Были проведены измерения методом атомно-силовой микроскопии (АСМ) ex situ для исследования шероховатости поверхности и механических свойств SEI, сформированного на медной фольге при 0,5 мА см9.1748 -2 (0,5 мАч · см -2 ) для 1-го цикла при -40 ° C (рис. 5b, c и дополнительный рис. 32). В 0,5 М NaOTf-ДЭГДМЭ/ДОЛ (2:8) высота СЭВ, образующихся на поверхности электрода, равномерна с отклонением 50 нм (рис. 5б), а средний модуль Юнга составляет ~1,2 ГПа (рис. 5c), которые лучше, чем в 1 M NaOTf-DEGDME (отклонение по высоте: 100 нм; модуль Юнга: 0,5 ГПа), как показано на дополнительном рисунке 32. Лучшая однородность и механические свойства SEI способствуют более эффективному нанесению покрытия. / поведение полос на медной фольге (дополнительный рисунок 33) в электролите с двойным растворителем по сравнению со случаем с одним растворителем. Морфология SEI после удаления Na была исследована с помощью SEM (дополнительный рисунок 34), на котором можно отметить более гладкую поверхность при использовании 0,5 M NaOTf-DEGDME / DOL (2: 8) по сравнению с нерегулярной и пористой морфологией, полученной с использованием 1 Раствор электролита M NaOTf-DEGDME.
Рис. 5: Электрохимические и физико-химические характеристики электродов из металлического Na, подвергнутых циклу в 0,5 M NaOTf-DEGDME/DOL (2:8) при низких температурах. a CE как функция числа циклов в ячейках из нержавеющей стали Na|| при −40 °C при 0,5 мА см −2 и 0,5 мА·ч см −2 . b АСМ-топография СЭВ, сформированного на медной фольге после напыления/зачистки Na при 0,5 мА см −2 (0,5 мА·ч см −2 ) с напряжением отсечки 1,5 В после 1-го цикла при −40 ° C (медная фольга полностью дезодиирована). c Модуль Юнга (определенный с помощью АСМ) SEI на рис. 5b. d СЭМ поверхности металлического Na-электрода после циклирования при температуре -80 °C (вставка: соответствующее СЭМ-изображение поперечного сечения). e Содержание C 1 s , O 1 s , F 1 s , S 2 p и Na 1 s элементов в SEI при -80 °C. f Содержание основных неорганических компонентов SEI, включая NaF, Na 2 SO 4 и Na 2 SO 3 , при -80 °С. г Крио-ПЭМ изображение SEI после циклирования при -40 °C. Видимые полосы решетки из кристаллических областей перекрываются разными цветами. Красные полосы решетки имеют d-промежуток 3,0 Å, синие — d-промежуток 3,5 Å, а зеленые — d-промежуток 3,8 Å. Эти три полосы, вероятно, соответствуют показанным помеченным плоскостям. ч SAED картина SEI, сформированная при -40 °C. Положения колец, как ожидается, будут наиболее интенсивными от Na 2 9.0086 O, Na 2 SO 4 , Na 2 CO 3 и NaF помечены; вероятно присутствие большого разнообразия кристаллических фаз затрудняет полную индексацию структур. Эти кристаллические фазы также приводят к появлению дополнительных колец, которые не отмечены, что, вероятно, объясняет отражения, попадающие между отмеченными линиями. Обратите внимание, что присутствие Na 2 O может быть связано с процессом переноса для этих образцов.
г Крио-ПЭМ изображение SEI после циклирования при -40 °C. Видимые полосы решетки из кристаллических областей перекрываются разными цветами. Красные полосы решетки имеют d-промежуток 3,0 Å, синие — d-промежуток 3,5 Å, а зеленые — d-промежуток 3,8 Å. Эти три полосы, вероятно, соответствуют показанным помеченным плоскостям. ч SAED картина SEI, сформированная при -40 °C. Положения колец, как ожидается, будут наиболее интенсивными от Na 2 9.0086 O, Na 2 SO 4 , Na 2 CO 3 и NaF помечены; вероятно присутствие большого разнообразия кристаллических фаз затрудняет полную индексацию структур. Эти кристаллические фазы также приводят к появлению дополнительных колец, которые не отмечены, что, вероятно, объясняет отражения, попадающие между отмеченными линиями. Обратите внимание, что присутствие Na 2 O может быть связано с процессом переноса для этих образцов.
Изображение с полным размером
Система с бинарным растворителем также может изменить состав и микроструктуру поверхности Na-электрода по сравнению с системой с одним растворителем. В частности, постепенное увеличение объемной доли DOL приводит к отсутствию образования неправильной морфологии, такой как наблюдаемая в NaOTf-DEGDME при низких температурах (рис. 5d и дополнительные рисунки 35 и 36). Что касается состава, посмертные измерения XPS ex situ металлических Na-электродов, подвергнутых циклу с использованием электролита NaOTf-DEGDME/DOL при температуре -80 °C (дополнительные рисунки 37–40), предполагают наличие неорганических компонентов (NaF, Na 2 SO 4 и Na 2 SO 3 ) в SEI аналогичны тем, которые образуются в аналоге с одним растворителем. Тем не менее, анализ профиля глубины XPS выявляет разницу в распределении элементов и неорганических компонентов в электролитах с двойным растворителем (рис. 5e, f и дополнительный рисунок 41) по сравнению с аналогом с одним растворителем (рис. 2d). В частности, соотношение NaF / Na 2 SO 4 выше на поверхности (~ 1: 1) при использовании электролитов с бинарным растворителем (рис.
В частности, постепенное увеличение объемной доли DOL приводит к отсутствию образования неправильной морфологии, такой как наблюдаемая в NaOTf-DEGDME при низких температурах (рис. 5d и дополнительные рисунки 35 и 36). Что касается состава, посмертные измерения XPS ex situ металлических Na-электродов, подвергнутых циклу с использованием электролита NaOTf-DEGDME/DOL при температуре -80 °C (дополнительные рисунки 37–40), предполагают наличие неорганических компонентов (NaF, Na 2 SO 4 и Na 2 SO 3 ) в SEI аналогичны тем, которые образуются в аналоге с одним растворителем. Тем не менее, анализ профиля глубины XPS выявляет разницу в распределении элементов и неорганических компонентов в электролитах с двойным растворителем (рис. 5e, f и дополнительный рисунок 41) по сравнению с аналогом с одним растворителем (рис. 2d). В частности, соотношение NaF / Na 2 SO 4 выше на поверхности (~ 1: 1) при использовании электролитов с бинарным растворителем (рис. 5f и дополнительный рис. 41b), чем те (1: 8,9).при –20 °С и 1:3,3 при –40 °С) в системе с одним растворителем (рис. 2г). Принимая во внимание исследования АСМ, предполагая, что более высокий процент неорганического компонента NaF в электролите с двойным растворителем способствует более высокому модулю Юнга (рис. 5c и дополнительный рис. 32b) и, следовательно, к лучшей механической прочности по сравнению с одинарным -система растворителей правдоподобна.
5f и дополнительный рис. 41b), чем те (1: 8,9).при –20 °С и 1:3,3 при –40 °С) в системе с одним растворителем (рис. 2г). Принимая во внимание исследования АСМ, предполагая, что более высокий процент неорганического компонента NaF в электролите с двойным растворителем способствует более высокому модулю Юнга (рис. 5c и дополнительный рис. 32b) и, следовательно, к лучшей механической прочности по сравнению с одинарным -система растворителей правдоподобна.
Крио-ПЭМ дополнительно указывает на кристаллическую природу SEI (вероятно, содержит Na 2 SO 4 и Na 2 CO 3 ) путем идентификации полос решетки и анализа электронограмм 34 . В частности, рост SEI в системе с бинарным растворителем (рис. 5g, h) демонстрирует мозаичную структуру, состоящую из аморфной матрицы с диспергированными внутри нанокристаллитами, богатыми натрием, аналогично той, что в системе с одним растворителем (дополнительный рис. 42). ). Эти данные согласуются с экспериментальными данными XPS по SEI для обоих случаев. Однако размер кристаллитов и общее количество кристаллитов в SEI больше в электролите с бинарным растворителем, как показано на изображениях TEM, а также на картинах быстрого преобразования Фурье (FFT) и дифракции электронов на выбранных участках (SAED) (рис. 5g). , h), в котором дискретных пятен для бинарно-растворительной системы больше, чем колец в однорастворительном случае. Кроме того, в отличие от системы с бинарным растворителем, система с одним растворителем вряд ли может выявить присутствие NaF (дополнительный рисунок 42). Поскольку NaF может быть обнаружен с помощью XPS SEI, образованного в одном растворителе, это позволяет предположить, что NaF в SEI одного растворителя в основном аморфен или имеет плохую кристалличность. Эти наблюдения согласуются в нескольких отображаемых областях SEI как для систем с одним растворителем, так и для систем с двойным растворителем.
Однако размер кристаллитов и общее количество кристаллитов в SEI больше в электролите с бинарным растворителем, как показано на изображениях TEM, а также на картинах быстрого преобразования Фурье (FFT) и дифракции электронов на выбранных участках (SAED) (рис. 5g). , h), в котором дискретных пятен для бинарно-растворительной системы больше, чем колец в однорастворительном случае. Кроме того, в отличие от системы с бинарным растворителем, система с одним растворителем вряд ли может выявить присутствие NaF (дополнительный рисунок 42). Поскольку NaF может быть обнаружен с помощью XPS SEI, образованного в одном растворителе, это позволяет предположить, что NaF в SEI одного растворителя в основном аморфен или имеет плохую кристалличность. Эти наблюдения согласуются в нескольких отображаемых областях SEI как для систем с одним растворителем, так и для систем с двойным растворителем.
По данным XPS и крио-ПЭМ, электролит с двойным растворителем способствует более высокому содержанию кристаллического NaF в верхней части SEI по сравнению с системой с одним растворителем. Кроме того, АСМ подтверждает результаты, предполагая более высокий модуль Юнга 1,2 ГПа (рис. 5с) в электролите с бинарным растворителем. Более того, как АСМ (рис. 5b и дополнительная рис. 32a), так и SEM (дополнительная рис. 34) предполагают, что в электролите с бинарным растворителем может развиваться SEI с меньшей шероховатостью поверхности (меньшее отклонение высоты) по сравнению с электролитом с одним растворителем. система. Мы предполагаем, что богатый NaF SEI с однородной морфологией и улучшенным модулем Юнга является основной причиной долговременной стабильности работы ячейки при -80 °C. Этот вывод согласуется с предыдущим отчетом о литий-металлическом аноде о том, что SEI с высоким содержанием LiF будет способствовать улучшению низкотемпературных характеристик литий-металлических батарей 9.1748 35 .
Кроме того, АСМ подтверждает результаты, предполагая более высокий модуль Юнга 1,2 ГПа (рис. 5с) в электролите с бинарным растворителем. Более того, как АСМ (рис. 5b и дополнительная рис. 32a), так и SEM (дополнительная рис. 34) предполагают, что в электролите с бинарным растворителем может развиваться SEI с меньшей шероховатостью поверхности (меньшее отклонение высоты) по сравнению с электролитом с одним растворителем. система. Мы предполагаем, что богатый NaF SEI с однородной морфологией и улучшенным модулем Юнга является основной причиной долговременной стабильности работы ячейки при -80 °C. Этот вывод согласуется с предыдущим отчетом о литий-металлическом аноде о том, что SEI с высоким содержанием LiF будет способствовать улучшению низкотемпературных характеристик литий-металлических батарей 9.1748 35 .
Испытание цельнолитых натриевых батарей типа «таблетка» при температурах ≤0 °C
Натриево-металлические батареи, содержащие Na 3 В 2 (PO 4 ) 3 в качестве активного материала 9 (8 917:4 2 мг см -2 ) и металлический Na в качестве анода в электролите 0,5 M NaOTf-DEGDME/DOL (2:8) были испытаны при 22 мА г -1 (эквивалентно 0,2C, 1C = 110 мА g -1 ) и низких температурах до -80 ° C (рис. 6 и дополнительный рис. 43). Гальваностатическое циклирование (рис. 6а) показывает, что разрядная емкость уменьшается по мере последовательного охлаждения ячейки. При -60 °С может сохраняться ~42% удельной емкости, полученной при -20 °С. Потеря емкости из-за ступенчатого изменения температуры является обратимой, и емкость полностью восстанавливается при повышении температуры до -20 °C (рис. 6а). Кроме того, CE увеличивается с понижением температуры. Он увеличивается со среднего значения 9от 1,3% при 0 ° C до 99,9% при -60 ° C, а затем снижается до 99,5%, когда температура снова повышается до -20 ° C (дополнительный рисунок 43a). Профили напряжения заряда-разряда от 0 ° C до -80 ° C (рис. 6b) позволяют предположить, что гистерезис напряжения элемента также чувствителен к температуре. При -60°С гистерезис напряжения ячейки примерно в четыре раза больше, чем при -40°С, и в пять раз больше, чем при -20°С. При длительном циклировании (рис. 6в) элемент при -20 °C имеет начальную разрядную емкость 92 мАч·г -1 и сохранение емкости 94% после 100 циклов при среднем CE 98,1%.
6 и дополнительный рис. 43). Гальваностатическое циклирование (рис. 6а) показывает, что разрядная емкость уменьшается по мере последовательного охлаждения ячейки. При -60 °С может сохраняться ~42% удельной емкости, полученной при -20 °С. Потеря емкости из-за ступенчатого изменения температуры является обратимой, и емкость полностью восстанавливается при повышении температуры до -20 °C (рис. 6а). Кроме того, CE увеличивается с понижением температуры. Он увеличивается со среднего значения 9от 1,3% при 0 ° C до 99,9% при -60 ° C, а затем снижается до 99,5%, когда температура снова повышается до -20 ° C (дополнительный рисунок 43a). Профили напряжения заряда-разряда от 0 ° C до -80 ° C (рис. 6b) позволяют предположить, что гистерезис напряжения элемента также чувствителен к температуре. При -60°С гистерезис напряжения ячейки примерно в четыре раза больше, чем при -40°С, и в пять раз больше, чем при -20°С. При длительном циклировании (рис. 6в) элемент при -20 °C имеет начальную разрядную емкость 92 мАч·г -1 и сохранение емкости 94% после 100 циклов при среднем CE 98,1%. При -40 °С начальная емкость снижается до 68 мАч·г -1 с сохранением емкости 94 % после 100 циклов, при этом может быть достигнут более высокий средний КЭ (99,6 %). Даже при -60 °C можно поддерживать аналогичный CE (99,5%) с сохранением емкости на уровне 91% (скорость распада < 0,089% за цикл) после 100 циклов. Увеличенные данные CE показаны на дополнительном рисунке 43b. На рис. 6d показаны характеристики скорости ячеек при токах до 110 мА g -1 (1 C) при -40 °C и -60 °C, что еще раз подтверждает способность металлического Na к циклированию в полной конфигурации элемента с использованием разработанного электролита в экстремально холодных условиях. Соответствующие данные CE при разных скоростях подробно описаны на дополнительном рисунке 43c, который показывает, что CE при обеих температурах увеличивается с увеличением скорости тока.
При -40 °С начальная емкость снижается до 68 мАч·г -1 с сохранением емкости 94 % после 100 циклов, при этом может быть достигнут более высокий средний КЭ (99,6 %). Даже при -60 °C можно поддерживать аналогичный CE (99,5%) с сохранением емкости на уровне 91% (скорость распада < 0,089% за цикл) после 100 циклов. Увеличенные данные CE показаны на дополнительном рисунке 43b. На рис. 6d показаны характеристики скорости ячеек при токах до 110 мА g -1 (1 C) при -40 °C и -60 °C, что еще раз подтверждает способность металлического Na к циклированию в полной конфигурации элемента с использованием разработанного электролита в экстремально холодных условиях. Соответствующие данные CE при разных скоростях подробно описаны на дополнительном рисунке 43c, который показывает, что CE при обеих температурах увеличивается с увеличением скорости тока.
Рис. 6: Характеристики электрохимического накопления энергии Na||Na 3 V 2 (PO 4 ) 3 с использованием 0,5 M раствора электролита NaOTf-DEGDME/DOL (2:8) при низких температурах.
a Зависимое от температуры гальваностатическое циклирование клеток при 22 мА g −1 (эквивалентно 0,2C, 1C=110 мA g −1 , на основе активного материала Na 2 6 6 V PO 4 ) 3 ) до -60 ° C с отсечкой напряжения 2,3 и 3,8 В. Обратите внимание, что продолжительность циклирования при каждой температуре была сохранена для сравнения. б Профили напряжения гальваностатического заряда-разряда при 22 мА g −1 от 0 °C до −80 °C. c Длительное гальваностатическое циклирование клеток при 22 мА g –1 при –20 °C, –40 °C и –60 °C. d Скорость циклирования (до 110 мА g −1 , эквивалентно 1C) клеток при –40 °C и –60 °C.
Изображение в натуральную величину
Хорошие циклические характеристики также достигаются при более высоких массовых нагрузках Na 3 V 2 (PO 4 ) 3 до 3,0 мг см −2 при –40 °C (дополнительные рисунки 44 и 45). Кроме того, анод из Na@MXene (металлический Na, включенный в электрод MXene) 36 используется для сопряжения с Na 3 V 2 (PO 4 ) 3 при -40 °C, показывая стабильная производительность (дополнительные рисунки 46 и 47), которая демонстрирует проверенную концепцию полной ячейки с меньшим количеством металла Na (2 мАч г -1 ), используемого на стороне анода.
Кроме того, анод из Na@MXene (металлический Na, включенный в электрод MXene) 36 используется для сопряжения с Na 3 V 2 (PO 4 ) 3 при -40 °C, показывая стабильная производительность (дополнительные рисунки 46 и 47), которая демонстрирует проверенную концепцию полной ячейки с меньшим количеством металла Na (2 мАч г -1 ), используемого на стороне анода.
Таким образом, мы разработали низкотемпературные электролиты, содержащие ациклические/циклические эфиры (DEGDME/DOL) и соль NaOTf, которые расширяют предел рабочих температур для батарей с металлическим Na. В частности, электролит с одним растворителем 1 М NaOTf-DEGDME обеспечивает стабильное циклирование металлического натрия до -40 °C, демонстрируя низкое перенапряжение 100 мВ при 1 мА см 9 .1748 −2 емкостью 1 мА·ч см −2 более 300 ч. Теоретические расчеты показывают, что NaOTf имеет умеренно высокий восстановительный потенциал (1,02 В по сравнению с Na/Na + ) по сравнению с другими обычно используемыми солями Na, что приводит к образованию неорганического защитного слоя до разложения растворителя электролита, но с умеренная движущая сила. Это может способствовать умеренной реакции с металлическим Na и, таким образом, образованию гладкого и однородного SEI. Для дальнейшего снижения температурного порога был введен DOL для образования электролитов на бинарных растворителях. Оптимизированный электролит, состоящий из 0,5 М NaOTf-DEGDME/DOL (объемное соотношение 2:8), демонстрирует увеличение сопротивления всего в 3,4 раза от +20 °C до −80 °C и высокую термическую стабильность без фазового перехода до −150 °С. Кроме того, мы демонстрируем стабильное циклирование Na с небольшим перенапряжением 50 мВ в течение более 2000 часов при -80 ° C. Хорошие электрохимические характеристики могут быть приписаны образованию прочного богатого NaF SEI (с высоким содержанием NaF в верхнем слое) с однородной морфологией и механической прочностью, выявленной набором характеристик, включая SEM, AFM, XPS и крио- ТЕМ. В качестве доказательства концепции, батареи из металлического натрия, содержащие Na 3 V 2 (PO 4 ) 3 в качестве катода и металлический Na в качестве анода имеют низкую скорость спада емкости и высокие значения CE при циклировании до -60 °C.
Это может способствовать умеренной реакции с металлическим Na и, таким образом, образованию гладкого и однородного SEI. Для дальнейшего снижения температурного порога был введен DOL для образования электролитов на бинарных растворителях. Оптимизированный электролит, состоящий из 0,5 М NaOTf-DEGDME/DOL (объемное соотношение 2:8), демонстрирует увеличение сопротивления всего в 3,4 раза от +20 °C до −80 °C и высокую термическую стабильность без фазового перехода до −150 °С. Кроме того, мы демонстрируем стабильное циклирование Na с небольшим перенапряжением 50 мВ в течение более 2000 часов при -80 ° C. Хорошие электрохимические характеристики могут быть приписаны образованию прочного богатого NaF SEI (с высоким содержанием NaF в верхнем слое) с однородной морфологией и механической прочностью, выявленной набором характеристик, включая SEM, AFM, XPS и крио- ТЕМ. В качестве доказательства концепции, батареи из металлического натрия, содержащие Na 3 V 2 (PO 4 ) 3 в качестве катода и металлический Na в качестве анода имеют низкую скорость спада емкости и высокие значения CE при циклировании до -60 °C. Кроме того, также были продемонстрированы полные элементы с металлическим натрием с контролируемым количеством металлического Na, используемого в качестве анода.
Кроме того, также были продемонстрированы полные элементы с металлическим натрием с контролируемым количеством металлического Na, используемого в качестве анода.
Методы
Материалы
Металлические натриевые (Na) чипсы (средняя толщина 1 мм) были изготовлены из прессованных прокаткой кубиков металлического Na (99,9% на основе микроэлементов, Sigma-Aldrich) в перчатке, заполненной аргоном (Ar). коробка (О 2 < 0,6 м.д., H 2 O < 0,1 м.д., Mbraun), оксидированные поверхности которых были срезаны ножом. Гексафторфосфат натрия (NaPF 6 , Sigma-Aldrich), трифторметансульфонат натрия (NaOTf, Beantown Chemical), перхлорат натрия (NaClO 4 , Sigma-Aldrich), бис(трифторметансульфонил)имид натрия (NaTFSI, Solvionic) и бис(трифторметансульфонил)имид натрия (NaTFSI, Solvionic) фторсульфонил)имида (NaFSI, Solvionic) сушили в стеклянных флаконах в течение более 12 часов в перчаточном боксе (O 2 < 0,6 частей на миллион, H 2 O < 0,1 частей на миллион, Mbraun) перед использованием. Диметиловый эфир диэтиленгликоля (DEGDME, безводный, H 2 O < 50 ppm, Sigma-Aldrich), 1,2-диметоксиэтан (безводный, H 2 O < 30 ppm воды, Sigma-Aldrich) и 1,3- диоксолан (безводный, H 2 O < 30 ppm, Sigma-Aldrich) непосредственно использовали в качестве растворителей для приготовления электролитов.
Диметиловый эфир диэтиленгликоля (DEGDME, безводный, H 2 O < 50 ppm, Sigma-Aldrich), 1,2-диметоксиэтан (безводный, H 2 O < 30 ppm воды, Sigma-Aldrich) и 1,3- диоксолан (безводный, H 2 O < 30 ppm, Sigma-Aldrich) непосредственно использовали в качестве растворителей для приготовления электролитов.
Для синтеза Na 3 V 2 (PO 4 ) 3 , 0,364 г оксида ванадия (V 2 O 5 , Alfar Aesar) и 0,54 г щавелевой кислоты (H 2 C 2 O 4 , безводная, Alfar Aesar) растворяли в 20 мл дистиллированной воды при 70°C. Добавляли дигидрофосфат натрия (NaH 2 PO 4 , 0,72 г, Alfar Aesar), 0,2 г глюкозы (безводной, Alfar Aesar) и 50 мл 1-пропанола (Alfar Aesar) и перемешивали с последующей сушкой при 70°С. С. Высушенный образец измельчали и отжигали при 400 °С в течение 4 ч, а затем при 750 °С в течение 8 ч в атмосфере газа Ar со скоростью нагрева 5 °С мин −1 . Отожженный порошок смешивали с сажей (Super C65, C-NERGY) и поливинилиденфторидом (PVDF, HSV 900, Arkema) в весовом соотношении 6:3:1 с использованием 1-метил-2-пирролидона (NMP, безводный, Sigma-Aldrich) до образования суспензии. Шлам отливали на алюминиевую фольгу (чистота 99,9%, толщина 16 мкм, MTI) и высушивали при 70 °С в вакуумной печи с последующей нарезкой образца на катод диаметром 12 мм (средняя толщина 60–160 мм). мкм). Загрузка активного материала составляла до 3 мг см −2 .
Отожженный порошок смешивали с сажей (Super C65, C-NERGY) и поливинилиденфторидом (PVDF, HSV 900, Arkema) в весовом соотношении 6:3:1 с использованием 1-метил-2-пирролидона (NMP, безводный, Sigma-Aldrich) до образования суспензии. Шлам отливали на алюминиевую фольгу (чистота 99,9%, толщина 16 мкм, MTI) и высушивали при 70 °С в вакуумной печи с последующей нарезкой образца на катод диаметром 12 мм (средняя толщина 60–160 мм). мкм). Загрузка активного материала составляла до 3 мг см −2 .
Для синтеза Ti 3 C 2 MXene, 3 g Ti 3 AlC 2 порошок (98%, 400 меш, Jilin 11 Technology Co., Ltd, Китай) добавляли в 30 мл плавиковой кислоты ( HF) (40%, Alfa Aesar) при перемешивании в течение 24 часов с получением Ti 3 C 2 MXene. Полученный Ti 3 C 2 MXene промывали деионизированной (DI) водой до достижения значения pH 6–7 для раствора, который затем сушили вымораживанием. Затем 0,25 г свежеприготовленного Ti 3 C 2 MXene взвешивали и добавляли в 50 мл раствора бромида цетилтриметиламмония (CTAB) (0,20% масс. , 99%, Alfa Aesar) при перемешивании при 40°C в течение 24 часов. Собранный Ti 3 C 2 MXene промывали деионизированной водой и сушили при 70 °C. После этого взвешивали 0,25 г полученного Ti 3 C 2 MXene и диспергировали в 40 мл раствора NaOH (1M) при перемешивании (500 об/мин) при комнатной температуре в течение 72 ч, после чего собирали осадок. и промывают деионизированной водой и сушат вымораживанием. Электродная суспензия, состоящая из только что синтезированного Ti 3 C 2 MXene и PVDF в весовом соотношении 9:1 (диспергированные в NMP) отливали на медную фольгу (чистота 99,8%, толщина 9 мкм, MTI). Влажное покрытие высушивали при 70 °С в вакуумной печи с последующей резкой на анод диаметром 12 мм (средняя толщина 100 мкм). Загрузка активного материала составляла до 2 мг см -2 .
, 99%, Alfa Aesar) при перемешивании при 40°C в течение 24 часов. Собранный Ti 3 C 2 MXene промывали деионизированной водой и сушили при 70 °C. После этого взвешивали 0,25 г полученного Ti 3 C 2 MXene и диспергировали в 40 мл раствора NaOH (1M) при перемешивании (500 об/мин) при комнатной температуре в течение 72 ч, после чего собирали осадок. и промывают деионизированной водой и сушат вымораживанием. Электродная суспензия, состоящая из только что синтезированного Ti 3 C 2 MXene и PVDF в весовом соотношении 9:1 (диспергированные в NMP) отливали на медную фольгу (чистота 99,8%, толщина 9 мкм, MTI). Влажное покрытие высушивали при 70 °С в вакуумной печи с последующей резкой на анод диаметром 12 мм (средняя толщина 100 мкм). Загрузка активного материала составляла до 2 мг см -2 .
Физико-химические характеристики
Измерения динамической вязкости (или абсолютной вязкости) проводились с использованием вискозиметра ( micro VISC TM , RheoSense), который был специально откалиброван для измерения низких температур (до −40 °C), в перчаточном боксе (O 2 < 0,6 PPM, H 2 O < 0,1 PPM , Мбраун). Перед тестированием каждый образец (100 мкл) выдерживался изотермически при заданной температуре более 10 часов. Изображения, полученные с помощью сканирующей электронной микроскопии (СЭМ), были получены с использованием системы СЭМ с автоэмиссионной пушкой (XL 300 ESEM-FEG). Анализ с помощью криогенной просвечивающей электронной микроскопии (крио-ПЭМ) проводили с использованием ПЭМ FEI Tecnai F30, работающего при 300 кВ. Все изображения были записаны при низкой мощности дозы от 1 до 2 × 10 2 электронов·Å −2 ·с −1 . Анализ рентгеновской фотоэлектронной спектроскопии (XPS) проводили с помощью сканирующего XPS-микрозонда PHI Versaprobe II с системным разрешением 0,47 эВ с использованием источника монохроматического рентгеновского излучения 1486,7. Дифференциальную сканирующую калориметрию (ДСК) проводили с использованием Netzsch DSC 204 F1 Phoenix. И образцы, и эталон были испытаны при температуре от -150°C до +20°C при контролируемой скорости 10°C мин -1 .
Перед тестированием каждый образец (100 мкл) выдерживался изотермически при заданной температуре более 10 часов. Изображения, полученные с помощью сканирующей электронной микроскопии (СЭМ), были получены с использованием системы СЭМ с автоэмиссионной пушкой (XL 300 ESEM-FEG). Анализ с помощью криогенной просвечивающей электронной микроскопии (крио-ПЭМ) проводили с использованием ПЭМ FEI Tecnai F30, работающего при 300 кВ. Все изображения были записаны при низкой мощности дозы от 1 до 2 × 10 2 электронов·Å −2 ·с −1 . Анализ рентгеновской фотоэлектронной спектроскопии (XPS) проводили с помощью сканирующего XPS-микрозонда PHI Versaprobe II с системным разрешением 0,47 эВ с использованием источника монохроматического рентгеновского излучения 1486,7. Дифференциальную сканирующую калориметрию (ДСК) проводили с использованием Netzsch DSC 204 F1 Phoenix. И образцы, и эталон были испытаны при температуре от -150°C до +20°C при контролируемой скорости 10°C мин -1 . Атомно-силовая микроскопия (АСМ) была проведена на медных фольгах после покрытия/зачистки Na с использованием АСМ Bruker’s Dimension Icon с зондом RTESPA-150.
Атомно-силовая микроскопия (АСМ) была проведена на медных фольгах после покрытия/зачистки Na с использованием АСМ Bruker’s Dimension Icon с зондом RTESPA-150.
Электрохимические характеристики
Температурная камера (MC-812, ESPEC) использовалась для обеспечения стабильной температуры окружающей среды от -80°C до +20°C. Тестируемые круглые ячейки выдерживали при заданной температуре не менее часа для достижения теплового равновесия. Электролиты готовили в перчаточном боксе (O 2 < 0,6 ppm, H 2 O < 0,1 ppm, Mbraun). Массу солей взвешивали с помощью весов (PA84C, OHAUS), а объемы растворителей измеряли с помощью пипеток (100–1000 мкл, High Performance Single-Channel Pipettor, VWR). Гальваностатическое симметричное циклирование Na||Na проводили в круглых ячейках типа 2032, которые были собраны из двух одинаковых Na-чипов (средняя толщина 1 мм, диаметр 12 мм) и сепаратора (Celgard 2400, толщина 24 мкм, диаметр 15 мм, средняя пористость 39%), заполненный 40 мкл электролита. Асимметричные монетные ячейки также были собраны с использованием фольги из нержавеющей стали (толщина 0,5 мм, нержавеющая сталь 316) в качестве рабочего электрода и свежесрезанного Na в качестве противоэлектрода с сепаратором Celgard 2400 и электролитом объемом 40 мкл. Измерения КЭ проводились в асимметричных ячейках типа «таблетка» путем нанесения покрытия и снятия при плотности тока 0,5 мА см 91 748 -2 91 749 в течение более 1 часа (0,5 мАч см 91 748 -2 91 749, нанесенных или снятых за полупериод). Ячейки с металлическим натрием были собраны с Na 3 V 2 (PO 4 ) 3 катоды и аноды из металла Na или Na@MXene с испытанными электролитами. Для изготовления электродов Na@MXene на электрод Ti 3 C 2 MXene с использованием асимметричных ячеек Na||MXene при 0,5 мА см −2 в тестируемом электролите с Сепаратор Селгард 2400. После осаждения Na ячейки Na||MXene разобрали и собрали электроды Na@MXene. Как симметричные элементы, так и батареи с металлическим натрием тестировали с использованием стандартного тестера батарей (CT2001A, Wuhan LANHE Electronics Co.
Асимметричные монетные ячейки также были собраны с использованием фольги из нержавеющей стали (толщина 0,5 мм, нержавеющая сталь 316) в качестве рабочего электрода и свежесрезанного Na в качестве противоэлектрода с сепаратором Celgard 2400 и электролитом объемом 40 мкл. Измерения КЭ проводились в асимметричных ячейках типа «таблетка» путем нанесения покрытия и снятия при плотности тока 0,5 мА см 91 748 -2 91 749 в течение более 1 часа (0,5 мАч см 91 748 -2 91 749, нанесенных или снятых за полупериод). Ячейки с металлическим натрием были собраны с Na 3 V 2 (PO 4 ) 3 катоды и аноды из металла Na или Na@MXene с испытанными электролитами. Для изготовления электродов Na@MXene на электрод Ti 3 C 2 MXene с использованием асимметричных ячеек Na||MXene при 0,5 мА см −2 в тестируемом электролите с Сепаратор Селгард 2400. После осаждения Na ячейки Na||MXene разобрали и собрали электроды Na@MXene. Как симметричные элементы, так и батареи с металлическим натрием тестировали с использованием стандартного тестера батарей (CT2001A, Wuhan LANHE Electronics Co. , Ltd). Электрохимическую импедансную спектроскопию (ЭИС) проводили с использованием электрохимической рабочей станции (VMP3, Bio-Logic Science Instruments) при частоте сканирования от 1 МГц до 0,1 Гц с амплитудой переменного тока 5 мВ и 10 точками на декаду. Среднее время напряжения холостого хода до измерения ЭИС составляло ~2 ч.
, Ltd). Электрохимическую импедансную спектроскопию (ЭИС) проводили с использованием электрохимической рабочей станции (VMP3, Bio-Logic Science Instruments) при частоте сканирования от 1 МГц до 0,1 Гц с амплитудой переменного тока 5 мВ и 10 точками на декаду. Среднее время напряжения холостого хода до измерения ЭИС составляло ~2 ч.
Общее сопротивление раствора электролита ( R и ) было измерено с помощью EIS в ячейках из нержавеющей стали || из нержавеющей стали 19 . Полимерная мембрана (Celgard, средняя толщина 25 мкм, пористость 39%, диаметр 15 мм) была зажата между двумя кусками нержавеющей стали 316 (толщина: 0,5 мм) в плоской ячейке типа 2032 с добавлением 40 мкл электролита ( Дополнительный рис. 3). Ионная проводимость ( δ ) раствора электролита была рассчитана на основе следующего уравнения:
$$\delta=L/(A{{\cdot }}Re)$$
где R e значение сопротивления из кривой подгонки EIS с использованием эквивалентной электрической схемы 37,38 , L — это расстояние между двумя кусками нержавеющей стали, а A — произведение площади мембраны и пористости.
Образцы для ТЭМ были приготовлены путем проведения одного цикла покрытия/зачистки Na (0,25 мА см -2 в течение 2 ч) с использованием сетки Cu для ТЭМ в качестве рабочего электрода. Плоская ячейка, содержащая сетку, была разобрана в перчаточном боксе, заполненном аргоном, и сетка была промыта 0,5 мл DEGDME и высушена в вакууме внутри перчаточного бокса. Затем сетка была загружена в держатель для криообразцов Gatan внутри перчаточного ящика. Сетка Cu для ТЭМ была быстро перенесена (выдержка на воздухе ~10 с) из аргоновой среды в загрузочный шлюз ТЭМ, где она была помещена в вакуум. Затем температуру образца снижали с помощью жидкого азота и поддерживали на уровне -175 °C во время визуализации. Образцы XPS переносили в камеру через герметичный сосуд, заполненный аргоном, чтобы избежать контакта с воздухом. Что касается изменений сопротивления электролита (рис. 4b), средние значения и отклонения были основаны на трех последовательных измерениях ЭИС.
Вычисления из первых принципов
Моделирование функционала плотности выполнялось с использованием пакета Gaussian 16 39 . Мы использовали функционал B3LYP с версией Grimme D3 (эмпирическая дисперсия = gd3) и базисным набором 6-311++G 40,41,42,43 . Эффекты растворителя были включены в модель поляризационного континуума (PCM) с использованием DEGDME в качестве растворителя (диэлектрическая проницаемость = 7,39) 44 . Восстановительный потенциал рассчитывали с использованием термодинамического цикла, описанного Han et al. и Бородин и др. 9{-}\right)\) и \(\triangle {G}_{{sol}}\left(S\right)\) — свободная энергия Гиббса для процесса сольватации заряженных и нейтральных частиц, соответственно, и F – постоянная Фарадея. Для преобразования потенциала в эталон Na/Na + согласно предыдущим работам 45,46 из уравнения было извлечено 1,8 В. Международный союз теоретической и прикладной химии рекомендует значение 4,42–4,44 В по шкале абсолютных потенциалов 47 .
Мы использовали функционал B3LYP с версией Grimme D3 (эмпирическая дисперсия = gd3) и базисным набором 6-311++G 40,41,42,43 . Эффекты растворителя были включены в модель поляризационного континуума (PCM) с использованием DEGDME в качестве растворителя (диэлектрическая проницаемость = 7,39) 44 . Восстановительный потенциал рассчитывали с использованием термодинамического цикла, описанного Han et al. и Бородин и др. 9{-}\right)\) и \(\triangle {G}_{{sol}}\left(S\right)\) — свободная энергия Гиббса для процесса сольватации заряженных и нейтральных частиц, соответственно, и F – постоянная Фарадея. Для преобразования потенциала в эталон Na/Na + согласно предыдущим работам 45,46 из уравнения было извлечено 1,8 В. Международный союз теоретической и прикладной химии рекомендует значение 4,42–4,44 В по шкале абсолютных потенциалов 47 .
Сводка отчетов
Дополнительную информацию о дизайне исследования можно найти в Кратком отчете об исследованиях в природе, связанном с этой статьей.
Доступность данных
Данные, подтверждающие результаты этого исследования, доступны в тексте, включая методы и дополнительную информацию. Необработанные наборы данных, относящиеся к текущей работе, доступны у соответствующего автора по обоснованному запросу.
Ссылки
Goodenough, J. & Park, K.-S. Литий-ионная аккумуляторная батарея: перспектива. Дж. Ам. хим. соц. 135 , 1167–1176 (2013).
КАС
Статья
пабмед
Google ученый
Тараскон Ж.-М. и Арманд, М. Проблемы и проблемы, стоящие перед перезаряжаемыми литиевыми батареями. Природа 414 , 359–367 (2001).
ОБЪЯВЛЕНИЕ
КАС
пабмед
Статья
Google ученый
Данн, Б., Камат, Х. и Тараскон, Дж.-М. Аккумулирование электроэнергии для сети: батарея выбора. Наука 334 , 928–935 (2011).
Наука 334 , 928–935 (2011).
ОБЪЯВЛЕНИЕ
КАС
пабмед
Статья
Google ученый
Сюй, Дж. и др. Расширение предела эксплуатации литий-ионных аккумуляторов при низких температурах до −80 °C. Материал для хранения энергии. 23 , 383–389 (2019).
Артикул
Google ученый
Чжан С., Сюй К. и Джоу Т. Характеристики литий-ионных аккумуляторов при низких температурах. J. Power Sources 115 , 137–140 (2003).
ОБЪЯВЛЕНИЕ
КАС
Статья
Google ученый
Чжу, Г. Материалы о характеристиках литий-ионных аккумуляторов при низких температурах. J. Power Sources 300 , 29–40 (2015).
ОБЪЯВЛЕНИЕ
КАС
Статья
Google ученый
Ван, Х., Ван, К., Матиос, Э. и Ли, В. Критическая роль ультратонких графеновых пленок с регулируемой толщиной в создании высокостабильных анодов из металлического натрия. Нано Летт. 17 , 6808–6815 (2017).
ОБЪЯВЛЕНИЕ
КАС
пабмед
Статья
Google ученый
Ван, К., Ван, Х., Матиос, Э., Ху, X. и Ли, В. Химически спроектированная пористая медная матрица с цилиндрическим каркасом ядро-оболочка в качестве стабильной основы для металлических натриевых анодов. Доп. Функц. Матер. 28 , 1802282 (2018).
Артикул
КАС
Google ученый
Wang, H., Wang, C., Matios, E. & Li, W. Легкая стабилизация металлического натриевого анода с добавками: неожиданная ключевая роль полисульфида натрия и неблагоприятное воздействие нитрата натрия. Анжю. хим. Междунар. Эд. 57 , 7734–7737 (2018).
КАС
Статья
Google ученый
Чаямбука, К., Малдер, Г., Данилов, Д. и Ноттен, П. Обзор материалов и электрохимических свойств натрий-ионных аккумуляторов. Доп. Энергия Матер. 8 , 1800079 (2018).
Артикул
КАС
Google ученый
Yi, Q. et al. Электролит на основе фторированного эфира обеспечивает натриево-металлическим батареям исключительную стабильность при циклировании. Приложение ACS Матер. Интерфейсы 11 , 46965–46972 (2019 г.).
КАС
пабмед
Статья
Google ученый
Yi, Q., Zhang, W., Li, S., Li, X. & Sun, C. Долговечная натриевая батарея с гибким Na 3 Zr 2 Si 2 PO 12 –PVDF– Композитный электролит HFP и анод из натрий/угольной ткани. Приложение ACS Матер. Интерфейсы 10 , 35039–35046 (2018 г.).
Приложение ACS Матер. Интерфейсы 10 , 35039–35046 (2018 г.).
КАС
пабмед
Статья
Google ученый
Фэн, Л., Ю, Т., Ченг, Д. и Сун, К. Прогресс в исследовании неисправности натриевой батареи. Науч. Грех. Чим. 50 , 1801–1815 (2020).
Артикул
Google ученый
Yang, G., Li, N. & Sun, C. Высокопроизводительные натриево-металлические батареи с анодом из натрий-висмутового сплава. Приложение ACS Энергия Матер. 3 , 12607–12612 (2020).
КАС
Статья
Google ученый
Мацумото, К. и др. Среднетемпературная работа натриевых вторичных батарей с высокой емкостью и возможностью циклирования с использованием ионно-жидкого электролита. ЭКС транс. 75 , 139–145 (2016).
КАС
Статья
Google ученый
Ван Ю.-Ю. и другие. Сверхдлительный срок службы и работающая при низких температурах натрий-ионная полная батарея для стационарного хранения энергии. Доп. Энергия Матер. 8 , 1703252 (2018).
Артикул
КАС
Google ученый
Гуо Ж.-З. и другие. Высокоэнергетический/мощный и низкотемпературный катод для натрий-ионных аккумуляторов: рентгенографическое исследование in situ и превосходные характеристики полноэлементных элементов. Доп. Матер. 29 , 1701968 (2017).
Артикул
КАС
Google ученый
Ду, Г. и др. Низкотемпературный, высокоскоростной и долговечный твердотельный натрий-ионный аккумулятор на основе полимерного электролита и катода из берлинской лазури. Доп. Энергия Матер. 10 , 1
1 (2020). КАС
Статья
Google ученый
«> Тенувара, А., Шетти, П. и Макдауэлл, М. Отчетливые наноразмерные межфазные границы и морфология электродов из металлического лития, работающих при низких температурах. Нано Летт. 19 , 8664–8672 (2019).
ОБЪЯВЛЕНИЕ
КАС
пабмед
Статья
Google ученый
Thenuwara, A. et al. Эффективное низкотемпературное циклирование литий-металлических анодов за счет адаптации границы твердого электролита. ACS Energy Письмо. 5 , 2411–2420 (2020).
КАС
Статья
Google ученый
Rustomji, C. et al. Сжиженные газовые электролиты для электрохимических накопителей энергии. Наука 356 , eaal4263 (2017).
ПабМед
Статья
КАС
Google ученый
Holoubek, J. et al. Адаптация сольватации электролита для литий-металлических аккумуляторов, подвергающихся циклированию при сверхнизкой температуре. Нац. Энергия 6 , 303–313 (2021).
Нац. Энергия 6 , 303–313 (2021).
ОБЪЯВЛЕНИЕ
КАС
Статья
Google ученый
Seh, Z., Sun, J., Sun, Y. & Cui, Y. Высокообратимый металлический натриевый анод при комнатной температуре. АКЦ Цент. науч. 1 , 449–455 (2015).
КАС
пабмед
ПабМед Центральный
Статья
Google ученый
Молдер, Дж. Ф. Справочник по рентгеновской фотоэлектронной спектроскопии: справочник стандартных спектров для идентификации и интерпретации данных XPS (Отдел физической электроники, Perkin-Elmer Corporation Press, 1992).
Аурбах, Д. и др. На поверхности химические аспекты очень высокой плотности энергии, перезаряжаемые литий-серные батареи. Дж. Электрохим. соц. 156 , A694–A702 (2009 г.).
КАС
Статья
Google ученый
Фидлер, К., Люерссен, Б., Ронке, М., Санн, Дж. и Янек, Дж. Анализ XPS и SIMS межфазных фаз твердого электролита на литии, образованном электролитами на основе эфира. Дж. Электрохим. соц. 164 , A3742–A3749 (2017).
КАС
Статья
Google ученый
Gu, Y. et al. Дизайнерские ультрагладкие ультратонкие твердоэлектролитные межфазные поверхности трех анодов из щелочных металлов. Нац. коммун. 9 , 1339 (2018).
ОБЪЯВЛЕНИЕ
пабмед
ПабМед Центральный
Статья
КАС
Google ученый
Цао, X. и др. Монолитные твердо-электролитные межфазные слои, сформированные во фторированных электролитах на основе ортоформиата, сводят к минимуму истощение лития и его измельчение. Нац. Энергия 4 , 796–805 (2019).
ОБЪЯВЛЕНИЕ
КАС
Статья
Google ученый
Лутц, Л. и др. Роль анионов электролита в батарее Na–O 2 : влияние на сольватацию NaO 2 и стабильность межфазной фазы твердого электролита натрия в эфирах глима. Хим. Матер. 29 , 6066–6075 (2017).
КАС
Статья
Google ученый
Насыбулин Е. и др. Влияние солей электролита на работу аккумуляторов Li–O 2 . J. Phys. хим. C. 117 , 2635–2645 (2013).
КАС
Статья
Google ученый
Maibach, J. et al. Экспериментальный метод рентгеновской фотоэлектронной спектроскопии высокого давления для определения характеристик границ раздела твердое тело-жидкость продемонстрирован на литий-ионной аккумуляторной системе. Rev. Sci. Инструм. 86 , 044101 (2015).
ОБЪЯВЛЕНИЕ
пабмед
Статья
КАС
Google ученый
Холл, Д., Селф, Дж. и Дан, Дж. Диэлектрические постоянные для квантовой химии и литий-ионных аккумуляторов: смеси растворителей этиленкарбоната и этилметилкарбоната. J. Phys. хим. C. 119 , 22322–22330 (2015).
КАС
Статья
Google ученый
Суо, Л., Ху, Ю.-С., Ли, Х., Арманд, М. и Чен, Л. Новый класс электролитов на основе растворителя в соли для высокоэнергетических перезаряжаемых металлических литиевых батарей. Нац. коммун. 4 , 1481 (2013).
ОБЪЯВЛЕНИЕ
пабмед
Статья
КАС
Google ученый
Хан, Б. и др. Исследование межфазной поверхности твердого электролита с металлическим Na с помощью криотрансмиссионной электронной микроскопии. Нац. коммун. 12 , 3066 (2021).
ОБЪЯВЛЕНИЕ
КАС
пабмед
ПабМед Центральный
Статья
Google ученый
Гао Ю. и др. Низкотемпературные и высокоскоростные литий-металлические аккумуляторы обеспечиваются электрохимически активным монослойно-регулируемым интерфейсом. Нац. Энергия 5 , 534–542 (2020).
ОБЪЯВЛЕНИЕ
КАС
Статья
Google ученый
Луо, Дж. и др. Настраиваемые 1D/2D-гибридные наноархитектуры на основе MXene в качестве стабильной матрицы для бездендритного металлического натриевого анода сверхвысокой емкости. Нано Летт. 20 , 7700–7708 (2020).
ОБЪЯВЛЕНИЕ
КАС
пабмед
Статья
Google ученый
Raccichini, R., Furness, L., Dibden, J., Owen, J. & García-Araez, N. Характеристика импеданса транспортных свойств электролитов, содержащихся в пористых электродах и сепараторах, полезных для Li-S аккумуляторов . Дж. Электрохим. соц. 165 , A2741–A2749 (2018).
КАС
Статья
Google ученый
Габершек М. Понимание материалов аккумуляторов на основе лития с помощью спектроскопии электрохимического импеданса. Нац. коммун. 12 , 6513 (2021).
ОБЪЯВЛЕНИЕ
пабмед
ПабМед Центральный
Статья
КАС
Google ученый
Gaussian 16, редакция C.01, Frisch, M.J. et al., Gaussian, Inc., Wallingford CT, 2016.
Lee, C., Yang, W. & Parr, R.G. -Корреляционно-энергетическая формула Сальветти в функционал электронной плотности. Физ. B 37 , 785–789 (1988).
ОБЪЯВЛЕНИЕ
КАС
Статья
Google ученый
Бекке, А. Д. Функциональная термохимия плотности. III. Роль точного обмена. J. Chem. физ. 98 , 5648–5652 (1993).
ОБЪЯВЛЕНИЕ
КАС
Статья
Google ученый
Гримме, С., Энтони, Дж., Эрлих, С. и Криг, Х. Непротиворечивая и точная параметризация ab initio поправки на дисперсию с помощью функции плотности (DFT-D) для 94 элемента H-Pu. J. Chem. физ. 132 , 154104 (2010).
ОБЪЯВЛЕНИЕ
пабмед
Статья
КАС
Google ученый
Hehre, W.J., Random, L., Schleyer, P.V.R. & Pople, J.A. Ab initio молекулярно-орбитальная теория (Wiley Press, 1986).
Томаси Дж. и Персико М. Молекулярные взаимодействия в растворе: обзор методов, основанных на непрерывном распределении растворителя. Хим. Ред. 94 , 2027–2094 (1994).
КАС
Статья
Google ученый
Хан Дж., Чжэн Ю., Го Н. и Бальбуэна П. Б. Расчетные восстановительные потенциалы частиц электролита в литий-серных батареях. J. Phys. хим. C. 124 , 20654–20670 (2020).
и Бальбуэна П. Б. Расчетные восстановительные потенциалы частиц электролита в литий-серных батареях. J. Phys. хим. C. 124 , 20654–20670 (2020).
КАС
Статья
Google ученый
Бородин О., Бел В. и Джоу Т. Р. Окислительная стабильность и начальные реакции разложения электролитов на основе карбонатов, сульфонов и алкилфосфатов. J. Phys. хим. C. 117 , 8661–8682 (2013).
КАС
Статья
Google ученый
Trasatti, S. Абсолютный электродный потенциал: пояснительная записка (Рекомендации 1986 г.). Чистое приложение. хим. 58 , 955–966 (1986).
КАС
Статья
Google ученый
Ссылки на скачивание
Благодарности
В.Л. и CW признательны за поддержку в виде грантов для факультета ранней карьеры в рамках Программы грантов для исследований в области космических технологий НАСА в рамках награды 80NSSC18K1514, а также за счет стартовых фондов Инженерной школы Тайера Дартмутского колледжа. В.Л. и J.L. признают частичную поддержку по PE 0603734A, «Энергетические и технологические исследования в холодных и арктических регионах», Задача 2 по контракту W913E519C0008 и по PE 0633119, «Энергетические и технологические исследования в холодных и арктических регионах», Задача 2 по контракту W913E520C0010, оба находятся в ведении Центра инженерных исследований и разработок армии США (ERDC). A.C.T., P.P.S. и М.Т.М. признательны за поддержку гранта факультета ранней карьеры Программы грантов НАСА в области космических технологий в рамках награды 80NSSC18K1507. Х.З. и Х.Х. признаем поддержку программы Министерства энергетики США, Управления науки, Управления фундаментальных энергетических наук под номером награды DE-SC0019121. Использование АСМ в окружающей среде было поддержано NSF MRI (грант № 1727026). Г.Х. выражает благодарность Французскому сообщению Бельгии за поддержку в рамках гранта №. АРК 18/23-093. С.П.-П. благодарит испанское министерство науки и инноваций за стипендию Хуана де ла Сьерва Формасьон (FJC2019-039623-I).
В.Л. и J.L. признают частичную поддержку по PE 0603734A, «Энергетические и технологические исследования в холодных и арктических регионах», Задача 2 по контракту W913E519C0008 и по PE 0633119, «Энергетические и технологические исследования в холодных и арктических регионах», Задача 2 по контракту W913E520C0010, оба находятся в ведении Центра инженерных исследований и разработок армии США (ERDC). A.C.T., P.P.S. и М.Т.М. признательны за поддержку гранта факультета ранней карьеры Программы грантов НАСА в области космических технологий в рамках награды 80NSSC18K1507. Х.З. и Х.Х. признаем поддержку программы Министерства энергетики США, Управления науки, Управления фундаментальных энергетических наук под номером награды DE-SC0019121. Использование АСМ в окружающей среде было поддержано NSF MRI (грант № 1727026). Г.Х. выражает благодарность Французскому сообщению Бельгии за поддержку в рамках гранта №. АРК 18/23-093. С.П.-П. благодарит испанское министерство науки и инноваций за стипендию Хуана де ла Сьерва Формасьон (FJC2019-039623-I). Авторы выражают признательность за помощь в рентгеновской фотоэлектронной спектроскопии доктору Мин Ли, Ирен Чжун и Цзышань Ву, а также в дифференциальной сканирующей калориметрии доктору Кайян Инь. Авторы выражают благодарность профессору Хайляну Вану за помощь в подготовке образцов.
Авторы выражают признательность за помощь в рентгеновской фотоэлектронной спектроскопии доктору Мин Ли, Ирен Чжун и Цзышань Ву, а также в дифференциальной сканирующей калориметрии доктору Кайян Инь. Авторы выражают благодарность профессору Хайляну Вану за помощь в подготовке образцов.
Информация об авторе
Авторы и организации
Thayer School of Engineering, Dartmouth College, 14 Engineering Drive, Hanover, NH, 03755, USA
Chuanlong Wang, Jianmin Luo, Geoffroy Hautier & Weiyang Li
G.W. Школа машиностроения Вудраффа, Технологический институт Джорджии, 801 Ферст Драйв, Атланта, Джорджия, 30332, США
Акила С. Тенувара, Пралав П. Шетти и Мэтью Т. Макдауэлл
Школа материаловедения и инженерии, Джорджия Технологический институт, 771 Ферст Драйв, Атланта, Джорджия, 30332, США
Matthew T. McDowell
Micron School of Materials Science and Engineering, Boise State University, 1910 University Drive, Boise, ID, 83725, USA
Haoyu Zhu & Hui Xiong
Institute of Matter and Condenseds , UCLouvain, Chemin des Étoiles 8, B-1348, Louvain-la-Neuve, Belgium
Sergio Posada-Pérez & Geoffroy Hautier
Institut de Química Computacional i Catalisi and Departament de Maria Química, C/Gironasitat Universitat Аурелия Капмани, 69 лет, 17003, Girona, Catalonia, Испания
Сержио Посада-Пресес
Центр исследований передовой энергии, Айдахо-Фолс, ID, 83401, США
Hui Xiong
Authrations 9000 9369
- .

Вы также можете искать этого автора в
PubMed Google Scholar
- Akila C. Thenuwara
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Академия
- Jianmin Luo
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar
- Pralav P. Shetty
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar
- Matthew T. McDowell
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar
- Haoyu Zhu
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar
- Sergio Posada-Pérez
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar
- Hui Xiong
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar
- Жоффруа Отье
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar
- Weiyang Li
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar
Contributions
C. W. and W.L. задумал идею. C.W. провела разработку состава электролита, определение характеристик материала и электрохимическую оценку. JL синтезировал электроды Na@MXene. Х.З. и Х.Х. выполнил АСМ характеристику и анализ. A.C.T., P.P.S. и М.Т.М. проведена криогенная просвечивающая электронная микроскопия и соответствующий анализ. С.П.-П. и Г.Х. провел теоретические расчеты. C.W., A.C.T., M.T.M., G.H. и В.Л. соавтор статьи. Все авторы обсудили результаты и прокомментировали рукопись.
W. and W.L. задумал идею. C.W. провела разработку состава электролита, определение характеристик материала и электрохимическую оценку. JL синтезировал электроды Na@MXene. Х.З. и Х.Х. выполнил АСМ характеристику и анализ. A.C.T., P.P.S. и М.Т.М. проведена криогенная просвечивающая электронная микроскопия и соответствующий анализ. С.П.-П. и Г.Х. провел теоретические расчеты. C.W., A.C.T., M.T.M., G.H. и В.Л. соавтор статьи. Все авторы обсудили результаты и прокомментировали рукопись.
Авторы переписки
Переписка с
Хуэй Сюн, Жоффруа Отье или Вейян Ли.
Заявление об этике
Конкурирующие интересы
Авторы не заявляют об отсутствии конкурирующих интересов.
Рецензирование
Информация о рецензировании
Nature Communications благодарит Chunwen Sun и других анонимных рецензентов за их вклад в рецензирование этой работы.
Дополнительная информация
Примечание издателя Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Дополнительная информация
Дополнительная информация
Резюме отчетности
Права и разрешения
Открытый доступ Использование, распространение и распространение этой статьи лицензируются в соответствии с лицензией Creative Commons. воспроизведение на любом носителе или в любом формате при условии, что вы укажете автора(ов) оригинала и источник, предоставите ссылку на лицензию Creative Commons и укажете, были ли внесены изменения. Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons для статьи, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.
Перепечатка и разрешения
Об этой статье
Комментарии
Отправляя комментарий, вы соглашаетесь соблюдать наши Условия и правила сообщества. Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
Разница между литий-ионными и литий-полимерными батареями
Литий-ионная полимерная (LiPo) батарея (также известная как Li-poly, Li-poly, PLiON и другие названия) представляет собой перезаряжаемую литий-ионную батарею с полимерным электролит в жидком электролите, используемом в обычных литий-ионных аккумуляторах. Доступны различные химические вещества LiPo. Все они используют гелевый полимер с высокой проводимостью в качестве электролита. LiPo обеспечивают более высокую удельную энергию, чем другие литиевые батареи, часто используемые в системах, где важным фактором является вес, таких как мобильные устройства, дроны и некоторые электромобили. Этот FAQ начинается с общего сравнения литий-ионных и LiPo аккумуляторов, за которым следует подробный обзор шести основных химических элементов литиевых аккумуляторов, наиболее подходящих для использования в LiPo аккумуляторах. Он завершается взглядом в будущее и возможной разработкой алюминиево-воздушных полимерных батарей и твердотельных батарей.
Он завершается взглядом в будущее и возможной разработкой алюминиево-воздушных полимерных батарей и твердотельных батарей.
Все литиевые батареи имеют барьер, разделяющий анод и катод, а также обеспечивающий движение ионов между электродами. В LiPo полимерный сепаратор также содержит электролит. Кроме того, полимерные сепараторы могут выполнять дополнительную функцию, действуя как «сепараторы отключения», которые могут отключать батарею, если она становится слишком горячей во время зарядки или разрядки. Сепараторы отключения представляют собой многослойные конструкции, по крайней мере, с одним полиэтиленовым слоем, который может остановить ток, когда температура становится слишком высокой, и по крайней мере с одним полипропиленовым слоем, который действует как форма механической поддержки сепаратора.
Интеркаляция и декаляция ионов лития с положительного электрода и отрицательного электрода. За исключением полимерного сепаратора, LiPos работают по тому же принципу, что и Li-ion. Однако упакованы они совершенно по-разному.
Однако упакованы они совершенно по-разному.
Li-ion обычно поставляются в корпусе из нержавеющей стали или алюминия. Корпус чаще всего цилиндрический, но может быть пуговичным или прямоугольным (призматический). Корпус относительно дорог в производстве и, как правило, ограничивает доступные размеры и формы. Но он также надежен, помогая защитить аккумулятор от повреждений. Корпус герметизирован методом лазерной сварки.
Конструкция литий-ионного аккумулятора относительно сложна и состоит из большого количества компонентов. (Изображение: TechSci Research)
LiPo аккумуляторы упакованы в «мешочек» из алюминиевой фольги и называются «мягкими» или «мешковыми» элементами. Пакет в основном призматический, его легче изготовить, и он дешевле, чем корпуса литий-ионных аккумуляторов из нержавеющей стали или алюминия. Этот тип конструкции также позволяет производить батареи с различными индивидуальными конфигурациями. Другие компоненты LiPos включают в себя тонкие слои (<100 мкм), которые можно производить серийно по относительно низкой цене. Замена мешочка из фольги на металл может привести к высокой плотности энергии и легкости батарей. Могут быть достигнуты как большие форматы, так и высота менее 1 мм, но ячейки требуют осторожного механического обращения.
Замена мешочка из фольги на металл может привести к высокой плотности энергии и легкости батарей. Могут быть достигнуты как большие форматы, так и высота менее 1 мм, но ячейки требуют осторожного механического обращения.
Конструкция чехла для литий-полимерного аккумулятора. (Изображение: Jauch)
Использование LiPos сопряжено со многими из тех же проблем, с которыми приходится сталкиваться пользователям Li-ion, включая перезарядку, чрезмерную разрядку, перегрев и внутренние короткие замыкания. Кроме того, раздавливание или проникновение гвоздя в пакет LiPo может привести к катастрофическим отказам, начиная от разрыва пакета и заканчивая утечкой электролита и возгоранием.
Как и литий-ионные, литий-полимерные аккумуляторы могут расширяться при высоких уровнях перезарядки из-за испарения электролита. Испарение электролита может привести к расслаиванию, ухудшению контакта между внутренними слоями элемента, снижению надежности и срока службы. Это расширение может быть особенно заметным для LiPo аккумуляторов, которые могут буквально раздуваться. Это также может привести к структурным повреждениям хост-системы.
Это также может привести к структурным повреждениям хост-системы.
В таблице ниже сравниваются напряжения и типичные области применения шести основных химических элементов литиевых батарей. Другие характеристики этих батарей включают в себя:
- LCO – 200 Втч/кг, обеспечивают высокую мощность, но при этом имеют относительно короткий срок службы, низкую номинальную мощность и низкую термическую стабильность.
- LFP – 120 Втч/кг, имеют длительный срок службы и стабильность при высоких рабочих температурах.
- LMO – 140 Втч/кг, катоды основаны на компонентах оксида марганца, которые широко распространены, недороги, нетоксичны и обеспечивают хорошую термическую стабильность.
- NCA – 250 Втч/кг, обеспечивает высокую удельную энергию и длительный срок службы.
- NMC – 200 Втч/кг, изменение соотношения химических компонентов позволяет разрабатывать батареи, оптимизированные как силовые или энергетические элементы.
 Благодаря своей гибкости это одна из самых успешных химических систем для литиевых батарей.
Благодаря своей гибкости это одна из самых успешных химических систем для литиевых батарей. - LTO — 80 Втч/кг, самая низкая удельная энергия, но может быть быстро заряжена, разряжена до 10-кратной номинальной емкости и безопасна.
Сравнение напряжений литиевых батарей и приложений. (Изображение: TechSci Research)
Обратите внимание, что батареи NMC, LCO и NCA содержат кобальт, который обеспечивает более высокую мощность. Они могут обеспечить большое количество энергии в небольшом корпусе, но могут быть более чувствительными к тепловым явлениям, которые могут вызвать проблемы с безопасностью.
На следующем рисунке представлены крестообразные диаграммы, в которых сравниваются основные типы литиевых аккумуляторов в зависимости от их пригодности для использования в электромобилях (EV). На этих диаграммах паука батареи, которые лучше подходят для электромобилей, имеют большую окрашенную область. Учитываемыми факторами являются удельная энергия, удельная мощность, безопасность, производительность, срок службы и стоимость. Удельная энергия в Втч/кг относится к диапазону EV. Удельная мощность в Вт/кг относится к ускорению электромобиля. В частности, в случае электромобилей безопасность является критически важным фактором. Параметр «Производительность» отражает возможность использования аккумулятора в экстремальных температурных условиях, что также является важным фактором в автомобильных приложениях. Life Span – это сочетание цикличности жизни и долговечности. Стоимость пытается охватить все сопутствующие расходы, включая вспомогательные системы для управления температурным режимом, безопасностью, управлением батареями и мониторингом, а также необходимость продления гарантийного срока для электромобилей.
Удельная энергия в Втч/кг относится к диапазону EV. Удельная мощность в Вт/кг относится к ускорению электромобиля. В частности, в случае электромобилей безопасность является критически важным фактором. Параметр «Производительность» отражает возможность использования аккумулятора в экстремальных температурных условиях, что также является важным фактором в автомобильных приложениях. Life Span – это сочетание цикличности жизни и долговечности. Стоимость пытается охватить все сопутствующие расходы, включая вспомогательные системы для управления температурным режимом, безопасностью, управлением батареями и мониторингом, а также необходимость продления гарантийного срока для электромобилей.
Сравнение характеристик различных литий-ионных химикатов для измерения пригодности для использования в электромобилях. (Изображение: MDPI)
LiPo химические вещества
Полимерный электролит приводит к нескольким улучшениям производительности, включая высокую плотность энергии и легкие батареи. В зависимости от структуры полимерных слоев это также может повысить безопасность батареи. По сравнению с обычными литий-ионными батареями, батареи LiPo могут изготавливаться с более широким диапазоном удельной плотности энергии (Втч/кг) и удельной плотности мощности (Вт/кг), что делает батареи LiPo более гибкими в более широком диапазоне потенциальных применений. В результате технология LiPo используется во всех основных химических элементах литиевых аккумуляторов:
В зависимости от структуры полимерных слоев это также может повысить безопасность батареи. По сравнению с обычными литий-ионными батареями, батареи LiPo могут изготавливаться с более широким диапазоном удельной плотности энергии (Втч/кг) и удельной плотности мощности (Вт/кг), что делает батареи LiPo более гибкими в более широком диапазоне потенциальных применений. В результате технология LiPo используется во всех основных химических элементах литиевых аккумуляторов:
- Литий-кобальт-оксидная батарея (LCO)
- Тройная литий-ионная батарея (NCA, NMC)
- Литий-ионная батарея на оксиде марганца (LMO)
- Литий-железо-фосфатная батарея (LFP)
График Рагона для сравнения Li-ion, LiPo (PLiON) и других аккумуляторов. (Изображение: MDPI)
Алюминиево-воздушные и твердополимерные батареи
Алюминиево-воздушные полимерные батареи находятся в активной разработке. Эти конструкции с высокой плотностью энергии имеют полимерный сепаратор, непосредственно контактирующий с литиевым анодом, чтобы отделить его от катода. Как и в других полимерных батареях, сепаратор предотвращает короткое замыкание в батарее и поглощает жидкий электролит, поддерживая перенос ионов и замыкая электрическую цепь.
Как и в других полимерных батареях, сепаратор предотвращает короткое замыкание в батарее и поглощает жидкий электролит, поддерживая перенос ионов и замыкая электрическую цепь.
К сожалению, литиевый анод может образовывать дендриты во время работы батареи. Эти дендриты могут проникать в полимерный сепаратор и укорачивать батарею. Разрабатываются модифицированные сепараторы, включающие слои оксида графена. Оксид графена защищает анод от загрязнений и предотвращает химические колебания на поверхности литиевого анода. Оксид графена работает вместе с полимерным слоем, чтобы предотвратить прямой контакт между электролитом и литиевым анодом без значительного снижения ионной проводимости. Эта комбинированная структура замедляет коррозию электролита на аноде. Есть надежда, что в будущем использование двух типов слоев для стабилизации литиевого анода приведет к созданию аккумуляторов с очень высокой плотностью энергии и приемлемым сроком службы.
Ячейки с настоящими твердыми полимерными электролитами (ТФЭ) вместо современных гелеобразных мембран также находятся в стадии разработки. Сегодняшние элементы LiPo считаются «гибридной» системой между обычным литий-ионным и полностью твердотельным литий-ионным аккумулятором. Гелевые мембраны представляют собой гибридные системы, в которых жидкие фазы содержатся в полимерной матрице. Хотя они могут быть сухими на ощупь, они могут содержать до 50% жидких растворителей. Современные системы также называются системами с гибридным полимерным электролитом (HPE), в которых сочетаются полимерный материал, жидкий растворитель и соль. В настоящее время разрабатываются ТФЭ, которые представляют собой полностью не содержащие растворителей системы в полимерной среде.
Сегодняшние элементы LiPo считаются «гибридной» системой между обычным литий-ионным и полностью твердотельным литий-ионным аккумулятором. Гелевые мембраны представляют собой гибридные системы, в которых жидкие фазы содержатся в полимерной матрице. Хотя они могут быть сухими на ощупь, они могут содержать до 50% жидких растворителей. Современные системы также называются системами с гибридным полимерным электролитом (HPE), в которых сочетаются полимерный материал, жидкий растворитель и соль. В настоящее время разрабатываются ТФЭ, которые представляют собой полностью не содержащие растворителей системы в полимерной среде.
В новой твердотельной структуре могут также использоваться недорогие катоды с высоким удельным преобразованием энергии, которые несовместимы с аккумуляторами на жидкой основе, такими как литий-ионные. Одним из примеров является запатентованный сульфидный твердый электролит, который поддерживает высокое содержание кремния и металлического лития в аноде в сочетании со стандартными промышленными катодами, включая оксиды лития, никеля, марганца, кобальта (NMC). Новые катоды можно комбинировать с металлическим литием для удаления кобальта и никеля, что может снизить затраты на катодный активный материал на 9%.0%.
Новые катоды можно комбинировать с металлическим литием для удаления кобальта и никеля, что может снизить затраты на катодный активный материал на 9%.0%.
Дорожная карта разработки твердотельных аккумуляторов удаляет кобальт и никель из катода (крайний справа). (Изображение: Solid Power)
Твердотельные элементы с емкостью 2 А·ч были произведены с использованием стандартного литий-ионного оборудования и процессов. Коммерческое производство элемента с кремниевым анодом емкостью 20 Ач ожидается к концу 2021 г., а производство 100 Ач ожидается в 2022 г. более легкие аккумуляторы. Кроме того, LiPo могут производиться в самых разных формах и размерах. Однако современные LiPo используют гелеобразные мембраны, а не полностью твердые полимерные электролиты (ТФЭ). SPE находятся в стадии разработки и могут расширить преимущества LiPo в производительности в определенных приложениях. Алюминиево-воздушные полимерные батареи обладают потенциалом очень высокой плотности энергии (что приводит к увеличению пробега электромобилей) и хорошим сроком службы. Полностью твердотельные литиевые батареи большого формата появятся на горизонте в 2021 году.
Полностью твердотельные литиевые батареи большого формата появятся на горизонте в 2021 году.
Ссылки
Текущие технологии литий-ионных аккумуляторов в электромобилях и возможности для усовершенствования, MDPI
Различные типы литий-полимерных аккумуляторов, Grepow
Введение в технологию литий-полимерных аккумуляторов, Jauch
Литий-полимерные аккумуляторы, Википедия
Производство литий- ion Batteries, TechSci Research
Types of Lithium-ion, Battery University
Стратегии производства твердых электролитов в батареях
Введение
Популяризация коммерческих аккумуляторов — одно из достижений современной цивилизации. За последние несколько десятилетий общество стало свидетелем изобретения медицинских имплантатов с автономным питанием, беспроводной электроники, электромобилей и многих других приложений, которые питаются от батарей разных форм и размеров. Традиционные батареи, использующие органические жидкие электролиты, продемонстрировали преимущества высокой ионной проводимости и превосходной смачиваемости электродами (Zhang, 2007; He et al. , 2019).), но страдают от потенциальных проблем с безопасностью, таких как высокая воспламеняемость, плохая термическая стабильность и утечка жидкости (Strauss et al., 2020; Yin et al., 2020; Yuan and Liu, 2020). Чтобы устранить присущие традиционным батареям недостатки безопасности, при этом отвечая высоким требованиям к электрохимическим характеристикам, батареи, использующие твердотельный электролит (SSE), продемонстрировали многообещающий выбор в качестве лучшей альтернативы.
, 2019).), но страдают от потенциальных проблем с безопасностью, таких как высокая воспламеняемость, плохая термическая стабильность и утечка жидкости (Strauss et al., 2020; Yin et al., 2020; Yuan and Liu, 2020). Чтобы устранить присущие традиционным батареям недостатки безопасности, при этом отвечая высоким требованиям к электрохимическим характеристикам, батареи, использующие твердотельный электролит (SSE), продемонстрировали многообещающий выбор в качестве лучшей альтернативы.
Как правило, SSE можно разделить на твердые полимерные электролиты (SPE), неорганические твердые электролиты (ISE) и составные твердые электролиты (CSE). ТФЭ состоят из полимерной матрицы с высокой молекулярной массой и растворенной соли лития, ИСЭ состоят из всех неорганических материалов, таких как керамика и стекло, а СПЭ состоят как из твердого полимера, так и из неорганических материалов (Zhang H. et al., 2017; Чен В. и др., 2018; Чен Ю. и др., 2020). В качестве одного из ключевых компонентов для практического применения твердотельных аккумуляторов ССЭ продемонстрировали многочисленные преимущества по сравнению с органическим жидким электролитом: (i) характеристики негорючести, высокотемпературной стабильности и нелетучести для предотвращения возгорания или взрыва. органических жидких электролитов (Fergus, 2010; Takada, 2013; Sun et al., 2020), (ii) широкое электрохимическое окно, обеспечивающее лучшую совместимость с катодом с более высоким потенциалом, что значительно улучшает плотность энергии (Judez et al. , 2017; Wang et al., 2018), (iii) повышенная механическая жесткость (особенно для ISE) для подавления роста дендритов из циклированных металлических анодов (Goodenough and Singh, 2015; Kim J.G. et al., 2015) и (iv ) настраиваемый модуль упругости (особенно для SPE и CSE), обеспечивающий более высокую степень технологичности и гибкости (Yue et al., 2016; Lau et al., 2018; Schnell et al., 2018; Zhou et al., 2018) . Однако следует дополнительно изучить и решить несколько проблем: (i) низкая ионная проводимость (<10 –5 См см –1 для ТФЭ и <10 –3 См см –1 для ИСЭ) по сравнению с жидким электролитом (>10 –3 См см –1 ), что приводит к низкая мощность и (ii) сложность изготовления миниатюрных/больших ИСЭ с высокой хрупкостью.
органических жидких электролитов (Fergus, 2010; Takada, 2013; Sun et al., 2020), (ii) широкое электрохимическое окно, обеспечивающее лучшую совместимость с катодом с более высоким потенциалом, что значительно улучшает плотность энергии (Judez et al. , 2017; Wang et al., 2018), (iii) повышенная механическая жесткость (особенно для ISE) для подавления роста дендритов из циклированных металлических анодов (Goodenough and Singh, 2015; Kim J.G. et al., 2015) и (iv ) настраиваемый модуль упругости (особенно для SPE и CSE), обеспечивающий более высокую степень технологичности и гибкости (Yue et al., 2016; Lau et al., 2018; Schnell et al., 2018; Zhou et al., 2018) . Однако следует дополнительно изучить и решить несколько проблем: (i) низкая ионная проводимость (<10 –5 См см –1 для ТФЭ и <10 –3 См см –1 для ИСЭ) по сравнению с жидким электролитом (>10 –3 См см –1 ), что приводит к низкая мощность и (ii) сложность изготовления миниатюрных/больших ИСЭ с высокой хрупкостью. В сочетании с новым дизайном материалов разработка передовых производственных стратегий обеспечит решение вышеуказанных проблем.
В сочетании с новым дизайном материалов разработка передовых производственных стратегий обеспечит решение вышеуказанных проблем.
Развитие аккумуляторных технологий демонстрировало экспоненциальную тенденцию с 1800-х годов, и мы стали свидетелями мотивации разработки аккумуляторов к постепенному переходу от улучшения характеристик гальванических элементов к удовлетворению конфигурационных требований сложных приложений. На рис. 1 показаны несколько важных вех в развитии производства аккумуляторов. Как самое раннее задокументированное изобретение батареи, гальванический столб состоял из штабеля меди, цинка и пропитанной соленой водой ткани в виде цилиндра для хранения электрохимической энергии (Абетти, 19).52; Уорнер, 2015). Почти шесть десятилетий спустя Гастон Планте (Kurzweil, 2010) погрузил пакеты из параллельных пластин из свинца/оксида свинца в серную кислоту и создал первую перезаряжаемую батарею. И гальванические батареи, и свинцово-кислотные батареи основывались на укладке металлических пластин для увеличения напряжения элемента (Warner, 2015). По мере того как эволюция продолжается, никель-кадмиевая батарея использовала цилиндрическую ячейку, заполненную уплотненными электродами из металлического листа, свернутыми в катушку с увеличенной площадью поверхности для уменьшения сопротивления батареи. Эта цилиндрическая конструкция была принята более поздней коммерческой щелочной батареей с электродными материалами, заполненными внутренним и внешним слоями (Furukawa et al., 19).84). В 1971 году изобретение литий-йодных аккумуляторов внесло значительный вклад в производство медицинского оборудования. В этом элементе батареи использовался металлический пакет с закругленными краями, чтобы предотвратить проблемы с проникновением, которые могут возникнуть из-за острых углов при имплантации в человеческое тело в составе кардиостимуляторов (Greatbatch and Holmes, 1991; Ruetschi et al., 1995).
По мере того как эволюция продолжается, никель-кадмиевая батарея использовала цилиндрическую ячейку, заполненную уплотненными электродами из металлического листа, свернутыми в катушку с увеличенной площадью поверхности для уменьшения сопротивления батареи. Эта цилиндрическая конструкция была принята более поздней коммерческой щелочной батареей с электродными материалами, заполненными внутренним и внешним слоями (Furukawa et al., 19).84). В 1971 году изобретение литий-йодных аккумуляторов внесло значительный вклад в производство медицинского оборудования. В этом элементе батареи использовался металлический пакет с закругленными краями, чтобы предотвратить проблемы с проникновением, которые могут возникнуть из-за острых углов при имплантации в человеческое тело в составе кардиостимуляторов (Greatbatch and Holmes, 1991; Ruetschi et al., 1995).
Рис. 1. Эволюция производства аккумуляторов.
С момента коммерциализации литий-ионных аккумуляторов (LIB) компанией Sony Co. в 1991 (Yoshio et al., 2009), многие традиционные и новые форм-факторы были применены в LIB, чтобы обеспечить разработку более качественных продуктов с точки зрения эстетики и функциональности. В литий-ионных призматических элементах использовались уплотненные и скрученные электроды, ранее использовавшиеся в никель-кадмиевых батареях, и они были упакованы в контейнеры, форма которых визуально напоминала плоскую плитку шоколада (Cousseau et al., 2006). Литий-ионные аккумуляторы достигли высокой эффективности упаковки 90–95% за счет сварки проводящих лепестков с электродной фольгой и герметичного запечатывания всех материалов внутри пакета (Buchmann, 2001). Изобретение литий-ионных призматических и карманных аккумуляторов является частью усилий по созданию более тонкой и легкой электроники. С прогрессом в технологической зрелости и сложности в последние годы новые производственные стратегии могут применяться к батареям в разных масштабах, которые подходят для различных приложений. Например, нанобатареи, используемые в качестве источника питания в биомедицинских приложениях (Johannessen et al.
в 1991 (Yoshio et al., 2009), многие традиционные и новые форм-факторы были применены в LIB, чтобы обеспечить разработку более качественных продуктов с точки зрения эстетики и функциональности. В литий-ионных призматических элементах использовались уплотненные и скрученные электроды, ранее использовавшиеся в никель-кадмиевых батареях, и они были упакованы в контейнеры, форма которых визуально напоминала плоскую плитку шоколада (Cousseau et al., 2006). Литий-ионные аккумуляторы достигли высокой эффективности упаковки 90–95% за счет сварки проводящих лепестков с электродной фольгой и герметичного запечатывания всех материалов внутри пакета (Buchmann, 2001). Изобретение литий-ионных призматических и карманных аккумуляторов является частью усилий по созданию более тонкой и легкой электроники. С прогрессом в технологической зрелости и сложности в последние годы новые производственные стратегии могут применяться к батареям в разных масштабах, которые подходят для различных приложений. Например, нанобатареи, используемые в качестве источника питания в биомедицинских приложениях (Johannessen et al. , 2006; Ruzmetov et al., 2012), гибкие батареи для складной/носимой электроники (Dudney, 2008; Leijonmarck et al., 2013; Deng et al., 2017), а также потенциально крупномасштабные аккумуляторные сети для хранения возобновляемой энергии (Diouf and Pode, 2015). Однако традиционные стратегии производства аккумуляторов, такие как сухое прессование, литье, центрифугирование и рулонное покрытие, неудовлетворительны при изготовлении аккумуляторов сложной формы или микро-/наноразмеров, особенно для ISE (Manthiram et al., 2017; Schnell et al., 2018 г.; Дирикан и др., 2019 г.). Поэтому существует потребность в использовании новой производственной стратегии для решения вышеуказанных проблем.
, 2006; Ruzmetov et al., 2012), гибкие батареи для складной/носимой электроники (Dudney, 2008; Leijonmarck et al., 2013; Deng et al., 2017), а также потенциально крупномасштабные аккумуляторные сети для хранения возобновляемой энергии (Diouf and Pode, 2015). Однако традиционные стратегии производства аккумуляторов, такие как сухое прессование, литье, центрифугирование и рулонное покрытие, неудовлетворительны при изготовлении аккумуляторов сложной формы или микро-/наноразмеров, особенно для ISE (Manthiram et al., 2017; Schnell et al., 2018 г.; Дирикан и др., 2019 г.). Поэтому существует потребность в использовании новой производственной стратегии для решения вышеуказанных проблем.
Появление технологии 3D-печати предложило уникальный метод производства, позволяющий создавать детали высокой сложности и с прекрасными характеристиками (Chen Z. et al., 2019; Santoliquido et al., 2019). Хотя использование технологии 3D-печати может быть многообещающей альтернативой в производстве SSE, первоначальная цель разработки 3D-печати не заключалась в производстве батарей. В результате существует огромный разрыв между возможностями современных методов 3D-печати и требованиями к производству аккумуляторов. Этот обзор направлен на устранение пробела путем анализа существующих ограничений в производстве SSE и определения будущих потребностей. Благодаря всестороннему обзору традиционных и новых производственных стратегий SSE мы стремимся предоставить рекомендации и информацию о потенциальных прорывах в производственных технологиях как для лабораторных исследований, так и для промышленного производства.
В результате существует огромный разрыв между возможностями современных методов 3D-печати и требованиями к производству аккумуляторов. Этот обзор направлен на устранение пробела путем анализа существующих ограничений в производстве SSE и определения будущих потребностей. Благодаря всестороннему обзору традиционных и новых производственных стратегий SSE мы стремимся предоставить рекомендации и информацию о потенциальных прорывах в производственных технологиях как для лабораторных исследований, так и для промышленного производства.
Традиционные производственные стратегии
Твердые полимерные/композитные электролиты
Твердые полимерные электролиты (ТПЭ) широко изучались для изготовления складных и растягиваемых аккумуляторов (Commarieu et al., 2018; Liang et al., 2018; Chen Y. et al. , 2020) благодаря нескольким преимуществам, таким как высокая гибкость, простота обработки и хорошая смачиваемость. Для производства ТФЭ можно использовать три разных способа: обработка на основе порошка, влажная химическая обработка и обработка с высокой вязкостью. Для обработки на основе порошка сначала используется процесс сухого измельчения на высокой скорости для приготовления хорошо перемешанных тонких порошков, а затем ТФЭ могут быть получены путем сухого прессования (Li et al., 2018), горячего/холодного изостатического прессования ( Appetecchi et al., 2001), или процесс осаждения (Hafner et al., 2019).). Преимущества обработки на основе порошка заключаются в простоте операции, низких требованиях к оборудованию и возможности избежать стадии уплотнения (Nguyen et al., 2019). Однако этот процесс занимает много времени, энергии и его трудно масштабировать. При мокрой химической обработке исходные частицы сначала диспергируют растворителем для получения суспензии заданной вязкости, а затем формируют ТФЭ методом литья из раствора (Sun et al., 2019), электрофоретического осаждения (Blanga et al., 2015), или процесс нанесения покрытия (Park et al., 2006). Преимущества влажной химической обработки заключаются в хорошей смачиваемости и высокой производительности (Liu et al.
Для обработки на основе порошка сначала используется процесс сухого измельчения на высокой скорости для приготовления хорошо перемешанных тонких порошков, а затем ТФЭ могут быть получены путем сухого прессования (Li et al., 2018), горячего/холодного изостатического прессования ( Appetecchi et al., 2001), или процесс осаждения (Hafner et al., 2019).). Преимущества обработки на основе порошка заключаются в простоте операции, низких требованиях к оборудованию и возможности избежать стадии уплотнения (Nguyen et al., 2019). Однако этот процесс занимает много времени, энергии и его трудно масштабировать. При мокрой химической обработке исходные частицы сначала диспергируют растворителем для получения суспензии заданной вязкости, а затем формируют ТФЭ методом литья из раствора (Sun et al., 2019), электрофоретического осаждения (Blanga et al., 2015), или процесс нанесения покрытия (Park et al., 2006). Преимущества влажной химической обработки заключаются в хорошей смачиваемости и высокой производительности (Liu et al. , 2017). Недостатком, однако, является необходимость удаления растворителя. Для обработки с высокой вязкостью при повышенных температурах сначала готовят высоковязкую пасту, не содержащую растворителей, состоящую из полимеров, а затем применяют процесс экструзии для создания ТФЭ с желаемым форм-фактором (Li W. et al., 2017), который в некоторых случаях помогает ультрафиолетовое (УФ) облучение для связывания полимерных цепей. Преимуществом этого процесса является обработка без использования растворителей и формирование гибких мембран с низкой пористостью (Wang et al., 2005). К недостаткам можно отнести ограниченную производительность в процессе экструзии и высокий процент брака при неравномерном осаждении полимерных пленок. Основными проблемами ТФЭ являются низкая ионная проводимость 10 –8 ∼10 –5 S см –1 при температуре окружающей среды (Liang et al., 2018) и высокое межфазное сопротивление из-за полимерной изоляции Li + (Wan et al., 2019).
, 2017). Недостатком, однако, является необходимость удаления растворителя. Для обработки с высокой вязкостью при повышенных температурах сначала готовят высоковязкую пасту, не содержащую растворителей, состоящую из полимеров, а затем применяют процесс экструзии для создания ТФЭ с желаемым форм-фактором (Li W. et al., 2017), который в некоторых случаях помогает ультрафиолетовое (УФ) облучение для связывания полимерных цепей. Преимуществом этого процесса является обработка без использования растворителей и формирование гибких мембран с низкой пористостью (Wang et al., 2005). К недостаткам можно отнести ограниченную производительность в процессе экструзии и высокий процент брака при неравномерном осаждении полимерных пленок. Основными проблемами ТФЭ являются низкая ионная проводимость 10 –8 ∼10 –5 S см –1 при температуре окружающей среды (Liang et al., 2018) и высокое межфазное сопротивление из-за полимерной изоляции Li + (Wan et al., 2019).
CSE, состоящие из полимерной и неорганической частей, разработаны для достижения удовлетворительных комплексных свойств и исключительных синергетических эффектов по сравнению с однокомпонентным электролитом. Из-за присутствия полимера стратегии производства CSE аналогичны стратегиям производства SPE, о которых сообщалось в предыдущих обзорах (Commarieu et al., 2018; Liu et al., 2018; Tan et al., 2018; Ли и др., 2020). Одной из самых популярных технологий получения CSE является электроформование, при котором получают переплетенные и высокопористые нановолокна с большим отношением поверхности к объему и повышенной механической прочностью за счет эффектов запутывания и армирования (Cavaliere et al., 2011; Wootthikanokkhan et al. ., 2015; Карли и др., 2019). Общей проблемой, которую следует отметить при производстве CSE, является ограниченная массовая загрузка неорганических материалов, которые легко агломерируются и, таким образом, ухудшают ионную проводимость и механическую прочность батарей. В целом ТФЭ и ЭПС обладают высокой степенью технологичности благодаря высокой гибкости полимерных материалов.
В целом ТФЭ и ЭПС обладают высокой степенью технологичности благодаря высокой гибкости полимерных материалов.
Неорганические твердые электролиты
Неорганические твердые электролиты можно разделить на группы кристаллических, стеклянных и стеклокерамических электролитов. Большинство кристаллических электролитов представляют собой керамику типа НАСИКОН, типа перовскита и типа граната, которая стабильна в окружающем воздухе, что может упростить изготовление элементов и повысить безопасность. Керамический электролит обычно готовят методом сухого прессования с последующим высокотемпературным спеканием (Li C. et al., 2019).). Для проведения сухого прессования с целью получения плотного керамического электролита тонкоизмельченные порошки необходимо предварительно смешать с ~5 мас.% поливинилового спирта, который легко образует дефекты микро-/макропор после обработки средством для удаления связующего. Кроме того, давление на порошок в разных точках в осевом направлении неодинаково, что приводит к неравномерной плотности и составу сухопрессованного образца (Suvacı and Messing, 2001; Tanaka et al. , 2006; Schiavo et al., 2018). . В качестве альтернативы можно выбрать коллоидный процесс для приготовления керамических электролитов с высокой относительной плотностью и хорошей однородностью состава (Lewis, 2004; Franks et al., 2017). При коллоидном формовании приготовление суспензий с высоким содержанием твердого вещества (>50 об.%) и низкой вязкостью [<1 Па⋅с при скорости сдвига 100 с –1 (Tallon and Franks, 2011; Chen A.N. et al., 2020)] является ключевым фактором для беспористого литья и получения плотной керамики. Следует отметить, что керамические электролиты обычно требуют осторожности при выборе растворителей, поскольку они могут вызвать нежелательную диффузию компонентов или реакцию (Li B. et al., 2017; Lim et al., 2018; Hitz et al., 2019). Другой частью кристаллического электролита является тио-ЛИЗИКОН (система Li 2 S-P 2 S 5 ), который позволяет достичь высокой ионной проводимости 10 –3 ∼10 –2 S см –1 из-за более поляризуемого электронного облака серы (Zhang et al.
, 2006; Schiavo et al., 2018). . В качестве альтернативы можно выбрать коллоидный процесс для приготовления керамических электролитов с высокой относительной плотностью и хорошей однородностью состава (Lewis, 2004; Franks et al., 2017). При коллоидном формовании приготовление суспензий с высоким содержанием твердого вещества (>50 об.%) и низкой вязкостью [<1 Па⋅с при скорости сдвига 100 с –1 (Tallon and Franks, 2011; Chen A.N. et al., 2020)] является ключевым фактором для беспористого литья и получения плотной керамики. Следует отметить, что керамические электролиты обычно требуют осторожности при выборе растворителей, поскольку они могут вызвать нежелательную диффузию компонентов или реакцию (Li B. et al., 2017; Lim et al., 2018; Hitz et al., 2019). Другой частью кристаллического электролита является тио-ЛИЗИКОН (система Li 2 S-P 2 S 5 ), который позволяет достичь высокой ионной проводимости 10 –3 ∼10 –2 S см –1 из-за более поляризуемого электронного облака серы (Zhang et al. , 2019; Shan et al., 2020). Процесс производства электролита тио-LISICON аналогичен керамическим электролитам, в то время как обычно требуется контролируемая инертная атмосфера из-за его чувствительности к воздуху (Manthiram et al., 2017). Кроме того, кристаллический электролит также может быть изготовлен с помощью тонкопленочной обработки, такой как импульсное лазерное осаждение (Fujimoto et al., 2015), химическое осаждение из паровой фазы (Gelfond et al., 2009).), напыление (Lethien et al., 2011), золь-гель осаждение (Jung et al., 2001) и т. д. , отсутствие сопротивления границ зерен, простота изготовления пленки, простота модификации состава и т. д. В общем, существует четыре основных метода обработки для получения стеклообразных электролитов: закалка расплава, механическое измельчение, золь-гель синтез и влажное химическое реакция. Метод закалки расплава включает в себя первоначальный предварительный нагрев/плавление исходных материалов, как правило, до температуры выше 900°C и последующим прессованием/отжигом (Pradel et al.
, 2019; Shan et al., 2020). Процесс производства электролита тио-LISICON аналогичен керамическим электролитам, в то время как обычно требуется контролируемая инертная атмосфера из-за его чувствительности к воздуху (Manthiram et al., 2017). Кроме того, кристаллический электролит также может быть изготовлен с помощью тонкопленочной обработки, такой как импульсное лазерное осаждение (Fujimoto et al., 2015), химическое осаждение из паровой фазы (Gelfond et al., 2009).), напыление (Lethien et al., 2011), золь-гель осаждение (Jung et al., 2001) и т. д. , отсутствие сопротивления границ зерен, простота изготовления пленки, простота модификации состава и т. д. В общем, существует четыре основных метода обработки для получения стеклообразных электролитов: закалка расплава, механическое измельчение, золь-гель синтез и влажное химическое реакция. Метод закалки расплава включает в себя первоначальный предварительный нагрев/плавление исходных материалов, как правило, до температуры выше 900°C и последующим прессованием/отжигом (Pradel et al. , 1985). Это наиболее распространенный метод получения стеклообразных и стеклокерамических электролитов. Из-за сильной склонности некоторых составов стекла к кристаллизации для достижения высокой скорости охлаждения за счет уменьшения объема расплавленного стекла используется двухроликовая закалочная установка (Pradel et al., 1985; Minami et al., 2006). . Недостатком метода закалки расплава являются высокие температуры и довольно сложная установка, которая может быть потенциально опасной. Благодаря простоте производственных процедур и способности улучшать измельчение/однородность при температуре и давлении окружающей среды, метод механического измельчения можно легко применять для производства большого количества хорошо перемешанных тонких порошков по низкой цене. Однако процесс аморфизации при измельчении имеет сильную зависимость от времени, и для наблюдения аморфного гало на рентгенограммах может потребоваться до 20 часов (Morimoto et al., 19).99; Хаяши и др., 2002). Метод золь-гель синтеза для производства стеклообразных электролитов включает процесс контролируемого гидролиза, поликонденсации, гелеобразования и дегидратации (Hench and West, 1990).
, 1985). Это наиболее распространенный метод получения стеклообразных и стеклокерамических электролитов. Из-за сильной склонности некоторых составов стекла к кристаллизации для достижения высокой скорости охлаждения за счет уменьшения объема расплавленного стекла используется двухроликовая закалочная установка (Pradel et al., 1985; Minami et al., 2006). . Недостатком метода закалки расплава являются высокие температуры и довольно сложная установка, которая может быть потенциально опасной. Благодаря простоте производственных процедур и способности улучшать измельчение/однородность при температуре и давлении окружающей среды, метод механического измельчения можно легко применять для производства большого количества хорошо перемешанных тонких порошков по низкой цене. Однако процесс аморфизации при измельчении имеет сильную зависимость от времени, и для наблюдения аморфного гало на рентгенограммах может потребоваться до 20 часов (Morimoto et al., 19).99; Хаяши и др., 2002). Метод золь-гель синтеза для производства стеклообразных электролитов включает процесс контролируемого гидролиза, поликонденсации, гелеобразования и дегидратации (Hench and West, 1990). В зависимости от состава стекла различные алкоксиды металлов или неорганические соединения используются в качестве прекурсоров для смешивания с соответствующим растворителем на стадии гидролиза. Последующая реакция конденсации образует связь и соединение для основы стеклянной сети (Hench and West, 1990). Благодаря реакции в жидком состоянии и перемешиванию золь-гель синтез может достигать высокой гомогенности при относительно низких температурах (Хенч и Уэст, 19).90; Венкатасубраманиан и др., 1991; Данн и др., 1994). Подобно процедурам золь-гель синтеза, метод влажной химической реакции позволяет получить желаемую композицию за счет перегруппировки молекул/связей во время реакции в жидком состоянии. Органические соединения обычно используются в качестве растворителя для растворения исходных химических веществ (Teragawa et al., 2014; Phuc et al., 2016; Choi et al., 2017).
В зависимости от состава стекла различные алкоксиды металлов или неорганические соединения используются в качестве прекурсоров для смешивания с соответствующим растворителем на стадии гидролиза. Последующая реакция конденсации образует связь и соединение для основы стеклянной сети (Hench and West, 1990). Благодаря реакции в жидком состоянии и перемешиванию золь-гель синтез может достигать высокой гомогенности при относительно низких температурах (Хенч и Уэст, 19).90; Венкатасубраманиан и др., 1991; Данн и др., 1994). Подобно процедурам золь-гель синтеза, метод влажной химической реакции позволяет получить желаемую композицию за счет перегруппировки молекул/связей во время реакции в жидком состоянии. Органические соединения обычно используются в качестве растворителя для растворения исходных химических веществ (Teragawa et al., 2014; Phuc et al., 2016; Choi et al., 2017).
Стеклокерамические электролиты включают класс материалов со смесью как аморфной, так и микрокристаллической микроструктуры, которые обычно получают путем контролируемой обработки зародышеобразования и кристаллизации соответствующего стеклянного материала при температуре выше температуры стеклования (Варшнея и Мауро, 2019). ). Подобно обычным технологиям производства стеклообразных электролитов, во многих предыдущих публикациях сообщалось о стеклокерамических электролитах, полученных путем закалки расплава или механического измельчения с последующей стадией отжига (Hayashi et al., 2003; Trevey et al., 2009; Tatsumisago and Хаяси, 2012). Однако температура и время отжига могут повлиять на структурное расположение кристаллических фаз и повлиять на ионную проводимость (Xie et al., 2009). Использование золь-гель синтеза и методов влажной химической реакции при производстве ИСЭ из стеклокерамики также сообщалось в нескольких недавних работах (Kotobuki et al., 2013; Teragawa et al., 2014; Li et al., 2015; Ma и др., 2016; Фук и др., 2016).
). Подобно обычным технологиям производства стеклообразных электролитов, во многих предыдущих публикациях сообщалось о стеклокерамических электролитах, полученных путем закалки расплава или механического измельчения с последующей стадией отжига (Hayashi et al., 2003; Trevey et al., 2009; Tatsumisago and Хаяси, 2012). Однако температура и время отжига могут повлиять на структурное расположение кристаллических фаз и повлиять на ионную проводимость (Xie et al., 2009). Использование золь-гель синтеза и методов влажной химической реакции при производстве ИСЭ из стеклокерамики также сообщалось в нескольких недавних работах (Kotobuki et al., 2013; Teragawa et al., 2014; Li et al., 2015; Ma и др., 2016; Фук и др., 2016).
Несмотря на то, что ISE предлагают многочисленные преимущества в технологии твердотельных аккумуляторов, их хрупкий характер создает множество проблем при обработке и интеграции. После изготовления ИСЭ обычно требуется последующая обработка, такая как шлифовка или резка, для получения желаемых форм для объединения с электродными слоями. Однако многие материалы ISE неизбежно сталкиваются с дилеммой химического перекрестного загрязнения или структурного повреждения во время последующей обработки. Например, керамические электролиты могут расколоться при резке, а электролиты для стекла/стеклокерамики могут иметь побочные реакции, связанные с водой или повышенной температурой при шлифовке/полировке. Следовательно, последующая обработка может значительно увеличить производственные затраты и удлинить производственный цикл. Краткое изложение традиционных методов производства SSE представлено схемами на рис. 2, где эти распространенные методы имеют аналогичные ограничения в достижении сложных форм-факторов, необходимых для будущих применений аккумуляторов. В этих условиях исследования 3D-печати SSE привлекают все большее внимание из-за возможности одноэтапного производства SSE с желаемыми форм-факторами. В обход многих дополнительных шагов, необходимых для традиционных методов, полностью интегрированное производство всей твердотельной батареи также может быть достигнуто с помощью 3D-печати в будущем.
Однако многие материалы ISE неизбежно сталкиваются с дилеммой химического перекрестного загрязнения или структурного повреждения во время последующей обработки. Например, керамические электролиты могут расколоться при резке, а электролиты для стекла/стеклокерамики могут иметь побочные реакции, связанные с водой или повышенной температурой при шлифовке/полировке. Следовательно, последующая обработка может значительно увеличить производственные затраты и удлинить производственный цикл. Краткое изложение традиционных методов производства SSE представлено схемами на рис. 2, где эти распространенные методы имеют аналогичные ограничения в достижении сложных форм-факторов, необходимых для будущих применений аккумуляторов. В этих условиях исследования 3D-печати SSE привлекают все большее внимание из-за возможности одноэтапного производства SSE с желаемыми форм-факторами. В обход многих дополнительных шагов, необходимых для традиционных методов, полностью интегрированное производство всей твердотельной батареи также может быть достигнуто с помощью 3D-печати в будущем. Далее в этом обзоре обсуждаются существующие стратегии 3D-печати для SSE, а затем подчеркиваются перспективы и возможности повышения производительности SSE, напечатанных на 3D-принтере.
Далее в этом обзоре обсуждаются существующие стратегии 3D-печати для SSE, а затем подчеркиваются перспективы и возможности повышения производительности SSE, напечатанных на 3D-принтере.
Рис. 2. Схема традиционных производственных стратегий с (A) Оптическое изображение твердого полимерного электролита на основе полиэтиленоксида (ПЭО). Воспроизведено из Chen C. et al. (2019) по лицензии Creative Commons Attribution. (B) Схема твердого композиционного электролита, сочетающего Li 6,75 La 3 Zr 1,75 Ta 0,25 O 12 (LLZTO) и поливинилиденфторид (ПВДФ). Воспроизведено из Zhang X. et al. (2017) с разрешения John Wiley & Sons-Books. (C) Оптическое изображение пленки керамического электролита Li 0,34 La 0,56 TiO 3 (LLTO). Воспроизведено из Jiang et al. (2020) с разрешения John Wiley & Sons-Books.
Технологии 3D-печати
Аддитивное производство, т. е. 3D-печать, относится к передовой технологии изготовления, при которой трехмерные объекты строятся послойно на основе файлов автоматизированного проектирования (САПР) (Chen A.N. et и др., 2017; Мао и др., 2017). По сравнению с традиционным методом, технология 3D-печати продемонстрировала уникальные преимущества в быстром прототипировании очень сложных и точных структур. Это преимущество может значительно упростить процедуру изготовления и сократить отходы материала, чтобы снизить себестоимость продукции (Chen A.N. et al., 2018; Li M. et al., 2019).). Кроме того, 3D-печать способна снять присущие батареям ограничения форм-фактора и преобразовать производство батарей из простого двухмерного в сложное трехмерное (Pang et al., 2019; Cheng et al., 2020; Yang et al., 2020). ). Учитывая вышеуказанные преимущества, для изготовления SSE было применено несколько методов 3D-печати. Эти методы 3D-печати SSE можно разделить на следующие две категории: печать на основе прямой записи (DW) [например, прямая запись чернилами (DIW), струйная печать (IJP), аэрозольная струйная печать (AJP) и наплавление.
е. 3D-печать, относится к передовой технологии изготовления, при которой трехмерные объекты строятся послойно на основе файлов автоматизированного проектирования (САПР) (Chen A.N. et и др., 2017; Мао и др., 2017). По сравнению с традиционным методом, технология 3D-печати продемонстрировала уникальные преимущества в быстром прототипировании очень сложных и точных структур. Это преимущество может значительно упростить процедуру изготовления и сократить отходы материала, чтобы снизить себестоимость продукции (Chen A.N. et al., 2018; Li M. et al., 2019).). Кроме того, 3D-печать способна снять присущие батареям ограничения форм-фактора и преобразовать производство батарей из простого двухмерного в сложное трехмерное (Pang et al., 2019; Cheng et al., 2020; Yang et al., 2020). ). Учитывая вышеуказанные преимущества, для изготовления SSE было применено несколько методов 3D-печати. Эти методы 3D-печати SSE можно разделить на следующие две категории: печать на основе прямой записи (DW) [например, прямая запись чернилами (DIW), струйная печать (IJP), аэрозольная струйная печать (AJP) и наплавление. моделирование (FDM)] и печать на основе литографии [например, стереолитография (SL) и цифровая обработка света (DLP)]. Далее будут обсуждаться последние достижения в исследованиях стратегий 3D-печати SSE с точки зрения выбора исходного сырья, оболочки сборки и разрешения печати.
моделирование (FDM)] и печать на основе литографии [например, стереолитография (SL) и цифровая обработка света (DLP)]. Далее будут обсуждаться последние достижения в исследованиях стратегий 3D-печати SSE с точки зрения выбора исходного сырья, оболочки сборки и разрешения печати.
3D-печать твердотельных электролитов на основе DW
Прямая запись чернилами
Прямое письмо чернилами (DIW) является наиболее широко используемым методом 3D-печати для производства SSE из-за его низкой стоимости, простоты в эксплуатации и широкого выбора сырья ( металлы, полимеры и керамика) (Ambrosi and Pumera, 2016; Du et al., 2017). Схема процесса DIW показана на рисунке 3A. В процессе печати вязкоупругие чернила на гелевой основе выдавливаются непосредственно из головки сопла в виде непрерывной нити. Перемещая сопло вверх, проектируемые 3D-объекты могут быть созданы путем последовательного послойного осаждения. После печати материалы чернил быстро затвердевают под воздействием испарения растворителя, гелеобразования, фазовых переходов, вызванных температурой или растворителем (Naficy et al. , 2014). Как правило, разрешение печати DIW-объектов определяется диаметром сопла, который составляет от десятков до сотен микрометров. Для печати SSE с высоким разрешением (10–100 мкм) решающим фактором является высокоэффективный состав чернил. Печатная краска должна быть отрегулирована таким образом, чтобы обеспечить хорошее разжижение при сдвиге, обеспечивающее плавный поток чернил через сопло, а также достаточно высокий предел текучести и модуль накопления, чтобы обеспечить сохранение формы экструдированных нитей (Chang et al., 2019).).
, 2014). Как правило, разрешение печати DIW-объектов определяется диаметром сопла, который составляет от десятков до сотен микрометров. Для печати SSE с высоким разрешением (10–100 мкм) решающим фактором является высокоэффективный состав чернил. Печатная краска должна быть отрегулирована таким образом, чтобы обеспечить хорошее разжижение при сдвиге, обеспечивающее плавный поток чернил через сопло, а также достаточно высокий предел текучести и модуль накопления, чтобы обеспечить сохранение формы экструдированных нитей (Chang et al., 2019).).
Рис. 3. Прямое письмо чернилами (DIW). (A) Схематическая и СЭМ-микроскопия гелевого электролита для Zn-MnO 2 микробатареи. Воспроизведено из Ho et al. (2010) с разрешения IOP Publishing, Ltd. (B) Схематические и оптические изображения полимерного электролита для Li 4 Ti 5 O 12 -графеноксидной батареи. Воспроизведено из Fu et al. (2016) с разрешения John Wiley & Sons-Books. (C) Схема и СЭМ-микрофотография композитного твердого электролита (CSE) для гибких ЛИА (LiFePO 4 /CSE/Li 4 Ti 5 O 12 ). Воспроизведено из Blake et al. (2017) с разрешения John Wiley & Sons-Books. (D) СЭМ-микроскопия и оптическое изображение CSE для ЛИА с электродом MnO 2 . Воспроизведено из Cheng et al. (2018) с разрешения John Wiley & Sons-Books. (E) Схема и СЭМ-микрофотографии Li 7 La 3 Zr 2 O 12 (LLZ) керамический электролит для литий-металлического аккумулятора (Li/LLZ/Li). Воспроизведено из Mcowen et al. (2018) с разрешения John Wiley & Sons-Books.
(C) Схема и СЭМ-микрофотография композитного твердого электролита (CSE) для гибких ЛИА (LiFePO 4 /CSE/Li 4 Ti 5 O 12 ). Воспроизведено из Blake et al. (2017) с разрешения John Wiley & Sons-Books. (D) СЭМ-микроскопия и оптическое изображение CSE для ЛИА с электродом MnO 2 . Воспроизведено из Cheng et al. (2018) с разрешения John Wiley & Sons-Books. (E) Схема и СЭМ-микрофотографии Li 7 La 3 Zr 2 O 12 (LLZ) керамический электролит для литий-металлического аккумулятора (Li/LLZ/Li). Воспроизведено из Mcowen et al. (2018) с разрешения John Wiley & Sons-Books.
В 2010 году Ho et al. сообщили о первом DIW-печатном SSE с ионной жидкостью. (2010). Как показано на рисунке 3A, SSE был зажат между электродами в микробатарейке Zn-MnO 2 . Напечатанная ячейка показала ёмкость 0,98 мАч·см·–2· и плотность энергии 1,2 мВтч·см·–2· в течение более чем 70 циклов. Фу и др. (2016) печатные полимерно-композитные электролитные чернила с регулируемой вязкостью для встречно-штыревой батареи Li 4 Ti 5 O 12 -графеноксида (GO) (рис. 3B). Отметив, что чешуйки GO контролировались, чтобы выровняться вдоль направления экструзии в осажденных электродах, что могло улучшить электропроводность и обеспечить достаточную площадь поверхности для размещения электролита. CSE были созданы для гибких LIB компанией DIW (рис. 3C, D; Blake et al., 2017; Cheng et al., 2018). По сравнению с коммерческим полиолефиновым сепаратором печатные CSE продемонстрировали сопоставимые высокие электрохимические характеристики, лучшую термическую стабильность, смачиваемость электролитом и способность к повторному использованию (Blake et al., 2017). Макоуэн и др. (2018) подготовил Ли 7 La 3 Zr 2 O 12 (LLZ) керамический электролит с различными микрометрическими характеристиками для литий-металлической батареи (рис.
Фу и др. (2016) печатные полимерно-композитные электролитные чернила с регулируемой вязкостью для встречно-штыревой батареи Li 4 Ti 5 O 12 -графеноксида (GO) (рис. 3B). Отметив, что чешуйки GO контролировались, чтобы выровняться вдоль направления экструзии в осажденных электродах, что могло улучшить электропроводность и обеспечить достаточную площадь поверхности для размещения электролита. CSE были созданы для гибких LIB компанией DIW (рис. 3C, D; Blake et al., 2017; Cheng et al., 2018). По сравнению с коммерческим полиолефиновым сепаратором печатные CSE продемонстрировали сопоставимые высокие электрохимические характеристики, лучшую термическую стабильность, смачиваемость электролитом и способность к повторному использованию (Blake et al., 2017). Макоуэн и др. (2018) подготовил Ли 7 La 3 Zr 2 O 12 (LLZ) керамический электролит с различными микрометрическими характеристиками для литий-металлической батареи (рис. 3E). Было доказано, что эти структуры электролита обеспечивают батареи с хорошими механическими свойствами, более низким сопротивлением полного элемента и улучшенной плотностью энергии и мощности. Об аналогичной работе DIW сообщалось и в других источниках (Braam et al., 2012; Wei et al., 2018; Ma and Devin Mackenzie, 2019). Основные преимущества DIW заключаются в широком выборе исходного сырья и широком диапазоне рабочей зоны (100 мкм–10 см). Использование концентрированных вязкоупругих паст позволяет создавать трехмерные конструкции без необходимости в опорах (таких как порошковый слой, жидкий чан или печатные ручные опоры) (Chen Z. et al., 2019).), что может упростить процесс печати, исключить процесс обработки поверхности и максимизировать использование сырья. DIW хорошо изучен для изготовления специальных пористых структур, обладающих периодическими характеристиками, с небольшим разрешением или без него. Однако приготовление вязкоупругих паст на основе геля для DIW является сложной задачей.
3E). Было доказано, что эти структуры электролита обеспечивают батареи с хорошими механическими свойствами, более низким сопротивлением полного элемента и улучшенной плотностью энергии и мощности. Об аналогичной работе DIW сообщалось и в других источниках (Braam et al., 2012; Wei et al., 2018; Ma and Devin Mackenzie, 2019). Основные преимущества DIW заключаются в широком выборе исходного сырья и широком диапазоне рабочей зоны (100 мкм–10 см). Использование концентрированных вязкоупругих паст позволяет создавать трехмерные конструкции без необходимости в опорах (таких как порошковый слой, жидкий чан или печатные ручные опоры) (Chen Z. et al., 2019).), что может упростить процесс печати, исключить процесс обработки поверхности и максимизировать использование сырья. DIW хорошо изучен для изготовления специальных пористых структур, обладающих периодическими характеристиками, с небольшим разрешением или без него. Однако приготовление вязкоупругих паст на основе геля для DIW является сложной задачей. Кроме того, печатные элементы DIW ограничены структурами из поленницы из-за экструдированных форм нитей, что свидетельствует о трудностях изготовления плотных структур.
Кроме того, печатные элементы DIW ограничены структурами из поленницы из-за экструдированных форм нитей, что свидетельствует о трудностях изготовления плотных структур.
Струйная печать
Струйная печать (IJP) представляет собой метод бесконтактного нанесения материала на основе капель, который позволяет напрямую выбрасывать микрокапли чернил через сопла на различные типы подложек для создания двумерных (2D) рисунков (Доброжан и др., 2020). Схема процесса IJP показана на рисунке 4A. В качестве многообещающего метода IJP был изучен для печати несколькими материалами, включая металл, полимеры, со-гель, белковые материалы и т. Д. (Fritzler and Prinz, 2017). Как правило, чернила для IJP должны быть в разбавленной жидкой форме с достаточно низкой динамической вязкостью и поверхностным натяжением. Количественная характеристика, основанная на физических свойствах чернил, была предложена Дерби (2010) для оценки того, можно ли описать чернила как «пригодность для печати» для IJP: Z = 1/ Ох = ( γρα ) 1/2 / η , где Z — обратное число безразмерного числа, 0 0 0 О — число, обратное безразмерному характерная длина, представляющая радиус сопла, а ρ , η и γ — плотность, динамическая вязкость и поверхностное натяжение чернил соответственно. В случае 1 < Z < 10 ожидается, что чернила будут образовывать стабильные капли, чтобы обеспечить процесс IJP.
В случае 1 < Z < 10 ожидается, что чернила будут образовывать стабильные капли, чтобы обеспечить процесс IJP.
Рис. 4. Струйная печать (IJP). (А) Схема процесса IJP; (B) СЭМ в поперечном сечении и картирование элементов пористого композитного LiFePO 4 электрода с напечатанными ионогелевыми электролитами; (C) Температурно-зависимая ионная проводимость печатных ионогелей; (D) Гальваностатическое циклирование полуэлемента с использованием печатных ионогелей и пористых композитных электродов LiFePO 4 и Li 4 Ti 5 O 12 . Воспроизведено из Delannoy et al. (2015) с разрешения Elsevier Science and Technology Journals.
Применение IJP для печати SSE было впервые описано в литературе Delannoy et al. (2015). Авторы нанесли ионогелевые чернила на основе кремнезема непосредственно на пористые композитные электроды, чтобы сформировать SSE для LIB (рис. 4A–D). Ионогель SSE показал высокую ионную проводимость, хорошую термостойкость и отличную совместимость с пористыми электродами, что позволило изготовить микро-ЛИА с высокой поверхностной емкостью и хорошими характеристиками электрохимического циклирования. Полная ячейка с использованием напечатанного IJP ионогеля SSE с LiFePO 4 и Li 4 Ti 5 O 12 пористые композитные электроды показали поверхностную емкость 300 мА·ч·см –2 в течение более 100 циклов, что было более конкурентоспособным, чем у микроустройств, полученных дорогостоящим физическим процесс парообразования. В методе IJP диаметр сопла обычно составляет менее 5 мкм, что меньше по сравнению с DIW (от десятков до сотен микрометров). В этом случае ИПП позволяет изготавливать спроектированные структуры с более высоким разрешением (5–20 мкм), что способствовало применению ИПП в области микроэлектроники и энергетических устройств. Однако объекты, напечатанные IJP, в основном ограничены двумерным пространством с оболочкой здания 50–10 мм и не могут быть адаптированы для нанесения толстых рисунков из-за очень небольшого объема исходных чернил.
Ионогель SSE показал высокую ионную проводимость, хорошую термостойкость и отличную совместимость с пористыми электродами, что позволило изготовить микро-ЛИА с высокой поверхностной емкостью и хорошими характеристиками электрохимического циклирования. Полная ячейка с использованием напечатанного IJP ионогеля SSE с LiFePO 4 и Li 4 Ti 5 O 12 пористые композитные электроды показали поверхностную емкость 300 мА·ч·см –2 в течение более 100 циклов, что было более конкурентоспособным, чем у микроустройств, полученных дорогостоящим физическим процесс парообразования. В методе IJP диаметр сопла обычно составляет менее 5 мкм, что меньше по сравнению с DIW (от десятков до сотен микрометров). В этом случае ИПП позволяет изготавливать спроектированные структуры с более высоким разрешением (5–20 мкм), что способствовало применению ИПП в области микроэлектроники и энергетических устройств. Однако объекты, напечатанные IJP, в основном ограничены двумерным пространством с оболочкой здания 50–10 мм и не могут быть адаптированы для нанесения толстых рисунков из-за очень небольшого объема исходных чернил. Кроме того, IJP имеет ограниченную гибкость при изготовлении сложных структур (таких как полые и выступающие) из-за трудностей подготовки подложки с использованием экструдированных разбавленных жидких чернил. Эти ограничения ограничили его дальнейшее применение.
Кроме того, IJP имеет ограниченную гибкость при изготовлении сложных структур (таких как полые и выступающие) из-за трудностей подготовки подложки с использованием экструдированных разбавленных жидких чернил. Эти ограничения ограничили его дальнейшее применение.
Аэрозольная струйная печать
Аэрозольная струйная печать (AJP) — это относительно новый метод бесконтактного нанесения, ориентированный в первую очередь на изготовление печатной электроники. Сырье (например, металлы, полимеры и керамика) для осаждения AJP должно быть в жидкой форме и подвергаться пневматическому или ультразвуковому аэрозольному распылению в капли диаметром 1–5 мкм. Эти капли затем доставляются на подложку потоком газа для формирования желаемых узоров (Mahajan et al., 2013). Схема процесса AJP показана на рисунке 5A. Разрешение печати AJP зависит не только от размера сопла, но и от плотности капель и их взаимодействия с подложкой (Hoey et al., 2012). AJP считается потенциальным конкурентом IJP в миллиметровом производстве, поскольку он позволяет бесконтактное нанесение на гибкие и трехмерные неплоские подложки, что невозможно для методов IJP или DIW.
Рис. 5. Аэрозольная струйная печать (AJP). (А) Схема процесса AJP. Воспроизведено из Hoey et al. (2012) по лицензии Creative Commons Attribution. AJP для электролитов на основе полиэтиленоксида (ПЭО) в ЛИА с LiFePO 4 в качестве катода: (B) СЭМ-микрофотография поперечного сечения электролитов на основе ПЭО; (C) Температурно-зависимая проводимость электролитов на основе ПЭО; (D) Кривые разряда для батарей, созданных из печатного электролита на основе ПЭО, при 45°C с вставкой для измерения при 75°C. Воспроизведено из Deiner et al. (2019) с разрешения John Wiley & Sons-Books.
Применение AJP для печати SSE было впервые описано в литературе Deiner et al. (2019). В этой работе был представлен состав чернил, состоящий из ПЭО, дифтор(оксалата)бората лития и наночастиц Al 2 O 3 , подходящих для нанесения AJP (рис. 5B–D). Результаты показали, что геометрия и транспортные свойства печатных ТФЭ были в основном чувствительны к химической идентичности аниона соли лития и соотношению ЭО: Li. ЛИА с ТФЭ, осажденными из AJP, могли быть разряжены при C/15 с емкостью >85 мА·ч·г·9.1748 –1 при 45°C и 162 мА·ч g –1 при 75°C. По сравнению с IJP, AJP имеет следующие преимущества: (i) экструдированные чернила обеспечивают гораздо более высокую вязкость, больший размер частиц и загрузку твердых частиц благодаря процессу распыления, который воспроизводит мелкие капли, (ii) он основан на непрерывном образовании туман из капель диаметром 1–5 мкм, что указывает на более высокое разрешение печати (∼5 мкм) и скорость осаждения, чем в процессе IJP drop-on-demand, и (iii) непрерывный туман состоит из высокоплотных капли, которые плотно сфокусированы, демонстрируя способность препятствовать засорению тонкого сопла. Тем не менее, масштабируемость системы напыления, особенно для обработки больших площадей (с оболочкой > 3 мм) по-прежнему является сложной задачей для AJP из-за размера сопла и дополнительных принадлежностей. Кроме того, стоимость дополнительных приспособлений и сфокусированного потока газа в системе AJP обычно высока.
ЛИА с ТФЭ, осажденными из AJP, могли быть разряжены при C/15 с емкостью >85 мА·ч·г·9.1748 –1 при 45°C и 162 мА·ч g –1 при 75°C. По сравнению с IJP, AJP имеет следующие преимущества: (i) экструдированные чернила обеспечивают гораздо более высокую вязкость, больший размер частиц и загрузку твердых частиц благодаря процессу распыления, который воспроизводит мелкие капли, (ii) он основан на непрерывном образовании туман из капель диаметром 1–5 мкм, что указывает на более высокое разрешение печати (∼5 мкм) и скорость осаждения, чем в процессе IJP drop-on-demand, и (iii) непрерывный туман состоит из высокоплотных капли, которые плотно сфокусированы, демонстрируя способность препятствовать засорению тонкого сопла. Тем не менее, масштабируемость системы напыления, особенно для обработки больших площадей (с оболочкой > 3 мм) по-прежнему является сложной задачей для AJP из-за размера сопла и дополнительных принадлежностей. Кроме того, стоимость дополнительных приспособлений и сфокусированного потока газа в системе AJP обычно высока.
Моделирование наплавлением
Моделирование наплавлением (FDM) — это хорошо известный метод 3D-печати для создания сложных объектов как в промышленности, так и в научных кругах благодаря своей простоте и доступности оборудования (Bellini and Güçeri, 2003). Механизм формирования FDM аналогичен механизму DIW, который основан на принципе экструдирования материала, в то время как их исходное сырье и процесс подачи отличаются. Схема процесса FDM показана на рисунке 6A. Материалы для FDM-печати должны быть твердыми и термопластичными в форме тонких нитей, которые могут быть доставлены к экструзионной головке с помощью ведущих колес. После экструзии из сопла термопластические материалы, которые нагреваются до состояния стеклования, кристаллизуются и затвердевают, осаждаясь на подложку. Обычными термопластическими материалами, используемыми в технике FDM, являются акрилонитрил-бутадиен-стирольные и полимолочные нити (PLA), в которых PLA приобретает все большую популярность благодаря своей безвредности для окружающей среды. Несмотря на эти преимущества, метод FDM редко применялся для изготовления SSE из-за низкой ионной проводимости термопластов. Таким образом, разработка термопластичных материалов в форме нитей с высокой ионной проводимостью является ключом к производству SSE методом FDM.
Несмотря на эти преимущества, метод FDM редко применялся для изготовления SSE из-за низкой ионной проводимости термопластов. Таким образом, разработка термопластичных материалов в форме нитей с высокой ионной проводимостью является ключом к производству SSE методом FDM.
Рис. 6. Моделирование методом наплавления (FDM). (А) Схема процесса FDM. Воспроизведено из Klippstein et al. (2018) с разрешения John Wiley & Sons-Books. FDM для электролитов на основе полимолочной кислоты (PLA) в LIB (титанат лития/матрица PLA/оксид лития-марганца): (B) Отдельные компоненты 3D-печатной монетной ячейки; (C) Емкость и кулоновский выход при плотности тока 20 мА –1 за 100 циклов; (D) Оптическое изображение печатной батареи, питающей светодиод; (E) SEM поперечное сечение одной батареи печати. Воспроизведено из Reyes et al. (2018) с разрешения Американского химического общества.
В 2018 г. Reyes et al. (2018) впервые синтезировали электролитные нити на основе PLA для FDM-печати с наивысшей ионной проводимостью 0,031 мСм⋅см –1 путем вливания смеси этилметилкарбоната, пропиленкарбоната и LiClO 4 . Они также разработали электродные материалы из PLA для 3D-печати полных литий-ионных аккумуляторов произвольной формы, таких как батарейки типа «таблетка» и встроенные батареи, используемые в носимых электронных устройствах, как показано на рисунках 6B–E. Однако напечатанная полная ячейка имеет более низкую кулоновскую эффективность (∼88,5% в течение первых 50 циклов) по сравнению с традиционными LIB (∼95–99%) (Смит и др., 2010). FDM предлагает множество преимуществ, таких как низкая стоимость печати, возможности большого размера (максимальная ширина сборки около 10 см) и, в частности, возможность печати структуры из нескольких исходных материалов. Тем не менее, все еще существует несколько ограничений на производство SSE с помощью FDM: (i) материалы для печати ограничены термопластами и должны быть сформированы в нити, (ii) термопластичные нити должны быть нагреты до их состояния стеклования при высокой температуре 150 –180°C, и (iii) разрешение печати FDM вместе с Z -ось колеблется от 50 до 200 мкм, что приводит к плохому качеству поверхности и управляемости структуры.
Они также разработали электродные материалы из PLA для 3D-печати полных литий-ионных аккумуляторов произвольной формы, таких как батарейки типа «таблетка» и встроенные батареи, используемые в носимых электронных устройствах, как показано на рисунках 6B–E. Однако напечатанная полная ячейка имеет более низкую кулоновскую эффективность (∼88,5% в течение первых 50 циклов) по сравнению с традиционными LIB (∼95–99%) (Смит и др., 2010). FDM предлагает множество преимуществ, таких как низкая стоимость печати, возможности большого размера (максимальная ширина сборки около 10 см) и, в частности, возможность печати структуры из нескольких исходных материалов. Тем не менее, все еще существует несколько ограничений на производство SSE с помощью FDM: (i) материалы для печати ограничены термопластами и должны быть сформированы в нити, (ii) термопластичные нити должны быть нагреты до их состояния стеклования при высокой температуре 150 –180°C, и (iii) разрешение печати FDM вместе с Z -ось колеблется от 50 до 200 мкм, что приводит к плохому качеству поверхности и управляемости структуры.
3D-печать твердотельных электролитов на основе литографии
Стереолитография
Стереолитография (SL) считается наиболее известным и популярным методом 3D-печати и применяется для изготовления полимерных, керамических и стеклянных деталей (Eckel et al., 2016; Ngo et al., 2018; Santoliquido et al., 2019). Схема процесса SL показана на рисунке 7A. SL позволяет производить сложные трехмерные микрорешетки путем селективной полимеризации и отверждения фотоотверждаемой смолы с использованием источника света определенной длины волны (обычно в УФ-диапазоне) (Chartrain et al., 2018). Процесс полимеризации обычно протекает на поверхности жидкости. Как только один слой полимеризации завершен, чан или платформа, поддерживающая строительную часть, поднимается или опускается на толщину слоя. Иногда требуется лезвие, чтобы выровнять поверхность жидкости перед полимеризацией следующего слоя. Фотоотверждаемая смола SL состоит в основном из фотоактивных мономеров и других добавок в очень небольших количествах, в частности фотоинициатора (Manapat et al. , 2017). По сравнению с технологией 3D-печати на основе DW (например, DIW, IJP, AJP и FDM), SL способна изготавливать произвольные 3D-геометрии, включая различные полые резные элементы с высоким разрешением вплоть до микрометрового масштаба, и может устранить ограничения. из траектории и серийной экструзии (Янг и др., 2016). Таким образом, СР обладает высоким потенциалом для изготовления различных типов ЭСЭ, в том числе ТФЭ, ЭСЭ и ИСЭ.
, 2017). По сравнению с технологией 3D-печати на основе DW (например, DIW, IJP, AJP и FDM), SL способна изготавливать произвольные 3D-геометрии, включая различные полые резные элементы с высоким разрешением вплоть до микрометрового масштаба, и может устранить ограничения. из траектории и серийной экструзии (Янг и др., 2016). Таким образом, СР обладает высоким потенциалом для изготовления различных типов ЭСЭ, в том числе ТФЭ, ЭСЭ и ИСЭ.
Рис. 7. Стереолитография (SL). (А) Схема процесса СЛ. Воспроизведено из Gross et al. (2014) с разрешения Американского химического общества. SL для твердотельных электролитов (SSE): (B) Процесс трафаретной печати с УФ-отверждением твердых полимерных электролитов (SPE, = этоксилированный триметилолпропантриакрилатный мономер/высококипящий электролит/Al 2 O 3 наночастицы) тонкий слой для ЛИА [LiFePO 4 (LFP)/SPE/Li 4 Ti 5 O 12 (LTO)]. Воспроизведено из Ким С.Х. и другие. (2015) с разрешения Американского химического общества. (C) Оптическое изображение и трехмерная структура ТФЭ на основе полиэтиленгликоля для микроЛИБ (LFP/SPE/LTO). Воспроизведено из Chen Q. et al. (2017) с разрешения IOP Publishing, Ltd. (D) Схематические изображения и изображения SEM 3D-печатных шаблонов с кубической, гироидной, ромбовидной и полученной из биджеля микроархитектурой Li 1,4 Al 0,4 Ge 1,6 (PO 4 ) 3 (LAGP)-эпоксидные электролиты для литий-металлических аккумуляторов с симметричными литиевыми электродами. Воспроизведено из Zekoll et al. (2018) с разрешения Королевского химического общества. (E) Оптическое изображение, СЭМ-изображения и кривые зависимости напряжения/мощности от плотности тока для элементов из твердого оксида лантана-стронция (LSM-YSZ)/YSZ/Ni-YSZ. Воспроизведено из Pesce et al. (2020) по лицензии Creative Commons Attribution 3.0 Unported License, опубликованной Королевским химическим обществом.
Воспроизведено из Ким С.Х. и другие. (2015) с разрешения Американского химического общества. (C) Оптическое изображение и трехмерная структура ТФЭ на основе полиэтиленгликоля для микроЛИБ (LFP/SPE/LTO). Воспроизведено из Chen Q. et al. (2017) с разрешения IOP Publishing, Ltd. (D) Схематические изображения и изображения SEM 3D-печатных шаблонов с кубической, гироидной, ромбовидной и полученной из биджеля микроархитектурой Li 1,4 Al 0,4 Ge 1,6 (PO 4 ) 3 (LAGP)-эпоксидные электролиты для литий-металлических аккумуляторов с симметричными литиевыми электродами. Воспроизведено из Zekoll et al. (2018) с разрешения Королевского химического общества. (E) Оптическое изображение, СЭМ-изображения и кривые зависимости напряжения/мощности от плотности тока для элементов из твердого оксида лантана-стронция (LSM-YSZ)/YSZ/Ni-YSZ. Воспроизведено из Pesce et al. (2020) по лицензии Creative Commons Attribution 3.0 Unported License, опубликованной Королевским химическим обществом.
В 2015 году Ким Ш.Х. и другие. (2015) подготовили слой ТФЭ и электроды, встроенные в матрицу ТФЭ, на произвольных объектах, а затем собрали в многослойные структурированные гибкие LIB в различных форм-факторах (рис. 7B). Напечатанные батареи показали хорошую способность долговременного хранения заряда и средний уровень объемной плотности энергии. Чен К. и соавт. (2017) разработали УФ-отверждаемую смолу на основе поли(этиленгликоля) для SL-печати 3D-гелевого полимерного электролита для микролитиевых батарей недорогим и высокопроизводительным способом. Как показано на рисунке 7C, напечатанный зигзагообразный GPE может увеличить площадь контакта с электродами и улучшить ионную проводимость до 4,8 × 10 –3 S см –1 можно получить при температуре окружающей среды, сравнимой с температурой жидкого электролита. Зеколл и др. (2018) сообщили о CSE, напечатанных методом SL, содержащих 3D-биконтинуум Li 1,4 Al 0,4 Ge 1,6 (PO 4 ) 3 (LAGP) керамический электролит и изолирующий полимер (эпоксидный полимер, полипропилен) для Li 1,4 Al 0,4 Ge 1,6 металлическая батарея (рис. 7D). Этот метод может точно контролировать соотношение керамики и полимера, а также геометрию и размер разнообразных точных микроархитектур, таких как кубические, гироидальные, алмазные и биджелевые структуры. Гироидный LAGP-эпоксидный электролит имел ионную проводимость 1,6·10 –4 S см –1 , что было того же порядка, что и таблетка LAGP, в то время как печатный электролит продемонстрировал до 28% более высокую прочность на сжатие и до пяти раз большую прочность на изгиб. Недавняя работа, о которой сообщили Pesce et al. (2020) разработали самонесущие цельнокерамические электролиты из оксида циркония, стабилизированного 8 мол.% иттрия (YSZ), для твердооксидного топливного элемента (ТОТЭ), напечатанного SL (рис. 7E). Напечатанные плотные и без трещин электролиты 8YSZ достигли ионной проводимости до 3,0 × 10 –2 S см –1 при 800°С в плоской и гофрированной геометриях. Гофрированные электролиты YSZ с SL-печатью показали увеличение удельной мощности на 57% (410 мВт см –2 при 900°C) по сравнению с обычной технологией ТОТЭ, что в основном связано с геометрическими аспектами с высоким коэффициентом сжатия.
7D). Этот метод может точно контролировать соотношение керамики и полимера, а также геометрию и размер разнообразных точных микроархитектур, таких как кубические, гироидальные, алмазные и биджелевые структуры. Гироидный LAGP-эпоксидный электролит имел ионную проводимость 1,6·10 –4 S см –1 , что было того же порядка, что и таблетка LAGP, в то время как печатный электролит продемонстрировал до 28% более высокую прочность на сжатие и до пяти раз большую прочность на изгиб. Недавняя работа, о которой сообщили Pesce et al. (2020) разработали самонесущие цельнокерамические электролиты из оксида циркония, стабилизированного 8 мол.% иттрия (YSZ), для твердооксидного топливного элемента (ТОТЭ), напечатанного SL (рис. 7E). Напечатанные плотные и без трещин электролиты 8YSZ достигли ионной проводимости до 3,0 × 10 –2 S см –1 при 800°С в плоской и гофрированной геометриях. Гофрированные электролиты YSZ с SL-печатью показали увеличение удельной мощности на 57% (410 мВт см –2 при 900°C) по сравнению с обычной технологией ТОТЭ, что в основном связано с геометрическими аспектами с высоким коэффициентом сжатия. SL продемонстрировал многочисленные преимущества, такие как высокое разрешение печати (10–100 мкм) и качество поверхности. Кроме того, SL обладает большим потенциалом в подготовке SSE для многоразмерных батарей, особенно батарей микронного размера. Однако доступность фоточувствительных смол или полимеров-предшественников, пригодных для печати SL, ограничена и дорога (около 100 долларов США за кг для светочувствительных смол и дороже для прекурсоров), а для печати полых или выступающих структур требуются ручные опоры.
SL продемонстрировал многочисленные преимущества, такие как высокое разрешение печати (10–100 мкм) и качество поверхности. Кроме того, SL обладает большим потенциалом в подготовке SSE для многоразмерных батарей, особенно батарей микронного размера. Однако доступность фоточувствительных смол или полимеров-предшественников, пригодных для печати SL, ограничена и дорога (около 100 долларов США за кг для светочувствительных смол и дороже для прекурсоров), а для печати полых или выступающих структур требуются ручные опоры.
Цифровая обработка света
Цифровая обработка света (DLP) — это метод SL на основе маски, использующий цифровое микрозеркальное устройство (DMD) для проецирования световой маски, которая служит для затвердевания всего слоя за несколько секунд (Chartrain et al. , 2018). Механизм формирования и исходное сырье DLP аналогичны SL. Схема процесса DLP показана на рисунке 8A. В системе DLP DMD представляет собой массив из нескольких миллионов микроскопически маленьких зеркал на полупроводниковом чипе, и каждое зеркало представляет один или несколько пикселей в проецируемом изображении (Han et al. , 2019).). В этом случае разрешение печати DLP связано с количеством зеркал в DMD. Послойное затвердевание в DLP предлагает многочисленные преимущества по сравнению с процессом точечного сканирования SL: (i) время сборки значительно сокращается, поскольку оно в основном зависит от толщины слоя и времени воздействия, и (ii) остаточное напряжение образцов DLP невелика, так как при затвердевании слоя нет разницы между контуром и внутренней областью. Эти преимущества привлекли значительное внимание при изготовлении плотной керамики в различных областях, включая керамические электролиты для ТОТЭ.
, 2019).). В этом случае разрешение печати DLP связано с количеством зеркал в DMD. Послойное затвердевание в DLP предлагает многочисленные преимущества по сравнению с процессом точечного сканирования SL: (i) время сборки значительно сокращается, поскольку оно в основном зависит от толщины слоя и времени воздействия, и (ii) остаточное напряжение образцов DLP невелика, так как при затвердевании слоя нет разницы между контуром и внутренней областью. Эти преимущества привлекли значительное внимание при изготовлении плотной керамики в различных областях, включая керамические электролиты для ТОТЭ.
Рис. 8. Цифровая обработка света (DLP). (A) Схема процесса DLP. Воспроизведено из Luongo et al. (2020) с разрешения John Wiley & Sons-Books. DLP для полностью плотного электролита из оксида циркония, стабилизированного оксидом иттрия (8YSZ), 8 мол. % в твердооксидном топливном элементе (NiO-8YSZ/8YSZ/La 0,8 Sr 0,2 MnO 3 ): (B) СЭМ-изображения напечатанных ЯСЗ с разными углами; (C) СЭМ-изображения YSZ в форме ряби; (Д) Кривые плотности напряжения и мощности тока полных волнистых ячеек. Воспроизведено из Xing et al. (2020) с разрешения Elsevier Science & Technology Journals.
Воспроизведено из Xing et al. (2020) с разрешения Elsevier Science & Technology Journals.
Самая последняя работа по производству керамического электролита методом DLP была проведена Xing et al. (2020). Для повышения производительности ТОТЭ полностью плотный электролит YSZ с концентрацией 8 мол. % был разработан с волнообразной формой и подготовлен методом DLP с различными углами печати (0°, 15°, 30°, 45°) (рис. 8B, C). Этот печатный специальный электролит может увеличить поверхность раздела электрод-электролит примерно на 36 % и, таким образом, повысить удельную мощность примерно на 32 % при температуре испытания 800 °C и примерно на 37 % при температуре 700 °C по сравнению с эталонной плоской поверхностью. ячейка (рис. 8D). Эта работа продемонстрировала потенциал изготовления SSE с определенным рисунком с помощью DLP для изготовления ТОТЭ с улучшенными и предсказуемыми характеристиками. DLP имеет разрешение печати (10–100 мкм) и качество поверхности, сравнимое с SL, но значительно сокращает время сборки и меньшее остаточное напряжение, что позволяет производить высоконадежные SSE с высокой эффективностью. Тем не менее, дорогостоящие светочувствительные смолы/прекурсоры и ручные подложки по-прежнему являются проблемами, с которыми сталкивается DLP.
Тем не менее, дорогостоящие светочувствительные смолы/прекурсоры и ручные подложки по-прежнему являются проблемами, с которыми сталкивается DLP.
В последние годы было разработано несколько методов 3D-печати на основе литографии, таких как двухфотонная полимеризация (TPP) (Truby and Lewis, 2016), непрерывное производство жидкостного интерфейса (CLIP) (Tumbleston et al., 2015) и проекционная микростереолитография (PµSL) (Park et al., 2012), все они могут обеспечить сопоставимое или более высокое разрешение печати, чем 10–100 мкм (рис. 9). CLIP имеет разрешение печати 50~100 мкм, в то время как детали могут быть вытянуты из полимера за считанные минуты с помощью кислородопроницаемого окна (Tumbleston et al., 2015). PµSL может достигать разрешения печати 2~8,5 мкм, используя трехмерный DMD в градациях серого в качестве динамической маски и систему уменьшающих линз в качестве пространственного модулятора света (Sun et al., 2005). В частности, TPP позволяет создавать элементы размером менее 1 мкм за счет одновременного поглощения двух фотонов ближнего инфракрасного (780 нм) или зеленого (515 нм) лазера (Obata et al. , 2013). Этот метод 3D-печати на основе литографии имеет большой потенциал для изготовления SSE с мелкими деталями от сотен нанометров до микронов.
, 2013). Этот метод 3D-печати на основе литографии имеет большой потенциал для изготовления SSE с мелкими деталями от сотен нанометров до микронов.
Рисунок 9. Сравнение разрешения при печати методом 3D-печати на основе литографии [стереолитография (SL), цифровая обработка света (DLP), непрерывное создание жидкостного интерфейса (CLIP), проекционная микростереолитография (PµSL) и двухфотонная полимеризация ( ТЭС)]. SL воспроизведено из Jansen et al. (2009) с разрешения Американского химического общества. DLP воспроизведено из Lee et al. (2007) с разрешения Американского химического общества. CLIP воспроизведено из Tumbleston et al. (2015) с разрешения Американской ассоциации содействия развитию науки. PµSL воспроизведено из Lee et al. (2008) с разрешения John Wiley & Sons-Books. TPP воспроизведено из Obata et al. (2013) по лицензии Creative Commons.
Заключение и перспективы
В этом обзоре мы сначала обсудили общие процессы и ограничения традиционных методов производства SSE. Затем, посредством всестороннего обзора двух больших групп методов 3D-печати, основанных либо на DW, либо на SL, мы указали на преимущества новых методов 3D-печати по сравнению с традиционными методами производства SSE с точки зрения строительных механизмов, выбора исходного сырья, сборки. конверт, разрешение печати и применение (наноразмерные, гибкие и крупномасштабные аккумуляторные сетки). Мы подчеркнули перспективы и осуществимость производства SSE с использованием 3D-печати на основе литографии для преодоления технических барьеров и улучшения совместимости твердотельных интерфейсов. Наконец, мы обсудили несколько существующих проблем, связанных с процессом 3D-печати, и соответствующие будущие перспективы для более эффективного решения этих проблем, стремясь предоставить рекомендации, которые будут способствовать развитию методов 3D-печати, более тесно ориентированных на производство аккумуляторов. В целом, за эволюцией аккумуляторов устойчивой движущей силой всегда были постоянно совершенствующиеся и совершенствующиеся технологии производства.
Затем, посредством всестороннего обзора двух больших групп методов 3D-печати, основанных либо на DW, либо на SL, мы указали на преимущества новых методов 3D-печати по сравнению с традиционными методами производства SSE с точки зрения строительных механизмов, выбора исходного сырья, сборки. конверт, разрешение печати и применение (наноразмерные, гибкие и крупномасштабные аккумуляторные сетки). Мы подчеркнули перспективы и осуществимость производства SSE с использованием 3D-печати на основе литографии для преодоления технических барьеров и улучшения совместимости твердотельных интерфейсов. Наконец, мы обсудили несколько существующих проблем, связанных с процессом 3D-печати, и соответствующие будущие перспективы для более эффективного решения этих проблем, стремясь предоставить рекомендации, которые будут способствовать развитию методов 3D-печати, более тесно ориентированных на производство аккумуляторов. В целом, за эволюцией аккумуляторов устойчивой движущей силой всегда были постоянно совершенствующиеся и совершенствующиеся технологии производства.
Учитывая преимущества высокого разрешения печати, гибкой подготовки очень сложных структур и широкого выбора исходного сырья, технология 3D-печати продемонстрировала свой большой потенциал для производства SSE различных типов и форм-факторов. Тем не менее, все еще есть несколько проблем, которые необходимо решить следующим образом: (i) проблемы в производстве чувствительных к воздуху/влаге SSE. В большинстве методов 3D-печати используется сырье в виде жидкости или чернил, таких как DIW, IJP и AJP, (ii) ограничения производства с высоким разрешением (вплоть до наномасштаба). Например, nano-LIB для биомедицинских приложений и нанометровые SSE в форме гребня для снижения внутреннего сопротивления, (iii) проблемы производства SSE для приложений в масштабе сетки. Например, ТОТЭ и крупномасштабные аккумуляторные сети для хранения возобновляемой энергии, а также (iv) потенциальные проблемы последующей обработки для ИСЭ. Например, напряжение, трещины, летучесть лития и побочные реакции легко возникают в результате длительных затрат времени (удаление связующего или спекание) (Nyman et al. , 2010; Pfenninger et al., 2019).). Для решения вышеуказанных проблем настоятельно рекомендуется предпринять дальнейшие усилия в следующих аспектах: (i) интегрировать технологию 3D-печати и традиционное производство аккумуляторов для содействия разработке полностью твердотельных аккумуляторов с высокой плотностью энергии, (ii) увеличить разрешение печати вплоть до нанометров с помощью новых нанотехнологий, (iii) разработать принтеры промышленного уровня или платформу конвейерной печати для производства SSE для приложений в масштабе сетки и (iv) объединить некоторые инновационные технологии спекания, совместимые со сложными деталями, напечатанными на 3D-принтере.
, 2010; Pfenninger et al., 2019).). Для решения вышеуказанных проблем настоятельно рекомендуется предпринять дальнейшие усилия в следующих аспектах: (i) интегрировать технологию 3D-печати и традиционное производство аккумуляторов для содействия разработке полностью твердотельных аккумуляторов с высокой плотностью энергии, (ii) увеличить разрешение печати вплоть до нанометров с помощью новых нанотехнологий, (iii) разработать принтеры промышленного уровня или платформу конвейерной печати для производства SSE для приложений в масштабе сетки и (iv) объединить некоторые инновационные технологии спекания, совместимые со сложными деталями, напечатанными на 3D-принтере.
Этот обзор продемонстрировал возможность изготовления SSE с помощью 3D-печати, но требуются дополнительные усилия, чтобы полностью преодолеть разрыв между текущими технологическими возможностями и будущими производственными требованиями. Хотя 3D-печать предлагает беспрецедентную гибкость в настройке структурной размерности и сложности SSE по сравнению с традиционными методами, ее не следует ошибочно принимать за всемогущее решение многих внутренних препятствий в производстве аккумуляторов. Чтобы реализовать больший потенциал применения 3D-печати в производстве аккумуляторов, требуются междисциплинарные совместные усилия. С точки зрения материаловедения необходимы дальнейшие экспериментальные и вычислительные исследования для систематического изучения взаимосвязей SSE состав-структура-свойство. Это должно способствовать выполнению более высоких плотностей тока и лучшей механической/химической стабильности элемента батареи. Углубляясь в механизмы реакции с электрохимической точки зрения, можно исследовать и оптимизировать кинетику переноса ионов на границе раздела электрод/электролит, чтобы повысить эффективность переноса проводящего иона. Благодаря более комплексному дизайну в машиностроении можно было бы интегрировать специальные приспособления для чувствительных к воздуху / влаге образцов в существующие инструментальные установки 3D-печати, чтобы обеспечить более широкий выбор материалов. В целом, технология 3D-печати использует многие преимущества традиционных методов производства на протяжении многих лет.
Чтобы реализовать больший потенциал применения 3D-печати в производстве аккумуляторов, требуются междисциплинарные совместные усилия. С точки зрения материаловедения необходимы дальнейшие экспериментальные и вычислительные исследования для систематического изучения взаимосвязей SSE состав-структура-свойство. Это должно способствовать выполнению более высоких плотностей тока и лучшей механической/химической стабильности элемента батареи. Углубляясь в механизмы реакции с электрохимической точки зрения, можно исследовать и оптимизировать кинетику переноса ионов на границе раздела электрод/электролит, чтобы повысить эффективность переноса проводящего иона. Благодаря более комплексному дизайну в машиностроении можно было бы интегрировать специальные приспособления для чувствительных к воздуху / влаге образцов в существующие инструментальные установки 3D-печати, чтобы обеспечить более широкий выбор материалов. В целом, технология 3D-печати использует многие преимущества традиционных методов производства на протяжении многих лет. Благодаря совместным усилиям междисциплинарных исследований 3D-печать с оптимизмом смотрит на то, что вскоре она полностью реализует свой потенциал в производстве SSE. Мы считаем, что широкое внедрение технологий 3D-печати должно быть сосредоточено не только на производственном процессе, но и на вдохновении таких дисциплин, как химия поверхности, материаловедение и машиностроение. Например, ограниченная доступность и высокая стоимость пригодных для печати светочувствительных смол или полимеров-предшественников (выше 100 долларов за килограмм) для SL заставит нас разработать новые материалы для печати SL с низкой стоимостью и широкой совместимостью материалов. Плохая совместимость интерфейса твердого тела/твердого интерфейса подтолкнет нас к изучению модификации поверхности и структурного дизайна SSE с сильным взаимодействием между частицами и низким импедансом интерфейса. Кроме того, некоторые особые требования (такие как инертная атмосфера и сухая среда) заставят нас разработать специальную технологию 3D-печати для производства аккумуляторов.
Благодаря совместным усилиям междисциплинарных исследований 3D-печать с оптимизмом смотрит на то, что вскоре она полностью реализует свой потенциал в производстве SSE. Мы считаем, что широкое внедрение технологий 3D-печати должно быть сосредоточено не только на производственном процессе, но и на вдохновении таких дисциплин, как химия поверхности, материаловедение и машиностроение. Например, ограниченная доступность и высокая стоимость пригодных для печати светочувствительных смол или полимеров-предшественников (выше 100 долларов за килограмм) для SL заставит нас разработать новые материалы для печати SL с низкой стоимостью и широкой совместимостью материалов. Плохая совместимость интерфейса твердого тела/твердого интерфейса подтолкнет нас к изучению модификации поверхности и структурного дизайна SSE с сильным взаимодействием между частицами и низким импедансом интерфейса. Кроме того, некоторые особые требования (такие как инертная атмосфера и сухая среда) заставят нас разработать специальную технологию 3D-печати для производства аккумуляторов. Таким образом, применение SSE 3D-печати в будущем требует совместной разработки нескольких дисциплин, таких как химия поверхности, материаловедение и машиностроение.
Таким образом, применение SSE 3D-печати в будущем требует совместной разработки нескольких дисциплин, таких как химия поверхности, материаловедение и машиностроение.
Вклад авторов
FS и YS: концепция или дизайн работы и критический пересмотр статьи. AC и CQ: написание статьи. Все авторы внесли свой вклад в статью и одобрили представленную версию.
Финансирование
FS выражает признательность Департаменту энергетики и разработки месторождений полезных ископаемых Университета штата Пенсильвания за поддержку стартового фонда.
Конфликт интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Сокращения
2D, двумерный; AJP, аэрозольная струйная печать; CLIP, непрерывное производство интерфейса жидкости; CSE, композитные твердые электролиты; DIW, прямое письмо тушью; DLP, цифровая обработка света; DMD, цифровое микрозеркальное устройство; DW, прямое письмо; FDM, моделирование наплавленных отложений; GO, оксид графена; IJP, струйная печать; ISE, неорганический твердый электролит; LAGP, Li 1,4 Al 0,4 Ge 1,6 (PO 4 ) 3 ; LFP, LiFePO 4 ; LIB, литий-ионные аккумуляторы; LLZ, Li 7 La 3 Zr 2 O 12 ; LTO, Li 4 Ti 5 O 12 ; P µ SL — проекционная микростереолитография; PLA, полимолочная кислота; СЛ, стереолитография; SOFC, твердооксидный топливный элемент; ТФЭ – твердый полимерный электролит; SSE, твердотельный электролит; ТФП, двухфотонная полимеризация; УФ, ультрафиолет; YSZ, цирконий, стабилизированный оксидом иттрия.
Ссылки
Abetti, PA (1952). Письма Алессандро Вольта. Электр. англ. 71, 773–776. doi: 10.1109/ee.1952.6437680
Полный текст CrossRef | Google Scholar
Амброси А. и Пумера М. (2016). Технологии 3D-печати для электрохимических приложений. Хим. соц. Ред. 45, 2740–2755. doi: 10.1039/c5cs00714c
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Appetecchi, G.B., Alessandrini, F., Carewska, M., Caruso, T., Prosini, P.P., Scaccia, S., et al. (2001). Исследование аккумуляторов с литий-полимерным электролитом. Дж. Источники питания 97, 790–794.
Google Scholar
Беллини, А., и Гючери, С. (2003). Механические характеристики деталей, изготовленных с использованием моделирования наплавления. Быстрый прототип. J. 9, 252–264. doi: 10.1108/13552540310489631
CrossRef Полный текст | Google Scholar
Блейк А. Дж., Колмейер Р. Р., Хардин Дж. О., Кармона Э. А., Маруяма Б. , Берриган Дж. Д. и др. (2017). Керамо-полимерные электролиты для 3D-печати для гибких высокопроизводительных литий-ионных аккумуляторов с повышенной термостойкостью. Доп. Энергия Матер. 7:1602920. doi: 10.1002/aenm.201602920
, Берриган Дж. Д. и др. (2017). Керамо-полимерные электролиты для 3D-печати для гибких высокопроизводительных литий-ионных аккумуляторов с повышенной термостойкостью. Доп. Энергия Матер. 7:1602920. doi: 10.1002/aenm.201602920
Полный текст CrossRef | Google Scholar
Бланга Р., Бурштейн Л., Берман М., Гринбаум С. Г. и Голодницкий Д. (2015). Твердый полимерно-керамический электролит, образованный методом электрофоретического осаждения. Дж. Электрохим. соц. 162, Д3084–Д3089.
Google Scholar
Браам, К. Т., Фолькман, С. К., и Субраманиан, В. (2012). Характеристика и оптимизация печатной первичной серебряно-цинковой батареи. Дж. Источники питания 199, 367–372. doi: 10.1016/j.jpowsour.2011.09.076
CrossRef Полный текст | Google Scholar
Бухманн, И. (2001). Аккумуляторы в портативном мире: Справочник по аккумуляторным батареям для не инженеров . Ричмонд: Cadex Electronics.
Google Scholar
Карли, М. Д., Касо, М. Ф., Аврора, А., Сета, Л. Д., и Просини, П. П. (2019). «Электроспиннинговые нановолокна как сепараторы для литий-ионных аккумуляторов», в: Материалы 15-й Международной конференции по концентраторным фотоэлектрическим системам (CPV-15) Мелвилл, Нью-Йорк.
Д., Касо, М. Ф., Аврора, А., Сета, Л. Д., и Просини, П. П. (2019). «Электроспиннинговые нановолокна как сепараторы для литий-ионных аккумуляторов», в: Материалы 15-й Международной конференции по концентраторным фотоэлектрическим системам (CPV-15) Мелвилл, Нью-Йорк.
Google Scholar
Кавальер С., Субианто С., Савич И., Джонс Д. Дж., Розьер Дж. Дж. Э. и Наука Э. (2011). Электропрядение: разработанные архитектуры для устройств преобразования и хранения энергии. Энергетика Окружающая среда. науч. 4, 4761–4785. doi: 10.1039/c1ee02201f
Полный текст CrossRef | Google Scholar
Чанг П., Мэй Х., Чжоу С., Дассиос К.Г. и Ченг Л. (2019). 3D-печатные электрохимические накопители энергии. Дж. Матер. хим. А 7, 4230–4258. doi: 10.1039/c8ta11860d
Полный текст CrossRef | Google Scholar
Чартрейн, Н. А., Уильямс, К. Б., и Уиттингтон, А. Р. (2018). Обзор изготовления тканевых каркасов с использованием фотополимеризации в ваннах. Акта Биоматер. 74, 90–111. doi: 10.1016/j.actbio.2018.05.010
74, 90–111. doi: 10.1016/j.actbio.2018.05.010
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Чен А.-Н., Ли М., Ву Дж.-М., Ченг Л.-Дж., Лю Р.-З., Ши Ю.-С. и др. др. (2019). Механизм улучшения механических характеристик высокопористой муллитовой керамики с бимодальной структурой пор, полученной методом селективного лазерного спекания. J. Alloys Compd. 776, 486–494. doi: 10.1016/j.jallcom.2018.10.337
Полный текст CrossRef | Google Scholar
Чен А.-Н., Ли М., Сюй Дж., Лу С.-Х., Ву Дж.-М., Ченг Л.-Дж. и др. (2018). Высокопористые муллитовые керамические пены, полученные методом селективного лазерного спекания с использованием полых сфер из летучей золы в качестве сырья. Дж. Евро. Керам. соц. 38, 4553–4559. doi: 10.1016/j.jeurceramsoc.2018.05.031
CrossRef Полный текст | Google Scholar
Чен А.-Н., Ву Дж.-М., Ченг Л.-Дж., Лю С.-Дж., Ма, Ю.-С., Ли Х. и др. др. (2020). Повышенное уплотнение и диэлектрические свойства керамики CaTiO3-0,3NdAlO3, полученной методом прямого коагуляционного литья. Дж. Евро. Керам. соц. 40, 1174–1180. doi: 10.1016/j.jeurceramsoc.2019.12.033
Дж. Евро. Керам. соц. 40, 1174–1180. doi: 10.1016/j.jeurceramsoc.2019.12.033
CrossRef Полный текст | Google Scholar
Чен А.-Н., Ву Дж.-М., Лю К., Чен Дж.-Ю., Сяо Х., Чен П. и др. (2017). Высококачественные керамические детали сложной формы, полученные методом селективного лазерного спекания: обзор. Доп. заявл. Керам. 117, 100–117. doi: 10.1080/17436753.2017.1379586
CrossRef Полный текст | Google Scholar
Чен, К., Ю, Т., Ян, М., Чжао, X. и Шен, X. (2019). Полностью твердотельная перезаряжаемая хлорид-ионная батарея. Доп. науч. 6:1802130. doi: 10.1002/advs.201802130
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Чен К., Сюй Р., Хе З., Чжао К. и Пан Л. (2017). Трехмерная печать гелевого полимерного электролита в литий-ионной микробатарее с использованием стереолитографии. Дж. Электрохим. соц. 164, А1852–А1857.
Google Scholar
Chen, W., Lei, T., Wu, C., Deng, M., Gong, C. , Hu, K., et al. (2018). Разработка безопасных электролитных систем для высокостабильной литий-серной батареи. Доп. Энергия Матер. 8:1702348. doi: 10.1002/aenm.201702348
, Hu, K., et al. (2018). Разработка безопасных электролитных систем для высокостабильной литий-серной батареи. Доп. Энергия Матер. 8:1702348. doi: 10.1002/aenm.201702348
Полный текст CrossRef | Google Scholar
Чен Ю., Чжо С., Ли З. и Ван К. (2020). Окислительно-восстановительные полимеры для перезаряжаемых металлоионных аккумуляторов. EnergyChem 2:100030. doi: 10.1016/j.enchem.2020.100030
Полный текст CrossRef | Google Scholar
Чен З., Ли З., Ли Дж., Лю К., Лао К., Фу Ю. и др. (2019). 3D-печать керамики: обзор. Дж. Евро. Керам. соц. 39, 661–687.
Google Scholar
Ченг М., Дейванаягам Р. и Шахбазян-Яссар Р. (2020). 3D-печать электрохимических накопителей энергии: обзор методов печати и архитектур электродов/электролитов. Тесто. Суперкапс 3, 130–146. doi: 10.1002/batt.201
0 CrossRef Full Text | Google Scholar
Ченг М., Цзян Ю., Яо В., Юань Ю., Дейванаягам Р., Форузан Т. и др. (2018). 3D-печать гибридного твердотельного электролита для литий-ионных аккумуляторов при повышенной температуре. Доп. Матер. 30:e1800615.
Доп. Матер. 30:e1800615.
Google Scholar
Чой, Ю. Э., Парк, К. Х., Ким, Д. Х., О, Д. Ю., Квак, Х. Р., Ли, Ю. Г., и др. (2017). Твердые электролиты Li4SnS4 с покрытием, приготовленные из водных растворов для полностью твердотельных литий-ионных аккумуляторов. ChemSusChem 10, 2605–2611. doi: 10.1002/cssc.201700409
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Коммарье, Б., Паолелла, А., Дайгл, Дж.-К., и Загиб, К. (2018). К высокой проводимости лития в твердополимерных и полимерно-керамических батареях. Курс. мнение Электрохим. 9, 56–63. doi: 10.1016/j.coelec.2018.03.033
Полный текст CrossRef | Google Scholar
Куссо Ж.-Ф., Сирет К., Бьенсан П. и Бруссли М. (2006). Последние разработки в области литий-ионных призматических элементов. Дж. Источники питания 162, 790–796. doi: 10.1016/j.jpowsour.2005.02.095
CrossRef Полный текст | Google Scholar
Дейнер Л.Дж., Дженкинс Т. , Хауэлл Т. и Роттмайер М. (2019). Полимерные композиционные электролиты аэрозольной печати для твердотельных литий-ионных аккумуляторов. Доп. англ. Матер. 21:1
, Хауэлл Т. и Роттмайер М. (2019). Полимерные композиционные электролиты аэрозольной печати для твердотельных литий-ионных аккумуляторов. Доп. англ. Матер. 21:1
2. doi: 10.1002/adem.201 2 CrossRef Full Text | Google Scholar
Деланнуа, П. Э., Риу, Б., Лестрие, Б., Гиомар, Д., Брусс, Т., и Ле Бидо, Дж. (2015). На пути к быстрой и экономичной струйной печати с твердым электролитом для литиевых микробатарей. Дж. Источники питания 274, 1085–1090. doi: 10.1016/j.jpowsour.2014.10.164
CrossRef Полный текст | Google Scholar
Дэн З., Цзян Х., Ху Ю., Лю Ю., Чжан Л., Лю Х. и др. (2017). Трехмерная упорядоченная макропористая наноструктура MoS2@ C для гибких литий-ионных аккумуляторов. Доп. Матер. 29:1603020. doi: 10.1002/adma.201603020
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Дерби, Б. (2010). Струйная печать функциональных и конструкционных материалов: требования к свойствам жидкости, стабильность характеристик и разрешение. год. Преподобный Матер. Рез. 40, 395–414. doi: 10.1146/annurev-matsci-070909-104502
год. Преподобный Матер. Рез. 40, 395–414. doi: 10.1146/annurev-matsci-070909-104502
Полный текст CrossRef | Google Scholar
Диуф Б. и Поде Р. (2015). Возможности литий-ионных аккумуляторов в возобновляемой энергетике. Продлить. Энергия 76, 375–380. doi: 10.1016/j.renene.2014.11.058
CrossRef Полный текст | Google Scholar
Дирикан, М., Ян, К., Чжу, П. и Чжан, X. (2019). Композитные твердые электролиты для полностью твердотельных литиевых аккумуляторов. Матер. науч. англ. R Rep. 136, 27–46.
Google Scholar
Доброжан О., Пшеничный Р., Воробьев С., Курбатов Д., Команицкий В. и Опанасюк А. (2020). Влияние термического отжига на морфологические и структурные свойства пленок ZnO, нанесенных на полиимидные подложки методом струйной печати. SN Заяв. науч. 2:365.
Google Scholar
Du, C.-F., Liang, Q., Luo, Y., Zheng, Y., and Yan, Q. (2017). Последние достижения в области вторичных батарей, пригодных для печати. Дж. Матер. хим. А 5, 22442–22458. doi: 10.1039/c7ta07856k
Дж. Матер. хим. А 5, 22442–22458. doi: 10.1039/c7ta07856k
Полный текст CrossRef | Google Scholar
Дадни, Нью-Джерси (2008). Тонкопленочные микробатареи. Электрохим. соц. Интерфейс 17, 44–48.
Google Scholar
Данн Б., Фаррингтон Г. К. и Кац Б. (1994). Золь-гель подходы для твердых электролитов и электродных материалов. Твердотельный ион. 70, 3–10. doi: 10.1016/0167-2738(94)-x
CrossRef Full Text | Google Scholar
Экель, З. К., Чжоу, К., Мартин, Дж. Х., Якобсен, А. Дж., Картер, В. Б., и Шедлер, Т. А. Дж. С. (2016). Аддитивное производство керамики на основе полимеров. Наука 351, 58–62. doi: 10.1126/science.aad2688
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Фергус, Дж. В. (2010). Керамические и полимерные твердые электролиты для литий-ионных аккумуляторов. J. Источники питания 195, 4554–4569. doi: 10.1016/j.jpowsour.2010.01.076
CrossRef Полный текст | Google Scholar
Фрэнкс Г. В., Таллон К., Стударт А. Р., Сессо М. Л. и Лео С. (2017). Коллоидная обработка: создание керамики сложной формы с уникальными многоуровневыми структурами. Дж. Ам. Керам. соц. 100, 458–490. doi: 10.1111/jace.14705
В., Таллон К., Стударт А. Р., Сессо М. Л. и Лео С. (2017). Коллоидная обработка: создание керамики сложной формы с уникальными многоуровневыми структурами. Дж. Ам. Керам. соц. 100, 458–490. doi: 10.1111/jace.14705
Полный текст CrossRef | Академия Google
Fritzler, K.B., and Prinz, V.Y.J.P.U. (2017). Методы 3D-печати микро- и наноструктур. Физ. Успехи. 62, 54–69. doi: 10.3367/ufne.2017.11.038239
CrossRef Полный текст | Google Scholar
Fu, K., Wang, Y., Yan, C., Yao, Y., Chen, Y., Dai, J., et al. (2016). Электродные чернила на основе оксида графена для 3D-печати литий-ионных аккумуляторов. Доп. Матер. 28, 2587–2594. doi: 10.1002/adma.201505391
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Фудзимото Д., Кувата Н., Мацуда Ю., Кавамура Дж. и Канг Ф. (2015). Изготовление твердотельных тонкопленочных батарей с использованием тонких пленок LiMnPO 4 , нанесенных методом импульсного лазерного осаждения. Тонкие твердые пленки 579, 81–88. doi: 10.1016/j.tsf.2015.02.041
Тонкие твердые пленки 579, 81–88. doi: 10.1016/j.tsf.2015.02.041
CrossRef Полный текст | Google Scholar
Фурукава Н., Иноуэ К. и Мураками С. (1984). Щелочная батарея. Патенты Google.
Google Scholar
Гельфонд Н. В., Бобренок О. Ф., Предтеченский М. Р., Морозова Н. Б., Жерикова К. В., Игуменов И. К. (2009). Химическое осаждение из газовой фазы электролитных тонких пленок на основе диоксида циркония, стабилизированного оксидом иттрия. Неорг. Матер. 45, 659–665.
Google Scholar
Гуденаф, Дж. Б., и Сингх, П. (2015). Обзор — твердые электролиты в перезаряжаемых гальванических элементах. Дж. Электрохим. соц. 162, А2387–А2392.
Google Scholar
Greatbatch, W. and Holmes, C.F. (1991). История имплантируемых устройств. IEEE англ. Мед. биол. Маг. 10, 38–41.
Google Scholar
Гросс Б. К., Эркал Дж. Л., Локвуд С. Ю., Чен К. и Спенс Д. М. Дж. А. К. (2014). Оценка 3D-печати и ее потенциального влияния на биотехнологии и химические науки. 86, 3240–3253. doi: 10.1021/ac403397r
86, 3240–3253. doi: 10.1021/ac403397r
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Хафнер С., Гатри Х., Ли С.-Х. и Бан К. (2019). Синхронизированный метод электропрядения и электрораспыления для производства полностью твердотельных литий-ионных аккумуляторов. Дж. Источники питания 431, 17–24. doi: 10.1016/j.jpowsour.2019.05.008
Полный текст CrossRef | Google Scholar
Хан Т., Кунду С., Наг А. и Сюй Ю. (2019). 3D-печатные датчики для биомедицинских приложений: обзор. Датчики 19:1706. doi: 10.3390/s1
06
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Хаяши А., Отомо Т., Мизуно Ф., Таданага К. и Тацумисаго М. (2003). Полностью твердотельные Li/S аккумуляторы с высокопроводящими стеклокерамическими электролитами. Электрохим. коммун. 5, 701–705. doi: 10.1016/s1388-2481(03)00167-x
CrossRef Full Text | Google Scholar
Хаяши А., Ямасита Х., Тацумисаго М. и Минами Т. (2002). Характеристика аморфных твердых электролитов Li2S–SiS2–LixMOy (M = Si, P, Ge), полученных закалкой расплава и механическим измельчением. Твердотельный ион. 148, 381–389. doi: 10.1016/s0167-2738(02)00077-2
и Минами Т. (2002). Характеристика аморфных твердых электролитов Li2S–SiS2–LixMOy (M = Si, P, Ge), полученных закалкой расплава и механическим измельчением. Твердотельный ион. 148, 381–389. doi: 10.1016/s0167-2738(02)00077-2
Полный текст CrossRef | Google Scholar
Хе, П., Чен, К., Ян, М., Сюй, X., Чжоу, Л., Май, Л., и др. (2019). Создание более совершенных цинк-ионных аккумуляторов: материальная перспектива. EnergyChem 1:100022. doi: 10.1016/j.enchem.2019.100022
Полный текст CrossRef | Google Scholar
Хенч, Л.Л., и Уэст, Дж.К. (1990). Золь-гель процесс. Хим. Ред. 90, 33–72.
Google Scholar
Хитц, Г. Т., Макоуэн, Д. В., Чжан, Л., Ма, З., Фу, З., Вен, Ю., и др. (2019). Высокоскоростное циклирование лития в масштабируемой трехслойной архитектуре литий-гранат-электролит. Матер. Сегодня 22, 50–57. doi: 10.1016/j.mattod.2018.04.004
Полный текст CrossRef | Google Scholar
Хо, К.С., Эванс, Дж. В., и Райт, П.К. (2010). Диспенсерная печать цинковой микробатареи с ионным жидким гелевым электролитом. Дж. Микромех. Микроангл. 20:104009. doi: 10.1088/0960-1317/20/10/104009
В., и Райт, П.К. (2010). Диспенсерная печать цинковой микробатареи с ионным жидким гелевым электролитом. Дж. Микромех. Микроангл. 20:104009. doi: 10.1088/0960-1317/20/10/104009
Полный текст CrossRef | Google Scholar
Хоуи Дж. М., Лутфурахманов А., Шульц Д. Л. и Ахатов И. С. (2012). Обзор прямой записи на основе аэрозолей и ее приложений для микроэлектроники. Ж. Нанотехнолог. 2012, 1–22. doi: 10.1155/2012/324380
Полный текст CrossRef | Google Scholar
Jansen, J., Melchels, F. P. W., Grijpma, D. W. and Feijen, J. J. B. (2009). Поли(D,L-лактид)/N-винил-2-пирролидон смолы, функционализированные моноэтиловым эфиром фумаровой кислоты, для изготовления матриксов для тканевой инженерии методом стереолитографии. Биомакромолекулы 10, 214–220. doi: 10.1021/bm801001r
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Цзян З., Ван С., Чен С., Ян В., Яо С., Ху С. и др. (2020). Ленточное литье керамических электролитных пленок Li0,34La0,56TiO3 обеспечивает высокую плотность энергии литий-металлических аккумуляторов. Доп. Матер. 32:1
Доп. Матер. 32:1
1. doi: 10.1002/adma.201 1 PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Йоханнессен Э. А., Ван Л., Вайс К., Камминг Д. Р. и Купер Дж. М. (2006). Биосовместимость датчика «лаборатория на таблетке» в искусственных средах желудочно-кишечного тракта. IEEE Trans. Биомед. англ. 53, 2333–2340. doi: 10.1109/tbme.2006.883698
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Judez, X., Zhang, H., Li, C., Eshetu, G.G., Gonzalez-Marcos, J.A., Armand, M., et al. (2017). Обзор — твердые электролиты для безопасных литий-серных аккумуляторов с высокой плотностью энергии: перспективы и проблемы. Дж. Электрохим. соц. 165, А6008–А6016.
Google Scholar
Jung, G.B., Huang, T., Huang, MH, and Chang, C.L.J.J.O.M.S. (2001). Получение оксида церия, легированного самарием, для электролита твердооксидного топливного элемента модифицированным золь-гель методом. Дж. Матер. науч. 36, 5839–5844.
Дж. Матер. науч. 36, 5839–5844.
Google Scholar
Ким Дж. Г., Сон Б., Мукерджи С., Шупперт Н., Бейтс А., Квон О. и др. (2015). Обзор твердотельных аккумуляторов на литиевой и нелитиевой основе. Дж. Источники питания 282, 299–322.
Google Scholar
Ким С. Х., Чой К. Х., Чо С. Дж., Чой С., Парк С. и Ли С. Ю. (2015). Готовые к печати твердотельные литий-ионные аккумуляторы: новый путь к источникам питания с изменяемой формой и эстетической универсальностью для гибкой электроники. Нано Летт. 15, 5168–5177. doi: 10.1021/acs.nanolett.5b01394
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Клиппштейн Х., Диас Де Серио Санчес А., Хассанин Х., Цвейри Ю. и Сеневиратне Л. (2018). Моделирование наплавленного осаждения для беспилотных летательных аппаратов (БПЛА): обзор. Доп. англ. Матер. 20:1700552. doi: 10.1002/adem.201700552
Полный текст CrossRef | Google Scholar
Котобуки М., Коиси М. и Като Ю. (2013). Получение твердого электролита Li1.5Al0.5Ti1.5(PO4)3 методом соосаждения. Ионика 19, 1945–1948. doi: 10.1007/s11581-013-1000-4
и Като Ю. (2013). Получение твердого электролита Li1.5Al0.5Ti1.5(PO4)3 методом соосаждения. Ионика 19, 1945–1948. doi: 10.1007/s11581-013-1000-4
Полный текст CrossRef | Google Scholar
Курцвейл, П. (2010). Гастон Планте и его изобретение свинцово-кислотной батареи — происхождение первой практичной перезаряжаемой батареи. J. Источники питания 195, 4424–4434. doi: 10.1016/j.jpowsour.2009.12.126
CrossRef Полный текст | Google Scholar
Лау Дж., Деблок Р. Х., Баттс Д. М., Эшби Д. С., Чой К. С. и Данн Б. С. (2018). Сульфидные твердые электролиты для литиевых батарей. Доп. Энергия Матер. 8:1800933. doi: 10.1002/aenm.201800933
Полный текст CrossRef | Google Scholar
Ли, Дж. В., Лан, П. X., Ким, Б., Лим, Г., и Чо, Д. В. (2008). Изготовление и анализ характеристик каркаса из поли(пропиленфумарата) с использованием технологии микростереолитографии. Дж. Биомед. Матер. Рез. Б заявл. Биоматер. 87, 1–9. doi: 10.1002/jbm. b.31057
b.31057
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Lee, K.W., Wang, S., Fox, B.C., Ritman, E.L., Yaszemski, M.J., and Lu, L.J.B. (2007). Изготовление каркаса для инженерии костной ткани из поли(пропиленфумарата) с использованием стереолитографии: влияние составов смол и параметров лазера. Биомакромолекулы 8, 1077–1084. doi: 10.1021/bm060834v
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Лейонмарк С., Корнелл А., Линдберг Г. и Вогберг Л. (2013). Гибкие литий-ионные аккумуляторные элементы из одной бумаги в процессе производства бумаги на основе нанофибриллированной целлюлозы. Дж. Матер. хим. А 1, 4671–4677. doi: 10.1039/c3ta01532g
Полный текст CrossRef | Google Scholar
Летиен К., Зегауи М., Руссель П., Тилмант П., Роллан Н. и Роллан П. А. (2011). Микроструктура материала LiPON и литий-железо-фосфата, нанесенного на массив кремниевых наностолбиков для литий-ионной твердотельной трехмерной микробатареи. Микроэлектрон. англ. 88, 3172–3177. doi: 10.1016/j.mee.2011.06.022
Микроэлектрон. англ. 88, 3172–3177. doi: 10.1016/j.mee.2011.06.022
Полный текст CrossRef | Google Scholar
Льюис, Дж. А. (2004). Коллоидная обработка керамики. Дж. Ам. Керам. соц. 83, 2341–2359.
Google Scholar
Li, B., Gu, P., Feng, Y., Zhang, G., Huang, K., Xue, H., et al. (2017). Ультратонкие двумерные нанолисты из фосфата никеля и кобальта для электрохимического накопления энергии в водном/твердотельном электролите. Доп. Функц. Матер. 27:1605784. doi: 10.1002/adfm.201605784
Полный текст CrossRef | Google Scholar
Li, C., Liu, Y., Li, B., Zhang, F., Cheng, Z., He, P., et al. (2019). Интегрированный твердый электролит с пористым катодом путем легкого одноэтапного спекания для полностью твердотельной батареи Li-O2. Нанотехнологии 30:364003. doi: 10.1088/1361-6528/ab226f
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Li, M., Chen, A.-N., Lin, X., Wu, J.-M., Chen, S. , Cheng, L.-J., et al. (2019). Легкая муллитовая керамика с контролируемой пористостью и улучшенными свойствами, полученная методом SLS с использованием механически смешанных композитов FAHS/полиамид12. Керам. Междунар. 45, 20803–20809. doi: 10.1016/j.ceramint.2019.07.067
, Cheng, L.-J., et al. (2019). Легкая муллитовая керамика с контролируемой пористостью и улучшенными свойствами, полученная методом SLS с использованием механически смешанных композитов FAHS/полиамид12. Керам. Междунар. 45, 20803–20809. doi: 10.1016/j.ceramint.2019.07.067
CrossRef Полный текст | Google Scholar
Li, S., Zhang, S.Q., Shen, L., Liu, Q., Ma, J.B., Lv, W., et al. (2020). Развитие и перспективы керамических/полимерных композиционных твердых электролитов для литиевых аккумуляторов. Доп. науч. 7:1
8. Google Scholar
Ли В., Чен Л., Сунь Ю., Ван К., Ван Ю. и Ся Ю. (2017). Полностью твердотельная вторичная литиевая батарея с твердым полимерным электролитом и антрахиноновым катодом. Твердотельный ион. 300, 114–119. doi: 10.1016/j.ssi.2016.12.013
Полный текст CrossRef | Google Scholar
Li X., Zhang Z., Yin K., Yang L., Tachibana K. и Hirano S.-I. (2015). Квазитвердые электролиты мезопористый кремнезем/ионная жидкость и их применение в литий-металлических батареях. Дж. Источники питания 278, 128–132. doi: 10.1016/j.jpowsour.2014.12.053
Дж. Источники питания 278, 128–132. doi: 10.1016/j.jpowsour.2014.12.053
CrossRef Полный текст | Google Scholar
Li, Y., Ding, F., Xu, Z., Sang, L., Ren, L., Ni, W., et al. (2018). Твердотельный литий-ионный аккумулятор, работающий при температуре окружающей среды, на основе твердого полимерного электролита с высокой концентрацией солей. J. Источники питания 397, 95–101. doi: 10.1016/j.jpowsour.2018.05.050
CrossRef Полный текст | Google Scholar
Лян С., Ян В., Ву X., Чжан Ю., Чжу Ю., Ван Х. и др. (2018). Гелевые полимерные электролиты для литий-ионных аккумуляторов: изготовление, характеристики и характеристики. Твердотельный ион. 318, 2–18. doi: 10.1016/j.ssi.2017.12.023
Полный текст CrossRef | Google Scholar
Lim, H.-D., Lim, H.-K., Xing, X., Lee, B.-S., Liu, H., Coaty, C., et al. (2018). Слои твердого электролита методом осаждения из раствора. Доп. Матер. Интерфейсы 5:1701328. doi: 10.1002/admi.201701328
Полный текст CrossRef | Google Scholar
Лю В. , Ли С. В., Лин Д., Ши Ф., Ван С., Сендек А. Д. и др. (2017). Повышение ионной проводимости в композитных полимерных электролитах с хорошо ориентированными керамическими нанопроволоками. Нац. Энергия 2:17035.
, Ли С. В., Лин Д., Ши Ф., Ван С., Сендек А. Д. и др. (2017). Повышение ионной проводимости в композитных полимерных электролитах с хорошо ориентированными керамическими нанопроволоками. Нац. Энергия 2:17035.
Google Scholar
Лю, X., Ли, X., Ли, Х., и Ву, Х. Б. (2018). Недавний прогресс гибридных твердотельных электролитов для литиевых батарей. Химия 24, 18293–18306. doi: 10.1002/chem.201803616
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Луонго А., Фальстер В., Дост М. Е. Б., Рибо М. М., Эйрикссон Э. Р., Педерсен Д. Б. и др. (2020). Контроль микроструктуры в 3D-печати с цифровой обработкой света. 39, 347–359.
Google Scholar
Ma, F., Zhao, E., Zhu, S., Yan, W., Sun, D., Jin, Y., et al. (2016). Приготовление и оценка твердого электролита Li1.3Al0.3Ti1.7(PO4)3 с высокой литий-ионной проводимостью, полученного новым растворным методом. Твердотельный ион. 295, 7–12. doi: 10.1016/j.ssi.2016.07. 010
010
Полный текст CrossRef | Google Scholar
Ма, Т., и Девин Маккензи, Дж. (2019). Полностью печатные гибкие воздушно-цинковые батареи с высокой плотностью энергии на основе твердых полимерных электролитов и иерархического каталитического токосъемника. Гибкий. Распечатать. Электрон. 4:015010. doi: 10.1088/2058-8585/ab0b91
Полный текст CrossRef | Google Scholar
Махаджан А., Фрисби К. Д. и Фрэнсис Л. Ф. (2013). Оптимизация аэрозольной струйной печати для серебряных линий с высоким разрешением и высоким соотношением сторон. Приложение ACS Матер. Интерфейсы 5, 4856–4864. doi: 10.1021/am400606y
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Манапат Дж. З., Чен К., Йе П. и Адвинкула Р. К. (2017). 3D-печать полимерных нанокомпозитов методом стереолитографии. Макромоль. Матер. англ. 302:1600553. doi: 10.1002/mame.201600553
Полный текст CrossRef | Google Scholar
Мантирам А., Ю Х. и Ван С. (2017). Химический состав литиевых батарей благодаря твердотельным электролитам. Нац. Преподобный Матер. 2:16103.
и Ван С. (2017). Химический состав литиевых батарей благодаря твердотельным электролитам. Нац. Преподобный Матер. 2:16103.
Google Scholar
Мао, М., Хе, Дж., Ли, X., Чжан, Б., Лей, К., Лю, Ю., и др. (2017). Новые границы и области применения 3D-печати с высоким разрешением. Микромашины 8:113. дои: 10.3390/mi8040113
CrossRef Полный текст | Google Scholar
Макоуэн Д. В., Сюй С., Гонг Ю., Вен Ю., Годби Г. Л., Гриттон Дж. Э. и др. (2018). Электролиты для 3D-печати твердотельных аккумуляторов. Доп. Матер. 30:1707132.
Google Scholar
Минами Т., Хаяши А. и Тацумисаго М. (2006). Недавний прогресс стекла и стеклокерамики в качестве твердых электролитов для литиевых вторичных батарей. Твердотельный ион. 177, 2715–2720. doi: 10.1016/j.ssi.2006.07.017
Полный текст перекрестной ссылки | Google Scholar
Моримото Х., Ямасита Х., Тацумисаго М. и Минами Т. (1999). Механохимический синтез новых аморфных материалов 60Li2S⋅ 40SiS2 с высокой ионно-литиевой проводимостью. Дж. Ам. Керам. соц. 82, 1352–1354. doi: 10.1111/j.1151-2916.1999.tb01923.x
Дж. Ам. Керам. соц. 82, 1352–1354. doi: 10.1111/j.1151-2916.1999.tb01923.x
Полный текст CrossRef | Google Scholar
Нафиси С., Джалили Р., Абуталеби С. Х., Горкин И. Р. А., Константинов К., Иннис П. К. и др. (2014). Дисперсии оксида графена: настройка реологии для производства. Матер. Гориз. 1, 326–331. doi: 10.1039/c3mh00144j
CrossRef Полный текст | Google Scholar
Нго, Т. Д., Кашани, А., Имбальцано, Г., Нгуен, К. Т. К., и Хуи, Д. (2018). Аддитивное производство (3D-печать): обзор материалов, методов, приложений и проблем. Композ. Б инж. 143, 172–196. doi: 10.1016/j.compositesb.2018.02.012
CrossRef Полный текст | Google Scholar
Нгуен Х., Банерджи А., Ван Х., Тан Д., Ву Э. А., Дукс Дж. и др. (2019). Одностадийный синтез высокопроводящего твердого электролита Na3PS4 для полностью натриевых твердотельных аккумуляторов. J. Источники питания 435, 126623–126623. doi: 10.1016/j.jpowsour.2019.05.031
CrossRef Полный текст | Google Scholar
Найман М. , Алам Т. М., Макинтайр С. К., Блейер Г. К. и Ингерсолл Д. (2010). Альтернативный подход к увеличению подвижности Li в электролитах Li-La-Nb/Ta-гранат. Хим. Матер. 22, 5401–5410. doi: 10.1021/cm101438x
, Алам Т. М., Макинтайр С. К., Блейер Г. К. и Ингерсолл Д. (2010). Альтернативный подход к увеличению подвижности Li в электролитах Li-La-Nb/Ta-гранат. Хим. Матер. 22, 5401–5410. doi: 10.1021/cm101438x
CrossRef Full Text | Академия Google
Обата К., Эль-Тамер А., Кох Л., Хинзе У. и Чичков Б. Н. (2013). Трехмерное двухфотонное полимеризационное структурирование высокого качества с расширенным рабочим диапазоном объектива (WOW-2PP). Легкие науки. заявл. 2:e116. doi: 10.1038/lsa.2013.72
Полный текст CrossRef | Google Scholar
Панг Ю., Цао Ю., Чу Ю., Лю М., Снайдер К., Маккензи Д. и др. (2019). Аддитивное производство аккумуляторов. Доп. Функц. Матер. 30:1
4. Google Scholar
Пак С.-Х., Пак М., Ю С.-И. и Джу С.-К. (2006). Твердый полимерный электролит с центрифужным покрытием для полностью твердотельных перезаряжаемых тонкопленочных литий-полимерных аккумуляторов. J. Источники питания 158, 1442–1446. doi: 10. 1016/j.jpowsour.2005.10.022
1016/j.jpowsour.2005.10.022
CrossRef Полный текст | Google Scholar
Парк, И.-Б., Ха, Ю.-М., Ким, М.-С., Ким, Х.-К., и Ли, С.-Х. (2012). Трехмерная шкала серого для улучшения качества поверхности в проекционной микростереолитографии. Междунар. Дж. Точность. англ. Производство. 13, 291–298. doi: 10.1007/s12541-012-0036-0
Полный текст CrossRef | Google Scholar
А. Пеше, А. Хорнес, М. Нуньес, А. Мората, М. Торрелл и А. Таранкон (2020). 3D-печать следующего поколения усовершенствованных твердооксидных топливных и электролизных элементов. Дж. Матер. хим. A. doi: 10.1039/d0ta02803g
CrossRef Full Text | Google Scholar
Пфеннингер Р., Струзик М., Гарбайо И., Стилп Э. и Рупп Дж. Л. М. (2019). Низкая температура обработки для быстрой проводимости лития в пленках твердотельных батарей на основе граната. Нац. Энергия 4, 475–483. doi: 10.1038/s41560-019-0384-4
CrossRef Полный текст | Google Scholar
Фук Н.Х. Х., Тотани М., Морикава К., Муто Х. и Мацуда А. (2016). Приготовление твердого электролита Li3PS4 с использованием этилацетата в качестве синтетической среды. Твердотельный ион. 288, 240–243. doi: 10.1016/j.ssi.2015.11.032
Х., Тотани М., Морикава К., Муто Х. и Мацуда А. (2016). Приготовление твердого электролита Li3PS4 с использованием этилацетата в качестве синтетической среды. Твердотельный ион. 288, 240–243. doi: 10.1016/j.ssi.2015.11.032
Полный текст CrossRef | Google Scholar
Прадель А., Панье Т. и Рибес М. (1985). Влияние быстрой закалки на электрические свойства литиевых проводящих стекол. Твердотельный ион. 17, 147–154. doi: 10.1016/0167-2738(85)-5 Полный текст CrossRef | Google Scholar
Рейес К., Шомоджи Р., Ниу С., Круз М. А., Ян Ф., Катеначчи М. Дж. и др. (2018). Трехмерная печать полной литий-ионной батареи с изготовлением плавленых нитей. Приложение ACS Энергия Матер. 1, 5268–5279.
Google Scholar
Руетчи П., Мели Ф. и Десильвестро Дж. (1995). Никель-металлогидридные аккумуляторы. Предпочтительные батареи будущего? Дж. Источники питания 57, 85–91. doi: 10.1016/0378-7753(95)02248-1
Полный текст CrossRef | Google Scholar
Рузметов Д. , Олешко В. П., Хейни П. М., Лезек Х. Дж., Карки К., Белох К. Х. и др. (2012). Стабильность электролита определяет пределы масштабирования для твердотельных литий-ионных аккумуляторов 3D. Нано Летт. 12, 505–511. doi: 10.1021/nl204047z
, Олешко В. П., Хейни П. М., Лезек Х. Дж., Карки К., Белох К. Х. и др. (2012). Стабильность электролита определяет пределы масштабирования для твердотельных литий-ионных аккумуляторов 3D. Нано Летт. 12, 505–511. doi: 10.1021/nl204047z
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Сантоликвидо О., Коломбо П. и Ортона А. (2019 г.). Аддитивное производство керамических компонентов с помощью цифровой световой обработки: сравнение подходов «снизу вверх» и «сверху вниз». Дж. Евро. Керам. соц. 39, 2140–2148. doi: 10.1016/j.jeurceramsoc.2019.01.044
CrossRef Полный текст | Google Scholar
Скьяво, Л. С. А., Мантас, П. К., Сегадайнс, А. М., и Круз, Р. К. Д. (2018). От сухого прессования к пластическому формованию керамики: оценка окна обрабатываемости. Констр. Строить. Матер. 189, 594–600. doi: 10.1016/j.conbuildmat.2018.09.015
CrossRef Полный текст | Google Scholar
Schnell, J., Günther, T., Knoche, T. , Vieider, C., Köhler, L., Just, A., et al. (2018). Полностью твердотельные литий-ионные и литий-металлические батареи — путь к крупносерийному производству. Дж. Источники питания 382, 160–175. doi: 10.1016/j.jpowsour.2018.02.062
, Vieider, C., Köhler, L., Just, A., et al. (2018). Полностью твердотельные литий-ионные и литий-металлические батареи — путь к крупносерийному производству. Дж. Источники питания 382, 160–175. doi: 10.1016/j.jpowsour.2018.02.062
CrossRef Полный текст | Google Scholar
Шан Ю., Ли Ю. и Панг Х. (2020). Применение материалов на основе сульфида олова в литий-ионных батареях и натрий-ионных батареях. Доп. Функц. Матер. 30:2001298. doi: 10.1002/adfm.202001298
Полный текст CrossRef | Google Scholar
Смит, А. Дж., Бернс, Дж. К., Трасслер, С., и Дан, Дж. Р. (2010). Прецизионные измерения кулоновской эффективности литий-ионных аккумуляторов и материалов электродов для литий-ионных аккумуляторов. Дж. Электрохим. соц. 157: А196.
Google Scholar
Strauss, F., Teo, J.H., Schiele, A., Bartsch, T., Hatsukade, T., Hartmann, P., et al. (2020). Выделение газа в литий-ионных батареях: твердый электролит против жидкого. Приложение ACS Матер. Интерфейсы 12, 20462–20468.
Интерфейсы 12, 20462–20468.
Google Scholar
Сун, К., Фанг, Н., Ву, Д. М., и Чжан, X. (2005). Проекционная микростереолитография с использованием цифровой микрозеркальной динамической маски. Сенсорные приводы A Физ. 121, 113–120. doi: 10.1016/j.sna.2004.12.011
CrossRef Полный текст | Google Scholar
Сунь Дж., Ли Ю., Чжан К., Хоу К., Ши К. и Ван Х. (2019). Композитный электролит из полиметилметакрилата с высокой ионной проводимостью с нанопроволоками Li6,75La3Zr1,75Nb0,25O12 типа граната. Хим. англ. Дж. 375:121922. doi: 10.1016/j.cej.2019.121922
Полный текст CrossRef | Google Scholar
Sun, Y., Shi, P., Chen, J., Wu, Q., Liang, X., Rui, X., et al. (2020). Разработка и вызов передовых неводных натрий-ионных аккумуляторов. EnergyChem 2:100031. doi: 10.1016/j.enchem.2020.100031
Полный текст CrossRef | Google Scholar
Сувачи, Э., и Мессинг, Г.Л. (2001). Текстурированная алюмооксидная керамика методом одноосного прессования. Ключ инж. Матер. 206–213, 405–408. doi: 10.4028/www.scientific.net/kem.206-213.405
Ключ инж. Матер. 206–213, 405–408. doi: 10.4028/www.scientific.net/kem.206-213.405
CrossRef Full Text | Google Scholar
Такада, К. (2013). Прогресс и перспективы твердотельных литиевых аккумуляторов. Acta Mater. 61, 759–770. doi: 10.1016/j.actamat.2012.10.034
CrossRef Полный текст | Google Scholar
Tallon, C., and Franks, GV (2011). Последние тенденции формообразования в результате коллоидной обработки: обзор. 119, 147–160. doi: 10.2109/jcersj2.119.147
Полнотекстовая перекрестная ссылка | Google Scholar
Tan, SJ, Zeng, XX, Ma, Q., Wu, XW, and Guo, YG (2018). Последние достижения в области композитных электролитов на полимерной основе для перезаряжаемых литиевых батарей. Электрохим. Energy Rev. 1, 113–138. doi: 10.1007/s41918-018-0011-2
CrossRef Полный текст | Google Scholar
Танака С., Пин К.С. и Уэмацу К. (2006). Влияние сегрегации органического связующего на прочность после спекания оксида алюминия сухого прессования. Дж. Ам. Керам. соц. 89, 1903–1907 гг. doi: 10.1111/j.1551-2916.2006.01057.x
Дж. Ам. Керам. соц. 89, 1903–1907 гг. doi: 10.1111/j.1551-2916.2006.01057.x
Полный текст CrossRef | Google Scholar
Тацумисаго, М., и Хаяши, А. (2012). Суперионные стекла и стеклокерамика в системе Li2S–P2S5 для полностью твердотельных литиевых аккумуляторных батарей. Твердотельный ион. 225, 342–345. doi: 10.1016/j.ssi.2012.03.013
Полный текст CrossRef | Google Scholar
Терагава С., Асо К., Таданага К., Хаяши А. и Тацумисаго М. (2014). Приготовление твердого электролита Li2S–P2S5 из раствора N-метилформамида и применение для полностью твердотельных литиевых аккумуляторов. Дж. Источники питания 248, 939–942. doi: 10.1016/j.jpowsour.2013.09.117
CrossRef Полный текст | Google Scholar
Треви Дж., Джанг Дж. С., Юнг Ю. С., Столдт Ч. Р. и Ли С. Х. (2009). Стеклокерамические электролиты Li2S–P2S5, приготовленные методом одноэтапной шаровой набивки, и их применение для полностью твердотельных литий-ионных аккумуляторов. Электрохим. коммун. 11, 1830–1833 гг. doi: 10.1016/j.elecom.2009.07.028
Электрохим. коммун. 11, 1830–1833 гг. doi: 10.1016/j.elecom.2009.07.028
Полный текст CrossRef | Академия Google
Труби Р.Л. и Льюис Дж.А. (2016). Печать мягкой материи в трех измерениях. Природа 540, 371–378. doi: 10.1038/nature21003
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Тамблстон Дж. Р., Ширванянц Д., Ермошкин Н., Янушевич Р., Джонсон А. Р., Келли Д. и др. (2015). Непрерывное создание жидкостного интерфейса трехмерных объектов. Наука 347, 1349–1352. doi: 10.1126/science.aaa2397
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Варшнея А.К. и Мауро Дж.К. (2019). Основы неорганических стекол . Амстердам: Эльзевир.
Google Scholar
Венкатасубраманиан Н., Уэйд Б., Десаи П., Абхираман А. и Гелбаум Л. (1991). Синтез и характеристика полиборатов, полученных из золь-геля, пригодных для прядения. J. Без кристаллов. Твердые вещества 130, 144–156. doi: 10.1016/0022-3093(91)
doi: 10.1016/0022-3093(91)
-k CrossRef Full Text | Google Scholar
Wan, J., Xie, J., Kong, X., Liu, Z., Liu, K., Shi, F., et al. (2019). Ультратонкий, гибкий, твердый полимерный композитный электролит с выровненной нанопористой основой для литиевых батарей. Нац. нанотехнологии. 14, 705–711. doi: 10.1038/s41565-019-0465-3
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Ван Л., Йе Ю., Чен Н., Хуанг Ю., Ли Л., Ву Ф. и др. (2018). Разработка и проблемы функциональных электролитов для высокоэффективных литий-серных аккумуляторов. Доп. Функц. Матер. 28:1800919. DOI: 10.1002/adfm.201800919
Полнотекстовая перекрестная ссылка | Google Scholar
Wang, X.J., Zhang, H.P., Kang, J.J., Wu, Y.P., and Fang, S.B. (2005). Новые композиционные полимерные электролиты на основе поли(эфируретанового) сетчатого полимера и пирогенных кремнеземов. J. Твердотельная электрохимия. 11, 21–26. doi: 10.1007/s10008-005-0029-3
11, 21–26. doi: 10.1007/s10008-005-0029-3
Полный текст CrossRef | Google Scholar
Warner, JT (2015). Справочник по проектированию литий-ионных аккумуляторов: химия, компоненты, типы и терминология . Амстердам: Эльзевир.
Google Scholar
Вей Т.С., Ан Б.Ю., Гротто Дж. и Льюис Дж.А. (2018). 3D-печать индивидуальных литий-ионных аккумуляторов с толстыми электродами. Доп. Матер. 30:1703027. doi: 10.1002/adma.201703027
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Вуттиканокхан Дж., Фириявирут М. и Понгчумпон О. Дж. (2015). Влияние параметров электроформования и содержания нанонаполнителя на морфологию и свойства гелеобразного электролита композиционных нановолокон на основе ПВДФ-ГФП, наполненного La2O3. Междунар. Дж. Полим. Матер. Полим. Биоматер. 64, 416–426. doi: 10.1080/00
7.2014.0
CrossRef Full Text | Google Scholar
Се Дж., Иманиши Н., Чжан Т., Хирано А., Такеда Ю. и Ямамото О. (2009). Транспорт Li-ion в полностью твердотельных литиевых батареях с LiCoO2 с использованием стеклокерамических электролитов типа NASICON. Дж. Источники питания 189, 365–370. doi: 10.1016/j.jpowsour.2008.08.015
и Ямамото О. (2009). Транспорт Li-ion в полностью твердотельных литиевых батареях с LiCoO2 с использованием стеклокерамических электролитов типа NASICON. Дж. Источники питания 189, 365–370. doi: 10.1016/j.jpowsour.2008.08.015
CrossRef Полный текст | Google Scholar
Xing, B., Yao, Y., Meng, X., Zhao, W., Shen, M., Gao, S., et al. (2020). Самонесущий стабилизированный оксидом иттрия электролит в форме ряби циркония для применения в твердооксидных топливных элементах с помощью цифровой световой обработки трехмерной печати. Скр. Матер. 181, 62–65. doi: 10.1016/j.scriptamat.2020.02.004
Полный текст CrossRef | Google Scholar
Yang, Y., Chen, Z., Song, X., Zhu, B., Hsiai, T., Wu, P.-I., et al. (2016). Трехмерная печать конденсатора с высокой диэлектрической проницаемостью методом проекционной стереолитографии. Nano Energy 22, 414–421. doi: 10.1016/j.nanoen.2016.02.045
CrossRef Full Text | Google Scholar
Yang, Y., Yuan, W. , Zhang, X., Yuan, Y., Wang, C., Ye, Y., et al. (2020). Обзор приложений трехмерной печати для перезаряжаемых литий-ионных аккумуляторов. Заяв. Энергия 257:14002.
, Zhang, X., Yuan, Y., Wang, C., Ye, Y., et al. (2020). Обзор приложений трехмерной печати для перезаряжаемых литий-ионных аккумуляторов. Заяв. Энергия 257:14002.
Google Scholar
Yin, Y.C., Wang, Q., Yang, J.T., Li, F., Zhang, G., Jiang, C.H., et al. (2020). Поверхностный слой на основе тонкой пленки перовскита хлорида металла для защиты металлического лития от жидкого электролита. Нац. коммун. 11:1761.
Google Scholar
Йошио М., Бродд Р. Дж. и Кодзава А. (2009). Литий-ионные батареи . Нью-Йорк, штат Нью-Йорк: Спрингер.
Google Scholar
Юань М. и Лю К. (2020). Рациональный дизайн сепараторов и жидких электролитов для более безопасных литий-ионных аккумуляторов. J. Energy Chem. 43, 58–70. doi: 10.1016/j.jechem.2019.08.008
Полный текст CrossRef | Google Scholar
Юэ Л., Ма Дж., Чжан Дж., Чжао Дж., Донг С., Лю З. и др. (2016). Все твердотельные полимерные электролиты для высокопроизводительных литий-ионных аккумуляторов. Материал для хранения энергии. 5, 139–164.
Материал для хранения энергии. 5, 139–164.
Google Scholar
Зеколл С., Марринер-Эдвардс К., Хексельман А. К. О., Касемчайнан Дж., Кусс К., Армстронг Д. Е. Дж. и др. (2018). Гибридные электролиты с трехмерными бинепрерывными упорядоченными керамическими и полимерными микроканалами для полностью твердотельных аккумуляторов. Энергетика Окружающая среда. науч. 11, 185–201. doi: 10.1039/c7ee02723k
Полный текст CrossRef | Google Scholar
Чжан Х., Ли К., Пищ М., Койя Э., Рохо Т., Родригес-Мартинес Л. М. и др. (2017). Одиночные литий-ионные проводящие твердые полимерные электролиты: достижения и перспективы. Хим. соц. Ред. 46, 797–815.
Google Scholar
Чжан К., Цао Д., Ма Ю., Натан А., Аврора П. и Чжу Х. (2019). Твердотельные электролиты на основе сульфидов: синтез, стабильность и потенциал для полностью твердотельных аккумуляторов. Доп. Матер. 31:e11.
Google Scholar
Чжан С.С. (2007). Обзор сепараторов литий-ионных аккумуляторов с жидким электролитом.
 47
47 6]
6] Нитта Н. , Ву Ф.С., Ли Дж.Т., Юшин Г. Матер. Сегодня, 2015, 18(5):252.
, Ву Ф.С., Ли Дж.Т., Юшин Г. Матер. Сегодня, 2015, 18(5):252.
doi: 10.1016/j.mattod.2014.10.040
Zeng X Q, Li M, Abd El-Hady D, Alshitari W, Al-Bogami A S, Lu J, Amine K. Adv. Энергетика, 2019, 9(27):1
1.
дои: 10.1002/aenm.v9.27
Pan H L, Han K S, Engelhard M H, Cao R G, Chen J Z, Zhang J G, Mueller K T, Shao Y Y, Liu J. Adv. Функц. мат., 2018, 28(38):1707234.
дои: 10.1002/adfm.v28.38
Girishkumar G, McCloskey B, Luntz A C, Swanson S, Wilcke W. J. Phys. хим. Письма., 2010, 1(14):2193.
дои: 10.1021/jz1005384
Tu S B, Chen X, Zhao X X, Cheng M R, Xiong P X, He Y W, Zhang Q, Xu Y H. Adv. мат., 2018, 30(45):1804581.
дои: 10.1002/adma.v30.45
Чжао З. В., Хуан Дж., Пэн З. К. Анжу. хим. Междунар. ред., 2018, 57(15):3874.
В., Хуан Дж., Пэн З. К. Анжу. хим. Междунар. ред., 2018, 57(15):3874.
doi: 10.1002/anie.201710156
Li J C, Ma C, Chi MF, Liang C D, Dudney N J. Adv. Энергетические мат., 2015, 5(4):1401408.
doi: 10.1002/aenm.201401408
Сантанам Р., Рамбабу Б.Дж. Источники питания, 2010 г., 195(13):4313.
doi: 10.1016/j.jpowsour.2010.01.016
Чжун К., Бонакдарпур А., Чжан М., Гао Ю., Дан Дж. Р. ХимИнформ, 2010, 28(20):205.
Черкашинин Г., Шарат С.У., Ягерманн В. Adv. Энергетические мат., 2017, 7(13):1602321.
doi: 10.1002/aenm.201602321
Yim T, Woo S G, Lim S H, Cho W, Song J H, Han Y K, Kim Y J J Mater. хим. А, 2015, 3(11):6157.
хим. А, 2015, 3(11):6157.
дои: 10.1039/C4TA06531J
Song Y M, Han J G, Park S, Lee K T, Choi N S. J. Mater. хим. А, 2014, 2(25):9506.
дои: 10.1039/C4TA01129E
Фламме Б., Родригес Гарсия Г., Вейл М., Хаддад М., Фансават П., Ратовеломанана-Видаль В., Чагнес А. Зеленая химия, 2017, 19(8): 1828.
дои: 10.1039/C7GC00252A
Чой Н.С., Ю К.Х., Ли К.Ю., Сун М., Ким Х., Ким С.С.Дж. Power Sources, 2006, 161(2):1254.
doi: 10.1016/j.jpowsour.2006.05.049
Моги Р., Инаба М., Чон С.К., Ирияма Ю., Абэ Т., Огуми З. Дж. Электрохим. Soc., 2002, 149(12):A1578.
дои: 10.1149/1.1516770
Ху Л.Б., Чжан З. С., Амин К. Электрохим. коммун., 2013, 35:76.
С., Амин К. Электрохим. коммун., 2013, 35:76.
doi: 10.1016/j.elecom.2013.08.009
Xia L, Xia Y G, Wang C S, Hu H S, Lee S, Yu Q, Chen HC, Liu Z P. ChemElectroChem, 2015, 2(11):1707.
doi: 10.1002/celc.201500286
Smart MC, Ratnakumar BV, Whitcanack LD, Chin KB, Surampudi S, Croft H, Tice D, Staniewicz R.J. Power Sources, 2003, 119/121:349.
дои: 10.1016/S0378-7753(03)00154-X
Мацуда Ю., Накадзима Т., Одзава Ю., Кох М., Ямаути А., Кагава М., Аояма Х. Дж. Fluor. хим., 2011, 132(12):1174.
doi: 10.1016/j.jfluchem.2011.07.019
He M N, Hu L B, Xue Z, Su C C, Redfern P, Curtiss L A, Polzin B, von Cresce A, Xu K, Zhang Z C. J. Electrochem. соц., 2015, 162(9).):A1725.
дои: 10.1149/2.0231509jes
Zheng X, Liao Y, Zhang ZR, Zhu JP, Ren FC, He HJ, Xiang Y X, Zheng Y Z, Yang Y. J. Energy Chem., 2020, 42:62.
doi: 10.1016/j.jechem.2019.05.023
Kim C K, Shin D S, Kim K E, Shin K, Woo J J, Kim S, Hong S Y, Choi N S. ChemElectroChem, 2016, 3(6):913.
doi: 10.1002/celc.201600025
Ся Л., Ю Л. П., Ху Д., Чен З. Г. Acta Chim. Синица, 2017, 75(12):1183.
дои: 10.6023/A17060284
Xia L, Lee S, Jiang Y B, Li S Q, Liu Z P, Yu LP, Hu D, Wang S H, Liu Y T, Chen G Z. ChemElectroChem, 2019, 6(14):3747.
дои: 10.1002/celc.v6.14
Zhang L L, Ma Y L, Du C Y, Yin G P. Prog. хим., 2014, 26:553.
Prog. хим., 2014, 26:553.
(张玲玲, 马玉林, 杜春雨, 尹鸽平, 化学进展, 2014, 26:553.).
дои: 10.7536/PC130816
Уэ М., Такеда М., Такехара М., Мори С.Дж. Электрохим. Соц., 1997, 144(8):2684.
дои: 10.1149/1.1837882
Duncan H, Salem N, Abu-Lebdeh Y. J. Electrochem. Soc., 2013, 160(6):A838.
дои: 10.1149/2.088306jes
Rohan R, Kuo T C, Lin J H, Hsu Y C, Li C C, Lee J T. J. Phys. хим. С, 2016, 120(12):6450.
doi: 10.1021/acs.jpcc.6b00980
Абу-Лебде Ю., Дэвидсон И. Дж. Электрохим. Soc., 2009, 156(1):A60.
дои: 10.1149/1.3023084
Абу-Лебде Й. , Дэвидсон И. Дж. Источники питания, 2009 г., 189(1):576.
, Дэвидсон И. Дж. Источники питания, 2009 г., 189(1):576.
doi: 10.1016/j.jpowsour.2008.09.113
Farhat D, Lemordant D, Jacquemin J, Ghamouss F. J. Electrochem. соц., 2019, 166(14):A3487.
дои: 10.1149/2.1261914jes
Хилбиг П., Ибинг Л., Винтер М., Чекич-Ласкович И. Энергии, 2019, 12(15):2869.
doi: 10.3390/en12152869
Zhang W L, Lan X Y, Shi Z W, Li C L. Chem. Бюлл., 2017, 80:1021.
(张文林, 兰晓艳, 史紫薇, 李春利, 化学通报, 2017, 80:1021.).
Цао G Z. Sci. China Mater., 2018, 61(10):1360.
doi: 10.1007/s40843-018-9296-y
Flamme B, Rodriguez Garcia G, Weil M, Haddad M, Phansavath P, Ratovelomanana-Vidal V, Chagnes A. Green Chem., 2017, 19(8):1828.
Green Chem., 2017, 19(8):1828.
дои: 10.1039/C7GC00252A
Сюэ Л. Г., Уэно К., Ли С. Ю., Энджелл К. А. Дж. Источники питания, 2014, 262:123.
doi: 10.1016/j.jpowsour.2014.03.099
Wu F, Zhou H, Bai Y, Wang H L, Wu C. Приложение ACS. Матер. Интерфейсы, 2015, 7(27):15098.
дои: 10.1021/acsami.5b04477
Hess S, Wohlfahrt-Mehrens M, Wachtler M. J. Electrochem. Соц., 2015, 162(2):A3084.
дои: 10.1149/2.0121502jes
Sun X G, Angell C A. Electrochem. Комм., 2005, 7(3):261.
doi: 10.1016/j.elecom.2005.01.010
Левандовски А., Курц Б., Свидерска-Мочек А., Куса Н. Дж. Источники энергии, 2014, 266:132.
doi: 10.1016/j.jpowsour.2014.04.083
Альварадо Дж., Шредер М.А., Чжан М.Х., Бородин О., Гоброгге Э., Ольгин М., Дин М.С., Гобет М., Гринбаум С., Мэн Ю.С., Сюй К. Матер. Сегодня, 2018, 21(4):341.
doi: 10.1016/j.mattod.2018.02.005
Чжан Т., Порчер В., Пайярд Э. Дж. Источники питания, 2018 г., 395:212.
doi: 10.1016/j.jpowsour.2018.05.077
Flamme B, Haddad M, Phansavath P, Ratovelomanana-Vidal V, Chagnes A. ChemElectroChem, 2018, 5(16):2279.
doi: 10.1002/celc.201701343
Макфарлейн Д. Р., Тачикава Н., Форсайт М., Прингл Дж. М., Хоулетт П. К., Эллиотт Г. Д., Дэвис Дж. Х., Ватанабэ М., Саймон П., Энджелл К. А. Energy Environ. наук, 2014, 7(1):232.
дои: 10.
 1039/C3EE42099J
1039/C3EE42099JВатанабэ М., Томас М.Л., Чжан С.Г., Уэно К., Ясуда Т., Докко К. Chem. Rev., 2017, 117(10):7190.
doi: 10.1021/acs.chemrev.6b00504
Zhang S G, Zhang J H, Zhang Y, Deng Y Q. Chem. Rev., 2017, 117(10):6755.
doi: 10.1021/acs.chemrev.6b00509
Эфтехари А., Лю Ю., Чен П. Дж. Источники питания, 2016 г., 334:221.
doi: 10.1016/j.jpowsour.2016.10.025
Seki S, Kobayashi Y, Miyashiro H, Ohno Y, Mita Y, Terada N, Charest P, Guerfi A, Zaghib K. J. Phys. хим. С, 2008, 112(42):16708.
дои: 10.1021/jp805403e
Юэ З., Дуня Х., Мэй Х.Ю., МакГарри К., Мандал Б.К. Ионикс, 2019 г., 25(12):5979.
doi: 10.1007/s11581-019-03133-y
Bordes E, Douce L, Quitevis E L, Pádua A A H, Costa Gomes M. J. Chem. физ., 2018, 148(19):1
.дои: 10.1063/1.5010604
Le LTM, Vo T D, Ngo K H P, Okada S, Alloin F, Garg A, Le P M L. J. Mol. лик., 2018, 271:769.
doi: 10.1016/j.molliq.2018.09.068
Wu C J, Rath PC, Patra J, Bresser D, Passerini S, Umesh B, Dong Q F, Lee TC, Chang J K. ACS Appl. Матер. Интерфейсы, 2019, 11(45):42049.
дои: 10.1021/acsami.9b12915
Zhang S J, Li J H, Jiang N Y, Li X Q, Pasupath S, Fang Y X, Liu Q B, Dang D. Chem. Азиат Ж., 2019, 14(16):2810.
Лян Ф. Х., Ю Дж. Л., Ван Д..jpg) , Дун Л., Ма С. С., Чен Дж. Х., Ян Б. Б., Чжу С. З., Гао Й, Ли Ч. Электрохимика Acta, 2019, 307:83.
, Дун Л., Ма С. С., Чен Дж. Х., Ян Б. Б., Чжу С. З., Гао Й, Ли Ч. Электрохимика Acta, 2019, 307:83.
doi: 10.1016/j.electacta.2019.03.110
Xu K, von Cresce AJ Mater. хим., 2011, 21(27):9849.
дои: 10.1039/c0jm04309e
Кан Х. Хим. Rev., 2014, 114(23):11503.
дои: 10.1021/cr500003w
Цурумаки А., Бранчи М., Ригано А., Пояна Р., Панеро С., Наварра М. А. Electrochimica Acta, 2019, 315:17.
doi: 10.1016/j.electacta.2019.04.190
Qian Y X, Hu S G, Zou X S, Deng Z H, Xu Y Q, Cao Z Z, Kang Y Y, Deng Y F, Shi Q, Xu K, Deng Y H. Материал накопления энергии, 2019 г., 20:208.
Хофманн А., Хёвелинг А. , Бон Н., Мюллер М., Биндер Дж. Р., Ханеманн Т. ChemElectroChem, 2019, 6(20):5255.
, Бон Н., Мюллер М., Биндер Дж. Р., Ханеманн Т. ChemElectroChem, 2019, 6(20):5255.
дои: 10.1002/celc.v6.20
Xu G J, Pang C G, Chen B B, Ma J, Wang X, Chai J C, Wang Q F, An W Z, Zhou X H, Cui GL, Chen L Q. Adv. Энергетические мат., 2018, 8(9):1870038.
дои: 10.1002/aenm.v8.9
Lu D, Xu G J, Hu Z W, Cui Z L, Wang X, Li J D, Huang L, Du X F, Wang Y T, Ma J, Lu X L, Lin H J, Chen C T, Nugroho A A, Tjeng L H, Cui G L. Малые методы, 2019, 3(10):1
6.
дои: 10.1002/smtd.v3.10
Чжао В.М., Чжэн Б.З., Лю Х.Д., Жэнь Ф.К., Чжу Дж.П., Чжэн Г.Р., Чен С.Дж., Лю Р., Ян Х.Р., Ян Ю. Нано Энергия, 2019, 63:103815.
doi: 10.1016/j.nanoen.2019.06.011
Beltrop K, Klein S, Nölle R, Wilken A, Lee JJ, Köster TKJ, Reiter J, Tao L, Liang CD, Winter M, Qi X, Placke T. Chem. мат., 2018, 30(8):2726.
Chem. мат., 2018, 30(8):2726.
doi: 10.1021/acs.chemmater.8b00413
Yue H Y, Dong Z Y, Yang Y G, Han Z L, Wang L, Zhang H S, Yin Y H, Zhang X G, Zhang Z T, Yang S T. J. Colloid Interface Sci., 2020, 559: 236.
doi: 10.1016/j.jcis.2019.10.002
Zuo X X, Fan C J, Liu J S, Xiao X, Wu J H, Nan J M. J. Power Sources, 2013, 229:308.
doi: 10.1016/j.jpowsour.2012.12.056
Yu Q P, Chen Z T, Xing L D, Chen D R, Rong H B, Liu Q F, Li W S. Electrochimica Acta, 2015, 176:919.
doi: 10.1016/j.electacta.2015.07.058
Wang Z S, Xing L D, Li J H, Xu M Q, Li W S. J. Power Sources, 2016, 307:587.
doi: 10.1016/j.jpowsour.2015.11.091
Qin Z M, Hong S, Hong B, Duan B Y, Lai Y Q, Feng JJ Electroanal. хим., 2019, 854:113506.
хим., 2019, 854:113506.
doi: 10.1016/j.jelechem.2019.113506
Liu Q Y, Yang G J, Liu S, Han M, Wang Z X, Chen L Q. Приложение ACS. Матер. Интерфейсы, 2019, 11(19):17435.
дои: 10.1021/acsami.9b03417
Yue H Y, Yang Y G, Xiao Y, Dong Z Y, Cheng S G, Yin Y H, Ling C, Yang W G, Yu Y H, Yang S T. J. Mater. хим. А, 2019, 7(2):594.
дои: 10.1039/C8TA09380F
Dong Y N, Young B T, Zhang Y Z, Yoon T, Heskett DR, Hu Y F, Lucht B L. ACS Appl. Матер. Интерфейсы, 2017, 9(24):20467.
дои: 10.1021/acsami.7b01481
Шкроб И. А., Чжу Ю., Марин Т. В., Абрахам Д. П. J. Phys. хим. С, 2013, 117(45):23750.
дои: 10.1021/jp407714p
Ha S Y, Han J G, Song Y M, Chun M J, Han S I, Shin WC, Choi N S. Electrochimica Acta, 2013, 104:170.
Electrochimica Acta, 2013, 104:170.
doi: 10.1016/j.electacta.2013.04.082
Xu M Q, Zhou L, Dong Y N, Chen Y J, Garsuch A, Lucht B L. J. Electrochem. Соц., 2013, 160(11):A2005.
дои: 10.1149/2.053311jes
Pieczonka N P W, Yang L, Balogh M P, Powell B R, Chemelewski K, Manthiram A, Krachkovskiy S A, Goward GR, Liu M H, Kim J H. J. Phys. хим. С, 2013, 117(44):22603.
дои: 10.1021/jp408717x
Ларуш-Асраф Л., Битон М., Теллер Х., Зиниград Э., Аурбах Д. Дж. Источники питания, 2007, 174(2):400.
doi: 10.1016/j.jpowsour.2007.06.171
Чжан С. С. Электрохим. Общ., 2006, 8:1423.
doi: 10.1016/j.elecom.2006.06.016
Чжан С. С. Дж. Источники питания, 2007 г., 163 (2): 713.
С. Дж. Источники питания, 2007 г., 163 (2): 713.
doi: 10.1016/j.jpowsour.2006.09.040
Liu J, Chen ZH, Busking S, Amine K. Electrochem. Комм., 2007, 9(3):475.
doi: 10.1016/j.elecom.2006.10.022
Li J, Xie K Y, Lai Y Q, Zhang Z A, Li F Q, Hao X, Chen X J, Liu Y X. J. Power Sources, 2010, 195(16):5344.
doi: 10.1016/j.jpowsour.2010.03.038
Сюй М. К., Чжоу Л., Хао Л. С., Син Л. Д., Ли В. С., Лучт Б. Л. Дж. Источники питания, 2011, 196(16):6794.
doi: 10.1016/j.jpowsour.2010.10.050
Hu M, Wei J P, Xing L Y, Zhou Z. J. Appl. Электрохим., 2012, 42(5):291.
doi: 10.1007/s10800-012-0398-0
Ся Л. , Ли С., Цзян И. Б., Ся И. Г., Чен Г. З., Лю З. П. ACS Omega, 2017, 2(12):8741.
, Ли С., Цзян И. Б., Ся И. Г., Чен Г. З., Лю З. П. ACS Omega, 2017, 2(12):8741.
дои: 10.1021/acsomega.7b01196
Zhuang Y, Lei Y Q, Guan M Y, Du F H, Cao H S, Dai H, Zhou Q, Adkins J, Zheng J W. Electrochimica Acta, 2020, 331:135465.
doi: 10.1016/j.electacta.2019.135465
Хамену Л., Мадзвамусе А., Мохаммед Л., Ли Ю. М., Ко Дж. М., Бон С. И., Ким С. Дж., Чо В. И., Пэк И. Г., Парк Дж. Дж. Инд. хим., 2017, 53:241.
doi: 10.1016/j.jiec.2017.04.031
Tu W Q, Xia P, Li J H, Zeng L Z, Xu M Q, Xing L D, Zhang L P, Yu L, Fan W Z, Li W S. Electrochimica Acta, 2016, 208:251.
doi: 10.1016/j.electacta.2016.05.029
Xia J, Harlow J E, Petibon R, Burns J C, Chen L P, Dahn J R. J. Electrochem. Соц., 2014, 161(4):A547.
J. Electrochem. Соц., 2014, 161(4):A547.
дои: 10.1149/2.049404jes
Бирроцци А., Лащински Н., Хекматфар М., фон Замори Дж., Гиффин Г.А., Пассерини С.Дж. Источники энергии, 2016, 325:525.
doi: 10.1016/j.jpowsour.2016.06.054
Пирес Дж., Тимперман Л., Кастетс А., Пенья Дж. С., Дюмон Э., Левассер С., Дедривер Р., Тессье С., Анути М. RSC Adv., 2015, 5(52):42088.
дои: 10.1039/C5RA05650K
Хекматфар М., Хаса И., Эгбал Р., Карвалью Д. В., Моретти А., Пассерини С. Adv. Матер. Интерфейсы, 2020, 7(1):1
дои: 10.1002/адми.v7.1
Ши С.Г., Шен С.Х., Пэн Х.С., Луо С.Х., Шен Л.Ф., Шэн В.Дж., Фан Дж.Дж., Ван Ц., Чжан С.Дж., Сюй Б.Б., Сиань Дж. Дж., Вэй Ю.М., Хуан Л., Ли Дж.Т., Сун С.Г. Нано Энергия, 2019, 65:104084.
Дж., Вэй Ю.М., Хуан Л., Ли Дж.Т., Сун С.Г. Нано Энергия, 2019, 65:104084.
doi: 10.1016/j.nanoen.2019.104084
Park E J, Kwon Y G, Yoon S, Cho K Y J Power Sources, 2019, 441:126668.
doi: 10.1016/j.jpowsour.2019.05.074
Сян Ф.Ю., Ван П.П., Ченг Х. Energy Technol., 2020, 8(5):1
дои: 10.1002/ente.v8.5
Liu Q, Xu H L, Wu F, Mu DB, Shi L L, Wang L, Bi J Y, Wu B R. ACS Appl. Энергетические материи, 2019, 2(12):8878.
дои: 10.1021/acsaem.9б01917
Wu B R, Liu Q, Mu D B, Xu H L, Wang L, Shi L L, Gai L, Wu F. RSC Adv., 2016, 6(57):51738.
дои: 10.1039/C6RA09480E
Yang T X, Zeng H N, Wang W L, Zhao X Y, Fan W Z, Wang C Y, Zuo X X, Zeng R H, Nan J M. J. Mater. хим. А, 2019, 7(14):8292.
J. Mater. хим. А, 2019, 7(14):8292.
дои: 10.1039/C9TA01293A
Хан Ю. К., Ю Дж., Йим Т. Electrochimica Acta, 2016, 215:455.
doi: 10.1016/j.electacta.2016.08.131
Zhang G, Musgrave C B. J. Phys. хим. А, 2007, 111(8):1554.
пмид: 17279730
 Квазитвердотельный механизм преобразования серных катодов
[Дж]. Успехи химии, 2022, 34(4): 909-925.
Квазитвердотельный механизм преобразования серных катодов
[Дж]. Успехи химии, 2022, 34(4): 909-925. Неорганические твердые электролиты для литий-ионных аккумуляторов
[Дж]. Успехи химии, 2021, 33(8): 1344-1361.
Неорганические твердые электролиты для литий-ионных аккумуляторов
[Дж]. Успехи химии, 2021, 33(8): 1344-1361. Гелевые полимерные электролиты в литиевых батареях
[Дж]. Успехи химии, 2021, 33(12): 2270-2282.
Гелевые полимерные электролиты в литиевых батареях
[Дж]. Успехи химии, 2021, 33(12): 2270-2282. 22 MnO 2 and Na 0.44 MnO 2 /TiP 2 O 7 ), основанный на двух электрохимических процессах. Один включает реакцию внедрения/экстракции Li + , а другой в основном относится к реакции экстракции/вставки Na + . Две батареи имеют удельную энергию 17 Втч кг −1 и 25 Втч кг -1 в расчете на общую массу материалов активного электрода соответственно. Кроме того, водная батарея LiMn 2 O 4 /Na 0,22 MnO 2 способна разделять Li + и Na + в отличие от традиционного литиевого «кресла-качалки» благодаря своему специфическому механизму. ионные аккумуляторы. Следовательно, смешанные батареи Li + / Na + предлагают многообещающие применения в накоплении энергии и разделении Li + / Na + .
22 MnO 2 and Na 0.44 MnO 2 /TiP 2 O 7 ), основанный на двух электрохимических процессах. Один включает реакцию внедрения/экстракции Li + , а другой в основном относится к реакции экстракции/вставки Na + . Две батареи имеют удельную энергию 17 Втч кг −1 и 25 Втч кг -1 в расчете на общую массу материалов активного электрода соответственно. Кроме того, водная батарея LiMn 2 O 4 /Na 0,22 MnO 2 способна разделять Li + и Na + в отличие от традиционного литиевого «кресла-качалки» благодаря своему специфическому механизму. ионные аккумуляторы. Следовательно, смешанные батареи Li + / Na + предлагают многообещающие применения в накоплении энергии и разделении Li + / Na + . Батареи являются хорошим средством хранения электричества в виде химической энергии. Благодаря хорошей безопасности, высокой ионной проводимости и низкой стоимости, водные перезаряжаемые батареи потенциально выгоднее своих органических аналогов для крупномасштабного хранения энергии 1 .
Батареи являются хорошим средством хранения электричества в виде химической энергии. Благодаря хорошей безопасности, высокой ионной проводимости и низкой стоимости, водные перезаряжаемые батареи потенциально выгоднее своих органических аналогов для крупномасштабного хранения энергии 1 . В последнее время различные металлоионные аккумуляторы на водной основе (например, Li + , Na + , K + и Zn 2+ и др.) на основе химии интеркаляции ионов металлов вызвали большой интерес , 11 , 12 , 13 , 14 , 15 , 16 , 17 , 18 9174. Литий-ионные батареи типа «кресло-качалка» на водной основе с катодными материалами, заимствованными из элементов с органическим электролитом (например, LiMn 2 O 4 /VO 2 , LiMn 2 O 4 /LiV 3 O 8 , LiMn 2 O 4 /TiP 2 O 7 , LiMn 2 O 4 /LiTi 2 (PO 4 ) 3 и LiFePO 4 /LiTi 2 (PO 4 )
В последнее время различные металлоионные аккумуляторы на водной основе (например, Li + , Na + , K + и Zn 2+ и др.) на основе химии интеркаляции ионов металлов вызвали большой интерес , 11 , 12 , 13 , 14 , 15 , 16 , 17 , 18 9174. Литий-ионные батареи типа «кресло-качалка» на водной основе с катодными материалами, заимствованными из элементов с органическим электролитом (например, LiMn 2 O 4 /VO 2 , LiMn 2 O 4 /LiV 3 O 8 , LiMn 2 O 4 /TiP 2 O 7 , LiMn 2 O 4 /LiTi 2 (PO 4 ) 3 и LiFePO 4 /LiTi 2 (PO 4 )5 в целом были разработаны 6, и т. д. срок службы 7 ,8 ,9 ,10 . Исследование, проведенное группой Ся, показало, что циклическая стабильность может быть повышена до коммерческого уровня путем исключения O9.0085 2 , контроль pH электролитов и покрытие кабоном материалов электродов 10 . Куи и др. сообщил о новой калий-ионной батарее с гибридным углеродно-полипиррольным (AC-PPy) анодом и катодом из гексацианоферрата меди (CuHCF), который обеспечивает длительный срок службы и хорошую скорость 12 . Kang et al. исследовал уникальную цинк-ионную батарею на основе Zn-анода, α-MnO 2 катода и мягких электролитов. Он продемонстрировал высокую емкость и возможность быстрой зарядки/разрядки 13 .
Исследование, проведенное группой Ся, показало, что циклическая стабильность может быть повышена до коммерческого уровня путем исключения O9.0085 2 , контроль pH электролитов и покрытие кабоном материалов электродов 10 . Куи и др. сообщил о новой калий-ионной батарее с гибридным углеродно-полипиррольным (AC-PPy) анодом и катодом из гексацианоферрата меди (CuHCF), который обеспечивает длительный срок службы и хорошую скорость 12 . Kang et al. исследовал уникальную цинк-ионную батарею на основе Zn-анода, α-MnO 2 катода и мягких электролитов. Он продемонстрировал высокую емкость и возможность быстрой зарядки/разрядки 13 .
В отличие от лития, калия и цинка, натрий наиболее распространен и экономичен. Поэтому система накопления энергии на основе натрия рассматривается как перспективная технология крупномасштабного хранения энергии. Однако сообщалось только о нескольких материалах для деинтеркаляции/интеркаляции иона натрия в водной среде , 14, , , 15, , , 16, , , 17, , , 18, , , 19, , 2074. Причина в том, что в водной среде происходит несколько побочных реакций, таких как электродные материалы, реагирующие с водой или O 2 , коинтеркаляция протонов в электродные материалы параллельно интеркаляции иона натрия, реакции эволюции H 2 / O 2 и растворение электродных материалов в воде. Уитакр и др. обнаружили, что ион натрия может быть обратимо введен в Na 0,44 MnO 2 благодаря его уникальной туннельной структуре 14 . Но он обеспечивал только удельную емкость 45 мА·ч г −1 при скорости 0,125 C. Ямаки и др. исследовал электрохимическое поведение NaTi 2 (PO 4 ) 3 в водных натриевых электролитах 15 . Его окислительно-восстановительный потенциал составляет -0,6 В по сравнению со стандартным водородным электродом, что указывает на то, что NaTi 2 (PO 4 ) 3 можно использовать в качестве анода для водной натриевой батареи.
Причина в том, что в водной среде происходит несколько побочных реакций, таких как электродные материалы, реагирующие с водой или O 2 , коинтеркаляция протонов в электродные материалы параллельно интеркаляции иона натрия, реакции эволюции H 2 / O 2 и растворение электродных материалов в воде. Уитакр и др. обнаружили, что ион натрия может быть обратимо введен в Na 0,44 MnO 2 благодаря его уникальной туннельной структуре 14 . Но он обеспечивал только удельную емкость 45 мА·ч г −1 при скорости 0,125 C. Ямаки и др. исследовал электрохимическое поведение NaTi 2 (PO 4 ) 3 в водных натриевых электролитах 15 . Его окислительно-восстановительный потенциал составляет -0,6 В по сравнению со стандартным водородным электродом, что указывает на то, что NaTi 2 (PO 4 ) 3 можно использовать в качестве анода для водной натриевой батареи. Водная натрий-ионная батарея «кресло-качалка» состояла из NaTi 2 (PO 4 ) 3 и Na 0,44 MnO 2 , о чем сообщили группы Уитакра и Чанга 161749 ,17 . Куи и др. обнаружили, что материалы с кристаллической структурой берлинской лазури (гексацианоферрат меди и никеля) содержали большие междоузлия, что позволяло вводить и извлекать Na + и/или K + (ссылка 18 , 19 ). Их емкости находились в диапазоне 50–60 мАч·г −1 . Одним словом, требуется гораздо больше работы по исследованию новых материалов с интеркалированным натрием, чтобы сделать водные натриевые батареи жизнеспособными в области крупномасштабного хранения энергии.
Водная натрий-ионная батарея «кресло-качалка» состояла из NaTi 2 (PO 4 ) 3 и Na 0,44 MnO 2 , о чем сообщили группы Уитакра и Чанга 161749 ,17 . Куи и др. обнаружили, что материалы с кристаллической структурой берлинской лазури (гексацианоферрат меди и никеля) содержали большие междоузлия, что позволяло вводить и извлекать Na + и/или K + (ссылка 18 , 19 ). Их емкости находились в диапазоне 50–60 мАч·г −1 . Одним словом, требуется гораздо больше работы по исследованию новых материалов с интеркалированным натрием, чтобы сделать водные натриевые батареи жизнеспособными в области крупномасштабного хранения энергии.
Поскольку материалы с интеркалированным натрием, подходящие для водных сред, ограничены, для создания перезаряжаемых батарей используется инновационная концепция электролитов со смешанными ионами Li + / Na + , как показано на рис. В таких батареях одна сторона связана с иммиграцией Li + между электролитами и электродом, а другая относится к обмену Na + между электродом и электролитами. При зарядке и разрядке общая концентрация Li + и Na + фиксируется для обеспечения зарядовой нейтральности электролитов, но изменяется соотношение Li + /Na + . Они отличаются от традиционных «кресел-качалок» литий-ионных аккумуляторов на основе иммиграции Li + между катодом и анодом. При этом две системы на основе смешанных электролитов Li 2 SO 4 /Na 2 SO 4 (LiMn 2 O 4 /Na 0,22 8 29080 Mn0085 0,44 MnO 2 /TiP 2 O 7 ), о которых, насколько нам известно, ранее не сообщалось. Емкость, рабочее напряжение и стабильность таких батарей зависят от электролитов. Система LiMn 2 O 4 /Na 0,22 MnO 2 для разделения Li + и Na + , основанная на уникальном механизме смешанной ионной батареи.
В таких батареях одна сторона связана с иммиграцией Li + между электролитами и электродом, а другая относится к обмену Na + между электродом и электролитами. При зарядке и разрядке общая концентрация Li + и Na + фиксируется для обеспечения зарядовой нейтральности электролитов, но изменяется соотношение Li + /Na + . Они отличаются от традиционных «кресел-качалок» литий-ионных аккумуляторов на основе иммиграции Li + между катодом и анодом. При этом две системы на основе смешанных электролитов Li 2 SO 4 /Na 2 SO 4 (LiMn 2 O 4 /Na 0,22 8 29080 Mn0085 0,44 MnO 2 /TiP 2 O 7 ), о которых, насколько нам известно, ранее не сообщалось. Емкость, рабочее напряжение и стабильность таких батарей зависят от электролитов. Система LiMn 2 O 4 /Na 0,22 MnO 2 для разделения Li + и Na + , основанная на уникальном механизме смешанной ионной батареи.
Открыть в отдельном окне
Схема смешанной ионно-ионной батареи Li + / Na + .
Интеркаляционные соединения лития и интеркаляционные соединения натрия используются для анода и катода соответственно. При зарядке (или разрядке) на аноде происходит накопление (или выделение) Li + , а на катоде — выделение (или накопление) Na + .
Характеристики Na
0,44 MnO 2, LiMn 2 O 4 и TiP 2 O 7Подробные процедуры синтеза трех вышеуказанных материалов описаны в Методах. Оксиды марганца образуют богатое структурное семейство, включающее материалы с туннельной структурой 1D-, 2D-, 3D-типа. Среди них Na 0,44 MnO 2 принадлежит к пространственной группе Pbam с орторомбической структурой (см. Дополнительный рисунок S1). Ионы марганца находятся в двух различных средах: все ионы Mn 4+ и половина ионов Mn 9Ионы 1748 3+
находятся в октаэдрических позициях, тогда как другие ионы Mn 3+ собраны в квадратно-пирамидальном окружении. Последний образует реберные цепочки, связанные вершинами с двумя двойными и одной тройной октаэдрической цепью, что приводит к образованию двух типов туннелей (S-образный туннель и пятиугольный туннель). Площадки в S-образном туннеле заполнены примерно наполовину, а площадки в пятиугольном туннеле заняты почти полностью. Исследования Ab initio показывают, что половина ионов натрия может обратимо встраиваться в Na 0,44 MnO 2 в диапазоне -0,10–0,85 В по сравнению с насыщенным каломельным электродом (SCE), что дает теоретическую емкость 60 мА·ч г -1 (ссылка 19 ). Рентгенограмма (XRD) порошков Na 0,44 MnO 2 на дополнительном рисунке S1 показывает пять сильных пиков при 14,2 °, 16,8 °, 19,7 °, 34,2 ° и 37,6 °, отвечающих отражениям ( 130), (140), (150), (280) и (151) плоскость орторомбической структуры соответственно 21 ,22 . Кроме того, не обнаруживаются пики, относящиеся к примеси Mn 2 O 3 14 ,22 .
Последний образует реберные цепочки, связанные вершинами с двумя двойными и одной тройной октаэдрической цепью, что приводит к образованию двух типов туннелей (S-образный туннель и пятиугольный туннель). Площадки в S-образном туннеле заполнены примерно наполовину, а площадки в пятиугольном туннеле заняты почти полностью. Исследования Ab initio показывают, что половина ионов натрия может обратимо встраиваться в Na 0,44 MnO 2 в диапазоне -0,10–0,85 В по сравнению с насыщенным каломельным электродом (SCE), что дает теоретическую емкость 60 мА·ч г -1 (ссылка 19 ). Рентгенограмма (XRD) порошков Na 0,44 MnO 2 на дополнительном рисунке S1 показывает пять сильных пиков при 14,2 °, 16,8 °, 19,7 °, 34,2 ° и 37,6 °, отвечающих отражениям ( 130), (140), (150), (280) и (151) плоскость орторомбической структуры соответственно 21 ,22 . Кроме того, не обнаруживаются пики, относящиеся к примеси Mn 2 O 3 14 ,22 . Частицы также хорошо кристаллизованы и растут анизотропно, что приводит к форме наностержней. Наностержни демонстрируют превосходное упорядочение атомов и всегда демонстрируют кристаллическую плоскость (110) с межплоскостным расстоянием 0,87 нм (дополнительный рисунок S1).
Частицы также хорошо кристаллизованы и растут анизотропно, что приводит к форме наностержней. Наностержни демонстрируют превосходное упорядочение атомов и всегда демонстрируют кристаллическую плоскость (110) с межплоскостным расстоянием 0,87 нм (дополнительный рисунок S1). Он состоит из октаэдра TiO 6 и тетраэдра PO 4 , имеющих общие углы в трехмерной сети (дополнительный рисунок S3). Такой каркас может приспособить Li + для вставки и извлечения, что приводит к теоретической емкости 121 мАч г -1 . Покрытый углеродом TiP 2 O 7 с чистой кубической фазой синтезируется методом твердофазной реакции (см. Метод и дополнительный рисунок S3). Он демонстрирует высокодисперсную морфологию частиц. ПЭМ-изображение TiP 9 с высоким разрешениемЧастица 0085 2 O 7 показывает, что аморфный углерод со средней толщиной 7 нм равномерно покрыт на поверхности частицы (дополнительный рисунок S3). Количество углерода в материалах составляет около 16 %, что оценивается термогравиметрическим анализом.
Он состоит из октаэдра TiO 6 и тетраэдра PO 4 , имеющих общие углы в трехмерной сети (дополнительный рисунок S3). Такой каркас может приспособить Li + для вставки и извлечения, что приводит к теоретической емкости 121 мАч г -1 . Покрытый углеродом TiP 2 O 7 с чистой кубической фазой синтезируется методом твердофазной реакции (см. Метод и дополнительный рисунок S3). Он демонстрирует высокодисперсную морфологию частиц. ПЭМ-изображение TiP 9 с высоким разрешениемЧастица 0085 2 O 7 показывает, что аморфный углерод со средней толщиной 7 нм равномерно покрыт на поверхности частицы (дополнительный рисунок S3). Количество углерода в материалах составляет около 16 %, что оценивается термогравиметрическим анализом. отображает три обратимые окислительно-восстановительные пары прибл. 0,05, 0,28 и 0,46 В относительно SCE в водном растворе Na 2 SO 4 электролиты, соответствующие введению и извлечению Na + (арт. 13 и 20 ). В смешанных электролитах Li 2 SO 4 /Na 2 SO 4 эти окислительно-восстановительные пары все еще существуют, но их потенциалы отличаются от потенциалов в электролитах Na 2 SO 4 . В электролитах Li 2 SO 4 три пика необратимого окисления при 0,08 В, 0,31 В и 0,49 В, связанные с удалением Na + из Na 0,44 MnO 2 наблюдаются в первом цикле. В последующих циклах видны очень слабые пики, связанные с внедрением и экстракцией Li + . Он заключает, что только очень небольшое количество Li + может быть обратимо вставлено/отключено в/из Na 0,44 MnO 2 , несмотря на его меньший ионный радиус (76 pm) по сравнению с Na + ( 102 pm).
отображает три обратимые окислительно-восстановительные пары прибл. 0,05, 0,28 и 0,46 В относительно SCE в водном растворе Na 2 SO 4 электролиты, соответствующие введению и извлечению Na + (арт. 13 и 20 ). В смешанных электролитах Li 2 SO 4 /Na 2 SO 4 эти окислительно-восстановительные пары все еще существуют, но их потенциалы отличаются от потенциалов в электролитах Na 2 SO 4 . В электролитах Li 2 SO 4 три пика необратимого окисления при 0,08 В, 0,31 В и 0,49 В, связанные с удалением Na + из Na 0,44 MnO 2 наблюдаются в первом цикле. В последующих циклах видны очень слабые пики, связанные с внедрением и экстракцией Li + . Он заключает, что только очень небольшое количество Li + может быть обратимо вставлено/отключено в/из Na 0,44 MnO 2 , несмотря на его меньший ионный радиус (76 pm) по сравнению с Na + ( 102 pm). Более того, Na + могут быть селективно экстрагированы и вставлены из/в Na 0,44 MnO 2 в присутствии Li + и Na 0,44 MnO 2 проявляет высокую селективность Na + по отношению к Li + . От –0,1 до 0,65 В против SCE, емкость разряда Na 0,44 MNO 2 в 1 м NA 2 SO 4 , 1 M NA 2 SO 4 + 0,125 M LI 2 2 SO 4 + 0,125 M LI 2 2 SO 4 , 1 M Na 2 SO 4 + 0,25 M Li 2 SO 4 и 1 M Na 2 SO 4 + 0,5 м LI 2 SO 4 Электролиты составляют 62,1, 60,7, 60,2 и 57,9 мэх соответственно (дополнительный рис. S4). Эти значения намного больше, чем 45 мА·ч·г -1·, полученные группой Уитакра, и хорошо согласуются с теоретической емкостью 60 мА·ч·г·-1·, что указывает на то, что примерно половина ионов натрия содержится в Na 0,44 MnO 2 может быть обратимо интеркалирован в туннели Na 0,44 MnO 2 в смешанных электролитах.
Более того, Na + могут быть селективно экстрагированы и вставлены из/в Na 0,44 MnO 2 в присутствии Li + и Na 0,44 MnO 2 проявляет высокую селективность Na + по отношению к Li + . От –0,1 до 0,65 В против SCE, емкость разряда Na 0,44 MNO 2 в 1 м NA 2 SO 4 , 1 M NA 2 SO 4 + 0,125 M LI 2 2 SO 4 + 0,125 M LI 2 2 SO 4 , 1 M Na 2 SO 4 + 0,25 M Li 2 SO 4 и 1 M Na 2 SO 4 + 0,5 м LI 2 SO 4 Электролиты составляют 62,1, 60,7, 60,2 и 57,9 мэх соответственно (дополнительный рис. S4). Эти значения намного больше, чем 45 мА·ч·г -1·, полученные группой Уитакра, и хорошо согласуются с теоретической емкостью 60 мА·ч·г·-1·, что указывает на то, что примерно половина ионов натрия содержится в Na 0,44 MnO 2 может быть обратимо интеркалирован в туннели Na 0,44 MnO 2 в смешанных электролитах. Уникальная форма наностержня и хорошая кристалличность Na 0,44 MnO 2 могут объяснить его высокую емкость и хорошую обратимость. Также установлено, что емкость немного снижается с увеличением соотношения Li + /Na + .
Уникальная форма наностержня и хорошая кристалличность Na 0,44 MnO 2 могут объяснить его высокую емкость и хорошую обратимость. Также установлено, что емкость немного снижается с увеличением соотношения Li + /Na + .
 соотношение, как и следовало ожидать из кинетических соображений. На кинетику введения и экстракции сильно влияет концентрация лития. В ходе реакции внедрения Li + уменьшение концентрации лития приводит к уменьшению предельного диффузионного тока и, следовательно, к увеличению концентрационного перенапряжения, что приводит к отрицательному сдвигу потенциала пика. С точки зрения реакции экстракции Li + уменьшение концентрации лития приводит к более легкому удалению Li + из объемного LiMn 2 O 4 , что также смещает потенциал пика в сторону меньшего значения. Также наблюдается, что как потенциал плато заряда / разряда, так и емкость уменьшаются с уменьшением соотношения Li + / Na + (см. Дополнительный рис. S4).
соотношение, как и следовало ожидать из кинетических соображений. На кинетику введения и экстракции сильно влияет концентрация лития. В ходе реакции внедрения Li + уменьшение концентрации лития приводит к уменьшению предельного диффузионного тока и, следовательно, к увеличению концентрационного перенапряжения, что приводит к отрицательному сдвигу потенциала пика. С точки зрения реакции экстракции Li + уменьшение концентрации лития приводит к более легкому удалению Li + из объемного LiMn 2 O 4 , что также смещает потенциал пика в сторону меньшего значения. Также наблюдается, что как потенциал плато заряда / разряда, так и емкость уменьшаются с уменьшением соотношения Li + / Na + (см. Дополнительный рис. S4). В смешанных электролитах потенциал пика уменьшается с уменьшением отношения Li + /Na + . Аналогичная тенденция наблюдается и для материала LiMn 2 O 4 . В электролитах Na 2 SO 4 пиков окислительно-восстановительного потенциала не наблюдается, что означает, что TiP 2 O 7 может только накапливать и выделять Li + . Зарядно-разрядная емкость между 0 В и -0,9 В по сравнению с SCE в смешанных электролитах близка к емкости в электролитах Li 2 SO 4 , что указывает на то, что Na + не оказывает очевидного влияния на емкость TiP . 2 O 7 (дополнительный рис. S4). Кулоновская эффективность в 1 м Li 2 SO 4 , 1 M N NA 2 SO 4 + 0,5 м LI 2 SO 4 , 1 M NA 2 SO 4 + 0,25 М. Ли 2 SO 4 и 1 M Na 2 SO 4 + 0,125 M Li 2 SO 4 электролиты составляют 86,7 %, 81,3 % и 92,3 % соответственно.
В смешанных электролитах потенциал пика уменьшается с уменьшением отношения Li + /Na + . Аналогичная тенденция наблюдается и для материала LiMn 2 O 4 . В электролитах Na 2 SO 4 пиков окислительно-восстановительного потенциала не наблюдается, что означает, что TiP 2 O 7 может только накапливать и выделять Li + . Зарядно-разрядная емкость между 0 В и -0,9 В по сравнению с SCE в смешанных электролитах близка к емкости в электролитах Li 2 SO 4 , что указывает на то, что Na + не оказывает очевидного влияния на емкость TiP . 2 O 7 (дополнительный рис. S4). Кулоновская эффективность в 1 м Li 2 SO 4 , 1 M N NA 2 SO 4 + 0,5 м LI 2 SO 4 , 1 M NA 2 SO 4 + 0,25 М. Ли 2 SO 4 и 1 M Na 2 SO 4 + 0,125 M Li 2 SO 4 электролиты составляют 86,7 %, 81,3 % и 92,3 % соответственно. Все они намного ниже теоретического 100%. Это может быть в основном вызвано разложением воды и следов кислорода в электролитах. Согласно уравнению Нернста, теоретический эволюционный потенциал H 2 при pH = 7 находится при -0,66 В относительно SCE, так же, как и окислительно-восстановительный потенциал Ti 3+ /Ti 4+ в TiP 2 O 7 (-0,66 В против SCE). Это означает, что эволюция H 2 может быть параллельна внедрению Li + в TiP 2 O 7 при разрядке. Отрицательные электроды-кандидаты для водной литий-ионной батареи оказались чувствительными к кислороду и воде в разряженном состоянии 10 . Потенциал плато заряда/разряда уменьшается с уменьшением отношения Li + /Na + , что согласуется с явлениями, наблюдаемыми в экспериментах CV.
Все они намного ниже теоретического 100%. Это может быть в основном вызвано разложением воды и следов кислорода в электролитах. Согласно уравнению Нернста, теоретический эволюционный потенциал H 2 при pH = 7 находится при -0,66 В относительно SCE, так же, как и окислительно-восстановительный потенциал Ti 3+ /Ti 4+ в TiP 2 O 7 (-0,66 В против SCE). Это означает, что эволюция H 2 может быть параллельна внедрению Li + в TiP 2 O 7 при разрядке. Отрицательные электроды-кандидаты для водной литий-ионной батареи оказались чувствительными к кислороду и воде в разряженном состоянии 10 . Потенциал плато заряда/разряда уменьшается с уменьшением отношения Li + /Na + , что согласуется с явлениями, наблюдаемыми в экспериментах CV. Рабочее напряжение батареи колеблется от 0,65 В до 1,3 В. А напряжение плато зарядки/разрядки в 1 M Na 2 SO 4 + 0,125 M Li 2 SO 4 составляет 30 мВ–4. выше, чем в 1 M Na 2 SO 4 + 0,25 M Li 2 SO 4 . В диапазоне от 0,65 В до 1,3 В батарея может давать обратимую емкость 23,5 мА·ч г·9.1748 -1 в 1 м NA 2 SO 4 + 0,25 м LI 2 SO 4 и 25,0 мАч G -1 в 1 M NA 2 SO 4 + 0,1255 M LI 2 SO 4 + 0,1255 M LI 2 SO 4 + 0,1255 M LI 2 . 2 SO 4 при скорости 0,4 C. При этом он показывает хороший кулоновский КПД после первого цикла (>96%) в обоих электролитах, что свидетельствует о хорошей обратимости аккумулятора. Также исследуется его циклическая устойчивость. Скорость угасания разрядной емкости намного выше в первые 10 циклов, чем после 10 циклов (см.
Рабочее напряжение батареи колеблется от 0,65 В до 1,3 В. А напряжение плато зарядки/разрядки в 1 M Na 2 SO 4 + 0,125 M Li 2 SO 4 составляет 30 мВ–4. выше, чем в 1 M Na 2 SO 4 + 0,25 M Li 2 SO 4 . В диапазоне от 0,65 В до 1,3 В батарея может давать обратимую емкость 23,5 мА·ч г·9.1748 -1 в 1 м NA 2 SO 4 + 0,25 м LI 2 SO 4 и 25,0 мАч G -1 в 1 M NA 2 SO 4 + 0,1255 M LI 2 SO 4 + 0,1255 M LI 2 SO 4 + 0,1255 M LI 2 . 2 SO 4 при скорости 0,4 C. При этом он показывает хороший кулоновский КПД после первого цикла (>96%) в обоих электролитах, что свидетельствует о хорошей обратимости аккумулятора. Также исследуется его циклическая устойчивость. Скорость угасания разрядной емкости намного выше в первые 10 циклов, чем после 10 циклов (см. ). Аналогичные явления наблюдаются и для LiMn 2 O 4 /Na 0,22 MnO 2 система. В 1 М электролитах Na 2 SO 4 + 0,125 M Li 2 SO 4 после 10 и 50 циклов сохраняется 83 % и 62 % исходной разрядной емкости соответственно. В случае 1 M Na 2 SO 4 + 0,25 M Li 2 SO 4 электролитов сохраняется только 76% и 58% исходной разрядной емкости. В результате повышение Na + /Li 9Соотношение 1748 + может улучшить циклическую стабильность батареи Na 0,44 MnO 2 /TiP 2 O 7 . Исследование возможностей сброса NA 0,44 MNO 2 /TIP 2 O 7 Батарея в 1 м NA 2 SO 4 + 0,125 м LI 2 SO 4 + 0,125 м LI 2 SO 4 IS Показывается в Попульке. Рис. S5. Разрядная емкость 23,3, 20,6, 17,7, 14,5 и 11,1 мА·ч г -1 найдена при скорости 0,5, 1, 2, 4 и 8 C соответственно.
). Аналогичные явления наблюдаются и для LiMn 2 O 4 /Na 0,22 MnO 2 система. В 1 М электролитах Na 2 SO 4 + 0,125 M Li 2 SO 4 после 10 и 50 циклов сохраняется 83 % и 62 % исходной разрядной емкости соответственно. В случае 1 M Na 2 SO 4 + 0,25 M Li 2 SO 4 электролитов сохраняется только 76% и 58% исходной разрядной емкости. В результате повышение Na + /Li 9Соотношение 1748 + может улучшить циклическую стабильность батареи Na 0,44 MnO 2 /TiP 2 O 7 . Исследование возможностей сброса NA 0,44 MNO 2 /TIP 2 O 7 Батарея в 1 м NA 2 SO 4 + 0,125 м LI 2 SO 4 + 0,125 м LI 2 SO 4 IS Показывается в Попульке. Рис. S5. Разрядная емкость 23,3, 20,6, 17,7, 14,5 и 11,1 мА·ч г -1 найдена при скорости 0,5, 1, 2, 4 и 8 C соответственно.
 Мы выбрали несколько электролитов для изучения (см. ). Во-первых, Na 2 SO 4 и раствор Li 2 SO 4 . Перед зарядкой в ячейку вводят первичный раствор Na 2 SO 4 с соотношением Li + /Na + 1/83. После зарядки соотношение Li + / Na + увеличивается до 1/10. Это связано с выходом Li + из катода LiMn 2 O 4 и селективным захватом Na + из электролитов катодом Na 0,22 MnO 2 анод. Напротив, раствор Li 2 SO 4 заменяет раствор Na 2 SO 4 в процессе разрядки. Соотношение Li + /Na + в электролитах падает со 144/1 до 13/1 после разрядки. Причина в том, что Li + в электролитах интеркалируется в катод, а Na + диффундирует с анода в электролиты при разряде. Аналогичные изменения наблюдаются и для растворов смешанных ионов.
Мы выбрали несколько электролитов для изучения (см. ). Во-первых, Na 2 SO 4 и раствор Li 2 SO 4 . Перед зарядкой в ячейку вводят первичный раствор Na 2 SO 4 с соотношением Li + /Na + 1/83. После зарядки соотношение Li + / Na + увеличивается до 1/10. Это связано с выходом Li + из катода LiMn 2 O 4 и селективным захватом Na + из электролитов катодом Na 0,22 MnO 2 анод. Напротив, раствор Li 2 SO 4 заменяет раствор Na 2 SO 4 в процессе разрядки. Соотношение Li + /Na + в электролитах падает со 144/1 до 13/1 после разрядки. Причина в том, что Li + в электролитах интеркалируется в катод, а Na + диффундирует с анода в электролиты при разряде. Аналогичные изменения наблюдаются и для растворов смешанных ионов. Ли 9Отношение 1748 + /Na + увеличивается после зарядки и уменьшается после разрядки. Таким образом, система LiMn 2 O 4 /Na 0,22 MnO 2 может обогащать Li + в электролитах при зарядке и обогащать Na + при разрядке.
Ли 9Отношение 1748 + /Na + увеличивается после зарядки и уменьшается после разрядки. Таким образом, система LiMn 2 O 4 /Na 0,22 MnO 2 может обогащать Li + в электролитах при зарядке и обогащать Na + при разрядке. A.
A. A.
A. Отсечка напряжения: 0,1 В и 1,05 В.
Отсечка напряжения: 0,1 В и 1,05 В. Несоответствие приводит к свободному перемещению Li + в туннелях. Как LiMn 2 O 4 , так и TiP 2 O 7 ведут себя как ионные сита, демонстрирующие очень высокую ионную селективность по отношению к Li + . Их специфическая селективность легко объясняется стерическим эффектом: туннели слишком малы для проникновения ионов металлов с ионными радиусами больше, чем Li + .
Несоответствие приводит к свободному перемещению Li + в туннелях. Как LiMn 2 O 4 , так и TiP 2 O 7 ведут себя как ионные сита, демонстрирующие очень высокую ионную селективность по отношению к Li + . Их специфическая селективность легко объясняется стерическим эффектом: туннели слишком малы для проникновения ионов металлов с ионными радиусами больше, чем Li + . Если теоретические возможности NA 0,44 . LiMn 2 O 4 и TiP 2 O 7 полностью израсходованы, батареи с удельной энергией ок. Может потребоваться 21 Втч кг -1 или 40 Втч кг -1 в расчете на общий вес материалов активного электрода. Таким образом, Na 0,44 MnO 2 /TiP 2 O 7 система может превосходить CuHCF/AC-PPy и Na 0,44 MnO 2 /системы с активированным углем для крупномасштабного хранения энергии . Фактически в нашей работе получены две батареи с удельной энергией 17 Втч·кг·-1· и 25 Втч·кг·-1·. Как достичь теоретических возможностей этих соединений и длительного срока службы систем, все еще остается проблемой.
Если теоретические возможности NA 0,44 . LiMn 2 O 4 и TiP 2 O 7 полностью израсходованы, батареи с удельной энергией ок. Может потребоваться 21 Втч кг -1 или 40 Втч кг -1 в расчете на общий вес материалов активного электрода. Таким образом, Na 0,44 MnO 2 /TiP 2 O 7 система может превосходить CuHCF/AC-PPy и Na 0,44 MnO 2 /системы с активированным углем для крупномасштабного хранения энергии . Фактически в нашей работе получены две батареи с удельной энергией 17 Втч·кг·-1· и 25 Втч·кг·-1·. Как достичь теоретических возможностей этих соединений и длительного срока службы систем, все еще остается проблемой. Существующие методы очистки лития («поточный процесс выпаривания соды», аморфный Al 2 O 3 процесс и метод ионного обмена) являются методами влажной химии 24 ,25 . Поскольку такие методы требуют большого количества химикатов (например, Na 2 CO 3 , AlCl 3 , оксиды марганца и HCl и т. д.), они дороги, медленны и неэффективны. Поэтому необходимо исследовать новые эффективные методы извлечения лития из рассола. На основе продемонстрированного механизма Li + / Na + смешанных ионных батарей предлагается новый электрохимический метод. схематически показан принцип работы системы смешанных ионных аккумуляторов для Li 9.1748 + /Na + разделение. Батарея основана на высвобождающем катоде Li + и захватывающем аноде Na + . На первом этапе (зарядка) батарея высвобождает Li + и захватывает Na + для обогащения Li + в растворе смешанного иона I.
Существующие методы очистки лития («поточный процесс выпаривания соды», аморфный Al 2 O 3 процесс и метод ионного обмена) являются методами влажной химии 24 ,25 . Поскольку такие методы требуют большого количества химикатов (например, Na 2 CO 3 , AlCl 3 , оксиды марганца и HCl и т. д.), они дороги, медленны и неэффективны. Поэтому необходимо исследовать новые эффективные методы извлечения лития из рассола. На основе продемонстрированного механизма Li + / Na + смешанных ионных батарей предлагается новый электрохимический метод. схематически показан принцип работы системы смешанных ионных аккумуляторов для Li 9.1748 + /Na + разделение. Батарея основана на высвобождающем катоде Li + и захватывающем аноде Na + . На первом этапе (зарядка) батарея высвобождает Li + и захватывает Na + для обогащения Li + в растворе смешанного иона I. После зарядки раствор I заменяется другим раствором смешанного иона II. Затем батарея разряжается для обогащения Na + , так как Li + захватываются катодом, а Na + освобождаются от анода. На последнем этапе смешанный ионный раствор II заменяется смешанным ионным раствором I для следующего цикла. В ходе повторяющихся циклов в конечном итоге получают растворы, обогащенные Li + и Na + , соответственно. По сравнению с другими способами очистки, указанными выше, этот метод имеет следующие два очевидных преимущества. Во-первых, он двухфункциональный. Смешанная ионная батарея Li + / Na + может использоваться как для очистки лития, так и для хранения энергии. Во-вторых, этот электрохимический метод экологически чистый и энергоэффективный. В отличие от мокрых химических методов, он не требует никаких химикатов и не производит отходов для утилизации. Для проверки работоспособности метода LiMn 2 O 4 /Na 0,22 MnO 2 система выбрана.
После зарядки раствор I заменяется другим раствором смешанного иона II. Затем батарея разряжается для обогащения Na + , так как Li + захватываются катодом, а Na + освобождаются от анода. На последнем этапе смешанный ионный раствор II заменяется смешанным ионным раствором I для следующего цикла. В ходе повторяющихся циклов в конечном итоге получают растворы, обогащенные Li + и Na + , соответственно. По сравнению с другими способами очистки, указанными выше, этот метод имеет следующие два очевидных преимущества. Во-первых, он двухфункциональный. Смешанная ионная батарея Li + / Na + может использоваться как для очистки лития, так и для хранения энергии. Во-вторых, этот электрохимический метод экологически чистый и энергоэффективный. В отличие от мокрых химических методов, он не требует никаких химикатов и не производит отходов для утилизации. Для проверки работоспособности метода LiMn 2 O 4 /Na 0,22 MnO 2 система выбрана. Используются два смешанных электролита, как показано на рис. Сначала в ячейку добавляют раствор Li 2 SO 4 +Na 2 SO 4 с соотношением Li + /Na + 100/42 (раствор I). После зарядки соотношение Li + / Na + увеличивается до 100/35. Затем раствор I удаляют и заменяют другим раствором (раствором II) для следующего шага. После разрядки Li 9Соотношение 1748 + /Na + в растворе II снижается с 47/100 до 41/100. Затем батарею LiMn 2 O 4 /Na 0,22 MnO 2 подвергают второму циклу. После двух циклов соотношение Li + /Na + в растворе I увеличивается до 100/29, а соотношение Li + /Na + в растворе II падает до 36/100. Эти результаты показывают, что смешанная батарея Li + / Na + может применяться для разделения Li + и Na + .
Используются два смешанных электролита, как показано на рис. Сначала в ячейку добавляют раствор Li 2 SO 4 +Na 2 SO 4 с соотношением Li + /Na + 100/42 (раствор I). После зарядки соотношение Li + / Na + увеличивается до 100/35. Затем раствор I удаляют и заменяют другим раствором (раствором II) для следующего шага. После разрядки Li 9Соотношение 1748 + /Na + в растворе II снижается с 47/100 до 41/100. Затем батарею LiMn 2 O 4 /Na 0,22 MnO 2 подвергают второму циклу. После двух циклов соотношение Li + /Na + в растворе I увеличивается до 100/29, а соотношение Li + /Na + в растворе II падает до 36/100. Эти результаты показывают, что смешанная батарея Li + / Na + может применяться для разделения Li + и Na + .

 Эту пасту измельчали в шаровой мельнице на планетарной шаровой мельнице при 400 об/мин в течение 8 ч. После измельчения в шаровой мельнице смесь сушили при 80°С для выпаривания этанола. Затем последовательно прогревали 5 ч при 300°С и 12 ч при 900°С на воздухе с промежуточными перетираниями. Полученный белый TiP 2 O 7 твердые вещества, называемые свежеприготовленными TiP 2 O 7 , гомогенизировали в ступке для дальнейшего использования. Для TiP 2 O 7 с углеродным покрытием смешивали 2,5 г свежеприготовленного TiP 2 O 7 , 2 г глюкозы и соответствующее количество этанола, а затем измельчали в шаровой мельнице в течение 4 часов. Твердые вещества получали выпариванием этанола при 80°С. После прокаливания при 700°C в течение 5 ч в Ar твердые вещества стали черными, что указывает на то, что TiP 2 O 7 были покрыты углеродом.
Эту пасту измельчали в шаровой мельнице на планетарной шаровой мельнице при 400 об/мин в течение 8 ч. После измельчения в шаровой мельнице смесь сушили при 80°С для выпаривания этанола. Затем последовательно прогревали 5 ч при 300°С и 12 ч при 900°С на воздухе с промежуточными перетираниями. Полученный белый TiP 2 O 7 твердые вещества, называемые свежеприготовленными TiP 2 O 7 , гомогенизировали в ступке для дальнейшего использования. Для TiP 2 O 7 с углеродным покрытием смешивали 2,5 г свежеприготовленного TiP 2 O 7 , 2 г глюкозы и соответствующее количество этанола, а затем измельчали в шаровой мельнице в течение 4 часов. Твердые вещества получали выпариванием этанола при 80°С. После прокаливания при 700°C в течение 5 ч в Ar твердые вещества стали черными, что указывает на то, что TiP 2 O 7 были покрыты углеродом. Морфология и структура образцов были проанализированы с помощью автоэмиссионного сканирующего электронного микроскопа Hitachi S-4800 и просвечивающего электронного микроскопа FEI Tecnai G2 F20 при ускоряющем напряжении 200 кВ. Термогравиметрический анализ выполняли на термогравиметрическом/дифференциальном термическом анализаторе Pyris Diamond фирмы Perkin-Elmer. Элементный анализ проводили на оптико-эмиссионном спектрометре с индуктивно-связанной плазмой (Perkin Elmer Optima 2100 DV).
Морфология и структура образцов были проанализированы с помощью автоэмиссионного сканирующего электронного микроскопа Hitachi S-4800 и просвечивающего электронного микроскопа FEI Tecnai G2 F20 при ускоряющем напряжении 200 кВ. Термогравиметрический анализ выполняли на термогравиметрическом/дифференциальном термическом анализаторе Pyris Diamond фирмы Perkin-Elmer. Элементный анализ проводили на оптико-эмиссионном спектрометре с индуктивно-связанной плазмой (Perkin Elmer Optima 2100 DV). %) в н-метил-2-пирролидиноне на стальной железной сетке и сушки на воздухе при 80°С в течение 12 ч. Для электрохимических испытаний были вырезаны диски диаметром 1,3 см. Массовые нагрузки на электроды определяли путем сравнения массы электрода с массой исходного бланка. На 0,22 MnO 2 электродов были изготовлены электрохимическим окислением электродов Na 0,44 MnO 2 (постоянный ток: 30 мАg −1 , напряжение отсечки: 0,65 V против SCE). Для электродов TiP 2 O 7 использовали деаэрированные растворы, полученные барботированием газа Ar в течение 60 мин. Соотношение масс материалов анода и катода рассчитано как 1,80 для системы LiMn 2 O 4 /Na 0,22 MnO 2 и 0,85 для Na 0,44 MNO 2 /TIP 2 O 7 , в соответствии с возможностями NA 0,44 MNO 2 , LIMN 2 O 4 и Carbon-Coated 2 O 4 и Carbon-Coated 2 O 4 и Carbon-Coated 2 O 4 и Carbon-Coated 2 O 4 и Carbon-Coated 2 O 4 и Carbon-Coated 2 .
%) в н-метил-2-пирролидиноне на стальной железной сетке и сушки на воздухе при 80°С в течение 12 ч. Для электрохимических испытаний были вырезаны диски диаметром 1,3 см. Массовые нагрузки на электроды определяли путем сравнения массы электрода с массой исходного бланка. На 0,22 MnO 2 электродов были изготовлены электрохимическим окислением электродов Na 0,44 MnO 2 (постоянный ток: 30 мАg −1 , напряжение отсечки: 0,65 V против SCE). Для электродов TiP 2 O 7 использовали деаэрированные растворы, полученные барботированием газа Ar в течение 60 мин. Соотношение масс материалов анода и катода рассчитано как 1,80 для системы LiMn 2 O 4 /Na 0,22 MnO 2 и 0,85 для Na 0,44 MNO 2 /TIP 2 O 7 , в соответствии с возможностями NA 0,44 MNO 2 , LIMN 2 O 4 и Carbon-Coated 2 O 4 и Carbon-Coated 2 O 4 и Carbon-Coated 2 O 4 и Carbon-Coated 2 O 4 и Carbon-Coated 2 O 4 и Carbon-Coated 2 . 7 . Микроэлектрохимическая ячейка, состоящая из анода Na 0,22 MnO 2 и катода LiMn 2 O 4 , была изготовлена для проверки изменения соотношения Li + / Na + во время заряда и разряда. Расстояние между двумя электродами было зафиксировано на уровне 2,2 мм. Объем электролитов составлял 1,0 мл, а общая концентрация Li + и Na + составляло около 0,35 M. Для определения соотношения Li + / Na + использовали оптическую эмиссионную спектроскопию с индуктивно связанной плазмой (ICP-OES).
7 . Микроэлектрохимическая ячейка, состоящая из анода Na 0,22 MnO 2 и катода LiMn 2 O 4 , была изготовлена для проверки изменения соотношения Li + / Na + во время заряда и разряда. Расстояние между двумя электродами было зафиксировано на уровне 2,2 мм. Объем электролитов составлял 1,0 мл, а общая концентрация Li + и Na + составляло около 0,35 M. Для определения соотношения Li + / Na + использовали оптическую эмиссионную спектроскопию с индуктивно связанной плазмой (ICP-OES). (672K, pdf)
(672K, pdf)  Нац. коммун.
3, 917 (2012). [PubMed] [Google Scholar]
Нац. коммун.
3, 917 (2012). [PubMed] [Google Scholar] Повышение циклической стабильности литий-ионных аккумуляторов на водной основе за счет удаления кислорода из электролита. Нац. хим.
2, 760–765 (2010). [PubMed] [Google Scholar]
Повышение циклической стабильности литий-ионных аккумуляторов на водной основе за счет удаления кислорода из электролита. Нац. хим.
2, 760–765 (2010). [PubMed] [Google Scholar] Электрохим. коммун.
12, 463–466 (2010). [Google Scholar]
Электрохим. коммун.
12, 463–466 (2010). [Google Scholar] Нац. коммун.
2, 550 (2011). [PubMed] [Google Scholar]
Нац. коммун.
2, 550 (2011). [PubMed] [Google Scholar] 46, 3289–3294 (2007). [PubMed] [Google Scholar]
46, 3289–3294 (2007). [PubMed] [Google Scholar] Подробнее на странице для начинающих.
Подробнее на странице для начинающих.
 Эта путаница возникает из-за того, что мы склонны предполагать, что единственными носителями тока являются электроны. На самом деле положительные ионы также являются носителями тока и текут в том же направлении, что и ток. В гальваническом элементе положительные ионы переносят ток через элемент, а электроны переносят ток во внешней цепи. Посмотрите на Бенджамина Франклина, которого ложно обвинили в неправильном названии текущего потока.
Эта путаница возникает из-за того, что мы склонны предполагать, что единственными носителями тока являются электроны. На самом деле положительные ионы также являются носителями тока и текут в том же направлении, что и ток. В гальваническом элементе положительные ионы переносят ток через элемент, а электроны переносят ток во внешней цепи. Посмотрите на Бенджамина Франклина, которого ложно обвинили в неправильном названии текущего потока.
Анод или отрицательный электрод является восстановительным или топливным электродом. Он отдает электроны во внешнюю цепь и окисляется в ходе электрохимической (разрядной) реакции. Обычно это металл или сплав, но также используется водород. Анодный процесс – окисление металлического восстановителя с образованием ионов металлов.
( LEO Потерянные электроны — Окисление )
Альтернативно
( МАСЛО — Окисление — это потеря)
 Обычно это оксид металла или сульфид, но также используется кислород. Катодный процесс представляет собой восстановление окислителя (оксида) до выхода металла.
Обычно это оксид металла или сульфид, но также используется кислород. Катодный процесс представляет собой восстановление окислителя (оксида) до выхода металла. ( GER Прирост электронов — Уменьшение ). Помните мнемонику рычания льва.
Альтернативно
( Буровая установка — Уменьшение усиления) Альтернативная мнемоника — НЕФТЯНАЯ БУРАЯ
Ионы металлов представляют собой атомы металлов, у которых отсутствуют электроны, и поэтому они заряжены положительно. Частицы с отсутствующими электронами называются катионами , и во время разряда они движутся через электролит к положительному электроду, ошибочно называемому катодом * См. примечание ниже.
примечание ниже.
Анионы представляют собой атомы или частицы с избытком электронов и, следовательно, отрицательно заряженные. Во время разряда они притягиваются через внешнюю цепь к отрицательному электроду, называемому анодом 9.0043 * .
 Это действие уменьшает разность потенциалов на ячейке до нуля. Цепь замыкается или уравновешивается потоком положительных ионов в электролите от анода к катоду.
Это действие уменьшает разность потенциалов на ячейке до нуля. Цепь замыкается или уравновешивается потоком положительных ионов в электролите от анода к катоду.
КАТОД
ДЭНИЭЛЛ СЕЛЛ
АНОД
положительный полюс батареи
отрицательный полюс аккумулятора
Цинк теряет электроны быстрее, чем медь
Принимает электроны из внешней цепи
Поставляет электроны во внешнюю цепь
Отложения металлической меди на катоде
Цинк переходит в водный раствор
Сайт Сокращение
Участок Окисление
Полуэлемент с самым высоким электродным потенциалом
Полуэлемент с самым низким электродным потенциалом
Германия
Лев
 Такое расположение показывает, что фактически имеется два полуклеток , в которых происходят химические действия. Каждый электрод погружен в отдельный электролит, с которым он реагирует. Потенциал электрода , положительный или отрицательный, представляет собой напряжение, развиваемое одним электродом. Электролиты отделены друг от друга солевым мостиком или пористой мембраной , которая является нейтральной и не принимает участия в реакции. В процессе осмоса он пропускает ионы сульфата, но блокирует ионы металлов.
Такое расположение показывает, что фактически имеется два полуклеток , в которых происходят химические действия. Каждый электрод погружен в отдельный электролит, с которым он реагирует. Потенциал электрода , положительный или отрицательный, представляет собой напряжение, развиваемое одним электродом. Электролиты отделены друг от друга солевым мостиком или пористой мембраной , которая является нейтральной и не принимает участия в реакции. В процессе осмоса он пропускает ионы сульфата, но блокирует ионы металлов.

* Важное примечание: Существует много путаницы, связанной с обозначением электродов вторичных элементов как анодов или катодов. Строго говоря, обозначение зависит от направления тока. Это означает, что он меняется в зависимости от того, заряжается или разряжается элемент. Это связано с тем, что анод определяется как электрод, который производит электроны (окислительная полуреакция), а катод определяется как электрод, который получает электроны (восстановительная полуреакция). Это справедливо как для зарядки, так и для разрядки. Другими словами:
Во время разряда анод является отрицательным электродом, а катод — положительным электродом.
Во время зарядки анод является положительным электродом, а катод — отрицательным электродом.
Мнемоника ACID для «Анодный ток в устройство» связывает обозначение электрода с направлением тока.
Путаница, к сожалению, усугубляется из-за различных соглашений об именах, обычно применяемых к электродам батареи. Электроды вторичных элементов обычно называют просто анодами и катодами, которые соответствуют реакции разрядки, при вводящем в заблуждение игнорировании реверсирования, соответствующего процессу зарядки.
Другой способ взглянуть на это состоит в том, что полярность катода по отношению к аноду может быть положительной или отрицательной. Таким образом, общепринятые обозначения катода и анода не меняются в зависимости от направления тока.
 Таким образом, ячейки можно использовать только один раз.
Таким образом, ячейки можно использовать только один раз.Действие аккумуляторной батареи (значительно упрощенное)
 Энергия, закачиваемая в клетку, возвращает активные химические вещества в исходное состояние.
Энергия, закачиваемая в клетку, возвращает активные химические вещества в исходное состояние. Относительные восстановительные и окислительные способности элементов указаны цветной стрелкой в Периодической таблице ниже. Сильные восстановители сгруппированы слева, а сильные окислители сгруппированы справа.
Относительные восстановительные и окислительные способности элементов указаны цветной стрелкой в Периодической таблице ниже. Сильные восстановители сгруппированы слева, а сильные окислители сгруппированы справа.Элементы в каждой отдельной группе имеют одинаковое количество «валентных» электронов на внешней валентной оболочке. Поскольку количество валентных электронов определяет, как атом химически реагирует с другими атомами, элементы в пределах определенной группы, как правило, имеют схожие химические свойства.
Внешняя электронная оболочка может иметь до восьми электронов, но с полным набором из восьми электронов, как в благородных газах (группа 18), нет «свободных» электронов, доступных для участия в химических реакциях, поэтому благородные газы химически нереактивный или инертный. Таким образом, во внешней валентной оболочке атомов фактически имеется только семь возможных валентных электронов, и каждый элемент имеет уникальное характеристическое число электронов, определяющее его свойства. Способы взаимодействия атомов с другими атомами, другими словами их возможные химические реакции, определяются числом электронов в их валентных оболочках.
Способы взаимодействия атомов с другими атомами, другими словами их возможные химические реакции, определяются числом электронов в их валентных оболочках.
Наиболее реактивные элементы находятся в левом и правом краях таблицы. Это щелочные металлы (группа 1), атомы которых имеют только один электрон в своих валентных оболочках, и галогены (группа 17) с семью валентными электронами, у которых отсутствует только один электрон из полной оболочки.
Все элементы в любой период имеют одинаковое количество электронных оболочек или орбит, что соответствует количеству возможных энергетических уровней электронов в атоме. Номер периода соответствует количеству электронных оболочек.
Число, содержащееся в каждой ячейке в таблице, представляет собой атомный номер элемента, который представляет собой число протонов в ядре каждого атома. Двигаясь слева направо по таблице от группы 1 к группе 18 в каждом периоде, число протонов на атом увеличивается на один от каждого элемента к соседнему элементу.
Двигаясь слева направо по таблице от группы 1 к группе 18 в каждом периоде, число протонов на атом увеличивается на один от каждого элемента к соседнему элементу.
 Порядок показывает тенденцию одного металла восстанавливать ионы любого другого металла ниже его в ряду. Потенциалы выбраны по отношению к водороду, потенциал которого был произвольно определен как ноль, что приводит к положительным и отрицательным значениям электродного потенциала. На самом деле они следуют прогрессивной последовательности, охватывающей диапазон около 6 вольт.
Порядок показывает тенденцию одного металла восстанавливать ионы любого другого металла ниже его в ряду. Потенциалы выбраны по отношению к водороду, потенциал которого был произвольно определен как ноль, что приводит к положительным и отрицательным значениям электродного потенциала. На самом деле они следуют прогрессивной последовательности, охватывающей диапазон около 6 вольт. Катод (восстановление) | Стандартный потенциал |
Li + (водный) + e — —> Li(s) | -3,04 |
K + (водный) + e — —> K(s) | -2,92 |
Ca 2+ (водный) + 2e — —> Ca(s) | -2,76 |
Na + (водный) + e — —> Na(s) | -2,71 |
Zn 2+ (водн. | -0,76 |
2H + + 2e — —> H 2 | 0 |
Cu 2+ (водн.) + 2e — —> Cu(s) | 0,34 |
О 3 + (г) + 2H + (водн.) + 2e — —> O 2 (г) + H 2 O(л) | 2,07 |
F 2 (g) + 2e — —> 2F — (aq) | 2,87 |
 Самым сильным окислителем является фтор с наибольшим положительным числом для стандартного электродного потенциала.
Самым сильным окислителем является фтор с наибольшим положительным числом для стандартного электродного потенциала. Атомы с одним или двумя валентными электронами меньше, чем у закрытой оболочки, также обладают высокой реакционной способностью из-за тенденции либо приобретать недостающие электроны и образовывать отрицательные ионы (восстановление), либо делиться электронами и образовывать ковалентные связи. Самая низкая энергия для вида наступает, когда его внешняя оболочка полностью занята электронами. Приобретение или потеря электронов изменяет энергетический уровень атома, и именно эта энергия высвобождается в виде электрической энергии во время разряда первичной или вторичной батареи или поглощается при зарядке вторичной батареи.
Атомы с одним или двумя валентными электронами меньше, чем у закрытой оболочки, также обладают высокой реакционной способностью из-за тенденции либо приобретать недостающие электроны и образовывать отрицательные ионы (восстановление), либо делиться электронами и образовывать ковалентные связи. Самая низкая энергия для вида наступает, когда его внешняя оболочка полностью занята электронами. Приобретение или потеря электронов изменяет энергетический уровень атома, и именно эта энергия высвобождается в виде электрической энергии во время разряда первичной или вторичной батареи или поглощается при зарядке вторичной батареи. Ф
Ф 
(Отрицательные клеммы)
(плюсовые клеммы)
ЛУЧШИЙ — (самый отрицательный)
ЛУЧШИЙ- (самый положительный)
ХУДШЕЕ — (наименее отрицательное)
ХУДШИЙ — (наименее положительный)
 Литиевые батареи (см. ниже), в которых используются неводные электролиты, не имеют этой проблемы и доступны с напряжением от 2,7 до 3,7 вольт. Однако использование неводных электролитов приводит к тому, что эти элементы имеют относительно высокий внутренний импеданс.
Литиевые батареи (см. ниже), в которых используются неводные электролиты, не имеют этой проблемы и доступны с напряжением от 2,7 до 3,7 вольт. Однако использование неводных электролитов приводит к тому, что эти элементы имеют относительно высокий внутренний импеданс. Такие металлы или сплавы используются для отрицательных электродов. Положительный электрод представляет собой гидроксид никеля, как в никель-кадмиевых батареях. Электролит, который также представляет собой водный раствор, поглощающий водород, такой как гидроксид калия, не принимает участия в реакции, а служит для переноса водорода между электродами.
Такие металлы или сплавы используются для отрицательных электродов. Положительный электрод представляет собой гидроксид никеля, как в никель-кадмиевых батареях. Электролит, который также представляет собой водный раствор, поглощающий водород, такой как гидроксид калия, не принимает участия в реакции, а служит для переноса водорода между электродами.

Слой SEI необходим для стабильности литиевых вторичных элементов, использующих угольные аноды.
Электролит энергично реагирует с угольным анодом во время начального формирования заряда, и образуется тонкий пассивирующий слой SEI, который замедляет скорость заряда и ограничивает ток |
Отложение слоя SEI является важной частью процесса формирования, когда клетки получают свой первый заряд.
НО слой SEI увеличивает внутреннее сопротивление элемента и снижает возможные скорости заряда, а также характеристики при высоких и низких температурах.
Чрезмерное тепло может привести к разрушению защитного барьерного слоя SEI, что приведет к перезапуску анодной реакции с выделением большего количества тепла, что приведет к тепловому разгону.
Толщина слоя SEI неоднородна и увеличивается с возрастом, увеличивая внутреннее сопротивление элемента, уменьшая его емкость и, следовательно, срок его службы.
Аноды из оксида титаната лития (LTO)
не вступают в неблагоприятную реакцию с обычно используемыми электролитами в литий-ионных элементах, поэтому слой SEI не образуется и не требуется в элементах LTO. Это дает новые степени свободы в изменении производительности ячеек. См. Варианты литиевых элементов
 К ним относятся литий-тионилхлорид и литий-диоксид серы, в которых используются реактивные электролиты и жидкие катоды для получения более высокой плотности энергии и мощности.
К ним относятся литий-тионилхлорид и литий-диоксид серы, в которых используются реактивные электролиты и жидкие катоды для получения более высокой плотности энергии и мощности.

 Плотность энергии также зависит от качества активных материалов, используемых в конструкции ячейки, с примесями, ограничивающими достижимую емкость ячейки. Вот почему элементы разных производителей с одинаковым химическим составом элементов и похожей конструкцией могут иметь различное энергосодержание и характеристики разряда.
Плотность энергии также зависит от качества активных материалов, используемых в конструкции ячейки, с примесями, ограничивающими достижимую емкость ячейки. Вот почему элементы разных производителей с одинаковым химическим составом элементов и похожей конструкцией могут иметь различное энергосодержание и характеристики разряда.
Примечание. На приведенной выше диаграмме литий в 20-100 раз более распространен по количеству атомов, чем свинец и никель. Причина, по которой он менее распространен, заключается в том, что литий, будучи гораздо более реакционноспособным, чем любой из металлов, обычно не встречается в свободном состоянии, а сочетается с другими элементами. Напротив, свинец, будучи менее реакционноспособным, чаще встречается в свободном состоянии, и его легче извлекать и очищать. Тяжелые металлы кадмий и ртуть, использование которых в настоящее время не рекомендуется из-за их токсичности, в 1000 раз менее распространены, чем литий.


 Кроме того, земная 1,4 × 10 21 килограммов морской воды содержат относительно высокое содержание лития 0,17 частей на миллион, что означает, что в Мировом океане содержится более 200 миллиардов тонн лития.
Кроме того, земная 1,4 × 10 21 килограммов морской воды содержат относительно высокое содержание лития 0,17 частей на миллион, что означает, что в Мировом океане содержится более 200 миллиардов тонн лития. С 1940-х годов литий в форме карбоната лития успешно использовался при лечении психических расстройств, особенно маниакальной депрессии. Однако, как и в случае с большинством химических веществ, небольшие дозы могут быть безопасными или терапевтическими, но слишком большие дозы могут привести к летальному исходу.
С 1940-х годов литий в форме карбоната лития успешно использовался при лечении психических расстройств, особенно маниакальной депрессии. Однако, как и в случае с большинством химических веществ, небольшие дозы могут быть безопасными или терапевтическими, но слишком большие дозы могут привести к летальному исходу. Однако, несмотря на многообещающие характеристики при температуре окружающей среды, на их работу при низких температурах (например, <0 °C) отрицательно влияет увеличение сопротивления электролита и межфазная нестабильность твердого электролита (SEI). Здесь, чтобы обойти эти проблемы, мы предлагаем специальные составы электролитов, включающие линейные и циклические растворители на основе эфира и соль трифторметансульфоната натрия, которые термически стабильны до -150 °C и позволяют формировать стабильный SEI при низких температурах. При тестировании в конфигурации батарейки типа «таблетка» Na||Na низкотемпературные электролиты допускают длительное циклирование при температурах до −80 °C. С помощью физико-химических измерений ex situ (например, рентгеновской фотоэлектронной спектроскопии, криогенной просвечивающей электронной микроскопии и атомно-силовой микроскопии) электродных измерений и расчетов теории функционала плотности мы исследуем механизмы, ответственные за эффективное низкотемпературное электрохимическое поведение.
Однако, несмотря на многообещающие характеристики при температуре окружающей среды, на их работу при низких температурах (например, <0 °C) отрицательно влияет увеличение сопротивления электролита и межфазная нестабильность твердого электролита (SEI). Здесь, чтобы обойти эти проблемы, мы предлагаем специальные составы электролитов, включающие линейные и циклические растворители на основе эфира и соль трифторметансульфоната натрия, которые термически стабильны до -150 °C и позволяют формировать стабильный SEI при низких температурах. При тестировании в конфигурации батарейки типа «таблетка» Na||Na низкотемпературные электролиты допускают длительное циклирование при температурах до −80 °C. С помощью физико-химических измерений ex situ (например, рентгеновской фотоэлектронной спектроскопии, криогенной просвечивающей электронной микроскопии и атомно-силовой микроскопии) электродных измерений и расчетов теории функционала плотности мы исследуем механизмы, ответственные за эффективное низкотемпературное электрохимическое поведение. Мы также сообщаем о сборке и испытаниях полного Na||Na 9 при температуре от −20 °C до −60 °C.0085 3 V 2 (PO 4 ) 3 ячейки для монет. Ячейка, испытанная при температуре -40 °C, показала начальную разрядную емкость 68 мАч·г·–1· с сохранением емкости примерно на 94% после 100 циклов при 22 мА g·–1·.
Мы также сообщаем о сборке и испытаниях полного Na||Na 9 при температуре от −20 °C до −60 °C.0085 3 V 2 (PO 4 ) 3 ячейки для монет. Ячейка, испытанная при температуре -40 °C, показала начальную разрядную емкость 68 мАч·г·–1· с сохранением емкости примерно на 94% после 100 циклов при 22 мА g·–1·.
 Тем не менее исследования Na-аккумуляторов при низких температурах ограничены, и, в частности, в значительной степени отсутствует понимание поведения металлического Na в качестве электрода 15,16,17,18 .
Тем не менее исследования Na-аккумуляторов при низких температурах ограничены, и, в частности, в значительной степени отсутствует понимание поведения металлического Na в качестве электрода 15,16,17,18 . Здесь, применяя такую стратегию электролита, мы демонстрируем, что раствор электролита, содержащий ациклический эфирный растворитель и совместимую соль Na, может увеличить рабочую температуру металлического Na до -40 °C. Обнаружено, что соль трифторметансульфоната (OTf) играет решающую роль в обеспечении образования стабильного SEI при низких температурах. Кроме того, добавление циклического эфирного растворителя для приготовления раствора электролита с бинарным растворителем может расширить температурный порог термостабильности до -150 °C. Мы демонстрируем стабильное металлическое покрытие/зачистку Na в симметричных ячейках при низких температурах до -80 °C, демонстрируя низкое перенапряжение ~150 мВ в течение более 750 ч. Эти характеристики расширяют возможности эксплуатации электродов из щелочных металлов при низких температурах в неводных растворах электролитов (см. Дополнительный рисунок 1 и Дополнительную таблицу 1 для сравнения с современным уровнем техники). Связанные экспериментальные характеристики (например, рентгеновская фотоэлектронная спектроскопия, криогенная просвечивающая электронная микроскопия и атомно-силовая микроскопия) и расчеты теории функционала плотности позволяют понять механистические особенности, которые обеспечивают эффективные низкотемпературные электрохимические характеристики.
Здесь, применяя такую стратегию электролита, мы демонстрируем, что раствор электролита, содержащий ациклический эфирный растворитель и совместимую соль Na, может увеличить рабочую температуру металлического Na до -40 °C. Обнаружено, что соль трифторметансульфоната (OTf) играет решающую роль в обеспечении образования стабильного SEI при низких температурах. Кроме того, добавление циклического эфирного растворителя для приготовления раствора электролита с бинарным растворителем может расширить температурный порог термостабильности до -150 °C. Мы демонстрируем стабильное металлическое покрытие/зачистку Na в симметричных ячейках при низких температурах до -80 °C, демонстрируя низкое перенапряжение ~150 мВ в течение более 750 ч. Эти характеристики расширяют возможности эксплуатации электродов из щелочных металлов при низких температурах в неводных растворах электролитов (см. Дополнительный рисунок 1 и Дополнительную таблицу 1 для сравнения с современным уровнем техники). Связанные экспериментальные характеристики (например, рентгеновская фотоэлектронная спектроскопия, криогенная просвечивающая электронная микроскопия и атомно-силовая микроскопия) и расчеты теории функционала плотности позволяют понять механистические особенности, которые обеспечивают эффективные низкотемпературные электрохимические характеристики. Полный Na||Na 3 V 2 (PO 4 ) 3 батарейки типа «таблетка» также собраны и испытаны при температуре от −20 °C до −60 °C. Ячейки, протестированные при -40 °C и -60 °C, показали начальную разрядную емкость ~68 и 39 мА·ч·г −1 соответственно, с сохранением емкости ~94% и 91% после 100 циклов при 22 мА g − 1 .
Полный Na||Na 3 V 2 (PO 4 ) 3 батарейки типа «таблетка» также собраны и испытаны при температуре от −20 °C до −60 °C. Ячейки, протестированные при -40 °C и -60 °C, показали начальную разрядную емкость ~68 и 39 мА·ч·г −1 соответственно, с сохранением емкости ~94% и 91% после 100 циклов при 22 мА g − 1 . Концентрацию соли в растворителе поддерживали на уровне 1 М для скрининга растворимости этих электролитов с одним растворителем при низких температурах. Результаты (дополнительная таблица 3) показывают, что растворимость NaPF 6 не может достигать концентрации 1 М во всех трех растворителях при температуре -35 ° C, в то время как другие четыре соли хорошо растворяются в ДЭГДМЭ. Следовательно, в то время как 1 M NaPF 6 -DEGDME оказался подходящим электролитом для металлического Na-анода в условиях окружающей среды 23 , он может не подходить для работы при низких температурах. Кроме того, DOL не может легко растворять соли Na, за исключением NaTFSI. Электролит, состоящий из 1 M NaPF 6 -DEGDME, был дополнительно исследован в диапазоне температур в симметричных ячейках Na||Na и нержавеющей стали||нержавеющей стали соответственно (дополнительный рисунок 2). Сравнение спектров электрохимической импедансной спектроскопии (ЭИС) 1 M NaPF 6 -DEGDME, испытанный в симметричных ячейках Na||Na, показывает, что сопротивление на границе раздела электрод-электролит при -20°C значительно выше, чем при 20°C (дополнительная таблица 4).
Концентрацию соли в растворителе поддерживали на уровне 1 М для скрининга растворимости этих электролитов с одним растворителем при низких температурах. Результаты (дополнительная таблица 3) показывают, что растворимость NaPF 6 не может достигать концентрации 1 М во всех трех растворителях при температуре -35 ° C, в то время как другие четыре соли хорошо растворяются в ДЭГДМЭ. Следовательно, в то время как 1 M NaPF 6 -DEGDME оказался подходящим электролитом для металлического Na-анода в условиях окружающей среды 23 , он может не подходить для работы при низких температурах. Кроме того, DOL не может легко растворять соли Na, за исключением NaTFSI. Электролит, состоящий из 1 M NaPF 6 -DEGDME, был дополнительно исследован в диапазоне температур в симметричных ячейках Na||Na и нержавеющей стали||нержавеющей стали соответственно (дополнительный рисунок 2). Сравнение спектров электрохимической импедансной спектроскопии (ЭИС) 1 M NaPF 6 -DEGDME, испытанный в симметричных ячейках Na||Na, показывает, что сопротивление на границе раздела электрод-электролит при -20°C значительно выше, чем при 20°C (дополнительная таблица 4). Между тем, общее сопротивление электролиту, измеренное в элементах из нержавеющей стали || из нержавеющей стали (конфигурация элемента показана на дополнительном рисунке 3), увеличивается с понижением температуры. Это увеличение сопротивления электролита особенно значительно при температуре ниже -20 ° C (дополнительная таблица 5), что может быть связано в основном с осаждением NaPF 6 в DEGDME при низких температурах. Таким образом, восемь из пятнадцати электролитов с одним растворителем термически стабильны при -35°C при концентрации 1M, и они были выбраны для дальнейшей электрохимической оценки с металлическим Na.
Между тем, общее сопротивление электролиту, измеренное в элементах из нержавеющей стали || из нержавеющей стали (конфигурация элемента показана на дополнительном рисунке 3), увеличивается с понижением температуры. Это увеличение сопротивления электролита особенно значительно при температуре ниже -20 ° C (дополнительная таблица 5), что может быть связано в основном с осаждением NaPF 6 в DEGDME при низких температурах. Таким образом, восемь из пятнадцати электролитов с одним растворителем термически стабильны при -35°C при концентрации 1M, и они были выбраны для дальнейшей электрохимической оценки с металлическим Na. Все электролиты с солью NaTFSI демонстрируют гораздо более высокие перенапряжения, чем другие электролиты. В частности, ячейка с NaTFSI-DOL демонстрирует возрастающее перенапряжение, которое быстро достигает 1 В, а ячейки с 1 М NaTFSI-DEGDME и 1 М NaTFSI-DME быстро выходят из строя, достигая защитного напряжения (5 В) через 32 и 44 ч. соответственно.
Все электролиты с солью NaTFSI демонстрируют гораздо более высокие перенапряжения, чем другие электролиты. В частности, ячейка с NaTFSI-DOL демонстрирует возрастающее перенапряжение, которое быстро достигает 1 В, а ячейки с 1 М NaTFSI-DEGDME и 1 М NaTFSI-DME быстро выходят из строя, достигая защитного напряжения (5 В) через 32 и 44 ч. соответственно. 1a, б). Для сравнения, для других составов электролита наблюдаются нестабильные и флуктуирующие скачки напряжения (рис. 1b, c). Из-за лучшей производительности NaOTf-DEGDME как при +20 ° C, так и при -20 ° C он был выбран для дальнейшего тестирования в симметричных ячейках при -40 ° C (рис. 2a). При такой низкой температуре начальное перенапряжение 40 мВ возрастает только до 50 мВ даже после 500 ч циклирования при 0,5 мА см -2 (емкость: 1 мАч · см -2 ), что соответствует увеличению менее чем на 0,2% за цикл. Даже при плотности тока 1 мА см -2 среднее перенапряжение 100 мВ может поддерживаться в течение более 300 часов. Что касается оценки кулоновской эффективности (КЭ) (рис. 2b), низкое среднее значение КЭ при -40°С по сравнению со значением при +20°С предполагает, что значительная потеря запасов Na происходит при -40°С.
1a, б). Для сравнения, для других составов электролита наблюдаются нестабильные и флуктуирующие скачки напряжения (рис. 1b, c). Из-за лучшей производительности NaOTf-DEGDME как при +20 ° C, так и при -20 ° C он был выбран для дальнейшего тестирования в симметричных ячейках при -40 ° C (рис. 2a). При такой низкой температуре начальное перенапряжение 40 мВ возрастает только до 50 мВ даже после 500 ч циклирования при 0,5 мА см -2 (емкость: 1 мАч · см -2 ), что соответствует увеличению менее чем на 0,2% за цикл. Даже при плотности тока 1 мА см -2 среднее перенапряжение 100 мВ может поддерживаться в течение более 300 часов. Что касается оценки кулоновской эффективности (КЭ) (рис. 2b), низкое среднее значение КЭ при -40°С по сравнению со значением при +20°С предполагает, что значительная потеря запасов Na происходит при -40°С. NaTFSI, NaClO 4 и соли NaFSI приводят к неровным поверхностям (порам и/или трещинам) осажденного Na (дополнительные рисунки 6–9).). Напротив, NaOTf-DEGDME обеспечивает относительно гладкие поверхности как при +20 °C, так и при −20 °C, где на поверхности и в поперечном сечении можно наблюдать неоднородную текстуру. Эта микроструктура становится более отчетливой при -40 °C (рис. 2в).
NaTFSI, NaClO 4 и соли NaFSI приводят к неровным поверхностям (порам и/или трещинам) осажденного Na (дополнительные рисунки 6–9).). Напротив, NaOTf-DEGDME обеспечивает относительно гладкие поверхности как при +20 °C, так и при −20 °C, где на поверхности и в поперечном сечении можно наблюдать неоднородную текстуру. Эта микроструктура становится более отчетливой при -40 °C (рис. 2в). Для S 2 p , дублеты при 169,6 эВ и 167,2 эВ (на основе 2 p 3/2 ) отнесены к SO 4 2− и SO 92−915 3 9, соответственно. Для F 1 s пики при 689,3 эВ и 684,1 эВ относятся к C–F и NaF соответственно 24,25,26,27,28,29 . Эти РФЭС-спектры при разных температурах показывают сходный состав поверхности SEI, что позволяет предположить существование соединений, содержащих –CF 3 , Na 2 SO 4 , Na 2 SO 3 , Na 2 CO 3 , NaF, C–O–Na и органические остатки. Na 2 SO 3 можно обнаружить только на поверхности при +20 °C. Кроме того, Na 2 S (S 2–: 161,1 эВ) не может быть обнаружен во внутреннем SEI при –20 °C и –40 °C (дополнительные рисунки 11–13). Отсутствие частиц с более низкими степенями окисления при низких температурах свидетельствует о подавлении паразитных реакций между электролитом и металлическим Na-электродом.
Для S 2 p , дублеты при 169,6 эВ и 167,2 эВ (на основе 2 p 3/2 ) отнесены к SO 4 2− и SO 92−915 3 9, соответственно. Для F 1 s пики при 689,3 эВ и 684,1 эВ относятся к C–F и NaF соответственно 24,25,26,27,28,29 . Эти РФЭС-спектры при разных температурах показывают сходный состав поверхности SEI, что позволяет предположить существование соединений, содержащих –CF 3 , Na 2 SO 4 , Na 2 SO 3 , Na 2 CO 3 , NaF, C–O–Na и органические остатки. Na 2 SO 3 можно обнаружить только на поверхности при +20 °C. Кроме того, Na 2 S (S 2–: 161,1 эВ) не может быть обнаружен во внутреннем SEI при –20 °C и –40 °C (дополнительные рисунки 11–13). Отсутствие частиц с более низкими степенями окисления при низких температурах свидетельствует о подавлении паразитных реакций между электролитом и металлическим Na-электродом. Важно отметить, что состав SEI, образованный в NaOTf-DEGDME, демонстрирует высокую стабильность при этих температурах. Для других протестированных систем обсуждение морфологии поверхности Na (дополнительные рисунки 6–9) и химический состав SEI (дополнительные рисунки 14–22, дополнительные таблицы 7 и 8) подробно описан в дополнительных примечаниях 1 и 2 соответственно.
Важно отметить, что состав SEI, образованный в NaOTf-DEGDME, демонстрирует высокую стабильность при этих температурах. Для других протестированных систем обсуждение морфологии поверхности Na (дополнительные рисунки 6–9) и химический состав SEI (дополнительные рисунки 14–22, дополнительные таблицы 7 и 8) подробно описан в дополнительных примечаниях 1 и 2 соответственно.
 NaOTf проявляет промежуточный восстановительный потенциал (1,02 В по сравнению с Na/Na + ), что приводит к образованию неорганического защитного слоя перед разложением электролита, но с умеренной движущей силой, что приводит к мягкой реакции и образованию гладкая пленка SEI (рис. 2в). Для сравнения мы также приводим результаты для NaPF 9.0085 6 , который, как известно, образует стабильный SEI при комнатной температуре 23 . NaPF 6 также демонстрирует умеренный восстановительный потенциал (0,75 В по сравнению с Na/Na + ), что подтверждает наше предположение о том, что соль с промежуточным восстановительным потенциалом способствует образованию однородного SEI на поверхности металлического Na-электрода. Обратите внимание, что NaPF 6 может не подходить для низкотемпературной соли из-за проблем с растворимостью и того факта, что характеристики NaOTf обусловлены сочетанием низкотемпературной растворимости и умеренного восстановительного потенциала.
NaOTf проявляет промежуточный восстановительный потенциал (1,02 В по сравнению с Na/Na + ), что приводит к образованию неорганического защитного слоя перед разложением электролита, но с умеренной движущей силой, что приводит к мягкой реакции и образованию гладкая пленка SEI (рис. 2в). Для сравнения мы также приводим результаты для NaPF 9.0085 6 , который, как известно, образует стабильный SEI при комнатной температуре 23 . NaPF 6 также демонстрирует умеренный восстановительный потенциал (0,75 В по сравнению с Na/Na + ), что подтверждает наше предположение о том, что соль с промежуточным восстановительным потенциалом способствует образованию однородного SEI на поверхности металлического Na-электрода. Обратите внимание, что NaPF 6 может не подходить для низкотемпературной соли из-за проблем с растворимостью и того факта, что характеристики NaOTf обусловлены сочетанием низкотемпературной растворимости и умеренного восстановительного потенциала.
 .
. 26).
26). Обратите внимание, что начальное ступенчатое снижение температуры (серая зона) применялось для стабилизации клеток. f Увеличенные профили напряжения на рис. 4e после стабилизации и через 500 ч при −80 °C.
Обратите внимание, что начальное ступенчатое снижение температуры (серая зона) применялось для стабилизации клеток. f Увеличенные профили напряжения на рис. 4e после стабилизации и через 500 ч при −80 °C. Эта разница почти вдвое меньше, чем для 0,5 М NaOTf-DEGDME/DOL (5:5) (в 7,0 раз от +20 °C до –80 °C) и в девятую от разницы для 1 M NaOTf-DEGDME (31,7 раза от +20 °C до –80 °C). °C до −80 °C) (дополнительные таблицы 12 и 13). Кроме того, ионная проводимость электролита может быть рассчитана на основе сопротивления раствора электролита (подробности расчета см. в разделе «Методы расчета»). На рисунке 4c показано, что 0,5 M NaOTf-DEGDME/DOL (2:8) дает самое медленное снижение ионной проводимости с температурой. При -80 °C ионная проводимость 0,5 М NaOTf-DEGDME/DOL (2:8), 0,5 M NaOTf-DEGDME/DOL (5:5) и 1 M NaOTf-DEGDME составляет 1,05 мСм см -1 , 0,44 мСм см -1 и 0,16 мСм см -1 соответственно. Ионная проводимость других четырех систем с одним растворителем показана на дополнительном рисунке 28. Небольшое изменение сопротивления электролиту и ионной проводимости NaOTf-DEGDME/DOL (2:8) может быть связано с относительно низкой динамической вязкостью растворители (дополнительный рисунок 29).
Эта разница почти вдвое меньше, чем для 0,5 М NaOTf-DEGDME/DOL (5:5) (в 7,0 раз от +20 °C до –80 °C) и в девятую от разницы для 1 M NaOTf-DEGDME (31,7 раза от +20 °C до –80 °C). °C до −80 °C) (дополнительные таблицы 12 и 13). Кроме того, ионная проводимость электролита может быть рассчитана на основе сопротивления раствора электролита (подробности расчета см. в разделе «Методы расчета»). На рисунке 4c показано, что 0,5 M NaOTf-DEGDME/DOL (2:8) дает самое медленное снижение ионной проводимости с температурой. При -80 °C ионная проводимость 0,5 М NaOTf-DEGDME/DOL (2:8), 0,5 M NaOTf-DEGDME/DOL (5:5) и 1 M NaOTf-DEGDME составляет 1,05 мСм см -1 , 0,44 мСм см -1 и 0,16 мСм см -1 соответственно. Ионная проводимость других четырех систем с одним растворителем показана на дополнительном рисунке 28. Небольшое изменение сопротивления электролиту и ионной проводимости NaOTf-DEGDME/DOL (2:8) может быть связано с относительно низкой динамической вязкостью растворители (дополнительный рисунок 29). Обратите внимание, что электролиты как с бинарным растворителем, так и с одним растворителем демонстрируют хорошую однородность без осаждения солей при разных температурах (дополнительный рисунок 30). Дифференциальная сканирующая калориметрия (ДСК) дополнительно подтверждает термическую стабильность 0,5 M NaOTf-DEGDME/DOL (2:8), не обнаруживая фазового перехода даже при температурах до −150 °C (рис. 4d) 33 . Точно так же фазовый переход не обнаружен до -140 ° C для 0,5 M NaOTf-DEGDME / DOL (5: 5). Для сравнения, 1 M NaOTf-DEGDME демонстрирует фазовый переход второго рода при −126 °C во время охлаждения и фазовый переход первого рода при −64 °C (температура плавления DEGDME) при последующем нагревании.
Обратите внимание, что электролиты как с бинарным растворителем, так и с одним растворителем демонстрируют хорошую однородность без осаждения солей при разных температурах (дополнительный рисунок 30). Дифференциальная сканирующая калориметрия (ДСК) дополнительно подтверждает термическую стабильность 0,5 M NaOTf-DEGDME/DOL (2:8), не обнаруживая фазового перехода даже при температурах до −150 °C (рис. 4d) 33 . Точно так же фазовый переход не обнаружен до -140 ° C для 0,5 M NaOTf-DEGDME / DOL (5: 5). Для сравнения, 1 M NaOTf-DEGDME демонстрирует фазовый переход второго рода при −126 °C во время охлаждения и фазовый переход первого рода при −64 °C (температура плавления DEGDME) при последующем нагревании. 1748 -2 с циклической емкостью 0,1 мАч см -2 (дополнительный рисунок 31). Даже при более высоком токе 0,5 мА см −2 с более высокой емкостью 0,25 мА см −2 стабильная работа в течение более 750 ч все еще может быть достигнута (рис. 4e). Увеличенный профиль напряжения (рис. 4f) также свидетельствует о том, что перенапряжение при 0,5 мА см -2 первоначально составляет 147 мВ (после процесса стабилизации) и немного увеличивается до 150 мВ через 500 ч, демонстрируя плавный профиль напряжения без каких-либо всплесков. . Для сравнения, 0,5 M NaOTf-DEGDME/DOL (5:5) показывает большие пики (>4000 мВ) и асимметричный профиль напряжения во время циклирования.
1748 -2 с циклической емкостью 0,1 мАч см -2 (дополнительный рисунок 31). Даже при более высоком токе 0,5 мА см −2 с более высокой емкостью 0,25 мА см −2 стабильная работа в течение более 750 ч все еще может быть достигнута (рис. 4e). Увеличенный профиль напряжения (рис. 4f) также свидетельствует о том, что перенапряжение при 0,5 мА см -2 первоначально составляет 147 мВ (после процесса стабилизации) и немного увеличивается до 150 мВ через 500 ч, демонстрируя плавный профиль напряжения без каких-либо всплесков. . Для сравнения, 0,5 M NaOTf-DEGDME/DOL (5:5) показывает большие пики (>4000 мВ) и асимметричный профиль напряжения во время циклирования. Были проведены измерения методом атомно-силовой микроскопии (АСМ) ex situ для исследования шероховатости поверхности и механических свойств SEI, сформированного на медной фольге при 0,5 мА см9.1748 -2 (0,5 мАч · см -2 ) для 1-го цикла при -40 ° C (рис. 5b, c и дополнительный рис. 32). В 0,5 М NaOTf-ДЭГДМЭ/ДОЛ (2:8) высота СЭВ, образующихся на поверхности электрода, равномерна с отклонением 50 нм (рис. 5б), а средний модуль Юнга составляет ~1,2 ГПа (рис. 5c), которые лучше, чем в 1 M NaOTf-DEGDME (отклонение по высоте: 100 нм; модуль Юнга: 0,5 ГПа), как показано на дополнительном рисунке 32. Лучшая однородность и механические свойства SEI способствуют более эффективному нанесению покрытия. / поведение полос на медной фольге (дополнительный рисунок 33) в электролите с двойным растворителем по сравнению со случаем с одним растворителем. Морфология SEI после удаления Na была исследована с помощью SEM (дополнительный рисунок 34), на котором можно отметить более гладкую поверхность при использовании 0,5 M NaOTf-DEGDME / DOL (2: 8) по сравнению с нерегулярной и пористой морфологией, полученной с использованием 1 Раствор электролита M NaOTf-DEGDME.
Были проведены измерения методом атомно-силовой микроскопии (АСМ) ex situ для исследования шероховатости поверхности и механических свойств SEI, сформированного на медной фольге при 0,5 мА см9.1748 -2 (0,5 мАч · см -2 ) для 1-го цикла при -40 ° C (рис. 5b, c и дополнительный рис. 32). В 0,5 М NaOTf-ДЭГДМЭ/ДОЛ (2:8) высота СЭВ, образующихся на поверхности электрода, равномерна с отклонением 50 нм (рис. 5б), а средний модуль Юнга составляет ~1,2 ГПа (рис. 5c), которые лучше, чем в 1 M NaOTf-DEGDME (отклонение по высоте: 100 нм; модуль Юнга: 0,5 ГПа), как показано на дополнительном рисунке 32. Лучшая однородность и механические свойства SEI способствуют более эффективному нанесению покрытия. / поведение полос на медной фольге (дополнительный рисунок 33) в электролите с двойным растворителем по сравнению со случаем с одним растворителем. Морфология SEI после удаления Na была исследована с помощью SEM (дополнительный рисунок 34), на котором можно отметить более гладкую поверхность при использовании 0,5 M NaOTf-DEGDME / DOL (2: 8) по сравнению с нерегулярной и пористой морфологией, полученной с использованием 1 Раствор электролита M NaOTf-DEGDME.
 г Крио-ПЭМ изображение SEI после циклирования при -40 °C. Видимые полосы решетки из кристаллических областей перекрываются разными цветами. Красные полосы решетки имеют d-промежуток 3,0 Å, синие — d-промежуток 3,5 Å, а зеленые — d-промежуток 3,8 Å. Эти три полосы, вероятно, соответствуют показанным помеченным плоскостям. ч SAED картина SEI, сформированная при -40 °C. Положения колец, как ожидается, будут наиболее интенсивными от Na 2 9.0086 O, Na 2 SO 4 , Na 2 CO 3 и NaF помечены; вероятно присутствие большого разнообразия кристаллических фаз затрудняет полную индексацию структур. Эти кристаллические фазы также приводят к появлению дополнительных колец, которые не отмечены, что, вероятно, объясняет отражения, попадающие между отмеченными линиями. Обратите внимание, что присутствие Na 2 O может быть связано с процессом переноса для этих образцов.
г Крио-ПЭМ изображение SEI после циклирования при -40 °C. Видимые полосы решетки из кристаллических областей перекрываются разными цветами. Красные полосы решетки имеют d-промежуток 3,0 Å, синие — d-промежуток 3,5 Å, а зеленые — d-промежуток 3,8 Å. Эти три полосы, вероятно, соответствуют показанным помеченным плоскостям. ч SAED картина SEI, сформированная при -40 °C. Положения колец, как ожидается, будут наиболее интенсивными от Na 2 9.0086 O, Na 2 SO 4 , Na 2 CO 3 и NaF помечены; вероятно присутствие большого разнообразия кристаллических фаз затрудняет полную индексацию структур. Эти кристаллические фазы также приводят к появлению дополнительных колец, которые не отмечены, что, вероятно, объясняет отражения, попадающие между отмеченными линиями. Обратите внимание, что присутствие Na 2 O может быть связано с процессом переноса для этих образцов. В частности, постепенное увеличение объемной доли DOL приводит к отсутствию образования неправильной морфологии, такой как наблюдаемая в NaOTf-DEGDME при низких температурах (рис. 5d и дополнительные рисунки 35 и 36). Что касается состава, посмертные измерения XPS ex situ металлических Na-электродов, подвергнутых циклу с использованием электролита NaOTf-DEGDME/DOL при температуре -80 °C (дополнительные рисунки 37–40), предполагают наличие неорганических компонентов (NaF, Na 2 SO 4 и Na 2 SO 3 ) в SEI аналогичны тем, которые образуются в аналоге с одним растворителем. Тем не менее, анализ профиля глубины XPS выявляет разницу в распределении элементов и неорганических компонентов в электролитах с двойным растворителем (рис. 5e, f и дополнительный рисунок 41) по сравнению с аналогом с одним растворителем (рис. 2d). В частности, соотношение NaF / Na 2 SO 4 выше на поверхности (~ 1: 1) при использовании электролитов с бинарным растворителем (рис.
В частности, постепенное увеличение объемной доли DOL приводит к отсутствию образования неправильной морфологии, такой как наблюдаемая в NaOTf-DEGDME при низких температурах (рис. 5d и дополнительные рисунки 35 и 36). Что касается состава, посмертные измерения XPS ex situ металлических Na-электродов, подвергнутых циклу с использованием электролита NaOTf-DEGDME/DOL при температуре -80 °C (дополнительные рисунки 37–40), предполагают наличие неорганических компонентов (NaF, Na 2 SO 4 и Na 2 SO 3 ) в SEI аналогичны тем, которые образуются в аналоге с одним растворителем. Тем не менее, анализ профиля глубины XPS выявляет разницу в распределении элементов и неорганических компонентов в электролитах с двойным растворителем (рис. 5e, f и дополнительный рисунок 41) по сравнению с аналогом с одним растворителем (рис. 2d). В частности, соотношение NaF / Na 2 SO 4 выше на поверхности (~ 1: 1) при использовании электролитов с бинарным растворителем (рис. 5f и дополнительный рис. 41b), чем те (1: 8,9).при –20 °С и 1:3,3 при –40 °С) в системе с одним растворителем (рис. 2г). Принимая во внимание исследования АСМ, предполагая, что более высокий процент неорганического компонента NaF в электролите с двойным растворителем способствует более высокому модулю Юнга (рис. 5c и дополнительный рис. 32b) и, следовательно, к лучшей механической прочности по сравнению с одинарным -система растворителей правдоподобна.
5f и дополнительный рис. 41b), чем те (1: 8,9).при –20 °С и 1:3,3 при –40 °С) в системе с одним растворителем (рис. 2г). Принимая во внимание исследования АСМ, предполагая, что более высокий процент неорганического компонента NaF в электролите с двойным растворителем способствует более высокому модулю Юнга (рис. 5c и дополнительный рис. 32b) и, следовательно, к лучшей механической прочности по сравнению с одинарным -система растворителей правдоподобна. Однако размер кристаллитов и общее количество кристаллитов в SEI больше в электролите с бинарным растворителем, как показано на изображениях TEM, а также на картинах быстрого преобразования Фурье (FFT) и дифракции электронов на выбранных участках (SAED) (рис. 5g). , h), в котором дискретных пятен для бинарно-растворительной системы больше, чем колец в однорастворительном случае. Кроме того, в отличие от системы с бинарным растворителем, система с одним растворителем вряд ли может выявить присутствие NaF (дополнительный рисунок 42). Поскольку NaF может быть обнаружен с помощью XPS SEI, образованного в одном растворителе, это позволяет предположить, что NaF в SEI одного растворителя в основном аморфен или имеет плохую кристалличность. Эти наблюдения согласуются в нескольких отображаемых областях SEI как для систем с одним растворителем, так и для систем с двойным растворителем.
Однако размер кристаллитов и общее количество кристаллитов в SEI больше в электролите с бинарным растворителем, как показано на изображениях TEM, а также на картинах быстрого преобразования Фурье (FFT) и дифракции электронов на выбранных участках (SAED) (рис. 5g). , h), в котором дискретных пятен для бинарно-растворительной системы больше, чем колец в однорастворительном случае. Кроме того, в отличие от системы с бинарным растворителем, система с одним растворителем вряд ли может выявить присутствие NaF (дополнительный рисунок 42). Поскольку NaF может быть обнаружен с помощью XPS SEI, образованного в одном растворителе, это позволяет предположить, что NaF в SEI одного растворителя в основном аморфен или имеет плохую кристалличность. Эти наблюдения согласуются в нескольких отображаемых областях SEI как для систем с одним растворителем, так и для систем с двойным растворителем. Кроме того, АСМ подтверждает результаты, предполагая более высокий модуль Юнга 1,2 ГПа (рис. 5с) в электролите с бинарным растворителем. Более того, как АСМ (рис. 5b и дополнительная рис. 32a), так и SEM (дополнительная рис. 34) предполагают, что в электролите с бинарным растворителем может развиваться SEI с меньшей шероховатостью поверхности (меньшее отклонение высоты) по сравнению с электролитом с одним растворителем. система. Мы предполагаем, что богатый NaF SEI с однородной морфологией и улучшенным модулем Юнга является основной причиной долговременной стабильности работы ячейки при -80 °C. Этот вывод согласуется с предыдущим отчетом о литий-металлическом аноде о том, что SEI с высоким содержанием LiF будет способствовать улучшению низкотемпературных характеристик литий-металлических батарей 9.1748 35 .
Кроме того, АСМ подтверждает результаты, предполагая более высокий модуль Юнга 1,2 ГПа (рис. 5с) в электролите с бинарным растворителем. Более того, как АСМ (рис. 5b и дополнительная рис. 32a), так и SEM (дополнительная рис. 34) предполагают, что в электролите с бинарным растворителем может развиваться SEI с меньшей шероховатостью поверхности (меньшее отклонение высоты) по сравнению с электролитом с одним растворителем. система. Мы предполагаем, что богатый NaF SEI с однородной морфологией и улучшенным модулем Юнга является основной причиной долговременной стабильности работы ячейки при -80 °C. Этот вывод согласуется с предыдущим отчетом о литий-металлическом аноде о том, что SEI с высоким содержанием LiF будет способствовать улучшению низкотемпературных характеристик литий-металлических батарей 9.1748 35 . 6 и дополнительный рис. 43). Гальваностатическое циклирование (рис. 6а) показывает, что разрядная емкость уменьшается по мере последовательного охлаждения ячейки. При -60 °С может сохраняться ~42% удельной емкости, полученной при -20 °С. Потеря емкости из-за ступенчатого изменения температуры является обратимой, и емкость полностью восстанавливается при повышении температуры до -20 °C (рис. 6а). Кроме того, CE увеличивается с понижением температуры. Он увеличивается со среднего значения 9от 1,3% при 0 ° C до 99,9% при -60 ° C, а затем снижается до 99,5%, когда температура снова повышается до -20 ° C (дополнительный рисунок 43a). Профили напряжения заряда-разряда от 0 ° C до -80 ° C (рис. 6b) позволяют предположить, что гистерезис напряжения элемента также чувствителен к температуре. При -60°С гистерезис напряжения ячейки примерно в четыре раза больше, чем при -40°С, и в пять раз больше, чем при -20°С. При длительном циклировании (рис. 6в) элемент при -20 °C имеет начальную разрядную емкость 92 мАч·г -1 и сохранение емкости 94% после 100 циклов при среднем CE 98,1%.
6 и дополнительный рис. 43). Гальваностатическое циклирование (рис. 6а) показывает, что разрядная емкость уменьшается по мере последовательного охлаждения ячейки. При -60 °С может сохраняться ~42% удельной емкости, полученной при -20 °С. Потеря емкости из-за ступенчатого изменения температуры является обратимой, и емкость полностью восстанавливается при повышении температуры до -20 °C (рис. 6а). Кроме того, CE увеличивается с понижением температуры. Он увеличивается со среднего значения 9от 1,3% при 0 ° C до 99,9% при -60 ° C, а затем снижается до 99,5%, когда температура снова повышается до -20 ° C (дополнительный рисунок 43a). Профили напряжения заряда-разряда от 0 ° C до -80 ° C (рис. 6b) позволяют предположить, что гистерезис напряжения элемента также чувствителен к температуре. При -60°С гистерезис напряжения ячейки примерно в четыре раза больше, чем при -40°С, и в пять раз больше, чем при -20°С. При длительном циклировании (рис. 6в) элемент при -20 °C имеет начальную разрядную емкость 92 мАч·г -1 и сохранение емкости 94% после 100 циклов при среднем CE 98,1%. При -40 °С начальная емкость снижается до 68 мАч·г -1 с сохранением емкости 94 % после 100 циклов, при этом может быть достигнут более высокий средний КЭ (99,6 %). Даже при -60 °C можно поддерживать аналогичный CE (99,5%) с сохранением емкости на уровне 91% (скорость распада < 0,089% за цикл) после 100 циклов. Увеличенные данные CE показаны на дополнительном рисунке 43b. На рис. 6d показаны характеристики скорости ячеек при токах до 110 мА g -1 (1 C) при -40 °C и -60 °C, что еще раз подтверждает способность металлического Na к циклированию в полной конфигурации элемента с использованием разработанного электролита в экстремально холодных условиях. Соответствующие данные CE при разных скоростях подробно описаны на дополнительном рисунке 43c, который показывает, что CE при обеих температурах увеличивается с увеличением скорости тока.
При -40 °С начальная емкость снижается до 68 мАч·г -1 с сохранением емкости 94 % после 100 циклов, при этом может быть достигнут более высокий средний КЭ (99,6 %). Даже при -60 °C можно поддерживать аналогичный CE (99,5%) с сохранением емкости на уровне 91% (скорость распада < 0,089% за цикл) после 100 циклов. Увеличенные данные CE показаны на дополнительном рисунке 43b. На рис. 6d показаны характеристики скорости ячеек при токах до 110 мА g -1 (1 C) при -40 °C и -60 °C, что еще раз подтверждает способность металлического Na к циклированию в полной конфигурации элемента с использованием разработанного электролита в экстремально холодных условиях. Соответствующие данные CE при разных скоростях подробно описаны на дополнительном рисунке 43c, который показывает, что CE при обеих температурах увеличивается с увеличением скорости тока. Кроме того, анод из Na@MXene (металлический Na, включенный в электрод MXene) 36 используется для сопряжения с Na 3 V 2 (PO 4 ) 3 при -40 °C, показывая стабильная производительность (дополнительные рисунки 46 и 47), которая демонстрирует проверенную концепцию полной ячейки с меньшим количеством металла Na (2 мАч г -1 ), используемого на стороне анода.
Кроме того, анод из Na@MXene (металлический Na, включенный в электрод MXene) 36 используется для сопряжения с Na 3 V 2 (PO 4 ) 3 при -40 °C, показывая стабильная производительность (дополнительные рисунки 46 и 47), которая демонстрирует проверенную концепцию полной ячейки с меньшим количеством металла Na (2 мАч г -1 ), используемого на стороне анода. Это может способствовать умеренной реакции с металлическим Na и, таким образом, образованию гладкого и однородного SEI. Для дальнейшего снижения температурного порога был введен DOL для образования электролитов на бинарных растворителях. Оптимизированный электролит, состоящий из 0,5 М NaOTf-DEGDME/DOL (объемное соотношение 2:8), демонстрирует увеличение сопротивления всего в 3,4 раза от +20 °C до −80 °C и высокую термическую стабильность без фазового перехода до −150 °С. Кроме того, мы демонстрируем стабильное циклирование Na с небольшим перенапряжением 50 мВ в течение более 2000 часов при -80 ° C. Хорошие электрохимические характеристики могут быть приписаны образованию прочного богатого NaF SEI (с высоким содержанием NaF в верхнем слое) с однородной морфологией и механической прочностью, выявленной набором характеристик, включая SEM, AFM, XPS и крио- ТЕМ. В качестве доказательства концепции, батареи из металлического натрия, содержащие Na 3 V 2 (PO 4 ) 3 в качестве катода и металлический Na в качестве анода имеют низкую скорость спада емкости и высокие значения CE при циклировании до -60 °C.
Это может способствовать умеренной реакции с металлическим Na и, таким образом, образованию гладкого и однородного SEI. Для дальнейшего снижения температурного порога был введен DOL для образования электролитов на бинарных растворителях. Оптимизированный электролит, состоящий из 0,5 М NaOTf-DEGDME/DOL (объемное соотношение 2:8), демонстрирует увеличение сопротивления всего в 3,4 раза от +20 °C до −80 °C и высокую термическую стабильность без фазового перехода до −150 °С. Кроме того, мы демонстрируем стабильное циклирование Na с небольшим перенапряжением 50 мВ в течение более 2000 часов при -80 ° C. Хорошие электрохимические характеристики могут быть приписаны образованию прочного богатого NaF SEI (с высоким содержанием NaF в верхнем слое) с однородной морфологией и механической прочностью, выявленной набором характеристик, включая SEM, AFM, XPS и крио- ТЕМ. В качестве доказательства концепции, батареи из металлического натрия, содержащие Na 3 V 2 (PO 4 ) 3 в качестве катода и металлический Na в качестве анода имеют низкую скорость спада емкости и высокие значения CE при циклировании до -60 °C. Кроме того, также были продемонстрированы полные элементы с металлическим натрием с контролируемым количеством металлического Na, используемого в качестве анода.
Кроме того, также были продемонстрированы полные элементы с металлическим натрием с контролируемым количеством металлического Na, используемого в качестве анода. Диметиловый эфир диэтиленгликоля (DEGDME, безводный, H 2 O < 50 ppm, Sigma-Aldrich), 1,2-диметоксиэтан (безводный, H 2 O < 30 ppm воды, Sigma-Aldrich) и 1,3- диоксолан (безводный, H 2 O < 30 ppm, Sigma-Aldrich) непосредственно использовали в качестве растворителей для приготовления электролитов.
Диметиловый эфир диэтиленгликоля (DEGDME, безводный, H 2 O < 50 ppm, Sigma-Aldrich), 1,2-диметоксиэтан (безводный, H 2 O < 30 ppm воды, Sigma-Aldrich) и 1,3- диоксолан (безводный, H 2 O < 30 ppm, Sigma-Aldrich) непосредственно использовали в качестве растворителей для приготовления электролитов. Отожженный порошок смешивали с сажей (Super C65, C-NERGY) и поливинилиденфторидом (PVDF, HSV 900, Arkema) в весовом соотношении 6:3:1 с использованием 1-метил-2-пирролидона (NMP, безводный, Sigma-Aldrich) до образования суспензии. Шлам отливали на алюминиевую фольгу (чистота 99,9%, толщина 16 мкм, MTI) и высушивали при 70 °С в вакуумной печи с последующей нарезкой образца на катод диаметром 12 мм (средняя толщина 60–160 мм). мкм). Загрузка активного материала составляла до 3 мг см −2 .
Отожженный порошок смешивали с сажей (Super C65, C-NERGY) и поливинилиденфторидом (PVDF, HSV 900, Arkema) в весовом соотношении 6:3:1 с использованием 1-метил-2-пирролидона (NMP, безводный, Sigma-Aldrich) до образования суспензии. Шлам отливали на алюминиевую фольгу (чистота 99,9%, толщина 16 мкм, MTI) и высушивали при 70 °С в вакуумной печи с последующей нарезкой образца на катод диаметром 12 мм (средняя толщина 60–160 мм). мкм). Загрузка активного материала составляла до 3 мг см −2 . , 99%, Alfa Aesar) при перемешивании при 40°C в течение 24 часов. Собранный Ti 3 C 2 MXene промывали деионизированной водой и сушили при 70 °C. После этого взвешивали 0,25 г полученного Ti 3 C 2 MXene и диспергировали в 40 мл раствора NaOH (1M) при перемешивании (500 об/мин) при комнатной температуре в течение 72 ч, после чего собирали осадок. и промывают деионизированной водой и сушат вымораживанием. Электродная суспензия, состоящая из только что синтезированного Ti 3 C 2 MXene и PVDF в весовом соотношении 9:1 (диспергированные в NMP) отливали на медную фольгу (чистота 99,8%, толщина 9 мкм, MTI). Влажное покрытие высушивали при 70 °С в вакуумной печи с последующей резкой на анод диаметром 12 мм (средняя толщина 100 мкм). Загрузка активного материала составляла до 2 мг см -2 .
, 99%, Alfa Aesar) при перемешивании при 40°C в течение 24 часов. Собранный Ti 3 C 2 MXene промывали деионизированной водой и сушили при 70 °C. После этого взвешивали 0,25 г полученного Ti 3 C 2 MXene и диспергировали в 40 мл раствора NaOH (1M) при перемешивании (500 об/мин) при комнатной температуре в течение 72 ч, после чего собирали осадок. и промывают деионизированной водой и сушат вымораживанием. Электродная суспензия, состоящая из только что синтезированного Ti 3 C 2 MXene и PVDF в весовом соотношении 9:1 (диспергированные в NMP) отливали на медную фольгу (чистота 99,8%, толщина 9 мкм, MTI). Влажное покрытие высушивали при 70 °С в вакуумной печи с последующей резкой на анод диаметром 12 мм (средняя толщина 100 мкм). Загрузка активного материала составляла до 2 мг см -2 . Перед тестированием каждый образец (100 мкл) выдерживался изотермически при заданной температуре более 10 часов. Изображения, полученные с помощью сканирующей электронной микроскопии (СЭМ), были получены с использованием системы СЭМ с автоэмиссионной пушкой (XL 300 ESEM-FEG). Анализ с помощью криогенной просвечивающей электронной микроскопии (крио-ПЭМ) проводили с использованием ПЭМ FEI Tecnai F30, работающего при 300 кВ. Все изображения были записаны при низкой мощности дозы от 1 до 2 × 10 2 электронов·Å −2 ·с −1 . Анализ рентгеновской фотоэлектронной спектроскопии (XPS) проводили с помощью сканирующего XPS-микрозонда PHI Versaprobe II с системным разрешением 0,47 эВ с использованием источника монохроматического рентгеновского излучения 1486,7. Дифференциальную сканирующую калориметрию (ДСК) проводили с использованием Netzsch DSC 204 F1 Phoenix. И образцы, и эталон были испытаны при температуре от -150°C до +20°C при контролируемой скорости 10°C мин -1 .
Перед тестированием каждый образец (100 мкл) выдерживался изотермически при заданной температуре более 10 часов. Изображения, полученные с помощью сканирующей электронной микроскопии (СЭМ), были получены с использованием системы СЭМ с автоэмиссионной пушкой (XL 300 ESEM-FEG). Анализ с помощью криогенной просвечивающей электронной микроскопии (крио-ПЭМ) проводили с использованием ПЭМ FEI Tecnai F30, работающего при 300 кВ. Все изображения были записаны при низкой мощности дозы от 1 до 2 × 10 2 электронов·Å −2 ·с −1 . Анализ рентгеновской фотоэлектронной спектроскопии (XPS) проводили с помощью сканирующего XPS-микрозонда PHI Versaprobe II с системным разрешением 0,47 эВ с использованием источника монохроматического рентгеновского излучения 1486,7. Дифференциальную сканирующую калориметрию (ДСК) проводили с использованием Netzsch DSC 204 F1 Phoenix. И образцы, и эталон были испытаны при температуре от -150°C до +20°C при контролируемой скорости 10°C мин -1 . Атомно-силовая микроскопия (АСМ) была проведена на медных фольгах после покрытия/зачистки Na с использованием АСМ Bruker’s Dimension Icon с зондом RTESPA-150.
Атомно-силовая микроскопия (АСМ) была проведена на медных фольгах после покрытия/зачистки Na с использованием АСМ Bruker’s Dimension Icon с зондом RTESPA-150. Асимметричные монетные ячейки также были собраны с использованием фольги из нержавеющей стали (толщина 0,5 мм, нержавеющая сталь 316) в качестве рабочего электрода и свежесрезанного Na в качестве противоэлектрода с сепаратором Celgard 2400 и электролитом объемом 40 мкл. Измерения КЭ проводились в асимметричных ячейках типа «таблетка» путем нанесения покрытия и снятия при плотности тока 0,5 мА см 91 748 -2 91 749 в течение более 1 часа (0,5 мАч см 91 748 -2 91 749, нанесенных или снятых за полупериод). Ячейки с металлическим натрием были собраны с Na 3 V 2 (PO 4 ) 3 катоды и аноды из металла Na или Na@MXene с испытанными электролитами. Для изготовления электродов Na@MXene на электрод Ti 3 C 2 MXene с использованием асимметричных ячеек Na||MXene при 0,5 мА см −2 в тестируемом электролите с Сепаратор Селгард 2400. После осаждения Na ячейки Na||MXene разобрали и собрали электроды Na@MXene. Как симметричные элементы, так и батареи с металлическим натрием тестировали с использованием стандартного тестера батарей (CT2001A, Wuhan LANHE Electronics Co.
Асимметричные монетные ячейки также были собраны с использованием фольги из нержавеющей стали (толщина 0,5 мм, нержавеющая сталь 316) в качестве рабочего электрода и свежесрезанного Na в качестве противоэлектрода с сепаратором Celgard 2400 и электролитом объемом 40 мкл. Измерения КЭ проводились в асимметричных ячейках типа «таблетка» путем нанесения покрытия и снятия при плотности тока 0,5 мА см 91 748 -2 91 749 в течение более 1 часа (0,5 мАч см 91 748 -2 91 749, нанесенных или снятых за полупериод). Ячейки с металлическим натрием были собраны с Na 3 V 2 (PO 4 ) 3 катоды и аноды из металла Na или Na@MXene с испытанными электролитами. Для изготовления электродов Na@MXene на электрод Ti 3 C 2 MXene с использованием асимметричных ячеек Na||MXene при 0,5 мА см −2 в тестируемом электролите с Сепаратор Селгард 2400. После осаждения Na ячейки Na||MXene разобрали и собрали электроды Na@MXene. Как симметричные элементы, так и батареи с металлическим натрием тестировали с использованием стандартного тестера батарей (CT2001A, Wuhan LANHE Electronics Co. , Ltd). Электрохимическую импедансную спектроскопию (ЭИС) проводили с использованием электрохимической рабочей станции (VMP3, Bio-Logic Science Instruments) при частоте сканирования от 1 МГц до 0,1 Гц с амплитудой переменного тока 5 мВ и 10 точками на декаду. Среднее время напряжения холостого хода до измерения ЭИС составляло ~2 ч.
, Ltd). Электрохимическую импедансную спектроскопию (ЭИС) проводили с использованием электрохимической рабочей станции (VMP3, Bio-Logic Science Instruments) при частоте сканирования от 1 МГц до 0,1 Гц с амплитудой переменного тока 5 мВ и 10 точками на декаду. Среднее время напряжения холостого хода до измерения ЭИС составляло ~2 ч.
 Мы использовали функционал B3LYP с версией Grimme D3 (эмпирическая дисперсия = gd3) и базисным набором 6-311++G 40,41,42,43 . Эффекты растворителя были включены в модель поляризационного континуума (PCM) с использованием DEGDME в качестве растворителя (диэлектрическая проницаемость = 7,39) 44 . Восстановительный потенциал рассчитывали с использованием термодинамического цикла, описанного Han et al. и Бородин и др. 9{-}\right)\) и \(\triangle {G}_{{sol}}\left(S\right)\) — свободная энергия Гиббса для процесса сольватации заряженных и нейтральных частиц, соответственно, и F – постоянная Фарадея. Для преобразования потенциала в эталон Na/Na + согласно предыдущим работам 45,46 из уравнения было извлечено 1,8 В. Международный союз теоретической и прикладной химии рекомендует значение 4,42–4,44 В по шкале абсолютных потенциалов 47 .
Мы использовали функционал B3LYP с версией Grimme D3 (эмпирическая дисперсия = gd3) и базисным набором 6-311++G 40,41,42,43 . Эффекты растворителя были включены в модель поляризационного континуума (PCM) с использованием DEGDME в качестве растворителя (диэлектрическая проницаемость = 7,39) 44 . Восстановительный потенциал рассчитывали с использованием термодинамического цикла, описанного Han et al. и Бородин и др. 9{-}\right)\) и \(\triangle {G}_{{sol}}\left(S\right)\) — свободная энергия Гиббса для процесса сольватации заряженных и нейтральных частиц, соответственно, и F – постоянная Фарадея. Для преобразования потенциала в эталон Na/Na + согласно предыдущим работам 45,46 из уравнения было извлечено 1,8 В. Международный союз теоретической и прикладной химии рекомендует значение 4,42–4,44 В по шкале абсолютных потенциалов 47 .
Goodenough, J. & Park, K.-S. Литий-ионная аккумуляторная батарея: перспектива. Дж. Ам. хим. соц. 135 , 1167–1176 (2013).
КАС Статья пабмед Google ученый
Тараскон Ж.-М. и Арманд, М. Проблемы и проблемы, стоящие перед перезаряжаемыми литиевыми батареями. Природа 414 , 359–367 (2001).
ОБЪЯВЛЕНИЕ КАС пабмед Статья Google ученый
Данн, Б., Камат, Х. и Тараскон, Дж.-М. Аккумулирование электроэнергии для сети: батарея выбора. Наука 334 , 928–935 (2011).
Наука 334 , 928–935 (2011).
ОБЪЯВЛЕНИЕ КАС пабмед Статья Google ученый
Сюй, Дж. и др. Расширение предела эксплуатации литий-ионных аккумуляторов при низких температурах до −80 °C. Материал для хранения энергии. 23 , 383–389 (2019).
Артикул Google ученый
Чжан С., Сюй К. и Джоу Т. Характеристики литий-ионных аккумуляторов при низких температурах. J. Power Sources 115 , 137–140 (2003).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Чжу, Г. Материалы о характеристиках литий-ионных аккумуляторов при низких температурах. J. Power Sources 300 , 29–40 (2015).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Ван, Х., Ван, К., Матиос, Э. и Ли, В. Критическая роль ультратонких графеновых пленок с регулируемой толщиной в создании высокостабильных анодов из металлического натрия. Нано Летт. 17 , 6808–6815 (2017).
ОБЪЯВЛЕНИЕ КАС пабмед Статья Google ученый
Ван, К., Ван, Х., Матиос, Э., Ху, X. и Ли, В. Химически спроектированная пористая медная матрица с цилиндрическим каркасом ядро-оболочка в качестве стабильной основы для металлических натриевых анодов. Доп. Функц. Матер. 28 , 1802282 (2018).
Артикул КАС Google ученый
Wang, H., Wang, C., Matios, E. & Li, W. Легкая стабилизация металлического натриевого анода с добавками: неожиданная ключевая роль полисульфида натрия и неблагоприятное воздействие нитрата натрия. Анжю. хим. Междунар. Эд. 57 , 7734–7737 (2018).
КАС Статья Google ученый
Чаямбука, К., Малдер, Г., Данилов, Д. и Ноттен, П. Обзор материалов и электрохимических свойств натрий-ионных аккумуляторов. Доп. Энергия Матер. 8 , 1800079 (2018).
Артикул КАС Google ученый
Yi, Q. et al. Электролит на основе фторированного эфира обеспечивает натриево-металлическим батареям исключительную стабильность при циклировании. Приложение ACS Матер. Интерфейсы 11 , 46965–46972 (2019 г.).
КАС пабмед Статья Google ученый
Yi, Q., Zhang, W., Li, S., Li, X. & Sun, C. Долговечная натриевая батарея с гибким Na 3 Zr 2 Si 2 PO 12 –PVDF– Композитный электролит HFP и анод из натрий/угольной ткани. Приложение ACS Матер. Интерфейсы 10 , 35039–35046 (2018 г.).
Приложение ACS Матер. Интерфейсы 10 , 35039–35046 (2018 г.).
КАС пабмед Статья Google ученый
Фэн, Л., Ю, Т., Ченг, Д. и Сун, К. Прогресс в исследовании неисправности натриевой батареи. Науч. Грех. Чим. 50 , 1801–1815 (2020).
Артикул Google ученый
Yang, G., Li, N. & Sun, C. Высокопроизводительные натриево-металлические батареи с анодом из натрий-висмутового сплава. Приложение ACS Энергия Матер. 3 , 12607–12612 (2020).
КАС Статья Google ученый
Мацумото, К. и др. Среднетемпературная работа натриевых вторичных батарей с высокой емкостью и возможностью циклирования с использованием ионно-жидкого электролита. ЭКС транс. 75 , 139–145 (2016).
КАС Статья Google ученый
Ван Ю.-Ю. и другие. Сверхдлительный срок службы и работающая при низких температурах натрий-ионная полная батарея для стационарного хранения энергии. Доп. Энергия Матер. 8 , 1703252 (2018).
Артикул КАС Google ученый
Гуо Ж.-З. и другие. Высокоэнергетический/мощный и низкотемпературный катод для натрий-ионных аккумуляторов: рентгенографическое исследование in situ и превосходные характеристики полноэлементных элементов. Доп. Матер. 29 , 1701968 (2017).
Артикул КАС Google ученый
Ду, Г. и др. Низкотемпературный, высокоскоростной и долговечный твердотельный натрий-ионный аккумулятор на основе полимерного электролита и катода из берлинской лазури. Доп. Энергия Матер. 10 , 1
КАС Статья Google ученый
«>Тенувара, А., Шетти, П. и Макдауэлл, М. Отчетливые наноразмерные межфазные границы и морфология электродов из металлического лития, работающих при низких температурах. Нано Летт. 19 , 8664–8672 (2019).
ОБЪЯВЛЕНИЕ КАС пабмед Статья Google ученый
Thenuwara, A. et al. Эффективное низкотемпературное циклирование литий-металлических анодов за счет адаптации границы твердого электролита. ACS Energy Письмо. 5 , 2411–2420 (2020).
КАС Статья Google ученый
Rustomji, C. et al. Сжиженные газовые электролиты для электрохимических накопителей энергии. Наука 356 , eaal4263 (2017).
ПабМед Статья КАС Google ученый
Holoubek, J. et al. Адаптация сольватации электролита для литий-металлических аккумуляторов, подвергающихся циклированию при сверхнизкой температуре. Нац. Энергия 6 , 303–313 (2021).
Нац. Энергия 6 , 303–313 (2021).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Seh, Z., Sun, J., Sun, Y. & Cui, Y. Высокообратимый металлический натриевый анод при комнатной температуре. АКЦ Цент. науч. 1 , 449–455 (2015).
КАС пабмед ПабМед Центральный Статья Google ученый
Молдер, Дж. Ф. Справочник по рентгеновской фотоэлектронной спектроскопии: справочник стандартных спектров для идентификации и интерпретации данных XPS (Отдел физической электроники, Perkin-Elmer Corporation Press, 1992).
Аурбах, Д. и др. На поверхности химические аспекты очень высокой плотности энергии, перезаряжаемые литий-серные батареи. Дж. Электрохим. соц. 156 , A694–A702 (2009 г.).
КАС Статья Google ученый
Фидлер, К., Люерссен, Б., Ронке, М., Санн, Дж. и Янек, Дж. Анализ XPS и SIMS межфазных фаз твердого электролита на литии, образованном электролитами на основе эфира. Дж. Электрохим. соц. 164 , A3742–A3749 (2017).
КАС Статья Google ученый
Gu, Y. et al. Дизайнерские ультрагладкие ультратонкие твердоэлектролитные межфазные поверхности трех анодов из щелочных металлов. Нац. коммун. 9 , 1339 (2018).
ОБЪЯВЛЕНИЕ пабмед ПабМед Центральный Статья КАС Google ученый
Цао, X. и др. Монолитные твердо-электролитные межфазные слои, сформированные во фторированных электролитах на основе ортоформиата, сводят к минимуму истощение лития и его измельчение. Нац. Энергия 4 , 796–805 (2019).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Лутц, Л. и др. Роль анионов электролита в батарее Na–O 2 : влияние на сольватацию NaO 2 и стабильность межфазной фазы твердого электролита натрия в эфирах глима. Хим. Матер. 29 , 6066–6075 (2017).
КАС Статья Google ученый
Насыбулин Е. и др. Влияние солей электролита на работу аккумуляторов Li–O 2 . J. Phys. хим. C. 117 , 2635–2645 (2013).
КАС Статья Google ученый
Maibach, J. et al. Экспериментальный метод рентгеновской фотоэлектронной спектроскопии высокого давления для определения характеристик границ раздела твердое тело-жидкость продемонстрирован на литий-ионной аккумуляторной системе. Rev. Sci. Инструм. 86 , 044101 (2015).
ОБЪЯВЛЕНИЕ пабмед Статья КАС Google ученый
Холл, Д., Селф, Дж. и Дан, Дж. Диэлектрические постоянные для квантовой химии и литий-ионных аккумуляторов: смеси растворителей этиленкарбоната и этилметилкарбоната. J. Phys. хим. C. 119 , 22322–22330 (2015).
КАС Статья Google ученый
Суо, Л., Ху, Ю.-С., Ли, Х., Арманд, М. и Чен, Л. Новый класс электролитов на основе растворителя в соли для высокоэнергетических перезаряжаемых металлических литиевых батарей. Нац. коммун. 4 , 1481 (2013).
ОБЪЯВЛЕНИЕ пабмед Статья КАС Google ученый
Хан, Б. и др. Исследование межфазной поверхности твердого электролита с металлическим Na с помощью криотрансмиссионной электронной микроскопии. Нац. коммун. 12 , 3066 (2021).
ОБЪЯВЛЕНИЕ КАС пабмед ПабМед Центральный Статья Google ученый
Гао Ю. и др. Низкотемпературные и высокоскоростные литий-металлические аккумуляторы обеспечиваются электрохимически активным монослойно-регулируемым интерфейсом. Нац. Энергия 5 , 534–542 (2020).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Луо, Дж. и др. Настраиваемые 1D/2D-гибридные наноархитектуры на основе MXene в качестве стабильной матрицы для бездендритного металлического натриевого анода сверхвысокой емкости. Нано Летт. 20 , 7700–7708 (2020).
ОБЪЯВЛЕНИЕ КАС пабмед Статья Google ученый
Raccichini, R., Furness, L., Dibden, J., Owen, J. & García-Araez, N. Характеристика импеданса транспортных свойств электролитов, содержащихся в пористых электродах и сепараторах, полезных для Li-S аккумуляторов . Дж. Электрохим. соц. 165 , A2741–A2749 (2018).
КАС Статья Google ученый
Габершек М. Понимание материалов аккумуляторов на основе лития с помощью спектроскопии электрохимического импеданса. Нац. коммун. 12 , 6513 (2021).
ОБЪЯВЛЕНИЕ пабмед ПабМед Центральный Статья КАС Google ученый
Gaussian 16, редакция C.01, Frisch, M.J. et al., Gaussian, Inc., Wallingford CT, 2016.
Lee, C., Yang, W. & Parr, R.G. -Корреляционно-энергетическая формула Сальветти в функционал электронной плотности. Физ. B 37 , 785–789 (1988).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Бекке, А. Д. Функциональная термохимия плотности. III. Роль точного обмена. J. Chem. физ. 98 , 5648–5652 (1993).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Гримме, С., Энтони, Дж., Эрлих, С. и Криг, Х. Непротиворечивая и точная параметризация ab initio поправки на дисперсию с помощью функции плотности (DFT-D) для 94 элемента H-Pu. J. Chem. физ. 132 , 154104 (2010).
ОБЪЯВЛЕНИЕ пабмед Статья КАС Google ученый
Hehre, W.J., Random, L., Schleyer, P.V.R. & Pople, J.A. Ab initio молекулярно-орбитальная теория (Wiley Press, 1986).
Томаси Дж. и Персико М. Молекулярные взаимодействия в растворе: обзор методов, основанных на непрерывном распределении растворителя. Хим. Ред. 94 , 2027–2094 (1994).
КАС Статья Google ученый
Хан Дж., Чжэн Ю., Го Н. и Бальбуэна П. Б. Расчетные восстановительные потенциалы частиц электролита в литий-серных батареях. J. Phys. хим. C. 124 , 20654–20670 (2020).
и Бальбуэна П. Б. Расчетные восстановительные потенциалы частиц электролита в литий-серных батареях. J. Phys. хим. C. 124 , 20654–20670 (2020).
КАС Статья Google ученый
Бородин О., Бел В. и Джоу Т. Р. Окислительная стабильность и начальные реакции разложения электролитов на основе карбонатов, сульфонов и алкилфосфатов. J. Phys. хим. C. 117 , 8661–8682 (2013).
КАС Статья Google ученый
Trasatti, S. Абсолютный электродный потенциал: пояснительная записка (Рекомендации 1986 г.). Чистое приложение. хим. 58 , 955–966 (1986).
КАС Статья Google ученый
Ссылки на скачивание
Благодарности
В.Л. и CW признательны за поддержку в виде грантов для факультета ранней карьеры в рамках Программы грантов для исследований в области космических технологий НАСА в рамках награды 80NSSC18K1514, а также за счет стартовых фондов Инженерной школы Тайера Дартмутского колледжа. В.Л. и J.L. признают частичную поддержку по PE 0603734A, «Энергетические и технологические исследования в холодных и арктических регионах», Задача 2 по контракту W913E519C0008 и по PE 0633119, «Энергетические и технологические исследования в холодных и арктических регионах», Задача 2 по контракту W913E520C0010, оба находятся в ведении Центра инженерных исследований и разработок армии США (ERDC). A.C.T., P.P.S. и М.Т.М. признательны за поддержку гранта факультета ранней карьеры Программы грантов НАСА в области космических технологий в рамках награды 80NSSC18K1507. Х.З. и Х.Х. признаем поддержку программы Министерства энергетики США, Управления науки, Управления фундаментальных энергетических наук под номером награды DE-SC0019121. Использование АСМ в окружающей среде было поддержано NSF MRI (грант № 1727026). Г.Х. выражает благодарность Французскому сообщению Бельгии за поддержку в рамках гранта №. АРК 18/23-093. С.П.-П. благодарит испанское министерство науки и инноваций за стипендию Хуана де ла Сьерва Формасьон (FJC2019-039623-I).
В.Л. и J.L. признают частичную поддержку по PE 0603734A, «Энергетические и технологические исследования в холодных и арктических регионах», Задача 2 по контракту W913E519C0008 и по PE 0633119, «Энергетические и технологические исследования в холодных и арктических регионах», Задача 2 по контракту W913E520C0010, оба находятся в ведении Центра инженерных исследований и разработок армии США (ERDC). A.C.T., P.P.S. и М.Т.М. признательны за поддержку гранта факультета ранней карьеры Программы грантов НАСА в области космических технологий в рамках награды 80NSSC18K1507. Х.З. и Х.Х. признаем поддержку программы Министерства энергетики США, Управления науки, Управления фундаментальных энергетических наук под номером награды DE-SC0019121. Использование АСМ в окружающей среде было поддержано NSF MRI (грант № 1727026). Г.Х. выражает благодарность Французскому сообщению Бельгии за поддержку в рамках гранта №. АРК 18/23-093. С.П.-П. благодарит испанское министерство науки и инноваций за стипендию Хуана де ла Сьерва Формасьон (FJC2019-039623-I). Авторы выражают признательность за помощь в рентгеновской фотоэлектронной спектроскопии доктору Мин Ли, Ирен Чжун и Цзышань Ву, а также в дифференциальной сканирующей калориметрии доктору Кайян Инь. Авторы выражают благодарность профессору Хайляну Вану за помощь в подготовке образцов.
Авторы выражают признательность за помощь в рентгеновской фотоэлектронной спектроскопии доктору Мин Ли, Ирен Чжун и Цзышань Ву, а также в дифференциальной сканирующей калориметрии доктору Кайян Инь. Авторы выражают благодарность профессору Хайляну Вану за помощь в подготовке образцов.
Информация об авторе
Авторы и организации
Thayer School of Engineering, Dartmouth College, 14 Engineering Drive, Hanover, NH, 03755, USA
Chuanlong Wang, Jianmin Luo, Geoffroy Hautier & Weiyang Li
G.W. Школа машиностроения Вудраффа, Технологический институт Джорджии, 801 Ферст Драйв, Атланта, Джорджия, 30332, США
Акила С. Тенувара, Пралав П. Шетти и Мэтью Т. Макдауэлл
Школа материаловедения и инженерии, Джорджия Технологический институт, 771 Ферст Драйв, Атланта, Джорджия, 30332, США
Matthew T. McDowell
Micron School of Materials Science and Engineering, Boise State University, 1910 University Drive, Boise, ID, 83725, USA
Haoyu Zhu & Hui Xiong
Institute of Matter and Condenseds , UCLouvain, Chemin des Étoiles 8, B-1348, Louvain-la-Neuve, Belgium
Sergio Posada-Pérez & Geoffroy Hautier
Institut de Química Computacional i Catalisi and Departament de Maria Química, C/Gironasitat Universitat Аурелия Капмани, 69 лет, 17003, Girona, Catalonia, Испания
Сержио Посада-Пресес
Центр исследований передовой энергии, Айдахо-Фолс, ID, 83401, США
Hui Xiong
Authrations 9000 9369

Вы также можете искать этого автора в PubMed Google Scholar
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Академия
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Contributions
C. W. and W.L. задумал идею. C.W. провела разработку состава электролита, определение характеристик материала и электрохимическую оценку. JL синтезировал электроды Na@MXene. Х.З. и Х.Х. выполнил АСМ характеристику и анализ. A.C.T., P.P.S. и М.Т.М. проведена криогенная просвечивающая электронная микроскопия и соответствующий анализ. С.П.-П. и Г.Х. провел теоретические расчеты. C.W., A.C.T., M.T.M., G.H. и В.Л. соавтор статьи. Все авторы обсудили результаты и прокомментировали рукопись.
W. and W.L. задумал идею. C.W. провела разработку состава электролита, определение характеристик материала и электрохимическую оценку. JL синтезировал электроды Na@MXene. Х.З. и Х.Х. выполнил АСМ характеристику и анализ. A.C.T., P.P.S. и М.Т.М. проведена криогенная просвечивающая электронная микроскопия и соответствующий анализ. С.П.-П. и Г.Х. провел теоретические расчеты. C.W., A.C.T., M.T.M., G.H. и В.Л. соавтор статьи. Все авторы обсудили результаты и прокомментировали рукопись.
Авторы переписки
Переписка с Хуэй Сюн, Жоффруа Отье или Вейян Ли.
Заявление об этике
Конкурирующие интересы
Авторы не заявляют об отсутствии конкурирующих интересов.
Рецензирование
Информация о рецензировании
Nature Communications благодарит Chunwen Sun и других анонимных рецензентов за их вклад в рецензирование этой работы.
Дополнительная информация
Примечание издателя Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Дополнительная информация
Дополнительная информация
Резюме отчетности
Права и разрешения
Открытый доступ Использование, распространение и распространение этой статьи лицензируются в соответствии с лицензией Creative Commons. воспроизведение на любом носителе или в любом формате при условии, что вы укажете автора(ов) оригинала и источник, предоставите ссылку на лицензию Creative Commons и укажете, были ли внесены изменения. Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons для статьи, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.
Перепечатка и разрешения
Об этой статье
Комментарии
Отправляя комментарий, вы соглашаетесь соблюдать наши Условия и правила сообщества. Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
Разница между литий-ионными и литий-полимерными батареями
Литий-ионная полимерная (LiPo) батарея (также известная как Li-poly, Li-poly, PLiON и другие названия) представляет собой перезаряжаемую литий-ионную батарею с полимерным электролит в жидком электролите, используемом в обычных литий-ионных аккумуляторах. Доступны различные химические вещества LiPo. Все они используют гелевый полимер с высокой проводимостью в качестве электролита. LiPo обеспечивают более высокую удельную энергию, чем другие литиевые батареи, часто используемые в системах, где важным фактором является вес, таких как мобильные устройства, дроны и некоторые электромобили. Этот FAQ начинается с общего сравнения литий-ионных и LiPo аккумуляторов, за которым следует подробный обзор шести основных химических элементов литиевых аккумуляторов, наиболее подходящих для использования в LiPo аккумуляторах. Он завершается взглядом в будущее и возможной разработкой алюминиево-воздушных полимерных батарей и твердотельных батарей.
Он завершается взглядом в будущее и возможной разработкой алюминиево-воздушных полимерных батарей и твердотельных батарей.
Все литиевые батареи имеют барьер, разделяющий анод и катод, а также обеспечивающий движение ионов между электродами. В LiPo полимерный сепаратор также содержит электролит. Кроме того, полимерные сепараторы могут выполнять дополнительную функцию, действуя как «сепараторы отключения», которые могут отключать батарею, если она становится слишком горячей во время зарядки или разрядки. Сепараторы отключения представляют собой многослойные конструкции, по крайней мере, с одним полиэтиленовым слоем, который может остановить ток, когда температура становится слишком высокой, и по крайней мере с одним полипропиленовым слоем, который действует как форма механической поддержки сепаратора.
Интеркаляция и декаляция ионов лития с положительного электрода и отрицательного электрода. За исключением полимерного сепаратора, LiPos работают по тому же принципу, что и Li-ion. Однако упакованы они совершенно по-разному.
Однако упакованы они совершенно по-разному.
Li-ion обычно поставляются в корпусе из нержавеющей стали или алюминия. Корпус чаще всего цилиндрический, но может быть пуговичным или прямоугольным (призматический). Корпус относительно дорог в производстве и, как правило, ограничивает доступные размеры и формы. Но он также надежен, помогая защитить аккумулятор от повреждений. Корпус герметизирован методом лазерной сварки.
Конструкция литий-ионного аккумулятора относительно сложна и состоит из большого количества компонентов. (Изображение: TechSci Research)
LiPo аккумуляторы упакованы в «мешочек» из алюминиевой фольги и называются «мягкими» или «мешковыми» элементами. Пакет в основном призматический, его легче изготовить, и он дешевле, чем корпуса литий-ионных аккумуляторов из нержавеющей стали или алюминия. Этот тип конструкции также позволяет производить батареи с различными индивидуальными конфигурациями. Другие компоненты LiPos включают в себя тонкие слои (<100 мкм), которые можно производить серийно по относительно низкой цене. Замена мешочка из фольги на металл может привести к высокой плотности энергии и легкости батарей. Могут быть достигнуты как большие форматы, так и высота менее 1 мм, но ячейки требуют осторожного механического обращения.
Замена мешочка из фольги на металл может привести к высокой плотности энергии и легкости батарей. Могут быть достигнуты как большие форматы, так и высота менее 1 мм, но ячейки требуют осторожного механического обращения.
Конструкция чехла для литий-полимерного аккумулятора. (Изображение: Jauch)
Использование LiPos сопряжено со многими из тех же проблем, с которыми приходится сталкиваться пользователям Li-ion, включая перезарядку, чрезмерную разрядку, перегрев и внутренние короткие замыкания. Кроме того, раздавливание или проникновение гвоздя в пакет LiPo может привести к катастрофическим отказам, начиная от разрыва пакета и заканчивая утечкой электролита и возгоранием.
Как и литий-ионные, литий-полимерные аккумуляторы могут расширяться при высоких уровнях перезарядки из-за испарения электролита. Испарение электролита может привести к расслаиванию, ухудшению контакта между внутренними слоями элемента, снижению надежности и срока службы. Это расширение может быть особенно заметным для LiPo аккумуляторов, которые могут буквально раздуваться. Это также может привести к структурным повреждениям хост-системы.
Это также может привести к структурным повреждениям хост-системы.
В таблице ниже сравниваются напряжения и типичные области применения шести основных химических элементов литиевых батарей. Другие характеристики этих батарей включают в себя:
- LCO – 200 Втч/кг, обеспечивают высокую мощность, но при этом имеют относительно короткий срок службы, низкую номинальную мощность и низкую термическую стабильность.
- LFP – 120 Втч/кг, имеют длительный срок службы и стабильность при высоких рабочих температурах.
- LMO – 140 Втч/кг, катоды основаны на компонентах оксида марганца, которые широко распространены, недороги, нетоксичны и обеспечивают хорошую термическую стабильность.
- NCA – 250 Втч/кг, обеспечивает высокую удельную энергию и длительный срок службы.
- NMC – 200 Втч/кг, изменение соотношения химических компонентов позволяет разрабатывать батареи, оптимизированные как силовые или энергетические элементы.
 Благодаря своей гибкости это одна из самых успешных химических систем для литиевых батарей.
Благодаря своей гибкости это одна из самых успешных химических систем для литиевых батарей. - LTO — 80 Втч/кг, самая низкая удельная энергия, но может быть быстро заряжена, разряжена до 10-кратной номинальной емкости и безопасна.
Сравнение напряжений литиевых батарей и приложений. (Изображение: TechSci Research)
Обратите внимание, что батареи NMC, LCO и NCA содержат кобальт, который обеспечивает более высокую мощность. Они могут обеспечить большое количество энергии в небольшом корпусе, но могут быть более чувствительными к тепловым явлениям, которые могут вызвать проблемы с безопасностью.
На следующем рисунке представлены крестообразные диаграммы, в которых сравниваются основные типы литиевых аккумуляторов в зависимости от их пригодности для использования в электромобилях (EV). На этих диаграммах паука батареи, которые лучше подходят для электромобилей, имеют большую окрашенную область. Учитываемыми факторами являются удельная энергия, удельная мощность, безопасность, производительность, срок службы и стоимость. Удельная энергия в Втч/кг относится к диапазону EV. Удельная мощность в Вт/кг относится к ускорению электромобиля. В частности, в случае электромобилей безопасность является критически важным фактором. Параметр «Производительность» отражает возможность использования аккумулятора в экстремальных температурных условиях, что также является важным фактором в автомобильных приложениях. Life Span – это сочетание цикличности жизни и долговечности. Стоимость пытается охватить все сопутствующие расходы, включая вспомогательные системы для управления температурным режимом, безопасностью, управлением батареями и мониторингом, а также необходимость продления гарантийного срока для электромобилей.
Удельная энергия в Втч/кг относится к диапазону EV. Удельная мощность в Вт/кг относится к ускорению электромобиля. В частности, в случае электромобилей безопасность является критически важным фактором. Параметр «Производительность» отражает возможность использования аккумулятора в экстремальных температурных условиях, что также является важным фактором в автомобильных приложениях. Life Span – это сочетание цикличности жизни и долговечности. Стоимость пытается охватить все сопутствующие расходы, включая вспомогательные системы для управления температурным режимом, безопасностью, управлением батареями и мониторингом, а также необходимость продления гарантийного срока для электромобилей.
Сравнение характеристик различных литий-ионных химикатов для измерения пригодности для использования в электромобилях. (Изображение: MDPI)
LiPo химические вещества
Полимерный электролит приводит к нескольким улучшениям производительности, включая высокую плотность энергии и легкие батареи. В зависимости от структуры полимерных слоев это также может повысить безопасность батареи. По сравнению с обычными литий-ионными батареями, батареи LiPo могут изготавливаться с более широким диапазоном удельной плотности энергии (Втч/кг) и удельной плотности мощности (Вт/кг), что делает батареи LiPo более гибкими в более широком диапазоне потенциальных применений. В результате технология LiPo используется во всех основных химических элементах литиевых аккумуляторов:
В зависимости от структуры полимерных слоев это также может повысить безопасность батареи. По сравнению с обычными литий-ионными батареями, батареи LiPo могут изготавливаться с более широким диапазоном удельной плотности энергии (Втч/кг) и удельной плотности мощности (Вт/кг), что делает батареи LiPo более гибкими в более широком диапазоне потенциальных применений. В результате технология LiPo используется во всех основных химических элементах литиевых аккумуляторов:
- Литий-кобальт-оксидная батарея (LCO)
- Тройная литий-ионная батарея (NCA, NMC)
- Литий-ионная батарея на оксиде марганца (LMO)
- Литий-железо-фосфатная батарея (LFP)
График Рагона для сравнения Li-ion, LiPo (PLiON) и других аккумуляторов. (Изображение: MDPI)
Алюминиево-воздушные и твердополимерные батареи
Алюминиево-воздушные полимерные батареи находятся в активной разработке. Эти конструкции с высокой плотностью энергии имеют полимерный сепаратор, непосредственно контактирующий с литиевым анодом, чтобы отделить его от катода. Как и в других полимерных батареях, сепаратор предотвращает короткое замыкание в батарее и поглощает жидкий электролит, поддерживая перенос ионов и замыкая электрическую цепь.
Как и в других полимерных батареях, сепаратор предотвращает короткое замыкание в батарее и поглощает жидкий электролит, поддерживая перенос ионов и замыкая электрическую цепь.
К сожалению, литиевый анод может образовывать дендриты во время работы батареи. Эти дендриты могут проникать в полимерный сепаратор и укорачивать батарею. Разрабатываются модифицированные сепараторы, включающие слои оксида графена. Оксид графена защищает анод от загрязнений и предотвращает химические колебания на поверхности литиевого анода. Оксид графена работает вместе с полимерным слоем, чтобы предотвратить прямой контакт между электролитом и литиевым анодом без значительного снижения ионной проводимости. Эта комбинированная структура замедляет коррозию электролита на аноде. Есть надежда, что в будущем использование двух типов слоев для стабилизации литиевого анода приведет к созданию аккумуляторов с очень высокой плотностью энергии и приемлемым сроком службы.
Ячейки с настоящими твердыми полимерными электролитами (ТФЭ) вместо современных гелеобразных мембран также находятся в стадии разработки. Сегодняшние элементы LiPo считаются «гибридной» системой между обычным литий-ионным и полностью твердотельным литий-ионным аккумулятором. Гелевые мембраны представляют собой гибридные системы, в которых жидкие фазы содержатся в полимерной матрице. Хотя они могут быть сухими на ощупь, они могут содержать до 50% жидких растворителей. Современные системы также называются системами с гибридным полимерным электролитом (HPE), в которых сочетаются полимерный материал, жидкий растворитель и соль. В настоящее время разрабатываются ТФЭ, которые представляют собой полностью не содержащие растворителей системы в полимерной среде.
Сегодняшние элементы LiPo считаются «гибридной» системой между обычным литий-ионным и полностью твердотельным литий-ионным аккумулятором. Гелевые мембраны представляют собой гибридные системы, в которых жидкие фазы содержатся в полимерной матрице. Хотя они могут быть сухими на ощупь, они могут содержать до 50% жидких растворителей. Современные системы также называются системами с гибридным полимерным электролитом (HPE), в которых сочетаются полимерный материал, жидкий растворитель и соль. В настоящее время разрабатываются ТФЭ, которые представляют собой полностью не содержащие растворителей системы в полимерной среде.
В новой твердотельной структуре могут также использоваться недорогие катоды с высоким удельным преобразованием энергии, которые несовместимы с аккумуляторами на жидкой основе, такими как литий-ионные. Одним из примеров является запатентованный сульфидный твердый электролит, который поддерживает высокое содержание кремния и металлического лития в аноде в сочетании со стандартными промышленными катодами, включая оксиды лития, никеля, марганца, кобальта (NMC). Новые катоды можно комбинировать с металлическим литием для удаления кобальта и никеля, что может снизить затраты на катодный активный материал на 9%.0%.
Новые катоды можно комбинировать с металлическим литием для удаления кобальта и никеля, что может снизить затраты на катодный активный материал на 9%.0%.
Дорожная карта разработки твердотельных аккумуляторов удаляет кобальт и никель из катода (крайний справа). (Изображение: Solid Power)
Твердотельные элементы с емкостью 2 А·ч были произведены с использованием стандартного литий-ионного оборудования и процессов. Коммерческое производство элемента с кремниевым анодом емкостью 20 Ач ожидается к концу 2021 г., а производство 100 Ач ожидается в 2022 г. более легкие аккумуляторы. Кроме того, LiPo могут производиться в самых разных формах и размерах. Однако современные LiPo используют гелеобразные мембраны, а не полностью твердые полимерные электролиты (ТФЭ). SPE находятся в стадии разработки и могут расширить преимущества LiPo в производительности в определенных приложениях. Алюминиево-воздушные полимерные батареи обладают потенциалом очень высокой плотности энергии (что приводит к увеличению пробега электромобилей) и хорошим сроком службы. Полностью твердотельные литиевые батареи большого формата появятся на горизонте в 2021 году.
Полностью твердотельные литиевые батареи большого формата появятся на горизонте в 2021 году.
Ссылки
Текущие технологии литий-ионных аккумуляторов в электромобилях и возможности для усовершенствования, MDPI
Различные типы литий-полимерных аккумуляторов, Grepow
Введение в технологию литий-полимерных аккумуляторов, Jauch
Литий-полимерные аккумуляторы, Википедия
Производство литий- ion Batteries, TechSci Research
Types of Lithium-ion, Battery University
Стратегии производства твердых электролитов в батареях
Введение
Популяризация коммерческих аккумуляторов — одно из достижений современной цивилизации. За последние несколько десятилетий общество стало свидетелем изобретения медицинских имплантатов с автономным питанием, беспроводной электроники, электромобилей и многих других приложений, которые питаются от батарей разных форм и размеров. Традиционные батареи, использующие органические жидкие электролиты, продемонстрировали преимущества высокой ионной проводимости и превосходной смачиваемости электродами (Zhang, 2007; He et al. , 2019).), но страдают от потенциальных проблем с безопасностью, таких как высокая воспламеняемость, плохая термическая стабильность и утечка жидкости (Strauss et al., 2020; Yin et al., 2020; Yuan and Liu, 2020). Чтобы устранить присущие традиционным батареям недостатки безопасности, при этом отвечая высоким требованиям к электрохимическим характеристикам, батареи, использующие твердотельный электролит (SSE), продемонстрировали многообещающий выбор в качестве лучшей альтернативы.
, 2019).), но страдают от потенциальных проблем с безопасностью, таких как высокая воспламеняемость, плохая термическая стабильность и утечка жидкости (Strauss et al., 2020; Yin et al., 2020; Yuan and Liu, 2020). Чтобы устранить присущие традиционным батареям недостатки безопасности, при этом отвечая высоким требованиям к электрохимическим характеристикам, батареи, использующие твердотельный электролит (SSE), продемонстрировали многообещающий выбор в качестве лучшей альтернативы.
Как правило, SSE можно разделить на твердые полимерные электролиты (SPE), неорганические твердые электролиты (ISE) и составные твердые электролиты (CSE). ТФЭ состоят из полимерной матрицы с высокой молекулярной массой и растворенной соли лития, ИСЭ состоят из всех неорганических материалов, таких как керамика и стекло, а СПЭ состоят как из твердого полимера, так и из неорганических материалов (Zhang H. et al., 2017; Чен В. и др., 2018; Чен Ю. и др., 2020). В качестве одного из ключевых компонентов для практического применения твердотельных аккумуляторов ССЭ продемонстрировали многочисленные преимущества по сравнению с органическим жидким электролитом: (i) характеристики негорючести, высокотемпературной стабильности и нелетучести для предотвращения возгорания или взрыва. органических жидких электролитов (Fergus, 2010; Takada, 2013; Sun et al., 2020), (ii) широкое электрохимическое окно, обеспечивающее лучшую совместимость с катодом с более высоким потенциалом, что значительно улучшает плотность энергии (Judez et al. , 2017; Wang et al., 2018), (iii) повышенная механическая жесткость (особенно для ISE) для подавления роста дендритов из циклированных металлических анодов (Goodenough and Singh, 2015; Kim J.G. et al., 2015) и (iv ) настраиваемый модуль упругости (особенно для SPE и CSE), обеспечивающий более высокую степень технологичности и гибкости (Yue et al., 2016; Lau et al., 2018; Schnell et al., 2018; Zhou et al., 2018) . Однако следует дополнительно изучить и решить несколько проблем: (i) низкая ионная проводимость (<10 –5 См см –1 для ТФЭ и <10 –3 См см –1 для ИСЭ) по сравнению с жидким электролитом (>10 –3 См см –1 ), что приводит к низкая мощность и (ii) сложность изготовления миниатюрных/больших ИСЭ с высокой хрупкостью.
органических жидких электролитов (Fergus, 2010; Takada, 2013; Sun et al., 2020), (ii) широкое электрохимическое окно, обеспечивающее лучшую совместимость с катодом с более высоким потенциалом, что значительно улучшает плотность энергии (Judez et al. , 2017; Wang et al., 2018), (iii) повышенная механическая жесткость (особенно для ISE) для подавления роста дендритов из циклированных металлических анодов (Goodenough and Singh, 2015; Kim J.G. et al., 2015) и (iv ) настраиваемый модуль упругости (особенно для SPE и CSE), обеспечивающий более высокую степень технологичности и гибкости (Yue et al., 2016; Lau et al., 2018; Schnell et al., 2018; Zhou et al., 2018) . Однако следует дополнительно изучить и решить несколько проблем: (i) низкая ионная проводимость (<10 –5 См см –1 для ТФЭ и <10 –3 См см –1 для ИСЭ) по сравнению с жидким электролитом (>10 –3 См см –1 ), что приводит к низкая мощность и (ii) сложность изготовления миниатюрных/больших ИСЭ с высокой хрупкостью. В сочетании с новым дизайном материалов разработка передовых производственных стратегий обеспечит решение вышеуказанных проблем.
В сочетании с новым дизайном материалов разработка передовых производственных стратегий обеспечит решение вышеуказанных проблем.
Развитие аккумуляторных технологий демонстрировало экспоненциальную тенденцию с 1800-х годов, и мы стали свидетелями мотивации разработки аккумуляторов к постепенному переходу от улучшения характеристик гальванических элементов к удовлетворению конфигурационных требований сложных приложений. На рис. 1 показаны несколько важных вех в развитии производства аккумуляторов. Как самое раннее задокументированное изобретение батареи, гальванический столб состоял из штабеля меди, цинка и пропитанной соленой водой ткани в виде цилиндра для хранения электрохимической энергии (Абетти, 19).52; Уорнер, 2015). Почти шесть десятилетий спустя Гастон Планте (Kurzweil, 2010) погрузил пакеты из параллельных пластин из свинца/оксида свинца в серную кислоту и создал первую перезаряжаемую батарею. И гальванические батареи, и свинцово-кислотные батареи основывались на укладке металлических пластин для увеличения напряжения элемента (Warner, 2015). По мере того как эволюция продолжается, никель-кадмиевая батарея использовала цилиндрическую ячейку, заполненную уплотненными электродами из металлического листа, свернутыми в катушку с увеличенной площадью поверхности для уменьшения сопротивления батареи. Эта цилиндрическая конструкция была принята более поздней коммерческой щелочной батареей с электродными материалами, заполненными внутренним и внешним слоями (Furukawa et al., 19).84). В 1971 году изобретение литий-йодных аккумуляторов внесло значительный вклад в производство медицинского оборудования. В этом элементе батареи использовался металлический пакет с закругленными краями, чтобы предотвратить проблемы с проникновением, которые могут возникнуть из-за острых углов при имплантации в человеческое тело в составе кардиостимуляторов (Greatbatch and Holmes, 1991; Ruetschi et al., 1995).
По мере того как эволюция продолжается, никель-кадмиевая батарея использовала цилиндрическую ячейку, заполненную уплотненными электродами из металлического листа, свернутыми в катушку с увеличенной площадью поверхности для уменьшения сопротивления батареи. Эта цилиндрическая конструкция была принята более поздней коммерческой щелочной батареей с электродными материалами, заполненными внутренним и внешним слоями (Furukawa et al., 19).84). В 1971 году изобретение литий-йодных аккумуляторов внесло значительный вклад в производство медицинского оборудования. В этом элементе батареи использовался металлический пакет с закругленными краями, чтобы предотвратить проблемы с проникновением, которые могут возникнуть из-за острых углов при имплантации в человеческое тело в составе кардиостимуляторов (Greatbatch and Holmes, 1991; Ruetschi et al., 1995).
Рис. 1. Эволюция производства аккумуляторов.
С момента коммерциализации литий-ионных аккумуляторов (LIB) компанией Sony Co. в 1991 (Yoshio et al., 2009), многие традиционные и новые форм-факторы были применены в LIB, чтобы обеспечить разработку более качественных продуктов с точки зрения эстетики и функциональности. В литий-ионных призматических элементах использовались уплотненные и скрученные электроды, ранее использовавшиеся в никель-кадмиевых батареях, и они были упакованы в контейнеры, форма которых визуально напоминала плоскую плитку шоколада (Cousseau et al., 2006). Литий-ионные аккумуляторы достигли высокой эффективности упаковки 90–95% за счет сварки проводящих лепестков с электродной фольгой и герметичного запечатывания всех материалов внутри пакета (Buchmann, 2001). Изобретение литий-ионных призматических и карманных аккумуляторов является частью усилий по созданию более тонкой и легкой электроники. С прогрессом в технологической зрелости и сложности в последние годы новые производственные стратегии могут применяться к батареям в разных масштабах, которые подходят для различных приложений. Например, нанобатареи, используемые в качестве источника питания в биомедицинских приложениях (Johannessen et al.
в 1991 (Yoshio et al., 2009), многие традиционные и новые форм-факторы были применены в LIB, чтобы обеспечить разработку более качественных продуктов с точки зрения эстетики и функциональности. В литий-ионных призматических элементах использовались уплотненные и скрученные электроды, ранее использовавшиеся в никель-кадмиевых батареях, и они были упакованы в контейнеры, форма которых визуально напоминала плоскую плитку шоколада (Cousseau et al., 2006). Литий-ионные аккумуляторы достигли высокой эффективности упаковки 90–95% за счет сварки проводящих лепестков с электродной фольгой и герметичного запечатывания всех материалов внутри пакета (Buchmann, 2001). Изобретение литий-ионных призматических и карманных аккумуляторов является частью усилий по созданию более тонкой и легкой электроники. С прогрессом в технологической зрелости и сложности в последние годы новые производственные стратегии могут применяться к батареям в разных масштабах, которые подходят для различных приложений. Например, нанобатареи, используемые в качестве источника питания в биомедицинских приложениях (Johannessen et al. , 2006; Ruzmetov et al., 2012), гибкие батареи для складной/носимой электроники (Dudney, 2008; Leijonmarck et al., 2013; Deng et al., 2017), а также потенциально крупномасштабные аккумуляторные сети для хранения возобновляемой энергии (Diouf and Pode, 2015). Однако традиционные стратегии производства аккумуляторов, такие как сухое прессование, литье, центрифугирование и рулонное покрытие, неудовлетворительны при изготовлении аккумуляторов сложной формы или микро-/наноразмеров, особенно для ISE (Manthiram et al., 2017; Schnell et al., 2018 г.; Дирикан и др., 2019 г.). Поэтому существует потребность в использовании новой производственной стратегии для решения вышеуказанных проблем.
, 2006; Ruzmetov et al., 2012), гибкие батареи для складной/носимой электроники (Dudney, 2008; Leijonmarck et al., 2013; Deng et al., 2017), а также потенциально крупномасштабные аккумуляторные сети для хранения возобновляемой энергии (Diouf and Pode, 2015). Однако традиционные стратегии производства аккумуляторов, такие как сухое прессование, литье, центрифугирование и рулонное покрытие, неудовлетворительны при изготовлении аккумуляторов сложной формы или микро-/наноразмеров, особенно для ISE (Manthiram et al., 2017; Schnell et al., 2018 г.; Дирикан и др., 2019 г.). Поэтому существует потребность в использовании новой производственной стратегии для решения вышеуказанных проблем.
Появление технологии 3D-печати предложило уникальный метод производства, позволяющий создавать детали высокой сложности и с прекрасными характеристиками (Chen Z. et al., 2019; Santoliquido et al., 2019). Хотя использование технологии 3D-печати может быть многообещающей альтернативой в производстве SSE, первоначальная цель разработки 3D-печати не заключалась в производстве батарей. В результате существует огромный разрыв между возможностями современных методов 3D-печати и требованиями к производству аккумуляторов. Этот обзор направлен на устранение пробела путем анализа существующих ограничений в производстве SSE и определения будущих потребностей. Благодаря всестороннему обзору традиционных и новых производственных стратегий SSE мы стремимся предоставить рекомендации и информацию о потенциальных прорывах в производственных технологиях как для лабораторных исследований, так и для промышленного производства.
В результате существует огромный разрыв между возможностями современных методов 3D-печати и требованиями к производству аккумуляторов. Этот обзор направлен на устранение пробела путем анализа существующих ограничений в производстве SSE и определения будущих потребностей. Благодаря всестороннему обзору традиционных и новых производственных стратегий SSE мы стремимся предоставить рекомендации и информацию о потенциальных прорывах в производственных технологиях как для лабораторных исследований, так и для промышленного производства.
Традиционные производственные стратегии
Твердые полимерные/композитные электролиты
Твердые полимерные электролиты (ТПЭ) широко изучались для изготовления складных и растягиваемых аккумуляторов (Commarieu et al., 2018; Liang et al., 2018; Chen Y. et al. , 2020) благодаря нескольким преимуществам, таким как высокая гибкость, простота обработки и хорошая смачиваемость. Для производства ТФЭ можно использовать три разных способа: обработка на основе порошка, влажная химическая обработка и обработка с высокой вязкостью. Для обработки на основе порошка сначала используется процесс сухого измельчения на высокой скорости для приготовления хорошо перемешанных тонких порошков, а затем ТФЭ могут быть получены путем сухого прессования (Li et al., 2018), горячего/холодного изостатического прессования ( Appetecchi et al., 2001), или процесс осаждения (Hafner et al., 2019).). Преимущества обработки на основе порошка заключаются в простоте операции, низких требованиях к оборудованию и возможности избежать стадии уплотнения (Nguyen et al., 2019). Однако этот процесс занимает много времени, энергии и его трудно масштабировать. При мокрой химической обработке исходные частицы сначала диспергируют растворителем для получения суспензии заданной вязкости, а затем формируют ТФЭ методом литья из раствора (Sun et al., 2019), электрофоретического осаждения (Blanga et al., 2015), или процесс нанесения покрытия (Park et al., 2006). Преимущества влажной химической обработки заключаются в хорошей смачиваемости и высокой производительности (Liu et al.
Для обработки на основе порошка сначала используется процесс сухого измельчения на высокой скорости для приготовления хорошо перемешанных тонких порошков, а затем ТФЭ могут быть получены путем сухого прессования (Li et al., 2018), горячего/холодного изостатического прессования ( Appetecchi et al., 2001), или процесс осаждения (Hafner et al., 2019).). Преимущества обработки на основе порошка заключаются в простоте операции, низких требованиях к оборудованию и возможности избежать стадии уплотнения (Nguyen et al., 2019). Однако этот процесс занимает много времени, энергии и его трудно масштабировать. При мокрой химической обработке исходные частицы сначала диспергируют растворителем для получения суспензии заданной вязкости, а затем формируют ТФЭ методом литья из раствора (Sun et al., 2019), электрофоретического осаждения (Blanga et al., 2015), или процесс нанесения покрытия (Park et al., 2006). Преимущества влажной химической обработки заключаются в хорошей смачиваемости и высокой производительности (Liu et al. , 2017). Недостатком, однако, является необходимость удаления растворителя. Для обработки с высокой вязкостью при повышенных температурах сначала готовят высоковязкую пасту, не содержащую растворителей, состоящую из полимеров, а затем применяют процесс экструзии для создания ТФЭ с желаемым форм-фактором (Li W. et al., 2017), который в некоторых случаях помогает ультрафиолетовое (УФ) облучение для связывания полимерных цепей. Преимуществом этого процесса является обработка без использования растворителей и формирование гибких мембран с низкой пористостью (Wang et al., 2005). К недостаткам можно отнести ограниченную производительность в процессе экструзии и высокий процент брака при неравномерном осаждении полимерных пленок. Основными проблемами ТФЭ являются низкая ионная проводимость 10 –8 ∼10 –5 S см –1 при температуре окружающей среды (Liang et al., 2018) и высокое межфазное сопротивление из-за полимерной изоляции Li + (Wan et al., 2019).
, 2017). Недостатком, однако, является необходимость удаления растворителя. Для обработки с высокой вязкостью при повышенных температурах сначала готовят высоковязкую пасту, не содержащую растворителей, состоящую из полимеров, а затем применяют процесс экструзии для создания ТФЭ с желаемым форм-фактором (Li W. et al., 2017), который в некоторых случаях помогает ультрафиолетовое (УФ) облучение для связывания полимерных цепей. Преимуществом этого процесса является обработка без использования растворителей и формирование гибких мембран с низкой пористостью (Wang et al., 2005). К недостаткам можно отнести ограниченную производительность в процессе экструзии и высокий процент брака при неравномерном осаждении полимерных пленок. Основными проблемами ТФЭ являются низкая ионная проводимость 10 –8 ∼10 –5 S см –1 при температуре окружающей среды (Liang et al., 2018) и высокое межфазное сопротивление из-за полимерной изоляции Li + (Wan et al., 2019).
CSE, состоящие из полимерной и неорганической частей, разработаны для достижения удовлетворительных комплексных свойств и исключительных синергетических эффектов по сравнению с однокомпонентным электролитом. Из-за присутствия полимера стратегии производства CSE аналогичны стратегиям производства SPE, о которых сообщалось в предыдущих обзорах (Commarieu et al., 2018; Liu et al., 2018; Tan et al., 2018; Ли и др., 2020). Одной из самых популярных технологий получения CSE является электроформование, при котором получают переплетенные и высокопористые нановолокна с большим отношением поверхности к объему и повышенной механической прочностью за счет эффектов запутывания и армирования (Cavaliere et al., 2011; Wootthikanokkhan et al. ., 2015; Карли и др., 2019). Общей проблемой, которую следует отметить при производстве CSE, является ограниченная массовая загрузка неорганических материалов, которые легко агломерируются и, таким образом, ухудшают ионную проводимость и механическую прочность батарей. В целом ТФЭ и ЭПС обладают высокой степенью технологичности благодаря высокой гибкости полимерных материалов.
В целом ТФЭ и ЭПС обладают высокой степенью технологичности благодаря высокой гибкости полимерных материалов.
Неорганические твердые электролиты
Неорганические твердые электролиты можно разделить на группы кристаллических, стеклянных и стеклокерамических электролитов. Большинство кристаллических электролитов представляют собой керамику типа НАСИКОН, типа перовскита и типа граната, которая стабильна в окружающем воздухе, что может упростить изготовление элементов и повысить безопасность. Керамический электролит обычно готовят методом сухого прессования с последующим высокотемпературным спеканием (Li C. et al., 2019).). Для проведения сухого прессования с целью получения плотного керамического электролита тонкоизмельченные порошки необходимо предварительно смешать с ~5 мас.% поливинилового спирта, который легко образует дефекты микро-/макропор после обработки средством для удаления связующего. Кроме того, давление на порошок в разных точках в осевом направлении неодинаково, что приводит к неравномерной плотности и составу сухопрессованного образца (Suvacı and Messing, 2001; Tanaka et al. , 2006; Schiavo et al., 2018). . В качестве альтернативы можно выбрать коллоидный процесс для приготовления керамических электролитов с высокой относительной плотностью и хорошей однородностью состава (Lewis, 2004; Franks et al., 2017). При коллоидном формовании приготовление суспензий с высоким содержанием твердого вещества (>50 об.%) и низкой вязкостью [<1 Па⋅с при скорости сдвига 100 с –1 (Tallon and Franks, 2011; Chen A.N. et al., 2020)] является ключевым фактором для беспористого литья и получения плотной керамики. Следует отметить, что керамические электролиты обычно требуют осторожности при выборе растворителей, поскольку они могут вызвать нежелательную диффузию компонентов или реакцию (Li B. et al., 2017; Lim et al., 2018; Hitz et al., 2019). Другой частью кристаллического электролита является тио-ЛИЗИКОН (система Li 2 S-P 2 S 5 ), который позволяет достичь высокой ионной проводимости 10 –3 ∼10 –2 S см –1 из-за более поляризуемого электронного облака серы (Zhang et al.
, 2006; Schiavo et al., 2018). . В качестве альтернативы можно выбрать коллоидный процесс для приготовления керамических электролитов с высокой относительной плотностью и хорошей однородностью состава (Lewis, 2004; Franks et al., 2017). При коллоидном формовании приготовление суспензий с высоким содержанием твердого вещества (>50 об.%) и низкой вязкостью [<1 Па⋅с при скорости сдвига 100 с –1 (Tallon and Franks, 2011; Chen A.N. et al., 2020)] является ключевым фактором для беспористого литья и получения плотной керамики. Следует отметить, что керамические электролиты обычно требуют осторожности при выборе растворителей, поскольку они могут вызвать нежелательную диффузию компонентов или реакцию (Li B. et al., 2017; Lim et al., 2018; Hitz et al., 2019). Другой частью кристаллического электролита является тио-ЛИЗИКОН (система Li 2 S-P 2 S 5 ), который позволяет достичь высокой ионной проводимости 10 –3 ∼10 –2 S см –1 из-за более поляризуемого электронного облака серы (Zhang et al. , 2019; Shan et al., 2020). Процесс производства электролита тио-LISICON аналогичен керамическим электролитам, в то время как обычно требуется контролируемая инертная атмосфера из-за его чувствительности к воздуху (Manthiram et al., 2017). Кроме того, кристаллический электролит также может быть изготовлен с помощью тонкопленочной обработки, такой как импульсное лазерное осаждение (Fujimoto et al., 2015), химическое осаждение из паровой фазы (Gelfond et al., 2009).), напыление (Lethien et al., 2011), золь-гель осаждение (Jung et al., 2001) и т. д. , отсутствие сопротивления границ зерен, простота изготовления пленки, простота модификации состава и т. д. В общем, существует четыре основных метода обработки для получения стеклообразных электролитов: закалка расплава, механическое измельчение, золь-гель синтез и влажное химическое реакция. Метод закалки расплава включает в себя первоначальный предварительный нагрев/плавление исходных материалов, как правило, до температуры выше 900°C и последующим прессованием/отжигом (Pradel et al.
, 2019; Shan et al., 2020). Процесс производства электролита тио-LISICON аналогичен керамическим электролитам, в то время как обычно требуется контролируемая инертная атмосфера из-за его чувствительности к воздуху (Manthiram et al., 2017). Кроме того, кристаллический электролит также может быть изготовлен с помощью тонкопленочной обработки, такой как импульсное лазерное осаждение (Fujimoto et al., 2015), химическое осаждение из паровой фазы (Gelfond et al., 2009).), напыление (Lethien et al., 2011), золь-гель осаждение (Jung et al., 2001) и т. д. , отсутствие сопротивления границ зерен, простота изготовления пленки, простота модификации состава и т. д. В общем, существует четыре основных метода обработки для получения стеклообразных электролитов: закалка расплава, механическое измельчение, золь-гель синтез и влажное химическое реакция. Метод закалки расплава включает в себя первоначальный предварительный нагрев/плавление исходных материалов, как правило, до температуры выше 900°C и последующим прессованием/отжигом (Pradel et al. , 1985). Это наиболее распространенный метод получения стеклообразных и стеклокерамических электролитов. Из-за сильной склонности некоторых составов стекла к кристаллизации для достижения высокой скорости охлаждения за счет уменьшения объема расплавленного стекла используется двухроликовая закалочная установка (Pradel et al., 1985; Minami et al., 2006). . Недостатком метода закалки расплава являются высокие температуры и довольно сложная установка, которая может быть потенциально опасной. Благодаря простоте производственных процедур и способности улучшать измельчение/однородность при температуре и давлении окружающей среды, метод механического измельчения можно легко применять для производства большого количества хорошо перемешанных тонких порошков по низкой цене. Однако процесс аморфизации при измельчении имеет сильную зависимость от времени, и для наблюдения аморфного гало на рентгенограммах может потребоваться до 20 часов (Morimoto et al., 19).99; Хаяши и др., 2002). Метод золь-гель синтеза для производства стеклообразных электролитов включает процесс контролируемого гидролиза, поликонденсации, гелеобразования и дегидратации (Hench and West, 1990).
, 1985). Это наиболее распространенный метод получения стеклообразных и стеклокерамических электролитов. Из-за сильной склонности некоторых составов стекла к кристаллизации для достижения высокой скорости охлаждения за счет уменьшения объема расплавленного стекла используется двухроликовая закалочная установка (Pradel et al., 1985; Minami et al., 2006). . Недостатком метода закалки расплава являются высокие температуры и довольно сложная установка, которая может быть потенциально опасной. Благодаря простоте производственных процедур и способности улучшать измельчение/однородность при температуре и давлении окружающей среды, метод механического измельчения можно легко применять для производства большого количества хорошо перемешанных тонких порошков по низкой цене. Однако процесс аморфизации при измельчении имеет сильную зависимость от времени, и для наблюдения аморфного гало на рентгенограммах может потребоваться до 20 часов (Morimoto et al., 19).99; Хаяши и др., 2002). Метод золь-гель синтеза для производства стеклообразных электролитов включает процесс контролируемого гидролиза, поликонденсации, гелеобразования и дегидратации (Hench and West, 1990). В зависимости от состава стекла различные алкоксиды металлов или неорганические соединения используются в качестве прекурсоров для смешивания с соответствующим растворителем на стадии гидролиза. Последующая реакция конденсации образует связь и соединение для основы стеклянной сети (Hench and West, 1990). Благодаря реакции в жидком состоянии и перемешиванию золь-гель синтез может достигать высокой гомогенности при относительно низких температурах (Хенч и Уэст, 19).90; Венкатасубраманиан и др., 1991; Данн и др., 1994). Подобно процедурам золь-гель синтеза, метод влажной химической реакции позволяет получить желаемую композицию за счет перегруппировки молекул/связей во время реакции в жидком состоянии. Органические соединения обычно используются в качестве растворителя для растворения исходных химических веществ (Teragawa et al., 2014; Phuc et al., 2016; Choi et al., 2017).
В зависимости от состава стекла различные алкоксиды металлов или неорганические соединения используются в качестве прекурсоров для смешивания с соответствующим растворителем на стадии гидролиза. Последующая реакция конденсации образует связь и соединение для основы стеклянной сети (Hench and West, 1990). Благодаря реакции в жидком состоянии и перемешиванию золь-гель синтез может достигать высокой гомогенности при относительно низких температурах (Хенч и Уэст, 19).90; Венкатасубраманиан и др., 1991; Данн и др., 1994). Подобно процедурам золь-гель синтеза, метод влажной химической реакции позволяет получить желаемую композицию за счет перегруппировки молекул/связей во время реакции в жидком состоянии. Органические соединения обычно используются в качестве растворителя для растворения исходных химических веществ (Teragawa et al., 2014; Phuc et al., 2016; Choi et al., 2017).
Стеклокерамические электролиты включают класс материалов со смесью как аморфной, так и микрокристаллической микроструктуры, которые обычно получают путем контролируемой обработки зародышеобразования и кристаллизации соответствующего стеклянного материала при температуре выше температуры стеклования (Варшнея и Мауро, 2019). ). Подобно обычным технологиям производства стеклообразных электролитов, во многих предыдущих публикациях сообщалось о стеклокерамических электролитах, полученных путем закалки расплава или механического измельчения с последующей стадией отжига (Hayashi et al., 2003; Trevey et al., 2009; Tatsumisago and Хаяси, 2012). Однако температура и время отжига могут повлиять на структурное расположение кристаллических фаз и повлиять на ионную проводимость (Xie et al., 2009). Использование золь-гель синтеза и методов влажной химической реакции при производстве ИСЭ из стеклокерамики также сообщалось в нескольких недавних работах (Kotobuki et al., 2013; Teragawa et al., 2014; Li et al., 2015; Ma и др., 2016; Фук и др., 2016).
). Подобно обычным технологиям производства стеклообразных электролитов, во многих предыдущих публикациях сообщалось о стеклокерамических электролитах, полученных путем закалки расплава или механического измельчения с последующей стадией отжига (Hayashi et al., 2003; Trevey et al., 2009; Tatsumisago and Хаяси, 2012). Однако температура и время отжига могут повлиять на структурное расположение кристаллических фаз и повлиять на ионную проводимость (Xie et al., 2009). Использование золь-гель синтеза и методов влажной химической реакции при производстве ИСЭ из стеклокерамики также сообщалось в нескольких недавних работах (Kotobuki et al., 2013; Teragawa et al., 2014; Li et al., 2015; Ma и др., 2016; Фук и др., 2016).
Несмотря на то, что ISE предлагают многочисленные преимущества в технологии твердотельных аккумуляторов, их хрупкий характер создает множество проблем при обработке и интеграции. После изготовления ИСЭ обычно требуется последующая обработка, такая как шлифовка или резка, для получения желаемых форм для объединения с электродными слоями. Однако многие материалы ISE неизбежно сталкиваются с дилеммой химического перекрестного загрязнения или структурного повреждения во время последующей обработки. Например, керамические электролиты могут расколоться при резке, а электролиты для стекла/стеклокерамики могут иметь побочные реакции, связанные с водой или повышенной температурой при шлифовке/полировке. Следовательно, последующая обработка может значительно увеличить производственные затраты и удлинить производственный цикл. Краткое изложение традиционных методов производства SSE представлено схемами на рис. 2, где эти распространенные методы имеют аналогичные ограничения в достижении сложных форм-факторов, необходимых для будущих применений аккумуляторов. В этих условиях исследования 3D-печати SSE привлекают все большее внимание из-за возможности одноэтапного производства SSE с желаемыми форм-факторами. В обход многих дополнительных шагов, необходимых для традиционных методов, полностью интегрированное производство всей твердотельной батареи также может быть достигнуто с помощью 3D-печати в будущем.
Однако многие материалы ISE неизбежно сталкиваются с дилеммой химического перекрестного загрязнения или структурного повреждения во время последующей обработки. Например, керамические электролиты могут расколоться при резке, а электролиты для стекла/стеклокерамики могут иметь побочные реакции, связанные с водой или повышенной температурой при шлифовке/полировке. Следовательно, последующая обработка может значительно увеличить производственные затраты и удлинить производственный цикл. Краткое изложение традиционных методов производства SSE представлено схемами на рис. 2, где эти распространенные методы имеют аналогичные ограничения в достижении сложных форм-факторов, необходимых для будущих применений аккумуляторов. В этих условиях исследования 3D-печати SSE привлекают все большее внимание из-за возможности одноэтапного производства SSE с желаемыми форм-факторами. В обход многих дополнительных шагов, необходимых для традиционных методов, полностью интегрированное производство всей твердотельной батареи также может быть достигнуто с помощью 3D-печати в будущем. Далее в этом обзоре обсуждаются существующие стратегии 3D-печати для SSE, а затем подчеркиваются перспективы и возможности повышения производительности SSE, напечатанных на 3D-принтере.
Далее в этом обзоре обсуждаются существующие стратегии 3D-печати для SSE, а затем подчеркиваются перспективы и возможности повышения производительности SSE, напечатанных на 3D-принтере.
Рис. 2. Схема традиционных производственных стратегий с (A) Оптическое изображение твердого полимерного электролита на основе полиэтиленоксида (ПЭО). Воспроизведено из Chen C. et al. (2019) по лицензии Creative Commons Attribution. (B) Схема твердого композиционного электролита, сочетающего Li 6,75 La 3 Zr 1,75 Ta 0,25 O 12 (LLZTO) и поливинилиденфторид (ПВДФ). Воспроизведено из Zhang X. et al. (2017) с разрешения John Wiley & Sons-Books. (C) Оптическое изображение пленки керамического электролита Li 0,34 La 0,56 TiO 3 (LLTO). Воспроизведено из Jiang et al. (2020) с разрешения John Wiley & Sons-Books.
Технологии 3D-печати
Аддитивное производство, т. е. 3D-печать, относится к передовой технологии изготовления, при которой трехмерные объекты строятся послойно на основе файлов автоматизированного проектирования (САПР) (Chen A.N. et и др., 2017; Мао и др., 2017). По сравнению с традиционным методом, технология 3D-печати продемонстрировала уникальные преимущества в быстром прототипировании очень сложных и точных структур. Это преимущество может значительно упростить процедуру изготовления и сократить отходы материала, чтобы снизить себестоимость продукции (Chen A.N. et al., 2018; Li M. et al., 2019).). Кроме того, 3D-печать способна снять присущие батареям ограничения форм-фактора и преобразовать производство батарей из простого двухмерного в сложное трехмерное (Pang et al., 2019; Cheng et al., 2020; Yang et al., 2020). ). Учитывая вышеуказанные преимущества, для изготовления SSE было применено несколько методов 3D-печати. Эти методы 3D-печати SSE можно разделить на следующие две категории: печать на основе прямой записи (DW) [например, прямая запись чернилами (DIW), струйная печать (IJP), аэрозольная струйная печать (AJP) и наплавление.
е. 3D-печать, относится к передовой технологии изготовления, при которой трехмерные объекты строятся послойно на основе файлов автоматизированного проектирования (САПР) (Chen A.N. et и др., 2017; Мао и др., 2017). По сравнению с традиционным методом, технология 3D-печати продемонстрировала уникальные преимущества в быстром прототипировании очень сложных и точных структур. Это преимущество может значительно упростить процедуру изготовления и сократить отходы материала, чтобы снизить себестоимость продукции (Chen A.N. et al., 2018; Li M. et al., 2019).). Кроме того, 3D-печать способна снять присущие батареям ограничения форм-фактора и преобразовать производство батарей из простого двухмерного в сложное трехмерное (Pang et al., 2019; Cheng et al., 2020; Yang et al., 2020). ). Учитывая вышеуказанные преимущества, для изготовления SSE было применено несколько методов 3D-печати. Эти методы 3D-печати SSE можно разделить на следующие две категории: печать на основе прямой записи (DW) [например, прямая запись чернилами (DIW), струйная печать (IJP), аэрозольная струйная печать (AJP) и наплавление. моделирование (FDM)] и печать на основе литографии [например, стереолитография (SL) и цифровая обработка света (DLP)]. Далее будут обсуждаться последние достижения в исследованиях стратегий 3D-печати SSE с точки зрения выбора исходного сырья, оболочки сборки и разрешения печати.
моделирование (FDM)] и печать на основе литографии [например, стереолитография (SL) и цифровая обработка света (DLP)]. Далее будут обсуждаться последние достижения в исследованиях стратегий 3D-печати SSE с точки зрения выбора исходного сырья, оболочки сборки и разрешения печати.
3D-печать твердотельных электролитов на основе DW
Прямая запись чернилами
Прямое письмо чернилами (DIW) является наиболее широко используемым методом 3D-печати для производства SSE из-за его низкой стоимости, простоты в эксплуатации и широкого выбора сырья ( металлы, полимеры и керамика) (Ambrosi and Pumera, 2016; Du et al., 2017). Схема процесса DIW показана на рисунке 3A. В процессе печати вязкоупругие чернила на гелевой основе выдавливаются непосредственно из головки сопла в виде непрерывной нити. Перемещая сопло вверх, проектируемые 3D-объекты могут быть созданы путем последовательного послойного осаждения. После печати материалы чернил быстро затвердевают под воздействием испарения растворителя, гелеобразования, фазовых переходов, вызванных температурой или растворителем (Naficy et al. , 2014). Как правило, разрешение печати DIW-объектов определяется диаметром сопла, который составляет от десятков до сотен микрометров. Для печати SSE с высоким разрешением (10–100 мкм) решающим фактором является высокоэффективный состав чернил. Печатная краска должна быть отрегулирована таким образом, чтобы обеспечить хорошее разжижение при сдвиге, обеспечивающее плавный поток чернил через сопло, а также достаточно высокий предел текучести и модуль накопления, чтобы обеспечить сохранение формы экструдированных нитей (Chang et al., 2019).).
, 2014). Как правило, разрешение печати DIW-объектов определяется диаметром сопла, который составляет от десятков до сотен микрометров. Для печати SSE с высоким разрешением (10–100 мкм) решающим фактором является высокоэффективный состав чернил. Печатная краска должна быть отрегулирована таким образом, чтобы обеспечить хорошее разжижение при сдвиге, обеспечивающее плавный поток чернил через сопло, а также достаточно высокий предел текучести и модуль накопления, чтобы обеспечить сохранение формы экструдированных нитей (Chang et al., 2019).).
Рис. 3. Прямое письмо чернилами (DIW). (A) Схематическая и СЭМ-микроскопия гелевого электролита для Zn-MnO 2 микробатареи. Воспроизведено из Ho et al. (2010) с разрешения IOP Publishing, Ltd. (B) Схематические и оптические изображения полимерного электролита для Li 4 Ti 5 O 12 -графеноксидной батареи. Воспроизведено из Fu et al. (2016) с разрешения John Wiley & Sons-Books. (C) Схема и СЭМ-микрофотография композитного твердого электролита (CSE) для гибких ЛИА (LiFePO 4 /CSE/Li 4 Ti 5 O 12 ). Воспроизведено из Blake et al. (2017) с разрешения John Wiley & Sons-Books. (D) СЭМ-микроскопия и оптическое изображение CSE для ЛИА с электродом MnO 2 . Воспроизведено из Cheng et al. (2018) с разрешения John Wiley & Sons-Books. (E) Схема и СЭМ-микрофотографии Li 7 La 3 Zr 2 O 12 (LLZ) керамический электролит для литий-металлического аккумулятора (Li/LLZ/Li). Воспроизведено из Mcowen et al. (2018) с разрешения John Wiley & Sons-Books.
(C) Схема и СЭМ-микрофотография композитного твердого электролита (CSE) для гибких ЛИА (LiFePO 4 /CSE/Li 4 Ti 5 O 12 ). Воспроизведено из Blake et al. (2017) с разрешения John Wiley & Sons-Books. (D) СЭМ-микроскопия и оптическое изображение CSE для ЛИА с электродом MnO 2 . Воспроизведено из Cheng et al. (2018) с разрешения John Wiley & Sons-Books. (E) Схема и СЭМ-микрофотографии Li 7 La 3 Zr 2 O 12 (LLZ) керамический электролит для литий-металлического аккумулятора (Li/LLZ/Li). Воспроизведено из Mcowen et al. (2018) с разрешения John Wiley & Sons-Books.
В 2010 году Ho et al. сообщили о первом DIW-печатном SSE с ионной жидкостью. (2010). Как показано на рисунке 3A, SSE был зажат между электродами в микробатарейке Zn-MnO 2 . Напечатанная ячейка показала ёмкость 0,98 мАч·см·–2· и плотность энергии 1,2 мВтч·см·–2· в течение более чем 70 циклов. Фу и др. (2016) печатные полимерно-композитные электролитные чернила с регулируемой вязкостью для встречно-штыревой батареи Li 4 Ti 5 O 12 -графеноксида (GO) (рис. 3B). Отметив, что чешуйки GO контролировались, чтобы выровняться вдоль направления экструзии в осажденных электродах, что могло улучшить электропроводность и обеспечить достаточную площадь поверхности для размещения электролита. CSE были созданы для гибких LIB компанией DIW (рис. 3C, D; Blake et al., 2017; Cheng et al., 2018). По сравнению с коммерческим полиолефиновым сепаратором печатные CSE продемонстрировали сопоставимые высокие электрохимические характеристики, лучшую термическую стабильность, смачиваемость электролитом и способность к повторному использованию (Blake et al., 2017). Макоуэн и др. (2018) подготовил Ли 7 La 3 Zr 2 O 12 (LLZ) керамический электролит с различными микрометрическими характеристиками для литий-металлической батареи (рис.
Фу и др. (2016) печатные полимерно-композитные электролитные чернила с регулируемой вязкостью для встречно-штыревой батареи Li 4 Ti 5 O 12 -графеноксида (GO) (рис. 3B). Отметив, что чешуйки GO контролировались, чтобы выровняться вдоль направления экструзии в осажденных электродах, что могло улучшить электропроводность и обеспечить достаточную площадь поверхности для размещения электролита. CSE были созданы для гибких LIB компанией DIW (рис. 3C, D; Blake et al., 2017; Cheng et al., 2018). По сравнению с коммерческим полиолефиновым сепаратором печатные CSE продемонстрировали сопоставимые высокие электрохимические характеристики, лучшую термическую стабильность, смачиваемость электролитом и способность к повторному использованию (Blake et al., 2017). Макоуэн и др. (2018) подготовил Ли 7 La 3 Zr 2 O 12 (LLZ) керамический электролит с различными микрометрическими характеристиками для литий-металлической батареи (рис. 3E). Было доказано, что эти структуры электролита обеспечивают батареи с хорошими механическими свойствами, более низким сопротивлением полного элемента и улучшенной плотностью энергии и мощности. Об аналогичной работе DIW сообщалось и в других источниках (Braam et al., 2012; Wei et al., 2018; Ma and Devin Mackenzie, 2019). Основные преимущества DIW заключаются в широком выборе исходного сырья и широком диапазоне рабочей зоны (100 мкм–10 см). Использование концентрированных вязкоупругих паст позволяет создавать трехмерные конструкции без необходимости в опорах (таких как порошковый слой, жидкий чан или печатные ручные опоры) (Chen Z. et al., 2019).), что может упростить процесс печати, исключить процесс обработки поверхности и максимизировать использование сырья. DIW хорошо изучен для изготовления специальных пористых структур, обладающих периодическими характеристиками, с небольшим разрешением или без него. Однако приготовление вязкоупругих паст на основе геля для DIW является сложной задачей.
3E). Было доказано, что эти структуры электролита обеспечивают батареи с хорошими механическими свойствами, более низким сопротивлением полного элемента и улучшенной плотностью энергии и мощности. Об аналогичной работе DIW сообщалось и в других источниках (Braam et al., 2012; Wei et al., 2018; Ma and Devin Mackenzie, 2019). Основные преимущества DIW заключаются в широком выборе исходного сырья и широком диапазоне рабочей зоны (100 мкм–10 см). Использование концентрированных вязкоупругих паст позволяет создавать трехмерные конструкции без необходимости в опорах (таких как порошковый слой, жидкий чан или печатные ручные опоры) (Chen Z. et al., 2019).), что может упростить процесс печати, исключить процесс обработки поверхности и максимизировать использование сырья. DIW хорошо изучен для изготовления специальных пористых структур, обладающих периодическими характеристиками, с небольшим разрешением или без него. Однако приготовление вязкоупругих паст на основе геля для DIW является сложной задачей. Кроме того, печатные элементы DIW ограничены структурами из поленницы из-за экструдированных форм нитей, что свидетельствует о трудностях изготовления плотных структур.
Кроме того, печатные элементы DIW ограничены структурами из поленницы из-за экструдированных форм нитей, что свидетельствует о трудностях изготовления плотных структур.
Струйная печать
Струйная печать (IJP) представляет собой метод бесконтактного нанесения материала на основе капель, который позволяет напрямую выбрасывать микрокапли чернил через сопла на различные типы подложек для создания двумерных (2D) рисунков (Доброжан и др., 2020). Схема процесса IJP показана на рисунке 4A. В качестве многообещающего метода IJP был изучен для печати несколькими материалами, включая металл, полимеры, со-гель, белковые материалы и т. Д. (Fritzler and Prinz, 2017). Как правило, чернила для IJP должны быть в разбавленной жидкой форме с достаточно низкой динамической вязкостью и поверхностным натяжением. Количественная характеристика, основанная на физических свойствах чернил, была предложена Дерби (2010) для оценки того, можно ли описать чернила как «пригодность для печати» для IJP: Z = 1/ Ох = ( γρα ) 1/2 / η , где Z — обратное число безразмерного числа, 0 0 0 О — число, обратное безразмерному характерная длина, представляющая радиус сопла, а ρ , η и γ — плотность, динамическая вязкость и поверхностное натяжение чернил соответственно. В случае 1 < Z < 10 ожидается, что чернила будут образовывать стабильные капли, чтобы обеспечить процесс IJP.
В случае 1 < Z < 10 ожидается, что чернила будут образовывать стабильные капли, чтобы обеспечить процесс IJP.
Рис. 4. Струйная печать (IJP). (А) Схема процесса IJP; (B) СЭМ в поперечном сечении и картирование элементов пористого композитного LiFePO 4 электрода с напечатанными ионогелевыми электролитами; (C) Температурно-зависимая ионная проводимость печатных ионогелей; (D) Гальваностатическое циклирование полуэлемента с использованием печатных ионогелей и пористых композитных электродов LiFePO 4 и Li 4 Ti 5 O 12 . Воспроизведено из Delannoy et al. (2015) с разрешения Elsevier Science and Technology Journals.
Применение IJP для печати SSE было впервые описано в литературе Delannoy et al. (2015). Авторы нанесли ионогелевые чернила на основе кремнезема непосредственно на пористые композитные электроды, чтобы сформировать SSE для LIB (рис. 4A–D). Ионогель SSE показал высокую ионную проводимость, хорошую термостойкость и отличную совместимость с пористыми электродами, что позволило изготовить микро-ЛИА с высокой поверхностной емкостью и хорошими характеристиками электрохимического циклирования. Полная ячейка с использованием напечатанного IJP ионогеля SSE с LiFePO 4 и Li 4 Ti 5 O 12 пористые композитные электроды показали поверхностную емкость 300 мА·ч·см –2 в течение более 100 циклов, что было более конкурентоспособным, чем у микроустройств, полученных дорогостоящим физическим процесс парообразования. В методе IJP диаметр сопла обычно составляет менее 5 мкм, что меньше по сравнению с DIW (от десятков до сотен микрометров). В этом случае ИПП позволяет изготавливать спроектированные структуры с более высоким разрешением (5–20 мкм), что способствовало применению ИПП в области микроэлектроники и энергетических устройств. Однако объекты, напечатанные IJP, в основном ограничены двумерным пространством с оболочкой здания 50–10 мм и не могут быть адаптированы для нанесения толстых рисунков из-за очень небольшого объема исходных чернил.
Ионогель SSE показал высокую ионную проводимость, хорошую термостойкость и отличную совместимость с пористыми электродами, что позволило изготовить микро-ЛИА с высокой поверхностной емкостью и хорошими характеристиками электрохимического циклирования. Полная ячейка с использованием напечатанного IJP ионогеля SSE с LiFePO 4 и Li 4 Ti 5 O 12 пористые композитные электроды показали поверхностную емкость 300 мА·ч·см –2 в течение более 100 циклов, что было более конкурентоспособным, чем у микроустройств, полученных дорогостоящим физическим процесс парообразования. В методе IJP диаметр сопла обычно составляет менее 5 мкм, что меньше по сравнению с DIW (от десятков до сотен микрометров). В этом случае ИПП позволяет изготавливать спроектированные структуры с более высоким разрешением (5–20 мкм), что способствовало применению ИПП в области микроэлектроники и энергетических устройств. Однако объекты, напечатанные IJP, в основном ограничены двумерным пространством с оболочкой здания 50–10 мм и не могут быть адаптированы для нанесения толстых рисунков из-за очень небольшого объема исходных чернил. Кроме того, IJP имеет ограниченную гибкость при изготовлении сложных структур (таких как полые и выступающие) из-за трудностей подготовки подложки с использованием экструдированных разбавленных жидких чернил. Эти ограничения ограничили его дальнейшее применение.
Кроме того, IJP имеет ограниченную гибкость при изготовлении сложных структур (таких как полые и выступающие) из-за трудностей подготовки подложки с использованием экструдированных разбавленных жидких чернил. Эти ограничения ограничили его дальнейшее применение.
Аэрозольная струйная печать
Аэрозольная струйная печать (AJP) — это относительно новый метод бесконтактного нанесения, ориентированный в первую очередь на изготовление печатной электроники. Сырье (например, металлы, полимеры и керамика) для осаждения AJP должно быть в жидкой форме и подвергаться пневматическому или ультразвуковому аэрозольному распылению в капли диаметром 1–5 мкм. Эти капли затем доставляются на подложку потоком газа для формирования желаемых узоров (Mahajan et al., 2013). Схема процесса AJP показана на рисунке 5A. Разрешение печати AJP зависит не только от размера сопла, но и от плотности капель и их взаимодействия с подложкой (Hoey et al., 2012). AJP считается потенциальным конкурентом IJP в миллиметровом производстве, поскольку он позволяет бесконтактное нанесение на гибкие и трехмерные неплоские подложки, что невозможно для методов IJP или DIW.
Рис. 5. Аэрозольная струйная печать (AJP). (А) Схема процесса AJP. Воспроизведено из Hoey et al. (2012) по лицензии Creative Commons Attribution. AJP для электролитов на основе полиэтиленоксида (ПЭО) в ЛИА с LiFePO 4 в качестве катода: (B) СЭМ-микрофотография поперечного сечения электролитов на основе ПЭО; (C) Температурно-зависимая проводимость электролитов на основе ПЭО; (D) Кривые разряда для батарей, созданных из печатного электролита на основе ПЭО, при 45°C с вставкой для измерения при 75°C. Воспроизведено из Deiner et al. (2019) с разрешения John Wiley & Sons-Books.
Применение AJP для печати SSE было впервые описано в литературе Deiner et al. (2019). В этой работе был представлен состав чернил, состоящий из ПЭО, дифтор(оксалата)бората лития и наночастиц Al 2 O 3 , подходящих для нанесения AJP (рис. 5B–D). Результаты показали, что геометрия и транспортные свойства печатных ТФЭ были в основном чувствительны к химической идентичности аниона соли лития и соотношению ЭО: Li. ЛИА с ТФЭ, осажденными из AJP, могли быть разряжены при C/15 с емкостью >85 мА·ч·г·9.1748 –1 при 45°C и 162 мА·ч g –1 при 75°C. По сравнению с IJP, AJP имеет следующие преимущества: (i) экструдированные чернила обеспечивают гораздо более высокую вязкость, больший размер частиц и загрузку твердых частиц благодаря процессу распыления, который воспроизводит мелкие капли, (ii) он основан на непрерывном образовании туман из капель диаметром 1–5 мкм, что указывает на более высокое разрешение печати (∼5 мкм) и скорость осаждения, чем в процессе IJP drop-on-demand, и (iii) непрерывный туман состоит из высокоплотных капли, которые плотно сфокусированы, демонстрируя способность препятствовать засорению тонкого сопла. Тем не менее, масштабируемость системы напыления, особенно для обработки больших площадей (с оболочкой > 3 мм) по-прежнему является сложной задачей для AJP из-за размера сопла и дополнительных принадлежностей. Кроме того, стоимость дополнительных приспособлений и сфокусированного потока газа в системе AJP обычно высока.
ЛИА с ТФЭ, осажденными из AJP, могли быть разряжены при C/15 с емкостью >85 мА·ч·г·9.1748 –1 при 45°C и 162 мА·ч g –1 при 75°C. По сравнению с IJP, AJP имеет следующие преимущества: (i) экструдированные чернила обеспечивают гораздо более высокую вязкость, больший размер частиц и загрузку твердых частиц благодаря процессу распыления, который воспроизводит мелкие капли, (ii) он основан на непрерывном образовании туман из капель диаметром 1–5 мкм, что указывает на более высокое разрешение печати (∼5 мкм) и скорость осаждения, чем в процессе IJP drop-on-demand, и (iii) непрерывный туман состоит из высокоплотных капли, которые плотно сфокусированы, демонстрируя способность препятствовать засорению тонкого сопла. Тем не менее, масштабируемость системы напыления, особенно для обработки больших площадей (с оболочкой > 3 мм) по-прежнему является сложной задачей для AJP из-за размера сопла и дополнительных принадлежностей. Кроме того, стоимость дополнительных приспособлений и сфокусированного потока газа в системе AJP обычно высока.
Моделирование наплавлением
Моделирование наплавлением (FDM) — это хорошо известный метод 3D-печати для создания сложных объектов как в промышленности, так и в научных кругах благодаря своей простоте и доступности оборудования (Bellini and Güçeri, 2003). Механизм формирования FDM аналогичен механизму DIW, который основан на принципе экструдирования материала, в то время как их исходное сырье и процесс подачи отличаются. Схема процесса FDM показана на рисунке 6A. Материалы для FDM-печати должны быть твердыми и термопластичными в форме тонких нитей, которые могут быть доставлены к экструзионной головке с помощью ведущих колес. После экструзии из сопла термопластические материалы, которые нагреваются до состояния стеклования, кристаллизуются и затвердевают, осаждаясь на подложку. Обычными термопластическими материалами, используемыми в технике FDM, являются акрилонитрил-бутадиен-стирольные и полимолочные нити (PLA), в которых PLA приобретает все большую популярность благодаря своей безвредности для окружающей среды. Несмотря на эти преимущества, метод FDM редко применялся для изготовления SSE из-за низкой ионной проводимости термопластов. Таким образом, разработка термопластичных материалов в форме нитей с высокой ионной проводимостью является ключом к производству SSE методом FDM.
Несмотря на эти преимущества, метод FDM редко применялся для изготовления SSE из-за низкой ионной проводимости термопластов. Таким образом, разработка термопластичных материалов в форме нитей с высокой ионной проводимостью является ключом к производству SSE методом FDM.
Рис. 6. Моделирование методом наплавления (FDM). (А) Схема процесса FDM. Воспроизведено из Klippstein et al. (2018) с разрешения John Wiley & Sons-Books. FDM для электролитов на основе полимолочной кислоты (PLA) в LIB (титанат лития/матрица PLA/оксид лития-марганца): (B) Отдельные компоненты 3D-печатной монетной ячейки; (C) Емкость и кулоновский выход при плотности тока 20 мА –1 за 100 циклов; (D) Оптическое изображение печатной батареи, питающей светодиод; (E) SEM поперечное сечение одной батареи печати. Воспроизведено из Reyes et al. (2018) с разрешения Американского химического общества.
В 2018 г. Reyes et al. (2018) впервые синтезировали электролитные нити на основе PLA для FDM-печати с наивысшей ионной проводимостью 0,031 мСм⋅см –1 путем вливания смеси этилметилкарбоната, пропиленкарбоната и LiClO 4 . Они также разработали электродные материалы из PLA для 3D-печати полных литий-ионных аккумуляторов произвольной формы, таких как батарейки типа «таблетка» и встроенные батареи, используемые в носимых электронных устройствах, как показано на рисунках 6B–E. Однако напечатанная полная ячейка имеет более низкую кулоновскую эффективность (∼88,5% в течение первых 50 циклов) по сравнению с традиционными LIB (∼95–99%) (Смит и др., 2010). FDM предлагает множество преимуществ, таких как низкая стоимость печати, возможности большого размера (максимальная ширина сборки около 10 см) и, в частности, возможность печати структуры из нескольких исходных материалов. Тем не менее, все еще существует несколько ограничений на производство SSE с помощью FDM: (i) материалы для печати ограничены термопластами и должны быть сформированы в нити, (ii) термопластичные нити должны быть нагреты до их состояния стеклования при высокой температуре 150 –180°C, и (iii) разрешение печати FDM вместе с Z -ось колеблется от 50 до 200 мкм, что приводит к плохому качеству поверхности и управляемости структуры.
Они также разработали электродные материалы из PLA для 3D-печати полных литий-ионных аккумуляторов произвольной формы, таких как батарейки типа «таблетка» и встроенные батареи, используемые в носимых электронных устройствах, как показано на рисунках 6B–E. Однако напечатанная полная ячейка имеет более низкую кулоновскую эффективность (∼88,5% в течение первых 50 циклов) по сравнению с традиционными LIB (∼95–99%) (Смит и др., 2010). FDM предлагает множество преимуществ, таких как низкая стоимость печати, возможности большого размера (максимальная ширина сборки около 10 см) и, в частности, возможность печати структуры из нескольких исходных материалов. Тем не менее, все еще существует несколько ограничений на производство SSE с помощью FDM: (i) материалы для печати ограничены термопластами и должны быть сформированы в нити, (ii) термопластичные нити должны быть нагреты до их состояния стеклования при высокой температуре 150 –180°C, и (iii) разрешение печати FDM вместе с Z -ось колеблется от 50 до 200 мкм, что приводит к плохому качеству поверхности и управляемости структуры.
3D-печать твердотельных электролитов на основе литографии
Стереолитография
Стереолитография (SL) считается наиболее известным и популярным методом 3D-печати и применяется для изготовления полимерных, керамических и стеклянных деталей (Eckel et al., 2016; Ngo et al., 2018; Santoliquido et al., 2019). Схема процесса SL показана на рисунке 7A. SL позволяет производить сложные трехмерные микрорешетки путем селективной полимеризации и отверждения фотоотверждаемой смолы с использованием источника света определенной длины волны (обычно в УФ-диапазоне) (Chartrain et al., 2018). Процесс полимеризации обычно протекает на поверхности жидкости. Как только один слой полимеризации завершен, чан или платформа, поддерживающая строительную часть, поднимается или опускается на толщину слоя. Иногда требуется лезвие, чтобы выровнять поверхность жидкости перед полимеризацией следующего слоя. Фотоотверждаемая смола SL состоит в основном из фотоактивных мономеров и других добавок в очень небольших количествах, в частности фотоинициатора (Manapat et al. , 2017). По сравнению с технологией 3D-печати на основе DW (например, DIW, IJP, AJP и FDM), SL способна изготавливать произвольные 3D-геометрии, включая различные полые резные элементы с высоким разрешением вплоть до микрометрового масштаба, и может устранить ограничения. из траектории и серийной экструзии (Янг и др., 2016). Таким образом, СР обладает высоким потенциалом для изготовления различных типов ЭСЭ, в том числе ТФЭ, ЭСЭ и ИСЭ.
, 2017). По сравнению с технологией 3D-печати на основе DW (например, DIW, IJP, AJP и FDM), SL способна изготавливать произвольные 3D-геометрии, включая различные полые резные элементы с высоким разрешением вплоть до микрометрового масштаба, и может устранить ограничения. из траектории и серийной экструзии (Янг и др., 2016). Таким образом, СР обладает высоким потенциалом для изготовления различных типов ЭСЭ, в том числе ТФЭ, ЭСЭ и ИСЭ.
Рис. 7. Стереолитография (SL). (А) Схема процесса СЛ. Воспроизведено из Gross et al. (2014) с разрешения Американского химического общества. SL для твердотельных электролитов (SSE): (B) Процесс трафаретной печати с УФ-отверждением твердых полимерных электролитов (SPE, = этоксилированный триметилолпропантриакрилатный мономер/высококипящий электролит/Al 2 O 3 наночастицы) тонкий слой для ЛИА [LiFePO 4 (LFP)/SPE/Li 4 Ti 5 O 12 (LTO)]. Воспроизведено из Ким С.Х. и другие. (2015) с разрешения Американского химического общества. (C) Оптическое изображение и трехмерная структура ТФЭ на основе полиэтиленгликоля для микроЛИБ (LFP/SPE/LTO). Воспроизведено из Chen Q. et al. (2017) с разрешения IOP Publishing, Ltd. (D) Схематические изображения и изображения SEM 3D-печатных шаблонов с кубической, гироидной, ромбовидной и полученной из биджеля микроархитектурой Li 1,4 Al 0,4 Ge 1,6 (PO 4 ) 3 (LAGP)-эпоксидные электролиты для литий-металлических аккумуляторов с симметричными литиевыми электродами. Воспроизведено из Zekoll et al. (2018) с разрешения Королевского химического общества. (E) Оптическое изображение, СЭМ-изображения и кривые зависимости напряжения/мощности от плотности тока для элементов из твердого оксида лантана-стронция (LSM-YSZ)/YSZ/Ni-YSZ. Воспроизведено из Pesce et al. (2020) по лицензии Creative Commons Attribution 3.0 Unported License, опубликованной Королевским химическим обществом.
Воспроизведено из Ким С.Х. и другие. (2015) с разрешения Американского химического общества. (C) Оптическое изображение и трехмерная структура ТФЭ на основе полиэтиленгликоля для микроЛИБ (LFP/SPE/LTO). Воспроизведено из Chen Q. et al. (2017) с разрешения IOP Publishing, Ltd. (D) Схематические изображения и изображения SEM 3D-печатных шаблонов с кубической, гироидной, ромбовидной и полученной из биджеля микроархитектурой Li 1,4 Al 0,4 Ge 1,6 (PO 4 ) 3 (LAGP)-эпоксидные электролиты для литий-металлических аккумуляторов с симметричными литиевыми электродами. Воспроизведено из Zekoll et al. (2018) с разрешения Королевского химического общества. (E) Оптическое изображение, СЭМ-изображения и кривые зависимости напряжения/мощности от плотности тока для элементов из твердого оксида лантана-стронция (LSM-YSZ)/YSZ/Ni-YSZ. Воспроизведено из Pesce et al. (2020) по лицензии Creative Commons Attribution 3.0 Unported License, опубликованной Королевским химическим обществом.
В 2015 году Ким Ш.Х. и другие. (2015) подготовили слой ТФЭ и электроды, встроенные в матрицу ТФЭ, на произвольных объектах, а затем собрали в многослойные структурированные гибкие LIB в различных форм-факторах (рис. 7B). Напечатанные батареи показали хорошую способность долговременного хранения заряда и средний уровень объемной плотности энергии. Чен К. и соавт. (2017) разработали УФ-отверждаемую смолу на основе поли(этиленгликоля) для SL-печати 3D-гелевого полимерного электролита для микролитиевых батарей недорогим и высокопроизводительным способом. Как показано на рисунке 7C, напечатанный зигзагообразный GPE может увеличить площадь контакта с электродами и улучшить ионную проводимость до 4,8 × 10 –3 S см –1 можно получить при температуре окружающей среды, сравнимой с температурой жидкого электролита. Зеколл и др. (2018) сообщили о CSE, напечатанных методом SL, содержащих 3D-биконтинуум Li 1,4 Al 0,4 Ge 1,6 (PO 4 ) 3 (LAGP) керамический электролит и изолирующий полимер (эпоксидный полимер, полипропилен) для Li 1,4 Al 0,4 Ge 1,6 металлическая батарея (рис. 7D). Этот метод может точно контролировать соотношение керамики и полимера, а также геометрию и размер разнообразных точных микроархитектур, таких как кубические, гироидальные, алмазные и биджелевые структуры. Гироидный LAGP-эпоксидный электролит имел ионную проводимость 1,6·10 –4 S см –1 , что было того же порядка, что и таблетка LAGP, в то время как печатный электролит продемонстрировал до 28% более высокую прочность на сжатие и до пяти раз большую прочность на изгиб. Недавняя работа, о которой сообщили Pesce et al. (2020) разработали самонесущие цельнокерамические электролиты из оксида циркония, стабилизированного 8 мол.% иттрия (YSZ), для твердооксидного топливного элемента (ТОТЭ), напечатанного SL (рис. 7E). Напечатанные плотные и без трещин электролиты 8YSZ достигли ионной проводимости до 3,0 × 10 –2 S см –1 при 800°С в плоской и гофрированной геометриях. Гофрированные электролиты YSZ с SL-печатью показали увеличение удельной мощности на 57% (410 мВт см –2 при 900°C) по сравнению с обычной технологией ТОТЭ, что в основном связано с геометрическими аспектами с высоким коэффициентом сжатия.
7D). Этот метод может точно контролировать соотношение керамики и полимера, а также геометрию и размер разнообразных точных микроархитектур, таких как кубические, гироидальные, алмазные и биджелевые структуры. Гироидный LAGP-эпоксидный электролит имел ионную проводимость 1,6·10 –4 S см –1 , что было того же порядка, что и таблетка LAGP, в то время как печатный электролит продемонстрировал до 28% более высокую прочность на сжатие и до пяти раз большую прочность на изгиб. Недавняя работа, о которой сообщили Pesce et al. (2020) разработали самонесущие цельнокерамические электролиты из оксида циркония, стабилизированного 8 мол.% иттрия (YSZ), для твердооксидного топливного элемента (ТОТЭ), напечатанного SL (рис. 7E). Напечатанные плотные и без трещин электролиты 8YSZ достигли ионной проводимости до 3,0 × 10 –2 S см –1 при 800°С в плоской и гофрированной геометриях. Гофрированные электролиты YSZ с SL-печатью показали увеличение удельной мощности на 57% (410 мВт см –2 при 900°C) по сравнению с обычной технологией ТОТЭ, что в основном связано с геометрическими аспектами с высоким коэффициентом сжатия. SL продемонстрировал многочисленные преимущества, такие как высокое разрешение печати (10–100 мкм) и качество поверхности. Кроме того, SL обладает большим потенциалом в подготовке SSE для многоразмерных батарей, особенно батарей микронного размера. Однако доступность фоточувствительных смол или полимеров-предшественников, пригодных для печати SL, ограничена и дорога (около 100 долларов США за кг для светочувствительных смол и дороже для прекурсоров), а для печати полых или выступающих структур требуются ручные опоры.
SL продемонстрировал многочисленные преимущества, такие как высокое разрешение печати (10–100 мкм) и качество поверхности. Кроме того, SL обладает большим потенциалом в подготовке SSE для многоразмерных батарей, особенно батарей микронного размера. Однако доступность фоточувствительных смол или полимеров-предшественников, пригодных для печати SL, ограничена и дорога (около 100 долларов США за кг для светочувствительных смол и дороже для прекурсоров), а для печати полых или выступающих структур требуются ручные опоры.
Цифровая обработка света
Цифровая обработка света (DLP) — это метод SL на основе маски, использующий цифровое микрозеркальное устройство (DMD) для проецирования световой маски, которая служит для затвердевания всего слоя за несколько секунд (Chartrain et al. , 2018). Механизм формирования и исходное сырье DLP аналогичны SL. Схема процесса DLP показана на рисунке 8A. В системе DLP DMD представляет собой массив из нескольких миллионов микроскопически маленьких зеркал на полупроводниковом чипе, и каждое зеркало представляет один или несколько пикселей в проецируемом изображении (Han et al. , 2019).). В этом случае разрешение печати DLP связано с количеством зеркал в DMD. Послойное затвердевание в DLP предлагает многочисленные преимущества по сравнению с процессом точечного сканирования SL: (i) время сборки значительно сокращается, поскольку оно в основном зависит от толщины слоя и времени воздействия, и (ii) остаточное напряжение образцов DLP невелика, так как при затвердевании слоя нет разницы между контуром и внутренней областью. Эти преимущества привлекли значительное внимание при изготовлении плотной керамики в различных областях, включая керамические электролиты для ТОТЭ.
, 2019).). В этом случае разрешение печати DLP связано с количеством зеркал в DMD. Послойное затвердевание в DLP предлагает многочисленные преимущества по сравнению с процессом точечного сканирования SL: (i) время сборки значительно сокращается, поскольку оно в основном зависит от толщины слоя и времени воздействия, и (ii) остаточное напряжение образцов DLP невелика, так как при затвердевании слоя нет разницы между контуром и внутренней областью. Эти преимущества привлекли значительное внимание при изготовлении плотной керамики в различных областях, включая керамические электролиты для ТОТЭ.
Рис. 8. Цифровая обработка света (DLP). (A) Схема процесса DLP. Воспроизведено из Luongo et al. (2020) с разрешения John Wiley & Sons-Books. DLP для полностью плотного электролита из оксида циркония, стабилизированного оксидом иттрия (8YSZ), 8 мол. % в твердооксидном топливном элементе (NiO-8YSZ/8YSZ/La 0,8 Sr 0,2 MnO 3 ): (B) СЭМ-изображения напечатанных ЯСЗ с разными углами; (C) СЭМ-изображения YSZ в форме ряби; (Д) Кривые плотности напряжения и мощности тока полных волнистых ячеек. Воспроизведено из Xing et al. (2020) с разрешения Elsevier Science & Technology Journals.
Воспроизведено из Xing et al. (2020) с разрешения Elsevier Science & Technology Journals.
Самая последняя работа по производству керамического электролита методом DLP была проведена Xing et al. (2020). Для повышения производительности ТОТЭ полностью плотный электролит YSZ с концентрацией 8 мол. % был разработан с волнообразной формой и подготовлен методом DLP с различными углами печати (0°, 15°, 30°, 45°) (рис. 8B, C). Этот печатный специальный электролит может увеличить поверхность раздела электрод-электролит примерно на 36 % и, таким образом, повысить удельную мощность примерно на 32 % при температуре испытания 800 °C и примерно на 37 % при температуре 700 °C по сравнению с эталонной плоской поверхностью. ячейка (рис. 8D). Эта работа продемонстрировала потенциал изготовления SSE с определенным рисунком с помощью DLP для изготовления ТОТЭ с улучшенными и предсказуемыми характеристиками. DLP имеет разрешение печати (10–100 мкм) и качество поверхности, сравнимое с SL, но значительно сокращает время сборки и меньшее остаточное напряжение, что позволяет производить высоконадежные SSE с высокой эффективностью. Тем не менее, дорогостоящие светочувствительные смолы/прекурсоры и ручные подложки по-прежнему являются проблемами, с которыми сталкивается DLP.
Тем не менее, дорогостоящие светочувствительные смолы/прекурсоры и ручные подложки по-прежнему являются проблемами, с которыми сталкивается DLP.
В последние годы было разработано несколько методов 3D-печати на основе литографии, таких как двухфотонная полимеризация (TPP) (Truby and Lewis, 2016), непрерывное производство жидкостного интерфейса (CLIP) (Tumbleston et al., 2015) и проекционная микростереолитография (PµSL) (Park et al., 2012), все они могут обеспечить сопоставимое или более высокое разрешение печати, чем 10–100 мкм (рис. 9). CLIP имеет разрешение печати 50~100 мкм, в то время как детали могут быть вытянуты из полимера за считанные минуты с помощью кислородопроницаемого окна (Tumbleston et al., 2015). PµSL может достигать разрешения печати 2~8,5 мкм, используя трехмерный DMD в градациях серого в качестве динамической маски и систему уменьшающих линз в качестве пространственного модулятора света (Sun et al., 2005). В частности, TPP позволяет создавать элементы размером менее 1 мкм за счет одновременного поглощения двух фотонов ближнего инфракрасного (780 нм) или зеленого (515 нм) лазера (Obata et al. , 2013). Этот метод 3D-печати на основе литографии имеет большой потенциал для изготовления SSE с мелкими деталями от сотен нанометров до микронов.
, 2013). Этот метод 3D-печати на основе литографии имеет большой потенциал для изготовления SSE с мелкими деталями от сотен нанометров до микронов.
Рисунок 9. Сравнение разрешения при печати методом 3D-печати на основе литографии [стереолитография (SL), цифровая обработка света (DLP), непрерывное создание жидкостного интерфейса (CLIP), проекционная микростереолитография (PµSL) и двухфотонная полимеризация ( ТЭС)]. SL воспроизведено из Jansen et al. (2009) с разрешения Американского химического общества. DLP воспроизведено из Lee et al. (2007) с разрешения Американского химического общества. CLIP воспроизведено из Tumbleston et al. (2015) с разрешения Американской ассоциации содействия развитию науки. PµSL воспроизведено из Lee et al. (2008) с разрешения John Wiley & Sons-Books. TPP воспроизведено из Obata et al. (2013) по лицензии Creative Commons.
Заключение и перспективы
В этом обзоре мы сначала обсудили общие процессы и ограничения традиционных методов производства SSE. Затем, посредством всестороннего обзора двух больших групп методов 3D-печати, основанных либо на DW, либо на SL, мы указали на преимущества новых методов 3D-печати по сравнению с традиционными методами производства SSE с точки зрения строительных механизмов, выбора исходного сырья, сборки. конверт, разрешение печати и применение (наноразмерные, гибкие и крупномасштабные аккумуляторные сетки). Мы подчеркнули перспективы и осуществимость производства SSE с использованием 3D-печати на основе литографии для преодоления технических барьеров и улучшения совместимости твердотельных интерфейсов. Наконец, мы обсудили несколько существующих проблем, связанных с процессом 3D-печати, и соответствующие будущие перспективы для более эффективного решения этих проблем, стремясь предоставить рекомендации, которые будут способствовать развитию методов 3D-печати, более тесно ориентированных на производство аккумуляторов. В целом, за эволюцией аккумуляторов устойчивой движущей силой всегда были постоянно совершенствующиеся и совершенствующиеся технологии производства.
Затем, посредством всестороннего обзора двух больших групп методов 3D-печати, основанных либо на DW, либо на SL, мы указали на преимущества новых методов 3D-печати по сравнению с традиционными методами производства SSE с точки зрения строительных механизмов, выбора исходного сырья, сборки. конверт, разрешение печати и применение (наноразмерные, гибкие и крупномасштабные аккумуляторные сетки). Мы подчеркнули перспективы и осуществимость производства SSE с использованием 3D-печати на основе литографии для преодоления технических барьеров и улучшения совместимости твердотельных интерфейсов. Наконец, мы обсудили несколько существующих проблем, связанных с процессом 3D-печати, и соответствующие будущие перспективы для более эффективного решения этих проблем, стремясь предоставить рекомендации, которые будут способствовать развитию методов 3D-печати, более тесно ориентированных на производство аккумуляторов. В целом, за эволюцией аккумуляторов устойчивой движущей силой всегда были постоянно совершенствующиеся и совершенствующиеся технологии производства.
Учитывая преимущества высокого разрешения печати, гибкой подготовки очень сложных структур и широкого выбора исходного сырья, технология 3D-печати продемонстрировала свой большой потенциал для производства SSE различных типов и форм-факторов. Тем не менее, все еще есть несколько проблем, которые необходимо решить следующим образом: (i) проблемы в производстве чувствительных к воздуху/влаге SSE. В большинстве методов 3D-печати используется сырье в виде жидкости или чернил, таких как DIW, IJP и AJP, (ii) ограничения производства с высоким разрешением (вплоть до наномасштаба). Например, nano-LIB для биомедицинских приложений и нанометровые SSE в форме гребня для снижения внутреннего сопротивления, (iii) проблемы производства SSE для приложений в масштабе сетки. Например, ТОТЭ и крупномасштабные аккумуляторные сети для хранения возобновляемой энергии, а также (iv) потенциальные проблемы последующей обработки для ИСЭ. Например, напряжение, трещины, летучесть лития и побочные реакции легко возникают в результате длительных затрат времени (удаление связующего или спекание) (Nyman et al. , 2010; Pfenninger et al., 2019).). Для решения вышеуказанных проблем настоятельно рекомендуется предпринять дальнейшие усилия в следующих аспектах: (i) интегрировать технологию 3D-печати и традиционное производство аккумуляторов для содействия разработке полностью твердотельных аккумуляторов с высокой плотностью энергии, (ii) увеличить разрешение печати вплоть до нанометров с помощью новых нанотехнологий, (iii) разработать принтеры промышленного уровня или платформу конвейерной печати для производства SSE для приложений в масштабе сетки и (iv) объединить некоторые инновационные технологии спекания, совместимые со сложными деталями, напечатанными на 3D-принтере.
, 2010; Pfenninger et al., 2019).). Для решения вышеуказанных проблем настоятельно рекомендуется предпринять дальнейшие усилия в следующих аспектах: (i) интегрировать технологию 3D-печати и традиционное производство аккумуляторов для содействия разработке полностью твердотельных аккумуляторов с высокой плотностью энергии, (ii) увеличить разрешение печати вплоть до нанометров с помощью новых нанотехнологий, (iii) разработать принтеры промышленного уровня или платформу конвейерной печати для производства SSE для приложений в масштабе сетки и (iv) объединить некоторые инновационные технологии спекания, совместимые со сложными деталями, напечатанными на 3D-принтере.
Этот обзор продемонстрировал возможность изготовления SSE с помощью 3D-печати, но требуются дополнительные усилия, чтобы полностью преодолеть разрыв между текущими технологическими возможностями и будущими производственными требованиями. Хотя 3D-печать предлагает беспрецедентную гибкость в настройке структурной размерности и сложности SSE по сравнению с традиционными методами, ее не следует ошибочно принимать за всемогущее решение многих внутренних препятствий в производстве аккумуляторов. Чтобы реализовать больший потенциал применения 3D-печати в производстве аккумуляторов, требуются междисциплинарные совместные усилия. С точки зрения материаловедения необходимы дальнейшие экспериментальные и вычислительные исследования для систематического изучения взаимосвязей SSE состав-структура-свойство. Это должно способствовать выполнению более высоких плотностей тока и лучшей механической/химической стабильности элемента батареи. Углубляясь в механизмы реакции с электрохимической точки зрения, можно исследовать и оптимизировать кинетику переноса ионов на границе раздела электрод/электролит, чтобы повысить эффективность переноса проводящего иона. Благодаря более комплексному дизайну в машиностроении можно было бы интегрировать специальные приспособления для чувствительных к воздуху / влаге образцов в существующие инструментальные установки 3D-печати, чтобы обеспечить более широкий выбор материалов. В целом, технология 3D-печати использует многие преимущества традиционных методов производства на протяжении многих лет.
Чтобы реализовать больший потенциал применения 3D-печати в производстве аккумуляторов, требуются междисциплинарные совместные усилия. С точки зрения материаловедения необходимы дальнейшие экспериментальные и вычислительные исследования для систематического изучения взаимосвязей SSE состав-структура-свойство. Это должно способствовать выполнению более высоких плотностей тока и лучшей механической/химической стабильности элемента батареи. Углубляясь в механизмы реакции с электрохимической точки зрения, можно исследовать и оптимизировать кинетику переноса ионов на границе раздела электрод/электролит, чтобы повысить эффективность переноса проводящего иона. Благодаря более комплексному дизайну в машиностроении можно было бы интегрировать специальные приспособления для чувствительных к воздуху / влаге образцов в существующие инструментальные установки 3D-печати, чтобы обеспечить более широкий выбор материалов. В целом, технология 3D-печати использует многие преимущества традиционных методов производства на протяжении многих лет. Благодаря совместным усилиям междисциплинарных исследований 3D-печать с оптимизмом смотрит на то, что вскоре она полностью реализует свой потенциал в производстве SSE. Мы считаем, что широкое внедрение технологий 3D-печати должно быть сосредоточено не только на производственном процессе, но и на вдохновении таких дисциплин, как химия поверхности, материаловедение и машиностроение. Например, ограниченная доступность и высокая стоимость пригодных для печати светочувствительных смол или полимеров-предшественников (выше 100 долларов за килограмм) для SL заставит нас разработать новые материалы для печати SL с низкой стоимостью и широкой совместимостью материалов. Плохая совместимость интерфейса твердого тела/твердого интерфейса подтолкнет нас к изучению модификации поверхности и структурного дизайна SSE с сильным взаимодействием между частицами и низким импедансом интерфейса. Кроме того, некоторые особые требования (такие как инертная атмосфера и сухая среда) заставят нас разработать специальную технологию 3D-печати для производства аккумуляторов.
Благодаря совместным усилиям междисциплинарных исследований 3D-печать с оптимизмом смотрит на то, что вскоре она полностью реализует свой потенциал в производстве SSE. Мы считаем, что широкое внедрение технологий 3D-печати должно быть сосредоточено не только на производственном процессе, но и на вдохновении таких дисциплин, как химия поверхности, материаловедение и машиностроение. Например, ограниченная доступность и высокая стоимость пригодных для печати светочувствительных смол или полимеров-предшественников (выше 100 долларов за килограмм) для SL заставит нас разработать новые материалы для печати SL с низкой стоимостью и широкой совместимостью материалов. Плохая совместимость интерфейса твердого тела/твердого интерфейса подтолкнет нас к изучению модификации поверхности и структурного дизайна SSE с сильным взаимодействием между частицами и низким импедансом интерфейса. Кроме того, некоторые особые требования (такие как инертная атмосфера и сухая среда) заставят нас разработать специальную технологию 3D-печати для производства аккумуляторов. Таким образом, применение SSE 3D-печати в будущем требует совместной разработки нескольких дисциплин, таких как химия поверхности, материаловедение и машиностроение.
Таким образом, применение SSE 3D-печати в будущем требует совместной разработки нескольких дисциплин, таких как химия поверхности, материаловедение и машиностроение.
Вклад авторов
FS и YS: концепция или дизайн работы и критический пересмотр статьи. AC и CQ: написание статьи. Все авторы внесли свой вклад в статью и одобрили представленную версию.
Финансирование
FS выражает признательность Департаменту энергетики и разработки месторождений полезных ископаемых Университета штата Пенсильвания за поддержку стартового фонда.
Конфликт интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Сокращения
2D, двумерный; AJP, аэрозольная струйная печать; CLIP, непрерывное производство интерфейса жидкости; CSE, композитные твердые электролиты; DIW, прямое письмо тушью; DLP, цифровая обработка света; DMD, цифровое микрозеркальное устройство; DW, прямое письмо; FDM, моделирование наплавленных отложений; GO, оксид графена; IJP, струйная печать; ISE, неорганический твердый электролит; LAGP, Li 1,4 Al 0,4 Ge 1,6 (PO 4 ) 3 ; LFP, LiFePO 4 ; LIB, литий-ионные аккумуляторы; LLZ, Li 7 La 3 Zr 2 O 12 ; LTO, Li 4 Ti 5 O 12 ; P µ SL — проекционная микростереолитография; PLA, полимолочная кислота; СЛ, стереолитография; SOFC, твердооксидный топливный элемент; ТФЭ – твердый полимерный электролит; SSE, твердотельный электролит; ТФП, двухфотонная полимеризация; УФ, ультрафиолет; YSZ, цирконий, стабилизированный оксидом иттрия.
Ссылки
Abetti, PA (1952). Письма Алессандро Вольта. Электр. англ. 71, 773–776. doi: 10.1109/ee.1952.6437680
Полный текст CrossRef | Google Scholar
Амброси А. и Пумера М. (2016). Технологии 3D-печати для электрохимических приложений. Хим. соц. Ред. 45, 2740–2755. doi: 10.1039/c5cs00714c
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Appetecchi, G.B., Alessandrini, F., Carewska, M., Caruso, T., Prosini, P.P., Scaccia, S., et al. (2001). Исследование аккумуляторов с литий-полимерным электролитом. Дж. Источники питания 97, 790–794.
Google Scholar
Беллини, А., и Гючери, С. (2003). Механические характеристики деталей, изготовленных с использованием моделирования наплавления. Быстрый прототип. J. 9, 252–264. doi: 10.1108/13552540310489631
CrossRef Полный текст | Google Scholar
Блейк А. Дж., Колмейер Р. Р., Хардин Дж. О., Кармона Э. А., Маруяма Б. , Берриган Дж. Д. и др. (2017). Керамо-полимерные электролиты для 3D-печати для гибких высокопроизводительных литий-ионных аккумуляторов с повышенной термостойкостью. Доп. Энергия Матер. 7:1602920. doi: 10.1002/aenm.201602920
, Берриган Дж. Д. и др. (2017). Керамо-полимерные электролиты для 3D-печати для гибких высокопроизводительных литий-ионных аккумуляторов с повышенной термостойкостью. Доп. Энергия Матер. 7:1602920. doi: 10.1002/aenm.201602920
Полный текст CrossRef | Google Scholar
Бланга Р., Бурштейн Л., Берман М., Гринбаум С. Г. и Голодницкий Д. (2015). Твердый полимерно-керамический электролит, образованный методом электрофоретического осаждения. Дж. Электрохим. соц. 162, Д3084–Д3089.
Google Scholar
Браам, К. Т., Фолькман, С. К., и Субраманиан, В. (2012). Характеристика и оптимизация печатной первичной серебряно-цинковой батареи. Дж. Источники питания 199, 367–372. doi: 10.1016/j.jpowsour.2011.09.076
CrossRef Полный текст | Google Scholar
Бухманн, И. (2001). Аккумуляторы в портативном мире: Справочник по аккумуляторным батареям для не инженеров . Ричмонд: Cadex Electronics.
Google Scholar
Карли, М. Д., Касо, М. Ф., Аврора, А., Сета, Л. Д., и Просини, П. П. (2019). «Электроспиннинговые нановолокна как сепараторы для литий-ионных аккумуляторов», в: Материалы 15-й Международной конференции по концентраторным фотоэлектрическим системам (CPV-15) Мелвилл, Нью-Йорк.
Д., Касо, М. Ф., Аврора, А., Сета, Л. Д., и Просини, П. П. (2019). «Электроспиннинговые нановолокна как сепараторы для литий-ионных аккумуляторов», в: Материалы 15-й Международной конференции по концентраторным фотоэлектрическим системам (CPV-15) Мелвилл, Нью-Йорк.
Google Scholar
Кавальер С., Субианто С., Савич И., Джонс Д. Дж., Розьер Дж. Дж. Э. и Наука Э. (2011). Электропрядение: разработанные архитектуры для устройств преобразования и хранения энергии. Энергетика Окружающая среда. науч. 4, 4761–4785. doi: 10.1039/c1ee02201f
Полный текст CrossRef | Google Scholar
Чанг П., Мэй Х., Чжоу С., Дассиос К.Г. и Ченг Л. (2019). 3D-печатные электрохимические накопители энергии. Дж. Матер. хим. А 7, 4230–4258. doi: 10.1039/c8ta11860d
Полный текст CrossRef | Google Scholar
Чартрейн, Н. А., Уильямс, К. Б., и Уиттингтон, А. Р. (2018). Обзор изготовления тканевых каркасов с использованием фотополимеризации в ваннах. Акта Биоматер. 74, 90–111. doi: 10.1016/j.actbio.2018.05.010
74, 90–111. doi: 10.1016/j.actbio.2018.05.010
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Чен А.-Н., Ли М., Ву Дж.-М., Ченг Л.-Дж., Лю Р.-З., Ши Ю.-С. и др. др. (2019). Механизм улучшения механических характеристик высокопористой муллитовой керамики с бимодальной структурой пор, полученной методом селективного лазерного спекания. J. Alloys Compd. 776, 486–494. doi: 10.1016/j.jallcom.2018.10.337
Полный текст CrossRef | Google Scholar
Чен А.-Н., Ли М., Сюй Дж., Лу С.-Х., Ву Дж.-М., Ченг Л.-Дж. и др. (2018). Высокопористые муллитовые керамические пены, полученные методом селективного лазерного спекания с использованием полых сфер из летучей золы в качестве сырья. Дж. Евро. Керам. соц. 38, 4553–4559. doi: 10.1016/j.jeurceramsoc.2018.05.031
CrossRef Полный текст | Google Scholar
Чен А.-Н., Ву Дж.-М., Ченг Л.-Дж., Лю С.-Дж., Ма, Ю.-С., Ли Х. и др. др. (2020). Повышенное уплотнение и диэлектрические свойства керамики CaTiO3-0,3NdAlO3, полученной методом прямого коагуляционного литья. Дж. Евро. Керам. соц. 40, 1174–1180. doi: 10.1016/j.jeurceramsoc.2019.12.033
Дж. Евро. Керам. соц. 40, 1174–1180. doi: 10.1016/j.jeurceramsoc.2019.12.033
CrossRef Полный текст | Google Scholar
Чен А.-Н., Ву Дж.-М., Лю К., Чен Дж.-Ю., Сяо Х., Чен П. и др. (2017). Высококачественные керамические детали сложной формы, полученные методом селективного лазерного спекания: обзор. Доп. заявл. Керам. 117, 100–117. doi: 10.1080/17436753.2017.1379586
CrossRef Полный текст | Google Scholar
Чен, К., Ю, Т., Ян, М., Чжао, X. и Шен, X. (2019). Полностью твердотельная перезаряжаемая хлорид-ионная батарея. Доп. науч. 6:1802130. doi: 10.1002/advs.201802130
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Чен К., Сюй Р., Хе З., Чжао К. и Пан Л. (2017). Трехмерная печать гелевого полимерного электролита в литий-ионной микробатарее с использованием стереолитографии. Дж. Электрохим. соц. 164, А1852–А1857.
Google Scholar
Chen, W., Lei, T., Wu, C., Deng, M., Gong, C. , Hu, K., et al. (2018). Разработка безопасных электролитных систем для высокостабильной литий-серной батареи. Доп. Энергия Матер. 8:1702348. doi: 10.1002/aenm.201702348
, Hu, K., et al. (2018). Разработка безопасных электролитных систем для высокостабильной литий-серной батареи. Доп. Энергия Матер. 8:1702348. doi: 10.1002/aenm.201702348
Полный текст CrossRef | Google Scholar
Чен Ю., Чжо С., Ли З. и Ван К. (2020). Окислительно-восстановительные полимеры для перезаряжаемых металлоионных аккумуляторов. EnergyChem 2:100030. doi: 10.1016/j.enchem.2020.100030
Полный текст CrossRef | Google Scholar
Чен З., Ли З., Ли Дж., Лю К., Лао К., Фу Ю. и др. (2019). 3D-печать керамики: обзор. Дж. Евро. Керам. соц. 39, 661–687.
Google Scholar
Ченг М., Дейванаягам Р. и Шахбазян-Яссар Р. (2020). 3D-печать электрохимических накопителей энергии: обзор методов печати и архитектур электродов/электролитов. Тесто. Суперкапс 3, 130–146. doi: 10.1002/batt.201
0CrossRef Full Text | Google Scholar
Ченг М., Цзян Ю., Яо В., Юань Ю., Дейванаягам Р., Форузан Т. и др. (2018). 3D-печать гибридного твердотельного электролита для литий-ионных аккумуляторов при повышенной температуре. Доп. Матер. 30:e1800615.
Доп. Матер. 30:e1800615.
Google Scholar
Чой, Ю. Э., Парк, К. Х., Ким, Д. Х., О, Д. Ю., Квак, Х. Р., Ли, Ю. Г., и др. (2017). Твердые электролиты Li4SnS4 с покрытием, приготовленные из водных растворов для полностью твердотельных литий-ионных аккумуляторов. ChemSusChem 10, 2605–2611. doi: 10.1002/cssc.201700409
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Коммарье, Б., Паолелла, А., Дайгл, Дж.-К., и Загиб, К. (2018). К высокой проводимости лития в твердополимерных и полимерно-керамических батареях. Курс. мнение Электрохим. 9, 56–63. doi: 10.1016/j.coelec.2018.03.033
Полный текст CrossRef | Google Scholar
Куссо Ж.-Ф., Сирет К., Бьенсан П. и Бруссли М. (2006). Последние разработки в области литий-ионных призматических элементов. Дж. Источники питания 162, 790–796. doi: 10.1016/j.jpowsour.2005.02.095
CrossRef Полный текст | Google Scholar
Дейнер Л.Дж., Дженкинс Т. , Хауэлл Т. и Роттмайер М. (2019). Полимерные композиционные электролиты аэрозольной печати для твердотельных литий-ионных аккумуляторов. Доп. англ. Матер. 21:1
, Хауэлл Т. и Роттмайер М. (2019). Полимерные композиционные электролиты аэрозольной печати для твердотельных литий-ионных аккумуляторов. Доп. англ. Матер. 21:1
CrossRef Full Text | Google Scholar
Деланнуа, П. Э., Риу, Б., Лестрие, Б., Гиомар, Д., Брусс, Т., и Ле Бидо, Дж. (2015). На пути к быстрой и экономичной струйной печати с твердым электролитом для литиевых микробатарей. Дж. Источники питания 274, 1085–1090. doi: 10.1016/j.jpowsour.2014.10.164
CrossRef Полный текст | Google Scholar
Дэн З., Цзян Х., Ху Ю., Лю Ю., Чжан Л., Лю Х. и др. (2017). Трехмерная упорядоченная макропористая наноструктура MoS2@ C для гибких литий-ионных аккумуляторов. Доп. Матер. 29:1603020. doi: 10.1002/adma.201603020
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Дерби, Б. (2010). Струйная печать функциональных и конструкционных материалов: требования к свойствам жидкости, стабильность характеристик и разрешение. год. Преподобный Матер. Рез. 40, 395–414. doi: 10.1146/annurev-matsci-070909-104502
год. Преподобный Матер. Рез. 40, 395–414. doi: 10.1146/annurev-matsci-070909-104502
Полный текст CrossRef | Google Scholar
Диуф Б. и Поде Р. (2015). Возможности литий-ионных аккумуляторов в возобновляемой энергетике. Продлить. Энергия 76, 375–380. doi: 10.1016/j.renene.2014.11.058
CrossRef Полный текст | Google Scholar
Дирикан, М., Ян, К., Чжу, П. и Чжан, X. (2019). Композитные твердые электролиты для полностью твердотельных литиевых аккумуляторов. Матер. науч. англ. R Rep. 136, 27–46.
Google Scholar
Доброжан О., Пшеничный Р., Воробьев С., Курбатов Д., Команицкий В. и Опанасюк А. (2020). Влияние термического отжига на морфологические и структурные свойства пленок ZnO, нанесенных на полиимидные подложки методом струйной печати. SN Заяв. науч. 2:365.
Google Scholar
Du, C.-F., Liang, Q., Luo, Y., Zheng, Y., and Yan, Q. (2017). Последние достижения в области вторичных батарей, пригодных для печати. Дж. Матер. хим. А 5, 22442–22458. doi: 10.1039/c7ta07856k
Дж. Матер. хим. А 5, 22442–22458. doi: 10.1039/c7ta07856k
Полный текст CrossRef | Google Scholar
Дадни, Нью-Джерси (2008). Тонкопленочные микробатареи. Электрохим. соц. Интерфейс 17, 44–48.
Google Scholar
Данн Б., Фаррингтон Г. К. и Кац Б. (1994). Золь-гель подходы для твердых электролитов и электродных материалов. Твердотельный ион. 70, 3–10. doi: 10.1016/0167-2738(94)-x
CrossRef Full Text | Google Scholar
Экель, З. К., Чжоу, К., Мартин, Дж. Х., Якобсен, А. Дж., Картер, В. Б., и Шедлер, Т. А. Дж. С. (2016). Аддитивное производство керамики на основе полимеров. Наука 351, 58–62. doi: 10.1126/science.aad2688
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Фергус, Дж. В. (2010). Керамические и полимерные твердые электролиты для литий-ионных аккумуляторов. J. Источники питания 195, 4554–4569. doi: 10.1016/j.jpowsour.2010.01.076
CrossRef Полный текст | Google Scholar
Фрэнкс Г. В., Таллон К., Стударт А. Р., Сессо М. Л. и Лео С. (2017). Коллоидная обработка: создание керамики сложной формы с уникальными многоуровневыми структурами. Дж. Ам. Керам. соц. 100, 458–490. doi: 10.1111/jace.14705
В., Таллон К., Стударт А. Р., Сессо М. Л. и Лео С. (2017). Коллоидная обработка: создание керамики сложной формы с уникальными многоуровневыми структурами. Дж. Ам. Керам. соц. 100, 458–490. doi: 10.1111/jace.14705
Полный текст CrossRef | Академия Google
Fritzler, K.B., and Prinz, V.Y.J.P.U. (2017). Методы 3D-печати микро- и наноструктур. Физ. Успехи. 62, 54–69. doi: 10.3367/ufne.2017.11.038239
CrossRef Полный текст | Google Scholar
Fu, K., Wang, Y., Yan, C., Yao, Y., Chen, Y., Dai, J., et al. (2016). Электродные чернила на основе оксида графена для 3D-печати литий-ионных аккумуляторов. Доп. Матер. 28, 2587–2594. doi: 10.1002/adma.201505391
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Фудзимото Д., Кувата Н., Мацуда Ю., Кавамура Дж. и Канг Ф. (2015). Изготовление твердотельных тонкопленочных батарей с использованием тонких пленок LiMnPO 4 , нанесенных методом импульсного лазерного осаждения. Тонкие твердые пленки 579, 81–88. doi: 10.1016/j.tsf.2015.02.041
Тонкие твердые пленки 579, 81–88. doi: 10.1016/j.tsf.2015.02.041
CrossRef Полный текст | Google Scholar
Фурукава Н., Иноуэ К. и Мураками С. (1984). Щелочная батарея. Патенты Google.
Google Scholar
Гельфонд Н. В., Бобренок О. Ф., Предтеченский М. Р., Морозова Н. Б., Жерикова К. В., Игуменов И. К. (2009). Химическое осаждение из газовой фазы электролитных тонких пленок на основе диоксида циркония, стабилизированного оксидом иттрия. Неорг. Матер. 45, 659–665.
Google Scholar
Гуденаф, Дж. Б., и Сингх, П. (2015). Обзор — твердые электролиты в перезаряжаемых гальванических элементах. Дж. Электрохим. соц. 162, А2387–А2392.
Google Scholar
Greatbatch, W. and Holmes, C.F. (1991). История имплантируемых устройств. IEEE англ. Мед. биол. Маг. 10, 38–41.
Google Scholar
Гросс Б. К., Эркал Дж. Л., Локвуд С. Ю., Чен К. и Спенс Д. М. Дж. А. К. (2014). Оценка 3D-печати и ее потенциального влияния на биотехнологии и химические науки. 86, 3240–3253. doi: 10.1021/ac403397r
86, 3240–3253. doi: 10.1021/ac403397r
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Хафнер С., Гатри Х., Ли С.-Х. и Бан К. (2019). Синхронизированный метод электропрядения и электрораспыления для производства полностью твердотельных литий-ионных аккумуляторов. Дж. Источники питания 431, 17–24. doi: 10.1016/j.jpowsour.2019.05.008
Полный текст CrossRef | Google Scholar
Хан Т., Кунду С., Наг А. и Сюй Ю. (2019). 3D-печатные датчики для биомедицинских приложений: обзор. Датчики 19:1706. doi: 10.3390/s1
06
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Хаяши А., Отомо Т., Мизуно Ф., Таданага К. и Тацумисаго М. (2003). Полностью твердотельные Li/S аккумуляторы с высокопроводящими стеклокерамическими электролитами. Электрохим. коммун. 5, 701–705. doi: 10.1016/s1388-2481(03)00167-x
CrossRef Full Text | Google Scholar
Хаяши А., Ямасита Х., Тацумисаго М. и Минами Т. (2002). Характеристика аморфных твердых электролитов Li2S–SiS2–LixMOy (M = Si, P, Ge), полученных закалкой расплава и механическим измельчением. Твердотельный ион. 148, 381–389. doi: 10.1016/s0167-2738(02)00077-2
и Минами Т. (2002). Характеристика аморфных твердых электролитов Li2S–SiS2–LixMOy (M = Si, P, Ge), полученных закалкой расплава и механическим измельчением. Твердотельный ион. 148, 381–389. doi: 10.1016/s0167-2738(02)00077-2
Полный текст CrossRef | Google Scholar
Хе, П., Чен, К., Ян, М., Сюй, X., Чжоу, Л., Май, Л., и др. (2019). Создание более совершенных цинк-ионных аккумуляторов: материальная перспектива. EnergyChem 1:100022. doi: 10.1016/j.enchem.2019.100022
Полный текст CrossRef | Google Scholar
Хенч, Л.Л., и Уэст, Дж.К. (1990). Золь-гель процесс. Хим. Ред. 90, 33–72.
Google Scholar
Хитц, Г. Т., Макоуэн, Д. В., Чжан, Л., Ма, З., Фу, З., Вен, Ю., и др. (2019). Высокоскоростное циклирование лития в масштабируемой трехслойной архитектуре литий-гранат-электролит. Матер. Сегодня 22, 50–57. doi: 10.1016/j.mattod.2018.04.004
Полный текст CrossRef | Google Scholar
Хо, К.С., Эванс, Дж. В., и Райт, П.К. (2010). Диспенсерная печать цинковой микробатареи с ионным жидким гелевым электролитом. Дж. Микромех. Микроангл. 20:104009. doi: 10.1088/0960-1317/20/10/104009
В., и Райт, П.К. (2010). Диспенсерная печать цинковой микробатареи с ионным жидким гелевым электролитом. Дж. Микромех. Микроангл. 20:104009. doi: 10.1088/0960-1317/20/10/104009
Полный текст CrossRef | Google Scholar
Хоуи Дж. М., Лутфурахманов А., Шульц Д. Л. и Ахатов И. С. (2012). Обзор прямой записи на основе аэрозолей и ее приложений для микроэлектроники. Ж. Нанотехнолог. 2012, 1–22. doi: 10.1155/2012/324380
Полный текст CrossRef | Google Scholar
Jansen, J., Melchels, F. P. W., Grijpma, D. W. and Feijen, J. J. B. (2009). Поли(D,L-лактид)/N-винил-2-пирролидон смолы, функционализированные моноэтиловым эфиром фумаровой кислоты, для изготовления матриксов для тканевой инженерии методом стереолитографии. Биомакромолекулы 10, 214–220. doi: 10.1021/bm801001r
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Цзян З., Ван С., Чен С., Ян В., Яо С., Ху С. и др. (2020). Ленточное литье керамических электролитных пленок Li0,34La0,56TiO3 обеспечивает высокую плотность энергии литий-металлических аккумуляторов. Доп. Матер. 32:1
Доп. Матер. 32:1
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Йоханнессен Э. А., Ван Л., Вайс К., Камминг Д. Р. и Купер Дж. М. (2006). Биосовместимость датчика «лаборатория на таблетке» в искусственных средах желудочно-кишечного тракта. IEEE Trans. Биомед. англ. 53, 2333–2340. doi: 10.1109/tbme.2006.883698
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Judez, X., Zhang, H., Li, C., Eshetu, G.G., Gonzalez-Marcos, J.A., Armand, M., et al. (2017). Обзор — твердые электролиты для безопасных литий-серных аккумуляторов с высокой плотностью энергии: перспективы и проблемы. Дж. Электрохим. соц. 165, А6008–А6016.
Google Scholar
Jung, G.B., Huang, T., Huang, MH, and Chang, C.L.J.J.O.M.S. (2001). Получение оксида церия, легированного самарием, для электролита твердооксидного топливного элемента модифицированным золь-гель методом. Дж. Матер. науч. 36, 5839–5844.
Дж. Матер. науч. 36, 5839–5844.
Google Scholar
Ким Дж. Г., Сон Б., Мукерджи С., Шупперт Н., Бейтс А., Квон О. и др. (2015). Обзор твердотельных аккумуляторов на литиевой и нелитиевой основе. Дж. Источники питания 282, 299–322.
Google Scholar
Ким С. Х., Чой К. Х., Чо С. Дж., Чой С., Парк С. и Ли С. Ю. (2015). Готовые к печати твердотельные литий-ионные аккумуляторы: новый путь к источникам питания с изменяемой формой и эстетической универсальностью для гибкой электроники. Нано Летт. 15, 5168–5177. doi: 10.1021/acs.nanolett.5b01394
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Клиппштейн Х., Диас Де Серио Санчес А., Хассанин Х., Цвейри Ю. и Сеневиратне Л. (2018). Моделирование наплавленного осаждения для беспилотных летательных аппаратов (БПЛА): обзор. Доп. англ. Матер. 20:1700552. doi: 10.1002/adem.201700552
Полный текст CrossRef | Google Scholar
Котобуки М., Коиси М. и Като Ю. (2013). Получение твердого электролита Li1.5Al0.5Ti1.5(PO4)3 методом соосаждения. Ионика 19, 1945–1948. doi: 10.1007/s11581-013-1000-4
и Като Ю. (2013). Получение твердого электролита Li1.5Al0.5Ti1.5(PO4)3 методом соосаждения. Ионика 19, 1945–1948. doi: 10.1007/s11581-013-1000-4
Полный текст CrossRef | Google Scholar
Курцвейл, П. (2010). Гастон Планте и его изобретение свинцово-кислотной батареи — происхождение первой практичной перезаряжаемой батареи. J. Источники питания 195, 4424–4434. doi: 10.1016/j.jpowsour.2009.12.126
CrossRef Полный текст | Google Scholar
Лау Дж., Деблок Р. Х., Баттс Д. М., Эшби Д. С., Чой К. С. и Данн Б. С. (2018). Сульфидные твердые электролиты для литиевых батарей. Доп. Энергия Матер. 8:1800933. doi: 10.1002/aenm.201800933
Полный текст CrossRef | Google Scholar
Ли, Дж. В., Лан, П. X., Ким, Б., Лим, Г., и Чо, Д. В. (2008). Изготовление и анализ характеристик каркаса из поли(пропиленфумарата) с использованием технологии микростереолитографии. Дж. Биомед. Матер. Рез. Б заявл. Биоматер. 87, 1–9. doi: 10.1002/jbm. b.31057
b.31057
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Lee, K.W., Wang, S., Fox, B.C., Ritman, E.L., Yaszemski, M.J., and Lu, L.J.B. (2007). Изготовление каркаса для инженерии костной ткани из поли(пропиленфумарата) с использованием стереолитографии: влияние составов смол и параметров лазера. Биомакромолекулы 8, 1077–1084. doi: 10.1021/bm060834v
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Лейонмарк С., Корнелл А., Линдберг Г. и Вогберг Л. (2013). Гибкие литий-ионные аккумуляторные элементы из одной бумаги в процессе производства бумаги на основе нанофибриллированной целлюлозы. Дж. Матер. хим. А 1, 4671–4677. doi: 10.1039/c3ta01532g
Полный текст CrossRef | Google Scholar
Летиен К., Зегауи М., Руссель П., Тилмант П., Роллан Н. и Роллан П. А. (2011). Микроструктура материала LiPON и литий-железо-фосфата, нанесенного на массив кремниевых наностолбиков для литий-ионной твердотельной трехмерной микробатареи. Микроэлектрон. англ. 88, 3172–3177. doi: 10.1016/j.mee.2011.06.022
Микроэлектрон. англ. 88, 3172–3177. doi: 10.1016/j.mee.2011.06.022
Полный текст CrossRef | Google Scholar
Льюис, Дж. А. (2004). Коллоидная обработка керамики. Дж. Ам. Керам. соц. 83, 2341–2359.
Google Scholar
Li, B., Gu, P., Feng, Y., Zhang, G., Huang, K., Xue, H., et al. (2017). Ультратонкие двумерные нанолисты из фосфата никеля и кобальта для электрохимического накопления энергии в водном/твердотельном электролите. Доп. Функц. Матер. 27:1605784. doi: 10.1002/adfm.201605784
Полный текст CrossRef | Google Scholar
Li, C., Liu, Y., Li, B., Zhang, F., Cheng, Z., He, P., et al. (2019). Интегрированный твердый электролит с пористым катодом путем легкого одноэтапного спекания для полностью твердотельной батареи Li-O2. Нанотехнологии 30:364003. doi: 10.1088/1361-6528/ab226f
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Li, M., Chen, A.-N., Lin, X., Wu, J.-M., Chen, S. , Cheng, L.-J., et al. (2019). Легкая муллитовая керамика с контролируемой пористостью и улучшенными свойствами, полученная методом SLS с использованием механически смешанных композитов FAHS/полиамид12. Керам. Междунар. 45, 20803–20809. doi: 10.1016/j.ceramint.2019.07.067
, Cheng, L.-J., et al. (2019). Легкая муллитовая керамика с контролируемой пористостью и улучшенными свойствами, полученная методом SLS с использованием механически смешанных композитов FAHS/полиамид12. Керам. Междунар. 45, 20803–20809. doi: 10.1016/j.ceramint.2019.07.067
CrossRef Полный текст | Google Scholar
Li, S., Zhang, S.Q., Shen, L., Liu, Q., Ma, J.B., Lv, W., et al. (2020). Развитие и перспективы керамических/полимерных композиционных твердых электролитов для литиевых аккумуляторов. Доп. науч. 7:1
Google Scholar
Ли В., Чен Л., Сунь Ю., Ван К., Ван Ю. и Ся Ю. (2017). Полностью твердотельная вторичная литиевая батарея с твердым полимерным электролитом и антрахиноновым катодом. Твердотельный ион. 300, 114–119. doi: 10.1016/j.ssi.2016.12.013
Полный текст CrossRef | Google Scholar
Li X., Zhang Z., Yin K., Yang L., Tachibana K. и Hirano S.-I. (2015). Квазитвердые электролиты мезопористый кремнезем/ионная жидкость и их применение в литий-металлических батареях. Дж. Источники питания 278, 128–132. doi: 10.1016/j.jpowsour.2014.12.053
Дж. Источники питания 278, 128–132. doi: 10.1016/j.jpowsour.2014.12.053
CrossRef Полный текст | Google Scholar
Li, Y., Ding, F., Xu, Z., Sang, L., Ren, L., Ni, W., et al. (2018). Твердотельный литий-ионный аккумулятор, работающий при температуре окружающей среды, на основе твердого полимерного электролита с высокой концентрацией солей. J. Источники питания 397, 95–101. doi: 10.1016/j.jpowsour.2018.05.050
CrossRef Полный текст | Google Scholar
Лян С., Ян В., Ву X., Чжан Ю., Чжу Ю., Ван Х. и др. (2018). Гелевые полимерные электролиты для литий-ионных аккумуляторов: изготовление, характеристики и характеристики. Твердотельный ион. 318, 2–18. doi: 10.1016/j.ssi.2017.12.023
Полный текст CrossRef | Google Scholar
Lim, H.-D., Lim, H.-K., Xing, X., Lee, B.-S., Liu, H., Coaty, C., et al. (2018). Слои твердого электролита методом осаждения из раствора. Доп. Матер. Интерфейсы 5:1701328. doi: 10.1002/admi.201701328
Полный текст CrossRef | Google Scholar
Лю В. , Ли С. В., Лин Д., Ши Ф., Ван С., Сендек А. Д. и др. (2017). Повышение ионной проводимости в композитных полимерных электролитах с хорошо ориентированными керамическими нанопроволоками. Нац. Энергия 2:17035.
, Ли С. В., Лин Д., Ши Ф., Ван С., Сендек А. Д. и др. (2017). Повышение ионной проводимости в композитных полимерных электролитах с хорошо ориентированными керамическими нанопроволоками. Нац. Энергия 2:17035.
Google Scholar
Лю, X., Ли, X., Ли, Х., и Ву, Х. Б. (2018). Недавний прогресс гибридных твердотельных электролитов для литиевых батарей. Химия 24, 18293–18306. doi: 10.1002/chem.201803616
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Луонго А., Фальстер В., Дост М. Е. Б., Рибо М. М., Эйрикссон Э. Р., Педерсен Д. Б. и др. (2020). Контроль микроструктуры в 3D-печати с цифровой обработкой света. 39, 347–359.
Google Scholar
Ma, F., Zhao, E., Zhu, S., Yan, W., Sun, D., Jin, Y., et al. (2016). Приготовление и оценка твердого электролита Li1.3Al0.3Ti1.7(PO4)3 с высокой литий-ионной проводимостью, полученного новым растворным методом. Твердотельный ион. 295, 7–12. doi: 10.1016/j.ssi.2016.07. 010
010
Полный текст CrossRef | Google Scholar
Ма, Т., и Девин Маккензи, Дж. (2019). Полностью печатные гибкие воздушно-цинковые батареи с высокой плотностью энергии на основе твердых полимерных электролитов и иерархического каталитического токосъемника. Гибкий. Распечатать. Электрон. 4:015010. doi: 10.1088/2058-8585/ab0b91
Полный текст CrossRef | Google Scholar
Махаджан А., Фрисби К. Д. и Фрэнсис Л. Ф. (2013). Оптимизация аэрозольной струйной печати для серебряных линий с высоким разрешением и высоким соотношением сторон. Приложение ACS Матер. Интерфейсы 5, 4856–4864. doi: 10.1021/am400606y
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Манапат Дж. З., Чен К., Йе П. и Адвинкула Р. К. (2017). 3D-печать полимерных нанокомпозитов методом стереолитографии. Макромоль. Матер. англ. 302:1600553. doi: 10.1002/mame.201600553
Полный текст CrossRef | Google Scholar
Мантирам А., Ю Х. и Ван С. (2017). Химический состав литиевых батарей благодаря твердотельным электролитам. Нац. Преподобный Матер. 2:16103.
и Ван С. (2017). Химический состав литиевых батарей благодаря твердотельным электролитам. Нац. Преподобный Матер. 2:16103.
Google Scholar
Мао, М., Хе, Дж., Ли, X., Чжан, Б., Лей, К., Лю, Ю., и др. (2017). Новые границы и области применения 3D-печати с высоким разрешением. Микромашины 8:113. дои: 10.3390/mi8040113
CrossRef Полный текст | Google Scholar
Макоуэн Д. В., Сюй С., Гонг Ю., Вен Ю., Годби Г. Л., Гриттон Дж. Э. и др. (2018). Электролиты для 3D-печати твердотельных аккумуляторов. Доп. Матер. 30:1707132.
Google Scholar
Минами Т., Хаяши А. и Тацумисаго М. (2006). Недавний прогресс стекла и стеклокерамики в качестве твердых электролитов для литиевых вторичных батарей. Твердотельный ион. 177, 2715–2720. doi: 10.1016/j.ssi.2006.07.017
Полный текст перекрестной ссылки | Google Scholar
Моримото Х., Ямасита Х., Тацумисаго М. и Минами Т. (1999). Механохимический синтез новых аморфных материалов 60Li2S⋅ 40SiS2 с высокой ионно-литиевой проводимостью. Дж. Ам. Керам. соц. 82, 1352–1354. doi: 10.1111/j.1151-2916.1999.tb01923.x
Дж. Ам. Керам. соц. 82, 1352–1354. doi: 10.1111/j.1151-2916.1999.tb01923.x
Полный текст CrossRef | Google Scholar
Нафиси С., Джалили Р., Абуталеби С. Х., Горкин И. Р. А., Константинов К., Иннис П. К. и др. (2014). Дисперсии оксида графена: настройка реологии для производства. Матер. Гориз. 1, 326–331. doi: 10.1039/c3mh00144j
CrossRef Полный текст | Google Scholar
Нго, Т. Д., Кашани, А., Имбальцано, Г., Нгуен, К. Т. К., и Хуи, Д. (2018). Аддитивное производство (3D-печать): обзор материалов, методов, приложений и проблем. Композ. Б инж. 143, 172–196. doi: 10.1016/j.compositesb.2018.02.012
CrossRef Полный текст | Google Scholar
Нгуен Х., Банерджи А., Ван Х., Тан Д., Ву Э. А., Дукс Дж. и др. (2019). Одностадийный синтез высокопроводящего твердого электролита Na3PS4 для полностью натриевых твердотельных аккумуляторов. J. Источники питания 435, 126623–126623. doi: 10.1016/j.jpowsour.2019.05.031
CrossRef Полный текст | Google Scholar
Найман М. , Алам Т. М., Макинтайр С. К., Блейер Г. К. и Ингерсолл Д. (2010). Альтернативный подход к увеличению подвижности Li в электролитах Li-La-Nb/Ta-гранат. Хим. Матер. 22, 5401–5410. doi: 10.1021/cm101438x
, Алам Т. М., Макинтайр С. К., Блейер Г. К. и Ингерсолл Д. (2010). Альтернативный подход к увеличению подвижности Li в электролитах Li-La-Nb/Ta-гранат. Хим. Матер. 22, 5401–5410. doi: 10.1021/cm101438x
CrossRef Full Text | Академия Google
Обата К., Эль-Тамер А., Кох Л., Хинзе У. и Чичков Б. Н. (2013). Трехмерное двухфотонное полимеризационное структурирование высокого качества с расширенным рабочим диапазоном объектива (WOW-2PP). Легкие науки. заявл. 2:e116. doi: 10.1038/lsa.2013.72
Полный текст CrossRef | Google Scholar
Панг Ю., Цао Ю., Чу Ю., Лю М., Снайдер К., Маккензи Д. и др. (2019). Аддитивное производство аккумуляторов. Доп. Функц. Матер. 30:1
Google Scholar
Пак С.-Х., Пак М., Ю С.-И. и Джу С.-К. (2006). Твердый полимерный электролит с центрифужным покрытием для полностью твердотельных перезаряжаемых тонкопленочных литий-полимерных аккумуляторов. J. Источники питания 158, 1442–1446. doi: 10. 1016/j.jpowsour.2005.10.022
1016/j.jpowsour.2005.10.022
CrossRef Полный текст | Google Scholar
Парк, И.-Б., Ха, Ю.-М., Ким, М.-С., Ким, Х.-К., и Ли, С.-Х. (2012). Трехмерная шкала серого для улучшения качества поверхности в проекционной микростереолитографии. Междунар. Дж. Точность. англ. Производство. 13, 291–298. doi: 10.1007/s12541-012-0036-0
Полный текст CrossRef | Google Scholar
А. Пеше, А. Хорнес, М. Нуньес, А. Мората, М. Торрелл и А. Таранкон (2020). 3D-печать следующего поколения усовершенствованных твердооксидных топливных и электролизных элементов. Дж. Матер. хим. A. doi: 10.1039/d0ta02803g
CrossRef Full Text | Google Scholar
Пфеннингер Р., Струзик М., Гарбайо И., Стилп Э. и Рупп Дж. Л. М. (2019). Низкая температура обработки для быстрой проводимости лития в пленках твердотельных батарей на основе граната. Нац. Энергия 4, 475–483. doi: 10.1038/s41560-019-0384-4
CrossRef Полный текст | Google Scholar
Фук Н.Х. Х., Тотани М., Морикава К., Муто Х. и Мацуда А. (2016). Приготовление твердого электролита Li3PS4 с использованием этилацетата в качестве синтетической среды. Твердотельный ион. 288, 240–243. doi: 10.1016/j.ssi.2015.11.032
Х., Тотани М., Морикава К., Муто Х. и Мацуда А. (2016). Приготовление твердого электролита Li3PS4 с использованием этилацетата в качестве синтетической среды. Твердотельный ион. 288, 240–243. doi: 10.1016/j.ssi.2015.11.032
Полный текст CrossRef | Google Scholar
Прадель А., Панье Т. и Рибес М. (1985). Влияние быстрой закалки на электрические свойства литиевых проводящих стекол. Твердотельный ион. 17, 147–154. doi: 10.1016/0167-2738(85)-5 Полный текст CrossRef | Google Scholar Рейес К., Шомоджи Р., Ниу С., Круз М. А., Ян Ф., Катеначчи М. Дж. и др. (2018). Трехмерная печать полной литий-ионной батареи с изготовлением плавленых нитей. Приложение ACS Энергия Матер. 1, 5268–5279. Google Scholar Руетчи П., Мели Ф. и Десильвестро Дж. (1995). Никель-металлогидридные аккумуляторы. Предпочтительные батареи будущего? Дж. Источники питания 57, 85–91. doi: 10.1016/0378-7753(95)02248-1 Полный текст CrossRef | Google Scholar Рузметов Д. PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar Сантоликвидо О., Коломбо П. и Ортона А. (2019 г.). Аддитивное производство керамических компонентов с помощью цифровой световой обработки: сравнение подходов «снизу вверх» и «сверху вниз». Дж. Евро. Керам. соц. 39, 2140–2148. doi: 10.1016/j.jeurceramsoc.2019.01.044 CrossRef Полный текст | Google Scholar Скьяво, Л. С. А., Мантас, П. К., Сегадайнс, А. М., и Круз, Р. К. Д. (2018). От сухого прессования к пластическому формованию керамики: оценка окна обрабатываемости. Констр. Строить. Матер. 189, 594–600. doi: 10.1016/j.conbuildmat.2018.09.015 CrossRef Полный текст | Google Scholar Schnell, J., Günther, T., Knoche, T. CrossRef Полный текст | Google Scholar Шан Ю., Ли Ю. и Панг Х. (2020). Применение материалов на основе сульфида олова в литий-ионных батареях и натрий-ионных батареях. Доп. Функц. Матер. 30:2001298. doi: 10.1002/adfm.202001298 Полный текст CrossRef | Google Scholar Смит, А. Дж., Бернс, Дж. К., Трасслер, С., и Дан, Дж. Р. (2010). Прецизионные измерения кулоновской эффективности литий-ионных аккумуляторов и материалов электродов для литий-ионных аккумуляторов. Дж. Электрохим. соц. 157: А196. Google Scholar Strauss, F., Teo, J.H., Schiele, A., Bartsch, T., Hatsukade, T., Hartmann, P., et al. (2020). Выделение газа в литий-ионных батареях: твердый электролит против жидкого. Приложение ACS Матер. Google Scholar Сун, К., Фанг, Н., Ву, Д. М., и Чжан, X. (2005). Проекционная микростереолитография с использованием цифровой микрозеркальной динамической маски. Сенсорные приводы A Физ. 121, 113–120. doi: 10.1016/j.sna.2004.12.011 CrossRef Полный текст | Google Scholar Сунь Дж., Ли Ю., Чжан К., Хоу К., Ши К. и Ван Х. (2019). Композитный электролит из полиметилметакрилата с высокой ионной проводимостью с нанопроволоками Li6,75La3Zr1,75Nb0,25O12 типа граната. Хим. англ. Дж. 375:121922. doi: 10.1016/j.cej.2019.121922 Полный текст CrossRef | Google Scholar Sun, Y., Shi, P., Chen, J., Wu, Q., Liang, X., Rui, X., et al. (2020). Разработка и вызов передовых неводных натрий-ионных аккумуляторов. EnergyChem 2:100031. doi: 10.1016/j.enchem.2020.100031 Полный текст CrossRef | Google Scholar Сувачи, Э., и Мессинг, Г.Л. (2001). Текстурированная алюмооксидная керамика методом одноосного прессования. CrossRef Full Text | Google Scholar Такада, К. (2013). Прогресс и перспективы твердотельных литиевых аккумуляторов. Acta Mater. 61, 759–770. doi: 10.1016/j.actamat.2012.10.034 CrossRef Полный текст | Google Scholar Tallon, C., and Franks, GV (2011). Последние тенденции формообразования в результате коллоидной обработки: обзор. 119, 147–160. doi: 10.2109/jcersj2.119.147 Полнотекстовая перекрестная ссылка | Google Scholar Tan, SJ, Zeng, XX, Ma, Q., Wu, XW, and Guo, YG (2018). Последние достижения в области композитных электролитов на полимерной основе для перезаряжаемых литиевых батарей. Электрохим. Energy Rev. 1, 113–138. doi: 10.1007/s41918-018-0011-2 CrossRef Полный текст | Google Scholar Танака С., Пин К.С. и Уэмацу К. (2006). Влияние сегрегации органического связующего на прочность после спекания оксида алюминия сухого прессования. Полный текст CrossRef | Google Scholar Тацумисаго, М., и Хаяши, А. (2012). Суперионные стекла и стеклокерамика в системе Li2S–P2S5 для полностью твердотельных литиевых аккумуляторных батарей. Твердотельный ион. 225, 342–345. doi: 10.1016/j.ssi.2012.03.013 Полный текст CrossRef | Google Scholar Терагава С., Асо К., Таданага К., Хаяши А. и Тацумисаго М. (2014). Приготовление твердого электролита Li2S–P2S5 из раствора N-метилформамида и применение для полностью твердотельных литиевых аккумуляторов. Дж. Источники питания 248, 939–942. doi: 10.1016/j.jpowsour.2013.09.117 CrossRef Полный текст | Google Scholar Треви Дж., Джанг Дж. С., Юнг Ю. С., Столдт Ч. Р. и Ли С. Х. (2009). Стеклокерамические электролиты Li2S–P2S5, приготовленные методом одноэтапной шаровой набивки, и их применение для полностью твердотельных литий-ионных аккумуляторов. Полный текст CrossRef | Академия Google Труби Р.Л. и Льюис Дж.А. (2016). Печать мягкой материи в трех измерениях. Природа 540, 371–378. doi: 10.1038/nature21003 PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar Тамблстон Дж. Р., Ширванянц Д., Ермошкин Н., Янушевич Р., Джонсон А. Р., Келли Д. и др. (2015). Непрерывное создание жидкостного интерфейса трехмерных объектов. Наука 347, 1349–1352. doi: 10.1126/science.aaa2397 PubMed Abstract | Полный текст перекрестной ссылки | Академия Google Варшнея А.К. и Мауро Дж.К. (2019). Основы неорганических стекол . Амстердам: Эльзевир. Google Scholar Венкатасубраманиан Н., Уэйд Б., Десаи П., Абхираман А. и Гелбаум Л. (1991). Синтез и характеристика полиборатов, полученных из золь-геля, пригодных для прядения. J. Без кристаллов. Твердые вещества 130, 144–156. CrossRef Full Text | Google Scholar Wan, J., Xie, J., Kong, X., Liu, Z., Liu, K., Shi, F., et al. (2019). Ультратонкий, гибкий, твердый полимерный композитный электролит с выровненной нанопористой основой для литиевых батарей. Нац. нанотехнологии. 14, 705–711. doi: 10.1038/s41565-019-0465-3 PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar Ван Л., Йе Ю., Чен Н., Хуанг Ю., Ли Л., Ву Ф. и др. (2018). Разработка и проблемы функциональных электролитов для высокоэффективных литий-серных аккумуляторов. Доп. Функц. Матер. 28:1800919. DOI: 10.1002/adfm.201800919 Полнотекстовая перекрестная ссылка | Google Scholar Wang, X.J., Zhang, H.P., Kang, J.J., Wu, Y.P., and Fang, S.B. (2005). Новые композиционные полимерные электролиты на основе поли(эфируретанового) сетчатого полимера и пирогенных кремнеземов. J. Твердотельная электрохимия. Полный текст CrossRef | Google Scholar Warner, JT (2015). Справочник по проектированию литий-ионных аккумуляторов: химия, компоненты, типы и терминология . Амстердам: Эльзевир. Google Scholar Вей Т.С., Ан Б.Ю., Гротто Дж. и Льюис Дж.А. (2018). 3D-печать индивидуальных литий-ионных аккумуляторов с толстыми электродами. Доп. Матер. 30:1703027. doi: 10.1002/adma.201703027 PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar Вуттиканокхан Дж., Фириявирут М. и Понгчумпон О. Дж. (2015). Влияние параметров электроформования и содержания нанонаполнителя на морфологию и свойства гелеобразного электролита композиционных нановолокон на основе ПВДФ-ГФП, наполненного La2O3. Междунар. Дж. Полим. Матер. Полим. Биоматер. 64, 416–426. doi: 10.1080/00 0 CrossRef Full Text | Google Scholar Се Дж., Иманиши Н., Чжан Т., Хирано А., Такеда Ю. CrossRef Полный текст | Google Scholar Xing, B., Yao, Y., Meng, X., Zhao, W., Shen, M., Gao, S., et al. (2020). Самонесущий стабилизированный оксидом иттрия электролит в форме ряби циркония для применения в твердооксидных топливных элементах с помощью цифровой световой обработки трехмерной печати. Скр. Матер. 181, 62–65. doi: 10.1016/j.scriptamat.2020.02.004 Полный текст CrossRef | Google Scholar Yang, Y., Chen, Z., Song, X., Zhu, B., Hsiai, T., Wu, P.-I., et al. (2016). Трехмерная печать конденсатора с высокой диэлектрической проницаемостью методом проекционной стереолитографии. Nano Energy 22, 414–421. doi: 10.1016/j.nanoen.2016.02.045 CrossRef Full Text | Google Scholar Yang, Y., Yuan, W. Google Scholar Yin, Y.C., Wang, Q., Yang, J.T., Li, F., Zhang, G., Jiang, C.H., et al. (2020). Поверхностный слой на основе тонкой пленки перовскита хлорида металла для защиты металлического лития от жидкого электролита. Нац. коммун. 11:1761. Google Scholar Йошио М., Бродд Р. Дж. и Кодзава А. (2009). Литий-ионные батареи . Нью-Йорк, штат Нью-Йорк: Спрингер. Google Scholar Юань М. и Лю К. (2020). Рациональный дизайн сепараторов и жидких электролитов для более безопасных литий-ионных аккумуляторов. J. Energy Chem. 43, 58–70. doi: 10.1016/j.jechem.2019.08.008 Полный текст CrossRef | Google Scholar Юэ Л., Ма Дж., Чжан Дж., Чжао Дж., Донг С., Лю З. и др. (2016). Все твердотельные полимерные электролиты для высокопроизводительных литий-ионных аккумуляторов. Google Scholar Зеколл С., Марринер-Эдвардс К., Хексельман А. К. О., Касемчайнан Дж., Кусс К., Армстронг Д. Е. Дж. и др. (2018). Гибридные электролиты с трехмерными бинепрерывными упорядоченными керамическими и полимерными микроканалами для полностью твердотельных аккумуляторов. Энергетика Окружающая среда. науч. 11, 185–201. doi: 10.1039/c7ee02723k Полный текст CrossRef | Google Scholar Чжан Х., Ли К., Пищ М., Койя Э., Рохо Т., Родригес-Мартинес Л. М. и др. (2017). Одиночные литий-ионные проводящие твердые полимерные электролиты: достижения и перспективы. Хим. соц. Ред. 46, 797–815. Google Scholar Чжан К., Цао Д., Ма Ю., Натан А., Аврора П. и Чжу Х. (2019). Твердотельные электролиты на основе сульфидов: синтез, стабильность и потенциал для полностью твердотельных аккумуляторов. Доп. Матер. 31:e11. Google Scholar Чжан С.С. (2007). Обзор сепараторов литий-ионных аккумуляторов с жидким электролитом. , Олешко В. П., Хейни П. М., Лезек Х. Дж., Карки К., Белох К. Х. и др. (2012). Стабильность электролита определяет пределы масштабирования для твердотельных литий-ионных аккумуляторов 3D. Нано Летт. 12, 505–511. doi: 10.1021/nl204047z
, Олешко В. П., Хейни П. М., Лезек Х. Дж., Карки К., Белох К. Х. и др. (2012). Стабильность электролита определяет пределы масштабирования для твердотельных литий-ионных аккумуляторов 3D. Нано Летт. 12, 505–511. doi: 10.1021/nl204047z , Vieider, C., Köhler, L., Just, A., et al. (2018). Полностью твердотельные литий-ионные и литий-металлические батареи — путь к крупносерийному производству. Дж. Источники питания 382, 160–175. doi: 10.1016/j.jpowsour.2018.02.062
, Vieider, C., Köhler, L., Just, A., et al. (2018). Полностью твердотельные литий-ионные и литий-металлические батареи — путь к крупносерийному производству. Дж. Источники питания 382, 160–175. doi: 10.1016/j.jpowsour.2018.02.062 Интерфейсы 12, 20462–20468.
Интерфейсы 12, 20462–20468. Ключ инж. Матер. 206–213, 405–408. doi: 10.4028/www.scientific.net/kem.206-213.405
Ключ инж. Матер. 206–213, 405–408. doi: 10.4028/www.scientific.net/kem.206-213.405 Дж. Ам. Керам. соц. 89, 1903–1907 гг. doi: 10.1111/j.1551-2916.2006.01057.x
Дж. Ам. Керам. соц. 89, 1903–1907 гг. doi: 10.1111/j.1551-2916.2006.01057.x Электрохим. коммун. 11, 1830–1833 гг. doi: 10.1016/j.elecom.2009.07.028
Электрохим. коммун. 11, 1830–1833 гг. doi: 10.1016/j.elecom.2009.07.028 doi: 10.1016/0022-3093(91)
doi: 10.1016/0022-3093(91)-k 7.2014. 11, 21–26. doi: 10.1007/s10008-005-0029-3
11, 21–26. doi: 10.1007/s10008-005-0029-3 и Ямамото О. (2009). Транспорт Li-ion в полностью твердотельных литиевых батареях с LiCoO2 с использованием стеклокерамических электролитов типа NASICON. Дж. Источники питания 189, 365–370. doi: 10.1016/j.jpowsour.2008.08.015
и Ямамото О. (2009). Транспорт Li-ion в полностью твердотельных литиевых батареях с LiCoO2 с использованием стеклокерамических электролитов типа NASICON. Дж. Источники питания 189, 365–370. doi: 10.1016/j.jpowsour.2008.08.015 , Zhang, X., Yuan, Y., Wang, C., Ye, Y., et al. (2020). Обзор приложений трехмерной печати для перезаряжаемых литий-ионных аккумуляторов. Заяв. Энергия 257:14002.
, Zhang, X., Yuan, Y., Wang, C., Ye, Y., et al. (2020). Обзор приложений трехмерной печати для перезаряжаемых литий-ионных аккумуляторов. Заяв. Энергия 257:14002. Материал для хранения энергии. 5, 139–164.
Материал для хранения энергии. 5, 139–164.