Кипит аккумулятор: причины и мифы — Блог
Вокруг вопроса – почему кипит аккумулятор – на просторах Интернета за последнее время родилось очень много мифов. В некоторые из них действительно легко поверить, так как они сильно смахивают на правду. Другие и вовсе смешные. Задача этой статьи – обоснованно развеять эти, и другие мифы о кипении АКБ, а также простыми словами объяснить, почему на самом деле это происходит, где искать причины, и как их устранять.
Условия для кипения АКБ и природа этого процесса
Начать следует с того, что кипение аккумулятора, о котором идет речь, не совсем является кипением, к которому мы привыкли в быту. Как большинство представляет себе этот процесс? Если набрать в посуду воды, и погрузить в нее включенный в сеть кипятильник, то со временем жидкость закипит. Сначала появятся пузырьки воздуха, затем начнется обильное бурление с выделением водяного пара. Чтобы начался этот процесс, упрощенно необходимо всего лишь одно условие – вода должна нагреться до 100°C.
Упрощенно потому, что температура кипения воды далеко не всегда 100°C. На эту цифру влияет давление и другие факторы. Так, например, если нагревать воду в абсолютно герметичной посуде, она закипит при большей температуре, поскольку внутри емкости из-за расширения жидкости и испарений повысится давление. С другой стороны, если нагревать воду, скажем, на горе Эверест (в открытой посуде), то из-за пониженного атмосферного давления она закипит при температуре всего 69°C.
Но вернемся к аккумуляторам. Чтобы описанный выше процесс начался в автомобильной аккумуляторной батарее, очевидно, необходимо нагревать электролит. Температура его кипения, поскольку он состоит из воды и кислоты, составляет примерно 113°C. Как он может нагреться до такой температуры? Если пропускать через пластины АКБ очень большой ток, то теоретически свинец можно превратить в кипятильник, и электролит закипит. Нагреться он может и от внешних источников тепла, например, от мотора.
К счастью для всех владельцев авто – указанные два варианта являются ничем иным, как ничем не обоснованными мифами. К ним мы еще вернемся.
На самом же деле природа кипения аккумулятора совсем иная. По-научному этот процесс и кипением-то не называется. То, что происходит внутри АКБ при выделении пузырьков воздуха или бурлении, называется электролизом
. Это такая электрохимическая реакция, при которой проходящий через свинцовые пластины ток расщепляет содержащуюся в электролите воду на ее составные компоненты – водород и кислород (h3O – формулу воды наверняка все помнят). Получающиеся в результате электролиза эти два вещества в газообразном состоянии поднимаются на поверхность электролита, что и можно, собственно, наблюдать во время «кипения» аккумулятора.Какие же условия необходимы для того, чтобы в аккумуляторе запустился этот процесс? Как в обычном бытовом кипении, температура тут не является решающим фактором. Решающим тут является напряжение, при котором пропускается ток через пластины, а также степень заряженности АКБ. Рассмотрим эти факторы подробнее.
Рассмотрим эти факторы подробнее.
Когда аккумулятор не заряжен полностью, при пропускании через него электрического тока в нем происходит электрохимическая реакция, благодаря которой накапливается заряд. Упрощенно это происходит, как растворение находящегося на пластинах сульфата свинца в воде. В результате жидкость в «банках» АКБ превращается в электролит, состоящий из воды и кислоты. Соответственно, когда сульфат заканчивается (условно, для простоты понимания), батарея более не принимает заряд.
Если после этого продолжать пропускать через АКБ электрический ток, то на смену реакции растворения сульфата свинца в воде придет реакция электролиза. Содержащаяся в электролите вода начнет распадаться на водород и кислород, которые в газообразном состоянии улетучиваются.
На этом этапе в процесс вступает второй фактор – напряжение. Чтобы заставить электрический ток течь через заряженную 12-вольтовую батарею, напряжение должно быть выше 14.4 В (или выше 2.4 В на каждую «банку»).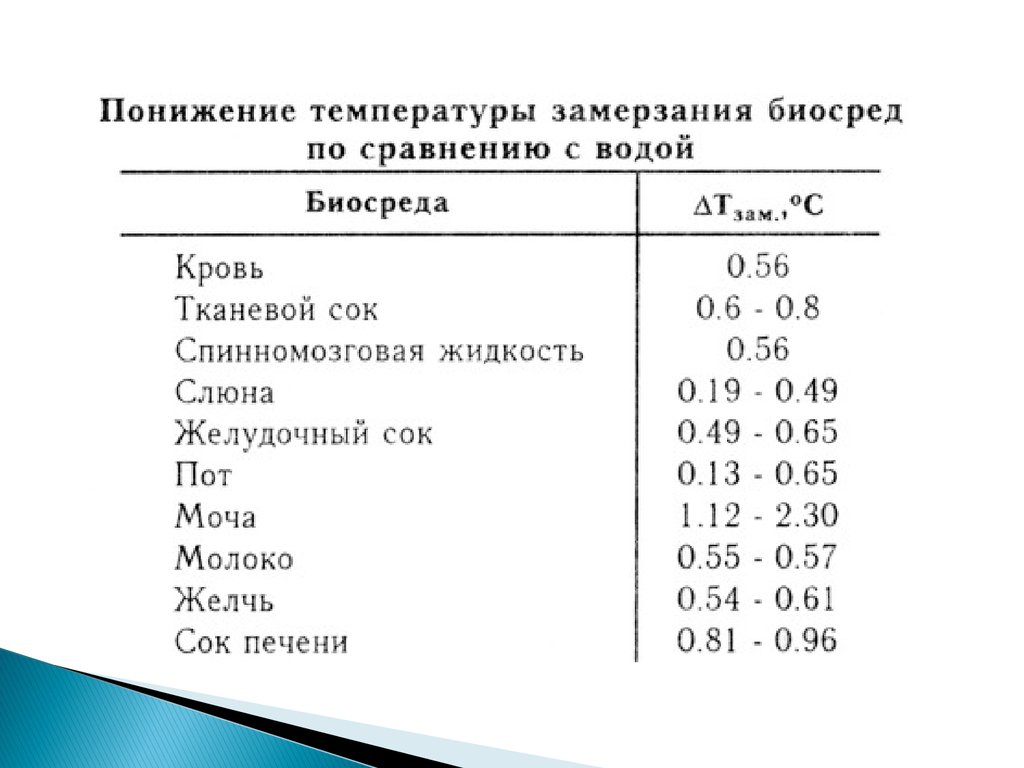
Отсюда следует вывод: чтобы аккумулятор начал «кипеть», необходимо, чтобы он был полностью заряжен, а напряжение на клеммах превышало 14.4 В.
Единственная причина кипения АКБ на машине или во время зарядки от СЗУ
Собственно, эта самая причина уже известна. Что на машине под капотом, что при зарядке от стационарного зарядного устройства – аккумулятор кипит потому, что он зарядился, но на него продолжается подача напряжение выше 14.4 В. Рассмотрим теперь причины, по которым это происходит на практике.
Аккумулятор кипит на машине
Начнем с автомобиля. Будучи установленным в машине, разряженная АКБ заряжается от генератора во время работы двигателя. Поскольку скорость вращения генератора напрямую зависит от оборотов двигателя, то и выдаваемое им напряжение постоянно меняется по мере того, как водитель нажимает на педаль газа, либо отпускает ее.
Чтобы от генератора к аккумулятору «приходило» нормальное для зарядки последнего напряжение, между этими двумя узлами устанавливается реле-регулятор. Это устройство, которое стабилизирует (ограничивает) напряжение, подаваемое от генератора в бортовую сеть автомобиля.
Это устройство, которое стабилизирует (ограничивает) напряжение, подаваемое от генератора в бортовую сеть автомобиля.
Соответственно, уже вырисовывается та самая единственная причина, из-за которой может кипеть аккумулятор на машине. Кроется она в реле-регуляторе. Если он неисправен, работает некорректно и так далее, то на аккумулятор может подаваться напряжение, превышающее 14.4 В. В результате батарея со временем заряжается полностью, после чего (если автомобиль не заглушили) начинается так называемый перезаряд. По факту же, как мы уже знаем, в аккумуляторе начинается процесс электролиза. Электролит покидает расщепленная на водород и кислород вода, и если в это время заглянуть внутрь, то можно увидеть пузырьки этих газов или даже бурление.
Как проверить реле-регулятор напряжения?
Чтобы удостовериться в том, что аккумулятор кипит на машине из-за неисправного реле-регулятора, его можно легко проверить своими руками. Для этого понадобится мультиметр, включенный в режим измерения постоянного напряжения или постоянно подключенный к АКБ вольтметр. Процесс проверки очень простой. При запущенном двигателе и выключенных потребителях (свет, печка и прочее) необходимо измерить напряжение на клеммах аккумулятора. Если оно превышает 14.4 В, то реле-регулятор неисправен.
Процесс проверки очень простой. При запущенном двигателе и выключенных потребителях (свет, печка и прочее) необходимо измерить напряжение на клеммах аккумулятора. Если оно превышает 14.4 В, то реле-регулятор неисправен.
Как правило, на автомобилях реле-регулятор настраивается таким образом, чтобы при включенных потребителях (напряжение из-за них проседает) на АКБ поступало менее 14.4 В. Это делается для того, чтобы батарея не смогла зарядиться в процессе длительной езды до 100%, и не начался процесс электролиза воды. А как мы уже выяснили, если до конца АКБ не зарядится, то и кипеть она не начнет.
При проверке реле-регулятора следует учитывать один важный фактор. Когда батарея сильно разряжена, то на ее клеммах будет не самое максимальное напряжение, которое способен пропускать регулятор напряжения. Самым высоким оно будет тогда, когда АКБ зарядится до максимально возможного на конкретном автомобиле уровня. По этой причине проверять работу реле-регулятора удобнее не мультиметром, а встроенным в бортовую сеть вольтметром. По его показаниям можно оценить напряжение в процессе езды, когда аккумулятор зарядится на максимум.
По его показаниям можно оценить напряжение в процессе езды, когда аккумулятор зарядится на максимум.
Почему кипит аккумулятор при зарядке?
При зарядке АКБ от стационарного зарядного устройства она кипит абсолютно по той же причине. Батарея полностью заряжена, но ток продолжает течь через ее электроды. Такое возможно лишь при условии, что зарядное устройство выдает напряжение большее, чем 14.4 В.
К сожалению, таким недостатком страдают практически все дешевые зарядники. Если разобрать одно из таких устройств, то внутри можно будет обнаружить всего три детали – трансформатор и два диода. Трансформатор понижает сетевое напряжение с 230 В до 14-18 В, а диоды – выпрямляют его, из переменного превращая в постоянное. Никаких стабилизирующих и ограничивающих напряжение деталей в таких девайсах нет. Соответственно, на аккумулятор может подаваться значительно больше 14.4 В.
Как правило, дешевые зарядники и вольтметром не оснащаются (только амперметром). Поэтому, используя такие приборы, настоятельно рекомендуется дополнительно контролировать напряжение заряда при помощи мультиметра.
Поэтому, используя такие приборы, настоятельно рекомендуется дополнительно контролировать напряжение заряда при помощи мультиметра.
АКБ кипит при исправном регуляторе (или на нормальной зарядке)
Многие эту причину относят к отдельной категории, хотя аккумулятор кипит из-за того же электролиза и превышения напряжения. Речь идет об АКБ, в которых имеется закороченная «банка». Такие аккумуляторы способны закипать при абсолютно исправном реле-регуляторе, а также при подзарядке от самого современного и напичканного автоматикой зарядного устройства. И вот почему.
Автомобильные АКБ состоят из шести отсеков («банок»), каждый из которых является независимым маленьким аккумулятором. Для нормальной (полной) зарядки одной такой «банки» нужно напряжение 14.4 / 6 = 2.4 В. Когда одна из ячеек оказывается закороченной, она превращается из аккумулятора в проводник тока. Соответственно, для зарядки всей батареи с закороченным отсеком нужно напряжение уже не 14.4 В, а 14.4 – 2.4 = 12.
А идеально работающий регулятор напряжения на машине выдает 14.4 В (или чуть меньше). В результате получается, что процесс электролиза в АКБ с закороченной банкой начинается гораздо раньше, чем в «здоровой». На практике такой аккумулятор на машине начинает кипеть практически сразу после запуска двигателя.
Вычислить АКБ с закороченной банкой достаточно просто. Когда все остальные ячейки обильно бурлят, закороченная банка – не кипит.
5 мифических причин кипения аккумулятора
Теперь рассмотрим причины, по которым аккумулятор кипеть не может, но Интернет нам говорит об обратном. Причем не просто рассмотрим, а обоснуем каждый миф настолько простыми для понимания словами, насколько это возможно.
Миф №1. Батарея кипит, так как через нее проходит большой ток
На самом деле на машине через АКБ идет ток не более 10 А. И то – кратковременно. В основном через нее проходит от силы пара ампер, а то и доли ампера. Если представить пластины в банках в роли кипятильника, то его мощность составит (умножаем вольты на амперы) 14. 5 * 10 = 145 Вт. Напомним – это кратковременно.
5 * 10 = 145 Вт. Напомним – это кратковременно.
Чтобы кипятильник мощностью всего в полста ватт довел до кипения (113°C) около трех литров электролита (примерно столько его в среднем АКБ), понадобится вечность. Если не бесконечность. Конечно, если допустить, что через АКБ пойдут все выдаваемые генератором 80 А, то мощность получится уже более киловатта. Однако это не более, чем сказка. Миф. Такого не бывает.
Миф №2. АКБ кипит, так как перегревается от жары под капотом
Если бы под капотом автомобиля была температура, достаточная для закипания электролита в пластиковом корпусе АКБ, то вы бы все равно не дождались этого момента. При такой температуре намного раньше взорвалась бы система охлаждения двигателя. Для проверки можете замерить температуру АКБ летним жарким днем при долго работающем двигателе. Никаких 113°C там вы не намеряете. А теплу еще же надо преодолеть корпус АКБ, чтобы греть электролит. Да и теплопотери никто еще не отменял.
Миф №3. АКБ закипает, так как она меньшей емкости, чем надо
Очередной бред. Даже если вы установите на свой автомобиль АКБ емкостью 10 А*ч, при исправном реле-регуляторе она себе преспокойно зарядится, и все. Пока напряжение будет ниже 14.4 В, кипение электролиз не начнется.
Даже если вы установите на свой автомобиль АКБ емкостью 10 А*ч, при исправном реле-регуляторе она себе преспокойно зарядится, и все. Пока напряжение будет ниже 14.4 В, кипение электролиз не начнется.
Миф №4. АКБ большей емкости закипает, так как из-за размеров и тесноты она хуже обдувается
Это миф из той же сказки, что и №2. Если вы установили аккумулятор большей емкости, чем надо, и боитесь, что он из-за этого перегреется, измерьте температуру при условиях, описанных выше. До температуры кипения электролита там будет очень далеко. Даже если вы в Сахару поедете для того, чтобы сделать замеры (там же ездят на машинах). Что уж о нашем регионе говорить…
Миф №5. АКБ кипит из-за сульфатации
Все, чем страдает засульфатировавшийся аккумулятор, это уменьшением емкости и тока холодной прокрутки. Заряжается он абсолютно так же, как и новая батарея, только быстрее (энергии то меньше может принять). Дальше, если напряжение заряда не превышает номинальное – кипение не начнется.
Видео по вопросу кипения аккумулятора
Схожий материал
5 возможных причин почему аккумулятор быстро разряжается на авто
Плохо крутит стартер: диагностика и устранение причин
Простые способы проверки высоковольтных проводов зажигания
Зачем нужно менять тормозную жидкость
5 способов проверить амортизаторы автомобиля
Вибрация при торможении авто: диагностика своими силами
Правила эксплуатации и мойка машины после покраски кузова
Кипит аккумулятор: причины и мифы
Просадки напряжения ВАЗ и на других автомобилях
Подготовка автомобиля к продаже
Как лучше настроить магнитолу в автомобиле
10 возможных причин почему хрипят динамики в машине
Советы как снизить расход топлива на автомобиле
Как правильно подключить любую автомагнитолу к чему угодно
Как починить магнитолу своими руками
В АКБ одна «банка» не кипит при зарядке
Неравномерный износ шин
Можно ли не снимая клеммы заряжать аккумулятор – мифы и реальность
Как в машине сделать 220 вольт
Почему глохнет машина при снятии клеммы с аккумулятора и можно ли так делать
Нужно ли отключать аккумулятор? 10 случаев, когда реально не помешает.
Подключение амперметра в автомобиле
Как правильно отключать и подключать аккумулятор на машине
Плохо ловит радио в машине: возможные причины и способы улучшить прием
Можно ли доливать воду в антифриз: мифы и реальность
7 способов как подключить телефон к штатной магнитоле автомобиля
10 причин почему могут греться колеса автомобиля
Можно ли подкрашивать номера на автомобиле
Принцип работы датчиков давления в шинах и их основные разновидности
Срок службы автомобильной резины и как его продлить
Как правильно обкатать автомобиль: мифы и реальность
Разница между 92-м и 95-м бензином – какой лучше заправлять и почему
Как правильно устанавливать светодиоды на машину
Гудит ГУР: причины
Какая самая экономичная скорость на автомобиле и почему
Почему окисляются клеммы на аккумуляторе и как правильно с этим бороться
Почему плохо играет магнитола и как улучшить музыку в машине
Что выбрать – шипованную резину или липучки
Как заряжать кальциевый аккумулятор – мифы и реальность
10 причин почему машину уводит в сторону
Как и сколько можно хранить бензин в домашних условиях
Обкатка шин – мифы и реальность
Где установить видеорегистратор в машине
Какие диски лучше – литые или штампованные
Полировка кузова своими руками без машинки
Нужно ли заряжать новый автомобильный аккумулятор и как правильно это делать
Установка и подключение второго аккумулятора в машину
История шин Dunlop / Данлоп
Самые большие шины Michelin / Мишлен для карьерных самосвалов
Кипение — электролит — Большая Энциклопедия Нефти и Газа, статья, страница 3
Cтраница 3
При таком заряде кипение электролита практически отсутствует. Однако мощность зарядного агрегата должна соответствовать начальному току, который может оказаться слишком большим. Поэтому целесообразно комбинировать оба способа заряда ( при постоянстве тока и напряжения) в соответствии с располагаемой мощностью зарядного агрегата. Заряд начинают некоторым током постоянного значения и продолжают его до тех пор, пока напряжение не достигнет приблизительно 2 15 — 2 2 В на один аккумулятор. Далее поддерживают напряжение постоянным и продолжают заряд при плавно спадающем токе.
[31]
Однако мощность зарядного агрегата должна соответствовать начальному току, который может оказаться слишком большим. Поэтому целесообразно комбинировать оба способа заряда ( при постоянстве тока и напряжения) в соответствии с располагаемой мощностью зарядного агрегата. Заряд начинают некоторым током постоянного значения и продолжают его до тех пор, пока напряжение не достигнет приблизительно 2 15 — 2 2 В на один аккумулятор. Далее поддерживают напряжение постоянным и продолжают заряд при плавно спадающем токе.
[31]
При заряде свинцовых аккумуляторов наблюдаются кипение электролита и выделение пузырьков газа. Это выделяется водород, образующийся за счет разложения ( электролиза) воды и электролита. Водород — горючий газ; при смещении его с воздухом образуется взрывчатая смесь — гремучий газ. При 4 5 — 5 % смесь горюча, а при содержании водорода 6 % и более торение переходит во взрыв. Наибольшим разрушительным действием обладает смесь, содержащая около 28 % водорода. При формировании аккумуляторной батареи после замены пластин, когда аккумуляторы длительно кипят, в аккумуляторное помещение выделяется очень много водорода. Поэтому во время формировочного заряда должна непрерывно действовать принудительная приточно-вы-тяжная вентиляция.
[32]
При формировании аккумуляторной батареи после замены пластин, когда аккумуляторы длительно кипят, в аккумуляторное помещение выделяется очень много водорода. Поэтому во время формировочного заряда должна непрерывно действовать принудительная приточно-вы-тяжная вентиляция.
[32]
Необходимо отметить, что возможность повышения температуры в электролизере ограничена определенными пределами. При температуре, близкой к температуре кипения электролита, резко возрастает парциальное давление паров воды и увеличивается объем влажных газов, выделяющихся на электродах, что приводит к значительному увеличению степени газонаполнения электролита и повышению напряжения на электролитической ячейке. При температуре выше 100 — 105 С электролит вскипает и увеличивается количество электролита, уносимого газами. [33]
Перед пуском электролизер должен быть хорошо просушен, что осуществляют электрическими спиральными нагревателями с постепенным подъемом температуры до 500 С, после чего его заполняют перегретым расплавом и включают электролизер в серию.
Конец зарядки определяют, таким образом, по постоянству плотности электролита и постоянству напряжения всех аккумуляторов батарей, сохраняющемуся в течение 3 час. Признаком окончания зарядки служит также обильное выделение газов, кипение электролита во всех элементах. [35]
Короткое замыкание является следствием осыпания активной массы, разрушения сепараторов, коробления пластин при разряде батареи большими токами. Признаками короткого замыкания являются отсутствие или малая ЭДС аккумулятора, кипение электролита, падение напряжения, снижение плотности электролита. [36]
| Потенциал никелевого электрода при катодной и анодной поляризации. [37] |
На рис.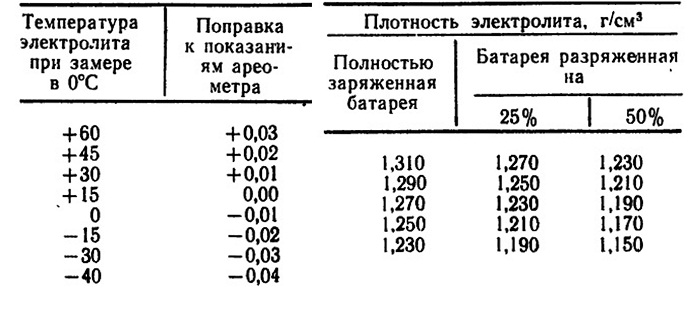 2 — 18 приведена зависимость напряжения на ячейке при различной плотности тока от температуры. При работе под атмосферным давлением повышение температуры в электролизере ограничено ее значением, близким к кипению электролита. Обычно эта температура не превышает 95 С. Проведение электролиза под давлением позволяет увеличить рабочую температуру тем в большей — степени, чем при более высоком давлении будет осуществляться процесс.
[38]
2 — 18 приведена зависимость напряжения на ячейке при различной плотности тока от температуры. При работе под атмосферным давлением повышение температуры в электролизере ограничено ее значением, близким к кипению электролита. Обычно эта температура не превышает 95 С. Проведение электролиза под давлением позволяет увеличить рабочую температуру тем в большей — степени, чем при более высоком давлении будет осуществляться процесс.
[38]
Другим недостатком холодных электролитов является очень медленное наращивание слоя железного покрытия. Для ускорения процесса жеяезнения рекомендуется применение концентрированных электролитов и высоких температур электролиза, близких к температуре кипения электролита. [39]
Батарею включают на контрольный заряд током 35 А до появления признаков конца заряда. Этими признаками являются постоянство напряжения и плотности электролита у всех элементов батареи в течение последних двух часов и активное кипение электролита. [40]
[40]
| Зависимость температуры кипения растворов едких натра и кали от концентрации. [41] |
Таким образом, количество уносимых водяных паров будет тем больше, чем выше температура в ванне, определяющая объем выделяющихся газов v и давление насыщенных водяных паров над электролитом. Оно будет тем меньше, чем выше давление газов в ванне и больше концентрация электролита, определяющая температуру кипения электролита и депрессию t5Q давления водяного пара. [42]
Кислотную батарею включают на контрольный заряд током 35 А до окончания ее заряда. Признаками окончания заряда являются постоянство напряжения и плотности электролита у всех элементов батареи в течение последних 2 ч заряда и активное кипение электролита. После контрольного заряда батарею разряжают током 10-часового режима ( 45 А), пока напряжение хотя бы на одном-двух элементах не достигнет 1 8 В. После этого батарею вновь заряжают сначала током 65 А до достижения напряжения 2 3 — 2 4 В у большинства элементов, затем ток уменьшают до 35 А и продолжают питать батарею до окончания заряда.
[43]
После этого батарею вновь заряжают сначала током 65 А до достижения напряжения 2 3 — 2 4 В у большинства элементов, затем ток уменьшают до 35 А и продолжают питать батарею до окончания заряда.
[43]
| Проверка уровня ( а и плотности ( б электролита. [44] |
Если плотность электролита в отдельных аккумуляторах отличается более чем на 0 01 г / см3, то ее следует выравнять, доливая электролит плотностью 1 4 г / см3 или дистиллированную воду. Доливать в аккумулятор электролит плотностью 1 4 г / см3 можно, если батарея полностью заряжена и обеспечивается быстрое и надежное перемешивание вследствие кипения электролита. [45]
Страницы: 1 2 3 4
16.15: Электролиты и коллигативные свойства
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 53863
Добавление ионов приводит к значительным изменениям свойств растворов. -} \left( aq \right)\nonumber \]
-} \left( aq \right)\nonumber \]
Значения понижения температуры замерзания и повышения температуры кипения для раствора \(\ce{CaCl_2}\) будут в три раза больше, чем они были бы для той же моляльности неэлектролита.
Пример \(\PageIndex{1}\)
Определите температуру замерзания и кипения раствора, приготовленного путем растворения \(82,20 \: \text{g}\) хлорида кальция в \(400 \: \text {г}\) воды.
Решение
Шаг 1: Перечислите известные количества и спланируйте задачу. 9\текст{о} \текст{С}\)Сначала рассчитывается количество молей \(\ce{CaCl_2}\), а затем моляльность раствора. Затем определяются температуры замерзания и кипения, включая умножение на 3 для трех ионов.
Шаг 2: Решить. \[\begin{align*} 82,20 \: \text{g} \: \ce{CaCl_2} \times \frac{1 \: \text{mol} \: \ce{CaCl_2}}{110,98 \ : \text{g} \: \ce{CaCl_2}} &= 0,7407 \: \text{моль} \: \ce{CaCl_2} \\ \frac{0,7407 \: \text{моль} \: \ce{CaCl_2 }}{0,400 \: \text{кг} \: \ce{H_2O}} &= 1,85 \: \textit{м} \: \ce{CaCl_2} \end{align*}\nonumber \] 9\text{o} \text{C}\), вычисленный результат для \(\Delta T_b\) должен быть добавлен к 100,00, чтобы найти новую точку кипения.
Резюме
- Ионные соединения являются электролитами и при растворении диссоциируют на два или более ионов.
- Описано влияние ионизации на коллигативные свойства.
Эта страница под названием 16.15: Электролиты и коллигативные свойства распространяется под лицензией CK-12 и была создана, изменена и/или курирована Фондом CK-12 через исходный контент, отредактированный в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
ПОД ЛИЦЕНЗИЕЙ
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Фонд СК-12
- Лицензия
- СК-12
- Программа OER или Publisher
- СК-12
- Показать страницу TOC
- № на стр.

- Теги
- источник@https://flexbooks.ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
Электролиты и коллигативные свойства | Химия для неспециалистов |
Цели обучения
- Выполнение расчетов влияния электролитов на коллигативные свойства.
Какое действие оказывают ионы?
Измерение ионных растворов. Изображение из Викимедиа.
Добавление ионов приводит к значительным изменениям свойств растворов. Молекулы воды окружают ионы и несколько прочно связаны с ними. На коллигативные свойства влияет то, что свойства растворителя уже не такие, как у чистого растворителя.
Ионные соединения являются электролитами и при растворении диссоциируют на два или более ионов. Это необходимо учитывать при расчете температур замерзания и кипения растворов электролитов. Пример задачи ниже демонстрирует, как рассчитать температуру замерзания и точку кипения раствора хлорида кальция. Хлорид кальция диссоциирует на три иона по уравнению:
Пример задачи ниже демонстрирует, как рассчитать температуру замерзания и точку кипения раствора хлорида кальция. Хлорид кальция диссоциирует на три иона по уравнению:
Значения понижения температуры замерзания и повышения температуры кипения для раствора CaCl 2 будут в три раза больше, чем они были бы для равной моляльности неэлектролита.
Пример задачи: температура замерзания и кипения электролита
Определите температуру замерзания и кипения раствора, приготовленного путем растворения 82,20 г хлорида кальция в 400 г воды.
Шаг 1: Перечислите известные количества и спланируйте проблему.
Известно
- масса CaCl 2 = 82,20 г
- молярная масса CaCl 2 = 110,98 г/моль
- масса H 2 O = 400. г = 0,400 кг
- CaCl 2 диссоциирует на 3 иона
Неизвестно
Сначала вычисляются моли CaCl 2 , а затем моляльность раствора. Затем определяются температуры замерзания и кипения, включая умножение на 3 для трех ионов.
Затем определяются температуры замерзания и кипения, включая умножение на 3 для трех ионов.
Шаг 2: Решить.
Шаг 3: Подумайте о своем результате.
Поскольку нормальная температура кипения воды составляет 100,00°C, расчетный результат для должен быть добавлен к 100,00, чтобы найти новую температуру кипения.
Резюме
- Описано влияние ионизации на коллигативные свойства.
Практика
Выполняйте практические и домашние задания, связанные с ионными растворами в конце раздела по ссылке ниже:
http://avon-chemistry.com/solution_lec_p2.html
Обзор
- Почему ионные материалы изменяют коллигативные свойства раствора?
- Можно ли ожидать, что HCl изменит коллигативные свойства?
- Карбонат кальция является ионным, но нерастворимым в воде. Как это повлияет на температуру кипения воды?
Лицензии и атрибуты
Контент под лицензией CC, совместно используемый ранее
- Химические понятия Промежуточный.

