Характеристики автомобиля Лада Икс Рей Кросс – АЦ Высота
Lada XRAY Cross
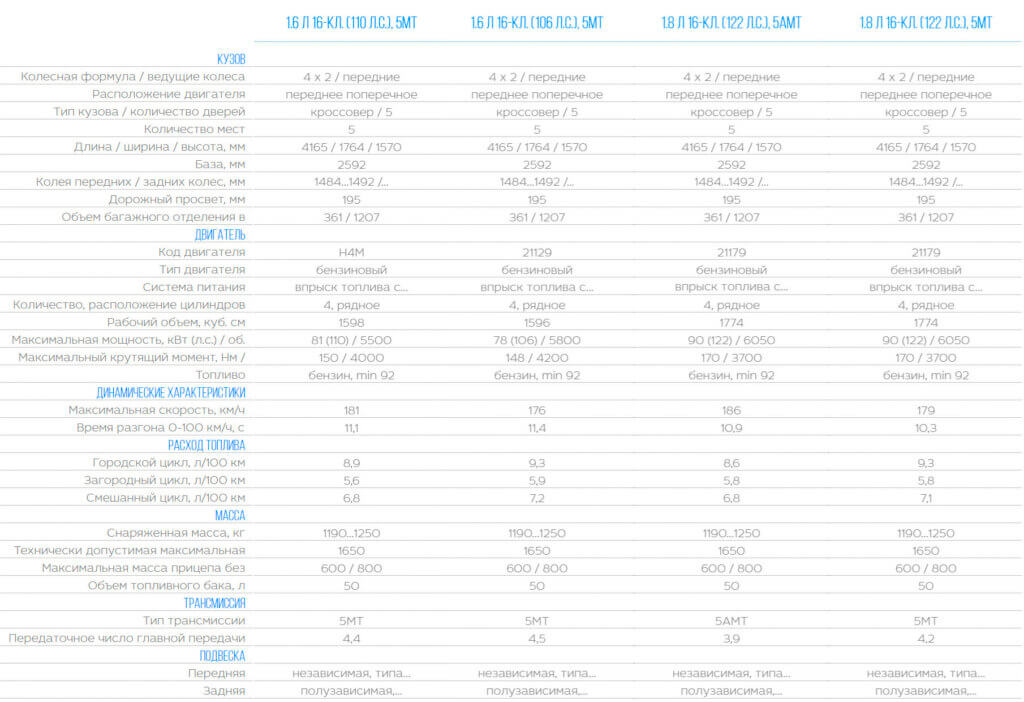
Технические характеристики
1.6 AT 113 л.с. бензин передний 1.8 МТ 122 л.с. бензин передний
1.6 AT 1.8 МТ
Выделить разные характеристики
Объем
1.6
1.8
Мощность
113
122
Коробка
вариатор
механика
Топливо
АИ-92
АИ-92
Запас хода
Разгон
12.8
10.9
Расход
7.3
7.5
Страна марки
Россия
Россия
Класс автомобиля
B
B
Количество дверей
5
5
Количество мест
Оценка безопасности
нет/нет данных
нет/нет данных
Название рейтинга
нет/нет данных
нет/нет данных
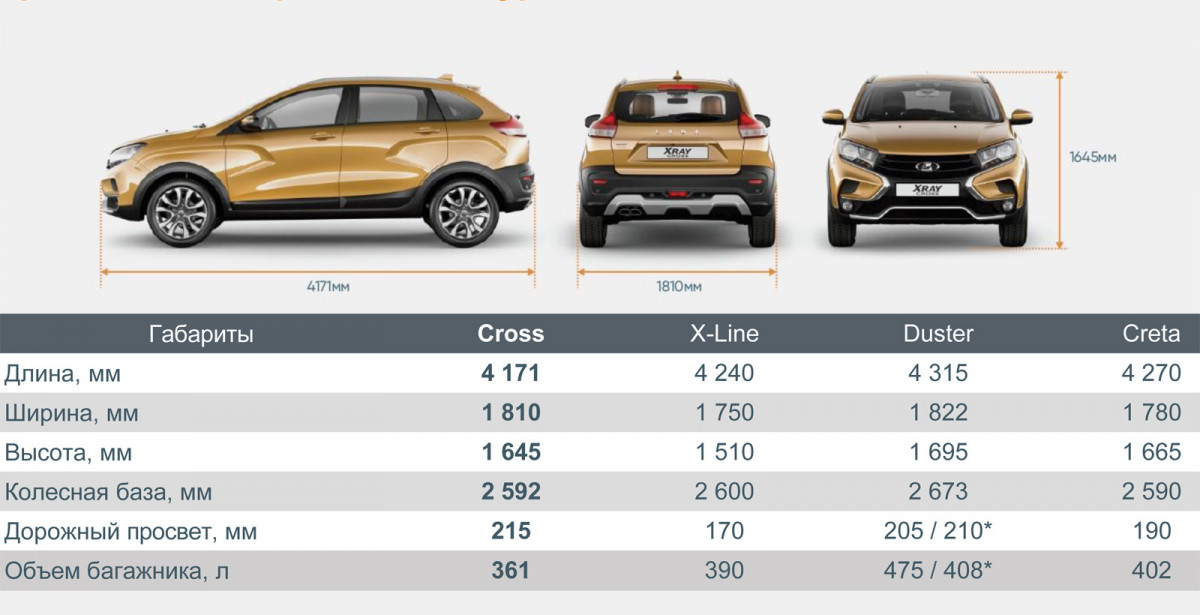
Длина
4171
4171
Ширина
1810
1810
Высота
1645
1645
Колёсная база
2592
2592
Клиренс
215
215
Ширина передней колеи
1503
1503
Ширина задней колеи
1546
1546
Размер колёс
215/50/R17
215/50/R17
Объем багажника мин/макс, л
361/1207
361/1207
Объём топливного бака, л
50
50
Снаряженная масса, кг
1295
1295
Полная масса, кг
1650
Коробка передач
вариатор
механика
Количество передач
5
Тип привода
передний
передний
Тип передней подвески
независимая, пружинная
независимая, пружинная
Тип задней подвески
полунезависимая, торсионная
полунезависимая, пружинная
Передние тормоза
дисковые вентилируемые
дисковые вентилируемые
Задние тормоза
нет/нет данных
дисковые
Максимальная скорость, км/ч
162
180
Разгон до 100 км/ч, с
12. 8
8
10.9
Марка топлива
АИ-92
АИ-92
Экологический класс
Euro 5
Euro 5
Выбросы CO2, г/км
Расход топлива, л город/трасса/смешанный
нет/нет данных
нет/нет данных
Расход топлива, л город/трасса/смешанный
нет/нет данных
нет/нет данных
Расход топлива, л смешанный
нет/нет данных
нет/нет данных
Расход топлива, л город/смешанный
нет/нет данных
нет/нет данных
Расход топлива, л город/трасса
нет/нет данных
нет/нет данных
Расход топлива, л город
нет/нет данных
нет/нет данных
Расход топлива, л трасса
нет/нет данных
нет/нет данных
Расход топлива, л трасса/смешанный
нет/нет данных
нет/нет данных
Тип двигателя
бензин
бензин
Расположение двигателя
переднее, поперечное
переднее, поперечное
Объем двигателя, см³
1598
1774
Тип наддува
нет
нет
Максимальная мощность, л. с./кВт при об/мин
с./кВт при об/мин
113 / 83 при 5500
122 / 90 при 6050
Максимальный крутящий момент, Н*м при об/мин
152 при 4000
170 при 3700
Расположение цилиндров
рядное
рядное
Количество цилиндров
4
4
Число клапанов на цилиндр
4
4
Система питания двигателя
распределенный впрыск (многоточечный)
распределенный впрыск (многоточечный)
Степень сжатия
10.7
10.5
Диаметр цилиндра и ход поршня, мм
78 × 83.5
82 × 84
Запас хода на электричестве, км
Емкость батареи, кВт⋅ч
Время зарядки, ч
Купить в кредит
Получите до 900 000 руб за свой старый автомобиль
Как вас зовут? Телефон Марка, модель и год старого авто Даю согласие на обработку персональных данных
Похожие предложения
-10%
скидка от автосалона
-30%
при покупке в кредит
-15%
при утилизации
-20%
по программе Trade-In
4
подарка на выбор
new
Lada Largus Cross 5
828 900 руб
В кредит от 10 000 руб/мес
от 3,9%
В кредит Бронь
-10%
скидка от автосалона
-30%
при покупке в кредит
-15%
при утилизации
-20%
по программе Trade-In
4
подарка на выбор
new
Renault Logan Stepway
1 443 000 руб
945 000 руб
В кредит от 11 400 руб/мес
от 3,9%
В кредит Бронь
-10%
скидка от автосалона
-30%
при покупке в кредит
-15%
при утилизации
-20%
по программе Trade-In
4
подарка на выбор
new
Skoda Rapid 2019
1 336 400 руб
935 480 руб
В кредит от 11 300 руб/мес
от 3,9%
В кредит Бронь
-10%
скидка от автосалона
-30%
при покупке в кредит
-15%
при утилизации
-20%
по программе Trade-In
4
подарка на выбор
new
Brilliance V3
1 090 700 руб
839 000 руб
В кредит от 10 100 руб/мес
от 3,9%
В кредит Бронь
-10%
скидка от автосалона
-30%
при покупке в кредит
-15%
при утилизации
-20%
по программе Trade-In
4
подарка на выбор
new
Lifan X70
1 285 700 руб
695 000 руб
В кредит от 8 400 руб/мес
от 3,9%
В кредит Бронь
-10%
скидка от автосалона
-30%
при покупке в кредит
-15%
при утилизации
-20%
по программе Trade-In
4
подарка на выбор
new
Zotye T600
1 263 100 руб
760 000 руб
В кредит от 9 200 руб/мес
от 3,9%
В кредит Бронь
-10%
скидка от автосалона
-30%
при покупке в кредит
-15%
при утилизации
-20%
по программе Trade-In
4
подарка на выбор
new
Zotye Coupa
1 546 500 руб
935 000 руб
В кредит от 11 300 руб/мес
от 3,9%
В кредит Бронь
-10%
скидка от автосалона
-30%
при покупке в кредит
-15%
при утилизации
-20%
по программе Trade-In
4
подарка на выбор
new
Renault New Sandero
1 384 500 руб
910 000 руб
В кредит от 11 000 руб/мес
от 3,9%
В кредит Бронь
-10%
скидка от автосалона
-30%
при покупке в кредит
-15%
при утилизации
-20%
по программе Trade-In
4
подарка на выбор
new
Jac S3
1 428 700 руб
780 000 руб
В кредит от 9 400 руб/мес
от 3,9%
В кредит Бронь
-10%
скидка от автосалона
-30%
при покупке в кредит
-15%
при утилизации
-20%
по программе Trade-In
4
подарка на выбор
new
Changan CS35
1 143 900 руб
800 730 руб
В кредит от 9 700 руб/мес
от 3,9%
В кредит Бронь
Остались вопросы?
Мы перезвоним вам и поможем сделать выбор
Как вас зовут? Телефон Даю согласие на обработку персональных данных
Пора обновляться!
Максимальная выгода от Trade-In
250 000 руб
Технические характеристики двигателя Лада Х-рей и разгон до 100
Двигатель и разгонЕвгений Мосензов
Send an email
13. 04.2022
04.2022
0 357 2 минут
Объем двигателя и разгон до 100 км/час автомобиля Лада Х-рей. Наведены основные поколения и комплектации модели, а так же возможные вариации в пределах одной генерации.
Генерации Lada X-Ray/X-Ray Cross:
- 1 поколение 2015 (X-Ray, хэтчбек)
- 1 поколение 2018 (X-Ray Cross, GAB, SUV)
Характеристики агрегата чаще всего решают динамические свойства машины. Как правило, чем больше крутящий момент, тем быстрей стартует автомобиль и тем больше его ускорение. По данным производителя, до 100 км/час Лада Х-Рей может разогнаться от 10,3 до 13,6 секунды.
Что касается разнообразия агрегатов, то здесь нечем особо не удивят покупателя новые модификации Lada X-Ray. Под капотом производитель предложил ранее известные агрегаты, которые устанавливаются на другие, уже продаваемые модели автомобилей марки Lada. Аналогичная ситуация с коробкой переключения передач, выбрать можно будет между механической, роботизированной или вариатором (последняя только для X-Ray Cross).
Характеристики двигателя Lada X-Ray 2015, 1 поколение, хэтчбек
Модель производится с 11.2015 по нынешнее время.
| Модификация | Объем двигателя, см.куб. | Максимальный крутящий момент, Н*м | Разгон до 100 км/ч, с |
| 1.6 л, 106 л.с., бензин, МКПП, передний привод | 1596 | 148 | 11,4 |
| 1.6 л, 106 л.с., бензин, робот, передний привод | 1596 | 148 | 13,6 |
| 1.6 л, 110 л.с., бензин, МКПП, передний привод | 1598 | 150 | 11,1 |
| 1.8 л, 122 л.с., бензин, МКПП, передний привод | 1774 | 170 | 10,3 |
| 1.8 л, 122 л.с., бензин, робот, передний привод | 1774 | 170 | 10,9 |
Характеристики двигателя Lada X-Ray Cross 2018, 1 поколение, SUV, рестайлинг, GAB
Модель производится с 08. 2018 по нынешнее время.
2018 по нынешнее время.
| Модификация | Объем двигателя, см.куб. | Максимальный крутящий момент, Н*м | Разгон до 100 км/ч, с |
| 1.6 л, 106 л.с., бензин, МКПП, передний привод | 1596 | 148 | 13,5 |
| 1.6 л, 113 л.с., бензин, вариатор (CVT), передний привод | 1598 | 152 | 12,8 |
| 1.8 л, 122 л.с., бензин, МКПП, передний привод | 1774 | 170 | 10,9 |
Как видим, динамические характеристики нового Lada X-Ray и X-Ray Cross особо не отличаются, хотя классы моделей немного отличаются. Некоторые модификации вовсе получили одинаковые динамические данные, соответственно начинка и вся внутренность будет одинаковой. Больше всего отличий пришлось на двигатель, объемом 1,6 литра. Покупателю предложат данный агрегат мощностью 106, 110 и 113 лошадок. Несмотря на одинаковый объем, и минимальные отличия мощности, максимальный крутящий момент будет так же отличаться.
Таких отличий вполне достаточно, чтобы немного изменить время разгона Lada X-Ray/X-Ray Cross от 0 до 100 км/час. Все же, это не те показатели, которые хотелось бы увидеть, да и назвать особо динамической данную модель нельзя, так как показатель меньше 10 секунд не опускается даже в топ версии. Самой вялой будет модификация Lada X-Ray с роботизированной трансмиссией и двигателем 1,6 литра на 106 лошадок.
С большой вероятностью можно говорить о том, что гамму двигателем и трансмиссий производитель менять не будет. Было бы неплохо предложить хотя бы один агрегат дизельный, но такого нет в гамме производителя. Крайним случаем было бы наличие заводской газовой установки, так как учитывая стоимость бензина, такая модификация пользовалась бы спросом. Все же, пока выбрать можно лишь чистый бензиновый агрегат, но разного объема.
Похожие
Молекулярная динамика, выявленная с помощью измерения FRET одной молекулы
Abstract
Недавние достижения в области визуализации одиночных молекул привели к ряду открытий, касающихся характерного поведения и динамики отдельных молекул. Среди методов визуализации одиночных молекул измерение переноса энергии резонанса флуоресценции (FRET) относительно легко настроить, но это мощный метод; он может визуализировать связывание и диссоциацию субстрата, а также внутримолекулярные структурные изменения в пределах одной молекулы в режиме реального времени. Здесь мы сначала рассмотрим методы визуализации флуоресценции одной молекулы, которые открывают способ установить измерение FRET одной молекулы (smFRET). Затем мы опишем два примера характерной динамики отдельных молекул, обнаруженных с помощью smFRET: ингибирование трансляции белка, опосредованное антибиотиками, и внутримолекулярные структурные изменения в CRISPR-Cas9., универсальный инструмент для редактирования генома. Наконец, мы представляем некоторые из последних достижений в технике smFRET.
Среди методов визуализации одиночных молекул измерение переноса энергии резонанса флуоресценции (FRET) относительно легко настроить, но это мощный метод; он может визуализировать связывание и диссоциацию субстрата, а также внутримолекулярные структурные изменения в пределах одной молекулы в режиме реального времени. Здесь мы сначала рассмотрим методы визуализации флуоресценции одной молекулы, которые открывают способ установить измерение FRET одной молекулы (smFRET). Затем мы опишем два примера характерной динамики отдельных молекул, обнаруженных с помощью smFRET: ингибирование трансляции белка, опосредованное антибиотиками, и внутримолекулярные структурные изменения в CRISPR-Cas9., универсальный инструмент для редактирования генома. Наконец, мы представляем некоторые из последних достижений в технике smFRET.
Ключевые слова
- Резонансный перенос энергии флуоресценции
- Молекулярная биофизика
- Одномолекулярный FRET
- Аминогликозидные антибиотики
- Методы редактирования генов 10010 900Cas 4 900PR
- CRIS
Скачать документ конференции в формате PDF
Методы FRET широко используются для измерения динамики биомолекул из-за их высокой чувствительности в качестве наноразмерного датчика расстояния.
 Между двумя близко расположенными флуоресцентными молекулами энергия возбужденного донорного флуоресцентного зонда резонансно передается соседнему акцепторному флуоресцентному зонду, тем самым уменьшая интенсивность флуоресценции донора и увеличивая интенсивность флуоресценции акцептора. Эффективность этой передачи энергии обратно пропорциональна шестой степени расстояния между двумя флуоресцентными молекулами. Соответственно, FRET представляет собой чрезвычайно чувствительную измерительную систему для обнаружения изменений расстояния между двумя флуоресцентными зондами, особенно вокруг так называемого расстояния Фёрстера, а именно расстояния, при котором эффективность FRET составляет 0,5 (4–7 нм для пары типичных флуоресцентные зонды) (Lakowicz 2006). Таким образом, измерение FRET идеально подходит для обнаружения изменений расстояния между доменами или субъединицами в белке или нуклеиновых кислотах во время конформационных изменений. Более того, на основе соотношения интенсивностей флуоресценции двух флуоресцентных молекул можно достичь высокого отношения сигнал/шум при измерении реакций связывания и диссоциации по сравнению с измерениями с участием одной флуоресцентной молекулы.
Между двумя близко расположенными флуоресцентными молекулами энергия возбужденного донорного флуоресцентного зонда резонансно передается соседнему акцепторному флуоресцентному зонду, тем самым уменьшая интенсивность флуоресценции донора и увеличивая интенсивность флуоресценции акцептора. Эффективность этой передачи энергии обратно пропорциональна шестой степени расстояния между двумя флуоресцентными молекулами. Соответственно, FRET представляет собой чрезвычайно чувствительную измерительную систему для обнаружения изменений расстояния между двумя флуоресцентными зондами, особенно вокруг так называемого расстояния Фёрстера, а именно расстояния, при котором эффективность FRET составляет 0,5 (4–7 нм для пары типичных флуоресцентные зонды) (Lakowicz 2006). Таким образом, измерение FRET идеально подходит для обнаружения изменений расстояния между доменами или субъединицами в белке или нуклеиновых кислотах во время конформационных изменений. Более того, на основе соотношения интенсивностей флуоресценции двух флуоресцентных молекул можно достичь высокого отношения сигнал/шум при измерении реакций связывания и диссоциации по сравнению с измерениями с участием одной флуоресцентной молекулы. Эти преимущества сделали FRET широко используемым методом исследования динамики биомолекул.
Эти преимущества сделали FRET широко используемым методом исследования динамики биомолекул.Обычные объемные измерения FRET, однако, дают только средние значения измерения большого количества молекул. Следовательно, эти измерения не могут извлечь информацию о распределении нескольких молекул. Развитие технологий визуализации одиночных молекул, способных отличать интенсивность флуоресценции от отдельных молекул, преодолело это ограничение. В сочетании с методами визуализации отдельных молекул измерения FRET позволяют различать состояние каждой молекулы в режиме реального времени. Это сочетание привело к открытию различий в динамике и состояниях биомолекул в одних и тех же условиях.
В этой главе мы сначала описываем методы визуализации одиночных молекул, которые обеспечивают основу для измерения smFRET, затем представляем примеры исследования динамики белков с использованием smFRET и, наконец, знакомим с некоторыми современными приложениями smFRET.
1 Флуоресцентная визуализация одиночных молекул
Для обнаружения одиночных молекулярных флуоресцентных зондов с помощью оптической микроскопии требуются методы уменьшения фонового света в сочетании с интенсивным освещением и высокочувствительными системами камер.
 К концу 19В 80-х годах системы освещения и визуализации уже были усовершенствованы до такой степени, что теоретически можно было обнаруживать отдельные молекулы флуоресцентных зондов. Тем не менее, влияние фонового света от ненаблюдаемых флуоресцентных зондов остановило разработку системы, способной идентифицировать флуоресценцию одной молекулы. В 1990 году Шера и соавт. удалось различить флуоресцентные сигналы, испускаемые одной молекулой флуоресцентного зонда, используя импульсный свет, чтобы вызвать фотовозбуждение раствора флуоресцентного зонда с низкой концентрацией, протекающего через проточную кювету (Шера и др. 19).90). Однако этот метод, возможно, более подходит для классификации как проточная цитометрия, а не микроскопическая визуализация. Позже, в 1993 г., Betzig et al. проложили путь к технологии флуоресцентной визуализации одиночных молекул с помощью сканирующей оптической микроскопии ближнего поля (Betzig and Chichester, 1993). В их методе использовалось явление, при котором освещение небольшого отверстия диаметром меньше длины волны света приводит к тому, что свет появляется только в непосредственной близости от отверстия.
К концу 19В 80-х годах системы освещения и визуализации уже были усовершенствованы до такой степени, что теоретически можно было обнаруживать отдельные молекулы флуоресцентных зондов. Тем не менее, влияние фонового света от ненаблюдаемых флуоресцентных зондов остановило разработку системы, способной идентифицировать флуоресценцию одной молекулы. В 1990 году Шера и соавт. удалось различить флуоресцентные сигналы, испускаемые одной молекулой флуоресцентного зонда, используя импульсный свет, чтобы вызвать фотовозбуждение раствора флуоресцентного зонда с низкой концентрацией, протекающего через проточную кювету (Шера и др. 19).90). Однако этот метод, возможно, более подходит для классификации как проточная цитометрия, а не микроскопическая визуализация. Позже, в 1993 г., Betzig et al. проложили путь к технологии флуоресцентной визуализации одиночных молекул с помощью сканирующей оптической микроскопии ближнего поля (Betzig and Chichester, 1993). В их методе использовалось явление, при котором освещение небольшого отверстия диаметром меньше длины волны света приводит к тому, что свет появляется только в непосредственной близости от отверстия. Ограничив область освещения до минимума, то есть уменьшив фоновый свет от флуоресцентных зондов за пределами области наблюдения, они добились флуоресцентного изображения одиночной молекулы. После этого флуоресцентная микроскопия полного внутреннего отражения (TIRFM) также реализовала флуоресцентную визуализацию одиночных молекул, используя аналогичную стратегию (Funatsu et al. 19).95). TIRFM использует затухающие волны, которые возникают в непосредственной близости (~ 200 нм) от поверхности раздела между стеклом и водой. Таким образом, при TIRFM освещались только флуоресцентные зонды, находившиеся в пределах ~ 200 нм от поверхности стекла (Axelrod 1981). По сравнению со сканирующей микроскопией ближнего поля TIRFM проста в настройке и подходит для высокоскоростной визуализации. Для TIRFM требуется только стандартный флуоресцентный лазерный микроскоп с возможностью регулировки угла падения возбуждающего света. Кроме того, отсутствие необходимости в процессе сканирования делает TIRFM способным быстро захватывать изображения обширной области за один снимок.
Ограничив область освещения до минимума, то есть уменьшив фоновый свет от флуоресцентных зондов за пределами области наблюдения, они добились флуоресцентного изображения одиночной молекулы. После этого флуоресцентная микроскопия полного внутреннего отражения (TIRFM) также реализовала флуоресцентную визуализацию одиночных молекул, используя аналогичную стратегию (Funatsu et al. 19).95). TIRFM использует затухающие волны, которые возникают в непосредственной близости (~ 200 нм) от поверхности раздела между стеклом и водой. Таким образом, при TIRFM освещались только флуоресцентные зонды, находившиеся в пределах ~ 200 нм от поверхности стекла (Axelrod 1981). По сравнению со сканирующей микроскопией ближнего поля TIRFM проста в настройке и подходит для высокоскоростной визуализации. Для TIRFM требуется только стандартный флуоресцентный лазерный микроскоп с возможностью регулировки угла падения возбуждающего света. Кроме того, отсутствие необходимости в процессе сканирования делает TIRFM способным быстро захватывать изображения обширной области за один снимок. Эти два преимущества способствовали широкому использованию TIRFM в области визуализации одиночных молекул. Сегодня модифицированная эпифлуоресцентная микроскопия (Sase et al. 1995), конфокальная микроскопия (Ни и др., 1994), микроскопия с косым освещением (Токунага и др., 2008) и световая микроскопия (Риттер и др., 2010), которые имеют более глубокий диапазон фотовозбуждения, чем TIRFM. для визуализации одиночных молекул. Кроме того, доступность все более ярких коммерческих светодиодов означает, что лазерное осветительное оборудование больше не является необходимым условием. Эти технические достижения предоставляют множество возможностей для создания микроскопии отдельных молекул, подходящей для каждого эксперимента.
Эти два преимущества способствовали широкому использованию TIRFM в области визуализации одиночных молекул. Сегодня модифицированная эпифлуоресцентная микроскопия (Sase et al. 1995), конфокальная микроскопия (Ни и др., 1994), микроскопия с косым освещением (Токунага и др., 2008) и световая микроскопия (Риттер и др., 2010), которые имеют более глубокий диапазон фотовозбуждения, чем TIRFM. для визуализации одиночных молекул. Кроме того, доступность все более ярких коммерческих светодиодов означает, что лазерное осветительное оборудование больше не является необходимым условием. Эти технические достижения предоставляют множество возможностей для создания микроскопии отдельных молекул, подходящей для каждого эксперимента.Хотя вышеупомянутые высокоскоростные методы визуализации одиночных молекул включают методы уменьшения фонового света, необходимо ограничить концентрацию флуоресцентных зондов в растворе до наномолярного порядка, чтобы отличить отдельные молекулы друг от друга. Любые более высокие концентрации затрудняют различение отдельных молекул.
Рис. 10.1 Однако константа диссоциации большинства биомолекул находится в пределах микромолярного диапазона, что требует измерения при концентрациях, примерно в 1000 раз превышающих максимальный предел обнаружения методов TIRFM. Для решения этой проблемы были разработаны волноводы с нулевой модой (ZMW) (Левен и др., 2003). ZMW представляет собой оптический волновод, в котором используется стеклянная основа, к которой методом осаждения из паровой фазы прикрепляется металлическая пластинка с многочисленными порами диаметром менее 100 нм. В ZMW фотовозбуждаются только флуоресцентные зонды, расположенные очень близко к поверхности стекла, на глубине примерно 10–20 нм. Следовательно, метод ZMWs может различать сигналы одиночных молекул при гораздо более высоких концентрациях флуоресцентного зонда по сравнению с TIRFM (рис. 10.1). Действительно, Уемура и соавт. удалось визуализировать динамику тРНК, которая связывается и диссоциирует от одномолекулярных рибосом в присутствии флуоресцентно меченой тРНК в высокой концентрации 2 мкМ во время трансляции, тем самым разрешая давнюю загадку относительно времени связывания тРНК и диссоциации от три сайта связывания тРНК (Uemura et al.
Однако константа диссоциации большинства биомолекул находится в пределах микромолярного диапазона, что требует измерения при концентрациях, примерно в 1000 раз превышающих максимальный предел обнаружения методов TIRFM. Для решения этой проблемы были разработаны волноводы с нулевой модой (ZMW) (Левен и др., 2003). ZMW представляет собой оптический волновод, в котором используется стеклянная основа, к которой методом осаждения из паровой фазы прикрепляется металлическая пластинка с многочисленными порами диаметром менее 100 нм. В ZMW фотовозбуждаются только флуоресцентные зонды, расположенные очень близко к поверхности стекла, на глубине примерно 10–20 нм. Следовательно, метод ZMWs может различать сигналы одиночных молекул при гораздо более высоких концентрациях флуоресцентного зонда по сравнению с TIRFM (рис. 10.1). Действительно, Уемура и соавт. удалось визуализировать динамику тРНК, которая связывается и диссоциирует от одномолекулярных рибосом в присутствии флуоресцентно меченой тРНК в высокой концентрации 2 мкМ во время трансляции, тем самым разрешая давнюю загадку относительно времени связывания тРНК и диссоциации от три сайта связывания тРНК (Uemura et al. 2010). В дополнение к возможности визуализации одиночных молекул в присутствии зондов с высокой концентрацией, возможность сбора данных с высокой пропускной способностью делает ZMW заметным среди методов визуализации одиночных молекул. Большое количество мелких пор в ячейке ZMWs позволяет одновременно и параллельно получать данные о реакции одной молекулы в огромных количествах. Используя преимущества этих возможностей сбора данных с высокой пропускной способностью, один из секвенсоров третьего поколения теперь включает ZMW. Например, одномолекулярные секвенаторы Pacific Biosciences в режиме реального времени отслеживают и количественно оценивают сотни тысяч молекулярных реакций одновременно, обеспечивая таким образом пропускную способность, которая в 1–10 миллионов раз выше, чем при обычном секвенировании по Сэнгеру (Perkel 2016). Поэтому, используя ZMW, мы теперь можем получать данные о большом количестве одиночных молекул даже в присутствии флуоресцентных зондов с высокой концентрацией.
2010). В дополнение к возможности визуализации одиночных молекул в присутствии зондов с высокой концентрацией, возможность сбора данных с высокой пропускной способностью делает ZMW заметным среди методов визуализации одиночных молекул. Большое количество мелких пор в ячейке ZMWs позволяет одновременно и параллельно получать данные о реакции одной молекулы в огромных количествах. Используя преимущества этих возможностей сбора данных с высокой пропускной способностью, один из секвенсоров третьего поколения теперь включает ZMW. Например, одномолекулярные секвенаторы Pacific Biosciences в режиме реального времени отслеживают и количественно оценивают сотни тысяч молекулярных реакций одновременно, обеспечивая таким образом пропускную способность, которая в 1–10 миллионов раз выше, чем при обычном секвенировании по Сэнгеру (Perkel 2016). Поэтому, используя ZMW, мы теперь можем получать данные о большом количестве одиночных молекул даже в присутствии флуоресцентных зондов с высокой концентрацией.
Схемы типичных систем освещения с использованием флуоресцентного микроскопа
( a ) Обычное эпи-освещение. Флуоресцентные зонды (пурпурные звезды), находящиеся за пределами фокальной плоскости, также фотовозбуждаются, что затрудняет устранение фонового света. Флуоресцентные зонды, находящиеся на расстоянии 100–200 нм от поверхности стекла, фотовозбуждаются. Флуоресцентные зонды, существующие за пределами этого диапазона (белые звезды), не мешают наблюдению
( c ): Освещение нулевого режима волновода. Алюминиевая пластинка с порами диаметром около 100 нм прикрепляется к поверхности стекла методом осаждения из паровой фазы. Фотовозбуждаются только флуоресцентные зонды, находящиеся на расстоянии 10–20 нм от поверхности стекла. Эта особенность дает этой системе возможность измерять отдельные молекулы в присутствии флуоресцентных зондов при гораздо более высоких концентрациях по сравнению с флуоресцентной микроскопией полного внутреннего отражения
Полноразмерное изображение
2 Молекулярная динамика белков, измеренная с помощью smFRET
Достижения в технологии флуоресцентной визуализации одиночных молекул сделали возможным проведение измерений с помощью smFRET.
Рис. 10.2 Измерения smFRET выявили различия в поведении отдельных молекул во многих типах биореакций, опровергнув общепринятое представление о том, что молекулы в одних и тех же условиях демонстрируют однородную реакцию и динамику. Ингибирование синтеза белка, опосредованное аминогликозидными антибиотиками, представляет собой пример такого разнообразия среди сходных молекул, выявленных с помощью smFRET. Известно, что три аминогликозидных антибиотика, апрамицин, паромомицин и гентамицин, ингибируют синтез белка путем связывания с сайтом А малой субъединицы рибосомы бактерий. До недавнего времени оставалось неясным, какой этап рибосом-опосредованного процесса трансляции белков ингибируют эти антибиотики. Цай и др. исследовали шаги, ингибируемые этими антибиотиками, визуализируя поведение отдельных рибосом с помощью методов smFRET и ZMWs (Tsai et al. 2013). Основные конформационные изменения в рибосомах (вращение большой и малой субъединиц) и процессы отбора тРНК в А-сайте отслеживались с помощью smFRET в клетках ZMW.
Измерения smFRET выявили различия в поведении отдельных молекул во многих типах биореакций, опровергнув общепринятое представление о том, что молекулы в одних и тех же условиях демонстрируют однородную реакцию и динамику. Ингибирование синтеза белка, опосредованное аминогликозидными антибиотиками, представляет собой пример такого разнообразия среди сходных молекул, выявленных с помощью smFRET. Известно, что три аминогликозидных антибиотика, апрамицин, паромомицин и гентамицин, ингибируют синтез белка путем связывания с сайтом А малой субъединицы рибосомы бактерий. До недавнего времени оставалось неясным, какой этап рибосом-опосредованного процесса трансляции белков ингибируют эти антибиотики. Цай и др. исследовали шаги, ингибируемые этими антибиотиками, визуализируя поведение отдельных рибосом с помощью методов smFRET и ZMWs (Tsai et al. 2013). Основные конформационные изменения в рибосомах (вращение большой и малой субъединиц) и процессы отбора тРНК в А-сайте отслеживались с помощью smFRET в клетках ZMW. В результате Tsai et al. обнаружили, что апрамицин ингибирует транслокацию тРНК из сайта А, но не влияет на основное конформационное изменение в рибосоме, которое предшествует транслокации тРНК. Между тем, паромомицин и гентамицин индуцировали связывание незнакомых тРНК и ингибировали конформационные изменения рибосом (рис. 10.2). Эти результаты, полученные из измерений smFRET, проясняют подробные этапы синтеза белка и раскрывают различные механизмы ингибирования антибиотиков одного и того же типа.
В результате Tsai et al. обнаружили, что апрамицин ингибирует транслокацию тРНК из сайта А, но не влияет на основное конформационное изменение в рибосоме, которое предшествует транслокации тРНК. Между тем, паромомицин и гентамицин индуцировали связывание незнакомых тРНК и ингибировали конформационные изменения рибосом (рис. 10.2). Эти результаты, полученные из измерений smFRET, проясняют подробные этапы синтеза белка и раскрывают различные механизмы ингибирования антибиотиков одного и того же типа.Механизм действия аминогликозидных антибиотиков, выявленный мономолекулярным измерением FRET
В норме, когда вторая аминоацил-тРНК связывается с рибосомой, большая и малая субъединицы рибосомы вращаются. Затем следует транслокация тРНК, при этом рибосома возвращается к исходной конформации. Флуоресцентная маркировка двух субъединиц визуализирует это вращение между субъединицами. Измерения smFRET показали, что паромомицин и гентамицин ингибируют первое вращение, а апрамицин ингибирует транслокацию тРНК и второе вращение рибосомы, что возвращает рибосому в ее исходную конформацию (Tsai et al.
 2013)
2013)Изображение в полный размер
Измерение smFRET — исключительно универсальный метод, позволяющий отслеживать динамику не только рибосом, но и многих других молекул в режиме реального времени. Далее мы представляем некоторые из последних результатов, касающихся динамики РНК-управляемой эндонуклеазы Cas9, которая была признана мощным инструментом редактирования генома. Белок Cas9 связывается с одноцепочечной направляющей РНК (sgRNA) с образованием комплекса sgRNA-Cas9, который затем связывается с двухцепочечной ДНК со специфической последовательностью оснований (NGG для 9).0067 S. pyogenes Cas9), известный как мотив, прилегающий к протоспейсеру (PAM). Когда последовательность ДНК, предшествующая PAM, такая же, как и у sgRNA, комплекс Cas9 расщепляет обе цепи ДНК. Интересно, что измерения smFRET показали, что последовательности ДНК почти не влияют на скорость связывания ДНК с sgRNA-Cas9 (Singh et al. 2016). Напротив, скорость диссоциации значительно увеличивается при введении несоответствий проксимальнее последовательности PAM.
Рис. 10.3 Этот механизм, вероятно, подавляет дальнейшие реакции против нецелевых ДНК. Другой анализ smFRET выявил гетерогенность в поведении Cas9.молекул в процессе расщепления ДНК. В любых решенных на сегодняшний день кристаллических структурах тройного комплекса ДНК-sgRNA-Cas9 активный сайт нуклеазного домена HNH в Cas9 не присоединяется к сайту расщепления ДНК (Nishimasu et al. 2014; Sternberg et al. 2015; Jiang et al. др. 2016). Таким образом, было предсказано, что тройной комплекс примет дополнительные временные конформации помимо решенных кристаллических структур во время расщепления ДНК. Одномолекулярные измерения внутримолекулярного FRET между зондами в домене HNH и домене, расположенном проксимальнее сайта расщепления ДНК, показали, что тройной комплекс демонстрирует как статическую, так и флуктуирующую фазы (Osuka et al. 2018). В статической фазе домен HNH остается в незастыкованном положении ДНК, которое находится на расстоянии 3 нм от сайта расщепления ДНК в течение длительного периода времени.
Этот механизм, вероятно, подавляет дальнейшие реакции против нецелевых ДНК. Другой анализ smFRET выявил гетерогенность в поведении Cas9.молекул в процессе расщепления ДНК. В любых решенных на сегодняшний день кристаллических структурах тройного комплекса ДНК-sgRNA-Cas9 активный сайт нуклеазного домена HNH в Cas9 не присоединяется к сайту расщепления ДНК (Nishimasu et al. 2014; Sternberg et al. 2015; Jiang et al. др. 2016). Таким образом, было предсказано, что тройной комплекс примет дополнительные временные конформации помимо решенных кристаллических структур во время расщепления ДНК. Одномолекулярные измерения внутримолекулярного FRET между зондами в домене HNH и домене, расположенном проксимальнее сайта расщепления ДНК, показали, что тройной комплекс демонстрирует как статическую, так и флуктуирующую фазы (Osuka et al. 2018). В статической фазе домен HNH остается в незастыкованном положении ДНК, которое находится на расстоянии 3 нм от сайта расщепления ДНК в течение длительного периода времени. Наоборот, в флуктуирующей фазе домен HNH часто перемещается между ДНК-недостыкованными, полу-пристыкованными и компетентными при расщеплении стыкованными позициями. Поскольку комплекс расщепляет ДНК только тогда, когда HNH находится в состыкованном положении, мутации, которые дестабилизируют другие положения HNH, могут усилить нуклеазную активность Cas9.. Тот факт, что smFRET обнаружил эту временную компетентную конформацию расщепления, которая не определяется кристаллическими структурами, демонстрирует полезность smFRET в качестве аналитического инструмента для исследования полиморфизмов и флуктуаций в белковых структурах (рис. 10.3).
Наоборот, в флуктуирующей фазе домен HNH часто перемещается между ДНК-недостыкованными, полу-пристыкованными и компетентными при расщеплении стыкованными позициями. Поскольку комплекс расщепляет ДНК только тогда, когда HNH находится в состыкованном положении, мутации, которые дестабилизируют другие положения HNH, могут усилить нуклеазную активность Cas9.. Тот факт, что smFRET обнаружил эту временную компетентную конформацию расщепления, которая не определяется кристаллическими структурами, демонстрирует полезность smFRET в качестве аналитического инструмента для исследования полиморфизмов и флуктуаций в белковых структурах (рис. 10.3).Динамика домена расщепления ДНК Cas9. (Воспроизведено из Osuka et al. 2018)
Измерения smFRET показали, что нуклеазный домен HNH Cas9 принимает две разные фазы: ( a ) статическая фаза, в которой домен HNH остается неподвижным в течение длительного периода (более 100 с), и ( b ) флуктуирующая фаза, в которой домен часто перемещается между несколькими положениями (Osuka et al.
 2018). Только во время флуктуирующей фазы Cas9 принимает структуру, способную расщеплять нити ДНК. Кроме того, измерение также показало, что домену HNH необходимо временно перемещаться в неподключенное положение во время переходов между полупристыкованными и пристыкованными положениями 9.0005
2018). Только во время флуктуирующей фазы Cas9 принимает структуру, способную расщеплять нити ДНК. Кроме того, измерение также показало, что домену HNH необходимо временно перемещаться в неподключенное положение во время переходов между полупристыкованными и пристыкованными положениями 9.0005Полноразмерное изображение
3 Улучшения в методах smFRET
Методы smFRET, представленные в этой главе, получили дальнейшее развитие за счет включения других методологий. Например, предпринимаются попытки применения люминесцентных зондов для наблюдения за динамикой одиночных молекул. Люминесцентные зонды не требуют освещения, преодолевая препятствия флуоресцентной визуализации: аутофлуоресценция, фотоповреждение образцов и строгие ограничения в использовании оптогенетических инструментов. Однако низкая яркость люминесцентных зондов ограничивает применение люминесцентной визуализации. Недавно было разработано несколько ярких и многоцветных люминесцентных зондов с использованием резонансной передачи энергии от люминесцентных зондов к флуоресцентным белкам (Suzuki and Nagai 2017).
 Разработанные зонды значительно повысили чувствительность люминесцентной визуализации. В дополнение к люминесцентным зондам были разработаны различные биосенсоры с использованием метода FRET, позволяющие выяснить локализацию и динамику различных внутриклеточных молекул в чувствительности одиночных молекул.
Разработанные зонды значительно повысили чувствительность люминесцентной визуализации. В дополнение к люминесцентным зондам были разработаны различные биосенсоры с использованием метода FRET, позволяющие выяснить локализацию и динамику различных внутриклеточных молекул в чувствительности одиночных молекул.В настоящее время предпринимаются усилия по ускорению процесса измерения smFRET. В то время как обычный smFRET способен обнаруживать динамику биомолекул в пределах порядка 10–100 миллисекунд, недавнее исследование показало, что smFRET может отслеживать конформационные изменения белка на микросекундном уровне (Otosu et al. 2015). Когда происходит FRET, донорский флуоресцентный зонд показывает снижение интенсивности флуоресценции, а также укороченный цикл времени перед возвращением в основное состояние после фотовозбуждения (время жизни флуоресценции). По сравнению с обычными измерениями интенсивности измерения времени жизни требуют меньшего количества флуоресцентных фотонов для контроля эффективности FRET и, следовательно, могут улучшить временное разрешение измерений FRET.
 Исследование с использованием этого метода выявило подробный процесс конформационных изменений в белке цитохрома с с временным разрешением субмикросекунды (Otosu et al. 2015).
Исследование с использованием этого метода выявило подробный процесс конформационных изменений в белке цитохрома с с временным разрешением субмикросекунды (Otosu et al. 2015).Хотя представленные выше методы FRET основаны на маркировке образцов двумя (или более) зондами разного цвета, smFRET можно измерить с помощью флуоресцентного зонда. Использование нефлуоресцентных гасителей позволяет экспериментаторам проводить анализ, аналогичный двухцветному измерению FRET, просто измеряя интенсивность флуоресценции одного флуоресцентного зонда. При приближении флуоресцентного зонда донора к тушителю интенсивность флуоресценции снижается за счет резонансной передачи энергии от донора к тушителю. Следовательно, можно наблюдать конформационные изменения, связывание и диссоциацию меченых биомолекул, просто измеряя изменение интенсивности флуоресценции донорного зонда (Chen et al. 2012). Более того, можно измерить FRET не только между гетерологичными молекулами, но и между гомологичными зондами (называемые гомо-FRET).
 При освещении поляризованным светом только флуоресцентные зонды в определенной ориентации фотовозбуждаются и испускают поляризованную флуоресценцию. Если два идентичных флуоресцентных зонда расположены близко друг к другу из-за FRET между зондами, зонды, не находящиеся в фотовозбудимой ориентации, также излучают флуоресцентный свет, поляризованный иначе, чем свет от фотовозбужденного донорного зонда, что приводит к уменьшению анизотропии флуоресценции. Таким образом, изменения расстояния между идентичными зондами можно контролировать, измеряя компоненты поляризации флуоресценции. Этот метод гомо-FRET расширяет применение измерения FRET в исследованиях динамики биомолекул, которые могут быть помечены только одним типом флуоресцентного зонда, например, процессы олигомеризации эндогенного белка (Bader et al. 2011). Эти передовые оптические методы усовершенствовали метод smFRET, так что мы можем выяснить более детальное поведение более широкого круга биомолекул.
При освещении поляризованным светом только флуоресцентные зонды в определенной ориентации фотовозбуждаются и испускают поляризованную флуоресценцию. Если два идентичных флуоресцентных зонда расположены близко друг к другу из-за FRET между зондами, зонды, не находящиеся в фотовозбудимой ориентации, также излучают флуоресцентный свет, поляризованный иначе, чем свет от фотовозбужденного донорного зонда, что приводит к уменьшению анизотропии флуоресценции. Таким образом, изменения расстояния между идентичными зондами можно контролировать, измеряя компоненты поляризации флуоресценции. Этот метод гомо-FRET расширяет применение измерения FRET в исследованиях динамики биомолекул, которые могут быть помечены только одним типом флуоресцентного зонда, например, процессы олигомеризации эндогенного белка (Bader et al. 2011). Эти передовые оптические методы усовершенствовали метод smFRET, так что мы можем выяснить более детальное поведение более широкого круга биомолекул.4 Заключение
smFRET — особенно полезный метод для исследования поведения отдельных биомолекул.
 Его применение неуклонно расширяется за счет включения различных других оптических технологий. Сила smFRET заключается в его способности отслеживать динамические конформационные изменения и связывание/диссоциацию лигандов в условиях, близких к физиологическим, в режиме реального времени. Хотя измерения smFRET определяют только расстояния и углы между несколькими позициями, помеченными зондами FRET, этот недостаток можно компенсировать с помощью рентгеноструктурного анализа и электронно-микроскопического анализа, которые визуализируют целые структуры с высоким разрешением. Соответствующие комбинации технологий еще больше углубят наше понимание молекулярной основы биологических явлений.
Его применение неуклонно расширяется за счет включения различных других оптических технологий. Сила smFRET заключается в его способности отслеживать динамические конформационные изменения и связывание/диссоциацию лигандов в условиях, близких к физиологическим, в режиме реального времени. Хотя измерения smFRET определяют только расстояния и углы между несколькими позициями, помеченными зондами FRET, этот недостаток можно компенсировать с помощью рентгеноструктурного анализа и электронно-микроскопического анализа, которые визуализируют целые структуры с высоким разрешением. Соответствующие комбинации технологий еще больше углубят наше понимание молекулярной основы биологических явлений.Ссылки
Axelrod D (1981) Контакты клетки-субстрата, освещенные флуоресценцией полного внутреннего отражения. J Cell Biol 89(1):141–145
CrossRef КАС Google Scholar
Бадер А.
 Н., Хетцль С., Хофман Э.Г., Воортман Дж., Ван Берген и Хенегувен П.М., ван Меер Г. и др. (2011) Визуализация Homo-FRET как инструмент для количественной оценки кластеризации белков и липидов. ChemPhysChem 12(3):475–483
Н., Хетцль С., Хофман Э.Г., Воортман Дж., Ван Берген и Хенегувен П.М., ван Меер Г. и др. (2011) Визуализация Homo-FRET как инструмент для количественной оценки кластеризации белков и липидов. ChemPhysChem 12(3):475–483CrossRef КАС Google Scholar
Betzig E, Chichester RJ (1993) Отдельные молекулы, наблюдаемые с помощью сканирующей оптической микроскопии ближнего поля. Science 262(5138):1422–1425
CrossRef КАС Google Scholar
Чен Дж., Цай А., Петров А., Пуглиси Дж. Д. (2012) Нефлуоресцентные гасители для корреляции конформационной и композиционной динамики одной молекулы. J Am Chem Soc 134(13):5734–5737
CrossRef КАС Google Scholar
Funatsu T, Harada Y, Tokunaga M, Saito K, Yanagida T (1995) Визуализация отдельных флуоресцентных молекул и отдельных оборотов АТФ отдельными молекулами миозина в водном растворе.
 Природа 374(6522):555
Природа 374(6522):555CrossRef КАС Google Scholar
Цзян Ф., Тейлор Д.В., Чен Дж.С., Корнфельд Дж.Е., Чжоу К., Томпсон А.Дж. и др. (2016) Структуры комплекса R-петли CRISPR-Cas9, подготовленного для расщепления ДНК. Наука 351(6275):867–871
Перекрёстная ссылка КАС Google Scholar
Лакович Дж. Р. (2006) Принципы флуоресцентной спектроскопии. Спрингер, Нью-Йорк
CrossRef Google Scholar
Levene MJ, Korlach J, Turner SW, Foquet M, Craighead HG, Webb WW (2003) Волноводы нулевого режима для анализа одиночных молекул при высоких концентрациях. Science 299(5607):682–686
CrossRef КАС Google Scholar
Ни С., Чиу Д.Т., Заре Р.Н. (1994) Исследование отдельных молекул с помощью конфокальной флуоресцентной микроскопии.
 Science 266(5187):1018–1021
Science 266(5187):1018–1021CrossRef КАС Google Scholar
Nishimasu H, Ran FA, Hsu PD, Konermann S, Shehata SI, Dohmae N et al (2014) Кристаллическая структура Cas9 в комплексе с направляющей РНК и ДНК-мишенью. Cell 156(5):935–949
CrossRef КАС Google Scholar
Осука С., Исомура К., Каджимото С., Комори Т., Нисимасу Х., Шима Т. и др. (2018, в печати) Наблюдение за движениями гибких доменов в Cas9 в режиме реального времени. EMBO J 37 (10): e96941
Google Scholar
Otosu T, Ishii K, Tahara T (2015) Микросекундная динамика белка, наблюдаемая на уровне одной молекулы. Nat Commun 6:7685
CrossRef Google Scholar
Perkel J (2016) Элейн Мардис и Ричард Уилсон, директора Института генома Макдоннелла в Вашингтонском университете, перед секвенсором Illumina HiSeq 2000.
 BioTechniques 60(2):56–60
BioTechniques 60(2):56–60CrossRef Google Scholar
Ritter JG, Veith R, Veenendaal A, Siebrasse JP, Kubitscheck U (2010) Световая листовая микроскопия для отслеживания отдельных молекул в живой ткани. PLoS One 5(7):e11639
Перекрестная ссылка Google Scholar
Sase I, Miyata H, Corrie J, Craik JS, Kinosita K Jr (1995) Визуализация одиночных флуорофоров на движущемся актине в режиме реального времени с помощью эпифлуоресцентного микроскопа. Biophys J 69(2):323–328
CrossRef КАС Google Scholar
Шера Э.Б., Зейцингер Н.К., Дэвис Л.М., Келлер Р.А., Сопер С.А. (1990) Обнаружение одиночных флуоресцентных молекул. Chem Phys Lett 174(6):553–557
CrossRef КАС Google Scholar
Сингх Д., Штернберг С.Х., Фей Дж., Дудна Дж.
 А., Ха Т. (2016) Наблюдение в реальном времени за распознаванием и отторжением ДНК эндонуклеазой Cas9, управляемой РНК. Nat Commun 7:12778
А., Ха Т. (2016) Наблюдение в реальном времени за распознаванием и отторжением ДНК эндонуклеазой Cas9, управляемой РНК. Nat Commun 7:12778CrossRef КАС Google Scholar
Sternberg SH, LaFrance B, Kaplan M, Doudna JA (2015) Конформационный контроль расщепления ДНК-мишени с помощью CRISPR-Cas9. Природа 527(7576):110
CrossRef КАС Google Scholar
Suzuki K, Nagai T (2017) Недавний прогресс в расширении набора хемилюминесцентных инструментов для биовизуализации. Curr Opin Biotechnol 48:135–141
CrossRef КАС Google Scholar
Токунага М., Имамото Н., Саката-Согава К. (2008) Тонкое освещение с большим углом наклона обеспечивает четкое изображение отдельных молекул в клетках. Nat Methods 5(2):159
CrossRef КАС Google Scholar
Tsai A, Uemura S, Johansson M, Puglisi EV, Marshall RA, Aitken CE et al (2013) Влияние аминогликозидов на динамику элонгации трансляции.
 Cell Rep 3(2):497–508
Cell Rep 3(2):497–508CrossRef КАС Google Scholar
Uemura S, Aitken CE, Korlach J, Flusberg BA, Turner SW, Puglisi JD (2010) Транзит тРНК в реальном времени на одиночных транслирующих рибосомах при разрешении кодонов. Природа 464(7291):1012
CrossRef КАС Google Scholar
Download references
Author information
Authors and Affiliations
The University of Tokyo, Tokyo, Japan
Tomohiro Shima & Sotaro Uemura
Authors
- Tomohiro Shima
View author publications
Вы также можете искать этого автора в PubMed Google Scholar
- Sotaro Uemura
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
Автор, ответственный за корреспонденцию
Сотаро Уэмура.

Информация для редактора
Редакторы и сотрудники
Кафедра ортопедической хирургии, Университет Кейо, Медицинский факультет, Синдзюку, Токио, Япония
Проф. Функциональная динамика, Вако, Сайтама, Япония
к.т.н. Atsushi Miyawaki
Кафедра ортопедической хирургии, Университет Кэйо, Медицинский факультет, Синдзюку, Токио, Япония
Проф. Масая Накамура
Кафедра диагностической радиологии, Университет Кэйо, Медицинский факультет, Синдзюку, Токио, Япония
Профессор Масахиро Дзинзаки
Права и разрешения
Открытый доступ Эта глава распространяется под лицензией Creative Commons Attribution 4.0 International License (http://creativecommons.org/licenses/by/4.0/) , который разрешает использование, совместное использование, адаптацию, распространение и воспроизведение на любом носителе или в любом формате, при условии, что вы укажете автора(ов) оригинала и источник, предоставите ссылку на лицензию Creative Commons и укажите, были ли внесены изменения .

Изображения или другие сторонние материалы в этой главе включены в лицензию Creative Commons главы, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons главы, а предполагаемое использование вами не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от владельца авторских прав.
Перепечатка и разрешения
Информация об авторских правах
© 2020 Автор(ы)
Об этой статье
Малоугловое рассеяние рентгеновских лучей и спектроскопия FRET одиночных молекул дают сильно расходящиеся представления о развернутом состоянии с низким уровнем денатурации.
- DOI:10.1016/j.jmb.2012.01.016
- Идентификатор корпуса: 36281634
@article{Yoo2012SmallangleXS, title={Малоугловое рассеяние рентгеновских лучей и спектроскопия FRET одиночных молекул дают сильно расходящиеся представления о развернутом состоянии с низким уровнем денатурации. },
автор = {Тэ Ён Ю, Стив П. Мейсбургер, Джеймс Р. Хиншоу, Лоис Поллак, Гилад Харан, Тобин Р. Сосник и Кевин В. Пласко},
journal={Журнал молекулярной биологии},
год = {2012},
объем={418 3-4},
страницы={
226-36
}
}
},
автор = {Тэ Ён Ю, Стив П. Мейсбургер, Джеймс Р. Хиншоу, Лоис Поллак, Гилад Харан, Тобин Р. Сосник и Кевин В. Пласко},
journal={Журнал молекулярной биологии},
год = {2012},
объем={418 3-4},
страницы={
226-36
}
} - Тэ Ён Ю, С. Мейсбургер, К. Пласко
- Опубликовано 4 мая 2012 г.
Обнаружено, что SEFSR может производить незначительные изменения расстояния между красителями на основе FRET в различных растворах с интенсивностью, соответствующей ряду Хофмейстера в ионных растворах и зависящей от конфигураций маркировки.
Непротиворечивое представление о расширении полипептидной цепи в химических денатурантах, основанное на множественных экспериментальных методах.
Это первый случай, когда SAXS и FRET дали хотя бы качественно согласованные результаты относительно экспансии в денатуранте при применении к одним и тем же белкам, и этот анализ демонстрирует, что оба этих экспериментальных зонда совместимы с общим набором белковых конфигураций для каждого денатуранта.
 концентрация.
концентрация.Отрицательный контроль со случайной катушкой воспроизводит несоответствие между измерениями рассеяния и FRET размеров денатурированного белка
В этой работе исследуются причины несоответствия между белками, развернутыми в физиологических условиях, и белками, развернутыми в результате химической денатурации с использованием ПЭГ в качестве отрицательного контроля, и показано, что размеры полимера не зависят от денатурации.
Широко используемые флуорофоры FRET способствуют коллапсу неупорядоченного белка
- Joshua A. Riback, Micayla A. Bowman, A. Zmyslowski, K. Plaxco, P. Clark, T. Sosnick
Биология
- 2018
Сделан вывод, что мягкое сокращение цепи и взаимодействие на основе флуорофора при более низких концентрациях денатуранта, наряду с улучшенными процедурами анализа как SAXS, так и FRET, могут объяснить преобладание существующих данных о природе полипептидных цепей.
 разворачивается в отсутствие денатуранта.
разворачивается в отсутствие денатуранта.Широко используемые флуорофоры FRET способствуют коллапсу неупорядоченного белка
- Joshua A. Riback, Micayla A. Bowman, A. Zmyslowski, K. Plaxco, P. Clark, T. Sosnick
Биология
Proceedings of the National Academy of Sciences
- 2019
Усовершенствованные процедуры анализа и поправка на значительные взаимодействия, вызванные флуорофорами, достаточны для согласования предыдущих исследований SAXS и FRET, таким образом обеспечивая единую картину характер развернутых полипептидных цепей в отсутствие денатуранта.
Количественное описание внутренне неупорядоченных белков с использованием одномолекулярного FRET, ЯМР и SAXS
- Samuel Naudi-Fabra, Maud Tengo, M. R. Jensen, M. Blackledge, Sigrid Milles
Biology
Journal of the American Chemical Society
- 2021
- D. Kempe, M. Cerminara, S. Poblete, Antonie Schöne, Matteo Gabba, J. Fitter
Химия
Аналитическая химия
- 2017
1 902 Время жизни флуоресценции, химические сдвиги ЯМР и усиление парамагнитной релаксации (PRE), а также малоугловое рассеяние рентгеновских лучей (SAXS) для получения количественных конформационных ансамблей в соответствии со всеми параметрами.

Признаки малоуглового рассеяния рентгеновских лучей конформационной гетерогенности и гомогенности неупорядоченных белковых ансамблей.
Гетерополимерные вариации отношения РЗЭ-Rg были дополнительно продемонстрированы с использованием аналитической теории возмущений, разработанной здесь для гибких гетерополимеров, и показано, что MFF SAXS не дают уникальных характеристик основных свойств конформационных ансамблей в целом.
Универсальный характер складчатости в контексте сворачивания и эволюции белков.
Развязка флуктуаций размера и формы в гетерополимерных последовательностях устраняет расхождения в измерениях SAXS и FRET. RG и RE в сочетании с измерениями форм полимеров должны давать непротиворечивую и полную картину лежащих в их основе ансамблей.
Одномолекулярные измерения FRET в водных растворах, обогащенных добавками.
 1 9 к данным одномолекулярного FRET (smFRET) и использует подход для проверки дальнейшего уплотнения уже развернутого состояния фосфоглицераткиназы (PGK) с уменьшением концентрации денатуранта, механизм, известный как переход клубок-глобула.
1 9 к данным одномолекулярного FRET (smFRET) и использует подход для проверки дальнейшего уплотнения уже развернутого состояния фосфоглицераткиназы (PGK) с уменьшением концентрации денатуранта, механизм, известный как переход клубок-глобула. - Д. Сегель, А. Бахманн, Дж. Хофрихтер, К. Ходжсон, С. Дониах, Т. Кифхабер
Биология, химия
Журнал молекулярной биологии
- 1999
ПОКАЗАНЫ 1-10 ИЗ 56 ССЫЛОК
СОРТИРОВАТЬ ПОРелевантность Наиболее влиятельные статьиНедавность
Малоугловое рентгеновское рассеяние восстановленной рибонуклеазы А: влияние условий раствора и сравнение с вычислительной моделью развернутых белков.
Исследование малоуглового рентгеновского рассеяния с временным разрешением динамики сворачивания барназы.
Характеристика переходных промежуточных продуктов при сворачивании лизоцима с помощью малоуглового рассеяния рентгеновских лучей с временным разрешением.

Мы использовали синхротрон вместе с методами смешивания с остановленным и непрерывным потоком для мониторинга рефолдинга лизоцима при рН 5,2. Из данных, измеренных в интервале времени от 14 мс до…
Картирование коллапса белка с помощью флуоресценции одиночных молекул и спектроскопии кругового дихроизма с кинетическим синхротронным излучением
Результаты показывают, что содержание β-структуры в коллапсированном развернутом состоянии составляет ≈20% по сравнению со свернутым белком, что позволяет предположить, что коллапс может индуцировать вторичную структуру в развернутом состоянии, не мешая распределениям на большие расстояния, характерным для случайной клубки.
Одномолекулярный резонансный перенос энергии Ферстера для исследования динамики белков в денатурирующих условиях
Структура и динамика малого фермента рибонуклеазы HI (РНКазы Н) в присутствии химического денатуранта флуоресцентная микроскопия с особым акцентом на характеристику ансамбля развернутого состояния.

Поведение случайных клубков и размеры химически развернутых белков.
Похоже, что средние размеры подавляющего большинства химически денатурированных белков фактически неотличимы от средних размеров ансамбля случайных клубков.
Распределение размеров молекул в ансамбле развернутых состояний с использованием малоуглового рассеяния рентгеновских лучей и методов ЯМР с градиентом импульсного поля.
Результаты показывают, что это развернутое состояние N-концевого домена Sh4 drk (drkN Sh4), которое существует в равновесии со свернутым состоянием F(exch) в неденатурирующих условиях, является относительно компактным, со средним размером конформеров в ансамбле развернутого состояния всего на 30-40% больше, чем в структуре складчатого состояния.
Исследование малоуглового рассеяния рентгеновских лучей с временным разрешением динамики сворачивания гемоксигеназы: применение масштабного соотношения для субмиллисекундных промежуточных продуктов сворачивания белка.

