характеристика и комплектация :: SYL.ru
Самым красивым российским автомобилем современности по праву можно считать выпущенную в 2015 году модель «АвтоВАЗа», которая стала известна под названием Lada XRAY. Высокий и привлекательный хэтчбек, выполненный во внедорожном стиле, был ожидаемой новинкой. У многих автолюбителей после презентации в гараже появилась именно «Лада Х-Рей». Характеристика данной модели впечатляет, но, чтобы иметь о ней большее представление, стоит вкратце рассказать обо всех её достоинствах.
Внешность
Первым делом хотелось бы отметить дизайн модели «Лада Х-Рей». Характеристика автомобиля в эстетическом плане действительно хороша. Привлекательный хэтчбек получил оптику выразительной формы, хромированные декор-элементы и узнаваемые Х-образные выштамповки.
Удачно дополняет образ бампер с мощной накладкой, выполненной из некрашеного пластика, короткие свесы и аккуратная багажная крышка.
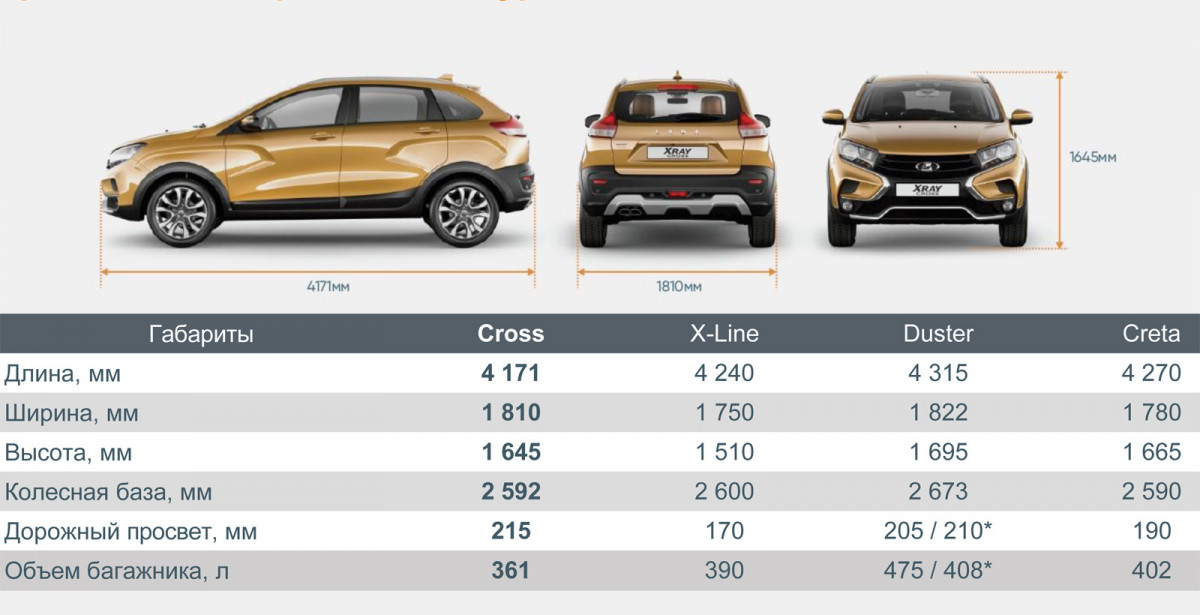
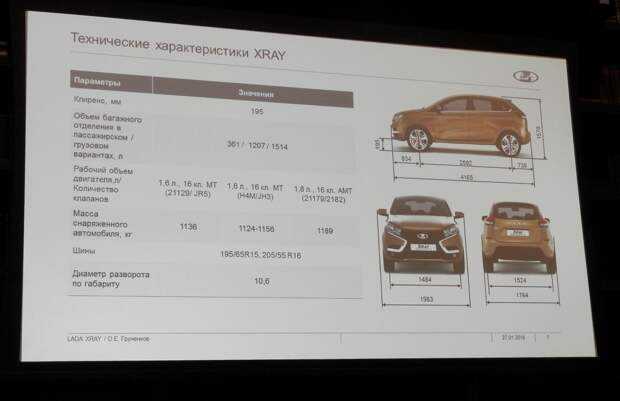
Глядя на этот автомобиль, хочется назвать его внедорожником. Но габариты этого не позволяют. В длину Lada XRAY достигает 4164 мм. Ширина автомобиля равна 1764 мм, а высота составляет 1570 мм. Зато дорожный просвет впечатляет. Клиренс у этого хэтчбека равен 19,5 см.
Но габариты этого не позволяют. В длину Lada XRAY достигает 4164 мм. Ширина автомобиля равна 1764 мм, а высота составляет 1570 мм. Зато дорожный просвет впечатляет. Клиренс у этого хэтчбека равен 19,5 см.
Внутреннее убранство
О салоне тоже стоит сказать пару слов. Поскольку он является одним из достоинств автомобиля «Лада Х-Рей». Характеристика подтверждается представленным ниже фото. Действительно, интерьер выглядит очень современно, стильно, эстетично и даже благородно.
Дизайнеры потрудились на славу, сделав салон не только интересным, но ещё и эргономичным. «Инструментарий» в хэтчбеке простой и незатейливый по своей архитектуре, но от этого не менее информативный. Все приборы утопают в глубоких «колодцах», а всю необходимую информацию водитель может считывать с широкого цветного дисплея бортового компьютера, находящегося справа. Красивый 4-спицевый руль удобно ложится в руку, а в максимальной комплектации на него помещают ещё кнопки управления функциями мультимедиа.
Что ещё есть в салоне?
Каждый человек почувствует себя комфортно в таком автомобиле, как «Лада Х-Рей». Характеристика сидений, кстати, заслуживает отдельного внимания. Поскольку именно в креслах люди проводят время, которое они находятся в машине.
В XRAY установлены удобные симпатичные сиденья с боковой поддержкой, выпуклыми подушками и большим диапазоном регулировок. Также не может не радовать наличие различных ёмкостей для хранения вещей. В дверях можно заметить объёмные карманы с подстаканниками, под пассажирским сиденьем находится большой выдвигающийся бокс, а под центральной консолью разработчики поместили несколько ниш и подстаканники. Пассажирам заднего ряда будет комфортно на грамотно спрофилированном диване. Недостатка пространства точно никто не ощутит.
Также стоит отметить вниманием переднюю панель хэтчбека. Центральную часть украшает 7-дюймовый экран мультимедийного комплекса, который окружён аккуратными вентиляционными дефлекторами. Чуть ниже размещён блок климат-контроля. Всё очень эргономично – разработчики приняли во внимание замечания автомобилистов по поводу предшественников XRAY и сделали всё, чтобы устранить недостатки.
Всё очень эргономично – разработчики приняли во внимание замечания автомобилистов по поводу предшественников XRAY и сделали всё, чтобы устранить недостатки.
Технические особенности
Их также необходимо затронуть вниманием, рассказывая про хэтчбек «Лада Х-Рей». Фото, характеристики, дизайн и оформление интерьера – это важные темы, но интересно обратиться и к основе. Данный автомобиль построен на переднеприводной платформе В0, которая была разработана альянсом Renault Nissan.
Переднюю ось разработчики комплектовали независимой подвеской «МакФерсон», а на заднюю установили полунезависимую архитектуру с балкой кручений. И естественно, модель может похвастаться эффективной тормозной системой. Спереди у неё стоит вентилируемая дисковая конструкция, а сзади — барабанная. Все детали надёжные и проверенные временем – они обеспечивают отличную управляемость и поведение на дороге.
Варианты двигателей
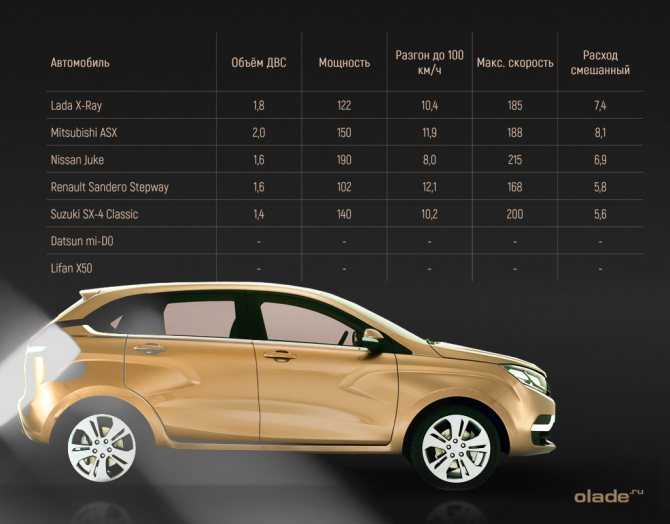
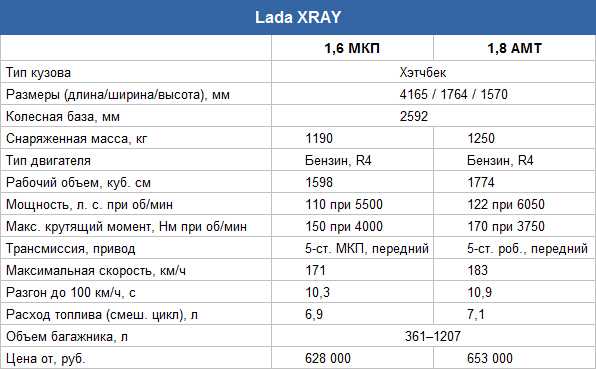
Рассказывая о том, какие имеет «Лада Х-Рей» характеристики, нельзя не затронуть тему силовых агрегатов. Всего предлагается три варианта. Базовым считается 1,6-литровый 106-сильный двигатель, работающий в тандеме с 5-ступенчатой механикой. Чтобы стрелка спидометра достигла отметки в 100 км/ч, машине потребуется 11,9 секунды. Скоростной предел хэтчбека с таким мотором составляет 170 км/ч. А расход в смешанном цикле – около 7,5 литров на 100 км.
Всего предлагается три варианта. Базовым считается 1,6-литровый 106-сильный двигатель, работающий в тандеме с 5-ступенчатой механикой. Чтобы стрелка спидометра достигла отметки в 100 км/ч, машине потребуется 11,9 секунды. Скоростной предел хэтчбека с таким мотором составляет 170 км/ч. А расход в смешанном цикле – около 7,5 литров на 100 км.
Второй предлагаемый двигатель имеет такой же объём, но вырабатывает он мощность в 114 «лошадей». И с таким агрегатом под капотом машина разгоняется до максимальных 171 км/ч. Разницы практически никакой, но зато первую сотню хэтчбек разменивает быстрее – всего за 10,3 секунды. И расход меньше. Лишь 6,9 литра топлива в смешанном цикле.
Самым лучшим двигателем является 1,8-литровый 122-сильный, который предлагается не только с 5-скоростной механикой, но ещё и с «роботом». Динамика разгона такая же, как и у предыдущего мотора, но вот максимальная скорость выше – 183 км/ч. Потребляет двигатель 7,1 литра топлива в комбинированном режиме. Модель с таким агрегатом считается топовой.
Безопасность
Важно поговорить и о том, каким оборудованием в стандартном варианте оснащается «Лада Х-Рей». Характеристики комплектации Optima, считающейся самой скромной, неплохие. В неё включено всё, что способно создать водителю и пассажирам достойный уровень безопасности.
Имеются подушки безопасности водителя и переднего пассажира, два подголовника второго ряда, крепления для детских кресел ISOFIX, блокировка задних дверей, а также автоматическое запирание их при движении и столкновении (то же самое касается передних). Помимо этого, внутри имеется охранная сигнализация, иммобилайзер, светодиодные ходовые огни, опция экстренного оповещения, защита подкапотного пространства и мотора, помощник при трогании на подъёме, противобуксовочная система, а также BAS, ABS и ESC.
В максимальной комплектации имеется всё то же самое, но с небольшими отличиями. Подголовников, например, три, а не два. И ещё есть противотуманные фары.
Другие опции
Есть ещё масса другого оборудования, наличием которого может похвастаться авто «Лада Х-Рей». Технические характеристики у данной модели неплохие, но и в плане оснащения она хороша.
Технические характеристики у данной модели неплохие, но и в плане оснащения она хороша.
В базовой комплектации Optima внутри имеется бортовой компьютер, розетка 12V, противосолнечный козырёк пассажира с зеркалом и подсказчик переключения скоростей в комбинации приборов. В максимальной, которая называется Top, к этому всему добавляется прикуриватель, футляр для очков и выдвижной ящик под сиденьем переднего пассажира. Но в топовой комплектации нет розетки.
В Optima есть ещё электрогидроусилитель регулируемого мультифункционального руля, настройки ремней безопасности, воздушный салонный фильтр, заводская тонировка, складной ключ, ЦЗ с ДУ, электростеклоподъёмники всех дверей, подогрев сидений, кондиционер, охлаждаемый вещевой ящик и аудиосистема с AUX, USB, Bluetooth и функцией Hands free. В топовой комплектации к этому прибавляется мультимедийная система с навигацией, задний парктроник, а также электропривод с подогревом наружных зеркал.
В плане экстерьера Optima от Тор практически ничем не отличается. У топовой комплектации разве что наружные ручки окрашены в цвет кузова.
У топовой комплектации разве что наружные ручки окрашены в цвет кузова.
Стоимость
Эту тему также необходимо отметить вниманием, рассказывая про технические характеристики «Лады Х-Рей». Но для начала хотелось бы оговориться, что есть ещё третий вариант комплектации. Называется люксовым. Он является золотой серединой между стандартной комплектацией и максимальной. В нём имеется всё вышеперечисленное, кроме усиленной тонировки, датчиков света и дождя, обогрева ветрового стекла и камеры заднего вида. Если это человеку необходимо, то ему надо заказывать топовую версию, известную ещё под названием TOP-PRESTIGE, в которой действительно имеется всё.
Что ж, фото и характеристики «Лады Х-Рей» представлены, теперь можно поговорить и о цене. Самый недорогой вариант предлагается за 600 т. р. За эти деньги человек получит модель с 106-сильным двигателем в базовой комплектации. Машина с этим же мотором, но с люксовым оснащением обойдётся в 710 т. р. А вот за модель в максимальной комплектации придётся отдать порядка 800 т. р. Но с топовым оснащением можно приобрести автомобиль с двигателем на 110 или 122 л. с. Младший силовой агрегат с такой комплектацией не предлагается.
р. Но с топовым оснащением можно приобрести автомобиль с двигателем на 110 или 122 л. с. Младший силовой агрегат с такой комплектацией не предлагается.
Что рассказывают владельцы?
Напоследок стоит сказать пару слов о том, какие оставляют об автомобиле «Лада Х-Рей» отзывы. Характеристика, которую можно прочитать в любом описании, действительно впечатляет, но комментарии реальных владельцев демонстрируют машину такой, какой она является.
Впрочем, плохие отзывы ещё нужно поискать. Судя по комментариям, машина демонстрирует себя как надёжное транспортное средство. Люди отмечают вниманием отличную шумоизоляцию и крепкую, комфортную подвеску. Внутри тепло даже в лютые морозы, что немаловажно, учитывая русскую зиму. Сиденья удобные, спина не затекает. И расход такой же, как и в описании. Многие люди, протестировав этот автомобиль, с удовольствием отмечают: от того ВАЗа, который был знаком всем раньше, остался только логотип. Lada XRAY – современное доказательство тому, что и машина российского производства может быть хорошей. И это не может не радовать.
И это не может не радовать.
Введение в технологию передачи энергии флуоресцентного резонанса (FRET) и ее применение в биологических науках
Скачать
Связанные продукты:
Synergy HTX
Автор : Пол Хелд, доктор философии, отдел приложений, BioTek Instruments
Флуоресцентно-резонансная передача энергии (FRET) — это физическое явление, впервые описанное более 50 лет назад, которое сегодня все больше и больше используется в биомедицинских исследованиях и разработке лекарств. FRET основан на передаче энергии от молекулы-донора к молекуле-акцептору в зависимости от расстояния. Из-за своей чувствительности к расстоянию FRET использовался для исследования молекулярных взаимодействий. FRET — это безызлучательная передача энергии от молекулы-донора к молекуле-акцептору. Молекула-донор — это краситель или хромофор, который первоначально поглощает энергию, а акцептор — это хромофор, которому впоследствии передается энергия. Это резонансное взаимодействие происходит на расстояниях, превышающих межатомные, без преобразования в тепловую энергию и без каких-либо столкновений молекул. Перенос энергии приводит к уменьшению интенсивности флуоресценции донора и времени жизни в возбужденном состоянии, а также к увеличению интенсивности излучения акцептора. Пара молекул, которые взаимодействуют таким образом, что возникает FRET, часто называют парой донор/акцептор.
Молекула-донор — это краситель или хромофор, который первоначально поглощает энергию, а акцептор — это хромофор, которому впоследствии передается энергия. Это резонансное взаимодействие происходит на расстояниях, превышающих межатомные, без преобразования в тепловую энергию и без каких-либо столкновений молекул. Перенос энергии приводит к уменьшению интенсивности флуоресценции донора и времени жизни в возбужденном состоянии, а также к увеличению интенсивности излучения акцептора. Пара молекул, которые взаимодействуют таким образом, что возникает FRET, часто называют парой донор/акцептор.
Хотя существует множество факторов, влияющих на FRET, первичных условий, которые необходимо выполнить для возникновения FRET, относительно немного. Молекулы донора и акцептора должны находиться в непосредственной близости друг от друга (обычно 10-100 Å). Спектр поглощения или возбуждения акцептора должен перекрываться со спектром флуоресценции донора (рис. 1). Степень, в которой они перекрываются, называется интегралом спектрального перекрытия (J).
Где Ro — расстояние Фёрстера, на котором передается половина энергии, а r — фактическое расстояние между донором и акцептором. Расстояние, на котором передача энергии эффективна на 50%, называется радиусом Фёрстера (Ro). Величина Ro зависит от спектральных свойств донора и акцептора. Расстояния Фёрстера от 20 до 90 Å наиболее полезны для изучения биологических макромолекул. Эти расстояния сравнимы с диаметрами многих белков, толщиной биологических мембран и расстояниями между сайтами на многосубъединичных белках.
Рис. 1. Схематическое изображение интеграла спектрального перекрытия
В качестве примера влияния расстояния на эффективность передачи энергии можно использовать произвольные числа для расстояния Фёрстера (Ro) и фактического расстояния (r). Если Ro произвольно установить равным 1 (Ro =1), а расстояние между донором и акцептором также равно 1, то r=Ro, и уравнение для эффективности будет E =1 6 /(1 6 + 1 6 ), что равно 0,5 (т. е. 50%). Это полумаксимальное значение и есть то, что определяется как расстояние Фёрстера. Если расстояние в 10 раз меньше (например, r = 0,1Ro), то E = 1 6 / (1 6 + 0,1 6 ) = 0,999999, что значительно эффективнее. Однако, если расстояние между донором и акцептором в 10 раз больше (т.е. r=10Ro), то E = 1
е. 50%). Это полумаксимальное значение и есть то, что определяется как расстояние Фёрстера. Если расстояние в 10 раз меньше (например, r = 0,1Ro), то E = 1 6 / (1 6 + 0,1 6 ) = 0,999999, что значительно эффективнее. Однако, если расстояние между донором и акцептором в 10 раз больше (т.е. r=10Ro), то E = 1
Обычно донорные и акцепторные фрагменты различаются, и в этом случае FRET можно обнаружить по появлению флуоресценции акцептора или по тушению флуоресценции донора. Донорный зонд всегда представляет собой флуоресцентную молекулу. Обратите внимание, что люминесцентные молекулы ведут себя как флуоресцентные молекулы в отношении их излучения. При соответствующем возбуждении его электроны перескакивают из основного состояния (So) на более высокий колебательный уровень.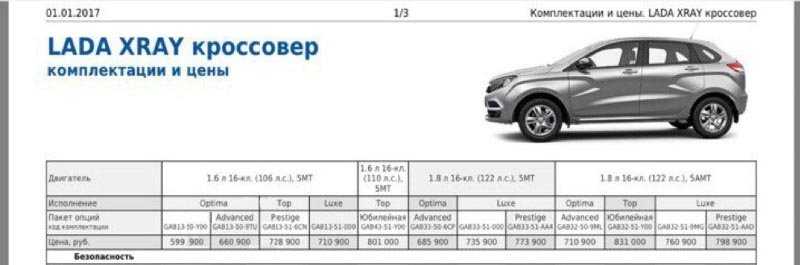 Очень быстро (в течение пикосекунд) эти электроны распадаются до самых низких колебательных уровней (S1) и, в конечном счете, (в течение наносекунд) распадаются обратно в состояние So, при этом испускается фотон света. Когда условия для возникновения FRET соблюдены, затухание флуоресценции донора и передача энергии акцептору будут конкурировать за затухание энергии возбуждения. При резонансной передаче энергии фотон НЕ излучается, а энергия передается молекуле-акцептору, электроны которой, в свою очередь, возбуждаются, как описано для молекулы-донора. Последующий возврат в основное состояние испускает фотон (рис. 2).
Очень быстро (в течение пикосекунд) эти электроны распадаются до самых низких колебательных уровней (S1) и, в конечном счете, (в течение наносекунд) распадаются обратно в состояние So, при этом испускается фотон света. Когда условия для возникновения FRET соблюдены, затухание флуоресценции донора и передача энергии акцептору будут конкурировать за затухание энергии возбуждения. При резонансной передаче энергии фотон НЕ излучается, а энергия передается молекуле-акцептору, электроны которой, в свою очередь, возбуждаются, как описано для молекулы-донора. Последующий возврат в основное состояние испускает фотон (рис. 2).
Рис. 2. Схематическое изображение колебательных энергетических состояний электрона, возникающих во время FRET.
Измерение
Обнаружение и количественное определение FRET, безусловно, может быть выполнено различными способами. Поскольку FRET может привести как к уменьшению флуоресценции донорной молекулы, так и к увеличению флуоресценции акцептора, можно провести пропорциональное определение двух сигналов.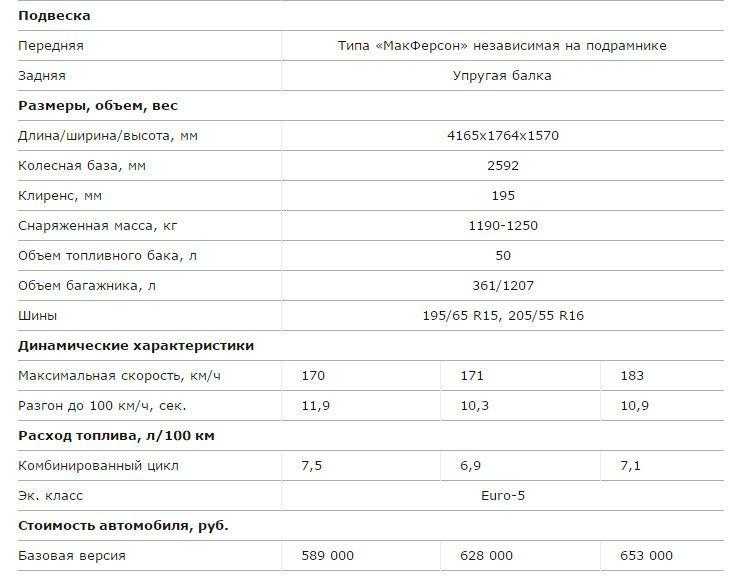
Некоторые примеры
Генетически кодируемые флуоресцентные красители, такие как зеленый флуоресцентный белок (GFP) и родственные молекулы синего, голубого, желтого и красного цветов, обеспечили способность выполнять FRET in vitro, особенно в живых клетках [2].
Рис. 3. Схематическое изображение взаимодействия двух разных химер флуоресцентных белков. Взаимодействия белок-белок между белками, помеченными A и B, приводят к тому, что синий флуоресцентный белок и зеленый флуоресцентный белок оказываются достаточно близко друг к другу, что делает возможным возникновение FRET. В этом примере возбуждение синего флуоресцентного белка приводит к испусканию флуоресценции зеленым флуоресцентным белком.
В этом примере возбуждение синего флуоресцентного белка приводит к испусканию флуоресценции зеленым флуоресцентным белком.
Органические цианиновые красители Cy3, Cy5, Cy5.5 и Cy7, излучающие в красном диапазоне (>550 нм), имеют ряд преимуществ. Диапазон их излучения таков, что фоновая флуоресценция часто снижается. Кроме того, можно измерять большие расстояния (> 100 Å) благодаря высоким коэффициентам экстинкции и хорошим квантовым выходам. Даже пары донор-акцептор с разделенными спектрами излучения (т. е. с низким интегралом перекрытия) приводят к приемлемым расстояниям Фёрстера. Например, Cy3, который максимально излучает при 570 нм, и Cy5, который излучает при 670 нм, имеют расстояние Ферстера>
50 Å. Большое расстояние между парами позволяет измерять излучение акцептора в результате FRET без помех от излучения донора. Кроме того, эти молекулы могут быть связаны непосредственно с определенными участками в синтетически полученных нуклеиновых кислотах, что позволяет использовать FRET для оценки отжига нуклеиновых кислот.
Рис. 4. Схематическое изображение FRET, возникающего между флуоресцентными фрагментами Cy3 и Cy5 при отжиге меченых олигонуклеотидов.
В примере, изображенном на рисунке 4, два комплементарных олигонуклеотида РНК помечены Cy3 и Cy5 соответственно. Когда эти меченые молекулы не отжигаются (рис. 4А), возбуждение олигонуклеотида РНК, меченного Cy3, светом при 540 нм приводит только к испусканию света Cy3 при 59 нм.0 нм, в то время как комплементарная РНК-олиго, меченная Cy5, не излучает никакого света при 590 нм или его истинной длине волны излучения 680 нм. Однако, когда двум олигонуклеотидам дают возможность отжигаться, непосредственная близость молекул позволяет осуществить перенос FRET. Это приводит к излучению света с длиной волны 680 нм, когда отожженная молекула возбуждается светом с длиной волны 540 нм. Обратите внимание, что не вся эмиссия Cy3 при 590 нм теряется, но значительная ее часть теряется.
Рисунок 5. Схематическая диаграмма активности FRET, используемая VSP
Датчики напряжения (VSP) представляют собой технологию анализа на основе переноса энергии флуоресцентного резонанса (FRET), используемую для обнаружения высокопроизводительных препаратов с ионными каналами. Донор FRET представляет собой связанный с мембраной кумарин-фосфолипид (CC2-DMPE), который связывается только с внешней стороной клеточной мембраны. Акцептор FRET представляет собой подвижный, отрицательно заряженный, гидрофобный оксонол [либо DiSBAC 2 (3), либо DiSBAC 4 (3)], который будет связываться с любой стороной плазматической мембраны в ответ на изменения мембранного потенциала (рис. 5). Именно зависимость от расстояния используется в ВСП. Только когда акцептор DISBAC 2 (3) расположен снаружи клеточной мембраны, FRET может иметь место. Покоящиеся клетки имеют относительно отрицательный потенциал, поэтому два зонда связываются с внешней стороной клеточной мембраны, что приводит к эффективному FRET. Возбуждение донорного зонда CC2-DMPE (при ~ 400 нм) генерирует сильный сигнал красной флуоресценции (при ~ 59 нм).0 нм) от оксонолового акцепторного зонда. Когда мембранный потенциал становится более положительным, как это происходит при деполяризации клеток, оксоноловый зонд быстро перемещается (в масштабе доли секунды) на другую сторону мембраны (рис. 5). Таким образом, каждый оксоноловый зонд «чувствует» изменения напряжения в клетке и реагирует на них. Эта транслокация разделяет пару FRET, поэтому возбуждение донорного зонда CC2-DMPE теперь генерирует сильный сигнал синей флуоресценции (при ~ 460 нм) от зонда CC2-DMPE. Деполяризация клетки, вызывающая DISBAC 2 (3) для перемещения на внутреннюю сторону мембраны, как ожидается, приведет к снижению активности FRET.
Возбуждение донорного зонда CC2-DMPE (при ~ 400 нм) генерирует сильный сигнал красной флуоресценции (при ~ 59 нм).0 нм) от оксонолового акцепторного зонда. Когда мембранный потенциал становится более положительным, как это происходит при деполяризации клеток, оксоноловый зонд быстро перемещается (в масштабе доли секунды) на другую сторону мембраны (рис. 5). Таким образом, каждый оксоноловый зонд «чувствует» изменения напряжения в клетке и реагирует на них. Эта транслокация разделяет пару FRET, поэтому возбуждение донорного зонда CC2-DMPE теперь генерирует сильный сигнал синей флуоресценции (при ~ 460 нм) от зонда CC2-DMPE. Деполяризация клетки, вызывающая DISBAC 2 (3) для перемещения на внутреннюю сторону мембраны, как ожидается, приведет к снижению активности FRET.
Соединения лантанидов, такие как европий и тербий, эффективно использовались в качестве доноров в реакциях FRET. Эти соединения обеспечивают очень хорошее соотношение сигнал/шум в результате их длительного периода полураспада флуоресценции и спектральных характеристик. Излучение этих соединений имеет резко пиковый профиль с большим стоксовским сдвигом от возбуждения. Кроме того, длительный период полураспада флуоресценции позволяет начинать измерения после прекращения действия возбуждающего света. Задержка между возбуждением и измерением (диапазон мс) позволяет рассеять фоновую флуоресценцию органической акцепторной молекулы с периодом полураспада в наносекундном диапазоне. Таким образом, измеряется только донорно-акцепторное излучение, когда включена соответствующая задержка.
Излучение этих соединений имеет резко пиковый профиль с большим стоксовским сдвигом от возбуждения. Кроме того, длительный период полураспада флуоресценции позволяет начинать измерения после прекращения действия возбуждающего света. Задержка между возбуждением и измерением (диапазон мс) позволяет рассеять фоновую флуоресценцию органической акцепторной молекулы с периодом полураспада в наносекундном диапазоне. Таким образом, измеряется только донорно-акцепторное излучение, когда включена соответствующая задержка.
Молекула донора не обязательно должна включать флуоресцентное соединение. Люминесцентные молекулы испускают фотоны способом, очень похожим на флуоресценцию. Основное отличие состоит в том, что электронное возбуждение является результатом не поглощения фотонов, а скорее высвобождения химической энергии, содержащейся внутри молекулы. Когда возбужденные электроны возвращаются к своей основной энергии, она может высвобождаться в виде фотона света или передаваться через RET к молекуле-акцептору, если условия правильные. Хотя количество молекул, которые можно использовать, ограничено, эта технология имеет то преимущество, что нет внешнего возбуждения молекулы-акцептора.
Хотя количество молекул, которые можно использовать, ограничено, эта технология имеет то преимущество, что нет внешнего возбуждения молекулы-акцептора.
Проблемы
При планировании экспериментов FRET необходимо учитывать ряд вопросов. Самая очевидная проблема — это близость. В зависимости от дизайна анализа близость будет либо установлена, либо удалена во время анализа, что приведет к изменению сигнала, который можно измерить. Необходимо выбрать подходящие пары донор/акцептор. Пары должны иметь достаточное спектральное перекрытие для эффективной передачи энергии, но при этом иметь достаточную разницу в спектрах, чтобы их можно было отличить друг от друга. Выбор фильтров для выбора длины волны флуоресценции также имеет решающее значение для успеха или неудачи экспериментального обнаружения FRET. Возбуждающий фильтр для донора должен избирательно возбуждать молекулу донора, сводя к минимуму прямое возбуждение молекулы акцептора. Загрязнение прямого возбуждения акцепторной молекулы можно объяснить с помощью соответствующих контролей, но большие количества затруднят интерпретацию данных. Как показано на рисунке 1, фильтры, используемые для возбуждения Cy3, сводят к минимуму возбуждение Cy5, обеспечивая при этом достаточный сигнал возбуждения для Cy3.
Загрязнение прямого возбуждения акцепторной молекулы можно объяснить с помощью соответствующих контролей, но большие количества затруднят интерпретацию данных. Как показано на рисунке 1, фильтры, используемые для возбуждения Cy3, сводят к минимуму возбуждение Cy5, обеспечивая при этом достаточный сигнал возбуждения для Cy3.
Еще одна важная проблема, связанная с обнаружением FRET, связана с концентрацией аналита. Только те молекулы, которые взаимодействуют друг с другом, приведут к FRET. Если большое количество донорных и акцепторных молекул присутствует, но не взаимодействует, количество происходящих FRET будет довольно низким. В этом примере, хотя молекулы донора и акцептора могут быть очень легко обнаружены по отдельности, фактической активности FRET может быть недостаточно для обнаружения. Что касается FRET, фактически измеряемым «аналитом» являются пары донор/акцептор, а не отдельные компоненты. Кроме того, как донорные, так и акцепторные молекулы должны быть в достаточной концентрации, чтобы произошел FRET. Большинство событий связывания представляют собой динамический процесс, который достигает устойчивого состояния. Если одного из компонентов реакции не хватает, то общее связанное количество будет, естественно, низким. Например, временные трансфекции двумя разными генетическими элементами, которые приводят к тому, что один из элементов не транслируется эффективно в белок, приведут к низким уровням FRET. Клеточная локализация также может играть роль. Если одна молекула находится в цитоплазме, а другая молекула находится в ядре, взаимодействия друг с другом не будет, несмотря на достаточное количество каждого из них.
Большинство событий связывания представляют собой динамический процесс, который достигает устойчивого состояния. Если одного из компонентов реакции не хватает, то общее связанное количество будет, естественно, низким. Например, временные трансфекции двумя разными генетическими элементами, которые приводят к тому, что один из элементов не транслируется эффективно в белок, приведут к низким уровням FRET. Клеточная локализация также может играть роль. Если одна молекула находится в цитоплазме, а другая молекула находится в ядре, взаимодействия друг с другом не будет, несмотря на достаточное количество каждого из них.
Применение FRET
- Структура и конформация белков [3]
- Пространственное распределение и сборка белков [4]
- Взаимодействие рецептор/лиганд [5]
- Иммуноанализ [6]
- Структура и конформация нуклеиновых кислот [7]
- ПЦР в реальном времени и обнаружение SNP [8,9]
- Гибридизация нуклеиновых кислот [10]
- Распределение и транспорт липидов [11]
- Анализы слияния мембран [12]
- Датчик мембранного потенциала [13, 14]
- Анализы флуорогенной протеазы [15]
- Индикаторы циклического AMP [16]
Узнайте больше о Synergy HTX
Многорежимный считыватель
Ссылки
- Фёрстер, Т.
 (1948) Межмолекулярная миграция энергии и флуоресценция Ann. Физ. 2:55-75.
(1948) Межмолекулярная миграция энергии и флуоресценция Ann. Физ. 2:55-75. - Циен, Р. (1998) Энн. Обзор Биохим, 67:509-544
- Jonsson T, Waldburger CD, Sauer RT, (1996) Нелинейные соотношения свободной энергии в разворачивании репрессора Arc подразумевают существование нестабильных, нативных промежуточных продуктов сворачивания.». Biochemistry 35:4795-4802.
- Уотсон Б.С., Хазлетт Т.Л., Экклстон Дж.Ф., Дэвис С., Джеймсон Д.М., Джонсон А.Е. (1995) Расположение макромолекул в тройном комплексе аминоацил-тРНК. фактор элонгации Tu.GTP. Исследование переноса энергии флуоресценции. Биохимия 34:7904-7912
- Berger W, Prinz H, Striessnig J, Kang HC, Haugland R, Glossmann H. (1994) Сложный молекулярный механизм связывания дигидропиридина с Ca(2+)-каналами L-типа, выявленный с помощью резонансного переноса энергии флуоресценции. Биохимия 33: 1875-11883.
- Ханна П.Л., Ульман Э.Ф. (1980) 4′,5′-Диметокси-6-карбоксифлуоресцеин: новый акцептор переноса энергии флуоресценции с диполь-дипольной связью, полезный для иммунофлуоресцентных анализов.
 Анальный биохим 108:156-161.
Анальный биохим 108:156-161. - Клегг Р.М., Мурчи А.И., Лилли Д.М. (1994) Структура раствора четырехстороннего соединения ДНК в условиях с низким содержанием соли: анализ переноса энергии флуоресцентного резонанса. Биофиз J 66:99-109.
- Ли Л.Г., Ливак К.Дж., Мулла Б., Грэм Р.Дж., Винаяк Р.С., Воуденберг ТМ. (1999) Семицветное гомогенное обнаружение шести продуктов ПЦР. Biotechniques 27:342-349.
- Мякишев М.В., Хрипин Ю., Ху С., Хамер Д.Х. 2001) Высокопроизводительное генотипирование SNP с помощью аллель-специфичной ПЦР с универсальными праймерами, меченными переносом энергии. Геном Res 11: 163-169.
- Паркхерст К.М., Паркхерст Л.Дж. (1995)Кинетические исследования переноса энергии флуоресцентного резонанса с использованием олигонуклеотида с двойной меткой: гибридизация с комплементом олигонуклеотида и с одноцепочечной ДНК. Биохимия 34:285-292.
- Николс Дж.В., Пагано Р.Э. (1983) Резонансный анализ переноса энергии белково-опосредованного переноса липидов между везикулами.
 J Biol Chem 258:5368-5371.
J Biol Chem 258:5368-5371. - Uster PS (1993) In situ резонансная микроскопия переноса энергии: мониторинг слияния мембран в живых клетках. Методы Энзимол. 221:239-246.
- Хоффман Р. и Хелд П. Примечание по применению BioTek.
- Гонсалес Дж.Э., Циен Р.Ю. (1995)Определение напряжения с помощью переноса энергии флуоресцентного резонанса в одиночных клетках. Биофиз J 69: 1272-1280.
- Matayoshi ED, Wang GT, Krafft GA, Erickson J. (1990) Новые флуорогенные субстраты для анализа ретровирусных протеаз методом резонансного переноса энергии. Science 247, 954-958.
- . Адамс С.Р. и др. (1993) Оптические зонды для циклического АМФ, флуоресцентные и люминесцентные зонды для биологической активности, Mason WT, Ed. стр. 133-149.
Молекулярная динамика, выявленная с помощью измерения FRET одиночных молекул
Abstract
Недавние достижения в области визуализации одиночных молекул привели к ряду открытий, касающихся характерного поведения и динамики отдельных молекул. Среди методов визуализации одиночных молекул измерение переноса энергии флуоресцентного резонанса (FRET) относительно легко настроить, но это мощный метод; он может визуализировать связывание и диссоциацию субстрата, а также внутримолекулярные структурные изменения в пределах одной молекулы в режиме реального времени. Здесь мы сначала рассмотрим методы визуализации флуоресценции одной молекулы, которые открывают способ установить измерение FRET одной молекулы (smFRET). Затем мы опишем два примера характерной динамики отдельных молекул, обнаруженных с помощью smFRET: ингибирование трансляции белков, опосредованное антибиотиками, и внутримолекулярные структурные изменения в CRISPR-Cas9., универсальный инструмент для редактирования генома. Наконец, мы представляем некоторые из последних достижений в технике smFRET.
Среди методов визуализации одиночных молекул измерение переноса энергии флуоресцентного резонанса (FRET) относительно легко настроить, но это мощный метод; он может визуализировать связывание и диссоциацию субстрата, а также внутримолекулярные структурные изменения в пределах одной молекулы в режиме реального времени. Здесь мы сначала рассмотрим методы визуализации флуоресценции одной молекулы, которые открывают способ установить измерение FRET одной молекулы (smFRET). Затем мы опишем два примера характерной динамики отдельных молекул, обнаруженных с помощью smFRET: ингибирование трансляции белков, опосредованное антибиотиками, и внутримолекулярные структурные изменения в CRISPR-Cas9., универсальный инструмент для редактирования генома. Наконец, мы представляем некоторые из последних достижений в технике smFRET.
Ключевые слова
- Резонансный перенос энергии флуоресценции
- Молекулярная биофизика
- Одномолекулярный FRET
- Аминогликозидные антибиотики
- Методы редактирования генов 2901Cas4 901Cas4
- CRIS90PR_
- Скачать документ конференции в формате PDF
Методы FRET широко используются для измерения динамики биомолекул из-за их высокой чувствительности в качестве наноразмерного датчика расстояния.
 Между двумя близко расположенными флуоресцентными молекулами энергия возбужденного донорного флуоресцентного зонда резонансно передается соседнему акцепторному флуоресцентному зонду, тем самым уменьшая интенсивность флуоресценции донора и увеличивая интенсивность флуоресценции акцептора. Эффективность этой передачи энергии обратно пропорциональна шестой степени расстояния между двумя флуоресцентными молекулами. Соответственно, FRET представляет собой чрезвычайно чувствительную измерительную систему для обнаружения изменений расстояния между двумя флуоресцентными зондами, особенно вокруг так называемого расстояния Фёрстера, а именно расстояния, при котором эффективность FRET составляет 0,5 (4–7 нм для пары типичных флуоресцентные зонды) (Lakowicz 2006). Таким образом, измерение FRET идеально подходит для обнаружения изменений расстояния между доменами или субъединицами в белке или нуклеиновых кислотах во время конформационных изменений. Более того, на основе соотношения интенсивностей флуоресценции двух флуоресцентных молекул можно достичь высокого отношения сигнал/шум при измерении реакций связывания и диссоциации по сравнению с измерениями с участием одной флуоресцентной молекулы.
Между двумя близко расположенными флуоресцентными молекулами энергия возбужденного донорного флуоресцентного зонда резонансно передается соседнему акцепторному флуоресцентному зонду, тем самым уменьшая интенсивность флуоресценции донора и увеличивая интенсивность флуоресценции акцептора. Эффективность этой передачи энергии обратно пропорциональна шестой степени расстояния между двумя флуоресцентными молекулами. Соответственно, FRET представляет собой чрезвычайно чувствительную измерительную систему для обнаружения изменений расстояния между двумя флуоресцентными зондами, особенно вокруг так называемого расстояния Фёрстера, а именно расстояния, при котором эффективность FRET составляет 0,5 (4–7 нм для пары типичных флуоресцентные зонды) (Lakowicz 2006). Таким образом, измерение FRET идеально подходит для обнаружения изменений расстояния между доменами или субъединицами в белке или нуклеиновых кислотах во время конформационных изменений. Более того, на основе соотношения интенсивностей флуоресценции двух флуоресцентных молекул можно достичь высокого отношения сигнал/шум при измерении реакций связывания и диссоциации по сравнению с измерениями с участием одной флуоресцентной молекулы. Эти преимущества сделали FRET широко используемым методом исследования динамики биомолекул.
Эти преимущества сделали FRET широко используемым методом исследования динамики биомолекул.Обычные объемные измерения FRET, однако, дают только средние значения измерения большого количества молекул. Следовательно, эти измерения не могут извлечь информацию о распределении нескольких молекул. Развитие технологий визуализации одиночных молекул, способных отличать интенсивность флуоресценции от отдельных молекул, преодолело это ограничение. В сочетании с методами визуализации отдельных молекул измерения FRET позволяют различать состояние каждой молекулы в режиме реального времени. Это сочетание привело к открытию различий в динамике и состояниях биомолекул в одних и тех же условиях.
В этой главе мы сначала описываем методы визуализации одиночных молекул, которые обеспечивают основу для установления измерения smFRET, затем представляем примеры исследования динамики белка с использованием smFRET и, наконец, знакомим с некоторыми современными приложениями smFRET.
1 Флуоресцентная визуализация одиночных молекул
Для обнаружения одиночных молекулярных флуоресцентных зондов с помощью оптической микроскопии требуются методы уменьшения фонового света в сочетании с интенсивным освещением и высокочувствительными системами камер.
 К концу 19В 80-х годах системы освещения и визуализации уже были усовершенствованы до такой степени, что теоретически можно было обнаруживать отдельные молекулы флуоресцентных зондов. Тем не менее, влияние фонового света от ненаблюдаемых флуоресцентных зондов остановило разработку системы, способной идентифицировать флуоресценцию одной молекулы. В 1990 году Шера и соавт. удалось различить флуоресцентные сигналы, испускаемые одной молекулой флуоресцентного зонда, используя импульсный свет, чтобы вызвать фотовозбуждение раствора флуоресцентного зонда с низкой концентрацией, протекающего через проточную кювету (Шера и др. 19).90). Однако этот метод, возможно, более подходит для классификации как проточная цитометрия, а не микроскопическая визуализация. Позже, в 1993 г., Betzig et al. проложили путь к технологии флуоресцентной визуализации одиночных молекул с помощью сканирующей оптической микроскопии ближнего поля (Betzig and Chichester 1993). В их методе использовалось явление, при котором освещение небольшого отверстия диаметром меньше длины волны света приводит к тому, что свет появляется только в непосредственной близости от отверстия.
К концу 19В 80-х годах системы освещения и визуализации уже были усовершенствованы до такой степени, что теоретически можно было обнаруживать отдельные молекулы флуоресцентных зондов. Тем не менее, влияние фонового света от ненаблюдаемых флуоресцентных зондов остановило разработку системы, способной идентифицировать флуоресценцию одной молекулы. В 1990 году Шера и соавт. удалось различить флуоресцентные сигналы, испускаемые одной молекулой флуоресцентного зонда, используя импульсный свет, чтобы вызвать фотовозбуждение раствора флуоресцентного зонда с низкой концентрацией, протекающего через проточную кювету (Шера и др. 19).90). Однако этот метод, возможно, более подходит для классификации как проточная цитометрия, а не микроскопическая визуализация. Позже, в 1993 г., Betzig et al. проложили путь к технологии флуоресцентной визуализации одиночных молекул с помощью сканирующей оптической микроскопии ближнего поля (Betzig and Chichester 1993). В их методе использовалось явление, при котором освещение небольшого отверстия диаметром меньше длины волны света приводит к тому, что свет появляется только в непосредственной близости от отверстия.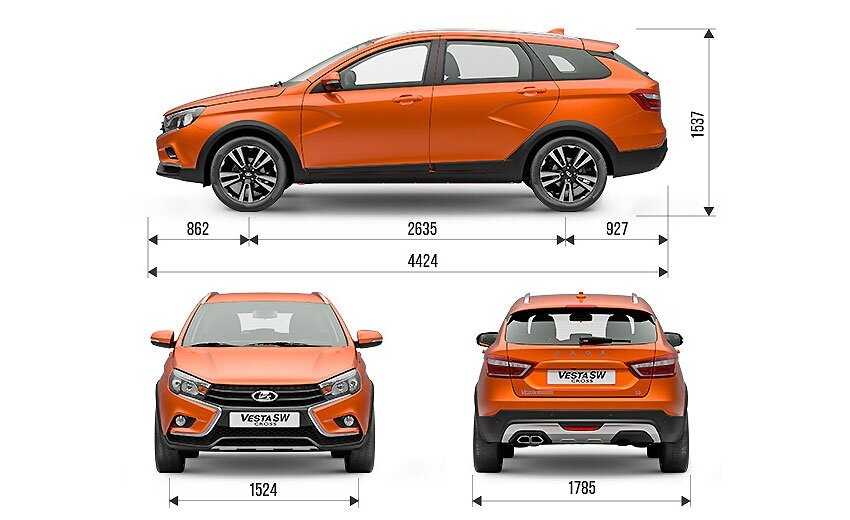 Ограничив область освещения до минимума, то есть уменьшив фоновый свет от флуоресцентных зондов за пределами области наблюдения, они добились флуоресцентного изображения одиночной молекулы. После этого флуоресцентная микроскопия полного внутреннего отражения (TIRFM) также реализовала флуоресцентную визуализацию одиночных молекул, используя аналогичную стратегию (Funatsu et al. 19).95). TIRFM использует затухающие волны, которые возникают в непосредственной близости (~ 200 нм) от поверхности раздела между стеклом и водой. Таким образом, при TIRFM освещались только флуоресцентные зонды, находившиеся в пределах ~ 200 нм от поверхности стекла (Axelrod 1981). По сравнению со сканирующей микроскопией ближнего поля TIRFM проста в настройке и подходит для высокоскоростной визуализации. Для TIRFM требуется только стандартный флуоресцентный лазерный микроскоп с возможностью регулировки угла падения возбуждающего света. Кроме того, отсутствие необходимости в процессе сканирования делает TIRFM способным быстро захватывать изображения обширной области за один снимок.
Ограничив область освещения до минимума, то есть уменьшив фоновый свет от флуоресцентных зондов за пределами области наблюдения, они добились флуоресцентного изображения одиночной молекулы. После этого флуоресцентная микроскопия полного внутреннего отражения (TIRFM) также реализовала флуоресцентную визуализацию одиночных молекул, используя аналогичную стратегию (Funatsu et al. 19).95). TIRFM использует затухающие волны, которые возникают в непосредственной близости (~ 200 нм) от поверхности раздела между стеклом и водой. Таким образом, при TIRFM освещались только флуоресцентные зонды, находившиеся в пределах ~ 200 нм от поверхности стекла (Axelrod 1981). По сравнению со сканирующей микроскопией ближнего поля TIRFM проста в настройке и подходит для высокоскоростной визуализации. Для TIRFM требуется только стандартный флуоресцентный лазерный микроскоп с возможностью регулировки угла падения возбуждающего света. Кроме того, отсутствие необходимости в процессе сканирования делает TIRFM способным быстро захватывать изображения обширной области за один снимок. Эти два преимущества способствовали широкому использованию TIRFM в области визуализации одиночных молекул. Сегодня модифицированная эпифлуоресцентная микроскопия (Sase et al. 1995), конфокальная микроскопия (Ни и др., 1994), микроскопия с косым освещением (Токунага и др., 2008) и световая микроскопия (Риттер и др., 2010), которые имеют более глубокий диапазон фотовозбуждения, чем TIRFM. для визуализации одиночных молекул. Кроме того, доступность все более ярких коммерческих светодиодов означает, что лазерное осветительное оборудование больше не является необходимым условием. Эти технические достижения предоставляют множество возможностей для создания микроскопии отдельных молекул, подходящей для каждого эксперимента.
Эти два преимущества способствовали широкому использованию TIRFM в области визуализации одиночных молекул. Сегодня модифицированная эпифлуоресцентная микроскопия (Sase et al. 1995), конфокальная микроскопия (Ни и др., 1994), микроскопия с косым освещением (Токунага и др., 2008) и световая микроскопия (Риттер и др., 2010), которые имеют более глубокий диапазон фотовозбуждения, чем TIRFM. для визуализации одиночных молекул. Кроме того, доступность все более ярких коммерческих светодиодов означает, что лазерное осветительное оборудование больше не является необходимым условием. Эти технические достижения предоставляют множество возможностей для создания микроскопии отдельных молекул, подходящей для каждого эксперимента.Хотя вышеупомянутые высокоскоростные методы визуализации одиночных молекул включают методы уменьшения фонового света, необходимо ограничить концентрацию флуоресцентных зондов в растворе до наномолярного порядка, чтобы отличить отдельные молекулы друг от друга. Любые более высокие концентрации затрудняют различение отдельных молекул.
Рис. 10.1 Однако константа диссоциации большинства биомолекул находится в пределах микромолярного диапазона, что требует измерения при концентрациях, примерно в 1000 раз превышающих максимальный предел обнаружения методов TIRFM. Для решения этой проблемы были разработаны волноводы с нулевой модой (ZMW) (Левен и др., 2003). ZMW представляет собой оптический волновод, в котором используется стеклянная основа, к которой методом осаждения из паровой фазы прикрепляется металлическая пластинка с многочисленными порами диаметром менее 100 нм. В ZMW фотовозбуждаются только флуоресцентные зонды, расположенные очень близко к поверхности стекла, на глубине примерно 10–20 нм. Следовательно, метод ZMWs может различать сигналы одиночных молекул при гораздо более высоких концентрациях флуоресцентного зонда по сравнению с TIRFM (рис. 10.1). Действительно, Уемура и соавт. удалось визуализировать динамику тРНК, которая связывается и диссоциирует от одномолекулярных рибосом в присутствии флуоресцентно меченой тРНК в высокой концентрации 2 мкМ во время трансляции, тем самым разрешая давнюю загадку относительно времени связывания тРНК и диссоциации от три сайта связывания тРНК (Uemura et al.
Однако константа диссоциации большинства биомолекул находится в пределах микромолярного диапазона, что требует измерения при концентрациях, примерно в 1000 раз превышающих максимальный предел обнаружения методов TIRFM. Для решения этой проблемы были разработаны волноводы с нулевой модой (ZMW) (Левен и др., 2003). ZMW представляет собой оптический волновод, в котором используется стеклянная основа, к которой методом осаждения из паровой фазы прикрепляется металлическая пластинка с многочисленными порами диаметром менее 100 нм. В ZMW фотовозбуждаются только флуоресцентные зонды, расположенные очень близко к поверхности стекла, на глубине примерно 10–20 нм. Следовательно, метод ZMWs может различать сигналы одиночных молекул при гораздо более высоких концентрациях флуоресцентного зонда по сравнению с TIRFM (рис. 10.1). Действительно, Уемура и соавт. удалось визуализировать динамику тРНК, которая связывается и диссоциирует от одномолекулярных рибосом в присутствии флуоресцентно меченой тРНК в высокой концентрации 2 мкМ во время трансляции, тем самым разрешая давнюю загадку относительно времени связывания тРНК и диссоциации от три сайта связывания тРНК (Uemura et al. 2010). В дополнение к возможности визуализации одиночных молекул в присутствии зондов с высокой концентрацией, возможность сбора данных с высокой пропускной способностью делает ZMW заметным среди методов визуализации одиночных молекул. Большое количество мелких пор в ячейке ZMWs позволяет одновременно и параллельно получать данные о реакции одной молекулы в огромных количествах. Используя преимущества этих возможностей сбора данных с высокой пропускной способностью, один из секвенсоров третьего поколения теперь включает ZMW. Например, одномолекулярные секвенаторы Pacific Biosciences в режиме реального времени отслеживают и количественно оценивают сотни тысяч молекулярных реакций одновременно, обеспечивая таким образом пропускную способность, которая в 1–10 миллионов раз выше, чем при обычном секвенировании по Сэнгеру (Perkel 2016). Поэтому, используя ZMW, мы теперь можем получать данные о большом количестве одиночных молекул даже в присутствии флуоресцентных зондов с высокой концентрацией.
2010). В дополнение к возможности визуализации одиночных молекул в присутствии зондов с высокой концентрацией, возможность сбора данных с высокой пропускной способностью делает ZMW заметным среди методов визуализации одиночных молекул. Большое количество мелких пор в ячейке ZMWs позволяет одновременно и параллельно получать данные о реакции одной молекулы в огромных количествах. Используя преимущества этих возможностей сбора данных с высокой пропускной способностью, один из секвенсоров третьего поколения теперь включает ZMW. Например, одномолекулярные секвенаторы Pacific Biosciences в режиме реального времени отслеживают и количественно оценивают сотни тысяч молекулярных реакций одновременно, обеспечивая таким образом пропускную способность, которая в 1–10 миллионов раз выше, чем при обычном секвенировании по Сэнгеру (Perkel 2016). Поэтому, используя ZMW, мы теперь можем получать данные о большом количестве одиночных молекул даже в присутствии флуоресцентных зондов с высокой концентрацией.
Схемы типичных систем освещения с использованием флуоресцентного микроскопа
( a ) Обычное эпи-освещение. Флуоресцентные зонды (пурпурные звезды), находящиеся вне фокальной плоскости, также фотовозбуждаются, что затрудняет устранение фонового света.
( b ) Освещение с полным внутренним отражением (ПВО). Флуоресцентные зонды, находящиеся на расстоянии 100–200 нм от поверхности стекла, фотовозбуждаются. Флуоресцентные зонды, существующие за пределами этого диапазона (белые звезды), не мешают наблюдению
( c ): Освещение нулевого режима волновода. Алюминиевая пластинка с порами диаметром около 100 нм прикрепляется к поверхности стекла методом осаждения из паровой фазы. Фотовозбуждаются только флуоресцентные зонды, находящиеся на расстоянии 10–20 нм от поверхности стекла. Эта особенность дает этой системе возможность измерять отдельные молекулы в присутствии флуоресцентных зондов при гораздо более высоких концентрациях по сравнению с флуоресцентной микроскопией полного внутреннего отражения
Полноразмерное изображение
2 Молекулярная динамика белков, измеренная с помощью smFRET
Достижения в технологии флуоресцентной визуализации отдельных молекул сделали возможным проведение измерений с помощью smFRET.
Рис. 10.2 Измерения smFRET выявили различия в поведении отдельных молекул во многих типах биореакций, опровергнув общепринятое представление о том, что молекулы в одних и тех же условиях демонстрируют однородную реакцию и динамику. Ингибирование синтеза белка, опосредованное аминогликозидными антибиотиками, представляет собой пример такого разнообразия среди сходных молекул, выявленных с помощью smFRET. Известно, что три аминогликозидных антибиотика, апрамицин, паромомицин и гентамицин, ингибируют синтез белка путем связывания с сайтом А малой субъединицы рибосомы бактерий. До недавнего времени оставалось неясным, какой этап рибосом-опосредованного процесса трансляции белков ингибируют эти антибиотики. Цай и др. исследовали шаги, ингибируемые этими антибиотиками, визуализируя поведение отдельных рибосом с помощью методов smFRET и ZMWs (Tsai et al. 2013). Основные конформационные изменения в рибосомах (вращение большой и малой субъединиц) и процессы отбора тРНК в А-сайте отслеживались с помощью smFRET в клетках ZMW.
Измерения smFRET выявили различия в поведении отдельных молекул во многих типах биореакций, опровергнув общепринятое представление о том, что молекулы в одних и тех же условиях демонстрируют однородную реакцию и динамику. Ингибирование синтеза белка, опосредованное аминогликозидными антибиотиками, представляет собой пример такого разнообразия среди сходных молекул, выявленных с помощью smFRET. Известно, что три аминогликозидных антибиотика, апрамицин, паромомицин и гентамицин, ингибируют синтез белка путем связывания с сайтом А малой субъединицы рибосомы бактерий. До недавнего времени оставалось неясным, какой этап рибосом-опосредованного процесса трансляции белков ингибируют эти антибиотики. Цай и др. исследовали шаги, ингибируемые этими антибиотиками, визуализируя поведение отдельных рибосом с помощью методов smFRET и ZMWs (Tsai et al. 2013). Основные конформационные изменения в рибосомах (вращение большой и малой субъединиц) и процессы отбора тРНК в А-сайте отслеживались с помощью smFRET в клетках ZMW. В результате Tsai et al. обнаружили, что апрамицин ингибирует транслокацию тРНК из сайта А, но не влияет на основное конформационное изменение в рибосоме, которое предшествует транслокации тРНК. Между тем, паромомицин и гентамицин индуцировали связывание незнакомых тРНК и ингибировали конформационные изменения рибосом (рис. 10.2). Эти результаты, полученные из измерений smFRET, проясняют подробные этапы синтеза белка и раскрывают различные механизмы ингибирования антибиотиков одного и того же типа.
В результате Tsai et al. обнаружили, что апрамицин ингибирует транслокацию тРНК из сайта А, но не влияет на основное конформационное изменение в рибосоме, которое предшествует транслокации тРНК. Между тем, паромомицин и гентамицин индуцировали связывание незнакомых тРНК и ингибировали конформационные изменения рибосом (рис. 10.2). Эти результаты, полученные из измерений smFRET, проясняют подробные этапы синтеза белка и раскрывают различные механизмы ингибирования антибиотиков одного и того же типа.Механизм действия аминогликозидных антибиотиков, выявленный мономолекулярным измерением FRET
В норме, когда вторая аминоацил-тРНК связывается с рибосомой, большая и малая субъединицы рибосомы вращаются. Затем следует транслокация тРНК, при этом рибосома возвращается к исходной конформации. Флуоресцентная маркировка двух субъединиц визуализирует это вращение между субъединицами. Измерения smFRET показали, что паромомицин и гентамицин ингибируют первое вращение, а апрамицин ингибирует транслокацию тРНК и второе вращение рибосомы, что возвращает рибосому в ее исходную конформацию (Tsai et al.
 2013)
2013)Изображение в натуральную величину
Измерение smFRET — исключительно универсальный метод, позволяющий отслеживать динамику не только рибосом, но и многих других молекул в режиме реального времени. Далее мы представляем некоторые из последних результатов, касающихся динамики РНК-управляемой эндонуклеазы Cas9, которая была признана мощным инструментом редактирования генома. Белок Cas9 связывается с одноцепочечной направляющей РНК (sgRNA) с образованием комплекса sgRNA-Cas9, который затем связывается с двухцепочечной ДНК со специфической последовательностью оснований (NGG для 9).0335 S. pyogenes Cas9), известный как мотив, прилегающий к протоспейсеру (PAM). Когда последовательность ДНК, предшествующая PAM, такая же, как и у sgRNA, комплекс Cas9 расщепляет обе цепи ДНК. Интересно, что измерения smFRET показали, что последовательности ДНК почти не влияют на скорость связывания ДНК с sgRNA-Cas9 (Singh et al. 2016). Напротив, скорость диссоциации значительно увеличивается при введении несоответствий проксимальнее последовательности PAM.
Рис. 10.3 Этот механизм, вероятно, подавляет дальнейшие реакции против нецелевых ДНК. Другой анализ smFRET выявил гетерогенность в поведении Cas9.молекул в процессе расщепления ДНК. В любых решенных на сегодняшний день кристаллических структурах тройного комплекса ДНК-sgRNA-Cas9 активный сайт нуклеазного домена HNH в Cas9 не присоединяется к сайту расщепления ДНК (Nishimasu et al. 2014; Sternberg et al. 2015; Jiang et al. др. 2016). Таким образом, было предсказано, что тройной комплекс примет дополнительные временные конформации помимо решенных кристаллических структур во время расщепления ДНК. Одномолекулярные измерения внутримолекулярного FRET между зондами в домене HNH и домене, расположенном проксимальнее сайта расщепления ДНК, показали, что тройной комплекс демонстрирует как статическую, так и флуктуирующую фазы (Osuka et al. 2018). В статической фазе домен HNH остается в незастыкованном положении ДНК, которое находится на расстоянии 3 нм от сайта расщепления ДНК в течение длительного периода времени.
Этот механизм, вероятно, подавляет дальнейшие реакции против нецелевых ДНК. Другой анализ smFRET выявил гетерогенность в поведении Cas9.молекул в процессе расщепления ДНК. В любых решенных на сегодняшний день кристаллических структурах тройного комплекса ДНК-sgRNA-Cas9 активный сайт нуклеазного домена HNH в Cas9 не присоединяется к сайту расщепления ДНК (Nishimasu et al. 2014; Sternberg et al. 2015; Jiang et al. др. 2016). Таким образом, было предсказано, что тройной комплекс примет дополнительные временные конформации помимо решенных кристаллических структур во время расщепления ДНК. Одномолекулярные измерения внутримолекулярного FRET между зондами в домене HNH и домене, расположенном проксимальнее сайта расщепления ДНК, показали, что тройной комплекс демонстрирует как статическую, так и флуктуирующую фазы (Osuka et al. 2018). В статической фазе домен HNH остается в незастыкованном положении ДНК, которое находится на расстоянии 3 нм от сайта расщепления ДНК в течение длительного периода времени. Наоборот, в флуктуирующей фазе домен HNH часто перемещается между ДНК-недостыкованными, полу-пристыкованными и компетентными при расщеплении стыкованными позициями. Поскольку комплекс расщепляет ДНК только тогда, когда HNH находится в состыкованном положении, мутации, которые дестабилизируют другие положения HNH, могут усилить нуклеазную активность Cas9.. Тот факт, что smFRET обнаружил эту временную компетентную конформацию расщепления, которая не определяется кристаллическими структурами, демонстрирует полезность smFRET в качестве аналитического инструмента для исследования полиморфизмов и флуктуаций в белковых структурах (рис. 10.3).
Наоборот, в флуктуирующей фазе домен HNH часто перемещается между ДНК-недостыкованными, полу-пристыкованными и компетентными при расщеплении стыкованными позициями. Поскольку комплекс расщепляет ДНК только тогда, когда HNH находится в состыкованном положении, мутации, которые дестабилизируют другие положения HNH, могут усилить нуклеазную активность Cas9.. Тот факт, что smFRET обнаружил эту временную компетентную конформацию расщепления, которая не определяется кристаллическими структурами, демонстрирует полезность smFRET в качестве аналитического инструмента для исследования полиморфизмов и флуктуаций в белковых структурах (рис. 10.3).Динамика домена расщепления ДНК Cas9. (Воспроизведено из Osuka et al. 2018)
Измерения smFRET показали, что нуклеазный домен HNH Cas9 принимает две разные фазы: ( a ) статическая фаза, в которой домен HNH остается неподвижным в течение длительного периода (более 100 с), и ( b ) флуктуирующая фаза, в которой домен часто перемещается между несколькими положениями (Osuka et al.
 2018). Только во время флуктуирующей фазы Cas9 принимает структуру, способную расщеплять нити ДНК. Кроме того, измерение также показало, что домену HNH необходимо временно перемещаться в неподключенное положение во время переходов между полупристыкованными и пристыкованными положениями 9.0009
2018). Только во время флуктуирующей фазы Cas9 принимает структуру, способную расщеплять нити ДНК. Кроме того, измерение также показало, что домену HNH необходимо временно перемещаться в неподключенное положение во время переходов между полупристыкованными и пристыкованными положениями 9.0009Полноразмерное изображение
3 Улучшения в методах smFRET
Методы smFRET, представленные в этой главе, получили дальнейшее развитие за счет включения других методологий. Например, предпринимаются попытки применения люминесцентных зондов для наблюдения за динамикой одиночных молекул. Люминесцентные зонды не требуют освещения, преодолевая препятствия флуоресцентной визуализации: аутофлуоресценция, фотоповреждение образцов и строгие ограничения в использовании оптогенетических инструментов. Однако низкая яркость люминесцентных зондов ограничивает применение люминесцентной визуализации. Недавно было разработано несколько ярких и многоцветных люминесцентных зондов с использованием резонансной передачи энергии от люминесцентных зондов к флуоресцентным белкам (Suzuki and Nagai 2017).
 Разработанные зонды значительно повысили чувствительность люминесцентной визуализации. В дополнение к люминесцентным зондам были разработаны различные биосенсоры с использованием метода FRET, позволяющие выяснить локализацию и динамику различных внутриклеточных молекул в чувствительности одиночных молекул.
Разработанные зонды значительно повысили чувствительность люминесцентной визуализации. В дополнение к люминесцентным зондам были разработаны различные биосенсоры с использованием метода FRET, позволяющие выяснить локализацию и динамику различных внутриклеточных молекул в чувствительности одиночных молекул.В настоящее время предпринимаются усилия по ускорению процесса измерения smFRET. В то время как обычный smFRET способен обнаруживать динамику биомолекул в пределах порядка 10–100 миллисекунд, недавнее исследование показало, что smFRET может отслеживать конформационные изменения белка на микросекундном уровне (Otosu et al. 2015). Когда происходит FRET, донорский флуоресцентный зонд показывает снижение интенсивности флуоресценции, а также укороченный цикл времени перед возвращением в основное состояние после фотовозбуждения (время жизни флуоресценции). По сравнению с обычными измерениями интенсивности измерения времени жизни требуют меньшего количества флуоресцентных фотонов для контроля эффективности FRET и, следовательно, могут улучшить временное разрешение измерений FRET.
 Исследование с использованием этого метода выявило подробный процесс конформационных изменений в белке цитохрома с с временным разрешением субмикросекунды (Otosu et al. 2015).
Исследование с использованием этого метода выявило подробный процесс конформационных изменений в белке цитохрома с с временным разрешением субмикросекунды (Otosu et al. 2015).Хотя представленные выше методики FRET основаны на маркировке образцов двумя (или более) зондами разного цвета, smFRET можно измерить с помощью флуоресцентного зонда. Использование нефлуоресцентных гасителей позволяет экспериментаторам проводить анализ, аналогичный двухцветному измерению FRET, просто измеряя интенсивность флуоресценции одного флуоресцентного зонда. При приближении флуоресцентного зонда донора к тушителю интенсивность флуоресценции снижается за счет резонансной передачи энергии от донора к тушителю. Следовательно, можно наблюдать конформационные изменения, связывание и диссоциацию меченых биомолекул, просто измеряя изменение интенсивности флуоресценции донорного зонда (Chen et al. 2012). Более того, можно измерить FRET не только между гетерологичными молекулами, но и между гомологичными зондами (называемые гомо-FRET).
 При освещении поляризованным светом только флуоресцентные зонды в определенной ориентации фотовозбуждаются и испускают поляризованную флуоресценцию. Если два идентичных флуоресцентных зонда расположены близко друг к другу из-за FRET между зондами, зонды, не находящиеся в фотовозбудимой ориентации, также излучают флуоресцентный свет, поляризованный иначе, чем свет от фотовозбужденного донорного зонда, что приводит к уменьшению анизотропии флуоресценции. Таким образом, изменения расстояния между идентичными зондами можно контролировать, измеряя компоненты поляризации флуоресценции. Этот метод гомо-FRET расширяет применение измерения FRET в исследованиях динамики биомолекул, которые могут быть помечены только одним типом флуоресцентного зонда, например, процессы олигомеризации эндогенного белка (Bader et al. 2011). Эти передовые оптические методы усовершенствовали метод smFRET, так что мы можем выяснить более детальное поведение более широкого круга биомолекул.
При освещении поляризованным светом только флуоресцентные зонды в определенной ориентации фотовозбуждаются и испускают поляризованную флуоресценцию. Если два идентичных флуоресцентных зонда расположены близко друг к другу из-за FRET между зондами, зонды, не находящиеся в фотовозбудимой ориентации, также излучают флуоресцентный свет, поляризованный иначе, чем свет от фотовозбужденного донорного зонда, что приводит к уменьшению анизотропии флуоресценции. Таким образом, изменения расстояния между идентичными зондами можно контролировать, измеряя компоненты поляризации флуоресценции. Этот метод гомо-FRET расширяет применение измерения FRET в исследованиях динамики биомолекул, которые могут быть помечены только одним типом флуоресцентного зонда, например, процессы олигомеризации эндогенного белка (Bader et al. 2011). Эти передовые оптические методы усовершенствовали метод smFRET, так что мы можем выяснить более детальное поведение более широкого круга биомолекул.4 Заключение
smFRET — особенно полезный метод для исследования поведения отдельных биомолекул.
 Его применение неуклонно расширяется за счет включения различных других оптических технологий. Сила smFRET заключается в его способности отслеживать динамические конформационные изменения и связывание/диссоциацию лигандов в условиях, близких к физиологическим, в режиме реального времени. Хотя измерения smFRET определяют только расстояния и углы между несколькими позициями, помеченными зондами FRET, этот недостаток можно компенсировать с помощью рентгеноструктурного анализа и электронно-микроскопического анализа, которые визуализируют целые структуры с высоким разрешением. Соответствующие комбинации технологий еще больше углубят наше понимание молекулярной основы биологических явлений.
Его применение неуклонно расширяется за счет включения различных других оптических технологий. Сила smFRET заключается в его способности отслеживать динамические конформационные изменения и связывание/диссоциацию лигандов в условиях, близких к физиологическим, в режиме реального времени. Хотя измерения smFRET определяют только расстояния и углы между несколькими позициями, помеченными зондами FRET, этот недостаток можно компенсировать с помощью рентгеноструктурного анализа и электронно-микроскопического анализа, которые визуализируют целые структуры с высоким разрешением. Соответствующие комбинации технологий еще больше углубят наше понимание молекулярной основы биологических явлений.Ссылки
Axelrod D (1981) Контакты клетки-субстрата, освещенные флуоресценцией полного внутреннего отражения. J Cell Biol 89(1):141–145
CrossRef КАС Google Scholar
Bader AN, Hoetzl S, Hofman EG, Voortman J, van Bergen en Henegouwen PM, van Meer G et al (2011)Визуализация Homo-FRET как инструмент для количественной оценки кластеризации белков и липидов.
 ChemPhysChem 12(3):475–483
ChemPhysChem 12(3):475–483CrossRef КАС Google Scholar
Betzig E, Chichester RJ (1993) Отдельные молекулы, наблюдаемые с помощью сканирующей оптической микроскопии ближнего поля. Science 262(5138):1422–1425
CrossRef КАС Google Scholar
Чен Дж., Цай А., Петров А., Пуглиси Дж. Д. (2012) Нефлуоресцентные гасители для корреляции конформационной и композиционной динамики одиночных молекул. J Am Chem Soc 134(13):5734–5737
CrossRef КАС Google Scholar
Funatsu T, Harada Y, Tokunaga M, Saito K, Yanagida T (1995) Визуализация отдельных флуоресцентных молекул и отдельных оборотов АТФ отдельными молекулами миозина в водном растворе. Природа 374(6522):555
CrossRef КАС Google Scholar
Цзян Ф., Тейлор Д.В., Чен Дж.
 С., Корнфельд Дж.Е., Чжоу К., Томпсон А.Дж. и др. (2016) Структуры комплекса R-петли CRISPR-Cas9, подготовленного для расщепления ДНК. Наука 351(6275):867–871
С., Корнфельд Дж.Е., Чжоу К., Томпсон А.Дж. и др. (2016) Структуры комплекса R-петли CRISPR-Cas9, подготовленного для расщепления ДНК. Наука 351(6275):867–871Перекрёстная ссылка КАС Google Scholar
Лакович Дж. Р. (2006) Принципы флуоресцентной спектроскопии. Спрингер, Нью-Йорк
CrossRef Google Scholar
Levene MJ, Korlach J, Turner SW, Foquet M, Craighead HG, Webb WW (2003) Волноводы нулевого режима для анализа одиночных молекул при высоких концентрациях. Science 299(5607):682–686
CrossRef КАС Google Scholar
Ни С., Чиу Д.Т., Заре Р.Н. (1994) Исследование отдельных молекул с помощью конфокальной флуоресцентной микроскопии. Science 266(5187):1018–1021
CrossRef КАС Google Scholar
Nishimasu H, Ran FA, Hsu PD, Konermann S, Shehata SI, Dohmae N et al (2014) Кристаллическая структура Cas9 в комплексе с направляющей РНК и ДНК-мишенью.
 Сотовый 156(5):935–949
Сотовый 156(5):935–949CrossRef КАС Google Scholar
Осука С., Исомура К., Каджимото С., Комори Т., Нисимасу Х., Шима Т. и др. (2018, в печати) Наблюдение за движениями гибких доменов в Cas9 в режиме реального времени. EMBO J 37 (10): e96941
Google Scholar
Otosu T, Ishii K, Tahara T (2015) Микросекундная динамика белка, наблюдаемая на уровне одной молекулы. Nat Commun 6:7685
CrossRef Google Scholar
Perkel J (2016) Элейн Мардис и Ричард Уилсон, директора Института генома Макдоннелла в Вашингтонском университете, перед секвенсором Illumina HiSeq 2000. BioTechniques 60(2):56–60
CrossRef Google Scholar
Ritter JG, Veith R, Veenendaal A, Siebrasse JP, Kubitscheck U (2010) Световая листовая микроскопия для отслеживания отдельных молекул в живой ткани.
 PLoS One 5(7):e11639
PLoS One 5(7):e11639Google Scholar
Sase I, Miyata H, Corrie J, Craik JS, Kinosita K Jr (1995) Визуализация одиночных флуорофоров на движущемся актине в режиме реального времени с помощью эпифлуоресцентного микроскопа. Biophys J 69(2):323–328
CrossRef КАС Google Scholar
Шера Э.Б., Зейцингер Н.К., Дэвис Л.М., Келлер Р.А., Сопер С.А. (1990) Обнаружение одиночных флуоресцентных молекул. Chem Phys Lett 174(6):553–557
CrossRef КАС Google Scholar
Сингх Д., Штернберг С.Х., Фей Дж., Дудна Дж.А., Ха Т. (2016) Наблюдение в реальном времени за распознаванием и отторжением ДНК эндонуклеазой Cas9, управляемой РНК. Nat Commun 7:12778
CrossRef КАС Google Scholar
Sternberg SH, LaFrance B, Kaplan M, Doudna JA (2015) Конформационный контроль расщепления ДНК-мишени с помощью CRISPR-Cas9.
 Природа 527(7576):110
Природа 527(7576):110CrossRef КАС Google Scholar
Suzuki K, Nagai T (2017) Недавний прогресс в расширении набора хемилюминесцентных инструментов для биовизуализации. Curr Opin Biotechnol 48:135–141
CrossRef КАС Google Scholar
Токунага М., Имамото Н., Саката-Согава К. (2008) Тонкое освещение с большим наклоном обеспечивает четкое изображение отдельных молекул в клетках. Nat Methods 5(2):159
CrossRef КАС Google Scholar
Tsai A, Uemura S, Johansson M, Puglisi EV, Marshall RA, Aitken CE et al (2013) Влияние аминогликозидов на динамику элонгации трансляции. Cell Rep 3(2):497–508
CrossRef КАС Google Scholar
Uemura S, Aitken CE, Korlach J, Flusberg BA, Turner SW, Puglisi JD (2010) Транзит тРНК в реальном времени на одиночных транслирующих рибосомах при разрешении кодонов.
 Природа 464(7291):1012
Природа 464(7291):1012CrossRef КАС Google Scholar
Download references
Author information
Authors and Affiliations
The University of Tokyo, Tokyo, Japan
Tomohiro Shima & Sotaro Uemura
Authors
- Tomohiro Shima
View author publications
Вы также можете искать этого автора в PubMed Google Scholar
- Sotaro Uemura
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
Автор, ответственный за корреспонденцию
Сотаро Уэмура.
Информация для редактора
Редакторы и сотрудники
Кафедра ортопедической хирургии, Университет Кэйо, Медицинский факультет, Синдзюку, Токио, Япония
Проф. Функциональная динамика, Вако, Сайтама, Япония
к.
 т.н. Atsushi Miyawaki
т.н. Atsushi MiyawakiКафедра ортопедической хирургии, Университет Кэйо, Медицинский факультет, Синдзюку, Токио, Япония
Проф. Масая Накамура
Кафедра диагностической радиологии, Университет Кэйо, Медицинский факультет, Синдзюку, Токио, Япония
Профессор Масахиро Дзинзаки
Права и разрешения
Открытый доступ Эта глава распространяется под лицензией Creative Commons Attribution 4.0 International License (http://creativecommons.org/licenses/by/4.0/) , который разрешает использование, совместное использование, адаптацию, распространение и воспроизведение на любом носителе или в любом формате, при условии, что вы укажете автора(ов) оригинала и источник, предоставите ссылку на лицензию Creative Commons и укажите, были ли внесены изменения .
Изображения или другие сторонние материалы в этой главе включены в лицензию Creative Commons главы, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons главы, а предполагаемое использование вами не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от владельца авторских прав.