Быстрая реакция: Зачем нужны катализаторы
- Наука
- / Химия
2 мая 2019 г. | Автор: Евгений Фёдоров
Быстрая реакция: Зачем нужны катализаторы
Без универсальных ускорителей мир вокруг нас превратился бы в замедленное кино. Не образуя химических связей с реагирующими веществами, катализаторы искусно управляют динамикой реакций.
Эта статья была опубликована в журнале OYLA №11(39). Оформить подписку на печатную и онлайн-версию можно здесь.
Рабочая лошадка химии
Что мешает веществам реагировать самостоятельно и обходиться без катализаторов? Энергия активации. Молекулам исходных веществ необходимо преодолеть её для запуска взаимодействия. Катализатор же снижает эту энергию.
Химические ускорители различаются по эффективности, избирательности, а также по масштабам воздействия — от отдельных атомов до гигантских белков-ферментов. Катализатор может выбрать две или более молекул, которым нужна помощь в осуществлении реакции. Он запускает процесс без образования химических связей, после чего отрывается от продукта и прикрепляется к новым молекулам.
Впрочем, есть способ обойтись без катализаторов. В промышленном производстве можно точно настроить температуру, подобрать концентрацию веществ, давление и время контакта реагентов — всё это помогает ускорить процесс, но дорого стоит и очень сложно.
В некоторых ситуациях без катализаторов вообще не обойтись. К примеру, получение аммиака из азота и водорода возможно только при температуре не более 6000°С, а для разрыва тройной связи в молекуле N2 требуются бóльшие температуры.
Использование химических катализаторов ещё и экологично. Без них реакции пришлось бы ускорять путём повышения температуры и давления. А это означает сжигание миллионов тонн топлива, что неизбежно увеличило бы вредные выбросы в атмосферу.
Катализаторы позволили значительно снизить расход реагентов. Например, раньше эпоксиэтилен С2H4O, важный компонент для синтеза антифриза, получали в три стадии — вместе с вредными побочными продуктами. Катализатор (серебро, активированное хлором) позволил уменьшить количество стадий до одной, а из вредных выбросов осталось лишь немного CO2. Катализаторы применяются в 85–90% промышленных химических процессов: от пищевой индустрии до каталитической переработки нефти.
Катализ и чёрное золото
Транспортировка реактора гидроочистки нефти
Доля тяжёлых остатков нефти (их ещё называют «дно бочки») в добыче жидких углеводородов со временем будет увеличиваться.
Нефтяные ресурсы истощаются: лёгкой нефти становится всё меньше — приходится выкачивать тяжёлую и высоковязкую. Ключевую роль в её переработке играют катализаторы. Увеличение выхода бензина из тяжёлых остатков (мазут) всего на 1% снизит потребность США в импорте нефти на миллионы баррелей в год!
Рециркуляция отработанных газов
EGR (Exhaust Gas Recirculation) — система в двигателях внутреннего сгорания, направляющая отработанные выхлопные газы обратно в цилиндры. Это делается для снижения расхода топлива и количества вредных выбросов.
Дело в том, что при сгорании топлива азот «крадёт» кислород из топливной смеси. А это уменьшает экономичность и мощность мотора. Повторная подача в цилиндры охлаждённых выхлопных газов снижает температуру — кислород перестаёт реагировать с азотом. В итоге падает расход топлива и количество вредных выбросов, а каталитический нейтрализатор работает эффективнее.
AdBlue
Для селективной нейтрализации вредных выхлопов применяют мочевину (NH
2)2CO3. Этот способ получил название AdBlue. Система впрыскивает мочевину порциями в горячий выпускной тракт дизельного двигателя, где она сразу же разлагается:
Этот способ получил название AdBlue. Система впрыскивает мочевину порциями в горячий выпускной тракт дизельного двигателя, где она сразу же разлагается:
(NH
2)2CO3 = NH3 + HNCO.Далее аммиак Nh4 нейтрализует оксиды азота:
NO + NO
2 + 2NH3 = 2N2 + 3H2O.
Преимущество такого метода в возможности использования в дизельных моторах, выхлопные газы которых бедны кислородом, отчего использование трёхкомпонентных каталитических нейтрализаторов становится невозможно.
Помимо экономической выгоды стоит сказать и об экологической: одно только удаление серы и азота снижает токсичность выхлопных газов автомобилей в несколько раз. В воздух перестают попадать серная кислота и ядовитые оксиды, образующиеся в цилиндрах двигателей внутреннего сгорания.
Катализатор гидроочистки
Для удаления атомов N и S и внедрения атомов Н используют катализаторы гидроочистки нефти. Типичным примером такого соединения является дисульфид молибдена MoS
2 с кобальтом или никелем, покрытый оксидом алюминия Al2O3. Самые стойкие к гидрированию молекулы приходится атаковать дорогостоящими катализаторами, в которых молибден заменён на вольфрам.
Типичным примером такого соединения является дисульфид молибдена MoS
2 с кобальтом или никелем, покрытый оксидом алюминия Al2O3. Самые стойкие к гидрированию молекулы приходится атаковать дорогостоящими катализаторами, в которых молибден заменён на вольфрам.
Дисульфид молибдена
Против термически стабильных серосодержащих молекул в составе нефти применяются вещества на основе палладия и платины. Механика работы таких катализаторов достаточно проста: они приближаются к органической молекуле, содержащей серу, отрывают её, присоединяют к собственному атому металла, а затем отпускают его на свободу в виде сероводорода. При этом химики до сих пор не изучили все тонкости каталитической гидроочистки нефти. А постоянное ужесточение требований к содержанию серы в бензине с каждым днём делает это направление науки всё более актуальным.
Ферменты (Каталитические клубки)
Высокоточными природными катализаторами являются белки-ферменты, или энзимы. Их активность зависит от конфигурации клубка, в который сворачивается молекула. Существует 6 классов ферментов.
Их активность зависит от конфигурации клубка, в который сворачивается молекула. Существует 6 классов ферментов.
Оксиредуктазы отвечают за окисление и восстановление веществ.
Гидролазы участвуют в гидролитическом разрушении химических связей.
Лиазы — агрессивные катализаторы, разрывающие связи без гидролиза.
Лигазы — ферменты-строители, способные формировать химические связи.
Изомеразы отвечают за преобразование структуры молекул и изомеризацию.
Защитники природы
Заслуги катализаторов перед экологией не сводятся к перечисленным выше. Существует целая группа химических ускорителей, отвечающих непосредственно за чистоту воздуха (их называют каталитическими нейтрализаторами). Их задача — связывать угарный газ, оксиды азота и серы, а также недогоревшие органические соединения различной природы. Весь этот букет присутствует в выхлопных газах автомобилей и дымах промышленных предприятий. Каталитические нейтрализаторы превращают эти яды в менее токсичные вещества типа H
2, умеренно вредный углекислый газ CO2 и уж совсем нейтральную воду.
Весь этот букет присутствует в выхлопных газах автомобилей и дымах промышленных предприятий. Каталитические нейтрализаторы превращают эти яды в менее токсичные вещества типа H
2, умеренно вредный углекислый газ CO2 и уж совсем нейтральную воду.
Оксид ванадия под микроскопическим увеличением
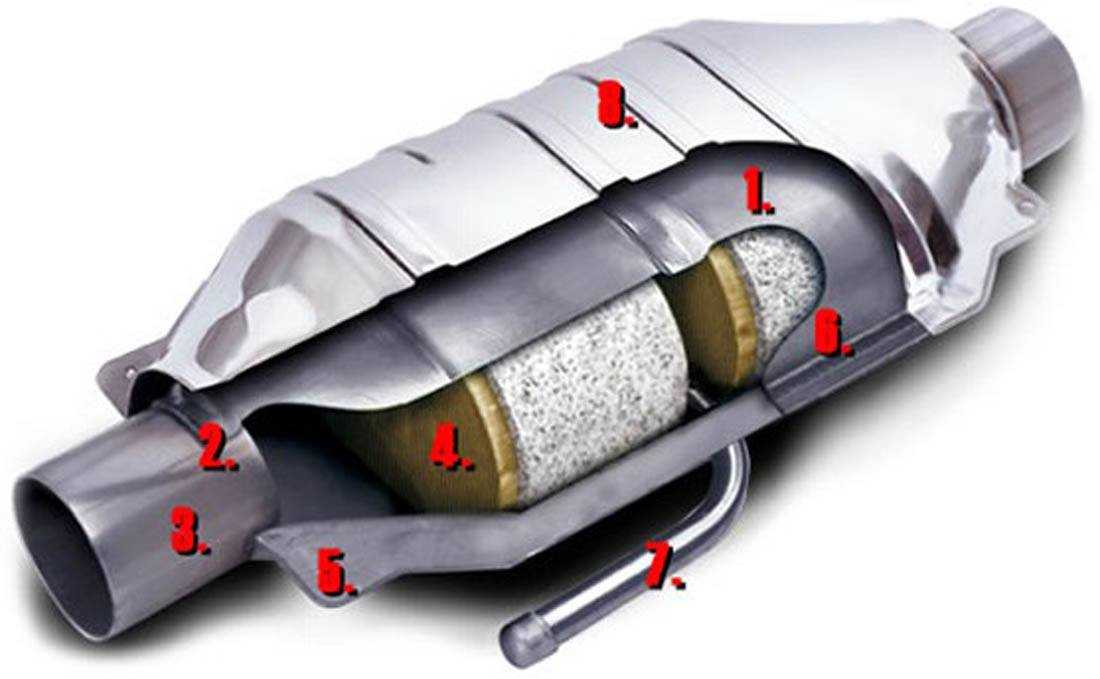
Трёхкомпонентный каталитический нейтрализатор стал чрезвычайно удачным образцом химического инжиниринга и ставится сейчас практически в каждый автомобиль. На пористом керамическом монолите, покрытом тонким слоем платины и родия, проходят трансформацию три главных загрязнителя: CO, NO и несгоревшие углеводороды. Реакции выглядят так:
СО + О
2 = СО2С
xHy + O2 = CO2NO + CO = N
2 + CO2.
Доля кислорода в этих процессах должна регулироваться, потому что его избыток может пойти на полное окисление угарного газа, и, как следствие, оксиды азота останутся в составе выхлопных газов.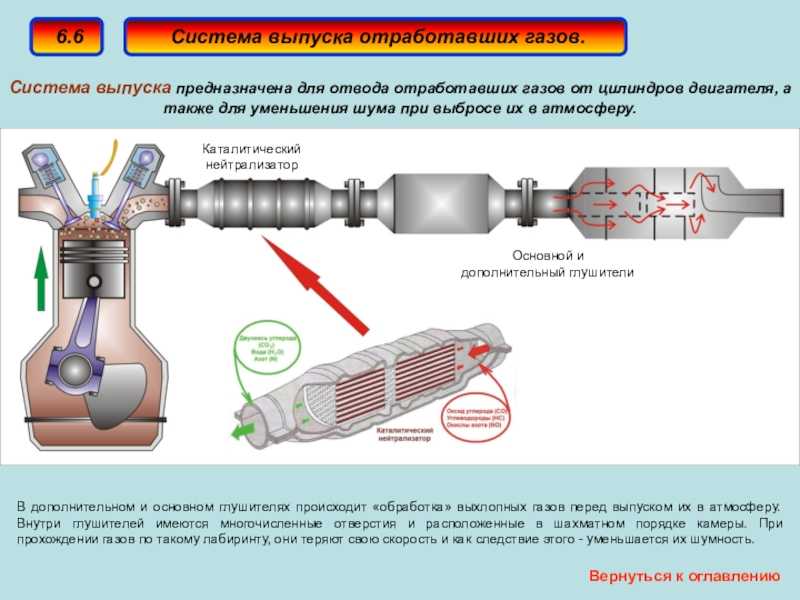 Уровень кислорода контролируется лямбда-зондом, который подаёт корректирующие сигналы двигателю о составе топливно-воздушной смеси. Оптимальным является соотношение воздуха и топлива в пропорции 14,7:1.
Уровень кислорода контролируется лямбда-зондом, который подаёт корректирующие сигналы двигателю о составе топливно-воздушной смеси. Оптимальным является соотношение воздуха и топлива в пропорции 14,7:1.
Рабочий диапазон каталитического нейтрализатора лежит в пределах от 3500 до 6500°С, что создаёт трудности при холодном запуске двигателя.
Нейтрализатор
Автомобильные нейтрализаторы впервые внедрили в массовое производство в США в 1975 году. Это стало одной из мер по борьбе с удушающими смогами, которые накрывали мегаполисы с их избытком автомобилей.
Непрогретый катализатор не выполняет защитную функцию, и в воздух попадают все три токсичных отхода: СO, NO и С xHy. Именно поэтому в некоторых странах (к примеру, скандинавских) запрещено прогревать мотор на холостых оборотах — только в движении. Так быстрее.
Промышленные выбросы, содержащие оксид серы SO
2, стали причиной кислотных дождей во второй половине XX века.
Экологические последствия кислотных дождей
Многие промышленные предприятия стали попутно серную кислоту производить! Бороться с NО x в дымовых трубах пришлось более сложными методами — добавляя восстановитель-аммиак и катализатор на основе оксидов титана и ванадия. Каталитическая реакция в полном виде:
4NH
3 + 4NO + O2 = 4N2 + 6H2O.Каталитическая химия находится в зените славы — её достижения экономят гигантские ресурсы и помогают бережно относиться к природе. В то же время это одна из самых сложных и малоизученных областей химии, а значит, главные каталитические прорывы ещё впереди.
Тэги:
химиянефтьнефтехимияпроизводствонефтепереработка
зачем, почему, нужен ли он вообще
Главная страницаАвтоблогКатализатор в автомобиле: зачем, почему, нужен ли он вообще
Катализатор в автомобиле: зачем, почему, нужен ли он вообще
02. 02.2021
02.2021
14
Катализатор служит для очистки вредных выхлопов. Он расположен в системе выпуска, в процессе его работы происходят химические реакции: опасные вещества переходят в безопасные формы, после чего выбрасываются вместе с выхлопом. И, как результат, автомобиль наносит меньший вред окружающей среде.
Как определить неисправность?
Определить неисправность можно по нескольким признакам:
- На панели приборов загорелась лампочка “Check Engine”.
- Снижение мощности двигателя. При неисправном катализаторе машина начинает троить, дергаться, хуже разгоняется.
- Грохот под днищем. Обычно проявляется на высоких оборотах, изредка сразу после запуска.
- Недостаточно сильный или ровный напор газов из глушителя.
Катализатор не выходит из строя резко и неожиданно. Обычно перед отказом начинаются мелкие проблемы из списка выше
Почему не стоит его «вырезать»?
Нужно ли это Вам? Есть достаточно способов обмануть датчик, чтобы двигатель работал более-менее стабильно, но минусов от этого больше, чем плюсов, а это:
- Постоянная выдача ошибок.
- Невозможность пройти СТО.
- Нарушаются нормальные циклы работы мотора и много ещё чего неприятного.
Заключение
В случае возникновения проблем с катализатором, необходимо его заменить. В случае игнорирования, получение диагностической карты становится невозможным, а также создаётся дополнительная нагрузка на экологию и ваш автомобиль.
Понравилась статья? Делитесь в соцсетях!
Вам может быть интересно!
Обслуживание автомобиля после зимы — что нужно проверить?
Специалисты рекомендуют после зимней эксплуатации осуществлять внеплановое техническое обслуживание автомобиля.
Далее
05.04.2021
0
Как подготовить автомобиль к путешествию?
Многие выбирают путешествовать на собственном автомобиле, но прежде чем отправиться в дальнюю поездку, необходимо обязательно выполнить техобслуживание, чтобы предупредить всевозможные поломки непредвиденные…
Далее
15. 06.2021
06.2021
0 0
Что делать, если залило свечи?
Заливает свечи в результате того, что топливо поступает в камеру сгорания, а воспламенения не происходит. Таким образом свечи заливает горючим и дальнейший запуск мотора становится невозможным. Основными причинами появления проблем с воспламенением топлива являются
Далее
12.08.2019
127 0
Тормозная система автомобиля: устройство и работа
Конечно же, важно регулярно следить за состоянием тормозной системы, осуществлять своевременную замену тормозных колодок и всех расходных материалов. Только таким образом можно обеспечить безопасное управление…
Далее
28.04.2021
0 0
Что входит в диагностику и ремонт ходовой части авто?
Проводить диагностику ходовой части транспортного средства специалисты рекомендуют каждые 10-15 км пробега, но в случае частой эксплуатации автомобиля по бездорожью эту процедуру стоит проводить почаще. Важно…
Важно…
Далее
13.07.2021
0 0
Катализатор в автомобиле: зачем, почему, нужен ли он вообще
Катализатор служит для очистки вредных выхлопов. Он расположен в системе выпуска, в процессе его работы происходят химические реакции: опасные вещества переходят в безопасные формы, после чего выбрасываются вместе с выхлопом. И, как результат, автомобиль наносит меньший вред окружающей среде.
Далее
02.02.2021
14 0
Почему важны катализаторы? — Advanced ChemTech
Скорее всего, вы уже слышали о катализаторах. Но знаете ли вы, что они собой представляют и для чего используются?
Эти вещества используются для ускорения химических реакций. Например, никель используется при гидрогенизации пальмового масла в маргарин, катализатор расщепляет бумажную массу, чтобы сделать ее гладкой, а другие катализаторы используются в процессе производства для уменьшения образования вредных побочных продуктов, токсинов и химических веществ.
Использование катализатора для многочисленных химических реакций имеет ряд преимуществ. Вы можете не только ускорить реакцию, но и уменьшить количество вредных побочных продуктов, создать новые продукты и вещества и лучше контролировать результат конечного продукта.
Итак, имея это в виду, в оставшейся части этой статьи мы обсудим, почему катализаторы важны, как они работают в отношении химических реакций и живых организмов и многое другое.
Как работает катализатор?
Итак, знайте, что вы знаете, что такое катализатор и что они используются во многих химических реакциях — как они на самом деле работают?
Во время химической реакции молекулы разрывают химические связи между атомами. Новые связи также образуются с другими атомами. Для протекания любой химической реакции необходима определенная энергия активации.
Чем выше требуемая энергия, тем больше времени потребуется для завершения реакции от начала до конца.
Но когда вы вводите катализатор, вы можете ускорить реакцию, разрушая и перестраивая атомы и структуры за счет снижения необходимой энергии активации.
Это ключ к пониманию катализа.
Проще говоря, катализаторы помогают молекулам разрывать химические связи между атомами и образовывать новые связи с другими атомами намного быстрее, чем без использования катализатора.
Почему катализаторы играют важную роль в химических реакциях?
Когда происходит химическая реакция, связи между атомами разрываются, перестраиваются и перестраиваются, образуя новые молекулы.
Как упоминалось ранее, когда вы вводите катализатор в химическую реакцию, энергия активации снижается. Это облегчает разрушение атомов и образование новых химических связей для производства новых веществ, элементов и продуктов.
Но почему они важны именно в химических реакциях?
Помимо ускорения химической реакции, они более энергоэффективны, а также могут уменьшить количество нежелательных побочных продуктов за счет процесса, называемого селективностью. Это позволяет производить новые материалы и продукты с меньшим количеством негативных побочных эффектов для совершенно новых применений.
В основном известно, что нежелательные побочные эффекты традиционных химических реакций вредны для окружающей среды, будь то вредные токсины или повышенный расход энергии.
Использование катализаторов в химии изменило способ производства многих химикатов и других продуктов. Например, теперь мы можем создавать экологически чистые источники топлива, удобрения и даже биоразлагаемые пластмассы.
Это означает, что мы можем не только создавать лучшие продукты, но и заботиться об окружающей среде и уменьшать количество вредных побочных продуктов, которым мы подвергались ранее. Это победа, победа.
Почему катализаторы важны для живых организмов?
Знаете ли вы, что человеческий организм тоже работает на катализаторах? Это белки, известные как ферменты, которые помогают вам двигаться, переваривать пищу и вырабатывать энергию. Сказать, что катализаторы фундаментальны, было бы преуменьшением.
Использование катализаторов для многих реакций может помочь сделать вещи более экологичными — они также лучше для живых организмов.
Например, использование катализаторов может помочь производить меньше токсичных побочных продуктов, включая пестициды, топливо и чрезмерный расход энергии, что вредно для окружающей среды. Только подумайте о белых медведях.
Таким образом, причины использования катализатора, как правило, двоякие: вы сокращаете время, необходимое для протекания химической реакции, и вы уменьшаете количество вредных и потенциально токсичных побочных продуктов, образующихся в результате реакции.
Связанный: Каковы наилучшие способы уменьшить глобальное потепление?
В заключение
Хотя вы, вероятно, никогда не задумывались о катализаторах со времен уроков естествознания, они являются неотъемлемой частью жизни.
Верно: они не только используются в организме для многих химических реакций, но и ежедневно используются для многочисленных химических реакций, уменьшая количество токсичных побочных продуктов, ускоряя производство и производя совершенно новые продукты.
Итак, подумайте о том, как катализаторы влияют на вашу повседневную жизнь, от автомобилей, которые вы водите, до лекарств, которые вы принимаете, и даже от бумаги, на которой вы пишете.
Химические реакции и катализаторы — Science Learning Hub
Добавить в коллекцию
Химическая реакция включает химическое изменение, которое происходит, когда две или более частицы (которые могут быть молекулами, атомами или ионами) взаимодействовать. Например, когда железо и кислород реагируют, они превращаются в новое вещество, оксид железа (ржавчина). Оксид железа по своим химическим свойствам отличается от железа и кислорода. Это отличается от физического изменения. Например, вода может превратиться в лед, но лед остается водой в другом физическом состоянии — лед и вода имеют одинаковые химические свойства.
Когда химические вещества вступают в реакцию, частицы должны столкнуться друг с другом с достаточной энергией, чтобы произошла реакция. Чем чаще они сталкиваются, тем больше вероятность того, что они отреагируют. Не все столкновения приводят к реакциям — часто для этого не хватает энергии.
Чем чаще они сталкиваются, тем больше вероятность того, что они отреагируют. Не все столкновения приводят к реакциям — часто для этого не хватает энергии.
Некоторые реакции происходят быстрее, чем другие. Скорость зависит от вероятности столкновения между частицами. На скорость реакции влияет ряд факторов.
- Концентрация – Чем больше частиц, тем выше вероятность столкновения.
- Температура — Частицы больше перемещаются при более высоких температурах, поэтому вероятность столкновений выше, и у столкновений больше энергии.
- Давление – Частицы в газах сильно разбросаны. Если вы увеличиваете давление, частицы сталкиваются вместе, поэтому шансы на столкновение увеличиваются.
- Площадь поверхности – Если одним из реагирующих химических веществ является твердое тело, могут столкнуться только частицы на поверхности. Чем больше поверхность, тем быстрее реакция. Более мелкие частицы имеют большую площадь поверхности для своего размера, чем более крупные.
 Это объясняет, почему порошок обычно реагирует быстрее, чем комки.
Это объясняет, почему порошок обычно реагирует быстрее, чем комки. - Катализаторы – Катализатор представляет собой вещество, которое изменяет скорость химической реакции, но остается химически неизменным в конце реакции. Ингибитор действует наоборот – замедляет химические реакции.
Катализаторы
Катализаторы играют важную роль во многих химических процессах. Они увеличивают скорость реакции, не расходуются в ходе реакции и необходимы только в очень малых количествах.
Катализаторы работают двумя основными способами.
Адсорбция
Частицы прилипают к поверхности катализатора (так называемая адсорбция), а затем перемещаются, что повышает вероятность их столкновения и реакции. Хорошим примером является то, как работает платиновый катализатор в каталитическом нейтрализаторе автомобиля, превращая токсичный монооксид углерода в менее токсичный диоксид углерода.
Промежуточные соединения
В этом процессе катализатор сначала соединяется с химическим веществом для получения нового соединения. Это новое соединение нестабильно, поэтому оно распадается, высвобождая другое новое соединение и оставляя катализатор в своей первоначальной форме. Так работают многие ферменты (специальные биологические катализаторы). Многие промышленные химические процессы основаны на таких катализаторах.
Это новое соединение нестабильно, поэтому оно распадается, высвобождая другое новое соединение и оставляя катализатор в своей первоначальной форме. Так работают многие ферменты (специальные биологические катализаторы). Многие промышленные химические процессы основаны на таких катализаторах.
Один из примеров катализатора, который включает промежуточное соединение, можно найти высоко в атмосфере Земли. Там, наверху, химический озон (с молекулами, содержащими три атома кислорода) помогает защитить Землю от вредного ультрафиолетового излучения. Но также там есть хлор, который попадает в атмосферу из химикатов (хлорфторуглеродов, фреонов), используемых в некоторых холодильниках, кондиционерах и аэрозольных баллончиках.
Хлор – катализатор, который крадет атом кислорода у озона (O 3 ), оставляя стабильный кислород (O 2 ). В то же время он образует нестабильное промежуточное хлор-кислородное соединение, которое распадается с выделением своего кислорода.
