Первый и второй законы термодинамики.
Первый закон термодинамики
Первый закон термодинамики представляет собой закон сохранения энергии применительно к термодинамическим процессам: энергия не исчезает в никуда и не возникает из ничего, а лишь переходит из одного вида в другой в эквивалентных количествах. Примером может послужить переход теплоты (тепловой энергии) в механическую энергию, и наоборот.
Если к М кг газа, занимающего объем V (м3) при температуре Т подвести при постоянном давлении некоторое количество теплоты dQ, то в результате этого температура газа повысится на dT, а объем – на dV. Повышение температуры связано с увеличением кинетической энергии движения молекул dK.
Увеличение объема сопровождается увеличением расстояния между молекулами и, как следствие, уменьшением потенциальной энергии dH взаимодействия между ними. Кроме того, увеличив объем, газ совершает работу dA по преодолению внешних сил.
Если, кроме указанных, никаких иных процессов в рабочем теле не происходит, то на основании закона сохранения энергии можно записать:
dQ = dK + dH + dA.
Сумма dK + dH представляет собой изменение внутренней энергии dU молекул системы в результате подвода теплоты.
Тогда формулу сохранения энергии для термодинамического процесса можно записать в виде:
dQ = dU + dA или dQ = dU + pdV.
Это уравнение представляет собой математическое выражение первого закона термодинамики: количество теплоты dQ, подводимое к системе газа, затрачивается на изменение ее внутренней энергии dU и совершение внешней работы dA.
Условно считают, что при dQ > 0 теплота сообщается рабочему телу, а при dQ < 0 теплота отнимается от тела. При dA > 0 система совершает работу (газ расширяется), а при dA < 0 работа совершается над системой (газ сжимается).
Для идеального газа, между молекулами которого нет взаимодействия, изменение внутренней энергии dU полностью определяется изменением кинетической энергии движения (т.
Первый закон термодинамики имеет еще одну формулировку: энергия изолированной термодинамической системы остается неизменной независимо от того, какие процессы в ней протекают.
Невозможно построить вечный двигатель первого рода, т. е. периодически действующую машину, которая совершала бы работу без затраты энергии.
***
Второй закон термодинамики
Первый закон термодинамики описывает количественные соотношения между параметрами термодинамической системы, имеющими место в процессах преобразования тепловой энергии в механическую и наоборот, но не устанавливает условия, при которых эти процессы возможны. Эти условия, необходимые для преобразования одного вида энергии в другой, раскрывает второй закон термодинамики.
Существует несколько формулировок этого закона, и каждая из них имеет одинаковое смысловое содержание. Здесь приведены наиболее часто упоминающиеся формулировки второго закона термодинамики.
Здесь приведены наиболее часто упоминающиеся формулировки второго закона термодинамики.
1. Для превращения теплоты в механическую работу необходимо иметь источник теплоты и холодильник, температура которого ниже температуры источника, т. е. необходим температурный перепад.
2. Нельзя осуществить тепловой двигатель, единственным результатом действия которого было бы превращение теплоты какого-либо тела в работу без того, чтобы часть теплоты не передавалась другим телам.
Из этой формулировки можно сделать вывод, что невозможно построить вечный двигатель, совершающий работу благодаря лишь одному источнику теплоты, поскольку любой, даже самый колоссальный источник теплоты в виде материального тела не способен отдать тепловой энергии больше, чем ему позволяет энтальпия (часть полной энергии тела, которую можно превратить в теплоту, охладив тело до температуры абсолютного нуля).
3. Теплота не может сама по себе переходить от менее нагретого тела к более нагретому без затраты внешней работы.
Как видите, второй закон термодинамики не имеет в своей основе формулярнго содержания, а лишь описывает условия, при которых возможны те или иные термодинамические явления и процессы, подтверждая, по сути, общий закон сохранения энергии.
***
Что такое удельная теплоемкость?
Скачать теоретические вопросы к экзаменационным билетам
по учебной дисциплине «Основы гидравлики и теплотехники»
(в формате Word, размер файла 68 кБ)
Скачать рабочую программу
- для специальности СПО «Механизация сельского хозяйства»
- для специальности СПО «Техническое обслуживание и ремонт автомобильного транспорта»
Скачать календарно-тематический план
по учебной дисциплине «Основы гидравлики и теплотехники» (в формате Word):
- для специальности СПО «Механизация сельского хозяйства»
- для специальности СПО «Техническое обслуживание и ремонт автомобильного транспорта»
Главная страница
- Страничка абитуриента
Дистанционное образование
- Группа ТО-81
- Группа М-81
- Группа ТО-71
Специальности
- Ветеринария
- Механизация сельского хозяйства
- Коммерция
- Техническое обслуживание и ремонт автотранспорта
Учебные дисциплины
- Инженерная графика
- МДК.
 01.01. «Устройство автомобилей»
01.01. «Устройство автомобилей» - Карта раздела
- Общее устройство автомобиля
- Автомобильный двигатель
- Трансмиссия автомобиля
- Рулевое управление
- Тормозная система
- Подвеска
- Колеса
- Кузов
- Электрооборудование автомобиля
- Основы теории автомобиля
- Основы технической диагностики
- Основы гидравлики и теплотехники
- Метрология и стандартизация
- Сельскохозяйственные машины
- Основы агрономии
- Перевозка опасных грузов
- Материаловедение
- Техническая механика
- Советы дипломнику
Олимпиады и тесты
- «Инженерная графика»
- «Техническая механика»
- «Двигатель и его системы»
- «Шасси автомобиля»
- «Электрооборудование автомобиля»
Первый закон термодинамики
На рисунке 3. 9.1 условно проиллюстрированы энергетические потоки между выделенной термодинамической системой и окружающими телами. В случае, если тепловой поток направлен к термодинамической системе, то некоторая величина Q>0, если же система совершает положительную работу над окружающими ее объектами, то справедливо неравенство A>0.
9.1 условно проиллюстрированы энергетические потоки между выделенной термодинамической системой и окружающими телами. В случае, если тепловой поток направлен к термодинамической системе, то некоторая величина Q>0, если же система совершает положительную работу над окружающими ее объектами, то справедливо неравенство A>0.
Рисунок 3.9.1. Обмен энергией между термодинамической системой и окружающими телами в результате теплообмена и совершаемой работы.
Состояние системы меняется, когда происходит процесс ее обмена теплом с окружающими объектами, и она совершает положительную или отрицательную работу. Изменяются макроскопические параметры системы, такие как температура, объем и давление. По причине того, что внутренняя энергия U всецело определяется макроскопическими параметрами, которые характеризуют состояние системы, процессы совершения работы и теплообмена провоцируют изменения внутренней энергии данной системы ΔU.
Определение 1-го закона термодинамики
Первый закон термодинамики представляет собой некое обобщение закона сохранения и превращения энергии для термодинамической системы, и формулируется следующим образом:
∆U=Q-A.
Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами.
Формула первого закона термодинамики, зачастую записывается в ином виде:
Q=∆U+A.
Определение 2 Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.Первый закон термодинамики представляет из себя, по сути, обобщение опытных фактов. Если руководствоваться им, то можно заявить, что энергия не возникает и не исчезает бесследно, а передается от одной системы к другой, меняя свои формы. Невозможность создания вечного двигателя (perpetuum mobile) первого рода, то есть машины, которая может совершать полезную работу, не потребляя энергию извне и не претерпевая каких-либо изменений во внутренней конструкции агрегата, являлась важным следствием первого закона термодинамики. В подтверждение этого выступает тот факт, что каждая из огромного множества попыток создания такого устройства неизменно заканчивалась неудачей. Реальная машина может совершать положительную работу A над внешними объектами, только получая некоторое количество теплоты Q от окружающих тел или уменьшая ΔU своей внутренней энергии.
Реальная машина может совершать положительную работу A над внешними объектами, только получая некоторое количество теплоты Q от окружающих тел или уменьшая ΔU своей внутренней энергии.
Первый закон термодинамики в процессах газов
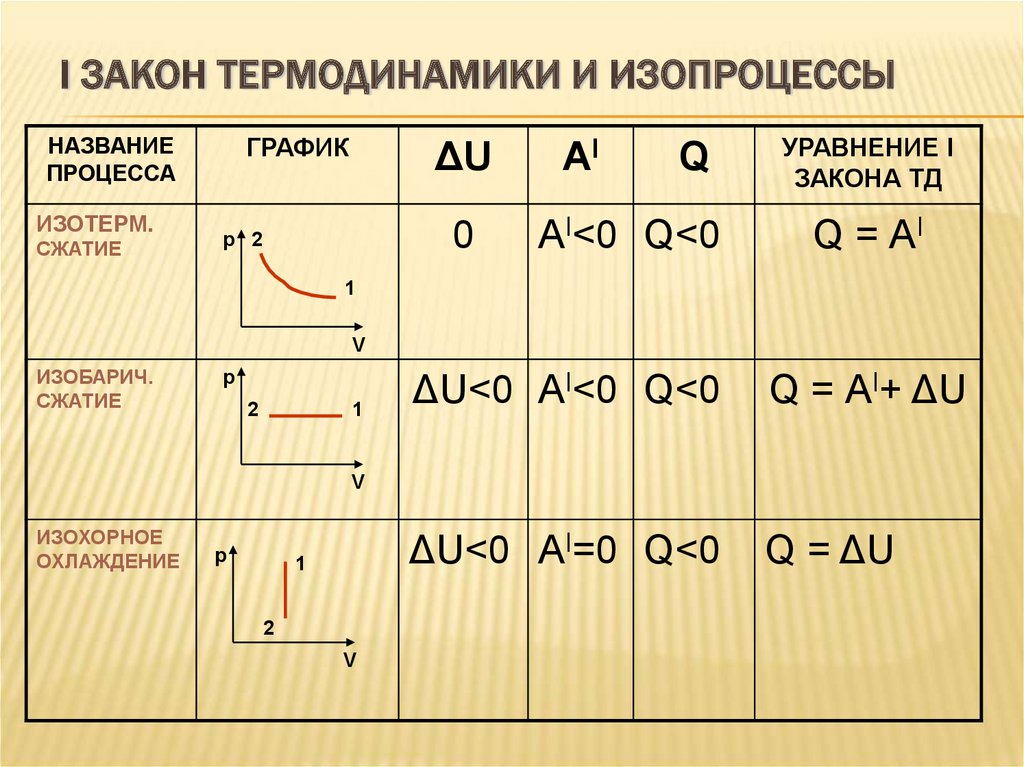
Первый закон термодинамики может применяться к изопроцессам в газах.
Определение 3В изохорном процессе, то есть в условиях неизменного объема (V=const), газ не совершает работы, A=0.
В этом случае справедливой будет формула внутренней энергии газа:
Q=∆U=U(T2)-U(T1).
В данном выражении U(T1) и U(T2) представляют внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит лишь от температуры, что исходит из закона Джоуля. При изохорном нагревании газ поглощает тепло (Q>0), чем провоцирует увеличение его внутренней энергии. В условиях охлаждения тепло отдается внешним объектам (Q<0).
Определение 4В изобарном процессе, предполагающем постоянность значения давления (p=const), работа, совершаемая газом, выражается в виде соотношения:
A=p(V2-V1)=p∆V.
Первый закон термодинамики для изобарного процесса дает:
Q=U(T2)-U(T1)+p(V2-V1)=∆U+p∆V.
При изобарном расширении Q>0 тепло поглощается газом, и он совершает положительную работу. При изобарном сжатии Q<0 тепло переходит внешним телам. В таком случае A<0. При изобарном сжатии уменьшаются температура газа T2<T1 и значение внутренней энергии ΔU<0.
Определение 5В изотермическом процессе температура газа не меняет своей величины, следовательно, не изменяется и внутренняя энергия газа, ΔU=0.
Первый закон термодинамики для изотермического процесса выражается соотношением
Q=A
Теплота Q, приобретенная газом в процессе изотермического расширения, превращается в работу, совершаемую над внешними объектами. И наоборот, изотермическое сжатие приводит к преобразованию уже работы внешних сил, произведенной над газом, в передающееся окружающим телам тепло.
Вместе с изохорным, изотермическим и изобарным процессами в термодинамике нередко исследуют процессы, происходящие в условиях отсутствующего теплообмена с окружающими объектами.
Адиабатическая оболочка – это сосуд с теплонепроницаемыми стенками.
Определение 7Процессы сжатия или расширения газа в подобных емкостях называют адиабатическими.
Рисунок 3.9.2. Модель адиабатического процесса.
Определение 8В адиабатическом процессе Q=0. По данной причине первый закон термодинамики принимает вид:
A=–ΔU.
Выходит, что газ производит работу за счет падения значения его внутренней энергии.
Определение 9Расширение или сжатие газа на плоскости p, V проиллюстрирована кривой, называемой адиабатой.
В процессе адиабатического расширения газом совершается положительная работа A>0, что является причиной понижения значения внутренней энергии ΔU<0. Данное явление провоцирует падение его температуры. Исходя из этого, можно заявить, что величина давления газа при адиабатическом расширении понижается быстрее, чем это происходит в изотермическом (рис. 3.9.3).
Рисунок 3. 9.3. Семейства изотерм (красные кривые) и адиабат (синие кривые) идеального газа.
9.3. Семейства изотерм (красные кривые) и адиабат (синие кривые) идеального газа.
В условиях координат (p, V) выводящееся в термодинамике уравнение адиабатического процесса для идеального газа принимает следующий вид:
pVγ=const.
Данное выражение, в котором γ=CpCV – показатель адиабаты, Cp и CV – теплоемкости газа в процессах с постоянным давлением и с постоянным объемом, называется уравнением Пуассона. В условиях одноатомного газа γ=53=1,67, двухатомного γ=75=1,4, многоатомного γ=1,33.
Работа газа в адиабатическом процессе выражается через температуры начального T1 и конечного T2 состояний и принимает вид:
A=CV(T2-T1)
Адиабатический процесс относится к изопроцессам.
В термодинамике важное место занимает физическая величина, называемая энтропией. Изменение энтропии в том или ином квазистатическом процессе эквивалентно некоторому обретенному системой теплу ΔQT. Так как на каждом участке адиабатического процесса ΔQ=0, энтропия в нем не претерпевает изменений.
Любые изопроцессы, в том числе и адиабатические, являются квазистатическими. Промежуточные состояния газа в таких процессах близки к состояниям термодинамического равновесия. Каждая точка, принадлежащая адиабате, описывает равновесное состояние. Однако, процесс, который проводится в адиабатической оболочке, то есть при отсутствующем теплообмене с окружающими объектами, не обязательно удовлетворяет данному условию.
Пример 1Примером неквазистатического процесса, в котором промежуточные состояния не находятся в состоянии равновесия, служит расширение газа в пустоту. На рисунке 3.9.3 иллюстрируется жесткая адиабатическая оболочка, состоящая из двух разделенных вентилем K сообщающихся емкостей. В изначальном состоянии газом заполнен один из сосудов, в это же время во втором находится лишь вакуум. Открытие вентиля запускает процесс расширения газа. Он заполняет оба сосуда, и устанавливается новое равновесное состояние.
В таком процессе Q=0, по той причине, что исключен теплообмен с окружающими телами, и A=0, так как оболочка недеформируема.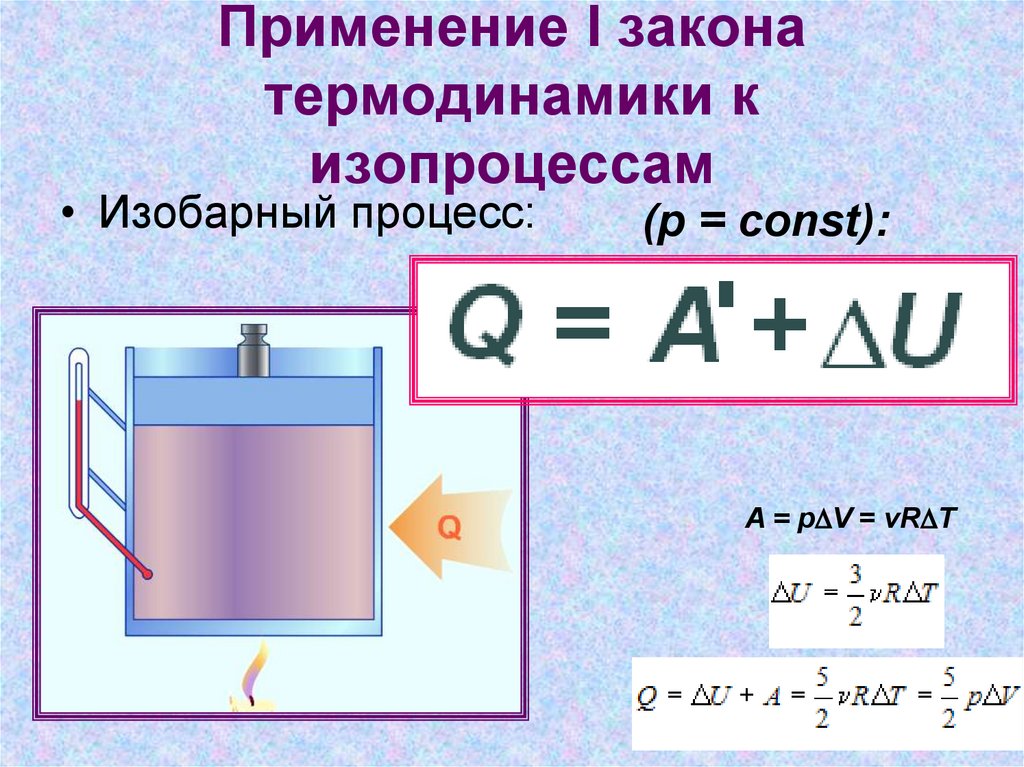 Первый закон термодинамики позволяет сказать, что ΔU=0, то есть внутренняя энергия газа не претерпела никаких изменений. Так как внутренняя энергия идеального газа зависит лишь от температуры, температура газа в начальном и конечном состояниях одинакова. Изображающие эти состояния точки на плоскости (p, V) лежат на одной изотерме. Все промежуточные состояния газа не являются равновесными и не могут быть изображены на диаграмме.
Первый закон термодинамики позволяет сказать, что ΔU=0, то есть внутренняя энергия газа не претерпела никаких изменений. Так как внутренняя энергия идеального газа зависит лишь от температуры, температура газа в начальном и конечном состояниях одинакова. Изображающие эти состояния точки на плоскости (p, V) лежат на одной изотерме. Все промежуточные состояния газа не являются равновесными и не могут быть изображены на диаграмме.
Расширение газа в пустоту – пример необратимого процесса. Его нельзя провести в противоположном направлении.
Рисунок 3.9.4. Расширение газа в пустоту.
Решение задач
от 1 дня / от 150 р.
Курсовая работа
от 5 дней / от 1800 р. Реферат
от 1 дня / от 700 р.
Реферат
от 1 дня / от 700 р.
Что такое первый закон термодинамики?
Когда вы покупаете по ссылкам на нашем сайте, мы можем получать партнерскую комиссию. Вот как это работает.
Горячий газ, заключенный в камере, оказывает давление на поршень, заставляя его двигаться вниз. Движение можно использовать для выполнения работы, равной общей силе, приложенной к верхней части поршня, умноженной на расстояние, на которое перемещается поршень. (Изображение предоставлено: GoodIll | Shutterstock)Связанное содержание
Первый закон термодинамики гласит, что теплота является формой энергии, поэтому термодинамические процессы подчиняются принципу сохранения энергии. Это означает, что тепловая энергия не может быть создана или уничтожена, согласно Britannica . Однако его можно перемещать из одного места в другое и преобразовывать в другие формы энергии и из них.
Это означает, что тепловая энергия не может быть создана или уничтожена, согласно Britannica . Однако его можно перемещать из одного места в другое и преобразовывать в другие формы энергии и из них.
Термодинамика — это раздел физики, изучающий отношения между теплом и другими формами энергии. В частности, он описывает, как тепловая энергия преобразуется в другие формы энергии и из них, и как это влияет на материю. Фундаментальные принципы термодинамики выражены в четырех законах.
«Первый закон гласит, что внутренняя энергия системы должна быть равна работе, совершаемой над системой, плюс или минус теплота, поступающая в систему или выходящая из нее, и любая другая работа, совершаемая над системы», — сказал Live Science Сайбал Митра, профессор физики Университета штата Миссури. «Итак, это новое заявление о сохранении энергии».
«Изменение внутренней энергии системы представляет собой сумму всех энергетических входов и выходов в систему и из нее, подобно тому, как все ваши депозиты и снятия определяют изменения в вашем банковском балансе», — сказал Митра.
Математически это выражается следующим образом: Δ U = Q — Вт , где Δ U — изменение внутренней энергии, Q — теплота, подводимая к системе, а Вт — работа, проделанная системой, согласно Britannica.
История первого закона термодинамики
Ученые в конце 18-го и начале 19-го веков придерживались теории теплоты, впервые предложенной Антуаном Лавуазье в 1783 году и получившей дальнейшее развитие в работах Сади Карно в 1824 году, согласно данным American Physical Общество (откроется в новой вкладке). Эта научная теория рассматривала тепло как своего рода жидкость, которая естественным образом перетекает из горячих областей в холодные, подобно тому, как вода течет из высоких мест в низкие. Когда эта теплотворная жидкость перетекала из горячей области в холодную, ее можно было преобразовать в кинетическую энергию и заставить выполнять работу так же, как падающая вода приводит в движение водяное колесо. По данным Университета Вирджинии, только когда Рудольф Клаузиус опубликовал «Механическую теорию тепла» в 1867 году, теория калорий была окончательно положена в конец, согласно Университету Вирджинии .
Термодинамические системы
Энергию можно разделить на две части, сказал Дэвид Макки, профессор физики Южного государственного университета Миссури. Одним из них является наш макроскопический вклад в человеческом масштабе, такой как поршень, движущийся и толкающий систему газа. Остальное состоит из вещей, которые происходят в очень маленьком масштабе, где мы не можем отследить вклад каждого отдельного человека.
«Когда я ставлю два образца металла друг против друга, а атомы гремят на границе, и два атома отскакивают друг от друга, и один из них отрывается быстрее другого, я не могу уследить Это происходит в очень небольшом временном масштабе и на очень небольшом расстоянии, и это происходит много-много раз в секунду», — сказал Макки в интервью Live Science. «Итак, мы просто делим всю передачу энергии на две группы: то, что мы будем отслеживать, и то, что мы не будем отслеживать. Последнее из них мы называем теплом».
Термодинамические системы обычно считаются открытыми, закрытыми или изолированными. По данным Университета Калгари , открытая система свободно обменивается энергией и веществом с окружающей средой; замкнутая система обменивается с окружающей средой энергией, но не материей; и изолированная система не обменивается энергией или веществом с окружающей средой. Например, кастрюля с кипящим супом получает энергию от плиты, излучает тепло от кастрюли и выделяет вещество в виде пара, который также уносит тепловую энергию. Это будет открытая система. Если мы накроем кастрюлю плотно крышкой, она по-прежнему будет излучать тепловую энергию, но в идеале больше не будет выделять материю в виде пара. Это будет закрытая система. Однако, если бы мы налили суп в идеально изолированный термос и запечатали крышку, в систему не попало бы ни энергии, ни материи. Это будет изолированная система.
По данным Университета Калгари , открытая система свободно обменивается энергией и веществом с окружающей средой; замкнутая система обменивается с окружающей средой энергией, но не материей; и изолированная система не обменивается энергией или веществом с окружающей средой. Например, кастрюля с кипящим супом получает энергию от плиты, излучает тепло от кастрюли и выделяет вещество в виде пара, который также уносит тепловую энергию. Это будет открытая система. Если мы накроем кастрюлю плотно крышкой, она по-прежнему будет излучать тепловую энергию, но в идеале больше не будет выделять материю в виде пара. Это будет закрытая система. Однако, если бы мы налили суп в идеально изолированный термос и запечатали крышку, в систему не попало бы ни энергии, ни материи. Это будет изолированная система.
Однако на практике идеально изолированные системы не могут существовать. Все системы передают энергию окружающей среде независимо от того, насколько хорошо они изолированы. Суп в термосе будет оставаться горячим всего несколько часов и на следующий день достигнет комнатной температуры. В другом примере белые карлики, горячие остатки сгоревших звезд, которые больше не производят энергию, могут быть изолированы световыми годами почти идеального вакуума в межзвездном пространстве, но в конечном итоге они остынут с нескольких десятков тысяч градусов. почти до абсолютного нуля из-за потерь энергии на излучение. Хотя этот процесс занимает больше времени, чем нынешний возраст Вселенной, остановить его невозможно.
В другом примере белые карлики, горячие остатки сгоревших звезд, которые больше не производят энергию, могут быть изолированы световыми годами почти идеального вакуума в межзвездном пространстве, но в конечном итоге они остынут с нескольких десятков тысяч градусов. почти до абсолютного нуля из-за потерь энергии на излучение. Хотя этот процесс занимает больше времени, чем нынешний возраст Вселенной, остановить его невозможно.
Тепловые двигатели
Наиболее распространенным практическим применением первого закона является тепловой двигатель. Тепловые двигатели преобразуют тепловую энергию в механическую и наоборот. Большинство тепловых двигателей относятся к категории открытых систем. По данным Университета штата Джорджия, основной принцип работы тепловой машины использует взаимосвязь между теплом, объемом и давлением рабочей жидкости (любого вещества, которое течет), обычно газа. Примеры рабочих жидкостей включают пар в паровой машине и гидрофторуглероды в холодильных системах.
При нагревании газ расширяется; однако, когда этот газ не расширяется, его давление увеличивается. Если нижняя стенка камеры удержания представляет собой верхнюю часть подвижного поршня, это давление оказывает силу на поверхность поршня, заставляя его двигаться вниз. Затем это движение можно использовать для выполнения работы, равной общей силе, приложенной к верхней части поршня, умноженной на расстояние, на которое перемещается поршень.
Существует множество вариантов базовой тепловой машины. Например, паровые двигатели полагаются на внешнее сгорание для нагрева бака котла, содержащего рабочее тело, обычно воду. Вода преобразуется в пар, а затем давление используется для привода поршня, который преобразует тепловую энергию в механическую. Автомобильные двигатели, однако, используют внутреннее сгорание, при котором жидкое топливо испаряется, смешивается с воздухом и воспламеняется внутри цилиндра над подвижным поршнем, толкая его вниз, согласно Университету Оклахомы .
Холодильники, кондиционеры и тепловые насосы
Холодильники и тепловые насосы представляют собой тепловые двигатели, преобразующие механическую энергию в тепловую. Большинство из них относятся к категории закрытых систем. При сжатии рабочего тела или газа его температура повышается. Затем этот горячий газ может передавать тепло окружающей среде. Затем, когда сжатому газу дают возможность расшириться, его температура становится ниже, чем до сжатия, потому что часть его тепловой энергии была удалена во время горячего цикла. Затем этот холодный газ может поглощать тепловую энергию из окружающей среды. По данным Бостонского университета, это принцип работы кондиционера . Кондиционеры на самом деле не производят холод; они отводят тепло.
Механический насос перекачивает рабочую жидкость наружу, где она нагревается за счет сжатия. Затем тепло передается во внешнюю среду, обычно через теплообменник с воздушным охлаждением, в котором часто используется электрический вентилятор для отвода тепла в окружающую среду. Затем рабочая жидкость возвращается в помещение, где ей дают возможность расшириться и охладиться, чтобы она могла поглощать тепло из воздуха в помещении через другой теплообменник.
Затем рабочая жидкость возвращается в помещение, где ей дают возможность расшириться и охладиться, чтобы она могла поглощать тепло из воздуха в помещении через другой теплообменник.
Тепловой насос — это просто кондиционер, работающий в обратном направлении. Тепло от сжатого рабочего тела используется для обогрева здания. Затем он переносится наружу, где расширяется и становится холодным, что позволяет ему поглощать тепло из наружного воздуха, который даже зимой обычно теплее холодного рабочего тела. Рабочая жидкость обычно имеет достаточно низкую температуру замерзания, чтобы продолжать течь даже при очень низких температурах.
Геотермальные или наземные системы кондиционирования воздуха и тепловые насосы используют длинные U-образные трубы в глубоких колодцах или массив горизонтальных труб, заглубленных на большой площади, по которым циркулирует рабочая жидкость, и тепло передается к земле или от нее , по данным Министерства энергетики США . Другие системы используют речную или океанскую воду для нагрева или охлаждения рабочей жидкости.
Участник Live Science Эшли Хамер обновила эту статью 28 января 2022 г.
Дополнительные ресурсы
Вот еще три объяснения первого закона термодинамики:
- Концептуальная академия (открывается в новой вкладке) на YouTube
- Профессор наук о Земле Университета Джорджа Мейсона Роберт М. Хейзен на The Great Courses Daily ( открывается в новой вкладке)
- Эта глава OpenStax College Physics (открывается в новой вкладке) из Университета Айовы
Библиография
Britannica, «Первый закон термодинамики», 1 июня 2021 г. https://www.britannica .com/science/thermodynamics/The-first-law-of-thermodynamics (открывается в новой вкладке)
Институт истории науки, «Антуан-Лоран Лавуазье», 11 декабря 2017 г. Николя Леонар Сади Карно», 10 апреля 2012 г., https://www.asme.org/topics-resources/content/nicolas-leonard-sadi-carnot (открывается в новой вкладке)
Рудольф Клаузиус, «Механическая теория тепла». .» Джон Ван Ворст, 1867 г.
Американское физическое общество, «История физики в этом месяце, декабрь 1840 г .: реферат Джоуля о преобразовании механической энергии в тепло», декабрь 2009 г.. https://www.aps.org/publications/apsnews/200912/physicshistory.cfm
University of Virginia, «Teaching Heat: the Rise and Fall of the Caloric Theory», июль 2003 г. http: //galileoandeinstein.physics.virginia.edu/more_stuff/TeachingHeat.htm (открывается в новой вкладке)
University of Calgary Energy Education, «System and Surrounding», 27 сентября 2021 г. https://energyeducation.ca/encyclopedia/ System_and_surrounding (открывается в новой вкладке)
Гиперфизический университет Джорджии, «Цикл теплового двигателя», http://hyperphysics.phy-astr.gsu.edu/hbase/thermo/heaeng.html (открывается в новой вкладке)
Университет Оклахомы ECCourses, «Термодинамика — Теория». http://www.ecourses.ou.edu/cgi-bin/ebook.cgi?topic=th&chap_sec=08.1&page=theory (открывается в новой вкладке)
Бостонский университет, «Тепловые двигатели и второй закон», 10 декабря. 1999 г. http://physics.bu.edu/~duffy/py105/Heatengines.html (открывается в новой вкладке)
1999 г. http://physics.bu.edu/~duffy/py105/Heatengines.html (открывается в новой вкладке)
Министерство энергетики США, «Геотермальные тепловые насосы». https://www.energy.gov/energysaver/geothermal-heat-pumps (открывается в новой вкладке)
Джим Лукас — автор статей для Live Science. Он охватывает физику, астрономию и инженерное дело. Джим окончил Университет штата Миссури, где получил степень бакалавра наук в области физики, а также астрономию и техническое письмо. После окончания университета он работал в Лос-Аламосской национальной лаборатории системным администратором, техническим писателем-редактором и специалистом по ядерной безопасности. Помимо написания статей, он редактирует статьи в научных журналах по различным тематическим направлениям.
При участии
- Эшли ХамерЛайв, участник науки
Что такое первый закон термодинамики?
Когда вы покупаете по ссылкам на нашем сайте, мы можем получать партнерскую комиссию.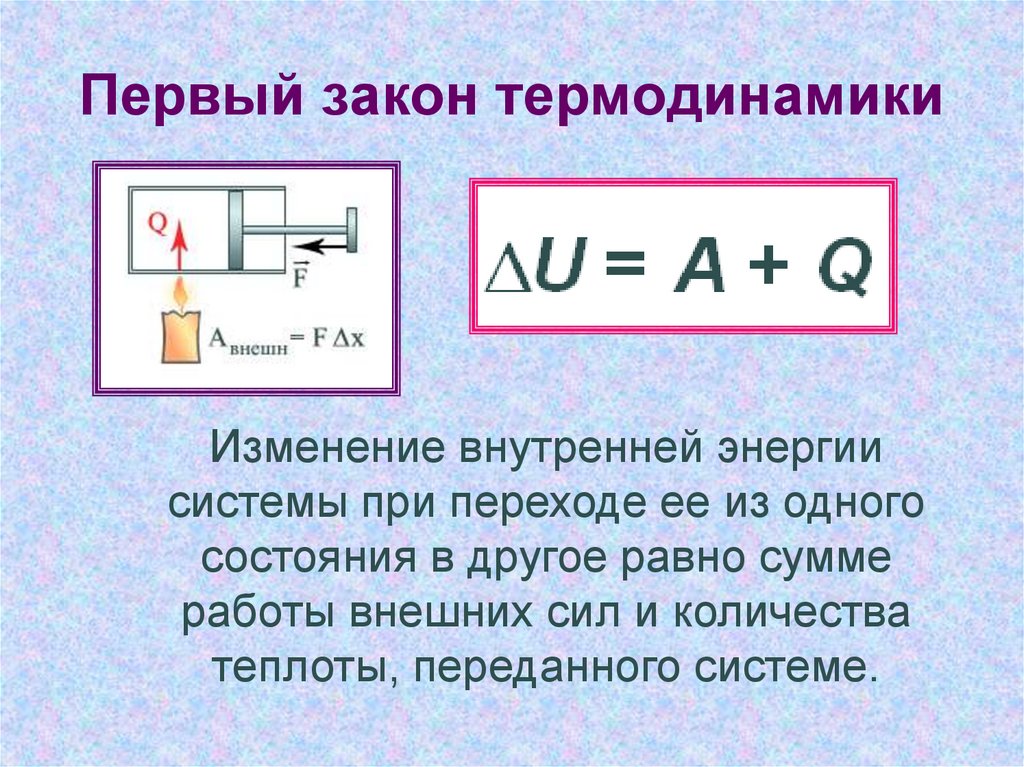 Вот как это работает.
Вот как это работает.
Связанное содержание
Первый закон термодинамики гласит, что теплота является формой энергии, поэтому термодинамические процессы подчиняются принципу сохранения энергии. Это означает, что тепловая энергия не может быть создана или уничтожена, согласно Britannica . Однако его можно перемещать из одного места в другое и преобразовывать в другие формы энергии и из них.
Термодинамика — это раздел физики, изучающий взаимосвязь между теплом и другими формами энергии. В частности, он описывает, как тепловая энергия преобразуется в другие формы энергии и из них, и как это влияет на материю. Фундаментальные принципы термодинамики выражены в четырех законах.
«Первый закон гласит, что внутренняя энергия системы должна быть равна работе, совершаемой над системой, плюс или минус теплота, поступающая в систему или выходящая из нее, и любая другая работа, совершаемая над системы», — сказал Live Science Сайбал Митра, профессор физики Университета штата Миссури. «Итак, это новое заявление о сохранении энергии».
«Изменение внутренней энергии системы представляет собой сумму всех энергетических входов и выходов в систему и из нее, подобно тому, как все ваши депозиты и снятия определяют изменения в вашем банковском балансе», — сказал Митра.
Математически это выражается следующим образом: Δ U = Q — Вт , где Δ U — изменение внутренней энергии, Q — теплота, подводимая к системе, а Вт — работа, проделанная системой, согласно Britannica.
История первого закона термодинамики
Ученые в конце 18-го и начале 19-го веков придерживались теории теплоты, впервые предложенной Антуаном Лавуазье в 1783 году и получившей дальнейшее развитие в работах Сади Карно в 1824 году, согласно данным American Physical Общество (откроется в новой вкладке). Эта научная теория рассматривала тепло как своего рода жидкость, которая естественным образом перетекает из горячих областей в холодные, подобно тому, как вода течет из высоких мест в низкие. Когда эта теплотворная жидкость перетекала из горячей области в холодную, ее можно было преобразовать в кинетическую энергию и заставить выполнять работу так же, как падающая вода приводит в движение водяное колесо. По данным Университета Вирджинии, только когда Рудольф Клаузиус опубликовал «Механическую теорию тепла» в 1867 году, теория калорий была окончательно положена в конец, согласно Университету Вирджинии .
Эта научная теория рассматривала тепло как своего рода жидкость, которая естественным образом перетекает из горячих областей в холодные, подобно тому, как вода течет из высоких мест в низкие. Когда эта теплотворная жидкость перетекала из горячей области в холодную, ее можно было преобразовать в кинетическую энергию и заставить выполнять работу так же, как падающая вода приводит в движение водяное колесо. По данным Университета Вирджинии, только когда Рудольф Клаузиус опубликовал «Механическую теорию тепла» в 1867 году, теория калорий была окончательно положена в конец, согласно Университету Вирджинии .
Термодинамические системы
Энергию можно разделить на две части, сказал Дэвид Макки, профессор физики Южного государственного университета Миссури. Одним из них является наш макроскопический вклад в человеческом масштабе, такой как поршень, движущийся и толкающий систему газа. Остальное состоит из вещей, которые происходят в очень маленьком масштабе, где мы не можем отследить вклад каждого отдельного человека.
«Когда я ставлю два образца металла друг против друга, а атомы гремят на границе, и два атома отскакивают друг от друга, и один из них отрывается быстрее другого, я не могу уследить Это происходит в очень небольшом временном масштабе и на очень небольшом расстоянии, и это происходит много-много раз в секунду», — сказал Макки в интервью Live Science. «Итак, мы просто делим всю передачу энергии на две группы: то, что мы будем отслеживать, и то, что мы не будем отслеживать. Последнее из них мы называем теплом».
Термодинамические системы обычно считаются открытыми, закрытыми или изолированными. По данным Университета Калгари , открытая система свободно обменивается энергией и веществом с окружающей средой; замкнутая система обменивается с окружающей средой энергией, но не материей; и изолированная система не обменивается энергией или веществом с окружающей средой. Например, кастрюля с кипящим супом получает энергию от плиты, излучает тепло от кастрюли и выделяет вещество в виде пара, который также уносит тепловую энергию. Это будет открытая система. Если мы накроем кастрюлю плотно крышкой, она по-прежнему будет излучать тепловую энергию, но в идеале больше не будет выделять материю в виде пара. Это будет закрытая система. Однако, если бы мы налили суп в идеально изолированный термос и запечатали крышку, в систему не попало бы ни энергии, ни материи. Это будет изолированная система.
Это будет открытая система. Если мы накроем кастрюлю плотно крышкой, она по-прежнему будет излучать тепловую энергию, но в идеале больше не будет выделять материю в виде пара. Это будет закрытая система. Однако, если бы мы налили суп в идеально изолированный термос и запечатали крышку, в систему не попало бы ни энергии, ни материи. Это будет изолированная система.
Однако на практике идеально изолированные системы не могут существовать. Все системы передают энергию окружающей среде независимо от того, насколько хорошо они изолированы. Суп в термосе будет оставаться горячим всего несколько часов и на следующий день достигнет комнатной температуры. В другом примере белые карлики, горячие остатки сгоревших звезд, которые больше не производят энергию, могут быть изолированы световыми годами почти идеального вакуума в межзвездном пространстве, но в конечном итоге они остынут с нескольких десятков тысяч градусов. почти до абсолютного нуля из-за потерь энергии на излучение. Хотя этот процесс занимает больше времени, чем нынешний возраст Вселенной, остановить его невозможно.
Тепловые двигатели
Наиболее распространенным практическим применением первого закона является тепловой двигатель. Тепловые двигатели преобразуют тепловую энергию в механическую и наоборот. Большинство тепловых двигателей относятся к категории открытых систем. По данным Университета штата Джорджия, основной принцип работы тепловой машины использует взаимосвязь между теплом, объемом и давлением рабочей жидкости (любого вещества, которое течет), обычно газа. Примеры рабочих жидкостей включают пар в паровой машине и гидрофторуглероды в холодильных системах.
При нагревании газ расширяется; однако, когда этот газ не расширяется, его давление увеличивается. Если нижняя стенка камеры удержания представляет собой верхнюю часть подвижного поршня, это давление оказывает силу на поверхность поршня, заставляя его двигаться вниз. Затем это движение можно использовать для выполнения работы, равной общей силе, приложенной к верхней части поршня, умноженной на расстояние, на которое перемещается поршень.
Существует множество вариантов базовой тепловой машины. Например, паровые двигатели полагаются на внешнее сгорание для нагрева бака котла, содержащего рабочее тело, обычно воду. Вода преобразуется в пар, а затем давление используется для привода поршня, который преобразует тепловую энергию в механическую. Автомобильные двигатели, однако, используют внутреннее сгорание, при котором жидкое топливо испаряется, смешивается с воздухом и воспламеняется внутри цилиндра над подвижным поршнем, толкая его вниз, согласно Университету Оклахомы .
Холодильники, кондиционеры и тепловые насосы
Холодильники и тепловые насосы представляют собой тепловые двигатели, преобразующие механическую энергию в тепловую. Большинство из них относятся к категории закрытых систем. При сжатии рабочего тела или газа его температура повышается. Затем этот горячий газ может передавать тепло окружающей среде. Затем, когда сжатому газу дают возможность расшириться, его температура становится ниже, чем до сжатия, потому что часть его тепловой энергии была удалена во время горячего цикла. Затем этот холодный газ может поглощать тепловую энергию из окружающей среды. По данным Бостонского университета, это принцип работы кондиционера . Кондиционеры на самом деле не производят холод; они отводят тепло.
Затем этот холодный газ может поглощать тепловую энергию из окружающей среды. По данным Бостонского университета, это принцип работы кондиционера . Кондиционеры на самом деле не производят холод; они отводят тепло.
Механический насос перекачивает рабочую жидкость наружу, где она нагревается за счет сжатия. Затем тепло передается во внешнюю среду, обычно через теплообменник с воздушным охлаждением, в котором часто используется электрический вентилятор для отвода тепла в окружающую среду. Затем рабочая жидкость возвращается в помещение, где ей дают возможность расшириться и охладиться, чтобы она могла поглощать тепло из воздуха в помещении через другой теплообменник.
Тепловой насос — это просто кондиционер, работающий в обратном направлении. Тепло от сжатого рабочего тела используется для обогрева здания. Затем он переносится наружу, где расширяется и становится холодным, что позволяет ему поглощать тепло из наружного воздуха, который даже зимой обычно теплее холодного рабочего тела. Рабочая жидкость обычно имеет достаточно низкую температуру замерзания, чтобы продолжать течь даже при очень низких температурах.
Рабочая жидкость обычно имеет достаточно низкую температуру замерзания, чтобы продолжать течь даже при очень низких температурах.
Геотермальные или наземные системы кондиционирования воздуха и тепловые насосы используют длинные U-образные трубы в глубоких колодцах или массив горизонтальных труб, заглубленных на большой площади, по которым циркулирует рабочая жидкость, и тепло передается к земле или от нее , по данным Министерства энергетики США . Другие системы используют речную или океанскую воду для нагрева или охлаждения рабочей жидкости.
Участник Live Science Эшли Хамер обновила эту статью 28 января 2022 г.
Дополнительные ресурсы
Вот еще три объяснения первого закона термодинамики:
- Концептуальная академия (открывается в новой вкладке) на YouTube
- Профессор наук о Земле Университета Джорджа Мейсона Роберт М. Хейзен на The Great Courses Daily ( открывается в новой вкладке)
- Эта глава OpenStax College Physics (открывается в новой вкладке) из Университета Айовы
Библиография
Britannica, «Первый закон термодинамики», 1 июня 2021 г. https://www.britannica .com/science/thermodynamics/The-first-law-of-thermodynamics (открывается в новой вкладке)
https://www.britannica .com/science/thermodynamics/The-first-law-of-thermodynamics (открывается в новой вкладке)
Институт истории науки, «Антуан-Лоран Лавуазье», 11 декабря 2017 г. Николя Леонар Сади Карно», 10 апреля 2012 г., https://www.asme.org/topics-resources/content/nicolas-leonard-sadi-carnot (открывается в новой вкладке)
Рудольф Клаузиус, «Механическая теория тепла». .» Джон Ван Ворст, 1867 г.
Американское физическое общество, «История физики в этом месяце, декабрь 1840 г .: реферат Джоуля о преобразовании механической энергии в тепло», декабрь 2009 г.. https://www.aps.org/publications/apsnews/200912/physicshistory.cfm
University of Virginia, «Teaching Heat: the Rise and Fall of the Caloric Theory», июль 2003 г. http: //galileoandeinstein.physics.virginia.edu/more_stuff/TeachingHeat.htm (открывается в новой вкладке)
University of Calgary Energy Education, «System and Surrounding», 27 сентября 2021 г. https://energyeducation.ca/encyclopedia/ System_and_surrounding (открывается в новой вкладке)
Гиперфизический университет Джорджии, «Цикл теплового двигателя», http://hyperphysics. phy-astr.gsu.edu/hbase/thermo/heaeng.html (открывается в новой вкладке)
phy-astr.gsu.edu/hbase/thermo/heaeng.html (открывается в новой вкладке)
Университет Оклахомы ECCourses, «Термодинамика — Теория». http://www.ecourses.ou.edu/cgi-bin/ebook.cgi?topic=th&chap_sec=08.1&page=theory (открывается в новой вкладке)
Бостонский университет, «Тепловые двигатели и второй закон», 10 декабря. 1999 г. http://physics.bu.edu/~duffy/py105/Heatengines.html (открывается в новой вкладке)
Министерство энергетики США, «Геотермальные тепловые насосы». https://www.energy.gov/energysaver/geothermal-heat-pumps (открывается в новой вкладке)
Джим Лукас — автор статей для Live Science. Он охватывает физику, астрономию и инженерное дело. Джим окончил Университет штата Миссури, где получил степень бакалавра наук в области физики, а также астрономию и техническое письмо. После окончания университета он работал в Лос-Аламосской национальной лаборатории системным администратором, техническим писателем-редактором и специалистом по ядерной безопасности.
