Абсолютная температура. Температура — мера средней кинетической энергии молекул
Абсолютная температура. Температура — мера средней кинетической энергии молекул
- Подробности
- Просмотров: 610
«Физика — 10 класс»
Абсолютная температура.
Вместо температуры Θ, выражаемой в энергетических единицах, введём температуру, выражаемую в привычных для нас градусах.
Будем считать величину Θ прямо пропорциональной температуре Т, измеряемой в градусах:
Θ = kТ, (9.12)
где k — коэффициент пропорциональности.
>Определяемая равенством (9.12) температура называется абсолютной.
Такое название, как мы сейчас увидим, имеет достаточные основания. Учитывая определение (9.12), получим
По этой формуле вводится температурная шкала (в градусах), не зависящая от вещества, используемого для измерения температуры.
Температура, определяемая формулой (9.13), очевидно, не может быть отрицательной, так как все величины, стоящие в левой части этой формулы, заведомо положительны. Следовательно, наименьшим возможным значением температуры Т является значение Т = 0, если давление р или объём V равны нулю.
Предельную температуру, при которой давление идеального газа обращается в нуль при фиксированном объёме или при которой объём идеального газа стремится к нулю при неизменном давлении, называют абсолютным нулём температуры.
Это самая низкая температура в природе, та «наибольшая или последняя степень холода», существование которой предсказывал Ломоносов.
Английский учёный У. Томсон (лорд Кельвин) (1824—1907) ввёл абсолютную шкалу температур. Нулевая температура по абсолютной шкале (её называют также шкалой Кельвина) соответствует абсолютному нулю, а каждая единица температуры по этой шкале равна градусу по шкале Цельсия.
Единица абсолютной температуры в СИ называется кельвином (обозначается буквой К).
Постоянная Больцмана.
Определим коэффициент k в формуле (9.13) так, чтобы изменение температуры на один кельвин (1 К) было равно изменению температуры на один градус по шкале Цельсия (1 °С).
Мы знаем значения величины Θ при 0 °С и 100 °С (см. формулы (9.9) и (9.11)). Обозначим абсолютную температуру при 0 °С через Т1, а при 100 °С через Т2. Тогда согласно формуле (9.12)
Θ100 — Θ0 = k(T2 -T1),
Θ100 — Θ0 = k • 100 K = (5,14 — 3,76) • 10-21 Дж.
Отсюда
Коэффициент
k = 1,38 • 10-23 Дж/К (9.14)
называется постоянной Больцмана
Постоянная Больцмана связывает температуру Θ в энергетических единицах с температурой Т в кельвинах.
Это одна из наиболее важных постоянных в молекулярно-кинетической теории.
Зная постоянную Больцмана, можно найти значение абсолютного нуля по шкале Цельсия. Для этого найдём сначала значение абсолютной температуры, соответствующее 0 °С. Так как при 0 °С kT1 = 3,76 • 10-21 Дж, то
Один кельвин и один градус шкалы Цельсия совпадают. Поэтому любое значение абсолютной температуры Т будет на 273 градуса выше соответствующей температуры t по Цельсию:
Т (К) = (f + 273) (°С). (9.15)
Изменение абсолютной температуры ΔТ равно изменению температуры по шкале Цельсия Δt: ΔТ(К) = Δt (°С).
На рисунке 9.5 для сравнения изображены абсолютная шкала и шкала Цельсия. Абсолютному нулю соответствует температура t = -273 °С.
В США используется шкала Фаренгейта. Точка замерзания воды по этой шкале 32 °F, а точка кипения 212 °Е Пересчёт температуры из шкалы Фаренгейта в шкалу Цельсия производится по формуле t(°C) = 5/9 (t(°F) — 32).
Отметим важнейший факт: абсолютный нуль температуры недостижим!
Температура — мера средней кинетической энергии молекул.
Из основного уравнения молекулярно-кинетической теории (9.8) и определения температуры (9.13) вытекает важнейшее следствие:
абсолютная температура есть мера средней кинетической энергии движения молекул.
Докажем это.
Из уравнений (9.7) и (9.13) следует, что Отсюда вытекает связь между средней кинетической энергией поступательного движения молекулы и температурой:
Средняя кинетическая энергия хаотичного поступательного движения молекул газа пропорциональна абсолютной температуре.
Чем выше температура, тем быстрее движутся молекулы. Таким образом, выдвинутая ранее догадка о связи температуры со средней скоростью молекул получила надёжное обоснование. Соотношение (9.16) между температурой и средней кинетической энергией поступательного движения молекул установлено для идеальных газов.
Однако оно оказывается справедливым для любых веществ, у которых движение атомов или молекул подчиняется законам механики Ньютона. Оно верно для жидкостей, а также и для твёрдых тел, где атомы могут лишь колебаться возле положений равновесия в узлах кристаллической решётки.
Оно верно для жидкостей, а также и для твёрдых тел, где атомы могут лишь колебаться возле положений равновесия в узлах кристаллической решётки.
При приближении температуры к абсолютному нулю энергия теплового движения молекул приближается к нулю, т. е. прекращается поступательное тепловое движение молекул.
Зависимость давления газа от концентрации его молекул и температуры. Учитывая, что из формулы (9.13) получим выражение, показывающее зависимость давления газа от концентрации молекул и температуры:
Из формулы (9.17) вытекает, что при одинаковых давлениях и температурах концентрация молекул у всех газов одна и та же.
Отсюда следует закон Авогадро, известный вам из курса химии.
Закон Авогадро:
В равных объёмах газов при одинаковых температурах и давлениях содержится одинаковое число молекул.
Источник: «Физика — 10 класс», 2014, учебник Мякишев, Буховцев, Сотский
Основные положения МКТ. Тепловые явления — Физика, учебник для 10 класса — Класс!ная физика
Тепловые явления — Физика, учебник для 10 класса — Класс!ная физика
Почему тепловые явления изучаются в молекулярной физике — Основные положения молекулярно-кинетической теории. Размеры молекул — Примеры решения задач по теме «Основные положения МКТ» — Броуновское движение — Силы взаимодействия молекул. Строение газообразных, жидких и твёрдых тел — Идеальный газ в МКТ. Среднее значение квадрата скорости молекул — Основное уравнение молекулярно-кинетической теории газов — Примеры решения задач по теме «Основное уравнение молекулярно-кинетической теории» — Температура и тепловое равновесие — Определение температуры. Энергия теплового движения молекул — Абсолютная температура. Температура — мера средней кинетической энергии молекул — Измерение скоростей молекул газа — Примеры решения задач по теме «Энергия теплового движения молекул» — Уравнение состояния идеального газа — Примеры решения задач по теме «Уравнение состояния идеального газа» — Газовые законы — Примеры решения задач по теме «Газовые законы» — Примеры решения задач по теме «Определение параметров газа по графикам изопроцессов»
Абсолютная температура идеального газа
Давление газа определяют хаотические удары перемещающихся молекул. Это означает, что уменьшение давления при охлаждении газа можно объяснить уменьшением средней энергии поступательного движения молекул (). Давление газа достигнет нуля, когда в соответствии с основным законом молекулярно кинетической теории:
Это означает, что уменьшение давления при охлаждении газа можно объяснить уменьшением средней энергии поступательного движения молекул (). Давление газа достигнет нуля, когда в соответствии с основным законом молекулярно кинетической теории:
. Концентрация молекул газа n считается постоянной отличной от нуля.
Абсолютная температура идеального газа
Для охлаждения газа существует предел. Абсолютным нулем называют температуру, при которой прекращается поступательное движение молекул.
Идеальный газ (в отличие от реальных газов) остается в газообразном состоянии при любых температурах. Величину температуры, при которой прекратится поступательное движение молекул, можно найти из закона, который определил Ж. Шарль: температурный коэффициент давления идеального газа не зависит от рода газа и равен . При этом давление идеального газа при произвольной температуре равно:
где t – температура по шкале Цельсия; – давление при . Приравняем давление в выражении (2) к нулю, выразим температуру, при которой молекулы идеального газа прекратят свое поступательное движение:
В. Кельвин предположил, что полученное значение абсолютного нуля будет соответствовать прекращению поступательного движения молекул любого вещества. Температуры ниже абсолютного нуля (T=0 К) природе не бывает. Так как при температуре абсолютного нуля нельзя отнимать энергию теплового движения молекул и уменьшать температуру тела, так как энергия теплового движения отрицательной быть не может. В лабораториях получена температура близкая к абсолютному нулю (около тысячной доли градуса).
Кельвин предположил, что полученное значение абсолютного нуля будет соответствовать прекращению поступательного движения молекул любого вещества. Температуры ниже абсолютного нуля (T=0 К) природе не бывает. Так как при температуре абсолютного нуля нельзя отнимать энергию теплового движения молекул и уменьшать температуру тела, так как энергия теплового движения отрицательной быть не может. В лабораториях получена температура близкая к абсолютному нулю (около тысячной доли градуса).
Термодинамическая шкала температур
По термодинамической шкале температур (она же шкала Кельвина) началом отсчета считается абсолютный нуль температур. Температуру обозначают большой буквой T. Размер градуса совпадает с градусом по шкале Цельсия:
Одинаковыми будут производные, если брать их с использованием разных температурных кал:
При переходе от шкалы Кельвина к шкале Цельсия сохраняются определения термических коэффициентов объемного расширения и коэффициента давления.
В международной системе единиц (СИ) единица температуры является основной, ее называют кельвином (К). В системе СИ термодинамическая шкала температур используется для отсчета температуры.
В соответствии с международным соглашением размер кельвина определяют из таких условий: температуру тройной точки волы принимают равной 273,16 К. Тройной точке воды по Цельсию, соответствует 0,01 oС, температура таяния льда по кельвину равна 273,15 К.
Температура, измеряемая в кельвинах, называется абсолютной. Связью между абсолютной температурой и температурой по Цельсию отражает выражение:
Абсолютная температура, кинетическая энергия молекул и давление идеального газа
Величина средней энергии поступательного движения молекул прямо пропорциональна температуре газа:
где – постоянная Больцмана. Формула (6) означает, что средняя величина кинетической энергии поступательного движения молекул не зависит от рода идеального газа, а определено только его температурой.
Давление идеального газа определено только его температурой:
Примеры решения задач
Температура абсолютная — Справочник химика 21
Более точное рассмотрение показывает, что любая система атомов ни при каких условиях, даже при температуре абсолютного нуля, не может обладать энергией, меньшей некоторой [c.142]Теоретическая прочность твердого тела — прочность тела с идеальной структурой (без повреждений и дефектов) при температуре абсолютного нуля (т. е. в отсутствие теплового движения) при однородной статической деформации растяжения и сдвига. [c.406]
Излучательная, поглощательная и отражательная способности. Тепловое излучение реального тела меньше теплового излучения абсолютно черного тела при той же температуре. Для определения излучательной способности реального тела по закону Стефана — Больцмана вводится так называемый коэффии иент черноты тела, или степень черноты е.
 Он определяется как отношение потока теплового излучения, испускаемого реальным телом, к потоку теплового излучения, испускаемого абсолютно черным телом при той же температуре. Абсолютно черное тело поглощает всю падающую на него энергию излучения, в то время как реальное тело отражает часть этой энергии, так что можно ввести коэффициент поглощения, аналогичный коэффициенту чер-иоты тела. Для теплового излучения при любой данной температуре коэффициенты черноты тела и поглощения одинаковы. [c.43]
Он определяется как отношение потока теплового излучения, испускаемого реальным телом, к потоку теплового излучения, испускаемого абсолютно черным телом при той же температуре. Абсолютно черное тело поглощает всю падающую на него энергию излучения, в то время как реальное тело отражает часть этой энергии, так что можно ввести коэффициент поглощения, аналогичный коэффициенту чер-иоты тела. Для теплового излучения при любой данной температуре коэффициенты черноты тела и поглощения одинаковы. [c.43] Здесь о—изменение энергии, сопутствующее реакции при температуре абсолютного нуля. Указанный энергетический член присутствует в уравнении по той причине, что не введен единый нулевой уровень энергии для каждого отдельного компонента взамен этого наиболее низкий из возможных уровень энергии каждого компонента принимается как его индивидуальный нулевой уровень. Таким образом, —поправочный множитель, учитывающий разность нулевых уровней энергий в рассматриваемых состояниях отдельных компонентов. [c.43]
[c.43]
Из других работ Менделеева в областях, относящихся к физической химии, следует назвать его работы по упругости газов, введению универсальной газовой постоянной в уравнение состояния идеального газа, изучению термического расширения жидкостей и их поверхностного натяжения при различных температурах. В частности, последние работы привели к установлению Менделеевым существования температуры абсолютного кипения жидкостей (критической температуры). [c.17]
Рассмотренные выше уравнения (11.16) и (11.19) позволяют вычислять изменение энтропии в результате перехода какого-либо вещества из одного состояния в другое. Однако с их помощью нельзя вычислить абсолютное значение энтропии вещества в рассматриваемых условиях. Такую возможность дает положение, которое было сформулировано Планком. Согласно этому положению, называемому постулатом Планка, энтропия индивидуального кристаллического вещества при температуре абсолютного нуля равна нулю [c. 105]
105]
Предложите способ вычисления энтропии кристаллического N0 при температуре абсолютного нуля. Вычислите энтропию 5 ко при О К. [c.45]
Каким было бы значение константы равновесия, Крав , в реакции диссоциации 80з, если бы реагенты и продукты имели равную энтропию Это значение константы равновесия должно соответствовать температуре абсолютного нуля, в чем можно убедиться при помощи рис. 17-4, если считать верной пунктирную экстраполяцию приведенных на нем графиков (что приблизительно соответствует действительности). [c.112]
Т —температура, абсолютная температура. К [c.10]
В системе может существовать не одна, а несколько жидкостей. Многие системы содержат не только углеводороды, но и воду в жидкой фазе, так как они нерастворимы друг в друге. Они образуют отдельные жидкие фазы, имеющие различные свойства. Для системы, состоящей из паров, углеводородной жидкости и воды, р = 3 и и = 2. Подобными свойствами могут обладать и некоторые индивидуальные вещества. Например, гелий при температурах, близких к температуре абсолютного нуля, образует несколько жидких фаз, каждая из которых имеет свою характеристику. [c.26]
Подобными свойствами могут обладать и некоторые индивидуальные вещества. Например, гелий при температурах, близких к температуре абсолютного нуля, образует несколько жидких фаз, каждая из которых имеет свою характеристику. [c.26]
Постулат М. Планка отражает предельную, идеальную структуру рабочего тела при абсолютном нуле. Он формулируется в таком виде энтропия твердого индивидуального тела с идеальной кристаллической решеткой равна нулю при температуре абсолютного нуля. Практически значение теплоемкости сильно снижается при приближении к абсолютному нулю, а для некоторых твердых тел она принимает исчезающе малое значение уже в окрестности абсолютного нуля, как показано на рис. 25. [c.101]
Покажите, что при температуре абсолютного нуля, когда все частицы находятся на нулевом энергетическом уровне, молярная энтропия определяется уравнением 5о = / 1п о. где — статистический вес нулевого электронного уровня. [c.122]
Интенсивность подогрева воздуха после смешения с паром тем выше (при прочих равных условиях), чем ниже была его начальная температура. Абсолютные величины температур смеси [c.100]
Абсолютные величины температур смеси [c.100]
Как ВИДНО из приведен ных данных, несмотря на резкое снижение скорости коррозии при постоянном давлении и повышении температуры, абсолютная величина скорости коррозии остается довольно высокой, даже если считать, что характер коррозиовнопо поражения равномерный. [c.213]
Увеличится или уменьшится теплота реакции гидрирования этилена с температурой в интервале 300—1000° К Каков темп ее изменения с температурой Ответ. Теплота реакции уменьшится с температурой (абсолютная величина ее увеличивается, так как в данном случае АЯ[c.91]
Кривые спектрального распределения интенсивности характеризуются наличием максимума с резким спадом в сторону коротких волн и более пологим спадом в сторону длинных волн. Месторасположение максимума зависит от температуры абсолютно черного тела и с повышением ее смещается в сторону коротковолновой области спектра. [c.12]
Под поглощательной способностью тела обычно понимают его поглощательную способность по отношению к излучению абсолютно черного тела. В этом случае поглощательная способность любого тела определяется в долях от поглощательной способности абсолютно черного тела, принимаемой за единицу. Однако для соблюдения закона Кирхгофа поглощательная способность любого тела должна определяться при условии, что его температура равна температуре абсолютно черного источника излучения. [c.14]
В этом случае поглощательная способность любого тела определяется в долях от поглощательной способности абсолютно черного тела, принимаемой за единицу. Однако для соблюдения закона Кирхгофа поглощательная способность любого тела должна определяться при условии, что его температура равна температуре абсолютно черного источника излучения. [c.14]
Больцмана, основанной на максвелловском распределении частиц в газе по скоростям, использовать статистику Ферми, учитывающую принцип Паули. Тогда при температуре абсолютного нуля электронный газ обладает некоторой энергией, так как все электроны должны обладать различной энергией, т. е. только один электрон может иметь энергию, равную нулю. На рис. А.60 показано распределение энергии N электронов в объеме 1 см для трех значений температуры. Верхний энергетический уровень, занятый электронами при абсолютном нуле тем- [c.139]
При температуре абсолютного нуля в отсутствие других внешних зоздействий электроны в полупроводниках не обладают энергией, цостаточной для преодоления запрещенной зоны. Поэтому полу- проводник в этих условиях является диэлектриком. Следовательно, целение веществ на полупроводники и диэлектрики условно. Чем больше ширина запрещенной зоны, тем выше должна быть температура, при которой возникает электронно-дырочная проводимость. [c.118]
Поэтому полу- проводник в этих условиях является диэлектриком. Следовательно, целение веществ на полупроводники и диэлектрики условно. Чем больше ширина запрещенной зоны, тем выше должна быть температура, при которой возникает электронно-дырочная проводимость. [c.118]
Подобные рассуждения по процессам, происходящим в инфраструктуре различных реальных объектов, позволяют с известной степенью риска приближаться к более глубокому анализу и описанию нефтяных дисперсных систем. В этом случае необходимо сразу исключить возможность образования идеальной системы вследствие наличия в нефтяной дисперсной системе множества дефектов, не позволяющих ей, даже при температуре абсолютного нуля перейти в идеальное состояние, то есть достичь превращения в нуль остаточной энтропии системы. [c.175]
На основании изложенного ясно, что энтропия характеризует термодинамическую вероятность состояния системы. При абсолютном нуле большинство чистых веществ в кристаллическом состоянии находятся в самом низком энергетическом состоянии, которое возможно для системы. Ясно, что оно может реализоваться одним единственным способом. Поэтому в соответствии с (1.44) энтропия чистых кристаллических веществ при температуре абсолютного нуля обращается в нуль. Это утверждение можно рассматривать как формулировку третьего начала термодинамики. [c.23]
Ясно, что оно может реализоваться одним единственным способом. Поэтому в соответствии с (1.44) энтропия чистых кристаллических веществ при температуре абсолютного нуля обращается в нуль. Это утверждение можно рассматривать как формулировку третьего начала термодинамики. [c.23]
Наряду с тепловыми эффектами в термохимии часто используют понятие энергии связи. Энергия связи — это минимальная энергия, необходимая для удаления двух фрагментов (А и В) молекулы АВ на бесконечно большое расстояние друг от друга при температуре абсолютного нуля [c.41]
Можно уточнить значение энергии связи, если экстраполировать ее к температуре абсолютного нуля с учетом зависимостей теплоемкостей обоих фрагментов и исходной молекулы от температуры [c.41]
Чтобы понять, какое отношение имеет сказанное выше к энтропии, представим себе чистое вещество с идеальной кристаллической решеткой, находящееся при минимально возможной температуре-абсолютном нуле. В этом состоянии не совершается ни один из типов движения, о которьк было рассказано выше. Индивидуальные атомы и молекулы могут быть предельно хорошо (насколько это допустимо) охарактеризованы определенными положениями и энергией. Будем считать, что энтропия рассматриваемого вещества в описанном состоянии равна нулю. При повышении [c.179]
В этом состоянии не совершается ни один из типов движения, о которьк было рассказано выше. Индивидуальные атомы и молекулы могут быть предельно хорошо (насколько это допустимо) охарактеризованы определенными положениями и энергией. Будем считать, что энтропия рассматриваемого вещества в описанном состоянии равна нулю. При повышении [c.179]
Поскольку диффузность слоя противоионов определяется тепловым разбрасыванием, то при температуре абсолютного нуля все противоионы должны были бы находиться у твердой поверхности. [c.177]
Следовательно, целесообразно определить степень необратимости рассматриваемого стандартного процесса не с помощью количества переданной теплоты Q, а с помощью величины Q/6, где 0 — некоторая величина, количественно удовлетворяющая принятому определению температуры. Как только функция 0 будет определена, количественная характеристика степени деградации энергии окажется законченной. Мы удостоверимся в дальнейшем, что 0, которую Кельвин назвал термодинамической температурой, может быть полностью отождествлена с температурой абсолютной шкалы, которую мы раньше определили с помощью идеального газа. Поэтому положим 0 = 7″. Значение приведенного тепла Q/7 в этом процессе мы можем назвать возрастанием энтропии системы пружина — резервуар. Если Sa — энтропия в начале процесса, а Sb — в конце, то в соответствии с принятым определением можем записать [c.95]
Поэтому положим 0 = 7″. Значение приведенного тепла Q/7 в этом процессе мы можем назвать возрастанием энтропии системы пружина — резервуар. Если Sa — энтропия в начале процесса, а Sb — в конце, то в соответствии с принятым определением можем записать [c.95]
Равенство ( .27) доказывает, что отношение теплот Q2 Q равно отношению температур Тг/Ту при выражении с помощью шкалы газового термометра. Однако согласно уравнению ( .25) это же отношение равно отношению температур источников при выражении их с помощью абсолютной термодинамической шкалы. Из этого следует, что отношение двух температур по шкале газового термометра равно отношению двух температур абсолютной термодинамической шкалы, т. е. эти две температурные шкалы про- [c.102]
Если рассматривать в качестве гипотетической исходной модели твердого тела идеальный кристалл, находящийся при температуре абсолютного нуля, то все образующие его частицы будут занимать вполне определенные места, образуя правильную кристаллическую решетку.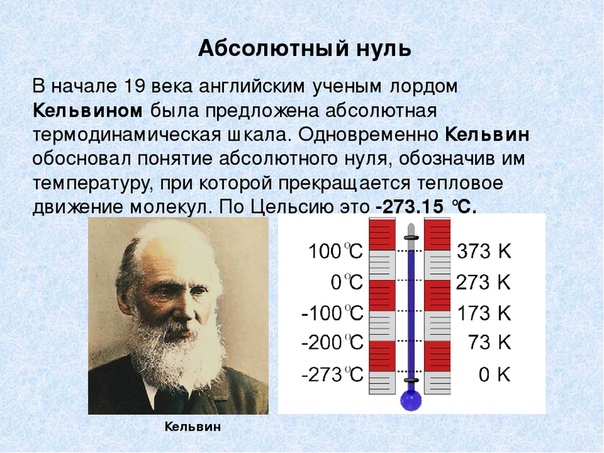 При повышении температуры, в результате теплового движения частиц, этот порядок нарушается. Часть частиц может покинуть свои места в узлах решетки (образуются вакантные узлы) и занять положение в междууз-лиях ( дефекты по Френкелю ). В некоторых случаях частица может покинуть положение в междуузлии и выйти на поверхность в этом случае в решетке образуются только вакантные места ( дефекты по Шоттки ). При данной температуре Г число п дефектов данного вида, находящихся в термодинамическом равновесии с кристаллической фазой, будет определяться выражением [c.339]
При повышении температуры, в результате теплового движения частиц, этот порядок нарушается. Часть частиц может покинуть свои места в узлах решетки (образуются вакантные узлы) и занять положение в междууз-лиях ( дефекты по Френкелю ). В некоторых случаях частица может покинуть положение в междуузлии и выйти на поверхность в этом случае в решетке образуются только вакантные места ( дефекты по Шоттки ). При данной температуре Г число п дефектов данного вида, находящихся в термодинамическом равновесии с кристаллической фазой, будет определяться выражением [c.339]
В уравнение Больцмана (16-5) входит важная физическая величина-число способов получения заданного состояния, Существует всего один способ упаковки идеального кристалла, при условии что молекулы неотличимы одна от другой и неподвижно упакованы среди своих соседей (последнее означает, что кристалл находится при температуре абсолютного нуля). Для идеального кристалла с неподвижными молекулами при О К И =1и5 = /с1п1=0. В отличие от этого существует множество эквивалентных способов построения 1 л определенного газа при заданных температуре и давлении. Нет никакой необходимости указывать индивидуальные положения молекул в газе и их индивидуальные скорости, для того чтобы газ соответствовал заданным условиям, ему достаточно иметь необходимое число молекул каждого сорта и необходимую молярную энергию все газы, удовлетворяющие этим условиям, должны казаться одинаковыми стороннему наблюдателю. Отсюда следует, что для любого газа величина IV очень велика, а значит, 1п И -положительное число и поэтому 5 = 1пИ больше нуля. Разумеется, даже идеальный кристалл должен обладать некоторой положительной энтропией, если он нагрет выше [c.56]
В отличие от этого существует множество эквивалентных способов построения 1 л определенного газа при заданных температуре и давлении. Нет никакой необходимости указывать индивидуальные положения молекул в газе и их индивидуальные скорости, для того чтобы газ соответствовал заданным условиям, ему достаточно иметь необходимое число молекул каждого сорта и необходимую молярную энергию все газы, удовлетворяющие этим условиям, должны казаться одинаковыми стороннему наблюдателю. Отсюда следует, что для любого газа величина IV очень велика, а значит, 1п И -положительное число и поэтому 5 = 1пИ больше нуля. Разумеется, даже идеальный кристалл должен обладать некоторой положительной энтропией, если он нагрет выше [c.56]
Поскольку в обеих реакциях происходит поглощение газа (кислорода) для них AS° абсолютной величине. Следовательно, при повышении температуры абсолютная величина АС° первой реакции будет сильнее [c.345]
При по ыщенир температуры вещество расщиряется, ослабляются силы взаимного притяжения между молекулами внутри вещества и в поверхностном слое. Поэтому с повышением температуры поверхностное натяжение уменьшается. При температурах более высоких, чем нормальная температура кипения данной жидкости, поверхностное натяжение измеряют уже не при атмосферном давлении, а при давлении насыщенного пара. Если результаты измерений представить графически, отложив поверхностное натяжение как функцию температуры (рис. 128), то зависимость для многих веществ оказывается линейной, почти вплоть до критической температуры, при которой поверхностное натяжение становится равным нулю, так как исчезает различие между жидкостью и паром. Основываясь на линейном уменьщении поверхностного натяжения с повышением температуры, Менделеев установил (1860) существование такой температуры, при которой поверхностное натяжение становится равным нулю. Выще этой температуры вещество уже не может находиться в жидком состоянии. Эту температуру Менделеев назвал температурой абсолютного кипения (позднее ее стали называть критической температурой). [c.357]
Поэтому с повышением температуры поверхностное натяжение уменьшается. При температурах более высоких, чем нормальная температура кипения данной жидкости, поверхностное натяжение измеряют уже не при атмосферном давлении, а при давлении насыщенного пара. Если результаты измерений представить графически, отложив поверхностное натяжение как функцию температуры (рис. 128), то зависимость для многих веществ оказывается линейной, почти вплоть до критической температуры, при которой поверхностное натяжение становится равным нулю, так как исчезает различие между жидкостью и паром. Основываясь на линейном уменьщении поверхностного натяжения с повышением температуры, Менделеев установил (1860) существование такой температуры, при которой поверхностное натяжение становится равным нулю. Выще этой температуры вещество уже не может находиться в жидком состоянии. Эту температуру Менделеев назвал температурой абсолютного кипения (позднее ее стали называть критической температурой). [c.357]
Вязкость нефти изменяется с температурой неравномерно сначала резко, затем более медленно причем чем выше температура, тем медленнее. Основное снижение вязкости большинства нефтей наблюдается при температурах до 70-90 °С [14, 36—40]. При дальнейшем повышении температуры абсолютное снижение вязкости незначительно, но относи-тельж)е еще достаточно велико (рис. 9), при температурах же выше 130 ° С и оно становится небольшим. Нефти разных месторождений различаются между собой по вязкости и скорости ее изменения с температурой. Известно много эмпирических формул, характеризующих изменение вязкости нефти и нефтепродуктов с температурой [33, 34]. Часто применяемой и дающей достаточную сходимость в широком интервале температур является формула Фульчера-Таммана [c.42]
Основное снижение вязкости большинства нефтей наблюдается при температурах до 70-90 °С [14, 36—40]. При дальнейшем повышении температуры абсолютное снижение вязкости незначительно, но относи-тельж)е еще достаточно велико (рис. 9), при температурах же выше 130 ° С и оно становится небольшим. Нефти разных месторождений различаются между собой по вязкости и скорости ее изменения с температурой. Известно много эмпирических формул, характеризующих изменение вязкости нефти и нефтепродуктов с температурой [33, 34]. Часто применяемой и дающей достаточную сходимость в широком интервале температур является формула Фульчера-Таммана [c.42]
Точка на диаграмме р—7, в которой сходятся к ривые зависимости давления от температуры для равновесий жидкость — пар, жидкость —твердая фаза и твердая фаза —пар, называется тройной точкой. При термодинамических параметрах тройной точки в системе находятся в равновесии одновременно три фазы твердая, жидкая и газообразная. Кривая сублимации твердой фазы идет от тройной точки до температуры абсолютного нуля, при которой давление в соответствии с тепловым законом Нернста приближается к нулю по касательной, параллельной оси температуры. Кривые равновесий жидкость — пар, жидкость — твердая фаза и твердая фаза — пар делят диаграмму состояния на три области области существования пара, жидкости и твердой фазы (рис. Б.25). Видно, что при температуре тройной то чки кончается область жидкости. Твердая фаза и пар могут существовать вплоть до абсолютного нуля температуры (даже вблизи абсолютного нуля над тве рдой фазой имеется некоторое давление пара данного вещества). Особую диаграмму состояния имеет гелий на ней нет тройной точки гелий находится в жидком состоянии при температуре, максимально близкой к абсолютному нулю для того чтобы перевести его в твердое состояние, необходимо увеличить давление до 2 МПа. [c.277]
Кривые равновесий жидкость — пар, жидкость — твердая фаза и твердая фаза — пар делят диаграмму состояния на три области области существования пара, жидкости и твердой фазы (рис. Б.25). Видно, что при температуре тройной то чки кончается область жидкости. Твердая фаза и пар могут существовать вплоть до абсолютного нуля температуры (даже вблизи абсолютного нуля над тве рдой фазой имеется некоторое давление пара данного вещества). Особую диаграмму состояния имеет гелий на ней нет тройной точки гелий находится в жидком состоянии при температуре, максимально близкой к абсолютному нулю для того чтобы перевести его в твердое состояние, необходимо увеличить давление до 2 МПа. [c.277]
Изменение энтальпии в химической реакции обычно нетрудно измерить при помощи калориметра, как описано в разд. 4.7, ч. 1. Однако для измерения изменений энтропии не существует столь простых способов. Тем не менее с помощью различных способов измерений можно определить абсолютную энтропию большого числа веществ при любой температуре.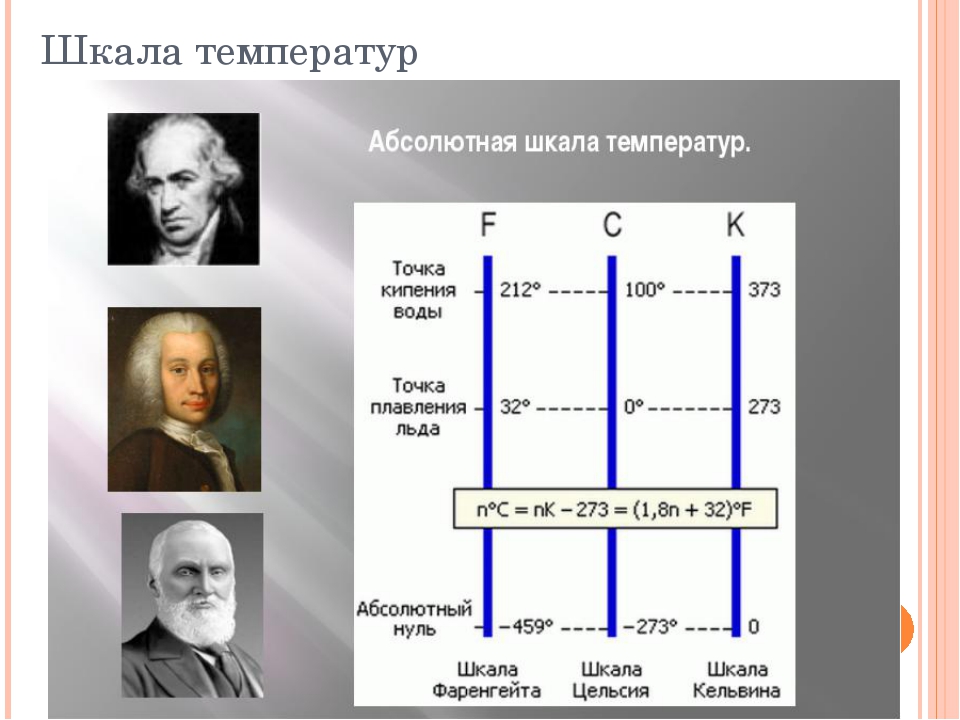 При получении значений энтропии исходят из того, что энтропия всякого чистого кристалла при температуре абсолютного нуля равна нулю. В приложении Г приведена таблица значений абсолютной энтропии (обычно обозначаемой как 5°) многих веществ. Эти значения выражены в единицах, имеющих размерность ДжДК-моль). [c.182]
При получении значений энтропии исходят из того, что энтропия всякого чистого кристалла при температуре абсолютного нуля равна нулю. В приложении Г приведена таблица значений абсолютной энтропии (обычно обозначаемой как 5°) многих веществ. Эти значения выражены в единицах, имеющих размерность ДжДК-моль). [c.182]
Физическая и коллоидная химия (1988) — [ c.28 , c.52 ]
Химический энциклопедический словарь (1983) — [ c.562 ]
Компьютерное материаловедение полимеров Т.1 Атомно-молекулярный уровень (1999) — [ c.114 ]
Основные формулы и данные по теплообмену для инженеров Справочник (1979) — [ c.16 ]
Большой энциклопедический словарь Химия изд.2 (1998) — [ c.562 ]
Химическая термодинамика (1963) — [
c. 19
]
19
]
Краткий курс физической химии Изд5 (1978) — [ c.211 ]
Термодинамика многокомпонентных систем (1969) — [ c.60 , c.73 ]
Учебник физической химии (1952) — [ c.25 , c.35 ]
Современная общая химия Том 3 (1975) — [ c.228 , c.231 ]
Краткая химическая энциклопедия Том 1 (1961) — [ c.17 ]
Техно-химические расчёты Издание 4 (1966) — [ c.22 ]
Современная общая химия (1975) — [ c.228 , c.231 ]
Физическая химия Том 1 Издание 5 (1944) — [
c. 219
,
c.301
]
219
,
c.301
]
Физическая и коллоидная химия (1974) — [ c.15 ]
Понятия и основы термодинамики (1970) — [ c.13 , c.183 ]
Основы химической термодинамики и кинетики химических реакций (1981) — [ c.14 ]
Химическая термодинамика Издание 2 (1953) — [ c.14 , c.20 , c.80 ]
Физическая химия для биологов (1976) — [ c.28 , c.29 ]
Учебник физической химии (0) — [ c.25 , c.35 ]
Основы химической кинетики (1964) — [
c. 137
]
137
]
Краткая химическая энциклопедия Том 1 (1961) — [ c.17 ]
Физическая химия Книга 2 (1962) — [ c.12 ]
Основы общей химии Том 2 Издание 3 (1973) — [ c.23 ]
Общая химия (1968) — [ c.35 ]
Термодинамика (0) — [ c.47 , c.48 ]
Справочник по физико-техническим основам глубокого охлаждения (1963) — [ c.7 , c.10 , c.19 , c.30 ]
Справочник инженера-химика Том 1 (1937) — [ c.22 ]
Техника низких температур (1962) — [
c. 151
,
c.161
,
c.169
,
c.171
,
c.183
]
151
,
c.161
,
c.169
,
c.171
,
c.183
]
Абсолютная температура в физике с формулой и примером
Абсолютная температура
Таким образом, величина которую, в отличие от микропараметра , легко измерить, является вполне однозначной характеристикой теплового состояния газа, как и температура. Измеряется (как и энергия) в джоулях. Зависит она только от температуры и может рассматриваться как естественная мера температуры. Однако в силу укоренившейся привычки измерять температуру в градусах был введён коэффициент пропорциональности между температурой , выраженной в энергетических единицах, и температурой , выраженной в градусах:
или
(2.11) Температура , определяемая равенством (2.10), называется абсолютной температурой.
Значения температуры, определённой по формуле (2.9), всегда положительны в силу положительности (ни давление, ни объём, ни число частиц отрицательными быть не могут). Поэтому минимальным значением температуры является нуль. Температура может равняться нулю, если давление либо объём равны нулю. Из принятого определения температуры следует, что нулем температуры является температура, при которой прекращается хаотическое движение молекул. Она называется абсолютным нулем температуры.
Температура, как и давление, определяется средней кинетической энергией молекул идеального газа. Поэтому температура, как и давление, является статистической величиной. Нельзя говорить о температуре одной или нескольких молекул.
Абсолютную шкалу температур ввёл английский учёный У. Кельвин в 1850 г. Нулевая температура по ней соответствует абсолютному нулю, а каждая единица температуры равна градусу по шкале Цельсия. Единица абсолютной температуры является одной из семи основных единиц СИ и измеряется в кельвинах (К).
Связь между температурами, измеренными по шкалам Цельсия (t) и Кельвина (Г), описывается формулой:
Абсолютный нуль равен -273,15°С. Как правило, при расчётах пользуются округлённым значением абсолютного нуля (-273 °C).
Постоянная Больцмана
Коэффициент в формуле (2.10) называется постоянной Больцмана в честь одного из основателей молекулярно-кинетической теории газа и составляет
Постоянная Больцмана связывает температуру 0 в энергетических единицах с температурой в кельвинах. Это одна из наиболее важных постоянных в МКТ.
Температура как мера кинетической энергии
Из основного уравнения МКТ, записанного в форме (2.9) и определения абсолютной температуры согласно (2.11) получим:
Средняя кинетическая энергия хаотического поступательного движения молекул газа пропорциональна абсолютной температуре.
Из полученного результата однозначно следует, что абсолютная температура есть мера средней кинетической энергии движения молекул.
Соотношение между температурой и кинетической энергией справедливо для любых тел, подчиняющихся законам механики Ньютона.
Из формулы (2.7) может быть получена зависимость давления газа от абсолютной температуры и концентрации его молекул, если воспользоваться выражением для средней кинетической энергии:
где — постоянная Больцмана.
Из формулы (2.12) очевидно, что при одинаковых давлениях и температурах концентрация молекул у всех газов одинакова.
Отсюда следует известный закон Авогадро:
В равных объёмах газов при одинаковых температурах и давлениях содержится одинаковое число молекул.
Средняя скорость теплового движения молекул может быть также выражена через абсолютную температуру, если в формуле
заменить на
Квадратный корень из этой величины — средняя квадратичная скорость:
Эта лекция взята со страницы лекций по всем темам предмета физика:
Предмет физика
Возможно эти страницы вам будут полезны:
Абсолютная температура – есть такое понятие
Мы все знаем, что окружающие нас тела бывают горячими или холодными. Стакан, в который налит кипяток, горячий, но тот же стакан, когда он пустой, – холодный. Мы чувствуем холод или тепло рукой, когда прикасаемся к стакану. А что именно мы ощущаем? Для понимания этого учеными было введено такое понятие, как температура.
Стакан, в который налит кипяток, горячий, но тот же стакан, когда он пустой, – холодный. Мы чувствуем холод или тепло рукой, когда прикасаемся к стакану. А что именно мы ощущаем? Для понимания этого учеными было введено такое понятие, как температура.
Первоначально, когда не была ещё создана молекулярно-кинетическая теория, ученые считали, что за температуру отвечает специальное вещество – теплород. Именно он, точнее, его количество, определяет, горячим или холодным будет тело. Это похоже на оценку того, насколько «крепкой» получилась смесь вещества и теплорода. Исходя из этой аналогии, крепость спиртных напитков и температура измеряются в одних и тех же единицах – градусах.
Сейчас температура считается мерой кинетической энергии молекул и служит, в частности, мерой степени нагрева тел. Для ее оценки ученые используют энергетические единицы: в системе единиц СИ это будет джоуль. Но измерять температуру начали задолго до появления энергетической теории. Как уже упоминалось, в повседневной деятельности используется специальная единица измерения – градус.
Практикуют несколько различных подходов к измерению температуры. Для каждого из них существует своя шкала температуры для установления единицы градуса. Они называются по именам ученых, предложивших способ определения – шкала Фаренгейта, Реомюра, Цельсия. Принцип заключается в том, что берут какой-то диапазон температур и делят его на определённое число. Так, по системе Цельсия 0 градусов равен температуре замерзания воды, а 100 градусов – температуре ее кипения. Данный диапазон делят на 100 и получают значение 1 градуса.
В каждой системе для установления значения в один градус используются свои опорные точки, при этом у одного и того же тела в каждой из них будет своя температура. Правда, ее значение можно переводить из одной шкалы в другую. Но ученые ввели новое понятие – абсолютная температура. Оно опять-таки связано с пониманием температуры как меры энергии теплового движения молекул.
Из данного подхода следует, что абсолютная температура – это та, которая отсчитывается от абсолютного нуля, представляющего собой значение температуры, при котором полностью отсутствует тепловое движение, а внутренняя энергия тела минимальна. Такой способ ее оценки производится по так называемой шкале Кельвина, за начало отсчета в которой принимают температуру абсолютного нуля, равную минус 273,15 градусов по Цельсию.
Такой способ ее оценки производится по так называемой шкале Кельвина, за начало отсчета в которой принимают температуру абсолютного нуля, равную минус 273,15 градусов по Цельсию.
Таким образом, абсолютная температура в повседневном понимании ничем не отличается от обычной – у нее просто другая точка начального отсчета. Конечно, никто не скажет, что на улице плюс 296,15 градусов Кельвина, когда там плюс 23 градуса Цельсия, хотя обе цифры будут справедливы. У температуры по шкале Кельвина – совсем другое применение, не связанное с житейскими ситуациями.
Получается, что абсолютная температура или температура по шкале Кельвина – это инструмент, которым пользуются в основном ученые. Применяют его при рассмотрении самых разных теоретических и практических вопросов, связанных с исследованиями свойств, возможностей и явлений, происходящих в окружающем мире. Обычных людей, не имеющих отношения к науке, больше должна интересовать возможность практического использования такого понятия, как абсолютная температура.
Введение определения абсолютного нуля приводит ко многим любопытным явлениям. Например, при попытках его достижения возникает такое явление как сверхпроводимость. Теоретически, если проводник электрического тока охладить до нуля градусов Кельвина (0°К), тепловое движение в объёме вещества прекратится, электрическое сопротивление проводника будет стремиться к нулю, и потери тока будут минимальны. Однако считается, что на практике абсолютный нуль температур недостижим, хотя в лабораторных условиях удалось приблизиться к данному значению максимально близко.
Не менее интересно такое явление, как сверхтекучесть. Если абсолютная температура газа начинает понижаться, то при некотором ее значении, для каждого газа своем, происходит переход газа в жидкость. Когда гелий превращается в жидкость, он приобретает способность проникать сквозь мельчайшие капилляры. Для использования в повседневной жизни подобные явления пока не применяются, но позволяют понять многие вопросы квантовой механики и фундаментальной науки.
Такое понятие, как абсолютная температура, используется в теоретических исследованиях и практических экспериментах по изучению окружающего мира. Кроме него, в статье рассмотрено само понятие температуры с точки зрения молекулярно-кинетической теории.
Что происходит при абсолютном нуле температуры. Абсолютный ноль температур
Предельную температуру, при которой объем идеального газа становится равным нулю, принимают за абсолютный нуль температуры.
Найдем значение абсолютного нуля по шкале Цельсия.
Приравнивая объем V в формуле (3.1) нулю и учитывая, что
.
Отсюда абсолютный нуль температуры равен
t = –273 °С. 2
Это предельная, самая низкая температура в природе, та «наибольшая или последняя степень холода», существование которой предсказал Ломоносов.
Наибольшие температуры на Земле – сотни миллионов градусов – получены при взрывах термоядерных бомб. Еще более высокие температуры характерны для внутренних областей некоторых звезд.
2Более точное значение абсолютного нуля: –273,15 °С.
Шкала Кельвина
Английский ученый У. Кельвин ввел абсолютную шкалу температур. Нулевая температура по шкале Кельвина соответствует абсолютному нулю, и единица температуры по этой шкале равна градусу по шкале Цельсия, поэтому абсолютная температура Т связана с температурой по шкале Цельсия формулой
Т = t + 273. (3.2)
На рис. 3.2 для сравнения изображены абсолютная шкала и шкала Цельсия.
Единица абсолютной температуры в СИ называется кельвином (сокращенно К). Следовательно, один градус по шкале Цельсия равен одному градусу по шкале Кельвина:
Таким образом, абсолютная температура по определению, даваемому формулой (3.2), является производной величиной, зависящей от температуры Цельсия и от экспериментально определяемого значения a.
Читатель: А какой физический смысл имеет абсолютная температура?
Запишем выражение (3. 1) в виде
1) в виде
.
Учитывая, что температура по шкале Кельвина связана с температурой по шкале Цельсия соотношением Т = t + 273, получим
где Т 0 = 273 К, или
Поскольку это соотношение справедливо для произвольной температуры Т , то закон Гей-Люссака можно сформулировать так:
Для данной массы газа при р = const выполняется соотношение
Задача 3.1. При температуре Т 1 = 300 К объем газа V 1 = 5,0 л. Определите объем газа при том же давлении и температуре Т = 400 К.
СТОП! Решите самостоятельно: А1, В6, С2.
Задача 3.2. При изобарическом нагревании объем воздуха увеличился на 1 %. На сколько процентов повысилась абсолютная температура?
= 0,01.
Ответ : 1 %.
Запомним полученную формулу
СТОП! Решите самостоятельно: А2, А3, В1, В5.
Закон Шарля
Французский ученый Шарль экспериментально установил, что если нагревать газ так, чтобы его объем оставался постоянным, то давление газа будет увеличиваться. Зависимость давления от температуры имеет вид:
Зависимость давления от температуры имеет вид:
р (t ) = p 0 (1 + bt ), (3.6)
где р (t ) – давление при температуре t °С; р 0 – давление при 0 °С; b – температурный коэффициент давления, который одинаков для всех газов: 1/К.
Читатель: Удивительно, что температурный коэффициент давления b в точности равен температурному коэффициенту объемного расширения a!
Возьмем определенную массу газа объемом V 0 при температуре Т 0 и давлении р 0 . В первый раз, поддерживая давление газа постоянным, нагреем его до температуры Т 1 . Тогда газ будет иметь объем V 1 = V 0 (1 + at ) и давление р 0 .
Во второй раз, поддерживая объем газа постоянным, нагреем его до той же температуры Т 1 . Тогда газ будет иметь давление р 1 = р 0 (1 + bt ) и объем V 0 .
Так как в обоих случаях температура газа одинакова, то справедлив закон Бойля–Мариотта:
p 0 V 1 = p 1 V 0 Þ р 0 V 0 (1 + at ) = р 0 (1 + bt )V 0 Þ
Þ 1 + at = 1 + bt Þ a = b.
Так что ничего удивительного в том, что a = b, нет!
Перепишем закон Шарля в виде
.
Учитывая, что Т = t °С + 273 °С, Т 0 = 273 °С, получим
Что такое абсолютный ноль (чаще — нуль)? Действительно ли эта температура существует где-либо во Вселенной? Можем ли мы охладить что-либо до абсолютного нуля в реальной жизни? Если вам интересно, можно ли обогнать волну холода, давайте исследуем самые дальние пределы холодной температуры…
Что такое абсолютный ноль (чаще — нуль)? Действительно ли эта температура существует где-либо во Вселенной? Можем ли мы охладить что-либо до абсолютного нуля в реальной жизни? Если вам интересно, можно ли обогнать волну холода, давайте исследуем самые дальние пределы холодной температуры…
Даже если вы не физик, вы, вероятно, знакомы с понятием температуры. Температура — это мера измерения количества внутренней случайной энергии материала. Слово «внутренней» очень важно. Бросьте снежок, и хотя основное движение будет достаточно быстрым, снежный ком останется довольно холодным. С другой стороны, если вы посмотрите на молекулы воздуха, летающие по комнате, обычная молекула кислорода жарит со скоростью тысяч километров в час.
С другой стороны, если вы посмотрите на молекулы воздуха, летающие по комнате, обычная молекула кислорода жарит со скоростью тысяч километров в час.
Мы обычно умолкаем, когда речь заходит о технических деталях, поэтому специально для экспертов отметим, что температура немного более сложная вещь, чем мы сказали. Истинное определение температуры подразумевает то, сколько энергии вам нужно затратить на каждую единицу энтропии (беспорядка, если хотите более понятное слово). Но давайте опустим тонкости и просто остановимся на том, что случайные молекулы воздуха или воды в толще льда будут двигаться или вибрировать все медленнее и медленнее, по мере понижения температуры.
Абсолютный ноль — это температура -273,15 градусов Цельсия, -459,67 по Фаренгейту и просто 0 по Кельвину. Это точка, где тепловое движение полностью останавливается.
Все останавливается?
В классическом рассмотрении вопроса при абсолютном нуле останавливается все, но именно в этот момент из-за угла выглядывает страшная морда квантовой механики. Одним из предсказаний квантовой механики, которое попортило кровь немалому количеству физиков, является то, что вы никогда не можете измерить точное положение или импульс частицы с совершенной определенностью. Это известно как принцип неопределенности Гейзенберга.
Одним из предсказаний квантовой механики, которое попортило кровь немалому количеству физиков, является то, что вы никогда не можете измерить точное положение или импульс частицы с совершенной определенностью. Это известно как принцип неопределенности Гейзенберга.
Если бы вы могли охладить герметичную комнату до абсолютного нуля, произошли бы странные вещи (об этом чуть позже). Давление воздуха упало бы практически до нуля, и поскольку давление воздуха обычно противостоит гравитации, воздух сколлапсирует в очень тонкий слой на полу.
Но даже в этом случае, если вы сможете измерить отдельные молекулы, вы обнаружите кое-что любопытное: они вибрируют и вращаются, совсем немного — квантовая неопределенность в работе. Чтобы поставить точки над i: если вы измерите вращение молекул углекислого газа при абсолютном нуле, вы обнаружите, что атомы кислорода облетают углерод со скоростью несколько километров в час — куда быстрее, чем вы предполагали.
Разговор заходит в тупик. Когда мы говорим о квантовом мире, движение теряет смысл. В таких масштабах все определяется неопределенностью, поэтому не то чтобы частицы были неподвижными, вы просто никогда не сможете измерить их так, словно они неподвижны.
В таких масштабах все определяется неопределенностью, поэтому не то чтобы частицы были неподвижными, вы просто никогда не сможете измерить их так, словно они неподвижны.
Как низко можно пасть?
Стремление к абсолютному нулю по существу встречается с теми же проблемами, что и стремление к скорости света. Чтобы набрать скорость света, понадобится бесконечное количество энергии, а достижение абсолютного нуля требует извлечения бесконечного количества тепла. Оба этих процесса невозможны, если что.
Несмотря на то, что мы пока не добились фактического состояния абсолютного нуля, мы весьма близки к этому (хотя «весьма» в этом случае понятие очень растяжимое; как детская считалочка: два, три, четыре, четыре с половиной, четыре на ниточке, четыре на волоске, пять). Самая низкая температура, когда-либо зарегистрированная на Земле, была зафиксирована в Антарктиде в 1983 году, на отметке -89,15 градусов Цельсия (184K).
Конечно, если вы хотите остыть не по-детски, вам нужно нырнуть в глубины космоса. Вся вселенная залита остатками излучения от Большого Взрыва, в самых пустых регионах космоса — 2,73 градуса по Кельвину, что немногим холоднее, чем температура жидкого гелия, который мы смогли получить на Земле век назад.
Но физики-низкотемпературщики используют замораживающие лучи, чтобы вывести технологию на совершенно новый уровень. Вас может удивить то, что замораживающие лучи принимают форму лазеров. Но как? Лазеры должны сжигать.
Все верно, но у лазеров есть одна особенность — можно даже сказать, ультимативная: весь свет излучается на одной частоте. Обычные нейтральные атомы вообще не взаимодействуют со светом, если частота не настроена точным образом. Если же атом летит к источнику света, свет получает допплеровский сдвиг и выходит на более высокую частоту. Атом поглощает меньшую энергию фотона, чем мог бы. Так что если настроить лазер пониже, быстродвижущиеся атомы будут поглощать свет, а излучая фотон в случайном направлении, будут терять немного энергии в среднем. Если повторять процесс, вы можете охладить газ до температуры меньше одного наноКельвина, миллиардной доли градуса.
Все приобретает более экстремальную окраску. Мировой рекорд самой низкой температуры составляет менее одной десятой миллиарда градуса выше абсолютного нуля. Устройства, которые добиваются этого, захватывают атомы в магнитные поля. «Температура» зависит не столько от самих атомов, сколько от спина атомных ядер.
Теперь, для восстановления справедливости, нам нужно немного пофантазировать. Когда мы обычно представляем себе что-то, замороженной до одной миллиардной доли градуса, вам наверняка рисуется картинка, как даже молекулы воздуха замерзают на месте. Можно даже представить разрушительное апокалиптическое устройство, замораживающее спины атомов.
В конечном счете, если вы действительно хотите испытать низкую температуру, все, что вам нужно, это ждать. Спустя примерно 17 миллиардов лет радиационный фон во Вселенной остынет до 1К. Через 95 миллиардов лет температура составит примерно 0,01К. Через 400 миллиардов лет глубокий космос будет таким же холодным, как самый холодный эксперимент на Земле, и после этого — еще холоднее.
Если вам интересно, почему вселенная остывает так быстро, скажите спасибо нашим старым друзьям: энтропии и темной энергии. Вселенная находится в режиме акселерации, вступая в период экспоненциального роста, который будет продолжаться вечно. Вещи буду замерзать очень быстро.
Какое нам дело?
Все это, конечно, замечательно, да и рекорды побивать тоже приятно. Но в чем смысл? Что ж, есть масса веских причин разбираться в низинах температуры, и не только на правах победителя.
Хорошие ребята из Национального института стандартов и технологий, например, просто хотели бы сделать классные часы. Стандарты времени основаны на таких вещах, как частота атома цезия. Если атом цезия движется слишком много, появляется неопределенность в измерениях, что, в конечном счете, приведет к сбою часов.
Но что более важно, особенно с точки зрения науки, материалы ведут себя безумно на экстремально низких температурах. К примеру, как лазер состоит из фотонов, которые синхронизируются друг с другом — на одной частоте и фазе — так и материал, известный как конденсат Бозе-Эйнштейна, может быть создан. В нем все атомы находятся в одном и том же состоянии. Или представьте себе амальгаму, в которой каждый атом теряет свою индивидуальность, и вся масса реагирует как один нуль-супер-атом.
При очень низких температурах многие материалы становятся сверхтекучими, что означает, что они могут совершенно не обладать вязкостью, укладываться сверхтонкими слоями и даже бросать вызов гравитации в достижении минимума энергии. Также при низких температурах многие материалы становятся сверхпроводящими, что означает отсутствие какого-либо электрического сопротивления.
Сверхпроводники способны реагировать на внешние магнитные поля таким образом, чтобы полностью отменять их внутри металла. В результате, вы можете объединить холодную температуру и магнит и получить что-то типа левитации.
Почему есть абсолютный ноль, но нет абсолютного максимума?
Давайте взглянем на другую крайность.32 K. Это в септиллион раз горячее, чем нутро нашего Солнца.
Опять же, мы совсем не уверены, самая ли это горячая температура из всех, что могли быть. Поскольку у нас даже нет большой модели вселенной в момент времени Планка, мы даже не уверены, что Вселенная кипятилась до такого состояния. В любом случае, к абсолютному нулю мы во много раз ближе, чем к абсолютной жаре.
Абсолютный температурный нуль соответствует 273,15 градусам Цельсия ниже нуля, 459,67 ниже нуля по Фаренгейту. Для температурной шкалы Кельвина такая температура сама по себе является нулевой отметкой.
Сущность абсолютного нуля температуры
Понятие абсолютного нуля исходит из самой сущности температуры. Любое тело , которую отдает во внешнюю среду в ходе . При этом снижается температура тела, т.е. энергии остается меньше. Теоретически этот процесс может продолжаться до тех пор, пока количество энергии не достигнет такого минимума, при котором отдавать ее тело уже не сможет.
Отдаленное предвестие такой идеи можно найти уже у М.В.Ломоносова. Великий русский ученый объяснял теплоту «коловратным» движением. Следовательно, предельная степень охлаждения – это полная остановка такого движения.
По современным представлениям, абсолютный нуль температуры – , при котором молекулы наименьшим возможным уровнем энергии. При меньшем количестве энергии, т.е. при более низкой температуре ни одно физическое тело существовать не может.
Теория и практика
Абсолютный нуль температуры – понятие теоретическое, достичь его на практике невозможно в принципе, даже в условиях научных лабораторий с самой сложной аппаратурой. Но ученым удается охлаждать вещество до очень низких температур, которые близки к абсолютному нулю.
При таких температурах вещества приобретают удивительные свойства, которых они не могут иметь при обычных обстоятельствах. Ртуть, которую называют «живым серебром» из-за ее пребывания в состоянии, близком к жидкому, при такой температуре становится твердой – до такой степени, что ею можно забивать гвозди. Некоторые металлы становятся хрупкими, как стекло. Такой же твердой и становится резина. Если при температуре, близкой к абсолютному нулю, ударить молотком какой-нибудь резиновый предмет, он разобьется, как стеклянный.
Такое изменение свойств тоже связано с природой теплоты. Чем выше температура физического тела, тем интенсивнее и хаотичнее двигаются молекулы. По мере снижения температуры движение становится менее интенсивным, а структура – более упорядоченной. Так газ становится жидкостью, а жидкость твердым телом. Предельный уровень упорядоченности – кристаллическая структура. При сверхнизких температурах ее приобретают даже такие вещества, которые в обычном состоянии остаются аморфными, например, резина.
Интересные явления происходят и с металлами. Атомы кристаллической решетки колеблются с меньше амплитудой, рассеяние электронов уменьшается, поэтому падает электрическое сопротивление. Металл приобретает сверхпроводимость, практическое применение которой представляется весьма заманчивым, хотя и труднодостижимым.
Источники:
- Ливанова А. Низкие температуры, абсолютный нуль и квантовая механика
Тело – это одно из основных понятий в физике, под которым подразумевается форма существования материи или вещества. Это материальный объект, который характеризуется объемом и массой, иногда также другими параметрами. Физическое тело явно отделено от других тел границей. Существует несколько особенных видов физических тел, не следует понимать их перечисление как классификацию.
В механике под физическим телом чаще всего понимается материальная точка. Это некая абстракция, главным свойством которой является факт того, что реальными размерами тела для решения конкретной задачи можно пренебречь. Иными , материальная точка – это вполне конкретное тело, которое имеет размеры, форму и прочие подобные характеристики, но они не важны для того, чтобы решить имеющуюся задачу. К примеру, если нужно посчитать объекта на определенном участке пути, с его длиной при решении задачи можно совершенно не считаться. Еще один тип физических тел, рассматриваемый механикой – это абсолютно твердое тело. Механика такого тела точно такая же, как и механика материальной точки, но дополнительно обладает и другими свойствами. Абсолютно твердое тело состоит из точек, но ни расстояние между ними, ни распределение массы не меняются под нагрузками, которым подвергается тело. Это означает, что оно не может быть деформировано. Чтобы определить положение абсолютно твердого тела, достаточно задать привязанную к нему систему координат, обычно декартову. В большинстве случаев центр массы является также и центром системы координат. В абсолютно твердого тела не существует, но для решения многих задач такая абстракция очень удобна, хотя в релятивистской механике она не рассматривается, так как при движениях, скорость которых сравнима со скоростью света, эта модель демонстрирует внутренние противоречия. Противоположностью абсолютно твердому телу является деформируемое тело, которого могут смещаться друг относительно друга. Существуют особенные типы физических тел и в других отраслях физики. Например, в термодинамике введено понятие абсолютно черного тела. Это идеальная модель, физическое тело, которое поглощает абсолютно все электромагнитное излучение, попадающее на него. При этом, само оно вполне может продуцировать электромагнитное излучение и иметь любой цвет. Пример объекта, который наиболее приближен по свойствам к абсолютно черному телу – это Солнце. Если взять вещества, распространенные за Земле, то можно вспомнить о саже, которая поглощает 99% , попадающего на нее, кроме инфракрасного, с поглощением которого справляется гораздо хуже.
Видео по теме
Когда в сводке погоды предсказывают температуру около нуля, на каток
идти не стоит: лед будет таять. Температура таяния льда принята за нуль
градусов по шкале Цельсия — самой распространенной температурной шкале.
Нам отлично знакомы отрицательные градусы шкалы Цельсия — градусы , градусы холода. Наиболее низкая температура на Земле была
зарегистрирована в Антарктиде: -88,3°Ц. Вне Земли возможны и еще более
низкие температуры: на поверхности Луны в лунную полночь бывает до —
160°Ц.
Но нигде не могут существовать сколь угодно низкие температуры.
Предельно низкая температура — абсолютный нуль — по шкале Цельсия
соответствует — 273,16°.
От абсолютного нуля берет начало абсолютная температурная шкала, шкала
Кельвина. Лед тает при 273,16° Кельвина, а вода кипит при 373,16° К.
Таким образом, градус К равен градусу Ц. Но по шкале Кельвина все
температуры положительны.
Почему же 0°К — предел холода?
Тепло — хаотическое движение атомов и молекул вещества. Когда вещество
охлаждают, у него отнимают тепловую энергию, и при этом беспорядочное
движение частиц ослабевает. В конце концов, при сильном охлаждении,
тепловая частиц почти полностью прекращается. Совсем замерли бы
атомы и молекулы при температуре, которая и принята за абсолютный нуль.
Согласно принципам квантовой механики, при абсолютном нуле прекратилось
бы именно тепловое движение частиц, но сами частицы не замерли бы, так
как они не могут находиться в полном покое. Таким образом, при
абсолютном нуле частицы все же должны сохранять какое-то движение,
которое называют нулевым.
Однако охладить вещество до температуры ниже абсолютного нуля — замысел столь же бессмысленный, как, скажем, намерение .
Более того, даже достичь точного абсолютного нуля практически тоже
невозможно. К нему можно лишь приблизиться. Потому что никакими способами нельзя отнять у вещества абсолютно всю его
тепловую энергию. Некоторая доля тепловой энергии остается при самом
глубоком охлаждении.
Как же достигают сверхнизких температур?
Заморозить вещество сложнее, чем нагреть. Это видно хотя бы из сравнения
устройства печки и холодильника.
В большинстве бытовых и промышленных холодильников тепло отнимается
благодаря испарению особой жидкости — фреона, который циркулирует по
металлическим трубкам. Секрет в том, что фреон может пребывать в жидком
состоянии лишь при достаточно низкой температуре. В холодильной камере
за счет тепла камеры он нагревается и кипит, превращаясь в пар. Но пар
сжимается компрессором, сжижается и поступает в испаритель, восполняя
убыль испаряющегося фреона. Энергия расходуется на работу компрессора.
В аппаратах глубокого охлаждения носителем холода служит сверххолодная
жидкость — жидкий гелий. Бесцветный, легкий (в 8 раз легче воды), он
кипит под атмосферным давлением при 4,2°К, а в вакууме — при 0,7°К. Еще
более низкую температуру дает легкий изотоп гелия: 0,3°К.
Устроить постоянно действующий гелиевый холодильник довольно сложно.
Исследования ведутся просто в ваннах с жидким гелием. А чтобы сжижить
этот газ, физики пользуются разными приемами. Например, расширяют
предварительно охлажденный и сжатый гелий, выпуская его через тонкое
отверстие в вакуумную камеру. При этом температура еще снижается и
некоторая часть газа обращается в жидкость. Более эффективно не только
расширять охлажденный газ, но и заставить его выполнять работу — двигать
поршень.
Полученный жидкий гелий хранят в специальных термосах — сосудах Дьюара.
Стоимость этой самой холодной жидкости (единственной не замерзающей у
абсолютного нуля) получается довольно высокой. Тем не менее жидкий гелий
в наши дни используется все шире, не только в науке, но и в различных
технических устройствах.
Самых низких температур удалось добиться иным способом. Оказывается,
молекулы некоторых солей, например хромокалиевых квасцов, могут
поворачиваться вдоль силовых магнитных линий. Такую соль предварительно
охлаждают жидким гелием до 1°К и помещают в сильное магнитное поле. При
этом молекулы поворачиваются вдоль силовых линий, а выделившееся тепло
отбирается жидким гелием. Затем магнитное поле резко снимают, молекулы
вновь поворачиваются в разные стороны, а затраченная
на это работа ведет к дальнейшему охлаждению соли. Так получили
температуру 0,001° К. Подобным же в принципе методом, применяя другие
вещества, можно получить еще более низкую температуру.
Наинизшая температура, полученная пока на Земле, равна 0,00001° К.
Сверхтекучесть
Вещество, замороженное до сверхнизких температур в ваннах с жидким гелием, заметно изменяется. Резина становится хрупкои, свинец — твердым, как сталь, и упругим, многие сплавы увеличивают прочность.
Своеобразно ведет себя сам жидкий гелий. При температуре ниже 2,2° К он
приобретает небывалое для обычных жидкостей свойство — сверхтекучесть:
некоторая его часть полностью теряет вязкость и без всякого трения
протекает сквозь самые узкие щели.
Явление это, открытое в 1937 г. советским физиком академиком П. JI.
Капицей, было затем объяснено академиком JI. Д. Ландау.
Оказывается, при сверхнизких температурах начинают заметно сказываться
квантовые законы поведения вещества. Как требует один из таких законов,
от тела к телу энергия может передаваться лишь вполне определенными
порциями-квантами. В жидком гелии так мало квантов тепла, что на все
атомы их не хватает. Часть жидкости, лишенная квантов тепла, пребывает
как бы при абсолютном нуле температуры, ее атомы совершенно не участвуют
в беспорядочном тепловом движении и никак не взаимодействуют со стенками
сосуда. Эта часть (ее назвали гелием-Н) и обладает сверхтекучестью. С
понижением температуры гелия-П становится все больше, и при абсолютном
нуле весь гелий превратился бы в гелий-Н.
Сверхтекучесть сейчас изучена очень подробно и даже нашла полезное
практическое применение: с ее помощью удается разделять изотопы гелия.
Сверхпроводимость
Возле абсолютного нуля чрезвычайно любопытные изменения происходят с
электрическими свойствами некоторых материалов.
В 1911 г. голландский физик Камерлинг-Оннес сделал неожиданное открытие:
оказалось, что при температуре 4,12° К в ртути полностью исчезает
электрическое сопротивление. Ртуть становится сверхпроводником.
Электрический ток, наведенный в сверхпроводящем кольце, не затухает и
может течь практически вечно.
Над таким кольцом сверхпроводящий шарик будет парить в воздухе и не
падать, будто сказочный , потому что его тяжесть
компенсируется магнитным отталкиванием между кольцом и шариком. Ведь
незатухающий ток в кольце создаст магнитное поле, а оно, в свою очередь,
наведет в шарике электрический ток и вместе с ним противоположно
направленное магнитное поле.
Кроме ртути, сверхпроводимостью возле абсолютного нуля обладают олово,
свинец, цинк, алюминий. Это свойство обнаружено у 23 элементов и более
ста различных сплавов и других химических соединений.
Температуры появления сверхпроводимости (критические температуры)
составляют довольно широкий интервал — от 0,35° К (гафний) до 18° К
(сплав ниобий-олово).
Явление сверхпроводимости, как и сверх-
текучести, подробно изучено. Найдены зависимости критических температур
от внутренней структуры материалов и внешнего магнитного поля.
Разработана глубокая теория сверхпроводимости (важный вклад внесен
советским ученым академиком Н. Н. Боголюбовым).
Сущность этого парадоксального явления опять-таки сугубо квантовая. При
сверхнизких температурах электроны в
сверхпроводнике образуют систему попарно связанных частиц, которые не
могут отдавать энергию кристаллической решетке, тратить кванты энергии
на ее нагревание. Пары электронов движутся, как бы , между
— ионами и обходят их без столкновений и передачи
энергии.
Сверхпроводимость все шире используется в технике.
Входят в практику, например, сверхпроводящие соленоиды — катушки из
сверхпроводника, погруженные в жидкий гелий. В них сколь угодно долго
может храниться однажды наведенный ток и, следовательно, магнитное поле.
Оно может достигать гигантской величины — свыше 100 ООО эрстед. В
будущем, несомненно, появятся мощные промышленные сверхпроводящие
устройства — электродвигатели, электромагниты и т. д.
В радиоэлектронике немалую роль начинают играть сверхчувствительные
усилители и генераторы электромагнитных волн, которые особенно хорошо
действуют в ваннах с жидким гелием, — там полностью исчезают внутренние
аппаратуры. В электронно-вычислительной технике блестящую
будущность сулят маломощным сверхпроводящим переключателям — криотронам
(см. ст. ).
Нетрудно представить себе, сколь заманчиво было бы продвинуть действие
подобных приборов в область более высоких, более доступных температур. В
последнее время открывается надежда создания полимерных пленочных
сверхпроводников. Своеобразный характер электропроводности в таких
материалах сулит блистательную возможность сохранить сверхпроводимость
даже при комнатных температурах. Ученые настойчиво ищут пути
осуществления этой надежды.
В недрах звезд
А теперь заглянем в царство самого горячего, что есть на свете, — в
недра звезд. Туда, где температуры достигают миллионов градусов.
Беспорядочное тепловое движение в звездах настолько интенсивно, что
целые атомы там существовать не могут: они разрушаются в бесчисленных
столкновениях.
Столь сильно раскаленное вещество поэтому не может быть ни твердым, ни
жидким, ни газообразным. Оно пребывает в состоянии плазмы, т. е. смеси
электрически заряженных атомов — атомных ядер и электронов.
Плазма — своеобразное состояние вещества. Поскольку ее частицы
электрически заряжены, они чутко повинуются электрическим и магнитным
силам. Поэтому близкое соседство двух атомных ядер (они несут
положительный заряд) — явление редкое. Лишь при высоких плотностях и
огромных температурах налетающие друг на друга атомные ядра способны
сблизиться вплотную. Тогда совершаются термоядерные реакции — источник
энергии звезд.
Ближайшая к нам звезда — Солнце состоит главным образом из водородной
плазмы, которая раскалена в недрах светила до 10 млн. градусов. При
таких условиях тесные сближения быстрых водородных ядер — протонов хоть
и редко, но случаются. Иногда сблизившиеся протоны вступают во
взаимодействие: преодолев электрическое отталкивание, они попадают во
власть гигантских ядерных сил притяжения, стремительно друг на
друга и сливаются. Тут происходит мгновенная перестройка: вместо двух
протонов возникают дейтрон (ядро тяжелого изотопа водорода), позитрон и
нейтрино. Освобождается энергия 0,46 млн. электрон-вольт (Мэв).
Каждый отдельно взятый солнечный протон может вступить в такую реакцию в
среднем один раз за 14 млрд. лет. Но протонов в недрах светила так
много, что то тут, то там совершается это маловероятное событие, — и
горит наша звезда своим ровным, ослепительным пламенем.
Синтез дейтронов лишь первый шаг солнечных термоядерных превращений.
Новорожденный дейтрон очень скоро (в среднем через 5,7 сек) соединяется
еще с одним протоном. Возникает ядро легкого гелия и гамма-квант
электромагнитного излучения. Освобождается 5,48 Мэв энергии.
Наконец, в среднем раз в миллион лет могут сойтись и соединиться два
ядра легкого гелия. Тогда образуется ядро обычного гелия (альфа-частица)
и отщепляются два протона. Выделяется 12,85 Мэв энергии.
Этот трехступенчатый термоядерных реакций не единственный.
Существует и другая цепочка ядерных превращений, более быстрых. В ней
участвуют (не расходуясь) атомные ядра углерода и азота. Но в обоих
вариантах из водородных ядер синтезируются альфа-частицы. Фигурально
выражаясь, водородная плазма Солнца , превращаясь в —
плазму гелия. И в процессе синтеза каждого грамма гелиевой плазмы
выделяется 175 тыс. квт-ч энергии. Огромное количество!
Ежесекундно Солнце излучает 4 1033 эргов энергии, теряя в весе 4 1012 г
(4 млн. т) вещества. Но полная масса Солнца 2 1027 т. Значит, за миллион
лет благодаря лучеиспусканию Солнце всего лишь на одну
десятимиллионную часть своей массы. Эти цифры красноречиво иллюстрируют
эффективность термоядерных реакций и гигантскую калорийность солнечного
— водорода.
Термоядерный синтез, по-видимому, главный источник энергии всех звезд.
При разных температурах и плотностях звездных недр осуществляются разные
типы реакций. В частности, солнечная -ядра гелия — при 100 млн.
градусов сама становится термоядерным . Тогда из альфа-частиц
могут синтезироваться еще более тяжелые атомные ядра — углерода и даже
кислорода.
Как считают многие ученые, вся наша Метагалактика в целом тоже плод
термоядерного синтеза, который проходил при температуре в миллиард
градусов (см. ст. ).
К искусственному солнцу
Необычайная калорийность термоядерного побудила ученых
добиваться искусственного осуществления реакций ядерного синтеза.
— изотопов водорода на нашей планете немало. Например,
сверхтяжелый водород тритий можно получить из металла лития в ядерных
реакторах. А тяжелый водород — дейтерий входит в состав тяжелой воды,
которую можно добыть из обычной воды.
Тяжелый водород, извлеченный из двух стаканов обычной воды, дал бы в
термоядерном реакторе столько энергии, сколько сейчас дает сжигание
бочки первосортного бензина.
Трудность заключается в том, чтобы предварительно нагреть до
температур, при которых оно способно воспламениться могучим термоядерным
огнем.
Впервые эта задача была решена в водородной бомбе. Изотопы водорода там
поджигаются взрывом атомной бомбы, что сопровождается нагревом вещества
до многих десятков миллионов градусов. В одном из вариантов водородной
бомбы термоядерным горючим служит химическое соединение тяжелого
водорода с легким литием — дейтерид легкого л и т и я. Этот белый
порошок, похожий на столовую соль, от , которой
служит атомная бомба, мгновенно взрывается и создает температуру в сотни
миллионов градусов.
Чтобы возбудить мирную термоядерную реакцию, надо прежде всего научиться
без услуг атомной бомбы разогревать малые дозы достаточно плотной плазмы
изотопов водорода до температур в сотни миллионов градусов. Эта проблема
— одна из труднейших в современной прикладной физике. Над ней уже много
лет работают ученые всего мира.
Мы уже говорили, что именно хаотическое движение частиц создает
нагретость тел, причем средняя энергия их беспорядочного движения и
соответствует температуре. Нагреть холодное тело — значит любым способом
создать этот беспорядок.
Вообразите, что две группы бегунов стремительно несутся навстречу друг
другу. Вот они столкнулись, перемешались, началась толчея, неразбериха.
Отличный беспорядок!
Примерно так же физики на первых порах пытались получить высокую
температуру — путем сталкивания газовых струй высокого давления. Газ
нагревался до 10 тыс. градусов. В свое время это был рекорд: температура
выше, чем на поверхности Солнца.
Но при этом способе дальнейший, достаточно медленный, не взрывной нагрев
газа невозможен, так как тепловой беспорядок мгновенно распространяется
во все стороны, согревая стенки экспериментальной камеры и окружающую
среду. Полученное тепло быстро покидает систему, и изолировать ее
невозможно.
Если струи газа заменить потоками плазмы, проблема теплоизоляции
остается очень трудной, но открывается и надежда на ее решение.
Правда, и плазму нельзя оградить от потерь тепла сосудами,
изготовленными из вещества пусть даже самого тугоплавкого. Соприкасаясь
с твердыми стенками, горячая плазма немедленно остывает. Зато можно
попытаться удержать и разогреть плазму, создав ее скопление в вакууме
так, чтобы она не касалась стенок камеры, а висела в пустоте, ни до чего
не дотрагиваясь. Тут следует воспользоваться тем, что частицы плазмы не
нейтральные, как атомы газа, а электрически заряженные. Поэтому в
движении они подвергаются действию магнитных сил. Возникает задача:
устроить магнитное поле особой конфигурации, в котором горячая плазма
висела бы как в мешке с невидимыми стенками.
Простейший вид такого п.эля создается автоматически, когда через плазму
пропускают сильные импульсы электрического тока. Вокруг плазменного
шнура при этом наводятся магнитные силы, которые стремятся сжать шнур.
Плазма отделяется от стенок разрядной трубки, и у оси шнура в толчее
частиц температура поднимается до 2 млн. градусов.
У нас в стране такие эксперименты были исполнены еще в 1950 г. под
руководством академиков JI. А. Арцимовича и М. А. Леонтовича.
Другое направление опытов — использование магнитной бутылки,
предложенной в 1952 г. советским физиком Г. И. Буд-кером, ныне
академиком. Магнитная бутылка устраивается в пробкотроне —
цилиндрической вакуумной камере, снабженной наружной обмоткой, которая
сгущается у концов камеры. Ток, протекающий по обмотке, создает в камере
магнитное поле. Его силовые линии в средней части располагаются
параллельно образующим цилиндра, а у концов сжимаются и образуют
магнитные пробки. Частицы плазмы, впрыснутой в магнитную бутылку, вьются
вокруг силовых линий, отражаются от пробок. В результате плазма
некоторое время удерживается внутри бутылки. Если энергия введенных в
бутылку плазменных частиц достаточно велика и их достаточно много, они
вступают в сложные силовые взаимодействия, их поначалу упорядоченное
движение запутывается, становится беспорядочным — температура водородных
ядер поднимается до десятков миллионов градусов.
Дополнительный нагрев достигается электромагнитными по плазме,
сжатием магнитного поля и т. д. Сейчас плазму ядер тяжелого водорода
раскаляют до сотен миллионов градусов. Правда, это удается сделать либо
на короткое время, либо при малой плотности плазмы.
Чтобы возбудить самоподдерживающуюся реакцию, предстоит дальше поднять
температуру и плотность плазмы. Добиться этого трудно. Однако проблема,
как убеждены ученые, бесспорно разрешима.
Г.Б. Анфилов
Размещение фотографий и цитирование статей с нашего сайта на других ресурсах разрешается при условии указания ссылки на первоисточник и фотографии.
АБСОЛЮТНЫЙ НОЛЬ
АБСОЛЮТНЫЙ НОЛЬ , температура, при которой все компоненты системы обладают наименьшим количеством энергии, допустимым по законам КВАНТОВОЙ МЕХАНИКИ; ноль на шкале температур по Кельвину, или -273,15 °С (-459,67° по Фаренгейту). При этой температуре энтропия системы — количество энергии, пригодной для совершения полезной работы, — также равняется нулю, хотя общее количество энергии системы может быть и отличным от нуля.
Научно-технический энциклопедический словарь .
Смотреть что такое «АБСОЛЮТНЫЙ НОЛЬ» в других словарях:
Температуры это минимальный предел температуры, которую может иметь физическое тело. Абсолютный ноль служит началом отсчёта абсолютной температурной шкалы, например, шкалы Кельвина. По шкале Цельсия абсолютному нулю соответствует температура −273 … Википедия
АБСОЛЮТНЫЙ НОЛЬ ТЕМПЕРАТУРЫ — начало отсчёта термодинамической шкалы температуры; расположен на 273,16 К (Кельвин) ниже (см.) воды, т.е. равен 273,16°С (Цельсия). Абсолютный ноль предельно низкая температура, в природе и практически недостижимая … Большая политехническая энциклопедия
Это минимальный предел температуры, которую может иметь физическое тело. Абсолютный ноль служит началом отсчёта абсолютной температурной шкалы, например, шкалы Кельвина. По шкале Цельсия абсолютному нулю соответствует температура −273,15 °C.… … Википедия
Абсолютный ноль температуры это минимальный предел температуры, которую может иметь физическое тело. Абсолютный ноль служит началом отсчёта абсолютной температурной шкалы, например, шкалы Кельвина. По шкале Цельсия абсолютному нулю соответствует… … Википедия
Разг. Пренебр. Ничтожный, незначительный человек. ФСРЯ, 288; БТС, 24; ЗС 1996, 33 …
ноль — абсолютный ноль … Словарь русской идиоматики
Ноль и нуль сущ., м., употр. сравн. часто Морфология: (нет) чего? ноля и нуля, чему? нолю и нулю, (вижу) что? ноль и нуль, чем? нолём и нулём, о чём? о ноле, нуле; мн. что? ноли и нули, (нет) чего? нолей и нулей, чему? нолям и нулям, (вижу)… … Толковый словарь Дмитриева
Абсолютный ноль (нуль). Разг. Пренебр. Ничтожный, незначительный человек. ФСРЯ, 288; БТС, 24; ЗС 1996, 33 В ноль. 1. Жарг. мол. Шутл. ирон. О сильном опьянении. Югановы, 471; Вахитов 2003, 22. 2. Жарг. муз. Точно, в полном соответствии с… … Большой словарь русских поговорок
абсолютный — абсолютный абсурд абсолютный авторитет абсолютный безупречность абсолютный беспорядок абсолютный вымысел абсолютный иммунитет абсолютный лидер абсолютный минимум абсолютный монарх абсолютный мораль абсолютный ноль … … Словарь русской идиоматики
Книги
- Абсолютный ноль , Абсолют Павел. Жизнь всех творений безумного ученого расы нэсов очень коротка. Но у очередного эксперимента появляется шанс на существование. Что же ждет его впереди?…
Абсолютная температура — Викизнание… Это Вам НЕ Википедия!
Абсолютная температура измеряется в градусах Кельвина и ведет отсчет от асболютного нуля. Впервые «Абсолютная температура» как понятие было введено в 1848 году Томсоном Кельвином.
Абсолютная температура — температура, отсчитываемая от абсолютного нуля (см .), т. е. от точки, лежащей на 273,16° ниже температуры таю-шего льда но шкале Цельсия. Понятие А. т. было введено В. Тпмсоном (лордом Кельвином) (см.), в связи с чем шкала А. т. обозначается часто буквой К (Кельвин), подобно тому, как буквой С обозначается шкала Цельсия. Величина А. т. обозначается обычно буквой Т. Таким образом, точка кипения воды при атмосферном давлении по шкале А. т. равна: Г=г-100°-|-273,160=373,160К..
Несмотря на то, что температура является величиной, хорошо известной из повседневного опыта, точно определить её нелегко, т. к. измерение температуры при помощи термометров не позволяет установить её как величину, независимую от механических, тепловых и других свойств применяемых при этом веществ. Например, вследствие неодинаковой зависимости коэфициента расширения различных жидкостей и газов от температуры, показания в различных термометрах (ртутном, спиртовом, газовом и др.), вообще говоря, никогда не совпадают (за исключением точек 0° и 100°). Как показывает опыт, такие трудно сжижаемые газы, как водород, азот и другие, подчиняются весьма близким закономерностям, приближаясь в разреженном состоянии при низких давлениях к так называемому классическому идеальному easy (см.). Именно, при повышении температуры на 1° С объём этих газов 1) увеличивается приблизительно на 1/273 их объема при 0°, если давление р остаётся постоянным (закон Гей-Люссака). Если ж объём сохранять постоянным, то при нагревании на 1°С давление увеличивается также приблизительно па Vara- Обе эти закономерности описываются формулой Клапейрона для идеальных газов: pv-RT (R — газовая постоянная, если взять грамм-молекулу газа).Таким образом, мерой газовой температуры может служить либо изменение объёма, либо (как всегда используется на практике) изменение давления газа (при постоянном объёме). Если бы указанные законы идеальных газов оставались справедливыми при всех температурах, то при -273°С, или точнее нри -273,160С, объём газа или, соответственно,
давление оказались бы равными нулю. Эта точка и есть абсолютный нуль температуры. На самом доле все реальные газы, как выяснилось уже после опытов Реньо в 1-й четверти 19 в., показывают нек-рые характерные для каждого газа отступления от указанных законов. Напр, даже при высоких температурах вместо А. т. 300°К водородный газовый термометр покажет 299,983°К, а азотный покажет 299,973°К. При низких же температурах, когда особенно заметными становятся взаимодействия молекул, а также влияние их размеров, и все газы превращаются в жидкость, не может быть никакой речи об «исчезновении» объёма или давления или о справедливости указанных законов идеальных газов. Кроме того, при низких температурах с особой силой проявляются различные квантовые эффекты (см. Кванты), так что даже идеальные газы (при пренебрежении взаимодействием и объёмом частиц) должны рассматриваться согласно квантовой статистике (см.), а не па основании классич. теории. Всё же благодаря близости водорода к идеальному газу можно использовать водородный термометр в широком интервале для измерений А. т., введя соответствующие поправки, что и было закреплено рядом международных соглашений, установивших практически водородную температурную шкалу как шкалу А. т. Однако весьма существенно полностью избежать произвола, заключающегося в применении тех или иных реальных газов, и построить шкалу температур, основывающуюся на каком-либо универсальном законе.
В 1848 Томсон указал на подобную принципиальную возможность определения температуры, не зависящего от свойств термометрии, веществ, при помощи второго закона термодинамики (см.). Именно, если в тепловом двигателе рабочее вещество, совершающее обратимый круговой процесс (см. in-ie Э11Г
N1|O(-1U градус’
Важнейшее значение А. т. заключается в том, что она является наиболее естественной мерой теплового движения и применяется поэтому во всех фундаментальных законах физики, определяющих зависимость энергии молекул от температуры, зависимость энергии излучения от температуры и т. д. По классической теории, вполне пригодной при высоких температурах, на одну степень свободы любого тела приходится в среднем в со стоянии теплового равновесия энергия E=kT/2, т. е., например, на поступательное движение молекулы идеального газа, коллоидной частицы и т. д.-3/2 kT.
Распространение понятия А. т. на поле излучения, находящееся в тепловом равновесии, дано русским физиком Б. Б. Голицыным (см.). Дальнейшее исследование принципиальных вопросов термодинамики и статистической физики, связанных с понятием абсолютной температуры, освещено в работах Болышана, Гиббса и русских физиков — В. А. Мн-хельсопа, Н. Н. Шиллера и Т. А. Афаиасьеной-Эронфест.
Лит.: М л о д з е е в о к н и Л. В., Термодинамика, 2 изд., М., 1948: Ван-дер-Ваальс И. Д., К о н-стамм Ф., Курс термостатики, пер. с нем…, ч. 1-2, М., 1У36; л е о н т о в и ч М. А., Статистическая физика, М.- л., 1944; Г и б б с Д ж. В., Основные шшнщшы статистической механики…, пер. с англ…, М. — л., 1940.
Требуется проверка викификации!
Шаблон:Проверить источникиСтатья из Большой советской энциклопедии
Эта статья подлежит модернизации и корректировке!
Если Вы заметили неточность — Вы можете исправить её с помощью ссылки редактировать (или править) на этой странице.
Требуется сведение текстов!
Эта статья фактически состоит из нескольких не связанных между собой фрагментов. Требуется исправить ее так, чтобы она была однородной! Вы можете сделать это с помощью ссылки редактировать или править.
Что такое абсолютная температура? — Вселенная сегодня
Если вы измеряете температуру относительно абсолютного нуля, температура является абсолютной температурой; абсолютный ноль равен 0.
Наиболее широко используемая шкала абсолютных температур — это шкала Кельвина, обозначаемая заглавной буквой K, в которой используются градусы по шкале Цельсия (есть еще одна шкала, шкала Ренкина, которая связана со шкалой Фаренгейта). Мы пишем температуру в кельвинах без символа градуса; абсолютный ноль равен 0 К.
Другое название абсолютной температуры — термодинамическая температура.Почему? Потому что абсолютный умеренный климат напрямую связан с термодинамикой; фактически именно Нулевой закон термодинамики приводит к (формальному) определению (термодинамической) температуры.
Грубо говоря, температура объекта (или подобного, например газа в воздушном шаре) измеряет кинетическую энергию частиц (атомов, молекул и т. Д.) Вещества, из которого он состоит… в среднем смысле и макроскопически. Обратите внимание, что капли вещества имеют гораздо больше энергии, чем просто кинетическая энергия атомов в капле — есть энергия, которая удерживает атомы вместе в молекулах (если они есть), энергия связи ядер (если блог не чистый водород без дейтерия) и т. д .; ни одна из этих энергий не учитывается в температуре капли.
Вы можете подумать, что при абсолютном нуле вещество находится в самом низком энергетическом состоянии, особенно если это чистое соединение (или изотопно чистый элемент). Что ж, это не так просто … не говоря уже об энергии нулевой точки (что-то довольно противоречивое, из квантовой механики), есть тот факт, что многие твердые тела имеют несколько различных стабильных кристаллических структур (даже при 0 К), но только одну с минимальной энергией. Затем идет гелий, который является жидкостью при 0 К (твердая фаза вещества имеет более низкую энергию, чем соответствующая жидкая фаза), если только он не находится под давлением.
Кельвин является одной из основных единиц Международной системы единиц (СИ) (их семь) и определяется по отношению к тройной точке воды (« Кельвин, единица термодинамической температуры, представляет собой дробную часть 1. / 273,16 термодинамической температуры тройной точки воды »- определение 1967/8 г., текущее определение, принятое в 2005 г., расширяет его, чтобы учесть изотропные вариации).
Почему он называется Кельвином? Потому что Уильям Томпсон — лорд Кельвин — был первым, кто описал шкалу абсолютных температур в статье, написанной им в 1848 году; он также оценил абсолютный ноль, как -273 o C.
Project Skymath дает хорошее введение в абсолютную температуру.
Некоторые материалы «Вселенная сегодня», которые могут вас заинтересовать: «Абсолютный ноль», «Самая низкая температура из когда-либо созданных» и «Первый свет Планка».
Источники: Википедия, Гиперфизика
Нравится:
Нравится Загрузка …
Отрицательные абсолютные температуры | Группа Квантовой Оптики
Здесь мы даем ответы на часто задаваемые вопросы по интригующей теме отрицательных абсолютных температур.
Здесь мы хотим ответить на некоторые часто задаваемые вопросы об отрицательных абсолютных температурах. Если на ваш вопрос еще нет ответа, отправьте электронное письмо Саймону Брауну или Ульриху Шнайдеру, и мы добавим его.
Что такое абсолютная температура?
Абсолютная температура относится к температуре по шкале Кельвина, где 0K — это точка абсолютного нуля, при которой все движение в классическом газе прекращается.
Могут ли все системы достигать отрицательных температур?
Нет! Большинство систем, в том числе классический газ (например.грамм. воздух вокруг нас), ограничиваются положительными абсолютными температурами.
Чтобы иметь возможность достигать отрицательных температур, система должна обладать верхней границей энергии ее частиц, то есть максимально возможной энергией, которую может иметь частица системы.
Этот предел не является внешним пределом в том смысле, что просто больше нет доступной энергии. Это внутренний предел — частицы не могут поглотить больше энергии, даже если ее достаточно. Например, атомы в классическом газе не имеют такого верхнего предела энергии — их кинетическая энергия может быть сколь угодно высокой.Даже скорость света как предел скорости для частиц не накладывает ограничения на их кинетическую энергию: хотя скорость частиц ограничена скоростью света, кинетическая энергия может быть сколь угодно высокой.
На самом деле идея отрицательной абсолютной температуры устарела, но редко обсуждалась для мобильных частиц, потому что все полагали, что ее невозможно реализовать.
Действительно ли ваша система холоднее нуля по Кельвину?
Нет! Нет ничего холоднее абсолютного нуля (0К)!
Отрицательные абсолютные температуры (или отрицательные температуры по Кельвину) горячее, чем все положительные температуры — даже горячее, чем бесконечная температура.
Что на самом деле означает «горячее» или «холоднее»?
Возьмите два стакана воды, один с горячей водой, а другой с холодной. Если смешать воду, получится вода средней температуры. На языке термодинамики это означает, что тепло передавалось от горячей воды к холодной, пока они оба не достигли одинаковой температуры.
Таким образом, тепло всегда течет от более горячей системы к более холодной.
А поскольку системы с отрицательной температурой обладают большим количеством энергии, тепло будет течь от систем с отрицательной температурой к системам с положительной температурой.
Вы изменили определение температуры?
Нет. Мы используем определение температуры из учебника.
Как формально определяется температура?
Температура определяется через энтропию: величина, обратная температуре (1 / T), определяется как изменение энтропии (S) в системе при изменении полной энергии E системы: 1 / T = ∂S / ∂E .
Полная энергия — это сумма энергии всех частиц системы, а энтропия объясняется позже в этом FAQ. Ниже мы показываем типичную кривую зависимости энтропии от энергии в системе, которая имеет минимальную (E min ) и максимальную (E max ) энергию.Наклон этой кривой показывает, как энтропия изменяется с энергией, ∂S / ∂E, и, следовательно, дает обратную температуру, 1 / T.
Определение температуры: Если энергия в системе минимальна (E мин ), все частицы находятся в минимально возможном энергетическом состоянии, а энтропия равна нулю. Кривая в этой точке вертикальная с бесконечным наклоном, поэтому температура равна нулю. Если энергия увеличивается, частицы начинают занимать более высокие энергетические состояния, и энтропия увеличивается.Однако при низких энергиях всегда больше частиц, чем при высоких — обычное распределение Больцмана (см. Зеленую кривую). Наклон зависимости энтропии от энергии уменьшается, и, следовательно, температура увеличивается. В какой-то момент, когда в системе достаточно энергии, частицы равномерно распределяются по всем энергетическим состояниям. Беспорядок и, следовательно, энтропия максимальны (S max ). Кривая в этой точке полностью плоская с нулевым наклоном, поэтому температура бесконечна.Если общая энергия в системе еще больше увеличится, больше частиц будет занимать высокие энергии, чем низкие энергии — распределение Больцмана будет инвертировано. Поскольку распределение энергии снова сужается, беспорядок и, следовательно, энтропия начинают уменьшаться. Это очень необычное поведение — обычно энтропия увеличивается с увеличением энергии. В этом режиме наклон кривой отрицательный, следовательно, и абсолютная температура отрицательна. Если энергия в системе максимальна (E max ), все частицы имеют максимально возможную энергию.Энтропия снова равна нулю. Кривая снова вертикальная, поэтому температура снова равна нулю, но на этот раз с отрицательными значениями. Таким образом, хотя температуры положительной и отрицательной бесконечности физически идентичны, температуры положительного и отрицательного нуля сильно различаются. Скачок температуры от положительной бесконечности к отрицательной является следствием исторического определения температуры. Если бы температура была определена по-другому, например, как -β = -1 / T, как показано во второй строке, такой неоднородности не было бы.
Определение температуры: если энергия в системе минимальна (E мин ), все частицы находятся в самом низком возможном энергетическом состоянии, а энтропия равна нулю. Кривая в этой точке вертикальная с бесконечным наклоном, поэтому температура равна нулю. Если энергия увеличивается, частицы начинают занимать более высокие энергетические состояния, и энтропия увеличивается. Однако при низких энергиях всегда больше частиц, чем при высоких — обычное распределение Больцмана (см. Зеленую кривую).Наклон зависимости энтропии от энергии уменьшается, и, следовательно, температура увеличивается. В какой-то момент, когда в системе достаточно энергии, частицы равномерно распределяются по всем энергетическим состояниям. Беспорядок и, следовательно, энтропия максимальны (S max ). Кривая в этой точке полностью плоская с нулевым наклоном, поэтому температура бесконечна. Если общая энергия в системе еще больше увеличится, больше частиц будет занимать высокие энергии, чем низкие энергии — распределение Больцмана будет инвертировано.Поскольку распределение энергии снова сужается, беспорядок и, следовательно, энтропия начинают уменьшаться. Это очень необычное поведение — обычно энтропия увеличивается с увеличением энергии. В этом режиме наклон кривой отрицательный, следовательно, и абсолютная температура отрицательна. Если энергия в системе максимальна (E max ), все частицы имеют максимально возможную энергию. Энтропия снова равна нулю. Кривая снова вертикальная, поэтому температура снова равна нулю, но на этот раз с отрицательными значениями.
Таким образом, хотя температуры положительной и отрицательной бесконечности физически идентичны, температуры положительного и отрицательного нуля сильно различаются.
Скачок температуры от положительной бесконечности к отрицательной является следствием исторического определения температуры. Если бы температура была определена по-другому, например, как -β = -1 / T, как показано во второй строке, такой неоднородности не было бы.
Что такое энтропия и как она связана с температурой?
Энтропия — это мера беспорядка в системе.
Это связано с количеством энергетических состояний, которые заняты частицами: если занято только одно энергетическое состояние, как, например, самое низкое энергетическое состояние в случае нулевой температуры по Кельвину, система очень упорядочена и энтропия равно нулю. Однако, если частицы распределены по многим энергетическим состояниям, низкой и высокой энергии, система сильно разупорядочена и энтропия велика. Температура определяется через энтропию — см. Выше.
Что на самом деле означает температура?
В классическом газе — подумайте о множестве независимых бильярдных шаров — температура описывает, как частицы распределяются по своим возможным состояниям, например по их скоростям.Поскольку эти состояния могут иметь разные энергии, это означает, что в таком газе все атомы вместе имеют одну определенную температуру, но отдельные атомы не имеют одинаковой энергии.
Распределение энергий называется распределением Больцмана и описывает следующее: при абсолютном нуле (плюс ноль) все частицы находятся в состоянии покоя, а их кинетическая энергия равна нулю. Таким образом, распределение энергий имеет острый пик в нуле — здесь все атомы — и в противном случае равен нулю. Если вы сейчас нагреете газ, вы увеличите его температуру и общую энергию, и этот острый пик расширится (см. Левую вставку на приведенном выше рисунке).Итак, теперь вы можете найти некоторые атомы с более высокими энергиями. Но вы все равно найдете больше атомов в состоянии с более низкой энергией, чем в состоянии с более высокой энергией. Чем горячее становится газ, тем шире и мельче становится этот пик, пока при бесконечной температуре распределение не станет полностью плоским и все состояния будут равновероятными (средняя вставка).
Отрицательная температура теперь означает, что это распределение перевернуто или перевернуто, так что вы обнаружите больше атомов в более высоком энергетическом состоянии, чем в более низком (правая вставка).Это означает, что пик в распределении больше не при самой низкой энергии, а при максимально возможной энергии.
В общем, тепловое распределение учитывает не только кинетическую энергию, но и все формы энергии, которыми могут обладать частицы, например потенциальную энергию или магнитную энергию.
Как вы измеряете температуру? Вы ставите термометр рядом с атомами?
Измерение температуры — действительно сложная задача. К сожалению, мы не можем поместить термометр в нашу систему рядом с атомами.
Вместо этого мы делаем изображения наших атомов с помощью камеры CCD. Эти изображения показывают нам распределение атомов. Для каждой температуры мы теоретически ожидаем определенного распределения. Мы сравниваем распределение наших атомов с теоретически ожидаемыми распределениями. Лучше всего подходит распределение, которое дает нам температуру атомов.
Действительно ли ваши атомы имеют отрицательную абсолютную температуру или они просто так себя ведут?
Наши атомы действительно имеют отрицательную абсолютную температуру!
Способ определения температуры говорит нам следующее: если система термализуется, т.е.е. пытается достичь теплового равновесия, и если мы можем описать распределение системы с некоторым распределением Больцмана, и если это распределение остается стабильным в течение некоторого времени, мы знаем, что система достигла теплового равновесия. Затем мы можем присвоить системе соответствующую температуру. Тогда система действительно имеет эту температуру. В нашем случае, поскольку распределение Больцмана наших атомов инвертировано, эта температура отрицательна.
Как мне относиться к оси температур? Я всегда думал, что он идет от нуля до бесконечности.
Для большинства систем (например, классического газа) это правильно, поскольку в этих системах не может быть отрицательных абсолютных температур. Для тех систем, которые могут допускать отрицательные температуры, шкала температур также начинается с плюса нуля, увеличивается до бесконечности, затем перескакивает до минус бесконечности и увеличивается до минус нуля.
Означает ли это, что температура круговая?
Нет! Плюс ноль и минус ноль в этом случае не связаны, фактически они находятся как можно дальше.
Подумайте об обычной строке вещественных чисел: она начинается с минус бесконечности, проходит через ноль и продолжается до плюс бесконечности. Теперь представьте, как разрезать эту линию с нулевой отметкой на две части. В итоге вы получите две строки, одна идет от минус бесконечности до нуля, этот конец называется минус ноль; а вторая часть — от плюс нуля до плюс бесконечности. Теперь мы склеиваем два конца в точках плюс и минус бесконечности и тянем два свободных конца у нулей. Итак, мы заканчиваем такой строкой:
+0, …, + 10, …, + infinity, -infinity, …, — 10, …, — 0
Таким образом, два нуля находятся как можно дальше друг от друга, фактически плюс ноль соответствует состоянию, в котором все частицы находятся в состоянии с наименьшей энергией ( нижняя часть долины на рисунке ниже), а минус ноль соответствует состоянию, когда все частицы находятся в состоянии с максимально возможной энергией (вершина холма).
Температура в игре в шарики
Распределение тепла (или распределение Больцмана) можно проиллюстрировать с помощью шаров, которые расположены на холмистой местности, где высота символизирует энергию шаров.При положительных температурах (левый рисунок), что является обычным явлением в повседневной жизни, большинство шаров лежит в долине около минимума энергии. Это показывает, что состояния с малой полной энергией более вероятны, чем состояния с большой полной энергией — обычное распределение Больцмана. При плюсовой или минусовой бесконечной температуре (центральная фигура) шары равномерно распределяются по низким и высоким энергиям в одном и том же ландшафте. Здесь все энергетические состояния равновероятны. Однако при отрицательных температурах (правый рисунок) большинство шаров можно найти на вершине холма, на верхнем пределе возможных энергий.Энергетические состояния с большой полной энергией заняты больше, чем состояния с малой полной энергией — распределение Больцмана инвертировано.
Распределение тепла (или распределение Больцмана) можно проиллюстрировать с помощью шаров, которые расположены на холмистой местности, где высота символизирует энергию шаров. При положительных температурах (левый рисунок), что является обычным явлением в повседневной жизни, большинство шаров лежит в долине около минимума энергии. Это показывает, что состояния с малой полной энергией более вероятны, чем состояния с большой полной энергией — обычное распределение Больцмана.При плюсовой или минусовой бесконечной температуре (центральная фигура) шары равномерно распределяются по низким и высоким энергиям в одном и том же ландшафте. Здесь все энергетические состояния равновероятны. Однако при отрицательных температурах (правый рисунок) большинство шаров можно найти на вершине холма, на верхнем пределе возможных энергий. Энергетические состояния с большой полной энергией заняты больше, чем состояния с малой полной энергией — распределение Больцмана инвертировано.
Почему вам нужен верхний предел энергии для состояния с отрицательной температурой, а не для состояния с положительной температурой?
На самом деле ситуация полностью симметрична: вам нужна нижняя граница энергии, чтобы получить положительные температуры, и верхнюю границу, чтобы получить отрицательные температуры.
Самый интуитивный способ увидеть это — рассмотреть картину долины и холма: при небольших положительных температурах вы найдете большинство шариков рядом с самой низкой точкой, около дна долины, которая представляет собой нижнюю границу энергии. Если бы не было такой границы, вместо этого была бы бесконечно глубокая дыра, и все шарики продолжали бы падать в яму, никогда не достигнув стабильного состояния. Для отрицательных температур, когда все частицы хотят скапливаться на вершине горы, мы аналогичным образом требуем, чтобы гора имела конечную высоту.
Для классической картины свободно движущихся частиц кинетическая энергия, очевидно, имеет нижнюю границу — частицы стоят на месте, так что нам редко приходится задумываться об этом требовании.
Как могут плюс бесконечность и минус бесконечность быть одним и тем же?
В статистической механике температура T используется не так часто. В большинстве случаев мы используем β, что является обратным: β = 1 / T. Что касается β, плюс бесконечная температура и минус бесконечная температура одинаковы, а именно ноль. Фактически, -β был бы лучшим выбором для определения температуры, поскольку он проходит от минус бесконечности через ноль до плюс бесконечности, тем самым избегая скачка от плюса к минус бесконечности и путаницы с «горячими отрицательными абсолютными температурами».(см. также «Как формально определяется температура?»)
Действительно ли атомы стабильны при отрицательной абсолютной температуре или вы просто удерживаете атомы на месте при максимальной энергии?
Атомы при отрицательной абсолютной температуре сами по себе действительно стабильны!
Создаем систему с несколькими лазерными лучами и магнитным полем в вакуумной камере. Все вместе это составляет среду, в которой «живут» атомы, мир с яркими и темными областями, в которых атомы заперты.Как только атомы подготовлены при отрицательной абсолютной температуре, когда энергия многих атомов близка к максимальной, они остаются там. Они остаются там столько же, сколько атомы с положительной абсолютной температурой в сопоставимой системе, которые в основном находятся в минимальной энергии.
Это можно проиллюстрировать на изображении выше. При положительной температуре большая часть мрамора лежит в долине. Это состояние стабильно — это природа, какой мы ее знаем. Если шарики лежат на вершине холма, они обычно скатываются с холма и тем самым преобразуют потенциальную энергию в кинетическую.Однако, если эти шарики имеют отрицательную абсолютную температуру, все их энергетические формы будут близки к максимально допустимым значениям. На картинке это очевидно верно для потенциальной энергии, поскольку шарики лежат на вершине холма, самой высокой точки ландшафта. Но это также верно и для кинетической энергии: шарики на вершине холма движутся быстро. Поскольку кинетическая энергия не может увеличиваться дальше, шарики не могут преобразовывать потенциальную энергию в кинетическую энергию. Поэтому они вообще не могут скатиться.Они держатся на вершине холма — система устойчива.
Разве атомы с отрицательной абсолютной температурой, которые горячее бесконечности, не должны сжечь вашу лабораторию?
Нет. Здесь важно учитывать количество энергии, которое содержится в системе.
Наши атомы очень горячие в том смысле, что они содержат много энергии: энергия большинства атомов близка к максимуму, допускаемому верхним пределом их энергии. Однако эта максимальная энергия очень мала по сравнению, например, с кинетической энергией типичной молекулы воды в горшке с водой при комнатной температуре.Вдобавок наша система при отрицательной абсолютной температуре состоит всего из около ста тысяч атомов. Это примерно на 17 порядков меньше, чем количество молекул воды всего в миллилитре воды. Если вы суммируете энергию всех наших атомов, общая энергия, содержащаяся в нашей системе при отрицательной абсолютной температуре, поэтому очень мала по сравнению с энергиями, к которым мы привыкли в повседневной жизни.
Определенно легче навредить себе кастрюлей с кипятком. Хотя вода имеет не отрицательную абсолютную температуру, а «только» положительную абсолютную температуру, общая энергия, содержащаяся в горшке, будет намного выше, чем в нашей системе.Если вы окунете палец в горячую воду, к нему будет передано много энергии, и это будет больно. Однако, если бы вы могли погрузить палец в нашу систему, было бы передано очень мало энергии.
Откуда вы берете верхний предел кинетической энергии?
Мы помещаем наши атомы в так называемую оптическую решетку, которая состоит из периодического потенциала, создаваемого мешающими лазерными лучами. Для наших атомов этот периодический потенциал действует так же, как потенциал, образованный ионами в твердом теле, действует на электроны — он создает зонную структуру.
Это означает, что из-за этого потенциала кинетическая энергия распадается на разные полосы, например валентная зона и зона проводимости в металле или полупроводнике. Эти зоны разделены по энергии так называемыми запрещенными зонами — энергетическими областями без каких-либо состояний для частиц. Следовательно, каждая полоса, естественно, имеет как нижнюю, так и верхнюю границу кинетической энергии. Мы поместили все наши атомы в одну из этих полос и, следовательно, создали требуемый верхний предел кинетической энергии.
Это само по себе в настоящее время обычно выполняется во многих лабораториях.Новым ингредиентом в нашей работе является то, что мы также установили верхние пределы для энергии взаимодействия и потенциальной энергии. Последнюю, например, мы ограничили, превратив оптическую ловушку, в которой находятся атомы, в антиловушку, то есть превратив долину в холм.
Есть ли у лазеров отрицательная абсолютная температура?
Нет! Температуру можно приписать только состоянию теплового равновесия. Это означает, что, если оставить ее в покое (когда система термически изолирована), она останется стабильной и не изменится с течением времени.Частицы в лазерной среде действительно имеют инвертированную энергетическую населенность — больше частиц находится в возбужденных состояниях, чем в состояниях с низкой энергией — и их распределение действительно похоже на состояние при отрицательной температуре. Однако эта инвертированная энергетическая совокупность существует только до тех пор, пока лазер непрерывно накачивается, то есть частицы активно накачиваются в возбужденные состояния. Когда вы выключите накачку, все атомы вернутся в нижнее состояние, и их энергия перейдет в лазерный луч. Таким образом, во время накачки лазерная среда находится в устойчивом состоянии , но не в тепловом состоянии .Он не находится в тепловом равновесии и, следовательно, не может иметь температуру.
Что это за возможная связь с космологией?
Мы могли бы показать, что наша атомная система стабильна, даже несмотря на то, что атомы сильно притягиваются друг к другу — это означает, что они хотят схлопнуться, но не могут из-за того, что находятся при отрицательной температуре.
И Вселенная в целом тоже не коллапсирует под действием силы притяжения гравитации — наоборот, ее расширение ускоряется. В космологии темная энергия вводится именно для описания этого эффекта.
Но указывает ли это на некую связь или это просто совпадение, еще неизвестно.
Что такое абсолютный ноль?
Наука полна нулей. Свет имеет нулевую массу. У нейтронов нулевой заряд. Математическая точка имеет нулевую длину. Эти нули могут быть незнакомыми, но они следуют последовательной логике. Все представляют собой отсутствие определенного качества: массы, электрического заряда, расстояния.
Тогда есть загадочный случай абсолютного нуля.
Мы склонны думать о горячем и холодном как об относительных вещах.Например, чашка чая часовой выдержки холоднее, чем огонь на плите, но горячее, чем кубик льда. Абсолютный ноль представляет собой самую низкую возможную температуру, что противоречит модели «это по сравнению с тем».
Связанные
Еще более странно то, что абсолютный ноль даже не равен нулю на температурных шкалах, используемых неучеными. Это минус 273,15 градуса по шкале Цельсия или минус 459,67 градуса по Фаренгейту.
Как может быть самая низкая температура?
Ключ к расшифровке абсолютного нуля — это понимание температуры.Это просто мера того, насколько быстро движутся атомы или молекулы в веществе, или, если быть более точным, средняя кинетическая энергия этих частиц.
Думайте об этом как об атомной игре в вышибалы. Когда мяч попадает в вас, вы чувствуете его энергию. Триллионы и триллионы этих попаданий в вышибалы, происходящие в невидимо малых масштабах, и есть то, что мы воспринимаем как температуру.
Быстро движущиеся атомы сильно ударяются, что мы ощущаем как высокую температуру. Когда горячий объект касается холодного объекта, более быстрые и горячие атомы передают часть своей скорости более медленным и холодным.Горячий объект остывает. Холодный объект становится теплее.
Теперь ноль в абсолютном нуле имеет смысл: Абсолютный ноль — это температура, при которой частицы в веществе по существу неподвижны. Их нельзя еще больше замедлить, поэтому более низкой температуры быть не может.
Все перестает двигаться при абсолютном нуле? Не совсем. Атомы не совсем неподвижны; они колеблются в результате эффектов, связанных с квантовой физикой. И, конечно же, активность внутри каждого атома продолжается, как бы холодно он ни становился.Электроны продолжают двигаться, как и протоны и нейтроны.
Кто открыл абсолютный ноль?
Гийом Амонтон, французский изобретатель, потерявший слух в детстве и никогда не учившийся в колледже, в 1702 году понял основную концепцию. Его эксперименты показали, что давление воздуха пропорционально температуре, и он пришел к выводу, что существует минимальная температура, при которой давление упадет до нуля. Он даже оценил эту температуру, минус 240 градусов по Цельсию, что очень близко к фактическому значению.
В 1848 году шотландско-ирландский физик Уильям Томсон, более известный как лорд Кельвин, расширил работу Амонтона, разработав то, что он назвал «абсолютной» температурной шкалой, которая применима ко всем веществам. Он установил абсолютный ноль как 0 на своей шкале, избавившись от громоздких отрицательных чисел. Физики теперь полагаются на шкалу Кельвина (K) для измерения температуры.
Где самое холодное место во Вселенной?
Энергия, оставшаяся от Большого взрыва, нагревает всю Вселенную, удерживая ее значительно выше абсолютного нуля.Средняя температура космоса составляет 2,74 Кельвина, или минус 454,7 градуса по Фаренгейту.
Удивительно, но некоторые небесные объекты холоднее пустого космоса. Расширяющееся газовое облако, называемое туманностью Бумеранг, ведет себя как межзвездный холодильник. Это самое холодное место в космосе с температурой около 1 К.
Связанные
Но люди стали холоднее, чем здесь, на Земле. В 2003 году исследователи из Массачусетского технологического института использовали лазерные лучи, чтобы замедлить атомы натрия, охладив их до половины миллиардной градуса выше абсолютного нуля.Это все еще мировой рекорд.
Самое холодное место за пределами Земли тоже искусственно. Прошлым летом астронавты активировали эксперимент под названием «Лаборатория холодного атома» на борту Международной космической станции. Лаборатория достигла температуры в 30 миллионов раз ниже, чем в пустом пространстве. «Я работал над этой идеей, время от времени, более 20 лет, — говорит Роберт Томпсон из Лаборатории реактивного движения НАСА, один из исследователей, разработавших эксперимент. «Это невероятное чувство — наблюдать, как это работает.
Что происходит, когда материя становится настолько холодной?
Если Томпсон звучит взволнованно, то это потому, что ультрахолодные атомы ведут себя увлекательно и потенциально полезно. Во-первых, они теряют свою индивидуальность, сливаясь, образуя причудливое состояние материи, называемое конденсатом Бозе-Эйнштейна.
«У нас есть люди, стремящиеся использовать конденсаты для практических целей, таких как улучшение спутниковой навигации, в то время как другие пытаются проверить фундаментальные теории физики или моделировать физику ранней Вселенной», — говорит Томпсон.
Близко к абсолютному нулю, также можно управлять химическими реакциями способами, которые невозможны в других условиях.
Прошлой весной химик из Гарварда Канг-Куен Ни собрал молекулу непосредственно из двух низкотемпературных, медленно движущихся атомов, что сделало его самым маленьким химическим экспериментом, который когда-либо проводился. В таких условиях становятся очевидными тонкие эффекты квантовой физики. «При таких ультрахолодных температурах мы действительно можем наблюдать волновую природу атомов и молекул», — говорит она.
Затем Ni надеется изучить неоткрытые правила химии и разработать новые молекулы. Другие вероятные применения экспериментов с абсолютным нулем включают прецизионные датчики и часы — возможно, даже сверхмощные квантовые компьютеры, которые технологические компании продолжают многообещать. В области сверххолодных исследований можно сказать, что предел — это предел.
ХОТИТЕ БОЛЬШЕ ИСТОРИЙ О ФИЗИКЕ?
ПОДПИСАТЬСЯ НА NBC NEWS MACH В TWITTER, FACEBOOK И INSTAGRAM.
Температура
Температура (иногда называемая термодинамической температурой) — это мера средней кинетической энергии частиц в системе.Температура — это степень « тепла, » (или « холод, ») — мера интенсивности тепла . Наиболее распространенное обозначение или сокращение для обозначения температуры — T .
Когда два объекта с разной температурой соприкасаются, более теплый объект становится холоднее, а более холодный объект становится теплее. Это означает, что тепло перетекает от более теплого объекта к более холодному.
Конвертер температуры
Преобразование между ° C (Цельсий), ° F, (Фаренгейт), K (Кельвин) и ° R (Ранкин) с помощью калькулятора ниже:
| Ренкин | Кельвин | Фаренгейт | Цельсий | |||||||
| ° R | K 9028 | 0 | -459.67 | -273,15 | ||||||
| 100 | 55,56 | -359,67 | -217,59 | |||||||
| 180 | 100 | -279,67 | -173 -17,78 | |||||||
| 491,67 | 273,15 | 32 | 0 | |||||||
| 559,67 | 310,93 | 100 | 37,78 | |||||||
| 67 | 373,15 | 212 | 100 |
Конвертер температуры — веб-приложение
Добавьте веб-приложение преобразователя температуры на свое мобильное устройство или рабочий стол. Приложение сохраняется в вашем браузере и автоматически работает в автономном режиме после первого посещения.
Градус Цельсия (° C) и Градус Фаренгейта (° F)
Термометр может помочь нам определить, насколько холодным или горячим является вещество. Температура в большинстве стран мира измеряется и указывается в градусах Цельсия ( ° C ). В США принято указывать температуру в градусов по Фаренгейту ( ° F ) . В шкалах Цельсия и Фаренгейта в качестве контрольных точек используются температуры, при которых лед тает (вода замерзает) и вода закипает.
- По шкале Цельсия точка замерзания воды определяется как 0 ° C , а точка кипения определяется как 100 ° C
- По шкале Фаренгейта вода замерзает при 32 ° F и кипит при 212 ° F
По шкале Цельсия между точкой замерзания и точкой кипения воды находится 100 градусов по сравнению с 180 градусов по шкале Фаренгейта.Это означает, что 1 ° C = 1,8 ° F (см. Раздел о разнице температур ниже).
Значения можно преобразовать между двумя единицами измерения температуры с помощью уравнений:
T (° F) = 1,8 T (° C) + 32 (1)
T (° C) = (T ( ° F) — 32) / 1,8 (2)
где
T (° C) = температура (° C)
T (° F) = температура (° F)
Цельсия vs.По Фаренгейту
| Температура | |||
|---|---|---|---|
| o C | o F | ||
| -20 | -4 | -20-4 | -20-4 | —
| 14 | |||
| -5 | 23 | ||
| 0 | 32 | ||
| 5 | 41 | ||
| 10 | 50 | 20 | 68 |
| 25 | 77 | ||
| 30 | 86 | ||
| 35 | 95 | ||
| 40 | 104 | ||
| 40 | 104 | 122 | |
Пример : Пациент с атипичной пневмонией (респиратор для тяжелых острых состояний). y Syndrome) имеет температуру 106 ° F.Какая температура в градусах Цельсия?
T (° C) = (106 ° F — 32) / 1,8 = 41,1 o C
Таблица преобразования температуры —
o C vs ° FРазница температур — или Изменение температуры — градус Цельсия по сравнению с градусом Фаренгейта
Обратите внимание, что для разницы температур (изменения) — как показано на диаграммах потерь тепла
- 1 градус Цельсия разницы температур равен 1.8 градусов Фаренгейта разницы температур
ΔT (° C) = ΔT (° F) / 1,8 (3)
ΔT (° F) = 1,8 ΔT (° C) (4)
где
ΔT (° F) = разность температур (° F)
ΔT (° C) = разность температур (° C)
Пример : Вода охлаждается от 100 ° C до 60 ° C.Какая разница температур в ° F?
Разница температур в градусах Цельсия:
ΔT (° C) = 100 ° C 60182 = 40 C ° температура относительно 273.15 K) и C ° используется для разницы температур.
Разница температур в градусах Фаренгейта, рассчитанная с использованием (1)
100 ° C = 1,8 (100 ° C ) + 32 = 212 ° F
60 ° C = 1,8 (60 ° C ) + 32 = 140 ° F
ΔT (° F) 212 ° F — 140 ° F = 72 ° F
Разница температур в градусах Фаренгейта, рассчитанная с использованием (3)
(ΔT) ) = 1.8 (40 C ° Температурный преобразователь = 72 ° F Разница
C °
° F
Кельвин — K
Другая шкала (общепринятая в науке) — Кельвин или шкала абсолютной температуры .По шкале Кельвина самая низкая возможная температура, –273 ° C , имеет значение 0 Кельвина ( 0 K ) и называется абсолютным нулем. Единицы по шкале Кельвина называются Кельвинами ( K ), и символ градуса не используется.
Потому что не бывает температур ниже 0 К — шкала Кельвина не имеет отрицательных чисел.
Кельвин имеет ту же инкрементную шкалу, что и шкала Цельсия, и одна единица Кельвина равна по размеру одной единице Цельсия:
1 единица Кельвина = 1 единица ° C
ΔT (° K) = ΔT ( ° C) (5)
Чтобы вычислить температуру Кельвина, добавьте 273 к температуре Цельсия:
T (K) = T (° C) + 273.15 (6)
Пример: Какова нормальная температура тела 37 o C по шкале Кельвина?
T (K) = T ( ° C) + 273,15 = 37 ° C
градусов Ренкина — R
В английской системе абсолютная температура выражается в градусах Ранкина (R) , а не в градусах Фаренгейта:
T (° R) = 1.8 * T (K) (7)
T (° R) = 1,8 * (T (° C) +273,15)
T (° R) = T (° F) + 459,67 (8)
ΔT (° R) = ΔT (° F) (9)
Конвертер Цельсия в Фаренгейта (и наоборот)
Загрузите и распечатайте Конвертер Цельсия в Фаренгейта!
Абсолютная температура
Термодинамическая температура — это абсолютная мера температуры.Это один из основных параметров термодинамики и кинетической теории газов. Термодинамическая температура — это «абсолютная» шкала, потому что это мера фундаментального свойства, лежащего в основе температуры: ее нулевая или нулевая точка («абсолютный ноль») — это температура, при которой частицы, составляющие материю, имеют минимальное движение и не могут стать холоднее. То есть они имеют минимальное движение, сохраняя только квантово-механическое движение, как показано на рисунке.
График зависимости давления от температуры
График зависимости давления от температуры для различных газов при постоянном объеме.Обратите внимание, что все графики экстраполированы на нулевое давление при одной и той же температуре
В самом простом случае, «температура» возникает из кинетической энергии случайных движений составляющих материальных частиц, таких как молекулы или атомы, как показано на рис. Поэтому разумно выбрать абсолютный ноль, при котором все классическое движение прекращается, в качестве точки отсчета (T = 0) нашей температурной системы. Используя шкалу абсолютных температур (система Кельвина), которая является наиболее часто используемой термодинамической температурой, мы показали, что средняя поступательная кинетическая энергия (KE) частицы в газе имеет простую связь с температурой:
Поступательное движение гелия
Реальные газы не всегда ведут себя в соответствии с идеальной моделью при определенных условиях, например при высоком давлении.Здесь размер атомов гелия относительно их расстояния показан в масштабе при давлении 1950 атмосфер.
$ \ overline {KE} = \ frac {3} {2} kT $.
Обратите внимание, что это уравнение не выглядело бы так элегантно, если бы вместо него использовалась шкала Фаренгейта.
Шкала Кельвина
Кельвин (или «абсолютная температура») — это стандартная термодианмическая единица измерения температуры. Это одна из семи основных единиц Международной системы единиц (СИ), которой присвоен символ единицы K.По международному соглашению единица измерения кельвина и ее шкала определяются двумя точками: абсолютным нулем и тройной точкой Венской стандартной средней океанской воды (вода с определенной смесью изотопов водорода и кислорода). Абсолютный ноль, минимально возможная температура, определяется как 0 K и −273,15 ° C. Тройная точка воды определяется точно как 273,16 K и 0,01 ° C.
Температура
В твердых телах частицы, составляющие твердое тело, плотно удерживаются вместе, поэтому их движение ограничивается колебаниями назад и вперед в их заданных положениях.В жидкостях частицы могут двигаться вперед и назад друг относительно друга, но сам объект не имеет определенной формы. В газах частицы движутся по доступному объему, взаимодействуя друг с другом и со стенками любого контейнера, в котором они находятся. Во всех случаях полная тепловая энергия объекта — это сумма кинетических энергий составляющих его частиц.
Вместо того, чтобы просто смотреть на сумму кинетических энергий всех отдельных частиц, вы могли бы исследовать среднюю кинетическую энергию частиц, составляющих объект, понимая, что фактические кинетические энергии отдельных частиц могут значительно различаться.Средняя кинетическая энергия частиц напрямую связана с температурой объекта следующим уравнением:
Рассматривая это уравнение, средняя кинетическая энергия дается в Джоулях, k B — постоянная Больцмана (1,38 × 10 -23 Дж / К), а температура дается в Кельвинах, единицах измерения температуры в системе СИ. Обратите внимание, что даже если два объекта могут иметь одинаковую температуру (и, следовательно, одинаковую среднюю кинетическую энергию), они могут иметь разные внутренние энергии.
Шкала Кельвина тесно связана с температурной шкалой Цельсия, но там, где шкала Цельсия нацелена на точку замерзания воды, равную 0 ° C, шкала Кельвина использует ее ноль на так называемом абсолютном нуле (точка на шкале объема vs. График температуры газа, где расширенная кривая гипотетически достигнет нулевого объема), считается теоретической минимальной температурой. Следовательно, абсолютный ноль равен 0 Кельвина, что эквивалентно -273,15 ° Цельсия. Чтобы преобразовать градусы Кельвина в градусы Цельсия, просто добавьте 273.15 к вашему показанию температуры в градусах Цельсия. Таким образом, точка замерзания воды составляет 0 ° C или 273,15 K, а температура кипения воды составляет 100 ° C или 373,15 K. Сравните это со шкалой Фаренгейта, где вода замерзает при 32 ° F и закипает при 212 °. F!
Вопрос: Какова средняя кинетическая энергия молекул в стейке при температуре 345 Кельвинов?
Ответ:
Вопрос: Нормальная температура тела собаки — 101.5 ° F. Какова нормальная температура тела собаки в градусах Цельсия? В Кельвинах?
Ответ:
Вопрос: Учитывая, что средняя кинетическая энергия частиц, составляющих наше Солнце, составляет 1,2 × 10 -19 Дж, найдите температуру Солнца.
Ответ:
Вопрос: Какой график лучше всего отображает соотношение между средней кинетической энергией (K avg ) случайного движения молекул идеального газа и его абсолютной температурой (T)?
Ответ: (2), поскольку K avg является линейной функцией абсолютной температуры T.
Вопрос: На орбите Земли космический челнок зафиксировал температуру в диапазоне от 398K до 118K. Эти температуры соответствуют температурам Цельсия в диапазоне от
- от 125 ° C до -391 ° C
- от 125 ° C до -155 ° C
- от 671 ° C до 391 ° C
- от 671 ° C до 155 ° C
Ответ: (2) от 125 ° C до -155 ° C
Вопрос: Температура, при которой тепловая энергия не может передаваться от одного объекта к другому, равна
- -273 К
- 0 К
- 0 ° С
- 273 ° C
Ответ: (2) 0 K является абсолютным нулем.
