Температура газов абсолютная — Справочник химика 21
Относительная излучательная способность или степень черноты газа Ёз определяется как отношение лучеиспускательной способности газа Е ккал мЧас к лучеиспускательной способности абсолютно черного тела о ккал/м час при температуре газа Т, т. е. [c.142]Т— абсолютная температура газа. [c.53]
Т — абсолютная температура газов, °К с — константа, зависяш,ая от состава газа. [c.58]
Абсолютная температура газов на перевале (выходе из топки) [c.121]
В кратком курсе нет необходимости более детально рассматривать эти соотношения. Однако следует характеризовать специфические особенности механизма электронной проводимости в полупроводниках, существенно отличного от механизма проводимости металлов. Металлы н полупроводники не только количественно сильно различаются по проводимости.

Параметры газа во всасывающем патрубке температура газа абсолютное давление, Р удельный вес V - [c.296]
Закон Гей-Люссака при постоянном давлении объем образца газа пропорционален его температуре в абсолютной шкале Кельвина. [c.155]
[c.155]
Тъ — абсолютная температура окружающего воздуха в К Ту — абсолютная средняя температура газов в дымовой трубе I. °К [c.134]
Закон Шарля при постоянном объеме давление образца газа пропорционально его температуре в абсолютной шкале Кельвина. [c.155]
Если же сравнить этот результат, полученный на основании молеку-лярно-кинетической теории, с экспериментально установленным уравнением состояния идеального газа (уравнение 3-8), можно сделать вывод, что кинетическая энергия 1 моля газа пропорциональна его температуре. Но представляет интерес воспользоваться этим выводом, наоборот, для того, чтобы осмыслить понятие температуры газа. Абсолютная температура Т газа-не что иное, как проявление кинетической энергии газовых молекул, точнее температура-это мера среднеквадратичной скорости мoлeкyJl. Для 1 моля идеального газа имеем РУ = КТ. Подстановка в это равенство значения РУ, соответствующего формуле (3-25), дает 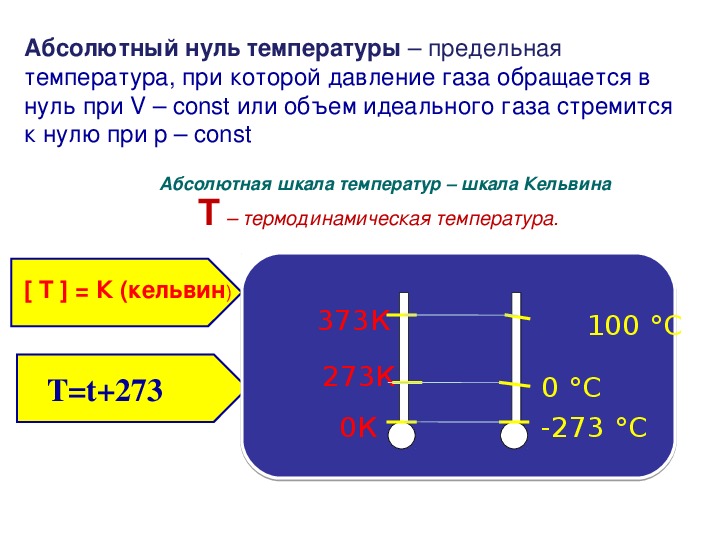 138]
138]
Эквивалентное излучение газов в случае теплообмена излучением между газом при температуре и абсолютно черной поверхностью при температуре 0 выражается отношением [c.66]
В уравнениях (41) и (42) Зо обозначает так называемую эквивалентную черную поверхность радиационной секции, определяемую как абсолютно черная поверхность, которая поглощает то же количество излученного тепла при температуре газов Тр, как и действительная поверхность при температуре Та. [c.81]
Степень черноты газа определяется на рис, 11-7 и 11-8 (стр, 406) в зависимости от температуры газа н произведения р1, где р — парциальное давление излучающего газа в ат (парциальное давление равно полному абсолютному давлению газовой смеси, умноженному на объемную долю данного [c.404]
Здесь 7 г и 7 .— абсолютные температуры газа и стенки [c.407]
При более низкой температуре и абсолютном давлении 0,13 МПа (Проводят конверсию моноксида углерода водяным паром в реакторе с радиальным потоком газа (рис. 4.42). Процесс происходит в две ступени в коробках 2 и 4 с катализатором, выполненных в виде коаксиальных перфорированных цилиндров из жаропрочной стали, обтянутых сеткой и расположенных с зазором относительно корпуса 1. В зону реакции газ поступает из внутреннего решетчатого цилиндра в кольцевое пространство, заполненное катализатором, движется в радиальном направлении в зоне реакции и отводится по зазору между наружной стенкой коробки и корпусом реактора. Между ступенями конверсии теплота отводится за счет испарения очищенной воды (конденсата), ко-
4.42). Процесс происходит в две ступени в коробках 2 и 4 с катализатором, выполненных в виде коаксиальных перфорированных цилиндров из жаропрочной стали, обтянутых сеткой и расположенных с зазором относительно корпуса 1. В зону реакции газ поступает из внутреннего решетчатого цилиндра в кольцевое пространство, заполненное катализатором, движется в радиальном направлении в зоне реакции и отводится по зазору между наружной стенкой коробки и корпусом реактора. Между ступенями конверсии теплота отводится за счет испарения очищенной воды (конденсата), ко-
Каковы же достижимые в настоящее время параметры плазмы Генераторы плазмы позволяют получать плазму практически любых газов при давлении от нескольких паскалей до десятков мегапаскалей. Температуру газа можно менять от близких к абсолютному нулю до десятков тысяч градусов при числе заряженных частиц 10 —в 1 см . Скорости плазменных струй можно изменять в широких пределах — от близких к нулю до нескольких километров в секунду. [c.295]
[c.295]
На — эквивалентная абсолютно черная поверхность в Тп — абсолютная температура газов на перевале в °К [c.456]
Пример V. 4. В теплообменнике нагревают 1,81 кмоль ч бутана от 20 до 550″ С. Греющим агентом является газ, выходящий из реактора состав газа (в мольн. долях) бутан л 1 = 0,481 пропилен Хг = 0,124 метан Хз = 0,124 этилен Х4 = 0,094 этан х = 0,094 бутилен Хй = 0,0415 водород х = 0,0415. Начальная температура газа, поступающего в теплообменник, / 2 = 650° С. Мольная теплоемкость газов изменяется с температурой по закону Ср = а + ЬТ + — -сТ [ъ. ккал [кмоль-град)], где Т—абсолютная температура. Константы а, Ь и с приведены в табл. У-2. [c.120]
Предел возможного охлаждения газа в холодильнике определяется начальной температурой поступающей воды. Даже при равенстве температур газа, всасываемого I ступенью, и поступающей воды неполное охлаждение неизбежно. В зимнее же время года, когда температура всасываемого газа ниже температуры охлаждающей воды, оно еще значительнее. Необходимость соблюдения требуемых промежуточных давлений заставляет увеличивать размеры цилиндров ступеней, расположенных за холодильником, с таким расчетом, чтобы относительное возрастание объема всасываемого газа было пропорционально относительному повышению абсолютной температуры газа, вызванному недоохлаждением, т. е.
Необходимость соблюдения требуемых промежуточных давлений заставляет увеличивать размеры цилиндров ступеней, расположенных за холодильником, с таким расчетом, чтобы относительное возрастание объема всасываемого газа было пропорционально относительному повышению абсолютной температуры газа, вызванному недоохлаждением, т. е.
Уравнение теплопередачи должно учитывать теплоотдачу экрану радиацией и конвекцией. Передача тепла радиацией определяется уравнением Стефана-Больцмана, для решения которого необходимо знать температуры излучающего и поглощающего источников. Температура последнего, т. е. радиантных труб, обычно известна, но неизвестна средняя эффективная температура продуктов горения (но1 ло1цающен среды). Выше было отмечено, что изменение температур в TOHi e подчиняется сложному закону. Предполагается, что в больших топочных нространстпах процесс теплоотдачи определяется периферийными температурами, в данном случае температурой газов 1Ш перевале. Ото не означает, одпако, что температура ) газов на перевале раина средней эффективной температуре поглощающей среды последняя всегда вьппе.
Графики (рпс. 80, 81) служат для предварительной прибли кенной оценки величины эквивалентной абсолютно черной поверхности пс заданной допустимой температуре газов па перепале, максимальной температуре горепия, температуре экрана и общему количеству тепла, введенного в топку. График на рис. 80 построен для температуры поверхности экрана 200° С. График па рпс. 81 служит для внесенпя поправки на температуру экрана, отличную от 200° С. [c.125]
Последним примером применения эф-фузиоппого потока является так называемый абсолютный манометр, предложенный Кнудсепом [9] для измерения очень ма-/хих давлений. Если около нагретой поверхности на малом расстоянии по сравнению с длиной свободного пробега молекул газа подвешен диск, то будет происходить эффузия молекул газа, находящихся в пространстве между поверхностью и диском, в остальной газ и обратно (рис.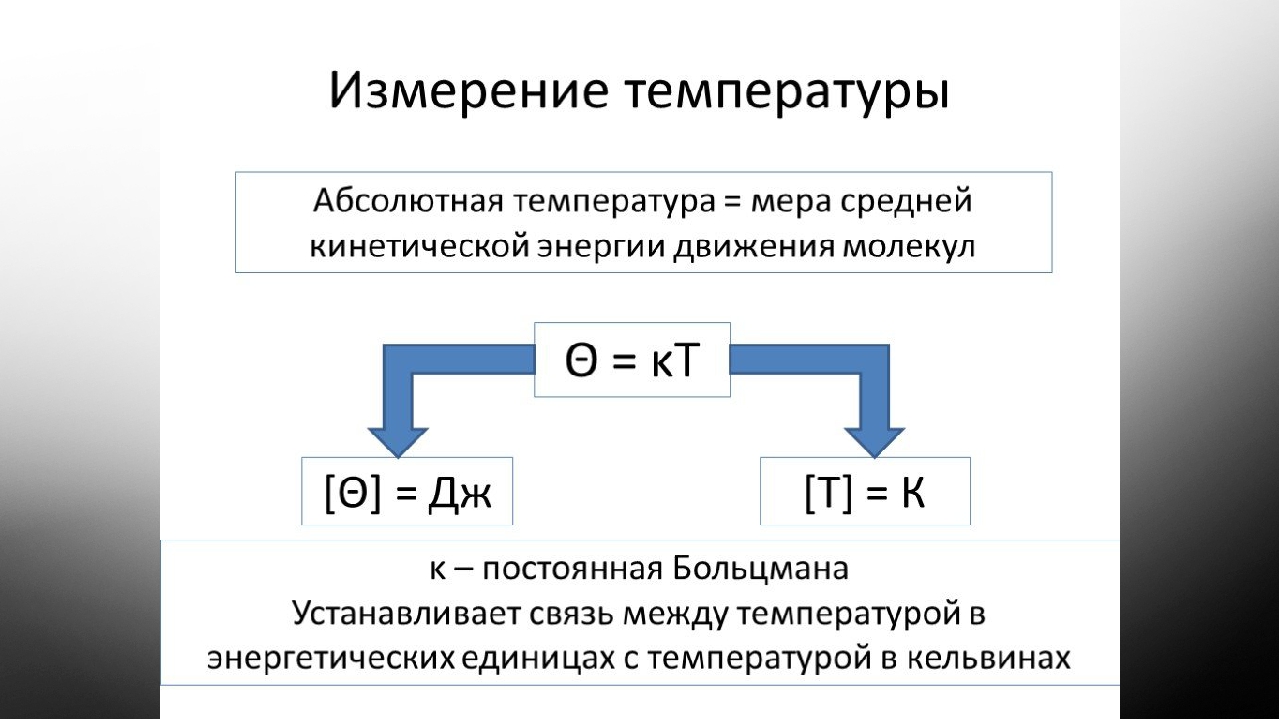
Ткон — абсолютная температура газа в системе в конце испытания, °С [c.30]
Расчет величины эквивалентной абсолютно черной поверхности. Для ориентировочного расчета величины Я, используют графики, предложенные С. В. Адельсон. Эти графики позволяют найти вспомогательную величину 7, = Вдпр, Н , где дпрчх определяется из уравнения (XI, 3) в зависимости от температуры газов на перевале и температуры /.щх. Графики построены для температур наружной поверхности стенки труб 0, равной 200, 400 и 600 °С. Общий вид такого графика дан на рис. Х1-12. [c.204]
Здесь М — масса одной килограмм-молекулы, кг1кмоль 22,4 м /кмоль — объем одной килограмм-молекулы при нормальных условиях, т. е. при То = 273° К и ро= 1,01-10 н/м (760 мм рт. сг.) р —давление газа при рабочих условиях, н/л 2 Т — абсолютная температура газа при рабочих условиях, ° К.
 [c.355]
[c.355] Пример П-15. Определить количество тепла, отдаваемое топочными газами стенкам труб из хромоникелевой стали. Наружный диаметр труб / = 57 мм трубы расположены в шахматном порядке с шагом / = 150 мм, расстоянием между рядами h = 130 мм. Средняя температура газов ir= 700 С, средняя температура стенок труб коэффициент теплоотдачи конвекцией а = 17,4 emjM -zpad (15 ккал м — ч-град). Состав топочных газов 10% СО2 и 5% Н2О (по объему). Абсолютное давление 1 ат. Решение. Эффективная степень черноты стенки
Воспламенение в ударной волне. Сжатие в ударной волне приводит к практически мгновенному изменению состояния газа, увеличемию его плотности и температуры. Нагревание при сжатии в ударной волне гораздо больше, чем при аналогичном сравнительно мед-лен ном адиабатическом сжатии, описываемом адиабатой Пуассона. Абсолютная температура газа, сжатого сильной ударной волной, приблизительно пропорциональна давлению в волне. При медленном адиабатическом сжатии конечная температура пропорциональна давлению в степени, равной (у—1)/у, где у= Ср/С — отношение теплоемкостей при постоянных давлении и температуре для воздуха при комнатной температуре (у— —1)/ул 0,3. Поэтому ударное сжатие представляет собой наиболее мощный распространенный в природе и технике импульс сильного нагревания (кроме электрического разряда). [c.34]
Поэтому ударное сжатие представляет собой наиболее мощный распространенный в природе и технике импульс сильного нагревания (кроме электрического разряда). [c.34]
Водоохлаждаемая црубка облицована бронзой, чтобы предотвратить конденсацию влапи, содержащейся в газах. Холодный циклон Вентури расположен за водоохлаждаемой секцией температуру газа определяют с помощью платинового термометра сопротивления, поскольку изменение со)цротивлвния этих термометров пропорционально абсолютной температуре в рассматриваемой области температур. [c.71]
Охлаждаемые емкости. Если вместимость емкостей превышает 2 тыс. т, более экономичным становится хранение СНГ в охлаждаемых емкостях, изолированных пенополиуретаном. Теплоизолированные емкости под СНГ на нефтеперерабатывающих заводах имеют вместимость, превышаюш,ую 10 тыс. т. Неотъемлемой частью складского хозяйства в этом случае является оборудование для удаления ассимилированной влаги из СНГ и холодильные машины. Пропан хранят при температуре, близкой к —40 °С, бутан — около 0°С. Для сооружения таких емкостей применяют специальные сорта сталей, регламентированные британским (В51501) и американским (АР1620) стандартами. В тех случаях, когда возможны небольшие изменения температур, теплоизолированные емкости необходимо оборудовать средствами, обеспечивающими их дыхание . Испаряемый в результате незначительного увеличения температуры газ выводится через вакуумный клапан безопасности, установленный в верхней части емкости и отрегулированный на абсолютное давление 10,3—17,2 кПа. Затем он рекомпримируется в жидкость и после охлаждения (часть газа при этом неизбежно сжигается на факеле) возвращается в емкость. Аналогично вакуумный кран срабатывает в случаях, когда давление внутри емкости становится ниже атмосферного или понижается температура. Возникающий вакуум заполняется инертными газами. [c.136]
Пропан хранят при температуре, близкой к —40 °С, бутан — около 0°С. Для сооружения таких емкостей применяют специальные сорта сталей, регламентированные британским (В51501) и американским (АР1620) стандартами. В тех случаях, когда возможны небольшие изменения температур, теплоизолированные емкости необходимо оборудовать средствами, обеспечивающими их дыхание . Испаряемый в результате незначительного увеличения температуры газ выводится через вакуумный клапан безопасности, установленный в верхней части емкости и отрегулированный на абсолютное давление 10,3—17,2 кПа. Затем он рекомпримируется в жидкость и после охлаждения (часть газа при этом неизбежно сжигается на факеле) возвращается в емкость. Аналогично вакуумный кран срабатывает в случаях, когда давление внутри емкости становится ниже атмосферного или понижается температура. Возникающий вакуум заполняется инертными газами. [c.136]
Абсолютная температура идеального газа. Формулы. Пример задачи
Температура — термодинамическая макроскопическая характеристика, которая играет важную роль практически во всех физических процессах. В данной статье сосредоточим свое внимание на освещении вопросов, что такое абсолютная температура газа идеального и как ее можно вычислить.
В данной статье сосредоточим свое внимание на освещении вопросов, что такое абсолютная температура газа идеального и как ее можно вычислить.
Абсолютная шкала температур
Для начала познакомимся со шкалой, которая используется в физике для описания температуры. Она называется абсолютной или шкалой Кельвина. Впервые ее ввел в использование английский физик лорд Кельвин в 1848 году. При этом ученый основывался на завоевавшей популярность шкале Цельсия.
Абсолютная температура так называется потому, что она имеет нижний предел — 0 кельвин, при котором считается «замороженным» любой вид движения (на самом деле при 0 К существуют так называемые нулевые колебания). Верхнего предела у этой шкалы нет.
С градусами Цельсия C абсолютная шкала T связана следующим простым равенством:
T = C + 273,15.
В отличие от других температурных шкал, например, от шкалы Фаренгейта, кельвин имеет точно такой же масштаб, что и градус Цельсия. Последнее означает, что для перевода в абсолютную любой температуры по Цельсию достаточно добавить к ней число 273,15. Так, по шкале Кельвина вода замерзает при 273,15 К, а кипит при 373,15 К.
Последнее означает, что для перевода в абсолютную любой температуры по Цельсию достаточно добавить к ней число 273,15. Так, по шкале Кельвина вода замерзает при 273,15 К, а кипит при 373,15 К.
Краткое понятие о газе идеальном
Поскольку далее будет рассмотрена формула для определения абсолютной температуры газа идеального, то будет полезным познакомиться с этим понятием поближе. Под идеальным понимают такой газ, молекулы которого практически не взаимодействуют друг с другом, обладают большой кинетической энергией по сравнению с потенциальной, и расстояния между которыми значительно превышают их собственные размеры.
Все реальные газы проявляют поведение идеальных при небольших давлениях и высоких температурах. Примерами могут служить благородные газы, воздух, метан и другие. В то же время пар h3O даже при низких давлениях сильно отличается от идеального газа, поскольку в нем всегда присутствуют значительные водородные связи между полярными молекулами воды.
Температура абсолютная идеального газа
Существует два подхода к определению температуры в газах. Рассмотрим каждый из них.
Рассмотрим каждый из них.
Первый подход заключается в привлечении положений молекулярно-кинетической теории (МКТ) и физического смысла самой температуры T. Последний заключается в кинетической энергии частиц газа. Чем больше эта энергия, тем выше температура, причем зависимость является прямо пропорциональной. Используя формулу из механики для энергии кинетической и постоянную Больцмана kB можно записать следующее равенство МКТ:
m*v2/2 = 3/2*kB*T.
Где m — масса движущейся поступательно частицы. Выражая из этого равенства величину T, получаем формулу:
T = m*v2/(3*kB).
Чем меньше масса частицы и чем больше ее скорость, тем выше абсолютная температура.
Второй подход в определении величины T заключается в использовании универсального уравнения Клапейрона-Менделеева. Это уравнение было записано в XIX веке Эмилем Клапейроном (впоследствии модифицировано Д. И. Менделеевым) как результат обобщения открытых экспериментально в XVII-XIX веках газовых законов (Шарля, Гей-Люссака, Бойля-Мариотта, Авогадро). Математически универсальное уравнение записывается так:
Математически универсальное уравнение записывается так:
P*V = n*R*T.
Как видно, оно связывает три основных термодинамических величины системы: давление P, объем V и температуру абсолютную T. Две другие величины, присутствующие в уравнении, — это n — количество вещества и R — газовая постоянная.
Не представляет особого труда получить формулу для температуры из Клапейрона-Менделеева закона:
T = P*V/(n*R).
В закрытой системе (n = const) температура газа прямо пропорциональна произведению объема на давление.
Пример задачи
Воздух, которым мы дышим, является смесью газов идеальных. Известно, что молярная масса воздуха составляет 29 г/моль. Необходимо определить температуру воздуха, если средняя скорость его молекул составляет 530 м/с.
Очевидно, что решение этой задачи можно получить, если воспользоваться следующим выражением:
T = m*v2/(3*kB).
Массу одной молекулы m воздуха можно получить, если поделить величину M на число Авогадро NA. Произведение же числа NA на константу Больцмана kB — это не что иное, как газовая постоянная R, которая равна 8,314 Дж/(К*моль). Учитывая эти рассуждения, получаем рабочую формулу:
Произведение же числа NA на константу Больцмана kB — это не что иное, как газовая постоянная R, которая равна 8,314 Дж/(К*моль). Учитывая эти рассуждения, получаем рабочую формулу:
T = M*v2/(3*R ) = 0,029*6002/(3*8,314) = 326,60 К.
В градусах Цельсия найденной температуре соответствует значение 53,45 oC. На нашей планете такие температуры характерны для жарких песчаных пустынь в полдень.
Источник: Navolne
Физика — 10
6.15.
Какой участок диаграммы соответствует состоянию уменьшения температуры идеального газа данной массы (СD изотерма)?
6.16.
В сосуде имеется 8 г кислорда при давлении 105Па и температуре 300 К. Вычислите объем газа: (M = 32 ⋅ 10 -3кг
моль, R = 8 Дж
моль ⋅ K)
6. 17.
17.
При увеличении абсолютной температуры газа в 6 раз при постоянном давлении его объем стал равен 18 ⋅ 10-3м3. Вычислите первоначальный объем газа.
6.18.
Давление идеального газа данной массы увеличилась в 2,8 раза, а объем уменьшился в 4 раза. Как изменилась абсолютная температура газа?
6.19.
Определите плотность воздуха при температуре 17°С и давлении 3 ⋅ 105Па. (Mвоздуха = 29 ⋅ 10-3кг
моль, R = 8 Дж
моль ⋅ K).
6.20.
Концентрация водяного пара в воздухе при температуре 27°C равна 2⋅1023м-3. Каково давление водяного пара при этой температуре (k = 1,4⋅10-23Дж
Каково давление водяного пара при этой температуре (k = 1,4⋅10-23Дж
K)?
6.21.
Плотность водяного пара в воздухе при температуре 15°С равна 9,1 г
м3, а относительная влажность 70%. Какова плотность насыщенного водяного пара при этой температуре?
6.22.
Какое количество теплоты выделится при конденсации 200 г паров спирта
при постоянной температуре (L = 9 ⋅ 105Дж
кг)?
6.23.
В капиллярной трубке какого радиуса ртуть спустится на 30 см (σ = 510 мН
м, ρ = 13,6 ⋅ 103кг
м3, g = 10 м
с2)?
6. 24.
24.
Определите объем поднявшейся воды в капиллярной трубке радиусом 0,25 мм
( σ = 72 мН
м, ρ = 103кг
м3, g = 10 м
с2, π = 3).
6.25.
Водяная капля падает из вертикально расположенной трубки диаметром 2 мм. Определите массу водяной капли (σвода = 73 мН
м).
6.26.
Масса 76 капель минерального масла, капающих из пипетки, равна 910 мг. Внутренний радиус пипетки 1,2 мм. Определите коэффициент поверхностного натяжения масла.
6.27.
Чем определяется анизотропия монокристалла?
6. 28.
28.
Какими внешними признаками можно различать монокристаллы?
Богданов К.Ю. — учебник по физике для 10 класса
§ 23. ТЕМПЕРАТУРА, ТЕПЛОВОЕ РАВНОВЕСИЕ, АБСОЛЮТНАЯ ТЕМПЕРАТУРА.
Тепловое равновесие между телами возможно только тогда, когда их температура одинакова.
Прикоснувшись рукой к
любому предмету, мы легко можем определить, тёплый он или холодный. Если температура
предмета ниже температуры руки, предмет кажется холодным, а если наоборот, то -
тёплым. Если зажать в кулаке холодную монету, то теплота руки начнёт нагревать
монету, и через некоторое время её температура станет равной температуре руки,
или, как говорят, наступит тепловое равновесие. Поэтому температура
характеризует состояние теплового равновесия системы из двух или нескольких
тел, имеющих одну и ту же температуру. Так, говоря, что температура нашего тела
равна 36 оС, мы подразумеваем, что градусник подмышкой
находится в тепловом равновесии с окружающими тканями, когда он показывает 36
оС.
Температура наряду с объёмом и давлением газа являются макроскопическими параметрами. Для измерения температуры используют термометры. В некоторых из них регистрируют изменение объёма жидкости при нагревании, в других – изменение электрического сопротивления и т.п. Самой распространённой является температурная шкала Цельсия, названная так в честь шведского физика А. Цельсия. Чтобы получить температурную шкалу Цельсия для жидкостного термометра, его сначала погружают в тающий лёд и отмечают положение конца столбика, а потом — в кипящую воду. Отрезок между этими двумя положениями столбика делят на 100 равных частей, считая, что температура таяния льда соответствует нулю градусов шкалы Цельсия (оС), а температура кипящей воды – 100 оС (см. рис. 23а).
Основное уравнение
молекулярно-кинетической теории (22.4) связывает между собой давление газа,
концентрацию молекул и их среднюю кинетическую энергию. Однако средняя
кинетическая энергия молекул, как правило, неизвестна, хотя результаты многих
опытов говорят о том, что скорость молекул увеличивается с ростом температуры
(см., например, броуновское движение в §20). Зависимость средней кинетической
энергии молекул газа от его температуры можно получить из закона открытого
французским физиком Ж. Шарлем в 1787 году.
Однако средняя
кинетическая энергия молекул, как правило, неизвестна, хотя результаты многих
опытов говорят о том, что скорость молекул увеличивается с ростом температуры
(см., например, броуновское движение в §20). Зависимость средней кинетической
энергии молекул газа от его температуры можно получить из закона открытого
французским физиком Ж. Шарлем в 1787 году.
Согласно закону Шарля, если объём данной массы газа не меняется, его давление pt линейно зависит от температуры t:
где t – температура газа, измеренная в оС, а p0 – давление газа при температуре 0 оС (см. рис. 23б). Таким образом, из закона Шарля следует, что давление газа, занимающего неизменный объём, пропорционально сумме (t+273 оС). С другой стороны, из (22.4) вытекает, что, если концентрация молекул постоянна, т.е. объём, занимаемый газом, не изменяется, то давление газа должно быть пропорционально средней кинетической энергии молекул. Значит, средняя кинетическая энергия, ЕСР молекул газа, просто, пропорциональна величине (t+273 оС):
где b – постоянный коэффициент, значение которого мы позже определим. Из (23.2) следует, что средняя кинетическая энергия молекул станет равной нулю при -273 оС. Исходя из этого, английский учёный У. Кельвин в 1848 г. предложил использовать абсолютную температурную шкалу, нулевая температура в которой соответствовала бы -273 оС, а каждый градус температуры был бы равен градусу шкалы Цельсия. Таким образом, абсолютная температура, T связана с температурой t, измеренной по шкале Цельсия, следующим образом:
За единицу абсолютной температуры в СИ принят Кельвин (К).
Учитывая (23.3), уравнение (23.2) преобразуется в:
подставляя которое в (22.4), получаем следующее:
Чтобы избавиться от дроби в (23.5), заменим 2b/3 на k, и получим вместо (23.4) и (23.5) два очень важных уравнения:
где k – постоянная Больцмана, названная в честь Л. Больцмана. Эксперименты показали, что k=1,38.10-23 Дж/К. Таким образом, давление газа и средняя кинетическая энергия его молекул пропорциональны его абсолютной температуре.
Вопросы для повторения:
· Как связана температура с тепловым равновесием?
· Сформулируйте закон Шарля.
· При какой температуре прекращается тепловое движение?
Рис. 23. (а) – градуировка термометра по шкале Цельсия; (б) – графическое представление закона Шарля.
Температура газа
Важное свойство любого газа температура . У нас есть некоторый опыт работы с температура, которой у нас нет, с такими свойствами, как вязкость и сжимаемость. Мы слышали, как метеоролог по телевидению ежедневно значение температуры атмосфера (15 градусов Цельсия, для пример). Мы знаем, что горячий объект имеет высокую температуру, а холодный объект имеет низкую температуру. И мы знаем, что температура объекта изменяется, когда мы нагреваем объект или охлаждаем его.
Ученые, однако, должны быть более точными, чем просто описывать объект как «горячий» или «холодный». Целая отрасль физики, называемая термодинамика, посвящена изучению температура предметов и передача тепла между объектами с разной температурой. Мы включаем некоторые основы термодинамики в Руководстве для начинающих, чтобы помочь вам лучше разбираться в силовых установках. Мы также есть интерактивный симулятор чтобы вы могли изучить, как температура меняется с высотой через Атмосфера.
Есть два способа взглянуть на температуру: (1) в мелком масштабе. действие отдельных молекул воздуха и (2) крупномасштабное действие газ в целом. Начиная с мелкомасштабного действия, с кинетическая теория газов, газ составлен большого количества молекул, которые очень малы по сравнению с расстояние между молекулами. Молекулы находятся в постоянном, случайном движения и часто сталкиваются друг с другом и со стенками любой контейнер.Молекулы обладают физическими свойствами массы, импульс и энергия. Импульс отдельной молекулы равен произведение его массы и скорости, а кинетическая энергия равна единице. половина массы, умноженная на квадрат скорости, как показано слева рисунка выше. Для двухатомных газов , таких как кислород и азот, в котором молекулы состоят из пар атомов, энергия также может храниться в вибрации и вращении атомов друг о друге.Температура газа — это мера среднего поступательного кинетическая энергия молекул. В горячем газе молекулы движутся быстрее, чем на холодном газе; масса осталась прежней, но кинетическая энергия, а следовательно, и температура больше из-за увеличения скорость молекул.
В больших масштабах температура газа — это нечто что мы можем качественно определить с помощью наших органов чувств. Мы можем почувствовать что один газ горячее другого и, следовательно, имеет более высокую температура.Но для определения температуры количественно , чтобы присвоить номер, мы должны использовать некоторые принципы из термодинамика:
- Первый принцип заключается в том, что температура объект может влиять на некоторые физические свойства объекта, такие как длина твердого тела, или давление газа в закрытом сосуде, или электрическое сопротивление провода. Вы можете изучить эффекты температура от давления газа на анимированный газ лаборатория.
- Второй принцип — это определение термодинамических равновесие между двумя объектами. Два объекта находятся в термодинамическом равновесие, когда они имеют одинаковую температуру.
- И последний принцип — наблюдение, что если два объекта разных температур соприкасаются с одним другой, они в конечном итоге установят термодинамический равновесие. Слово «в конце концов» важно. Изоляция материалы достигают равновесия через очень долгое время, в то время как проводящих материалов очень быстро достигают равновесия.
Используя эти три термодинамических принципа, мы можем построить прибор для измерения температуры, термометр , который назначает число температуры объекта. Когда термометр соприкоснувшись с другим объектом, он быстро устанавливает термодинамическое равновесие.Измеряя термодинамическое воздействие на какое-то физическое свойство термометра при некоторых фиксированных условиях, например точки кипения и замерзания воды, мы можем установить шкалу для задания значений температуры.
Число, присвоенное температуре, зависит от того, что мы выберите для эталонного состояния. Так возникло несколько различных температурных шкал. Шкала Цельсия , обозначенная a C , использует точку замерзания чистой воды в качестве нулевой точки а температура кипения — 100 градусов по линейной шкале. между этими крайностями.Шкала по Фаренгейту , обозначенная с F намного сложнее. Изначально здесь использовалась точка замерзания моря. вода — нулевая точка, а точка замерзания чистой воды — 30 градусов, что сделало температура здорового человека равна 96 градусам. В этом масштабе температура кипения чистой воды составляла 212 градусов. Поэтому Фаренгейт скорректировал шкалу так, чтобы точка кипения чистой воды составила 212 и точка замерзания чистой воды 32, что дает 180 градусов между двумя контрольными точками.180 градусов было выбрано, потому что оно делится на 2, 3, 4, 5 и 6 без остатка. На новой шкале температур температура здорового человека 98,6 градусов по Фаренгейту. Потому что есть 100 ° C и 180 ° F при одинаковых исходных условиях:
1 градус C = 1 градус F * 100/180 = 1 градус F * 5/9
Поскольку шкалы начинаются с разных нулевых точек, мы можем преобразовать температуру на Шкала Фаренгейта (TF) к температуре по шкале Цельсия (TC) с помощью этого уравнения:
TF = 32 + (9/5) * TC
Конечно, у вас могут быть температуры ниже точки замерзания воды, и они назначаются отрицательные числа.Когда ученые начали изучать самые холодные возможная температура, они определили абсолютный ноль при которой кинетическая энергия молекул минимальна (но не строго равна нулю!). Они обнаружили, что это значение составляет -273,16 ° C. Используя эту точку в качестве новой нулевой точки, мы может определить другую температурную шкалу, называемую абсолютной температурой . Если мы сохраним размер одного градуса должен быть таким же, как шкала Цельсия, мы получаем шкалу температуры который был назван в честь лорда Кельвина и обозначен K .Потом:
К = С + 273,16
Аналогичная абсолютная температура соответствует градусу Фаренгейта. Он назван в честь ученый Рэнкин и обозначен цифрой R .
R = F + 459,69
Абсолютные температуры используются в уравнение состояния, вывод переменных состояния энтальпия и энтропия и определение скорость звука.
Температура, как и давление, — это скалярная величина. У температуры есть величина, но нет направления связанные с ним. У него есть только одно значение в каждом месте газа. В значение может меняться от места к месту, но направление не связано к температура.
Деятельность:
Экскурсии
Навигация..
- Руководство для начинающих Домашняя страница
Атомы при отрицательной абсолютной температуре — самые горячие системы в мире — ScienceDaily
То, что нормально для большинства людей зимой, до сих пор невозможно в физике: отрицательная температура. По шкале Цельсия минусовые температуры удивляют только летом. По шкале абсолютных температур, которая используется физиками и также называется шкалой Кельвина, невозможно опуститься ниже нуля — по крайней мере, не в том смысле, что становится холоднее нуля по шкале Кельвина.
Согласно физическому смыслу температуры, температура газа определяется хаотическим движением его частиц: чем холоднее газ, тем медленнее частицы. При нуле кельвина (минус 273 градуса Цельсия) частицы перестают двигаться, и весь беспорядок исчезает. Таким образом, ничто не может быть холоднее абсолютного нуля по шкале Кельвина. Физики из Университета Людвига-Максимилиана в Мюнхене и Института квантовой оптики Макса Планка в Гархинге создали в лаборатории атомный газ, который, тем не менее, имеет отрицательные значения Кельвина.Эти отрицательные абсолютные температуры имеют несколько, по-видимому, абсурдных последствий: хотя атомы в газе притягиваются друг к другу и создают отрицательное давление, газ не коллапсирует — поведение, которое также постулируется для темной энергии в космологии. Предположительно невозможные тепловые двигатели, такие как двигатель внутреннего сгорания с термодинамическим КПД более 100%, также могут быть реализованы с помощью отрицательных абсолютных температур.
Чтобы довести воду до кипения, необходимо добавить энергии.По мере того, как вода нагревается, молекулы воды со временем увеличивают свою кинетическую энергию и в среднем перемещаются все быстрее и быстрее. Тем не менее, отдельные молекулы обладают разной кинетической энергией — от очень медленной до очень быстрой. Состояния с низкой энергией более вероятны, чем состояния с высокой энергией, т.е. только несколько частиц движутся действительно быстро. В физике это распределение называется распределением Больцмана. Физики, работающие с Ульрихом Шнайдером и Иммануилом Блохом, теперь реализовали газ, в котором это распределение точно инвертировано: многие частицы обладают высокими энергиями, а лишь некоторые — низкими.Эта инверсия распределения энергии означает, что частицы приняли отрицательную абсолютную температуру.
«Перевернутое распределение Больцмана — признак отрицательной абсолютной температуры; и это то, чего мы достигли », — говорит Ульрих Шнайдер. «Тем не менее, газ не холоднее нуля по Кельвину, а горячее», — объясняет физик: «Он даже горячее, чем при любой положительной температуре — шкала температур просто не заканчивается на бесконечности, а вместо этого перескакивает к отрицательным значениям.”
Отрицательная температура может быть достигнута только с верхним пределом энергии
Значение отрицательной абсолютной температуры лучше всего можно проиллюстрировать с помощью катящихся сфер на холмистом ландшафте, где долины означают низкую потенциальную энергию, а холмы — высокую. Чем быстрее движутся сферы, тем выше их кинетическая энергия: если начать с положительных температур и увеличить общую энергию сфер, нагревая их, сферы будут все больше распространяться в области с высокой энергией.Если бы можно было нагреть сферы до бесконечной температуры, то была бы равная вероятность найти их в любой точке ландшафта, независимо от потенциальной энергии. Если бы теперь можно было добавить еще больше энергии и тем самым еще больше нагреть сферы, они бы предпочтительно собирались в высокоэнергетических состояниях и были бы даже горячее, чем при бесконечной температуре. Распределение Больцмана было бы инвертированным, и поэтому температура была бы отрицательной. На первый взгляд может показаться странным, что отрицательная абсолютная температура выше положительной.Однако это просто следствие исторического определения абсолютной температуры; если бы это было определено иначе, этого очевидного противоречия не существовало бы.
Эта инверсия населенности энергетических состояний невозможна в воде или любой другой природной системе, поскольку системе необходимо поглощать бесконечное количество энергии — невозможный подвиг! Однако, если частицы обладают верхним пределом своей энергии, например, вершиной холма в ландшафте потенциальной энергии, ситуация будет совершенно иной.Исследователи из исследовательской группы Иммануэля Блоха и Ульриха Шнайдера реализовали такую систему атомарного газа с верхним пределом энергии в своей лаборатории, следуя теоретическим предложениям Алларда Моска и Ахима Роша.
В своем эксперименте ученые сначала охлаждают около ста тысяч атомов в вакуумной камере до положительной температуры в несколько миллиардных долей Кельвина и захватывают их в оптические ловушки из лазерных лучей. Окружающий сверхвысокий вакуум гарантирует идеальную теплоизоляцию атомов от окружающей среды.Лазерные лучи создают так называемую оптическую решетку, в которой атомы расположены регулярно в узлах решетки. В этой решетке атомы все еще могут перемещаться с узла на узел посредством туннельного эффекта, но их кинетическая энергия имеет верхний предел и, следовательно, обладает требуемым верхним пределом энергии. Однако температура относится не только к кинетической энергии, но и к полной энергии частиц, которая в данном случае включает взаимодействие и потенциальную энергию. Система исследователей из Мюнхена и Гархинга также устанавливает предел для обоих из них.Затем физики подводят атомы к этой верхней границе полной энергии — таким образом достигается отрицательная температура, составляющая минус несколько миллиардных долей кельвина.
При отрицательных температурах двигатель может работать больше
I f сферы обладают положительной температурой и лежат в долине с минимальной потенциальной энергией, это состояние, очевидно, устойчиво — это природа, как мы ее знаем. Если сферы расположены на вершине холма с максимальной потенциальной энергией, они обычно скатываются вниз и тем самым преобразуют свою потенциальную энергию в кинетическую энергию.«Однако, если сферы имеют отрицательную температуру, их кинетическая энергия уже будет настолько большой, что не сможет увеличиваться дальше», — объясняет Саймон Браун, докторант исследовательской группы. «Таким образом, сферы не могут скатиться вниз и остаются на вершине холма. Таким образом, ограничение по энергии делает систему стабильной! » Состояние с отрицательной температурой в их эксперименте действительно так же стабильно, как и состояние с положительной температурой. «Таким образом, мы создали первое состояние с отрицательной абсолютной температурой для движущихся частиц», — добавляет Браун.
Материя при отрицательной абсолютной температуре имеет целый ряд поразительных последствий: с ее помощью можно создавать тепловые двигатели, такие как двигатели внутреннего сгорания, с КПД более 100%. Однако это не означает, что нарушается закон сохранения энергии. Вместо этого двигатель мог не только поглощать энергию из более горячей среды и, таким образом, работать, но, в отличие от обычного случая, также и из более холодной среды.
При чисто положительных температурах более холодная среда, напротив, неизбежно нагревается, тем самым поглощая часть энергии горячей среды и тем самым ограничивая эффективность.Если горячая среда имеет отрицательную температуру, возможно одновременное поглощение энергии обеих сред. Таким образом, работа, выполняемая двигателем, больше, чем энергия, получаемая от одной только более горячей среды — КПД превышает 100 процентов.
Достижение мюнхенских физиков может быть интересно для космологии, поскольку термодинамическое поведение отрицательной температуры обнаруживает параллели с так называемой темной энергией. Космологи постулируют темную энергию как неуловимую силу, которая ускоряет расширение Вселенной, хотя на самом деле космос должен сжиматься из-за гравитационного притяжения между всеми массами.Аналогичное явление наблюдается в атомном облаке в мюнхенской лаборатории: эксперимент основан на том факте, что атомы в газе не отталкиваются друг от друга, как в обычном газе, а вместо этого взаимодействуют привлекательно. Это означает, что атомы оказывают отрицательное давление вместо положительного. Как следствие, атомное облако хочет сжаться и действительно должно коллапсировать — как и следовало ожидать от Вселенной под действием силы тяжести. Но из-за его отрицательной температуры этого не происходит.Газ спасен от коллапса, как и Вселенная.
Температура квантового газа опускается ниже абсолютного нуля
Энергетическое распределение атомов в тепловом состоянии. Положительные абсолютные температуры сверху, синим цветом; отрицательные абсолютные температуры ниже, красным цветом. Предоставлено: LMU / MPQ Munich
.Физикам удалось создать атомарный газ, который может достигать температуры ниже абсолютного нуля, -273,15 ° C. Они смогли создать этот газ, используя материалы с отрицательным Кельвином и новые квантовые устройства.
Ученые опубликовали свои выводы в журнале Science ¹. Абсолютная шкала температуры восходит к лорду Кельвину, который создал ее в середине 1800-х годов. Он был разработан таким образом, чтобы ничто не могло быть холоднее абсолютного нуля. Позже физики обнаружили, что абсолютная температура газа связана со средней энергией его частиц. Абсолютный ноль соответствует теоретическому состоянию, в котором частицы не имеют энергии, а более высокие температуры соответствуют энергиям, превышающим средние.
В 1950-х годах физики, работавшие с экзотическими системами, начали понимать, что это не всегда так. Температуры системы считываются с графика, на котором показаны вероятности обнаружения ее частиц с определенными энергиями. Большинство частиц имеют среднюю или близкую к средней энергии, и лишь некоторые из них имеют более высокие энергии. Теоретически, если бы больше частиц имели более высокие энергии, график перевернулся бы, и знак температуры изменился бы с положительного на отрицательный.
Ульрих Шнайдер, физик из Университета Людвига-Максимилиана в Мюнхене, Германия, и его коллеги достигли температуры ниже абсолютного нуля с помощью ультрахолодного квантового газа, состоящего из атомов калия.Они использовали лазеры и магнитные поля, чтобы удерживать атомы в виде решетки. При положительных температурах атомы отталкиваются, делая всю конфигурацию стабильной. Когда магнитные поля были отрегулированы, заставляя атомы притягиваться, а не отталкивать друг друга, атомы переходят из своего наиболее стабильного состояния в состояние с максимально возможной энергией.
При положительных температурах такое обращение нестабильно, так как атомы схлопываются внутрь. Захватывающее лазерное поле также было отрегулировано, чтобы сделать его более энергетически выгодным, позволяя атомам оставаться в своих текущих положениях.Затем температура газа изменилась от температуры выше абсолютного нуля до нескольких миллиардных долей Кельвина ниже абсолютного нуля.
Экзотические высокоэнергетические состояния сложно создать в лаборатории. Эти методы позволяют детально изучать эти состояния, возможно, позволяя создавать новые формы материи в лаборатории. Такие системы будут вести себя странно. Облака атомов, которые обычно притягиваются вниз под действием силы тяжести, будут тянуться вверх, очевидно, бросая вызов гравитации.
Газ с уровнем ниже абсолютного нуля имитирует темную энергию, силу, которая заставляет Вселенную расширяться со все более высокой скоростью против силы тяжести.
Список литературы
- Браун, С. и др. . Science 339. С. 52–55 (2013).
[via Nature]
Что происходит при абсолютном нуле?
Хейзел Мьюир
Туманность Бумеранг — самый холодный из известных природных объектов во Вселенной, наблюдаемый здесь космическим телескопом Хаббла
(Изображение: ESA / NASA)
Любопытные вещи, происходящие при низких температурах, продолжают преподносить сюрпризы.На прошлой неделе ученые сообщили, что молекулы сверххолодного газа могут химически реагировать на расстояниях до 100 раз больших, чем при комнатной температуре.
В экспериментах с температурой, близкой к комнатной, химические реакции имеют тенденцию замедляться с понижением температуры. Но ученые обнаружили, что молекулы при низких температурах всего на несколько сотен миллиардных градуса выше абсолютного нуля (-273,15 ° C или 0 кельвинов) все еще могут обмениваться атомами, создавая новые химические связи в процессе, благодаря странным квантовым эффектам, которые расширяют их досягаемость. при низких температурах.
«Совершенно разумно ожидать, что когда вы перейдете в режим ультра-холода, химии не будет, о которой можно было бы говорить», — говорит Дебора Джин из Университета Колорадо в Боулдере, чья команда сообщила о находке в Science (DOI & col; 10.1126 / science.1184121). «В этой статье говорится, что нет, там много химии».
New Scientist рассказывает о странном и чудесном царстве ультра-холода.
Почему абсолютный ноль (0 кельвинов или −273.15 ° C) невозможная цель?
На практике работа, необходимая для отвода тепла от газа, увеличивается по мере того, как вы становитесь холоднее, и потребуется бесконечное количество работы, чтобы охладить что-либо до абсолютного нуля. С квантовой точки зрения вы можете винить принцип неопределенности Гейзенберга, согласно которому, чем точнее мы знаем скорость частицы, тем меньше мы знаем о ее положении, и наоборот. Если вы знаете, что ваши атомы находятся внутри вашего эксперимента, должна быть некоторая неопределенность в их импульсе, удерживающая их выше абсолютного нуля — если только ваш эксперимент не соответствует размеру всей Вселенной.
Какое самое холодное место в солнечной системе?
Самая низкая температура в Солнечной системе была на Луне. В прошлом году Lunar Reconnaissance Orbiter НАСА измерил температуру до −240 ° C в постоянно затененных кратерах около южного полюса Луны. Это примерно на 10 градусов холоднее, чем на Плутоне до сих пор. Бррррррррр.
Какой самый холодный природный объект во Вселенной?
Самым холодным известным местом во Вселенной является туманность Бумеранг, находящаяся на расстоянии 5000 световых лет от нас в созвездии Центавра.В 1997 году ученые сообщили, что газы, выходящие из центральной умирающей звезды, расширились и быстро остыли до 1 кельвина, что всего на один градус теплее абсолютного нуля. Обычно газовые облака в космосе нагреваются по крайней мере до 2,7 кельвина космическим микроволновым фоном, реликтовым излучением, оставшимся после Большого взрыва. Но расширение туманности Бумеранг создает своего рода космический холодильник, позволяющий газам сохранять необычную прохладу.
Какой объект в космосе самый холодный?
Если считать искусственные спутники, становится еще холоднее.Некоторые приборы на космической обсерватории Planck Европейского космического агентства, запущенной в мае 2009 года, замерзают до 0,1 кельвина, чтобы подавить микроволновый шум, который в противном случае затруднил бы обзор спутника. Космическая среда в сочетании с механическими и криогенными системами охлаждения, использующими водород и гелий, охлаждает самые холодные приборы до 0,1 кельвина за четыре последовательных этапа.
Какая самая низкая температура, когда-либо достигнутая в лаборатории?
Самая низкая температура, когда-либо зарегистрированная, была здесь, на Земле, в лаборатории.В сентябре 2003 года ученые Массачусетского технологического института объявили, что они охладили облако атомов натрия до рекордного значения 0,45 нанокельвина. Ранее ученые из Хельсинкского технологического университета в Финляндии в 1999 году достигли температуры 0,1 нанокельвина в куске металлического родия. Однако это была температура только для одного конкретного типа движения — квантового свойства, называемого ядерным спином, — а не для всего. температура для всех возможных движений.
Какое странное поведение могут проявлять газы около абсолютного нуля?
В повседневных твердых телах, жидкостях и газах тепло или тепловая энергия возникает в результате движения атомов и молекул, когда они кружатся и отскакивают друг от друга.Но при очень низких температурах действуют странные правила квантовой механики. Молекулы не сталкиваются в обычном смысле слова; вместо этого их квантово-механические волны растягиваются и перекрываются. Когда они таким образом перекрываются, они иногда образуют так называемый конденсат Бозе-Эйнштейна, в котором все атомы действуют одинаково, как один «суператом». Первый чистый конденсат Бозе-Эйнштейна был создан в Колорадо в 1995 году с использованием облака атомов рубидия, охлажденного до менее 170 нанокельвинов.
Еще по этим темам:
Исследователи доводят газ до температуры ниже абсолютного нуля
(Физ.org) — группе физиков в Германии удалось заставить газ стать холоднее абсолютного нуля. Используя лазеры и магнитное поле для управления ультрахолодным газом, исследователям, как они описывают в своей статье, опубликованной в журнале Science , удалось добиться температуры газа до нескольких миллиардных долей Кельвина ниже абсолютного нуля.
Абсолютный ноль был впервые определен лордом Кельвином еще в середине 1880-х годов как самое низкое возможное температурное состояние, при котором атомы перестают двигаться.Температурная шкала, носящая его имя, начинается с этой самой низкой точки, но за последние несколько десятилетий ученые обнаружили, что есть исключения из правила и что, по крайней мере теоретически, система должна иметь возможность создавать условия, при которых температура опускается ниже абсолютный ноль. Они говорят, что это возможно, потому что температура системы обычно считается средней энергией частиц в ней. Большинство парят около определенной точки, а некоторые перемещаются на более высокие уровни.Но когда система переворачивается вверх дном, когда большинство частиц демонстрируют более высокие уровни энергии, а лишь некоторые имеют более низкую энергию, система переворачивается, как и температурные знаки, указывающие на температуру ниже абсолютного нуля.
Чтобы перевернуть такую систему в реальном мире, физики начали с охлаждения квантового газа, состоящего из атомов калия, почти до абсолютного нуля. Они использовали лазеры и магнитные поля, чтобы заставить атомы образовывать решетку. При температурах выше абсолютного нуля атомы, естественно, хотят отталкиваться друг от друга, сохраняя стабильность системы.Но, регулируя лазеры и магнитное поле, исследователи смогли заставить атомы притягиваться друг к другу, по сути, перевернув систему с ног на голову. Они отмечают, что при положительных температурах такая система, естественно, будет нестабильной — чтобы сделать ее стабильной, команда также отрегулировала лазеры, удерживающие атомы в ловушке на месте. По их сообщениям, это привело к тому, что температура газа опустилась ниже абсолютного нуля.
Хотя это достижение вряд ли приведет к созданию таких систем для практических целей, оно действительно помогает лучше понять принцип температуры и может, по мнению некоторых, помочь объяснить другое, все еще загадочное явление, например, почему Вселенная продолжает изменяться. расширяться, несмотря на силу притяжения, которую некоторые приписывают силе, называемой темной энергией.Исследователи говорят, что есть параллели между тем, как газы в системе с субабсолютным нулем хотят схлопнуться, но не из-за отрицательных абсолютных температур и отрицательной силы, мешающей Вселенной делать то же самое.
Атомы при отрицательной абсолютной температуре: самые горячие системы в мире
Дополнительная информация: Отрицательная абсолютная температура для двигательных степеней свободы, Science , 4 января 2013 г .: Vol.339 нет. 6115 с. 52-55 DOI: 10.1126 / science.1227831
РЕФЕРАТ
Абсолютная температура обычно должна быть положительной. Однако при особых условиях отрицательные температуры — при которых высокоэнергетические состояния более заняты, чем низкоэнергетические состояния — также возможны. Такие состояния были продемонстрированы в локализованных системах с конечным дискретным спектром. Здесь мы подготовили состояние с отрицательной температурой для двигательных степеней свободы. Подгоняя гамильтониан Бозе-Хаббарда, мы создали привлекательно взаимодействующий ансамбль ультрахолодных бозонов при отрицательной температуре, устойчивый к коллапсу для произвольного числа атомов.В распределении квазиимпульса появляются резкие пики на верхнем краю зоны, что свидетельствует о тепловом равновесии и бозонной когерентности по нескольким узлам решетки. Отрицательные температуры подразумевают отрицательное давление и открывают новые режимы параметров для холодных атомов, открывая принципиально новые многочастичные состояния.
© 2013 Phys.org
Ссылка : Исследователи доводят газ до температуры ниже абсолютного нуля (4 января 2013 г.) получено 31 октября 2021 г. с https: // физ.org / news / 2013-01-gas-temperature-absolute.html
Этот документ защищен авторским правом. За исключением честных сделок с целью частного изучения или исследования, никакие часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в информационных целях.
Квантовый газ опускается ниже абсолютного нуля
Ультрахолодные атомы открывают дорогу материалам с отрицательной температурой Кельвина.
Температура в газе может опускаться ниже абсолютного нуля благодаря причуде квантовой физики. Предоставлено: PHOTOCREO Михал Беднарек / Thinkstock
Это может показаться менее вероятным, чем адский мороз, но физики впервые создали атомный газ с температурой ниже абсолютного нуля 1 . Их метод открывает двери для создания материалов с отрицательной температурой Кельвина и новых квантовых устройств, и может даже помочь решить космологическую загадку.
Лорд Кельвин определил шкалу абсолютных температур в середине 1800-х годов таким образом, что ничто не могло быть холоднее абсолютного нуля. Позже физики поняли, что абсолютная температура газа связана со средней энергией его частиц. Абсолютный ноль соответствует теоретическому состоянию, в котором частицы вообще не имеют энергии, а более высокие температуры соответствуют более высоким средним энергиям.
Однако к 1950-м годам физики, работающие с более экзотическими системами, начали понимать, что это не всегда верно: технически вы считываете температуру системы с графика, который отображает вероятность того, что ее частицы будут обнаружены с определенными энергиями. .Обычно большинство частиц имеют среднюю или близкую к средней энергии, и только несколько частиц носятся с более высокими энергиями. Теоретически, если ситуация обратная, когда больше частиц имеют более высокие, а не более низкие энергии, график перевернется, и знак температуры изменится с положительного на отрицательный абсолютная температура, объясняет Ульрих Шнайдер, физик из Университет Людвига Максимилиана в Мюнхене, Германия.
Шнайдер и его коллеги достигли таких температур ниже абсолютного нуля с помощью ультрахолодного квантового газа, состоящего из атомов калия.Используя лазеры и магнитные поля, они удерживали отдельные атомы в виде решетки. При положительных температурах атомы отталкиваются, делая конфигурацию стабильной. Затем команда быстро отрегулировала магнитные поля, заставляя атомы притягиваться, а не отталкиваться друг от друга. «Это внезапно переводит атомы из их наиболее стабильного состояния с самой низкой энергией в состояние с максимально возможной энергией, прежде чем они смогут отреагировать», — говорит Шнайдер. «Это похоже на прогулку по долине и мгновение на вершине горы.”
При положительных температурах такое обращение было бы нестабильным, и атомы коллапсировали бы внутрь. Но команда также скорректировала лазерное поле захвата, чтобы атомам было более энергетически выгодно оставаться на своих местах. Этот результат, описанный сегодня в Science 1 , отмечает переход газа от значения чуть выше абсолютного нуля до нескольких миллиардных долей Кельвина ниже абсолютного нуля.
Вольфганг Кеттерле, физик и лауреат Нобелевской премии Массачусетского технологического института в Кембридже, который ранее продемонстрировал отрицательные абсолютные температуры в магнитной системе 2 , называет последнюю работу «экспериментальным туром».Экзотические высокоэнергетические состояния, которые трудно создать в лаборатории при положительных температурах, становятся стабильными при отрицательных абсолютных температурах — «как если бы вы могли поставить пирамиду на голову и не беспокоиться о ее опрокидывании», — отмечает он, — и поэтому такие методы может позволить детально изучить эти состояния. «Это может быть способом создания новых форм материи в лаборатории», — добавляет Кеттерле.
Если бы такие системы были построены, такие системы вели бы себя странным образом, — говорит Ахим Рош, физик-теоретик из Кельнского университета в Германии, предложивший метод, используемый Шнайдером и его командой. 3 .Например, Рош и его коллеги подсчитали, что в то время как облака атомов обычно тянутся вниз под действием силы тяжести, если часть облака имеет отрицательную абсолютную температуру, некоторые атомы будут двигаться вверх, очевидно, игнорируя гравитацию 4 .
Другая особенность газа ниже абсолютного нуля заключается в том, что он имитирует «темную энергию», таинственную силу, которая заставляет Вселенную расширяться со все более высокой скоростью против притяжения внутренней силы тяжести. Шнайдер отмечает, что притягивающие атомы в газе, произведенном командой, также хотят схлопнуться внутрь, но не потому, что их стабилизирует отрицательная абсолютная температура.«Интересно, что эта странная особенность появляется во Вселенной, а также в лаборатории», — говорит он. «Это может быть то, на что космологи должны обратить более пристальное внимание».
Ссылки
- 1
Braun, S. et al. Наука 339 , 52–55 (2013).
ADS CAS Статья Google ученый
- 2
Медли, П., Велд, Д. М., Мияке, Х., Притчард, Д. Э. и Кеттерле, В. Phys. Rev. Lett. 106 , 195301 (2011).
ADS Статья Google ученый
- 3
Rapp, A., Mandt, S. & Rosch, A. Phys. Rev. Lett. 105 , 220405 (2010).
ADS Статья Google ученый
- 4
Mandt, S., Rapp, A. & Rosch, A. Phys. Rev. Lett. 106 , 250602 (2011).
ADS Статья Google ученый
Скачать ссылки
Об этой статье
Цитировать эту статью
Merali, Z. Квантовый газ опускается ниже абсолютного нуля. Природа (2013). https://doi.org/10.1038/nature.2013.12146
Ссылка для скачивания
Поделиться этой статьей
Все, с кем вы поделитесь следующей ссылкой, смогут прочитать это содержание:
Получить ссылку для совместного использованияИзвините, ссылка для совместного использования в настоящее время недоступно для этой статьи.
Предоставлено инициативой по обмену контентом Springer Nature SharedIt
Что будет с газом при температуре абсолютного нуля (0 К)?
Спросил: Rohit
Ответ
Прежде всего, газ больше не будет газом при абсолютном нуле, а будет твердым телом. Когда газ охлаждается, он совершает фазовый переход из газа в жидкость, и при дальнейшем охлаждении от жидкости до твердого состояния (т.е.замораживание). Некоторые газы, такие как диоксид углерода, полностью пропустите жидкую фазу и сразу перейдете от газа к твердому.Теперь вопрос: что атомы в твердом теле делают (если вообще что-то делают) при абсолютный ноль. Они совершенно неподвижны? Ответ — нет. Атомы, будучи очень крошечные частицы, должны быть проанализированы с помощью квантовой механики, и один из Краеугольным камнем этой теории является принцип неопределенности Гейзенберга (HUP).
HUP утверждает, что неопределенность положения и импульса частицы (масса умноженная на скорость) не являются независимыми друг от друга; продукт этих неопределенности должны быть больше определенного значения.В уравнении-ese:
(неопределенность положения) * (неопределенность импульса)> h
Число h называется постоянной Планка и появляется на протяжении всего кванта механика. Это уравнение требует, чтобы атомы в твердом теле имели определенное количество внутренней нервозности даже при абсолютном нуле. Если бы атомы были полностью неподвижен, то неопределенности положения и импульса будут равны нулю, неподчинение HUP.
Патологическим примером этого является элемент гелий.Потому что гелий — благородный газ (то есть не может образовывать ковалентные связи) и очень легкий, HUP требует неуверенность в его скорости довольно высока по сравнению с другими атомами. Это делает атомы гелия на самом деле так нервничают, что вообще отказываются затвердевать — при разумные давления, он остается жидкостью даже при абсолютном нуле!
Ответил: Дэвид Диксон, доктор философии, профессор, Университет Маркетт, Милуоки
Во-первых, 0K никогда не может быть достигнуто, поскольку количество энтропии в системе может никогда не быть равным нулю, что является утверждением второго закона термодинамики.Это можно хорошо проиллюстрировать вашим вопросом:
Используя уравнение состояния идеального газа:
PV = nRT
T, термодинамическая температура будет равна 0, поэтому произведение молярной газовая постоянная R (8,31 Дж / моль / К) и количество молей n также будут равны нулю.
