абсолютная температура — это… Что такое абсолютная температура?
- абсолютная температура
- абсолю́тная температу́ра
(термодинамическая температура), температура Т, отсчитываемая от абсолютного нуля. Понятие абсолютной температуры было введено У. Томсоном (Кельвином), в связи с чем шкалу абсолютной температуры называют шкалой Кельвина или термодинамической температурной шкалой. Единица абсолютной температуры — кельвин (К). Цены деления шкал Кельвина и Цельсия равны: ΔК = ΔTtºC. Значения абсолютной температуры связаны с температурой по шкале Цельсия (tºC) соотношением t = T – 273,15 К.
* * *
АБСОЛЮТНАЯ ТЕМПЕРАТУРА АБСОЛЮ́ТНАЯ ТЕМПЕРАТУ́РА (термодинамическая температура), температура Т, отсчитываемая от абсолютного нуля (см. АБСОЛЮТНЫЙ НУЛЬ). Понятие абсолютной температуры было введено У. Томсоном (Кельвином), в связи с чем шкалу абсолютной температуры называют шкалой Кельвина или термодинамической температурной шкалой ( ТЕРМОДИНАМИЧЕСКАЯ ТЕМПЕРАТУРНАЯ ШКАЛА). Единица абсолютной температуры — кельвин (см. КЕЛЬВИН (единица температуры)) (К). 1К = 1 °С. Значения абсолютной температуры связаны с температурой по Цельсия шкале (см. ЦЕЛЬСИЯ ШКАЛА) (t °С) соотношением t = Т — 273,15 К.
ТЕРМОДИНАМИЧЕСКАЯ ТЕМПЕРАТУРНАЯ ШКАЛА). Единица абсолютной температуры — кельвин (см. КЕЛЬВИН (единица температуры)) (К). 1К = 1 °С. Значения абсолютной температуры связаны с температурой по Цельсия шкале (см. ЦЕЛЬСИЯ ШКАЛА) (t °С) соотношением t = Т — 273,15 К.
Энциклопедический словарь. 2009.
- абсолютная погрешность
- абсолютно чёрное тело
Смотреть что такое «абсолютная температура» в других словарях:
АБСОЛЮТНАЯ ТЕМПЕРАТУРА — (термодинамическая температура), параметр состояния, характеризующий макроскопич. систему в состоянии термодинамич. равновесия (при этом А. т. всех её макроскопич. подсистем одинакова). А. т. введена в 1848 англ. физиком У. Томсоном (Кельвином)… … Физическая энциклопедия
АБСОЛЮТНАЯ ТЕМПЕРАТУРА — (термодинамическая температура) температура Т, отсчитываемая от абсолютного нуля.
 Понятие абсолютной температуры было введено У. Томсоном (Кельвином), в связи с чем шкалу абсолютной температуры называют шкалой Кельвина или термодинамической… … Большой Энциклопедический словарь
Понятие абсолютной температуры было введено У. Томсоном (Кельвином), в связи с чем шкалу абсолютной температуры называют шкалой Кельвина или термодинамической… … Большой Энциклопедический словарьабсолютная температура — (физ.) – измеряемая выше абсолютного нуля. Большой словарь иностранных слов. Издательство «ИДДК», 2007 … Словарь иностранных слов русского языка
АБСОЛЮТНАЯ ТЕМПЕРАТУРА — АБСОЛЮТНАЯ ТЕМПЕРАТУРА, измеряется в градусах Цельсиевой шкалы, но отсчитывается от точки, лежащей на 273° ниже точки замерзания воды. Такая система отсчета особенно удобна для выражения состояния газа формулой Бойля Гей Люссака (Boyle, Gay… … Большая медицинская энциклопедия
абсолютная температура — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN absolute temperatureabsolute temperatureabs … Справочник технического переводчика
Абсолютная температура — Хаотическое тепловое движение на плоскости частиц газа таких как атомы и молекулы Существует два определения температуры.
 Одно с молекулярно кинетической точки зрения, другое с термодинамической. Температура (от лат. temperatura надлежащее… … Википедия
Одно с молекулярно кинетической точки зрения, другое с термодинамической. Температура (от лат. temperatura надлежащее… … ВикипедияАбсолютная температура — ► absolute temperature Температура, отсчитываемая от абсолютного нуля (минимально возможная температура во Вселенной). Измеряется в кельвинах (0K = 273.16°С). Например, абсолютная температура кипения воды равна 100°С + 273.16°С = 373.16K … Нефтегазовая микроэнциклопедия
- абсолютная температура — термодинамическая (абсолютная) температура Температура, отсчитываемая по термодинамической шкале температур от абсолютного нуля … Политехнический терминологический толковый словарь
абсолютная температура — absoliučioji temperatūra statusas T sritis Standartizacija ir metrologija apibrėžtis Nesisteminis termodinamės temperatūros pavadinimas. atitikmenys: angl. absolute temperature vok. absolute Temperatur, f rus. абсолютная температура, f pranc.
 … … Penkiakalbis aiškinamasis metrologijos terminų žodynas
… … Penkiakalbis aiškinamasis metrologijos terminų žodynasабсолютная температура — absoliučioji temperatūra statusas T sritis Standartizacija ir metrologija apibrėžtis Temperatūra, skaičiuojama nuo absoliučiojo nulio, t. y. 0 K arba 273,16 ºC. atitikmenys: angl. absolute temperature vok. absolute Temperatur, f rus. абсолютная… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
Абсолютной температуры шкала — Энциклопедия по машиностроению XXL
Термодинамическая температурная шкала Шкала Кельвина—термодинамическая температурная шкала, в которой для температуры тройной точки воды установлено значение 273,16 °К (точно) Т—абсолютная температура (шкала Кельвина) °К К [c.22]Абсолютную шкалу энтропии можно построить, установив величину энтропии произвольно выбранного стандартного состояния. Определять абсолютную энтропийную шкалу наиболее удобно, произвольно придав постоянной интегрирования (S — k In значение, равное нулю для стандартного состояния при температуре абсолютного нуля. Утверждение, что 5f, «= k In при температуре абсолютного нуля, составляет основное положение третьего закона термодинамики в его наиболее общей форме. Действительно, для многих кристаллических веществ все атомы находятся на самом низком или основном уровне при температуре абсолютного нуля. Для этого полностью упорядоченного состояния, когда In = О должно быть равно нулю. Согласно этому
[c.133]
Утверждение, что 5f, «= k In при температуре абсолютного нуля, составляет основное положение третьего закона термодинамики в его наиболее общей форме. Действительно, для многих кристаллических веществ все атомы находятся на самом низком или основном уровне при температуре абсолютного нуля. Для этого полностью упорядоченного состояния, когда In = О должно быть равно нулю. Согласно этому
[c.133]
Таким образом, второй закон термодинамики позволяет определить температуру как величину, не зависящую от природы рабочего тела, и указывает путь построения абсолютной термодинамической шкалы температур. [c.133]
Тройная точка воды—это температура, при которой нее три фазы воды (твердая, жидкая, газообразная) находятся в равновесии. Нижним пределом шкалы является абсолютный нуль. Термодинамическую температурную шкалу называют также абсолютной шкалой. Параметром состояния рабочего тела является абсолютная температура, обозначаемая символом Т и измеренная в кельвинах (К). [c.7]
[c.7]
Температура характеризует степень нагретости тела и представляет собой одну из важнейших тепловых величин. В шкале Кельвина нижней границей температурного промежутка служит точка абсолютного нуля. Абсолютная температура выражается в кельвинах (К, 1 К = 1°С). Температура таяния льда соответствует 273,16 К. В настоящем разделе для обозначения абсолютной температуры использован символ Т, для приращения или разности температур — символ АТ», для начальной температуры тела — Т , для температуры окружающей среды — Т . [c.141]
Отсюда следует, что отрицательные абсолютные температуры являются более высокими, чем положительные, и лежат на температурной шкале не ниже абсолютного нуля, а выше бесконечно высокой температуры. Схематически эта ситуация изображена на рис.4.1. [c.78]
Абсолютная шкала температур. Шкала измерения температуры в соответствии с уравнением (25.4) называется абсолютной шкалой. Ее предложил английский физик у.
Так как единица температуры по абсолютной шкале 1 К выбрана равной единице температуры по шкале Цельсия 1 °С, то при любой температуре t по Цельсию значение абсолютной температуры Т выше на 273 градуса [c.79]
Абсолютный нуль температуры 78 Абсолютная температурная шкала 78 Автоколебания 220 Автоколебательная система 220 Адиабата 100 Адиабатный процесс 39 Активное сопротивление 241 Акустика 223 [c.359]
Как будет впоследствии показано, второе начало термодинамики полностью устраняет произвольность в определении температуры, позволяя строго установить абсолютную шкалу температуры (шкалу Кельвина), не зависящую ни от выбранного вещества, ни от того или иного термометрического параметра. [c.21]
Второе начало термодинамики устраняет этот недостаток и позволяет установить термодинамическую шкалу, температура по которой не зависит от термометрического вещества и поэтому называется абсолютной.

Температура, отсчитываемая от этого абсолютного нуля, называется абсолютной температурой, а сама шкала температур называется шкалой Кельвина. [c.16]
Следовательно, достижение абсолютного нуля термодинамической шкалы температур невозможно. Существование отрицательных абсолютных температур [2], которые по модулю больше любых значений положительных температур, также исключает достижение абсолютного нуля термодинамической шкалы температур. [c.54]
Из уравнения (л) видно, что при переходе из одного состояния в другое в рамках одной пространственно-временной системы абсолютная температура Г не может менять знак на обратный.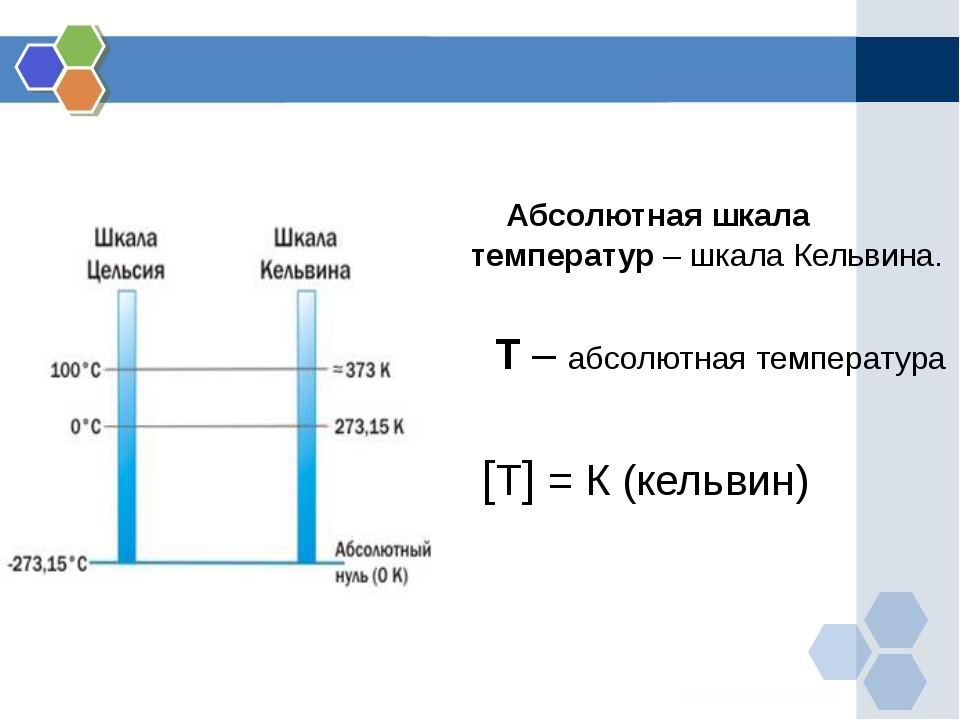 Она может быть всегда положительной или всегда отрицательной. Считая абсолютную температуру Т положительной, приходим к выводу, что обычные термодинамические системы не могут иметь отрицательных абсолютных температур. Вместе с тем уравнение (л) позволяет осуществить практическое построение абсолютной шкалы температур, например, путем сопоставления с идеальным термометром, наполненным идеальным газом, хотя идеальный термометр — это лишь абстракция.
[c.61]
Она может быть всегда положительной или всегда отрицательной. Считая абсолютную температуру Т положительной, приходим к выводу, что обычные термодинамические системы не могут иметь отрицательных абсолютных температур. Вместе с тем уравнение (л) позволяет осуществить практическое построение абсолютной шкалы температур, например, путем сопоставления с идеальным термометром, наполненным идеальным газом, хотя идеальный термометр — это лишь абстракция.
[c.61]
Абсолютная температура рабочего тела является мерой интенсивности теплового движения молекул. При тепловом равновесии двух тел, когда теплообмен между ними отсутствует, температура их одинакова. Абсолютная температура всегда положительна, а нулевое значение ее соответствует состоянию полного покоя молекул. Шкала, в которой температура отсчитывается от этого состояния, называется термодинамической шкалой Кельвина. Измеренная по этой шкале температура обозначается 7 К. В технике же принята международная стоградусная шкала — шкала Цельсия, в которой отсчет ведется от состояния тающего льда при нормальном давлении (соответствующего абсолютной температуре 7=273,15 К).
Наиболее универсальной шкалой температур, не зависящей от каких-либо свойств термометрического вещества, является абсолютная термодинамическая шкала температур Т — шкала Кельвина, построенная на основе второго закона термодинамики (см. п. 6.2) и [c.13]
Абсолютная термодинамическая шкала температур. Используя свойства цикла Карно, английский физик В. Кельвин предложил универсальную шкалу температур, которая не зависит от свойств отдельных веществ и получила название абсолютной термодинамической шкалы температур, или шкалы Кельвина. [c.107]
Температура тела, измеряемая по одной из подобных температурных шкал, будет зависеть от свойств применяемого термометрического вещества. Поэтому она называется эмпирической температурой в отличие от так называемой абсолютной температуры, обозначаемой через Т, к понятию которой приводит кинетическая теория материи. [c.11]
[c.11]
Если начало отсчета установлено от абсолютного нуля температур, то получаем абсолютную термодинамическую шкалу, единицей которой служит градус К. Значения температур по этим шкалам соотносятся Т = = t+ 273,15 К. [c.121]
Зависимость удельной проводимости жидкого масляно-канифольного компаунда от температуры (рис. 2-3) соответствует уравнению (2-4) при а — 9100 К. На рис. 2-3, как и на некоторых последующих, по оси ординат отложена удельная проводимость в логарифмическом масштабе, по оси абсцисс — числа, обратные абсолютным температурам, и соответствующие значения температуры по стоградусной шкале. [c.36]
Сходственные температуры. Удается наблюдать закономерности, до некоторой степени общие для ряда металлов, если ввести в качестве параметра не температуру в градусах той или иной шкалы, а так называемую сходственную (гомологическую) температуру. Сходственной температурой называется доля в процентах, составляемая рассматриваемой температурой, от температуры плавления данного металла в шкале абсолютных температур.
 На рис. 4.43 для двух металлов показаны графики, позволяющие переводить сходственные температуры в % в температуру по Цельсию.
[c.281]
Т — абсолютная температура t — температура по стоградусной шкале f t — к. п. д. теоретического цикла Q — количес
На рис. 4.43 для двух металлов показаны графики, позволяющие переводить сходственные температуры в % в температуру по Цельсию.
[c.281]
Т — абсолютная температура t — температура по стоградусной шкале f t — к. п. д. теоретического цикла Q — количесОпределение температуры. Абсолютная температура
На протяжении школьного
курса физики, вы уже много раз слышали о том, что температура является мерой
средней кинетической энергии молекул. Но, как сказал Лев Ландау, «верховным
судьёй всякой физической теории является опыт». Поэтому, на сегодняшнем уроке мы
рассмотрим опыты, позволяющие нам дать определение температуре. Возьмем сосуд с
перегородкой и поместим в половинки сосуда два различных газа разной
температуры. Если перегородка сосуда проводит тепло, то через некоторое время
оба газа будут иметь одинаковую температуру.
Основываясь на нашем начальном предположении о том, что температура является мерой средней кинетической энергии молекул, мы попытаемся доказать, что средняя кинетическая энергия молекул обладает таким же свойством, как и температура.
Как и было сказано в предыдущих уроках, измерить кинетическую энергию отдельной молекулы крайне сложно. Однако, мы можем выразить среднюю кинетическую энергию молекул газа через макроскопические параметры. Воспользуемся основным уравнением молекулярно-кинетической теории:
Заметим, что концентрация молекул равна отношению числа молекул газа к его объёму:
Тогда
Итак, мы выразили среднюю кинетическую энергию молекул через три величины, которые легко измеряются. Объём можно задать, поместив газ в герметичный баллон, а давление измерим с помощью манометра. Чтобы найти количество молекул, как вы знаете, нужно количество вещества умножить на число Авогадро:
Вспомним теперь, что количество вещества равно отношению массы к молярной массе:
Молярную массу, как вы
знаете, можно подсчитать, используя таблицу Менделеева.
Следовательно,
Для проведения опыта мы можем использовать баллоны с водородом и кислородом, давление, объёмы и количество молекул которых, различны.
Чтобы уравнять температуру газов их необходимо привести в тепловое равновесие с одним и тем же телом (как правило, используется тающий лед). Через некоторое время установится тепловое равновесие, то есть температуры кислорода и водорода будут равны 0 оС. Наша цель проверить — уравнялись ли при этом средние кинетические энергии молекул газов, и если это так, то наше начальное предположение верно. Опыты и сопутствующие расчеты говорят о том, что отношение произведения давления и объёма к количеству молекул газа остается постоянным при постоянной температуре, независимо от природы самого газа:
Это говорит нам о том, что средняя кинетическая энергия молекул — это и есть температура.
Необходимо отметить, что
данное соотношение все же начинает зависеть от рода газа при очень большом
давлении, таком как несколько сотен атмосфер.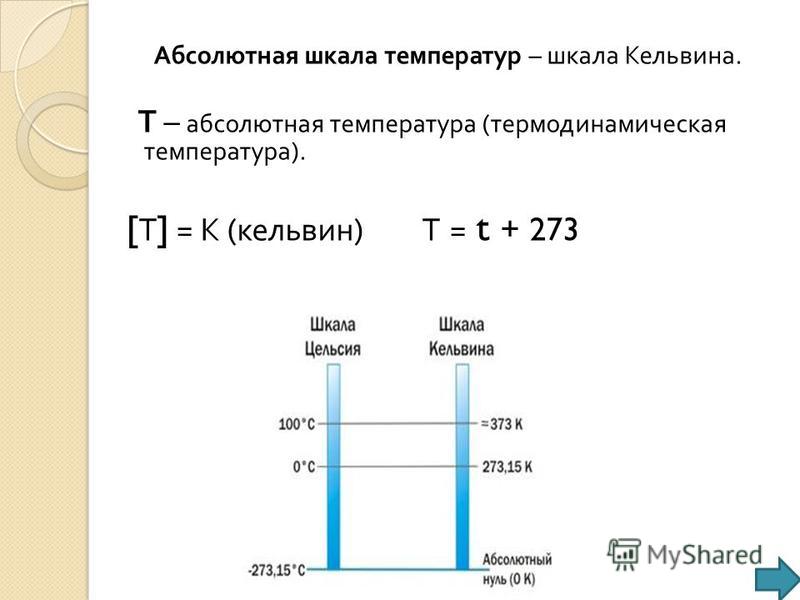 Однако, мы с уверенностью можем
сказать, что до тех пор, пока газ может считаться идеальным, данное соотношение
строго определено.
Однако, мы с уверенностью можем
сказать, что до тех пор, пока газ может считаться идеальным, данное соотношение
строго определено.
Поскольку температура фактически является мерой энергии, её иногда измеряют в энергетических единицах. Но, дело в том, что в повседневной жизни подобные единицы измерения неудобны. Например, если в баллоне объёмом 10 л находится 1 моль водорода при нормальном давлении, то средняя кинетическая энергия его молекул будет равна 1,68 х 10−21 Дж. В связи с этим возникает вопрос: как перевести температуру из энергетических единиц измерения в градусы, используемые в повседневной жизни? Ведь, люди могут выбирать какую угодно температурную шкалу, но этот выбор не может повлиять на кинетическую энергию молекул. Поэтому, вводится понятие абсолютной температуры. Будем считать эту температуру прямо пропорциональной температуре, выраженной в энергетических единицах:
В этой формуле мы
обозначили коэффициент пропорциональности буквой k.
Учитывая тот факт, что такие величины, как объём, давление и число молекул, не могут быть отрицательными, делаем вывод, что абсолютная температура тоже не может быть отрицательной.
Как видно из формулы, абсолютный ноль температуры — это такая температура, при которой давление газа равно нулю, при постоянном объёме. Такое возможно только в случае, если молекулы газа попросту остановились (это следует из основного уравнения молекулярно-кинетической теории).
Абсолютную шкалу температур предложил лорд Кельвин, в честь которого и названа единица измерения температуры по абсолютной шкале. 1 К равен 1 оС, поэтому перевести градусы Цельсия в кельвины довольно просто: нужно к температуре в градусах Цельсия прибавить 273 градуса:
Таким образом, абсолютный ноль температуры по шкале Цельсия равен −273 градуса. Необходимо отметить, что абсолютный ноль недостижим.
Вернемся теперь к уравнению, которое мы использовали в начале урока:
Также, мы выяснили, что отношение произведения давления и объёма к числу молекул должно быть пропорционально температуре:
Мы получили два
уравнения, левые части которых равны. Значит, должны быть равны и правые части:
Значит, должны быть равны и правые части:
Итак, мы вплотную подошли к связи между средней кинетической энергией и температурой. Остается только разобраться с коэффициентом пропорциональности.
Этот коэффициент получил название постоянной Больцмана, в честь Людвига Больцмана.
Больцман был первым, кто нашел соотношение между кинетической энергией и температурой. Постоянная Больцмана определяет связь между температурой в энергетических единицах измерения и температурой в кельвинах. Итак, средняя кинетическая энергия молекул равна
Сегодня мы можем повторить эксперимент, с помощью которого можно вычислить постоянную Больцмана. Возьмем газ, который можно считать идеальным, и измерим среднюю кинетическую энергию его молекул тем же способом, который мы использовали в начале урока — то есть, выразив её через макроскопические параметры:
Проведем измерения для
двух случаев: в одном случае поместим сосуд в тающий лед, а во втором случае —
в кипящую воду.
Тогда, разность между температурами в энергетических единицах измерения должна быть равна произведению разности температуры в кельвинах и постоянной Больцмана:
Отсюда выразим постоянную Больцмана:
Расчеты показывают, что эта величина остается постоянной для любого газа, который можно считать идеальным:
Несмотря на то, что соотношение между температурой и кинетической энергией установлено для газов, оно также выполняется для жидкостей и для твердых тел:
Данное соотношение не выполняется только в том случае, если движение частиц не подчиняется законам механики Ньютона. Это происходит при экстремальных условиях, например при колоссальном давлении, огромной температуре или сильнейших электромагнитных полях.
Пример решения задачи.
Задача. При
температуре 200 К средняя скорость молекул одного моля неизвестного газа равна
500 м/с. Считая этот газ идеальным, определите его молярную массу.
Считая этот газ идеальным, определите его молярную массу.
2.3 Абсолютная температура
На основании сказанного, можно сделать вывод: для измерения температуры необходима такая термометрическая величина, изменение которой при изменении температуры было бы независимо (или слабо зависимо) от химической природы вещества.
Такой термометрической величиной описывается газообразное состояние вещества, подчиняющееся уравнению Клапейрона – Менделеева:
| (2.3.1) |
Как видно из (2.3.1), давление газа при постоянном объеме и объем газа при постоянном давлении могут быть взяты в качестве термометрической величины, однако и здесь возникают те же трудности, так как реальные газы лишь приближенно могут рассматриваться как идеальные, т. е. удовлетворяющие уравнению (2.3.1).
Поэтому для устранения снова возникающей неоднозначности принято все термометры градуировать по эталонному газовому термометру с термометрическим телом Не (гелий) и термометрической величиной P (давление газа) при постоянном объеме.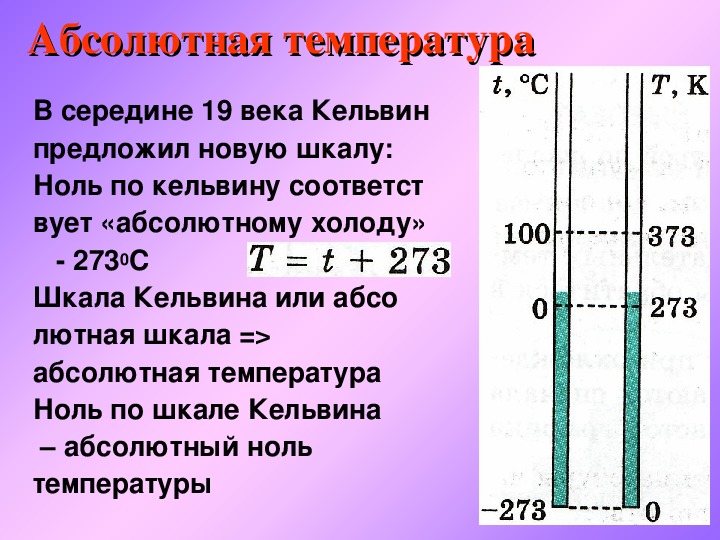 Этот выбор обосновывают следующим:
Этот выбор обосновывают следующим:
1. Гелий, после водорода, в наименьшей степени отклоняется от законов идеального газа (для воздуха, азота, углекислого газа и т. п. эти отклонения больше, чем для гелия). Исключение водорода связано с тем, что при высоких температурах он начинает химически действовать на материал сосуда (как правило, стекло), в котором он находится.
2. Измерение давления газа при постоянном объеме производится с большей точностью, чем измерение объема при постоянном давлении.
Однако и здесь возникают трудности: в области высоких температур применение эталонного гелиевого термометра ограничивается практическими осложнениями, а именно: гелий проникает через стенки сосуда, в котором он находится, при этом уменьшается число N молекул гелия в сосуде. В этих условиях гелий заменяют на азот. При низких температурах становятся заметными отступления от простого закона (2.3.1). Ввиду этого газовый термометр используют в качестве эталонного только для такого интервала температур, где с высокой степенью точности выполняется закон (2. 3.1).
3.1).
Для опытного определения вида функции f(х) уже до опыта необходимо уметь измерять температуру, так как для этого надо знать значения термометрической величины х, соответствующие ряду последовательных температур. Поэтому вид функциональной зависимости между температурой и термометрической величиной первоначально можно выбрать только произвольно. Простоты ради ее выбирают линейной, т. е. полагают
| (*) |
Таким образом, в идеально-газовой шкале температур в качестве термометрического тела выбирают газообразный гелий (азот), а термометрической величиной – его давление при постоянном объеме. Температуру в этой шкале обозначают буквой Т, а термометрическую величину х – буквой P. Зависимость между ними выбирают линейной, вида (*) с b = 0, т. е.
(2. 3.2) 3.2) |
Как видно из (2.3.2), температура в этой шкале равна нулю, когда давление газа Р = 0. Шкала, а также температура, измеренная в этой шкале, называется абсолютными, если в нуле температурной шкалы термометрическая величина обращается в нуль.
В абсолютной идеально-газовой шкале так же, как и в шкале Цельсия, разность температур между двумя реперными точками (температурой Т1 плавления льда и температурой Т2 кипения воды при нормальном атмосферном давлении) принимается равной 100, т. е. один градус в шкале Цельсия равен одному градусу в абсолютной шкале по определению. Таким образом, в абсолютной шкале
| Т2 – Т1 = 100. | (2.3.3) |
Второе уравнение для определения значений температур в реперных точках абсолютной шкалы находится измерением давлений P1 и P2 соответствующих температурам Т1 и Т2 в реперных точках. Эти измерения дают
Эти измерения дают
| (2.3.4) |
Решая уравнения (2.3.3)–(2.3.4), находим
| Т1=273,15 К, Т2 = 373,15 К. |
Tемпература Т в абсолютной шкале определяется по формуле
| (2.3.5) |
Разделим обе части выражения (2.3.5) на T1, получим
| (2.3.6) |
Подставив (2.3.4) в (2.3.6), находим
| (2.3.7) |
или
(2. 3.8) 3.8) |
где P1 – давление в газовом термометре, находящемся в тающем льду. Чтобы при помощи газового термометра измерить температуру тела, необходимо это тело привести в тепловой контакт с газовым термометром и измерить манометром давление газа в нем. Тогда температура Т вычисляется по формуле (2.3.8).
Ввиду того, что так называемая тройная точка воды (одновременное сосуществование в равновесии трех фаз воды твердой, жидкой и газообразной) значительно лучше воспроизводится на опыте, чем точки плавления льда и кипения воды, в 1954 г. по международному соглашению абсолютная шкала или шкала Кельвина строится по одной реперной точке – тройной точке воды температуре которой приписываются точно Ттр= 273,16 К (или 0,01 0С).
Тогда любая температура Т, измеряемая газовым термометром определяется по формуле, аналогичной (2.3.8):
(2. 3.9) 3.9) |
Указанный выше выбор численного значения температуры тройной точки воды сделан для того, чтобы промежуток между точками плавления льда и кипения воды с максимально возможной точностью составлял 100 К. Тем самым устанавливается преемственность температурной шкалы Кельвина с абсолютной шкалой, определяемой двумя реперными точками. Измерения показали, что температуры точек плавления льда и кипения воды в шкале, Кельвина с одной реперной точкой равны приблизительно 273,15 К и 373,15 К. Единица температуры в этой шкале – Кельвин – 1/273,16 температурного интервала между тройной точкой воды и точкой абсолютного нуля температуры.
Для шкал Кельвина и Цельсия
| (2.3.10) |
| (2.3.11) |
Вычитая из (2.3.10) выражение (2. 3.11), получим связь между шкалами Кельвина и Цельсия:
3.11), получим связь между шкалами Кельвина и Цельсия:
| Т,К = t 0С+273,15. | (2.3.12) |
Урок 19. температура. энергия теплового движения молекул — Физика — 10 класс
Физика, 10 класс
Урок №19. Температура. Энергия теплового движения молекул
На уроке рассматриваются понятия: температура и тепловое равновесие; шкалы Цельсия и Кельвина; абсолютная температура как мера средней кинетической энергии теплового движения частиц вещества, зависимость давления от концентрации молекул и температуры.
Глоссарий по теме:
Макроскопические параметры — величины объём V, давление p и температура t, характеризующие состояние макроскопических тел без учёта их молекулярного строения.
Температура характеризует степень нагретости тела (холодное, тёплое, горячее).
Температура (от лат. temperatura — надлежащее смешение, соразмерность, нормальное состояние) — физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы.
temperatura — надлежащее смешение, соразмерность, нормальное состояние) — физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы.
Тепловым равновесием называют – такое состояние тел, при котором температура во всех точках системы одинакова.
Тепловым или термодинамическим равновесием, изолированной системы тел, называют состояние, при котором все макроскопические параметры в системе остаются неизменными.
Термометр — это прибор для измерения температуры путём контакта с исследуемым телом. Различают жидкостные, газовые термометры, термопары, термометры сопротивления.
Абсолютная температура Т прямо пропорциональна температуре Θ (тета), выражаемой в энергетических единицах (Дж).
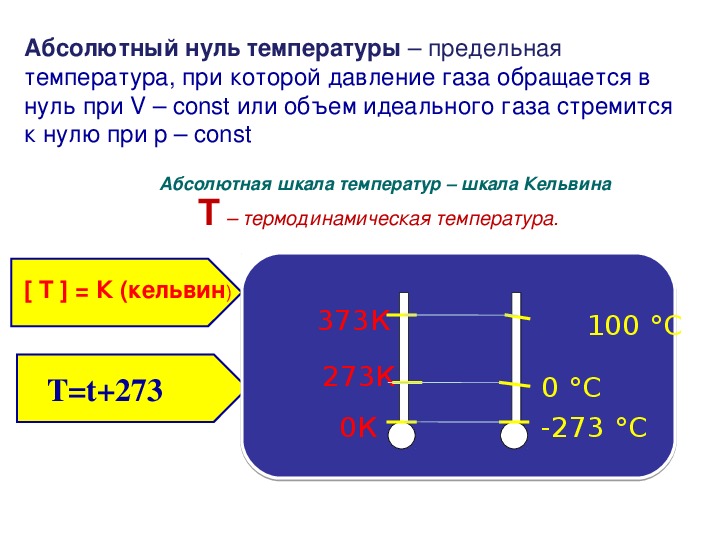
Абсолютный нуль — предельная температура, при которой давление идеального газа обращается в нуль при фиксированном объёме или объём идеального газа стремится к нулю при неизменном давлении.
Абсолютный нуль – температура, при которой прекращается тепловое движение молекул.
Абсолютная шкала температур (Шкала Кельвина) – здесь нулевая температура соответствует абсолютному нулю, а каждая единица температуры равна градусу по шкале Цельсия.
Кельвин — единица абсолютной температуры в Международной системе измерений (СИ).
Постоянная Больцмана – коэффициент, связывает температуру Θ энергетических единицах (Дж) с абсолютной температурой Т (К).
Абсолютная температура есть мера средней кинетической энергии молекул.
Давление газа прямо пропорционально концентрации его молекул и абсолютной температуре Т.
Закон Авогадро – в равных объёмах газов при одинаковых температурах и давлениях содержится одинаковое число молекул
Обязательная литература:
- Мякишев Г.Я., Буховцев Б.Б., Сотский Н.Н. Физика.10 класс. Учебник для общеобразовательных организаций М.: Просвещение, 2017. – С. 195 – 203.
Дополнительная литература:
- Смородинский Я.
 А. Температура. — 3-е издание. — М.: Бюро Квантум, 2007. (Библиотечка «Квант». Вып. 103. Приложение к журналу «Квант» № 5/2007.) С. 5— 25.
А. Температура. — 3-е издание. — М.: Бюро Квантум, 2007. (Библиотечка «Квант». Вып. 103. Приложение к журналу «Квант» № 5/2007.) С. 5— 25. - Кирик Л.А., Генденштейн Л.Э., Гельфгат И.М.. Задачи по физике. 10-11 классы для профильной школы. – М.: Илекса, 2010. – С. 111-115.
- Рымкевич А.П. Физика. Задачник. 10-11 классы. – М.: Дрофа, 2013. — С. 65 – 67.
- Орлов В.А., Сауров Ю.А. Практика решения физических задач. 10-11классы. – М.: Вентана-Граф, 2014. – С. 98-99.
- http://kvant.mccme.ru/1991/09/idealnyj_gaz_-_universalnaya_f.htm
Теоретический материал для самостоятельного изучения
Измеряя расположение звёзд на небе, расстояния на земле, время, люди знали, для чего они это делают и изобретали, телескопы, часы, прототипы современных линеек. О температуре такого же сказать было нельзя. О том, что такое тепловое равновесие и что означает степень нагрева тела (температура), существовали разные мнения. Но человек с незапамятных времен точно знал, что, когда два тела плотно соприкасаются, между ними устанавливается, выражаясь современным языком, тепловое равновесие.
Любое макроскопическое тело или группа макроскопических тел при неизменных внешних условиях самопроизвольно переходят в состояние теплового равновесия.
Тепловым равновесием называют такое состояние тел, при котором температура во всех точках системы одинакова.
Температура (от лат. temperatura — надлежащее смешение, соразмерность, нормальное состояние) — физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы.
К числу характеристик состояния макроскопических тел (твёрдых тел, жидкостей, газов) и процессов изменения их состояний, относят объём, давление и температуру. Эти величины описывают в целом тела, состоящие из большого числа молекул, а не отдельные молекулы. При этом микроскопические процессы внутри тела не прекращаются при тепловом равновесии: расположения молекул всё время меняются и меняются их скорости при столкновениях.
Величины объём, давление и температуру, характеризующие состояние макроскопических тел без учёта их молекулярного строения, называют макроскопическими параметрами.
Тепловым или термодинамическим равновесием, изолированной системы тел, называют состояние, при котором все макроскопические параметры в системе остаются неизменными.
Для точной характеристики нагретости тела, необходим прибор, способный измерить температуры тел и дать возможности их сравнения.
Термометр — это прибор для измерения температуры путём контакта с исследуемым телом. Различают жидкостные, газовые термометры, термопары, термометры сопротивления.
В 1597 году Галилей создал термоскоп, в собственных сочинениях учёного нет описания этого прибора, но его ученики засвидетельствовали этот факт. Аппарат представлял собой устройство для поднятия воды при помощи нагревания.
Изобретение термометра, данные которого не зависели бы от перепадов атмосферного давления, произошли благодаря экспериментам физика Э. Торричелли, ученика Галилея.
Во всех приборах, изобретённых в XVIII веке, измерение температуры было относительно расширению столбика воды, спирта или ртути и произвольности выбора начала отсчёта, т. е. нулевой температуры. Наполняющие их вещества замерзали или кипели и этими термометрами нельзя было измерять очень низкие или очень высокие температуры. Необходимо было изобрести такую шкалу, чтобы избавиться от зависимости выбранного вещества, на основе которого формировалось градуирование.
е. нулевой температуры. Наполняющие их вещества замерзали или кипели и этими термометрами нельзя было измерять очень низкие или очень высокие температуры. Необходимо было изобрести такую шкалу, чтобы избавиться от зависимости выбранного вещества, на основе которого формировалось градуирование.
Шкала, предложенная шведским учёным Андерсом Цельсием в 1742 г., точно устанавливала положение двух точек: 0 и 100 градусов. По шкале Цельсия температура обозначается буквой t, измеряется в градусах Цельсия (ºС).
На территории Англии и США используется шкала Фаренгейта. Такая шкала была предложена немецким учёным Даниелем Габриелем Фаренгейтом в 1724 г.: 0 °F — температура смеси снега с нашатырём или поваренною солью, 96 °F —температура здорового человеческого тела, во рту или под мышкой.
Рене Антуан де Реомюр не одобрял применения ртути в термометрах вследствие малого коэффициента расширения ртути. В 1730 году изобрёл водно-спиртовой термометр и предложил шкалу от 0 до 80°.
Шкала Реомюра очень долго использовалась на родине учёного во Франции вплоть до настоящего времени.
Различные жидкости при нагревании расширяются не одинаково. Поэтому расстояния на шкале между нулевой отметкой 0 °C и 100 °C будут разными.
Однако существует способ создать тело, которое приближенно обладает нужными качествами. Это идеальный газ. Было замечено, что в отличие от жидкостей все разряжённые газы – водород, гелий, кислород – расширяются при нагревании одинаково и одинаково меняют своё давление при изменении температуры. Это свойство газов позволяет избавиться в термометрах от одного существенного недостатка шкалы Цельсия – произвольности выбора начала отсчёта, то есть нулевой температуры.
При тепловом равновесии, если давление и объём газа массой m постоянны, то средняя кинетическая энергия молекул газа должна иметь строго определённое значение, как и температура.
Практически такую проверку произвести непосредственно невозможно, но с помощью основного уравнения молекулярно-кинетической теории её можно выразить через макроскопические параметры:
; ; ; ;
Если кинетическая энергия действительно одинакова для всех газов в состоянии теплового равновесия, то и значение давления р должно быть тоже одинаково для всех газов при постоянном значении отношения объёма к числу молекул. Подтвердить или опровергнуть данное предположение может только опыт.
Подтвердить или опровергнуть данное предположение может только опыт.
Возьмём несколько сосудов, заполненных различными газами, например, водородом, гелием и кислородом. Сосуды имеют определённые объёмы и снабжены манометрами, для измерения давления газов в сосудах. Массы газов известны, тем самым известно число молекул в каждом сосуде. Приведём газы в состояние теплового равновесия. Для этого поместим их в тающий лёд и подождём, пока не установится тепловое равновесие и давление газов перестанет меняться.
Здесь устанавливается тепловое равновесие и все газы имеют одинаковую температуру 0 °С. При этом показания манометра показывают разное давление р, объёмы сосудов V изначально были разными и число молекул N различно, так как газы, закаченные в баллоны разные. Найдём отношение для водорода всех параметров для одного моля вещества:
Такое значение отношения произведения давления газа на его объём к числу молекул получается для всех газов при температуре тающего льда. Обозначим это отношение через Θ0 (тета нулевое):
Обозначим это отношение через Θ0 (тета нулевое):
Таким образом, предположение, что средняя кинетическая энергия, а также давление р в состоянии теплового равновесия одинаковы для всех газов, если их объёмы и количества вещества одинаковы или если отношение
Если же сосуды с газами поместить в кипящую воду при нормальном атмосферном давлении, то согласно эксперименту, отношение макроскопических параметров будет также одинаковым для всех газов, но значение будет больше предыдущего
Отсюда следует, что величина Θ растёт с повышением температуры и не зависит от других параметром, кроме температуры. Этот опытный факт позволяет рассматривать величину Θ тета как естественную меру температуры и измерять в энергетических единицах — джоулях.
А теперь вместо энергетической температуры введём температуру, которая будет измеряться в градусах. Будем считать величину тета Θ прямо пропорциональной температуре Т, где k- коэффициент пропорциональности
Так как , то тогда
По этой формуле вводится температура, которая даже теоретически не может быть отрицательной, так как все величины левой части этого равенства больше или равны нулю. Следовательно, наименьшим значением этой температуры является нуль, при любом другом параметре p, V, N равным нулю.
Следовательно, наименьшим значением этой температуры является нуль, при любом другом параметре p, V, N равным нулю.
Предельную температуру, при которой давление идеального газа обращается в нуль при фиксированном объёме или при которой объём идеального газа стремится к нулю при неизменном давлении, называют абсолютным нулём температуры.
Тепловое движение молекул непрерывно и бесконечно, а при абсолютном нуле молекулы поступательно не двигаются. Следовательно, абсолютный нуль температур при наличии молекул вещества не может быть достигнут. Абсолютный нуль температур — это самая низкая температурная граница, верхней не существует, та «наибольшая или последняя степень холода», существование которой предсказывал М.В. Ломоносов.
В 1848 г. английскому физику Вильяму Томсону (лорд Кельвин) удалось построить абсолютную температурную шкалу (её в настоящее время называют шкалой Кельвина), которая имеет две основные точки 0 К (или абсолютный нуль) и 273К, точка в которой вода существует в трёх состояниях (в твёрдом, жидком и газообразном).
Абсолютная температурная шкала — шкала температур, в которой за начало отсчёта принят абсолютный нуль. Температура здесь обозначается буквой T и измеряется в кельвинах (К).
На шкале Цельсия, есть две основные точки: 0°С (точка, в которой тает лёд) и 100°С (кипение воды). Температура, которую определяют по шкале Цельсия, обозначается t. Шкала Цельсия имеет как положительные, так и отрицательные значения.
Из опыта мы определили значения величины Θ (тета) при 0 °С и 100 °С. Обозначим абсолютную температуру при 0 °С через Т1, а при 100 °С через Т2. Тогда согласно формуле:
Отсюда можно вычислить коэффициент k, который связывает температуру в Θ энергетических единицах (Дж) с абсолютной температурой Т (К)
k = 1,38 • 10-23 Дж/К — постоянная Больцмана.
Зная постоянную Больцмана, можно найти значение абсолютного нуля по шкале Цельсия. Для этого найдём сначала значение абсолютной температуры, соответствующее 0°С:
значение абсолютной температуры.
Один кельвин и один градус шкалы Цельсия совпадают. Поэтому любое значение абсолютной температуры Т будет на 273 градуса выше соответствующей температуры t по Цельсию:
Теперь выведем ещё одну зависимость температуры от средней кинетической энергии молекул. Из основного уравнения молекулярно-кинетической теории и уравнения для определения абсолютной температуры
Здесь видно, что левые части этих уравнений равны, значит правые равны тоже.
Средняя кинетическая энергия хаотического поступательного движения молекул газа пропорциональна абсолютной температуре.
Абсолютная температура есть мера средней кинетической энергии движения молекул.
Из выведенных формул мы можем получить выражение, которое показывает зависимость давления газа от концентрации молекул и температуры
Из этой зависимости вытекает, что при одинаковых давлениях и температурах концентрация молекул у всех газов одна и та же. Отсюда следует закон Авогадро, известный нам из курса химии.
Отсюда следует закон Авогадро, известный нам из курса химии.
Закон Авогадро: в равных объёмах газов при одинаковых температурах и давлениях содержится одинаковое число молекул.
Рассмотрим задачи тренировочного блока урока.
1. При температуре _______ (370C; 2830C; 270C) средняя кинетическая энергия поступательного движения молекул равна 6,21·10-21Дж.
Дано:
k = 1,38 • 10-23 Дж/К — постоянная Больцмана
t -?
Решение:
Запишем значение средней кинетической энергии хаотического поступательного движения молекул с зависимостью от абсолютной температуры:
Отсюда выразим Т:
Соотношение между абсолютной температурой и температурой в градусах Цельсия:
Подставим значение абсолютной температуры:
Правильный вариант ответа:
2. При температуре 290 К и давлении 0,8 МПа, средняя кинетическая энергия молекул равна __________ Дж, а концентрация составляет молекул ___________ м-3.
Дано:
Т = 290К
р = 0,8 МПа =0,8·106 Па
k = 1,38 • 10-23 Дж/К — постоянная Больцмана
Ек -? n — ?
Решение:
Значение средней кинетической энергии хаотического поступательного движения молекул:
Подставив значение абсолютной температуры, найдём ответ:
Определим концентрацию газа из соотношения:
Правильный вариант ответа: 6·10-21; 2·1026 м-3.
Шкала температуры. Шкала Цельсия, Фаренгейта, Кельвина, Реомюра
История
Слово «температура» возникло в те времена, когда люди считали, что в более нагретых телах содержится большее количество особого вещества — теплорода, чем в менее нагретых. Поэтому температура воспринималась как крепость смеси вещества тела и теплорода. По этой причине единицы измерения крепости спиртных напитков и температуры называются одинаково — градусами.
Из того, что температура — это кинетическая энергия молекул, ясно, что наиболее естественно измерять её в энергетических единицах (т.е. в системе СИ в джоулях). Однако измерение температуры началось задолго до создания молекулярно-кинетической теории, поэтому практические шкалы измеряют температуру в условных единицах — градусах.
Шкала Кельвина
В термодинамике используется шкала Кельвина, в которой температура отсчитывается от абсолютного нуля (состояние, соответствующее минимальной теоретически возможной внутренней энергии тела), а один кельвин равен 1/273.16 расстояния от абсолютного нуля до тройной точки воды (состояния, при котором лёд, вода и водяной пар находятся в равновесии). Для пересчета кельвинов в энергетические единицы служит постоянная Больцмана. Используются также производные единицы: килокельвин, мегакельвин, милликельвин и т.д.
Шкала Цельсия
В быту используется шкала Цельсия, в которой за 0 принимают точку замерзания воды, а за 100° точку кипения воды при атмосферном давлении. Поскольку температура замерзания и кипения воды недостаточно хорошо определена, в настоящее время шкалу Цельсия определяют через шкалу Кельвина: градус Цельсия равен кельвину, абсолютный ноль принимается за −273,15 °C. Шкала Цельсия практически очень удобна, поскольку вода очень распространена на нашей планете и на ней основана наша жизнь. Ноль Цельсия — особая точка для метеорологии, поскольку замерзание атмосферной воды существенно всё меняет.
Поскольку температура замерзания и кипения воды недостаточно хорошо определена, в настоящее время шкалу Цельсия определяют через шкалу Кельвина: градус Цельсия равен кельвину, абсолютный ноль принимается за −273,15 °C. Шкала Цельсия практически очень удобна, поскольку вода очень распространена на нашей планете и на ней основана наша жизнь. Ноль Цельсия — особая точка для метеорологии, поскольку замерзание атмосферной воды существенно всё меняет.
Шкала Фаренгейта
В Англии и, в особенности, в США используется шкала Фаренгейта. В этой шкале на 100 градусов раздёлен интервал от температуры самой холодной зимы в городе, где жил Фаренгейт, до температуры человеческого тела. Ноль градусов Цельсия — это 32 градуса Фаренгейта, а градус Фаренгейта равен 5/9 градуса Цельсия.
В настоящее время принято следующее определение шкалы Фаренгейта: это температурная шкала, 1 градус которой (1 °F) равен 1/180 разности температур кипения воды и таяния льда при атмосферном давлении, а точка таяния льда имеет температуру +32 °F. Температура по шкале Фаренгейта связана с температурой по шкале Цельсия (t °С) соотношением t °С = 5/9 (t °F — 32), то есть изменение температуры на 1 °F соответствует изменению на 5/9 °С. Предложена Г. Фаренгейтом в 1724.
Температура по шкале Фаренгейта связана с температурой по шкале Цельсия (t °С) соотношением t °С = 5/9 (t °F — 32), то есть изменение температуры на 1 °F соответствует изменению на 5/9 °С. Предложена Г. Фаренгейтом в 1724.
Шкала Реомюра
Предложенна в 1730 году Р. А. Реомюром, который описал изобретённый им спиртовой термометр.
Единица — градус Реомюра (°R), 1 °R равен 1/80 части температурного интервала между опорными точками — температурой таяния льда (0 °R) и кипения воды (80 °R)
1 °R = 1,25 °C.
В настоящее время шкала вышла из употребления, дольше всего она сохранялась во Франции, на родине автора.
|
Пересчёт температуры между основными шкалами |
|||
|
|
Кельвин |
Цельсий |
Фаренгейт |
|
Кельвин (K) |
= K |
= С + 273,15 |
= (F + 459,67) / 1,8 |
|
Цельсий (°C) |
= K − 273,15 |
= C |
= (F − 32) / 1,8 |
|
Фаренгейт (°F) |
= K · 1,8 − 459,67 |
= C · 1,8 + 32 |
= F |
Сравнение температурных шкал
|
Описание |
Кельвин | Цельсий |
Фаренгейт |
Ньютон | Реомюр |
|
Абсолютный ноль |
0 |
−273. |
−459.67 |
−90.14 |
−218.52 |
|
Температура таяния смеси Фаренгейта (соли и льда в равных количествах) |
255.37 |
−17.78 |
0 |
−5.87 |
−14.22 |
| Температура замерзания воды (нормальные условия) |
273.15 |
0 |
32 |
0 |
0 |
|
Средняя температура человеческого тела¹ |
310.0 |
36.8 |
98.2 |
12. |
29.6 |
|
Температура кипения воды (нормальные условия) |
373.15 |
100 |
212 |
33 |
80 |
| Температура поверхности Солнца |
5800 |
5526 |
9980 |
1823 |
4421 |
¹ Нормальная температура человеческого тела — 36.6 °C ±0.7 °C, или 98.2 °F ±1.3 °F. Приводимое обычно значение 98.6 °F — это точное преобразование в шкалу Фаренгейта принятого в Германии в XIX веке значения 37 °C. Поскольку это значение не входит в диапазон нормальной температуры по современным представлениям, можно говорить, что оно содержит избыточную (неверную) точность. Некоторые значения в этой таблице были округлены.
Некоторые значения в этой таблице были округлены.
Сопоставление шкал Фаренгейта и Цельсия
(oF — шкала Фаренгейта, oC — шкала Цельсия)
|
oF |
oC |
|
oF |
oC |
|
oF |
oC |
|
oF |
oC |
|
-459. |
-273.15 |
|
-60 |
-51.1 |
|
-4 |
-20.0 |
|
20 |
-6.7 |
Для перевода градусов цельсия в кельвины необходимо пользоваться формулой T=t+T0 где T- температура в кельвинах, t- температура в градусах цельсия, T0=273.15 кельвина. По размеру градус Цельсия равен Кельвину.
Что такое абсолютная температура
Понятие абсолютной температуры изучается и принимается в термодинамике, но также подразумевает понимание молекулярно-кинетической теории, ибо она связанас энергией теплового движения частиц вещества.Вам понадобитсяПрочитайте общее определение абсолютной температуры в учебнике по молекулярной физике. В данном разделе физики абсолютность температуры связана с несколько другими процессами, чем в термодинамике. Как известно, термодинамическая температура в молекулярно-кинетической теории вводится как некоторая величина, характеризующая степень интенсивности хаотического или теплового движения частиц вещества.
В данном контексте термодинамическая температура вводится при определении средней кинетической энергии системы частиц. Предполагается, что температура является мерой, пропорциональной кинетической энергии частиц вещества. Кинетическая энергия движения системы частиц равна одной второй произведения массы частицы на квадрат среднейскорости. Данную энергию приравнивают к выражению, пропорциональному температуре тела и равному трем вторым произведения постоянной Больцмана на абсолютную температуру. Из данного выражения можно найти, как определяется абсолютная температура.
Обратите внимание на то, что при молекулярно-кинетическом определении температуры нулевое значение соответствует отсутствию кинетической энергии у системы частиц вещества. Данное положение, конечно, практически нереализуемо, но теоретически вполне обосновано. На практике же при приближении к абсолютному нулю состояние частиц становится максимально упорядоченным. В какой-то момент кинетическая энергия частиц становится минимально возможной, и дальнейшее уменьшение температуры невозможно. Данное ограничение на невозможность достижения абсолютного нуля обосновывает квантовая механика.
Посмотрите, каково определение абсолютной температуры в любом учебнике по термодинамике. Первое, что бросается в глаза – это независимость данной температуры от рода и вообще каких-либо частных свойств вещества. Определение температуры в термодинамике связывается с работой тепловой машины и понятием энтропии. Температуру тела определяют в данном случае, определяя то количество тепла, которое поглощает тепловая машина, работающая между температурой исследуемого тела и температурой в один градус. Такая температура и называется абсолютной термодинамической температурой. Энтропия же вводится из предположений, что должна существовать некоторая функция, пропорциональная и температуре и количеству тепла. Из дифференциального соотношения для данной функции и выражается абсолютная температура в термодинамике.
Закон Гей-Люссака Зависимость температуры от давления в газах и определение абсолютного нуля
Чак Розер, преподаватель химии на пенсии
Школа естественных и математических наук Северной Каролины
Стандарты науки нового поколения
| Наука и инженерная практика | Основные дисциплинарные идеи | Общие концепции |
| Практика: планирование и проведение расследований Студенты исследуют взаимосвязь между температурой и давлением закрытого контейнера. | DCI: Материя и ее взаимодействия • Учащиеся определят взаимосвязь между давлением и температурой и свяжут температуру с кинетической энергией и движением частиц. | Концепция: масштаб, пропорции и количество • Учащиеся установят пропорциональную зависимость между температурой и давлением. |
Цели
Цели этого эксперимента заключаются в том, чтобы (а) наблюдать взаимосвязь между давлением и температурой. постоянного количества молей газа в контейнере постоянного объема, и (б) для экспериментального определения расчетное значение для абсолютного нуля.
Введение
Когда газ нагревается, средняя скорость его молекул и кинетическая энергия увеличиваются. Если контейнер имеет постоянный объем, молекулы будут ударять его по бокам с большей частотой. Это создает большую силу на стенках емкости на единицу площади, увеличивая давление в емкости. Это одна из основ предупреждение о недопустимости нагрева баллончика с аэрозольным баллончиком.
Можно построить график, чтобы показать, как давление фиксированной массы газа изменяется при изменении температуры.Температура, при которой давление идеального газа теоретически достигнет нуля, может быть определена путем экстраполяции график зависимости давления от температуры до нулевого давления. Эта температура называется абсолютным нулем и является нулевой точка для шкалы температур Кельвина. Экстраполяция к нулевому давлению необходима, потому что реальные газы конденсируются до жидкости и затвердевают до достижения абсолютного нуля. Связь между давлением идеального газа и его Температура Кельвина выражается законом Гей-Люссака:
.В этом эксперименте давление в пределах Абсолютного нуля Демонстрационный аппарат измеряется при нескольких различных температурах.График зависимости давления от температуры затем подготовлен для установления взаимосвязи между давлением и температурой и оценки значения абсолютного нуль. Аппарат состоит из медной колбы фиксированного объема (медь лишь слегка расширяется и сжимается температуры), манометра и фиксированной массы газа. Давление газа измеряется манометром. Перед выполняется измерение, прибору дают уравновеситься, чтобы гарантировать, что газ и баллон находятся в одном и том же состоянии. температура.
- 2 мензурки на 2 л (для водяных бань)
- 2 горячие пластины для перемешивания (с большими магнитными мешалками)
- 2 термометра Цельсия (предпочтительно спиртовые термометры)
- 2 стойки для колец (с большими 3-контактными зажимами и держателями зажимов для удержания Absolute Zero Demonstrator)
- 2 небольших зажима с 3 зубцами и держателя зажимов (для удержания термометров)
- 4 Стаканы объемом 2 л (для кипящей воды / водяной бани комнатной температуры 50/50; водяной бани комнатной температуры; бани с ледяной водой и бани с сухим льдом и этанолом или ацетоном)
- Демонстратор абсолютного нуля
- 1 пара теплоизоляционных перчаток (для работы с водяными банями, сухим льдом, жидким азотом и Absolute Zero Demonstrator)
- Сосуд Дьюара с широким горлышком (с жидким азотом) (опционально)
Безопасность
- Осторожно: Не используйте открытый огонь во время эксперимента.Этанол и ацетон легко воспламеняются.
- Осторожно: С сухим льдом и жидким азотом следует обращаться очень осторожно (надевать защитные очки и теплоизолированные перчатки) из-за риска обморожения.
- Осторожно: Никогда не кладите сухой лед или жидкий азот в закрытый контейнер, так как каждый из них создаст давление и взорвет контейнер.
- Надевайте защитные очки во время эксперимента.
- Используйте теплоизоляционные перчатки и соблюдайте соответствующие меры предосторожности при обращении с водяными банями, сухим льдом, жидким азотом и Absolute Zero Demonstrator.
Процедура
- Все участники надевают защитные очки. Лица, ответственные за работу с устройством Absolute Zero Demonstrator, водяными банями, сухим льдом и жидким азотом, надевают теплоизоляционные перчатки.
- Погрузить колбу прибора в кипящую водяную баню. Поддержите устройство с помощью большого зажима с тремя зубцами и держателя зажима, а термометр поддержите с помощью небольшого зажима с тремя зубцами и держателя зажима. Дайте воде снова закипеть.
- Подождите несколько минут, пока аппарат не уравновесится. Показание давления должно стабилизироваться на постоянном значении.
- Запишите давление с точностью до мм рт. Ст. И температуру с точностью до 0,1 ° C.
- Вынуть прибор из ванны.
- Осторожно слейте примерно половину кипящей воды и замените ее водой комнатной температуры, чтобы получилась водяная баня кипящая вода / вода комнатной температуры 50/50. Погрузите колбу аппарата в ванну.Поддерживайте прибор и термометр, как описано в шаге 2. Повторите шаги с 3 по 5.
- Погрузите колбу прибора в водяную баню комнатной температуры. Поддерживайте прибор и термометр, как описано в шаге 2. Повторите шаги с 3 по 5.
- Погрузите колбу устройства в водяную баню со льдом. Поддерживайте прибор и термометр, как описано в шаге 2. Повторите шаги с 3 по 5.
- Погрузите колбу прибора в баню сухой лед-этанол (или ацетон).Поддерживайте устройство, как описано в шаге 2. Не используйте термометр для измерения температуры. Предполагается, что баня с сухим льдом имеет температуру сублимации диоксида углерода, давление 1 атм и –78,5 ° C. Подождите несколько минут, пока прибор не уравновесится. Запишите показания манометра и –78,5 ° C.
- Вынуть прибор из ванны.
- Дополнительно: Продуйте прибор гелием. Погрузите колбу прибора в расширительную колбу Дьюара, содержащую жидкий азот.Поддерживайте устройство, как описано в шаге 2. Не используйте термометр для измерения температуры. Предполагается, что баня с жидким азотом имеет температуру кипения, давление 1 атм и –195,7 ° C. Подождите несколько минут, пока прибор не уравновесится. Запишите показания манометра и –195,7 ° C.
- Вынуть прибор из ванны.
Анализ данных
- Подготовьте график зависимости давления от температуры в ° C. На этом графике должны быть помечены оси с указанием следующих единиц: масштабируйте ось x от –300 до 100 ° C (или значение, достаточно отрицательное, чтобы четко показать точку пересечения с осью x), а ось y — от 0 до
1000 мм рт.Проведите лучшую прямую линию через данные. Продлите линию до пересечения с осью x . Перехват x (давление = 0) дает экстраполированное значение для абсолютного нуля. - Если у вас есть доступ к графическому калькулятору или графическому программному обеспечению, вы можете построить график данных и выполнить линейный регрессионный анализ.
- Запишите наклон, точку пересечения y и коэффициент корреляции ( r ). Чем ближе значение r к 1.00 или –1.00, тем лучше данные соответствуют прямой линии.
- Следуйте инструкциям инструктора по печати графика с линией линейной регрессии и статистикой регрессии.
- Чтобы найти значение абсолютного нуля, используйте уравнение для линии: y = mx + b . Абсолютный ноль — это температура, при которой давление газа равно нулю. Это линия x — перехват . Чтобы вычислить это значение, установите y = 0, подставьте значение наклона и решите для x .
Таблица данных
| Чтение № | Тип используемой ванны | Температура (° С) | Температура (° К) | Давление (мм рт. ст.) |
| 1 | ||||
| 2 | ||||
| 3 | ||||
| 4 | ||||
| 5 | ||||
| 6 |
Прикрепите график зависимости давления оттемпература в ° C. На этом графике должны быть помечены оси со следующими единицами измерения: масштабируйте ось x от –300 до 100 ° C (или значение, достаточно отрицательное, чтобы четко показать x -перехват) и y -ось от 0 до 1000 мм рт. Покажите линию линейной регрессии через ваш данные с наклоном, интервалом y и коэффициентом корреляции.
Расчеты и вопросы
- Регрессионный анализ:
Статистика линейной регрессии: наклон: _________ y -пересечение: _______ коэффициент корреляции ( r ): _____.
Уравнение линии регрессии:
Используйте наклон и нулевое значение y , чтобы вычислить значение для абсолютного нуля: ___________. Покажи свои расчеты.
- Рассчитайте относительную погрешность в процентах для значения абсолютного нуля на основе принятого значения –273 ° C.
- Связаны ли давление и температура прямо или наоборот? Обоснуйте свой ответ, основываясь на своем графике.
- Обсудите любые источники возникшей ошибки или любые улучшения, которые можно было бы сделать в этом эксперименте.
Записки инструктора
- Осторожно: Не используйте открытый огонь во время эксперимента. Этанол и ацетон легко воспламеняются.
- Осторожно: С сухим льдом и жидким азотом следует обращаться очень осторожно (надевать защитные очки и теплоизолированные перчатки) из-за риска обморожения.
- Осторожно: Никогда не кладите сухой лед или жидкий азот в закрытый контейнер, так как каждый из них создаст давление и взорвет контейнер.
- Примеры данных:
Чтение № Тип используемой ванны Температура (° С) Температура (° К) Давление (мм рт. Ст.) 1 Кипяток 100,0 373.1 945 2 Кипяток + комнатная темп. вода 53,0 326,1 840 3 Темп. вода 21,0 294,1 765 4 Ледяная вода 0.0 273,1 720 5 Сухой лед / этанол (или ацетон) –78,5 6 Азот жидкий –195,7 77,4 225 - Проще иметь 1 стакан для каждой ванны.Подготовьте ванны с кипящей водой, водой комнатной температуры, ледяной водой и ваннами с сухим льдом и ацетоном. Имейте в наличии очень большой стакан с кипящей водой для приготовления водяной бани с кипящей водой / комнатной температурой. Проверьте примерное количество воды, необходимое для покрытия колбы в ванне. Примечание: Будьте осторожны, чтобы не переполнить стаканы, иначе они переполнятся при погружении колбы.
- Различные пары учащихся могут считывать значения давления и температуры для каждой точки данных. Примечание: Ртутный термометр нельзя использовать с ваннами из сухого льда / ацетона или жидкого азота, так как ртуть замерзает при –39 ° C. Спиртовой термометр замерзает в жидком азоте. Предполагается, что баня сухой лед / ацетон имеет температуру сублимации 1 атм и –78,5 ° C, а жидкий азот — температуру кипения 1 атм и –195,7 ° C.
- Линейная зависимость между давлением и температурой может быть продемонстрирована с помощью 4 температур водяной бани.Хорошее значение для абсолютного нуля требует точки данных с низкой температурой, чтобы уменьшить диапазон, в котором выполняется экстраполяция. Баня сухой лед / ацетон обеспечивает хорошую низкотемпературную точку данных; однако значение жидкого азота работает лучше, поскольку оно ближе к абсолютному нулю.
- Если используется жидкий азот, устройство следует продуть гелием, поскольку кислород в воздухе будет конденсироваться при температуре жидкого азота, в результате чего показания давления будут слишком низкими.
- Денатурированный этанол и ацетон можно приобрести в хозяйственном магазине.Сухой лед можно приобрести в продуктовых магазинах или магазинах для вечеринок. Сосуд Дьюара и жидкий азот иногда можно приобрести в местном колледже.
- Сухой лед возгоняется в конце лаборатории, и этанол или ацетон можно использовать повторно. Жидкому азоту дают испариться.
Абсолютная шкала температуры — обзор
2.4 Теоретические разработки
Теоретическое развитие и формулировка фундаментальных законов термодинамики в первую очередь принадлежит Ранкину, Томсону и Клаузиусу.В 1849 году, через год после предложения основы для шкалы абсолютных температур, Томсон расширил исследования Клапейрона и пришел к следующему соотношению для количества работы, необходимой для производства единицы тепла, выделяющейся при сжатии воздуха [22].
(2.11) WQ = μ1 + EtE
, где W — количество работы, затрачиваемой на сжатие воздуха, Q — тепло, выделяемое при сжатии, μ функция Карно, t — температура и E коэффициент расширения воздуха.
Подобно Карно и Клапейрону, теоретический анализ Томсона был основан на комбинированных газовых законах, которые он выразил в следующей форме.
(2,12) pV = p0V01 + Et
Функциональная форма μ , принятая Томсоном [23], составляет
(2,13) μ = JE1 + Et
, где J обозначает механический эквивалент тепловой единицы. .
В объяснении уравнения. (2.13) Томсон пишет: « Мистер Джоуль предположил мне в письме от 9 декабря 1848 г., что истинное значение μ может быть обратно пропорциональным при температурах от нуля … Эта формула [Ур.(2.13)] также принят Клаузиусом, который принципиально использует его в своих математических исследованиях »[23]. В самом деле, Рудольф Клаузиус вывел уравнение в 1850 г., подобное уравнению, полученному по формуле. (2.13) в следующей форме [24]:
(2.14) C = Aa + t
, где C обозначает обратную функцию Карно, A обозначает эквивалент тепла для единицы работы, т. Е. инверсия Дж в уравнении. (2.13), а a = 273 — это величина, обратная коэффициенту расширения воздуха, т.е.е. 0,003665, определенное из экспериментов Магнуса и Реньо. Связь между шкалой абсолютной температуры и градусами Цельсия, [ K ] = [° C ] + a , была дана Уильямом Рэнкином в статье, прочитанной 4 февраля 1850 года перед Королевским обществом Эдинбурга [25] . Клаузиус также пришел к тому же соотношению [26] с той разницей, что в соотношении Клаузиуса a = 273, а в соотношении Ранкина a = 274,6.
Ренкин в своей последующей статье представил аналитическую формулировку для получения выражения для эффективности цикла Карно [27].
(2,15) WQ1 = T1 − T0T1
, где Q 1 — общее количество подаваемого тепла, T 1 и T 0 обозначают температуру, при которой тепло подается и отклоняется рабочее вещество соответственно.
Замечательный вывод, сделанный Рэнкином, состоит в том, что « Закон Карно не является независимым принципом в теории тепла; но выводится, как следствие, из уравнений взаимного преобразования тепла и расширяющей силы. ”Уравнение, аналогичное уравнению. (2.15) было также получено Томсоном с использованием законов комбинированного газа; т.е. уравнение. (2.12) и уравнения Пуассона, опубликованные в виде примечания к статье Джоуля о воздушных двигателях [28].
После представления модифицированного определения шкалы абсолютных температур, Томсон представил математические выражения первого и второго законов термодинамики для системы, претерпевающей обратимый процесс [21].
(2,16) W + JHt + Ht ′ +… + Htn − 1 + Htn = 0
(2.17) Htt + Ht′t ′ +… + Htn − 1tn − 1 + Htntn = 0
, где W обозначает проделанную работу, H t , H t ′ , …, H t n — 1 , H t n обозначают количества тепла, забираемого при температурах t , t ′,… , t n — 1 , t n соответственно.
Статья Томсона [21] была опубликована в мае 1854 года. В декабре того же года Клаузиус опубликовал свои четвертые мемуары [26] в Annalen Поггендова, в которых первый закон выражается как
(2.18) Q = U + A · W
, где, в соответствии с обозначениями Клаузиуса, Q обозначает тепло, передаваемое системе, U — это сумма тепловой энергии и внутренней работы, а W обозначает внешние работы. Клаузиус объясняет, что внутренняя работа происходит благодаря силам, «которые атомы тела действуют друг на друга и которые, конечно, зависят от природы тела.«Внешняя работа — это работа, выполняемая системой по преодолению внешних сил.
В той же статье Клаузиус сформулировал теорему об эквивалентности преобразований и вывел следующее соотношение для системы, претерпевающей циклический процесс.
(2,19) N = ∫dQT≥0
, где N , некомпенсированное преобразование , обозначенное Клаузиусом, положительно для всех реальных процессов и равно нулю, если процесс обратимый. Клаузиус получил неравенство (2.19) принимая тепло, выделяемое системой, как положительное, а тепло, передаваемое системе, как отрицательное. Однако в своих девятых мемуарах [29] Клаузиус принял соглашение о противоположных знаках и поэтому выразил неравенство (2.19) как
(2.20) ∫dQT≤0
Позже в тех же мемуарах он назначил новый параметр для термина под знаком интеграции.
(2.21) dS = dQT
Он писал: « Мы могли бы назвать S трансформационным содержанием тела, точно так же, как мы назвали величину U его термическим и эргональным содержанием.Но поскольку я считаю, что лучше заимствовать термины для важных величин из древних языков, чтобы они могли быть приняты без изменений во всех современных языках, я предлагаю называть величину S энтропией тела. ”
Интегрирующее уравнение. (2.21) по обратимому пути от эталонного состояния к произвольному состоянию дает
(2.22) S = S0 + ∫dQT
Как отмечал Клаузиус, уравнение. (2.22) используется для определения звездной величины S . Для случая идеальных газов он вывел следующие дифференциальные уравнения для единицы веса вещества [30].
(2,23) dU = cvdT
(2,24) dS = cvdTT + A · RgdVV
, где R г обозначает газовую постоянную. Уравнение (2.24) может быть получено комбинацией уравнений. (2.21), (2.23) и дифференциальная форма уравнения (2.18), то есть
(2.25) dQ = dU + A · dW
, где dW = pdV .
Вспомните коэффициент A в формулировке Клаузиуса, который обозначает эквивалент тепла для единицы работы. Если термины тепла, работы и энергии в формуле.(2.25) описываются в той же единице (например, J), тогда коэффициент A обращается в нуль. В книге, которую Клаузиус опубликовал спустя годы после своих девятых мемуаров, коэффициент A исключен из его формулировки. Например, уравнение. (2.24) после интегрирования выражается как [30]
(2.26) S = S0 + cvlnTT0 + RglnVV0
, где индекс «0» обозначает начальное или эталонное состояние.
Температурные и температурные шкалы | Безграничная физика
Шкала Цельсия
Цельсия или Цельсия — это шкала и единица измерения температуры.Это одна из наиболее часто используемых единиц измерения температуры.
Цели обучения
Объясните, как определяется шкала Цельсия
Основные выводы
Ключевые моменты
- Градус Цельсия (° C) может относиться к определенной температуре по шкале Цельсия, а также к единице измерения температурного интервала, разницы между двумя температурами или неопределенности.
- Шкала Цельсия в настоящее время определяется двумя разными температурами: абсолютным нулем и тройной точкой Венского стандарта средней океанской воды (VSMOW; специально очищенная вода).
- На основании этого соотношение между градусами Цельсия и Кельвином выглядит следующим образом: [latex] \ text {T} _ {\ text {Celsius}} = \ text {T} _ {\ text {Kelvin}} -273,15 [/ latex ].
Ключевые термины
- кельвин : в Международной системе единиц — основная единица термодинамической температуры; 1 / 273,16 термодинамической температуры тройной точки воды; обозначается как K
- абсолютный ноль : самая низкая из возможных температур: ноль по шкале Кельвина и приблизительно -273.15 ° C и -459,67 ° F. Полное отсутствие тепла; температура, при которой движение всех молекул прекратится.
- стандартная атмосфера : международное эталонное давление, определяемое как 101,325 кПа и ранее использовавшееся как единица измерения давления
Цельсия, также известный как градус Цельсия, — это шкала для измерения температуры. Единица измерения — градус Цельсия (° C). Это одна из наиболее часто используемых единиц измерения температуры в мире. Система единиц названа в честь шведского астронома Андерса Цельсия (1701-1744), который разработал аналогичную температурную шкалу.
Температурные шкалы : Краткое введение в температуру и температурные шкалы для студентов, изучающих теплофизику или термодинамику.
Термометр : термометр с калибровкой в градусах Цельсия
С 1743 по 1954 год 0 ° C определялось как точка замерзания воды, а 100 ° C определялась как точка кипения воды при давлении в одну стандартную атмосферу с ртутью в качестве рабочего материала.Хотя эти определяющие корреляции обычно преподаются в школах сегодня, по международному соглашению единица «градус Цельсия» и шкала Цельсия в настоящее время определяются двумя разными температурами: абсолютным нулем и тройной точкой Венской стандартной средней океанской воды (VSMOW; специально очищенная вода). ). Это определение также точно связывает шкалу Цельсия со шкалой Кельвина, которая определяет базовую единицу термодинамической температуры в системе СИ и использует символ K. Абсолютный ноль, самая низкая возможная температура (температура, при которой вещество достигает минимальной энтропии), определяется как равняется точно 0К и -273.15 ° С. Температура тройной точки воды определена как 273,16K и 0,01 ° C. Исходя из этого, соотношение между градусами Цельсия и Кельвина выглядит следующим образом:
Фазовая диаграмма воды : На этой типичной фазовой диаграмме воды зеленые линии отмечают точку замерзания, а синяя линия отмечает точку кипения, показывая, как они меняются в зависимости от давления. Пунктирная линия показывает аномальное поведение воды. Обратите внимание, что вода меняет состояние в зависимости от давления и температуры.
[латекс] \ text {T} _ {\ text {Celsius}} = \ text {T} _ {\ text {Kelvin}} -273,15 [/ latex].
Помимо выражения конкретных температур по шкале (например, «Галлий плавится при 29,7646 ° C» и «Температура на улице 23 градуса Цельсия»), градус Цельсия также подходит для выражения температурных интервалов — разницы между температурами или их неопределенности ( например, «Выходная мощность теплообменника выше на 40 градусов по Цельсию» и «Наша стандартная погрешность составляет ± 3 ° C»). Из-за этого двойного использования нельзя полагаться на название устройства или его символ для обозначения того, что величина является температурным интервалом; из контекста или явного утверждения должно быть ясно, что величина является интервалом.
Шкала Фаренгейта
По шкале Фаренгейта замерзание воды определяется как 32 градуса, а температура кипения воды определяется как 212 градусов.
Цели обучения
Объясните, как определяется шкала Фаренгейта, и преобразуйте ее в градусы Цельсия.
Основные выводы
Ключевые моменты
- Система по Фаренгейту разделяет точки кипения и замерзания воды точно на 180 градусов. Следовательно, градус по шкале Фаренгейта равен 1⁄180 интервала между точкой замерзания и точкой кипения.
- Чтобы преобразовать ° F в ° C, вы можете использовать следующую формулу: [latex] \ text {T} _ {\ text {Celsius}} = \ frac {5} {9} (\ text {T} _ {\ текст {Fahrenheit}} — 32) [/ латекс]. Шкалы Фаренгейта и Цельсия пересекаются при -40 °.
- Шкала Фаренгейта была заменена шкалой Цельсия в большинстве стран с середины до конца 20 века. Фаренгейт остается официальной шкалой США, Каймановых островов, Палау, Багамских островов и Белиза.
Ключевые термины
- рассол : раствор соли (обычно хлорида натрия) в воде
- холодильная смесь : Смесь двух или более химических веществ, достигающая равновесной температуры независимо от температуры любого из составляющих ее химических веществ.Температура также относительно не зависит от количества смесей до тех пор, пока значительное количество каждого исходного химического вещества присутствует в чистом виде
Шкала Фаренгейта измеряет температуру. Он основан на шкале, предложенной в 1724 году физиком Даниэлем Габриэлем Фаренгейтом (1686-1736). Единицей измерения этой шкалы является градус Фаренгейта (° F). По этой шкале точка замерзания воды составляет 32 градуса, а точка кипения воды — 212 градусов.
Исторически нулевая точка шкалы Фаренгейта определялась с помощью термометра, помещенного в рассол.Сам Фаренгейт использовал смесь льда, воды и хлорида аммония (соль) в соотношении 1: 1: 1. Это охлаждающая смесь, которая автоматически стабилизирует ее температуру; стабильная температура этой смеси была определена как 0 ° F (-17,78 ° C). Вторая определяющая точка, 32 градуса, представляла собой смесь льда и воды в соотношении 1: 1. Третья определяющая точка, 96 градусов, была приблизительно температурой человеческого тела, которая тогда называлась «кровяное тепло». ”
Система по Фаренгейту разделяет точки кипения и замерзания воды ровно на 180 градусов.Следовательно, градус по шкале Фаренгейта равен 1/180 интервала между точкой замерзания и точкой кипения. По шкале Цельсия точки замерзания и кипения воды различаются на 100 градусов. Температурный интервал 1 ° F равен интервалу 5/9 градусов Цельсия (° C). Чтобы преобразовать ° F в ° C, вы можете использовать следующую формулу:
[латекс] \ text {T} _ {\ text {Celsius}} = \ frac {5} {9} (\ text {T} _ {\ text {Fahrenheit}} — 32) [/ latex]
Шкалы Фаренгейта и Цельсия пересекаются при -40 ° (-40 ° F и -40 ° C представляют одну и ту же температуру).Абсолютный ноль (-273,15 ° C или 0K) определяется как -459,67 ° F.
Шкала Фаренгейта была заменена шкалой Цельсия в большинстве стран в середине-конце 20 века, хотя Канада сохраняет ее в качестве дополнительной шкалы, которую можно использовать вместе со шкалой Цельсия. Шкала Фаренгейта остается официальной шкалой США, Каймановых островов, Палау, Багамских островов и Белиза.
Рис. 2 : Сравнение шкал Цельсия и Фаренгейта.
Температурные шкалы : Краткое введение в температуру и температурные шкалы для студентов, изучающих теплофизику или термодинамику.
Абсолютный ноль
Абсолютный ноль — максимально низкая температура; формально это температура, при которой энтропия достигает минимального значения.
Цели обучения
Объясните, почему абсолютный ноль является естественным выбором в качестве нулевой точки для системы единиц температуры
Основные выводы
Ключевые моменты
- Абсолютный ноль универсален в том смысле, что при этой температуре вся материя находится в основном состоянии. Следовательно, это естественный выбор в качестве нулевой точки для системы единиц измерения температуры. Система
- K при абсолютном нуле все еще обладает квантово-механической нулевой энергией, энергией своего основного состояния. Однако в интерпретации классической термодинамики кинетическая энергия может быть равна нулю, а тепловая энергия вещества равна нулю.
- Самая низкая температура, которая была достигнута в лаборатории, находится в диапазоне 100 pK, где pK (пикокельвин) эквивалентен 10-12 K. Самая низкая естественная температура, когда-либо зарегистрированная, составляет приблизительно 1K, что наблюдается при быстром расширении газов. покидая туманность Бумеранг.
Ключевые термины
- энтропия : Мера того, насколько равномерно энергия (или какое-либо аналогичное свойство) распределяется в системе.
- термодинамика : раздел естествознания, связанный с теплом и его отношением к энергии и работе
Абсолютный ноль — это самая низкая из возможных температур. Формально это температура, при которой энтропия достигает минимального значения. Проще говоря, абсолютный ноль относится к состоянию, в котором извлекается вся энергия системы (по определению, самое низкое энергетическое состояние, которое может иметь система).Абсолютный ноль универсален в том смысле, что при этой температуре вся материя находится в основном состоянии. Следовательно, это естественный выбор в качестве нулевой точки для системы единиц измерения температуры.
График зависимости давления от температуры : График зависимости давления от температуры для различных газов с постоянным объемом. Обратите внимание, что все графики экстраполируются на нулевое давление при одной и той же температуре
Чтобы быть точным, система при абсолютном нуле все еще обладает квантово-механической нулевой энергией, энергией своего основного состояния.Принцип неопределенности гласит, что положение частицы не может быть определено с абсолютной точностью; следовательно, частица находится в движении, даже если она находится в абсолютном нуле, а основное состояние по-прежнему несет минимальное количество кинетической энергии. Однако в интерпретации классической термодинамики кинетическая энергия может быть равна нулю, а тепловая энергия вещества равна нулю.
Нулевая точка термодинамической шкалы температуры, такой как шкала Кельвина, устанавливается на абсолютный ноль. По международному соглашению абсолютный ноль определяется как 0K по шкале Кельвина и как -273.15 ° по шкале Цельсия (эквивалент -459,67 ° по шкале Фаренгейта). Ученые довели системы до температур, очень близких к абсолютному нулю, когда материя проявляет квантовые эффекты, такие как сверхпроводимость и сверхтекучесть. Самая низкая температура, которая была достигнута в лаборатории, находится в диапазоне 100 pK, где pK (пико-Кельвин) эквивалентен 10 -12 K. Самая низкая естественная температура, когда-либо зарегистрированная, составляет приблизительно 1K, наблюдаемую при быстром расширении газы, покидающие туманность Бумеранг, как показано ниже.
Туманность Бумеранг : Быстрое расширение газов, приводящее к образованию туманности Бумеранг, вызывает самую низкую наблюдаемую температуру за пределами лаборатории.
Температурные шкалы : Краткое введение в температуру и температурные шкалы для студентов, изучающих теплофизику или термодинамику.
Шкала Кельвина
Кельвин — это единица измерения температуры; нулевая точка шкалы Кельвина — это абсолютный ноль, минимально возможная температура.
Цели обучения
Объясните, как определяется шкала Кельвина
Основные выводы
Ключевые моменты
- 0K (абсолютный ноль) универсален, потому что все тепловые движения всего вещества максимально подавляются при этой температуре. Следовательно, абсолютный ноль — это естественный выбор в качестве нулевой точки шкалы Кельвина.
- Шкала Кельвина широко используется в научной работе, потому что ряд физических величин, таких как объем идеального газа, напрямую связаны с абсолютной температурой.
- Чтобы преобразовать градусы Кельвина в градусы Цельсия, мы используем следующую формулу: [latex] \ text {T} _ {\ text {Celsius}} = \ text {T} _ {\ text {Kelvin}} -273,15 [/ latex] .
Ключевые термины
- абсолютный ноль : самая низкая из возможных температур: ноль по шкале Кельвина и приблизительно -273,15 ° C и -459,67 ° F. Полное отсутствие тепла; температура, при которой движение всех молекул прекратится.
- Тройная точка : Уникальная температура и давление, при которых твердая, жидкая и газовая фазы вещества находятся в равновесии.
- идеальный газ : гипотетический газ, молекулы которого не взаимодействуют друг с другом и подвергаются упругому столкновению друг с другом и со стенками контейнера.
Кельвин — это единица измерения температуры. Это одна из семи основных единиц Международной системы единиц (СИ), которой присвоен символ единицы K. Шкала Кельвина — это абсолютная термодинамическая шкала температуры, использующая абсолютный ноль в качестве нулевой точки. В классическом описании термодинамики абсолютный ноль — это температура, при которой прекращается всякое тепловое движение.
Выбор абсолютного нуля в качестве нулевой точки шкалы Кельвина логичен. Различные типы материи кипят или замерзают при разных температурах, но при 0K (абсолютный ноль) все тепловые движения любого максимально подавляются. Шкала Кельвина широко используется в научной работе, потому что ряд физических величин, таких как объем идеального газа, напрямую связаны с абсолютной температурой.
Шкала Кельвина названа в честь инженера и физика Университета Глазго Уильяма Томсона, 1-го барона Кельвина (1824–1907), который писал о необходимости «абсолютных термометрических шкал».«В отличие от градуса Фаренгейта и градуса Цельсия, кельвин не называется градусом и не набирается. Кельвин — основная единица измерения в физических науках, но ее часто используют вместе с градусом Цельсия, который имеет ту же величину. Кельвин определяется как часть 1 / 273,16 термодинамической температуры тройной точки воды (точно 0,01 ° C или 32,018 ° F). Чтобы преобразовать кельвин в градусы Цельсия, мы используем следующую формулу:
[латекс] \ text {T} _ {\ text {Celsius}} = \ text {T} _ {\ text {Kelvin}} -273.15 [/ латекс]
Вычитание 273,16K из температуры тройной точки воды, 0,01 ° C, делает абсолютный ноль (0K) эквивалентным -273,15 ° C и -460 ° F.
Расчетный U
Взаимосвязи между температурными шкалами : Связи между температурными шкалами по Фаренгейту, Цельсию и Кельвину, округленные до ближайшего градуса. Также показаны относительные размеры шкал
Температурные шкалы : Краткое введение в температуру и температурные шкалы для студентов, изучающих теплофизику или термодинамику.
Абсолютный ноль
2
Напряжения и течения в сверххолодных сверхтекучих средах
11 мая 2020 г. — Ученые разработали математическую модель течения сверххолодных сверхтекучих жидкостей, показывающую, как они деформируются, когда сталкиваются с …
Квантовый термометр для измерения сверхнизких температур
16 сентября 2020 г. — В повседневной жизни измерить температуру довольно просто.Но в квантовом мире, который имеет дело с сверхмалым и сверхмалым, определение того, насколько горячо или холодно что-то, начинает …
Самый крутой конструктор LEGO® во Вселенной
23 декабря 2019 г. — LEGO® впервые был охлажден до минимально возможной температуры в эксперименте, который открывает новое применение популярной игрушки — развитие квантовых вычислений. Цифра и четверка …
Квантовый холодильник
29 июля 2021 г. — Объединив квантовую теорию и термодинамику, можно создать новый тип атомного холодильника, который может охлаждать даже чрезвычайно холодные бозе-эйнштейновские конденсаты…
Исследователи соблюдают предсказания 70-летней давности с далеко идущими эффектами
27 июня 2019 г. — Размешивая молоко в чашке кофе, вы увидите в действии турбулентность жидкости — быстрое перемешивание, которое не поддается глубокому научному пониманию. Исследователи задались целью узнать больше о повседневной жизни …
Теория описывает квантовые явления в наноматериалах
23 декабря 2020 г. — Физики-теоретики разработали математические формулы, описывающие физическое явление, происходящее внутри квантовых точек и других наноразмерных материалов.Формулы могут быть применены для дальнейшего …
В квантовой спиновой жидкости найдено новое доказательство двойственности электрона
13 мая 2021 г. — Новые эксперименты подтверждают старую десятилетиями теорию о том, что в квантовом режиме электрон ведет себя так, как будто он состоит из двух частиц: одной частицы, несущей свой отрицательный заряд, и …
Квантовые движения малых стеклянных сфер, контролируемые
14 июля 2021 г. — Квантовыми движениями небольшой стеклянной сферы можно было впервые управлять в Вене, объединив микроскопию с техникой управления, задав курс для квантов будущего…
Экспериментальное устройство генерирует электричество из холода Вселенной
6 мая 2019 г. — Недостатком солнечных панелей является то, что они требуют солнечного света для выработки электроэнергии. Некоторые заметили, что для устройства на Земле, обращенного в космос, леденящий поток энергии из устройства может быть …
Next Up: ультрахолодные симуляторы сверхплотных звезд
3 января 2019 г. — Физики создали первую в мире нейтральную плазму с лазерным охлаждением.Исследование открывает новые горизонты, на которых физики-экспериментаторы в области атомной энергии и плазмы могут уговорить материю вести себя по-новому …
474: Использование закона Чарльза для определения абсолютного нуля
- Последнее обновление
- Сохранить как PDF
Ниже проиллюстрирован простой эксперимент по определению абсолютного нуля с использованием закона Чарльза.Колбу Эрленмейера взвешивают и помещают в баню с кипящей водой и дают ей прийти в тепловое равновесие. Измеренная температура составляет 99,0 o ° C. Затем колбу погружают, переворачивают в ледяную баню (0,20 o ° C) и дают ей прийти в тепловое равновесие. Сжатие воздуха в колбе при более низкой температуре втягивает воду в колбу. Колбу осторожно снимают, сушат снаружи и взвешивают. Наконец, колбу наполняют водой (как показано справа внизу) и взвешивают.Измерения массы преобразуются в объемы газа с высокой и низкой температурой, и закон Чарльза, V = a⋅ T + b, используется для вычисления абсолютного нуля.
Преобразование измерений массы в объемы газа с высокой и низкой температурой:
Высокая температура: V ч : = \ (\ frac {224,4 г — 83,0 г} {1 \ frac {gm} {mL}} \) = 0,141 л; T h : = 99,0 по Цельсию
Низкая температура: V l : = \ (\ frac {224,4 г — 120,8 г} {1 \ frac {gm} {mL}} \) = 0. {resolve, \ begin {pmatrix}
a \\
b \\
T_ {o}
\ end {pmatrix}} \ rightarrow [0.3826 \ frac {mL} {Цельсия} ~ 103,5 мл ~ (-270,6) Цельсия] \)
Правильное значение для абсолютного нуля составляет -273,2 o C. Таким образом, этот результат имеет ошибку примерно на 1%.
Газовая фаза Gc Phy Абсолютная температура по шкале Кельвина — Газовая фаза
Кельвин — это единица измерения температуры; нулевая точка шкалы Кельвина — это абсолютный ноль, минимально возможная температура.
Кельвин — это единица измерения температуры.Это одна из семи основных единиц Международной системы единиц (СИ), которой присвоен символ единицы K. Шкала Кельвина — это абсолютная термодинамическая шкала температуры, использующая абсолютный ноль в качестве нулевой точки. В классическом описании термодинамики , абсолютный ноль — это температура, при которой прекращается все тепловое движение.
Выбор абсолютного нуля в качестве нулевой точки шкалы Кельвина логичен. Различные типы материи кипят или замерзают при разных температурах, но при 0K (абсолютный ноль) все тепловые движения любого максимально подавляются.Шкала Кельвина широко используется в научной работе, поскольку ряд физических величин, таких как объем идеального газа , напрямую связаны с абсолютной температурой.
Шкала Кельвина названа в честь инженера и физика Университета Глазго Уильяма Томсона, 1-го барона Кельвина (1824–1907), который писал о необходимости «абсолютных термометрических шкал». «В отличие от градуса Фаренгейта и градуса Цельсия, кельвин не называется градусом и не набирается. Кельвин — основная единица измерения в физических науках, но ее часто используют вместе с градусом Цельсия, который имеет ту же величину.Кельвин определяется как часть 1 / 273,16 термодинамической температуры тройной точки воды (точно 0,01 ° C, или 32,018 ° F). Чтобы преобразовать кельвин в градусы Цельсия, мы используем следующую формулу:
T по Цельсию = T по Кельвину −273,15
Вычитание 273,16K из температуры тройной точки воды, 0,01 ° C, делает абсолютный ноль (0K) эквивалентным -273,15 ° C и -460 ° F.
Абсолютный ноль — это самая низкая из возможных температур.Формально это температура, при которой энтропия достигает минимального значения. Проще говоря, абсолютный ноль относится к состоянию, в котором извлекается вся энергия системы (по определению, самое низкое энергетическое состояние, которое может иметь система). Абсолютный ноль универсален в том смысле, что при этой температуре вся материя находится в основном состоянии. Следовательно, это естественный выбор в качестве нулевой точки для системы единиц измерения температуры.
Чтобы быть точным, система при абсолютном нуле все еще обладает квантово-механической нулевой энергией, энергией своего основного состояния.Принцип неопределенности гласит, что положение частицы не может быть определено с абсолютной точностью; следовательно, частица находится в движении, даже если она находится в абсолютном нуле, а основное состояние по-прежнему несет минимальное количество кинетической энергии. Однако в интерпретации классической термодинамики кинетическая энергия может быть равна нулю, а тепловая энергия вещества равна нулю.
Нулевая точка термодинамической шкалы температуры, такой как шкала Кельвина, устанавливается на абсолютный ноль. По международному соглашению абсолютный ноль определяется как 0K по шкале Кельвина и как -273.15 ° по шкале Цельсия (эквивалент -459,67 ° по шкале Фаренгейта). Ученые довели системы до температур, очень близких к абсолютному нулю, когда материя проявляет квантовые эффекты, такие как сверхпроводимость и сверхтекучесть.
Практические вопросы
Академия Хана
Официальная подготовка MCAT (AAMC)
Практический экзамен 3 Раздел C / P Отрывок 4 Вопрос 17
Ключевые точки
• 0K (абсолютный ноль) универсален, потому что все тепловые движения всего вещества максимально подавляются при этой температуре.Следовательно, абсолютный ноль — это естественный выбор в качестве нулевой точки шкалы Кельвина.
• Шкала Кельвина широко используется в научной работе, потому что ряд физических величин, таких как объем идеального газа, напрямую связаны с абсолютной температурой.
• Чтобы преобразовать градусы Кельвина в градусы Цельсия, мы используем следующую формулу: T Celsius = T Kelvin −273,15.
• Абсолютный ноль универсален в том смысле, что при этой температуре вся материя находится в основном состоянии.Следовательно, это естественный выбор в качестве нулевой точки для системы единиц измерения температуры.
• Система K при абсолютном нуле все еще обладает квантово-механической нулевой энергией, энергией своего основного состояния. Однако в интерпретации классической термодинамики кинетическая энергия может быть равна нулю, а тепловая энергия вещества равна нулю.
Ключевые термины
Абсолютный ноль : самая низкая из возможных температур: ноль по шкале Кельвина и приблизительно -273.15 ° C и -459,67 ° F. Полное отсутствие тепла; температура, при которой движение всех молекул прекратится.
Тройная точка : Уникальная температура и давление, при которых твердая, жидкая и газовая фазы вещества находятся в равновесии.
Идеальный газ : гипотетический газ, молекулы которого не взаимодействуют друг с другом и подвергаются упругому столкновению друг с другом и со стенками контейнера.
Энтропия : мера того, насколько равномерно энергия (или какое-либо аналогичное свойство) распределяется в системе.
Термодинамика : раздел естествознания, связанный с теплом и его отношением к энергии и работе
Как достигается и измеряется температура, близкая к абсолютному нулю?
Объясняет Вольфганг Кеттерле из Массачусетского технологического института, получивший Нобелевскую премию по физике за свою работу с ультрахолодными атомами.
Во-первых, позвольте мне представить научное значение температуры: это мера содержания энергии в материи.Когда воздух горячий, молекулы движутся быстро и обладают высокой кинетической энергией. Чем холоднее молекулы, тем меньше их скорости, а следовательно, и энергия. Температура — это просто способ охарактеризовать энергию системы.
Температура может быть измерена в разных единицах измерения. В повседневной жизни широко распространены шкалы Цельсия и Фаренгейта, но обе они лишены того естественного свойства, что ноль шкалы температур должен соответствовать нулевой скорости частиц газа (то есть нулевой энергии).Таким образом, естественная шкала температуры — это абсолютная температура, измеренная в Кельвинах. Нулевой кельвин — это минимально возможная температура. При абсолютном нуле все движение останавливается. Очевидно, что более низкая температура невозможна, потому что нет скорости меньше нуля и нет энергии меньше нуля. (В качестве дополнительного замечания, энергия в этом случае означает только энергию, которая может быть отнята у частиц, и не включает массу покоя или квантово-механическую энергию нулевой точки для удерживаемых частиц.) Абсолютный ноль соответствует –273 градусам Цельсия и –460 градусам Фаренгейта.
Охлаждение объекта требует извлечения из него энергии и ее размещения в другом месте. В бытовых холодильниках, например, теплообменник сзади нагревается, потому что энергия, извлеченная из предметов внутри, накапливается там. (Кроме того, при работе холодильника выделяется некоторое количество тепла.)
В 1980-х и 1990-х годах были разработаны новые методы охлаждения атомарных газов: лазерное охлаждение и испарительное охлаждение.Комбинируя эти методы, были достигнуты температуры ниже одного нанокельвина (одной миллиардной градуса Кельвина). Самая низкая зарегистрированная до сих пор температура, описанная в публикации нашей группы в выпуске Science от 12 сентября 2003 г., составляет 450 пикокельвинов, что в шесть раз превышает предыдущий рекорд. За эти разработки были присуждены две недавние Нобелевские премии (1997 и 2001 гг.).
При лазерном охлаждении атомы рассеивают лазерный свет. Входящий лазерный фотон поглощается, а затем переизлучается в другом направлении.В среднем цвет рассеянного фотона немного смещен в синий по сравнению с лазерным светом. То есть рассеянный фотон имеет немного более высокую энергию, чем поглощенный фотон. Поскольку полная энергия сохраняется, разница в энергии фотонов извлекается из движения атомов — атомы замедляются. Сдвиги в длине волны могут происходить из-за эффекта Доплера (который представляет собой сдвиг, пропорциональный скорости атома) или из-за сдвигов Штарка (из-за электрического поля лазерных лучей) и предлагает одно объяснение того, как атомы теряют энергию.
Второе описание подчеркивает, как импульс передается атомам. Если на атомы воздействуют несколько лазерных лучей с тщательно подобранными значениями поляризации и частоты, то они предпочтительно поглощают фотоны из передней полусферы, где угловой момент фотона и скорость атома находятся под углом больше 90 градусов. Импульс фотона имеет компонент, противоположный движению атома, и, как следствие, импульс поглощенного фотона замедляет атом.Последующее испускание фотона происходит под случайными углами, и в результате, усредненный по нескольким циклам поглощения-испускания, отсутствует переданный импульс из-за испускания фотона. Решающий шаг — заставить атомы поглощать фотоны преимущественно в прямом направлении, что достигается за счет использования доплеровского сдвига. Когда импульс фотона и скорость атома находятся под углом больше 90 градусов, атом и свет распространяются в противоположных направлениях, а доплеровский сдвиг — это сдвиг частоты вверх.Когда лазерный свет расстраивается на красный цвет атомного резонанса, доплеровский сдвиг приближает свет к резонансу и увеличивает поглощение света. Для света, идущего в обратном направлении, для которого угол между импульсом фотона и скоростью атома меньше 90 градусов, доплеровский сдвиг противоположен и смещает свет еще дальше от атомного резонанса, уменьшая его поглощение.
Когда атомное облако становится плотнее и холоднее, в описанном выше охлаждающем эффекте преобладают другие процессы, вызывающие нагрев.Это включает в себя выделение энергии при столкновениях между атомами и случайные выбросы отдачи при рассеянии света, которые в среднем равны нулю, но все же приводят к некоторому дрожащему движению атомов и, следовательно, ограничивают минимально достижимую температуру. Однако в этот момент атомы достаточно холодные, чтобы удерживать их в магнитных полях. Мы выбираем виды атомов, у которых есть неспаренный электрон и, следовательно, магнитный момент. В результате эти атомы ведут себя как маленькие стержневые магниты. Внешние магнитные поля действуют на них, левитируют против силы тяжести и удерживают их вместе; атомы заключены в магнитную клетку с невидимыми стенками, образованными магнитными полями.
Дальнейшее охлаждение осуществляется за счет испарительного охлаждения путем выборочного удаления наиболее энергичных атомов из системы. Тот же процесс охлаждает чашку кофе, когда наиболее энергичные молекулы улетучиваются в виде пара, тем самым снижая среднюю энергию и, следовательно, температуру остальных молекул. В магнитной ловушке наиболее энергичные атомы могут двигаться дальше против притяжения магнитных сил и, следовательно, могут достигать областей с более высокими магнитными полями, чем более холодные атомы. В этих сильных магнитных полях они входят в резонанс с радиоволнами или микроволнами, что изменяет магнитный момент таким образом, что атомы улетают и вырываются из ловушки.Красивую анимацию процедуры охлаждения можно найти на http://www.colorado.edu/physics/2000/bec/temperature.html
.Как мы измеряем очень низкие температуры атомов? Один из способов — просто посмотреть на расширение облака. Чем больше облако, тем более энергичными должны быть атомы, потому что они могут двигаться дальше против магнитных сил. Это похоже на атмосферу на Земле, толщина которой составляет около 10 километров. То есть 10 километров — это расстояние, на которое атомы при комнатной температуре могут двигаться против гравитационной силы нашей планеты.Если бы температура воздуха была в 10 раз меньше (примерно 30 K или –240 градусов C), толщина атмосферы была бы всего один километр. При 30 микрокельвинах атмосфера уменьшится до одного миллиметра, а при 30 нанокельвинах высота атмосферы будет один микрон, или в сто раз меньше толщины человеческого волоса. (Конечно, воздух не является идеальным газом и к тому времени должен был бы сжижиться.) В наших экспериментах на атомы действуют как магнитные, так и гравитационные силы.В центре облака гравитационная сила в точности компенсируется магнитной силой.
Размер атомного облака определяется путем освещения облака лазерным светом, который сильно поглощается атомами, и они отбрасывают тень. С помощью нескольких линз тень передается на электронный датчик, аналогичный датчикам цифровых фотоаппаратов. Поскольку магнитные поля точно известны, размер облака является абсолютной мерой энергии и температуры атомов.(С научной точки зрения, распределение плотности атомов отражает распределение потенциальной энергии.)
Другой метод определения температуры — измерение кинетической энергии атомов. Для этого магнитная ловушка внезапно выключается путем отключения тока, протекающего через катушки магнита.

 15
15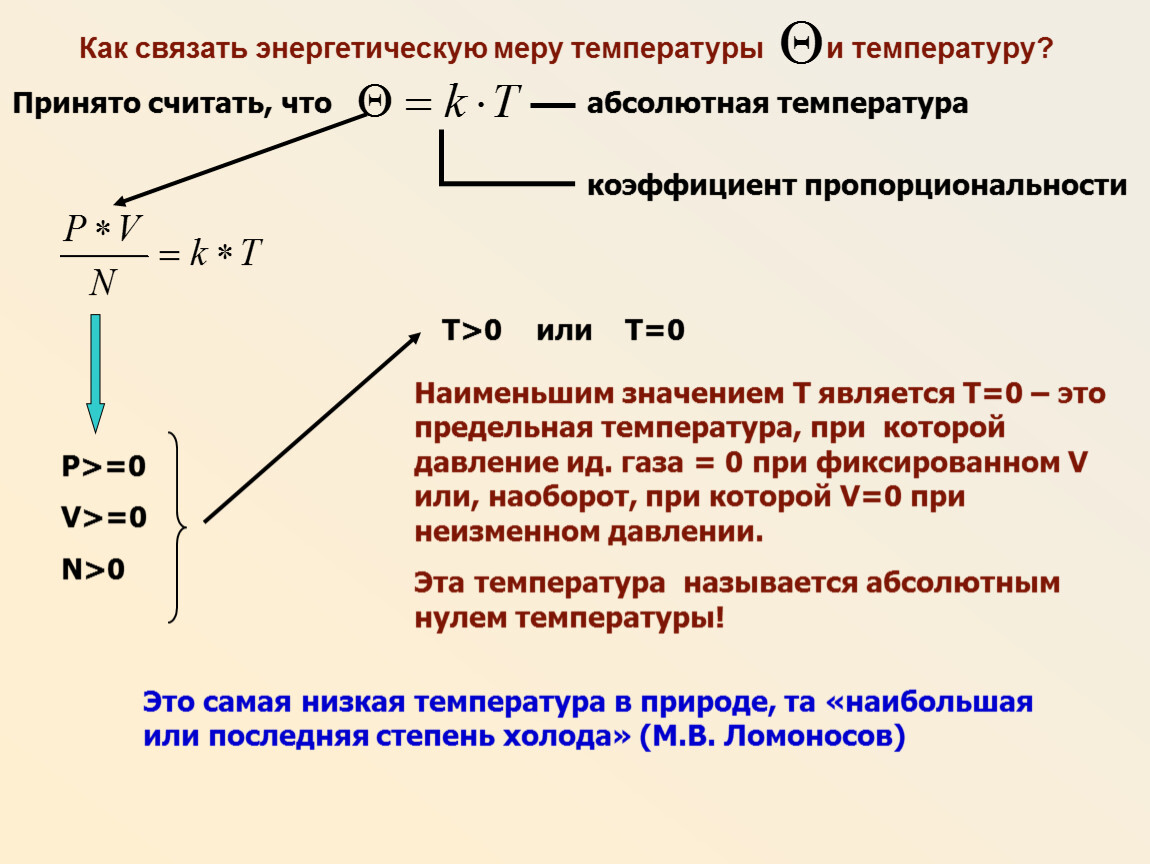 21
21 67
67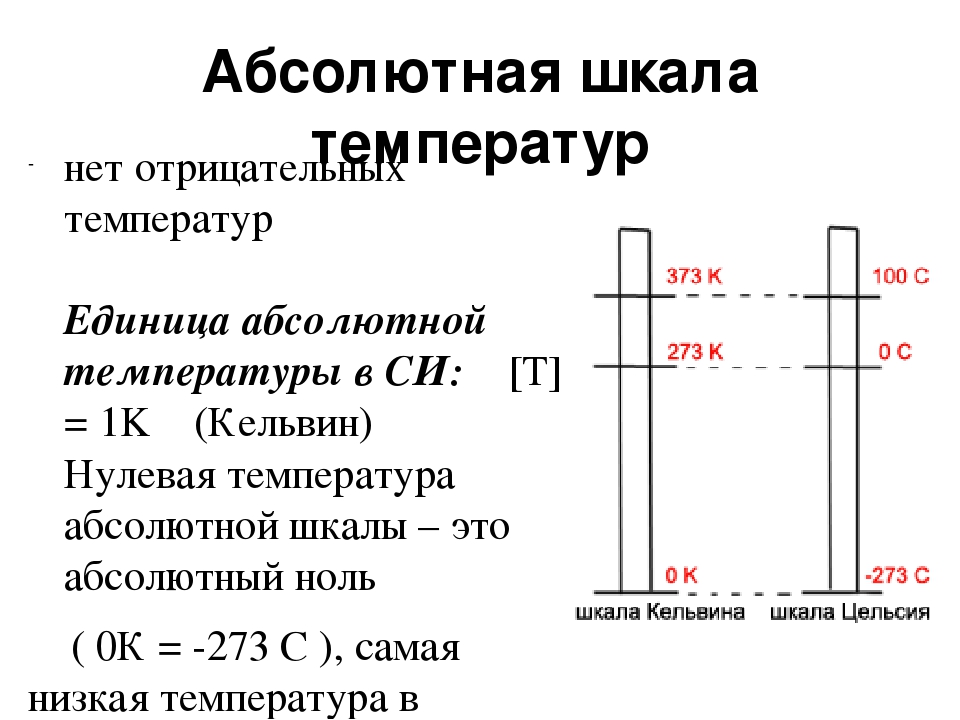 6
6 3
3