Технологический расчет участка по ремонту коробки передач
1. Курсовой проект на тему: Технологический расчет участка по ремонту коробки передач
Курсовой проект на тему:Выполнил:
Любезный А.С.
Группа ТОЗ-31
2. Введение
Даже при соблюдении всех мероприятий потехническому
обслуживанию
изнашивание
деталей автомобиля может приводить к
неисправностям
и
к
необходимости
восстановления его работоспособности или
ремонта.
Техническое состояние автомобиля и в
частности коробки передач оказывает заметное
влияние на расход топлива.
*
Цель данной курсовой работы являются организация
участка для ремонта коробки передач автомобилей ГАЗ-3309,
углубление, закрепление и систематизация знаний при
решении
вопросов
технологического
проектирования
производственных
подразделений
современных
эксплуатационных автотранспортных предприятий, освоение
методики технологических расчётов по техническому
обслуживанию
и
текущему
ремонту
автомобилей,
рассмотрение вопросов обеспечения требований по охране
участка.

* Основные задачи курсового проектирования состоят в
расчете объема работ и численности исполнителей,
разработке вопросов организации и технологии выполнения
работ, принятии планировочного решения, разработке
мероприятий
по
технике
безопасности,
разработке
последовательности
операций
по
техническому
обслуживанию и ремонту автомобилей.
4. Исходные данные
— тип подвижного состава: грузовой бортовой автомобильГАЗ-3309 грузоподъемностью 4,5т;
— списочное число автомобилей:;
— годовой пробег автомобиля 49400 км;
— КЭУ – категория условий эксплуатации: III;
— природно-климатические условия эксплуатации:
холодный климат;
– число дней работы подвижного состава в году на линии:
247;
– число смен работы автомобилей на линии: 1.
– продолжительность работы автомобиля на линии: 12.
5. Расчетная часть
Таблица 1Расчет количества воздействий и дней простоя за цикл при ТО, ТР, КР
Таблица 2
Определение пробега
6.
 Расчетная часть Таблица 3
Расчетная часть Таблица 3Расчет годовой и суточной производственной программы
Таблица 4
Скорректированная и годовая трудоемкость ТО и ТР
7. Расчетная часть
Таблица 5. Количества рабочих дней, необходимых для проведениякаждой вспомогательной работы
8. Расчетная часть
Таблица 6Распределение трудоемкости по видам работ (по ОНТП-01-86)
10. Расчетная часть
11. Расчетная часть
12. Расчетная часть
13. Расчетная часть
Началоэксплуатации
КР
ТО- 1
ТО- 1
ТО- 1
ТО- 1
ТО- 1
ТО- 1
ТО- 1
ТО- 1
ТО- 1
ТО- 1
ТО- 1
ТО- 1
ТО- 2
ТО- 2
ТО- 2
ТО- 2
ТО- 1
ТО- 1
ТО- 1
ТО- 1
ТО- 1
ТО- 1
ТО- 1
ТО- 1
ТО- 1
ТО- 1
ТО- 1
ТО- 1
ТО- 2
ТО- 2
ТО- 2
ТО- 1
ТО- 1
ТО- 1
ТО- 1
ТО- 1
ТО- 1
ТО- 1
ТО- 1
ТО- 1
ТО- 1
ТО- 1
ТО- 1
Рисунок 1 – Годовой график ТО автомобиля
ТО- 2
КР
ТО- 2
КР
14.
 Расчетная часть
Расчетная часть15. Расчетная часть
16. Таблица 14. Технологическое и организационное оборудование для объекта проектирования
17. Организационная часть
Рисунок 1 – Схема структуры управления технической службой АТП18. Организационная часть
Рисунок 2 – Технологический процесс работы агрегатного отделения19. Графическая часть
20. Заключение
В результате выполнения курсового проекта втехнологической части определена производственная
программа ТО и ТР в целом по АТП в количественном и
трудовом выражениях и по объекту проектирования.
В организационной части проекта решены вопросы
организации управления по АТП и объекту
проектирования, разработки схемы управления
производств отделов и комплексов и схемы
технологического процесса работ на объекте
проектирования, подобрано необходимое технологическое
оборудование, определена площадь объекта
проектирования. Решены вопросы и даны рекомендации
по технике безопасности, производственной санитарии.

В графической части проекта представлен план участка по
ремонту коробки передач.
Ремонт КПП грузовиков, ремонт двигателей тягачей и грузовых автом
Правильная работа двигателя, безусловно, увеличивает срок эксплуатации запчастей всей ходовой части автомобиля. Поэтому, при появлении первого же признака его некорректной работы – обращайтесь к нам. Опытные механики помогут вам решить все вопросы, связанные с ремонтом двигателя, и произведут быстрый и качественный его ремонт. Накопленный с годами опыт и профессионализм персонала тех центра, позволяет нам браться за ремонт любой сложности. Высокая инструментально-техническая база позволяет делать это не только быстро, но и по-настоящему качественно.Также наши специалисты используя современное высокотехнологичное оборудование произведут ремонт коробки переключения передач (КПП) любого грузового автомобиля.
Виды работ
- Капитальный ремонт двс Cummins, Detroit Diesel, CAT
- Ремонт головок блока — замена седел и направляющих клапанов, самих клапанов, опрессовка, замена стаканов форсунок
- Капитальный ремонт КПП
- Капитальный ремонт редукторов
Агрегатный участок по ремонту трансмиссий и двигателей
Агрегатный участок оснащен кран-балкой, стендами для разборки-сборки коробки переключения передач (КПП) , редукторов , двс и всем необходимым диагностическим и специнструментом.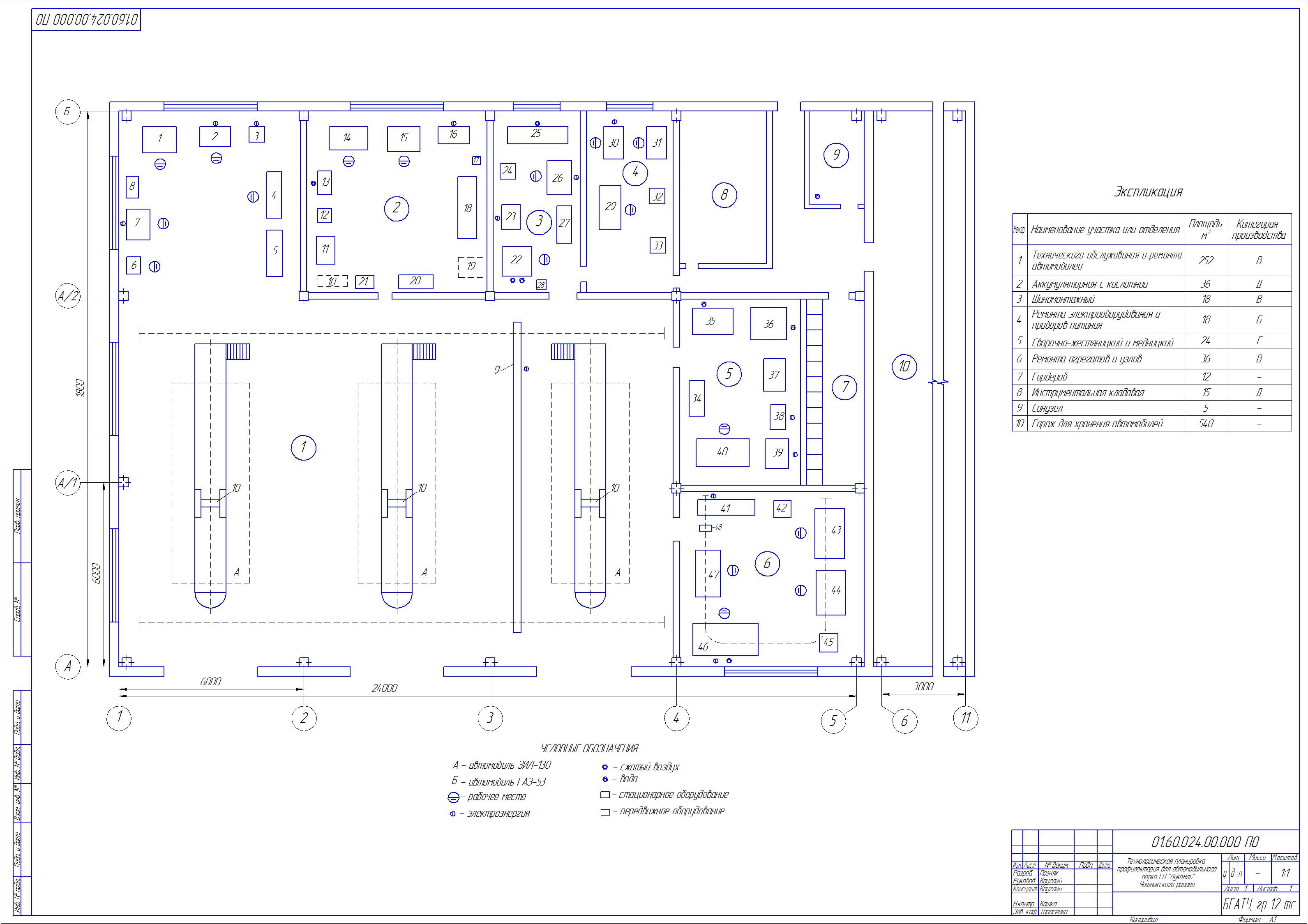 Работники агрегатного участка являются высококвалифицированными специалистами, прошедшими обучение в представительствах компаний «Eaton», «Meritor» и «Allison», Cummins и Detroit Diesel . Поэтому мы в состоянии провести в кратчайшие сроки надежный и качественный ремонт трансмиссий и двс любой сложности и для любой марки американского грузовика, включая Kenworth, Volvo, Freightliner, International, Peterbilt, Mack и прочих.
Работники агрегатного участка являются высококвалифицированными специалистами, прошедшими обучение в представительствах компаний «Eaton», «Meritor» и «Allison», Cummins и Detroit Diesel . Поэтому мы в состоянии провести в кратчайшие сроки надежный и качественный ремонт трансмиссий и двс любой сложности и для любой марки американского грузовика, включая Kenworth, Volvo, Freightliner, International, Peterbilt, Mack и прочих.Ремонт двигателей и КПП грузовиков
Разработка технологического процесса ремонта коробки передач автомобиля ЗИЛ-5301в условиях ООО «Ямашское УТТ»
Министерство образования и науки РТ
ГАПОУ «Альметьевский политехнический техникум»
Специальность — 23.02.03
«Техническое обслуживание и
ремонт автомобильного транспорта
курсовой проект разработан на тему:
Разработка технологического процесса ремонта коробки передач автомобиля ЗИЛ-5301 в условиях ООО «Ямашское УТТ»
Содержание
Введение………………………………………………………………………. ..
..
1 Технологический раздел………………………………………………………
1.1 Техническая характеристика автомобиля…………………………………….
1.2 Назначение и условия работы заданного узла………………………………..
1.3 Описание конструкции, назначение и условия работы ремонтируемой детали……………………………………………………………………………
1.4 Неисправности, возникающие при эксплуатации заданного узла, причины и методы их устранения………………………………………………………..
1.6 Инструмент и приспособления, применяемые при ремонте заданного узла
1.7 Технологический процесс ремонта заданной детали…………………………
1.8 Технологический процесс разборки и сборки заданного узла (механизма)..
1.9 Определение нормы времени на разборку и сборку заданного узла (механизма)………………………………………………………………………
1.10 Расчёт годовой трудоёмкости………………………………………………….
1.11 Расчёт числа рабочих…………………………………………………………..
1.12 Подбор технологического оборудования участка……………………………
1.13 Расчет площади участка……………………………………………………….
 .
.1.14 Мероприятия по охране труда и окружающей среды………………………..
Заключение…………………………………………………………………….
Литература……………………………………………………………………..
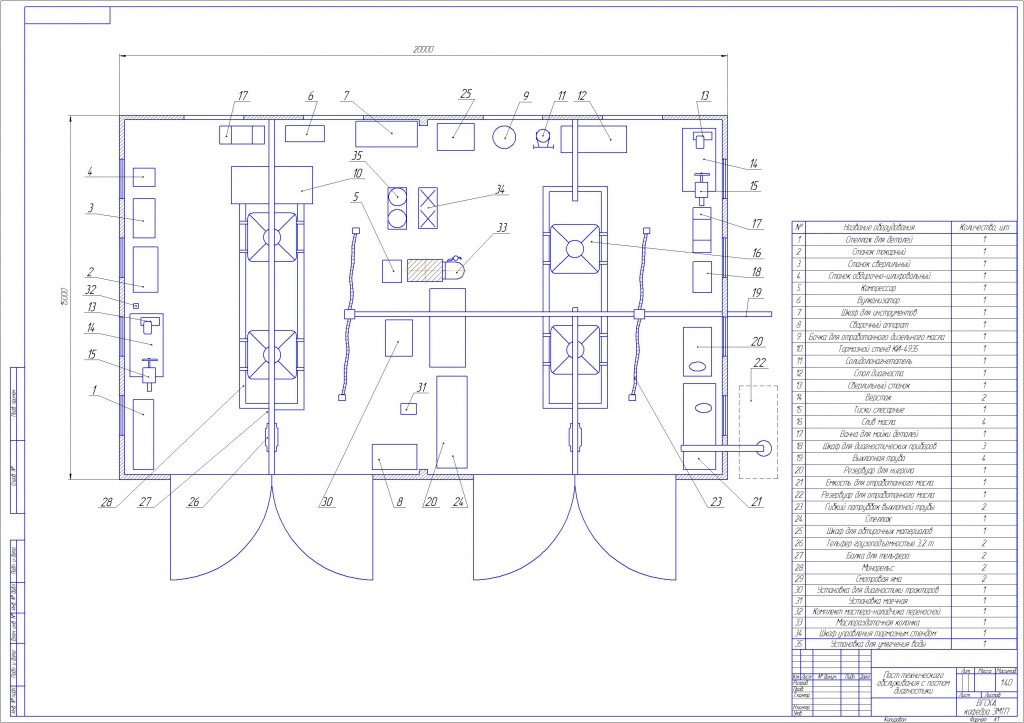
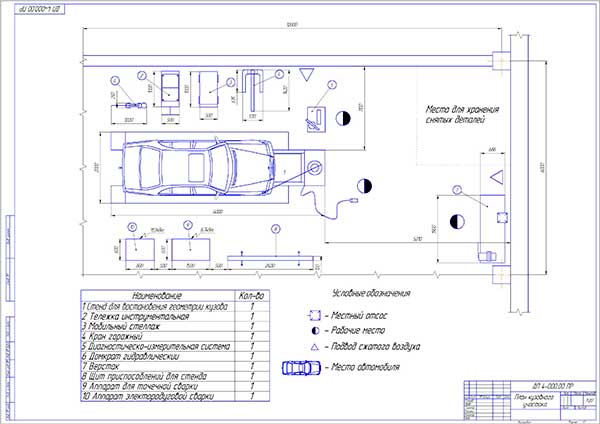
Состав: План участка.Карта дефектации первичного вала КПП зил-5301
Софт: КОМПАС-3D 16
Участок ремонта автотракторных КПП со стендом для разборки ведущего вала КПП тракторов Кировец
Содержание
Введение
1 Система бизнес-планирования на предприятии
1.1 Структура направления деятельности предприятия
1.2 Оценка проблемных ситуаций при организации ремонта КПП
1.3 Основные технико-экономические показатели предприятия
1.4 Сущность и задачи проекта
2 Технология процесса ремонта автотракторных кпп
2.1 Сущность технологического процесса ремонта КПП
2. 2 Структура дефектов КПП и методика их устранения
2 Структура дефектов КПП и методика их устранения
2.3 Подбор технологического оборудования с оценкой необходимых производственных площадей
2.5 Определение фондов времени и режима работы участка
3 Разработка технологии восстановления нажимного диска
3.1 Конструктивные элементы детали
3.2 Классификация способов восстановления детали
3.3 Составление маршрутизации процесса
3.4 Определение и расчет режима технологического процесса
3.5 Составление карты эскизов детали по операциям
4 Проектирование стенда для разборки и сборки ведущего вала
4.1 Оценка необходимости в разработке данной конструкции
4.2 Описание и задачи конструкции
4.3 Расчеты конструктивных элементов приспособления
4.3.1 Подбор гидроцилиндра
4.3.2 Подбор привода и марки насоса
4.3.3 Определение детали рычага
4.3.4 Расчет и выбор крепления опоры ведущего вала
5 Требования по безопасности и экологичности проекта
5.
 1 Оценка условий труда на производстве
1 Оценка условий труда на производстве5.2 Мероприятия по обеспечению безопасности труда при использовании разборочно-сборочного стенда
5.3 Условия по обеспечению охраны окружающей среды
5.4 Защита населения и материальных ценностей в чрезвычайных ситуациях
6 Техническая и экономическая оценка работы
6.1 Эффективность технологического процесса по восстановления нажимного диска
6.2 Определение себестоимости по изготовлению конструкции стенда
6.3 Технико-экономические показатели производственного участка
Заключение
Библиографический список
Состав чертежей
- Чертеж детали вал А3
- Втулка направляющая деталь А3
- Чертеж сборочный приспособления для разборки ведущего вала А1
- Рычаг А4
- Диск нажимной в сборе А2
- Палец чертеж детали А4
- Опора А3
- Чертеж сборочный приспособления для разборки ведущего вала А1
- Чертеж общего вида стенда для разборки ведущего вала А1
- Технико-экономические показатели А1
- Планировка участка ремонта КПП А1
- Операционная карта наплавки А2
- Маршрутная карта восстановления нажимного диска А1
- Схема бизнес-планирования организации А1
- Плакат технологического процесса ремонта КПП 2хА2
- Карта эскизов А2
Описание
В работе отражена структура техники используемой в сельском хозяйстве. Прописана методика технологического процесса ремонтных работ проводимых на предприятии. Описаны существенные условия проведения технологического процесса ремонта КПП. Предложены варианты по оптимизации технологического процесса на предприятии. Проведена пооперационная методика этапов процесса ремонта машин. Представлена технология процесса сборки КПП тракторов с подробным описанием технологического процесса. Графически изображена схема стенда для обкатки коробки передач, а также приведена схема ремонта КПП. Представлена структура дефектов КПП и методика их устранения. Выполнен подбор технологического оборудования с оценкой необходимых производственных площадей. Сделаны расчеты площадей производственных участков с описанием оборудования на участке ремонта КПП. Дана технологическая схема производственного участка. Определены фонд времени и режим работы участка.
Прописана методика технологического процесса ремонтных работ проводимых на предприятии. Описаны существенные условия проведения технологического процесса ремонта КПП. Предложены варианты по оптимизации технологического процесса на предприятии. Проведена пооперационная методика этапов процесса ремонта машин. Представлена технология процесса сборки КПП тракторов с подробным описанием технологического процесса. Графически изображена схема стенда для обкатки коробки передач, а также приведена схема ремонта КПП. Представлена структура дефектов КПП и методика их устранения. Выполнен подбор технологического оборудования с оценкой необходимых производственных площадей. Сделаны расчеты площадей производственных участков с описанием оборудования на участке ремонта КПП. Дана технологическая схема производственного участка. Определены фонд времени и режим работы участка.
Разработаны мероприятия по организации на предприятии ремонтных работ автотракторных КПП. Выполнено бизнес планирование разрабатываемого проекта с осуществлением расчетов по капиталовложениям и сроков окупаемости. Определен общий объем работы для безубыточности производственного процесса на предприятии.
Определен общий объем работы для безубыточности производственного процесса на предприятии.
Разработана технология по восстановлению нажимного диска КПП, что является положительным моментом в снижении себестоимости ремонтных работ. Описаны конструктивные элементы детали с уточнением материала детали и возможных дефектов. Дана классификация способов восстановления детали с описанием карты дефектации нажимного диска. На основе анализа дефектов детали и выбранного способа восстановления составлена маршрутизация процесса.
В графической части работы представлены маршрутная карта, а также ремонтный чертеж детали. Определен режим технологического процесса с расчетом нормы времени на выполнение работ. Составлена пооперационная карта эскизов детали. Выполнено проектирование стенда для разборки и сборки ведущего вала с оценкой необходимости данной конструкции. Приведено описание конструкции и задачи решаемые при разработки данного конструктивного решения. Представлены технологические и конструктивные решения элементов приспособления обоснованные проведенными инженерными расчетами: в том числе подбор гидроцилиндра, привода и марки насоса, напряжение среза и смятие, крепление опоры.
В ВКР предложены мероприятия по обеспечению безопасных условий труда и экологичности производства, для улучшения работы производственных рабочих. Дана оценка условий труда на предприятии. Представлены показатели производственного травматизма работников с анализом данных динамического ряда трех лет. Описаны основные требования по технике безопасности к участку по ремонту коробок передач, а также условия для обеспечения безопасности труда при использовании разборочно-сборочного стенда. Представлены мероприятия по защите работников и материальных ценностей в чрезвычайных ситуациях.
Выполнены все необходимые технико-экономические расчеты. В заключении дана оценка по целесообразности применения данной конструкторской разработке.
Презентация на тему: Типовой проект организации труда на участке ремонта агрегатов (для автобусных
1
Первый слайд презентации: Типовой проект организации труда на участке ремонта агрегатов (для автобусных автотранспортных предприятий)
Изображение слайда
2
Слайд 2: 1.
 ОБЩАЯ ЧАСТЬ
ОБЩАЯ ЧАСТЬ
1.1. Условия применения типового проекта Настоящий типовой проект предназначен для агрегатных участков, характеризующихся следующими данными:
Изображение слайда
3
Слайд 3
— вид выполняемых работ:
— ремонт агрегатов и узлов автобусов;
— годовой объем выполняемых работ
— ремонт агрегатов и узлов, снятых с автобусов — 19196 чел-час;
— производственная площадь
— 162 м2;
— сменность работы
— одна смена;
— тип производства
— мелкосерийное;
— вид технологического процесса
— типовой;
— характер технологического процесса
— маршрутно-операционный;
— вид системы управления
— неавтоматизированный, при наличии централизованной системы управления производством.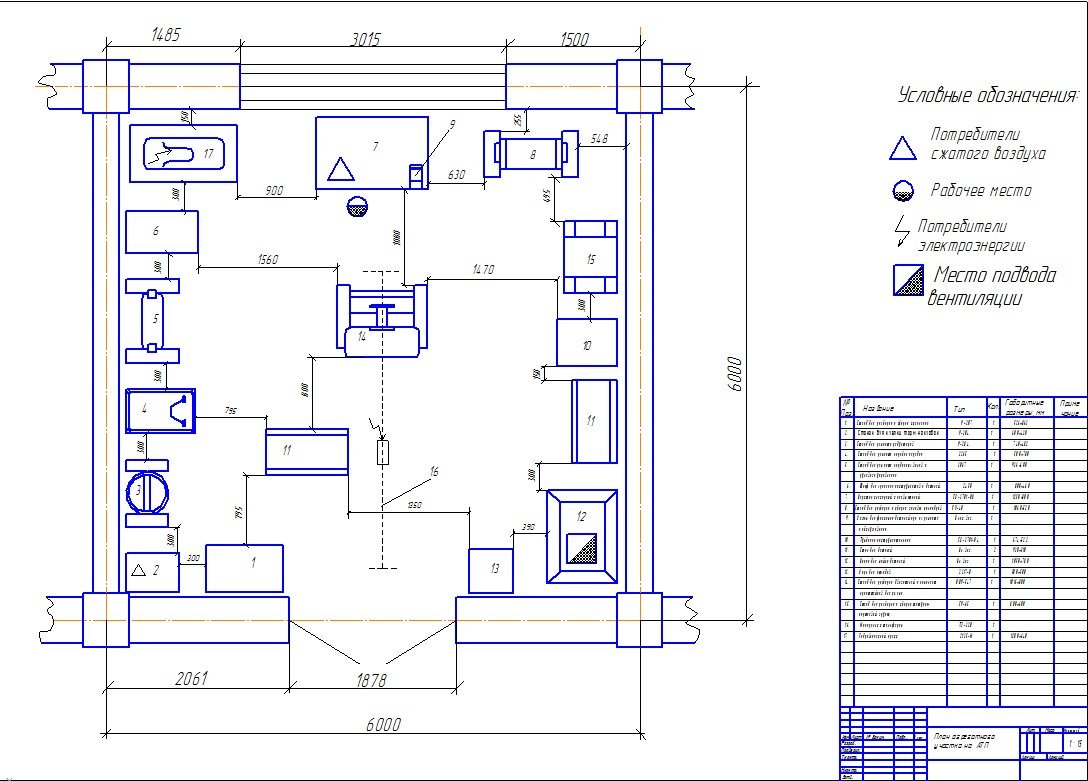
Изображение слайда
4
Слайд 4: 1.2. Основные проектные данные и технико-экономические показатели агрегатного участка
Агрегатный участок, организованный в соответствии с настоящим проектом, характеризуется следующими данными:
Изображение слайда
5
Слайд 5
— номенклатура выполняемых работ:
Разборка, ремонт, сборка и испытание коробок перемены передач, передних и задних мостов, карданных валов, рулевых механизмов, компрессоров, тормозных кранов и камер, сцепления, переклепка фрикционных накладок ведомого диска сцепления и тормозных колодок, водяного насоса и др.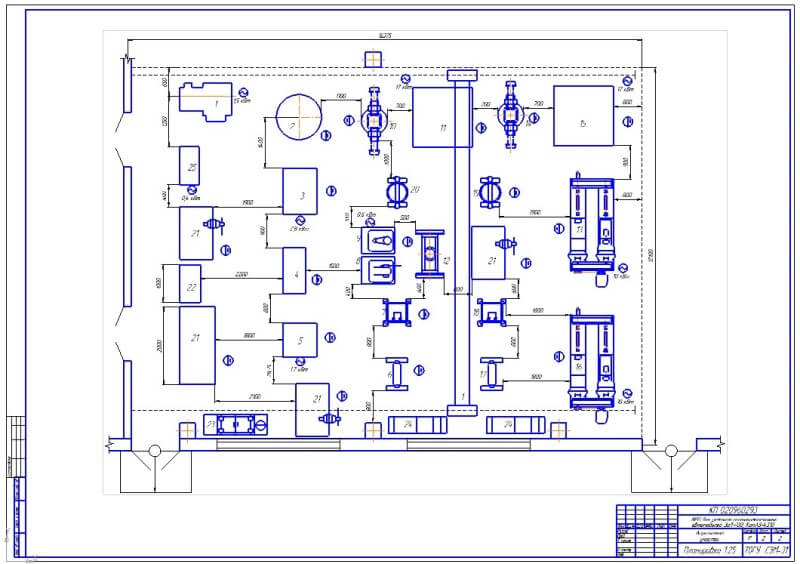 — численность основных рабочих
9 человек
— уровень механизации труда:
65%
— коэффициент сменности работы оборудования
87%
— средний коэффициент загрузки оборудования
80%
Условия труда на агрегатном участке соответствуют санитарным нормам, психофизиологическим и эстетическим требованиям, условиям противопожарной защиты и техники безопасности труда.
— численность основных рабочих
9 человек
— уровень механизации труда:
65%
— коэффициент сменности работы оборудования
87%
— средний коэффициент загрузки оборудования
80%
Условия труда на агрегатном участке соответствуют санитарным нормам, психофизиологическим и эстетическим требованиям, условиям противопожарной защиты и техники безопасности труда.
Изображение слайда
6
Слайд 6: 2. РАЗДЕЛЕНИЕ И КООПЕРАЦИЯ ТРУДА
Агрегатный участок организован по технологическому принципу. Производственная структура участка приведена на схеме 18.
Изображение слайда
7
Слайд 7
Схема 18.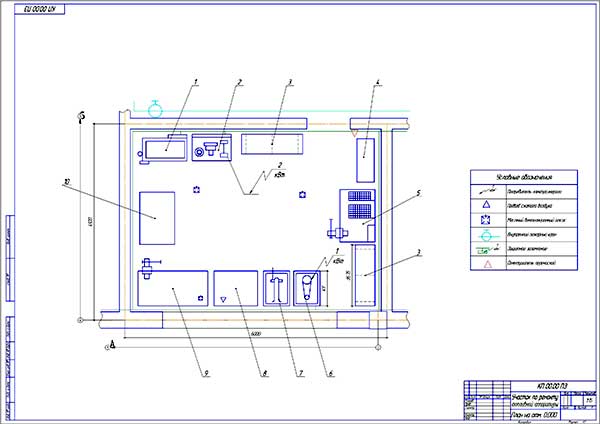 Производственная структура агрегатного участка
Производственная структура агрегатного участка
Изображение слайда
8
Слайд 8
Профессионально-квалификационный состав рабочих, их численность по формам организации труда, количество бригад по видам, карта бригадной формы организации труда и расстановка рабочих по рабочим местам приведены в табл. 56, 57, 58, 59, 60.
Изображение слайда
9
Слайд 9
Профессия
Число рабочих
В т. ч. по разрядам
I
II
III
IV
V
Слесарь по ремонту автомобилей
9
3
3
3
Таблица 56
Профессионально-квалификационный состав рабочих
Форма организации труда на участке
Численность рабочих, охваченных бригадной формой организации труда, чел.
Процент охвата от общей численности рабочих, %
Бригадная
9
100
Таблица 57
Численность рабочих по формам организации труда
Наименование объекта с бригадной формой организации труда
Вид бригады
Количество бригад
В смену
Всего
Участок по ремонту агрегатов
Специализированная
1
1
Таблица 58
Количество бригад по видам
ч. по разрядам
I
II
III
IV
V
Слесарь по ремонту автомобилей
9
3
3
3
Таблица 56
Профессионально-квалификационный состав рабочих
Форма организации труда на участке
Численность рабочих, охваченных бригадной формой организации труда, чел.
Процент охвата от общей численности рабочих, %
Бригадная
9
100
Таблица 57
Численность рабочих по формам организации труда
Наименование объекта с бригадной формой организации труда
Вид бригады
Количество бригад
В смену
Всего
Участок по ремонту агрегатов
Специализированная
1
1
Таблица 58
Количество бригад по видам
Изображение слайда
10
Слайд 10
Наименование бригады
Вид бригады
Состав работ, выполняемых бригадой
Исполнители
Выполняемые и совмещаемые функции
Форма руководства бригадой
Профессия
Раз-
ряд
Числен-
ность, чел
Бригада слесарей по ремонту автомобилей
Специализи —
рованная
Разборка, ремонт, сборка и испытание коробок перемены передач, передних и задних мостов,
Слесарь по ремонту автомобилей
4
3
—
Неосвобож —
денный бригадир
карданных валов, рулевых механизмов, компрессоров, тормозных кранов и камер, сцепления,
Слесарь по ремонту автомобилей
3
3
—
переклепка фрикционных накладок ведомого диска сцепления и тормозных колодок, водяного насоса и др. Слесарь по ремонту автомобилей
2
3
—
Таблица 59
Карта бригадной формы организации труда
Слесарь по ремонту автомобилей
2
3
—
Таблица 59
Карта бригадной формы организации труда
Изображение слайда
11
Слайд 11
№ п/п Рабочие места Рабочие Форма организации труда Смен- ность Наименование Кол- во № на плани — ровке Профессия Раз- ряд Численность на рабочем месте 1 Расточка тормозных барабанов и колодок 1 I Слесарь по ремонту автомобилей 3 1 Бригадная 1 2 Разборка и сборка редукторов заднего моста 1 II Слесарь по ремонту автомобилей 4 1 Бригадная 1 3 Разборка, сборка и регулировка сцеплений 1 III Слесарь по ремонту автомобилей 3 1 Бригадная 1 4 Регулировка и испытание редукторов заднего моста 1 IV Слесарь по ремонту автомобилей 4 1 Бригадная 1 Таблица 60 Карта расстановки рабочих по рабочим местам
Изображение слайда
12
Слайд 12
4 Регулировка и испытание редукторов заднего моста 1 IV Слесарь по ремонту автомобилей 4 1 Бригадная 1 5 Срезание и клепка фрикционных накладок на тормозные колодки и ведомые диски 1 V Слесарь по ремонту автомобилей 2 1 Бригадная 1 6 Ремонт карданных валов и рулевых механизмов 1 VI Слесарь по ремонту автомобилей 3 1 Бригадная 1 7 Ремонт передних и задних мостов 1 VII Слесарь по ремонту автомобилей 4 1 Бригадная 1 8 Ремонт компрессоров, тормозных кранов и камер, водяных насосов 1 VIII Слесарь по ремонту автомобилей 3 1 Бригадная 1 9 Ремонт коробки передач 1 IX Слесарь по ремонту автомобилей 3 1 Бригадная 1
Изображение слайда
13
Слайд 13: 3.
 РАБОЧИЕ МЕСТА
РАБОЧИЕ МЕСТА
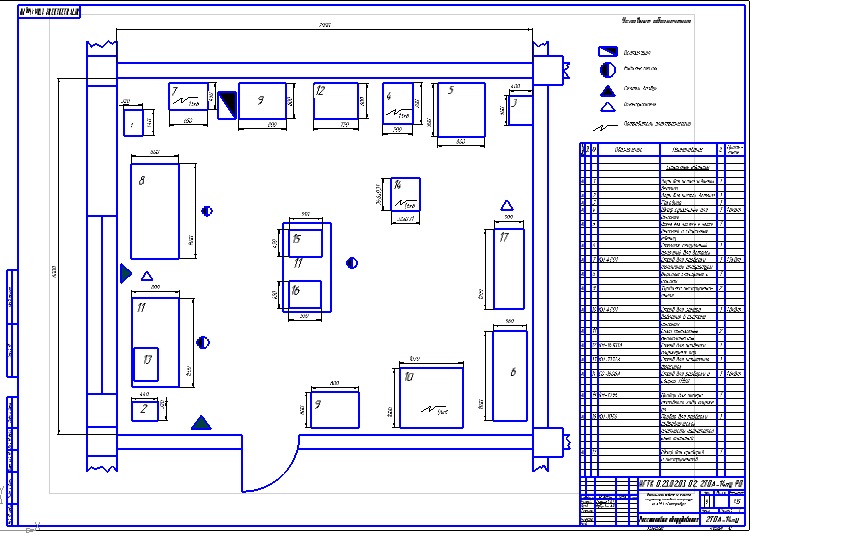
На агрегатном участке проектом предусмотрено 9 рабочих мест. Планировка участка, а также расстановка технологического оборудования и оргоснастки приведена на рис. 9.
Изображение слайда
14
Слайд 14
Рисунок 9.
Планировка участка по ремонту агрегатов
1 — стеллаж для деталей; 2 — ларь для обтирочных материалов; 3 — станок для расточки тормозных барабанов; 4 — телефон и радио; 5 — раднально -сверлильный настольный станок; 6 — слесарный верстак; 7 — настенный шкаф для приборов и инструментов; 8 — стенд для разборки и регулировки сцеплений; 9 — гидравлический пресс; 10 — стенд для ремонта редукторов задних мостов; 11 — стен для клепки тормозных накладок; 12 — подвесная кран-балка; 13 — тиски; 14 — стеллаж для инструментов; 15 — настольно-гидравлический. пресс; 16 — стенд для ремонта коробок передач; 17 — стенд для ремонта передних и задних мостов; 18 -ларь для отходов; 19 -раковина; 20 -рукосушитель; 21 — вертикально-сверлильный станок; 22 — заточный станок; 23 — установка моечная; 24 — стенд для ремонта карданных валов и рулевых механизмов
пресс; 16 — стенд для ремонта коробок передач; 17 — стенд для ремонта передних и задних мостов; 18 -ларь для отходов; 19 -раковина; 20 -рукосушитель; 21 — вертикально-сверлильный станок; 22 — заточный станок; 23 — установка моечная; 24 — стенд для ремонта карданных валов и рулевых механизмов
Изображение слайда
15
Слайд 15
Примерный перечень основного оборудования, организационной и технологической оснастки на участке приведен в табл. 61. Таблица 61 Примерный перечень основного оборудования, организационной и технологической оснастки п/п Наименование оборудования Коли- чество Тип, модель Изготовитель 1 Вертикально-сверлильный станок 1 2А-125 Покупной 2 Комплект двусторонних гаечных ключей с открытым зевом 1 И-153 Казанский завод «Автоспецоборудование» 3 Комплект универсальных съемников 1 ОАО «ГАРО» 4 Ларь для обтирочных материалов 2 Собственного изготовления 5 Ларь для отходов 2 Собственного изготовления 6 Пневматический гайковерт с набором головок 5 VALEX ОАО «ГАРО» 7 Подвесная кран-балка 1 Покупная 8 Пресс для клепки фрикционных накладок тормозных колодок и дисков сцепления 1 Р-335 Чистопольский завод «Автоспецоборудование» 9 Пресс настольный, ручной 1 ПР Казанский завод «Автоспецоборудование» 10 Пресс электрогидравлический 1 Р-342М Казанский завод «Автоспецоборудование» 11 Слесарный верстак 1 Шп-17 ОАО «ГАРО»
Изображение слайда
16
Слайд 16
12 Станок точильно-шлифовальный 1 ОШ-1 ОАО «ГАРО» 13 Стенд для обкатки и испытания двигателей 1 С-276 ОАО «ГАРО» 14 Стенд для разборки и сборки двигателей 1 Р-642М Свирский завод «Автоспецоборудование» 15 Стенд для разборки и сборки КПП 1 Р-201 Гремячинский завод «Автоспецоборудование» 16 Стенд для разборки и сборки редукторов ведущих мостов 1 Р-620 Гремячинский завод «Автоспецоборудование» 17 Стенд для разборки, сборки и регулировки сцеплений автомобильных двигателей 1 Р-207 Кочубеевский завод «Автоспецоборудование» 18 Стол конторский 1 Покупной 19 Стул 1 Покупной 20 Установка для расточки тормозных барабанов и обточки накладок тормозных колодок 1 Р-185 Чистопольский завод «Автоспецоборудование» 21 Установка моечная для деталей 1 196М ОАО «ГАРО» Установка сверлильная 1 Р-175 ОАО «ГАРО» Таблица 61
Изображение слайда
17
Слайд 17: 4.
 СТРУКТУРА УПРАВЛЕНИЯ УЧАСТКОМ Организационная структура управления участком приведена на схеме 19
СТРУКТУРА УПРАВЛЕНИЯ УЧАСТКОМ Организационная структура управления участком приведена на схеме 19
Изображение слайда
18
Последний слайд презентации: Типовой проект организации труда на участке ремонта агрегатов (для автобусных
Схема 19. Организационная структура управления агрегатным участком
Изображение слайда
Техника безопасности на агрегатном участке.
 Устройство, техническое обслуживание и ремонт системы охлаждения двигателя (5S-FE) автомобиля Toyota Camri XV-30
Устройство, техническое обслуживание и ремонт системы охлаждения двигателя (5S-FE) автомобиля Toyota Camri XV-30Похожие главы из других работ:
Организация работы на автотранспортном предприятии
3.7 Техника безопасности, охрана труда и противопожарная техника в зонах ТО и ТР
Ежедневно в начале работы мастер с инспектором по охране труда обходит все рабочие места. Они следят за чистотой рабочих мест, за использованием рабочими защитных средств, спец. одежды, за исправностью стендов и ограждений…
Планирование технического обслуживания и ремонта машин с разработкой производственного участка мастерской и технологической карты восстановления детали
3.5 Охрана труда и техника безопасности на участке. Инструкция по ТБ
Температура в помещениях гальванических цехов должна быть в пределах 18-22 0С. Сливные воды гальванических цехов должны отводиться в специальный коллектор и после их обезвреживания сливаться в канализацию или другие приемники. ..
Поезд Тальго модели PTI-200
4.Техника безопасности
a. Общие требования безопасности 1.1К работе по техническому обслуживанию ходовой части пассажирских вагонов допускаются лица не моложе 18 лет…
Проблемы управления техническим состоянием автомобиля
3.4 Техника безопасности
Перед началом работы слесарь обязан привести в порядок спецодежду, очистить рабочее место от лишних деталей и инструментов, проверить готовность и исправность оборудования и вспомогательных приспособлений…
Проект отделения ремонтно-машинного завода по испытанию двигателей после ремонта
1.10 Техника безопасности
Испытательный участок должен иметь прочные несгораемые стены. Потолки и стены следует закрашивать известковой краской . Пол помещения должен быть выложен керамическими плитками и иметь уклон для стока жидкости к отводным каналам…
Проект реконструкции моторного участка с разработкой технологического процесса на восстановление коленчатого вала автомобиля ГАЗ-53А
1.
 2.7. Техника безопасности и противопожарные мероприятия на участке.
2.7. Техника безопасности и противопожарные мероприятия на участке.При работе гаечными ключами необходимо подбирать их соответственно размерам гаек, правильно накладывать ключ на гайку…
Проект реконструкции слесарно-механического участка с разработкой технологического процесса на восстановление поворотной цапфы
1.2.7 Техника безопасности и противопожарные мероприятия на участке
Производительность труда при выполнении слесарно-механических работ во многом зависит от организации рабочего места и условий труда рабочих. Рабочие места станочника и слесаря должны быть организованны таким образом…
Проектирование кузнечного участка на авторемонтном предприятии
3.1 ТЕХНИКА БЕЗОПАСНОСТИ
Основные требования техники безопасности: Участок восстановления должен иметь прочные несгораемые стены. Полы на участке должны иметь ровную (без порогов) гладкую, но не скользкую удароустойчивость, не впитывающую нефтепродукты поверхность. ..
..
Разработка технологического процесса ремонта КПП Hyundai Solaris
1.9 Расчет количества рабочих в агрегатном участке
Число рабочих мест = 4 где Рт — число рабочих мест, ед.; Тi — объем работ на заданном для проектирования подразделении автотранспортного предприятия (зона, участок, отделение или цех), чел.-ч; Фт- фонд рабочего времени рабочего места, чел.-ч…
Разработка технологического процесса ремонта КПП Hyundai Solaris
2.3 Мероприятия по охране труда в агрегатном участке
Инструкция по технике безопасности автослесаря: К самостоятельной работе по ремонту и техническому обслуживанию автомобилей допускаются лица, имеющие соответствующую квалификацию…
Расчет моторного участка
1.2.1 Техника безопасности и противопожарные мероприятия на участке.
При работе гаечными ключами необходимо подбирать их соответственно размерам гаек, правильно накладывать ключ на гайку…
Расчет трудоемкости выполнения работ на агрегатном участке
1.
 1 Расчет трудоемкости выполнения работ на агрегатном участке
1 Расчет трудоемкости выполнения работ на агрегатном участке…
Техническое обслуживание и ремонт коробки передач автомобиля ЗИЛ-130
3.2 Техника безопасности
Общие положения В соответствии со СНиП Ш-4-80 (2000), ГОСТ 12.0.004-90 и ГОСТ 12.1.004-91 должна обеспечиваться система техники безопасности и пожарной защиты при проведении строительных работ…
Техническое обслуживание и ремонт подвижных составов
Техника безопасности
При работе гаечным ключами необходимо подбирать их соответственно размерам их гаек правильно накладывать ключ на гайку. Нельзя поджимать гайку рывком. Снять с АТС деталь…
Устройство и ремонт электромагнитных контакторов типа МК-310Б И МК-15-01
3. ТЕХНИКА БЕЗОПАСНОСТИ
3.1 ТРЕБОВАНИЯ ТЕХНИКИ БЕЗОПАСНОСТИ ПРИ СЛЕСАРНЫХ РАБОТАХ Перед началом работы проверить весь инструмент. Слесарные молотки изготовляют из стали марки 50 или У7. Рукоятки…
Текущий ремонт — Техническое Обслуживание и Ремонт Автомобилей
Текущим ремонтом называют такой ремонт, который производится для устранения возникших отказов и неисправностей и способствует выполнению установленных норм пробега до капитального ремонта при минимальных простоях. Потребность в проведении текущего ремонта для автомобиля, прицепа или полуприцепа устанавливается при контрольных осмотрах, выполняемых во время проведения всех видов технического обслуживания, а также по заявкам водителя. В результате осмотра составляется акт технического состояния автомобиля. Если автомобиль по техническому состоянию не требует ремонта, то его допускают к дальнейшей эксплуатации на определенный срок, о чем делается отметка в акте.
Потребность в проведении текущего ремонта для автомобиля, прицепа или полуприцепа устанавливается при контрольных осмотрах, выполняемых во время проведения всех видов технического обслуживания, а также по заявкам водителя. В результате осмотра составляется акт технического состояния автомобиля. Если автомобиль по техническому состоянию не требует ремонта, то его допускают к дальнейшей эксплуатации на определенный срок, о чем делается отметка в акте.
Текущий ремонт подвижного состава производится в автотранспортных предприятиях, автокомбинатах или на станциях технического обслуживания.
При текущем ремонте осуществляют разборочно-сборочные, слесарные, сварочные и другие необходимые работы. У агрегатов заменяют отдельные детали, достигшие предельно допустимого состояния, или поврежденные детали, кроме базовых. У автомобиля (прицепа, полуприцепа) производится замена отдельных узлов и агрегатов, требующих текущего или капитального ремонта. Как правило, текущий ремонт осуществляют агрегатным методом. Текущий ремонт должен обеспечить безотказную работу отремонтированных агрегатов и узлов на пробеге не меньше чем до очередного, второго технического обслуживания.
Текущий ремонт должен обеспечить безотказную работу отремонтированных агрегатов и узлов на пробеге не меньше чем до очередного, второго технического обслуживания.
Наиболее распространенными работами при текущем ремонте являются: замена поршневых колец, вкладышей подшипников коленчатого вала, подшипников ступиц колес, рессор и рессорных пальцев, шаровых пальцев рулевого привода, притирка клапанов, пайка радиатора, правка и заварка крыльев, подкраска поврежденных мест кузова и др. Также при текущем ремонте осуществляют замену гаек, болтов, шпилек, шайб, прокладок. Производят слесарно-механические работы, например притирку, сверление, развертывание отверстий и т. д.
Для планирования текущего ремонта установлены нормативы трудоемкости. Нормативы не учитывают трудовых затрат на вспомогательные работы, которые устанавливаются в пределах 20—30% к суммарной трудоемкости текущего ремонта по автотранспортному предприятию.
В состав вспомогательных работ включают: обслуживание и ремонт оборудования и инструментов; транспортные и погрузочно-разгрузочные работы, связанные с ремонтом автомобилей; перегон автомобилей внутри автотранспортного предприятия; хранение, приемку и выдачу материальных ценностей; уборку производственных и служебно-бытовых помещений.
Работы, выполняемые при текущем ремонте автомобилей, подразделяются на два вида: работы по съему и установке агрегатов и узлов, а также по разборке, устранению неисправностей и сборке снятых агрегатов и узлов.
Производственные участки, предназначенные для технического обслуживания и ремонта полнокомплектных автомобилей, считаются основными, участки, специализирующиеся по видам работ, например ремонту топливной аппаратуры, аккумуляторов и др., обеспечивающие работу основных участков, — вспомогательными.
На промышленных предприятиях существуют два метода текущего ремонта автомобилей — необезличенный и агрегатный.
При необезличенном методе ремонта сохраняется принадлежность восстановленных составных частей к определенному автомобилю. При этом автомобиль простаивает в течение всего времени ремонта его агрегатов. Агрегатный метод является таким обезличенным методом ремонта, при котором неисправные агрегаты заменяются новыми или заранее отремонтированными. Снятые с автомобиля агрегаты, требующие ремонта, отправляют на специализированные авторемонтные заводы или вспомогательные производственные участки для восстановления. При агрегатном методе значительно сокращается время простоя в ремонте, повышается коэффициент технической готовности и тем самым увеличивается эффективность использования автотранспортных средств.
Текущий ремонт выполняется на универсальных или специальных постах. На посты возлагают выполнение всех работ по текущему ремонту одного или нескольких агрегатов, сборочных единиц и систем автомобиля. Рекомендуется специализировать производственные участки на выполнение определенных работ по агрегатам, электрооборудованию. Узкая специализация ремонтных предприятий позволяет применять наиболее производительные технологические процессы, улучшать качество и снижать себестоимость ремонтных работ.
При текущем ремонте на СТОА происходит следующее перемещение автомобиля. При въезде на станцию автомобиль проезжает в зону приемки, где приемщик проводит его проверку, оформляет наряд-заказ на ремонт. На крышу автомобиля устанавливают опознавательный знак на магнитной подставке, номер которого вписывают в наряд-заказ. Оформляя наряд-заказ, приемщик вписывает в него данные о владельце и автомобиле, перечисляет операции, которые необходимо выполнить, указывает их стоимость по единому прейскуранту.
Оформленный наряд-заказ на ремонт приемщик передает в диспетчерскую, расположенную рядом с участком приемки. Диспетчер направляет автомобиль в определенную зону ремонта и устанавливает дату и время выдачи автомобиля из ремонта, которые отмечаются в наряде-заказе. Затем диспетчер рассылает с помощью пневмопочты формы наряда-заказа в соответствующие подразделения станции: на склад, в расчетный отдел, начальнику производства. Одна из форм остается на автомобиле, который передается персоналом участка приемки в одну из бригад соответствующего участка.
Таким образом, как только автомобиль принят и взят на учет диспетчером, соответствующие подразделения станции получают об этом информацию.
Бригада, в которую поступил автомобиль, выполняет операции, указанные в наряде-заказе. Бригадир записывает в наряде-заказе табельные номера рабочих, проводящих ремонт, и они в нем расписываются за каждую операцию. Затем автомобиль по указанию диспетчера передается в другие бригады для дальнейших работ.
После завершения всех работ автомобиль поступает на участок выдачи, где проводится контроль работ, выполненных ремонтными бригадами. Проверенный автомобиль выдается владельцу или устанавливается на стоянку готовых автомобилей.
Нормативы следует корректировать в зависимости от условий эксплуатации, изменения режимов технического обслуживания и других факторов.
Установленная общая трудоемкость текущего ремонта автомобилей распределяется по видам работ. Распределение характера работ приводится в нормативных материалах.
контрольных точек повреждения ДНК — обзор
1 Введение
Контрольные точки повреждения ДНК высоко консервативны на протяжении всей эволюции эукариот и играют решающую роль в поддержании стабильности генома и профилактике рака. Передача сигналов повреждения инициируется ATM / ATR-подобными протеинкиназами, которые фосфорилируют сотни эффекторов, преимущественно по мотивам серин-глутамин (SQ) или треонин-глутамин (TQ) (Matsuoka et al., 2007; Stokes et al., 2007) . Ключевым эффектором ATM человека является киназа CHK2 (Antoni, Sodha, Collins, & Garrett, 2007).В дополнение к домену киназы Ser / Thr, N-концевая регуляторная область CHK2-подобных киназ обычно содержит кластерный домен SQ / TQ (SCD) мотивов сайтов фосфорилирования (Traven & Heierhorst, 2005) и домен FHA, участвующий в pThr-специфические белок-белковые взаимодействия (Mahajan et al., 2008).
Ортолог CHK2 у почкующихся дрожжей, широко используемого простого модельного организма для исследований реакции на повреждение ДНК, называется Rad53 и содержит регуляторные модули SCD-FHA на обеих сторонах киназного домена (SCD1-FHA1 на N-конце, SCD2- FHA2 на C-конце). RAD53 важен для дрожжей, потому что он функционирует не только в ответ на факторы окружающей среды, повреждающие ДНК, но также потому, что он обеспечивает правильную репликацию ДНК даже при отсутствии экзогенного повреждения ДНК (Cha & Kleckner, 2002; Desany, Alcasabas, Bachant, & Elledge, 1998; Hoch et al., 2013; Zhao & Rothstein, 2002; Zheng et al., 1993).
Подробные механизмы того, как Rad53 выполняет эти функции, как они регулируются и как воздействуют на определенные субстраты, были предметом интенсивных исследований.Стало ясно, что активация Rad53 представляет собой сложный процесс, управляемый фосфорилированием, инициированный ATM / ATR-подобными киназами Mec1 и Tel1, который модулируется несколькими другими белками. Например, в ответ на нерепликативное повреждение ДНК Rad53 связывается с Mec1 ATR -фосфорилированным адаптерным белком Rad9 способом, который зависит от его доменов FHA (Pike, Yongkiettrakul, Tsai, & Heierhorst, 2003; Schwartz, Lee, Duong, Эминага и Стерн, 2003). Затем это способствует Mec1 ATR -зависимому фосфорилированию Rad53 по множеству сайтов (Chen et al., 2014; Schwartz et al., 2002), и все еще плохо изученным способом способствует самоактивирующемуся аутофосфорилированию Rad53 на Thr354. Кроме того, Mec1 ATR -зависимое фосфорилирование Rad53 и его доменов FHA также играет важную роль в связывании активированного Rad53 с его субстратами. Например, в то время как монофосфорилирование SCD1 необходимо для максимальной активации Rad53 (Hoch et al., 2013), дифосфорилирование в этой области особенно необходимо для связывания и активации близкородственной эффекторной киназы Dun1 (Lee et al., 2008), что, в свою очередь, играет ключевую роль в регуляции клеточных уровней dNTP (Zhao & Rothstein, 2002).
(PDF) Механизмы контрольных точек на пересечении между повреждением и репарацией ДНК
Цитируйте эту статью в прессе как: F. Lazzaro и др., Механизмы контрольных точек на пересечении между повреждением и репарацией ДНК, DNA
Repair (2009 г.) ), doi: 10.1016 / j.dnarep.2009.04.022
АРТИКУЛ В ПРЕССЕ
Г Модель
ДНАРЕП-1220; Кол-во страниц 13
F.Lazzaro et al. / DNA Repair xxx (2009) xxx – xxx 11
[5] X. Zhao, R. Rothstein, Киназа контрольной точки Dun1 фосфорилирует и регулирует
ингибитор рибонуклеотидредуктазы Sml1, Proc. Natl. Акад. Sci. США
99 (2002) 3746–3751.
[6] В.И. Башкиров, Ю. King и др., Белок репарации ДНК Rad55 является концевым субстратом
контрольных точек повреждения ДНК, Mol. Клетка. Биол. 20 (2000) 4393–4404.
[7] T. Lindahl, Подавление спонтанного мутагенеза в человеческих клетках с помощью ДНК
эксцизионная репарацияоснований, Mutat.Res. 462 (2000) 129–135.
[8] Х. Клокер, Б. Ауэр и др., Скорость репарации в человеческих фибробластах, измеренная с помощью
экскорпорации димера тимина, Мол. Genet Genet. 188 (1982) 309–312.
[9] H. Neecke, G. Lucchini, M.P. Longhese, Развитие клеточного цикла в присутствии
непоправимых повреждений ДНК контролируется Mec1- и Rad53-зависимой контрольной точкой
у почкующихся дрожжей, EMBO J. 18 (1999) 4485–4497.
[10] Л.Ф. Батиста, Б. Каина и др., Как повреждения ДНК превращаются в мощные убивающие структуры
: выводы из УФ-индуцированного апоптоза, Mutat.Res.6 81 (2008)
197–208.
[11] C. Zierhut, J.F. Различия, Дозировка разрыва, стадия клеточного цикла и репликация ДНК во флюиде-
, реакция двухцепочечного разрыва ДНК, EMBO J. 27 (2008) 1875–1885.
[12] S.J. Маккриди, Ф. Осман1, А. Ясуи, Восстановление УФ-повреждений делящихся дрожжей
Schizosaccharomyces pombe, Mutat. Res. 451 (2000) 197–210.
[13] J.H. Hoeijmakers, Механизмы поддержания генома для предотвращения рака,
Nature 411 (2001) 366–374.
[14] Дж. Бартек, Дж. Лукас, Контрольные точки повреждения ДНК: от инициации до восстановления или адаптации
, Curr. Opin. Cell Biol. 19 (2007) 238–245.
[15] C.L. Петерсон, Дж. Кот, Клеточные механизмы для репарации хромосомной ДНК, Genes
Dev. 18 (20 04) 602–616.
[16] Y. Bao, X. Shen, Ремоделирование хроматина при репарации двухцепочечных разрывов ДНК,
Curr. Opin. Genet. Dev. 17 (2007) 126–131.
[17] J.H. Барлоу, М. Лисби, Р. Ротштейн, Дифференциальная регуляция клеточного ответа
на двухцепочечные разрывы ДНК в G1, Mol.Cell 30 (2008) 73–85.
[18] Дж. Э. Габер, Партнеры и пути восстановления двунитевого разрыва, Trends
Genet. 16 (2000) 259–264.
[19] Л. Чен, К. Трухильо и др., Промотирование Dnl4-катализируемого присоединения концов ДНК
комплексами Rad50 / Mre11 / Xrs2 и Hdf1 / Hdf2, Мол. Ячейка 8 (2001)
110 5 –1115.
[20] Т.Т. Паулл, М. Геллерт, 3–5-экзонуклеазная активность Mre 11 способствует репарации
двухцепочечных разрывов ДНК, Мол.Cell 1 (1998) 969–979.
[21] J.P. Carney, R.S. Maser и др., Белковый комплекс hMre11 / hRad50 и синдром разрыва Неймегена
: связь репарации двухцепочечного разрыва с ответом на повреждение
клеточной ДНК, Cell 93 (1998) 477–486.
[22] Р. Варон, К. Виссинга и др., Нибрин, новый белок репарации двухцепочечных разрывов ДНК
, мутирован при синдроме разрыва Неймегена, Cell 93 (1998) 467–476.
[23] Г.С. Стюарт, Р.С. Maser, et al., Ген репарации двухцепочечных разрывов ДНК
hMRE11 мутирован у индивидуумов с расстройством, подобным атаксии-телеангиэктазии,
Cell 99 (1999) 577–587.
[24] G. Buscemi, C. Savio и др., Зависимость активации Chk2 от Nbs1 после повреждения ДНК
, Mol. Клетка. Биол. 21 (2001) 5214–5222.
[25] Т. Узиэль, Й. Леренталь и др., Необходимость комплекса MRN для активации ATM
путем повреждения ДНК, EMBO J. 22 (2003) 5612–5621.
[26] Э. Беркович, Р.Дж. Моннат, М. Кастан, Роль ATM и NBS1 в модуляции структуры хроматина
и репарации двухцепочечных разрывов ДНК, Nat. Cell Biol. 9
(2007) 683–690.
[27] J. Buis, Y. Wu и др., Нуклеазная активность Mre11 играет важную роль в репарации ДНК
и стабильности генома, отличной от активации ATM, Cell 135 (2008) 85–96.
[28] Р.С. Williams, G. Moncalian, et al., Димеры Mre11 координируют концевую связь ДНК-
и нуклеазный процессинг при репарации двухцепочечных разрывов, Cell 135 (2008)
97-109.
[29] К.Дж. Баккенист, М.Б. Кастан, Д.Н. Adamage активирует АТМ посредством межмолекулярного аутофосфорилирования
и диссоциации димеров, Nature 421 (2003) 499-506.
[30] J.H. Ли, Т.Т. Паулл, Прямая активация протеинкиназы ATM комплексом
Mre11 / Rad50 / Nbs1, Science 304 (2004) 93–96.
[31] J.H. Ли, Т.Т. Паулл, Активация ATM с помощью двухцепочечных разрывов ДНК через комплекс
Mre11 – Rad50 – Nbs1, Science 308 (2005) 551–554.
[32] M. Clerici, D. Mantiero и др., Резекция белка Sae2 Saccharomyces cerevisiae
и перекрытие двухцепочечных разрывов концов, J. Biol. Chem.280
(2005) 38631–38638.
[33] P. Huertas, F. Cortˇ
Zs-Ledesma и др., CDK нацелены на Sae2 для контроля резекции конца ДНК
и гомологичной рекомбинации, Nature 455 (2008) 689–692.
[34] A. Jazayeri, J. Falck и др., ATM- и зависимая от клеточного цикла регуляция ATR в ответе
на двухцепочечные разрывы ДНК, Nat. Cell Biol. 8 (2006) 37–45.
[35] E.P. Мимиту, Л. Symington, Sae2, Exo1 и Sgs1 сотрудничают в процессинге двойных разрывов цепи ДНК —
, Nature 455 (2008) 770–774.
[36] Z. Zhu, W.H. Chung и др., Геликаза Sgs1 и две нуклеазы Dna2 и Exo1
резектируют концы двухцепочечных разрывов ДНК, Cell 134 (20 08) 981–994.
[37] Д. Кортез, С. Гунтуку и др., ATR и ATRIP: партнеры в передаче сигналов контрольной точки,
Science 294 (2001) 1713-1716.
[38] A. Jazayeri, A. Balestrini и др., Mre11-Rad50-Nbs1-зависимый процессинг
разрывов ДНКгенерирует олигонуклеотиды, которые стимулируют активность ATM, EMBO J.
27 (2008) 1953–1962.
[39] Д. Мантьеро, М. Клеричи и др., Двойная роль Saccharomyces cerevisiaeTel1 в ответе контрольной точки
на двухцепочечные разрывы, EMBO Rep. 8 (2007) 380–387.
[40] G. Ira, A. Pellicioli и др., Резекция концов ДНК, гомологичная рекомбинация
и активация контрольной точки повреждения ДНК требуют CDK1, Nature 431 (2004)
1011–1017.
[41] Т. Кондо, Т. Вакаяма и др., Рекрутирование белков контрольной точки Mec1 и Ddc1
в двухцепочечные разрывы посредством различных механизмов, Science 294
(2001) 867–870.
[42] L. Zou, S.J. Элледж, Определение повреждений ДНК посредством распознавания ATRIP
комплексовRPA – оцДНК, Science 300 (2003) 1542–1548.
[43] М. Лисби, Дж. Х. Барлоу и др., Хореография реакции на повреждение ДНК: spa-
тиотемпоральные отношения между контрольными точками и белками репарации, Cell 118
(2004) 699–713.
[44] К.А. Кимприч, Д. Кортез, ATR: важный регулятор целостности генома, Nat.
Rev. Mol. Клетка. Биол. 9 (2008) 616–627.
[45] Д.А. Мордес, Э.А. Нам, Д. Кортез, Dpb11 активирует комплекс Mec1-Ddc2,
Proc. Natl. Акад. Sci. США 105 (2008) 18730–18734.
[46] Й. Майка, А. Недзела-Майка, П.М. Бургерс, зажим контрольной точки активирует
киназу Mec1 во время инициации контрольной точки повреждения ДНК, Mol. Ячейка 24
(2006) 891–901.
[47] Ф. Пудду, М. Граната и др., Фосфорилирование почкующихся дрожжей 9-1-1 com-
plex требуется для функции Dpb11 при полной активации УФ-индуцированного повреждения ДНК
. КПП, Мол.Клетка. Биол. 28 (2008) 4782–4793.
[48] Y. Yoo, X. Wu, J.L. Guan, Новая роль актин-нуклеирующего комплекса ARP2 / 3
в регуляции РНК-полимеразы II-зависимой транскрипции, J. Биол. Chem.
282 (2007) 7616–7623.
[49] Д.А. Брессан, Х.А. Olivares, et al., Изменение N-концевой фосфоэстеразы
сигнатурных мотивов инактивирует Saccharomyces cerevisiae Mre11, Genetics 150
(1998) 591–600.
[50] L.K. Льюис, Ф. Сторичи и др., Роль нуклеазной активности Saccharomyces cere-
visiae Mre11 в репарации двухцепочечных разрывов ДНК в митотических клетках, Генетика
166 (2004) 1701–1713.
[51] C.Y. Бонилла, Дж. Мело, Д. Toczyski, Совместной локализации сенсоров достаточно, чтобы
активировали контрольную точку повреждения ДНК при отсутствии повреждений, Mol. Cell 30
(2008) 267–276.
[52] Э. Сотоглоу, Т. Мистели, Активация ответа на повреждение клеточной ДНК при отсутствии повреждений ДНК
, Science 320 (2008) 1507–1510.
[53] Дж. Бушеми, П. Перего и др., Активация киназ ATM и Chk2 в зависимости от
количества разрывов цепи ДНК, Онкоген 23 (2004) 7691–7700.
[54] A. Pellicioli, S.E. Ли и др., Регулирование киназы Saccharomyces Rad53 checkpoint
во время адаптации от остановки G2 / M, вызванной повреждением ДНК, Mol. Ячейка 7
(2001) 293–300.
[55] М.Б. Vaze, A. Pellicioli и др., Восстановление после ареста, опосредованного контрольной точкой, после
репарации двухцепочечного разрыва требует Srs2-геликазы, Mol.Ячейка 10 (20 02)
373–385.
[56] Y. Ziv, D. Bielopolski и др., Релаксация хроматина в ответ на двойные разрывы цепи ДНК
модулируется новым ATM- и KAP-1-зависимым путем,
Nat. Cell Biol. 8 (2006) 870–876.
[57] А.А. Гударзи, А. Noon и др., Передача сигналов ATM облегчает репарацию
двухцепочечных разрывов ДНК, связанных с гетерохроматином, Mol. Ячейка 31 (2008 г.)
167–177.
[58] E.P. Рогаку, Д.R. Pilch и др., Двухцепочечные разрывы ДНК индуцируют фосфорилирование гистона
h3AX по серину 139, J. Biol. Chem. 273 (1998) 5858–5868.
[59] О. Фернандес-Капетилло, А. Ли и др., H3AX: хранитель гистонов генома
, Восстановление ДНК (Amst.) 3 (2004) 959–967.
[60] T.T.Paull, E.P. Rogakou, et al., Критическая роль гистона h3AX в рекрутировании
факторов репарации в ядерные очаги после повреждения ДНК, Curr. Биол. 10 (2000) 886–895.
[61] E.Сонода, Г.Ю. Чжао и др., Совместная роль gammah3AX и Rad51
paralog Xrcc3 в гомологичной рекомбинационной репарации, репарации ДНК. (Amst). 6
(2007) 280–292.
[62] М. Штуки, С.П. Джексон, gammah3AX и MDC1: закрепление механизма ответа на повреждение ДНК-
на сломанных хромосомах, Восстановление ДНК (Amst.) 5 (2006)
534–543.
[63] M.S. Huen, R. Grant и др., RNF8 трансдуцирует сигнал повреждения ДНК посредством убиквитилирования тона his-
и сборки белка контрольной точки, Cell 131 (20 07) 901-
914.
[64] Н.К. Колас, Дж. Р. Чапман и др., Оркестровка ответа на повреждение ДНК
убиквитин-лигазой RNF8, Science 318 (20 07) 1637–1640.
[65] N. Mailand, S. Bekker-Jensen, et al., RNF8 убиквитилирует гистоны в ДНК
,двухцепочечных разрывов и способствует сборке репарационных белков, Cell 131
(2007) 887–900.
[66] X. Zhao, A.Y. Chang и др., Роль Lte1p (низкотемпературный эссенциальный белок
, участвующий в митозе) в процессинге пропротеина в секреторном пути дрожжей,
J.Биол. Chem. 282 (2007) 1670–1678.
[67] C. Sjogren, K. Nasmyth, Сцепление сестринских хроматид требуется для пострепликационной репарации двухцепочечных разрывов у Saccharomyces cerevisiae, Curr. Биол. 11
(2001) 991–995.
[68] Л. Стром, Х.Б. Lindroos, et al., Пострепликативное рекрутирование когезина для двойных разрывов цепи
необходимо для репарации ДНК, Mol. Cell 16 (2004) 1003–1015.
[69] E. Unal, A. Arbel-Eden и др., Путь ответа на повреждение ДНК использует модификацию гистона
для сборки двунитевого домена, специфичного для разрыва, Mol.
Cell 16 (2004) 991–1002.
[70] К. Ли, Ю. Чжан, С.Е. Ли, ортолог ATM Saccharomyces cerevisiae подавляет
транслокаций хромосом, индуцированных разрывом, Nature 454 (2008) 543–546.
[71] H.C. Ван, W.C. Chou и др., Атаксия с телеангиэктазией мутировала и контрольная точка
киназа 2 регулирует BRCA1, способствуя точному соединению концов ДНК, Cancer
Res. 66 (2006) 1391–1400.
[72] J. Zhuang, J. Zhang и др., Checkpoint kinase 2-обусловленное фосфорилирование
BRCA1 регулирует точность негомологичного концевого соединения, Cancer Res.66
(2006) 1401–1408.
[73] П. Анесорг, С.П. Джексон, Негомологичный соединяющий концы белок Nej1p является мишенью
для контрольной точки повреждения ДНК, DNA Repair (Amst.) 6 (2007) 190–201.
[74] I. Morin, H.P. Ngo и др., Checkpoint-зависимое фосфорилирование Exo1 mod-
вызывает ответ на повреждение ДНК, EMBO J. 27 (2008) 2400-2410.
Качественные автомобильные услуги в Авроре, Колорадо
Куда вы идете, если вам нужен полный автомобильный осмотр и техосмотр? Приглашаем вас приехать в Checkpoint Automotive Services в Авроре! Мы — районный магазин, которым владеют и управляют семья и друзья, которые относятся ко всем, кто входит в наши двери, как к одному из нас.Мы снимаем стресс и неуверенность в ваших автомобильных нуждах, будучи механиком, которому вы можете доверять!
Все наши работы на гарантии!
Мы обеспечиваем полный уход за автомобилем, от услуг Quick Lube до проверки освещения двигателя, технического обслуживания на пробеге, точной регулировки углов установки колес, трансмиссии, амортизаторов и стоек, ремонта тормозов, полной продажи шин и многого другого! Наши сертифицированные специалисты ASE проведут тщательный осмотр, чтобы определить необходимость ремонта, а затем приступят к работе. На все наши запчасти и автосервис предоставляется гарантия либо 24 месяца / 24 000 миль, либо 36 месяцев / 36 000 миль.Пока вы ждете, вы можете быстро отправиться в ближайшую библиотеку, почтовое отделение, парикмахерскую или маникюрный салон. Вы также можете расслабиться и расслабиться в нашей зоне ожидания, где есть удобные кожаные кресла, Wi-Fi, кофе, вода, детские игрушки и журнал Highlights.
Если нам понадобится ваш автомобиль на день, мы можем отвезти вас домой или на работу на нашем бесплатном автобусе, или вы можете арендовать автомобиль. Мы также предлагаем трансфер и высадку в нерабочее время. Не забывайте, что мы находимся в нескольких минутах ходьбы от районов Прайдс-Кроссинг, Джексон Фармс, Тоскана, Сиенна, Наблюдение, Ферма, Смоки-Ридж, Фазан-Ран, Парк-Боро и Медный лист.Мы будем держать вас в курсе вашего ремонта по тексту или электронной почте с фотографиями и видео.
Услуги полного парка
Ваш парк автомобилей, фургонов, грузовиков и транспортных средств нуждается в особом обслуживании. Чтобы свести к минимуму вероятность простоев и капитального ремонта, мы составим для вас индивидуальный и проактивный график обслуживания.
к вашим услугам с 1999 года!
Президент и владелецЛарри Олсен основал компанию Checkpoint Automotive в 1999 году с целью создания культуры заботы и обслуживания клиентов, что практически неслыханно для автомобильной промышленности.Не удивляйтесь, если вы приедете в магазин и обнаружите, что сервисный писатель выкидывает гриль из своей задней двери, и если похоже, что наши технические специалисты хорошо проводят время на работе — так оно и есть! Даже клиенты в холле часто улыбаются, не особо переживая из-за своих автосервисов.
Мы предлагаем финансирование ремонта
Мы понимаем, что неожиданные автомобильные услуги не всегда могут соответствовать вашему бюджету, поэтому наши клиенты могут подавать заявки на финансирование ремонта.Это немного расширит ваши платежи и обезопасит вас и ваших близких в дороге.
Отрицательный регулятор факторов транскрипции E2F связывает контрольную точку клеточного цикла и восстановление повреждений ДНК
Значение
ДНК часто повреждается как эндогенными, так и экзогенными факторами. В ответ на повреждение ДНК клетки активируют контрольные точки, чтобы остановить развитие клеточного цикла, давая достаточно времени для восстановления ДНК. Дефекты репарации ДНК вызывают множество заболеваний, включая рак.Факторы транскрипции E2F являются ключевыми игроками в развитии клеточного цикла и негативно регулируются белком-супрессором опухолей ретинобластомы. В этом исследовании мы продемонстрировали, что белок репарации ДНК SNI1, субъединица комплекса SMC5 / 6, является негативным регулятором E2F. Кроме того, это исследование также предполагает, что контрольная точка и репарация ДНК напрямую связаны через SNI1, что дает представление о реакции на повреждение ДНК.
Abstract
Повреждение ДНК представляет серьезную угрозу целостности генома и сильно влияет на рост и развитие.Чтобы поддерживать стабильность генома, все организмы развили сложные механизмы реакции на повреждение ДНК, включая активацию контрольных точек клеточного цикла и репарацию ДНК. Здесь мы показываем, что белок репарации ДНК SNI1, субъединица эволюционно консервативного комплекса SMC5 / 6, напрямую связывает эти два процесса в Arabidopsis . SNI1 связывается с активационными доменами факторов транскрипции E2F, ключевыми регуляторами развития клеточного цикла, и подавляет их транскрипционную активность. В свою очередь, E2Fs активируют экспрессию SNI1 , предполагая, что E2Fs и SNI1 образуют петлю отрицательной обратной связи.Генетически сверхэкспрессия SNI1 подавляет фенотипы растений с избыточной экспрессией E2F, а потеря функции E2F полностью подавляет мутант sni1 , что указывает на то, что SNI1 необходим и достаточен для ингибирования E2Fs. В целом, наше исследование показало, что SNI1 является негативным регулятором E2F и играет двойную роль в ответах на повреждение ДНК, связывая контрольную точку клеточного цикла и репарацию ДНК.
Конечная цель организма — передать свою генетическую информацию (ДНК) своему потомству с высокой точностью.Однако целостность ДНК постоянно нарушается различными экзогенными факторами (такими как УФ-свет, ионизирующее излучение, озон и многочисленные генотоксичные химические вещества) и эндогенными сигналами (такими как ошибки репликации и побочные продукты метаболизма) (1, 2). Подсчитано, что каждая клетка человека может страдать от десятков тысяч повреждений ДНК в день (3). Чтобы справиться с этой угрозой, все организмы разработали сложные механизмы ответа на повреждение ДНК (DDR), которые включают транскрипционное репрограммирование, активацию контрольных точек, репарацию ДНК и апоптоз.Дефекты DDR сильно влияют на развитие и вызывают множество заболеваний, включая рак (2–5).
Активация контрольной точки приводит к временной остановке развития клеточного цикла, позволяя клеткам иметь достаточно времени для восстановления повреждений, прежде чем перейти к следующей фазе клеточного цикла. Следовательно, активация контрольной точки необходима для обеспечения стабильности генома (2, 6, 7). Типичный цикл эукариотических клеток состоит из четырех различных фаз: G 1 (промежуток 1), S (синтез), G 2 (промежуток 2) и фазы M (митоз).Во время S-фазы геном дублируется посредством репликации ДНК, тогда как во время M-фазы реплицированные сестринские хроматиды поровну делятся между дочерними клетками. Чтобы гарантировать точную репликацию ДНК, в клетках появились контрольные точки, работающие на разных стадиях клеточного цикла, включая контрольную точку G 1 / S, контрольную точку intra-S и контрольную точку G 2 / M. Переход G 1 / S является этапом, ограничивающим скорость развития клеточного цикла. Следовательно, контрольная точка G 1 / S также известна как контрольная точка ограничения (2).
Модуль Retinoblastoma (RB) -E2F — известный регулятор КПП G 1 / S (8⇓⇓⇓ – 12). E2F представляет собой семейство факторов транскрипции, которые функционируют вместе со своими партнерами по димеризации DP-белками. Комплексы E2F-DP регулируют экспрессию генов, участвующих в репликации ДНК, чтобы контролировать начало S-фазы. Активность E2F негативно регулируется белком-супрессором опухоли RB, который связывается с доменом активации транскрипции E2F.В конце фазы G 1 RB фосфорилируется циклин-зависимыми киназами (CDK) и впоследствии диссоциирует от факторов транскрипции E2F, которые активируют экспрессию генов в S-фазе. Функции модулей RB-E2F сохраняются у растений (13⇓ – 15). Модельное растение Arabidopsis кодирует один гомолог RB, называемый Retinoblastoma-related 1 (RBR1), и шесть гомологов E2F (E2Fa-f). E2Fa, E2Fb и E2Fc — канонические E2F, способные образовывать комплексы с RBR1 (16). Принято считать, что E2Fa и E2Fb являются активаторами транскрипции, а E2Fc — репрессором (17⇓⇓⇓ – 21).
Комплекс SMC5 / 6 принадлежит к семейству белков структурного поддержания хромосом (SMC) и эволюционно консервативен у всех эукариот. Накапливающиеся данные подтверждают, что комплекс SMC5 / 6 играет множество важных ролей в репарации повреждений ДНК (22-25). Он задействуется в сайтах повреждения ДНК и способствует восстановлению ДНК посредством гомологичной рекомбинации (HR) (26). Он также способствует спасению остановившихся вилок репликации за счет стабилизации этих структур в конфигурациях, способных к рекомбинации, и облегчения разрешения или предотвращения образования определенных промежуточных продуктов рекомбинации.Более того, комплекс SMC5 / 6 необходим для стабильности рибосомальной ДНК (рДНК) (27). У дрожжей комплекс SMC5 / 6 состоит из SMC5, SMC6 и шести не-SMC элементов (NSE1 – NSE6) (28). Недавно SNI1 (супрессор NPR1- 1, индуцибельный) был идентифицирован как функциональный аналог NSE6 в Arabidopsis , несмотря на низкое сходство последовательностей с NSE6 (29).
В этом исследовании мы обнаружили, что SNI1 является негативным регулятором факторов транскрипции E2F. SNI1 напрямую связывается с доменом активации E2F, подавляя их транскрипционную активность.Генетические данные убедительно указывают на то, что SNI1 необходим и достаточен для ингибирования функций E2Fs, напоминающих RB. Мы предполагаем, что SNI1 играет двойную роль в DDR, связывая активацию контрольных точек и репарацию ДНК.
Результаты
SNI1 требуется для корневого развертывания.
SNI1 — это высококонсервативный растительный белок, первоначально идентифицированный за его роль в поддержании целостности ДНК во время иммунных ответов растений (29–31). Помимо иммунных фенотипов, мутант sni1 обнаруживает плейотропные дефекты развития, указывая тем самым, что SNI1 играет очень важную роль в растениях.Как показано на фиг. 1 A и B , длина первичного корня была резко уменьшена у мутанта sni1 по сравнению с диким типом (WT). Для дальнейшего изучения дефектов развития корневой меристемы мы исследовали ее клеточную структуру с помощью конфокальной микроскопии. Все корни sni1 имели очень сильные дефекты. Как показано на фиг. 1 C , в отличие от стереотипной структуры у WT, структура корневой меристемы у мутанта sni1 была сильно дезорганизована.Клетки покоящегося центра (QC) подверглись делению, и асимметричное деление инициалов коры и энтодермы было нарушено в некоторых корнях. Эти результаты показывают, что стволовые клетки в sni1 не поддерживаются должным образом. Чтобы подтвердить это, мы исследовали экспрессию маркеров стволовых клеток у мутанта sni1 . SHORTROOT (SHR) и SCARECROW (SCR) являются ключевыми регуляторами радиального паттерна корня и поддержания стволовых клеток (32). AGAMOUS-LIKE 42 (AGL42) представляет собой фактор транскрипции MADS-бокса, обогащенный QC (33).По сравнению с WT мутант sni1 показал гораздо более низкие уровни экспрессии этих маркеров (фиг. 1 D ). Чтобы проверить экспрессию других генов, участвующих в развитии корня, был проведен анализ qPCR ( SI Приложение , рис. S1). Мы обнаружили, что уровни экспрессии большинства протестированных генов ( SCR , SHR , PLT1 , PLT2 , PLT3 , PLT4 , PIN1 , PIN2 PIN3 и ) были сильно сокращены в сни1 .Эти результаты предполагают, что для корневого развития требуется SNI1.
Рис. 1.SNI1 необходим для развития root. ( A ) Мутант sni1 демонстрирует фенотип с короткими корнями. WT и мутант sni1 выращивали вертикально на среде 1/2 MS. ( B ) Относительная длина корня в WT и sni1 . Данные представляют собой среднее значение ± стандартное отклонение ( n = 30). Статистическую значимость определяли с использованием критерия Стьюдента t . *** P <0.001. ( C ) Структура корневой меристемы дезорганизована в sni1 . Корни WT sni1 и окрашивали PI и наблюдали с помощью конфокальной микроскопии. ( D ) Экспрессия (зеленая флуоресценция) маркера стволовых клеток SHR: GFP , SCR: GFP и AGL42: GFP в sni1 снижены по сравнению с WT. (Масштаб: A , 1 см; C , 50 мкм; D , 20 мкм.)
Поскольку SNI1 является субъединицей комплекса SMC5 / 6, фенотипы sni1 могут быть отнесены к недостаточность репарации ДНК (29).Не восстановленное повреждение ДНК вызовет запрограммированную гибель клеток (PCD). Действительно, около клеток корня sni1 были мертвыми, на что указывало окрашивание пропидиум йодидом (PI) (рис. 1 C ). Предыдущие исследования показали, что потеря функции нескольких генов, связанных с HR, включая RAD51D , BRCA2 , ATR , RAD17 и SWIM , подавляла фенотипы sni1 (29, 34⇓ – 36 ). У этих двойных мутантов путь HR заблокирован, что позволяет восстановить повреждение ДНК с помощью альтернативных путей репарации.Однако, основываясь на длине корня, структуре корневой меристемы и PCD, эти мутанты только частично подавляли мутант sni1 ( SI Приложение , Fig. S2), указывая тем самым, что SNI1 выполняет другие функции в дополнение к репарации ДНК.
SNI1 является мишенью для факторов транскрипции E2F.
Для дальнейшего изучения функции SNI1 мы попытались изучить экспрессию SNI1 с помощью GENEVESTIGATOR (37). Сначала мы проанализировали паттерны его экспрессии в различных тканях и обнаружили, что SNI1 высоко экспрессируется в тканях, где клеточное деление очень активно (таких как каллус, клеточная суспензия, верхушка побега и верхушка корня).( SI Приложение , рис. S3 C ). Для подтверждения паттернов экспрессии мы сконструировали вектор, содержащий нативный промотор SNI1 и геномную последовательность в рамке считывания с кодирующей последовательностью β-глюкуронидазы (GUS), и трансформировали его в мутант sni1 для получения репортерных линий экспрессии SNI1 ( СНИ1: СНИ1-ГУС ). Длина корня трансгенных растений была восстановлена до уровня WT ( SI, приложение , фиг. S3 A ), что указывает на то, что конструкция является биологически активной.В соответствии с данными микроматрицы, мы обнаружили, что SNI1 высоко экспрессируется в апикальной меристеме побегов и апикальной меристеме корня ( SI Приложение , Fig. S3 B ), поддерживая его роль в поддержании меристемы.
Мы также проанализировали экспрессию SNI1 в различных мутантах и трансгенных растениях и обнаружили, что уровень его экспрессии был относительно стабильным. Однако он был заметно повышен в линиях со сверхэкспрессией E2Fa-DPa– ( SI Приложение , Fig. S4 A ).Интересно, что мы обнаружили, что промоторы SNI1 как в Arabidopsis , так и в рисе содержат сайты связывания E2F ( SI, приложение , рис. S4 B ), что позволяет предположить, что SNI1 может быть целевым геном E2Fa. фактор транскрипции.
Чтобы проверить нашу гипотезу, мы сначала подтвердили повышенную экспрессию SNI1 в линиях с избыточной экспрессией E2Fa-DPa– ( 35S: E2Fa-DPa ) с помощью qRT-PCR (рис. 2 A ). Чтобы определить, могут ли E2F связываться с предполагаемым сайтом связывания E2F в промоторе SNI1 , мы выполнили одногибридные анализы дрожжей. Arabidopsis кодирует три канонических E2F, среди которых E2Fa и E2Fb являются активаторами, а E2Fc — репрессором (17⇓⇓⇓ – 21). Как показано на фиг. 2 B , как E2Fa, так и E2Fb могут связываться с олигонуклеотидами, содержащими потенциальный E2F-связывающий сайт промотора Arabidopsis SNI1 . Чтобы определить, могут ли E2F связываться с промотором SNI1 in vivo, мы провели анализ иммунопреципитации хроматина (ChIP) с последующей кПЦР (ChIP-qPCR) с использованием трансгенных растений, экспрессирующих слияние E2Fa-3 × FLAG, управляемое промотором CaMV 35S . .Как показано на рис.2 C и D , зонды, покрывающие элемент E2F cis промотора SNI1 (P1 и P2), но не зонд в кодирующей области (P3), были значительно обогащены. в E2Fa-3 × FLAG по сравнению с WT.
Рис. 2.SNI1 является геном-мишенью E2Fa. ( A ) Экспрессия SNI1 резко повышена в линиях E2Fa и DPa ( 35S: E2Fa-DPa ) по сравнению с WT.Относительный уровень экспрессии SNI1 определяли с помощью анализа qRT-PCR с использованием убиквитина 5 ( UBQ5 ) в качестве внутреннего стандарта. ( B ) E2Fa и E2Fb связываются с промотором SNI1 в дрожжевых одногибридных анализах. Три тандемные копии фрагмента ДНК, содержащие E2F-связывающий сайт промотора SNI1 (названный «олиго»), клонировали в вектор pHis2.1. E2Fa и E2Fb были клонированы в вектор pGADT7-Rec соответственно. pGADT7-Rec-53 и pHis2.1-P53 использовали в качестве положительного контроля. pGADT7-Rec-53 и pHis2.1 использовали в качестве отрицательного контроля. DDO, среда с двойным выпадением (SD / -Trp / -Leu); TDO, среда с тройным отсевом (SD / -Trp / -Leu / -His); 3-АТ, 3-амино-1,2,4-триазол. ( C ) Схема геномной области SNI1 . P1, P2 и P3 представляют собой фрагменты, используемые в ChIP-qPCR в D . ( D ) E2Fa связывается с промотором SNI1 в анализах ChIP-qPCR. Показаны процентные доли фрагментов ДНК, коиммунопреципитированных антителом, по отношению к исходной ДНК.Данные представляют собой среднее значение ± стандартная ошибка трех биологических повторов ( n = 3). ( E ) Схематическое изображение конструкций, используемых для двойных люциферазных анализов. Репортерная конструкция содержит люциферазу светлячка (LUC), управляемую промотором SNI1 , и люциферазу Renilla (REN), управляемую промотором CaMV 35S . Эффекторные конструкции содержат E2Fa, E2Fb или DPa, управляемые промотором CaMV 35S , соответственно. ( F ) E2Fa-DPa и E2Fb-DPa активируют экспрессию SNI1 в двойных анализах люциферазы.Репортеры и эффекторы коэкспрессируются в N. benthamiana , и измеряется активность как REN, так и LUC. Показаны относительные активности LUC, нормализованные к активности REN (LUC / REN). Данные представляют собой среднее значение ± стандартная ошибка трех биологических повторов ( n = 3). Статистическую значимость определяли с использованием критерия Стьюдента t . ** P <0,01, *** P <0,001; нс, не имеет значения.
Чтобы проверить, могут ли E2Fa и E2Fb активировать экспрессию SNI1 , мы провели двойные люциферазные анализы в Nicotiana benthamiana .Репортерный вектор содержал ген люциферазы светлячка (LUC), управляемый промотором SNI1 , и ген люциферазы рениллы (REN), управляемый промотором CaMV 35S . Эффекторные векторы включали E2F и DPa, управляемые промотором CaMV 35S (фиг. 2 E ). Как показано на фиг. 2 F , как E2Fa, так и E2Fb активировали экспрессию SNI1 . В совокупности эти данные демонстрируют, что E2Fs связываются с промотором SNI1 и активируют его экспрессию, предполагая, что SNI1 является прямой мишенью для E2Fs.
SNI1 взаимодействует с E2F.
Учитывая, что E2Fs регулируют экспрессию SNI1 , а SNI1 может регулировать прогрессию клеточного цикла, мы предположили, что SNI1 может, в свою очередь, регулировать E2Fs. Поэтому мы стремились изучить возможность взаимодействия SNI1 с E2F. Сначала мы провели анализ двугибридных дрожжей (Y2H). Однако анализы не увенчались успехом, потому что и E2Fa, и E2Fb обладают активностью самоактивации, а SNI1 обладает активностью репрессии транскрипции в дрожжевых клетках (31), что делает их непригодными в качестве приманок.В качестве альтернативного подхода мы провели анализ сплит-люциферазы, чтобы проверить их взаимодействие с N. benthamiana (38). SNI1 был слит с С-концевой половиной люциферазы (CLuc), а E2F слили с N-концевой половиной люциферазы (NLuc). Взаимодействие между двумя белками объединяет две половинки люциферазы, что приводит к ферментативной активности. Как показано на рис. 3 A , SNI1 может взаимодействовать как с E2Fa, так и с E2Fb. Для дальнейшего подтверждения их взаимодействия мы провели анализы коиммунопреципитации (Co-IP).Слитые белки E2F-Strep II коэкспрессируются с SNI1-TAP (содержащим метку 9 × Myc) или GFP-TAP в N. benthamiana . После иммунопреципитации с использованием антитела против Myc проводили вестерн-блоттинг с использованием антитела против Strep II для обнаружения белков E2F-Strep II. И E2Fa, и E2Fb могут коиммунопреципитироваться с помощью SNI1-TAP, но не контроля GFP-TAP, что указывает на то, что SNI1 специфически взаимодействует как с E2Fa, так и с E2Fb in vivo (рис. 3 B ).
Рис. 3.SNI1 взаимодействует с E2Fa и E2Fb.( A ) Анализ расщепленной люциферазы. Agrobacterium , несущие указанные конструкции, подвергали совместной фильтрации в листьев N. benthamiana . Положительное свечение, отслеживаемое камерой CCD, указывает на взаимодействие. ( B ) Анализы коиммунопреципитации. E2Fa и E2Fb были помечены Strep II, а SNI1 был помечен TAP (содержащий тег 9 × Myc). GFP-TAP использовали в качестве отрицательного контроля. Конструкции коэкспрессировали в листьях N. benthamiana . Иммунопреципитацию проводили с использованием антитела против Myc, а вестерн-блоттинг выполняли с использованием антитела против Strep II или антитела против Myc.( C ) Схема структур E2Fa и E2Fb с выделением консервативных доменов. ( D и E ) Выполняемые исследования in vitro. Слитые белки GST-RBBD экспрессировали в E.coli BL21 и очищали с использованием гранул глутатиона. Myc-SNI1 был переведен in vitro. Myc-SNI1 может быть отключен с помощью GST-E2Fa RBBD ( D ) и GST-E2Fb RBBD ( E ) соответственно. Было использовано аналогичное количество GST и GST-RBBD, как показано окрашиванием Ponceau S.
Чтобы изучить, как SNI1 регулирует E2F, необходимо определить, какой домен E2F взаимодействует с SNI1.И E2Fa, и E2Fb содержат высококонсервативный ДНК-связывающий домен, умеренно консервативный домен димеризации и C-концевой домен трансактивации (фиг. 3 C ). В наших первоначальных анализах Y2H мы обнаружили, что N-концевая половина E2Fs не проявляет активности самоактивации ( SI, приложение , рис. S5 A ). Поэтому мы использовали Y2H, чтобы проверить, может ли N-концевая половина E2F взаимодействовать с SNI1. Как показано в Приложении SI , рис. S5 B , никакого взаимодействия обнаружено не было, что означает, что C-концевые домены E2F необходимы для их взаимодействия с SNI1.Предыдущие исследования показали, что Rb-связывающий домен (RBBD) в C-концевом домене трансактивации E2F отвечает за их взаимодействия с RB (39). Таким образом, мы предположили, что SNI1 также взаимодействует с E2F через RBBD. Чтобы проверить это, мы провели исследования in vitro. По сравнению с контролем GST, как GST-E2Fa-RBBD, так и GST-E2Fb-RBBD могут разрушать белок SNI1, меченный Myc (рис. 3 D и E ), что позволяет предположить, что SNI1 напрямую связывается с RBBD E2F. Эти данные убедительно подтверждают, что SNI1 взаимодействует с E2F.
SNI1 подавляет транскрипционную активность E2F.
Поскольку SNI1 может связываться с доменами трансактивации E2Fs, мы предположили, что SNI1 репрессирует транскрипционную активность E2Fs. Интересно, что в наших попытках проверить взаимодействия между SNI1 и E2F с помощью анализов Y2H мы обнаружили, что SNI1 может ингибировать активность самоактивации E2F и E2Fs-RBBD ( SI Приложение , рис. S5 C и D ). ), что подтверждает нашу гипотезу.Чтобы подтвердить эту активность SNI1 в planta , мы сначала выполнили анализы ChIP-qPCR, чтобы проверить, может ли SNI1 связываться с промоторами генов-мишеней E2F. Поскольку SNI1 высоко экспрессируется в каллусе, мы провели ChIP-анализы с использованием каллуса линии SNI1-TAP ( SNI1: SNI1-TAP ), описанных ранее (29, 34). Как показано на рис.4 A , промоторы генов-мишеней E2F ( MCM3 , ORC1B , CDC6 , ORC3 ) (40, 41) были значительно обогащены ChIP ДНК SNI1: SNI1. -TAP по сравнению с WT.Не удалось обнаружить обогащение для промотора CYCB1; 1 , специфического гена G 2 / M, на который не нацелены E2F. Эти результаты показывают, что SNI1 связывается с промоторами генов-мишеней E2F.
Рис. 4.SNI1 репрессирует транскрипционную активность факторов транскрипции E2F. ( A ) SNI1 связывается с промоторами генов-мишеней E2F. Анализы ChIP-qPCR проводили с использованием антител против Myc в каллусе SNI1: SNI1-TAP или WT.Фрагменты промоторов, содержащие консенсусный мотив E2F генов-мишеней E2F ( MCM , ORC1B , CDC6 и ORC3 ), были количественно определены, и было показано процентное содержание коиммунопреципитированной антителом ДНК по отношению к исходной ДНК. Actin7 и CYCB1: 1 использовали в качестве отрицательного контроля. Данные представляют собой среднее значение ± стандартная ошибка трех биологических повторов ( n = 3). ( B ) Схематическое изображение конструкций, используемых в двойных анализах люциферазы.( C и D ) SNI1 репрессирует транскрипционную активность E2Fa ( C ) и E2Fb ( D ), как показано двойными анализами люциферазы, соответственно. Промоторы генов-мишеней E2F ( ORC1B и CDC6 ) клонировали в репортерные векторы. E2Fa, E2Fb, DPa или SNI1 были клонированы в эффекторные векторы соответственно. Данные представляют собой среднее значение ± стандартная ошибка трех биологических повторов ( n = 3). Статистическую значимость определяли с использованием критерия Стьюдента t .** P <0,01, *** P <0,001; нс, не имеет значения.
Чтобы дополнительно проверить, репрессирует ли SNI1 транскрипционную активность E2Fs in planta , мы провели двойные люциферазные тесты. В этих экспериментах репортерные векторы содержали ген LUC , управляемый промоторами ORC1B и CDC6 , двух хорошо известных генов-мишеней E2F (40, 41). Эффекторные векторы содержали E2Fa-DPa, E2Fb-DPa и / или SNI1, управляемые промотором CaMV 35S (рис.4 В ). Как показано на фиг. 4 C и D , комплексы E2F-DP могут активировать экспрессию репортеров, что указывает на то, что Arabidopsis E2F может правильно функционировать в гетерологичной табачной системе. Как и ожидалось, активация подавлялась, когда SNI1 коэкспрессировался с E2Fa и E2Fb.
И SNI1, и E2F высоко консервативны в растениях. Поэтому нас интересовало, подавляет ли SNI1 E2Fs у других видов растений, таких как рис ( Oryza sativa ).Как показано в приложении SI, рис. S6, Os SNI1 взаимодействовал с Os E2F1 in vivo и подавлял транскрипционную активность Os E2F1. Взятые вместе, эти результаты подтверждают, что SNI1 репрессирует транскрипционную активность E2Fs и этот механизм хорошо сохраняется у растений.
SNI1 привлекает гистоновые деацетилазы для репрессии E2F.
Предыдущие исследования показали, что потеря функции SNI1 приводит к увеличению ацетилирования гистона 3 (Ach4) (31), предполагая, что SNI1 может рекрутировать гистоновые деацетилазы (HDAC) для подавления экспрессии генов.В Arabidopsis имеется 16 HDAC (42), и мы проверили их взаимодействие с SNI1 с помощью анализов Y2H. Мы обнаружили, что HADC6 и HDAC7, которые принадлежат к классу I HDAC, могут взаимодействовать с SNI1 (Fig. 5 A ). Чтобы подтвердить их взаимодействие in vivo, мы провели анализы расщепленной люциферазы. Как и ожидалось, и HDAC6, и HDAC7 действительно могут взаимодействовать с SNI1 (Fig. 5 B ). Чтобы проверить, вносят ли HDAC6 и HDAC7 вклад в активность репрессии транскрипции SNI1, мы провели двойные люциферазные тесты.По сравнению с одним только SNI1, коэкспрессия SNI1 и HDAC6 или HDAC7 дополнительно подавляла экспрессию генов-мишеней E2F ORC1B и CDC6 (фиг. 5 C и D ). Эти результаты подтверждают идею, что SNI1 может рекрутировать HDACs для репрессии транскрипционной активности E2Fs.
Рис. 5.SNI1 рекрутирует HDAC6 и HDAC7 для репрессии транскрипционной активности E2Fs. ( A ) SNI1 взаимодействует с HDAC6 и HDAC7 в анализах Y2H. pGBKT7-53 котрансформировали с pGADT7-RecT в качестве положительного контроля, а pGBKT7-Lam котрансформировали с pGADT7-RecT в качестве отрицательного контроля.DDO, носитель с двойным выпадением (SD / -Trp / -Leu). QDO, четырехкратное выпадение (SD / -Trp / -Leu / -His / -Ade) носитель. ( B ) SNI1 взаимодействует с HADC6 и HDAC7 в анализах сплит-люциферазы. ( C и D ) Репрессионная активность SNI1 в отношении E2Fa ( C ) и E2Fb ( D ) усиливается HDAC6 и HDAC7, как показывают тесты с двойной люциферазой. В качестве репортера использовали экспрессию генов-мишеней E2Fa- и E2Fb ( ORC1B и CDC6 ). Данные представляют собой среднее значение ± стандартная ошибка трех биологических повторов ( n = 3).Статистическую значимость определяли с использованием критерия Стьюдента t . * P <0,05, ** P <0,01.
Сверхэкспрессия
SNI1 Подавляет фенотип E2Fa и DPa растений со сверхэкспрессией.Наши биохимические данные убедительно свидетельствуют о том, что SNI1 ингибирует E2Fs. Чтобы еще больше подтвердить нашу гипотезу, мы использовали генетические подходы. Предыдущие исследования показали, что совместная экспрессия E2Fa и DPa приводит к увеличению уровня эндорепликации и замедлению роста (17).Поэтому мы стремились проверить, может ли сверхэкспрессия SNI1 подавлять эти фенотипы. Мы создали трансгенные растения, сверхэкспрессирующие E2Fa , DPa и SNI1 ( 35S: E2Fa-DPa-SNI1 ) путем скрещивания гомозиготных растений 35S: E2Fa с растениями, коэкспрессирующими SNI и ( a ). : DPa-SNI1 ). Анализ qPCR подтвердил, что E2Fa , DPa или SNI1 были сверхэкспрессированы в этих растениях ( SI Приложение , рис.S7 B ). В соответствии с предыдущими исследованиями, у проростков 35S: E2Fa-DPa корни были короче, чем WT, а семядоли были скрученными и меньше (17). В отличие от этого, сеянцы 35S: E2Fa-DPa-SNI1 были аналогичны саженцам WT (рис. 6 A и B и SI, приложение , рис. S7 A ). В соответствии с длиной корня размеры корневой меристемы были уменьшены у растений 35S: E2Fa-DPa и восстановлены у растений 35S: E2Fa-DPa-SNI1 ( SI Приложение , рис.S7 C ). Мы также сравнили уровень эндорепликации у этих растений с помощью анализа проточной цитометрии. Как и ожидалось, повышенный уровень эндорепликации в 35S: E2Fa-DPa был восстановлен до уровня WT при совместной экспрессии SNI1 (рис. 6 C и SI, приложение , рис. S8). Кроме того, повышенная экспрессия генов-мишеней E2F в 35S: E2Fa-DPa также подавлялась сверхэкспрессией SNI1 (фиг. 6 D ). Эти данные предполагают, что избыточной экспрессии SNI1 достаточно для подавления функций E2Fa.
Рис. 6. Сверхэкспрессия SNI1 подавляет растения со сверхэкспрессией E2Fa и Dpa. ( A ) Фенотипы WT, E2Fa и DPa со сверхэкспрессией ( 35S: E2Fa-DPa ) и E2Fa , DPa и SNI1008 со сверхэкспрессией: СНИ1
) заводы. ( B ) Длина основных корней указанных растений. Данные представляют собой среднее значение ± стандартное отклонение ( n = 30). Статистическую значимость определяли с использованием критерия Стьюдента t .( C ) Количественный анализ данных проточной цитометрии. Данные представляют собой среднее значение ± стандартное отклонение ( n = 3). ( D ) Уровни экспрессии генов-мишеней E2F ( ORC1B , CDC6 , ORC3 и RNR ) в указанных растениях с помощью анализа qRT-PCR с использованием UBQ5 в качестве внутреннего стандарта. Данные представляют собой среднее значение ± стандартное отклонение ( n = 3). * P <0,05, ** P <0,01, *** P <0,001; нс, не имеет значения.
Потеря функции E2F Подавляет мутант
sni1 .Подобно растениям 35S: E2Fa-DPa , мутант sni1 также показал фенотип с короткими корнями (фиг. 1 A и 7 A ). Кроме того, мы обнаружили, что уровень эндорепликации в sni1 был также увеличен с помощью анализа проточной цитометрии (Рис.7 D и SI Приложение , Рис. S9), предполагая, что фенотипы в sni1 могут быть связаны с отсутствие репрессии на E2Fs со стороны SNI1.Поэтому мы проверили, может ли потеря функции E2F подавлять мутант sni1 . С этой целью мы скрестили sni1 с двойным мутантом e2fa e2fb . Однако длина корня тройного мутанта sni1 e2fa e2fb была аналогична длине корня мутанта sni1 ( SI Приложение , рис. S10). Это напомнило нам, что Arabidopsis содержит еще один канонический фактор транскрипции E2F, E2Fc. Хотя предполагалось, что E2Fc является репрессором, а E2Fa и E2Fb — активаторами (17–21), недавно было сообщено, что E2Fa, E2Fb и E2Fc функционально избыточны (43).Действительно, мы обнаружили, что SNI1 может также взаимодействовать с E2Fc в анализах расщепленной люциферазы ( SI Приложение , Fig. S11). Следовательно, SNI1 взаимодействует со всеми тремя каноническими E2F (E2Fa / b / c). Напротив, неканонические E2F (E2Fd / e / f) не взаимодействовали с SNI1 ( SI, приложение , рис. S11). Эти результаты также показали, что SNI1 взаимодействует с E2F через домен RBBD. После скрещивания sni1 с тройным мутантом e2fa e2fb e2fc мы провели генотипирование для получения мутантов высокого порядка.Как и sni1 e2fa e2fb , длина корня в sni1 e2fa e2fc и sni1 e2fb e2fc была аналогична sni1 ( SI Приложение , рис. S10). По неизвестным причинам нам не удалось получить четверной мутант sni1 e2fa e2fb e2fc . Тем не менее, мы обнаружили, что фенотип коротких корней был полностью подавлен у мутанта sni1 e2fa e2fb / + e2fc (рис. 7 A и B ). Хотя E2Fb был гетерозиготным в мутанте sni1 e2fa e2fb / + e2fc , мы не смогли обнаружить экспрессию E2Fb в мутанте ( SI Приложение , рис.S12). Неорганизованная структура корневой меристемы, повышенный уровень эндорепликации и фенотипы PCD в sni1 также были полностью подавлены у мутанта sni1 e2fa e2fb / + e2fc (рис. 7 C и D ). Взятые вместе, эти результаты подтверждают, что потеря функции E2F может подавлять дефекты мутанта sni1 .
Рис. 7.Потеря функции E2F ингибирует фенотипы мутанта sni1 . ( A ) Фенотипы WT, sni1 , sni1 e2fa e2fb / + e2fc и мутант e2fa e2fb e2fc .( B ) Длина основных корней указанных растений. Данные представляют собой среднее значение ± стандартное отклонение ( n = 30). Статистическую значимость определяли с использованием критерия Стьюдента t . *** P <0,001. ( C ) Структура корневой меристемы указанных растений. (Масштаб: A , 1 см; C , 50 мкм.) ( D ) Количественный анализ данных проточной цитометрии указанных растений. Данные представляют собой среднее значение ± стандартное отклонение ( n = 3).
Обсуждение
DDR — это фундаментальный механизм, используемый всеми организмами для поддержания стабильности генома. В ответ на повреждение ДНК клетки активируют контрольные точки, чтобы остановить развитие клеточного цикла и дать клеткам достаточно времени для восстановления ДНК. В этом исследовании мы предоставили убедительные биохимические и генетические данные, чтобы продемонстрировать, что белок репарации ДНК SNI1 является молекулярным звеном между активацией контрольной точки и репарацией ДНК ( SI Приложение , рис. S14). SNI1 взаимодействует с факторами транскрипции E2F и ингибирует их, останавливая развитие клеточного цикла.Однако как субъединица комплекса SMC5 / 6 SNI1 способствует процессу репарации повреждений ДНК. Таким образом, мы предполагаем, что SNI1 играет двойную роль в DDR, обеспечивая эффективную репарацию повреждений ДНК для поддержания стабильности генома.
У мутанта sni1 нарушены как активация контрольных точек, так и механизмы восстановления повреждений ДНК. В результате повреждение ДНК не может быть исправлено должным образом, что приводит к гибели клеток и серьезным дефектам роста у мутанта sni1 . В мутантах sni1 ssn эффективность репарации повреждений ДНК повышается за счет блокирования пути HR и стимулирования других путей репарации, таких как негомологичное соединение концов (NHEJ) (29).Однако контрольная точка все еще неисправна из-за отсутствия подавления E2F с помощью SNI1 в sni1 ssn . Следовательно, у клеток может не хватить времени на восстановление ДНК. Кроме того, вероятно, что в Arabidopsis больше потенциальных генов SSN , и нарушение нескольких генов SSN может подавлять sni1 лучше, чем один мутант ssn . Поскольку некоторые гены SSN , такие как RAD17 и RAD51 , являются генами-мишенями E2F (41), экспрессия нескольких генов SSN может быть одновременно нарушена в мутанте sni1 e2fa e2fb / + e2fc .Следовательно, как активация контрольных точек, так и механизмы репарации повреждений ДНК восстанавливаются у мутанта sni1 e2fa e2fb / + e2fc , которые согласованно вносят вклад в супрессию sni1 . Поскольку E2Fs необходимы для гибели клеток во время иммунных ответов растений (43), потеря функции E2F также может напрямую объяснять подавление гибели клеток в sni1 . Хотя мутант sni1 e2fa e2fb / + e2fc похож на WT при нормальных условиях роста, он гиперчувствителен к повреждающим ДНК агентам гидроксимочевины (вызывающей стресс репликации) и камптотецину (вызывающим двухцепочечные разрывы), что еще раз подтверждает, что SNI1 играет роль важную роль в репарации повреждений ДНК ( SI Приложение , рис.S13).
В комплексе SMC5 / 6, в то время как субъединицы SMC5, SMC6 и NSE1-NSE4 высококонсервативны у всех эукариот, NSE5 и NSE6 расходятся даже между делящимися дрожжами и почковыми дрожжами (44–46). В результате биохимических и генетических исследований SNI1 и связанный с ним белок ASAP1 были идентифицированы как первые NSE6 и NSE5 в многоклеточных организмах (29). И SNI1, и ASAP1 высоко консервативны в растениях. В нашем исследовании SNI1 риса также может взаимодействовать с E2F риса и подавлять его ( SI Приложение , рис.S6), указывая на то, что этот механизм законсервирован у растений. Хотя животные не содержат гомологов SNI1, недавно было сообщено, что SLF2 (SMC5 / 6 факторы локализации 2) является белком NSE6 в клетках человека (46). Будет интересно посмотреть, может ли SLF2 взаимодействовать с E2Fs и ингибировать их.
У эукариот шесть белков SMC (SMC1-6), которые образуют три различных комплекса и регулируют почти все аспекты биологии хромосом. Cohesin (содержащий SMC1 и SMC3) поддерживает сцепление сестринских хроматид и необходим для правильной сегрегации хромосом.Конденсин (содержащий SMC2 и SMC4) обеспечивает конденсацию хромосом. Комплекс SMC5 / 6 играет несколько важных ролей в репарации ДНК (22, 28, 47). Хотя и когезин, и конденсин также участвуют в активации checkpoint (24, 48–51), неизвестно, выполняет ли комплекс SMC5 / 6 такие функции. Недавно сообщалось, что AtMMS21, субъединица NSE2 комплекса SMC5 / 6, также регулирует клеточный цикл (52). Это исследование проверило взаимодействие между AtMMS21 и восемью регуляторами клеточного цикла (CDKA, CYCB1; 1, RBR, E2Fa, E2Fb, E2Fc, DPa и DPb) и обнаружило, что AtMMS21 взаимодействует с DPa.AtMMS21 конкурирует с E2Fa за DPa и влияет на субклеточную локализацию E2Fa / DPa. Взятые вместе с нашим исследованием, эти данные предполагают, что комплекс SMC5 / 6 также может регулировать клеточный цикл посредством множества механизмов.
RB — хорошо известный регулятор E2F как у растений, так и у животных (8⇓⇓⇓ – 12). В этом исследовании мы обнаружили, что SNI1 также является регулятором E2F. В то время как экспрессия SNI1 активируется E2F, белок SNI1 ингибирует транскрипционную активность E2F, указывая на то, что SNI1 и E2F образуют петлю отрицательной обратной связи.Интересно, что SNI1 имеет несколько схожих характеристик с RB. Во-первых, как SNI1, так и RB могут взаимодействовать с доменом RBBD E2Fs и ингибировать их транскрипционную активность (53) (рис. 3 и 4). Во-вторых, и SNI1 , и RB являются генами-мишенями для E2F (54) (рис. 2). В-третьих, ни SNI1, ни RB не обладают явной биохимической активностью (31, 53). Примечательно, что когда впервые было сообщено о SNI1, было показано, что он имеет короткий участок гомологии последовательности с белком RB мыши, хотя полноразмерная последовательность SNI1 не гомологична каким-либо известным белкам (30).Также стоит отметить, что у человека есть три белка RB. Напротив, Arabidopsis имеет только один гомолог RB, хотя у них аналогичное количество E2F (13, 15). Основываясь на этих доказательствах, возникает соблазн предположить, что SNI1 является RB-подобным белком.
Недавно две независимые исследовательские группы продемонстрировали, что RBR1 напрямую регулирует репарацию ДНК (55, 56). Мутант rbr1 является сверхчувствительным к агентам, повреждающим ДНК. RBR1 может взаимодействовать с белками репарации ДНК BRCA1 и RAD51 и может быть задействован в сайтах повреждения ДНК.Хотя эти два исследования показали, что регулятор клеточного цикла непосредственно участвует в репарации ДНК, наше исследование показало, что белок репарации ДНК принимает непосредственное участие в регуляции клеточного цикла. Таким образом, эти исследования показывают, что прямое связывание контрольных точек клеточного цикла и репарации ДНК является общим механизмом, который обеспечивает эффективную репарацию ДНК для поддержания стабильности генома. Требуются дальнейшие исследования для определения дополнительных регулирующих органов.
Материалы и методы
Материалы.
Мутант sni1 описан в ссылке.30. Линии 35S: E2Fa и 35S: DPa описаны в ссылке. 17. Тройной мутант e2fa e2fb e2fc был описан в ссылке. 43.
Методы.
АнализыY2H выполняли с использованием системы Matchmaker Gal4 Two-Hybrid (Clontech). Анализы одного гибрида дрожжей проводили с использованием системы Matchmaker Yeast One-Hybrid (Clontech). Для анализов in vitro слияния слитые белки GST очищали от Escherichia coli BL21 (DE3), а Myc-SNI1 транслировали in vitro с использованием системы экстрактов зародышей пшеницы, связанных с TNT (Promega).Анализы коиммунопреципитации проводили, как описано ранее, с некоторыми модификациями (57). Иммунопреципитацию проводили с использованием антител против Myc. Сплит-люциферазные анализы выполняли, как описано (38). Двойные люциферазные анализы выполняли, как описано (58). ChIP-анализы были выполнены, как описано ранее, с некоторыми модификациями (59). Анализ проточной цитометрии выполняли с использованием проточного цитометра BD FACS Calibur. Анализы количественной ПЦР выполняли с использованием системы обнаружения Bio-Rad CFX 96.Подробные методы описаны в Приложении SI , SI Материалы и методы .
Благодарности
Мы благодарим Ксинниан Донг, Ливен Де Вейлдер и Джона Уизерса за критическое прочтение рукописи, а также Филипа Бенфея, Шуй Ванга, И Тао, Минъи Бай и Хунтао Лю за предоставленные материалы. Работа поддержана грантами 31571253 и 31771355 Национального научного фонда Китая, грантом 2014RC004 Научно-технологического фонда самоинноваций сельскохозяйственного университета Хуачжун, грантом 2662015PY064 Центральных университетов на фундаментальные исследования и грантом «План тысячи талантов Китая для молодых специалистов». (С.Ю.).
Сноски
Автор: L.W. и С.Ю. спланированное исследование; L.W., H.C., C.W. и Z.H. проведенное исследование; L.W., H.C., C.W. и S.Y. проанализированные данные; и Л. и С.Ю. написал газету.
Авторы заявляют об отсутствии конфликта интересов.
Эта статья представляет собой прямое представление PNAS. W.G. — приглашенный редактор по приглашению редакционной коллегии.
Эта статья содержит вспомогательную информацию на сайте www.pnas.org/lookup/suppl/doi:10.1073/pnas.1720094115/-/DCSupplemental.
Ремонт дизеля, Орегон, ИЛИ — Сервис дизельного топлива
Кредит изображения: Алекс Салас / Pixabay
В последние годы в мире дизельных автомобилей произошел некоторый ренессанс. Отчасти привлекательность дизельного двигателя заключается в его долговечности, поскольку автомобили с дизельным двигателем часто проезжают сотни тысяч миль. Другая часть привлекательности — исключительная экономия топлива, которая может сэкономить водителям Орегона сотни долларов в год.Когда дело доходит до ремонта дизельного топлива в Орегон-Сити, никто не может превзойти уровень обслуживания, который вы найдете в Checkpoint Motors.
Ремонт двигателя Powerstroke Oregon
Неважно, почему вы купили дизель или почему вы предпочитаете этот тип двигателя. Когда вам нужен ремонт или обслуживание, вам понадобится опытный механик в вашем углу, и это именно то, что вы получите, когда придете в Checkpoint Motors. Мы — ваши эксперты по дизельным двигателям, и вы можете положиться на нас в вопросах качественного обслуживания и длительного ремонта вашего автомобиля.
Зимняя служба
Как житель района Орегон-Сити, вы знаете, как холодно здесь, и как эти резкие перепады температур могут сказаться на вашем дизельном двигателе. Когда лето подходит к концу и начинается осень, самое время подготовить дизельный двигатель к приближающейся суровой зиме.
Подготовка к зиме — большая проблема для жителей штата Орегон, и компания Checkpoint Motors очень серьезно относится к ней. Если вам нужно подготовить свой дизельный автомобиль к зиме, самое время действовать.
Проверьте свечи накаливания сейчас
Вы полагаетесь на свои свечи накаливания, чтобы обеспечить легкий запуск в течение всего года, но когда вы в последний раз проверяли эти свечи накаливания? Даже самые прочные свечи накаливания не прослужат вечно, и вам не захочется ждать самого холодного дня в году, чтобы обнаружить, что ваши свечи нуждаются в обслуживании.
В Checkpoint Motors мы можем проверить ваши свечи накаливания и при необходимости дать рекомендации по замене. Проверка свечей накаливания сейчас даст вам душевное спокойствие позже, и сейчас идеальное время для планирования этого жизненно важного обслуживания дизельного транспортного средства.
Регулярное техническое обслуживание для продления срока службы дизельного двигателя
О долговечности дизельного двигателя ходят легенды, и этот долгий срок службы двигателя — большая часть его привлекательности. Существует множество историй о дизельных двигателях, которые работают на полмиллиона миль и более, и эти истории не так уж необычны.
Все эти долговечные дизельные двигатели объединяет то, что их владельцы хорошо о них заботятся. Если вы хотите, чтобы ваш собственный дизель продолжал работать, вам нужно правильно с ним обращаться.
Ремонт грузовиков рядом со мной
В Checkpoint Motors мы можем составить график профилактического обслуживания для вашего дизельного автомобиля или грузовика, включая замену масла, ротацию шин и другие важные услуги. Просто позвоните нам или зайдите, чтобы позаботиться о вашем ремонте и обслуживании дизельного топлива в городе Орегон.
контрольных точек клеточного цикла | Биология для майоров I
Определите и объясните важные контрольные точки, через которые проходит клетка во время клеточного цикла
Как мы только что узнали, клеточный цикл — довольно сложный процесс.Чтобы убедиться, что все идет правильно, в цикле есть контрольные точки. Давайте узнаем об этом и о том, как они помогают контролировать клеточный цикл.
Цели обучения
- Определите важные контрольные точки в делении клеток
- Объясните, как ошибки в делении клеток связаны с раком
Длина клеточного цикла сильно варьируется даже внутри клеток одного организма. У людей частота обновления клеток колеблется от нескольких часов на раннем этапе эмбрионального развития до в среднем от двух до пяти дней для эпителиальных клеток и до всей жизни человека, проведенной в G 0 специализированными клетками, такими как корковые нейроны. или клетки сердечной мышцы.Также существует вариация времени, которое клетка проводит в каждой фазе клеточного цикла. Когда быстро делящиеся клетки млекопитающих выращивают в культуре (вне тела при оптимальных условиях роста), продолжительность цикла составляет около 24 часов. В быстро делящихся человеческих клетках с 24-часовым клеточным циклом фаза G 1 длится примерно девять часов, фаза S длится 10 часов, фаза G 2 длится примерно четыре с половиной часа, а фаза M длится примерно четыре с половиной часа. длится примерно полчаса.У ранних эмбрионов плодовых мушек клеточный цикл завершается примерно за восемь минут. Время событий клеточного цикла контролируется механизмами, которые являются как внутренними, так и внешними по отношению к клетке.
Регуляция клеточного цикла внешними событиями
И инициация, и ингибирование клеточного деления запускаются внешними по отношению к клетке событиями, когда она собирается начать процесс репликации. Событие может быть таким простым, как смерть соседней клетки, или столь же масштабным, как выброс гормонов, способствующих росту, таких как гормон роста человека (HGH).Недостаток гормона роста может подавлять деление клеток, приводя к карликовости, тогда как избыток гормона роста может привести к гигантизму. Скученность клеток также может препятствовать делению клеток. Другой фактор, который может инициировать деление клетки, — это размер клетки; по мере роста клетки она становится неэффективной из-за уменьшения отношения поверхности к объему. Решение этой проблемы — разделить.
Независимо от источника сообщения, ячейка получает сигнал, и серия событий внутри ячейки позволяет ей перейти в промежуточную фазу.Двигаясь вперед от этой начальной точки, все параметры, требуемые во время каждой фазы клеточного цикла, должны быть соблюдены, иначе цикл не может продолжаться.
Правила на внутренних контрольно-пропускных пунктах
Важно, чтобы продуцируемые дочерние клетки были точными дубликатами родительской клетки. Ошибки в дупликации или распределении хромосом приводят к мутациям, которые могут передаваться каждой новой клетке, полученной из аномальной клетки. Чтобы предотвратить дальнейшее деление скомпрометированной клетки, существуют механизмы внутреннего контроля, которые работают в трех основных контрольных точках клеточного цикла.Контрольная точка — это одна из нескольких точек в цикле эукариотической клетки, в которой переход клетки к следующей стадии цикла может быть остановлен до тех пор, пока условия не станут благоприятными. Эти контрольные точки возникают ближе к концу G 1 , на переходе G 2 / M и во время метафазы (рисунок 1).
Рисунок 1. Клеточный цикл контролируется на трех контрольных точках. Целостность ДНК оценивается на контрольно-пропускном пункте G 1 . Правильная дупликация хромосом оценивается на контрольной точке G 2 .Присоединение каждой кинетохоры к волокну веретена оценивается в контрольной точке M.
G
1 Контрольно-пропускной пунктКонтрольная точка G 1 определяет, все ли условия благоприятны для продолжения деления клеток. Контрольная точка G 1 , также называемая точкой ограничения (у дрожжей), является точкой, в которой клетка необратимо присоединяется к процессу клеточного деления. Внешние воздействия, такие как факторы роста, играют большую роль в переносе клетки через контрольную точку G 1 .Помимо адекватных резервов и размера клеток, на контрольно-пропускном пункте G 1 проводится проверка на повреждение геномной ДНК. Ячейка, не отвечающая всем требованиям, не сможет перейти в фазу S. Ячейка может остановить цикл и попытаться исправить проблемное состояние, или ячейка может перейти в G 0 и ожидать дальнейших сигналов, когда условия улучшатся.
G
2 Контрольно-пропускной пунктКонтрольная точка G 2 блокирует вход в митотическую фазу, если не выполняются определенные условия.На контрольно-пропускном пункте G 1 оценивается размер клеток и запасы белка. Однако наиболее важная роль контрольной точки G 2 — гарантировать, что все хромосомы реплицированы и реплицируемая ДНК не повреждена. Если механизмы контрольной точки обнаруживают проблемы с ДНК, клеточный цикл останавливается, и клетка пытается либо завершить репликацию ДНК, либо восстановить поврежденную ДНК.
Контрольно-пропускной пункт M
Контрольная точка M возникает ближе к концу метафазной стадии кариокинеза.Контрольная точка M также известна как контрольная точка веретена, потому что она определяет, все ли сестринские хроматиды правильно прикреплены к микротрубочкам веретена. Поскольку разделение сестринских хроматид во время анафазы является необратимым этапом, цикл не будет продолжаться до тех пор, пока кинетохоры каждой пары сестринских хроматид не будут прочно закреплены по крайней мере на двух веретенообразных волокнах, выходящих из противоположных полюсов клетки.
Посмотрите, что происходит в контрольных точках G 1 , G 2 и M, загрузив эту анимацию клеточного цикла.Регулятор молекул клеточного цикла
В дополнение к внутренне контролируемым контрольным точкам есть две группы внутриклеточных молекул, которые регулируют клеточный цикл. Эти регуляторные молекулы либо способствуют переходу клетки к следующей фазе (позитивная регуляция), либо останавливают цикл (негативная регуляция). Молекулы-регуляторы могут действовать индивидуально или влиять на активность или продукцию других регуляторных белков. Следовательно, отказ одного регулятора может почти не повлиять на клеточный цикл, особенно если одно и то же событие контролируется несколькими механизмами.И наоборот, действие недостаточного или нефункционирующего регулятора может быть широкомасштабным и, возможно, фатальным для клетки, если затронуты несколько процессов.
Положительная регуляция клеточного цикла
Две группы белков, называемые циклинами и циклинзависимыми киназами (Cdks), отвечают за прохождение клетки через различные контрольные точки. Уровни четырех циклиновых белков колеблются на протяжении клеточного цикла предсказуемым образом (рис. 2). Повышение концентрации циклиновых белков вызывается как внешними, так и внутренними сигналами.После того, как клетка переходит на следующую стадию клеточного цикла, циклины, которые были активны на предыдущей стадии, разлагаются.
Рисунок 2. Концентрации циклиновых белков изменяются на протяжении клеточного цикла. Существует прямая корреляция между накоплением циклина и тремя основными контрольными точками клеточного цикла. Также обратите внимание на резкое снижение уровней циклина после каждой контрольной точки (переход между фазами клеточного цикла), поскольку циклин разрушается цитоплазматическими ферментами. (кредит: модификация работы «WikiMiMa» / Wikimedia Commons)
Циклины регулируют клеточный цикл только тогда, когда они прочно связаны с Cdks.Чтобы быть полностью активным, комплекс Cdk / cyclin также должен фосфорилироваться в определенных местах. Как и все киназы, Cdks представляют собой ферменты (киназы), которые фосфорилируют другие белки. Фосфорилирование активирует белок, изменяя его форму. Белки, фосфорилируемые Cdks, участвуют в продвижении клетки к следующей фазе (рис. 3). Уровни белков Cdk относительно стабильны на протяжении клеточного цикла; однако концентрации циклина колеблются и определяют, когда образуются комплексы Cdk / циклин.Различные циклины и Cdks связываются в определенных точках клеточного цикла и, таким образом, регулируют разные контрольные точки.
Рисунок 3. Циклинзависимые киназы (Cdks) — это протеинкиназы, которые при полной активации могут фосфорилировать и, таким образом, активировать другие белки, которые продвигают клеточный цикл мимо контрольной точки. Чтобы стать полностью активированным, Cdk должен связываться с белком циклина, а затем фосфорилироваться другой киназой.
Поскольку циклические колебания уровней циклина основаны на времени клеточного цикла, а не на конкретных событиях, регуляция клеточного цикла обычно происходит либо с помощью одних молекул Cdk, либо комплексов Cdk / циклин.Без определенной концентрации полностью активированных комплексов циклин / Cdk клеточный цикл не может проходить через контрольные точки.
Хотя циклины являются основными регуляторными молекулами, которые определяют поступательный импульс клеточного цикла, существует несколько других механизмов, которые регулируют ход цикла с отрицательными, а не положительными эффектами. Эти механизмы по существу блокируют развитие клеточного цикла до тех пор, пока не будут устранены проблемные условия. Молекулы, препятствующие полной активации Cdk, называются ингибиторами Cdk.Многие из этих молекул-ингибиторов прямо или косвенно контролируют конкретное событие клеточного цикла. Блок, помещенный на Cdks молекулами ингибитора, не будет удален до тех пор, пока не будет выполнено определенное событие, которое отслеживает ингибитор.
Отрицательная регуляция клеточного цикла
Вторая группа регуляторных молекул клеточного цикла — негативные регуляторы. Отрицательные регуляторы останавливают клеточный цикл. Помните, что при положительном регулировании активные молекулы заставляют цикл прогрессировать.
Наиболее изученными негативными регуляторными молекулами являются белок ретинобластомы (Rb), p53 и p21.Белки ретинобластомы представляют собой группу белков-супрессоров опухолей, распространенных во многих клетках. Обозначения 53 и 21 относятся к функциональным молекулярным массам белков (p) в килодальтонах. Многое из того, что известно о регуляции клеточного цикла, получено в результате исследований, проведенных с клетками, утратившими регуляторный контроль. Было обнаружено, что все три из этих регуляторных белков повреждены или нефункциональны в клетках, которые начали бесконтрольно реплицироваться (стали злокачественными). В каждом случае основной причиной неконтролируемого прохождения клеточного цикла была неправильная копия регуляторного белка.
Rb, p53 и p21 действуют в первую очередь на контрольную точку G 1 . p53 — это многофункциональный белок, который оказывает большое влияние на приверженность клетки к делению, потому что он действует, когда есть поврежденная ДНК в клетках, которые подвергаются подготовительным процессам во время G 1 . Если обнаружена поврежденная ДНК, p53 останавливает клеточный цикл и привлекает ферменты для восстановления ДНК. Если ДНК не может быть восстановлена, p53 может вызвать апоптоз или самоубийство клетки, чтобы предотвратить дублирование поврежденных хромосом.По мере повышения уровня p53 запускается производство p21. p21 обеспечивает остановку цикла, диктуемого p53, путем связывания и ингибирования активности комплексов Cdk / циклин. По мере того, как клетка подвергается большему стрессу, накапливаются более высокие уровни p53 и p21, что снижает вероятность перехода клетки в S-фазу.
Rb оказывает свое регулирующее влияние на другие положительные белки-регуляторы. В основном Rb контролирует размер ячейки. В активном дефосфорилированном состоянии Rb связывается с белками, называемыми факторами транскрипции, чаще всего с E2F (рис. 4).Факторы транскрипции «включают» определенные гены, позволяя производить белки, кодируемые этим геном. Когда Rb связан с E2F, производство белков, необходимых для перехода G 1 / S, блокируется. По мере увеличения размера клетки Rb медленно фосфорилируется, пока не станет инактивированным. Rb высвобождает E2F, который теперь может включать ген, продуцирующий переходный белок, и этот конкретный блок снимается. Чтобы клетка прошла через каждую из контрольных точек, все положительные регуляторы должны быть «включены», а все отрицательные регуляторы должны быть «выключены».”
Практический вопрос
Рис. 4. Rb останавливает клеточный цикл и освобождает его в ответ на рост клеток.
Rb и другие белки, негативно регулирующие клеточный цикл, иногда называют супрессорами опухолей. Как вы думаете, почему для этих белков подходит название «опухолевый супрессор»?
Показать ответRb и другие негативные регуляторные белки контролируют деление клеток и, следовательно, предотвращают образование опухолей. Мутации, мешающие этим белкам выполнять свои функции, могут привести к раку.
Рак и клеточный цикл
Рак включает множество различных заболеваний, вызываемых общим механизмом: неконтролируемым ростом клеток. Несмотря на избыточность и перекрывающиеся уровни контроля клеточного цикла, ошибки все же возникают. Одним из критических процессов, контролируемых механизмом контроля контрольных точек клеточного цикла, является правильная репликация ДНК во время S-фазы. Даже когда все элементы управления клеточным циклом полностью функциональны, небольшой процент ошибок репликации (мутаций) передается дочерним клеткам.Если изменения в нуклеотидной последовательности ДНК происходят в кодирующей части гена и не исправляются, возникает мутация гена. Все виды рака начинаются, когда мутация гена приводит к образованию дефектного белка, который играет ключевую роль в воспроизводстве клеток. Изменение в клетке, которое является результатом неправильного белка, может быть незначительным: возможно, небольшая задержка в связывании Cdk с циклином или Rb-белком, который отделяется от своей целевой ДНК, но все еще фосфорилирован. Однако даже незначительные ошибки могут способствовать более быстрому возникновению последующих ошибок.Снова и снова небольшие неисправленные ошибки передаются от родительской клетки к дочерним клеткам и усиливаются по мере того, как каждое поколение производит больше нефункциональных белков из-за неисправленных повреждений ДНК. В конце концов, скорость клеточного цикла увеличивается, поскольку эффективность механизмов контроля и восстановления снижается. Неконтролируемый рост мутировавших клеток опережает рост нормальных клеток в этой области, что может привести к опухоли (~ oma ).
Протоонкогены
Гены, кодирующие положительные регуляторы клеточного цикла, называются протоонкогенами .Протоонкогены — это нормальные гены, которые при определенных мутациях становятся онкогенами , генами, которые приводят к тому, что клетка становится злокачественной. Подумайте, что может произойти с клеточным циклом в клетке с недавно приобретенным онкогеном. В большинстве случаев изменение последовательности ДНК приводит к менее функциональному (или нефункциональному) белку. Результат пагубен для клетки и, вероятно, помешает клетке завершить клеточный цикл; тем не менее, организм не пострадает, потому что мутация не будет перенесена.Если клетка не может воспроизводиться, мутация не распространяется и ущерб минимален. Однако иногда мутация гена вызывает изменение, которое увеличивает активность положительного регулятора. Например, мутация, которая позволяет активировать Cdk без партнерства с циклином, может подтолкнуть клеточный цикл за контрольную точку до того, как будут выполнены все необходимые условия. Если полученные дочерние клетки будут слишком повреждены, чтобы подвергнуться дальнейшим клеточным делениям, мутация не будет распространяться, и организму не будет нанесен вред.Однако, если атипичные дочерние клетки способны подвергаться дальнейшим клеточным делениям, последующие поколения клеток, вероятно, будут накапливать еще больше мутаций, возможно, в дополнительных генах, регулирующих клеточный цикл.
Ген Cdk в приведенном выше примере — только один из многих генов, которые считаются протоонкогенами. Помимо белков, регулирующих клеточный цикл, любой белок, влияющий на цикл, может быть изменен таким образом, чтобы перекрыть контрольные точки клеточного цикла. Онкоген — это любой ген, изменение которого приводит к увеличению скорости развития клеточного цикла.
Гены-супрессоры опухоли
Подобно протоонкогенам, многие из негативных регуляторных белков клеточного цикла были обнаружены в клетках, ставших злокачественными. Гены-супрессоры опухоли представляют собой сегменты ДНК, которые кодируют белки-негативные регуляторы, тип регуляторов, которые при активации могут предотвращать неконтролируемое деление клетки. Коллективная функция наиболее изученных белков гена-супрессора опухолей, Rb, p53 и p21, состоит в том, чтобы создать препятствие на пути развития клеточного цикла до тех пор, пока не завершатся определенные события.Клетка, несущая мутированную форму негативного регулятора, может быть не в состоянии остановить клеточный цикл, если возникнет проблема. Подавители опухолей похожи на тормоза в автомобиле: неисправные тормоза могут способствовать автомобильной аварии.
Мутировавшие гены р53 были идентифицированы более чем в половине всех опухолевых клеток человека. Это открытие неудивительно в свете множества ролей, которые белок p53 играет в контрольной точке G 1 . Клетка с дефектным p53 может не обнаружить ошибки, присутствующие в геномной ДНК (рис. 5).Даже если частично функциональный p53 действительно идентифицирует мутации, он больше не может сигнализировать о необходимых ферментах репарации ДНК. В любом случае поврежденная ДНК останется неисправленной. На этом этапе функциональный p53 будет считать клетку не подлежащей спасению и запускать запрограммированную смерть клетки (апоптоз). Однако поврежденная версия p53, обнаруженная в раковых клетках, не может запускать апоптоз.
Рис. 5. Роль нормального p53 — контролировать ДНК и снабжение кислородом (гипоксия — это состояние пониженного снабжения кислородом).Если обнаружено повреждение, p53 запускает механизмы репарации. Если восстановление безуспешно, p53 сигнализирует об апоптозе. Клетка с аномальным белком p53 не может восстанавливать поврежденную ДНК и, следовательно, не может сигнализировать об апоптозе. Клетки с аномальным p53 могут стать злокачественными. (кредит: модификация работы Тьерри Сусси)
Утрата функции p53 имеет другие последствия для клеточного цикла. Мутировавший p53 может потерять способность запускать производство p21. Без адекватного уровня p21 нет эффективного блокирования активации Cdk.По сути, без полностью функционального p53 контрольная точка G 1 серьезно нарушена, и клетка переходит прямо из G 1 в S независимо от внутренних и внешних условий. По завершении этого укороченного клеточного цикла образуются две дочерние клетки, унаследовавшие мутировавший ген p53. Учитывая неоптимальные условия, в которых воспроизводилась родительская клетка, вполне вероятно, что дочерние клетки приобретут другие мутации в дополнение к дефектному гену-супрессору опухоли.Клетки, такие как эти дочерние клетки, быстро накапливают как онкогены, так и нефункциональные гены-супрессоры опухолей. И снова результат — рост опухоли.
В этом видео рассматривается, как рак является побочным продуктом нарушенной репликации ДНК:
Вкратце: контрольные точки клеточного цикла
Каждый этап клеточного цикла контролируется внутренними средствами контроля, называемыми контрольными точками. В клеточном цикле есть три основных контрольных точки: одна ближе к концу G 1 , вторая на переходе G 2 / M и третья во время метафазы.Положительные молекулы регулятора позволяют клеточному циклу перейти к следующей стадии. Отрицательные молекулы регулятора контролируют клеточные условия и могут останавливать цикл до тех пор, пока не будут выполнены определенные требования.
Рак — результат неконтролируемого деления клеток, вызванного нарушением механизмов, регулирующих клеточный цикл. Утрата контроля начинается с изменения последовательности ДНК гена, который кодирует одну из регуляторных молекул. Неправильные инструкции приводят к тому, что белок не функционирует должным образом.Любое нарушение работы системы мониторинга может привести к передаче дочерним клеткам других ошибок. Каждое последующее деление клеток приводит к появлению дочерних клеток с еще большим накопленным повреждением. В конце концов, все контрольные точки перестают функционировать, и быстро воспроизводящиеся клетки вытесняют нормальные клетки, что приводит к опухоли или лейкемии (раку крови).
Проверьте свое пониманиеОтветьте на вопросы ниже, чтобы увидеть, насколько хорошо вы понимаете темы, затронутые в предыдущем разделе.В этой короткой викторине , а не засчитываются в вашу оценку в классе, и вы можете пересдавать ее неограниченное количество раз.
Используйте этот тест, чтобы проверить свое понимание и решить, следует ли (1) изучить предыдущий раздел дальше или (2) перейти к следующему разделу.
Реагирование на повреждение ДНК: R&D Systems
Впервые напечатано в R&D Systems 2003 Каталог
Содержание
Введение
Поддержание целостности и точности генома важно для правильного функционирования и выживания всех организмов.Эта задача особенно сложна из-за постоянного воздействия на ДНК генотоксических агентов (как эндогенных, так и экзогенных), неправильного включения нуклеотидов во время репликации ДНК и внутренней биохимической нестабильности самой ДНК. 1
Неспособность восстановить повреждения ДНК может привести к блокировке транскрипции и репликации, мутагенезу и / или клеточной цитотоксичности. 2 Было показано, что у людей повреждение ДНК участвует в различных генетически наследуемых нарушениях, в старении, 3 и в канцерогенезе. 4, 5
| Рисунок 1. Ответ на повреждение ДНК. Повреждение ДНК вызывается множеством источников. Клеточный ответ на повреждение может включать активацию контрольной точки клеточного цикла, начало транскрипционных программ, выполнение репарации ДНК или, когда повреждение является серьезным, инициирование апоптоза. |
Все эукариотические клетки развили многогранный ответ, чтобы противодействовать потенциально пагубным эффектам повреждения ДНК (Рисунок 1). 2 При обнаружении повреждения ДНК или остановки репликации активируются контрольные точки клеточного цикла, чтобы остановить развитие клеточного цикла, чтобы дать время для восстановления до того, как повреждение передается дочерним клеткам. Помимо активации контрольной точки, реакция на повреждение ДНК приводит к индукции транскрипционных программ, усилению путей репарации ДНК и, когда уровень повреждения серьезный, к инициированию апоптоза. 6 Все эти процессы тщательно координируются, так что генетический материал точно сохраняется, дублируется и разделяется внутри клетки.
Контрольные точки клеточного цикла
Контрольные точки клеточного цикла — это регуляторные пути, которые регулируют порядок и время переходов клеточного цикла, чтобы гарантировать завершение одного клеточного события до начала другого. Ключевыми регуляторами путей контрольных точек в ответе на повреждение ДНК млекопитающих являются протеинкиназы ATM (атаксия телеангиэктазии, мутированные) и ATR (связанные с ATM и Rad3). Оба эти белка принадлежат к уникальному по структуре семейству серин-треониновых киназ, характеризующемуся С-концевым каталитическим мотивом, содержащим домен фосфатидилинозитол-3-киназы. 7, 8 Хотя ATM и ATR, по-видимому, фосфорилируют многие из одних и тех же клеточных субстратов, 9 они обычно отвечают на различные типы повреждений ДНК. ATM — это первичный медиатор реакции на двухцепочечные разрывы ДНК (DSB), которые могут возникать при воздействии ионизирующего излучения (IR). ATR, с другой стороны, играет только резервную роль в ответе DSB, но направляет основной ответ на УФ-повреждение и останавливает репликацию ДНК.
| Рисунок 2. Пути контрольных точек клеточного цикла млекопитающих. В ответ на повреждение ДНК ATM и / или ATR запускают активацию контрольной точки, которая приводит к остановке или задержке клеточного цикла. Пути контрольных точек характеризуются каскадами событий фосфорилирования белков (обозначенных буквой «P»), которые изменяют активность, стабильность или локализацию модифицированных белков. Указан общий обзор путей контрольных точек клеточного цикла G1, S и G2 (левая, центральная и правая панели соответственно). Дополнительную информацию см. В основном тексте. |
КПП G1
Контрольная точка клеточного цикла G1 предотвращает репликацию поврежденной ДНК и является наиболее понятной контрольной точкой в клетках млекопитающих (рис. 2). 10 Центральным элементом этой контрольной точки является накопление и активация белка p53; два свойства, тщательно контролируемые киназами ATM и ATR. В нормально растущих клетках уровни p53 низкие из-за взаимодействия с MDM2, который нацелен на p53 для ядерного экспорта и опосредованной протеосомами деградации в цитоплазме. 11 После повреждения IR, ATM активирует нижестоящую киназу Chk2 (путем фосфорилирования в положении T68), 12 , которая, в свою очередь, фосфорилирует остаток S20 р53. Фосфорилирование р53 по S20 блокирует взаимодействие р53 / MDM2, что приводит к накоплению р53. ATM оказывает вторую меру контроля стабильности p53, напрямую фосфорилируя отрицательный регулятор p53, MDM2, на S395. 13 Эта модификация допускает взаимодействие MDM2 / p53, но предотвращает ядерный экспорт p53 в цитоплазму, где обычно происходит деградация.Роль ATR в фосфорилировании p53 S20 (и последующей стабилизации) менее точно установлена, но подразумевается посредством in vitro доказательств, демонстрирующих фосфорилирование S20 с помощью ATR-зависимой киназы Chk1. 14
Хотя фосфорилирование S20 важно для стабильности p53, именно фосфорилирование S15, по-видимому, имеет решающее значение для усиления активности транскрипционной трансактивации p53. 15 Остаток S15 р53 может фосфорилироваться непосредственно с помощью ATM или ATR в ответ на IR (ATM и ATR), УФ-облучение (ATR) и остановку вилок репликации ДНК (ATR).Затем активированный p53 активирует ряд генов-мишеней, некоторые из которых также участвуют в ответе на повреждение ДНК (MDM2, GADD45a и p21 / Cip). Накопление p21, ингибитора циклин-зависимой киназы, подавляет активность киназы Cyclin E / Cdk2, что приводит к остановке G1 (см. Ссылку 10 и ссылки в ней).
КПП S-фазы
Контрольная точка S-фазы отслеживает развитие клеточного цикла и снижает скорость синтеза ДНК после повреждения ДНК. Хотя этот путь является наименее изученным из контрольных точек млекопитающих, недавние исследования IR-индуцированной активации контрольных точек S-фазы начинают давать важную информацию.Клетки предрасположенных к раку людей, страдающих атаксией телеангиэктазией (AT) или синдромом разрыва Неймегена (NBS), не могут замедлить скорость репликации ДНК после воздействия инфракрасного излучения; явление, известное как синтез радиоустойчивой ДНК (RDS). Это открытие предполагает участие ассоциированных генных продуктов (ATM и NBS1, соответственно) в пути контрольной точки S-фазы. Экспериментальные данные показывают, что повреждение IR активирует контрольную точку S-фазы как минимум через 2 параллельные ветви, каждая из которых регулируется банкоматом. 16, 17, 18 В первой ветви повреждение IR индуцирует фосфорилирование киназы Chk2 (на T68) с помощью ATM. 19 Chk2, однажды активированный, нацелен на фосфатазу Cdc25A для убиквитин-зависимой деградации, фосфорилируя ее на S123. 19 Результирующая дестабилизация Cdc25A не позволяет ему выполнять свою нормальную функцию удаления ингибирующего фосфорилирования (T14 и Y15) из Cdk2. Комплексы Cdk2 / Cyclin E и Cdk2 / Cyclin A остаются неактивными, препятствуя завершению синтеза ДНК.
Вторая ветвь пути IR-индуцированной контрольной точки S-фазы не зависит от Cdc25A, но требует активности как ATM, так и NBS1. 16, 17, 18 При повреждении IR ATM фосфорилирует ряд нижестоящих субстратов, включая NBS1 (на нескольких сайтах, включая S343), продукт гена 1 предрасположенности к раку груди (BRCA1; на нескольких сайтах, включая S1387) и SMC1 (структурное поддержание белка хромосомы 1; на S957 и S966).Потеря любого из этих белков или мутация указанных сайтов фосфорилирования приводит к ослаблению активации контрольной точки S-фазы. 16, 17, 18, 20 Интересно, что белки NBS1 и BRCA1 необходимы для оптимального фосфорилирования SMC1 при IR, 17, 18 , возможно, предполагая, что перед ATM может фосфорилировать SMC1. Действительно, было показано, что белки ATM, NBS1 и BRCA1 являются частью белкового комплекса мегадальтонного размера, называемого BASC (BRCA1-ассоциированный комплекс надзора за геномом), который также включает множество других факторов репарации и репликации ДНК. 21 Точные роли этих белков и механистические детали того, как активация этой ветви контрольной точки S-фазы приводит к снижению синтеза ДНК, еще предстоит выяснить.
Участие ATR в контрольной точке S-фазы также остается относительно неясным. Было показано, что ATR инициирует медленный IR-индуцированный ответ контрольной точки S-фазы путем фосфорилирования своей эффекторной киназы Chk1 (на S317 и S345), которая, в свою очередь, фосфорилирует Cdc25A, направляя его на деградацию. 22 Кроме того, SMC1 подвергается фосфорилированию S957 и S966 при УФ-облучении или обработке гидроксимочевиной независимо от ATM. 18 Продемонстрированная чувствительность ATR к УФ-повреждению и блокам репликации делает его основным подозреваемым в фосфорилировании SMC1 в этих условиях, однако экспериментальные доказательства отсутствуют. Кроме того, сообщалось о дополнительном пути контрольной точки S-фазы, направленном на ATR, для борьбы с УФ-повреждением и ошибками репликации. 7
КПП G2
Контрольная точка клеточного цикла G2 является важной мерой контроля, которая позволяет приостановить клеточный цикл до сегрегации хромосом.Вступление в митоз контролируется активностью циклинзависимой киназы Cdc2. 23 Поддержание ингибирующего фосфорилирования на Cdc2 (на T14 и Y15) важно для активации контрольной точки G2. ATM и ATR косвенно модулируют статус фосфорилирования этих сайтов в ответ на повреждение ДНК. В отличие от других контрольных точек, ответ на IR в основном опосредуется ATR 24 , при этом ATM играет роль резервного; реакция на УФ-повреждение и блоки репликации контролируются ATR.Следует отметить, что стадия клеточного цикла, когда происходит повреждение ДНК, может влиять на то, опосредуется ли ответ через ATR или ATM. 7 В любом случае, при повреждении ДНК, расположенные ниже киназы Chk1 и Chk2 (активируемые ATR- и ATM-зависимым фосфорилированием, соответственно) фосфорилируют фосфатазу двойной специфичности Cdc25C в положении S216. 25 Фосфорилирование этого остатка создает сайт связывания для белков 14-3-3. Белковые комплексы 14-3-3 / Cdc25C изолируются в цитоплазме, тем самым предотвращая активацию Cdc25C Cdc2 за счет удаления фосфорилирования, ингибирующего T14 и Y15.Это приводит к поддержанию комплекса Cdc2 / Cyclin B1 в его неактивном состоянии и блокированию входа в митоз.
Пути восстановления ДНК
Прямое обращение Простейший из путей репарации ДНК человека включает прямое обращение высокомутагенного повреждения алкилирования O 6 -метилгуанин (O 6 -mG) продуктом гена MGMT (O 6 — метилгуанин-ДНК-метилтрансфераза). 26 Аддукт O 6 -мг образуется в низких количествах в результате реакции клеточных катаболитов с остатками гуанина в ДНК. 27 Коррекция поражения происходит путем прямого переноса алкильной группы гуанина на остаток цистеина в активном центре MGMT в «суицидной» реакции. Затем инактивированный белок алкил-MGMT расщепляется по АТФ-зависимому протеолитическому пути убиквитина. 28 Этот энергозатратный механизм восстановления для коррекции относительно простого алкил-аддукта подразумевает, что O 6 -mG чрезвычайно вреден для клетки. Соответственно, был разработан ряд химиотерапевтических агентов, которые атакуют положение гуанина O 6 , и они сейчас используются в клинической практике. 29
BER эксцизионная репарация оснований (BER) — это многоэтапный процесс, который корректирует незначительные повреждения оснований, возникающие в результате окисления, метилирования, дезаминирования или спонтанной потери самой основы ДНК. 30 Эти изменения, хотя и являются простыми по своей природе, обладают сильным мутагенным действием и поэтому представляют значительную угрозу точности и стабильности генома. 2
| Рис. 3. Базовое эксцизионное восстановление (BER).Показана общая модель короткого (слева) и длинного (справа) путей BER. Ремонт короткого пятна заменяет поражение одним нуклеотидом; Ремонт длинного пластыря заменяет повреждение примерно на 2-10 нуклеотидов. Дополнительную информацию см. В основном тексте. |
BER имеет два подпути (рис. 3), оба из которых инициируются действием ДНК-гликозилазы, которая расщепляет N-гликозидную связь между поврежденным основанием и сахарофосфатным остовом ДНК.Это расщепление генерирует апиримидиновый / апуриновый (AP) или базовый сайт в ДНК. У человека было идентифицировано восемь ДНК-гликозилаз с частично перекрывающейся специфичностью по аддукту оснований. 31 Альтернативно, AP-сайты также могут возникать в результате спонтанного гидролиза N-гликозидной связи. В любом случае AP-сайт впоследствии обрабатывается AP-эндонуклеазой 1 (APE1), которая расщепляет фосфодиэфирный остов сразу на 5′-направлении от AP-сайта, что приводит к 3′-гидроксильной группе и временному 5′-базовому дезоксирибозофосфату (dRP).Удаление dRP может осуществляться под действием ДНК-полимеразы бета (Pol b), которая добавляет один нуклеотид к 3′-концу ника и удаляет фрагмент dRP за счет связанной с ним активности AP-лиазы. 32 Разрыв цепи окончательно запечатывается ДНК-лигазой, таким образом восстанавливается целостность ДНК. Замена поврежденного основания одним новым нуклеотидом, как описано выше, называется репарацией «коротким пятном» и составляет примерно 80-90% всей BER.
Резервный путь BER, называемый репарацией «длинным участком», используется, когда в ДНК присутствует модифицированное основание, устойчивое к активности AP-лиазы ДНК Pol beta. 33 Репарация с длинными участками приводит к замене примерно 2-10 нуклеотидов, включая поврежденное основание. Этот подпути требует многих из тех же факторов, которые участвуют в репарации коротких участков, включая ДНК-гликозилазу, APE1 и ДНК Pol beta. Однако, в отличие от репарации коротким участком, репарация длинным участком является PCNA-зависимым путем, 34 , где ДНК-полимераза (бета-d, дзета-р-эпсилон) добавляет несколько нуклеотидов к репарационной щели, таким образом вытесняя dRP как часть » лоскут «олигонуклеотид.Образующийся олигонуклеотидный выступ вырезается эндонуклеазой Flap FEN-1 перед герметизацией разрыва ДНК-лигазой.
NER Эксцизионная репарация нуклеотидов (NER), возможно, является наиболее гибким из путей репарации ДНК, учитывая разнообразие повреждений ДНК, на которые она воздействует. Наиболее значительными из этих повреждений являются димеры пиримидина (димеры циклобутан-пиримидина и 6-4 фотопродуктов), вызванные УФ-составляющей солнечного света. Другие субстраты NER включают объемные химические аддукты, внутрицепочечные сшивки ДНК и некоторые формы окислительного повреждения.Общими чертами повреждений, распознаваемых путем NER, является то, что они вызывают как спиральное искажение дуплекса ДНК, так и модификацию химического состава ДНК. 35
Значительное понимание процесса НЭР у человека было получено благодаря изучению двух редких аутосомно-рецессивных, но гетерогенных заболеваний — пигментной ксеродермии (XP) и синдрома Кокейна (CS). Люди, страдающие любым из этих заболеваний, проявляют тяжелую гиперчувствительность к ультрафиолету. Оба заболевания генетически неоднородны; XP вызывается мутациями в одном из семи генов (от XPA до XPG ), а CS вызывается дефектами одного из двух генов ( CSA или CSB ).В настоящее время известно, что продукты гена XP выполняют различные функции во время распознавания повреждений и разреза ДНК. 36 Продукты гена CS, с другой стороны, необходимы для основанной на NER репарации транскрипционно активных генов. 37
| Фигура 4. Нуклеотидная эксцизионная репарация (NER). Показана упрощенная модель шагов в NER. Распознавание повреждений ДНК (1) различается между глобальным геномным и связанным с транскрипцией NER (GG- и TC-NER, соответственно).Последующие этапы этих процессов являются общими и включают локальное раскручивание ДНК (2), двойной разрез цепи ДНК (3) и синтез репарации ДНК и лигирование цепи (4). Дополнительную информацию см. В основном тексте. |
Процесс NER требует поэтапного действия более 30 белков, который включает распознавание повреждений, локальное открытие дуплекса ДНК вокруг поражения, двойной разрез поврежденной цепи ДНК, синтез репарации разрывов и лигирование цепи ( Рисунок 4). 38 Как упоминалось выше, существуют две различные формы NER: глобальный геномный NER (GG-NER), который корректирует повреждения в транскрипционно молчащих областях генома, и связанный с транскрипцией NER (TC-NER), который восстанавливает повреждения на активно транскрибируемая цепь ДНК. Эти два подпути принципиально идентичны, за исключением механизма распознавания повреждений. В GG-NER белковый комплекс XPC / HHR23B отвечает за первоначальное обнаружение поврежденной ДНК. Напротив, распознавание повреждений во время TC-NER не требует XPC, скорее считается, что происходит, когда аппарат транскрипции останавливается в месте повреждения.Затем застопорившийся комплекс РНК-полимеразы должен быть вытеснен, чтобы позволить белкам NER получить доступ к поврежденной ДНК. Этому смещению способствует действие белков CSA и CSB, а также других факторов, специфичных для TC-NER. Последующие этапы GG- и TC-NER выполняются по существу идентичным образом. XPA и гетеротримерный белок репликации A (RPA) затем связываются в месте повреждения и дополнительно способствуют распознаванию повреждений. Затем геликазы XPB и XPD, компоненты мультисубъединичного фактора транскрипции TFIIH, раскручивают дуплекс ДНК в непосредственной близости от поражения.Эндонуклеазы XPG и ERCC1 / XPF затем расщепляют одну цепь ДНК в положениях 3 ‘и 5’ от повреждения соответственно, образуя олигонуклеотид приблизительно из 30 оснований, содержащий повреждение. Этот олигонуклеотид вытесняется, уступая место синтезу репарации разрывов (выполняемому ДНК Pol delta epsilon, а также несколькими вспомогательными факторами репликации). Наконец, разрыв в восстановленной цепи запечатывается ДНК-лигазой, таким образом завершая процесс NER.
MMR Путь репарации ошибочного спаривания ДНК (MMR) играет важную роль в коррекции ошибок репликации, таких как несоответствие оснований и оснований и петли вставки / удаления (IDL), которые возникают в результате неправильного включения нуклеотидов ДНК-полимеразой и проскальзывания матрицы, соответственно.Ошибочные пары, возникающие в результате спонтанного дезаминирования 5-метилцитозина, и гетеродуплексов, образованных в результате генетической рекомбинации, также исправляются с помощью MMR. Дефекты этого пути приводят к так называемому «мутаторному» клеточному фенотипу, характеризующемуся повышенной частотой спонтанных мутаций и повышенной микросателлитной нестабильностью (MSI). Мутации в нескольких генах MMR человека вызывают предрасположенность к наследственной неполипозной колоректальной карциноме (HNPCC), а также к множеству спорадических опухолей, которые демонстрируют MSI. 5
Общий процесс MMR аналогичен другим путям эксцизионной репарации (см. BER длинного участка и NER) в том, что повреждение ДНК (несоответствие или IDL) распознается, участок, содержащий повреждение, иссекается, и цепь удаляется. исправлено синтезом репарации ДНК и повторным лигированием (рис. 5). 39 Путь MMR у млекопитающих инициируется распознаванием несовпадающего или IDL гетеродимером белков MSh3-MSH6 (известного как MutS альфа-бета). Преобладающее несоответствие оснований и активность распознавания IDL одного основания в клетках человека обеспечивается MutS alpha; 40 более крупных IDL обычно распознаются бета-версией MutS.Однако существует некоторое частичное перекрытие субстратной специфичности этих двух гетеродимеров, что указывает по крайней мере на минимальный уровень избыточности распознавания субстрата посредством пути MMR. 40 После идентификации поражения MutS (альфа-бета) связывает АТФ, претерпевает конформационный сдвиг и перемещается по ДНК от места поражения до тех пор, пока не встретятся дополнительные белки MMR. 41, 42 Образуются белковые комплексы более высокого порядка, включая те, которые содержат гетеродимерные белки MLh2-PMS2 (MutL альфа-бета), MLh2-MLh4 и факторы репликации.Считается, что дискриминация цепи происходит за счет контакта белка MMR с репликационным механизмом. 43 Поддержка этой гипотезы обеспечивается открытием, что MutL alpha может взаимодействовать с дополнительным фактором репликации, PCNA. 44 Это взаимодействие может обеспечить физическую связь между распознаванием несоответствия и идентификацией вновь синтезированной цепи ДНК в репликационной вилке. Вырезание и ресинтез растущей цепи (содержащей несовпадение или IDL) выполняется рядом факторов, включая PCNA, RPA, RFC, экзонуклеазу I, ДНК-полимеразы дельта и эпсилон, эндонуклеазу FEN1 и дополнительные факторы. 43
| Рис. 5. Устранение несоответствия (MMR). Показана модель MMR ДНК млекопитающих. MMR инициируется распознаванием несоответствия и различением нити. После удаления вновь синтезированной цепи, содержащей несовпадающее основание или петлю вставки / делеции (IDL), выполняется ресинтез цепи для восстановления точности ДНК. |
Восстановление DSB Двухцепочечные разрывы (DSB), возможно, являются наиболее серьезной формой повреждения ДНК, поскольку они создают проблемы для транскрипции, репликации и сегрегации хромосом.Повреждения этого типа вызываются множеством источников, включая экзогенные агенты, такие как ионизирующее излучение и определенные генотоксические химические вещества, эндогенно генерируемые реактивные формы кислорода, репликация одноцепочечных разрывов ДНК и механический стресс на хромосомах. DSB отличаются от большинства других типов повреждений ДНК тем, что они влияют на обе цепи дуплекса ДНК и, следовательно, предотвращают использование комплементарной цепи в качестве матрицы для репарации (см. BER, NER и MMR). Неспособность исправить эти дефекты может привести к хромосомной нестабильности, ведущей к нарушению регуляции экспрессии генов и канцерогенезу. 4 Чтобы противодействовать пагубным эффектам этих мощных повреждений, клетки развили два различных пути репарации DSB: 45 гомологичная рекомбинация (HR) и негомологичное соединение концов (NHEJ) (Рисунок 6). Клеточное решение относительно того, какой путь использовать для репарации DSB, неясно, однако, по-видимому, в значительной степени зависит от стадии внутриклеточного цикла во время приобретения повреждения. 46
HR-направленная репарация исправляет дефекты DSB безошибочным образом, используя механизм, который извлекает генетическую информацию из гомологичной, неповрежденной молекулы ДНК.Большая часть репарации на основе HR происходит в поздних S- и G2-фазах клеточного цикла, когда неповрежденная сестринская хроматида доступна для использования в качестве матрицы для репарации. Группа белков эпистаза RAD52, включая RAD50, RAD51, RAD52, RAD54 и MRE11, опосредует этот процесс. 47 Считается, что сам белок RAD52 является исходным датчиком разорванных концов ДНК. Обработка поврежденных концов приводит к образованию выступов 3 ‘одноцепочечной ДНК (оцДНК). Вновь образованные концы оцДНК связываются RAD51 с образованием нуклеопротеиновой нити.Другие белки, включая RPA, RAD52, RAD54, BRCA1, BRCA2 и несколько дополнительных белков, связанных с RAD51, служат вспомогательными факторами в сборке филаментов и последующей активности RAD51. 45 Затем нуклеопротеиновая нить RAD51 ищет в неповрежденной ДНК сестринской хроматиды в поисках гомологичной репарационной матрицы. Как только гомологичная ДНК была идентифицирована, поврежденная цепь ДНК вторгается в неповрежденный дуплекс ДНК в процессе, называемом обменом цепи ДНК. Затем ДНК-полимераза удлиняет 3′-конец вторгающейся цепи, и последующее лигирование ДНК-лигазой I дает гетеродуплексную структуру ДНК.Это промежуточное звено рекомбинации устранено, и точная безошибочная коррекция DSB завершена.
| Рисунок 6. Ремонт двойного разрыва цепи (DSB). Показан обзор основных этапов и требований к факторам для репарации DSB ДНК путем гомологичной рекомбинации (слева) и негомологичного соединения концов (справа). См. Основной текст для подробностей. |
В отличие от HR, NHEJ не требует гомологичного шаблона для восстановления DSB и обычно приводит к исправлению разрыва с высокой вероятностью ошибок.Существенным для пути NHEJ является активность гетеродимерного белка Ku70 / Ku80. 48 Гетеродимер Ku инициирует NHEJ путем связывания со свободными концами ДНК и привлечения других факторов NHEJ, таких как ДНК-зависимая протеинкиназа (ДНК-PK), XRCC4 и ДНК-лигаза IV, в место повреждения. 45 DNA-PK активируется при связывании ДНК и фосфорилирует ряд субстратов, включая p53, Ku и кофактор XRCC4 ДНК-лигазы IV. Считается, что фосфорилирование этих факторов дополнительно облегчает процесс восстановления.Поскольку концы большинства DSB, генерируемых генотоксичными агентами, повреждены и не могут быть напрямую лигированы, они часто должны подвергаться ограниченному процессингу нуклеазами и / или полимеразами, прежде чем NHEJ сможет продолжить. Нуклеазы, ответственные за этот процессинг, еще предстоит определить, но сильные кандидаты на эту активность включают комплекс MRE11 / Rad50 / NBS1, 49, 50 FEN-1, 51 и белок Artemis. 52 Заключительный этап репарации NHEJ включает лигирование концов ДНК с помощью лигазы IV в комплекс, который также включает XRCC4 и Ku.
Список литературы
- Lindahl, T. (1993) Nature 362 : 709.
- Friedberg, E.C. et al. (1995) Ремонт ДНК и мутагенез, ASM Press, Вашингтон, округ Колумбия.
- Финкель, Т. и Н.Дж. Холбрук (2000) Nature 408 : 239.
- Hoeijmakers, J.H.J. (2001) Nature 411 : 366.
- Peltomaki, P. (2001) Mutation Res. 488 : 77.
- Zhou, B.B. & S.J. Элледж (2000) Nature 408 : 433.
- Abraham, R.T. (2001) Genes Dev. 15 : 2177.
- Шайло Ю. (2001) Curr. Opin. Genet. Dev. 11 : 71.
- Ким, С. et al. (1999) J. Biol. Chem. 274 : 37538.
- Bartek, J. & J. Lukas (2001) Curr. Opin. Клетка. Биол. 13 : 738.
- Аларкон-Варгас, Д. и З. Ронаи (2002) Канцерогенез 23 : 541.
- Matsuoka, S. et al. (2000) Proc. Natl. Акад.Sci. США 97 : 10389.
- Maya, R. et al. (2001) Genes Dev. 15 : 1067.
- Shieh, S.Y. et al. (2000) Genes Dev. 14 : 289.
- Dumaz, N. & D.W. Кроткий (1999) EMBO J. 18 : 7002.
- Falck, J. et al. (2002) Nature Genet. 30 : 290.
- Yardzi, P.T. et al. (2002) Genes Dev. 16 : 571.
- Ким, С. et al. (2002) Genes Dev. 16 : 560.
- Falck, J. et al. (2001) Природа 410 : 842.
- Xu, B. et al. (2002) Мол. Клетка. Биол. 22 : 1049.
- Wang, Y. et al. (2000) Genes Dev. 14 : 927.
- Чжоу X.Y. et al. (2002) Cancer Res. 62 : 1598.
- Медсестра П. (1990) Nature 344 : 503.
- Graves, P.R. et al. (2000) Дж.Биол. Chem. 275 : 5600.
- Peng, C.Y. et al. (1997) Наука 277 : 1501.
- Марджисон, Г. и М.Ф. Сантибанес-Кореф (2002) BioEssays 24 : 255.
- Седжвик Б. (1997) Канцерогенез 18 : 1561.
- Шривенугопал, К.С. et al. (1996) Биохимия 35 : 1328.
- Gerson, S.L. (2002) J. Clin. Онкол. 20 : 2388.
- Memisoglu, A. & L. Samson (2000) Mutation Res. 451 : 39.
- Акционер, О. И J. Jiricny (2001) BioEssays 23 : 270.
- Мацумото, Ю. и К. Ким (1995) Science 269 : 699.
- Matsumoto, Y. et al. (1994) Мол. Клетка. Биол. 14 : 6187.
- Frosina, G. et al. (1996) J. Biol. Chem. 271 : 9573.
- Hess, M.T. et al. (1997) Proc. Natl. Акад. Sci. США 94 : 6664.
- Линдал, Т.И Р.Д. Вуд (1999) Science 286 : 1897.
- Фридберг, E.C. (1996) BioEssays 18 : 731.
- Бэтти, Д.П. И Р.Д. Вуд (2000) Джин 241 : 193.
- Марти, Т. et al. (2002) J. Cell. Physiol. 191 : 28.
- Genschel, J. et al. (1998) J. Biol. Chem. 273 : 19895.
- Gradia, S. et al. (1999) Мол. Ячейка 3 : 255.
- Блэквелл, Л.J. et al. (1998) J. Biol. Chem. 273 : 32055.
- Buermeyer, A.B. et al. (1999) Annu. Преподобный Жене. 33 : 533.
- Umar, A. et al. (1996) Ячейка 87 : 65.
- Джексон, С.П. (2002) Канцерогенез 23 : 687.
- Takata, M. et al. (1998) EMBO J. 17 : 5497.
- Sonoda, E. et al. (2001) Proc. Natl. Акад. Sci.
