Схема агрегатного участка АТП. Основные аспекты
- Главная
- /
- Рубрики журнала Кузов
- /
- Слесарный ремонт и ТО
- /
- Схема агрегатного участка АТП
4 марта 2021
Опыт использования автотранспорта помогает понять, что при скоплении машин в городах необходимо создание особенных структурно-организационных подразделений. К ним относят производственные предприятия, автомобильные комбинаты, станции и базы тех. обслуживания и ремонта, центры по обслуживанию легковых машин. В 21-ом веке схема агрегатного участка АТП важна для последующей реализации, ведь она позволяет правильно создать нужный комплекс.
Особенности создания и развития АТП
Во многих ситуациях развитие АТП отстает от скорости развития автомобильного парка. Ситуация в ближайшие несколько лет не поменяется. По этой причине в каждом случае нужно четко понимать, как лучше реконструировать базу с более эффективным использованием производственного пространства. Эта задача может решаться благодаря особенным методикам технического обслуживания, ремонта подвижного состава, наращивание механизации производственных процессов, использования диагностических средств, научной организации трудовой деятельности.
Какие вопросы решаются при создании АТП
Планируя создание АТП, желательно ориентироваться на следующие аспекты:
- Подбор и обоснование исходной информации для организации внутригаражных процессов. Желательно осуществлять реконструкцию различных зон складских комплексов и складских помещений. От этого зависит, насколько успешно удастся создать АТП;
- Для реализации проектов новых производственных подразделений;
- Расчет производственной программы по техническому обслуживанию;
-
Определение количества ремонтно-обслуживающих мероприятий.
 Разделение обязанностей по объектам работы, специальностям и сменам;
Разделение обязанностей по объектам работы, специальностям и сменам; - Выбор оборудования с учетом степени механизации и автоматизации производственной деятельности;
- Определение количества рабочих постов, поточных линий, площадей для различных зон. При этом важно понимать, как лучше всего создать условия для технического обслуживания и ремонта подвижного состава;
- Расчет площадей необходимых помещений: цеха, склады, бытовые и административные;
- Определение необходимых параметров объектов;
- Разработка планировочных решений и генерального плана организаций;
- Технико-экономическое обоснование решений.
Проектирование предполагает учет многочисленных нюансов, связанных с реализацией плана.
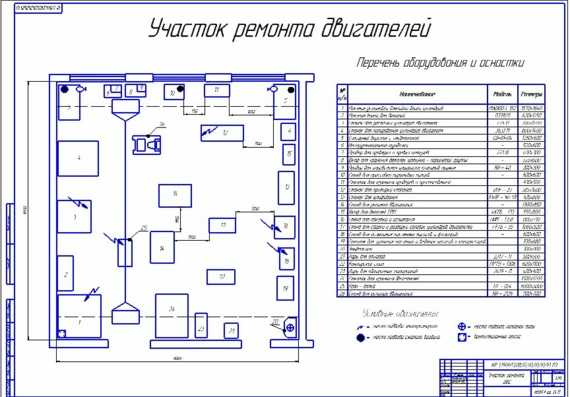
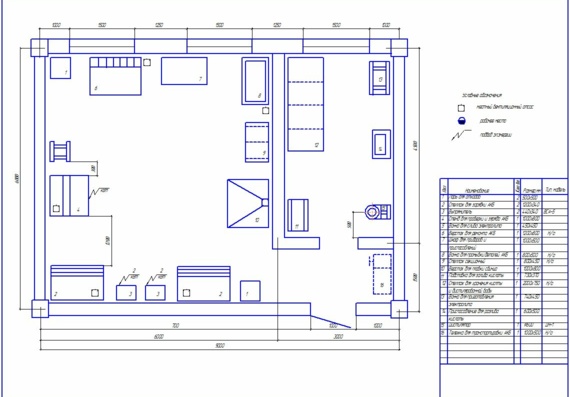
Особенности агрегатного участка
В настоящее время важно создать чертеж агрегатного участка АТП, который бывает значимым. В имеющемся агрегатном участке можно успешно ремонтировать автомобильные детали, а также восстанавливать их. Разборо-сборочные мероприятия в агрегатном цехе должны производиться на специальных стендах. Для размещения и разборки узлов обязательно используют слесарные верстаки, стеллажи, столы. Агрегатный участок обязателен для соблюдения основных норм безопасности.
В имеющемся агрегатном участке можно успешно ремонтировать автомобильные детали, а также восстанавливать их. Разборо-сборочные мероприятия в агрегатном цехе должны производиться на специальных стендах. Для размещения и разборки узлов обязательно используют слесарные верстаки, стеллажи, столы. Агрегатный участок обязателен для соблюдения основных норм безопасности.
Для чего требуется агрегатный участок
Планируя создать чертеж проектирование агрегатного участка в грузовом АТП, определяет возможность проведения обслуживания транспортных средств, планируемых на определенный период времени (год или сутки). Например, требуется создать подходящие условия для сезонного технического обслуживания транспортных средств или осуществление ремонтных мероприятий.
При разработке чертежей желательно учитывать возможные простои транспорта и объем работ с учетом нормативов на каждые 1000 километров пробега. Годовая программа ТО, ремонта автомобилей рассчитываются с помощью анализа за цикл. Цикловой способ предполагает выбор и корректирование программ, чтобы удалось успешно создать агрегатный участок.
Цикловой способ предполагает выбор и корректирование программ, чтобы удалось успешно создать агрегатный участок.
Комментарии
Рекомендованные статьи
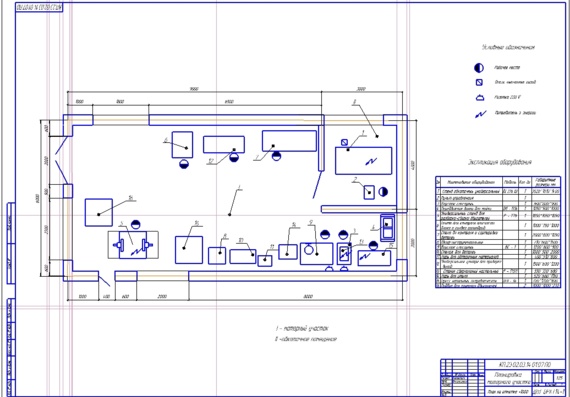
2.3.2. Режим работы агрегатного участка
Работа агрегатного участка организована в две смены, это обусловлено тем, что производственные площади и оборудование будут загружены наиболее рационально.
Учет работы производственных рабочих осуществляется на основе контрольного талона, который выписывается на снятый автомобиля агрегат или узел и поступает в отделение.
Если ремонт агрегата
или узла не может быть выполнен за время
нахождения автомобиля в зоне ТО-2 или
ТР, то на него устанавливается агрегат
или узел из резервного фонда. В этом
случае отремонтированные агрегаты и
узлы сдаются на склад готовой
продукции.
В этом
случае отремонтированные агрегаты и
узлы сдаются на склад готовой
продукции.
В отдельных случаях, когда ремонт агрегата или узла может быть выполнен без его снятия с автомобиля, то ремонтные рабочие выполняют ремонт непосредственно напостах ТО или ТР.
Учет расхода запасных частей на текущий ремонт агрегатов и механизмов осуществляется на основе требований стандартной формы.
Выполненная работа принимается механиком гаража, который выполняет функции и технического контроля.
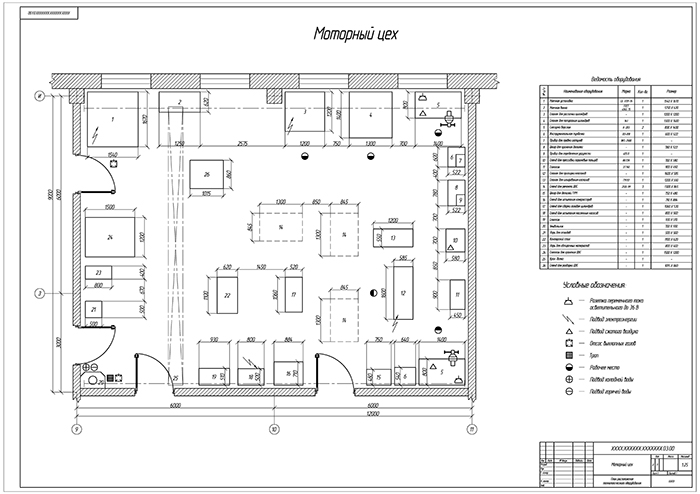
2.3.3. Обоснование планировочного решения.
В соответствие с общим планировочным решением производственного корпуса и особенностями ремонта агрегатов и узлов автомобиля, агрегатный участок располагается в непосредственной близости от зоны ТР и склада запасных частей.
Отделение расположено
в той части здания производственного
корпуса, которая выходит на улицу, что
позволяет с максимальной эффективностью
использовать естественное освещение.
Посты по ремонту агрегатов располагаются в центральной части помещения.
Это обеспечивает свободный доступ ремонтных рабочих к ремонтируемому агрегату в процессе ремонта, поскольку фиксированное рабочее место на таких постах не организуется
Мойка деталей, их дефектовка и стеллажи для хранения сосредоточены в одном месте, что представляет собой замкнутый технологический процесс.
Заточной станок оборудован местным вентиляционным отсосом. Это существенно снижает запыленность помещения и позволяет более качественно выполнять сборку агрегатов автомобилей.
По периметру помещения размещаются те рабочие места, где положение рабочего, как правило, фиксировано.
Рабочие верстаки
устанавливается вдоль стены, освещенной
естественным светом. В этой части
отделения установлен настольно-сверлильный
станок, пресс с ручным приводом и
станок для шлифовки фасок клапанов.
Верстак, установленный вдоль глухой стены, оборудуется искусственным индивидуальным освещением с подводом электроэнергии через осветительную розетку. Рядом с рабочими местами размещаются и шкафы для хранения инструмента, оснастки и приспособлений.
Оборудование отделения расположено по площади помещения с учетом требований нормативных документов по технике безопасности.
Заключение
В данном курсовом проекте произведен расчет технологической части, откорректированы нормативы периодичности ТО и пробеги до КР, с учетом производственной программы АТП по количеству технических воздействий. В результате проведенной работы для данного парка автомобилей рассчитали и спроектировали зоны ежедневного обслуживания, технического обслуживания, текущего ремонта, с детальной разработкой технологического участка.
Рассчитаны:
количество штатных рабочих участвующих
в техническом обслуживании и текущем
ремонте автомобилей.
На основании произведённых расчётов можно прийти к следующему выводу — что количество постов, численность работающих на АТП обеспечит бесперебойную, качественную работу по ТО и ремонту подвижного состава как за смену, так и за год.
Двойная роль АТФ в регуляции белковых агрегатов, разделенных фазами, в ядрышках ооцитов Xenopus
. 2018 17 июля; 7:e35224.doi: 10.7554/eLife.35224.
Майкл Х Хейс 1 , Элизабет Х. Пешен 2 , Норман Дж. Довичи 2 , Дэниел Л. Уикс 1
3
Пешен 2 , Норман Дж. Довичи 2 , Дэниел Л. Уикс 1
3
Принадлежности
- 1 Докторская программа по молекулярной медицине, Медицинский колледж Карвера Университета Айовы, Айова-Сити, США.
- 2 Кафедра химии и биохимии, Университет Нотр-Дам, Нотр-Дам, США.
- 3 Кафедра биохимии, Медицинский колледж Карвера Университета Айовы, Айова-Сити, США.
- PMID: 30015615
- PMCID: PMC6050040
- DOI:
10.
 7554/eLife.35224
7554/eLife.35224
Бесплатная статья ЧВК
Майкл Х. Хейс и соавт. Элиф. .
Бесплатная статья ЧВК
. 2018 17 июля; 7:e35224.
doi: 10.7554/eLife.35224.
Авторы
Майкл Х Хейс 1 , Элизабет Х. Пешен 2 , Норман Дж. Довичи 2 , Дэниел Л. Уикс 1 3
Принадлежности
- 1 Докторская программа по молекулярной медицине, Медицинский колледж Карвера Университета Айовы, Айова-Сити, США.
- 2 Кафедра химии и биохимии, Университет Нотр-Дам, Нотр-Дам, США.
- 3 Кафедра биохимии, Медицинский колледж Карвера Университета Айовы, Айова-Сити, США.
- PMID: 30015615
- PMCID: PMC6050040
- DOI: 10.7554/eLife.35224
Абстрактный
Для многих белков агрегация является частью структурного равновесия, которое может произойти. Баланс между продуктивной агрегацией и патогенной агрегацией, которая приводит к токсичности, имеет решающее значение и, как известно, включает зависимое от аденозинтрифосфата (АТФ) действие шаперонов и дезагрегаз.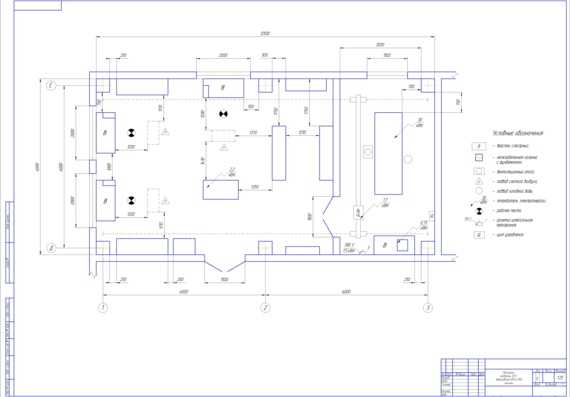 Недавно была идентифицирована вторая активность АТФ, активность гидротропа, которой, независимо от гидролиза, было достаточно для солюбилизации агрегированных белков in vitro. Предполагается, что эта новая функция АТФ помогает регулировать протеостаз in vivo. Мы проверили эту гипотезу на агрегатах, обнаруженных в Xenopus Ядрышки ооцита. Наши результаты показывают, что АТФ играет двойную роль в поддержании растворимости белка. Мы приводим доказательства эндогенного гидротропного действия АТФ, но показываем, что гидротропной солюбилизации ядрышковых агрегатов предшествует дестабилизирующее событие. Дестабилизация осуществляется посредством энергозависимого процесса, зависящего от АТФ и одного или нескольких растворимых ядерных факторов, или путем разрушения коагрегата, такого как РНК.
Недавно была идентифицирована вторая активность АТФ, активность гидротропа, которой, независимо от гидролиза, было достаточно для солюбилизации агрегированных белков in vitro. Предполагается, что эта новая функция АТФ помогает регулировать протеостаз in vivo. Мы проверили эту гипотезу на агрегатах, обнаруженных в Xenopus Ядрышки ооцита. Наши результаты показывают, что АТФ играет двойную роль в поддержании растворимости белка. Мы приводим доказательства эндогенного гидротропного действия АТФ, но показываем, что гидротропной солюбилизации ядрышковых агрегатов предшествует дестабилизирующее событие. Дестабилизация осуществляется посредством энергозависимого процесса, зависящего от АТФ и одного или нескольких растворимых ядерных факторов, или путем разрушения коагрегата, такого как РНК.
Ключевые слова: АТФ; клеточная биология; биология развития; ядрышко; ядро; ооцит; агрегация белков; ксеноп.
© 2018, Хейс и др.
Заявление о конфликте интересов
MH, EP, ND, DW Конкурирующие интересы не заявлены
Цифры
Рисунок 1. Белковые агрегаты выборочно сохраняются…
Рисунок 1. Белковые агрегаты избирательно сохраняются в изолированных ядрах ооцитов.
( A ) Синтетический…
Рисунок 1. Белковые агрегаты избирательно сохраняются в изолированных ядрах ооцитов. ( A ) Синтетическая мРНК, кодирующая локализованный в ядре dTomato, вводилась в ооциты V-VI стадии Xenopus laevis за 1 день до выделения. После выделения ядра инкубировали в буфере OR2 в течение указанного времени, а затем анализировали.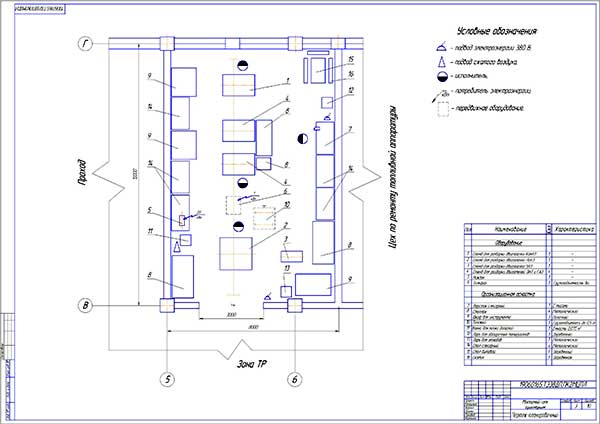 ( B ) Ооцит стадии VI с местом разреза (стрелка) и выделенным вручную ядром (пунктирная окружность). ( C ) 1-часовые цейтраферные изображения выделенных из воды и окрашенных тиофлавином Т (тио-Т, зеленый) ядер из dTomato-NLS (красный), экспрессирующих ооциты стадии VI, демонстрируют потерю растворимого dTomato, но сохранение тиофлавин-Т-положительных агрегатов. ( D–F ) Ядра выделяли из не подвергавшихся манипуляциям ооцитов, инкубировали в OR2, собирали с 15-минутными интервалами и анализировали с помощью SDS-PAGE ( Д ). Окрашивание кумасси ( E ) с количественным определением ( F ) ядер, обедненных растворимым белком, демонстрирует быструю потерю растворимых эндогенных белков и сохранение белков, связанных с агрегатами. Количество ядерных эквивалентов на дорожку указано внизу ( E ). Стрелки указывают на подмножество белков, обогащенных после истощения растворимых белков. Arrowhead выделяет актин с молекулярной массой 42 кДа, который обогащается после истощения растворимого белка (9).
( B ) Ооцит стадии VI с местом разреза (стрелка) и выделенным вручную ядром (пунктирная окружность). ( C ) 1-часовые цейтраферные изображения выделенных из воды и окрашенных тиофлавином Т (тио-Т, зеленый) ядер из dTomato-NLS (красный), экспрессирующих ооциты стадии VI, демонстрируют потерю растворимого dTomato, но сохранение тиофлавин-Т-положительных агрегатов. ( D–F ) Ядра выделяли из не подвергавшихся манипуляциям ооцитов, инкубировали в OR2, собирали с 15-минутными интервалами и анализировали с помощью SDS-PAGE ( Д ). Окрашивание кумасси ( E ) с количественным определением ( F ) ядер, обедненных растворимым белком, демонстрирует быструю потерю растворимых эндогенных белков и сохранение белков, связанных с агрегатами. Количество ядерных эквивалентов на дорожку указано внизу ( E ). Стрелки указывают на подмножество белков, обогащенных после истощения растворимых белков. Arrowhead выделяет актин с молекулярной массой 42 кДа, который обогащается после истощения растворимого белка (9). 0125 Ф ). ( G ) Покадровые изображения ядра изолированного ооцита стадии VI сразу после введения в ядро Люцифера желтого, флуоресцентного заменителя АТФ. Изображения в ( C ) и ( G ) являются репрезентативными из двух независимых экспериментов, охватывающих как минимум шесть ядер. Данные в ( F ) содержат три биологических повтора (3–10 ядер на повтор), представляющих материал от двух отдельных лягушек.
0125 Ф ). ( G ) Покадровые изображения ядра изолированного ооцита стадии VI сразу после введения в ядро Люцифера желтого, флуоресцентного заменителя АТФ. Изображения в ( C ) и ( G ) являются репрезентативными из двух независимых экспериментов, охватывающих как минимум шесть ядер. Данные в ( F ) содержат три биологических повтора (3–10 ядер на повтор), представляющих материал от двух отдельных лягушек.
Рисунок 2. Ядрышки устойчивы к АТФ…
Рисунок 2. Ядрышки устойчивы к гидротропной солюбилизации, опосредованной АТФ.
( A ) Принципиальная схема…
Рисунок 2. Ядрышки устойчивы к гидротропной солюбилизации, опосредованной АТФ. ( A ) Схематическая диаграмма трехслойной архитектуры ядрышка, с зернистым компонентом в зеленом цвете, плотным фибриллярным компонентом в красном цвете и фибриллярным ядром в синем цвете. Ядрышковые вакуоли не помечены и выглядят черными. ( B ) Синтетическая мРНК, кодирующая GFP-NLS, или флуоресцентно меченные Npm1 и/или Fbl инъецировали в ооциты стадии V/VI. После инкубации в течение ночи выделяли ядра, удаляли растворимые белки в течение 1 часа в OR2, затем анализировали с помощью флуоресцентной микроскопии ( C ) или иммуноблоттинга против GFP ( D-E ). ( C ) Npm1 (зеленый) или Fbl (красный) сохраняются (вверху) и устойчивы к солюбилизации 8 мМ АТФ (внизу). (D – E и рисунок 2 — дополнение к рисунку 1) Ядра из ооцитов, совместно экспрессирующих GFP-Fbl/GFP-NLS или GFP-Npm1/GFP-NLS, выделяли и лишали растворимых белков (сохраняли) и сравнивали с GFP-Fbl или Уровни GFP-Npm1 в сразу собранных (введенных) ядрах ( D ) или общий белок ( E ). Меченые белки анализировали с помощью вестерн-блоттинга анти-GFP, а общий белок определяли с помощью окрашивания белка REVERT (LI-Cor). Схему методологии и репрезентативные исходные данные для ( D–E ) можно найти на рис.
Ядрышковые вакуоли не помечены и выглядят черными. ( B ) Синтетическая мРНК, кодирующая GFP-NLS, или флуоресцентно меченные Npm1 и/или Fbl инъецировали в ооциты стадии V/VI. После инкубации в течение ночи выделяли ядра, удаляли растворимые белки в течение 1 часа в OR2, затем анализировали с помощью флуоресцентной микроскопии ( C ) или иммуноблоттинга против GFP ( D-E ). ( C ) Npm1 (зеленый) или Fbl (красный) сохраняются (вверху) и устойчивы к солюбилизации 8 мМ АТФ (внизу). (D – E и рисунок 2 — дополнение к рисунку 1) Ядра из ооцитов, совместно экспрессирующих GFP-Fbl/GFP-NLS или GFP-Npm1/GFP-NLS, выделяли и лишали растворимых белков (сохраняли) и сравнивали с GFP-Fbl или Уровни GFP-Npm1 в сразу собранных (введенных) ядрах ( D ) или общий белок ( E ). Меченые белки анализировали с помощью вестерн-блоттинга анти-GFP, а общий белок определяли с помощью окрашивания белка REVERT (LI-Cor). Схему методологии и репрезентативные исходные данные для ( D–E ) можно найти на рис. 2 — дополнение к рисунку 1. Изображения в ( C ) представляют собой репрезентативные оптические срезы, снятые с помощью оснащенного Apotome микроскопа Zeiss Axioplan2, и не имеют одинаковое время воздействия. Данные в ( D–E ) получены из 4 (GFP-Npm1 и GFP-FBL) или 6 (GFP) биологических повторов (группы из 2–20 ядер).
2 — дополнение к рисунку 1. Изображения в ( C ) представляют собой репрезентативные оптические срезы, снятые с помощью оснащенного Apotome микроскопа Zeiss Axioplan2, и не имеют одинаковое время воздействия. Данные в ( D–E ) получены из 4 (GFP-Npm1 и GFP-FBL) или 6 (GFP) биологических повторов (группы из 2–20 ядер).
Рисунок 2—дополнение к рисунку 1.. GFP-Fbl и GFP-Npm1,…
Рисунок 2 — дополнение к рисунку 1. GFP-Fbl и GFP-Npm1, но не GFP-NLS, сохраняются после растворимого белка…
( A ) GFP-Fbl/GFP-NLS или GFP-Npm1/GFP-NLS была совместно инъецирована в ооциты стадии V-VI и оставлена для трансляции в течение ночи. Ядра из коэкспрессирующих ооцитов выделяли и освобождали от растворимых белков (сохраняли) или немедленно собирали (ввод) и разделяли с помощью SDS-PAGE. После переноса на нитроцеллюлозную мембрану общий белок определяли с помощью окрашивания белка REVERT (LI-Cor), а меченые белки анализировали с помощью вестерн-блоттинга анти-GFP. ( B ) Репрезентативные необработанные данные с рис. 2E–D. Вестерн-блоттинг анти-GFP (вверху) демонстрирует обогащение GFP-Fbl и GFP-Npm1 по сравнению с растворимым внутренним контролем GFP-NLS, а также общим белком (внизу). Общее количество ядер на дорожку указано (внизу).
Ядра из коэкспрессирующих ооцитов выделяли и освобождали от растворимых белков (сохраняли) или немедленно собирали (ввод) и разделяли с помощью SDS-PAGE. После переноса на нитроцеллюлозную мембрану общий белок определяли с помощью окрашивания белка REVERT (LI-Cor), а меченые белки анализировали с помощью вестерн-блоттинга анти-GFP. ( B ) Репрезентативные необработанные данные с рис. 2E–D. Вестерн-блоттинг анти-GFP (вверху) демонстрирует обогащение GFP-Fbl и GFP-Npm1 по сравнению с растворимым внутренним контролем GFP-NLS, а также общим белком (внизу). Общее количество ядер на дорожку указано (внизу).
Рисунок 3. Агрегированные ядрышковые белки сохраняют внутреннюю…
Рисунок 3. Агрегированные ядрышковые белки сохраняют внутреннюю способность к динамическому обмену белками, но эта способность…
 Агрегированные ядрышковые белки сохраняют внутреннюю способность к динамическому обмену белками, но эта способность усиливается за счет растворимых ядерных компонентов.
Агрегированные ядрышковые белки сохраняют внутреннюю способность к динамическому обмену белками, но эта способность усиливается за счет растворимых ядерных компонентов. ( A ) Донорские ядра были выделены из ооцитов, коэкспрессирующих GFP-Npm1 и RFP-Fbl, а акцепторные ядра были выделены из неинъецированных ооцитов. ( B ) Верхнее донорное ядро с обедненным растворимым белком (SPD) было смешано с изолированным маслом акцепторным ядром, демонстрируя, что истощение растворимого белка не изменяет необратимо ядрышки, и предполагает, что растворимый ядерный фактор (факторы) отвечает за динамическую природу ядрышки. В середине перенос меченого белка от донора, изолированного в масле, к акцептору, обедненному растворимым белком, указывает на то, что истощение растворимого белка не предотвращает рекрутирование или агрегацию растворимых белков. Внизу: обмен агрегированными белками между ядрышками, обедненными растворимыми белками. Экспозиция была скорректирована на нижних изображениях, чтобы учесть снижение сигнала, а донорское ядрышко было включено в верхнюю вставку для сравнения. Яркость и контрастность были скорректированы пунктирной вставкой, чтобы облегчить визуализацию RFP-Fbl. Звездочки указывают на акцепторное ядрышко. ( C ) Обмен флуоресцентно мечеными белками из выделенных маслом и слитых ядер, по отдельности экспрессирующих GFP-Npm1 или RFP-Fbl. ( D ) Транснуклеолярное слияние после смешивания донора RFP-Fbl с обедненным растворимым белком (красный) и изолированного в масле GFP-Npm1 (зеленый) под маслом демонстрирует восстановление более нормального округлого фенотипа. ( E ) Обмен GFP-Npm1 и RFP-Fbl ограничен распространением. По мере увеличения расстояния от донора «D» интенсивность флуоресценции акцептора уменьшается. Изображения в ( B–C ) представляют собой 3 независимых эксперимента и не менее девяти биологических повторов (объединенных ядер). Получение изображений началось через 15 минут после трансядерного смешивания. Событие слияния, изображенное в ( D ), является наиболее полным событием, которое мы наблюдали.
Яркость и контрастность были скорректированы пунктирной вставкой, чтобы облегчить визуализацию RFP-Fbl. Звездочки указывают на акцепторное ядрышко. ( C ) Обмен флуоресцентно мечеными белками из выделенных маслом и слитых ядер, по отдельности экспрессирующих GFP-Npm1 или RFP-Fbl. ( D ) Транснуклеолярное слияние после смешивания донора RFP-Fbl с обедненным растворимым белком (красный) и изолированного в масле GFP-Npm1 (зеленый) под маслом демонстрирует восстановление более нормального округлого фенотипа. ( E ) Обмен GFP-Npm1 и RFP-Fbl ограничен распространением. По мере увеличения расстояния от донора «D» интенсивность флуоресценции акцептора уменьшается. Изображения в ( B–C ) представляют собой 3 независимых эксперимента и не менее девяти биологических повторов (объединенных ядер). Получение изображений началось через 15 минут после трансядерного смешивания. Событие слияния, изображенное в ( D ), является наиболее полным событием, которое мы наблюдали. Часто наблюдаются частичные сращения (например, средняя панель B).
Часто наблюдаются частичные сращения (например, средняя панель B).
Рисунок 4. Гидролиз АТФ и растворимая…
Рисунок 4. Гидролиз АТФ и растворимый фактор(ы) необходимы для ремоделирования ядрышка.
( А…
Рисунок 4. Гидролиз АТФ и растворимый фактор(ы) необходимы для ремоделирования ядрышка. ( A ) Ядра были выделены из ооцитов, экспрессирующих RFP-Fbl и GFP-Npm1, немедленно перенесены в только ISB (вверху), ISB с добавлением 8 мМ АТФ (в центре) или ISB с добавлением 8 мМ AMP-PNP (внизу) ), и изображение. ( B ) Свежевыделенные ядра переносили в ISB с добавлением увеличивающихся количеств АТФ. ( C–D ) Относительная максимальная интенсивность флуоресценции ядер, совместно экспрессирующих GFP-NPM1 и RFP-FBL, инкубированных в ISB (необработанном) или ISB с добавлением 0–8 мМ АТФ.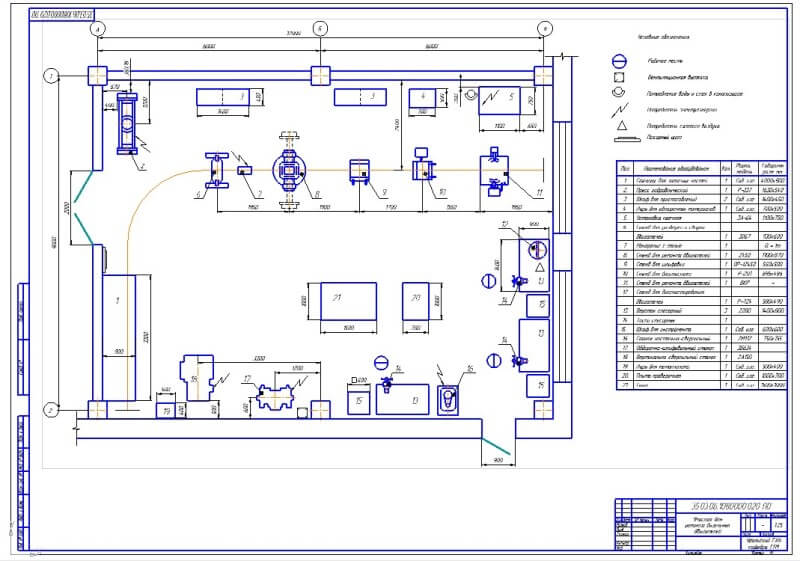 ( E ) Диаметр RFP-Fbl положительного плотного фибриллярного компонента после инкубации свежевыделенных ядер в повышающихся концентрациях АТФ. Чтобы проверить действие растворимых ядерных белков, ядра в ( A–E ) были выделены и немедленно помещены в ISB с указанными добавками или без них. Изображения в ( г. н.э. – г.) являются репрезентативными как минимум для трех независимых экспериментов. Данные в ( E ) представляют 298 независимых необработанных и 144 независимых обработанных 8 мМ АТФ очагов RFP-Fbl. Данные в ( C – D ) взяты из одного эксперимента с не менее чем 25 ядрышками на точку данных.
( E ) Диаметр RFP-Fbl положительного плотного фибриллярного компонента после инкубации свежевыделенных ядер в повышающихся концентрациях АТФ. Чтобы проверить действие растворимых ядерных белков, ядра в ( A–E ) были выделены и немедленно помещены в ISB с указанными добавками или без них. Изображения в ( г. н.э. – г.) являются репрезентативными как минимум для трех независимых экспериментов. Данные в ( E ) представляют 298 независимых необработанных и 144 независимых обработанных 8 мМ АТФ очагов RFP-Fbl. Данные в ( C – D ) взяты из одного эксперимента с не менее чем 25 ядрышками на точку данных.
Рисунок 5. Обработка 8 мМ GTP…
Рисунок 5. Обработка 8 мМ GTP повторяет результаты ATP.
( A ) Ядра были…
Рисунок 5. Обработка 8 мМ GTP повторяет результаты ATP.
Обработка 8 мМ GTP повторяет результаты ATP. ( A ) Ядра окрашивали конъюгированным фаллоидином Alexa Fluor 568 (Molecular Probes), удаляли растворимые белки в течение 1 часа, а затем помещали в реакционную камеру с ISB, дополненным тиофлавином Т и 8 мМ АТФ или 8 мМ GTP. . Затем выделили второе ядро и сразу же добавили в ту же реакционную камеру. Выделение и немедленное добавление к ИСБ обеспечивает перенос растворимых белков. Изображения были получены через 15 минут после добавления свежевыделенного ядра.
Рисунок 6. Суперфизиологический АТФ способствует ядрышковому…
Рисунок 6. Суперфизиологический АТФ способствует разборке ядрышек Ex Vivo, а AMPPNP – нет.
(…
Рисунок 6. Суперфизиологический АТФ способствует разборке ядрышек Ex Vivo, а AMPPNP – нет.
( A ) Ядра ооцитов, экспрессирующих GFP-Npm1 и RFP-Fbl, выделяли под маслом для сохранения содержимого ядер и инъецировали ~ равным объемом (9,2 нл) буфера (вверху), 50 мМ AMP-PNP (в центре), или 50 мМ АТФ (внизу). ( B ) Изображение с большим увеличением ядра, инъецированного 50 мМ АТФ. Стрелки указывают на устойчивые положительные точки RFP-Fbl. Изображения в ( B–C ) являются репрезентативными для 9 (буфер), 12 (AMP-PNP) или 18 (ATP) биологических повторов.
Рисунок 7. Гидротропная солюбилизация способствует ядрышковому…
Рисунок 7. Гидротропная солюбилизация способствует динамике ядрышкового белка.
( A ) Ядра ооцитов были…
Рисунок 7. Гидротропная солюбилизация способствует динамике ядрышковых белков.
( A ) Ядра ооцитов были выделены из ооцитов, экспрессирующих RFP-Fbl и GFP-Npm1, и немедленно перенесены в ISB отдельно (вверху) или ISB с добавлением АТФ, AMP-PNP или обоих нуклеотидов и визуализированы. ( B ) По сравнению с необработанными контролями, измерения максимальной интенсивности флуоресценции для GFP-Npm1 и C) RFP-Fbl показывают потерю интенсивности сигнала после добавления 1 мМ АТФ + 3 мМ AMP-PNP или 4 мМ АТФ. Изображения в ( A ) являются репрезентативными для 3 независимых экспериментов, в которых была количественно определена, объединена и проанализирована максимальная интенсивность флуоресценции GFP-Npm1 ( B ) и RFP-Fbl ( C ) от 155 до 264 ядрышек.
Рисунок 8. Обработка РНКазой повышает чувствительность ядрышек к…
Рисунок 8. Обработка РНКазой повышает чувствительность ядрышек к гидротропной солюбилизации.
Обработка РНКазой повышает чувствительность ядрышек к гидротропной солюбилизации.
( A ) Ядра GFP-Npm1…
Рисунок 8. Обработка РНКазой повышает чувствительность ядрышек к гидротропной солюбилизации. ( A ) Ядра из ооцитов, экспрессирующих GFP-Npm1 и RFP-Fbl, выделяли, переносили в OR2 или OR2 с добавлением 1 мг/мл РНКазы А и инкубировали в течение 1 часа перед обработкой нуклеотидами. ( B ) Оптические срезы истощенных растворимым белком и обработанных РНКазой А ядер, обедненных растворимым белком, не обработанных (слева), обработанных 8 мМ АТФ (в центре) или 8 мМ AMP-PNP (справа). ( C – D ) Интенсивность GFP-Npm1 и RFP-Fbl. Данные в ( B-D ) являются репрезентативными для трех независимых экспериментов и трех независимых лягушек. ( C – D ) представляют собой один эксперимент, содержащий 3–6 биологических повторов на группу лечения и 129–205 отдельных ядрышек.
Рисунок 9. Двухэтапная модель агрегации ядрышков…
Рисунок 9. Двухэтапная модель агрегации и дезагрегации ядрышков.
Мономерные белки самоассоциируются, стимулируя разделение фаз.…
Рисунок 9. Двухэтапная модель агрегации и дезагрегации ядрышков.Мономерные белки самоассоциируются, приводя к разделению фаз. Связывание РНК стабилизирует и созревает агрегаты, придавая устойчивость к гидротропной солюбилизации. Напротив, рибонуклеопротеиновые частицы дестабилизируются диффузионной АТФазой или истощением РНК, что делает их чувствительными к гидротропной солюбилизации, опосредованной АТФ.
См. это изображение и информацию об авторских правах в PMC
Похожие статьи
Активное жидкоподобное поведение ядрышек определяет их размер и форму в ооцитах Xenopus laevis.

Брэнгвинн С.П., Митчисон Т.Дж., Хайман А.А. Брангвинн С.П. и соавт. Proc Natl Acad Sci USA. 15 марта 2011 г.; 108 (11): 4334-9. doi: 10.1073/pnas.1017150108. Epub 2011 28 февраля. Proc Natl Acad Sci U S A. 2011. PMID: 21368180 Бесплатная статья ЧВК.
Протеостаз и регуляция внутри- и внеклеточной агрегации белков с помощью АТФ-независимых молекулярных шаперонов: α-кристаллинов хрусталика и молочных казеинов.
Карвер Дж. А., Экройд Х., Траскотт Р. Дж. В., Торн Д. С., Холт С. Карвер Дж.А. и соавт. Acc Chem Res. 2018 20 марта; 51 (3): 745-752. doi: 10.1021/acs.accounts.7b00250. Epub 2018 14 февраля. Acc Chem Res. 2018. PMID: 29442498 Рассмотрение.
Сборка частиц распознавания сигнала в связи с функцией амплифицированных ядрышек ооцитов Xenopus.
Соммервиль Дж., Брамвелл К.Л., Политц Дж.К., Педерсон Т. Соммервиль Дж. и др. Дж. Клеточные науки. 2005 15 марта; 118 (часть 6): 1299-307. doi: 10.1242/jcs.01726. Epub 2005 1 марта. Дж. Клеточные науки. 2005. PMID: 15741230
Пространственное расположение внутриядрышкового хроматина рДНК в амплифицированных ядрышках ооцитов Xenopus: структурные изменения предшествуют началу транскрипции рДНК.
Spring H, Meissneer B, Fischer R, Mouzaki D, Trendelenburg MF. Спринг Х и др. Int J Dev Biol. 1996 г., февраль; 40 (1): 263–72. Int J Dev Biol. 1996. PMID: 8735937
Гидротропная функция АТФ в хрусталике.
Greiner JV, Глонек Т. Greiner JV и др. Эксп. Разр. 2020 Январь; 190:107862.
 doi: 10.1016/j.exer.2019.107862. Epub 2019 24 октября.
Эксп. Разр. 2020.
PMID: 31669043
Рассмотрение.
doi: 10.1016/j.exer.2019.107862. Epub 2019 24 октября.
Эксп. Разр. 2020.
PMID: 31669043
Рассмотрение.
Посмотреть все похожие статьи
Цитируется
Раскрытие молекулярного механизма двойного действия АТФ на фазовое разделение в растворе ФУС.
Ren CL, Shan Y, Zhang P, Ding HM, Ma YQ. Рен С.Л. и соавт. Научная реклама 2022, 16 сентября; 8(37):eabo7885. doi: 10.1126/sciadv.abo7885. Epub 2022 14 сентября. Научная реклама 2022. PMID: 36103543 Бесплатная статья ЧВК.
АТФ: мг 2+ формирует материальные свойства белково-РНК-конденсатов и их разбиение на клиентов.
Юдалл Н.А., Андре А.А.М., ван Харен М.И.И., Нелиссен Ф.Т.Т., Йонкер А.
 , Спруйт Э.
Юдалл Н.А. и соавт.
Biophys J. 18 октября 2022 г.; 121 (20): 3962-3974. doi: 10.1016/j.bpj.2022.08.025. Epub 2022 24 августа.
Биофиз Дж. 2022.
PMID: 36004782
, Спруйт Э.
Юдалл Н.А. и соавт.
Biophys J. 18 октября 2022 г.; 121 (20): 3962-3974. doi: 10.1016/j.bpj.2022.08.025. Epub 2022 24 августа.
Биофиз Дж. 2022.
PMID: 36004782Компонентный анализ белковых компартментов ядрышек с использованием ооцитов Xenopus laevis.
Лаверинг Э.Д., Петрос И.Н., Уикс Д.Л. Лаверинг Э.Д. и соавт. Разница в росте разработчиков. 2022 авг; 64 (6): 306-317. doi: 10.1111/dgd.12794. Epub 2022 12 июня. Разница в росте разработчиков. 2022. PMID: 35607824 Бесплатная статья ЧВК.
Молекулярное и функциональное взаимодействие между мембраносвязанными органеллами и безмембранными конденсатами.
Чжоу С. Чжоу С. Front Cell Dev Biol. 2022 25 апр;10:896305. doi: 10.3389/fcell.
 2022.896305. Электронная коллекция 2022.
Front Cell Dev Biol. 2022.
PMID: 35547815
Бесплатная статья ЧВК.
Рассмотрение.
2022.896305. Электронная коллекция 2022.
Front Cell Dev Biol. 2022.
PMID: 35547815
Бесплатная статья ЧВК.
Рассмотрение.Высокие и стабильные уровни АТФ предотвращают аберрантную агрегацию внутриклеточных белков у дрожжей.
Такаине М., Имамура Х., Йошида С. Такаин М. и соавт. Элиф. 2022 19 апреля; 11: e67659. doi: 10.7554/eLife.67659. Элиф. 2022. PMID: 35438635 Бесплатная статья ЧВК.
Просмотреть все статьи «Цитируется по»
использованная литература
- Абравая К., Майерс М.П., Мерфи С.П., Моримото Р.И. Белок теплового шока человека hsp70 взаимодействует с HSF, фактором транскрипции, который регулирует экспрессию генов теплового шока. Гены и развитие. 1992; 6: 1153–1164. doi: 10.
 1101/gad.6.7.1153.
—
DOI
—
пабмед
1101/gad.6.7.1153.
—
DOI
—
пабмед
- Абравая К., Майерс М.П., Мерфи С.П., Моримото Р.И. Белок теплового шока человека hsp70 взаимодействует с HSF, фактором транскрипции, который регулирует экспрессию генов теплового шока. Гены и развитие. 1992; 6: 1153–1164. doi: 10.
- Андерсен Дж. С., Лам Ю. В., Леунг А. К., Онг С. Е., Лион К. Э., Ламонд А. И., Манн М. Динамика ядрышкового протеома. Природа. 2005; 433:77–83. дои: 10.1038/nature03207. — DOI — пабмед
- Банани С.
 Ф., Райс А.М., Пиплз В.Б., Лин И., Джайн С., Паркер Р., Розен М.К. Композиционный контроль фазово-разделенных клеточных тел. Клетка. 2016; 166: 651–663. doi: 10.1016/j.cell.2016.06.010.
—
DOI
—
ЧВК
—
пабмед
Ф., Райс А.М., Пиплз В.Б., Лин И., Джайн С., Паркер Р., Розен М.К. Композиционный контроль фазово-разделенных клеточных тел. Клетка. 2016; 166: 651–663. doi: 10.1016/j.cell.2016.06.010.
—
DOI
—
ЧВК
—
пабмед
- Банани С.
- Берри Дж., Брангвинн С.П., Хаатаджа М. Физические принципы внутриклеточной организации посредством активных и пассивных фазовых переходов. Отчеты о прогрессе в физике. 2018;81:046601. doi: 10.1088/1361-6633/aaa61e. — DOI — пабмед
- Боама Э.
 К., Котова Э., Гарабедян М., Ярник М., Тулин АВ. Поли(АДФ-рибоза) полимераза 1 (PARP-1) регулирует биогенез рибосом в ядрышках дрозофилы. Генетика PLoS. 2012;8:e1002442. doi: 10.1371/journal.pgen.1002442.
—
DOI
—
ЧВК
—
пабмед
К., Котова Э., Гарабедян М., Ярник М., Тулин АВ. Поли(АДФ-рибоза) полимераза 1 (PARP-1) регулирует биогенез рибосом в ядрышках дрозофилы. Генетика PLoS. 2012;8:e1002442. doi: 10.1371/journal.pgen.1002442.
—
DOI
—
ЧВК
—
пабмед
- Боама Э.
Типы публикаций
термины MeSH
вещества
Грантовая поддержка
- T32 GM007337/GM/NIGMS NIH HHS/США
- Программа обучения ученых-медиков/GM/NIGMS NIH HHS/США
- R01GM096767/GM/NIGMS NIH HHS/США
- R01HD084399/GM/NIGMS NIH HHS/США
- U54 GM105816/GM/NIGMS NIH HHS/США
- R01 HD084399/HD/NICHD NIH HHS/США
- R01 GM096767/GM/NIGMS NIH HHS/США
АТФ-независимая реверсия агрегата мембранного белка субъединицей 9 SRP хлоропласта0001
Balch, W. E., Morimoto, R.I., Dillin, A. & Kelly, J.F. Адаптация протеостаза для лечения заболеваний. Наука 319 , 916–919 (2008).
E., Morimoto, R.I., Dillin, A. & Kelly, J.F. Адаптация протеостаза для лечения заболеваний. Наука 319 , 916–919 (2008).
Артикул КАС пабмед Google Scholar
Хартл, Ф.У. и Хайер-Хартл, М. Молекулярные шапероны в цитозоле: от зарождающейся цепи к свернутому белку. Наука 295 , 1852–1858 (2002).
Артикул КАС пабмед Google Scholar
Чанг Х.-К., Танг Ю.-К., Хайер-Хартл М. и Хартл Ф.У. Снимок: молекулярный шаперон, часть I. Cell 128 , 212–213 (2007).
Артикул пабмед Google Scholar
Тан, Ю.-К., Чанг, Х.-К., Хайер-Хартл, М. и Хартл, Ф.У. Снимок: Молекулярные шапероны, часть II. Cell 128 , 412–413 (2007).
Артикул КАС пабмед Google Scholar
Дойл, С. М. и Викнер, С. Hsp104 и ClpB: машины для дезагрегации белков. Тренды Биохим. науч. 34 , 40–48 (2009).
М. и Викнер, С. Hsp104 и ClpB: машины для дезагрегации белков. Тренды Биохим. науч. 34 , 40–48 (2009).
Артикул КАС пабмед Google Scholar
Дойл, С.М., Хоскинс, Дж.Р. и Викнер, С. Сотрудничество между ремоделирующим белком ClpB AAA+ и системой шаперонов DnaK. Проц. Натл. акад. науч. США 104 , 11138–11144 (2007 г.).
Артикул КАС пабмед ПабМед Центральный Google Scholar
Рэндалл, Л.Л. и Харди, С.Дж.С. SecB, один маленький шаперон в сложной среде клетки. Сотовый. Мол. Жизнь наук. 59 , 1617–1623 (2002).
Артикул КАС пабмед Google Scholar
Уолтон, Т.А., Сандовал, К.М., Фаулер, К.А., Парди, А. и Соуза, М.К. Полость-шаперон Skp защищает свой субстрат от агрегации, но допускает независимую укладку доменов субстрата. Проц. Натл. акад. науч. США 106 , 1772–1777 (2009 г.).
Проц. Натл. акад. науч. США 106 , 1772–1777 (2009 г.).
Артикул КАС пабмед ПабМед Центральный Google Scholar
Стефанович С. и Хегде Р.С. Идентификация фактора таргетинга для вставки белка посттрансляционной мембраны в ER. Cell 128 , 1147–1159 (2007).
Артикул КАС пабмед Google Scholar
Михара К. и Омура Т. Цитоплазматические шапероны в нацеливании предшественников на митохондрии: роль MSF и hsp70. Trends Cell Biol. 6 , 104–108 (1996).
Артикул КАС пабмед Google Scholar
Шунеманн, Д. Структура и функция хлоропластной частицы распознавания сигнала. Курс. Жене. 44 , 295–304 (2004).
Артикул КАС Google Scholar
Schuenemann, D. et al. Новая частица распознавания сигналов нацеливает светособирающие белки на мембраны тилакоидов. Проц. Натл. акад. науч. США 95 , 10312–10316 (1998).
et al. Новая частица распознавания сигналов нацеливает светособирающие белки на мембраны тилакоидов. Проц. Натл. акад. науч. США 95 , 10312–10316 (1998).
Артикул КАС пабмед ПабМед Центральный Google Scholar
Groves, M.R. et al. Функциональная характеристика рекомбинантной частицы распознавания сигнала хлоропласта. Дж. Биол. хим. 276 , 27778–27786 (2001).
Артикул КАС пабмед Google Scholar
Ту, С.-Дж., Шунеманн, Д. и Хоффман, Н.Э. Хлоропласт FtsY, хлоропластная частица, распознающая сигнал, и GTP необходимы для восстановления растворимой фазы транспорта светособирающего белка хлорофилла в тилакоидные мембраны. Дж. Биол. хим. 274 , 27219–27224 (1999).
Артикул КАС пабмед Google Scholar
Климюк В. И. и другие. Белок хромодомен, кодируемый геном CAO Arabidopsis , представляет собой специфичный для растений компонент пути частицы распознавания сигнала хлоропласта, который участвует в нацеливании на LHCP. Plant Cell 11 , 87–99 (1999).
И. и другие. Белок хромодомен, кодируемый геном CAO Arabidopsis , представляет собой специфичный для растений компонент пути частицы распознавания сигнала хлоропласта, который участвует в нацеливании на LHCP. Plant Cell 11 , 87–99 (1999).
Артикул КАС пабмед ПабМед Центральный Google Scholar
Эйхакер, Л.А. и Генри, Р. Функция хлоропластного SRP в экспорте тилакоидного белка. Биохим. Биофиз. Acta 1541 , 120–134 (2001).
Артикул КАС пабмед Google Scholar
Йонас-Штраубе, Э., Хутин, К., Хоффман, Н.Э. и Шунеманн, Д. Функциональный анализ взаимодействующих с белком доменов хлоропласта SRP43. Дж. Биол. хим. 276 , 24654–24660 (2001).
Артикул КАС пабмед Google Scholar
Goforth, R. L. et al. Регуляция цикла GTPase в нацеливании на белок на основе частиц посттрансляционного распознавания сигнала включает cpSRP43. Дж. Биол. хим. 279 , 43077–43084 (2004 г.).
L. et al. Регуляция цикла GTPase в нацеливании на белок на основе частиц посттрансляционного распознавания сигнала включает cpSRP43. Дж. Биол. хим. 279 , 43077–43084 (2004 г.).
Артикул КАС пабмед Google Scholar
Стенгель, К.Ф. и другие. Структурная основа для специфического распознавания субстрата белком частицы распознавания сигналов хлоропластов cpSRP43. Наука 321 , 253–256 (2008).
Артикул КАС пабмед Google Scholar
Hermkes, R., Funke, S., Richter, C., Kuhlmann, J. & Schünemann, D. α-спираль второго хромодомена субъединицы 43 кДа хлоропластной частицы распознавания сигнала облегчает связывание с субъединица 54 кДа. ФЭБС Письмо. 580 , 3107–3111 (2006 г.).
Артикул КАС пабмед Google Scholar
Лю, З. и др. Кристаллическая структура основного светособирающего комплекса шпината при разрешении 2,72 Å. Природа 428 , 287–292 (2004).
и др. Кристаллическая структура основного светособирающего комплекса шпината при разрешении 2,72 Å. Природа 428 , 287–292 (2004).
Артикул КАС пабмед Google Scholar
Каммарата, К.В. и Шмидт, Г.В. Реконструкция in vitro продукта светособирающего гена: делеционный мутагенез и анализ связывания пигмента. Биохимия 31 , 2779–2789 (1992).
Артикул КАС пабмед Google Scholar
Paulsen, H., Rumler, U. & Rudiger, W. Реконструкция пигментсодержащих комплексов из светособирающего хлорофилл a/b-связывающего белка, сверхэкспрессированного в Escherichia coli . Planta 181 , 204–211 (1990).
Артикул КАС пабмед Google Scholar
Делилль, Дж. и др. Новый элемент распознавания предшественника облегчает посттрансляционное связывание с частицей распознавания сигнала в хлоропластах. Проц. Натл. акад. науч. США 97 , 1926–1931 (2000).
Проц. Натл. акад. науч. США 97 , 1926–1931 (2000).
Артикул КАС пабмед ПабМед Центральный Google Scholar
Ту, С.Дж., Петерсон, Э.К., Генри, Р. и Хоффман, Н.Э. Домен L18 светособирающих белков хлорофилла связывается с частицей распознавания сигналов хлоропластов 43. Дж. Биол. хим. 275 , 13187–13190 (2000).
Артикул КАС пабмед Google Scholar
Ореб, М., Тьюс, И. и Шлейфф, Э. Полицейские Tic ‘n’ Toc, дверь в хлоропласты. Trends Cell Biol. 18 , 19–27 (2008).
Артикул КАС пабмед Google Scholar
Ли, X., Генри, Р., Юань, Дж., Клайн, К. и Хоффман, Н.Е. Хлоропластный гомолог субъединицы частицы распознавания сигнала SRP54 участвует в посттрансляционной интеграции белка в мембраны тилакоидов. Проц. Натл. акад. науч. США 92 , 3789–3793 (1995).
Проц. Натл. акад. науч. США 92 , 3789–3793 (1995).
Артикул КАС пабмед ПабМед Центральный Google Scholar
Jansson, S. Справочник по генам Lhc и их родственникам в Arabidopsis . Trends Plant Sci. 4 , 236–240 (1999).
Артикул КАС пабмед Google Scholar
Барков С.Р., Левченко И., Бейкер Т.А. и Зауэр, Р.Т. Транслокация полипептида с помощью протеазной машины AAA+ ClpXP. Хим. биол. 16 , 605–612 (2009).
Артикул КАС пабмед ПабМед Центральный Google Scholar
Tomoyasu, T., Mogk, A., Langen, H., Goloubinoff, P. & Bukau, B. Генетическое исследование ролей шаперонов и протеаз в сворачивании и деградации белков в цитозоле Escherichia coli . Мол. микробиол. 40 , 397–413 (2001).
микробиол. 40 , 397–413 (2001).
Артикул КАС пабмед Google Scholar
Mogk, A. et al. Широкая, но высокая субстратная специфичность: проблема белков AAA+. Дж. Структура. биол. 146 , 90–98 (2004).
Артикул КАС пабмед Google Scholar
Ali, M., Lipfert, J., Seifert, S., Herschlag, D. & Doniach, S. Безлигандное состояние рибопереключателя TPP: частично свернутая структура РНК. Дж. Мол. биол. 396 , 153–165 (2010).
Артикул КАС пабмед Google Scholar
Sivaraja, V. et al. Трехмерные структуры решений хромодоменов cpSRP43. Дж. Биол. хим. 280 , 41465–41471 (2005 г.).
Артикул КАС пабмед Google Scholar
Голубинофф, П. , Могк, А., Бен Цви, А.П., Томоясу, Т. и Букау, Б. Последовательный механизм солюбилизации и рефолдинга стабильных белковых агрегатов с помощью сети бишаперонов. Проц. Натл. акад. науч. США 96 , 13732–13737 (1999).
, Могк, А., Бен Цви, А.П., Томоясу, Т. и Букау, Б. Последовательный механизм солюбилизации и рефолдинга стабильных белковых агрегатов с помощью сети бишаперонов. Проц. Натл. акад. науч. США 96 , 13732–13737 (1999).
Артикул КАС пабмед ПабМед Центральный Google Scholar
Mogk, A. et al. Рефолдинг субстратов, связанных с небольшими Hsps, зависит от реакции дезагрегации, наиболее эффективно опосредованной ClpB/DnaK. Дж. Биол. хим. 278 , 31033–31042 (2003 г.).
Артикул КАС пабмед Google Scholar
Дойл, С.М. и другие. Асимметричное замедление активности АТФазы ClpB или Hsp104 высвобождает активность ремоделирования белка. Нац. Структура Мол. биол. 14 , 114–122 (2007).
Артикул КАС пабмед ПабМед Центральный Google Scholar
Schlothauer, T. , Mogk, A., Dougan, D.A., Bukau, B. & Turgay, K. MecA, адаптерный белок, необходимый для активности шаперона ClpC. Проц. Натл. акад. науч. США 100 , 2306–2311 (2003 г.).
, Mogk, A., Dougan, D.A., Bukau, B. & Turgay, K. MecA, адаптерный белок, необходимый для активности шаперона ClpC. Проц. Натл. акад. науч. США 100 , 2306–2311 (2003 г.).
Артикул КАС пабмед ПабМед Центральный Google Scholar
Пансе В.Г., Фогель П., Троммер В.Е. и Варадараджан, Р. Термодинамический механизм соединения для дезагрегации модельного пептидного субстрата с помощью шаперона SecB. Дж. Биол. хим. 275 , 18698–18703 (2000 г.).
Артикул КАС пабмед Google Scholar
Хачия, Н. и др. MSF, новый цитоплазматический шаперон, который функционирует в направлении предшественников к митохондриям. EMBO J. 13 , 5146–5154 (1994).
Артикул КАС пабмед ПабМед Центральный Google Scholar
Комия Т. , Хачия Н., Сакагучи М., Омура Т. и Михара К. Распознавание сигналов, направленных на митохондрии, цитозольным фактором стимуляции импорта, MSF. Дж. Биол. хим. 269 , 30893–30897 (1994).
, Хачия Н., Сакагучи М., Омура Т. и Михара К. Распознавание сигналов, направленных на митохондрии, цитозольным фактором стимуляции импорта, MSF. Дж. Биол. хим. 269 , 30893–30897 (1994).
КАС пабмед Google Scholar
Jaru-Ampornpan, P., Chandrasekar, S. & Shan, S. Эффективное взаимодействие между двумя GTPases позволяет хлоропластному пути SRP обходить потребность в SRP РНК. Мол. биол. Cell 18 , 2636–2645 (2007).
Артикул КАС пабмед ПабМед Центральный Google Scholar
Юань Дж. и др. АТФ стимулирует интеграцию сигнальных частиц распознавания (SRP)/белков, поддерживаемых FtsY, в хлоропласты. Дж. Биол. хим. 277 , 32400–32404 (2002 г.).
Артикул КАС пабмед Google Scholar
Свергун Д. И. Математические методы анализа данных малоуглового рассеяния. J. Appl. Кристаллогр. 24 , 485–492 (1991).
И. Математические методы анализа данных малоуглового рассеяния. J. Appl. Кристаллогр. 24 , 485–492 (1991).
Артикул КАС Google Scholar
Свергун Д.И. Определение параметра регуляризации в методах косвенного преобразования с использованием критериев восприятия. J. Appl. Кристаллогр. 25 , 495–503 (1992).
Артикул КАС Google Scholar
Свергун Д.И. Восстановление структуры биологических макромолекул с низким разрешением из рассеяния в растворе с использованием имитации отжига. Биофиз. Дж. 76 , 2879–2886 (1999).
Артикул КАС пабмед ПабМед Центральный Google Scholar
Свергун Д.И., Петухов М.В. и Кох, М.Х.Дж. Определение доменной структуры белков по рассеянию рентгеновских лучей в растворе. Биофиз. J. 80 , 2946–2953 (2001).
Биофиз. J. 80 , 2946–2953 (2001).
Артикул КАС пабмед ПабМед Центральный Google Scholar
Козин М., Свергун Д.И. Автоматическое сопоставление структурных моделей высокого и низкого разрешения. J. Appl. Кристаллогр. 34 , 33–41 (2001).
Артикул КАС Google Scholar
Волков В., Свергун Д.И. Уникальность определения формы ab initio при малоугловом рассеянии. J. Appl. Кристаллогр. 36 , 860–864 (2003).
Артикул КАС Google Scholar
Wriggers, W., Milligan, R.A. и Маккаммон, Дж.А. Situs: пакет для стыковки кристаллических структур с картами низкого разрешения, полученными с помощью электронной микроскопии. Дж. Структура. биол. 125 , 185–195 (1999).
