Аналитическое оборудование SHIMADZU для фармацевтической отрасли. Обзор. Часть 6. Жидкостные хроматографы
Аналитическое оборудование производства японской приборостроительной корпорации SHIMADZU хорошо известно на фармацевтических предприятиях Украины. Большое количество уже установленных там приборов SHIMADZU (более 340 комплектов) и постоянные запросы на новое оборудование иллюстрируют растущий интерес к нему у специалистов отрасли. В целях предоставления информации о возможностях оборудования и по случаю отмечавшегося в 2019 г. 25-летия прямых поставок в Украину принято решение опубликовать обзор аналитического оборудования производства корпорации SHIMADZU, применяемого в фармацевтической отрасли. Предыдущие части обзора были опубликованы в № 6 за 2019 г. и в №№ 1, 2, 3 и 5 за 2020 г. В данном выпуске журнала публикуется шестая часть обзора.
Сухомлинов А.Б., директор компании «ШимЮкрейн»
Корпорация SHIMADZU выпускает жидкостные хроматографы в двух вариантах конструкционного исполнения – моноблочные (интегрированная конструкция) и модульные. На смену хорошо известным моноблочным приборам серии LC-2010 в настоящее время пришли приборы общей серии «i-Plus», включающей серии LC-2030 Plus и LC-2040 Plus. Преимущества интегрированной конструкции состоят в компактности прибора, содержащего изначально все блоки, которые необходимы для работы, включая насосную систему, дегазатор, термостат колонок, автоинжектор и детектор, а также в минимальной длине соединительных элементов. Новые моноблочные приборы выпускаются в двух сериях для того, чтобы изначально пользователь мог учитывать величину максимального давления. Приборы всех моделей серии LC-2030 Plus рассчитаны на максимальное давление 44 МПа, в то время как приборы серии LC-2040 Plus – на максимальное давление 66 МПа. Серия LC-2030 Plus объединяет три модели. Прибор модели LC-2030 Plus имеет встроенный спектрофотометрический детектор. Второй прибор этой серии – LC-2030C Plus – также оснащен встроенным спектрофотометрическим детектором, но отличается тем, что его автоинжектор предусматривает возможность охлаждения проб.
На смену хорошо известным моноблочным приборам серии LC-2010 в настоящее время пришли приборы общей серии «i-Plus», включающей серии LC-2030 Plus и LC-2040 Plus. Преимущества интегрированной конструкции состоят в компактности прибора, содержащего изначально все блоки, которые необходимы для работы, включая насосную систему, дегазатор, термостат колонок, автоинжектор и детектор, а также в минимальной длине соединительных элементов. Новые моноблочные приборы выпускаются в двух сериях для того, чтобы изначально пользователь мог учитывать величину максимального давления. Приборы всех моделей серии LC-2030 Plus рассчитаны на максимальное давление 44 МПа, в то время как приборы серии LC-2040 Plus – на максимальное давление 66 МПа. Серия LC-2030 Plus объединяет три модели. Прибор модели LC-2030 Plus имеет встроенный спектрофотометрический детектор. Второй прибор этой серии – LC-2030C Plus – также оснащен встроенным спектрофотометрическим детектором, но отличается тем, что его автоинжектор предусматривает возможность охлаждения проб. В третий прибор данной серии – LC-2030C-3D Plus – встроены диодно-матричный детектор и автоинжектор с возможностью охлаждения проб.
В третий прибор данной серии – LC-2030C-3D Plus – встроены диодно-матричный детектор и автоинжектор с возможностью охлаждения проб.
Фото № 1. Жидкостный хроматограф LC2040С PLus
Серия LC-2040 Plus объединяет две модели. Прибор модели LC-2040C Plus (фото № 1) имеет встроенный спектрофотометрический детектор и автоинжектор с возможностью охлаждения проб, а прибор модели LC-2040C- 3D оснащен встроенным диодноматричным детектором и автоинжектором с возможностью охлаждения проб. Применительно ко всем пяти приборам новых серий употребляется также общее название: приборы серии «i-Plus». Индекс «i» происходит от слов «innovative», «intuitive» и «intelligent», характеризующих приборы указанных серий. Аргументация каждого из этих трех определений состоит в следующем. Применение новых технологий обеспечивает высокие технические характеристики, что, в свою очередь, повышает надежность результатов и стабильность работы оборудования. Например, использование новой технологии температурного контроля детектора, которая предусматривает помимо температурного контроля проточной кюветы еще и температурный контроль оптической системы детектора (TC-optics) как для спектрофотометрического, так и для диодно-матричного детектора, обеспечивает стабильную базовую линию, практически не имеющую флуктуаций под влиянием изменения комнатной температуры. Существенным преимуществом приборов серии «i-Plus» является значительное сокращение цикла работы автоинжектора. При использовании этих приборов в течение 10 мин выполняется 40 инжекций, что позволяет быстрее проводить анализ серий из большого числа
Существенным преимуществом приборов серии «i-Plus» является значительное сокращение цикла работы автоинжектора. При использовании этих приборов в течение 10 мин выполняется 40 инжекций, что позволяет быстрее проводить анализ серий из большого числа
проб. Важной характеристикой для любого жидкостного хроматографа является доля переноса
остаточного загрязнения. В приборах серии «i-Plus» этот параметр составляет всего 0,0025%, что дает возможность осуществлять измерение низких концентраций с высокой точностью.
Приборы серии «i-Plus» отличаются высокой воспроизводимостью при инжектировании малых объемов (1 мкл и менее). Например, при вводе пробы объемом 1 мкл воспроизводимость по площади составляет 0,076% RSD, а при уменьшении объема пробы до 0,5 мкл воспроизводимость ухудшается всего лишь до величины 0,121% RSD. Такая характеристика прибора позволяет выполнять анализ концентрированных проб без их разбавления.
Фото № 2. Жидкостный хроматограф LC40
Приборы серии «i-Plus» могут работать с различными детекторами помимо тех, которые изначально встроены в каждую конкретную модель (то есть либо спектрофотометрического, либо диодно-матричного). Известно, что подавляющее большинство хроматографических методик, применяемых в фарманализе,
Известно, что подавляющее большинство хроматографических методик, применяемых в фарманализе,
предусматривает использование спектрофотометрических или диодно-матричных детекторов (которые также являются спектрофотометрическими, но с другим режимом измерения). В то же время имеется значительное количество соединений, которые не поглощают свет в ультрафиолетовом и видимом диапазонах, вследствие чего для их определения нужны другие детектирующие системы. Для этого в жидкостных хроматографах применяются следующие детекторы: рефрактометрический, электрохимический (вольтамперометрический) и детектор по светорассеянию. Приоритет спектрофотометрических детекторов в жидкостной хроматографии основан на ряде объективных причин, хорошо известных аналитикам. В первую очередь это удачное сочетание наличия фотометрической активности в УФ-видимом диапазоне у большинства определяемых соединений с отсутствием фотометрической активности в том же спектральном диапазоне у соединений, образующих подвижную фазу. Другими причинами являются высокая чувствительность, широкий динамический диапазон и хорошая воспроизводимость. Однако при отсутствии фотометрической активности в УФ-видимом диапазоне у того или иного определяемого соединения приходится использовать другие детекторы, чаще – достаточно простой рефрактометрический детектор. Ограничения в его применении – недостаточная чувствительность и невозможность работы с градиентными системами. Этих недостатков лишены электрохимический (вольт-амперометрический) детектор и детектор по светорассеянию. Поэтому, несмотря на относительную сложность данных детекторов, их использование в ряде случаев предусмотрено фармакопейными статьями. Важной особенностью приборов серии «i-Plus» является возможность включения дополнительного детектора (либо рефрактометрического, либо электрохимического, либо детектора по светорассеянию) в общую систему управления прибором вместе со встроенным спектрофотометрическим или диодно-матричным детектором. К удобствам работы на приборе серии «i-Plus» следует отнести также наличие графического дисплея, позволяющего осуществлять мониторинг процесса хроматографического разделения даже при отсутствии компьютера, наличие функции автовалидации, позволяющей проверять стабильность подачи растворителя, точность градиента, точность длины волны и т.
Другими причинами являются высокая чувствительность, широкий динамический диапазон и хорошая воспроизводимость. Однако при отсутствии фотометрической активности в УФ-видимом диапазоне у того или иного определяемого соединения приходится использовать другие детекторы, чаще – достаточно простой рефрактометрический детектор. Ограничения в его применении – недостаточная чувствительность и невозможность работы с градиентными системами. Этих недостатков лишены электрохимический (вольт-амперометрический) детектор и детектор по светорассеянию. Поэтому, несмотря на относительную сложность данных детекторов, их использование в ряде случаев предусмотрено фармакопейными статьями. Важной особенностью приборов серии «i-Plus» является возможность включения дополнительного детектора (либо рефрактометрического, либо электрохимического, либо детектора по светорассеянию) в общую систему управления прибором вместе со встроенным спектрофотометрическим или диодно-матричным детектором. К удобствам работы на приборе серии «i-Plus» следует отнести также наличие графического дисплея, позволяющего осуществлять мониторинг процесса хроматографического разделения даже при отсутствии компьютера, наличие функции автовалидации, позволяющей проверять стабильность подачи растворителя, точность градиента, точность длины волны и т. д. Кроме того, предусмотрена возможность управления прибором на расстоянии.
д. Кроме того, предусмотрена возможность управления прибором на расстоянии.
📜 Инструкция по применению Эфлейра® 💊 Состав препарата Эфлейра® ✅ Применение препарата Эфлейра® 📅 Условия хранения Эфлейра® ⏳ Срок годности Эфлейра® Сохраните у себя Поиск аналогов Взаимодействие Описание лекарственного препарата Эфлейра® (Efleira) Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для печатного издания справочника Видаль 2022 года. Дата обновления: 2021.12.14 Владелец регистрационного удостоверения:БИОКАД, АО (Россия) Контакты для обращений:БИОКАД АО (Россия) Код ATX: L04AC (Ингибиторы интерлейкина) Активное вещество: нетакимаб (netakimab) Rec.INN зарегистрированное ВОЗ Лекарственная форма
Форма выпуска, упаковка и состав препарата Эфлейра®Раствор для п/к введения от бесцветного до светло-желтого или светло-желтого с коричневатым оттенком цвета, прозрачный или слегка опалесцирующий.
Вспомогательные вещества: натрия ацетата тригидрат — 1.74 мг, трегалозы дигидрат — 80 мг, полоксамер 188 — 0.5 мг, уксусная кислота ледяная — до pH 5.0, вода д/и — до 1 мл. 1 мл — шприцы трехкомпонентные (1) — упаковки ячейковые контурные (2) в комплекте с салфетками спиртовыми (2 шт.) — пачки картонные. Клинико-фармакологическая группа: Ингибитор интерлейкина Фармако-терапевтическая группа: Интерлейкина ингибитор Фармакологическое действиеНетакимаб является рекомбинантным гуманизированным моноклональным антителом, в терапевтических концентрациях специфически связывающим интерлейкин-17А (ИЛ-17А), находящийся непосредственно в тканях или в крови и других биологических жидкостях. ИЛ-17А – провоспалительный цитокин, гиперпродукция которого преимущественно обусловлена активацией Th27-лимфоцитов. В рамках врожденного иммунитета ИЛ-17А выполняет защитную роль. При хронических иммуновоспалительных заболеваниях патологическая активация Th27-лимфоцитов и гиперпродукция ИЛ-17 стимулирует Т-клеточный ответ и усиленную продукцию других медиаторов воспаления: ИЛ-1, ИЛ-6, ФНОα, факторов роста (Г-КСФ, ГМ-КСФ) и различных хемокинов. Нетакимаб обладает высокой термодинамической константой специфического связывания с ИЛ-17А человека. Применение нетакимаба не сопровождается статистически значимым изменением уровня Т-лимфоцитов и не влияет на уровень и соотношение иммуноглобулинов классов А, G и М. Специфическая противовоспалительная активность нетакимаба продемонстрирована в тестах in vitro и in vivo. Нетакимаб дозозависимо ингибирует ИЛ-17 и ФНОα-зависимую продукцию ИЛ-6 на культуре клеток при IC50 40 pM. На модели коллаген-индуцированного артрита у яванских макак (Macaca fascicularis) многократное (1 раз в неделю в течение 4 недель) п/к введение нетакимаба сопровождается снижением выраженности воспалительной реакции в суставах, что подтверждено при гистологическом исследовании (суставной хрящ остается интактным, синовиальные оболочки — без признаков поражения и воспалительной реакции, пролиферации синовиоцитов не отмечено). У больных псориазом использование нетакимаба сопровождается угасанием явлений воспаления и гиперкератоза в коже, достоверным снижением уровня С-реактивного белка и СОЭ. У пациентов с активным анкилозирующим спондилитом и псориатическим артритом на фоне применения нетакимаба отмечается уменьшение симптомов воспаления в позвоночнике, энтезисах и суставах, а также быстрое снижение концентрации С-реактивного белка, являющегося маркером воспаления. ФармакокинетикаВсасывание/распределение Изменение концентрации нетакимаба после п/к введения препарата является дозозависимым (значения Сmax, Cmax—mult, AUC0-t находятся в прямой зависимости от дозы). Препарат характеризуется медленной фазой абсорбции с постепенным линейным нарастанием концентрации в сыворотке крови. При однократном п/к введении нетакимаба в дозе 120 мг пациентам с бляшечным псориазом препарат начинал обнаруживаться в сыворотке крови в течение 0. При повторных введениях отмечено накопление препарата в сыворотке крови с ростом концентрации в 1.8-3.6 раза. Максимальная концентрация при многократном введении (Cmax-mult) составляла 33.0 (23.1-44.0) мкг/мл и достигалась (Tmax—mult) через 1680 (672-2016) ч. Выведение Характеристики выведения нетакимаба являются типичными для препаратов на основе моноклональных антител: показатели Kel, T Средний клиренс нетакимаба при однократном введении в дозе 120 мг пациентам с бляшечным псориазом составил 1.8 л/сут. Фармакокинетические параметры нетакимаба у пациентов с анкилозирующим спондилитом схожи с таковыми у пациентов с бляшечным псориазом. Фармакокинетика в особых клинических случаях Фармакокинетические параметры нетакимаба у пациентов с анкилозирующим спондилитом схожи с таковыми у пациентов с бляшечным псориазом. Пациенты с почечной и печеночной недостаточностью: фармакокинетические данные у больных с почечной и печеночной недостаточностью отсутствуют. Пациенты в возрасте старше 65 лет: фармакокинетические данные у лиц в возрасте старше 65 лет отсутствуют. Показания препарата Эфлейра®
Открыть список кодов МКБ-10
Режим дозированияПрименение препарата Эфлейра® должно осуществляться под наблюдением врачей, имеющих опыт лечения заболеваний, при которых показан препарат Эфлейра®. После соответствующего обучения возможно самостоятельное введение препарата пациентом при условии динамического наблюдения со стороны лечащего врача. Препарат Эфлейра® можно применять как в стационарных, так и в амбулаторных условиях. Препарат вводят в дозе 120 мг в виде двух п/к инъекций по 1 мл препарата с концентрацией 60 мг/мл. Лечение бляшечного псориаза среднетяжелой и тяжелой степени у взрослых пациентов, когда показана системная терапия или фототерапия Рекомендуемая доза — 120 мг в виде двух подкожных инъекций по 1 мл (60 мг) препарата, каждая вводится 1 раз в неделю на неделях 0, 1 и 2, затем 1 раз каждые 4 недели. Лечение активного анкилозирующего спондилита при недостаточном ответе на стандартную терапию Рекомендуемая доза — 120 мг в виде двух подкожных инъекций по 1 мл (60 мг) препарата каждая. Препарат вводится 1 раз в неделю на неделях 0, 1 и 2, затем каждые 2 недели. Лечение активного псориатического артрита в режиме монотерапии или в комбинации с метотрексатом при недостаточном ответе на стандартную терапию Рекомендуемая доза — 120 мг в виде двух подкожных инъекций по 1 мл (60 мг) препарата каждая. Препарат вводится 1 раз в неделю на неделях 0, 1 и 2, затем каждые 2 недели до недели 10 включительно. Далее с недели 14 препарат вводится в дозе 120 мг в виде двух подкожных инъекций по 1 мл (60 мг) каждая 1 раз в 4 недели.
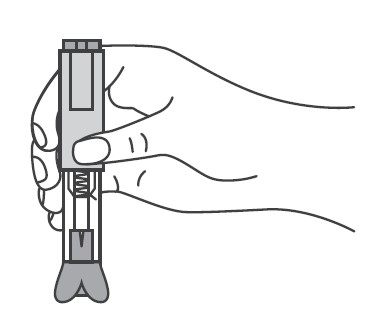
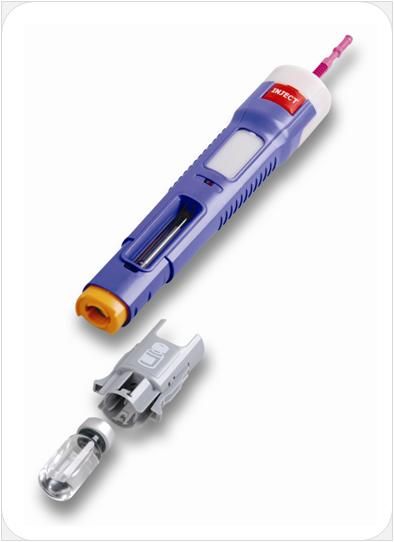
При пропуске очередного введения по любой причине инъекция препарата Эфлейра® должна быть произведена как можно быстрее. Указания по применению Подготовка к проведению п/к инъекции Тщательно вымыть руки. Достать упаковку с двумя шприцами/автоинжекторами с препаратом Эфлейра® из холодильника, затем извлечь из картонной пачки и ячейковой упаковки два шприца/автоинжектора и положить на чистую поверхность. Убедиться, что срок хранения препарата, указанный на картонной пачке и шприце/автоинжекторе не истек. Препарат Эфлейра® в преднаполненном шприце Препарат Эфлейра® в автоинжекторе Осмотреть шприцы/автоинжекторы, а также лекарственный препарат, находящийся в них.
Перед введением шприцы/автоинжекторы с препаратом Эфлейра® следует довести до комнатной температуры, для этого необходимо оставить шприц при комнатной температуре в течение приблизительно 25-30 мин. Не следует согревать шприц/автоинжектор каким-либо другим способом. Подготовить салфетку/ватный тампон, спиртовой раствор. На данном этапе не следует снимать колпачок шприца/автоинжектора. Техника выполнения п/к инъекции препарата Эфлейра® в преднаполненном шприце Выбор и подготовка места для инъекции Выбрать место инъекции (передняя брюшная стенка (отступая не менее 5 см от пупка), передняя и боковая поверхность бедра или средняя треть наружной части плеча (возможные места для инъекций закрашены на рисунке ниже)). Места инъекций и стороны следует менять при каждой последующей инъекции. Расстояние между двумя введениями должно составлять как минимум 5 см. Нельзя вводить препарат в место на коже, где имеется болезненность, покраснение, уплотнение или кровоподтек (эти признаки могут указывать на наличие инфекции). По возможности не следует вводить препарат в псориатическую бляшку. Место для укола необходимо обработать спиртовой салфеткой/ватным тампоном круговыми движениями. Шприц не встряхивать. Снять колпачок с иглы, не дотрагиваясь до иглы и избегая ее прикосновения к другим поверхностям. Большим и указательным пальцами одной руки взять в складку обработанную кожу. В другую руку взять шприц, держа его градуированной поверхностью вверх. Введение препарата необходимо осуществлять под углом 45 или 90 градусов к поверхности кожи в зависимости от толщины кожи и выраженности подкожно-жирового слоя (у худощавых пациентов введение препарата осуществляется под углом 45 градусов, у пациентов с толщиной кожной складки более 1. Одним быстрым движением полностью ввести иглу в кожную складку. После введения иглы складку кожи следует отпустить. Ввести весь раствор медленным постоянным надавливанием на поршень шприца в течение 2-5 сек. Когда шприц будет пустым, вынуть иглу из кожи под тем же углом. Сухой стерильной салфеткой/ватным шариком слегка прижать область инъекции, но не растирать. Из места инъекции может выделиться небольшое количество крови. При необходимости можно воспользоваться пластырем. Ввести вторую дозу препарата Эфлейра® аналогичным образом предпочтительно в ту же анатомическую область при условии, что место последующей инъекции должно быть не ближе 5 см от предыдущей. Время выполнения двух инъекций не должно превышать 10 мин. После инъекции шприц повторно не использовать. Техника выполнения п/к инъекции препарата Эфлейра® в автоинжекторе Устройство автоинжектора: Автоинжектор не встряхивать. Не следует снимать защитный колпачок с автоинжектора до выполнения инъекции. Необходимо проверить срок годности препарата по маркировке на упаковке, оценить целостность автоинжектора и состояние раствора через зону контроля автоинжектора. Не следует использовать автоинжектор в случае его повреждения, изменения цвета и прозрачности раствора, а также при истечении срока годности. Разместить автоинжектор на чистой горизонтальной поверхности. Выбрать место введения (область брюшной стенки (отступая не менее 5 см от пупка) или передняя поверхность бедра) и обработать кожу в области введения спиртовой салфеткой. Непосредственно перед инъекцией одной рукой снять колпачок с автоинжектора, удерживая другой рукой его корпус. Одной рукой взять в складку обработанную спиртовой салфеткой кожу и удерживать в течение всей процедуры инъекции. В другую руку взять автоинжектор, удерживая его за корпус. Введение препарата необходимо осуществлять, плотно прижав автоинжектор под углом 90 градусов к поверхности кожи. Удерживая автоинжектор под углом 90 градусов к поверхности кожной складки, надавить до упора на кнопку автоинжектора. Послышится щелчок, указывающий на начало инъекции. Не следует изменять положение автоинжектора. Необходимо удерживать кнопку в течение 10 сек до окончания инъекции. Если инъекция не запустилась, следует отпустить кнопку и проверить, плотно ли прижат автоинжектор к кожной складке. Необходимо прижать плотно автоинжектор к коже и повторить процедуру инъекции, вновь нажав на кнопку. Следует удерживать автоинжектор плотно прижатым к коже еще несколько секунд для полного введения лекарственного вещества. Осмотрев зону контроля, необходимо убедиться, что вся доза препарата введена и контейнер пуст. После окончания инъекции извлечь автоинжектор, игла автоматически закроется защитным цилиндром. Сухой стерильной салфеткой/ватным шариком слегка прижать область инъекции, но не растирать область выполненной инъекции. Ввести вторую дозу препарата Эфлейра® аналогичным образом предпочтительно в ту же анатомическую область при условии, что место последующей инъекции должно быть не ближе 5 см от предыдущей. Время выполнения двух инъекций не должно превышать 10 мин. После инъекции автоинжектор повторно не использовать. Утилизация расходного материала Неиспользованный раствор препарата, использованные шприцы/автоинжекторы, салфетки/ватные тампоны и другие расходные материалы подлежат утилизации с применением закрывающегося, устойчивого к проколам контейнера для острых предметов из пластика или стекла. Не допускать хранения использованных шприцев/автоинжекторов в местах, доступных для детей. Побочное действиеВ рамках проведенных клинических исследований у пациентов с бляшечным псориазом, псориатическим артритом и анкилозирующим спондилитом препарат Эфлейра® показал благоприятный профиль безопасности. Большинство зарегистрированных нежелательных явлений, связанных с приемом препарата Эфлейра®, имели легкую или среднюю степень тяжести и не требовали прекращения терапии. Летальных исходов, связанных с терапией препаратом Эфлейра®, в ходе клинических исследований выявлено не было. Наиболее частой нежелательной реакцией в проведенных клинических исследованиях была нейтропения, большинство случаев которой были легкой или средней степени тяжести, носили транзиторный характер и не требовали дополнительной терапии. В данной инструкции нежелательные реакции представлены в соответствии с MedDRA. Ниже приведен перечень нежелательных реакций, зарегистрированных у пациентов, получавших нетакимаб в рамках клинических исследований и имеющих определенную, вероятную или возможную связь с приемом препарата. Частота указана с учетом следующих критериев: очень часто (≥1/10), часто (от ≥1/100 до <1/10), нечасто (от ≥1/1000 до <1/100), редко (от ≥1/10000 до <1/1000), очень редко (≤10000). Инфекции и инвазии: часто – инфекции верхних дыхательных путей; нечасто – инфекция дыхательных путей, пневмония, назофарингит, фарингит, синусит, инфекция мочевыводящих путей, кандидоз пищевода, конъюнктивит вирусный, простой герпес, стафилококковое импетиго, фурункул, туберкулезная инфекция. Со стороны печени и желчевыводящих путей: часто — гипербилирубинемия. Со стороны ЖКТ: нечасто — боль в животе, диарея. Со стороны кожи и подкожной клетчатки: нечасто – экзема, дерматит, сыпь, зуд, крапивница. Со стороны крови и лимфатической системы: часто — нейтропения, лейкопения, лимфоцитоз; нечасто – тромбоцитопения, лимфопения. Со стороны иммунной системы: нечасто — гиперчувствительность. Со стороны органа зрения: нечасто – эписклерит. Со стороны нервной системы: нечасто — головная боль, головокружение, парестезия, поражение лицевого нерва. Со стороны сердца: нечасто — синусовая брадикардия, блокада левой ножки пучка Гиса. Со стороны сосудов: нечасто — гипертензия (в т.ч. изолированная систолическая/диастолическая гипертензия), гипертонический криз. Общие нарушения и реакции в месте введения: нечасто — гриппоподобное заболевание*, местная реакция** Со стороны метаболизма и питания: нечасто – гипергликемия. Со стороны почек и мочевыводящих путей: нечасто — протеинурия. Лабораторные и инструментальные данные: часто – повышение активности АЛТ, АСТ, положительный результат исследования на комплекс Mycobacterium tuberculosis; нечасто – повышение ГГТ, повышение уровня холестерина в крови, увеличение массы тела. Травмы, интоксикации и осложнения процедур: нечасто – головокружение во время процедуры (во время инъекции). Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы): нечасто – инфицированный невус. Со стороны репродуктивной системы и молочных желез: нечасто – фиброзно-кистозная болезнь молочных желез. * Гриппоподобное заболевание характеризуется появлением ряда симптомов, сходных с выявляемыми при гриппе или простуде, включая, например, но не ограничиваясь: повышение температуры тела, озноб, ломоту в теле, недомогание, слабость, снижение аппетита, сухой кашель, которые имеют временную связь с проведением инъекции препарата. ** Местные реакции могут включать любые неблагоприятные проявления, возникающие в мете инъекции. Противопоказания к применению
С осторожностью Следует соблюдать осторожность при назначении препарата пациентам с хроническими и рецидивирующими инфекциями или с указаниями на них в анамнезе, в периоде ранней реконвалесценции после тяжелых и среднетяжелых инфекционных заболеваний, а также после недавно проведенной вакцинации живыми вакцинами. В связи с ограниченными данными клинических исследований о применении нетакимаба у пациентов в возрасте старше 65 лет следует соблюдать осторожность при назначении препарата пациентам указанной возрастной группы. В связи с отсутствием сведений о применении нетакимаба у больных воспалительными заболеваниями кишечника следует избегать его назначения пациентам с болезнью Крона или язвенным колитом. Применение при беременности и кормлении грудьюБеременность При применении нетакимаба у животных не выявлено отрицательного влияния на репродуктивную функцию, эмбриотоксичности или тератогенных эффектов. Исследований влияния на плод у беременных женщин не проводилось. Препарат противопоказан к применению во время беременности. Грудное вскармливание Нет данных о выделении нетакимаба с грудным молоком. Учитывая, что иммуноглобулины класса G, к которым относится нетакимаб, при циркуляции в крови матери могут выделяться с грудным молоком, применение в период грудного вскармливания противопоказано. Фертильность В исследованиях у животных не обнаружено негативного воздействия нетакимаба на фертильность. Данные о влиянии препарата на фертильность у человека отсутствуют. Применение при нарушениях функции печениЭффективность и безопасность препарата у данной категории пациентов не изучались. Применение при нарушениях функции почекЭффективность и безопасность препарата у данной категории пациентов не изучались. Применение у детейПротивопоказано применение препарата в возрасте до 18 лет. Применение у пожилых пациентовВ связи с ограниченными данными клинических исследований о применении нетакимаба у пациентов в возрасте старше 65 лет следует соблюдать осторожность при назначении препарата пациентам указанной возрастной группы. Особые указанияНаличие таких потенциально тяжелых инфекций, как ВИЧ, активный гепатит В и/или С, сифилис, туберкулез, относится к противопоказаниям для назначения нетакимаба. Пациентам с активным туберкулезом терапия препаратом Эфлейра® противопоказана. Перед назначением препарата Эфлейра® и в ходе терапии необходимо проводить стандартный скрининг на туберкулез. Пациентам с латентным туберкулезом рекомендуется пройти стандартный курс противотуберкулезной терапии перед началом терапии препаратом Эфлейра®. При реактивации гепатита В лечение нетакимабом следует прекратить и назначить соответствующую противовирусную терапию. Женщины детородного возраста и их половые партнеры должны использовать эффективные средства контрацепции в период проведения терапии. При применении нетакимаба потенциально возможно развитие реакции гиперчувствительности. Наличие алкогольной или наркотической зависимости, а также психических расстройств может стать причиной несоблюдения пациентом графика лечения нетакимабом, что, в свою очередь, может привести к снижению эффективности терапии. Необходим более тщательный мониторинг за пациентами с указанными состояниями в связи с отсутствием результатов клинических исследований на данной категории пациентов и возможностью повышенного риска развития гепатотоксичности и других неблагоприятных последствий. Иммуногенность В ходе клинических исследований препарата Эфлейра® при лечении псориаза, псориатического артрита и анкилозирующего спондилита формирование связывающих антител к нетакимабу было зарегистрировано менее чем в 0. Пациенты в возрасте старше 65 лет Данные об эффективности и безопасности препарата у пациентов в возрасте старше 65 лет ограничены. Не предполагается наличия существенных возрастных различий в распределении и выведении препарата. Пациенты с нарушениями функции почек и печени Эффективность и безопасность препарата у данной категории пациентов не изучались. Использование в педиатрии Исследование эффективности и безопасности препарата у детей и подростков в возрасте до 18 лет не проводилось. Вакцинация Не следует проводить иммунизацию живыми вакцинами в ходе лечения препаратом Эфлейра®, т.к. клиническая оценка безопасности данного взаимодействия в рамках клинических исследований не проводилась. Вакцинация живыми вакцинами до начала терапии препаратом Эфлейра®, а также интервал между вакцинацией и началом терапии должны соответствовать действующим клиническим рекомендациям. Влияние на способность к управлению транспортными средствами и механизмами Отсутствуют данные о влиянии препарата Эфлейра® на способность управлять транспортными средствами и работать с машинами и/или механизмами. ПередозировкаКлинические данные о передозировке отсутствуют. Максимальная переносимая доза для человека не установлена. В клинических исследованиях явлений дозолимитирующей токсичности не зарегистрировано: при п/к введении препарата нетакимаб в максимальной дозе 3 мг/кг (195–355 мг для взрослого человека с массой тела 65–85 кг) патологических отклонений не было выявлено. Лечение: специфический антидот отсутствует; проводят симптоматическую терапию. Лекарственное взаимодействиеСведений о наличии неблагоприятного лекарственного взаимодействия нетакимаба с другими лекарственными препаратами до настоящего времени не получено. Смешивание препарата с другими лекарственными средствами и введение в виде инфузии строго запрещено. Условия хранения препарата Эфлейра®Препарат следует хранить в недоступном для детей, защищенном от света месте при температуре от 2° до 8°С; не замораживать. Срок годности препарата Эфлейра®Срок годности — 2 года. Не применять по истечении срока годности. Условия реализацииПрепарат отпускается по рецепту. Контакты для обращений
Сохраните у себя |
Козэнтикс 150 мг/мл раствор для подкожного введения 1 мл исполнение шприц в автоинжекторе (ручке) шприц 1 шт.
 Каждую дозу 150 мг вводят в виде одной п/к инъекции. Каждую дозу 300 мг вводят в виде двух отдельных п/к инъекций по 150 мг.
Каждую дозу 150 мг вводят в виде одной п/к инъекции. Каждую дозу 300 мг вводят в виде двух отдельных п/к инъекций по 150 мг. В зависимости от клинического ответа дозу препарата можно увеличить до 300 мг.
В зависимости от клинического ответа дозу препарата можно увеличить до 300 мг.
 После разведения препарата согласно инструкции по применению из флакона набирают 0,5 мл раствора для п/к введения, остатки раствора необходимо немедленно утилизировать. Подробная информация по разведению см. в инструкции по медицинскому применению лекарственного препарата Козэнтикс, лиофилизат для приготовления раствора для подкожного введения, 150 мг.
После разведения препарата согласно инструкции по применению из флакона набирают 0,5 мл раствора для п/к введения, остатки раствора необходимо немедленно утилизировать. Подробная информация по разведению см. в инструкции по медицинскому применению лекарственного препарата Козэнтикс, лиофилизат для приготовления раствора для подкожного введения, 150 мг. Не пытайтесь самостоятельно вводить препарат, пока Вы не прошли подготовку с Вашим врачом. В пачке находятся 1 или 2 предварительно заполненных шприца в блистере.
Не пытайтесь самостоятельно вводить препарат, пока Вы не прошли подготовку с Вашим врачом. В пачке находятся 1 или 2 предварительно заполненных шприца в блистере.


 Не используйте препарат, если жидкость содержит видимые частицы, мутная или очевидно коричневая. НЕ ИСПОЛЬЗУЙТЕ препарат, если целостность предварительно заполненного шприца нарушена. Во всех случаях обратитесь к врачу.
Не используйте препарат, если жидкость содержит видимые частицы, мутная или очевидно коричневая. НЕ ИСПОЛЬЗУЙТЕ препарат, если целостность предварительно заполненного шприца нарушена. Во всех случаях обратитесь к врачу.
 Внутренняя крышка иглы
Внутренняя крышка иглы
 Избегайте введения в места с наличием рубцов и растяжек.
Избегайте введения в места с наличием рубцов и растяжек. Положение автоинжектора
Положение автоинжектора
Интеллектуальная платформа автоинъектора | Филлипс Медисайз
Удовлетворение будущих потребностей в инъекциях – сегодня
Наш интеллектуальный автоинжектор Aria представляет собой мощную, гибкую платформу, разработанную для простоты использования, компактную форму и соответствующую ключевым новым глобальным тенденциям:
- Перемещение здравоохранения из больниц
- Готов к подключенному миру
- Более экологичные решения
Умнее.
 ..
..Наша интеллектуальная платформа автоинжектора Aria была создана с учетом четырех основных потребностей пациентов и клиентов
- Небольшой и простой в использовании для пациентов
- Мощная гибкая платформа для фармацевтики
- Сокращение отходов приносит пользу окружающей среде
- Готов к подключенному миру
- Маленький и простой в использовании для пациентов
- Мощная и гибкая платформа для фармацевтики
- Сокращение отходов приносит пользу окружающей среде
- Готов к подключенному миру
Компактный размер и знакомый внешний вид
Интеллектуальный автоинжектор Aria по размеру и внешнему виду приближается к лидирующим на рынке одноразовым автоинжекторам.
Простота использования
Простая активация с помощью рукава и большое смотровое окно обеспечивают унификацию современных одноразовых устройств. Встроенная электроника сочетает подсвеченные значки с богатыми звуковыми сигналами, чтобы предоставить пользователям четкую обратную связь о ходе и завершении инъекции, включая любое последующее время ожидания после того, как поршень перестал двигаться, что жизненно важно для обеспечения успешной доставки лекарства.
Защита иглы
Как и в современных одноразовых автоинжекторах, кожный фиксатор обеспечивает безопасность иглы до и после инъекции. Колпачок открывается только после загрузки кассеты в устройство и обеспечивает дополнительную защиту от травм от укола иглой.
Узнайте больше о возможностях интеллектуального автоинъектора Aria и наших отраслевых исследованиях
Будьте в курсе
Мощный, но адаптивный впрыск
Интеллектуальный автоинжектор Aria использует мощный электродвигатель для привода диапазон лекарственных форм от 0,2 мл до 2,25 мл и вязкостью более 70 сП. В отличие от пружин, этот двигатель поддерживает полную мощность на протяжении всего хода, приспосабливаясь к изменениям свойств жидкости и трения. Скорость и профиль инъекции также можно регулировать, что потенциально повышает комфорт пользователя. Наконец, управление двигателем также обеспечивает мягкое зацепление с пробкой поршня, независимо от объема и вязкости наполнения шприца.
В отличие от пружин, этот двигатель поддерживает полную мощность на протяжении всего хода, приспосабливаясь к изменениям свойств жидкости и трения. Скорость и профиль инъекции также можно регулировать, что потенциально повышает комфорт пользователя. Наконец, управление двигателем также обеспечивает мягкое зацепление с пробкой поршня, независимо от объема и вязкости наполнения шприца.
Модульный и гибкий
Шприцы объемом 1 мл и 2,25 мл можно разместить в одной одноразовой кассете, собранной из нескольких пластиковых профилей. Размещение трансмиссии и электроники в многоразовом техническом модуле позволяет повторно использовать его для многократного впрыска с несколькими одноразовыми кассетами. Амортизация этих расширенных функций в течение трехлетнего срока службы устройства может обеспечить очень конкурентоспособные цены на основе «затраты на инъекцию».
Новые возникающие потребности стимулируют разработку автоинъекторов (по доставке лекарств)
Узнать больше
Пространство, отходы и распределение
Кассета, в которой находится шприц и которая является одноразовым элементом нашего интеллектуального автоинъектора Aria, значительно меньше по размеру и требует меньше материала, чем современные одноразовые автоинъекторы.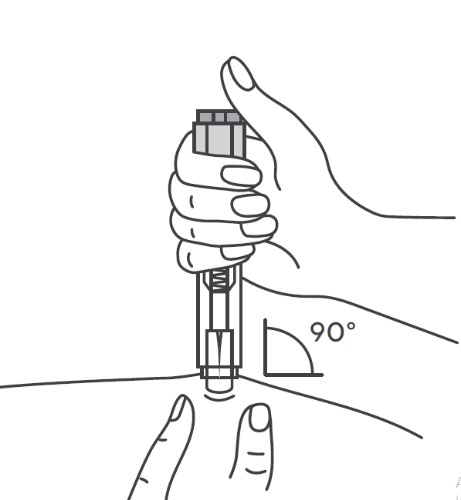 Конструкция приводит к меньшему количеству отходов и меньшему пространству, необходимому для транспортировки и хранения.
Конструкция приводит к меньшему количеству отходов и меньшему пространству, необходимому для транспортировки и хранения.
Непрерывное совершенствование
Завершена полная оценка жизненного цикла (LCA) с учетом материалов изготовления, производства, распределения, хранения, использования и утилизации, результаты опубликованы. LCA будет по-прежнему использоваться для дальнейшего улучшения конструкции с учетом более экологичных материалов, а также для оптимизации логистики поставок и распределения.
.
Оценка воздействия автоинъекторов на окружающую среду
Узнать больше
Встроенная возможность подключения
Благодаря встроенному Bluetooth в стандартной комплектации интеллектуальный автоинжектор Aria может подключаться к мобильным телефонам и планшетам. Соединение можно использовать для передачи данных об инъекциях и устройствах, помогая пациентам контролировать и управлять приемом лекарств. Мы можем предложить собственное мобильное приложение в качестве дополнения к интеллектуальному автоинжектору Aria. Устройство также может подключаться к другим мобильным приложениям, разработанным нашими клиентами или третьими лицами.
Устройство также может подключаться к другим мобильным приложениям, разработанным нашими клиентами или третьими лицами.
Connected Health Platforms
Компания Phillips-Medisize сыграла ключевую роль в первом одобрении FDA полностью подключенного устройства для доставки лекарств с регулируемым сопутствующим цифровым сервисом. Основываясь на этом опыте, интеллектуальный автоинжектор Aria был разработан для интеграции в наше комплексное решение Connected Health Platform, что позволяет нашим клиентам лучше понять, как их лекарственные активы используются в реальном мире. Эта система также может быть связана с порталами HCP, предоставляя медицинским работникам исторические тенденции, сравнительный анализ и данные в реальном времени, чтобы лучше понимать и поддерживать пациентов, принимающих лекарства в реальных условиях.
Повышение ценности доставки лекарств с помощью подключения
Узнать больше
Гибкость в основе своей
- Ария
- Ария+
Aria
Aria+
- Стандартный 10-секундный впрыск (программируемый)
- Опорожнение (доставлена полная доза)
- Вязкость от низкой до высокой
- Аудиовизуальная обратная связь с пользователем
- Предназначен для пользователей со средними и тяжелыми нарушениями подвижности
- BTLE-соединение
- Дополнительное считывание RFID кассеты
- Аккумулятор, рассчитанный на 2-3 года жизни
- Предварительно заполненный шприц с иглой со штифтом на 1 мл и на 2,25 мл
- Спусковой крючок
- Ручное введение/вытягивание иглы
- Предохранитель иглы, блокировка втулки
- Время впрыска устанавливается/регулируется пользователем
- Возможность частичного дозирования
- Вязкость от низкой до высокой
- Экран графического интерфейса пользователя и кнопки для управления и управления пользователем
- Предназначен для пользователей с умеренными нарушениями подвижности
- BTLE-соединение
- Дополнительное считывание RFID кассеты
- Аккумуляторная батарея, рассчитанная на 3 (+) года жизни
- Предварительно заполненный шприц с иглой со штифтом на 1 мл и на 2,25 мл
- Спусковой крючок
- Ручное введение/вытягивание иглы
- Предохранитель иглы, блокировка втулки
Начало работы с технологией Aria Smart Autoinjector
Воплощение возможностей в жизнь
Запросите время у нашей глобальной команды.

Свяжитесь с нами
Узнайте больше о возможностях интеллектуального автоинъектора Aria и наших отраслевых исследованиях.
Посмотреть ресурсы
Системы самоинжекции — BD
БД по всему миру
×
Инновационные самостоятельные инъекции для улучшения опыта пациентов
Ваше лекарство влияет на жизнь пациентов и подходы медицинских работников к лечению. Мы это понимаем, поэтому мы сотрудничаем с вами в разработке систем для самостоятельной инъекции, которые решают ваши проблемы с доставкой лекарств, а также учитывают конструктивные факторы для удовлетворения потребностей пациентов.
Мы обеспечиваем гибкое производство, настройку, совместимость с лекарственными препаратами и бесшовную интеграцию, которые необходимы сегодня для успеха комбинированных продуктов. Мы помогаем вам сократить время доставки, чтобы вы могли быстро вывести свое лекарство на рынок, снизив при этом риск — на благо вашей компании, ваших клиентов и ваших партнеров.
Дайте вашим пациентам уверенность в их самостоятельном введении
Мировой лидер в области систем для самостоятельной инъекции, компания BD предлагает дифференцированное решение и полный ассортимент систем для самостоятельной инъекции, разработанных для пациентов и разработанных с использованием технологии модульной платформы, которая позволяет нас, чтобы быстро настроить ваш продукт и стремится ускорить время его выхода на рынок.
Носимый инъектор BD Libertas™
и Носимый инжектор BD Libertas™ помогает автоматически вводить широкий спектр биотехнологических препаратов в больших объемах или с высокой вязкостью в течение определенного периода времени.
Одноразовая ручка BD Vystra™
Одноразовая ручка BD Vystra — это простой в использовании одноразовый шприц-ручка для частых инъекций небольшого объема или переменного дозирования.
Одноразовый автоинъектор BD Physioject™ 1 мл
Одноразовый автоинъектор BD Physioject объемом 1 мл для предварительно заполненных шприцев включает данные, полученные от пациента, и исследования человеческого фактора, чтобы обеспечить пациентам простое и эргономичное самостоятельное введение.
Тебе нравится это? Поделись:
Свяжитесь с намиBD Medical — Библиотека ресурсов фармацевтических систем
Наши разнообразные ресурсы дают вам возможность получить знания, получить представление и прочитать истории успеха наших решений.
Брошюры
Видео
Посмотреть полную библиотекуПродукты
- Игольчатые технологии
- Шприцевые системы предварительного заполнения
- Системы безопасности и защиты
- Системы автоматического впрыска
Фармацевтические системы
- Комплексные услуги
- Удовлетворение ваших потребностей
- Возможности дизайна продукта
- Совершенство производства
- Новое определение превосходства
Компания
- Экспертиза, которой доверяют
- Связаться с нами
- События
Поддержка
- Нормативная часть – LoA и TD
- Предупреждения и уведомления
- COVID-19
- Библиотека ресурсов
- Техническая поддержка
- Безопасность продукта и конфиденциальность
Простой в использовании самоинжектор: одноразовый автоинжектор BD Physioject™ 1 мл
Одноразовый автоинжектор BD Physioject™ 1 мл — это коммерчески проверенный, простой в использовании одноразовый автоинъектор, активируемый кнопкой, для лечения хронических заболеваний.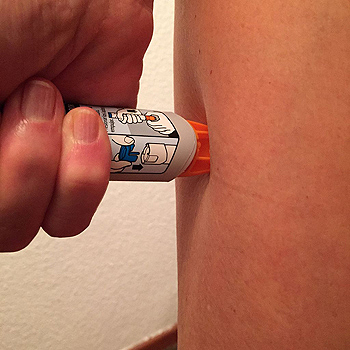 . 2,6,7
. 2,6,7
Одноразовый автоинжектор BD Physioject™ на 1 мл в сочетании с BD Hypak™ для стеклянных преднаполняемых шприцев Biotech обеспечивает точность дозы и обеспечивает введение полной инъекции использования на рынке, одноразовый автоинжектор BD Physioject™ 1 мл настраивается в соответствии со стратегией вашего бренда.
Одноразовый автоинжектор BD Physioject™ 1 мл предназначен для обеспечения контролируемой экспозиции по длине иглы для обеспечения глубины инъекции * и предлагает встроенную функцию защиты от травм острыми предметами. 1,2,3,6
Примечания
* Длина иглы 8 мм +/- 2 мм и 6 мм +/- 2 мм с BD Hypak для Biotech
** Стендовые испытания точности дозы проводились для различных условия (такие как холодная, стандартная и теплая атмосфера) на 540 образцах. Более того, использованная пробка находилась на конце цилиндра в 100% случаев, что подтверждает, что доза была доставлена полностью.
† В сочетании с BD Hypak™ для стеклянных преднаполняемых шприцев Biotech
Ссылки
- Отчет о проверке конструкции BD Physioject™ [внутренний отчет]. Пон-де-Кле, о.: Becton, Dickinson and Company; 2018
- Входная спецификация дизайна Physioject™ [внутренний отчет]. Пон-де-Кле, Франция: Бектон, Дикинсон и компания; 2014
- Глубина проникновения иглы BD Physioject™ [внутренний отчет]. Пон-де-Кле, Франция: Becton, Dickinson and Company; 2010
- Основание для лечения артрита®, https://www.arthritis.org/living-with-arthritis/tools-resources/ease-ofuse/health-and-wellness/bd-physioject-disposable-autoinjector.php
- Данные жалоб системы качества BD (2012–2018), выдержка жалобы Physioject для зарегистрированных жалоб пользователей, связанных с системной интеграцией
- Берто, Сесиль и др. (2010), «Оценка эффективности, безопасности, приемлемости и соответствия одноразового автоинъектора для подкожных инъекций у здоровых добровольцев».
 Предпочтения и приверженность пациентов, Vol. 4, с. 379-388.
Предпочтения и приверженность пациентов, Vol. 4, с. 379-388. - Шварценбах, Флоренция, и др. «Результаты эксперимента с человеческим фактором в отношении удобства использования и принятия пациентами нового автоинъектора у пациентов с ревматоидным артритом». Предпочтения и приверженность пациентов, Опубликовано в 2014 г. Том. 8, с. 199–209
- Оценка удобства использования и функциональности BD Physioject™ с помощью имитации инъекций, выполняемых пациентами с деструктивным воспалительным ревматизмом [внутреннее исследование]. Ле Пон-де-Кле, Франция; Бектон, Дикинсон и компания; 2011.
- Одноразовый автоинжектор BD Physioject™ 1 мл. Отчет о человеческом факторе и пользовательском опыте [внутренний отчет]. Ле Пон-де-Кле, Франция; Бектон, Дикинсон и компания; 2013.
- База данных спроса BD WW, продажи WW 2012–2018 для APAC, ЕС, США, Лос-Анджелеса.
Звуковые и визуальные индикаторы обратной связи
Обратная связь обеспечивается звуковым щелчком при запуске, а обзор на 360° обеспечивает видимость препарата во время инъекции.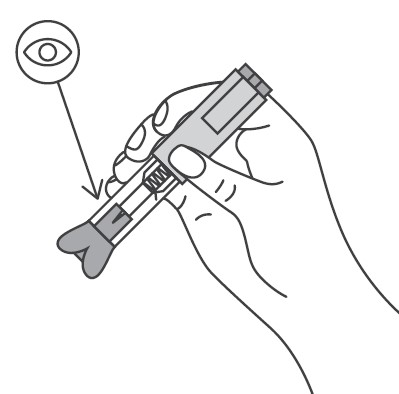 2
2
Автоматические функции безопасности
Встроенная пассивная защита иглы постоянно скрывает и защищает иглу 1 , а конструкция колпачка предотвращает повторное надевание колпачка после открытия устройства. 1
Надежная интеграция
Надежная интеграция с BD Hypak™ для стеклянных преднаполняемых шприцев Biotech объемом 1 мл в конфигурациях с тонкими стенками 29G и специальными тонкими стенками 27G. 1
Примечания
* Длина иглы 8 мм +/- 2 мм и 6 мм +/- 2 мм с BD Hypak для Biotech
стандартная и теплая атмосфера) на 540 образцах. Более того, использованная пробка находилась на конце цилиндра в 100% случаев, что подтверждает, что доза была доставлена полностью.
† В сочетании со стеклянными предварительно наполненными шприцами BD Hypak™ для Biotech
Ссылки
- Отчет о проверке дизайна BD Physioject™ [внутренний отчет]. Пон-де-Кле, о.: Becton, Dickinson and Company; 2018
- Входная спецификация дизайна Physioject™ [внутренний отчет]. Пон-де-Кле, Франция: Бектон, Дикинсон и компания; 2014
- Глубина проникновения иглы BD Physioject™ [внутренний отчет]. Пон-де-Кле, Франция: Becton, Dickinson and Company; 2010
- Arthritis Foundation®, https://www.arthritis.org/living-with-arthritis/tools-resources/ease-ofuse/health-and-wellness/bd-physioject-disposable-autoinjector.php
- Данные жалоб системы качества BD (2012–2018), выдержка жалобы Physioject для зарегистрированных жалоб пользователей, связанных с системной интеграцией
- Берто, Сесиль и др. (2010), «Оценка эффективности, безопасности, приемлемости и соответствия одноразового автоинъектора для подкожных инъекций у здоровых добровольцев».
 Предпочтения и приверженность пациентов, Vol. 4, с. 379-388.
Предпочтения и приверженность пациентов, Vol. 4, с. 379-388. - Шварценбах, Флоренция, и др. «Результаты эксперимента с человеческим фактором в отношении удобства использования и принятия пациентами нового автоинъектора у пациентов с ревматоидным артритом». Предпочтения и приверженность пациентов, Опубликовано в 2014 г. Том. 8, с. 199–209
- Оценка удобства использования и функциональности BD Physioject™ с помощью имитации инъекций, выполняемых пациентами с деструктивным воспалительным ревматизмом [внутреннее исследование]. Ле Пон-де-Кле, Франция; Бектон, Дикинсон и компания; 2011.
- Одноразовый автоинжектор BD Physioject™ 1 мл. Отчет о человеческом факторе и пользовательском опыте [внутренний отчет]. Ле Пон-де-Кле, Франция; Бектон, Дикинсон и компания; 2013.
- База данных спроса BD WW, продажи WW 2012–2018 для APAC, ЕС, США, Лос-Анджелеса.
Награда за простоту использования
Этот продукт получил награду за простоту использования SM награду от Arthritis Foundation ® . Продукты, отмеченные этой наградой, проверены и доказали свою эффективность в выполнении повседневных задач.
Продукты, отмеченные этой наградой, проверены и доказали свою эффективность в выполнении повседневных задач.
Улучшает опыт пациента при инъекции
Одноразовый автоинжектор BD Physioject™ 1 мл предназначен для последовательной активации инъекции, полной инъекции и обеспечения контролируемой глубины инъекции
Сертифицирован Arthritis Foundation® как продукт Ease of Use™ в 2015 году. 4
Обеспечивает безопасность пациента особенность.
1,2
Примечания
* Длина иглы 8 мм +/- 2 мм и 6 мм +/- 2 мм с BD Hypak для Biotech
** Стендовые испытания точности дозы проводились для различных условий (например, прохладная, стандартная и теплая атмосфера) на 540 образцах. Более того, использованная пробка находилась на конце цилиндра в 100% случаев, что подтверждает, что доза была доставлена полностью.
Более того, использованная пробка находилась на конце цилиндра в 100% случаев, что подтверждает, что доза была доставлена полностью.
† В сочетании со стеклянными предварительно наполненными шприцами BD Hypak™ для Biotech
Ссылки
- Отчет о проверке дизайна BD Physioject™ [внутренний отчет]. Пон-де-Кле, о.: Becton, Dickinson and Company; 2018
- Входная спецификация дизайна Physioject™ [внутренний отчет]. Пон-де-Кле, Франция: Бектон, Дикинсон и компания; 2014
- Глубина проникновения иглы BD Physioject™ [внутренний отчет]. Пон-де-Кле, Франция: Becton, Dickinson and Company; 2010
- Arthritis Foundation®, https://www.arthritis.org/living-with-arthritis/tools-resources/ease-ofuse/health-and-wellness/bd-physioject-disposable-autoinjector.php
- Данные жалоб системы качества BD (2012–2018), выдержка жалобы Physioject для зарегистрированных жалоб пользователей, связанных с системной интеграцией
- Берто, Сесиль и др.
 (2010), «Оценка эффективности, безопасности, приемлемости и соответствия одноразового автоинъектора для подкожных инъекций у здоровых добровольцев». Предпочтения и приверженность пациентов, Vol. 4, с. 379-388.
(2010), «Оценка эффективности, безопасности, приемлемости и соответствия одноразового автоинъектора для подкожных инъекций у здоровых добровольцев». Предпочтения и приверженность пациентов, Vol. 4, с. 379-388. - Шварценбах, Флоренция, и др. «Результаты эксперимента с человеческим фактором в отношении удобства использования и принятия пациентами нового автоинъектора у пациентов с ревматоидным артритом». Предпочтения и приверженность пациентов, Опубликовано в 2014 г. Том. 8, с. 199–209
- Оценка удобства использования и функциональности BD Physioject™ с помощью имитации инъекций, выполняемых пациентами с деструктивным воспалительным ревматизмом [внутреннее исследование]. Ле Пон-де-Кле, Франция; Бектон, Дикинсон и компания; 2011.
- Одноразовый автоинжектор BD Physioject™ 1 мл. Отчет о человеческом факторе и пользовательском опыте [внутренний отчет]. Ле Пон-де-Кле, Франция; Бектон, Дикинсон и компания; 2013.
- База данных спроса BD WW, продажи WW 2012–2018 для APAC, ЕС, США, Лос-Анджелеса.

Награда за простоту использования
Этот продукт получил награду за простоту использования SM награду от Arthritis Foundation ® . Продукты, отмеченные этой наградой, проверены и доказали свою эффективность в выполнении повседневных задач.
Учить больше Проговорив во времени интеграция системы
> 99,999% надежности системы, продемонстрированная для одноразового автоинъектора BD Physioject ™ 1 мл †
Одноразовый автоинъектор BD Physioject™ 1 мл основан на знаниях, данных и опыте, накопленных за более чем 10-летний опыт работы на рынке и более 118 миллионов проданных единиц. 10 * Длина иглы 8 мм +/- 2 мм и 6 мм +/- 2 мм с BD Hypak для Biotech стандартная и теплая атмосфера) на 540 образцах. Более того, использованная пробка находилась на конце цилиндра в 100% случаев, что подтверждает, что доза была доставлена полностью. † В сочетании с BD Hypak™ для стеклянных преднаполняемых шприцев Biotech Этот продукт получил награду Ease of Use SM от Arthritis Foundation ® . Продукты, отмеченные этой наградой, проверены и доказали свою эффективность в выполнении повседневных задач. * Длина иглы 8 мм +/- 2 мм и 6 мм +/- 2 мм с BD Hypak для Biotech ** Стендовые испытания точности дозы проводились для различных условий (таких как прохладное, стандартное и теплое) атмосфера) на 540 образцах. Более того, использованная пробка находилась на конце цилиндра в 100% случаев, что подтверждает, что доза была доставлена полностью. † В сочетании с BD Hypak™ для стеклянных преднаполняемых шприцев Biotech Commergyally Proven
4444.
 проверенное, надежное решение, подкрепленное строгими клиническими данными и данными о человеческом факторе 1,6,7,8,9
проверенное, надежное решение, подкрепленное строгими клиническими данными и данными о человеческом факторе 1,6,7,8,9 Наследие передового опыта
Примечания
Ссылки
 : Becton, Dickinson and Company; 2018
: Becton, Dickinson and Company; 2018 Предпочтения и приверженность пациентов, Опубликовано в 2014 г. Том. 8, с. 199–209
Предпочтения и приверженность пациентов, Опубликовано в 2014 г. Том. 8, с. 199–209 Награда за простоту использования
Одноразовый автоинъектор BD Physioject™ 1 мл, доступность и поддержка

Примечания
Ссылки
 php
php


 в компл. с салфетками
в компл. с салфетками ) — пачки картонные.
) — пачки картонные./14eb061237ebac3.ru.s.siteapi.org/img/2a429fc38f57d32ba5d54ef6a55fdd1f43bb58d0.jpg) По данным доклинических исследований специфическое связывание нетакимаба в нормальных тканях человека ограничено тканями легкого, тимуса, лимфатического узла, миндалин, что согласуется с данными об экспрессии ИЛ-17 клетками этих тканей.
По данным доклинических исследований специфическое связывание нетакимаба в нормальных тканях человека ограничено тканями легкого, тимуса, лимфатического узла, миндалин, что согласуется с данными об экспрессии ИЛ-17 клетками этих тканей.
 5-4 ч после введения; Сmax составляла 15.1 (7.7-19.3) мкг/мл, Тmax – 144 (72-168) ч, AUC0-168 – 1667.8 (932.2–2270.8) (мкг/мл)×ч.
5-4 ч после введения; Сmax составляла 15.1 (7.7-19.3) мкг/мл, Тmax – 144 (72-168) ч, AUC0-168 – 1667.8 (932.2–2270.8) (мкг/мл)×ч.

 Дата следующего введения рассчитывается исходя из продолжительности задержки с введением препарата: если со времени пропуска введения прошло не более 3 дней, следующую инъекцию препарата необходимо выполнить по текущему графику, если с момента пропуска дозы прошло более 3 дней, то новый отсчет для даты следующего введения начинают с момента фактически проведенной инъекции препарата Эфлейра®.
Дата следующего введения рассчитывается исходя из продолжительности задержки с введением препарата: если со времени пропуска введения прошло не более 3 дней, следующую инъекцию препарата необходимо выполнить по текущему графику, если с момента пропуска дозы прошло более 3 дней, то новый отсчет для даты следующего введения начинают с момента фактически проведенной инъекции препарата Эфлейра®. Препарат Эфлейра® представляет собой прозрачный, от бесцветного до светло-желтого цвета раствор. Нельзя использовать препарат в случае:
Препарат Эфлейра® представляет собой прозрачный, от бесцветного до светло-желтого цвета раствор. Нельзя использовать препарат в случае: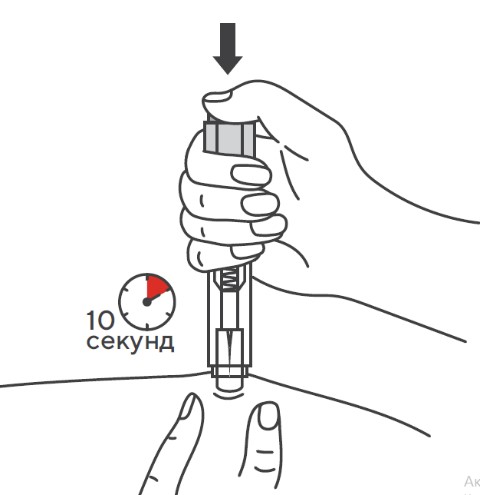
 5 см допустимо введение под углом 90 градусов).
5 см допустимо введение под углом 90 градусов).
 Надавливание автоинжектором на поверхность кожной складки приведет к разблокированию кнопки.
Надавливание автоинжектором на поверхность кожной складки приведет к разблокированию кнопки. Из места инъекции может выделиться небольшое количество крови. При необходимости можно воспользоваться пластырем.
Из места инъекции может выделиться небольшое количество крови. При необходимости можно воспользоваться пластырем. Явлений дозолимитирующей токсичности не выявлено.
Явлений дозолимитирующей токсичности не выявлено.



 Во избежание негативного воздействия на ребенка следует прекратить либо грудное вскармливание, либо терапию, учитывая соотношение риска и пользы для матери и ребенка.
Во избежание негативного воздействия на ребенка следует прекратить либо грудное вскармливание, либо терапию, учитывая соотношение риска и пользы для матери и ребенка. Применение нетакимаба у данной группы пациентов не изучено. Учитывая иммуносупрессивное действие нетакимаба, терапия этим препаратом потенциально может приводить к обострению хронических инфекций и повышению риска первичного инфицирования. Необходимо проводить скрининг и оценивать соотношение риска и пользы терапии нетакимабом у этих пациентов.
Применение нетакимаба у данной группы пациентов не изучено. Учитывая иммуносупрессивное действие нетакимаба, терапия этим препаратом потенциально может приводить к обострению хронических инфекций и повышению риска первичного инфицирования. Необходимо проводить скрининг и оценивать соотношение риска и пользы терапии нетакимабом у этих пациентов. В рамках проведенных клинических исследований нетакимаба анафилактические реакции не зарегистрированы, нечасто отмечались реакции гиперчувствительности и крапивница. Однако при применении других ингибиторов ИЛ-17 крапивница и анафилактические реакции отмечались в редких и очень редких случаях. При возникновении анафилактических или других серьезных аллергических реакций применение препарата Эфлейра® следует немедленно прекратить и начать соответствующую симптоматическую терапию.
В рамках проведенных клинических исследований нетакимаба анафилактические реакции не зарегистрированы, нечасто отмечались реакции гиперчувствительности и крапивница. Однако при применении других ингибиторов ИЛ-17 крапивница и анафилактические реакции отмечались в редких и очень редких случаях. При возникновении анафилактических или других серьезных аллергических реакций применение препарата Эфлейра® следует немедленно прекратить и начать соответствующую симптоматическую терапию. 5% случаев. Нейтрализующих антител выявлено не было. Полученные данные демонстрируют низкую иммуногенность нетакимаба у пациентов с псориазом, псориатическим артритом и пациентов с анкилозирующим спондилитом.
5% случаев. Нейтрализующих антител выявлено не было. Полученные данные демонстрируют низкую иммуногенность нетакимаба у пациентов с псориазом, псориатическим артритом и пациентов с анкилозирующим спондилитом. Иммунизацию инактивированными вакцинами во время терапии нетакимабом необходимо выполнять с осторожностью.
Иммунизацию инактивированными вакцинами во время терапии нетакимабом необходимо выполнять с осторожностью.
 Стрельна, ул. Связи, д. 38, стр. 1, помещение 89
Стрельна, ул. Связи, д. 38, стр. 1, помещение 89