Что такое автокатализатор, как сдать его выгодно?. Статьи компании «KatAlmaty»
Катализатор является одной из основных частей выхлопной системы транспортных средств. Его основная задача — снизить выброс в атмосферу вредных отработанных веществ. Основной механизм действия катализатора осуществляется благодаря так называемому каталитическому слою, который в процессе эксплуатации автомобиля постепенно приходит в негодность.
Длительность использования катализатора не зависит от эксплуатационных характеристик автомобиля. Поэтому в гаражах многих автомобилистов нередко скапливаются пришедшие в негодность катализаторы. Некоторые автолюбители просто выбрасывают пришедшие в негодность катализаторы. Но мало кто знает, что автокатализатор можно выгодно сдать на металлолом и получить за это финансовую прибыль.
Сдать на металлолом пришедший в негодность катализатор — это не только возможность получить финансовую прибыль, но и внести свой вклад в защиту экологической ситуации в регионе.
По сравнению с другими сервисами по сдаче металлолома, наша компания обладает определёнными преимуществами:
| Гарантированная высокая оплата | |
| Качественное предоставление услуг |
| Грамотное сервисное обслуживание | |
| Объективная оценка стоимости катализаторов |
Компания «Katalizator-Almaty» осуществляет приём пришедших в негодность катализаторов сразу после оформления заявки в режиме онлайн или после того, как клиент связался с нами по одному из указанных на сайте номеров телефона или по электронной почте. Наш менеджер примет и обработает заявку, уточнит все детали и время приёма катализатора.
Основные требования для сдачи катализаторов
Если вы хотите сдать неисправный катализатор в компании «Katalizator-Almaty», то вам необходимо учесть следующие требования:
1. | Оптимальная влажность катализатора не должна превышать 2% |
2. | Мы принимаем цельную керамическую массу (предпочтительный вариант), либо в виде крошек |
3. | Керамические катализаторы принимаются только в чистом виде, без посторонних примесей и элементов |
4. | Металлические катализаторы сдаются в виде цельного куска, поскольку в разобранном виде они могут утратить значительную часть ценного напыления |
Обратившись в компанию
Прием металла и кабеля Прием металла и кабеля
Катализатор автомобильный — что это такое в машине: где стоит, на что влияет
15.01.2019
Многие узнают о катализаторе, когда он выходит из строя. Ниже мы расскажем, что это за деталь, зачем она нужна и что делать, если она неисправна.
Что представляет собой автомобильный катализатор
Что такое катализатор? Его полное название — каталитический нейтрализатор. Это элемент выхлопной системы, отвечающий за концентрацию вредных веществ в выхлопных газах. Он помогает снизить содержание токсичных компонентов: окиси углерода (CO), углеводородов (CH) и оксидов азота (NO и NO2).
Конструктивные особенности
Катализатор расположен в выхлопной трубе, в промежутке между двигателем и глушителем. Внизу он закрыт защитным экраном, который частично поглощает тепло (в работе эта деталь сильно нагревается).
Катализаторы — это деталь, которая запускается в процессе движения авто, при работе двигателя вхолостую он не работает. Внутри корпуса находится специальная конструкция из металлических или керамических «сот», покрытых тонким слоем благородных металлов – например, платиноиридиевый сплав. Благодаря такой конструктивной особенности увеличивается плотность этого покрытия (каталитического слоя) с вредными газами перед их выходом наружу.
Внутри корпуса находится специальная конструкция из металлических или керамических «сот», покрытых тонким слоем благородных металлов – например, платиноиридиевый сплав. Благодаря такой конструктивной особенности увеличивается плотность этого покрытия (каталитического слоя) с вредными газами перед их выходом наружу.
Как благородные металлы помогают бороться с токсичными веществами? Они вступают в химическую реакцию окисления с CO и CH. В результате из глушителя выходят достаточно безобидные для окружающей среды соединения CO2 и N2.
В тандеме с каталитическим нейтрализатором «трудятся» кислородные датчики. Это они определяют точную концентрацию веществ в горючей смеси. После этого элемента выхлопной системы расположен еще один датчик, который уже оценивает концентрацию газов поступающих в окружающую среду.
Такой подход к очистке выхлопных газов эффективный, но не совершенный. Так как наше устройство работает только при высокой температуре, то в процессе нагрева от него мало пользы.
Почему катализатор выходит из строя?
У него есть три основных состояния:
- рабочее: когда авто работает нормально, на информационной панели отсутствуют сигналы об ошибках или неисправностях. Такое решение способно проработать намного меньше, чем оригинальная деталь — в среднем 70 тысяч километров, — но и стоит он меньше;
- полурабочее: авто работает с перебоями – пропадает тяга, долго и с трудом заводится двигатель, пропадают обороты, машина начинает потреблять больше топлива без видимых причин;
- нерабочее: автомобиль долго заводится и почти сразу глохнет, а иногда не заводится вовсе.
Когда многие узнают, как он работает катализатор – становится понятно, что у него достаточно большой рабочий ресурс. Автомобиль может проехать от ста до ста пятидесяти тысяч километров прежде чем его придется заменить. В среднем срок эксплуатации составляет пять-семь лет. За это время сотовая конструкция приходит в негодность и фильтр больше не может выполнять свое основное предназначение.
Но чаще выход из строя случается намного раньше из-за некачественного топлива. Недобросовестные продавцы бензина используют свинцовые добавки, чтобы получить необходимое октановое число. В результате при сгорании топлива температура поднимается выше привычной отметки и наше устройство перегревается сильнее положенного. То есть он просто быстрее выгорает, а «соты» забиваются.
Как поступить, если катализатор сломался?
Выход один — замена. Очень редко продавцу этой детали удается доказать, что она изначально была некачественная. Скорее всего, он укажет на то, что вы использовали бензин низкого качества, а последствия этого официальная гарантия не распространяется.
На замену в сервисном центре вам могут предложить:
- универсальный катализатор, выполненный в виде «бочки»;
- пламегаситель (он же предварительный резонатор), который не фильтрует, но выравнивает выхлопной поток газов и частично снижает громкость звуков.
Большинство автовладельцев, которые знают зачем используется катализатор в машине, при выходе этой детали из строя просто избавляются от него. Одни просто пробивают отверстие в корпусе, а другие полностью удаляют. На самом деле, экономить на установке новой детали не стоит: этим вы наносите огромный вред окружающей среде.
Одни просто пробивают отверстие в корпусе, а другие полностью удаляют. На самом деле, экономить на установке новой детали не стоит: этим вы наносите огромный вред окружающей среде.
Вы должны четко осознавать, какими будут последствия установки пламегасителя вместо катализатора!
Установка и замена
Если в работе транспортного средства возникли проблемы, вы хотите заменить вышедший из строя катализатор, обращайтесь к специалистам сервисного центра «Мастер Глушителей». Запишитесь на ремонт или диагностику в Санкт-Петербурге по телефону, указанному на сайте, и мы обслужим вас с 10:00 до 23:00. Ответственно подходим ко всем видам работ, решаем все вопросы быстро и по доступной цене, имеем большую базу запасных частей для автомобилей разных марок.
Ваш ник:видов катализа
ТИПЫ КАТАЛИЗА На этой странице рассматриваются различные типы катализаторов (гетерогенные и гомогенные) с примерами каждого вида и объяснением того, как они работают. | ||
Примечание: На этой странице не рассматривается влияние катализаторов на скорость реакции. Если вы еще не знаете об этом, вы можете сначала перейти по этой ссылке. Вернитесь на эту страницу с помощью кнопки НАЗАД в браузере. | ||
Типы каталитических реакций Катализаторыможно разделить на два основных типа — гетерогенные и гомогенные. В гетерогенной реакции катализатор находится в другой фазе, чем реагенты. В гомогенной реакции катализатор находится в той же фазе, что и реагенты. Что такое фаза ? Если вы посмотрите на смесь и увидите границу между двумя компонентами, эти вещества находятся в разных фазах. Смесь, содержащая твердое вещество и жидкость, состоит из двух фаз. Смесь различных химических веществ в одном растворе состоит только из одной фазы, потому что между ними не видно границы. Вы можете задаться вопросом, почему фаза отличается от термина физического состояния (твердое, жидкое или газообразное). Он включает в себя твердые тела, жидкости и газы, но на самом деле является более общим. Это также может относиться к двум жидкостям (например, маслу и воде), которые не растворяются друг в друге. Вы могли видеть границу между двумя жидкостями. Если вы хотите быть суетливым в вещах, на диаграммах на самом деле показано больше фаз, чем указано. Каждый, например, также имеет стеклянный стакан в качестве твердой фазы. У всех наверное газ выше жидкости — это другая фаза. Мы не учитываем эти дополнительные фазы, потому что они не являются частью реакции. Гетерогенный катализ Это включает использование катализатора в фазе, отличной от реагентов. Типичные примеры включают твердый катализатор с реагентами в виде жидкостей или газов . | ||
Примечание: Важно помнить разницу между двумя терминами гетерогенный и гомогенный . гетеро подразумевает другой (как в случае гетеросексуал). В гетерогенном катализе катализатор находится в другой фазе, чем реагенты. гомосексуалист подразумевает то же самое (как в гомосексуализме). В гомогенном катализе катализатор находится в той же фазе, что и реагенты. | ||
Принцип работы гетерогенного катализатора (в общих чертах) Большинство примеров гетерогенного катализа проходят одни и те же стадии:
Хороший катализатор должен адсорбировать молекулы реагентов достаточно сильно, чтобы они реагировали, но не настолько сильно, чтобы молекулы продукта более или менее постоянно прилипали к поверхности. , например, не является хорошим катализатором, потому что оно не образует достаточно прочных связей с молекулами реагентов. Вольфрам, с другой стороны, не является хорошим катализатором, потому что он слишком сильно адсорбирует. Такие металлы, как платина и никель, являются хорошими катализаторами, потому что они адсорбируются достаточно сильно, чтобы удерживать и активировать реагенты, но не настолько сильно, чтобы продукты не могли оторваться. Примеры гетерогенного катализа Гидрирование двойной углерод-углеродной связи Простейшим примером этого является реакция между этиленом и водородом в присутствии никелевого катализатора. На практике это бессмысленная реакция, потому что вы превращаете чрезвычайно полезный этен в относительно бесполезный этан. Однако такая же реакция произойдет с любым соединением, содержащим двойную углерод-углеродную связь. Одним из важных промышленных применений является гидрогенизация растительных масел для производства маргарина, которая также включает реакцию двойной углерод-углеродной связи в растительном масле с водородом в присутствии никелевого катализатора. молекул этилена. Двойная связь между атомами углерода разрывается, и электроны используются для связывания ее с поверхностью никеля. Молекулы водорода также адсорбируются на поверхности никеля. Когда это происходит, молекулы водорода распадаются на атомы. Они могут перемещаться по поверхности никеля. Если атом водорода диффундирует близко к одному из связанных атомов углерода, связь между углеродом и никелем заменяется связью между углеродом и водородом. Этот конец первоначального этена теперь отрывается от поверхности, и, в конце концов, то же самое произойдет и с другим концом. Как и прежде, один из атомов водорода образует связь с углеродом, и этот конец также отрывается. Теперь на поверхности никеля есть место для новых молекул реагентов, чтобы снова пройти весь процесс. Каталитические нейтрализаторы Каталитические нейтрализаторы превращают ядовитые молекулы, такие как окись углерода и различные оксиды азота в автомобильных выхлопах, в более безвредные молекулы, такие как двуокись углерода и азот. Металлы наносят тонким слоем на керамический сотовый заполнитель. Это увеличивает площадь поверхности и сводит к минимуму количество используемого металла. Принимая реакцию между монооксидом углерода и монооксидом азота как типичную: | ||
Примечание: Это упрощение, адекватное тому, что задают большинство экзаменаторов этого уровня. Уравнение представляет общее изменение в каталитическом нейтрализаторе, но имеет место более чем в одну стадию. Если вам интересно, вы можете следить за этим, прочитав эту страницу Википедии | ||
На каталитические нейтрализаторы может повлиять отравление катализатора . Это происходит, когда что-то, что не является частью реакции, очень сильно адсорбируется на поверхности катализатора, не позволяя обычным реагентам достичь его. Свинец — известный каталитический яд для каталитических нейтрализаторов. Он покрывает соты из дорогих металлов и останавливает их работу. В прошлом к бензину (бензину) добавляли соединения свинца, чтобы он легче сгорал в двигателе. Но вы не можете использовать каталитический нейтрализатор, если вы используете этилированное топливо. Таким образом, каталитические нейтрализаторы не только помогли удалить ядовитые газы, такие как окись углерода и оксиды азота, но и заставили удалить ядовитые соединения свинца из бензина. Использование оксида ванадия(V) в контактном процессе В процессе контактного производства серной кислоты диоксид серы должен быть преобразован в триоксид серы. Это делается путем пропускания диоксида серы и кислорода над твердым катализатором на основе оксида ванадия (V). | ||
Примечание: Уравнение написано с половиной, чтобы сделать объяснение ниже более аккуратным.  Возможно, вы знакомы с уравнением, записанным в два раза больше, чем показано, но настоящая версия вполне приемлема. Это также показано как односторонняя, а не обратимая реакция, чтобы не усложнять ситуацию. Возможно, вы знакомы с уравнением, записанным в два раза больше, чем показано, но настоящая версия вполне приемлема. Это также показано как односторонняя, а не обратимая реакция, чтобы не усложнять ситуацию. | ||
Этот пример немного отличается от предыдущих тем, что газы фактически реагируют с поверхностью катализатора, временно изменяя ее. Это хороший пример способности переходных металлов и их соединений действовать как катализаторы из-за их способности изменять степень окисления. | ||
Примечание: Если вы не уверены в степенях окисления, может быть полезно перейти по этой ссылке, прежде чем продолжить. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | ||
Диоксид серы окисляется до триоксида серы оксидом ванадия(V). При этом оксид ванадия (V) восстанавливается до оксида ванадия (IV). Затем оксид ванадия(IV) повторно окисляется кислородом. Это хороший пример замены катализатора в ходе реакции. Однако в конце реакции она будет химически такой же, как она началась. | ||
Примечание: Если вам нужна более подробная информация о процессе обращения, вы найдете полное описание используемых условий и их причин, перейдя по этой ссылке. | ||
Гомогенный катализ Катализатор находится в той же фазе, что и реагенты. Обычно все присутствует в виде газа или содержится в одной жидкой фазе. Примеры содержат по одному из них. . . Примеры гомогенного катализа Реакция между ионами персульфата и ионами йодида Это реакция растворения, которую вы можете встретить только в контексте катализа, но это прекрасный пример! Персульфат-ионы (пероксодисульфат-ионы), S 2 O 8 2-, являются очень сильными окислителями. Если вы посмотрите на уравнение, легко понять, почему это так: Для реакции необходимо столкновение двух отрицательных ионов. Отвращение серьезно помешает этому! Катализируемая реакция полностью решает эту проблему. Катализатором могут быть ионы железа (II) или железа (III), которые добавляют к тому же раствору. Это еще один хороший пример использования соединений переходных металлов в качестве катализаторов из-за их способности изменять степень окисления. В качестве аргумента возьмем в качестве катализатора ионы железа(II). Как вы скоро увидите, на самом деле не имеет значения, используете ли вы ионы железа (II) или железа (III). Ионы персульфата окисляют ионы железа(II) до ионов железа(III). При этом персульфат-ионы восстанавливаются до сульфат-ионов. Ионы железа (III) являются достаточно сильными окислителями, чтобы окислять иодид-ионы до йода. Обе эти отдельные стадии общей реакции связаны со столкновением положительных и отрицательных ионов. Это будет иметь гораздо больше шансов на успех, чем столкновение двух отрицательных ионов в некатализируемой реакции. Что произойдет, если в качестве катализатора использовать ионы железа(III) вместо ионов железа(II)? Просто реакции происходят в другом порядке. Разрушение атмосферного озона Это хороший пример гомогенного катализа, когда все присутствует в виде газа. Озон, O 3 , постоянно образуется и снова разрушается в верхних слоях атмосферы под действием ультрафиолетового света. Обычные молекулы кислорода поглощают ультрафиолет и распадаются на отдельные атомы кислорода. Они имеют неспаренные электроны и известны как свободные радикалы . Они очень реактивны. Затем радикалы кислорода могут соединяться с обычными молекулами кислорода, образуя озон. Озон также можно снова разделить на обычный кислород и кислородный радикал, поглощая ультрафиолетовый свет. Это образование и разрушение озона происходит все время. В совокупности эти реакции останавливают большое количество вредных ультрафиолетовых излучений, проникающих через атмосферу и достигающих поверхности Земли. Интересующая нас каталитическая реакция разрушает озон и, таким образом, останавливает его поглощение ультрафиолета. Хлорфторуглероды (ХФУ), такие как CF 2 Cl 2 , например, широко использовались в аэрозолях и в качестве хладагентов. При их медленном распаде в атмосфере образуются атомы хлора – свободные радикалы хлора. Они катализируют разрушение озона. Это происходит в два этапа. В первом случае озон расщепляется и образуется новый свободный радикал. Катализатор радикального хлора регенерируется второй реакцией. Это может произойти двумя способами в зависимости от того, сталкивается ли радикал ClO с молекулой озона или с радикалом кислорода. Если он сталкивается с кислородным радикалом (полученным в результате одной из реакций, которые мы рассматривали ранее): Или если попадет в молекулу озона: Поскольку радикал хлора продолжает регенерироваться, каждый из них может разрушить тысячи молекул озона. | ||
Примечание: Если вы учитесь на уровне A в Великобритании, вероятно, вам понадобится только одно из этих двух последних уравнений, в зависимости от того, что написано в вашей учебной программе. К сожалению, на момент написания в разных программах уровня А цитировались разные окончательные уравнения. Вам необходимо проверить текущий учебный план. Если у вас нет копии учебного плана, перейдите по этой ссылке, чтобы узнать, как ее получить. | ||
Автокатализ Окисление этандиовой кислоты ионами манганата(VII) При автокатализе реакция катализируется одним из ее продуктов. Реакция протекает очень медленно при комнатной температуре. Он используется в качестве титрования для определения концентрации раствора манганата калия (VII) и обычно проводится при температуре около 60°С. Тем не менее, это довольно медленно, чтобы начать с. Реакция катализируется ионами марганца(II). Очевидно, что до начала реакции их нет, поэтому при комнатной температуре она начинается очень медленно. Однако, если вы посмотрите на уравнение, вы обнаружите среди продуктов ионы марганца (II). По мере протекания реакции образуется все больше и больше катализатора, и поэтому реакция ускоряется. Вы можете измерить этот эффект, построив график зависимости концентрации одного из реагентов от времени. Вы получаете график, совсем не похожий на обычную кривую скорости реакции. Большинство реакций дают кривую скорости, которая выглядит следующим образом: Концентрации в начале высоки, поэтому реакция протекает быстро, о чем свидетельствует быстрое падение концентрации реагента. Пример автокатализа дает такую кривую: Вы можете увидеть медленную (некатализируемую) реакцию в начале. По мере того, как в смеси начинает образовываться катализатор, скорость реакции ускоряется, становясь все быстрее и быстрее по мере того, как образуется все больше и больше катализатора. В конце концов, конечно, скорость снова падает, когда вещи изнашиваются. Внимание! Не думайте, что кривая скорости, которая выглядит так , обязательно показывает пример автокатализа. Существуют и другие эффекты, которые могут привести к аналогичному графику. Например, если в реакции участвовало твердое вещество, реагирующее с жидкостью, на твердом теле может быть какое-то поверхностное покрытие, через которое жидкость должна проникнуть, прежде чем произойдет ожидаемая реакция. Более распространенная возможность заключается в том, что у вас сильно экзотермическая реакция и вы не контролируете температуру должным образом. Теплота, выделяющаяся во время реакции, ускоряет реакцию.
В меню катализа. . . В меню «Физическая химия» . . . В главное меню . . . © Джим Кларк, 2002 г. (последнее изменение: октябрь 2013 г.) | ||
Катализатор | Факты, резюме и определение
Ищете примечания к пересмотру, относящиеся к экзаменационной комиссии, которую вы изучаете? Если это так, щелкните ссылки ниже, чтобы просмотреть наши сжатые, простые для понимания примечания к пересмотру для каждой экзаменационной комиссии, буклеты с практическими экзаменационными вопросами, наглядные пособия по ментальным картам, интерактивные викторины, презентации PowerPoint и библиотеку прошлых работ непосредственно с экзаменационных комиссий.
Содержание
Ключевая информация и резюме
- Катализатор – это вещество, которое увеличивает скорость реакции, не расходуясь при этом само.
- Они обеспечивают альтернативный путь реакции с более низкой энергией активации.
- Катализаторы делятся на два основных типа: гетерогенные и гомогенные
- Автокатализ — это реакция, которая может ускоряться сама по себе, так как один из продуктов может катализировать реакцию
- Ферменты являются биологическими катализаторами
Что такое катализатор?
Катализатор представляет собой вещество, которое увеличивает скорость реакции , не израсходовав самого себя. Они действительно химически изменяют во время реакции, но не навсегда . Они могут либо снизить энергию активации реакции, либо полностью изменить механизм реакции. Катализаторами могут быть переходный металл , оксид переходного металла или фермент .
Как работают катализаторы?
Вам необходимо знать, что скорость реакции зависит от двух основных факторов: энергии активации и температуры . Энергия активации реакции — это 90 571 энергии, которая должна быть предоставлена 90 572 для того, чтобы произошла химическая реакция. Она измеряется в 90 571 джоулях (Дж) 90 572 . Если в реакцию добавить катализатор, он может обеспечить альтернативный механизм реакции с меньшей энергией активации . Эта более низкая энергия активации означает, что реакция может протекать с более высокой скоростью без необходимости изменения температуры или концентрации реагентов.
Поскольку катализаторы снижают энергию активации, больше молекул сталкивается с энергией, необходимой для достижения переходного состояния. Как видно из приведенной выше диаграммы, фактическая термодинамика и конечный продукт реакции остаются теми же независимо от того, присутствует катализатор или нет.
Катализаторы реагируют с одним (или несколькими) реагентами с образованием промежуточного продукта . Затем он вступает в реакцию с образованием конечного продукта реакции и, следовательно, регенерацией катализатора в процессе. Таким образом, катализаторы не расходуются в реакции. Так как катализаторы регенерируются в ходе реакции, это означает, что вам обычно достаточно добавить небольшое количество для увеличения скорости реакции.
Катализаторы можно разделить на два основных типа : гетерогенный и гомогенный.
Гетерогенные катализаторы
Гетерогенные катализаторы представляют собой катализаторы, которые существуют в фазе, отличной от реагентов. Например, твердый катализатор, используемый в реакции с жидкостями, будет гетерогенным катализатором — вы можете помнить об этом, зная, что «гетеро» означает «другой».
Гетерогенные катализаторы работают в основном по одному и тому же механизму. Один (или более) из реагентов поглощается на поверхность катализатора в его активных центрах. Адсорбция — это , а не то же самое, что и абсорбция: адсорбция — это когда молекула реагента прилипает к поверхности катализатора, в отличие от абсорбции, когда молекула поглощается.
Один (или более) из реагентов поглощается на поверхность катализатора в его активных центрах. Адсорбция — это , а не то же самое, что и абсорбция: адсорбция — это когда молекула реагента прилипает к поверхности катализатора, в отличие от абсорбции, когда молекула поглощается.
После адсорбции молекулы реагентов и катализатор взаимодействуют , делая молекулы реагентов более реактивными . Затем происходит основная реакция с образованием продукта 9.0572 , который затем десорбируется с поверхности катализатора. Это оставляет активный центр катализатора пустым, что означает, что больше молекул может адсорбироваться на нем и вступать в реакцию. На изображении ниже показан пример гетерогенной каталитической реакции.
Чтобы сделать хороший гетерогенный катализатор, он должен поглощать молекулы реагентов достаточно сильно, чтобы они могли реагировать, но не слишком сильно, чтобы продукт не мог десорбироваться . Например, платина является хорошим гетерогенным катализатором, потому что реагенты могут легко адсорбироваться, но продукт легко отделяется.
Например, платина является хорошим гетерогенным катализатором, потому что реагенты могут легко адсорбироваться, но продукт легко отделяется.
Катализаторы этого типа часто представляют собой мелкодисперсный порошок . Это помогает максимизировать площадь поверхности и, таким образом, обеспечить наиболее эффективную скорость реакции. Этот тип катализатора также можно очень легко отделить от реакционной смеси , что означает, что дорогостоящие катализаторы могут быть извлечены и повторно использованы .
Гомогенные катализаторы
Гомогенные катализаторы существуют в той же фазе , что и реагенты, обычно в растворе. Например, жидкий катализатор, используемый в реакции, где реагенты также являются жидкостями, катализаторы будут гомогенными — вы можете запомнить это, зная, что «гомо» означает «одинаковый».
Катализ в этой форме обусловлен временными изменениями степени окисления (и лигандов) переходного металла — это формирует то, что известно как каталитический цикл .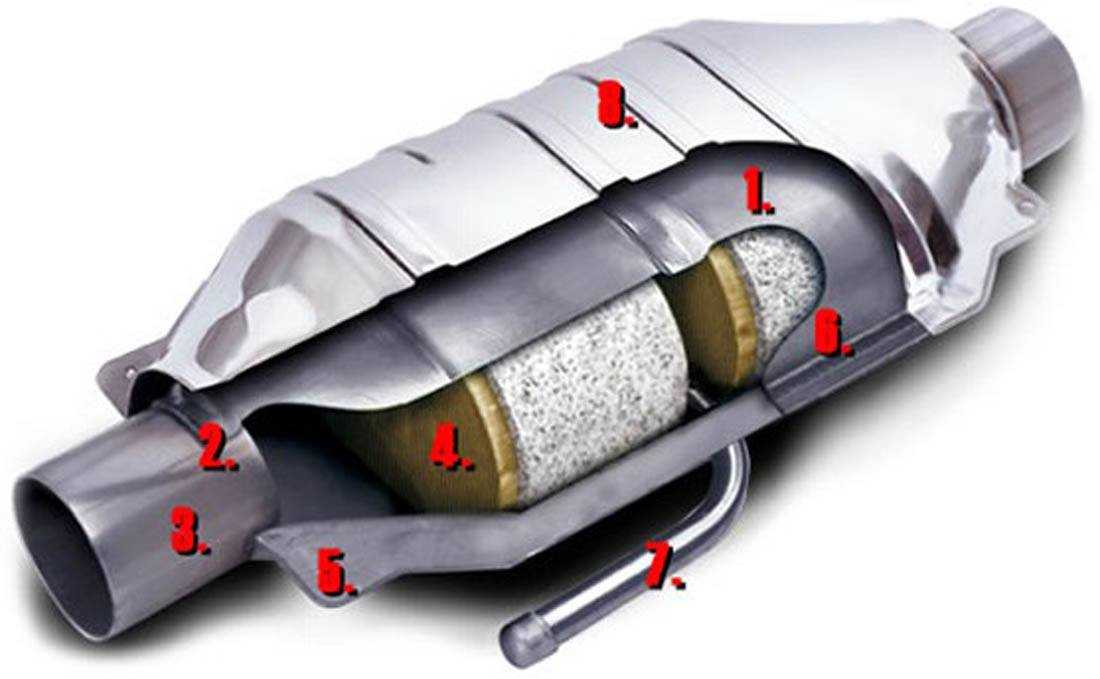 Проще говоря, реакции происходят через промежуточные частицы, и катализатор преобразуется в процессе .
Проще говоря, реакции происходят через промежуточные частицы, и катализатор преобразуется в процессе .
Гомогенные катализаторы могут «смешиваться» с реагентами, что означает, что степень взаимодействия между катализаторами и молекулами реагентов будет очень высокий . Однако это также означает, что катализаторы обычно не могут быть восстановлены после завершения реакции.
Автокатализ
Существует дополнительный тип катализа, который называется автокатализа . Это реакция , которая катализируется одним из продуктов реакции. В этом типе реакции по мере образования катализатора скорость реакции будет увеличиваться . Он будет продолжать ускоряться по мере образования большего количества катализатора. В итоге весь катализатор будет израсходован и скорость реакции снизится. Это хорошо поясняет приведенная ниже кривая.





 Будь осторожен!
Будь осторожен!

 В качестве гетерогенного катализатора они используют дорогие металлы, такие как платина, палладий и родий.
В качестве гетерогенного катализатора они используют дорогие металлы, такие как платина, палладий и родий.

 Иодид-ионы очень легко окисляются до йода. И все же реакция между ними в растворе в воде протекает очень медленно.
Иодид-ионы очень легко окисляются до йода. И все же реакция между ними в растворе в воде протекает очень медленно. В процессе они снова восстанавливаются до ионов железа (II).
В процессе они снова восстанавливаются до ионов железа (II).

 Одним из простейших примеров этого является окисление раствора этандиовой кислоты (щавелевой кислоты) подкисленным раствором манганата калия (VII) (перманганат калия).
Одним из простейших примеров этого является окисление раствора этандиовой кислоты (щавелевой кислоты) подкисленным раствором манганата калия (VII) (перманганат калия). По мере того, как вещи изнашиваются, реакция замедляется и в конце концов останавливается, когда один или несколько реагентов полностью израсходованы.
По мере того, как вещи изнашиваются, реакция замедляется и в конце концов останавливается, когда один или несколько реагентов полностью израсходованы.