Плотность электролита в аккумуляторе – важные данные
Падение плотности электролита в аккумуляторе автомобиля – одна из широко известных проблем, с которой нередко сталкиваются автовладельцы. Поэтому мы решили рассмотреть её в деталях. Наша сегодняшняя статья поможет вам узнать, как измерить плотность электролита и каким должен быть его уровень в АКБ.
Во многих случаях снижение плотности электролита связано с обыкновенным испарением раствора. Зачастую такое происходит после закипания жидкости в случае слишком длительной зарядки. Это одна из причин того, что аккумулятор начал быстро разряжаться.
Для того чтобы поддерживать в АКБ необходимое количество жидкости используется дистиллированная вода. Однако далеко не все понимают, что нужно также следить за плотностью электролита. Ведь выкипает не лишь вода, но и электролит. В итоге через определенный промежуток времени его плотность опускается до минимальных значений. Именно в таких случаях автомобилистам приходится узнавать, как повысить плотность аккумулятора.
Полезные рекомендации
- Определять плотность электролита рекомендуется при температуре воздуха около 20-22°С.
- Придерживайтесь правил безопасности во время использования кислоты (перчатки и очки не помешают точно).
- Поскольку плотность воды и электролита отличается, во время разведения последнего помните, что кислоту нужно добавлять в воду. В противном случае ожоги могут быть очень сильными («Химик, запомни как оду – льют кислоту в воду»).
- Предварительно подыщите подходящие емкости для замены и разведения электролита.
- Аккумулятор нельзя переворачивать вверх дном.
- После зарядки АКБ плотность электролита в нём возрастает.
- Упомянутые далее действия и показатели плотности электролита актуальны для кислотных аккумуляторов.
Инструменты и материалы
- Ареометр (определяет плотность электролита).
- Резиновая груша.
- Мерная емкость.

- Вода дистиллированная.
- Кислота для аккумулятора.
- Электролит.
- Раствор соды пищевой.
- Дрель.
- Паяльник.
Как определить уровень электролита в аккумуляторе
В жаркое время вода испаряется гораздо быстрее, чем зимой. Поэтому уровень электролита в АКБ автомобиля рекомендуется регулярно проверять именно в теплый период года (идеальный вариант – ежемесячно). Если корпус аккумулятора изготовлен со слегка прозрачного пластика, можно визуально определить приблизительный уровень электролита в банках. Помочь также могут соответствующие метки на корпусе, с помощью которых можно установить, надо ли доливать дистиллированную воду.
Если же корпус далеко не прозрачный, придется открутить пробки и определить уровень с помощью тонкой трубки из стекла. Необходимо опустить трубку в заливное отверстие, чтобы она коснулась верхней сетки пластин, после чего закрыть верхнее её отверстие с помощью пальца и вытащить. Оптимальный уровень электролита аккумулятора должен составлять в пределах 10-15 миллиметров.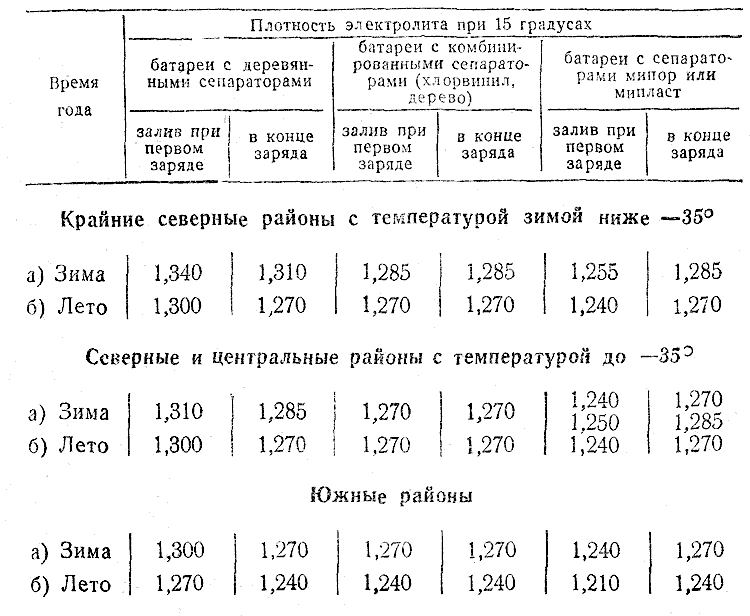
Плотность электролита в цифрах
Рекомендации по увеличению плотности электролита
- В первую очередь следует определить плотность электролита в разных банках аккумулятора. Многие автолюбители задают вопрос о том, какая должна быть плотность аккумулятора. В данном случае необходимо учитывать местные условия климата. Например, на севере страны данный показатель будет более высоким, по сравнению с югом. Оптимальной является плотность раствора в пределах 1.25-1.29. Показатели в разных банках не должны отличаться больше, чем на 0.01. Если результаты измерений показали, что плотность равна 1.18-1.20, необходимо просто добавить электролит, имеющий плотность 1.27.
- Выбираем одну из банок, из которой следует откачать максимальное количество прежнего раствора, воспользовавшись резиновой грушей. Не забудьте определить объем полученной жидкости.
- Добавляем новый электролит, причем его количество должно быть вдвое меньшим, чем количество слитого.
- Трясем и качаем АКБ в разные стороны, чтобы обеспечить перемешивание жидкостей.

- Определяем плотность. В случае необходимости добавляем вторую часть электролита. Осуществлять вышеупомянутые действия необходимо до того времени, пока плотность не будет подходящей.
- Далее доливаем требуемое количество дистиллированной воды.
Как поднять плотность в аккумуляторе – два варианта
- Если плотность не достигает даже 1.18, необходимо использовать аккумуляторная кислота, поскольку она имеет гораздо более высокую плотность. Все нужно делать в такой же последовательности, как и в случае заливки нового электролита.
- В некоторых случаях может понадобиться полная замена электролита. Для этого нужно воспользоваться резиновой грушей и откачать максимальное количество жидкости и полностью закрыть отверстия для вентиляции на банках АКБ. Аккумулятор надо положить на бок и просверлить отверстия, используя сверло на 3-5 миллиметров. Отверстия необходимо сделать в каждой банке. Затем выполняется промывка аккумулятора с помощью дистиллированной воды.
Для этих целей прекрасно подойдут старые пробки банок аккумулятора.
На финальном этапе производим заливку нового электролита. Рекомендуется применять раствор, приготовленный своими силами. Его плотность должна быть немного выше той, которая рекомендована для ваших климатических условий.
Не забывайте, что наши советы о том, как поднять плотность электролита в аккумуляторе, не помогут вам в том случае, если АКБ сильно изношена. Поскольку в автомобильном аккумуляторе протекают определенные химические процессы, даже замена электролита не может обеспечить долгий срок эксплуатации АКБ, которым и отличается новый аккумулятор.
Иногда приходится просто покупать новый аккумулятор, о выборе которого по марке машины написано тут.
Как поднять плотность электролита в аккумуляторе: советы, фото
Часто автовладельцы сталкиваются с проблемой запуска двигателя, что актуально после длительной стоянки автомобиля, в зимнее время. Причиной этого, является подсевший аккумулятор. В качестве альтернативы покупке нового, многие автовладельцы с помощью подзарядного устройства пытаются исправить ситуацию, но, не всегда это приводит к положительному результату. Даже зарядка АКБ длительное время не всегда помогает, так как не поднималась плотность аккумулятора при зарядке.
Причиной этого, является подсевший аккумулятор. В качестве альтернативы покупке нового, многие автовладельцы с помощью подзарядного устройства пытаются исправить ситуацию, но, не всегда это приводит к положительному результату. Даже зарядка АКБ длительное время не всегда помогает, так как не поднималась плотность аккумулятора при зарядке.
Когда возникает такая проблема, то, очевидно, что в электролите батареи снизилась плотность. Давайте подробнее разберемся, как поднять плотность электролита в аккумуляторе и что предпринять.
Почему снижается плотность электролита
Прежде чем, заняться восстановлением, выясним как правильно поднять плотность аккумулятора и найти причины, которые привели к падению этого показателя. В любой автомобильной батарее, данная величина не статична. Она постоянно изменяется и это является нормальным. Когда АКБ разряжается, то, понижается и плотность электролита. Когда заряжен, то вверх идет и этот параметр. Если происходит быстрая разрядка, то это, свидетельствует о том, что концентрация упала до критичного уровня.
Можно перечислить несколько основных причин, из-за которых образуется низкая плотность электролита в аккумуляторе:
- длительное воздействие низких температур;
- выкипание электролита в следствии перезарядки батареи;
- постоянное доливание воды.
Что касается третьего пункта, то, очень часто, чтобы поддержать уровень жидкости, доливают дистиллированную воду аккумуляторную. Обязательным условием является регулярная проверка плотности. Одновременно с водой выкипает электролит, что, в итоге ведет уменьшению. Кроме подзарядного устройства, важно иметь еще и ареометр для проверки значения плотности.
Подготовка к восстановлению батареи
Перед тем, как поднять плотность в аккумуляторе, проведем ее измерение ареометром. Делать замеры следует отдельно для каждой из банок. Что касается нормального уровня, то здесь диапазон должен составлять от 1,25 до 1,29. Такой разброс объясняется тем, что в регионах, где холодные зимы, лучше держать норму электролита повышенной, а в регионах с умеренным климатом чуть ниже.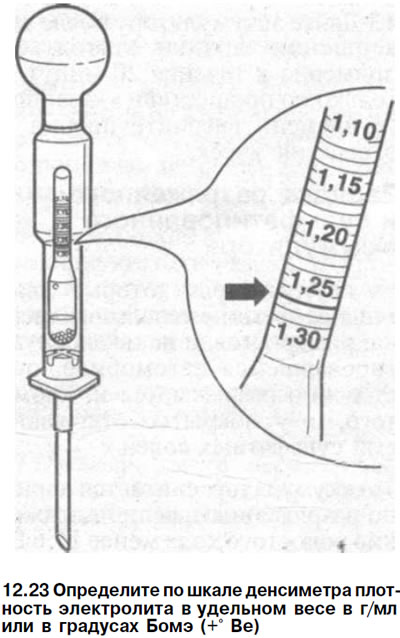 Если показатель ниже значения 1,25, восстановить нормальный уровень можно с помощью долива.
Если показатель ниже значения 1,25, восстановить нормальный уровень можно с помощью долива.
Повышение плотности электролита
Чтобы поднять плотность АКБ, следует начать со следующего:
- Следует убедиться, что аккумулятор заряжен. Если батарея разряжена, то, надо подзарядить и провести замер плотности. Нельзя приступать к работе, если АКБ имеет низкий заряд, так как, при заливе корректирующего раствора, в АКБ может резко подняться концентрация h3SO4. Как итог – полное разрушение в банках пластин, после чего, аккумуляторную батарею можно только утилизировать.
- Электролит в АКБ должен иметь температуру не менее 20, но не более 25 градусов цельсия.
- В каждой банке уровень должен быть в норме.
- Аккумулятор не должен иметь трещин и повреждений, особенно возле токовыводов. Часто возникает проблема снять клемму из-за того, что она прикипела или плотно закручена. Некоторые владельцы начинают расшатывать и стучать по токовыводу и клемме, что может целостность батареи.

При уровне не ниже 1,18, следует выполнять долив электролита с нормальной плотностью, чтобы увеличить, как минимум до 1,25. Долив выполняется для каждой банки отдельно. Через клизму-грушу берется забор старого, замеряется уровень и доливается свежий объемом не более половины от выкачанного. После этого, следует немного потрясти АКБ, чтобы дать жидкости возможность максимально перемешаться.
Можно ли повысить минимальную плотность
Что делать, если уровень упал ниже 1,18? Нужно предпринять более серьезные шаги, поскольку, доливом здесь не обойтись. В таких случаях используют кислоту аккумуляторную. Ее главное отличие в большей плотности (примерно 1,84). Сама работа производится по такой же схеме, как и добавление электролита. Обычно, после одной замены удается достичь нормальной концентрации, но если замеры показывают, что плотность ниже необходимой, то, следует повторить работу еще раз. Продается эта кислота в любом автомагазине, поэтому приобрести ее проблем не составит.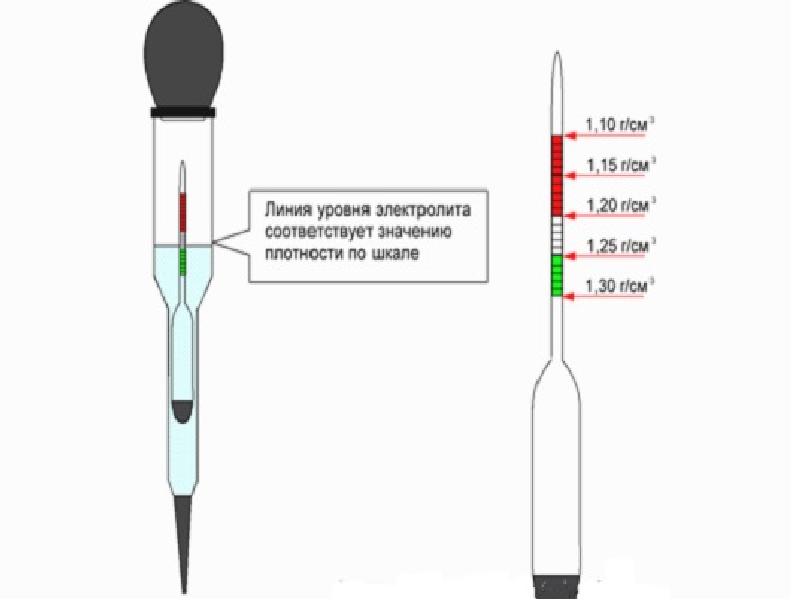 Выполнять работы с кислотой следует в открытом помещении или на воздухе и обязательно в перчатках. Попадание кислоты на незащищенные участки тела грозит появлением термических ожогов.
Выполнять работы с кислотой следует в открытом помещении или на воздухе и обязательно в перчатках. Попадание кислоты на незащищенные участки тела грозит появлением термических ожогов.
Как повысить при помощи зарядного устройства
Еще одним способом восстановления работоспособности АКБ, подзарядка ее на слабом токе. Этот способ требует много времени, но, довольно эффективен, если не поднимается плотность электролита до нормального уровня. Суть способа такова, что аккумуляторную батарею можно самостоятельно, через подзарядное устройство, зарядить до полного. Когда заряд будет максимальным, жидкость начнет кипеть. Признаком полной подзарядки будет появление мелких пузырьков (происходит испарение дистиллированной воды в батарее). Избыток воды испарится, а кислота останется. Одновременно понизится и общий уровень электролита. Теперь можно долить новый необходимой плотности. После этого, следует замерить показания ареометром и если они недостаточны, то повторить всю процедуру, пока не будет достигнута норма не ниже 1,25 г/см3.
Если станет вопрос о покупке нового или восстановления имеющегося аккумулятора, то конечно дешевле выбрать второе, тем более, что работа не является сложной и прочитав внимательно статью, даже человек, который плохо разбирается в технике, без труда сможет выполнить работу по повышению плотности электролита и восстановления работоспособности АКБ, как минимум на пару сезонов. Это серьезная экономия бюджета, тем более, что качественный аккумулятор стоит немалых средств.
Видео про поднятие плотности в аккумуляторе
Оптимальная плотность электролита в аккумуляторе зимой и летом
Споры по вопросу правильной эксплуатации автомобильных аккумуляторов ведутся давно, и конца им не видно. Это объясняется, в том числе, и тем, что число автолюбителей неуклонно растет, и каждый из тех, кто смог проехать самостоятельно даже пару сотню метров, уже априори считает себя авторитетом в данной области и высказывает «авторские», порой безапелляционные, суждения.
Это объясняется, в том числе, и тем, что число автолюбителей неуклонно растет, и каждый из тех, кто смог проехать самостоятельно даже пару сотню метров, уже априори считает себя авторитетом в данной области и высказывает «авторские», порой безапелляционные, суждения.
Если «пройтись» по Интернету, то порой встречается и такое, что вполне можно засомневаться в собственной компетенции, пожалеть о напрасно потраченных годах и даже пересмотреть свое мировоззрение.
Но это еще полбеды. Дело в том, что даже у профессионалов мнения по некоторым вопросам не всегда совпадают. Поэтому попробуем суммировать всю доступную информацию и вывести «среднее арифметическое», не кидаясь в крайности. Не будем утруждать читателя пояснениями относительно всех нюансов химических процессов, протекающих в АКБ, специфическими терминами, а рассмотрим проблему поддержания плотности электролита в аккумуляторе зимой и летом на приемлемом уровне с чисто практической точки зрения.
Главный советчик по уходу и сбережению аккумулятора, в том числе, и по плотности электролита – Производитель!
К каждой батарее прилагается сопроводительный документ (памятка, инструкция или что-то еще – не суть важно). Но именно в нем написано то, что необходимо знать автовладельцу и учитывать при эксплуатации конкретной батареи. Только тот, кто ее изготовил, разбирается во всех тонкостях ухода.
Но именно в нем написано то, что необходимо знать автовладельцу и учитывать при эксплуатации конкретной батареи. Только тот, кто ее изготовил, разбирается во всех тонкостях ухода.
Например, к какой категории относится АКБ – обслуживаемые, малообслуживаемые (не требующие регулярной доливки воды на протяжении многих месяцев) или необслуживаемые. А то, что они бывают разными и по материалам, и по технологии изготовления (и так далее), объяснять, думается, никому не стоит.
Максимальный, причем систематический, разряд батареи резко снижает срок ее пригодности к эксплуатации. Это никем не оспаривается. Дело в том, что он вызывает повышенную сульфатацию пластин (отложение солей), и часто такой процесс становится необратимым. Слишком «запущенный» аккумулятор восстановлению не подлежит, и его дальнейший путь – в утиль, даже если он не так уж и давно приобретен.
Для батареи одинакова вредна как пониженная, так и повышенная плотность электролита. Если он (в силу разряженности аккумулятора) мало чем отличается от воды, то банки при низких температурах могут просто замерзнуть.
Излишняя же плотность провоцирует активацию химических процессов, которые в батарее протекают постоянно, независимо от того, «работает» она или «отдыхает». А это влечет более интенсивное разрушение пластин и снижает срок службы изделия.
Для каждого региона есть свое значение оптимальной плотности электролита, поэтому единой рекомендации изначально быть не может. Например, для условий Крайнего Севера – не менее 1,29. Поэтому необходимо ориентироваться не только на сезон, но и на критические значения температуры, которыми характеризуется данная местность. Следовательно, встречающиеся в интернете советы о поддержании плотности на уровне 1,26 – 1,27 можно расценивать только как общую рекомендацию. Кстати, такой показатель приемлем для большей части территории РФ, наверное, поэтому его часто и упоминают.
Учитывая сказанное, есть смысл выяснить минимально допустимое (критическое) значение плотности, ниже которого оно не должно опускаться. И вот тут нужно вспомнить об инструкции Производителя! Хотя есть и распространенное правило – не менее 1,23.
Практические советы
- В зимний период запуск двигателя, как правило, затруднен. Поэтому, если машина стояла в холодном боксе и АКБ с нее не снималась, то ее желательно предварительно прогреть (повысить температуру электролита). Самый простой способ – включить осветительные приборы (например, дальний свет).
- Необходимо чаще контролировать состояние клемм, особенно при сезонном понижении температуры. Уменьшение плотности электролита влечет увеличение значения внутреннего сопротивления батареи, а, следовательно, и всей эл/цепи «запуска». Вспомнив закон Ома, несложно понять, что пусковой ток становится несколько меньше, что и затрудняет работу стартера (не создается должный крутящий момент).
- Если в батарею требуется долить воду (дистиллированную), то специалисты рекомендуют делать это, не снимая АКБ с машины и при запущенном двигателе.
 Объясняется это следующими причинами.
Объясняется это следующими причинами.
Во-первых, значения плотностей электролита и воды отличаются, и такой способ доведения уровня в банках до нормы обеспечивает качественное перемешивание жидкостей.
Во-вторых, если долить воды и после этого не эксплуатировать машину, а уйти хотя бы на время, то она может элементарно замерзнуть, так как легче электролита и, следовательно, будет являться «поверхностным слоем» жидкости в каждой банке.
- Ни в коем случае нельзя добиваться повышения значения плотности путем банального добавления в электролит кислоты!!! Объяснение простое – чем агрессивнее среда, тем меньше срок пригодности АКБ к использованию. Именно по этой причине некоторые автомобилисты не могут понять, почему уже через год после приобретения вроде бы новая батарея уже ни на что не годится. Вывод – только постановка на зарядку.
- Многие автомобилисты в зимний период ставят машину «на прикол». Им не рекомендуется оставлять АКБ по месту установки.
 Целесообразнее ее снять, полностью зарядить и перенести в прохладное помещение (например, спустить в погреб), предварительно «укутав» во влагонепроницаемый материал. В каждом регионе «своя» зима (по продолжительности). Поэтому не реже раза в пару месяцев ее стоит проверять «на плотность» и при необходимости подзаряжать. Такая аккуратность в уходе вполне окупится более продолжительным сроком эксплуатации батареи.
Целесообразнее ее снять, полностью зарядить и перенести в прохладное помещение (например, спустить в погреб), предварительно «укутав» во влагонепроницаемый материал. В каждом регионе «своя» зима (по продолжительности). Поэтому не реже раза в пару месяцев ее стоит проверять «на плотность» и при необходимости подзаряжать. Такая аккуратность в уходе вполне окупится более продолжительным сроком эксплуатации батареи.
И напоследок — не нужно стесняться спрашивать советов у людей опытных. В любом гаражном комплексе есть автолюбители, которые характеризуются продолжительной безаварийной эксплуатацией, аккуратностью в уходе за «железным конем». А если такой человек имеет и большой стаж вождения (а значит, и обслуживания), то его рекомендации (и по плотности тоже), лишними никак не будут.
Плотность электролита в аккумуляторе (АКБ)
Концентрация серной кислоты в электролите характеризуется плотностью электролита. Плотность любой жидкости определяется как отношение ее удельного веса к удельному весу воды. Иными словами, чем удельный вес вещества (жидкости) больше, тем выше ее плотность. Эталоном плотности выбрана дистиллированная вода, плотность которой принята равной 1,000 при температуре 80°Ф (27°С). Плотность чистой серной кислоты составляет 1,835. Нормальная концентрация водного раствора серной кислоты (раствора, состоящего на 64% из воды и на 36% из серной кислоты, называемого электролитом) характеризуется плотностью электролита в пределах от 1,260 до 1,280 при температуре 80°Ф (27°С). Чем выше плотность электролита в аккумуляторной батарее, тем выше степень ее заряженности.
Иными словами, чем удельный вес вещества (жидкости) больше, тем выше ее плотность. Эталоном плотности выбрана дистиллированная вода, плотность которой принята равной 1,000 при температуре 80°Ф (27°С). Плотность чистой серной кислоты составляет 1,835. Нормальная концентрация водного раствора серной кислоты (раствора, состоящего на 64% из воды и на 36% из серной кислоты, называемого электролитом) характеризуется плотностью электролита в пределах от 1,260 до 1,280 при температуре 80°Ф (27°С). Чем выше плотность электролита в аккумуляторной батарее, тем выше степень ее заряженности.
Рис. В процессе разряда аккумуляторной батареи плотность электролита снижается
Индикаторы степени заряженности аккумулятора
Некоторые типы аккумуляторных батарей оснащены встроенным индикатором степени заряженности. Такой индикатор представляет собой просто небольшой ареометр шарикового типа, вмонтированный в одну из ячеек аккумуляторной батареи. В этом ареометре используется пластмассовый шарик, который всплывает в электролите нормальной плотности (когда аккумулятор заряжен примерно на 65%).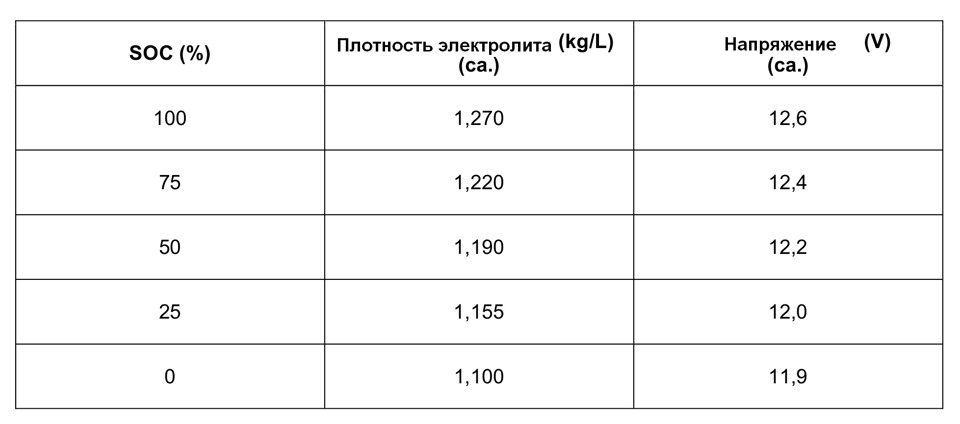 Когда шарик всплывает, он появляется в окошке ареометра, изменяя его цвет.
Когда шарик всплывает, он появляется в окошке ареометра, изменяя его цвет.
Рис. Типичный индикатор степени заряженности аккумуляторной батареи. При низкой плотности электролита (разряженная аккумуляторная батарея) шарик-поплавок тонет, соскальзывая с отражательной призмы. При достаточной степени заряженности аккумуляторной батареи шарик всплывает, и его цвет (обычно зеленый) приводит к изменению света, отражаемого призмой в сторону окошка индикатора, — оно темнеет
Рис. Аккумуляторная батарея с частично удаленным корпусом, в котором виден вмонтированный индикатор степени заряженности аккумулятора. Если уровень электролита опускается ниже дна призмы, окошко индикатора становится прозрачным (светлым). Производители аккумуляторных батарей предупреждают о том, что в случае снижения уровня электролита в герметизированной аккумуляторной батарее, такая аккумуляторная батарея подлежит немедленной замене. Попытка зарядить аккумуляторную батарею, имеющую недостаточный уровень электролита, может привести к скоплению в ней газов и закончиться взрывом аккумуляторной батареи
Поскольку ареометр контролирует плотность электролита только в одной из ячеек аккумуляторной батареи (а в 12-вольтовой аккумуляторной батарее их — шесть), и поскольку шарик ареометра может легко застрять в одном положении, полагаться на его показания, как на достоверную информацию о степени заряженности аккумуляторной батареи, не следует.
Связь между плотностью электролита, степенью заряженности и напряжением аккумуляторной батареи
Ниже в таблице приведены значения плотности электролита и соответствующие им значения степени заряженности и напряжения аккумуляторной батареи при температуре 80°Ф (27°С).
| Плотность электролита | Степень заряженности аккумуляторной батареи | Напряжение аккумуляторной батареи (В) |
| 1,265 | Полностью заряжена | Не ниже 12,6 |
| 1,225 | Заряжена на 75% | 12,04 |
| 1,19 | Заряжена на 50% | 12,2 |
| 1.155 | Заряжена на 25% | 12 |
| Ниже 1.120 | Разряжена | 11,9 и ниже |
Крепление аккумуляторной батареи в автомобиле
Аккумуляторная батарея, во избежание ее повреждения, должна быть обязательно надежно закреплена в автомобиле. Под действием нормальной вибрации автомобиля активная масса может осыпаться с пластин аккумуляторной батареи. Зажимы и кронштейны крепления аккумуляторной батареи обеспечивают ослабление ее вибрации, которая может стать причиной значительного снижения емкости и ресурса любой аккумуляторной батареи.
Под действием нормальной вибрации автомобиля активная масса может осыпаться с пластин аккумуляторной батареи. Зажимы и кронштейны крепления аккумуляторной батареи обеспечивают ослабление ее вибрации, которая может стать причиной значительного снижения емкости и ресурса любой аккумуляторной батареи.
Знакомство с батареей: возможности, ожидания и ограничения
BU-104: Conociendo la Batería (Español)
Признайте силу батареи и научитесь жить с ее слабостью.
Природа предлагает множество способов производства энергии. Большинство из них возникает в результате горения, механического движения и фотосинтеза, как в солнечных батареях. Генерация электрической энергии в батарее происходит в результате электрохимической реакции между двумя металлами с разным сродством.При воздействии кислот между металлами возникает напряжение как часть ионного переноса; замыкание цепи индуцирует ток. В 1800 году изобретатель Алессандро Вольта обнаружил, что потенциал напряжения становится тем сильнее, чем дальше друг от друга перемещаются числа сродства.
Самое простое проявление батарейки — лимон. Вбивание оцинкованного гвоздя и медной монеты в лимон создает напряжение, но эта квази-батарея не обеспечивает большой мощности. Система подачи тока слабая, и любая электрическая нагрузка вызывает падение напряжения.Энергия исходит не от самого лимона, а от химического превращения цинка в кислоту или лимонный сок. На рисунке 1 изображена лимонная батарея.
| Рисунок 1: Лимонная батарея Эксперимент часто используется в образовательных целях. Электроды цинковые в виде гальванизированного гвоздя и медные в форме монеты. Лимонный сок действует как электролит, вызывая химическую реакцию. Стандартный потенциал цинка = –0.76 |
Элементы с наибольшим потенциалом отрицательного электрода служат катодами; те, у кого самый высокий положительный потенциал, служат в качестве анодов. Разница между электродами обеспечивает напряжение на зажимах. Чтобы перезаряжаемая батарея была практичной, химические реакции между элементами должны быть обратимыми. Еще больше усложняет ситуацию то, что химические реакции между соединениями не могут потреблять активные химические вещества, и это ограничивает набор подходящих электродов.
Разница между электродами обеспечивает напряжение на зажимах. Чтобы перезаряжаемая батарея была практичной, химические реакции между элементами должны быть обратимыми. Еще больше усложняет ситуацию то, что химические реакции между соединениями не могут потреблять активные химические вещества, и это ограничивает набор подходящих электродов.
Умножение напряжения на ток дает мощность. Мощность измеряется в ваттах в честь Джеймса Ватта, разработчика паровой машины 18 века. Количество энергии, которое может хранить аккумулятор, выражается в ватт-часах (Втч).
Все источники энергии имеют ограничения, и питание следует использовать осторожно, чтобы не вызвать перегрузки. Аналогия — велосипедист (рис. 2), который выбирает наилучшее передаточное число для передачи мощности движущей силе. На ровной дороге повышенная передача пров
История развития аккумуляторов
Батареи прошли долгий путь с момента их появления в 250 году до нашей эры. Предоставлено: Flickr / Patty, CC BY-NC-SA.
Предоставлено: Flickr / Patty, CC BY-NC-SA.Батареи сегодня настолько распространены, что они почти незаметны для нас. Тем не менее, это замечательное изобретение с долгой и легендарной историей и не менее интересным будущим.
Батарея — это, по сути, устройство, в котором накапливается химическая энергия, которая преобразуется в электричество. По сути, батареи — это небольшие химические реакторы, в которых в результате реакции образуются энергичные электроны, готовые протекать через внешнее устройство.
Батареи у нас давно. В 1938 году директор Багдадского музея обнаружил в подвале музея то, что сейчас называют «Багдадской батареей». Анализ датировал его месопотамским происхождением примерно 250 г. до н. Э.
Споры вокруг этого самого раннего примера батареи, но предлагаемые варианты использования включают гальваническое покрытие, обезболивание или религиозное покалывание.
Американский ученый и изобретатель Бенджамин Франклин впервые использовал термин «батарея» в 1749 году, когда проводил эксперименты с электричеством с использованием набора соединенных конденсаторов.
Первая настоящая батарея была изобретена итальянским физиком Алессандро Вольта в 1800 году. Вольта сложил диски из меди (Cu) и цинка (Zn), разделенных тканью, пропитанной соленой водой.
Провода, подключенные к любому концу стопки, производили непрерывный стабильный ток. Каждая ячейка (набор из Cu, Zn диска и рассола) выдает 0,76 Вольт (В). Это значение, кратное этому значению, определяется количеством ячеек, сложенных вместе.
Один из самых долговечных аккумуляторов, свинцово-кислотный, был изобретен в 1859 году и до сих пор используется для запуска большинства автомобилей с двигателями внутреннего сгорания.Это старейший образец аккумуляторной батареи.
Сегодня батареи бывают разных размеров, от больших мегаваттных размеров, которые накапливают энергию солнечных ферм или подстанций, чтобы гарантировать стабильное энергоснабжение целых деревень или островов, до крошечных батарей, подобных тем, которые используются в электронных часах.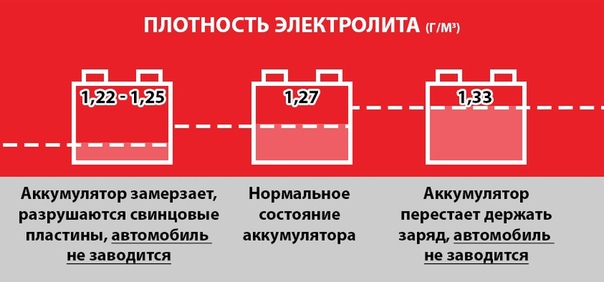
имеют различный химический состав, которые генерируют базовые напряжения элементов, как правило, в диапазоне от 1,0 до 3,6 В. Последовательное соединение ячеек увеличивает напряжение, а их параллельное соединение увеличивает подачу тока.Этот принцип используется для суммирования требуемых напряжений и токов, вплоть до мегаваттных размеров.
В настоящее время многие ожидают, что технология аккумуляторов совершит еще один скачок с разработкой новых моделей, обладающих достаточной емкостью для хранения энергии, вырабатываемой домашними солнечными или ветряными системами, а затем для некоторых из них обеспечит питание дома в более удобное (обычно ночное) время дней
Как работают аккумуляторы?
Когда батарея разряжается, в результате химической реакции образуются дополнительные электроны. Примером реакции с образованием электронов является окисление железа с образованием ржавчины. Железо реагирует с кислородом и отдает электроны кислороду с образованием оксида железа.
Примером реакции с образованием электронов является окисление железа с образованием ржавчины. Железо реагирует с кислородом и отдает электроны кислороду с образованием оксида железа.
В стандартной конструкции батареи используются два металла или соединения с разными химическими потенциалами и разделяются пористым изолятором. Химический потенциал — это энергия, запасенная в атомах и связях соединений, которая затем передается движущимся электронам, когда им разрешается перемещаться через подключенное внешнее устройство.
Проводящая жидкость, такая как соль и вода, используется для переноса растворимых ионов от одного металла к другому во время реакции и называется электролитом.
Металл или соединение, которое теряет электроны во время разряда, называется анодом, а металл или соединение, которое принимает электроны, называется катодом. Этот поток электронов от анода к катоду через внешнее соединение — это то, что мы используем для работы наших электронных устройств.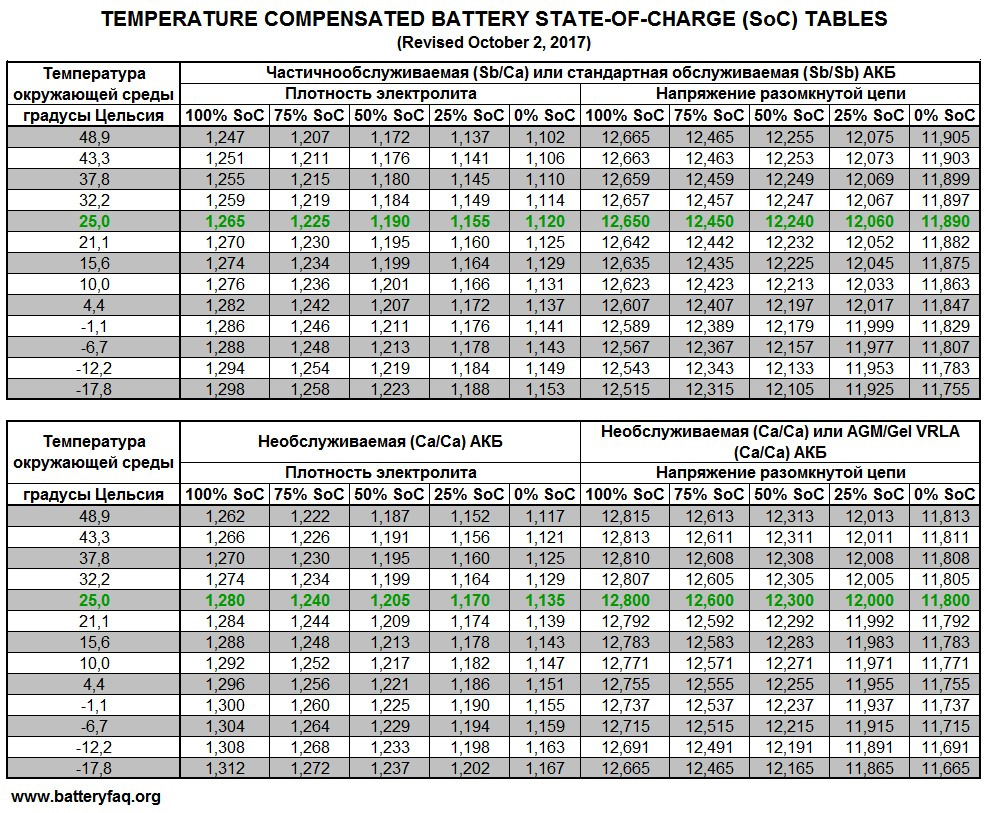
Первичные и аккумуляторные батареи
Типичный автомобильный аккумулятор.Предоставлено: Flickr / Асим Бхарвани, CC BY-NC-ND.Когда реакция, вызывающая поток электронов, не может быть обращена вспять, батарею называют первичной батареей. Когда один из реагентов израсходован, батарея разряжена.
Наиболее распространенной первичной батареей является угольно-цинковая батарея. Было обнаружено, что, когда электролитом является щелочь, батареи служат намного дольше. Это щелочные батареи, которые мы покупаем в супермаркете.
Проблема утилизации таких первичных батарей заключалась в том, чтобы найти способ их повторного использования путем подзарядки батарей.Это становится более важным по мере того, как батареи становятся больше, и частая их замена коммерчески нецелесообразна.
Одна из первых аккумуляторных батарей, никель-кадмиевая батарея (NiCd), также использует щелочь в качестве электролита. В 1989 году были разработаны никель-металл-водородные батареи (NiMH), которые имели более длительный срок службы, чем никель-кадмиевые батареи.
Батареи этих типов очень чувствительны к перезарядке и перегреву во время зарядки, поэтому скорость заряда контролируется ниже максимальной.Сложные контроллеры могут ускорить зарядку, не занимая меньше нескольких часов.
В большинстве других более простых зарядных устройств процесс обычно занимает всю ночь.
Портативные приложения, такие как мобильные телефоны и портативные компьютеры, постоянно ищут максимальную и наиболее компактную накопленную энергию. Хотя это увеличивает риск сильной разрядки, с этим можно справиться с помощью ограничителей скорости тока в аккумуляторах мобильных телефонов из-за их малого формата.
Но по мере того, как рассматриваются более крупные применения батарей, безопасность большого формата и большого количества элементов становится более важным соображением.
Первый большой шаг вперед: литий-ионные батареи
Новые технологии часто требуют более компактных, более емких, безопасных перезаряжаемых батарей.
В 1980 году американский физик профессор Джон Гуденаф изобрел новый тип литиевой батареи, в которой литий (Li) мог мигрировать через батарею от одного электрода к другому в виде иона Li +.
Литий — один из самых легких элементов в периодической таблице Менделеева и имеет один из самых больших электрохимических потенциалов, поэтому эта комбинация дает одни из самых высоких возможных напряжений в самых компактных и легких объемах.
Это основа литий-ионного аккумулятора. В этой новой батарее литий сочетается с переходным металлом, таким как кобальт, никель, марганец или железо, и кислородом, образуя катод. При подаче напряжения во время перезарядки положительно заряженный ион лития с катода мигрирует на графитовый анод и становится металлическим литием.
Поскольку литий обладает сильной электрохимической движущей силой, которая должна окисляться, если это разрешено, он мигрирует обратно на катод, чтобы снова стать ионом Li +, и отдает свой электрон обратно иону кобальта. Движение электронов в цепи дает нам ток, который мы можем использовать.
Движение электронов в цепи дает нам ток, который мы можем использовать.
Второй большой скачок вперед: нанотехнологии
В зависимости от переходного металла, используемого в литий-ионном аккумуляторе, элемент может иметь более высокую емкость, но может быть более реактивным и подверженным явлению, известному как тепловой разгон.
В случае литий-кобальтовых батарей (LiCoO 2 ), произведенных Sony в 1990-х годах, это привело к возгоранию многих таких батарей.О возможности изготовления аккумуляторных катодов из наноразмерного материала и, следовательно, более реактивного материала не могло быть и речи.
Но в 1990-х годах Гуденаф снова совершил огромный скачок в технологии аккумуляторов, представив стабильный литий-ионный катод на основе литий-железа и фосфата.
Этот катод термически устойчив. Это также означает, что наноразмерные материалы из фосфата лития-железа (LiFePO 4 ) или феррофосфата лития (LFP) теперь можно безопасно превращать в крупноформатные элементы, которые можно быстро заряжать и разряжать.
Сейчас для этих новых элементов существует множество новых приложений, от электроинструментов до гибридных и электромобилей. Возможно, наиболее важным применением будет хранение бытовой электроэнергии для домашних хозяйств.
Первый мобильный телефон имел большую батарею и короткое время автономной работы — современные мобильные телефоны и смартфоны требуют меньших батарей, но более продолжительного заряда.
Электромобили
Лидером в производстве аккумуляторов нового формата для транспортных средств является компания Tesla, занимающаяся электромобилями, которая планирует построить «гига-заводы» для производства этих аккумуляторов.
Размер литиевой аккумуляторной батареи для Tesla Model S составляет впечатляющие 85 кВтч.
Этого также более чем достаточно для бытовых нужд, поэтому было так много слухов относительно того, что основатель Tesla Илон Маск готовится раскрыть на этой неделе.
Модульная конструкция батареи позволяет создавать батареи, которые в некоторой степени взаимозаменяемы и подходят как для автомобилей, так и для бытовых применений без необходимости переделки или реконструкции.
Возможно, мы скоро станем свидетелями смены поколений в производстве и хранении энергии, обусловленной постоянно улучшающимися возможностями скромной батареи.
Помимо литий-ионных аккумуляторов — значительный шаг к более производительной батарее
Эта история опубликована с разрешения The Conversation (по лицензии Creative Commons-Attribution / Без производных).
Ссылка :
История и развитие батарей (2015, 30 апреля)
получено 19 декабря 2020
с https: // физ. org / news / 2015-04-history-battery.html
org / news / 2015-04-history-battery.html
Этот документ защищен авторским правом. За исключением честных сделок с целью частного изучения или исследования, нет часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в информационных целях.
Аккумулятор— Energy Education
Рисунок 1.Аккумулятор на 9 вольт. [1] Батарея — это устройство, которое накапливает энергию, а затем разряжает ее, преобразовывая химическую энергию в электричество. Обычные батареи чаще всего производят электричество химическим путем за счет использования одного или нескольких электрохимических элементов. [2] В аккумуляторах могут использоваться и использовались многие различные материалы, но наиболее распространенными типами аккумуляторов являются щелочные, литий-ионные, литий-полимерные и никель-металлогидридные. Батареи могут быть соединены друг с другом в последовательную или параллельную цепь.
Батареи могут быть соединены друг с другом в последовательную или параллельную цепь.
Существует широкий выбор аккумуляторов, доступных для покупки, и эти разные типы аккумуляторов используются в разных устройствах. Большие батареи используются для запуска автомобилей, а батареи меньшего размера могут питать слуховые аппараты. В целом, батареи чрезвычайно важны в повседневной жизни.
Ячейки
Элемент — это единое целое, которое каким-либо способом вырабатывает электричество. Вообще говоря, клетки генерируют энергию с помощью термического, химического или оптического процесса.
Типичная ячейка имеет два вывода (называемых электродами , ), погруженными в химикат (называемый электролитом ). Два электрода разделены пористой стенкой или перемычкой , которая позволяет электрическому заряду проходить с одной стороны на другую через электролит. Анод — отрицательный вывод — получает электроны, а катод — положительный вывод — теряет электроны. Этот обмен электронами позволяет развивать разность потенциалов или разность напряжений между двумя выводами, позволяя течь электричеству. [2]
Этот обмен электронами позволяет развивать разность потенциалов или разность напряжений между двумя выводами, позволяя течь электричеству. [2]
В батарее может быть огромное количество ячеек, от одной ячейки в батарее AA до более 7 100 ячеек в батарее Tesla Model S. [3]
Рис. 2. Схема в разрезе, показывающая анатомию щелочной батареи. [4]Первичные элементы («сухие»)
В этих элементах химическое взаимодействие между электродами и электролитом вызывает необратимые изменения, что означает, что они не подлежат перезарядке . [2] Эти батареи предназначены для одноразового использования, что приводит к большему количеству отходов от использования этих батарей, поскольку они утилизируются через относительно короткий период времени.
Вторичные элементы («мокрые»)
Этот тип элемента (обозначается как влажный из-за использования жидкого электролита) генерирует ток через вторичный элемент в направлении, противоположном направлению первого / нормального элемента. Это приводит к обратному химическому действию, которое эффективно восстанавливается, что означает, что они перезаряжаемые, . [2] Эти батареи могут быть более дорогими в приобретении, но производят меньше отходов, поскольку их можно использовать несколько раз.
Это приводит к обратному химическому действию, которое эффективно восстанавливается, что означает, что они перезаряжаемые, . [2] Эти батареи могут быть более дорогими в приобретении, но производят меньше отходов, поскольку их можно использовать несколько раз.
Емкость аккумулятора
Батареи часто оценивают по выходному напряжению и емкости.Емкость — это то, сколько времени хватит конкретной батареи в Ач (ампер-часах) [2] :
Аккумулятора емкостью 1 Ач хватит на один час работы при 1 А.Батареи можно также оценить по их энергоемкости. Это делается либо в ватт-часах, либо в киловатт-часах.
Батареи емкостью 1 кВтч хватит на один час при выработке 1 кВт электроэнергии.Phet Simulation
Университет Колорадо любезно разрешил нам использовать следующую симуляцию Фета.Это моделирование исследует, как батареи работают в электрической цепи:
Для дальнейшего чтения
Для получения дополнительной информации см. Соответствующие страницы ниже:
Соответствующие страницы ниже:
Список литературы
- ↑ Wikimedia Commons [Online], доступно: https://commons.wikimedia.org/wiki/File:Duracell_9_Volt_0849.jpg#/media/File:Duracell_9_Volt_0849.jpg
- ↑ 2,0 2,1 2,2 2,3 2,4 R.T. Пэйнтер, «Основные электрические компоненты и счетчики», в Введение в электричество , 1-е изд.Нью-Джерси: Прентис-Холл, 2011, гл. 3, сек. 3.4, с. 89-94.
- ↑ Technology Metals Research. (Проверено 28 июля 2015 г.). Going Natural: The Solution of Tesla’s Graphite Problem [Online], доступно: http://www.techmetalsresearch.com/2014/03/going-natural-the-solution-to-teslas-graphite-problem/
- ↑ Гиперфизика. (Проверено 28 июля 2015 г.). Угольно-цинковые батареи [Онлайн], доступно: http://hyperphysics.phy-astr.gsu.edu/hbase/electric/battery.html
Как работают литий-ионные батареи | HowStuffWorks
Литий-ионные аккумуляторные батареи бывают всех форм и размеров, но все они выглядят примерно одинаково внутри. Если бы вам пришлось разобрать аккумуляторную батарею ноутбука (что мы НЕ рекомендуем из-за возможности короткого замыкания аккумулятора и возникновения пожара), вы бы обнаружили следующее:
Если бы вам пришлось разобрать аккумуляторную батарею ноутбука (что мы НЕ рекомендуем из-за возможности короткого замыкания аккумулятора и возникновения пожара), вы бы обнаружили следующее:
- Литий-ионные элементы могут быть либо цилиндрическими батареями, которые почти идентичны элементам AA, либо они могут быть призматическими , то есть квадратными или прямоугольными. Компьютер, который включает:
- Один или несколько температур датчики для контроля температуры аккумулятора
- Схема преобразователя и регулятора напряжения для поддержания безопасных уровней напряжения и тока
- Экранированный разъем для ноутбука , который обеспечивает поток энергии и информации в аккумуляторный блок и из него
- A отвод напряжения , который контролирует энергоемкость отдельных ячеек в аккумуляторном блоке
- Монитор состояния заряда аккумулятора , который представляет собой небольшой компьютер, который обрабатывает весь процесс зарядки, чтобы обеспечить максимально быструю и полную зарядку аккумуляторов.
Если аккумулятор слишком нагревается во время зарядки или использования, компьютер отключит подачу питания, чтобы попытаться остыть. Если вы оставите свой ноутбук в очень горячей машине и попытаетесь использовать его, этот компьютер может не дать вам включиться, пока все не остынет. Если элементы когда-либо полностью разряжаются, аккумуляторная батарея отключится из-за разрушения элементов. Он также может отслеживать количество циклов зарядки / разрядки и отправлять информацию, чтобы индикатор заряда батареи ноутбука мог сказать вам, сколько заряда осталось в аккумуляторе.
Объявление
Это довольно сложный маленький компьютер, питающийся от батарей. Такое энергопотребление является одной из причин, по которой литий-ионные батареи теряют 5 процентов своей мощности каждый месяц, когда они простаивают.
Литий-ионные элементы
Как и у большинства батарей, у вас металлический корпус. Здесь особенно важно использование металла, потому что аккумулятор находится под давлением. В этом металлическом корпусе есть какое-то чувствительное к давлению вентиляционное отверстие .Если аккумулятор когда-либо станет настолько горячим, что может взорваться от избыточного давления, это отверстие сбросит дополнительное давление. Батарея, вероятно, впоследствии станет бесполезной, так что этого следует избегать. Отверстие строго предусмотрено в качестве меры безопасности. Так же и переключатель с положительным температурным коэффициентом (PTC) , устройство, которое должно предохранять аккумулятор от перегрева.
Этот металлический футляр содержит длинную спираль, состоящую из трех спрессованных вместе тонких листов:
- A Положительный электрод
- A Отрицательный электрод
- A сепаратор
Внутри корпуса эти листы погружены в органический растворитель, который действует как электролит.Эфир — один из распространенных растворителей.
Сепаратор представляет собой очень тонкий лист пластика с микроперфорацией. Как следует из названия, он разделяет положительный и отрицательный электроды, позволяя ионам проходить через них.
Положительный электрод изготовлен из оксида лития-кобальта или LiCoO 2 . Отрицательный электрод выполнен из углерода. Когда аккумулятор заряжается, ионы лития перемещаются через электролит от положительного электрода к отрицательному и прикрепляются к углю.Во время разряда ионы лития возвращаются в LiCoO 2 из углерода.
Движение этих ионов лития происходит при довольно высоком напряжении, поэтому каждая ячейка производит 3,7 вольт. Это намного выше, чем 1,5 В, типичные для обычного щелочного элемента AA, который вы покупаете в супермаркете, и помогает сделать литий-ионные батареи более компактными в небольших устройствах, таких как сотовые телефоны. См. «Как работают батареи» для получения подробной информации о батареях различного химического состава.
Мы рассмотрим, как продлить срок службы литий-ионной батареи, и выясним, почему они могут взорваться в следующий раз.
Как работает аккумулятор и 3 способа его испортить
Одно из самых полезных электронных устройств, доступных нам, также является одним из самых распространенных. Современные аккумуляторы используются во многих из наших любимых технологий, что можно почти простить за то, что вы не тратите время на изучение их работы.
Но теперь для вас настало время расширить свою базу знаний, поняв, как работает смартфон в вашем кармане, каковы распространенные разновидности аккумуляторов и что вы можете сделать, чтобы продлить срок их службы.
Краткая история батарей
Алессандро Вольта продемонстрировал первую работающую электромагнитную батарею в 1800 году.Его стопка медных и цинковых пластин, разделенных пропитанными рассолом бумажными дисками, вырабатывала стабильное напряжение в течение «разумного» периода времени. Это было известно как гальваническая батарея и послужило предшественником поколения экспериментов с батарейным питанием.
В 1836 году Джон Фредерик Дэниелл стандартизировал конструкцию батареи.Медный горшок, наполненный раствором медного купороса, погруженный в неглазурованный глиняный сосуд, наполненный серной кислотой, и цинковый электрод стали де-факто стандартом аккумуляторов, распространенным в бесчисленных электрических телеграфных сетях.
Перенесемся в Оксфордский университет, 1979 год.Джон Гуденаф и Коичи Мидзусима продемонстрировали работающий перезаряжаемый элемент с диапазоном 4 В, в котором в качестве положительного электрода использовался оксид лития-кобальта, а в качестве отрицательного — металлический литий. Предшественник литиевого элемента в том виде, в каком мы его знаем, родился, но коммерциализирован Sony и Asahi Kasei в их портативных электронных устройствах только в 1991 году.
Что такое современная батарея?
Мы используем термин современная батарея для описания электрохимических элементов, которые питают наши портативные технологические устройства.Батареи делятся на две общие категории:
- Одноразовые: одноразовые батарейки с электродами, которые необратимо меняются во время использования.
- Аккумуляторные: многоразовые батареи с электродами, восстанавливаемыми обратным током.
В большинстве современных портативных электронных устройств используется литиевая батарея, наиболее распространенной из которых является литий-ионный ( Li-ion ) элемент. Вы также можете встретить литий-полимерный ( Li-Po ) элемент, который имеет такой же электрохимический состав и общий химический состав, что и его аналог, но стоит дороже в производстве и имеет более низкую плотность энергии.
Тем не менее, Li-Po аккумуляторы по-прежнему популярны из-за их легкого веса, гибкости конструкции и улучшенных рабочих характеристик при более высоких и низких температурах, с чем Li-ion может бороться.
Литий-ионные батареи обычно содержат интеркалированное соединение лития, такое как оксид лития-кобальта (LiCoO 2 ) в качестве одного электрода, графит в качестве второго и органический растворитель в качестве электролита.Это соединение используется из-за его высокой плотности энергии и медленной потери заряда, когда он не используется, а также из-за того, что не требуется циклическое переключение памяти для продления срока службы батареи.
Все литиевые батареи содержат температурный коэффициент давления.Это отказоустойчивый выключатель или датчик, предназначенный для предотвращения перегрева батареи в экстремальных условиях или чрезмерного использования, процесса, который обычно делает батарею бесполезной из-за необратимого повреждения химических соединений, которые делают возможным процесс заряда / разряда.
Процесс зарядки
Литиевые батареи стали предпочтительными для портативных технологий благодаря их высокой плотности энергии и перезаряжаемым качествам.
Во время процесса зарядки ионы лития перемещаются через электролит от положительного электрода из оксида лития-кобальта к отрицательному электроду из графита.При разряде или использовании ионы возвращаются через электролит, от отрицательного к положительному. Этот процесс происходит при относительно высоком напряжении — 3,7 вольт по сравнению с щелочной батареей AA при 1,5 вольт — поэтому литиевые батареи стали предпочтительным портативным источником питания для многих потребительских электронных устройств.
Литиевые батареи также входят в состав более крупных аккумуляторных блоков, таких как аккумулятор для ноутбука.Эти аккумуляторные блоки содержат ряд литий-ионных элементов, связанных в один более крупный компонент, и будут содержать ряд дополнительных компонентов:
- Датчик температуры : Датчик, контролирующий температуру внутри упаковки с целью обеспечения безопасности и долговечности ячеек.
- Регулятор напряжения : Датчик и схема для контроля и регулирования выходной мощности / емкости каждой ячейки внутри блока
- Состояние заряда аккумулятора : Датчик, информирующий операционную систему о текущем состоянии заряда (например, на 47%)
- Разъем : Коннектор для портативного компьютера, зависит от марки.
Литиевые батареи могут выполнить тысячи циклов заряда / разряда, прежде чем качество элемента начнет действительно ухудшаться, но есть несколько способов испортить батарею, потенциально подвергая себя опасности.
Обслуживание батареи
Положительный электрод, который есть в большинстве литиевых батарей, LiCoO 2 , может представлять ряд опасностей в случае повреждения элемента.В отличие от ряда других вариантов батарей, использование горючего компаунда под давлением может привести к экстремальным результатам. Чтобы смягчить это, элементы литиевых батарей подвергаются ряду тестов на безопасность, многие из которых более строгие, чем их аналоги на кислотной основе.
Тепло
Было несколько случаев воспламенения литиевых батарей в условиях экстремальной жары.Батареи под воздействием тепла в сочетании с любым дополнительным, неожиданным давлением или коротким замыканием могут «взорваться», оставив разрушенную батарею и, чаще всего, поврежденную часть портативной техники.
Каждая литиевая батарея имеет встроенный сепаратор внутри элемента.Это различает положительный и отрицательный электроды в процессе заряда / разряда. Если этот разделитель будет перфорирован или поврежден, существует вероятность контакта электродов. Это приводит к быстрому нагреву аккумулятора, что может привести к взрыву.
Батарея имеет вентиляционный механизм, чтобы предотвратить такое происшествие, но, в конечном счете, из-за природы удаляемого химического соединения, вероятность взрывной реакции все еще сохраняется из-за тепла, выделяемого химической реакцией.
Номинальные значения разряда
Литиевые батареи предпочитают частичный разряд, а не «глубокий» или «полный».У них нет зарядной памяти, поэтому частичный разряд не повлияет на будущую производительность.
Однако «глубокая» разрядка i.е. полный разряд батареи приведет к падению напряжения литиевой батареи и может привести к необратимому повреждению батареи.
Процесс старения
Литиевые батареи стареют.Предполагается, что их максимальный срок службы составляет от 2 до 4 лет в зависимости от количества циклов заряда / разряда. Это не значит, что вам следует отслеживать количество раз, когда вы используете батарею, поскольку это было бы довольно сложно. Но отказ от использования новой батареи и оставление ее на полке не продлит срок службы батареи — батареи все равно прослужат те же 2-4 года.
Также стоит проверить, когда была произведена батарея, при покупке нового портативного технического продукта.Если он простаивал на складе в течение года, срок службы батареи уже истощился. Свяжитесь с производителем продукта и по возможности попросите новую батарею.
Существуют современные приложения для управления батареями, которые утверждают, что могут обратить вспять текущую приемлемую деградацию ячеек с течением времени, например, batteryOS, продукт, который будет запущен в феврале 2015 года.
Li-Air
В литиевых батареях следующего поколения будет использоваться химический состав лития и воздуха, обеспечивающий чрезвычайно высокую плотность энергии во все более легких конструкциях.Литий-воздушные батареи получают преимущество в плотности энергии по сравнению с традиционными аналогами за счет использования большого количества кислорода для индукции тока, вместо того, чтобы хранить необходимый химический окислитель внутри.
К сожалению, до того, как коммерчески жизнеспособный продукт Li-Air появится в наших портативных устройствах, все еще необходимы исследования в ряде ключевых областей.
Помогло ли это вам понять батареи в ваших портативных устройствах? Дайте нам знать, что вы думаете ниже!
Кредиты на изображения: Батареи через Wikimedia Commons, Voltaic Pile через Wikimedia Commons, Литий-ионные батареи через Wikimedia Commons, Литий-полимерные батареи через Wikimedia Commons, 3GS со сломанной батареей через Wikimedia Commons, Пустая батарея через Pixabay, Плотность энергии батареи через Wikimedia Commons
Как добавить таблицу в сообщения GmailВам нужно добавить таблицу к электронной почте? Не беспокойтесь о прикрепленных файлах, мы покажем вам, как легко добавить таблицу с помощью Gmail.
Об авторе Гэвин Филлипс (Опубликовано 645 статей)Гэвин — младший редактор отдела Windows and Technology Explained, регулярный участник Really Useful Podcast и редактор дочернего сайта MakeUseOf, посвященного криптографии, Blocks Decoded.У него есть степень бакалавра (с отличием) в области современного письма с использованием методов цифрового искусства, разграбленных на холмах Девона, а также более десяти лет профессионального писательского опыта. Он любит много пить чая, настольные игры и футбол.
Ещё от Gavin PhillipsПодпишитесь на нашу рассылку новостей
Подпишитесь на нашу рассылку, чтобы получать технические советы, обзоры, бесплатные электронные книги и эксклюзивные предложения!
Еще один шаг…!
Подтвердите свой адрес электронной почты в только что отправленном вам электронном письме.
Примеры электролитов
Электролиты — это химические соединения, такие как жидкости или гели, которые содержат ионы и могут проводить электричество при расплавлении или растворении в растворе. Электролиты необходимы для работы аккумуляторов, а также для того, чтобы клетки регулировали свой электрический заряд и поток молекул воды через клеточные мембраны. Чрезмерное потоотделение, обезвоживание, рвота или диарея могут вызвать потерю электролитов и серьезно повлиять на нормальное функционирование организма.
Химические вещества, являющиеся электролитами
Здесь вы найдете несколько примеров электролитов.
- Хлорид натрия — также известный под формулой NaCl, хлорид натрия представляет собой соединение с равными частями натрия и хлорида. Она более известна как «соль» или «поваренная соль» и является основным ингредиентом пищевой соли, которой посыпают пищу для улучшения вкуса. Хлорид натрия присутствует в океане и является главным фактором, придающим морской воде такой соленый вкус.
- Азотная кислота — Эта сильная минеральная кислота, известная под формулой HNO3, представляет собой коррозионно-активную кислоту, используемую во многих областях, одна из наиболее распространенных из которых является ингредиентом в удобрениях. Он также использовался в качестве одного из ингредиентов в определенных типах жидкого ракетного топлива и представляет собой химическое вещество, используемое в деревообработке, чтобы дерево выглядело так, как будто оно состарилось.
- Хлорная кислота — HClO3 — это еще одно название этого электролита, который является очень опасным окислителем. Его можно получить в результате химической реакции.
- Хлористоводородная кислота — Эта сильная кислота широко используется в химической промышленности, но также входит в состав желатина, кожи и бытовых чистящих средств.
- Хлорид кальция — Хотя это тоже «соль» по определению, она отличается от поваренной соли, описанной выше как хлорид натрия. Хлорид кальция представляет собой соединение, состоящее из кальция и хлорида, и является одним из типов соли, используемой для борьбы со льдом на тротуарах и дорогах. Компаунд часто производится из известняка.
- Нитрат калия — Этот электролит, широко известный под формулой KNO3, используется в самых разных веществах. Его можно использовать в качестве пищевой добавки, но он также входит в состав различных видов ракетного топлива и фейерверков. Нитрат калия когда-то был известен как селитра и много лет входил в состав пороха.
- Гидроксид натрия — Гидроксид натрия, также известный как щелочь, широко использовался в истории человечества и является важным ингредиентом многих моющих средств, мыла и средств для очистки канализации.Он очень опасен из-за своей способности разлагать липиды и белки в коже, вызывая ожоги при неправильном обращении.
- Серная кислота — известная когда-то как купоросное масло, эта сильно коррозионная сильная кислота (известная под молекулярной формулой h3SO4) может разъедать металлы, органические соединения, живые ткани и даже камень. Он используется в качестве электролита в некоторых типах автомобильных аккумуляторов для подачи электричества. Как и гидроксид натрия, он может вызвать очень серьезные химические ожоги при контакте с кожей, поэтому с ним очень важно обращаться с особой осторожностью.
- Ацетат натрия — еще один электролит, который включает натрий в качестве основного ингредиента. Ацетат натрия часто используется для герметизации бетона, чтобы защитить его от непогоды. Он также используется в качестве ингредиента в некоторых типах продуктов, таких как картофельные чипсы с солью и уксусом, из-за его соленого и острого вкуса при смешивании с другими приправами.
Гидроксид магния. Из-за своего молочного вида этот электролит долгое время был известен под названием «молоко магнезии».»Он является основным компонентом многих видов слабительных и антацидов, а также дезодорантов и антиперспирантов для подмышек. Его также можно наносить на кожу головы в качестве средства борьбы с себореей и перхотью.
