Контрольная работа по теме: «Электролитическая диссоциация» (9 класс)
Контрольная работа № 1
по теме: «Электролитическая диссоциация»
1 вариант.
Составить реакции ионного обмена, написать молекулярные, полные и сокращенные ионные уравнения:
а) KOH + h3SO4 =
б) Na2CO3 + HNO3 =
в) CuCI2 + NaOH =
2) Составить электронный баланс, указать окислитель и восстановитель и уравнять реакцию:
а) HCIO +Br2 + h3O = HBrO3 + HCI
б) PbO2 + Na3CrO3 + NaOH = Na2CrO4 + Na2PbO2 + h3O
3) Определить природу соли и указать, возможен ли гидролиз соли?
а) FeCI3
б) Na2S
в) K2SO4
г) CuCO3
4) Дать расшифровку понятиям:
электролит
электролитическая диссоциация
гидролиз солей
окислительно-восстановительные реакции
основания
5) Решить задачу:
К 50г раствора, содержащего 10% хлорида железа (II), добавили гидроксид натрия. Вычислите массу образовавшегося осадка.
Вычислите массу образовавшегося осадка.
Контрольная работа № 1
по теме: «Электролитическая диссоциация»
вариант.
1) Составить реакции ионного обмена, написать молекулярные, полные и сокращенные ионные уравнения:
а) KOH + h3SO4 =
б) Na2CO3 + HNO3 =
в) CuCI2 + NaOH =
2) Составить электронный баланс, указать окислитель и восстановитель и уравнять реакцию:
а) HCIO +Br2 + h3O = HBrO3 + HCI
б) PbO2 + Na3CrO3 + NaOH = Na2CrO4 + Na2PbO2 + h3O
3) Определить природу соли и указать, возможен ли гидролиз соли?
а) FeCI3
б) Na2S
в) K2SO4
г) CuCO3
4) Дать расшифровку понятиям:
электролит
электролитическая диссоциация
гидролиз солей
окислительно-восстановительные реакции
основания
5) Решить задачу:
К 50г раствора, содержащего 10% хлорида железа (II), добавили гидроксид натрия. Вычислите массу образовавшегося осадка.
Вычислите массу образовавшегося осадка.
Контрольная работа № 1
по теме: «Электролитическая диссоциация»
вариант.
1) Составить реакции ионного обмена, написать молекулярные, полные и сокращенные ионные уравнения:
а) NaOH + h4PO4 =
б) K2CO3 + HCI =
в) FeCI2 + NaOH =
2) Составить электронный баланс, указать окислитель и восстановитель и уравнять реакцию:
а) I2 + KOH = KIO3 + KI + h3O
б) CuCI + K2Cr2O7 + HCI = CuCI2 + CrCI3 + KCI + h3O
3) Определить природу соли и указать, возможен ли гидролиз соли?
а) CuCI2
б) K3PO4
в) Li2SO4
г) CuS
4) Дать расшифровку понятиям:
5) Решить задачу:
К 100г раствора, содержащего 10% хлорида меди (II), добавили гидроксид калия. Вычислите массу образовавшегося осадка.
Контрольная работа № 1
по теме: «Электролитическая диссоциация»
вариант.

1) Составить реакции ионного обмена, написать молекулярные, полные и сокращенные ионные уравнения:
а) NaOH + h4PO4 =
б) K2CO3 + HCI =
в) FeCI2 + NaOH =
2) Составить электронный баланс, указать окислитель и восстановитель и уравнять реакцию:
а) I2 + KOH = KIO3 + KI + h3O
б) CuCI + K2Cr2O7 + HCI = CuCI2 + CrCI3 + KCI + h3O
3) Определить природу соли и указать, возможен ли гидролиз соли?
а) CuCI2
б) K3PO4
в) Li2SO4
г) CuS
4) Дать расшифровку понятиям:
5) Решить задачу:
К 100г раствора, содержащего 10% хлорида меди (II), добавили гидроксид калия. Вычислите массу образовавшегося осадка.
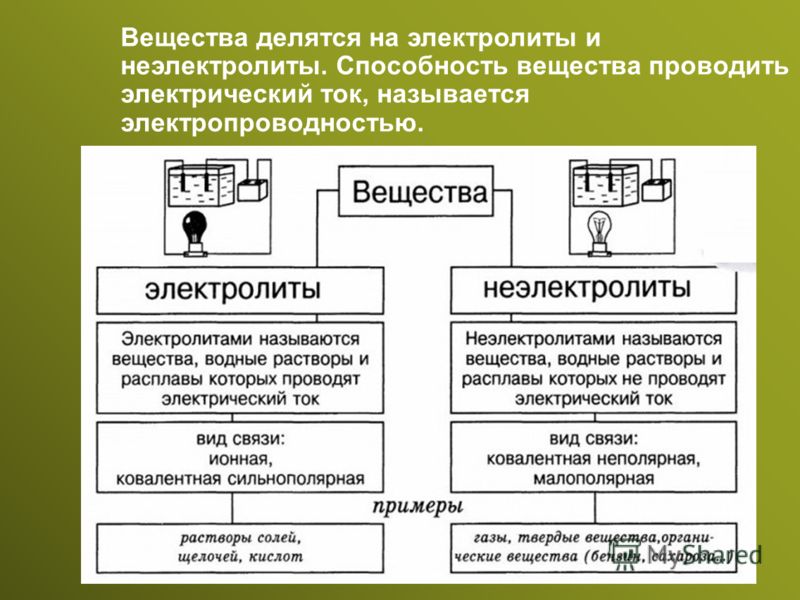
Проблемный урок по теме «Электролитическая диссоциация» (8-й класс)
Вопрос об электролитической диссоциации
веществ изучается в 8 классе в теме «Растворение.
Растворы. Свойства растворов электролитов».
Электролитическая диссоциация изучается на примере веществ с ионной и ковалентной полярной связью. Обычно демонстрируются опыты, связанные только с электропроводностью растворов и расплавов электролитов. Данные опыты порождают заблуждение у учащихся в том, что растворы веществ в любых растворителях проводят электрический ток. А значит, электролитическая диссоциация веществ наблюдается при растворении веществ в любых растворителях.
С целью предупреждения такой ошибки можно
начать рассмотрение вопроса об
электролитической диссоциации веществ с ионной
и ковалентной полярной связью без демонстрации
опытов с электрическим током. Сначала с помощью
химических опытов убедить учащихся в том, что в
водном растворе происходит распад соединений с
ионной и ковалентной полярной связью на ионы. А
опыты с электрическим током провести как
доказательство наличия в водных растворах
электролитов ионов.
Поэтому в данном случае можно создать проблемную ситуацию конфликта между практически достигнутым результатом и недостаточностью знаний для его теоретического обоснования.
Это вызывает интерес у учащихся к изучаемому вопросу и стремление объяснить наблюдаемые явления, а также стремление к получению новых знаний.
Задачи урока:
- Дать понятие об электролитах и неэлектролитах; рассмотреть механизм диссоциации веществ с различными типами связи; указать роль молекул воды в диссоциации веществ; познакомить с понятием «степень диссоциации» и классификацией электролитов.
Оборудование и реактивы:
- Концентрированная H2SO4; H2O; Ca(OH)2
кристаллический; метилоранж на ацетоне;
фенолфталеин кристаллический; ацетон;
обезвоженный CuSO4; железные гвозди;
пробирки; прибор для определения
электропроводности растворов с лампочкой; NaCl
кристаллический и раствор; растворы Ca(OH)2 и H2
Ход урока
Урок начинается с организационного момента: взаимное приветствие учащихся и учителя; фиксация отсутствующих; проверка готовности учащихся к уроку; организация внимания.
Далее следует создание опорных знаний: учитель ставит перед учащимися вопросы, ответы на которые будут использованы в процессе изучения нового материала:
1) Какие вещества относятся к классу кислот?
2) Приведите формулы известных вам кислот?
3) Выясните, что общего в составе всех кислот, как можно обнаружить кислоту в растворе?
4) Какие вещества относятся к классу оснований и как их классифицируют по растворимости в воде?
5) Приведите формулы известных щелочей и ответьте на вопросы:
а) что общего в их составе?
б) как можно обнаружить щелочь в растворе?
6)Какие вещества называются солями?
Вспомнив необходимые сведения, учитель
приступает к изложению нового материала.
Учитель еще раз обращает внимание учащихся на тему урока: в ней оба слова новые, а поэтому и непонятные. Эти термины в ходе урока необходимо расшифровать. Это сообщение нацеливает учащихся на восприятие нового материала.
Далее учитель формулирует учебную проблему-1 в форме проблемного вопроса: Будет ли изменяться окраска индикатора в кислоте, если ее растворить не в воде, а в другом растворителе (например, в ацетоне)? Мнения учащихся различны: часть дает утвердительный ответ, часть — отрицательный, часть — затрудняется ответить.
Для проверки гипотез, выдвинутых учениками, учитель демонстрирует опыты:
Т.Б. Осторожно приливать концентрированную H2SO4, т.к. происходит сильное разогревание.
В ходе эксперимента учащиеся отмечают, что в
первом случае цвет индикатора не изменился, а во
втором — изменился, стал красным.
Совместно с учителем учащиеся делают вывод:
Кислоты изменяют окраску индикатора только в водном растворе.
Следующий шаг: формулировка учебной проблемы-2 в форме проблемного вопроса: Будет ли изменять окраску индикатора сухая щелочь? Мнения учащихся различны: да, нет, затрудняются ответить.
Для разрешения противоречий в ответах учитель демонстрирует опыты:
В две сухие пробирки насыпать немного кристаллического гидроксида кальция и добавить в обе пробирки кристаллы фенолфталеина. Встряхнуть. В одну их пробирок прилить небольшое количество воды.
Т.Б. Пробирки должны быть абсолютно сухими.
Учащиеся отмечают, что в первой пробирке ни каких изменений не произошло, а во второй - окраска фенолфталеина изменилась в малиновую.
Совместно с учителем учащиеся делают вывод:
Индикатор изменяет окраску только в водном
растворе щелочи.
Учитель сообщает учащимся, что некоторые металлы, например железо, взаимодействуют с водными растворами некоторых солей, например, сульфата меди(II). Учитель формулирует проблему-3 в форме вопроса: Будет ли железо взаимодействовать с раствором сульфата меди(II), если соль растворена не в воде, а в ацетоне?
Исходя из результатов первого опыта, более сильные учащиеся догадываются, что, наверное, нет. Для подтверждения правильности гипотезы учитель демонстрирует опыт:
В две пробирки насыпать обезвоженный сульфат меди(II). В одну из пробирок прилить 1 мл ацетона, а в другую — 1 мл воды. Встряхнуть обе пробирки. В растворы опустить очищенные железные гвозди.
Сначала учащиеся наблюдают растворение соли в
обоих случаях, затем — наблюдают выделение меди
только на гвозде, находящемся в водном растворе
соли, а соль, растворенная в ацетоне, не
взаимодействует с железом.
Совместно с учителем учащиеся делают вывод:
Железо вытесняет медь только из водного раствора соли.
Учитель делает общий вывод: кислоты, щелочи, соли, т.е. вещества с ионной и ковалентной полярной связью проявляют свои качества только в водных растворах.
Значит, в водных растворах с веществами что-то происходит. Учитель обращает внимание учащихся на роль молекул воды в этих процессах и вводит понятие «электролитическая диссоциация». Определение заранее записано на доске. Учащиеся записывают определение в тетрадь.
Затем подробно рассматривается строение молекулы воды:
Связь в молекуле ковалентная полярная.
Схема рисуется учителем на доске.
Рассматривается механизм электролитической
диссоциации на примере диссоциации хлорида
натрия. Одновременно с объяснением учитель
рисует схему на доске. Учащиеся зарисовывают в
тетрадях и внимательно слушают и записывают
стадии диссоциации в тетрадь.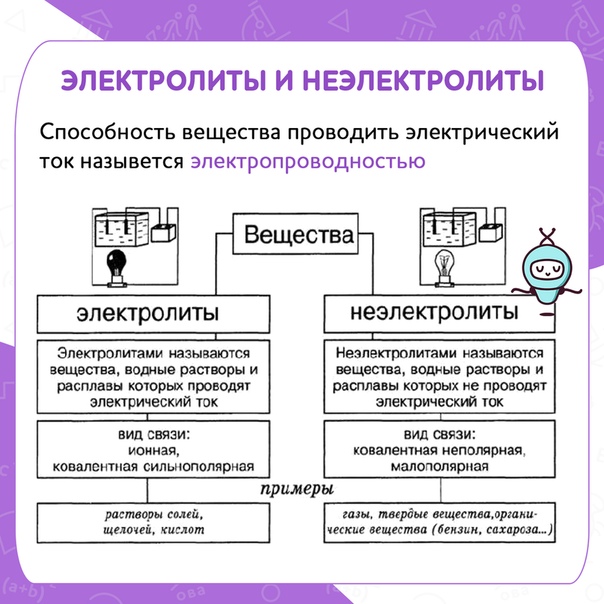
Механизм электролитической диссоциации:
а) Вначале хаотически движущиеся молекулы воды у ионов кристалла ориентируются к ним противоположно заряженными полюсами - происходит ориентация.
б) Затем диполи воды притягиваются, взаимодействуют с ионами поверхностного слоя кристалла — происходит гидратация.
в) Молекулы воды, перемещаясь в раствор, захватывают с собой гидратированные ионы - происходит диссоциация.
NaCl -> Na+ + Cl—
Учитель объясняет, как происходит диссоциация веществ с ковалентной полярной связью: диссоциация веществ с ковалентной полярной связью протекает на одну стадию больше - ориентация -> гидратация -> ионизация (т.е. превращение ковалентной полярной связи в молекуле в ионную связь) -> диссоциация.
HCl -> H+ + Cl—
Учащиеся углубляют знания о механизме
электролитической диссоциации; присваивают
знания, записывают стадии диссоциации в тетрадь.
Далее учитель задает вопрос: Можно ли экспериментально подтвердить тот факт, что в водных растворах кислот, щелочей, солей находятся ионы? Учащиеся затрудняются ответить. С целью разрешения затруднения учитель демонстрирует опыты по испытанию кристаллических веществ и их растворов на электропроводность. Учащиеся ведут наблюдения и записывают их на доске и в тетрадь.
Запись на доске.
NaCl кристаллический — лампочка не загорается, не проводит электрический ток.
NaCl раствор — лампочка загорается, проводит электрический ток.
Ca(OH)2 кристаллический — лампочка не загорается, не проводит электрический ток.
Ca(OH)2 раствор — лампочка загорается, проводит электрический ток.
H2SO4 раствор — лампочка загорается, проводит электрический ток.
По результатам эксперимента проводится беседа по вопросам:
Почему загорается лампочка?
Учащиеся отвечают, что при пропускании
электрического тока через раствор ионы
приобретают направленное движение: отрицательно
заряженные ионы (анионы) движутся к
положительному полюсу, а положительно
заряженные ионы (катионы) — к отрицательному
полюсу. Цепь замыкается и лампочка загорается.
Цепь замыкается и лампочка загорается.
Почему кристаллические вещества не проводят электрический ток?
Потому что в кристаллах ионы связаны друг с другом.
Затем учитель кратко освещает историю развития вопроса о теории электролитической диссоциации:
Автор теории электролитической диссоциации шведский ученый Сванте Аррениус. Будучи приверженцем физической теории растворов, С.Аррениус не смог ответить на вопрос: почему именно в водном растворе происходит диссоциация солей и щелочей (ведь сухие соли электрического тока не проводят) и откуда берутся ионы в растворах кислот? Ответ на него дали русские химики И.А.Каблуков и В.А.Кистяковский, которые применили к объяснению электролитической диссоциации химическую теорию растворов Д.И.Менделеева.
Учитель вводит понятия «электролиты» и «неэлектролиты», «степень электролитической диссоциации»:
Вещества, растворы которых проводят
электрический ток, называют электролитами;
вещества, растворы которых не проводят
электрический ток, называют неэлектролитами.
Так как в растворах электролитов наряду с ионами присутствуют и молекулы, то растворы электролитов характеризуются степенью диссоциации, которую обозначают греческой буквой a (альфа).
Степень диссоциации — это отношение числа молекул, распавшихся на ионы (Nд), к общему числу растворенных молекул (Nр): a = Nд / Np
Степень диссоциации электролита определяют опытным путем и выражают в долях или в процентах. Если a = 0, то диссоциация отсутствует, если a = 1, или 100%, то электролит полностью распадается на ионы.
Электролиты имеют различную степень диссоциации, т.е. степень диссоциации зависит от природы электролита. Она также зависит и от концентрации: с разбавлением раствора степень диссоциации увеличивается
Учащиеся расширяют и углубляют знания по теме
урока, присваивают знания, записывают
обозначения и формулу в тетрадь.
На основе понятия о степени электролитической диссоциации учитель дает понятие о сильных и слабых электролитах:
Сильные электролиты при растворении в воде практически полностью диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к единице.
К сильным электролитам относят:
1) все растворимые соли;
2) сильные кислоты, например: H2SO4, HCl, HNO3;
3) все щелочи, например: NaOH, KOH.
Слабые электролиты при растворении в воде почти не диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к нулю.
К слабым электролитам относят:
1) слабые кислоты — H2S, H2CO3, HNO2;
2) водный раствор аммиака NH3 * H2O.
Учащиеся расширяют понятие об электролитах, присваивают знания, записывают примеры в тетрадь.
После объяснения материала по теме следует
закрепление знаний. Учитель предлагает учащимся
выполнить следующие задания:
Учитель предлагает учащимся
выполнить следующие задания:
1) Объясните, почему раствор гидроксида калия проводит электрический ток, а раствор глюкозы С6Н12О6 — нет.
2) Почему при разбавлении раствора электролита степень его диссоциации увеличивается?
3) Как отличается по своей природе электропроводность металлов и электролитов?
4) Как объяснить электрическую проводимость водных растворов электролитов?
5) Какие из солей, чьи формулы приведены, являются электролитами: AlCl3, BaSO4, Cu(NO3)2, AgCl, Na3PO4, Mg3(PO4)2.
Учащиеся применяют полученные на уроке знания для решения вопросов.
Развивают умения объяснять свои ответы, анализировать условие задач, умения пользоваться дополнительными справочниками (таблицей растворимости).
После закрепления знаний задается домашнее задание:
Параграф 35, записи в тетради, упр. 1-5,с. 198.
1-5,с. 198.
Габриелян О.С. Химия. 8 класс : учеб. для общеобразоват. учреждений / О.С. Габриелян. — 11-е изд., испр. — М. : Дрофа, 2005. — 267 с. : ил.
Кислотные аккумуляторы; чтобы больше не было отвратительно читать то что люди о них пишут
Случайно узрел статью с комментариями к ней, и так злость во мне закипела по поводу безграмотности людей в области кислотных (свинцовых в простонародье) аккумуляторов, что не выдержал и решил написать «гикам» (чтобы быть гиком, как оказывается, мало купить дорогой телефон) краткую статью об аккумуляторах. С рассмотрением тех ошибок, которые мне постоянно мусолят глаза и вызывают праведное желание их исправить.Начнем с названия. Я очень часто вижу что тремя буквами А-К-Б называют все что можно зарядить, абсолютно любой аккумулятор. Особенно тремя буквами люди любят называть аккумуляторы типа Li-ion. На самом-же деле АКБ аббревиатура от Аккумуляторная Кислотная Батарея. Под ними подразумевается лишь один тип аккумулятора — свинцовый кислотный. С современной точки зрения это название вызывает некоторый когнитивный диссонанс т.к. на данный момент значение слова «батарейка» т.е. гальванического элемента который зарядить нельзя перешло на слово «батарея». И получается как будто бы из-за слова «аккумуляторная» это аккумулятор который зарядить можно, а из-за слова «батарея» это как будто батарейка которую зарядить нельзя. В реальности-же батарея — просто цепь гальванических элементов и со словом «батарейка» имеет общий лишь корень.
С современной точки зрения это название вызывает некоторый когнитивный диссонанс т.к. на данный момент значение слова «батарейка» т.е. гальванического элемента который зарядить нельзя перешло на слово «батарея». И получается как будто бы из-за слова «аккумуляторная» это аккумулятор который зарядить можно, а из-за слова «батарея» это как будто батарейка которую зарядить нельзя. В реальности-же батарея — просто цепь гальванических элементов и со словом «батарейка» имеет общий лишь корень.
Далее перейдем к некоторым мифам, а именно главный миф — АКБ для автомобиля имеет некие существенные отличия от АКБ для ИБП. И вот нельзя их применять и там и там.
С химической точки зрения любые АКБ абсолютно одинаковы. Как-же они устроены? Очень кратко — если аккумулятор заряжен, то один электрод представляет собой свинцовую решетку с нанесенной на нее пастой из PbO2, второй -такую-же решетку с пастой губчатого свинца. Электролитом служит раствор серной кислоты. В процессе разряда PbO2 восстанавливается и взаимодействуя с серной кислотой образует PbSO4. Свинец на другом электроде окисляется и опять-же образует PbSO4. В конце разрядки мы имеем обе решетчатые пластины заполненные (более или менее) сульфатом свинца. При зарядке аккумулятора происходит электролиз и из сульфата свинца вновь образуется диоксид и металлический свинец. Конечно-же, тут нужно подчеркнуть, что электроды при этом не равны и путать их полярность не стоит т.к. еще на стадии производства в намазку электродов вводятся соответствующие добавки, улучшающие их эксплуатационные свойства. При этом добавки полезные для одного электрода вредны для другого. В очень старые времена, где-то в начале прошлого века, в условиях простых аккумуляторов, вероятно, была допустима переполюсовка аккумулятора по ошибке или с какими-то целями и он какое-то время после этого работал. В том что она допустима сейчас я сомневаюсь.
Свинец на другом электроде окисляется и опять-же образует PbSO4. В конце разрядки мы имеем обе решетчатые пластины заполненные (более или менее) сульфатом свинца. При зарядке аккумулятора происходит электролиз и из сульфата свинца вновь образуется диоксид и металлический свинец. Конечно-же, тут нужно подчеркнуть, что электроды при этом не равны и путать их полярность не стоит т.к. еще на стадии производства в намазку электродов вводятся соответствующие добавки, улучшающие их эксплуатационные свойства. При этом добавки полезные для одного электрода вредны для другого. В очень старые времена, где-то в начале прошлого века, в условиях простых аккумуляторов, вероятно, была допустима переполюсовка аккумулятора по ошибке или с какими-то целями и он какое-то время после этого работал. В том что она допустима сейчас я сомневаюсь.
Таких ячеек в 12В аккумуляторе 6 шт, в 6В — 3 шт. и т.д. Многих вводит в заблуждение значение напряжения на аккумуляторах. Причем значений напряжения номинального, заряда, разряда. С одной стороны, аккумуляторы называются 12В (и 6В, 24В тоже есть, по-моему, даже 4В изредка встречаются) но на корпусе тех-же аккумуляторов для ИБП производитель указывает напряжение выше 13.5В.
С одной стороны, аккумуляторы называются 12В (и 6В, 24В тоже есть, по-моему, даже 4В изредка встречаются) но на корпусе тех-же аккумуляторов для ИБП производитель указывает напряжение выше 13.5В.
Например:
Тут мы видим, что в форсированном режиме напряжение заряда может быть аж 15В.
Все разъяснит кривая напряжения на АКБ:
Слева мы видим напряжение для аккумулятора из 12 ячеек (24В номинальных), 6 (12В номинальных) и, самое полезное, для одной ячейки. Там-же отмечены области нежелательных напряжений при разряде/ заряде. Из кривой можно сделать выводы:
1 Напряжение 12В, 24В и т.д. являются номинальными и показывают лишь число гальванических ячеек (путем деления на два) в батарее. Это просто название для удобства.
2 Напряжение при заряде могут достигать 2.5 В/ ячейку что для 12В аккумулятора соответствует 15В.
3 Напряжение заряженной батареи считается допустимым при значении 2.1-2.2 В/ячейку, что для 12В аккумулятора соответствует 12. 6-13.2В.
6-13.2В.
Теоретически, батарею можно зарядить и до значений 2.4 В/ячейку или даже немного выше, однако, такая зарядка будет негативно сказываться как на состоянии электродов, так и на концентрации электролита. Однажды, перед сдачей в утиль, я легко зарядил 12В батарею до напряжения ок. 14.5В (уже не помню точное значение).
Итак, автор статьи с которой я начал, решил, что напряжение заряда автомобильной АКБ и АКБ от ИБП отличаются. Это неверно, у них одинаковый тип электродов и одинаковая концентрация серной кислоты в электролите (подобранная давным-давно экспериментальным путем, чтобы предоставлять максимальное напряжение и минимальном саморазряде). Однако, что-же происходит в батарее, почему ее нельзя заряжать при слишком высоком значении напряжения?
Почему в автомобильную АКБ нужно подливать воду, а в АКБ от ИБП не нужно? Эти вопросы позволяют нам плавно перейти в область напряжения разложения воды. Как я написал выше, при зарядке аккумулятора происходит электролиз. Однако, не весь ток расходуется на превращение PbSO4 в PbO2 и Pb. Часть тока будет неизбежно расходоваться и на разложение воды, составляющей значительную часть электролита:
Часть тока будет неизбежно расходоваться и на разложение воды, составляющей значительную часть электролита:
2H2O = 2H2 + O2
Теоретический расчет дает значение напряжения для этой реакции ок. 1.2В. Напоминаю, что напряжение на ячейке при заряде заведомо более 2В. К счастью, активно вода начинает разлагаться только выше 2В, а в промышленности для получения водорода и кислорода из нее процесс ведут и вовсе при 2.1-2.6В (при повышенной температуре). Как бы то ни было, тут мы приходим к выводу, что в конце процесса заряда АКБ будет неизбежно происходить процесс разложения воды в электролите на элементы. Образующиеся кислород и водород попросту улетучиваются из сферы реакции. Про них бытуют следующие мифы:
1. Водород крайне взрывоопасен! Перезарядишь аккумулятор и как минимум лишишься комнаты где тот был!
На самом деле, водорода в процессе электролиза выделяется ничтожно мало по сравнению с объемом комнаты. Водород взрывается при концентрации от 4% в воздухе. Если мы допустим, что электролиз ведется в комнате размером 3*3*3 метра или 27 метров куб., то нам понадобится наполнить помещение 27*0.04=1.1 метров куб. водорода. Для получения такого количества h3 нужно было бы полностью разложить ок. 49 моль воды или 884 грамма ее. Если кто-то наблюдал электролиз, то поймет насколько это много. Или попробуем перейти ко времени. При силе тока в стандартной зарядке для крупногабаритных АКБ в 6А, уравнение Фарадея дает время, необходимое для получения этого количества водорода, аж 437 часов или 18.2 дня. Чтобы наполнить комнату водородом до взрывоопасной концентрации нужно забыть про зарядку на 2 с половиной недели! Но даже если это случится, концентрация серной кислоты просто будет расти пока ее раствор не приобретет слишком высокое сопротивление для жалких 12В зарядки и сила тока не станет ничтожной. Да и водород попросту улетучится.
Очень редко случаются взрывы непосредственно в корпусах крупногабаритных АКБ из-за того, что выделяющийся водород по какой-то причине не может покинуть замкнутого пространства. Но и в этом случае нечего страшного не бывает — чаще всего взрыва хватает только на небольшую деформацию верхней части корпуса, но не на разрыв свинцовых соединений. И АКБ еще может работать дальше даже после таких повреждений.
2. При электролизе может образоваться смертельно ядовитый и, не менее взрывоопасный чем водород, сероводород!
Не наш, периодически попадался миф в англоязычных постах. Теоретически конечно возможно подать такое большое напряжение и создать т.о. такую большую силу тока, что на катоде начнется процесс восстановления сульфат-иона. Напряжение для этого будет достаточным, а продукты восстановления не будут успевать диффундировать подальше от электрода и восстановление будет идти дальше. Но зарядка в пределах десятка-трех вольт и с ограничением силы тока в 6А на такое едва ли способна. Однажды, я наблюдал процесс восстановления сульфата до SO2, да, это возможно; однокурсницы по ошибке что-то сделали не то во время опыта. Но это большая редкость т.к. там концентрация серной кислоты была заметно выше той, что используется в АКБ, была иная конструкция электрода и иной его материал и, естественно, напряжения и сила тока были были непомерными. И SO2 не H2S.
3. При электролизе мышьяк и сурьма из материала решеток будут восстанавливаться до ядовитых арсина и стибина!
Действительно, решетки содержат относительно много сурьмы, мышьяка в современных решетках, вероятно, нет вообще. При работе АКБ та решетка на которой происходит восстановление, т.е. катод, разрушению не может подвергаться. Выделяйся даже каким-то образом стибин, он бы тут-же взаимодействовал с PbSO4, восстанавливая его до металла.
Однако, некоторая практическая неприятность тут есть. Газообразные водород и кислород могут увлекать за собой капельки электролита, создавая аэрозоль серной кислоты. Аэрозоль серной кислоты, даже концентрированной, для человека не опасен и просто вызывает кашель. Однако, серная кислота — кошмар для тканей и бумаги. Стоит даже небольшому количеству серной кислоты попасть на одежду и там обязательно появятся дырки или ткань разорвется по этому месту. Через недели, если кислоты много, через месяц, но одежда истлеет.
Так что газовыделения опасаться не стоит с бытовой точки зрения или стоит, но нужно ориентироваться именно на аэрозоль серной кислоты.
Итак, вода начала разлагаться на водород кислород, ее в электролите становится все меньше, что-же дальше? Если это АКБ в котором электролит просто налит в виде слоя жидкости, то начнется повышение саморазряда из-за повышения концентрации серной кислоты. Занятно, что это будет сопровождаться небольшим повышением напряжения (концентрация кислоты растет) на ячейке. Именно поэтому автовладельцы должны постоянно контролировать концентрацию серной кислоты в своих АКБ (при помощи ареометра) и доливать туда воду. Процедура доливания воды — необходимая часть процесса обслуживания любой АКБ. Кроме одного их типа, и мы сейчас об этом поговорим.
Иметь аккумулятор в котором болтается слой едкой, по отношению к металлам, жидкости конечно-же неудобно, а потому попытки избавиться непосредственно от жидкости предпринимались давно, начались чуть ли не в первой половине 20-го века. К слову сказать, не то чтобы слой серной кислоты прямо плескался вокруг электродов. В реальности она неплохо распределена между электродами и окружающими их сепараторами даже в дешевых моделях. Итак, первым вариантом было использование стекловолокна. Достаточно просто окружить электроды стекловолокном которое пропитано серной кислотой и большинство проблем решится. Этот тип АКБ носит название AGM (absorbent glass mat) и таких АКБ для ИБП подавляющее большинство. Хотя такие АКБ малого форм-фактора и зачастую позиционируются как те, которые можно эксплуатировать в любом положении, с этим нельзя вполне согласиться. Вскрытие крышки стандартного дешевого AGM аккумулятора показывает, что никаких особых крышек там нет, а следовательно, электролит от вытекания удерживают лишь капиллярные силы. Я почти уверен, что если погонять AGM аккумулятор перевернутым вверх дном, то уже после одной зарядки из него польется серная кислота под давление газов.
Второй распространенный тип интереснее, это т.н. гелевые АКБ. А получаются они благодаря следующему. Если подкислять растворимые силикаты, то будет происходить выделение кремневой кислоты:
Na2SiO3 + H2SO4 = Na2SO4 + SiO2 + H2O
Если исходный раствор силиката не отличается качеством, то кремневая кислота будет выделяться в виде стекловидной массы, но если он достаточно чист, то кремневая кислота осадится в виде красивого куска однородного полупрозрачного геля. На этом и основан способ получения гелевых АКБ — простое добавление силикатов к электролиту вызывает его затвердение в гелеобразную массу. Соответственно, вытекать оттуда уже нечему и АКБ действительно можно эксплуатировать в любом положении. Сам по себе процесс образования геля не повышает емкости АКБ и не улучшает его качеств, однако, производители его используют при производстве наиболее качественных моделей, а потому эти АКБ отличаются высоким качеством и большей емкостью. Занятно, что в обоих случаях носителем электролита является SiO2 в той или иной форме.
Оба типа АКБ объединяются в славный тип VRLA — valve-regulated lead-acid battery который и применяется в ИБП. Формально они считаются необслуживаемыми и терпящими эксплуатацию в любом положении, но это не совсем так. Более того, многие уже встречались с эффектом, когда буквально несколько мл воды возвращают к жизни, казалось бы, дохлую АКБ от ИБП. Так получается, потому что и эти аккумуляторы не капли не застрахованы от электролиза воды в электролите, а следовательно, и пересыхания. Все происходит точно так-же, как в крупногабаритных АКБ. А вот самые дорогие и крутые необслуживаемые АКБ содержат катализатор для рекомбинации выделяющихся газов обратно в воду и вот уже у них корпус действительно выполнен абсолютно герметичным. Обращаю внимание, что по-настоящему герметичным и необслуживаемым может быть и аккумулятор типа AGM и GEL, но они-же могут ими и не быть и не содержать катализатора рекомбинации кислорода и водорода. Тогда, несмотря на казалось бы продвинутую конструкцию, пользователю придется либо чаще покупать новые аккумуляторы, либо доливать воду при помощи шприца.
Хотелось бы добавить несколько слов о режимах разряда. Производители АКБ указывают какой ток максимально допустим для той или иной модели, но нужно понимать, что аккумулятор — просто смесь химических веществ и ЭДС генерируется исключительно химическим путем. Это не конденсатор который, по электрогидравлической аналогии, можно сравнить с неким механическим сосудом (с гибкой мембраной). Хотя АКБ могут выдавать очень большие значения силы тока, в реальности они лучше всего эксплуатируются как раз при небольших токах, что в разряде, что в заряде. Поэтому ИБП, рассчитанные на заряды небольших АКБ, при работе с крупногабаритными будут заряжать их в наиболее щадящем режиме. Впрочем, в течении далеко не одних суток. Интересно обратить внимание на то, что чем выше мощность ИБП, тем больше аккумуляторов последовательно предпочитает собирать производитель. Тут все логично — большие токи разряда маленькие АКБ выдерживают очень плохо.
Подводя итоги:
1. Малогабаритные и крупногабаритные АКБ идентичны по устройству.
2. Для подавляющего большинства АКБ любого размера доливание воды является необходимой частью текущего обслуживания.
3. Лишь немногие из дорогих моделей АКБ содержат механизм рекомбинации газов и могут быть названы действительно необслуживаемыми.
4. Сам по себе водород, который выделяется при заряде (а это равно постоянной работе в ИБП) АКБ, не является существенной угрозой или проблемой.
5. Нужно очень внимательно работать с АКБ, тщательно избегая пролива даже малейших капель электролита, или лишитесь одежды.
6. Разряд и заряд малыми токами являются наиболее предпочтительными режимами эксплуатации АКБ.
Электролитный баланс| Безграничная анатомия и физиология
Натрий, электролиты и баланс жидкости
Электролиты играют жизненно важную роль в поддержании гомеостаза в организме.
Цели обучения
Определите важность натрия и баланса жидкости / электролитов
Основные выводы
Ключевые моменты
- Электролиты помогают регулировать миокардиальные и неврологические функции, баланс жидкости, доставку кислорода, кислотно-щелочной баланс и многое другое.
- Наиболее серьезные электролитные нарушения связаны с нарушениями уровней натрия, калия и / или кальция.
- Почки поддерживают постоянную концентрацию электролитов в крови, несмотря на изменения в организме.
Ключевые термины
- гомеостаз : способность системы или живого организма регулировать свою внутреннюю среду для поддержания стабильного равновесия; например, способность теплокровных животных поддерживать постоянную температуру.
- электролит : любой из различных ионов (например, натрия или хлорида), регулирующих электрический заряд клеток и поток воды через их мембраны.
- натрий : химический элемент с символом Na (от латинского: natrium) и атомным номером 11. Это мягкий серебристо-белый металл с высокой реакционной способностью, входящий в группу щелочных металлов.
Важность электролитного баланса
Электролиты играют жизненно важную роль в поддержании гомеостаза в организме.Они помогают регулировать миокардиальную и неврологическую функцию, баланс жидкости, доставку кислорода, кислотно-щелочной баланс и другие биологические процессы.
Электролиты важны, потому что это то, что клетки (особенно нервные, сердечные и мышечные) используют для поддержания напряжения на своих клеточных мембранах и для передачи электрических импульсов (нервных импульсов, мышечных сокращений) через себя и к другим клеткам.
Электролитный дисбаланс может развиться из-за чрезмерного или недостаточного проглатывания, а также из-за чрезмерного или уменьшенного выведения электролита.Наиболее частой причиной электролитных нарушений является почечная недостаточность. Наиболее серьезные электролитные нарушения связаны с нарушениями уровня натрия, калия и / или кальция.
Другие нарушения баланса электролитов встречаются реже и часто возникают в связи с серьезными изменениями электролита. Хроническое злоупотребление слабительными, сильная диарея или рвота (гастроэнтерит) могут привести к электролитным нарушениям в сочетании с обезвоживанием. Люди, страдающие нервной булимией или нервной анорексией, особенно подвержены высокому риску электролитного дисбаланса.
Почки поддерживают постоянную концентрацию электролитов в крови, несмотря на изменения в организме. Например, во время тяжелых упражнений из-за потоотделения теряются электролиты, особенно натрий и калий, и потоотделение может увеличить потребность в замене электролитов (соли). Эти электролиты необходимо заменить, чтобы поддерживать их концентрацию в жидкостях организма на постоянном уровне.
Обезвоживание
Существует три типа обезвоживания:
- Гипотонический или гипонатремический (прежде всего потеря электролитов, в частности натрия).
- Гипертонический или гипернатремический (прежде всего потеря воды).
- Изотонический или изонатремический (равная потеря воды и электролитов).
У людей наиболее распространенным типом обезвоживания является изотоническое (изонатриемическое) обезвоживание; что эффективно приравнивается к гиповолемии; но различие изотонического обезвоживания от гипотонического или гипертонического может быть важным при лечении людей с обезвоживанием.
С физиологической точки зрения, несмотря на название, обезвоживание не означает просто потерю воды, поскольку и вода, и растворенные вещества (в основном натрий) обычно теряются примерно в равных количествах по сравнению с тем, как они присутствуют в плазме крови.При гипотонической дегидратации внутрисосудистая вода перемещается во внесосудистое пространство и увеличивает истощение внутрисосудистого объема для данного количества общей потери воды в организме.
Неврологические осложнения могут возникать при гипотоническом и гипертоническом состояниях. Первое может привести к судорогам, второе — к осмотическому отеку мозга при быстрой регидратации.
В более тяжелых случаях коррекция обезвоженного состояния осуществляется путем восполнения необходимого количества воды и электролитов (посредством пероральной регидратационной терапии или восполнения жидкости внутривенной терапией).Поскольку пероральная регидратация менее болезненна, менее инвазивна, менее дорога и более проста в применении, она является предпочтительным методом лечения легкого обезвоживания. Растворы, используемые для внутривенной регидратации, должны быть изотоническими или гипотоническими.
Клеточные электролиты : Эта диаграмма иллюстрирует механизм транспортировки воды и электролитов через эпителиальные клетки секреторных желез.
Регламент баланса натрия
Натрий — важный катион, который в основном распределяется вне клетки.
Цели обучения
Опишите механизмы, с помощью которых регулируется баланс натрия
Основные выводы
Ключевые моменты
- В организме есть мощный механизм удержания натрия: ренин-ангиотензиновая система.
- При истощении запасов натрия повышается уровень альдостерона; в состояниях избытка натрия снижается уровень альдостерона.
- Основным физиологическим регулятором секреции альдостерона является уровень ангиотензина II плазмы, который увеличивает секрецию альдостерона.
Ключевые термины
- натрий : химический элемент с символом Na (от латинского: natrium) и атомным номером 11. Это мягкий серебристо-белый металл с высокой реакционной способностью, входящий в группу щелочных металлов.
- альдостерон : минералокортикоидный гормон, который секретируется корой надпочечников и регулирует баланс натрия и калия в организме.
- ангиотензин : любой из нескольких полипептидов, которые сужают кровеносные сосуды и регулируют артериальное давление.
Регламент по натрию
Натрий — важный катион, который в основном распределяется вне клетки. Концентрация натрия в клетках составляет около 15 ммоль / л, но она варьируется в разных органах; он имеет внутриклеточный объем 30 литров, а внутри клетки находится около 400 ммоль.
Плазма и интерстициальный натрий составляют около 140 ммоль / л с внеклеточным объемом около 13 литров, 1800 ммоль находятся во внеклеточном пространстве. Однако общее содержание натрия в организме составляет около 3700 ммоль, так как в костях хранится около 1500 ммоль.
В организме есть мощные механизмы удержания натрия, и даже если человек принимает 5 ммоль Na + в день, он может поддерживать баланс натрия. Дополнительный натрий выводится из организма за счет снижения активности ренин-ангиотензиновой системы, что приводит к увеличению потери натрия из организма. Натрий выводится через почки, пот и кал.
При истощении запасов натрия уровень альдостерона повышается. В состояниях избытка натрия уровень альдостерона снижается. Основным физиологическим регулятором секреции альдостерона является уровень ангиотензина II в плазме, который увеличивает секрецию альдостерона.
Высокий уровень калия в плазме также увеличивает секрецию альдостерона, потому что, помимо удержания Na +, высокий уровень альдостерона в плазме вызывает потерю K + почками. Уровни Na + в плазме мало влияют на секрецию альдостерона.
Ренин-ангиотензиновая система : Регулирование натрия через гормоны ренин, ангиотензин и альдостерон. В состояниях истощения натрия уровень альдостерона повышается, а в состояниях избытка натрия уровень альдостерона снижается.
Низкое почечное перфузионное давление стимулирует высвобождение ренина, который образует ангиотензин I, который превращается в ангиотензин II. Ангиотензин II корректирует низкое перфузионное давление, вызывая сужение кровеносных сосудов, и увеличивает задержку натрия за счет своего прямого воздействия на проксимальные почечные канальцы и эффекта, действующего через альдостерон. Давление перфузии надпочечников имеет небольшое прямое влияние на секрецию альдостерона, а низкое кровяное давление управляет альдостероном через систему ренин-ангиотензин.
Альдостерон также действует на потовые протоки и эпителий толстой кишки, сохраняя натрий. Когда альдостерон активируется для удержания натрия, уровень натрия в плазме имеет тенденцию повышаться. Это немедленно вызывает высвобождение АДГ, что вызывает задержку воды, таким образом уравновешивая Na + и h3O в правильной пропорции для восстановления объема плазмы.
Помимо альдостерона и ангиотензина II, на экскрецию натрия влияют и другие факторы.
- Пептид предсердий вызывает потерю натрия почками: он секретируется сердцем в состояниях с высоким содержанием натрия из-за избыточного потребления или сердечных заболеваний.
- Повышенное кровяное давление также вызывает потерю Na +, а низкое кровяное давление обычно приводит к задержке натрия.
Положение о балансе калия
Калий — это в основном внутриклеточный ион.
Цели обучения
Описать механизмы регуляции баланса калия
Основные выводы
Ключевые моменты
- Большая часть калия в организме находится внутри клеток, а следующая по величине доля — в костях.
- В необработанной диете калия гораздо больше, чем натрия, и он присутствует в виде органической соли, а натрий добавляется в виде NaCl.
- Высокое потребление калия может потенциально увеличить внеклеточный уровень K + в два раза, прежде чем почки смогут вывести лишний калий.
- Высокий уровень калия в плазме увеличивает секрецию альдостерона, что увеличивает потерю калия организмом для восстановления баланса.
Ключевые термины
- щелочные : Состояние, при котором снижается концентрация ионов водорода в плазме артериальной крови (алкалиемия).Обычно считается, что алкалоз возникает, когда pH крови превышает 7,45.
- Калий : химический элемент с символом K и атомным номером 19. Элементарный калий — это мягкий серебристо-белый щелочной металл, который быстро окисляется на воздухе и очень реагирует с водой — он может выделять достаточно тепла, чтобы воспламенить водород, выделяющийся в результате реакции.
- ацидоз : Повышение кислотности крови и других тканей тела (т. Е. Повышенная концентрация ионов водорода).Если не уточнять, это обычно относится к кислотности плазмы крови.
Баланс калия
Калий — это преимущественно внутриклеточный ион. Большая часть калия в организме (около 4000 ммоль) находится внутри клеток, а следующая по величине доля (300–500 ммоль) находится в костях. Концентрация К + в клетках составляет около 150 ммоль / л, но варьируется в разных органах. Внеклеточный калий составляет около 4,0 ммоль / л, с внеклеточным значением около 13 литров, 52 ммоль (т.е.е., менее 1,5%) здесь присутствует и только 12 ммоль находится в плазме.
В необработанной диете калия гораздо больше, чем натрия. Он присутствует в виде органической соли, а натрий добавляется в виде NaCl. У охотника-собирателя потребление K + может достигать 400 ммоль / день, в то время как в западной диете оно составляет 70 ммоль / день или меньше, если человек ест минимальное количество свежих фруктов и овощей.
При переработке пищевых продуктов K + заменяется NaCl. В то время как организм может выделять большую нагрузку K +, он не может сохранять K +.При нулевом потреблении K + или у человека с его истощением, потеря K + с мочой и калом составляет 30–50 ммоль / день.
Кислотно-щелочной контроль статуса
Если есть высокое потребление калия, например, 100 ммоль, это потенциально может увеличить внеклеточный уровень K + в два раза, прежде чем почки смогут вывести лишний калий. Организм буферизует лишний калий, уравновешивая его в клетках.
Кислотно-щелочной статус контролирует распределение между плазмой и клетками.Высокий pH (то есть алкалоз> 7,4) способствует перемещению K + в клетки, а низкий pH (то есть ацидоз) вызывает движение из клетки. Высокий уровень калия в плазме увеличивает секрецию альдостерона, что увеличивает потерю калия из организма для восстановления баланса.
Это изменение распределения в зависимости от кислотно-основного статуса означает, что K + в плазме может не отражать общее содержание в организме. Следовательно, у человека с ацидозом (pH 7,1) и уровнем K + в плазме 6,5 ммоль / л может быть истощено содержание калия в организме.Это происходит при диабетическом ацидозе. И наоборот, у человека, страдающего алкалозом с уровнем K + в плазме 3,4 ммоль / л, может быть нормальный уровень общего калия в организме.
Положение о балансе кальция и фосфата
Кальций — ключевой электролит: 99% откладывается в костях, а оставшаяся часть связана с высвобождением гормонов и передачей клеточных сигналов.
Цели обучения
Описание регулирования кальциево-фосфатного баланса
Основные выводы
Ключевые моменты
- Всасывание кальция контролируется витамином D, а выведение кальция — паратиреоидными гормонами.
- Происходит постоянная потеря кальция почками, даже если его нет в рационе.
- Кальций в плазме существует в трех формах: ионизированной, неионизированной и связанной с белками.
Ключевые термины
- кальций : химический элемент с атомным номером 20, который является щелочноземельным металлом и встречается в природе в виде карбоната в известняке и силиката во многих породах.
- паратироидный гормон : полипептидный гормон, который вырабатывается главными клетками паращитовидных желез и участвует в повышении уровня ионов кальция в крови.
- витамин D : жирорастворимый витамин, необходимый для нормального развития костей и предотвращающий рахит; он может образовываться в коже под воздействием солнечного света.
Кальций — очень важный электролит. Девяносто девять процентов или более откладывается в костях, а оставшаяся часть играет жизненно важную роль в нервной проводимости, сокращении мышц, высвобождении гормонов и передаче сигналов клетками.
Концентрация Са ++ в плазме составляет 2,2 ммоль / л, а фосфата — 1.0 ммоль / л. Произведение растворимости Са и Р близко к насыщению в плазме. Концентрация Са ++ в цитоплазме <10–6 ммоль / л, но концентрация Са ++ в клетке намного выше, поскольку кальций поглощается (и может высвобождаться) клеточными органеллами.
В типичной австралийской диете содержится около 1200 мг кальция в день. Даже если он полностью растворим, он не всасывается, так как он соединяется с фосфатами в кишечных секретах. Кроме того, всасывание регулируется активным витамином D; повышенное количество витамина D увеличивает всасывание Са ++.
Всасывание контролируется витамином D, а выведение — паратиреоидными гормонами. Однако распределение из кости в плазму контролируется как гормонами паращитовидной железы, так и витамином D.
Также происходит постоянная потеря кальция через почки, даже если его нет в рационе. Выведение кальция почками и его распределение между костью и остальным телом в первую очередь контролируется паратиреоидным гормоном.
Кальций в плазме существует в трех формах:
- Ионизированный.
- Неионизированный.
- Связанный с белком.
Паращитовидная железа контролирует концентрацию ионизированного кальция: если она низкая, секреция паратироидного гормона увеличивается. Это увеличивает уровень ионизированного кальция за счет увеличения реабсорбции костями, уменьшения почечной экскреции и воздействия на почки, увеличивая скорость образования активного витамина D, тем самым увеличивая всасывание кальция в кишечнике.
Обычное количество фосфата в рационе составляет около 1 г / день, но не весь он усваивается.Избыток выводится почками, и это выведение увеличивается за счет паратироидного гормона.
Этот гормон также вызывает вымывание фосфатов из костей. Фосфат плазмы не оказывает прямого влияния на секрецию паратиреоидного гормона; однако, если он повышен, он соединяется с Ca ++, чтобы уменьшить ионизированный Ca ++ в плазме и, таким образом, увеличить секрецию паратироидного гормона.
Регулирование кальция : Это иллюстрация того, как паратироидный гормон регулирует уровень кальция в крови.
Положение об анионах
Анионы хлорид, бикарбонат и фосфат играют важную роль в поддержании баланса и нейтральности жизненно важных механизмов организма.
Цели обучения
Описать анионную регуляцию в организме
Основные выводы
Ключевые моменты
- Хлорид необходим для поддержания надлежащей гидратации, а также для баланса катионов и поддержания электрической нейтральности внеклеточной жидкости.
- Бикарбонат играет главную роль в поддержании кислотно-щелочного баланса организма через буферную систему.
- Фосфат является основным компонентом внутриклеточной жидкости, он важен для регуляции метаболических процессов и в качестве буферного агента в клетках животных.
- Почки регулируют солевой баланс в крови, контролируя выведение и реабсорбцию различных ионов.
Ключевые термины
- анион : отрицательно заряженный ион.
- гиперфосфатемия : повышенное количество фосфатов в крови.
- гипохлоремия : Электролитное нарушение, вызванное аномально низким уровнем хлорид-ионов в крови.
- гипофосфатемия : нарушение электролитного баланса, вызванное аномально низким уровнем фосфата в крови.
Постановление об анионах
Выведение ионов происходит в основном через почки, меньшее количество ионов теряется с потом и фекалиями.Кроме того, чрезмерное потоотделение может вызвать значительную потерю, особенно хлорида аниона. Сильная рвота или диарея также вызывают потерю ионов хлорида и бикарбоната.
Регулировка дыхательной и почечной функций позволяет организму регулировать уровни этих ионов во внеклеточной жидкости (ECF).
Хлорид
Хлорид является преобладающим внеклеточным анионом и вносит основной вклад в градиент осмотического давления между внутриклеточной жидкостью (ICF) и внеклеточной жидкостью (ECF).Хлорид поддерживает надлежащую гидратацию и балансирует катионы в ECF, чтобы сохранить электрическую нейтральность этой жидкости. Пути секреции и реабсорбции ионов хлора в почечной системе повторяют пути ионов натрия.
Гипохлоремия или уровень хлоридов в крови ниже нормы может возникать из-за нарушения абсорбции почечными канальцами. Рвота, диарея и метаболический ацидоз также могут вызывать гипохлоремию.
Напротив, гиперхлоремия или уровень хлоридов в крови выше нормы может возникать из-за обезвоживания, чрезмерного потребления пищевой соли (NaCl) или проглатывания морской воды, интоксикации аспирином, застойной сердечной недостаточности и наследственных хронических заболеваний легких. болезнь муковисцидоз.У людей с муковисцидозом уровень хлоридов в поту в два-пять раз превышает нормальный уровень; поэтому анализ их пота часто используется для диагностики болезни.
Бикарбонат
Бикарбонат — второй по распространенности анион в крови. Его основная функция — поддерживать кислотно-щелочной баланс вашего тела, будучи частью буферных систем.
Бикарбонат-ионы возникают в результате химической реакции, которая начинается с молекул углекислого газа (CO 2 ) и воды (H 2 O), которые образуются в конце аэробного метаболизма.Лишь небольшое количество CO 2 может растворяться в жидкостях организма; таким образом, более 90 процентов CO 2 превращается в ионы бикарбоната, HCO 3 -, посредством следующих реакций:
CO 2 + H 2 O ↔ H 2 CO 3 ↔ H 2 CO 3 — + H +
Двунаправленные стрелки указывают на то, что реакции могут идти в любом направлении в зависимости от концентраций реагентов и продуктов. Углекислый газ в больших количествах вырабатывается в тканях с высокой скоростью метаболизма и превращается в бикарбонат в цитоплазме красных кровяных телец под действием фермента, называемого карбоангидраза.
Бикарбонат транспортируется в крови и, попав в легкие, реакции меняются в обратном направлении, и CO 2 регенерируется из бикарбоната и выдыхается как отходы метаболизма.
Бикарбонат как буферная система : В легких CO 2 образуется из бикарбоната и удаляется как отходы метаболизма посредством обратной реакции двунаправленного уравнения бикарбоната.
Фосфат
Фосфат присутствует в организме в трех ионных формах:
- H 2 PO 4 —
- HPO 4 2-
- ПО 4 3-
Добавление и удаление фосфата из белков во всех клетках является ключевой стратегией регуляции метаболических процессов.Фосфат полезен в клетках животных в качестве буферного агента, и наиболее распространенной формой является HPO 2- 4 . Кости и зубы связывают 85 процентов фосфатов в организме в составе солей фосфата кальция. Кроме того, фосфат содержится в фосфолипидах, таких как те, которые составляют клеточную мембрану, а также в АТФ, нуклеотидах и буферах.
Гипофосфатемия, или аномально низкий уровень фосфатов в крови, возникает при интенсивном употреблении антацидов, во время отмены алкоголя и во время недоедания.Перед лицом истощения фосфатов почки обычно сохраняют фосфаты, но во время голодания это сохранение сильно нарушается.
Гиперфосфатемия или аномально повышенный уровень фосфатов в крови возникает при снижении функции почек или в случаях острого лимфолейкоза. Кроме того, поскольку фосфат является основным компонентом ICF, любое значительное разрушение клеток может привести к сбросу фосфата в ECF.
Жидкости и электролиты Учебное пособие и управление медсестринским уходом
Баланс жидкости и электролитов — это динамический процесс, который имеет решающее значение для жизни и гомеостаза.
- Жидкость занимает почти 60% веса взрослого человека.
- Жидкость организма находится в двух жидкостных отсеках: внутриклеточное пространство , и внеклеточное пространство , .
- Электролиты в жидкостях организма — это активные химические вещества или катионы, несущие положительные заряды, и анионы, несущие отрицательные заряды.
- основных катионов в жидкости организма — это ионы натрия, калия, кальция, магния и водорода.
- Основные анионы — это ионы хлорида, бикарбоната, сульфата и протеина.
Гомеостаз — это динамический процесс, в котором тело поддерживает баланс, постоянно приспосабливаясь к внутренним и внешним раздражителям.
Отрицательные и положительные отзывы- Обратная связь — это передача информации о данном состоянии соответствующему органу или системе.
- Отрицательный отзыв. Отрицательная обратная связь возникает, когда тело обращает исходный стимул для восстановления физиологического баланса.
- Положительный отзыв. Положительная обратная связь усиливает или усиливает исходный стимул.
- Примеры. Контроль артериального давления и поддержание нормальной температуры тела — примеры отрицательной обратной связи, в то время как свертывание крови после травмы и роженица — примеры положительной обратной связи.
Системы, участвующие в обратной связи
Основными системами обратной связи являются нервная и эндокринная системы.
- Нервная система. Нервная система регулирует гомеостаз, ощущая отклонения системы и посылая нервных импульсов в соответствующие органы.
- Эндокринная система. Эндокринная система использует высвобождение и действие гормонов для поддержания гомеостаза.
Жидкости составляют большую часть тела, которая составляет примерно 50-60% от общей массы тела.
Расположение жидкостей- Основные отсеки. Жидкости организма разделены на два основных отдела: внутриклеточную жидкость и внеклеточную жидкость.
- Внутриклеточная жидкость. Внутриклеточная жидкость действует как стабилизирующий агент для частей клетки, помогает поддерживать форму клетки и помогает транспортировать питательные вещества через клеточную мембрану внутрь и из клетки.
- Внеклеточная жидкость. Внеклеточная жидкость в основном представляет собой жидкость интерстициальной ткани и внутрисосудистую жидкость.
- Центр жажды. Центр жажды в гипоталамусе стимулирует или подавляет желание человека пить.
- Антидиуретический гормон. ADH регулирует количество воды, поглощаемой почечными канальцами, и высвобождается в ответ на низкий объем крови или в ответ на повышение концентрации натрия и других растворенных веществ во внутрисосудистых жидкостях.
- Система RAA. Система RAA контролирует объем жидкости, в которой, когда объем крови уменьшается, кровоток в почечном юкстагломерулярном аппарате уменьшается, тем самым активируя систему RAA.
- Предсердный натрийуретический пептид. Сердце также играет роль в коррекции дисбаланса перегрузки, высвобождая ANP из правого предсердия.
- Суточная доза. Взрослый человек в состоянии покоя потребляет соответственно 2,500 мл жидкости в день.
- Уровни поступления. Приблизительные уровни потребления включают жидкости 1 200 мл, продукты 1 000 мл и продукты обмена 30 мл.
- Суточный выпуск. Суточная доза должна примерно равняться потреблению.
- Нормальный выход. Нормальный диурез наблюдается в виде мочи, дыхания, потоотделения, фекалий и в минимальном количестве вагинальных выделений.
- Гипергидратация. Гипергидратация — это избыток воды в организме.
- Отеки. Отек — это избыточное скопление жидкости в интерстициальных тканевых пространствах, также называемое жидкостью третьего пространства.
- Причина отека. Отеки вызваны нарушением фильтрационных и осмотических сил циркулирующих в организме жидкостей.
- Лечение отеков. Диуретики обычно назначают при системных отеках.
- Обезвоживание. Обезвоживание — это недостаток воды в организме или чрезмерная потеря воды.
- Внешние причины. Внешние причины обезвоживания включают продолжительное пребывание на солнце и чрезмерные физические нагрузки, а также диарею, рвоту и ожоги.
- Лечение обезвоживания. Часто вводятся дополнительные жидкости и электролиты.
Электролит — это вещество, которое при растворении в воде распадается на ионы.
- Истоки. Электролиты находятся в форме неорганических солей, кислот и оснований.
- Активные химические вещества. Концентрация электролитов измеряется в соответствии с их химической активностью и выражается в миллиэквивалентах.
- Ионы. Каждый химический элемент имеет электрический заряд, положительный или отрицательный.
- Электролиты внутриклеточные. Важными внутриклеточными электролитами являются калий, магний, сульфат и фосфат, причем наиболее доминирующим катионом является калий, а наиболее доминирующим анионом является фосфат.
- Внеклеточные электролиты. Важные внеклеточные электролиты включают натрий, хлор, кальций и бикарбонат, наиболее важным катионом является натрий, а самым важным анионом является хлор.
Общая концентрация электролитов влияет на баланс жидкости в организме.
- Клетки тела. Питательные вещества и кислород должны поступать в клетки организма, а продукты жизнедеятельности должны выходить из организма.
- Клеточная мембрана. Клеточная мембрана отделяет внутриклеточную среду от внеклеточной.
- Проницаемость. Способность мембраны пропускать молекулы известна как проницаемость.
- Свободнопроницаемые мембраны. Эти мембраны пропускают практически любую пищу или отходы.
- Селективно проницаемый. Клеточная мембрана избирательно проницаема, что означает, что мембрана каждой клетки пропускает только определенные вещества.
- Пассивный транспорт. Пассивные транспортные механизмы включают диффузию, осмос и фильтрацию.
- Распространение. Диффузия, или процесс «широкого распространения». — это случайное перемещение молекул из области с более высокой концентрацией в область с более низкой концентрацией.
- Осмос. Осмос — это диффузия чистого растворителя, такого как вода, через полупроницаемую мембрану в ответ на градиент концентрации в ситуациях, когда молекулы с более высокой концентрацией не диффундируют.
- Фильтрация. Фильтрация — это перенос воды и растворенных веществ, концентрация которых уже существует в ячейке.
- Механизмы. Активные механизмы транспорта требуют определенных ферментов и затрат энергии в форме аденозинтрифосфата (АТФ) .
- Процессы. Активные процессы переноса могут перемещать растворенные вещества «в гору» вопреки обычным правилам концентрации и давления.
Баланс жидкости и электролитов жизненно важен для правильного функционирования всех систем организма.
- Осмолярность. Это свойство частиц в растворе диссоциировать на ионы.
- Электронейтральность. Это баланс положительных и отрицательных зарядов.
Кислотно-щелочной баланс — еще один важный аспект гомеостаза.
Кислоты, основания и соли- Кислота. Кислота — это один из типов соединений, содержащих ион водорода.
- База. Основание или щелочь — это соединение, содержащее гидроксильный ион.
- Соль. Соль — это комбинация основания и кислоты, которая образуется, когда положительные ионы основания заменяют положительные ионы водорода кислоты.
- Важные соли. Тело содержит несколько важных солей, таких как хлорид натрия, хлорид калия, хлорид кальция, карбонат кальция, фосфат кальция и фосфат натрия.
- pH. Символ pH обозначает потенциал или степень концентрации ионов водорода в растворе.
- Низкий уровень pH. Если число pH ниже, чем 7 , раствор представляет собой кислоту .
- Высокий pH. Если pH на больше, чем 7 , раствор является основным, или щелочным.
- Нейтральный pH. Если значение pH составляет 7 , то раствор нейтральный .
- Изменения. Изменение pH раствора на одну единицу pH означает десятикратное изменение концентрации водорода.
- Буферы. Буфер — это химическая система, созданная таким образом, чтобы противостоять изменениям, особенно уровням ионов водорода.
- Бикарбонатная буферная система. Бикарбонат натрия и угольная кислота являются основными химическими буферами организма.
- Двуокись углерода. Основным соединением, контролируемым легкими, является CO2, и дыхательная система может очень быстро компенсировать слишком много кислоты и слишком мало кислоты, увеличивая или уменьшая частоту дыхания, тем самым изменяя уровень CO2.
- Бикарбонат. Ионы бикарбоната являются основными компонентами организма, а почки играют ключевую роль в регулировании количества бикарбоната в организме.
- Измерение газов артериальной крови. Уровень pH и количество определенных газов в крови указывают на то, есть ли больше кислоты или основания, и связанные с ними значения.
- Респираторный ацидоз. Респираторный ацидоз возникает при недостаточном дыхании и накоплении PaCO2.
- Респираторный алкалоз. Респираторный алкалоз возникает в результате гипервентиляции или избыточного приема аспирина.
- Метаболический ацидоз. При метаболическом ацидозе метаболизм нарушается, вызывая снижение уровня бикарбонатов и накопление молочной кислоты.
- Метаболический алкалоз. Метаболический алкалоз возникает, когда концентрация бикарбонат-иона увеличивается, вызывая повышение pH крови.
Существуют различные нарушения объема жидкости, которые могут повлиять на человека.
- Дефицит объема жидкости или гиповолемия возникает, когда потеря объема ECF превышает потребление жидкости.
- Избыток объема жидкости или гиперволемия относится к изотоническому увеличению объема ECF, вызванному аномальным удержанием воды и натрия примерно в тех же пропорциях, в которых они обычно присутствуют в ECF.
Нарушения электролитного баланса являются обычным явлением в клинической практике и должны быть устранены.
- Гипонатриемия относится к уровню натрия в сыворотке, который на меньше 135 мэкв / л
- Гипернатриемия — уровень натрия в сыворотке выше 145 мэкв / л .
- Гипокалиемия обычно указывает на дефицит общих запасов калия.
- Гиперкалиемия относится к уровню калия более 5,0 мэкв / л.
- Гипокальциемия — сывороточные уровни ниже 8,6 мг / дл .
- Гиперкальциемия — уровень кальция выше 10,2 мг / дл .
- Гипомагниемия относится к концентрации магния в сыворотке на ниже нормы .
- Гипермагниемия — сывороточные уровни более 2,3 мг / дл .
- Гипофосфатемия обозначается значением ниже 2,5 мг / дл .
- Гиперфосфатемия — это уровень фосфора в сыворотке, который превышает 4,5 мг / дл у взрослых.
Медсестрам необходимо понимание патофизиологии жидкостного и электролитного баланса, чтобы предвидеть, идентифицировать и реагировать на возможные дисбалансы.
- Концентрации. Концентрации электролита варьируются от значений в ICF до значений в ECF.
- Натрий. Ионов натрия больше, чем любых других катионов в ECF; поэтому он важен для регуляции жидкости в организме.
- Калий. ECF имеет низкую концентрацию калия и может переносить только небольшие изменения его концентрации.
- Техническое обслуживание. Организм тратит много энергии на поддержание концентраций натрия и калия с помощью насосов клеточных мембран, которые обменивают ионы натрия и калия.
- Осмос. Когда два разных раствора разделены мембраной, непроницаемой для растворенных веществ, жидкость переходит из области низкой концентрации растворенного вещества в область высокой концентрации растворенного вещества, пока растворы не станут равными концентрациями.
- Распространение. Диффузия — это естественная тенденция вещества перемещаться из области с более высокой концентрацией в область с более низкой концентрацией.
Причины дисбаланса жидкости и электролитов в общих чертах обсуждаются ниже.
- Удержание жидкости. Удержание натрия связано с задержкой жидкости.
- Потеря натрия. Чрезмерная потеря натрия связана с уменьшением объема жидкости в организме.
- Травма. Травма вызывает выброс внутриклеточного калия, что крайне опасно.
- Потеря жидкостей организма. FVD возникает в результате потери жидкостей организма и возникает быстрее при снижении потребления жидкости.
- Перегрузка жидкости. Избыточный объем жидкости может быть связан с простой перегрузкой жидкостью или снижением функции гомеостатических механизмов, ответственных за регулирование баланса жидкости.
- Низкое или высокое потребление электролита. Диета с низким или избыточным содержанием электролитов также может вызвать дисбаланс электролитов.
- Лекарства. Существуют определенные лекарства, которые могут привести к дисбалансу электролитов, если их принимать против предписания врача.
Признаки и симптомы дисбаланса жидкости и электролитов обсуждаются ниже.
- Дефицит объема жидкости. Клинические признаки и симптомы включают острую потерю веса, снижение тургора кожи, олигурию, концентрированную мочу, ортостатическую гипотензию, слабое, учащенное сердцебиение, сплющенные шейные вены, повышенную температуру, жажду, уменьшение или задержку наполнения капилляров, прохладную, липкую кожу, мышцы слабость и судороги.
- Превышение объема жидкости. Клинические проявления FVE включают отек, вздутие шейных вен и хрипы.
- Гипонатриемия. Признаки и симптомы включают анорексию, тошноту и рвоту, головную боль, вялость, головокружение, спутанность сознания, мышечные судороги и слабость, мышечные подергивания, судороги, сухость кожи и отек.
- Гипернатриемия. Признаки и симптомы: жажда, повышенная температура тела, галлюцинации, летаргия, возбужденное состояние, отек легких, подергивание, повышение АД и пульса.
- Гипокалиемия. Клинические проявления: утомляемость, анорексия, мышечная слабость, полиурия, снижение перистальтики кишечника, парестезия, кишечная непроходимость, вздутие живота и гипоактивные рефлексы
- Гиперкалиемия. Признаки и симптомы включают мышечную слабость, тахикардию, парестезию, аритмии, кишечные колики, спазмы, вздутие живота и беспокойство.
- Гипокальциемия. Признаки и симптомы: онемение, покалывание пальцев рук и ног и околоротовой области, положительный симптом Труссо и симптом Хвостека, судороги, гиперактивные глубокие сухожильные рефлексы, раздражительность и бронхоспазм.
- Гиперкальциемия. Признаки и симптомы включают мышечную слабость, запор, анорексию, тошноту и рвоту, обезвоживание, гипоактивность глубоких сухожильных рефлексов, летаргию, кальциевые камни, боль в боку, патологические переломы и боль в глубоких костях.
- Гипомагниемия. Клинические проявления включают нервно-мышечную раздражительность, положительный симптом Труссо и Хвостека, бессонницу, изменения настроения, анорексию, рвоту и усиление глубоких сухожильных рефлексов.
- Гипермагниемия. Признаки и симптомы: гиперемия, гипотония, мышечная слабость, сонливость, гипоактивные рефлексы, угнетенное дыхание и потоотделение.
- Гипофосфатемия. Признаки и симптомы включают парестезии, мышечную слабость, боль и болезненность в костях, боль в груди, спутанность сознания, судороги, гипоксию тканей и нистагм.
- Гиперфосфатемия. Клинические проявления: тетания, тахикардия, анорексия, тошнота и рвота, мышечная слабость и гиперактивные рефлексы.
Дисбаланс жидкости и электролитов может привести к осложнениям, если не лечить вовремя.
- Обезвоживание. Дефицит объема жидкости может привести к обезвоживанию тканей тела.
- Сердечная перегрузка. Избыточный объем жидкости, если его не лечить, может привести к перегрузке сердца.
- SIADH. Вода ненормально задерживается в SIADH.
- Остановка сердца. Слишком много введенного калия может привести к остановке сердца.
Ниже приведены лабораторные исследования, полезные для диагностики дисбаланса жидкости и электролитов:
- БУЛ. АМК может быть уменьшено в FVE из-за разведения плазмы.
- Гематокрит. Уровни гематокрита при FVD выше нормы из-за уменьшения объема плазмы.
- Медицинский осмотр. Физический осмотр необходим для выявления признаков и симптомов дисбаланса.
- Уровни электролитов в сыворотке. Необходимо выполнить измерение уровня электролита для проверки наличия дисбаланса.
- ЭКГ. Изменения ЭКГ также могут способствовать диагностике дисбаланса жидкости и электролитов.
- Анализ ABG. Анализ ABG может выявить кислотно-щелочной дисбаланс.
Лечение дисбаланса жидкости и объема требует точности, чтобы избежать последствий, которые могут привести к осложнениям.
- Растворы изотонических электролитов. Эти растворы используются для лечения гипотензивных пациентов с FVD, поскольку они увеличивают объем плазмы.
- Точный ввод и вывод. Точные и частые оценки I&O должны выполняться, когда терапию следует замедлить или увеличить, чтобы предотвратить дефицит объема или перегрузку.
- Диализ. Гемодиализ или перитонеальный диализ выполняется для удаления азотистых отходов и контроля калиевого и кислотно-щелочного баланса, а также для удаления натрия и жидкости.
- Лечебное питание. Лечение дисбаланса жидкости и электролитов должно включать ограничения или принудительное применение соответствующего электролита.
- Агонисты рецептора AVP. Это новые фармакологические средства, которые лечат гипонатриемию, стимулируя выведение свободной воды.
- Мочегонные средства. Для уменьшения объема жидкости при FVE вводят диуретики.
- Глюконат кальция внутривенно. Если уровень калия в сыворотке опасно повышен, может потребоваться внутривенное введение глюконата кальция.
- Кальцитонин. Кальцитонин может использоваться для снижения уровня кальция в сыворотке крови и особенно полезен для пациентов с сердечными заболеваниями или сердечной недостаточностью, которые не могут переносить большие нагрузки натрия.
Медсестры могут использовать эффективные обучающие и коммуникативные навыки для предотвращения и лечения различных нарушений жидкости и электролитов.
Оценка медсестерСледует проводить тщательное наблюдение за пациентами с дисбалансом жидкости и электролитов.
- I&O. Медсестра должна контролировать I&O жидкости не реже, чем каждые 8 часов или даже ежечасно.
- Суточный вес. Ежедневно оценивайте вес пациента, чтобы оценить его прибавку или потерю.
- Знаки жизнедеятельности. Следует внимательно следить за жизненно важными показателями.
- Физический осмотр. Физическое обследование необходимо для подтверждения других данных о дисбалансе жидкости или электролита.
Следующие диагнозы устанавливаются у пациентов с дисбалансом жидкости и электролита.
- Избыточный объем жидкости , связанный с избыточным потреблением жидкости и потреблением натрия.
- Недостаточный объем жидкости , связанный с активной потерей жидкости или отказом регулирующих механизмов.
- Несбалансированное питание: меньше, чем требуется организму. связано с неспособностью принимать пищу или усваивать питательные вещества.
- Несбалансированное питание: больше, чем потребности организма , связанные с чрезмерным потреблением.
- Диарея , связанная с побочными эффектами лекарств или нарушением всасывания.
Основная статья: 10 Планы сестринского ухода при дисбалансе жидкости и электролита
Планирование и цели для устранения дисбаланса жидкости и электролитов включают:
- Поддержание объема жидкости на функциональном уровне.
- Отображение нормальных лабораторных значений.
- Демонстрация соответствующих изменений в образе жизни и поведении, включая режим питания и количество / качество пищи.
- Восстановление и поддержание нормального режима работы и функционирования GI.
Существуют специальные медсестринские вмешательства при дисбалансе жидкости и электролитов, которые могут помочь в облегчении состояния пациента.
- Монитор тургора. Тургор кожи и языка являются индикаторами жидкостного статуса пациента.
- Концентрация мочи. Возьмите образец мочи пациента, чтобы проверить концентрацию мочи.
- Жидкости для перорального и парентерального введения. Администрирование пероральных или парентеральных жидкостей, как указано для устранения дефицита.
- Растворы для пероральной регидратации. Эти растворы содержат жидкость, глюкозу и электролиты в легко абсорбируемых концентрациях.
- Изменения центральной нервной системы. Медсестра должна быть внимательна к изменениям центральной нервной системы, таким как летаргия, судороги, спутанность сознания и подергивания мышц.
- Диета. Медсестра должна поощрять потребление недостаточных электролитов или ограничивать их потребление, если уровень электролитов чрезмерный.
Оценка плана ухода может проверить эффективность лечения. Вмешательства считаются эффективными, если у клиента есть:
- Поддержание объема жидкости на рабочем уровне.
- Отображаются нормальные лабораторные результаты.
- Продемонстрировал соответствующие изменения в образе жизни и поведении, включая режим питания и количество / качество продуктов питания.
- Восстановлен и поддерживает нормальный паттерн и функционирование желудочно-кишечного тракта.
После госпитализации лечение и поддержание состояния необходимо продолжать дома.
- Диета. Необходимо соблюдать диету, богатую всеми необходимыми человеку питательными веществами и электролитами.
- Забор жидкости. Потребление жидкости должно соответствовать рекомендациям врача.
- Продолжение. Через неделю после выписки пациент должен вернуться на контрольный осмотр для оценки уровня электролитов и жидкости.
- Лекарства. Соблюдение предписанных лекарств должно быть строгим, чтобы избежать повторения состояния.
Данные должны быть задокументированы для будущих медицинских и юридических справок.Медсестра должна предоставить документ:
- Индивидуальные выводы, включая факторы, влияющие на способность управлять жидкостями организма и степень дефицита.
- I&O, баланс жидкости, изменения веса, удельного веса мочи и показателей жизнедеятельности.
- Результаты диагностических исследований и лабораторных исследований.
- План ухода.
- Ответы клиента на лечение, обучение и выполненные действия.
- Достижение или продвижение к желаемому результату.
- Изменения в плане ухода.
Вот тест из 10 пунктов об учебном пособии. Посетите наш банк медсестринских тестов, страница , чтобы получить больше практических вопросов NCLEX .
1. ECF в основном состоит из:
A. Водяная жидкость и лимфатическая жидкость.
Б. ЦСЖ и межклеточная жидкость.
C. Интерстициальные и внутрисосудистые жидкости.
D. Сосудистая жидкость и спинномозговая жидкость.
2. Химический состав, устойчивый к изменениям, особенно уровня pH:
А.База.
B. Буфер.
C. Соль.
D. Кислота.
3. Через какой процесс вода движется через полупроницаемую мембрану?
А. Активный транспорт.
Б. Распространение.
C. Фильтрация.
D. Осмос.
4. Чтобы сбалансировать выход воды, средний взрослый должен иметь ежедневное потребление жидкости примерно:
А. 500-900 мл.
Б. 1000–2000 мл.
C. 2,000-3,000 мл.
D. 4,000-6,000 мл.
5. Основными органами, участвующими в регулировании pH, являются:
А.Почки и легкие.
Б. Сердце и кишечник.
C. Легкие и железы внутренней секреции.
D. Кожа и почки.
6. Клинические проявления, не обнаруженные при гипокалиемии:
A. Мышечная слабость
B. Олигурия
C. Постуральная гипотензия
D. Брадикардия
7. Медсестра должна ожидать, что пациенту с небольшим превышением объема жидкости будет назначено мочегонное средство, блокирующее реабсорбцию натрия в дистальных канальцах, например:
А.Bumex
B. Demadex
C. HydroDIURIL
D. Lasix
8. Сестринское вмешательство для пациента с диагнозом гипонатриемия включает в себя все следующее, за исключением:
A. Оценка симптомов тошноты и недомогания.
B. Поощрение употребления жидкостей с низким содержанием натрия, таких как кофе или чай.
C. Мониторинг неврологического статуса
D. Ограничение потребления водопроводной воды.
9. Чтобы дополнить рацион продуктами, богатыми калием, медсестра должна порекомендовать добавить:
А.Фрукты, такие как бананы и абрикосы
B. Зеленые листовые овощи
C. Молоко и йогурт
D. Орехи и бобовые
10. Наиболее характерное проявление гипокальциемии и гипомагниемии:
А. Анорексия и тошнота.
B. Запор
C. Отсутствие координации
D. Тетани
Ответы и обоснование
1. Ответ: C. Интерстициальные и внутрисосудистые жидкости.
- C: Внеклеточная жидкость в основном состоит из интерстициальной и внутрисосудистой жидкости.
- A: Водная жидкость и лимфатическая жидкость не являются частью ECF.
- B: ЦСЖ не входит в состав ЭКФ, в то время как интерстициальная жидкость входит.
- D: Сосудистая жидкость и спинномозговая жидкость не входят в состав ЭКФ.
2. Ответ: Б. Буфер.
- B: Буфер — это химическая система, созданная таким образом, чтобы противостоять изменениям, особенно уровням ионов водорода.
- A: Основание или щелочь — это соединение, содержащее гидроксильный ион.
- C: Соль представляет собой комбинацию основания и кислоты и образуется, когда положительные ионы основания заменяют положительные ионы водорода кислоты.
- D: Кислота — это один из типов соединений, содержащих ион водорода.
3. Ответ: D. Осмос.
- D: Осмос — это диффузия чистого растворителя, такого как вода, через полупроницаемую мембрану в ответ на градиент концентрации в ситуациях, когда молекулы с более высокой концентрацией не диффундируют.
- A: Активные механизмы транспорта требуют определенных ферментов и расхода энергии в форме аденозинтрифосфата (АТФ).
- B: Диффузия или процесс «широкого распространения» — это случайное перемещение молекул из области с более высокой концентрацией в область с более низкой концентрацией.
- C: Фильтрация — это перенос воды и растворенных материалов, концентрация которых уже существует в ячейке.
4.Ответ: В. 2000-3000 мл.
- C: Взрослый человек в состоянии покоя потребляет 2 500 мл жидкости в день.
- A: 500-900 мл — недостаточное потребление жидкости.
- B: 1000–2000 мл — недостаточное потребление жидкости.
- D: 4000-6000 мл — недостаточное потребление жидкости.
5. Ответ: A. Почки и легкие.
- A: Почки и легкие являются основными органами, участвующими в регуляции pH.
- B: Сердце и кишечник не участвуют в регуляции pH.
- C: Легкие и железы внутренней секреции не участвуют в регуляции pH.
- D: Кожа и почки не участвуют в регуляции pH.
6. Ответ: Б. Олигурия
- B: Полиурия присутствует при гипокалиемии вместо олигурии.
- A: Мышечная слабость — клиническое проявление гипокалиемии.
- C: Постуральная гипотензия — клиническое проявление гипокалиемии.
- D: Брадикардия клиническое проявление гипокалиемии
7. Ответ: Ласикс Д.
- D: Лазикс — мочегонное средство, обычно назначаемое пациентам с умеренным избыточным объемом жидкости.
- A: Бумекс не рекомендуется пациентам с легким избыточным объемом жидкости.
- B: Demadex не рекомендуется пациентам с легким избыточным объемом жидкости.
- C: Гидродиурил не является диуретиком, блокирующим реабсорбцию натрия в дистальных канальцах.
8. Ответ: Б. Поощрение потребления жидкостей с низким содержанием натрия, таких как кофе или чай.
- B: Медсестра должна поощрять прием жидкостей с высоким содержанием натрия для коррекции гипонатриемии.
- A: Медсестра должна оценить тошноту и недомогание, поскольку это клинические проявления гипонатриемии.
- C: Неврологический статус следует контролировать, чтобы избежать неврологических осложнений.
- D: Потребление водопроводной воды должно быть ограничено для пациентов с гипонатриемией.
9. Ответ: A. Фрукты, такие как бананы и абрикосы
- A: Бананы и абрикосы богаты калием.
- B: Зеленые листовые овощи богаты железом.
- C: Молоко и йогурт богаты кальцием.
- D: Орехи и бобовые богаты белком.
10.Ответ: Тетани Д.
- D: Снижение уровня кальция и магния приводит к тетании.
- A: Анорексия — это проявление гипомагниемии, а тошнота — признак гиперкальциемии.
- B: Запор не является проявлением гипокальциемии или гипомагниемии.
- C: Отсутствие координации не является проявлением гипокальциемии или гипомагниемии.
Похожие сообщения:
(PDF) Основные концепции баланса жидкости и электролита
133
натрий в плазме 36, 37, 99, 104
мочевина в плазме 17, 30, 35, 85
объем плазмы 11, 17, 24, 25, 32, 37
41, 42, 43, 44, 45
Возможность увеличения объема плазмы 43
полиуретан 59
полиурия 109
положительный заряд 21, 24
после операции 33, 49, 100, 102
после операции почечный 81, 82
послеоперационное кровотечение 19, 76
послеоперационная заболеваемость 117
послеоперационный период 118, 120
преренальный 33, 35, 36, 75, 81, 82
84, 85, 96, 105
преренальное ОПП 35, 75, 82, 84, 85
96, 105
предоперационная жидкость 118
давление 11, 16, 17, 26, 29, 31
32, 33, 34, 42, 51, 73
74, 75, 82, 84, 87, 94
117, 118, 119
катаболизм белков 17, 30, 95
зуд 45
легочный y отек 29, 74, 75, 76, 77
84, 87, 88, 90
92, 117
частота пульса 29, 31, 32, 51
74, 78, 84
растворы для регидратации 57, 104
почечная недостаточность 27, 79, 105
функция почек 17, 21, 30, 33, 35, 36
перфузия почек 30, 44, 84, 117, 119
почечных канальцев 16, 17, 18, 84
респираторный ацидоз 28, 66, 69
респираторный алкалоз 28, 66, 68, 70
респираторное заболевание 61, 70
дыхательная недостаточность 28, 64, 111
респираторный процесс 65
частота дыхания 61, 76, 88
ограничение 119, 120
реанимация 19, 28, 41, 43, 44, 49
50, 51, 52, 55, 58, 88
99, 119, 120
Лактат Рингера 26, 46, 51, 53
фактора риска 79, 83, 86, 94
инфузия физиологического раствора 27, 68, 71, 119
сепсис 19, 20, 21, 30, 31, 49, 70
73, 75, 79, 81, 82, 86 , 87
9 2, 97, 103
септический шок 67, 82
шок 19, 31, 55, 64, 67, 82
98, 122, 123, 127
баланс натрия 18, 30, 36, 37, 43
102, 103, 104
бикарбонат натрия 86, 89
хлорид натрия 24, 26, 117
концентрация натрия 15, 30, 101
истощение натрия 30, 103
натриевый насос 9, 103, 105
задержка натрия 18, 20, 118
транспорт натрия 119
крахмал 26, 41, 43
44, 45, 57
эффект скворца 11
11.2 Электролиты — Химия 2e
Задачи обучения
К концу этого раздела вы сможете:
- Определите и приведите примеры электролитов
- Различают физические и химические изменения, сопровождающие растворение ионных и ковалентных электролитов
- Связать прочность электролита с силами притяжения растворенного вещества и растворителя
Когда некоторые вещества растворяются в воде, они претерпевают физические или химические изменения, в результате которых образуются ионы в растворе.Эти вещества составляют важный класс соединений, называемых электролитами. Вещества, не выделяющие ионы при растворении, называются неэлектролитами. Если физический или химический процесс, в результате которого образуются ионы, практически на 100% эффективен (все растворенное соединение дает ионы), то это вещество известно как сильный электролит. Если только относительно небольшая часть растворенного вещества подвергается процессу образования ионов, это называется слабым электролитом.
Вещества могут быть определены как сильные, слабые или неэлектролиты путем измерения электропроводности водного раствора, содержащего это вещество.Чтобы проводить электричество, вещество должно содержать свободно подвижные заряженные частицы. Наиболее знакомо проведение электричества по металлическим проводам, и в этом случае подвижными заряженными объектами являются электроны. Растворы также могут проводить электричество, если они содержат растворенные ионы, причем проводимость увеличивается с увеличением концентрации ионов. Подача напряжения на электроды, погруженные в раствор, позволяет оценить относительную концентрацию растворенных ионов либо количественно, измеряя электрический ток, либо качественно, наблюдая за яркостью лампочки, включенной в цепь (Рисунок 11.6).
Рис. 11.6 Растворы неэлектролитов, таких как этанол, не содержат растворенных ионов и не могут проводить электричество. Растворы электролитов содержат ионы, которые пропускают электричество. Электропроводность раствора электролита зависит от прочности электролита.
Ионные электролиты
Вода и другие полярные молекулы притягиваются к ионам, как показано на рисунке 11.7. Электростатическое притяжение между ионом и молекулой с диполем называется ионно-дипольным притяжением.Эти аттракционы играют важную роль в растворении ионных соединений в воде.
Рис. 11.7 По мере растворения хлорида калия (KCl) в воде ионы гидратируются. Полярные молекулы воды притягиваются зарядами ионов K + и Cl — . Молекулы воды перед ионами и за ними не показаны.
Когда ионные соединения растворяются в воде, ионы в твердом веществе разделяются и равномерно диспергируются по всему раствору, поскольку молекулы воды окружают и сольватируют ионы, уменьшая сильные электростатические силы между ними.Этот процесс представляет собой физическое изменение, известное как диссоциация. В большинстве условий ионные соединения при растворении почти полностью диссоциируют, поэтому они классифицируются как сильные электролиты. Даже в умеренных количествах растворимые ионные соединения являются сильными электролитами, поскольку небольшое количество, которое действительно растворяется, полностью диссоциирует.
Рассмотрим, что происходит на микроскопическом уровне при добавлении твердого KCl в воду. Ионно-дипольные силы притягивают положительный (водородный) конец полярных молекул воды к отрицательным ионам хлорида на поверхности твердого тела, а отрицательные (кислородные) концы — к положительным ионам калия.Молекулы воды окружают отдельные ионы K + и Cl — , уменьшая сильные межионные силы, связывающие ионы вместе, и позволяя им переходить в раствор в виде сольватированных ионов, как показано на рис. 11.7. Преодоление электростатического притяжения делает возможным независимое движение каждого гидратированного иона в разбавленном растворе, когда ионы переходят из фиксированных положений в нерастворенном соединении в широко диспергированные сольватированные ионы в растворе.
Ковалентные электролиты
Чистая вода — чрезвычайно плохой проводник электричества, потому что она очень слабо ионизирована — только две из каждых 1 миллиарда молекул ионизируются при 25 ° C.Вода ионизируется, когда одна молекула воды отдает протон (ион H + ) другой молекуле воды, давая ионы гидроксония и гидроксид.
h3O (l) + h3O (l) ⇌h4O + (водн.) + OH− (водн.) H3O (l) + h3O (l) ⇌h4O + (aq) + OH− (водн.)В некоторых случаях растворы, приготовленные из ковалентных соединений, проводят электричество, потому что молекулы растворенного вещества химически реагируют с растворителем с образованием ионов. Например, чистый хлористый водород — это газ, состоящий из ковалентных молекул HCl. Этот газ не содержит ионов. Однако водный раствор HCl является очень хорошим проводником, что указывает на то, что в растворе существует значительная концентрация ионов.
Поскольку HCl представляет собой кислоту , ее молекулы реагируют с водой, передавая ионы H + с образованием ионов гидроксония (H 3 O + ) и ионов хлора (Cl —):
Эта реакция практически на 100% завершена для HCl (т.е. это сильная кислота и, следовательно, сильный электролит). Точно так же слабые кислоты и основания, которые реагируют только частично, при растворении в воде генерируют относительно низкие концентрации ионов и классифицируются как слабые электролиты.Читатель может пожелать повторить обсуждение сильных и слабых кислот, приведенное в предыдущей главе этого текста о классах реакций и стехиометрии.
Дисбаланс жидкости и электролита: NCLEX-RN || RegisteredNursing.org
В этом разделе экзамена NCLEX-RN вы должны будете продемонстрировать свои знания и навыки в отношении гриппа и электролитного дисбаланса, чтобы:
- Определить признаки и симптомы дисбаланса жидкости и / или электролитов у клиента
- Применять знания патофизиологии при уходе за клиентом с жидкостным и электролитным дисбалансом
- Обеспечение ухода за клиентом с дисбалансом жидкости и электролита
- Оценить реакцию клиента на вмешательства по исправлению жидкостного или электролитного дисбаланса
Электролиты — это ионы, которые могут иметь отрицательный или положительный заряд.Электролиты и уровень электролитов играют важную роль в жизни. Например, эти электрически заряженные ионы сокращают мышцы, перемещают жидкости внутри тела, производят энергию и выполняют множество других функций в организме и его физиологии.
Электролиты, аналогичные эндокринным гормонам, вырабатываются и контролируются с помощью механизмов обратной связи, когда почки или надпочечники ощущают дефицит определенного электролита и дисбаланс электролитного баланса клиента.
Электролиты тела заряжены положительно или отрицательно, как показано ниже:
- Натрий, сокращенно Na +
- Калий, сокращенно K +
- Кальций, сокращенно Ca +
- Магний, сокращенно Mg +
- Хлорид, сокращенно Cl —
- Фосфат водорода, сокращенно HPO4 —
- Бикарбонат, сокращенно HCO3 —
- Сульфат, сокращенно SO4 —
Определение признаков и симптомов дисбаланса жидкости и / или электролита у клиента
Функции основных электролитов организма, дисбаланс этих электролитов с точки зрения дефицита и избытка, их признаки и симптомы, а также способы лечения этих дисбалансов обсуждаются ниже.
Натрий
Нормальный диапазон для натрия составляет 135–145 миллиэквивалентов на литр (мэкв / л).
Натрий играет первостепенную роль в балансе жидкости в организме, а также влияет на работу мышц тела и центральной нервной системы. Этого электролита больше всего в плазме крови; а телесная вода идет туда, где есть натрий. Например, высокий уровень жидкости в плазме будет иметь место, когда в плазме высокое содержание натрия, и обратное также верно.
Гипернатриемия, то есть уровень натрия выше 145, может быть результатом ряда различных факторов и сил, таких как несахарный диабет, обезвоживание, в результате лихорадки, рвоты, диареи, потоотделения, интенсивных физических упражнений, длительного воздействия тепло окружающей среды и синдром Кушинга.
Признаки и симптомы гипернатриемии, среди прочего, включают возбуждение, жажду, беспокойство, сухость слизистых оболочек, отек, спутанность сознания и, в более тяжелых случаях, судороги и кому.
Лечение гипернатриемии, как и других нарушений электролитного баланса, включает коррекцию и лечение любых основных причин и ограничений в отношении натрия в пище. Однако следует отметить, что быстрое снижение содержания натрия в организме может привести к быстрому потоку воды, что может привести к отеку мозга, необратимому повреждению мозга, которое часто называют центральным понтинемиолизом, и даже к смерти.
Гипонатриемия, то есть уровень натрия ниже 135, может быть результатом синдрома несоответствующего антидиуретического гормона, некоторых лекарств, таких как диуретики, некоторые антидепрессанты, водной интоксикации, а также в результате заболеваний и расстройств, таких как заболевание щитовидной железы, цирроз, почечная недостаточность, сердечная недостаточность, пневмония, несахарный диабет, болезнь Аддисона, гипотиреоз, первичная полидипсия, тяжелая диарея или рвота, рак и церебральные нарушения.
СВЯЗАННЫЕ С : Что такое диабет 1,5 типа
Признаки и симптомы, связанные с гипонатриемией, включают спутанность сознания, рвоту, судороги, мышечную слабость, тошноту, головные боли, потерю энергии, усталость, беспокойство и раздражительность.
Лечение гипонатриемии включает коррекцию и лечение любых основных причин, прием мочегонных препаратов, ограничение жидкости, внутривенное введение натрия и, если причиной является болезнь Аддисона, может потребоваться заместительная гормональная терапия.
Калий
Нормальный уровень калия составляет от 3,7 до 5,2 мг-экв / л.
В отличие от натрия, который представляет собой внеклеточный электролит, который содержится в плазме крови, калий наиболее распространен в клетках организма; это прежде всего внутриклеточный электролит. Этот электролит стимулирует и облегчает электрические импульсы, необходимые для мышечных сокращений, а также для нормального функционирования мозга.
Гиперкалиемия, то есть уровень калия выше 5.2 мг-экв / л, может быть опасным для жизни; Признаки и симптомы, связанные с гиперкалиемией, включают мышечную слабость, паралич, слабость, тошноту и возможные опасные для жизни сердечные аритмии. Гиперкалиемия чаще всего связана с заболеванием почек, но также может возникать в результате приема некоторых лекарств.
Опасная для жизни гиперкалиемия лечится диализом почек и препаратами, снижающими уровень калия. Более низкие, менее опасные уровни гиперкалиемии иногда можно лечить путем ограничения диетических продуктов, содержащих калий.
Гипокалиемия, которая представляет собой уровень калия менее 3,7 мэкв / л, чаще всего в результате потери жидкости организмом в результате диареи, рвоты и потоотделения, а также некоторых лекарств, таких как мочегонные и слабительные средства, а также при других заболеваниях. и такие заболевания, как кетоацидоз.
Легкие случаи гипокалиемии могут протекать бессимптомно, но умеренная и тяжелая гипокалиемия может характеризоваться мышечной слабостью, мышечными спазмами, покалыванием, онемением, усталостью, головокружением, учащенным сердцебиением, запорами, брадикардией и, в тяжелых случаях, остановкой сердца.
В дополнение к лечению основной причины этого электролитного дисбаланса обычно вводят дополнительный калий.
Кальций
Нормальный уровень кальция составляет 8,5 — 10,6 мг / дл.
Уровень кальция в организме регулируется кальцитонином, который снижает уровень кальция, и гормоном паращитовидной железы, который увеличивает уровень кальция. Кальций необходим для здоровья костей и других функций.
Гиперкальциемия, то есть уровень кальция более 10.6 мг / дл, чаще всего ассоциируется с эндокринным заболеванием гиперпаратиреоз, но он также связан с некоторыми лекарствами, такими как тиазидные диуретики и литий, некоторыми формами рака, такими как рак груди и рак легких, с множественной миеломой, болезнью Педжета. болезнь, активность без нагрузки и повышенный уровень кальцитриола, как при саркоидозе и туберкулезе.
Гиперкальциемия характеризуется жаждой, почечными камнями, анорексией, парестезией, частым мочеиспусканием, болью в костях, мышечной слабостью, спутанностью сознания, болью в животе, депрессией, усталостью, летаргией, запорами, тошнотой и рвотой.
Лечение гиперкальциемии может включать внутривенное введение жидкости и прием таких лекарств, как преднизон, диуретики и бисфосфонаты. Меры по облегчению симптомов и вмешательства могут включать обезболивание для уменьшения уровня боли у клиента, витамины D и A, а также защиту клиента от травм и несчастных случаев, таких как падения, потому что патологические переломы костей могут возникать вторично по отношению к декальцификации костей, которая происходит в много случаев гиперкальциемии.
Поскольку уровни магния в значительной степени связаны с уровнями кальция, часто необходимо также корректировать и лечить уровни магния, прежде чем можно будет скорректировать уровни кальция.
Гипокальциемия, то есть уровень кальция менее 8,5 мг / дл, может возникать в результате почечной недостаточности, недостаточного содержания кальция в пище, дефицита витамина D, поскольку витамин D необходим для усвоения кальция, низкого уровня магния, панкреатита. , гипопаратиреоз, расстройство пищевого поведения и некоторые лекарства, такие как противосудорожные препараты, алендронат, ибандронат бисфосфонаты, рифампин, фенитоин, фенобарбитол, кортикостероиды, пликамицин и другие.
Симптомы могут варьироваться от легких и едва заметных до тяжелых и опасных для жизни.Некоторые из этих признаков и симптомов включают мышечные боли и боли, бронхоспазм, который может вызывать респираторные проблемы, судороги, тетанию, опасные для жизни сердечные аритмии и покалывание в ступнях, пальцах, языке и губах.
Лечение гипокальциемии включает в себя мониторинг респираторного и сердечного статуса клиента в дополнение к предоставлению клиенту добавок кальция в сочетании с витамином D, поскольку витамин D необходим для усвоения кальция.
Магний
Нормальный уровень магния в крови — 1.От 7 до 2,2 мг / дл.
Магний играет важную роль в организме с точки зрения активности ферментов, нейронов мозга, сокращения скелетных мышц и расслабления гладких мышц дыхательных путей. Магний также играет важную роль в метаболизме кальция, калия и натрия.
Гипермагниемия, то есть уровень магния в крови более 2,2 мг / дл, чаще всего обнаруживается вторично по отношению к почечной недостаточности, обезвоживанию, диабетическому ацидозу, гиперпаратиреозу, гипотиреозу, болезни Аддисона, а также при чрезмерном и длительном употреблении магнийсодержащих слабительных или антациды.
Признаки и симптомы, связанные с гипермагниемией, включают тошноту, рвоту, респираторные нарушения, общую и мышечную слабость, сердечную аритмию, паралич дыхания, угнетение центральной нервной системы и гипотонию.
Лечение гипермагниемии обычно включает прекращение приема лекарств, вызывающих заболевание, таких как слабительные, содержащие магний, почечный диализ и введение глюконата кальция, хлорида кальция и / или внутривенного введения декстрозы и инсулина.
Гипомагниемия, с другой стороны, — это уровень магния в крови менее 1,7 мг / дл. Гипомагниемия часто возникает в результате длительного приема диуретиков, неконтролируемого диабета, гипопаратиреоза, диареи и желудочно-кишечных расстройств, таких как болезнь Хрона, тяжелые ожоги, недоедание, алкоголизм и такие лекарства, как цисплатин, циклоспорин, амфотерицин, ингибиторы протонной помпы и антимикробные препараты. .
Признаками и симптомами гипомагниемии являются онемение и покалывание, мышечная слабость, судороги, мышечные спазмы, судороги, утомляемость и нистагм.
Лечение гипомагниемии может включать лекарства для уменьшения боли и дискомфорта, а также введение внутривенных жидкостей и магния.
Фосфат
Нормальный уровень сывороточного фосфата составляет от 0,81 до 1,45 ммоль / л.
Гиперфосфатемия определяется как уровень фосфата выше 1,45 ммоль / л. Наибольшим фактором риска гиперфосфатемии является тяжелое и запущенное заболевание почек, но другие факторы риска могут включать гипопаратиреоз, диабетический кетоацидоз, серьезные системные инфекции и рабдомиоз, который представляет собой разрушение мышечной ткани.
Гиперфосфатемия может протекать бессимптомно, но когда она выражена, у клиента могут быть признаки и симптомы мышечных спазмов и спазмов, слабость костей, тетания и скопления кристаллов в системе кровообращения и в тканях тела, которые иногда могут приводить к сильному зуду и т. пальпируемые кальцификаты в подкожной клетчатке. Это нарушение электролитов также имеет осложнения, такие как нарушение кровообращения, нарушения мозгового кровообращения, инфаркт миокарда и атеросклероз.
Лечение гиперфосфатемии включает ограничение диетических пищевых продуктов, содержащих фосфаты, включая такие продукты, как молоко и яичные желтки, и фосфатсвязывающих веществ, таких как лантан и севеламер, которые затрудняют усвоение фосфатов телом клиента. Эти лекарства принимают во время еды.
Гипофосфатемия, которая определяется как уровень фосфата менее 0,81 ммоль / л, связана с такими факторами риска, как хроническая диарея, тяжелые ожоги, гиперпаратиреоз, тяжелое недоедание, выраженный алкоголизм, лимфома, лейкемия, печеночная недостаточность, остеомаляция, генетика и др. длительный прием некоторых диуретиков и антацидов алюминия, а также длительный прием теофиллина.
Это иногда опасное для жизни нарушение электролитного баланса может сопровождаться сердечной аритмией, смертью, респираторными изменениями, включая респираторный алкалоз, раздражительность, спутанность сознания, кому и смерть.
Лечение гипофосфатемии включает кардиологический мониторинг, пероральное и внутривенное введение фосфата калия, а также поощрение употребления продуктов с высоким содержанием фосфора, таких как молоко и яйца.
Хлорид
Нормальный уровень хлоридов составляет от 97 до 107 мэкв / л.
Гиперхлоремия, при которой уровень хлоридов превышает 107 мэкв / л, может отрицательно повлиять на транспортировку кислорода в организме.Гиперхлоремия может возникнуть в результате обезвоживания, приема некоторых лекарств, заболевания почек, диабета, диареи, гиперпаратиреоза, гипонатриемии и некоторых лекарств, таких как дополнительные гормоны и некоторые диуретики.
Клиент, страдающий гиперхлоремией, может протекать бессимптомно или иметь симптомы. Некоторые из признаков и симптомов гиперхлоремии аналогичны признакам и симптомам, связанным с гипернатриемией, и включают сильную жажду, точечный отек, обезвоживание, диарею, рвоту, дыхание Куссмауля, одышку, тахипноэ, гипертонию, снижение когнитивных функций и кому.
Лечение, помимо выявления и лечения основного заболевания, включает осторожное введение жидкости, поскольку слишком быстрая регидратация может привести к отеку мозга и другим осложнениям, отмене проблемных лекарств и коррекции любого заболевания почек и гипергликемии.
Гипохлоремия, представляющая собой низкий уровень хлорида менее 97 мэкв / л, может возникать в результате рвоты, гиповентиляции, муковисцидоза, метаболического алкалоза, респираторного ацидоза, высокого уровня бикарбонатов и гипонатриемии.
Признаки и симптомы гипохлоремии могут включать обезвоживание, гипонатриемию, тошноту, рвоту, мышечную спастичность, тетанию, угнетение дыхания, мышечную слабость и / или мышечные подергивания, потоотделение и высокую температуру.
Лечение этого электролитного дисбаланса может включать введение заменителей хлоридов, а иногда и введение соляной кислоты и ингибитора карбоангидразы, такого как ацетазоламид, при остром эпизоде гипохлоремического алкалоза.
Жидкости и дисбалансы
Гиперволемия — это аномальное увеличение объема жидкости в крови, особенно плазмы крови, а гиповолемия — это дефицит жидкостей организма.
Гиперволемия, которую часто называют перегрузкой жидкостью, может возникать в результате повышенного содержания натрия в организме, что является гипернатриемией, чрезмерным потреблением жидкости, с которым организм не может эффективно справиться, а также другими нарушениями и заболеваниями, такими как печеночная недостаточность, почечная недостаточность. недостаточность и сердечная недостаточность.
Признаки и симптомы гиперволемии включают гипертонию, одышку, одышку, сопутствующие звуки дыхания, такие как хрипы и потрескивания, абдоминальный асцит, вздутие и расширение яремных вен с пульсацией, периферический отек кистей, стоп и / или лодыжек, тахикардию и т. Д. скачущий и сильный пульс.
В дополнение к лечению основной причины, когда это возможно, другие методы лечения гиперволемии включают ограничение жидкости и натрия и диуретики.
Гиповолемия, с другой стороны, представляет собой дефицит телесных жидкостей.Гиповолемия может возникнуть на фоне кровотечения и кровоизлияния, сильного обезвоживания, рвоты и диареи. Этот дефицит жидкости может привести к таким осложнениям, как снижение сердечного выброса, гиповолемический шок, метаболический ацидоз, мультисистемная недостаточность, кома и смерть.
Опять же, в дополнение к лечению основного заболевания, некоторые вмешательства при гиповолемии могут включать внутривенную регидратацию жидкостями, такими как лактат Рингера, размещение клиента в позе Тренделенбурга и введение расширителей плазмы, крови и крови. продукты в зависимости от статуса клиента и тяжести гиповолемии.
Применение знаний патофизиологии при уходе за пациентом с жидкостным и электролитным дисбалансом
Патологическая этиология, факторы риска, а также признаки и симптомы, связанные с жидкостным и электролитным дисбалансом, были полностью обсуждены непосредственно выше в разделе, озаглавленном «Выявление признаков и симптомов жидкостного и / или электролитного дисбаланса клиента».
Организация ухода за клиентом с дисбалансом жидкости и электролита
Уход и лечение клиента с жидкостным и электролитным дисбалансом также обсуждались в разделе, озаглавленном «Выявление признаков и симптомов жидкостного и / или электролитного дисбаланса клиента», который находится непосредственно выше.
Оценка реакции клиента на вмешательства по исправлению дисбаланса жидкости и электролита
Медсестры оценивают реакцию клиента на вмешательства, которые были использованы для исправления дисбаланса жидкости и электролитов, сравнивая исходные данные клиента, включая данные диагностических лабораторий, а также признаки и симптомы клиента, с данными результатов после лечения и вмешательств. Например, лабораторные уровни калия или магния до и после лечения сравниваются, чтобы определить, является ли уровень электролитов у клиента снова нормальным и / или улучшается ли он в направлении достижения ожидаемых результатов клиента.
СВЯЗАННЫЙ СОДЕРЖАНИЕ:
SEE — Вопросы к экзамену по практике физиологической адаптации
Alene Burke, RN, MSN
Alene Burke RN, MSN является национально признанным преподавателем сестринского дела. Она начала свою карьеру учителем начальной школы в Нью-Йорке, а затем поступила в общественный колледж Квинсборо, чтобы получить степень младшего специалиста по медсестринскому делу. Она работала дипломированной медсестрой в отделении интенсивной терапии местной общественной больницы, и в то время она решила стать преподавателем медсестер.Она получила степень бакалавра наук по медсестринскому делу в колледже Excelsior, который входит в состав Университета штата Нью-Йорк, и сразу же по окончании обучения поступила в аспирантуру в университете Адельфи на Лонг-Айленде, штат Нью-Йорк. Она закончила Summa Cum Laude в Адельфи, получив двойную степень магистра в области сестринского образования и сестринского администрирования, и сразу же получила докторскую степень по сестринскому делу в том же университете. Она является автором сотен курсов для медицинских работников, включая медсестер, она работает медсестрой-консультантом в медицинских учреждениях и частных корпорациях, она также является утвержденным поставщиком непрерывного образования для медсестер и других дисциплин, а также была членом Американской ассоциации медсестер. Целевая группа ассоциации по компетентности и обучению членов медсестер.
Последние сообщения Alene Burke, RN, MSN (посмотреть все)концепций | Уход | Общественный колледж Меса
Быстрые ссылки
- Дисбаланс кислотной основы
- Диагностические тесты
- Жидкость и электролиты
- Мониторинг гемодинамики
- Внутривенная терапия
Кислотно-щелочной дисбаланс
Практическая викторина ABG
Ответьте на 18 вопросов, викторину ABG с несколькими вариантами ответов, чтобы отточить свои знания.
indstate.edu / mary / abgpract.htm
Анализ ABG
Перейдите на этот урок анализа ABG с практическими упражнениями.
classes.kumc.edu/son/nurs420/unit2/abg.html
Объект обучения газам артериальной крови
Это короткое руководство даст вам основы понимания газового состава крови.
http://www.wisc-online.com/objects/index_tj.asp?objid=NUR202
Дифференциация нарушений кислотных оснований
Эта интерактивная презентация поможет вам определить некоторые общие причины нарушений кислотных оснований.
http://www.wisc-online.com/objects/index_tj.asp?objid=NUR4904
Кислотно-щелочной дисбаланс и их этиология
Этот модуль поможет вам связать дисбаланс с причиной.
http://www.wisc-online.com/objects/index_tj.asp?objid=NUR4604
кислотно-щелочной баланс
Базовый инструмент для улучшения вашего понимания кислотно-щелочного баланса.
http://www.wisc-online.com/objects/index_tj.asp?objid=NUR302
Кислотно-щелочной дисбаланс
В этом руководстве приведены примеры кислотно-щелочного дисбаланса
http: // www.wisc-online.com/objects/index_tj.asp?objid=NUR602
ABG Tutorial
Это руководство поможет вам попрактиковаться в тематических исследованиях.
Набор исследований: газ артериальной крови
http://studystack.com/menu-6519
Диагностические тесты
Интерпретация результатов гематологической лаборатории
Этот объект позволяет просматривать общий анализ крови, функции клеток и определять причины отклонений.
http://www.wisc-online.com/objects/index_tj.asp? objid = NUR4304
Диагностические тесты, связанные с нарушениями здоровья желудочно-кишечного тракта
Объект позволяет сопоставить названия тестов с действиями медсестры.
http://www.wisc-online.com/objects/index_tj.asp?objid=NUR4304
LearnWell EKG Review
На этом сайте есть обзор ЭКГ с образцами полосок и тестов, которые вы можете пройти.
ce5.com/ekg.htm
Quia: Основная аритмия
http://www.quia.com/jg/405396.html
Ветерок: Сердечные аритмии
Ветерок.mc.maricopa.edu/p65735599/
Жидкость и электролиты
Осмотическое давление
Обучающий объект, демонстрирующий осмотическое или тянущее давление.
http://www.wisc-online.com/objects/index_tj.asp?objid=NUR4004
изменения жидкостного баланса
Этот объект позволяет определять признаки и симптомы жидкостного дисбаланса.
http://www.wisc-online.com/objects/index_tj.asp?objid=NUR2903
Игра с обзором информации о панели электролита
Эта игра в крестики-нолики поможет вам узнать больше об электролитах
http: // www.wisc-online.com/objects/index_tj.asp?objid=CLT1604
жидкость и электролиты
Этот объект позволяет просматривать структуру и функции жидкости и электролитов.
http://www.wisc-online.com/objects/index_tj.asp?objid=NUR1203
гидратация, обезвоживание и пожилые клиенты
Этот инструмент демонстрирует различия в жидкостном статусе у пожилых людей.
http://www.wisc-online.com/objects/index_tj.asp?objid=DTY2203
Осмоляльность крови и объем крови
В этом руководстве обсуждаются регуляторы осмоляльности и объема крови
http: // www.wisc-online.com/objects/index_tj.asp?objID=CLT1504
Пакет исследований: дисбаланс жидкости
http://studystack.com/menu-2463
Quia: ожоги и травмы
http://www.quia.com/jg/539800.html
quia: меры по устранению электролитного дисбаланса
Эта игра типа опасности станет большим хитом.
http://www.quia.com/cb/69834.html
Мониторинг гемодинамики
Внутривенная терапия
Breeze Презентация: жидкости для ухода за детьми
Breeze.mc.maricopa.edu/p64421667/
Пакет исследований: внутривенное введение и введение крови
http://studystack.com/menu-19802
Набор исследований: показания и осложнения для внутривенного вливания
http://studystack.com/menu-26495
Пакет исследований: IV-расчеты
http://studystack.com/menu-21468
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с вашим системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
