состав и свойства — Информация
Пластиковый корпус и два контакта для подключения проводов. Именно так представляется автомобильный аккумулятор большинству из современных владельцев авто. Однако чтобы эксплуатировать его максимально эффективно, безопасно и без неожиданных сюрпризов, о батарее стоит знать немного больше.
Сегодня речь пойдет о столь важной составляющей конструкции авто и мото аккумуляторов, как электролит. Он представляет собой раствор серной кислоты, которая считается, пожалуй, одним из ключевых химических соединений в мире. Это обусловлено широким спектром ее применения. Раствор серной кислоты продается под различными наименованиями, которые зависят от степени крепости, а также уровня чистоты. Приведем несколько распространенных примеров:
- Камерная кислота – раствор серной кислоты с водой в пропорции от 60:40 до 70:30.
- Башенная кислота – раствор с соотношением от 75:25 до 82:18.
- Купоросное масло с содержанием серной кислоты до 97%.

- 100% серная кислота – моногидрат.
Если говорить о максимальной крепости, получаемой способом выпаривания, то этот параметр может достигать 98,5%. Однако для заправки аккумуляторных батарей ключевое значение приобретает чистота растворов купоросного масла с химической точки зрения.
Отметим также, что концентрированной серной кислотой называется совершенно прозрачная жидкость, не имеющая ни цвета, ни запаха. Она обладает консистенцию легкого масла. Ее удельный вес составляет 1б84 при температуре 15°С. В ней содержится примерно 95% серной кислоты. Концентрат может смешиваться с водой в любой пропорции. Изготавливая электролит в бытовых условиях, следует помнить, что смешивание воды и кислоты вызывает выделение значительного количества тепла. Температура кипения концентрированной серной кислоты составляет 338 градусов Цельсия.
Интересным фактом из курса химии является сокращение объема раствора. Примечательно то, что при смешении двух объемов серной кислоты и воды, соответственно, их итоговый объем будет меньше, чем суммарный.
Также обратите внимание на то, что удельный вес или плотность электролита авто или мото аккумулятора имеет непосредственную зависимость от тех температур, при которых работают аккумуляторы. Так, при эксплуатации в условиях низких температур нужен более плотный электролит. А в жарких странах – напротив – плотность электролита сознательно снижается. Это объясняется тем, что при таких температурах существенно повышается химическая активность раствора.
В заключение отметим, что плотность электролита также зависит от того, в каких режимах эксплуатируется батарея. Так, данный параметр для тяговых аккумуляторов обычно составляет 1.26 кг\с м³ , пусковые и осветительные источники питания имеют плотность до 1.3 кг\с м³ и т.д. Для автомобильных аккумуляторных батарей эта характеристика читается нормой, когда составляет 1.28 кг\с м³ .
23.08.2013, 68116 просмотров.
Из каких элементов состоит аккумуляторная батарея
- Категория: Поддержка по аккумуляторным батареям
- Опубликовано 01.
 03.2016 05:05
03.2016 05:05 - Автор: Abramova Olesya
Электрохимическая батарея состоит из катода, анода и электролита. При зарядке аккумуляторной батареи происходит накопление электронов на аноде, которое создает потенциал напряжения между анодом и катодом. При обычной работе в качестве источника питания ток протекает от катода к аноду через нагрузку. При зарядке аккумулятора ток течет в противоположном направлении.
Электроды батареи связаны между собой двумя различными путями, первый это электрический контур, через который электроны текут питать нагрузку, а второй — через электролит, где ионы движутся между электродами через диэлектрический разделитель (сепаратор). Рассмотрим подробнее эти три компонента батареи.
Анод и катодЭлектрод, который высвобождает электроны в ходе окислительно-восстановительной реакции, называется анод. Электрический потенциал анода гальванического элемента отрицателен по отношению к катоду. Химическая реакция в аккумуляторной батарее является обратимым процессом, и, следовательно, полярность электродов меняется в зависимости от режима работы (заряд/разряд), но обозначение клемм всегда постоянно. В таблицах 1a, b, c и d описывается состав и процессы в литиевых, свинцовых, никелевых и щелочных батареях.
Химическая реакция в аккумуляторной батарее является обратимым процессом, и, следовательно, полярность электродов меняется в зависимости от режима работы (заряд/разряд), но обозначение клемм всегда постоянно. В таблицах 1a, b, c и d описывается состав и процессы в литиевых, свинцовых, никелевых и щелочных батареях.
| Литий-ионная батарея | Катод | Анод | Электролит |
| Материальный состав элементов | Оксиды кобальта, никеля, марганца, железа и алюминия | На углеродной основе | Соли лития в органическом растворителе |
| Состав и процессы при заряженном состоянии | Оксид металла с интеркаляционной структурой | Миграция ионов лития к аноду | |
| Состав и процессы при разряженном состоянии | Ионы лития возвращаются к положительному электроду | В основном, углеродная основа |
Таблица 1a: Состав и процессы в литий-ионном аккумуляторе.
| Свинцово-кислотная батарея | Катод | Анод | Электролит |
| Материальный состав элементов | Диоксид свинца | Серый губчатый свинец | Соляная кислота |
| Состав и процессы при заряженном состоянии | Диоксид свинца PbO2, электроны присоединяются | Свинец Pb, электроны отсоединяются | Сильная серная кислота |
| Состав и процессы при разряженном состоянии | Свинец преобразуется в сульфид свинца, на аноде – с выделением электронов, а на катоде — с присоединением | Слабая серная кислота (разбавленная водой) | |
Таблица 1b: Состав и процессы в свинцово-кислотном аккумуляторе.
| NiMH, NiCd | Катод | Анод | Электролит |
| Материальный состав элементов | Никель | NiMH: водородопоглощающий сплав NiCd: кадмий |
Гидроксид калия |
Таблица 1c: Состав никель-металл-гидридного и никель-кадмиевого аккумуляторах.
| Щелочная (алкалиновая) батарейка | Катод | Анод | Электролит |
| Материальный состав элементов | Диоксид марганца | Цинк | Водный раствор щелочи |
Таблица 1d: Состав щелочной (алкалиновой) батарейки.
Электролит и сепараторПри затопленной негерметичной системе конструкции аккумулятора, жидкий электролит свободно течет между двумя электродами. В герметичных же конструкциях электролит обычно выступает в роли пропитки для сепаратора, чтобы обеспечивать движение ионов от катода к аноду и в обратном направлении при зарядке. Ионы – это атомы, которые присоединили или потеряли электроны. Потеряв благодаря этому электронейтральность, они приобретают способность двигаться между электродами через сепаратор. Сам же сепаратор является диэлектрическим, то есть не способным к электропроводности.
Электролит для автомобильных аккумуляторов
Что такое электролит, его функции
Электролит в аккумуляторе автомобиля — это особая жидкость, обеспечивающая необходимое накопление энергии. От состава и качества такого проводника во многом зависит производительность и срок службы баратеи. Этот показатель измеряется циклами зарядка-разрядка и может отличаться для различных типов аккумулятора. Непосредственно в самом электролите происходит сохранение энергии после подзарядки. Большинство современных аккумуляторов работают с использованием электролитных растворов.
Отличия электролитов для разных типов аккумуляторов
Автомобильные аккумуляторные батареи можно классифицировать по типу используемых веществ. В основном они представлены двумя типами АКБ: щелочными и кислотными. Уже по названию становится понятно, что у них совершенно разная среда электролитного раствора.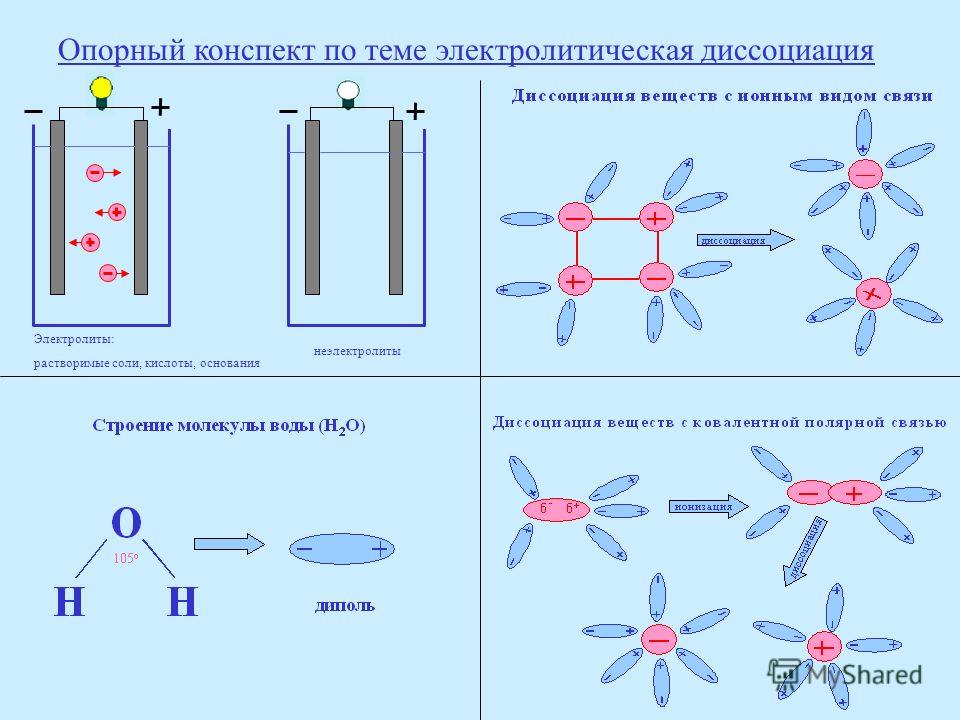
Состав электролитных растворов:
- Для щелочных АКБ используется смесь дистиллированной воды с растворенными в ней солями металлов.
- Кислотные аккумуляторы в качестве проводника используют раствор серной кислоты. Его плотность должна быть в пределах 1,1-1,3 гр/см³. Для самостоятельного приготовления раствора необходимо смешать кислоту и дистиллированную воду.
Недостатком подобных устройств можно считать необходимость регулярного осмотра и доливки в емкость дистиллированной воды. Батарея может выйти из строя при использовании обычной воды или другой подобной жидкости. Дело в том, что дистиллированная вода очищена от подавляющего большинства минеральных примесей. При использовании обычной жидкости, эти элементы вступают в реакцию с кислотой, что приводит к выпадению осадка и появлению налета на пластинах АКБ. Применение дистиллированной воды хорошего качества позволит избежать таких ситуаций и продлит срок полезной эксплуатации батареи.
Процесс изготовления электролита
Для дозаливки АКБ используется только дистиллированная вода, но этот момент относится к приобретенной батарее с уже набранным электролитным раствором. Если же аккумулятор продавался «сухим», приготовить раствор и осуществить его заливку придется самостоятельно. С этим справится любой человек, главное — соблюдать меры безопасности и пропорции разведения веществ.
Для приготовления такого раствора используется серная кислота именно для АКБ. Она подвергается более высокой степени очистки, а ее плотность обычно составляет 1,84 гр/см³. Применение других типов веществ не может обеспечить необходимую чистоту и концентрацию раствора. Если самостоятельное приготовление вызывает затруднения, можно также использовать готовую купленную жидкость для дозаливки АКБ.
Приготовление электролита с кислой средой:
- Емкость для разведения используется исключительно керамическая или из эбонита. Стекло быстро приходит в негодность вследствие агрессивного воздействия кислоты.
 Объем емкости также имеет значение и должен составлять не менее четырех литров.
Объем емкости также имеет значение и должен составлять не менее четырех литров. - Подходящий инструмент для размешивания раствора. Он также должен обладать стойкостью к кислой среде.
- Ареометр — специальный прибор, измеряющий плотность жидкости. Для конкретного случая он должен определять плотность раствора кислоты (продается в автомагазинах).
- Защитное снаряжение, включающее не только плотную одежду (рабочий фартук), но и перчатки, а также очки для защиты органов зрения.
- В первую очередь необходимо промыть все элементы, с которыми будет впоследствии контактировать химикаты, дистиллированной водой. Это позволит избежать попадания в раствор посторонних примесей.
- Важный момент: в емкость сначала наливают воду, а уже затем добавляют кислоту. Обратная последовательность вызовет бурную химическую реакцию с сильным повышением температуры. При такой ситуации трудно будет избежать ожогов и порчи окружающей обстановки, поэтому это правило следует запомнить обязательно.

- При добавлении кислоты в жидкость, необходимо тщательно медленными движениями перемешать раствор, добиваясь однородного состояния.
- Плотность электролитного раствора зависит от марки АКБ, поэтому этот момент обязательно стоит посмотреть в инструкции оборудования.
- Для приготовления одного литра раствора следует взять 0,35 л серной кислоты и 0,7 — воды. При смешении, объем жидкости немного уменьшается. Кроме того, следует учитывать и температуру раствора, которая также влияет на его плотность. Желательно проводить замеры несколько раз, а использовать готовый раствор только после того, как окончательно убедитесь в его пригодности.
Заливка раствора в АКБ осуществляется при помощи воронки и все того же инструмента для помешивания. Делать это необходимо очень аккуратно, чтобы не вызвать нежелательных химических реакций в батарее. Остатки раствора не стоит утилизировать. Они пригодятся для дозаправки АКБ, поэтому их переливают в стеклянную емкость, плотно закрывают и обязательно маркируют с указанием даты приготовления. Это необходимо, чтобы исключить риск использования негодного уже раствора, а также не перепутать емкость с другими техническими веществами.
Это необходимо, чтобы исключить риск использования негодного уже раствора, а также не перепутать емкость с другими техническими веществами.
Срок службы электролита
Непосредственно сам раствор может храниться длительный срок без потери основных характеристик. Для того, чтобы предупредить выпадение осадка, следует прятать емкость от прямых солнечных лучей и сильных температурных перепадов. Что касается электролита, уже залитого в батарею, его пригодность определить будет сложней, ведь на это влияют многие факторы.
На срок полезной эксплуатации АКБ влияют следующие факторы:
- Регулярная зарядка батареи.
- Поддержание комфортного температурного режима.
- Осмотр и дозаправка электролитом.
- Использование исключительно качественных химических веществ для приготовления раствора.
Точный период использования аккумулятора определить достаточно сложно. На это также влияет марка машины, оснащение дополнительными функциями и интенсивность эксплуатации авто. Кроме того, не так уж редко встречается и заводской брак, при котором из строя выходит вроде бы недавно приобретенная батарея. Обычно производители рекомендуют заменять аккумулятор каждые три-пять лет, но в современных реалиях многие автолюбители не расстаются с ним на протяжении пяти-семи лет.
Кроме того, не так уж редко встречается и заводской брак, при котором из строя выходит вроде бы недавно приобретенная батарея. Обычно производители рекомендуют заменять аккумулятор каждые три-пять лет, но в современных реалиях многие автолюбители не расстаются с ним на протяжении пяти-семи лет.
Как контролировать электролит
Электролит для кислотных аккумуляторов, впрочем, как и для его щелочных аналогов, не имеет фактического срока годности. Обычно сухозаряженная батарея заправляется только раз, после чего осуществляется доливка раствора при необходимости до нужного уровня. Полная замена раствора понадобится нечасто, обычно в случае его помутнения вследствие использования обычной или некачественной дистиллированной воды.
Плотность электролита летом и зимой
В зависимости от температурных режимов эксплуатации авто, необходимо контролировать и плотность используемого электролитного раствора. Для этого необходимо уяснить несколько правил, а также внимательно изучить инструкцию по эксплуатации именно вашего типа батареи.
Что важно знать:
- В северных регионах с суровыми зимами плотность электролита должна быть в пределах 1,27-1,29 гр/см³.
- Для Средней полосы с умеренным климатом предпочтительная плотность электролита от 1,25-1,27 гр/см³.
- В южной части страны плотность электролитного раствора варьируется в пределах 1,23-1,25 гр/см³.
Для продолжительной работы аккумулятора рекомендуется снимать устройство при длительном простое (например, на ночь). Считается, что окружающая температура ниже 30 градусов мороза отбирает у батареи более 50% заряда, что негативно влияет на ее дальнейшую эксплуатацию. Также необходимо знать, какой электролит заливать в аккумулятор летом. Он должен иметь меньшую плотность, нежели «зимний» вариант. Это облегчит прохождение и накопление разряда, а также положительно скажется на продолжительности эксплуатации батареи.
Как добиться нужной плотности в аккумуляторе
При самостоятельном изготовлении раствора, необходимо не только знать, из чего состоит электролит. Главное требование — обеспечение нужной плотности жидкости, чтобы заряд хорошо сохранялся в такой среде. Для контроля и проверки этого показателя применяется простой и доступный прибор — ареометр. Он работает по принципу закона Архимеда и показывает плотность жидкости. При недостаточном ее уровне, раствор разбавляется кислотой, а если необходимо понизить плотность — добавляется дистиллированная вода.
Главное требование — обеспечение нужной плотности жидкости, чтобы заряд хорошо сохранялся в такой среде. Для контроля и проверки этого показателя применяется простой и доступный прибор — ареометр. Он работает по принципу закона Архимеда и показывает плотность жидкости. При недостаточном ее уровне, раствор разбавляется кислотой, а если необходимо понизить плотность — добавляется дистиллированная вода.
Электролитный раствор обеспечивает работу аккумуляторной батареи, а также определяет ее производительность. При правильном подходе, эта жидкость в обязательном порядке периодически тестируется, доливается, либо заменяется полностью. На работу АКБ в большей мере влияет и температура окружающего воздуха, поэтому в особо суровые морозы стоит заносить аккумулятор в тепло. Какой электролит заливать в аккумулятор зимой, а также другие нюансы приготовления и применения этого проводника рассмотрены в нашей информации.
советы по подготовке, правила эксплуатации
Электрическая батарея автомобиля представляет собой перезаряжаемый аккумулятор, который обеспечивает электрической энергией двигатель при его запуске и позволяет функционировать всем системам транспортного средства. Работоспособность батареи определяется его выходным напряжением, которое в большей степени зависит от состава электролита для аккумуляторов.
Работоспособность батареи определяется его выходным напряжением, которое в большей степени зависит от состава электролита для аккумуляторов.
Общая информация
Аккумуляторная батарея получила такое название потому, что она состоит из нескольких ячеек, которые располагаются одна за другой в ряд. Такое устройство является последовательным соединением электрических элементов в цепи, что позволяет увеличить выходное напряжение. Каждая ячейка батареи представляет собой закрытый сосуд, в котором расположены два электрода, погруженные в специальную жидкость — электролит, представляющий собой смесь серной кислоты и дистиллированной воды. Он выступает в качестве среды, обеспечивающей ионный обмен между электродами.
Положительные электроды — пластины, которые состоят из пентоксида свинца, а отрицательные электроды — пластины из активного свинца. Они объединяются и группируются с помощью контактных прослоек горизонтального и вертикального типа. Такая структура обеспечивает равномерное распределение электрического тока. Объединение положительных и отрицательных свинцовых пластин называется элементом. Как правило, отрицательные пластины имеют большую толщину.
Объединение положительных и отрицательных свинцовых пластин называется элементом. Как правило, отрицательные пластины имеют большую толщину.
Каждый элемент батареи отделяется тонкой прослойкой из пластика. Эта прослойка предотвращает возникновение короткого замыкания между рядом находящимися плюсом и минусом соседних элементов.
Между электродами и электролитом происходят электрохимические реакции, в результате которых поглощаются или выделяются электроны. Такие реакции создают разницу напряжений между электродами элемента.
На внешнюю часть корпуса аккумулятора выводятся две клеммы, с помощью которых он подсоединяется к электрической цепи. Эти клеммы расположены на верху корпуса, однако в некоторых батареях они делаются сбоку. В последнем случае возникает множество проблем, связанных с их расположением, в частности, боковые клеммы облегчают скопление паров электролита внутри батареи, что приводит к быстрому выходу из строя его рабочих элементов.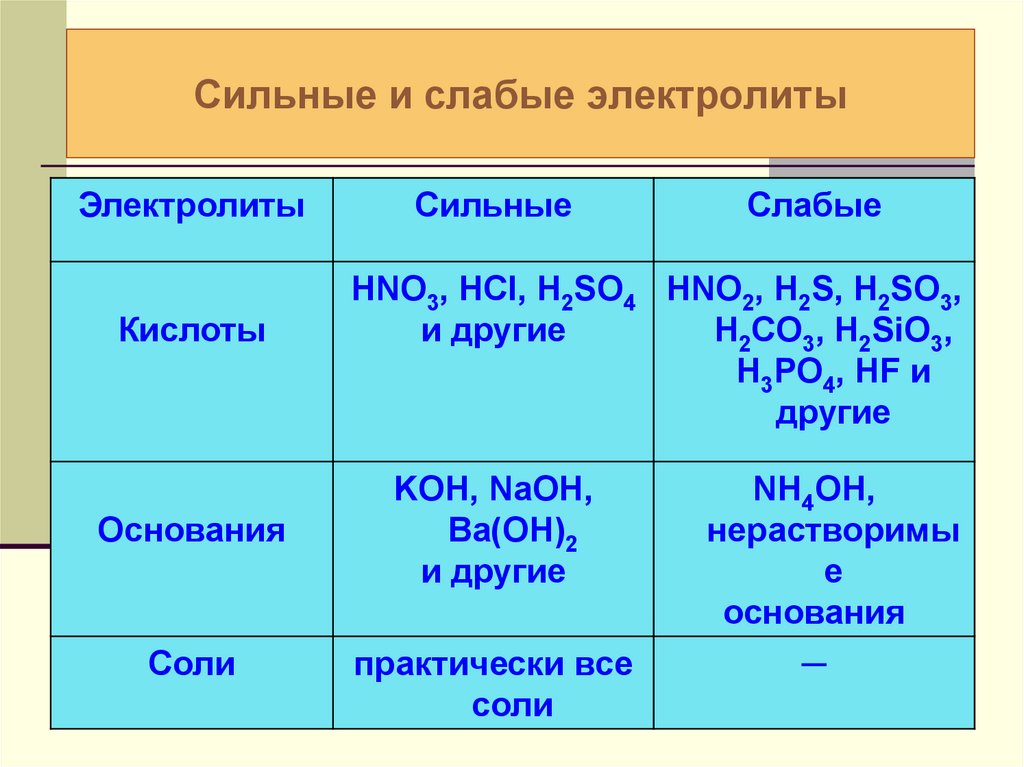
Клемма аккумулятора является либо положительной, либо отрицательной. Положительная клемма имеет больший размер, поэтому выполнить правильную установку батареи не составит никакого труда даже новичку. Если подсоединить неправильно аккумулятор, то есть перепутать плюс и минус, тогда можно повредить всю электрическую цепь.
Происходящие электрохимические реакции приводят к медленному износу активных элементов батареи, в частности, отрицательные электроды окисляются и становятся толще, а положительные электроды восстанавливаются и утончаются. По этой причине при покупке аккумулятора для автомобиля всегда следует обращать внимание на гарантийный срок службы устройства.
Аккумулятор может работать в ограниченном температурном диапазоне и плохо переносит низкие температуры, поэтому уход за ним состоит в периодических проверках напряжения на его клеммах и его механической целостности. Важно следить за наличием в батареи электролита для кислотных аккумуляторов и составом его.
Концентрация кислоты
Основным компонентом электролита автомобильной аккумуляторной батареи (АКБ) является концентрированная серная кислота. Но на чистой серной кислоте устройство работать не может, поэтому в составе автомобильного электролита также присутствует дистиллированная вода. Государственный стандарт ГОСТ 667–73 регулирует качество серной кислоты, поставляемой для АКБ. Важность соблюдения этого ГОСТа связаны с резким снижением срока службы устройства в случае использования грязной серной кислоты.
Плотность серной кислоты равна 1,84 г/мл, рабочее же значение плотности электролита составляет 1,3 г/мл. Следует знать, что при приготовлении электролита выделяется большое количество теплоты, поэтому не нужно забывать правило, что следует всегда лить кислоту в воду, и ни в коем случае наоборот.
Электролит, плотность которого лежит в пределе 1,07 — 1,30 г/мл, считается пригодным для работы. Этому пределу плотности соответствует концентрация h3SO4 27−40%.
Правила эксплуатации
Свойства электролита достаточно чувствительны к смене температурного режима окружающей среды, поэтому в зонах с умеренным климатом рекомендуется проверять его состояние два раза в год: в конце осени и в конце весны.
Измерение плотности
Плотность является важной характеристикой кислотного электролита, состав которого определяет ее величину. Прибор, которым измеряется плотность электролита, называется ареометром, который можно купить в любом автомагазине. При его использовании следует учитывать температуру окружающей среды и связанный с ней поправочный коэффициент.
Следующая таблица демонстрирует поправочные коэффициенты к полученным показаниям ареометра в зависимости от температуры (градусы Цельсия):
- от -40 до -26: -0,04;
- от -25 до -11: -0,03;
- от -10 до +4: -0,02;
- от +5 до +19: -0,01;
- от +20 до +30: 0,00;
- от +31 до +45: +0,01.

Помимо ареометра, для записи измеренных результатов рекомендуется заранее приготовить чистый лист бумаги и карандаш. Проверку необходимо проводить в каждом элементе батареи отдельно. Следующие шаги объясняют порядок действий:
- Первым делом следует открыть каждую емкость в батарее, плотность электролита в которой должна быть измерена.
- Предназначенную для измерения часть ареометра нужно поместить в электролит.
- Грушей прибора следует забрать некоторую порцию электролита так, чтобы поплавок ареометра начал плавать.
- В месте соприкосновения специального стержня и жидкости следует смотреть настоящие показания измеряемой величины.
- Полученный результат записать, а затем провести аналогичные действия для оставшихся емкостей батареи.
Плотность является физической величиной, размерность которой определяется как г/см3. В случае электролита после проведенных измерений следует удостовериться, что ее колебания во всех элементах АКБ не превышают 0,2−0,3 г/см3. Если средняя величина плотности по всем емкостям АКБ лежит ниже установленного значения в паспорте, тогда необходимо зарядить аккумулятор.
Если средняя величина плотности по всем емкостям АКБ лежит ниже установленного значения в паспорте, тогда необходимо зарядить аккумулятор.
При уходе за аккумулятором и контроле плотности электролита необходимо иметь в виду температурный режим. Так, в холодное время года следует поддерживать более высокие значения этой величины (1,30 г/см3), так как она обеспечивает более низкую температуру замерзания жидкости. Например, если значение плотности лежит ниже 1,1 г/см3, то в электролите могут появляться кристаллики льда уже при температуре -6 °C. Летом же лучше снижать плотность заряженной батареи до уровня 1,23 г/см3, поскольку чем она ниже, тем дольше прослужит устройство.
Зимой при низких температурах воздуха рекомендуется снимать аккумулятор с автомобиля и заносить его в помещение, в котором следует проводить все контролирующие замеры электролитических параметров. Кроме того, для эксплуатации электроприбора в северных районах страны следует приобрести специальный контейнер-рубашку, который позволяет сохранять тепло корпуса АКБ.
Уровень жидкости
Еще одной ключевой характеристикой аккумуляторной батареи, за которой необходимо следить регулярно, является уровень электролита в каждом элементе. Согласно общим рекомендациям, он не должен быть ниже 1−1,5 см верхнего края пластин.
Перед измерением уровня электролита в каждой секции батареи следует поставить электроприбор на горизонтальную поверхность. После этого рекомендуется взять стеклянную трубку длиной 25−30 см и диаметром 5−6 мм, опустить ее на дно измеряемой банки, закрыть свободный конец трубочки большим пальцем, чтобы предотвратить спад жидкости в ней при вытягивании из банки, а затем вытянуть ее из электролита и любой линейкой измерить уровень.
Эту операцию можно провести с помощью обычного листа бумаги, который следует свернуть в трубочку и опустить на дно измеряемой емкости. При последующем измерении линейкой мокрого отпечатка на листе следует учесть величину погрешности, возникающую из-за капиллярного эффекта.
Если при измерениях обнаружен недостаток жидкости в какой-либо емкости батареи, тогда следует в нее добавить нужное количество дистиллированной воды.
Делать это следует осторожно, небольшими порциями, поскольку вода, попадая в кислоту, вызывает большое выделение теплоты и вскипание. Добавлять следует именно воду, а не электролит, в противном случае можно серьезно повредить электроприбор.
Подготовка электролита и батареи
Если старый аккумулятор вышел из строя и пришло время купить новый, то можно поступить двумя способами: во-первых, можно купить уже готовый залитый в АКБ электролит, во-вторых, можно приобрести сухозаправленную батарею и самостоятельно выполнить ее заливку. Первый способ рекомендуется для новичков, ко второму же методу следует прибегать, если прибор будет эксплуатироваться в каких-либо экстремальных условиях.
При подготовке раствора самостоятельно необходимо следующее:
- Канистра с дистиллятом, которая продается в каждом автомагазине, приобрести эту воду можно и в аптеке.

- Серная кислота h3SO4. Рекомендуется приобретать ее в разбавленном виде, то есть с плотностью 1,40 г/см3. Реже используется концентрированная кислота с плотностью 1,84 г/см3.
- Градуированная емкость, которую можно использовать, чтобы отмерять нужные порции жидкости.
- При приготовлении электролита его нужно будет мешать, поэтому следует запастись трубкой из химически инертного материала, например, из стекла или керамики.
- Резиновые перчатки, прозрачные очки, защитный фартук, старая одежда — основные средства индивидуальной защиты.
Во время приготовления раствора следует соблюдать элементарные правила химической безопасности, которые заключаются в добавлении воды в электролит не большими порциями, что может привести к вскипанию и разбрызгиванию во все стороны жидкости, а тонкой струей. При этом трубкой рекомендуется плавно перемешивать раствор.
Аккумуляторный электролит нужного состава готовится согласно инструкции на упаковке путем смешивания кислоты и дистиллята. В ряде случаев их объемы смешиваются в равных количествах. После завершения процедуры надо будет замерить плотность ареометром.
В ряде случаев их объемы смешиваются в равных количествах. После завершения процедуры надо будет замерить плотность ареометром.
В различных моделях автомобилей используют АКБ разного объема, вариации которого составляют от 2,6 до 3,7 л. В любом случае электролит можно приготовить с запасом, а оставшийся раствор необходимо нейтрализовать, бросив в него несколько ложек пищевой соды.
Как только рабочий раствор подготовлен, его нужно залить во все емкости батареи. Использовать для этого нужно либо стеклянную воронку, либо стеклянную кружку с удобным носиком. Процесс заполнения банок прибора следует проводить аккуратно и не спеша.
Заполнение производят до уровня, когда свинцовые пластины поднимаются над поверхностью электролита на 1−1,5 см. Затем прибор оставляют на 3−4 часа, при этом плотность раствора может незначительно уменьшиться.
Через несколько часов после заправки АКБ заряжают. Выполняется это так: на корпусе батареи проверяется значение емкости в Ампер-часах, это число делится на 10, и полученную величину уже используют для установления тока зарядки. Например, если емкость батареи составляет 80 А*ч, тогда ток для ее зарядки равен 8 А. Заряжать следует в течение 4 часов, после чего замеряются значения плотности и уровня электролита, и если они соответствуют рабочим величинам, тогда аккумуляторная батарея готова к использованию.
Правильный и безопасный заряд аккумулятора — как и чем заряжать? | Статьи
Как правильно и безопасно зарядить авто (мото) свинцово-кислотный аккумулятор.
Сразу оговоримся — настоящая статья предназначена для неподготовленных людей, аккумуляторщики и опытные пользователи вряд ли почерпнут для себя что-то новое.
Не отвлекаясь на второстепенные моменты, мы постараемся донести до читателей статьи базовые основы заряда аккумулятора и поможем выбрать правильное зарядное устройство.
Какие существуют методы заряда.
1. Заряд постоянным током.
Заряд производится при установленном значении зарядного тока (измеряется в Ампер) без ограничения напряжения (измеряется в Вольт). Пример устройства, обеспечивающего данный способ заряда – классический тяжелый трансформаторный зарядник – выпрямитель. Величина зарядного тока и длительность заряда определяются исходя из значения емкости, технологии изготовления и состояния аккумулятора. Ограничить напряжение при таком способе заряда возможно только вручную, уменьшением значения тока. Данный способ используется как правило профессиональными аккумуляторщиками и рекомендуется только для опытных пользователей.
2. Заряд при постоянном напряжении.
Заряд производится при заданном постоянном значении напряжения. Ток может быть ограничен возможностями и настройками зарядного устройства (пользователем). Пример устройства, обеспечивающего данный способ заряда – автомобильный реле-регулятор. Современные продвинутые реле-регуляторы способны менять напряжение заряда по алгоритмам, установленным автопроизводителями, но суть от этого не меняется – заряд все равно происходит при постоянном напряжении.
3. Заряд смешанным методом.
Первый этап заряда производится методом постоянного тока установленным (ограниченным) значением тока до достижения заданного значения напряжения (предустановлено в зарядном устройстве или ограничено пользователем). Второй этап начинается по достижении заданного напряжения, зарядный ток стабилизируется и его значение начинает падать, по сути на данном этапе заряд уже идет при постоянном напряжении. Правильный заряд этим так называемым смешанным методом могут обеспечить современные импульсные зарядные устройства, но только те, которые имеют функцию ограничения напряжения значением, подходящим для технологии изготовления и состояния конкретно взятого аккумулятора. Данный способ (метод) и подходит больше всего обычному, неопытному пользователю, которому надо при проведении заряда учесть состояние своего аккумулятора и технологию его изготовления, а также уяснить ряд нехитрых правил проведения заряда. Ну и, конечно, надо иметь правильное зарядное устройство.
Необходимо уяснить, что ресурс батареи снижают три основных явления:
– Оплывание (осыпание) активной массы, которое происходит при перезаряде либо в процессе естественного механического износа. Данное явление носит необратимый характер, лечению не подлежит, при критическом уровне данного процесса батарея подлежит замене.
— Сульфатация, т.е. образование кристаллов сульфата свинца на пластинах в процессе разряда АКБ. Сульфат всегда присутствует в любой батарее, его образование и растворение – это естественный рабочий процесс, происходящий при разряде-заряде батареи. Кристаллы сульфата могут быть небольшими и легко растворимыми, при хроническом недозаряде они становятся крупными и тяжело растворимыми. Данное явление носит обратимый характер, но чем старее в батарее сульфат, тем тяжелее его растворить, тем больше усилий придется для этого приложить и больше действий совершить.
— Расслоение электролита (кислотная стратификация). Электролит состоит из воды и серной кислоты, причем кислота физически тяжелее воды. В процессе заряда сульфат растворяется и кислота снова попадает в электролит, причем стремится стечь по пластинам в нижнюю часть корпуса АКБ. Данное явление наиболее усиливается в разряженных батареях и наименее характерно для тех АКБ, в которых разряд незначительный и своевременно восполняется. Устраняется расслоение электролита путем доведения заряженной батареи до состояния, при котором происходит ее интенсивное «кипение», т.е. электролиз, разложение воды на кислород и водород.
Вышеперечисленные явления как правило идут рука об руку, и эксплуатация АКБ с застарелым сульфатом приводит к ускоренному осыпанию рабочей не покрытой сульфатом активной массы (нерабочая осыпающаяся активная масса называется шламом) и повышенному расходу воды из АКБ, все это сопровождается расслоением электролита. Это происходит потому, что крупные кристаллы сульфата уменьшают площадь пластин, на которой происходит химическая реакция, оставшаяся рабочая активная масса подвергается более высокой нагрузке, все больше зарядного тока бесполезно тратится впустую на электролиз – разложение воды на кислород и водород. Соответственно, чем больше в АКБ застарелого сульфата, тем быстрее происходят описанные негативные процессы и все ближе утилизация АКБ.
Правильный и полноценный заряд проводится при температуре АКБ, равной комнатной. Но начинать заряд вполне можно при любой температуре АКБ.
Если нам нужно зарядить исправный аккумулятор, который имеет свежий незначительный разряд, скажем, не более 50 % от емкости, достаточно будет ограничить напряжение окончания заряда 14,8 – 15 Вольт, зарядный ток ограничиваем значением, не превышающем 10 % от номинальной емкости аккумулятора. Свидетельством окончания заряда будет служить падение зарядного тока до значения 0,5 – 1 Ампер. Наличие пробок на аккумуляторе позволит окончательно убедиться в окончании заряда путем измерения контроля уровня электролита и его плотности, которая должна достичь заводской – 1,27 – 1,31 г/см3.
Если требуется зарядить аккумулятор с полностью разряженного состояния, либо есть сомнения относительно его исправности или есть необходимость в сезонном профилактическом заряде, целесообразно применить несколько иной алгоритм заряда, разделив заряд на два этапа.
На первом этапе, не нагружая активную массу на пластинах, проводим заряд током, не превышающем 10 % емкости АКБ, ограничив напряжение безопасным значением, не более 14,4 – 14,8 Вольт. Перед зарядом необходимо убедиться, что уровень электролита достаточен, чтобы были закрыты пластины, при необходимости долить дистиллированную воду. Доводить уровень до исходного на первом этапе не нужно, так как в процессе заряда он может подняться и есть риск получить избыточный уровень электролита. Если батарея была глубоко разряжена или долго эксплуатировалась в состоянии хронического недозаряда, лучше значение тока выставить как можно меньше, вплоть до 1 % от емкости. Чем меньше значение зарядного тока, тем качественнее и полнее происходит заряд. На первом этапе задача состоит в том, чтобы максимально полно восполнить емкость батареи без избыточной нагрузки на активную массу на решетках. Индикатор окончания первого этапа заряда – падение зарядного тока до значения менее 1 Ампер, чем меньше, тем лучше.
На втором, самом важном этапе заряда, нужно решить две основные задачи – растворить застарелый сульфат и устранить расслоение электролита. При наличии неравномерного и/или недостаточного уровня электролита также добавляется задача выровнять уровень и плотность электролита во всех банках. В таком случае второй этап заряда также называется уравновешивающим, или выравнивающим зарядом.
Необходимо тщательно выровнять уровень электролита дистиллированной водой. И довести его до уровня заводского, который в разных АКБ составляет от 1,5 до 3 см. Проще, если в АКБ есть какие-либо физические индикаторы в виде, например, пластиковых лапок-ограничителей. Если нет, нужно найти информацию в руководстве или на сайте завода-производителя.
Устанавливаем такие параметры заряда, которые обеспечат интенсивное газовыделение из электролита, т.е «кипение». Напряжение, при котором будет интенсивно кипеть АКБ по технологии Са/Са, составляет примерно 15,5 — 16 Вольт, выставляем 16, гибридная Sb/Ca – 15,3 – 15,6 Вольт, выставляем 15,5 – 15,7 Вольт, для сурьмянистых должно хватить 15 Вольт. Величину зарядного тока лучше ограничить 1 – 5 % от емкости АКБ, причем чем более «запущена» батарея, тем меньше зарядный ток есть смысл выставить, заданное напряжение при этом будет достигаться конечно же дольше.
Положительный результат можно будет считать достигнутым, если зарядный ток после достижения заданного напряжения упал до 1 Ампер и ниже, плотность электролита достигла исходного значения 1,27 – 1,31 г/см3 (необходимо знать заводские параметры плотности), стала равномерной во всех банках, и значение плотности не меняется на протяжении двух – трех часов. Даже если за короткое время зарядный ток упал до низкого значения (0,5 – 1 Ампер), заряд все равно целесообразно продолжить на протяжении нескольких часов для устранения кислотной стратификации. Если положительный результат не достигается на протяжении многих часов, если по плотности «отстают» некоторые банки, можно поднять напряжение заряда на 0,1 – 0,3 Вольт. Иногда можно и даже нужно поднять ток и напряжение заряда и выше, или вообще снять ограничение по напряжению, но, повторяемся, наша статья для неопытных пользователей, данные действия Вы будете осуществлять на свой страх и риск.
Если описанные действия не привели к нужному результату, отдайте АКБ в квалифицированный сервис или замените на новую. Либо выжмите из нее оставшийся ресурс и потом замените.
Если у Вас АКБ с лабиринтной крышкой без пробок, отрегулировать уровень электролита без «колхозинга» не получится, поэтому нужно хотя бы попытаться убедиться, что он есть, путем просвечивания АКБ мощным источником света. Такие батареи, несмотря на то, что маркетологи назвали их «необслуживаемыми», как раз таки очень нуждаются в своевременной правильной дозарядке, потому что полностью заряженная исправная кальциевая АКБ практически не расходует воду, и уровень электролита в ней долгое время остается ровным и стабильным.
Особенности заряда батарей по технологии Са/Са EFB.
Заряд аккумуляторов EFB производится так же, как и обычных кальциевых. Нужно только учесть одну особенность — в правильных EFB пластины толще и скомпонованы плотнее, расстояние между ними меньше, по этой причине электролит в них перемешать тяжелее, плотность в верхних слоях батареи может подниматься дольше. Будьте готовы к тому, что второй этап заряда на повышенном напряжении возможно придется производить дольше, напряжение поднимать выше.
Особенности заряда батарей по технологии AGM, GEL.
А вот AGM и GEL технологии заряжать с применением высоких значений напряжения крайне нежелательно. Ввиду того, что в них отсутствует электролит в жидком виде, кислотная стратификация как таковая отсутствует, перемешивать электролит не нужно, и избыточное напряжение приведет к безвозвратной утрате воды. Поэтому заряжать их следует в один этап с ограничением напряжения 14,3 — 14,4 Вольт. Если результат не достигнут, можно попробовать поднять напряжение заряда до 15 Вольт, но долго скорей всего такая батарея уже не прослужит. Глубокий разряд такие батареи переносят намного хуже классических, и вероятность их восстановления после глубокого разряда намного ниже. Их «конек» — цикличность, т.е. работа в режиме многократного частичного разряда-заряда. Но никак не глубокого разряда. Поэтому задача пользователя при эксплуатации таких батарей — не допускать их разряда и своевременно его восполнять.
Ну и собственно, какое зарядное устройство выбрать?
Полноценное зарядное устройство, которое позволит правильно зарядить аккумулятор, изготовленный по любой технологии, должно иметь регулировку не только зарядного тока, но и, что самое важное, напряжения заряда. Причем крайне желательно, чтобы регулировка была плавной (особенно для зарядного тока) и как можно более широкими диапазонами. Допустима ступенчатая регулировка напряжения заряда, лишь бы этого самого напряжения хватало для правильного заряда. Также важно, чтобы зарядное устройство без «разрешения» пользователя не переходило по окончании заряда в так называемый буферный режим (хранение аккумулятора при пониженном напряжении с компенсацией саморазряда), это препятствует полноценному окончанию заряда и «добивке» емкости до 100%.
Примером полноценного импульсного зарядного устройства, которое способно полностью заменить старый трансформаторник — выпрямитель, является «Вымпел-57» производства ООО «НПП «ОРИОН», либо более продвинутая «интеллектуальная» его версия — «Вымпел-55».
Ну и конечно, старое доброе трансформаторное зарядное устройство — выпрямитель, способное заряжать методом постоянного тока без ограничения напряжения, но, на наш взгляд, это инструмент скорее для опытного и умелого пользователя.
Помните, что своевременный и правильный профилактический заряд как минимум в два – три раза продлит ресурс Вашего аккумулятора!
Сравнение трубчатых и плоских пластин в свинцово-кислотных аккумуляторах
С момента изобретения свинцово-кислотной батареи Гастоном Планте, в 1860 году, производители батарей неустанно стремились к улучшению способов сохранения большего количества электрической энергии.
Между 1881 и 1892 годами, произошло стремительное развитие области конструкции решётки и формуле активной материала. Кроме того, технологические достижения в области техники и зарядного оборудования привели к улучшению более эффективных производственных процессов.
Принято считать, что технология трубчатой пластины развивалась в аналогичные сроки, что и технология плоской пластины. Интересно заметить, однако, что АКБ с трубчатыми пластинами, похоже, получили широкое признание в рамках Европейского сообщества, а также, в азиатских странах, которые были связаны с великими империями Европы на рубеже века. Целью данного документа является сравнение и различия особенностей и преимуществ плоских и трубчатых пластин в АКБ. Мы рассмотрим конструктивные и структурные различия, а также производительность и характеристики жизненного цикла. Наконец, укажем различия в зарядных характеристиках и техническом обслуживании.
Конструкция положительной пластины
Электролитическая ячейка, по определению, состоит из двух разнородных металлов, погруженных в электролит. В свинцово-кислотной ячейке, положительный электрод или анод, состоит из двуокиси свинца (PbO2) и является рабочей лошадкой батареи. Отрицательная пластина состоит из губчатого свинца (Pb). В обоих батареях с трубчатыми и плоскими пластинами, отрицательные пластины идентичны по внешнему виду и функциональности. Все отличия заключаются в дизайне и конструкции положительной пластины.
На Рисунке 1 показана типичная конструкция трубчатой пластины. Коллектор тока состоит из серии сердцевин, которые простираются вниз от верхней панели и называются «гребень». Параллельные трубки, или «перчатка», которые окружают сердцевину и сохраняют активный материал, сделаны из пористого, инертного материала. После заполнения, закручивается крышка в нижней части трубки, чтобы предотвратить потерю активного материала.
Плоская положительная пластина состоит из решётки и активного материала. Решётка отлита из сплава свинца и сурьмы. Горизонтальные и вертикальные линии называются «проволока» и подсоединены к «рамке». Как показано на Рисунке 2, активное вещество, при запрессовке в решётку, механически взаимодействует с сеткой из проволоки и рамки. Этот процесс экструзии также дает плоские поверхности по обе стороны пластины.
Основная цель конструкции обеих трубчатых и плоских пластин — равномерное распределение плотности активного материала в пластине. Если плотность слишком высокая, производительность будет снижена. Низкая плотность приводит к преждевременной потере мощности и уменьшает время автономной работы.
Производительность и срок службы
Время работы аккумуляторной батареи можно охарактеризовать различными критериями, ни один из которых следует рассматривать отдельно от другого, как основу для принятия решения о покупке. Следующие графики зависимости ёмкости от количества циклов наглядно демонстрируют различия между батареями с плоскими и трубчатыми пластинами.
При производстве свинцово-кислотной батареи, активное вещество в положительной пластине преобразуется в диоксид свинца (PbO2). Двуокись свинца существует в двух формах, альфа и бета. Соотношение альфа и бета PbO2 в готовой пластине во многом зависит от состава активной пасты и процессов отверждения.
Сегмент А на Рисунке 3 показывает постепенное увеличение ёмкости в течение многих циклов, при котором характерна высокая концентрация альфа-PbO2. График для трубчатых пластин показывает резкий, быстрый рост мощности в течение нескольких циклов, и является типичным активного материала с высоким содержанием бета-PbO2. Следует также отметить, что после достижения максимальной производительности, постепенное снижение ёмкости начинается в батареях с трубчатыми пластинами с высоким содержанием бета-PbO2. Это снижение ёмкости продолжается сегменте В графика, в котором, также как и в батарее с плоскими пластинами, полная производительность сохраняется на протяжении всего этого периода.
Батареи с плоскими пластинами начинают испытывать возрастные потери ёмкости в сегменте С, примерно в то же время аккумулятор с трубчатыми пластинами достигает конца срока его полезного использования.
Типичная причина выхода из строя в конце срока жизни батарей плоскими пластинами — ухудшение структурной целостности активного вещества в результате поглощения Альфа-PbO2 и повреждения решётки, в результате непрерывного коррозионного процесса в процессе заряда. Хотя сердцевины трубчатых пластин подвергаются тем же коррозионным процессам, как и решётки плоских пластин, нормальная причина отказа трубчатых аккумуляторах, связана с осыпанием активного материала. В конце заряда, газообразование является причиной того, что несвязанный положительный активный материал вступает в контакт с отрицательным электродом в результате формирования мохообразного губчатого свинца. «Мохообразование» это обычно приводит к короткому замыканию и преждевременному выходу из строя. Из-за физической нагрузки на трубки от разряда и заряда, в конце концов трубки разрываются и активный материал осыпается с положительной пластины. Вот почему батареи с трубчатыми пластинами, могут иметь в два раза больший лоток для осадка, чем соответствующие батареи с плоскими пластинами.
Заряд и обслуживание
Оптимальные производительность батареи и срок службы в значительной степени зависят от правильного заряда и обслуживания. Как уже говорилось ранее, активное вещество в положительном электроде батареи любого из двух типов — это двуокись свинца, продукт коррозии, схожий со ржавчиной (оксид железа). Скорость, с которой коррозия происходит в свинцово-кислотной батарее, связана с током конца заряда, необходимым для восстановления полного заряда батареи.
Наиболее очевидное преимущество трубчатой конструкции пластины по сравнению с плоской пластиной — более высокая удельная энергия. Удельная энергия — зависимость между энергоёмкостью батареи в час по отношению к весу батареи.
Такие преимущества, однако даром не обходятся. Малый диаметр сердцевин и снижение активной массы приводят к большему внутреннему сопротивлению. Это значит, что необходимо больше ватт-часов перезаряда для восстановления полного заряда батареи с трубчатыми пластинами. Далее, большой отсек для осадка на дне элемента с трубчатыми требует больше ватт-часов заряда, чтобы облегчить перемешивание электролита во время перезаряда после разряда. Если достаточный над перезаряд не достигнут, происходит процесс, известный как расслоение при котором концентрация сульфат-ионов а в нижней части элемента во время перезаряда возрастает. Газообразование, которое увеличивается в конце заряда, приводит к тому, что высококонцентрированный раствор кислоты равномерно равномерно распределяется по раствору электролита.
Когда время заряда имеет решающее значение, может потребоваться более высокое напряжение в конце заряда для полного заряда трубчатого аккумулятора. Лабораторные тесты показали, что полная производительность батареи с плоскими пластинами достигается, когда напряжение в конце заряда достигло в среднем 2,58 вольт на элемент. В то время как у батарей с трубчатыми пластинами, напряжение в конце заряда требовалось довести до 2,68 вольт на элемент, для достижения оптимальной производительности. Это более высокий потенциал перенапряжения в батарей с трубчатыми пластинами, в сочетании с более высокими токами, как правило, приводит к большей скорости коррозии гребня из свинцового сплава и увеличению потерь воды из раствора электролита.
Общепринятая рутинная практика обслуживания не сильно отличается у батарей с плоскими и трубчатыми пластинами. Полезно периодически проверять напряжение в элементах и конкретные значения удельной плотности, в дополнение к проверке правильной работы зарядного устройства. Кроме того, батареи нужно периодически очищать — удалять любую кислотно-насыщенную грязь и мусор, которые могут накапливаться на крышке аккумулятора.
Лабораторные испытания подтверждают, что потребление воды в батареях с трубчатыми пластинами было значительно больше, чем в аккумуляторах Trojan с плоскими пластинами — почти вдвое больше за срок службы батареи. Это, в свою очередь, предполагает, что расходы на техническое обслуживание батарей с трубчатыми пластинами, как правило, больше.
Заключение
Сторонники обеих конструкций спорят о возможных преимуществах их своих любимых технологий на протяжении десятилетий. Конечно, батареи с трубчатыми пластинами, как правило, превосходят в удельных энергетических показателях. Значит, соотношение ватт в час на фкилограмм больше у батарей с трубчатыми пластинами, чем в конструкциях с плоскими пластинами Конструкции с плоскими пластинами являются более надежными. То есть в них больше запас металла решётки и активного вещества, в результате чего получаем более тяжелые батареи при эквивалентной мощности ватт-час. Более тяжёлые решётки и большее количество активного материала удлиняют характеристика жизненного цикла, что снижает затраты, связанные с частой заменой. Малое потребление воды снижает себестоимость обслуживания.
Кроме того, опыт показал, что батареи с плоскими пластинами гораздо лучше держат напряжение при высокой скорости разрядов, например, когда погрузчик поднимающий тяжелые поддоны в ходе нормальной рабочей смены. Это связано с большей массой активного материала и больших проводников плоской пластины. Выбор аккумулятора лучше всего проводить для конкретной задачи и должен быть основан в значительной степени на соображения, которые обсуждались выше. Анализ требований и надлежащих размеров должен быть проведен прежде оценки конструкции батарей.
Наверх↑
В чем различия между кислотными и щелочными аккумуляторами?
На складах и заводах, как всем известно, большой объём работы, грузы всевозможной весовой категории, зачастую без подъёмной техники, например, погрузчиков или штабелеров, просто не обойтись. Данная техника работает благодаря тяговым аккумуляторам, стоит заметить, что тяговые батареи подразделяются на несколько наиболее известных видов – кислотные, щелочные и литий-ионные. Однако, сегодня мы разберем основные отличительные особенности между щелочными и кислотными аккумуляторами.
Для начала разберем устройство каждого из представленных аккумуляторов.
Устройство кислотного аккумулятора. Первое, на что стоит обратить внимание, это то, что тяговый кислотный аккумулятор, как правило, состоит из двух групп свинцовых пластин, которые по своему внешнему виду напоминают решётку, при этом сами пластины помещены в серную кислоту.
Теперь рассмотрим устройство щелочного аккумулятора. В данном типе, в основном используются никелевые или железные пластины, которые помещены в раствор едкого калия. Пластины изготавливаются из никелированного железа, с большим количеством отверстий. В качестве электролита у щелочных тяговых аккумуляторов выступает раствор щёлочи.
Одним из немаловажных факторов в сравнении двух вышеперечисленных батарей является – переносимость нагрузок.
В этом вопросе отдельно стоит выделить кислотный тип батарей, так как напряжение одного аккумулятора составляет 2 В., когда как, у щелочных всего 1,25 В. (Не стоит забывать, что батарея состоит из аккумуляторов. Модели батарей могут состоять из различного количества аккумуляторов, которые, чаще всего встречаются в диапазоне от 6 до 48 штук.)
Но при этом, при больших отрицательных температурах щелочные батареи свои свойства сохраняют гораздо лучше, нежели кислотные. Сохранение данных свойств во многом зависит от должного обслуживания батареи, а также необходимой качественной подзарядкой. Информируем о том, что устройство зарядки для щелочных батарей довольно таки дорогостоящее. Чтобы зарядное устройство работало гораздо дольше, нужно помнить о том, что щелочные аккумуляторы не стоит доводить до глубокой разрядки и зарядки, всё должно быть в меру.
Далее поговорим об одном из главных критериев в сравнении щелочных и кислотных батарей – срок службы!
В данном вопросе предпочтение с лёгкостью можно отдать щелочным видам батарей. Как мы ранее говорили, щелочные типы при долгом простое сохраняют свои свойства и характеристики эффективнее кислотных. Стойкость никель-железных пластин щелочной батареи гораздо лучше, нежили кислотной, у которой пластины более хрупкие, так как изготавливаются они из свинца с добавками сурьмы. За счёт этого, они подвержены ломкости, соответственно, к кислотным видам батарей стоит относится бережно.
Так же нельзя оставить без внимания моменты по уходу за каждым типом АКБ.
Сначала разберем кислотные батареи:
- Ни в коем случае нельзя оставлять разряженный АКБ более, чем на сутки. Если все же планируется простой, то при дальнейшем хранении батареи необходимо сделать следующее – аккумулятор следует немного разрядить, затем слить старый электролит и, желательно, промыть пластины дистиллированной водой.
- Заряд батареи не должен падать ниже 1,8 В.
- Зарядка аккумулятора происходит при открытых банках, до того момента пока в каждый не начнёт одинаково кипеть электролит.
- Если ваш заряженный аккумулятор некоторое время был в инертном состоянии, то через некоторое время его следует подзарядить.
Основные моменты по эксплуатации щелочных АКБ:
- При зарядке щелочной батареи крышки необходимо обязательно снимать для того, чтобы не допустить перегрева и, как следствие, разрушение аккумулятора. Соответственно, после полной зарядки, их нужно поставить на место.
- Заряд аккумулятора не должен падать ниже 1,1 В.
- По истечении каждого года во время эксплуатации необходимо заново заливать электролит, а в течение года подливать дистиллированную воду.
- Если заряженная батарея некоторое время была в инертном состоянии, то через некоторое время её необходимо подзарядить.
И самое главное, на что обращают свое внимание большинство пользователей батарей – это ценовая политика.
В данном вопросе предпочтение отдаётся кислотным видам аккумуляторов за счёт своей низкой стоимости. Во внимание можно взять даже тот фактор, что они намного лучше переносят сильную разрядку и, соответственно, зарядку с нуля. Поэтому им не нужны особенные или специальные зарядки, а подойдут самые обыкновенные и дешёвые.
Пришла пора делать выводы всему вышеперечисленному – если у вас производство не стоит на месте, и соответственно, вы проводите обслуживание батареи на регулярной основе, то кислотный аккумулятор определенно вам подойдет. Если все же на производстве случаются простои, а батарея обслуживается не регулярно, то лучше приобрести щелочной аккумулятор!
Электролиты — Химия LibreTexts
Одним из важнейших свойств воды является ее способность растворять самые разные вещества. Растворы, в которых вода является растворяющей средой, называются водными растворами . Для электролитов вода является наиболее важным растворителем. Этанол, аммиак и уксусная кислота являются одними из неводных растворителей, способных растворять электролиты.
Электролиты
Вещества, которые при растворении в воде выделяют ионы, называются электролитами .Их можно разделить на кислоты, основания и соли, потому что все они при растворении в воде дают ионы. Эти растворы проводят электричество благодаря подвижности положительных и отрицательных ионов, которые называются катионами и анионами соответственно. Сильные электролиты полностью ионизируются при растворении, и в растворе не образуются нейтральные молекулы.
Например, \ (\ ce {NaCl} \), \ (\ ce {HNO3} \), \ (\ ce {HClO3} \), \ (\ ce {CaCl2} \) и т. Д. Являются сильными электролитами.-_ {\ large {(aq)}}} \)
Поскольку \ (\ ce {NaCl} \) представляет собой ионное твердое вещество (s), которое состоит из катионов \ (\ ce {Na +} \) и анионов \ (\ ce {Cl -} \), молекулы \ (\ ce {NaCl} \) присутствуют в \ (\ ce {NaCl} \) твердом или \ (\ ce {NaCl} \) растворе. -]} {[H_2O]}} \)
Для чистой воды \ (\ ce {[h3O]} \) — постоянная величина (1000/18 = 55.+] = 7} \).
Обратите внимание, что только при 298 K pH воды равен 7. При более высоких температурах pH немного меньше 7, а при более низких температурах pH больше 7.
Электролиты в жидкостях организма
Жидкости нашего тела — это растворы электролитов и многое другое. Комбинация крови и кровеносной системы — это река жизни , потому что она координирует все жизненные функции. Когда сердце перестает биться при сердечном приступе, жизнь быстро заканчивается.Чтобы сохранить жизнь, крайне важно перезапустить сердце как можно скорее.
Основными электролитами, необходимыми в жидкости организма, являются катионы (кальция, калия, натрия и магния) и анионы (хлоридов, карбонатов, аминоацетатов, фосфатов и йодида). Они называются макроминералами .
Баланс электролитов имеет решающее значение для многих функций организма. Вот несколько крайних примеров того, что может случиться при дисбалансе электролитов: повышенный уровень калия может привести к сердечной аритмии; снижение внеклеточного калия вызывает паралич; чрезмерное количество внеклеточного натрия вызывает задержку жидкости; снижение содержания кальция и магния в плазме может вызвать мышечные спазмы конечностей.
При обезвоживании пациента для поддержания здоровья и благополучия требуется тщательно приготовленный (имеющийся в продаже) раствор электролита. С точки зрения здоровья ребенка пероральный электролит необходим, когда ребенок обезвоживается из-за диареи. Использование растворов для поддержания перорального электролита, благодаря которым за последние 25 лет были спасены миллионы жизней во всем мире, является одним из самых важных медицинских достижений в защите здоровья детей в этом веке, — объясняет Юилус Г.К. Гепп, доктор медицины, помощник директора отделения неотложной помощи детского центра при больнице Джона Хопкинса. Если родитель дает поддерживающий раствор электролита для приема внутрь в самом начале болезни, обезвоживание можно предотвратить. Функциональность растворов электролитов связана с их свойствами, и интерес к растворам электролитов выходит далеко за рамки химии.
Электролиты и батареи
Растворы электролитов всегда требуются в батареях, даже в сухих элементах .- \ rightarrow Cu _ {\ large {(s)}}} \)
В сухих ячейках раствор заменяют пастой, чтобы раствор не вытек из упаковки. В этой ячейке электроды \ (\ ce {Zn} \) и \ (\ ce {Cu} \) имеют напряжение 1,10 В, если концентрации ионов соответствуют указанным.
Химические реакции электролитов
При объединении растворов электролитов катионы и анионы встретятся друг с другом. Когда ионы безразличны друг к другу, реакции нет.Однако некоторые катионы и анионы могут образовывать молекулы или твердые тела, и, таким образом, катионы и анионы меняют партнеров. Это так называемые реакции метатезиса, которые включают:
- Образование твердого вещества реакции (или осаждения): катионы и анионы образуют менее растворимое твердое вещество, в результате чего появляется осадок.
- Нейтрализация реакции: \ (\ ce {H +} \) кислоты и \ (\ ce {OH -} \) основания объединяются с образованием нейтральной молекулы воды.
- Газообразование реакции: Когда в результате реакции образуются нейтральные газообразные молекулы, они покидают раствор, образуя газ.2 +} \)
- \ (\ ce {Na +} \)
- любой анион
- Движутся ли положительные ионы в солевом мостике?
- Какой раствор следует использовать для электрода \ (\ ce {Cu} \) ?
- любая соль цинка
- любая медная соль
- любой хлорид
- любая соль
- кислота
- базовый
- Что из следующего вы будете использовать в качестве соляного моста?
- твердый \ (\ ce {NaCl} \)
- концентрированный \ (\ ce {NaCl} \) раствор
- \ (\ ce {HNO3} \) раствор
- концентрированный \ (\ ce {h3SO4} \) раствор
- деионизированная вода
- любая твердая соль
- Какой из следующих растворов лучше всего проводит электричество? Все растворы имеют одинаковую концентрацию в М.
- спирт
- аммиак
- сахар
- уксусная кислота
- соль поваренная
- Какой из следующих растворов имеет самый высокий pH?
- 0,10 M \ (\ ce {NaCl} \) раствор
- 0,10 M \ (\ ce {HCl} \) раствор
- Вода при 273 K (точка замерзания воды)
- Вода при 293 K (комнатная температура)
- Вода при 373 K (точка кипения воды)
- При объединении растворов электролитов катионы и анионы обмениваются партнерами. Эти реакции называются:
- реакции горения
- окислительно-восстановительные реакции
- реакции окисления
- реакции восстановления
- реакции метатезиса
- Регулируйте уровень жидкости в плазме крови и в организме.
- Поддерживайте pH (кислотный / щелочной) вашей крови в пределах нормы (7.35-7,45, слабощелочная).
- Включите сокращение мышц, включая сердцебиение.
- Передает нервные сигналы от сердца, мышц и нервных клеток к другим клеткам.
- Помогает свертыванию крови.
- Помогите создать новую ткань.
- Потеря жидкости в результате постоянной рвоты или диареи, потоотделения или лихорадки.
- Недостаточно пить или есть.
- Хронические респираторные проблемы, такие как эмфизема.
- pH крови выше нормы (состояние, называемое метаболическим алкалозом ).
- Лекарства, такие как стероиды, мочегонные и слабительные средства.
- NaCl (s) → Na + + Cl —
- 2H 2 O + 2e — → 2OH — + H 2
- 2H 2 O → O 2 + 4H + + 4e —
- В электрической батарее в качестве электродов используются два металла с разным сродством к электрону. Электроны текут от одного электрода к другому вне батареи, в то время как внутри батареи цепь замыкается ионами электролита.Здесь электродные реакции медленно расходуют химическую энергию, запасенную в электролите.
- В некоторых топливных элементах твердый электролит или протонный проводник электрически соединяет пластины, сохраняя при этом водородный и кислородный топливные газы разделенными.
- В резервуарах для гальваники электролит одновременно наносит металл на покрываемый объект и электрически соединяет этот объект в цепи.
- В часовых манометрах два тонких столбика ртути разделены небольшим зазором, заполненным электролитом, и по мере прохождения заряда через устройство металл растворяется с одной стороны и отслаивается с другой, образуя видимый зазор. медленно двигаться вперед.
- В электролитических конденсаторах химический эффект используется для создания очень тонкого «диэлектрического» или изолирующего покрытия, в то время как слой электролита ведет себя как одна пластина конденсатора.
- В некоторых гигрометрах влажность воздуха определяется путем измерения проводимости почти сухого электролита.
- Горячее размягченное стекло является проводником электролита, и некоторые производители стекла поддерживают его в расплавленном состоянии, пропуская через него большой электрический ток.
- Chernecky, Cynthia C., Дениз Маклин и Кэтлин Мерфи-Энде. 2006. Жидкости и электролиты. Руководство по выживанию медсестер Сондерса. Сент-Луис: Эльзевьер Сондерс. ISBN 978-1416028796
- Джонсон, Джойс Янг, Эдвард Лайонс и Беннита В. Воганс. 2008. Жидкости и электролиты демистифицированы. Нью-Йорк: McGraw-Hill Medical. ISBN 9780071496247
- Престон, Ричард А. 1997. Кислотная основа, жидкости и электролиты стали до смешного простыми. Серия MedMaster. Майами: MedMaster, Inc.ISBN 0940780313.
- Натрий (Na +)
- Калий (K +)
- Кальций (Ca2 +)
- Магний (Mg2 +)
- Хлорид (Cl-)
- Фосфат водорода (HPO42-)
- Карбонат водорода (HCO3-).
Подсказка: e. любой анион
Навык:
Объяснять движение ионов в растворе электролитов.
Подсказка: да
Ионы двух типов движутся в противоположных направлениях.
Навык:
Объяснять движение ионов в растворе электролитов.
Подсказка: б. любая соль меди
В качестве \ (\ ce {Zn} \) — электрода можно использовать любую соль. Но для электрода \ (\ ce {Cu} \) обычно используется \ (\ ce {CuSO4} \) или \ (\ ce {CuCl2} \).
Навык:
Применять химические знания при установке батарей.
Подсказка: б.\ (\ ce {NaCl} \) раствор
Обычно используется солевой раствор, но подойдут и растворы кислот и щелочей. \ (\ ce {NaCl} \) раствор экономичен и прост в обращении.
Подсказка: e.поваренная соль
Навык:
Различать сильные и слабые электролиты.
Намек: ок.вода низкой температуры
См. PH.
Навык:
Определение и оценка pH.
См. Редокс.
Навык:
Объяснять реакции метатезиса.
электролитов — что это такое? Что произойдет, если у вас мало?
Он проснулся в луже пота, с онемевшими ногами и сокрушительной болью в груди.
Врачи скорой помощи исключили инфаркт и сердечно-сосудистые заболевания. Ему стало лучше, но онемение в ноге осталось. Желая понять, что произошло, он спросил специалистов, что он может сделать, чтобы предотвратить еще один пугающий эпизод. «Выпейте Pedialyte ® , — сказали ему, — и сократите потребление зеленого чая.”
Странный совет? Вот объяснение: его электролитов вышли из равновесия, поэтому ему нужно было принять их больше (выпив Педиалит, который содержит электролиты) и прекратить вымывать их из своего тела (зеленый чай — мочегонное средство — вещество что заставляет вас чаще мочиться).
Жидкости и электролиты необходимы для правильной работы наших клеток, органов и систем организма. Электролиты — это электрически заряженные минералы и соединения, которые помогают вашему организму выполнять большую часть своей работы, например, производить энергию и сокращать мышцы.Натрий, хлорид, калий и кальций — это все типы электролитов. (См. Дополнительные примеры в таблице ниже.) Мы получаем их от того, что мы едим и пьем. Уровни электролитов измеряются в анализах крови, и их уровни должны оставаться в довольно небольшом диапазоне, иначе могут возникнуть серьезные проблемы.
Что делают электролиты?
Электролиты:
Что может вызвать дисбаланс электролитов?
Дисбаланс электролита может быть вызван:
Чтобы обеспечить достаточное количество электролитов, избегайте обезвоживания и ешьте продукты, богатые электролитами, включая шпинат, индейку, картофель, бобы, авокадо, апельсины, соевые бобы (эдамаме), клубнику и бананы.
За исключением натрия * , маловероятно, что вы получите слишком много электролитов из своего рациона.(Риск может быть выше, если ваши почки плохо работают.) Однако добавки могут вызывать проблемы — например, слишком много кальция может увеличить риск образования камней в почках — поэтому всегда консультируйтесь с врачом, прежде чем начинать их принимать.
* Обработанные продукты и блюда в ресторанах могут содержать очень много натрия.
| Название Символ / заряд | Нормальный диапазон * | Банкноты |
|---|---|---|
| Натрий Na + Гипонатриемия Гипернатриемия | 135-145 | У пожилых людей с хроническими заболеваниями с низким уровнем натрия будет больше симптомов, чем у молодых, здоровых людей с таким же низким уровнем натрия. |
Хлорид Cl — | 96-106 | Симптомы могут отсутствовать, если не происходят серьезные изменения уровня. Поскольку он тесно связан с натрием, у некоторых людей наблюдаются симптомы гипонатриемии (низкий уровень натрия в крови). |
Калий K + | 3.5-5,5 | Работает с натрием для поддержания водного и кислотно-щелочного баланса. С кальцием регулирует нервную и мышечную деятельность. |
Магний Mg +2 | 1,7–2,2 | В основном в костях, около 1% — в внеклеточной жидкости (жидкость тела вне клеток). Важен для ферментативных реакций. |
Кальций Ca +2 | 8,5-10,2 | 99% в зубах и костях. Кальций в крови ионизирован (несет электрический заряд) и помогает регулировать функцию клеток, частоту сердечных сокращений и свертываемость крови. Организму необходим витамин D для усвоения кальция. (Диапазон уровня ионизированного кальция составляет 4,7-5,28.) |
Фосфат / фосфор PO4 — | 2.5–4,5 | В анализах крови измеряется неорганический фосфат. Около 85% находится в костях; большая часть остального находится внутри клеток. Фосфат помогает строить / восстанавливать кости и зубы, накапливает энергию, сокращает мышцы и поддерживает работу нервов. Организму необходим витамин D для усвоения фосфора. |
* Диапазоны могут отличаться в зависимости от лаборатории.
Натрий
Низкое содержание натрия, также называемое гипо натриемия, вызывает перемещение воды в клетки.Высокий уровень натрия, или натриемия гипер , заставляет жидкость выходить из клеток. Когда что-либо из этого происходит в клетках мозга, это может вызвать изменения личности, головную боль, спутанность сознания и летаргию. Если падение натрия слишком велико, это может привести к судорогам, коме и смерти. Ключевым симптомом гипернатриемии является жажда.
Хлорид
Низкое содержание хлорида ( гипо хлоремия) может быть следствием чрезмерной рвоты, всасывания содержимого желудка или приема «петлевых» мочегонных препаратов, которые часто используются для лечения задержки жидкости, вызванной проблемами сердца или почек или высоким кровяным давлением.Высокое содержание хлоридов ( гипер хлоремия) часто является следствием диареи или заболевания почек.
Никогда не пропустите еще один блог Обсуждения рака!
Подпишитесь на нашу ежемесячную электронную рассылку Cancer Talk.
Зарегистрируйтесь!
Калий
Низкий уровень калия ( гипо калемия) может не вызывать симптомов, но он может повлиять на то, как ваше тело накапливает глюкоген (источник энергии для мышц), или вызвать нарушение сердечного ритма. Уровень ниже трех может вызвать мышечную слабость, спазмы, судороги, паралич и проблемы с дыханием.Если это продолжится, могут возникнуть проблемы с почками. Высокий уровень калия ( гипер калемия) может не вызывать никаких симптомов, хотя может наблюдаться мышечная слабость или нарушение сердечного ритма. Если уровень поднимется очень высоко, сердце может перестать биться.
Кальций
Низкий уровень кальция ( гипо, кальциемия) может не вызывать симптомов, но хронически низкие уровни могут вызывать изменения кожи, ногтей и волос; дрожжевые инфекции; и катаракта. По мере снижения уровня могут развиться мышечная раздражительность и судороги (особенно в ногах и спине).Кальций ниже семи вызывает изменения в ваших рефлексах (гиперрефлексия , ), мышечные спазмы, спазмы гортани (голосовой ящик) и судороги. Высокий уровень кальция ( гипер кальциемия) может не вызывать симптомов. По мере повышения уровня кальция могут возникать запор, потеря аппетита, тошнота, рвота, боль в животе, нервно-мышечные симптомы и непроходимость кишечника ( ileus ). Выше 12 лет возникают эмоциональные перепады, замешательство, бред и ступор. Выше 18 лет это может привести к шоку, почечной недостаточности и смерти. Стойкая или тяжелая гиперкальциемия может повредить почки и вызвать проблемы с сердцем, включая изменения ритма и сердечный приступ.
Магний
Низкий уровень магния ( гипо, магнеземия) может вызывать симптомы, похожие на низкий уровень калия или кальция. Чрезвычайно низкий уровень может быть опасным для жизни. Высокий уровень магния ( гипермагнезия ) может вызвать низкое кровяное давление, проблемы с дыханием (медленное, неэффективное дыхание) и проблемы с сердцем (остановка сердца).
Фосфат / фосфор
Низкий уровень фосфата ( гипо фосфатемия) может вызвать мышечную слабость, дыхательную недостаточность, сердечную недостаточность, судороги и кому.Это может быть вызвано очень плохим питанием, некоторыми мочегонными препаратами, диабетическим кетоацидозом / DKA , алкоголизмом и тяжелыми ожогами. (ДКА — серьезное осложнение диабета, при котором клетки сжигают жир вместо глюкозы. При этом образуются кетоны, которые попадают в кровь и превращают ее в кислую. Нормальная кровь слегка щелочная.) Высокое содержание фосфатов ( гипер фосфатемия) может не вызывать симптомов. Это может быть связано с синдромом лизиса опухоли , подавляющей инфекцией, хроническим заболеванием почек, заболеванием паращитовидных желез или ацидозом (pH крови более кислый, чем обычно).
Электролит — Энциклопедия Нового Света
В аппарате (вольтаметре Хоффмана), установленном для электролиза воды, электролит состоит из раствора ионов в воде.Электролит (или лайт , сокращенно жаргон) — это материал, содержащий свободные ионы, которые могут проводить электрический ток. Большинство электролитов состоят из ионов в растворе, и их называют ионными растворами . Некоторые электролиты состоят из расплавленных солей, другие представляют собой твердые вещества (проводники протонов), а третьи — газы.
Все высшие формы жизни требуют сложного баланса электролитов внутри и вне их клеточных структур. У человека этот баланс регулируется гормонами, и нарушение этого баланса приводит к проблемам со здоровьем. Кроме того, электролиты полезны во множестве применений, таких как электрические батареи, топливные элементы и процессы гальваники.
Принципы
Электролиты обычно существуют в виде растворов кислот, оснований или солей. Кроме того, некоторые газы могут действовать как электролиты в условиях высокой температуры или низкого давления.Растворы электролитов также могут быть результатом растворения некоторых биологических полимеров (таких как ДНК и полипептиды) и синтетических полимеров (таких как полистиролсульфонат). Их называют полиэлектролитами , которые содержат электрические заряды в нескольких местах каждой молекулы.
Растворы электролитов обычно образуются, когда соль помещается в растворитель, такой как вода, и отдельные компоненты диссоциируют из-за термодинамических взаимодействий между молекулами растворителя и растворенного вещества в процессе, называемом сольватацией.Например, когда поваренная соль NaCl помещается в воду, она распадается на ионы следующим образом:
Раствор электролита можно обозначить как концентрированный , если он имеет высокую концентрацию ионов, или разбавленный , если он имеет низкую концентрацию ионов. Если высокая доля растворенного вещества диссоциирует с образованием свободных ионов, электролит будет сильным ; если большая часть растворенного вещества не диссоциирует, электролит слабый .Свойства электролитов можно использовать с помощью электролиза для извлечения составляющих элементов и соединений, содержащихся в растворе.
Физиологическое значение
В физиологии основными ионами электролитов являются натрий (Na + ), калий (K + ), кальций (Ca 2+ ), магний (Mg 2+ ), хлорид (Cl — ), фосфат (PO 4 3 — ) и гидрокарбонат (HCO 3 — ).Символы электрического заряда в виде плюса (+) и минуса (-) указывают на то, что рассматриваемое вещество имеет ионную природу и имеет несбалансированное распределение электронов. Это результат химической диссоциации.
Все высшие формы жизни требуют тонкого и сложного электролитного баланса между внутриклеточной и внеклеточной средами. В частности, важно поддержание точных осмотических градиентов электролитов. Такие градиенты влияют и регулируют гидратацию тела и pH крови, и они имеют решающее значение для функции нервов и мышц.
И мышечная ткань, и нейроны считаются электрическими тканями тела. Мышцы и нейроны активируются за счет активности электролитов между внеклеточной жидкостью или межклеточной жидкостью и внутриклеточной жидкостью. Электролиты могут проникать или покидать клеточную мембрану через специализированные белковые структуры, встроенные в плазматическую мембрану, называемые ионными каналами. Например, сокращение мышц зависит от присутствия кальция (Ca 2+ ), натрия (Na + ) и калия (K + ).Без достаточного уровня этих ключевых электролитов может возникнуть мышечная слабость или сильные мышечные сокращения.
Баланс электролитов поддерживается пероральным или (в экстренных случаях) внутривенным (в / в) приемом электролитсодержащих веществ и регулируется гормонами, как правило, с вымыванием излишков почек. У людей электролитный гомеостаз регулируется такими гормонами, как антидиуретический гормон, альдостерон и паратиреоидный гормон. Серьезные электролитные нарушения, такие как обезвоживание и гипергидратация, могут привести к сердечным и неврологическим осложнениям и, если они не будут быстро решены, вызовут неотложную медицинскую помощь.
Измерение
Измерение электролитов — это обычная диагностическая процедура, выполняемая медицинскими технологами посредством анализа крови с помощью ионоселективных электродов или анализа мочи. Интерпретация этих значений бессмысленна без анализа истории болезни человека и часто невозможна без параллельного измерения функции почек. Наиболее часто измеряемыми электролитами являются натрий и калий. Уровни хлоридов измеряются редко, за исключением анализа газов артериальной крови, поскольку они по своей природе связаны с уровнями натрия.Одним из важных тестов, проводимых с мочой, является тест на удельный вес, чтобы определить, есть ли электролитный дисбаланс.
Спортивные напитки
Электролиты обычно содержатся в спортивных напитках. При пероральной регидратационной терапии напитки с электролитами, содержащие соли натрия и калия, восстанавливают уровень воды и электролитов в организме после обезвоживания, вызванного физическими упражнениями, потоотделением, диареей, рвотой или голоданием. Давать чистую воду человеку в таком состоянии — не лучший способ восстановить уровень жидкости, потому что она разжижает соли внутри клеток тела и мешает их химическим функциям.Это может привести к отравлению водой.
Спортивные напитки, такие как Gatorade, Powerade или Lucozade, представляют собой электролитные напитки с большим количеством добавленных углеводов, таких как глюкоза, для получения энергии. Напитки, обычно продаваемые населению, являются изотоническими (с осмоляльностью, близкой к осмоляльности крови), с гипотоническими (с более низкой осмоляльностью) и гипертоническими (с более высокой осмоляльностью), доступными для спортсменов в зависимости от их потребностей в питании.
Нет необходимости восполнять потери натрия, калия и других электролитов во время тренировки, потому что маловероятно, что во время обычных тренировок произойдет значительное истощение запасов этих минералов в организме.Однако в условиях экстремальных упражнений продолжительностью более пяти или шести часов (например, Ironman или ультрамарафон) рекомендуется употребление комплексного спортивного напитка с электролитами. Спортсмены, которые не потребляют электролиты в этих условиях, рискуют получить гипергидратацию (или гипонатриемию). [1]
Поскольку спортивные напитки обычно содержат очень высокий уровень сахара, они не рекомендуются для регулярного употребления детьми. Скорее рекомендуются специально разработанные детские растворы электролитов.Спортивные напитки также не подходят для восполнения потери жидкости во время диареи. Роль спортивных напитков заключается в том, чтобы препятствовать потере электролитов, но их недостаточно для восстановления баланса, как только это происходит. Доступны лечебные саше для регидратации и напитки, чтобы восполнить потерю основных ионов электролита. Стоматологи рекомендуют постоянным потребителям спортивных напитков соблюдать меры предосторожности против кариеса.
Электролит и спортивные напитки можно приготовить в домашних условиях, используя правильные пропорции сахара, соли и воды. [2]
Электрохимия
Когда два электрода помещаются в электролит и подается напряжение, один электрод, называемый катодом , становится отрицательно заряженным; другой, называемый анодом , становится положительно заряженным. Каждый электрод притягивает ионы противоположного заряда. Положительно заряженные ионы (катионы) движутся к катоду, а отрицательно заряженные ионы (анионы) движутся к аноду. Ионы являются переносчиками электрического тока через электролит.Катод поставляет электроны катионам, а анод забирает электроны у анионов. В результате катионы и анионы нейтрализуются на электродах, образуя элементы или соединения.
В растворе ионов (из соли) в воде молекулы нейтральной воды (H 2 O) захватывают электроны с катода и распадаются на ионы гидроксида (OH — ) и газообразный водород (H 2). ). Кроме того, молекулы воды теряют электроны на аноде и распадаются на газообразный кислород (O 2 ) и ионы водорода (H + ).Ионы в электролите движутся, чтобы нейтрализовать эти заряды, чтобы реакции могли продолжаться, а электроны могли продолжать движение.
Например, в разбавленном растворе обычной соли (хлорид натрия, NaCl) в воде катодная реакция будет
и пузыри газообразного водорода. Анодная реакция
, и выделяется газообразный кислород.В то же время положительно заряженные ионы натрия (Na + ) движутся к катоду, нейтрализуя там отрицательный заряд OH — ; и отрицательно заряженные ионы хлорида (Cl — ) движутся к аноду, нейтрализуя там положительный заряд H + . Без ионов электролита заряды вокруг электрода замедлили бы непрерывный поток электронов; диффузия H + и OH — через воду к другому электроду занимает больше времени, чем перемещение гораздо более распространенных солевых ионов.
В других системах в электродных реакциях могут участвовать металлы электродов, а также ионы электролита.
Приложения
Электролитические проводники используются в электронных и других устройствах, где химическая реакция на границе раздела металл / электролит дает полезные эффекты.
См. Также
Примечания
Ссылки
Внешние ссылки
Все ссылки получены 18 сентября 2017 г.
Кредиты
Энциклопедия Нового Мира Писатели и редакторы переписали и завершили статью Википедия в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников New World Encyclopedia, , так и на самоотверженных добровольцев Фонда Викимедиа.Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в энциклопедию Нового Света :
Примечание. могут применяться ограничения на использование отдельных изображений, на которые распространяется отдельная лицензия.
26.3 Электролитный баланс — анатомия и физиология
Тело содержит большое количество ионов или электролитов, которые выполняют множество функций.Некоторые ионы способствуют передаче электрических импульсов по клеточным мембранам нейронов и мышц. Другие ионы помогают стабилизировать белковые структуры ферментов. Третьи способствуют высвобождению гормонов из желез внутренней секреции. Все ионы в плазме способствуют осмотическому балансу, который контролирует движение воды между клетками и окружающей их средой.
Электролиты в живых системах включают натрий, калий, хлорид, бикарбонат, кальций, фосфат, магний, медь, цинк, железо, марганец, молибден, медь и хром.С точки зрения функционирования организма наиболее важны шесть электролитов: натрий, калий, хлорид, бикарбонат, кальций и фосфат.
Эти шесть ионов помогают нервной возбудимости, эндокринной секреции, проницаемости мембран, буферизуют жидкости организма и контролируют движение жидкостей между отделами. Эти ионы попадают в организм через пищеварительный тракт. Более 90 процентов кальция и фосфата, попадающего в организм, включаются в кости и зубы, при этом кость служит минеральным резервом для этих ионов.В случае, если кальций и фосфат необходимы для других функций, костная ткань может разрушиться, чтобы снабдить кровь и другие ткани этими минералами. Фосфат — нормальный компонент нуклеиновых кислот; следовательно, уровень фосфата в крови будет увеличиваться всякий раз, когда нуклеиновые кислоты расщепляются.
Выведение ионов происходит в основном через почки, меньшее количество выводится с потом и калом. Чрезмерное потоотделение может вызвать значительную потерю, особенно натрия и хлорида. Сильная рвота или диарея вызывают потерю ионов хлорида и бикарбоната.Регулировка дыхательной и почечной функций позволяет организму регулировать уровни этих ионов в ЭКФ.
В таблице 26.1 приведены контрольные значения для плазмы крови, спинномозговой жидкости (CSF) и мочи для шести ионов, рассматриваемых в этом разделе. В клинических условиях натрий, калий и хлорид обычно анализируются в стандартном образце мочи. Напротив, анализ кальция и фосфата требует сбора мочи в течение 24-часового периода, потому что выход этих ионов может значительно варьироваться в течение дня.Показатели мочи отражают скорость выведения этих ионов. Бикарбонат — это единственный ион, который обычно не выводится с мочой; вместо этого он сохраняется почками для использования в буферных системах организма.
| Эталонные значения электролитов и ионов (таблица 26.1) | ||||
|---|---|---|---|---|
| Имя | Химический знак | Плазма | CSF | Моча |
| Натрий | Na + | 136.00–146,00 (мМ) | 138,00–150,00 (мМ) | 40,00–220,00 (мМ) |
| Калий | К + | 3,50–5,00 (мМ) | 0,35–3,5 (мМ) | 25,00–125,00 (мМ) |
| Хлорид | Класс — | 98,00–107,00 (мМ) | 118,00–132,00 (мМ) | 110,00–250,00 (мМ) |
| Бикарбонат | HCO 3 — | 22.00–29.00 (мМ) | —— | —— |
| Кальций | Ca ++ | 2,15–2,55 (ммоль / день) | —— | До 7,49 (ммоль / сутки) |
| Фосфат | HPO42 − HPO42− | 0,81–1,45 (ммоль / день) | —— | 12,90–42,00 (ммоль / день) |
Натрий
Натрий — главный катион внеклеточной жидкости. Он отвечает за половину градиента осмотического давления, который существует между внутренней частью клеток и окружающей их средой.Люди, соблюдающие типичную западную диету с очень высоким содержанием NaCl, обычно потребляют от 130 до 160 ммоль / день натрия, но людям требуется только 1-2 ммоль / день. Этот избыток натрия, по-видимому, является основным фактором гипертонии (высокого кровяного давления) у некоторых людей. Выведение натрия в основном осуществляется почками. Натрий свободно фильтруется через клубочковые капилляры почек, и хотя большая часть отфильтрованного натрия реабсорбируется в проксимальных извитых канальцах, некоторая часть остается в фильтрате и моче и обычно выводится из организма.
Гипонатриемия — это концентрация натрия ниже нормы, обычно связанная с избыточным накоплением воды в организме, которая разжижает натрий. Абсолютная потеря натрия может быть связана с уменьшением поступления иона в сочетании с его постоянным выведением с мочой. Аномальная потеря натрия из организма может быть результатом нескольких состояний, включая чрезмерное потоотделение, рвоту или диарею; употребление мочегонных средств; чрезмерное выделение мочи, которое может возникнуть при сахарном диабете; и ацидоз, метаболический ацидоз или диабетический кетоацидоз.
Относительное снижение натрия в крови может происходить из-за дисбаланса натрия в одном из других жидкостных отделов организма, таких как IF, или из-за разбавления натрия из-за задержки воды, связанной с отеком или застойной сердечной недостаточностью. На клеточном уровне гипонатриемия приводит к увеличению поступления воды в клетки за счет осмоса, потому что концентрация растворенных веществ в клетке превышает концентрацию растворенных веществ в теперь разбавленном ECF. Избыток воды вызывает набухание клеток; Набухание красных кровяных телец, снижающее их способность переносить кислород и делая их потенциально слишком большими для прохождения через капилляры, вместе с набуханием нейронов в головном мозге может привести к повреждению мозга или даже смерти.
Гипернатриемия — аномальное повышение натрия в крови. Это может быть результатом потери воды из крови, что приводит к гемоконцентрации всех компонентов крови. Это может привести к нервно-мышечной раздражительности, судорогам, вялости ЦНС и коме. Гормональный дисбаланс с участием АДГ и альдостерона также может приводить к повышению уровня натрия выше нормы.
Калий
Калий является основным внутриклеточным катионом. Он помогает установить мембранный потенциал покоя в нейронах и мышечных волокнах после деполяризации мембраны и потенциалов действия.В отличие от натрия калий очень мало влияет на осмотическое давление. Низкие уровни калия в крови и спинномозговой жидкости связаны с натриево-калиевыми насосами в клеточных мембранах, которые поддерживают нормальные градиенты концентрации калия между ICF и ECF. Рекомендуемая суточная доза / потребление калия — 4700 мг. Калий выводится как активно, так и пассивно через почечные канальцы, особенно через дистальные извитые канальцы и собирательные каналы. Калий участвует в обмене с натрием в почечных канальцах под действием альдостерона, который также зависит от базолатеральных натрий-калиевых насосов.
Гипокалиемия — аномально низкий уровень калия в крови. Подобно ситуации с гипонатриемией, гипокалиемия может возникать либо из-за абсолютного снижения содержания калия в организме, либо из-за относительного снижения содержания калия в крови из-за перераспределения калия. Абсолютная потеря калия может возникнуть из-за снижения потребления, часто связанного с голоданием. Это также может быть вызвано рвотой, диареей или алкалозом. Гипокалиемия может вызвать метаболический ацидоз, спутанность сознания ЦНС и сердечную аритмию.
Некоторые пациенты с инсулинозависимым диабетом испытывают относительное снижение содержания калия в крови в результате перераспределения калия. Когда вводится инсулин и глюкоза поглощается клетками, калий проходит через клеточную мембрану вместе с глюкозой, уменьшая количество калия в крови и IF, что может вызвать гиперполяризацию клеточных мембран нейронов, уменьшая их ответы на стимулы.
Гиперкалиемия , повышенный уровень калия в крови, также может нарушить функцию скелетных мышц, нервной системы и сердца.Гиперкалиемия может быть результатом повышенного потребления калия с пищей. В такой ситуации калий из крови попадает в ЭКФ в аномально высоких концентрациях. Это может привести к частичной деполяризации (возбуждению) плазматической мембраны волокон скелетных мышц, нейронов и сердечных клеток сердца, а также может привести к неспособности клеток реполяризоваться. Для сердца это означает, что оно не расслабляется после сокращения, а эффективно «схватывает» и прекращает перекачивать кровь, что в считанные минуты приводит к летальному исходу.Из-за такого воздействия на нервную систему человек с гиперкалиемией может также проявлять спутанность сознания, онемение и ослабление дыхательных мышц.
Хлорид
Хлорид — преобладающий внеклеточный анион. Хлорид вносит основной вклад в градиент осмотического давления между ICF и ECF и играет важную роль в поддержании надлежащей гидратации. Хлорид балансирует катионы в ECF, поддерживая электрическую нейтральность этой жидкости. Пути секреции и реабсорбции ионов хлора в почечной системе повторяют пути ионов натрия.
Гипохлоремия или более низкий, чем обычно, уровень хлоридов в крови может возникать из-за нарушения всасывания почечными канальцами. Рвота, диарея и метаболический ацидоз также могут привести к гипохлоремии. Гиперхлоремия или уровень хлоридов в крови выше нормы может возникнуть из-за обезвоживания, чрезмерного потребления пищевой соли (NaCl) или проглатывания морской воды, отравления аспирином, застойной сердечной недостаточности и наследственного хронического заболевания легких, кистозного фиброз. У людей с муковисцидозом уровни хлоридов в поте в два-пять раз превышают нормальные уровни, и анализ пота часто используется для диагностики заболевания.
Внешний веб-сайт
Посмотрите это видео, чтобы увидеть объяснение воздействия морской воды на людей. Какое влияние оказывает питьевая морская вода на организм?
Бикарбонат
Бикарбонат — второй по распространенности анион в крови. Его основная функция — поддерживать кислотно-щелочной баланс вашего тела, будучи частью буферных систем. Эта роль будет обсуждаться в другом разделе.
Бикарбонат-ионы возникают в результате химической реакции, которая начинается с двуокиси углерода (CO 2 ) и воды, двух молекул, которые образуются в конце аэробного метаболизма.Лишь небольшое количество CO 2 может растворяться в биологических жидкостях. Таким образом, более 90 процентов CO 2 превращается в ионы бикарбоната, HCO 3 — , посредством следующих реакций:
CO 2 + H 2 O H 2 CO 3 ↔ H 2 CO 3 — + H +
Двунаправленные стрелки указывают на то, что реакции могут идти в любом направлении, в зависимости от концентраций реагентов и продуктов.Углекислый газ в больших количествах вырабатывается в тканях с высокой скоростью метаболизма. Углекислый газ превращается в бикарбонат в цитоплазме эритроцитов под действием фермента, называемого карбоангидраза. Бикарбонат переносится кровью. Попадая в легкие, реакции меняют направление, и CO 2 регенерируется из бикарбоната и выдыхается как отходы метаболизма.
Кальций
Около двух фунтов кальция в вашем теле связано в кости, которая обеспечивает твердость кости и служит минеральным резервом для кальция и его солей для остальных тканей.В зубах также содержится высокая концентрация кальция. Немногим более половины кальция в крови связывается с белками, остальная часть остается в ионизированной форме. Ионы кальция, Ca 2+ , необходимы для сокращения мышц, активности ферментов и свертывания крови. Кроме того, кальций помогает стабилизировать клеточные мембраны и необходим для высвобождения нейротрансмиттеров из нейронов и гормонов из желез внутренней секреции.
Кальций всасывается через кишечник под действием активированного витамина D.Дефицит витамина D приводит к снижению абсорбированного кальция и, в конечном итоге, к истощению запасов кальция в костной системе, что потенциально может привести к рахиту у детей и остеомаляции у взрослых, способствующей развитию остеопороза.
Гипокальциемия , или аномально низкий уровень кальция в крови, наблюдается при гипопаратиреозе, который может следовать за удалением щитовидной железы, потому что в нее встроены четыре узелка паращитовидной железы. Это может привести к сердечной недостаточности, повышенной нервно-мышечной возбудимости, мышечным спазмам и слабости скелета. Гиперкальциемия , или аномально высокий уровень кальция в крови, наблюдается при первичном гиперпаратиреозе. Это может привести к аритмии и остановке сердца, мышечной слабости, спутанности сознания ЦНС и коме. Некоторые злокачественные новообразования также могут привести к гиперкальциемии.
Фосфат
Фосфат присутствует в организме в трех ионных формах: H 2 PO 4−, HPO42 и PO43−. Наиболее распространенная форма — HPO42 − HPO42−. Кости и зубы связывают 85 процентов фосфатов в организме в составе кальций-фосфатных солей.Фосфат содержится в фосфолипидах, таких как те, которые составляют клеточную мембрану, а также в АТФ, нуклеотидах и буферах.
Гипофосфатемия , или аномально низкий уровень фосфатов в крови, возникает при интенсивном употреблении антацидов, во время отмены алкоголя и во время недоедания. Перед лицом истощения фосфатов почки обычно сохраняют фосфаты, но во время голодания это сохранение сильно нарушается. Гиперфосфатемия , или аномально повышенный уровень фосфатов в крови, возникает при снижении функции почек или в случаях острого лимфолейкоза.Кроме того, поскольку фосфат является основным компонентом ICF, любое значительное разрушение клеток может привести к сбросу фосфата в ECF.
Electrolyte Solution — обзор
7.2.5.1 Коэффициенты активности
Водные электролиты и константы равновесия, которые определяют различные реакции в низкотемпературной геохимии, неразрывно связаны с проблемой коэффициентов активности или проблемой неидеальности водных растворов электролитов. Константы термодинамического равновесия, определенные путем экстраполяции на бесконечное разбавление для условий стандартного состояния (не единственного возможного стандартного состояния), требуют использования коэффициентов активности.К сожалению, нет ни простого, ни универсального метода неидеальности, который работал бы для всех электролитов при любых условиях. В этом разделе представлен краткий обзор основного предмета, который все еще находится в стадии исследований и разработок, но для которого доступно несколько удовлетворительных подходов.
Если активность растворенного вещества или иона была идеальной, ее можно было бы принять как эквивалент молярной концентрации, m i , иона или растворенного вещества i . Однако взаимодействия с другими ионами и с водой-растворителем достаточно сильны, чтобы вызвать неидеальное поведение, и характеристической переменной, связывающей концентрацию с химическим потенциалом, является коэффициент активности, γ i ,
[7] ai = γimi
При накоплении результатов измерений коэффициента активности и поиске теоретического выражения было обнаружено, что в разбавленных растворах логарифм коэффициента активности является приблизительной функцией квадратного корня из моляльности:
[8] lnγi = −αimi1 / 2
, где α i было просто константой.Бренстед (1922) ввел линейный член в уравнение [8], в котором коэффициент, β , является «параметром взаимодействия конкретных ионов»,
[9] lnγi = −αimi1 / 2 − βmi
Более поздние модификации этот общий подход стал известен как теория взаимодействия конкретных ионов (SIT) из-за явной зависимости от рассматриваемого растворенного вещества или ионов.
Важным понятием, которое помогло в развитии теории электролитов, была ионная сила I , введенная Льюисом и Рэндаллом (1921):
[10] I = 12∑mizi2
, где z i — ионный заряд.После этого ионная сила использовалась как параметр в уравнениях коэффициента активности. Дебай и Хюккель (1923) вывели уравнение из электростатической теории, которое в пределе бесконечного разбавления (отсюда и предельный закон Дебая-Хюккеля) принимает вид
[11] logγi = −Azi2I1 / 2
, где A — параметр растворителя Дебая – Хюккеля (зависит от свойств растворителя).
Их расширенное уравнение Дебая – Хюккеля:
[12] logγi = −Azi2I1 / 21 + BaiI1 / 2
, где B — еще один параметр растворителя Дебая – Хюккеля, а a i — диаметр размером с ион. получено эмпирическим путем, но приблизительно соответствует диаметру гидратированного иона.Это уравнение применимо до примерно 0,1 моль. Использование расширенного уравнения Дебая – Хюккеля с соответствующими константами равновесия для выражений массового действия для решения сложной задачи химического равновесия известно как метод IA. В этом методе используется концепция притяжения между ионами с противоположной зарядовой связью для создания ионной пары или триплета, что снижает концентрацию заряженных ионов. Следовательно, общая ионная сила будет без какой-либо ассоциации ионных пар, а эффективная ионная сила будет меньше, потому что она будет включать IA.
Хюккель (1925) продемонстрировал, что добавлением линейного члена с подобранным коэффициентом к расширенному уравнению Дебая – Хюккеля (уравнение [12]) можно надежно подобрать коэффициенты активности для ионной силы до нескольких моль для простых одиночных электролитов:
[13] logγi = −Azi2I1 / 21 + BaiI1 / 2 + biI
Уравнение [13] было принято в исходной водной модели, разработанной Helgeson и его коллегами (Helgeson, 1969; Helgeson et al., 1981) и Truesdell и Джонс (1974). Метод IA с использованием формулы [13] для основных ионов (смешанных электролитов) в природной воде хорошо сравнивается с другими более точными методами (см. Следующий текст) до эффективной ионной силы морской воды (0.7 м, тогда как общая ионная сила составляет почти 1 моль), но ненамного выше.
Дальнейшие модификации этих уравнений были опробованы в течение следующих нескольких десятилетий. Следующее лучшее приближение — позволить линейному коэффициенту быть функцией ионной силы (Pitzer and Brewer, 1961), и оно было использовано Helgeson и Kirkham (1974a, b, 1976), Helgeson et al. (1981) и Танжер и Хельгесон (1988) при разработке уравнений Хельгесона – Киркхама – Флауэрса (HKF), которые основаны на функции Борна (с использованием диэлектрической проницаемости растворителя) и гидратации ионов.
Вклады Гуггенхайма (1935) и Скэтчарда (1936) и шведской группы KTH (Grenthe et al., 1992, 1997) стали методом Бронстеда-Гуггенхайма-Скэтчарда или SIT (теория взаимодействия специфических ионов):
[14 ] logγi = −Azi2I1 / 21 + 1.5I1 / 2 + ∑kεikImk
, в котором линейный член является функцией моляльности, суммированной для всех других ионов в растворах, k и ε ( i , k , I ) имеет тенденцию быть постоянным при более высоких молях, но зависит от растворенного вещества или иона.Последний член в уравнении [14] представляет отклонение экспериментально измеренного коэффициента активности от предсказания упрощенного уравнения Дебая – Хюккеля.
Питцер (1973) повторно исследовал статистическую механику водных электролитов в воде и вывел другой полуэмпирический метод для коэффициентов активности, обычно называемый моделью взаимодействия специфических ионов Питцера. Он применил несколько иную функцию для поведения при низких концентрациях и использовал формулировку вириального коэффициента для высоких концентраций.Результаты оказались чрезвычайно полезными для моделирования коэффициентов активности в очень большом диапазоне моляльности. Общее уравнение, ограниченное членом второго порядка:
[15] lnγ ± = −A3z + z − fI + 2ν + ν − νBIm + 2ν + ν − 3 / 2νCm2
, где
fI = I1 / 21 + 1.2I1 / 2 + 1.67ln1 + 1.2I1 / 2
и
BI = 2β∘ + 2β′α2I1−1 + αI1 / 2−12α2Ie − αI1 / 2
, где β ° и β ′ — параметры конкретных ионов, α — константа для одинаково заряженного класса электролитов, а C — параметр конкретных ионов, не зависящий от ионной силы.Параметры B и C являются вторым и третьим вириальными коэффициентами. Параметр v = v + + v — представляет собой сумму стехиометрических коэффициентов для катиона v + и аниона v — растворенное вещество. Параметры Питцера были подобраны для широкого диапазона растворенных веществ и использовались для смешанных растворов электролитов для моделирования поведения растворимости минералов в рассолах (Harvie and Weare, 1980; Harvie et al., 1980). Grenthe et al. (1997) провели подробное сравнение метода SIT с методом Питцера и пришли к следующим выводам: (i) более параметризованная модель Питцера позволяет наиболее точно и точно моделировать коэффициенты активности и константы равновесия при условии, что все коэффициенты взаимодействия известны; (ii) когда параметры Питцера отсутствуют (недоступны из экспериментальных данных), они должны быть оценены, и точность и точность коэффициентов активности могут быть значительно скомпрометированы; (iii) параметры в модели SIT могут быть связаны с параметрами в модели Питцера и обеспечивать другое средство оценки параметров Питцера; (iv) модель SIT хорошо согласуется с моделью Питцера для диапазона м = 0.1–4 моль кг −1 ; и (v) модель Питцера является предпочтительным формализмом для растворов или рассолов с высокой ионной силой. Обширное обсуждение развития модели Питцера и нескольких гибридных подходов можно найти у Питцера (1991a) и Миллеро (2001). Похоже, что гибридные подходы являются наиболее перспективными в будущем, поскольку они сочетают в себе обширные данные о константах равновесия с лучшей формулировкой коэффициентов активности.
Разница между расширенным уравнением Дебая – Хюккеля и уравнениями Питцера связана с тем, какая часть неидеальности электростатических взаимодействий включена в выражения массового действия, а какая — в выражение коэффициента активности.Важно помнить, что выражения для коэффициентов активности неумолимо связаны с константами равновесия, и они должны согласовываться друг с другом в химической модели. Ионно-парные взаимодействия можно количественно оценить двумя способами: явно с помощью констант стабильности (метод IA) или неявно с помощью эмпирической подгонки с параметрами коэффициента активности (метод Питцера). Оба подхода могут быть успешными, если приложить достаточно усилий для достижения согласованности. В настоящее время метод Питцера работает намного лучше для рассолов, а метод IA лучше работает для разбавленных вод из-за большего количества компонентов и видов, по которым существуют основные данные.Когда делается попытка сравнить оба подхода для одного и того же набора высококачественных данных, а ионная сила не слишком высока, они оказываются сопоставимыми (Felmy et al., 1990). Основной задачей на будущее будет обеспечение согласованности между термодинамическими данными, выражениями неидеальности и массовыми действиями в кодах геохимического моделирования, а также включение большего количества микроэлементов и окислительно-восстановительных веществ в один и тот же состав.
Электролитов в батарее — Новости о хранении энергии, батареях, изменении климата и окружающей среде
Батареи используют электролитов в качестве химического источника для производства электроэнергии.Электролит — это любое вещество, которое выделяет ионы при растворении в подходящем растворителе (например, геле) или жидкости (например, воде или соке).
Каждая батарея состоит из анода, катода и электролитического раствора. Анод и катод — это электроды (проводящий электричество материал, через который могут протекать электрические заряды или ток), которые погружены в раствор электролита и соединены снаружи с помощью проводящего провода. При растворении в растворителе электролит выделяет ионы. И мы знаем, что движущиеся ионы или электроны производят электрический ток.Посмотрим как.
Ионы, высвобождаемые электролитом, реагируют с анодом с высвобождением одного или нескольких электронов. По мере того, как электроны накапливаются возле анода, они начинают двигаться по проволоке к катоду, у которого нет или очень мало электронов. Это движение электронов производит электрический ток, который питает любое устройство, подключенное через провод, как показано на Рис. 1 .
Рисунок 1: Базовая компоновка батарей
Вам интересно, что происходит со всеми электронами, идущими к катоду? Катод реагирует с электролитом и электронами с образованием соединения и расходует электроны в процессе.
В зависимости от степени ионизации электролита (высвобождения ионов) электролиты могут быть сильными или слабыми. Сильные электролиты — это те соединения, которые в значительной степени ионизируются в водном растворе и проводят сильный электрический ток. Слабые электролиты — это те соединения, которые в очень небольшой степени ионизируются в водном растворе и проводят очень небольшое количество электрического тока.
В разных батареях в качестве электролита используются разные химические соединения.Некоторые из таких часто используемых соединений: хлорид натрия, азотная кислота, серная кислота, ацетат натрия, хлорная кислота и т. Д.
Первая батарея была изобретена итальянским физиком Алессандро Вольта в 1799 году путем выработки постоянного электрического тока с использованием вольтовых свай . С тех пор форма батареи изменилась, но основная концепция осталась прежней. Анод, катод и электролит по-прежнему необходимы для изготовления батареи.
Что такое электролит?
Электролит — это медицинский термин, обозначающий соль или ион в крови или другой жидкости организма, несущие заряд.
Растворение некоторых биологических полимеров, таких как ДНК, или синтетических полимеров, таких как полистиролсульфонат, дает раствор электролитов, которые называются полиэлектролитами, и они содержат заряженные функциональные группы. Помещение соли в растворитель (например, воду) также приводит к получению раствора электролита, поскольку компоненты в соли диссоциируют в процессе, называемом сольватацией. Когда, например, в воду добавляют хлорид натрия или поваренную соль, соль растворяется и распадается на составляющие ионы натрия (Na +) и хлорид (Cl-).Точно так же, когда углекислый газ растворяется в воде, он производит ионы карбоната, ионы гидрокарбоната и ионы гидроксония. Расплавленные соли также могут быть электролитами. Например, расплавленный хлорид натрия становится жидкостью, которая может проводить электричество.
Электролит в растворе называется концентрированным, если он содержит большое количество ионов, и разбавленным, если он имеет низкое количество. Следовательно, если большое количество растворенного вещества диссоциирует с образованием свободных ионов, электролит является сильным, тогда как если небольшая часть растворенного вещества диссоциирует, электролит является слабым.Электролиты обладают несколькими свойствами, которые можно использовать в процессе электролиза как средство разделения и извлечения элементов и соединений, присутствующих в растворе.
В биологических системах основными электролитами являются:

