Приготовление электролита для аккумуляторов своими руками
В настоящее время выбор аккумуляторных батарей огромен — в продаже можно найти уже готовые к использованию источники питания, а также сухозаряженные батареи, которые требуют осуществить приготовление электролита и его заливку до начала эксплуатации. Дальнейшее обслуживание аккумуляторов многие часто осуществляют в сервисах. По разным причинам может возникнуть необходимость самостоятельно приготовить раствор. Чтобы это мероприятие увенчалось успехом, следует знать, как сделать электролит в домашних условиях.
Содержание:
- 1 Что такое электролит?
- 2 Концентрация серной кислоты в АКБ
- 3 Отличия электролитов для разных типов аккумуляторов
- 3.1 Щелочные АКБ
- 3.2 Кислотные АКБ
- 4 Другие виды АКБ: можно ли приготовить электролит для них самостоятельно?
- 4.1 Кадмиевоникелевые и железоникелевые аккумуляторы
- 5 Как правильно приготовить электролит в домашних условиях: техника безопасности
- 5.
 1 Оборудование
1 Оборудование - 5.2 Последовательность процесса: делаем электролит для кислотно-свинцового источника питания
- 5.
- 6 Способ развести электролит для щелочного источника питания
Что такое электролит?
Электролит — электропроводящий раствор, содержащий в своём составе дистиллированную воду и серную кислоту, едкий калий или натрий в зависимости от типа источника питания.
Концентрация серной кислоты в АКБ
Этот показатель кислотности напрямую зависит от необходимой плотности электролита. Изначально средняя концентрация этого раствора в автомобильном аккумуляторе — около 40% в зависимости от температуры и климата, в которых используется источник питания. Во время эксплуатации концентрация кислоты падает до 10–20%, что сказывается на работоспособности АКБ.
Вместе с тем стоит понимать, что аккумуляторная серная составляющая — наичистейшая жидкость, которая на 93% состоит непосредственно из кислоты остальные 7% — примеси. На территории России производство этого химиката строго регламентировано — продукция должна соответствовать требованиям ГОСТ.
Отличия электролитов для разных типов аккумуляторов
Несмотря на то что принцип работы раствора одинаков для разных источников питания, следует знать о некоторых различиях составов. В зависимости от состава принято выделять щелочной и кислотный электролиты.
Щелочные АКБ
Этот вид источников питания характеризуется наличием гидроокиси никеля, окиси бария и графита. Электролит в этом виде аккумуляторов представляет собой 20% раствор едкого калия. Традиционно используется добавка моногидрата лития, которая позволяет продлить срок эксплуатации АКБ.
Щелочные источники питания отличаются отсутствием взаимодействия калийного раствора с веществами, образуемыми во время работы аккумулятора, что способствует аксимальному уменьшению расхода.
Кислотные АКБ
Этот вид источников питания является одним из самых традиционных, поэтому и раствор в них знаком многим — смесь дистиллированной воды и серного раствора. Концентрат электролита для свинцово-кислотных аккумуляторов дешёво стоит и характеризуется способностью проводить ток большой величины. Плотность жидкости должна соответствовать климатическим показателям.
Плотность жидкости должна соответствовать климатическим показателям.
Таблица 1. Рекомендуемая плотность электролита
Другие виды АКБ: можно ли приготовить электролит для них самостоятельно?
Отдельно хотелось бы обратить внимание на современные свинцово-кислотные источники питания — гелевые и AGM. Они также могут быть заправлены собственноручно приготовленным раствором, который в них находится в специфической форме — в виде геля или внутри сепараторов. Для заправки гелевых аккумуляторов понадобится ещё один химический компонент — силикагель, который загустит кислотный раствор.
Кадмиевоникелевые и железоникелевые аккумуляторы
В отличие от свинцовых источников питания, кадмиево- и железоникелевые заливаются щелочным растовром, который является смесью дистиллированной воды и едкого калия или натрия. Гидроксид лития, входящий в состав этого раствора для определённых температурных режимов, позволяет увеличить срок службы АКБ.
Таблица 2.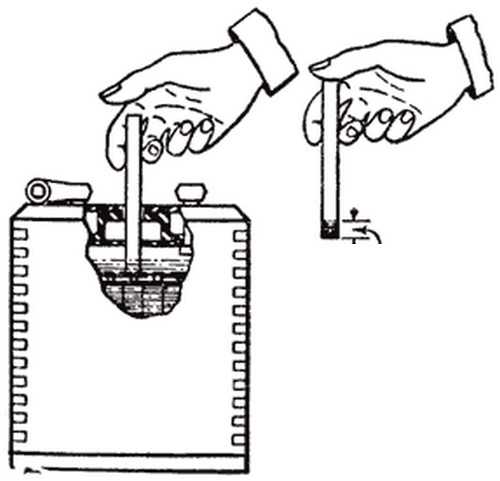 Состав и плотность электролита для кадмиево- и железоникелевых и аккумуляторов.
Состав и плотность электролита для кадмиево- и железоникелевых и аккумуляторов.
Железоникелевые источники питания рекомендуется эксплуатировать в тех же условиях, что и кадмиево-никелевые. Однако стоит отметить, что они более восприимчивы к низким температурам. Поэтому их следует использовать до минус 20 градусов.
Как правильно приготовить электролит в домашних условиях: техника безопасности
Приготовление раствора — работа с кислотами и щелочами, поэтому соблюдение мер предосторожности необходимо для самых опытных людей. Перед началом действия подготовьте средства защиты:
- резиновые перчатки
- одежду и фартук, устойчивый химическим веществам;
- защитные очки;
- нашатырный спирт, кальцинированную соду или борный раствор, чтобы нейтрализовать кислоту и щёлочь.
Оборудование
Для приготовления аккумуляторного электролита помимо самого источника питания потребуются следующие предметы:
- ёмкость и палочка, устойчивые к воздействию кислот и щелочей;
- дистиллированная вода;
- инструменты для измерения уровня, плотности и температуры раствора;
- аккумуляторная серная жидкость — для кислотной АКБ, твёрдые или жидкие щелочи, литий — для соответствующих видов АКБ, силикагель — для гелевых аккумуляторов.

Последовательность процесса: делаем электролит для кислотно-свинцового источника питания
Перед началом работ ознакомьтесь с информацией, приведённой в таблице 3. Она позволит выбрать необходимый объем жидкостей. В аккумуляторах залито от 2,6 до 3,7 литра кислотного раствора. Мы рекомендуем разводить примерно 4л электролита.
Таблица 3. Пропорции воды и серной кислоты.
- В ёмкость, устойчивую к едким веществам, налейте нужный объем воды.
- Разбавлять воду кислотой следует постепенно.
- По окончании процесса вливания замеряйте плотность получившегося электролита с помощью ареометра.
- Дайте составу отстояться около 12 часов.
Таблица 4. Плотность электролита для разных климатов.
Концентрация кислотного раствора должна соотноситься с минимальной температурой, при которой эксплуатируется аккумулятор. Если жидкость получилась слишком концентрированной, её необходимо разбавить дистиллированной водой.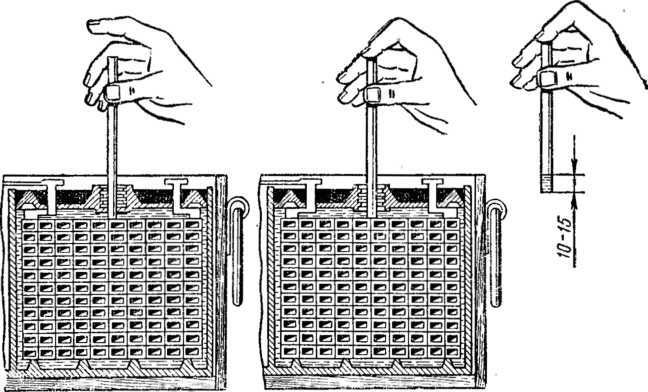
Смотрите видео, как измерить плотность электролита.
Внимание! Вливать воду в кислоту нельзя! В результате этой химической реакции может возникнуть закипание состава, что приведёт к его расплескиванию и возможности получить кислотные ожоги!
Обращаем ваше внимание, что во время смешивания компонентов выделяется тепло. В подготовленный аккумулятор следует заливать остывший раствор.
Способ развести электролит для щелочного источника питания
Плотность и количество электролита в таких аккумуляторах указана в инструкции по эксплуатации источника питания или на сайте компании-производителя.
Необходимая плотность раствора | Количество твёрдой щелочи равняется количеству электролита, разделенному на |
1,17–1,19 г/см³ | 5 |
1,19–1,21 г/см³ | 3 |
1,25–1,27 г/см³ | 2 |
- Влейте в посуду дистиллированную воду.

- Добавьте щелочь.
- Смешайте раствор, герметично его закройте и дайте настояться в течение 6 часов.
- По истечении времени слейте образовавшийся светлый раствор — электролит готов.
При появлении осадка следует его перемешивать. Если к концу отстаивания он остаётся, слейте электролит так, чтобы осадок не попал в аккумулятор — это приведёт к уменьшению срока его эксплуатации.
Внимание! Во время работ температура щелочного раствора не должна превышать 25 градусов по Цельсию. Если жидкость чрезмерно нагревается, охладите её.
После приведения раствора к комнатной температуре и его заливке в аккумулятор, источник питания необходимо полностью зарядить током, составляющим 10% от ёмкости АКБ (60Ач — 6А).
Как видите, приготовление раствора электролита не такое сложное дело. Главное, следует чётко определиться с необходимым количеством ингредиентов и помнить о безопасности. Вы пробовали развести электролит своими руками? Поделитесь опытом с нашими читателями в комментариях.
Приготовление электролита | Аккумуляторные батареи
- Подробности
- Категория: Оборудование
- эксплуатация
- ремонт
- хранение энергии
Содержание материала
- Аккумуляторные батареи
- Электрические характеристики аккумуляторных батарей
- Принцип действия аккумулятора
- Свинцово-кислотные аккумуляторы
- Пластины аккумуляторов
- Сепараторы для свинцово-кислотных аккумуляторов
- Сосуды для свинцово-кислотных аккумуляторов
- Сборка для свинцово-кислотных аккумуляторов
- Железо–никелевые аккумуляторы
- Никель-кадмиевые аккумуляторы
- Серебряно-цинковые аккумуляторы
- Электролит для свинцовых аккумуляторов
- Свойства щелочных электролитов
- Приготовление электролита
- Источники повреждений аккумуляторных батарей
- Заряд аккумуляторных батарей
- Зарядные устройства
- Ремонт аккумуляторных батарей
- Оборудование мастерской по ремонту аккумуляторных батарей
- Ремонт
- Сборка аккумуляторных батарей
- Охрана труда и техника безопасности
- Особенности эксплуатации аккумуляторных батарей на электростанциях и подстанциях
- Основные сведения по монтажу
- Порядок эксплуатации аккумуляторных батарей
- Техническое обслуживание аккумуляторных батарей
Страница 14 из 26
4. 3. Приготовление электролита для свинцовых аккумуляторов
3. Приготовление электролита для свинцовых аккумуляторов
Электролит для свинцовых аккумуляторов приготовляется путем разбавления чистой серной кислоты чистой водой. Кислота продается обычно концентрированной, удельного веса от 1,835 до 1,840. При разбавлении концентрированной кислоты раствор сильно нагревается. Во избежание опасности для лица, производящего смешивание, всегда необходимо наливать кислоту в воду, но не наоборот.

Для смешивания и хранения небольших количеств электролита наиболее подходят сосуды фарфоровые, гончарные или стеклянные; но так как они легко дают трещины, то им следует предпочесть чаны, выложенные свинцом, особенно для более значительных количеств.
Никакие другие металлические сосуды, кроме свинцовых, непригодны.
После разбавления кислоты, до заливки ее в батарею, необходимо подождать, пока она остынет, для того чтобы избежать повреждений пластин и сепараторов.
Охлаждение можно ускорить, пользуясь струей сжатого воздуха, но воздух при этом должен быть чистым.
Избежать сильного повышения температуры при смешивании кислоты с водой можно, применяя вместо воды лед, приготовленный из дистиллированной воды. Понижение температуры происходит вследствие того, что скрытая теплота плавления льда приблизительно равна количеству теплоты, освобождающемуся при растворении серной кислоты. Лед, свободный от воды, можно прибавлять к кислоте непосредственно. Избыток поглощенной теплоты показывает, что раствор должен получить температуру ниже нуля, что и наблюдалось в действительности.

Чтобы облегчить приготовление электролитов любой требуемой концентрации, на рис. 4.1 приведены необходимые пропорции кислоты и воды. Аккумуляторные заводы обычно сообщают сведения о том, какой крепости кислоту следует применять для каждой данной батареи.
Рис. 4.1. Приготовление электролита любого удельного веса из концентрированной кислоты удельного веса 1,835.
1- содержание серной кислоты, %; 2 – требующаяся добавка воды по объему; 3 – то же по весу.
Для кадмиевоникелевых и железоникелевых аккумуляторов в качестве электролита служит раствор в дистиллированной воде едкого калия (КОН) или едкого натрия (NaOH).
Кадмиевоникелевые аккумуляторы рассчитаны на работу на холоде при температуре до – 40°С, причем при температурах +35.
 ..– 19°С с составным электролитом, а при более низких температурах, например, – 20…– 40°С с электролитом без добавки едкого лития.
..– 19°С с составным электролитом, а при более низких температурах, например, – 20…– 40°С с электролитом без добавки едкого лития. При температурах – 20…– 40°С при отсутствии чистого едкого калия допускается как исключение применять составной электролит из едкого калия и едкого лития повышенной плотности, при этом емкость аккумулятора снижается на 10 – 15%. При отсутствии составного электролита из едкого калия и едкого лития при температуре – 19…+35°С можно воспользоваться составным электролитом из едкого натрия повышенной плотности 1,17 – 1,19 г/см 3 с добавкой на 1 л раствора 20 г едкого лития, но при этом следует учесть, не гарантируется.
Таблица 4.1.
Рекомендуемые состав и плотность электролита для кадмиевоникелевых и железоникелевых аккумуляторов при различной температуре окружающего воздуха
Температура воздуха, °С | Рекомендуемый состав электролита | Плотность, г/см3 |
– 19. | Составной раствор едкого калия с добавкой на 1 л раствора 20 г едкого лития аккумуляторного (моногидрата лития) | 1,19 – 1,21 |
– 20… – 40 | Раствор едкого калия | 1,25 – 1,27 |
+10…+50 | Раствор едкого натрия с добавкой на 1 л раствора 15 – 20 г едкого лития (моногидрата лития) | 1,1 – 1,12 |
Не гарантируется также долговечность аккумуляторов при работе их с электролитом из раствора чистого едкого калия плотностью 1,19 – 1,21 г/см3, т. е. без добавки едкого лития при температуре –19… + 10°С. При работе при температуре + 10…+50°С с рекомендуемым составным электролитом плотностью 1,1–1,12 г/см3 (табл. 5.1) емкость аккумуляторов также снижается по сравнению с номинальной, а долговечность не гарантируется.
Железоникелевые аккумуляторы рассчитаны на работу в тех же условиях и с тем же электролитом, что и кадмиевоникелевые, но они более чувствительны к низким температурам, поэтому могут применяться при температурах не ниже –20° С.
В процессе эксплуатации температурные условия в зависимости от времени года резко изменяются, поэтому для более эффективного использования емкости аккумуляторов их следует заливать электролитом, по составу и плотности соответствующим этим условиям.
Кроме того, необходимо систематически контролировать количество электролита, т. е. следить за уровнем последнего и поддерживать его в установленных пределах.
В аккумуляторах, находящихся в эксплуатации, уровень электролита постепенно снижается вследствие испарения, поэтому его необходимо периодически измерять и при необходимости дополнять до нормы дистиллированной водой. Не реже чем через 10 циклов нужно проверять плотность электролита и также доводить ее до нормы добавлением раствора плотностью 1,41 г/см3 или дистиллированной воды.
Уровень электролита в аккумуляторах должен постоянно находиться выше края пластин не менее чем на 5 мм и не более чем на 12 мм.
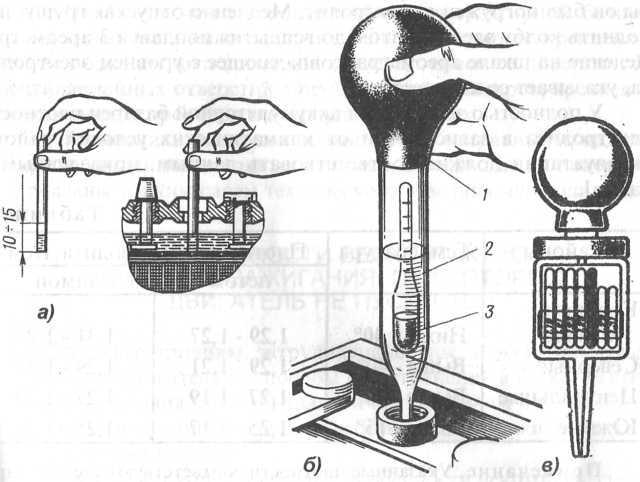
Снижение уровня электролита ниже верхнего края пластин или сетки, а также повышение плотности электролита при положительных температурах окружающего воздуха снижают емкость и долговечность последних. Уровень электролита необходимо проверять и доводить до указанной нормы перед каждым зарядом. Он проверяется с помощью стеклянной трубки диаметром 5 – 6 мм с метками на высоте 5 и 12 мм от конца. Для установления уровня электролита в аккумуляторе надо конец трубки с метками ввести через заливное отверстие до упора в пластины или сетку, после чего другой конец трубки закрыть пальцем. Вынув трубку из аккумулятора по высоте столбика электролита в ней, определим уровень электролита над верхним краем пластин или сетки в аккумуляторе. Для снижения уровня электролита в аккумуляторе можно пользоваться пипеткой или резиновой грушей со стеклянным или пластмассовым наконечником длиной около 100 мм. Доливку электролита или дистиллированной воды в аккумуляторы можно производить с помощью пипетки, резиновой груши или кружки через стеклянную воронку, размеры которых подбирают в зависимости от вместимости аккумуляторов. Проверка плотности электролита производится при помощи сифонного ареометра.
Доливку электролита или дистиллированной воды в аккумуляторы можно производить с помощью пипетки, резиновой груши или кружки через стеклянную воронку, размеры которых подбирают в зависимости от вместимости аккумуляторов. Проверка плотности электролита производится при помощи сифонного ареометра.
Проверку плотности электролита необходимо производить по возможности перед каждым зарядом, в каждом аккумуляторе, хотя и допускается выборочный контроль в 2 – 3 аккумуляторах батареи. В крайнем случае проверка должна проводиться не реже чем через 10 циклов во всех аккумуляторах батареи.
Таким образом, электролит необходим не только для первой заливки аккумуляторов при формировке, но и для замены, поддержания плотности и уровня электролита в действующих аккумуляторах, поэтому его требуется приготовлять и всегда иметь запас.
Для приготовления электролита поставляются следующие исходные материалы:
а) едкий калий аккумуляторный марки А (твердый) или марки В (жидкий) и едкий литий аккумуляторный;
б) составная щелочь сорта А – готовая смесь едкого калия и едкого лития в отношении едкий литий/едкий калий = 0,04. ..0,045;
..0,045;
в) едкий натрий аккумуляторный (сода каустическая) сорта А и едкий литий аккумуляторный;
г) составная щелочь сорта Б – готовая смесь едкого натрия и едкого лития в соотношении едкий литий/едкий натрий = 0,028…0,032.
Перед приготовлением электролита необходимо удостовериться, что имеющиеся в наличии химические ‘компоненты соответствуют приведенным выше требованиям и ГОСТам. Хранить эти материалы необходимо в герметически закрытой таре. Данные материалы могут поставляться как в жидком, так и в твердом состоянии в виде гранул, чешуек, кусков или слитка.
Приготовление электролита следует начинать с определения потребности в нем согласно норме расхода на один аккумулятор при первой заливке, указанной в табл. 4.2.
Определив требуемое количество электролита, приготовим примерно 3/4 этого объема свежей дистиллированной воды. При отсутствии последней допускается применение дождевой воды, собранной с чистой поверхности, или воды, полученной при таянии снега, а также конденсата.
Таблица 4.2
Ориентировочная норма расхода электролита на один аккумулятор при первой заливке
Тип | Норма расхода электролита при первой заливке, л | Тип | Норма расхода электролита при первой заливке, л |
АКН-2,25 | 0,04 | КН-60 | 0,75 |
Примечание. При приготовлении электролита желательно норму увеличить на 10 – 15 % для создания резерва на отход и другие непредвиденные случаи.
При приготовлении электролита желательно норму увеличить на 10 – 15 % для создания резерва на отход и другие непредвиденные случаи.
В крайнем случае можно использовать любую сырую чистую питьевую воду (кроме минеральной).
Затем, пользуясь данными табл. 5.3, определяем необходимое количество химических компонентов: едкого калия или едкого натрия, а также едкого лития для добавки. Расход дистиллированной воды на 1 кг твердой и на 1 л жидкой щелочи для приготовления электролита необходимой плотности приведен в табл. 4.3.
Таблица 4.3
Расход дистиллированной воды, необходимой для приготовления электролита для кадмиевоникелевых и железоникелевых аккумуляторов
Щелочь | Плотность, г/смз3 | Количество воды, л | |
на 1 кг твердой щелочи | на 1 кг жидкой щелочи плотностью 1,41 г/см3 | ||
Калиевая или готовая составная, т. Калиево-литиевая Натриевая или готовая составная натриево-литиевая |
1,19 – 1,21 1,25 – 1,27
1,17– 1,19 |
3 2
5 |
1 0,55
1,5 |
Для определения массы твердых щелочей, необходимой по норме, приведенной в табл. 19, достаточно разделить:
на три требуемое количество воды, если необходимо приготовить калиевый или составной калиево-литиевый раствор плотностью 1,19 – 1,21 г/см3;
на два, если необходимо приготовить калиевый электролит для работы при температуре
– 20. ..– 40° С или составной калиево-литиевый плотностью 1,25 –1,27 г/см3;
..– 40° С или составной калиево-литиевый плотностью 1,25 –1,27 г/см3;
на пять, если необходимо приготовить натриевый или составной натриево-литиевый электролит плотностью 1,17 – 1,19 г/см3.
Если составная калиево-литиевая или натриево-литиевая щелочь отсутствуют, а имеется едкий калий, едкий натрий и едкий литий, то расчет потребности в твердых щелочах производится по тому же принципу, как указано выше. Следует иметь в виду, что в частном, полученном в результате деления, учитывается и масса едкого лития.
- Назад
- Вперёд
- Назад
- Вперёд
- Вы здесь:
- Главная
- Книги
- Оборудование
- org/ListItem»> Аккумуляторные батареи
Еще по теме:
- Предремонтные испытания электрических машин
- Взрывозащищенная контрольно-измерительная и аппаратура автоматики
- Ремонт электрооборудования на судах
- Интеграция системы передачи и хранения ремонтных заявок с системой их режимной проработки
- Строительство, реконструкция и ремонт дымовых труб
Как приготовить состав электролита для аккумулятора
Основная масса автомобилей работают совместно с кислотными аккумуляторами. Но встречаются и щелочные устройства. Они используются в различных сферах.
В аккумуляторы на производстве заливается специальная жидкость. В её основе лежит кислота или щёлочь. Этот состав рассчитан на весь эксплуатационный период. Если батарея относится к обслуживаемому типу, тогда периодически автовладелец доливает туда небольшое количество воды по мере её испарения.
Если раствор замёрз или помутнел, но сами пластины остались целыми и пригодными к эксплуатации, можно заменить электролит. В большинстве случаев приобретают готовые растворы с нужной плотностью. Но есть и те, кто предпочитает делать их своими руками.
В большинстве случаев приобретают готовые растворы с нужной плотностью. Но есть и те, кто предпочитает делать их своими руками.
Содержание
- Состав рабочей жидкости
- Компоненты и плотность
- Требования безопасности при самостоятельном приготовлении
- Что необходимо для работы
- Как сделать смесь своими руками
- Кислотные АКБ
- Щелочные АКБ
- Какие ещё бывают электролиты
Состав рабочей жидкости
В составе электролита для автомобильных аккумуляторов присутствует несколько компонентов.
Он зависит от типа самой АКБ. Многим будет интересно узнать о том, из чего же состоит электролит, и какая жидкость находится внутри корпуса аккумулятора.
- Свинцовые. Это самые распространённые виды аккумуляторов. Здесь в состав входит серная кислота, а также дистиллированная вода.
- Щелочные. А вот для щелочных аккумуляторов используется иной состав электролита. Это 20% водный раствор калия или натрия. Состав получается крайне едким, потому при работе с ним следует быть предельно осторожным.
 Чтобы повысить эксплуатационные характеристики, в жидкость добавляют разные присадки. К примеру, моногидрат литиевые добавки.
Чтобы повысить эксплуатационные характеристики, в жидкость добавляют разные присадки. К примеру, моногидрат литиевые добавки.
Это даёт понять, из чего состоит используемый в конструкции аккумулятора жидкий электролит.
Существуют АКБ с гелевым наполнением. Это тот же электролит, но смешанный со специальными загустителями. Подобные батареи необслуживаемые. А потому приготовить гель и залить его никак не получится.
Такой состав для АКБ остаётся неизменным. Всегда рекомендуется заливать такой же электролит, который был использован производителем. Это связано ещё и с составом свинцовых пластин, где также применяются разные добавки для улучшения их характеристик.
Основной упор с позиции автомобилистов делают на электролит для кислотных аккумуляторов и их состав. Ведь именно такие АКБ применяются для запуска двигателя и питания других потребителей в машине.
Компоненты и плотность
Чтобы химические реакции внутри протекали правильно и эффективно, нужно знать, какой именно электролит следует заливать в аккумулятор.
Для таких целей используются электролитические жидкости без посторонних примесей. В противном случае они могут начать активно снижать ёмкость батареи, либо вообще не позволят источнику питания работать.
Чтобы поднять эффективность и работоспособность, используйте чистые компоненты. По регламенту при заправке свинцовых автомобильных аккумуляторов в составе серной кислоты должно быть не более 7-8% воды.
Смешивается кислота с дистиллированной очищенной водой. В ней не должно быть никаких солей и прочих минералов. Потому категорически запрещено использовать водопроводную или кипячёную воду. Она быстро выведет из строя аккумулятор, а также может спровоцировать его взрыв, активный износ пластин.
Покупая готовый электролит, нужно смотреть на его состав и такие свойства как плотность. Для аккумуляторов это важнейший показатель. Причём плотность заливаемой электролитической жидкости зависит от региона и температурных условий, в которых эксплуатируется АКБ вместе с автомобилем.
Тут требования такие:
- Континентальный климат. Средняя температура зимой тут составляет -40 градусов Цельсия. В зимний период используют электролит плотностью 1,29 г/см3, а летом 1,25.
- Северные регионы. Это около -35 градусов зимой. Оптимально брать электролит с показателями плотности 1,27 г/см3.
- Центральный климатический регион. Это около -30 градусов зимой. Круглый год заливают состав с плотностью 1,25 г/см3.
- Южные регионы. Это морозы около -5 градусов Цельсия. Подходит электролит с плотностью 1,23 г/см3.
- Тропический климат. Даже зимой температура не ниже 5 градусов тепла. Используется состав на 1,21 г/см3.
Если говорить о щелочах, то эти компоненты поставляются в виде сухого состава. Важно, чтобы при транспортировке или во время хранения сухая щёлочь не вступала в реакцию с другими реагентами.
Гранулы нужно засыпать в дистиллированную воду, после чего перемешать. При необходимости в состав добавляют присадки.
При необходимости в состав добавляют присадки.
Требования безопасности при самостоятельном приготовлении
Если вы решили сделать электролит для заправки своей свинцовой аккумуляторной батареи в домашних условиях, то крайне важно соблюдать технику безопасности.
Согласно этим правилам, состав приготовляется при выполнении следующих условий:
- Средства защиты. Они нужны для защиты глаз, кожи и органов дыхания. Важно использовать такие средства защиты, которые будут устойчивыми к агрессивным веществам. Потому на глаза надевают очки, на руки резиновые перчатки. Желательно резиновые сапоги на ноги и защитный фартук на тело.
- Нейтрализатор. Если кислота случайно разольётся, её следует засыпать нейтрализующим составом.
 Как известно, кислота нейтрализуется щёлочью. Потому наготове следует держать водный раствор на основе кальцинированной соды, либо нашатырный спирт. Обычно пищевая сода есть в каждом доме.
Как известно, кислота нейтрализуется щёлочью. Потому наготове следует держать водный раствор на основе кальцинированной соды, либо нашатырный спирт. Обычно пищевая сода есть в каждом доме. - Ёмкость для смешивания. Перемешивать между собой ингредиенты следует только в ёмкости из стекла или пластика. Материал должно быть устойчивым к агрессивным веществам. Если это щелочной раствор, тогда берите стальную или пластиковую тару. Ни один другой материал для таких целей не подходит.
- Проветриваемое помещение. Оптимально делать это на улице под навесом. Либо выбирать помещение с хорошей вентиляцией. Выделяющие кислотные и щелочные пары могут нанести вред здоровью, проникая в организм через дыхательные пути.
- Постепенное добавление. При приготовлении смеси своими руками кислоту постепенно заливают воду небольшими порциями. Жидкость требуется регулярно помешивать при этом, и стараться не останавливаться.
Соблюдение таких требований и правил убережёт вас от ошибок, сохранит здоровье, а также позволит успешно перезалить аккумуляторную батарею.
Что необходимо для работы
Для приготовления электролитической смеси рекомендуется заранее всё подготовить.
В список основного оборудования и приспособлений входят:
- Тара для смешивания ингредиентов. Примерно на 3-4 литра. Учитывайте объём заливаемой в аккумулятор жидкости. Материал тары выбирайте исходя из типа электролита.
- Мерная ёмкость. С её помощью отмеряется необходимое количество компонентов для создания правильного аккумуляторного электролита.
- Дистиллированная вода. Лучше взять специальную воду для заправки АКБ. Причём купить в проверенном и надёжном месте. Встречаются подделки, где вместо дистиллята залита обычная вода из-под крана.
- Серная концентрированная кислота. Приобретается в специализированных магазинах. Проще посетить магазин, который занимается продажами АКБ и комплектующих к ним.
- Палочка из стекла. Нужна для перемешивания ингредиентов. Другие материалы лучше не использовать. Может возникнуть реакция.
- Ареометр.
 Бывает разной конструкции и типа. С его помощью измеряется плотность получаемой смеси.
Бывает разной конструкции и типа. С его помощью измеряется плотность получаемой смеси.
Если всё это есть, то можно приступать к работе.
Как сделать смесь своими руками
Теперь к вопросу о том, как приготовить самостоятельно электролит для своего аккумулятора.
Здесь нет ничего сложного. В основном акцент делают на технике безопасности и постепенном добавлении кислоты. Не стоит сразу всю порцию заливать в дистиллят. Думайте о собственной безопасности.
Нюансы приготовления электролитов для свинцовых типов аккумуляторов не сильно отличаются от щелочных. Но будет правильно рассмотреть их отдельно.
Кислотные АКБ
Работать нужно только в проветриваемых помещениях, где температура не превышает 25 градусов Цельсия. Прежде чем готовить смесь, определите объём жидкости, помещающейся в вашу батарею. Это около 2,5-3,8 литров для АКБ под легковые автомобили.
Прежде чем готовить смесь, определите объём жидкости, помещающейся в вашу батарею. Это около 2,5-3,8 литров для АКБ под легковые автомобили.
Электролит лучше приготовить с небольшим запасом. Буквально 300 мл.
Ориентируйтесь на климатическую обстановку. Чем температура ниже, тем более плотный электролит потребуется залить.
Чаще всего используют стандартную плотность в 1,28 г/см3. Чтобы сделать электролит для автомобильных аккумуляторов такой плотности, состав должен соблюдать пропорции, где на 1 литр дистиллята идёт 360 мл. кислоты.
Если это южные регионы с жарким климатом, тогда расчётная плотность будет около 1,24 г/см3. Здесь уже на 1 литр воды идёт 330 мл. кислоты.
Теперь пошагово о том, как правильно и самостоятельно приготовить нужный электролит для заливки внутрь своего аккумулятора:
- сначала налейте в устойчивую к реакциям ёмкость дистиллированную воду в расчётном количестве;
- тонкой струйкой постепенно начинайте вливать серную кислоту;
- параллельно помешивайте смесь стеклянной палочкой, только не быстро;
- затем сделайте промежуточные замеры плотности;
- подождите около 10-12 часов, чтобы ингредиенты полноценно вступили в реакцию;
- ещё раз воспользуйтесь ареометром, чтобы проверить плотность;
- если она ниже требуемого, добавьте немного кислоты;
- если плотность оказалась слишком высокой, разбавьте состав дистиллятом.

Затем нужно дистиллированной водой промыть аккумулятор, чтобы вывести оттуда остатки старой жидкости.
Заливается свежая смесь и АКБ ставится на зарядку. По завершении зарядки проводится контрольный замер плотности. При необходимости состав корректируется кислотой или водой.
[important] Показатели плотности будут правильными лишь при условии, что АКБ полностью заряжена. [/important]
Даже если при смешивании получились нужные характеристики, это не означает, что после зарядки они останутся такими же.
Щелочные АКБ
Далее к вопросу приготовления электролита, но уже на щелочной основе.
Тут принимают во внимание текущее агрегатное состояние основного компонента. То есть щелочи. В основном это гранулы, либо жидкость. В жидком состоянии щёлочь смешивают с водой.
То есть щелочи. В основном это гранулы, либо жидкость. В жидком состоянии щёлочь смешивают с водой.
Если используются гранулы, тогда их следует засыпать в дистиллированную воду и перемешать палочкой из стекла. Пропорции прописаны в заводской инструкции АКБ. Поэтому стоит взглянуть на боковую часть батареи. Там должна быть наклейка.
Плотность также зависит от условий климата. При низкой температуре воздуха используется более плотная рабочая жидкость.
Есть несколько наиболее часто используемых пропорций:
- 1/5 часть сухой щёлочи на 4/5 части воды. Так получается электролитический раствор с плотностью 1,17-1,19 г/см3.
- 1/3 гранул на 2/3 воды. Актуально, если нужна плотность от 1,19 до 1,21 единиц.
- 1 к 1. Это равная пропорция. Она необходима для создания раствора с минимальными показателями температуры застывания.
После смешивания полученный состав следует оставить в течение 6 часов, герметично закрыв крышкой. Если будет контакт с воздухом, это приведёт к деградации смеси, и её свойства ухудшатся.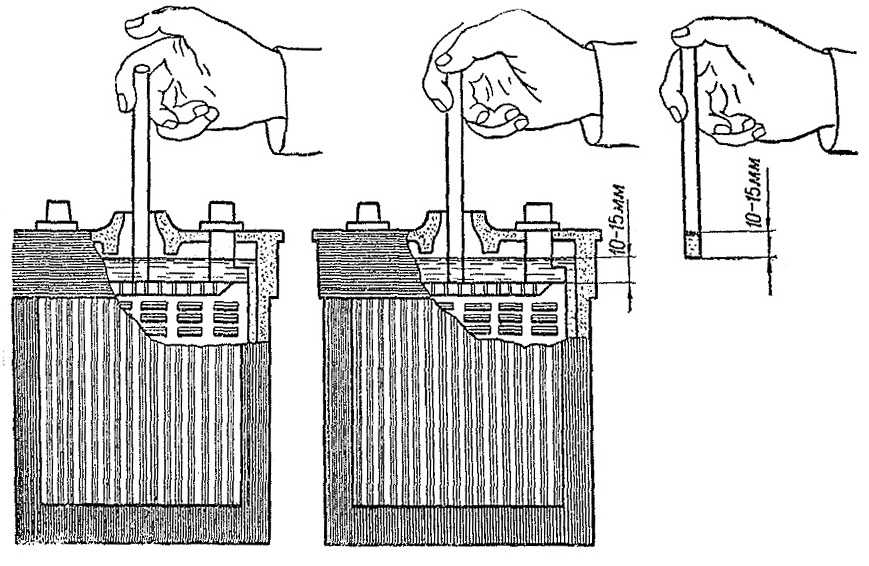
За время выдержки часть щелочей выпадает в осадок. Заливать внутрь аккумулятора необходимо только светлую жидкость, без осадка.
Если внутрь батареи попадут твёрдые фракции, это приведёт к замыканию электродов, и быстрому выходу из строя аккумулятора.
Какие ещё бывают электролиты
Если говорить о самостоятельном приготовлении электролита, проводимого в домашних условиях, то тут практикуется только жидкий щелочной и кислотный тип смеси. Причём первый делают намного чаще.
Остальные виды электролитических составов не готовят самостоятельно. Это касается гелевых и AGM аккумуляторов. Потому пытаться их перезалить своими силами не рекомендуется. Технологически это сложно. Плюс эти батареи относятся к числу необслуживаемых. Чтобы добраться до электролита, придётся нарушать герметичность корпуса. А это уже крайне опасная затея. Ничем хорошим для чрезмерно экономного автовладельца это не закончится.
В самостоятельном обслуживании аккумуляторных батарей, которые предусматривают наличие крышек с доступом к электролиту, нет ничего сложного. Тут главное — быть внимательным, осторожным и последовательным в своих действиях.
Тут главное — быть внимательным, осторожным и последовательным в своих действиях.
Рассчитать пропорции между водой и кислотой, либо щёлочью, легко. Можно ориентироваться на таблицы по ГОСТу, либо просто вооружиться калькулятором.
Вы когда-нибудь делали электролит своими руками? Почему отказались от идеи его покупки в готовом виде? Для какого аккумулятора готовили смесь? Каким получился результат?
Делитесь своим опытом и личными наблюдениями в комментариях.
Подписывайтесь, оставляйте отзывы и задавайте актуальные вопросы!
Подготовка к испытаниям ASE — свинцово-кислотные аккумуляторы
1. Аккумулятор электролит представляет собой смесь воды и:Перекись свинца.
Серная кислота.
Сульфат свинца.
Все вышеперечисленное
2. Пластины разряженного аккумулятора есть?
Два подобных металла в присутствии электролита.
Два подобных металла в присутствии воды.
Два разнородных металла в присутствии электролита.
Два разнородных металла в присутствии воды.
3. Что из нижеперечисленного относится к 12-вольтовому автомобильному аккумулятору?
Он состоит из шести последовательно соединенных ячеек.
Он состоит из трех ячеек, соединенных последовательно.
Он состоит из шести параллельно соединенных ячеек.
Он состоит из трех параллельно соединенных ячеек.
4. Правильное соотношение воды и серной кислоты в аккумуляторном электролите примерно:
80 процентов воды на 20 процентов серной кислоты.
65% воды на 35% серной кислоты.
35% воды на 65% серной кислоты.
20 процентов воды на 80 процентов серной кислоты.
5. Удельный вес от 1,170 до 1,190 при 80°F указывает на что уровень заряда батареи приблизительно равен:
75%
50%
25%
10%.
6. Каждая ячейка полностью заряженной шестиэлементной батареи производит:
1,75 вольта
4,2 вольта
1,2 вольта
2,1 вольта
7. Емкость аккумулятора определяется его:
количество пластин.
размер пластин.
оба а и Б.
ни а ни.
8. Коррозию аккумулятора можно очистить с помощью:
вода.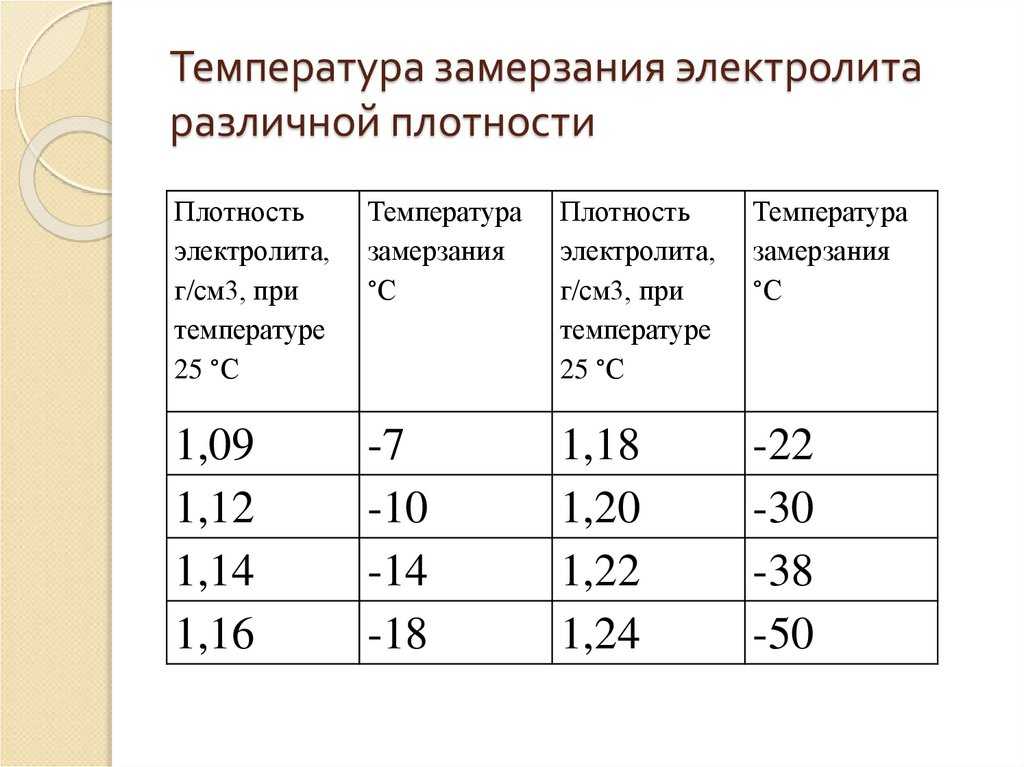
раствор пищевой соды и воды.
вода и запекание цветка.
керосин.
9. Чтобы проверить разряд батареи, вы должны подключить амперметр между:
аккумулятор и генератор.
клеммы аккумулятора (+) и (-).
клемма аккумулятора (+) и кабель заземления.
клемма аккумулятора (-) и кабель заземления.
10. Для правильного и точного выполнения испытаний с большой нагрузкой на батареях батарея должна быть не менее:
50% заряда.
25% заряда.
100% заряжен.
Заряжен на 75%.
11. При проведении проверки емкости аккумулятора (под большой нагрузкой) на Аккумулятор 12 вольт, напряжение не должно опускаться ниже 9 В.0003
12,0 вольт.
10,6 вольт.
9,6 вольт.
8,6 вольт.
12. Тест батареи под большой нагрузкой разряжает батарею для:
5 секунд.
10 секунд.
15 секунд.
20 секунд.
13. Состояние заряда герметичной батареи должно быть оценено в зависимости от напряжения холостого хода. Полностью заряженный аккумулятор который простоял несколько часов, будет разомкнутая цепь напряжение не менее:
12,6 вольт.
12,2 вольта.
11,5 вольт.
9,6 вольт.
14. Аккумулятор 400-CCA проходит испытания под нагрузкой. Правильная нагрузка будет быть:
1200 ампер.
400 ампер.
200 ампер.
330 ампер.
15. Что такое чтение на DVOM при выполнении разомкнутой цепи проверка напряжения на аккумуляторе с 50% зарядом:
12,0 вольт.
12,2 вольта.
12,4 вольта.
12,6 вольт
16. Аккумулятор, который был недозаряжен в течение длительного периода времени, стать:
зацикленный.
перегретый.
сульфатированный.
ни один из вышеперечисленных.
17. Чтобы определить, заряжена ли батарея с крышками вентиляционных отверстий или разряжен, техник использовал бы:
гидрометр.
амперметр.
нагрузочный тестер.
ни один из вышеперечисленных.
18. Какие действия должны быть предприняты с аккумулятором, который показал следующие значения удельного веса с электролитом при 80 градусах f:
Сотовый 1: 1,270
Ячейка 2: 1.260
Ячейка 3: 1.245
Ячейка 4: 1.190
Ячейка 5: 1.250
Ячейка 6: 1.260
нагрузочный тест батареи.
зарядить аккумулятор.
замените батарею.
выполните 3-минутный тест заряда.
19. Тестер, который разряжает батарею с высокой скоростью, чтобы определить его вместимость:
гидрометр.
амперметр.
нагрузочный тестер.
ни один из вышеперечисленных.
20. Какие действия должны быть предприняты с аккумулятором, который показал следующие значения удельного веса с электролитом при 80 градусах по Фаренгейту.
Сотовый 1: 1,265
Ячейка 2: 1.250
Ячейка 3: 1.245
Ячейка 4: 1.260
Ячейка 5: 1.245
Ячейка 6: 1.250
нагрузочный тест батареи.
зарядить аккумулятор.
замените батарею.
выполните 3-минутный тест заряда.
21. Необслуживаемая батарея имеет напряжение холостого хода
12,6 вольт и тест нагрузки (емкости) 8,9 вольт. Который
необходимо выполнить одно из следующих действий:
Необслуживаемая батарея имеет напряжение холостого хода
12,6 вольт и тест нагрузки (емкости) 8,9 вольт. Который
необходимо выполнить одно из следующих действий:
замените батарею.
перезарядите и снова проверьте аккумулятор.
переустановите батарею, батареи достаточно.
ни один из вышеперечисленных.
22. Какой тест выполняется на иллюстрации ниже:
Испытание большой нагрузкой.
Стартовый тест на рисование.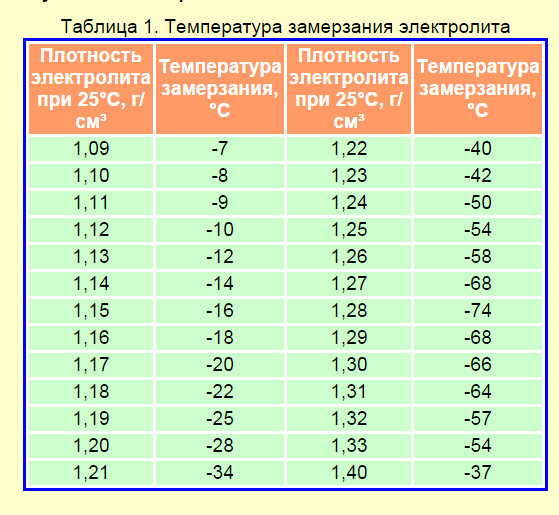
Падение напряжения на кабеле аккумулятора.
Проверка выхода системы зарядки.
23. При использовании тестера батареи Midtronics, как показано ниже. Чтобы правильно проверить состояние заряда батареи:
должен быть заряжен не менее 50%.
должно указывать напряжение холостого хода не менее 5,5 вольт.
должно указывать на то, что напряжение холостого хода должно быть не менее 9,6 вольт.
должен быть заряжен не менее 75%.
24. Тестер батареи Midtronics будет:
нагрузочный тест батареи типа VAT-40 или другой аккумуляторной нагрузки тестеры.
выполнить тест разрядки батареи, чтобы определить состояние батарея.
проверяет проводимость батареи (способность батарея для выработки тока).
только проверить состояние заряда аккумулятора.
25.
Аккумулятор многократно и сильно разряжается перед
он перезаряжается. Техник А говорит, что этот глубокий цикл
сокращает срок службы батареи. Техник B говорит, что это
не влияет на срок службы батареи. Кто прав?
Техник B говорит, что это
не влияет на срок службы батареи. Кто прав?
техник А.
техник Б.
оба техника А и Б.
ни техников A или B.
26. Аккумулятор переменного тока Delco со встроенным ареометром проверяется. Техник А говорит, что ТЕМНО-ЗЕЛЕНЫЙ глаз указывает на батарею. достаточно заряжен для дальнейшего тестирования. Техник Б говорит, что ЧИСТЫЙ глазок ареометра означает, что батарея должна быть заменены.
техник А.
техник Б.
оба техника А и Б.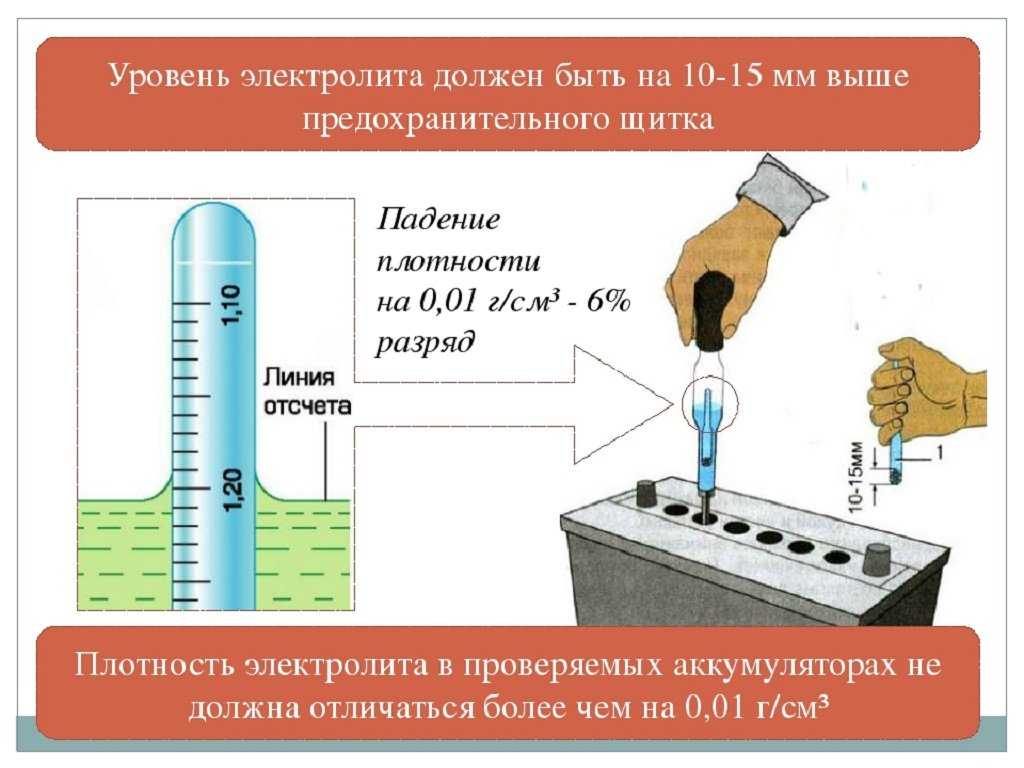
ни техников A или B.
Топ страницы |
Топ страницы
батарей | Бесплатный полнотекстовый | Концентрация добавки к электролиту для максимального сохранения энергии в свинцово-кислотных батареях
1. Введение
Добавление химической добавки в электролит свинцово-кислотной батареи может изменить удельную энергию, которую батарея может хранить. Этот факт был известен с момента изобретения батареи и в настоящее время представляет большой интерес для аккумуляторной промышленности. В этой статье представлен общий метод оценки влияния добавок к электролиту на энергоемкость свинцово-кислотной батареи и определения наилучшей концентрации добавок для использования. Рассматриваемая здесь добавка к электролиту носит довольно общий характер. Это может быть химическое соединение или смесь химических веществ; суспензия или гель, используемые для иммобилизации электролита. Единственным ограничением является то, что добавка — что бы это ни было — должна находиться в химическом равновесии и иметь низкую реакционную способность по отношению к другим компонентам батареи.
Этот факт был известен с момента изобретения батареи и в настоящее время представляет большой интерес для аккумуляторной промышленности. В этой статье представлен общий метод оценки влияния добавок к электролиту на энергоемкость свинцово-кислотной батареи и определения наилучшей концентрации добавок для использования. Рассматриваемая здесь добавка к электролиту носит довольно общий характер. Это может быть химическое соединение или смесь химических веществ; суспензия или гель, используемые для иммобилизации электролита. Единственным ограничением является то, что добавка — что бы это ни было — должна находиться в химическом равновесии и иметь низкую реакционную способность по отношению к другим компонентам батареи.
Добавки также добавляют в электролит батареи по целому ряду других причин, например, для продления срока службы батареи, уменьшения коррозии электродов, улучшения проводимости, снижения газовыделения на электродах, защиты от перезарядки или глубокой разрядки и т. д. полезное в одних отношениях может быть вредным в других. Таким образом, выбор и концентрация добавки всегда должны оцениваться с точки зрения побочных эффектов, которые она вызывает. Это означает, в частности, что добавка, повышающая энергоемкость батареи, может оказаться нежизнеспособной, по крайней мере, при определенных концентрациях, из-за других нежелательных эффектов, которые она вызывает.
Таким образом, выбор и концентрация добавки всегда должны оцениваться с точки зрения побочных эффектов, которые она вызывает. Это означает, в частности, что добавка, повышающая энергоемкость батареи, может оказаться нежизнеспособной, по крайней мере, при определенных концентрациях, из-за других нежелательных эффектов, которые она вызывает.
Существуют сотни статей, книг и патентов, посвященных добавкам к электролиту и их влиянию на свинцово-кислотные аккумуляторы. Полный обзор литературы вышел бы за рамки настоящей статьи. Глава 3 книги Павлова [1] содержит сравнительно краткий обзор основной литературы по теме примерно до 2011 года. Речь идет о классических неорганических добавках (фосфорная кислота, борная кислота, лимонная кислота, сульфат стронция, сульфат натрия), углеродных суспензиях, и эмульсии органических полимеров. В настоящее время активно изучается большой потенциал ионных жидкостей в качестве добавок к электролитам [2] благодаря способности этих солей расширять электрохимическое окно воды [3,4,5]. Кроме того, большой практический интерес представляет изучение добавок, образующих гелеобразные электролиты, в связи с их применением в области электродвижения [6,7,8]. Интересное исследование добавления добавки в гелеобразный электролит недавно было представлено в [9].].
Кроме того, большой практический интерес представляет изучение добавок, образующих гелеобразные электролиты, в связи с их применением в области электродвижения [6,7,8]. Интересное исследование добавления добавки в гелеобразный электролит недавно было представлено в [9].].
Разнообразие доступных добавок делает невозможным дать общие правила в отношении наилучшей добавки и наилучшей концентрации для использования для данной цели. Поэтому настоящая статья по необходимости должна быть несколько ограничена по объему. По этой причине, игнорируя другие эффекты, в данной статье основное внимание уделяется влиянию добавок на энергоемкость аккумулятора. Представленный анализ обеспечивает общий способ оценки влияния любой добавки к электролиту в отношении этой емкости. Он также показывает, как концентрация добавки, которая максимизирует эту способность, может быть определена на основе небольшого количества основных экспериментальных данных. Конечно, положительная оценка добавки в отношении энергоемкости батареи не исключает необходимости выяснить, вызывает ли добавка нежелательные побочные эффекты и в какой степени. Однако при поиске наилучших добавок для увеличения энергоемкости батареи результаты настоящей статьи могут помочь быстро отказаться от неэффективных добавок, что значительно упростит процесс выбора.
Однако при поиске наилучших добавок для увеличения энергоемкости батареи результаты настоящей статьи могут помочь быстро отказаться от неэффективных добавок, что значительно упростит процесс выбора.
Центральное место в анализе этой статьи занимает наблюдение, что при любой конечной температуре внутренняя энергия любой системы конечного объема должна быть конечной. Это следствие принципа сохранения энергии или первого закона термодинамики. При довольно широких предположениях, которым удовлетворяет большинство природных систем, и в частности растворы электролитов, это наблюдение вместе со вторым законом термодинамики подразумевает ограничение удельной свободной энергии, которую электролит может запасать и отдавать изотермически. Этот вопрос обсуждается в разделе 3. Подобный анализ ранее применялся в [10] для определения максимальной энергоемкости живой клетки — задачи, концептуально аналогичной рассматриваемой здесь.
Настоящий подход приводит к определению предельной кривой батареи (раздел 4). Эта кривая определяет предельную концентрацию компонентов электролита, при превышении которой в аккумуляторе происходят необратимые изменения или повреждения, что может привести к сокращению срока службы аккумулятора. В случае свинцово-кислотного аккумулятора это повреждение проявляется в выделении O 2 на положительном электроде при избыточном заряде или в необратимом сульфатировании отрицательного электрода при избыточном разряде. Упомянутая предельная кривая служит инструментом не только для определения значения максимального увеличения энергоемкости батареи, которое может быть достигнуто при использовании данной добавки к электролиту, но и для определения значения концентрации добавки, обеспечивающей это максимальное увеличение. . Это также приводит к установлению теоретических пределов заряда, в пределах которых батарея может работать без необратимых изменений. Практический пример применения полученных результатов приведен в разделе 5.9.0010
Эта кривая определяет предельную концентрацию компонентов электролита, при превышении которой в аккумуляторе происходят необратимые изменения или повреждения, что может привести к сокращению срока службы аккумулятора. В случае свинцово-кислотного аккумулятора это повреждение проявляется в выделении O 2 на положительном электроде при избыточном заряде или в необратимом сульфатировании отрицательного электрода при избыточном разряде. Упомянутая предельная кривая служит инструментом не только для определения значения максимального увеличения энергоемкости батареи, которое может быть достигнуто при использовании данной добавки к электролиту, но и для определения значения концентрации добавки, обеспечивающей это максимальное увеличение. . Это также приводит к установлению теоретических пределов заряда, в пределах которых батарея может работать без необратимых изменений. Практический пример применения полученных результатов приведен в разделе 5.9.0010
2. Свободная энергия аккумуляторных электролитов с добавками
Свободная энергия раствора или смеси представляет собой сумму свободных энергий ее компонентов.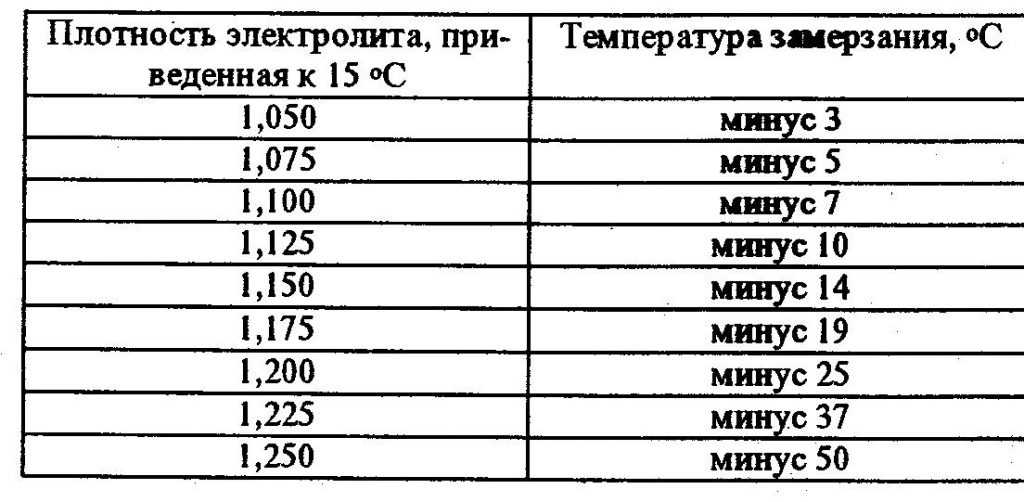 Так, если nh3O, nh3SO4 и n j (j = 1, 2, …, k) обозначают соответственно моли воды, серной кислоты и примесей, то свободная энергия Гиббса атома Pb — кислотный аккумуляторный электролит при давлении р и абсолютной температуре Т определяется по формуле:
Так, если nh3O, nh3SO4 и n j (j = 1, 2, …, k) обозначают соответственно моли воды, серной кислоты и примесей, то свободная энергия Гиббса атома Pb — кислотный аккумуляторный электролит при давлении р и абсолютной температуре Т определяется по формуле:
Здесь µh3O, µh3SO4 и µ j — парциальные молярные свободные энергии Гиббса или химические потенциалы воды, серной кислоты и добавок соответственно, а C — произвольная константа. Химический потенциал любого компонента раствора или смеси всегда можно выразить в виде:
В этом уравнении μ o – химический потенциал рассматриваемого компонента в стандартном состоянии при давлении p o и температуре T, а V¯ – парциальный молярный объем того же компонента, R – универсальный газ константа, Δp означает p − p o и, наконец, a – активность или эффективная концентрация рассматриваемого компонента.
Далее молярное соотношение:
принимается за меру концентрации растворителя, а концентрации серной кислоты и добавок измеряются в моляльностях (моль на кг H 2 O) и обозначаются bh3SO4 и b j соответственно. То есть:
То есть:
а также:
где M H 2 O = 18,015 × 10 −3 кг·моль −1 – молярная масса воды. В этих обозначениях активности компонентов электролита можно выразить как:
а также:
где γh3O, γh3SO4 и γ j – соответствующие коэффициенты активности, в общем случае зависящие от nh3O, nh3SO4 и n j , кроме Т и с. Выражая µh3O, µh3SO4 и µ j в уравнении (2) и используя уравнения (6)–(8), мы можем записать уравнение (1) в виде:
При написании этого уравнения мы использовали следующее уравнение:
которая связывает парциальные молярные объемы V¯h3O, V¯h3SO4 и V¯j компонентов электролита с объемом электролита, V. известное уравнение:
Отсюда и из уравнения (9) получается свободная энергия Гельмгольца электролита:
Приведенные выше формулы являются стандартными. Однако, как видно из уравнения (7), введенный выше коэффициент активности γh3SO4 относится к общей концентрации серной кислоты. Этот коэффициент следует отличать от среднего коэффициента активности ионов серной кислоты, который может быть обозначен как γh3SO4± и обычно рассматривается в электрохимии (хотя и реже при работе со свинцово-кислотными батареями). Использование γh3SO4 вместо γh3SO4± упрощает последующие формулы, поскольку детали диссоциации серной кислоты на ионы не играют явной роли в данном подходе. Соотношение между двумя коэффициентами активности:
Однако, как видно из уравнения (7), введенный выше коэффициент активности γh3SO4 относится к общей концентрации серной кислоты. Этот коэффициент следует отличать от среднего коэффициента активности ионов серной кислоты, который может быть обозначен как γh3SO4± и обычно рассматривается в электрохимии (хотя и реже при работе со свинцово-кислотными батареями). Использование γh3SO4 вместо γh3SO4± упрощает последующие формулы, поскольку детали диссоциации серной кислоты на ионы не играют явной роли в данном подходе. Соотношение между двумя коэффициентами активности:
Это можно получить из уравнения (7), если ah3SO4 выразить как функцию γh3SO4± в соответствии со стандартными формулами для ионных растворенных веществ (см., например, раздел 7.4 в [11]). Как γh3SO4, так и γh3SO4± зависят от bh3SO4 и лучше всего определяются из эксперимента.
Важное упрощение уравнения (12) достигается введением следующего уравнения:
доказательство которого в несколько измененном виде дано в [10].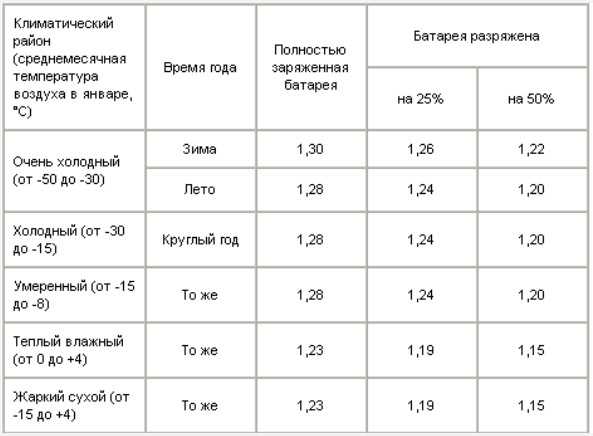 В этом уравнении мы устанавливаем:
В этом уравнении мы устанавливаем:
а также:
где символ Π обозначает произведение последовательности, т. е.:
Переписывая правую часть уравнения (12) как сумму двух частей и используя уравнение (14), свободная энергия Гельмгольца электролита может быть выражена в общем виде как:
где функции Ψ′ и Ψ″ задаются формулой:
а также:
соответственно. Как обсуждается в следующем разделе, Ψ″ — это часть Ψ, которая определяет допустимый диапазон электролита. Таким образом, что касается определения этого диапазона, уравнение (20) позволяет нам заменить все добавки к электролиту одной-единственной фиктивной добавкой в количестве n добавить и коэффициент активности γ добавить . Такая добавка будет называться эквивалентной добавкой.
Уравнение (20) достаточно общее. Это относится к любой комбинации добавок, будь то жидкости, твердые суспензии, коллоиды или любая их смесь. Независимо от количества и вида добавок значения n add и γ add можно определить экспериментально, используя тот факт, что, как обсуждается в следующем разделе, существует предел максимального количества свободной энергии, которое любая конечная система может храниться в изотермических условиях. Детали соответствующей экспериментальной процедуры приведены в разделе 5.9.0010
Это относится к любой комбинации добавок, будь то жидкости, твердые суспензии, коллоиды или любая их смесь. Независимо от количества и вида добавок значения n add и γ add можно определить экспериментально, используя тот факт, что, как обсуждается в следующем разделе, существует предел максимального количества свободной энергии, которое любая конечная система может храниться в изотермических условиях. Детали соответствующей экспериментальной процедуры приведены в разделе 5.9.0010
3. Предел свободной энергии раствора электролита
При любой заданной конечной температуре количество нетепловой энергии, которое конечная система может хранить или отдавать, конечно. Это прямое следствие первого закона термодинамики. Это подразумевает предел максимальной энергии, которую система может хранить. При рассмотрении в свете второго закона термодинамики предел максимальной энергии влечет за собой ограничение на состояния, которых система может достичь, не претерпевая необратимых изменений своих конститутивных свойств.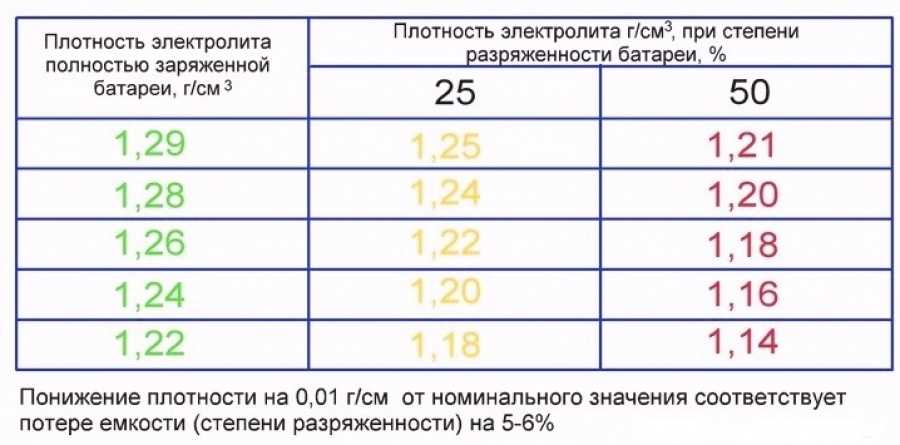 При достаточно общих предположениях такое ограничение определяет область всех состояний, в которые система может попасть без необратимых изменений своих свойств. Эта область является (термодинамически) допустимым диапазоном системы. Его границы являются предельной поверхностью системы. Частный случай решений, который нас интересует в этой статье, подробно обсуждается в [10]. Систематическое введение по этому вопросу, включая общие системы, содержится в [12].
При достаточно общих предположениях такое ограничение определяет область всех состояний, в которые система может попасть без необратимых изменений своих свойств. Эта область является (термодинамически) допустимым диапазоном системы. Его границы являются предельной поверхностью системы. Частный случай решений, который нас интересует в этой статье, подробно обсуждается в [10]. Систематическое введение по этому вопросу, включая общие системы, содержится в [12].
Из классической термодинамики мы знаем, что при постоянной температуре количество нетепловой энергии, которую система может накапливать или отдавать, равно изменению свободной энергии Гельмгольца системы. Однако не вся свободная энергия системы подвергается термодинамическому ограничению. Например, любая чисто механическая часть свободной энергии системы, например потенциальная энергия, обусловленная весом системы, не ограничивается термодинамикой. Поэтому при поиске допустимого диапазона системы следует пренебречь той частью свободной энергии системы, которая не ограничена термодинамикой.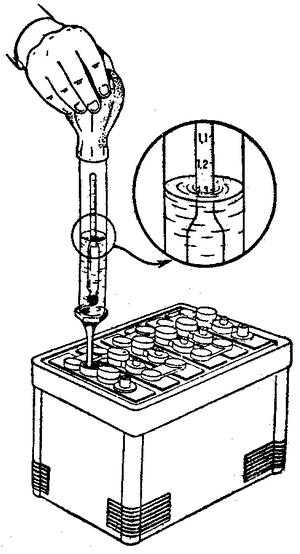
В данном случае часть свободной энергии электролита, не связанная термодинамикой, равна Ψ′. Это видно из уравнения (19), поскольку Ψ′ равно сумме свободных энергий компонентов электролита в их стандартном состоянии. Таким образом, Ψ′ зависит от количеств этих компонентов (nh3O, nh3SO4, n1, n2, …, nk) независимо от того, находятся ли они в растворе или отделены друг от друга. Поскольку не существует термодинамического предела для количества материала, которое можно объединить для образования системы, нет термодинамического предела для значений, которые может принимать Ψ′. Ситуация совершенно иная для Ψ″. Как следует из уравнений (6)–(8) и (20), Ψ″ зависит от концентрации вышеуказанных компонентов. Таким образом, это относится к энергии, которую эти компоненты имеют в результате их взаимного взаимодействия после их смешивания. Следовательно, любое термодинамическое ограничение энергии раствора электролита должно быть ограничением Ψ″, хотя полная свободная энергия раствора представляет собой сумму Ψ″ плюс часть энергии Ψ′, которую несет каждый компонент независимо от присутствия других компонентов.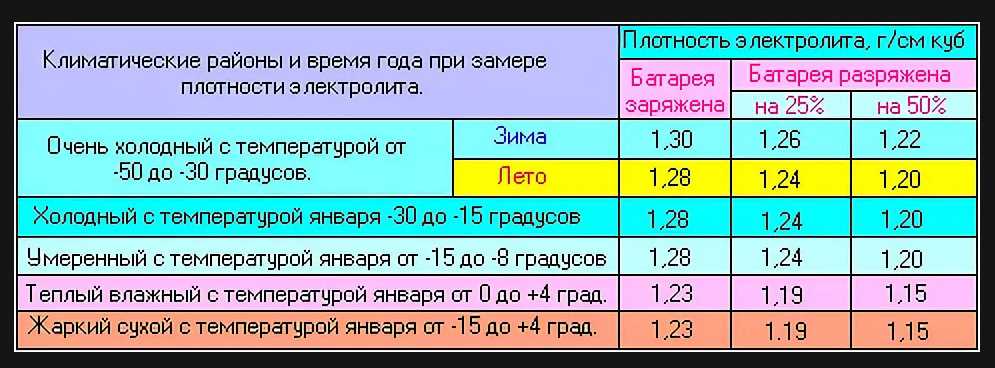
На самом деле можно проверить, что Ψ″ составляет лишь небольшую часть Ψ. Самая большая часть общей свободной энергии, которую батарея может накапливать или отдавать, связана с Ψ′ и происходит от изменений nh3O и nh3SO4, возникающих в результате химических реакций, происходящих в электролите. Однако при всей своей малости Ψ″ определяет допустимый диапазон электролита. Как следствие, Ψ″ устанавливает предел общей свободной энергии батареи, Ψ, поскольку ограничивает диапазон изменения nh3O и nh3SO4. Аналогичная ситуация может иметь место и для растворов, содержащих химически реагирующие компоненты. Например, в случае живой клетки та часть свободной энергии цитозоля, которая определяет допустимый диапазон клетки, составляет лишь долю полной свободной энергии цитозоля [10]. И в этом случае малая часть полной свободной энергии цитозоля ограничивает количество компонентов раствора, тем самым ограничивая энергию, которую живая клетка может запасать или выделять, а значит, и ее работоспособность.
Чтобы следующий анализ не зависел от количества электролита, удобно ссылаться на молярную концентрацию Ψ″ на кг растворителя. Эта концентрация энергии обозначается ψ″ и получается путем деления обеих частей уравнения (20) на nh3OMh3O (т. е. на вес в килограммах воды, содержащейся в электролите):
где V¯ – объем электролита на моль растворителя:
В обоих приведенных выше уравнениях nh3O является переменной, поскольку количество молей воды в электролите меняется по мере зарядки или разрядки аккумулятора.
В дальнейшем температура считается постоянной. Кроме того, зависимость свободной энергии от р будет игнорироваться, как это обычно делается в отсутствие газообразных фаз, а также при работе при постоянном или близком к нему давлении. Таким образом, если ψmax″ является значением, которое ψ″ достигает на термодинамическом пределе, упомянутом выше, следующее соотношение:
относится ко всем состояниям, которых может достичь электролит при рассматриваемой температуре. Вместе с уравнением (21) уравнение (23) определяет допустимый диапазон электролита в пространстве переменных nh3O, nh3SO4, nadd. Предельная поверхность электролита является границей этого диапазона:
Вместе с уравнением (21) уравнение (23) определяет допустимый диапазон электролита в пространстве переменных nh3O, nh3SO4, nadd. Предельная поверхность электролита является границей этого диапазона:
Следовательно, она эквипотенциальна для ψ″ или Ψ″ (однако одна и та же поверхность не является эквипотенциальной для полной свободной энергии системы или ее части Ψ′, как уравнения (18) и (19 ) показывать).
Несмотря на то, что V¯ является переменной величиной, она претерпевает незначительные изменения (менее 0,3%) при нормальной работе от батареи. Что касается настоящего анализа, член p° V¯/Mh3O, фигурирующий в уравнении (21), можно рассматривать как константу. Как следствие, его вкладом в ψ″ и ψmax″ можно в хорошем приближении пренебречь при применении уравнений (23) и (24), поскольку добавление или вычитание постоянного члена к обеим частям этих соотношений несущественно. Соответственно, при определении допустимого диапазона и предельной поверхности электролита или предельной кривой батареи в дальнейшем мы будем игнорировать член −p° V¯/Mh3O в правой части уравнения (21).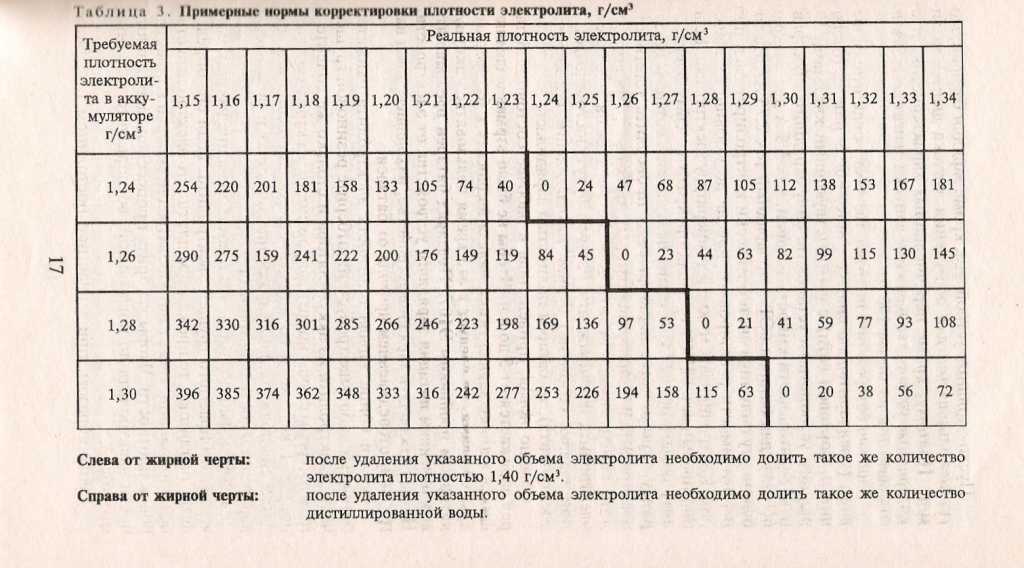 С этой оговоркой допустимый диапазон электролита может быть выражен как:
С этой оговоркой допустимый диапазон электролита может быть выражен как:
В трехмерном пространстве (nh3O, nh3SO4, n добавить ) это соотношение определяет область всех состояний, которых может достичь электролит без необратимых изменений. Границей этой области является предельная поверхность электролита:
и представляет собой поверхность в упомянутом выше трехмерном пространстве.
4. Допустимый диапазон батареи и предельная кривая
Не все состояния допустимого диапазона из уравнения (25) доступны для электролита внутри батареи. В нормальных условиях эксплуатации батарея не обменивается веществом с окружающей средой. В этих условиях общее количество молекул воды и серной кислоты внутри аккумулятора остается постоянным. Это прямое следствие известной общей реакции, управляющей работой батареи:
Реакция идет слева направо во время разрядки батареи. Это производит две молекулы воды на каждые две молекулы серной кислоты, которые потребляются. Зарядка батареи запускает реакцию в противоположном направлении, таким образом производя две молекулы серной кислоты на каждые две молекулы потребляемой воды. В обоих случаях сумма nh3O и nh3SO4 остается постоянной. Таким образом, в любой момент процесса зарядки или разрядки аккумулятора мы имеем:
Это производит две молекулы воды на каждые две молекулы серной кислоты, которые потребляются. Зарядка батареи запускает реакцию в противоположном направлении, таким образом производя две молекулы серной кислоты на каждые две молекулы потребляемой воды. В обоих случаях сумма nh3O и nh3SO4 остается постоянной. Таким образом, в любой момент процесса зарядки или разрядки аккумулятора мы имеем:
где n¯ — константа. Значение этой константы зависит от подготовки батареи и может быть определено по значениям nh3O и nh3SO4 в любой момент срока службы батареи. В частности, пусть nh3Oo и nh3SO4o — значения nh3O и nh3SO4 электролита, который необходимо ввести в батарею. Они совпадают со значениями nh3O и nh3SO4 электролита внутри батареи, поскольку батарея начинает работать после заполнения. Следовательно, должно выполняться следующее уравнение:
который фиксирует n¯.
Уравнение (28) можно использовать для исключения переменной nh3O из уравнений (25) и (26). Это уменьшает количество независимых переменных, появляющихся в этих уравнениях, тем самым еще больше ограничивая диапазон состояний, которые может достичь электролит. Более явно, вводя уравнение (28) в уравнение (25), мы получаем допустимый диапазон батареи:
Это уменьшает количество независимых переменных, появляющихся в этих уравнениях, тем самым еще больше ограничивая диапазон состояний, которые может достичь электролит. Более явно, вводя уравнение (28) в уравнение (25), мы получаем допустимый диапазон батареи:
Это область плоскости (nh3SO4, n добавить ), которая содержит все состояния, которые электролит может достичь при нормальной работе батареи без необратимых изменений. Его границей является предельная кривая батареи. Его получают, взяв знак равенства в уравнении (30):
Эта кривая на плоскости (nh3SO4, n add ) ограничивает область всех состояний, которых электролит может достичь обратимо при работе внутри батареи.
Уравнения (27)–(31) применимы к свинцово-кислотным батареям, содержащим нереагирующие добавки к электролиту, т. е. добавки, которые не вступают в химическую реакцию между собой или с другими компонентами батареи. Нереагирующие добавки обычно используются в коммерческих аккумуляторах. Как указывалось ранее, это единственные добавки, о которых мы говорим в этой статье. Те же уравнения применимы, в частности, и при отсутствии добавок к электролиту, когда n add = 0.
Как указывалось ранее, это единственные добавки, о которых мы говорим в этой статье. Те же уравнения применимы, в частности, и при отсутствии добавок к электролиту, когда n add = 0.
Типичная предельная кривая ψ″ = ψmax″ и, таким образом, сдвигает состояние батареи вверх, т. е. по линии AB на рис. 1. Допустимый диапазон батареи — заштрихованная область внутри кривой. Количество добавки в электролите остается постоянным во время заряда и разряда, так как добавка химически неактивна. Таким образом, зарядка или разрядка аккумулятора в этом диапазоне смещает состояние аккумулятора вверх и вниз по вертикальной линии, n прибавить = постоянное, в плоскости рисунка 1. В электролите происходят необратимые изменения, если предельная кривая аккумулятора превышен. В частности, зарядка аккумулятора увеличивает nh3SO4 и, таким образом, сдвигает состояние аккумулятора вверх, т. е. по линии АВ на рис. 1.
Процесс обратим, пока состояние батареи остается в пределах сегмента AB. Однако при превышении точки А на положительном электроде происходит выделение кислорода, что делает процесс необратимым. Аналогичная ситуация возникает при разрядке. В этом случае в процессе разрядки расходуется серная кислота, и состояние батареи движется вниз по линии AB. Точка B на предельной кривой батареи — это предел обратимого разряда. За пределами этой точки напряжение батареи становится ниже напряжения, необходимого для поддержания реакции отрицательного электрода:
Однако при превышении точки А на положительном электроде происходит выделение кислорода, что делает процесс необратимым. Аналогичная ситуация возникает при разрядке. В этом случае в процессе разрядки расходуется серная кислота, и состояние батареи движется вниз по линии AB. Точка B на предельной кривой батареи — это предел обратимого разряда. За пределами этой точки напряжение батареи становится ниже напряжения, необходимого для поддержания реакции отрицательного электрода:
в химическом равновесии. Это приводит к необратимому протеканию реакции вправо. Это явление происходит сравнительно быстро и известно как сульфатация. Это приводит к образованию нерастворимых кристаллов PbSO 2 на отрицательном электроде с сопутствующим выделением водорода. Выделение кислорода и водорода в пределах допустимого диапазона связано с электрохимическими окнами воды. Читатель может обратиться к соответствующей литературе за подробностями о химических реакциях, которые регулируют электрохимическую стабильность воды в водных электролитах (см. , например, ([13,14,15,16,17])).
, например, ([13,14,15,16,17])).
Ширина допустимого диапазона вдоль вертикальной линии через n добавить обозначена как Δnh3SO4 на рисунке 1. Эта ширина представляет собой максимальное количество серной кислоты, которое на килограмм воды-растворителя может обратимо реагировать в соответствии с уравнением (27 ). Таким образом, чем больше эта ширина, тем большее количество энергии аккумулятор может хранить и производить без ухудшения качества электролита. Максимальное значение Δnh3SO4 достигается при n add = nadd∗ и обозначено на рисунке выше как Δnh3SO4∗. Поскольку количество воды-растворителя зависит от состояния заряда батареи, может быть удобно определять концентрацию добавки относительно фиксированного состояния заряда батареи. Это будет считаться гипотетическим состоянием полного разряда, которого батарея достигнет, когда вся серная кислота в электролите будет израсходована в соответствии с уравнением (27). В этом состоянии количество воды в электролите будет n h3O= n¯, согласно уравнению (28).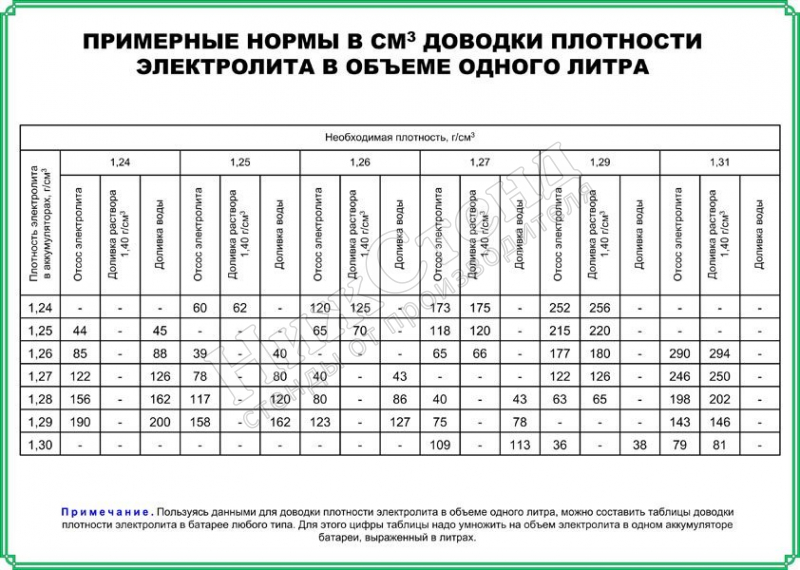 Следовательно, применительно к этому гипотетическому состоянию молярная концентрация добавки к электролиту, соответствующая nadd∗, определяется выражением:
Следовательно, применительно к этому гипотетическому состоянию молярная концентрация добавки к электролиту, соответствующая nadd∗, определяется выражением:
Это можно рассматривать как номинальную молярность добавки, которая требуется для обеспечения максимальной емкости накопления энергии в батарее.
Пусть Δnh3SO4o будет значением Δnh3SO4, когда электролит батареи не содержит добавок (см. рис. 1). Поскольку энергия, которую батарея может накапливать или отдавать, пропорциональна количеству молей серной кислоты, которые подчиняются уравнению (27), отношение:
представляет собой наибольшее относительное увеличение максимальной емкости накопления энергии, которое может быть получено от данной добавки к электролиту. Конечно, η max зависит от используемой добавки из-за зависимости от добавки предельной кривой батареи.
5. Экспериментальное определение предельной кривой
Для определения предельной кривой батареи нам необходимо знать значения ψmax″ и γ добавить , которые необходимо ввести в уравнение (31).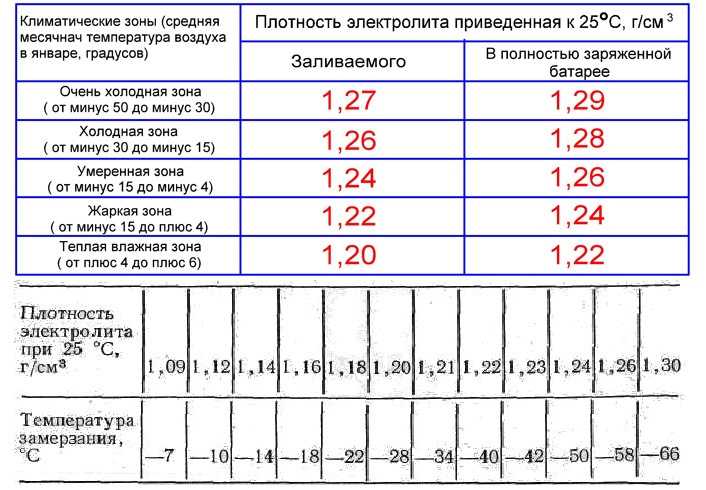 Эти значения могут быть определены экспериментально следующим образом: Начнем с того, что уравнение (31) верно, в частности, когда электролит не содержит добавок. В этом случае № добавить = 0 и уравнение (31) сводится к:
Эти значения могут быть определены экспериментально следующим образом: Начнем с того, что уравнение (31) верно, в частности, когда электролит не содержит добавок. В этом случае № добавить = 0 и уравнение (31) сводится к:
Это уравнение применимо к пределу допустимого диапазона батареи. Появляющаяся здесь величина n¯ определяется уравнением (29). Это зависит от подготовки батареи, но не от наличия добавок к электролиту. Таким образом, работая на аккумуляторе, лишенном добавки к электролиту, мы увеличиваем состояние заряда аккумулятора до тех пор, пока не достигнем предельной точки, за которой кислород начинает выделяться на положительном электроде в условиях разомкнутой цепи (точка A° на рис. 1). Появление этого необратимого явления свидетельствует о том, что состояние батареи достигло предельной кривой. Мы определяем значение nh3SO4 на этом пределе и подставляем его в уравнение (35). Таким образом, мы можем вычислить ψmax″.
Как известно, концентрация серной кислоты и напряжение аккумуляторной батареи связаны друг с другом (см. , например, [18,19,20,21]). Следовательно, вместо того, чтобы определять предельное значение nh3SO4, мы можем определить максимальное напряжение холостого хода, при котором батарея поддерживает свой заряд без образования кислорода на положительном электроде. Это напряжение значительно выше стандартного напряжения (1,229 В) электролиза воды [22] из-за перенапряжения, возникающего на электродах батареи. Степень перенапряжения зависит от свойства поверхности электродов и наличия в электродах небольших количеств различных добавок, вводимых при их изготовлении. Как видно из уравнений (20) и (21), функции Ψ″ и ψ″ не зависят от свободной энергии электродов. Однако перенапряжение, создаваемое электродами, влияет на допустимый диапазон батареи и предельную характеристику, поскольку влияет на предельное значение nh3SO4 и, следовательно, на значение ψmax″. Это делает допустимый диапазон батареи и предельную кривую зависящими от свойств батареи в целом, а не только от свойств ее электролита.
, например, [18,19,20,21]). Следовательно, вместо того, чтобы определять предельное значение nh3SO4, мы можем определить максимальное напряжение холостого хода, при котором батарея поддерживает свой заряд без образования кислорода на положительном электроде. Это напряжение значительно выше стандартного напряжения (1,229 В) электролиза воды [22] из-за перенапряжения, возникающего на электродах батареи. Степень перенапряжения зависит от свойства поверхности электродов и наличия в электродах небольших количеств различных добавок, вводимых при их изготовлении. Как видно из уравнений (20) и (21), функции Ψ″ и ψ″ не зависят от свободной энергии электродов. Однако перенапряжение, создаваемое электродами, влияет на допустимый диапазон батареи и предельную характеристику, поскольку влияет на предельное значение nh3SO4 и, следовательно, на значение ψmax″. Это делает допустимый диапазон батареи и предельную кривую зависящими от свойств батареи в целом, а не только от свойств ее электролита.
Процедура определения γ add аналогична процедуре определения ψmax″. Однако в этом случае электролит батареи должен содержать известное количество добавки. Снова заряжаем аккумулятор до предела, при котором на положительном электроде выделяется кислород в условиях разомкнутой цепи. Определяем соответствующее значение nh3SO4 и подставляем его вместе с рассматриваемым значением n и добавляем в уравнение (31). Поскольку ψmax″ уже определено, единственным неизвестным в этом уравнении является γ добавить , что можно, таким образом, определить. Из-за наличия трансцендентных членов значение γ add лучше всего вычислять графически или численно.
Однако в этом случае электролит батареи должен содержать известное количество добавки. Снова заряжаем аккумулятор до предела, при котором на положительном электроде выделяется кислород в условиях разомкнутой цепи. Определяем соответствующее значение nh3SO4 и подставляем его вместе с рассматриваемым значением n и добавляем в уравнение (31). Поскольку ψmax″ уже определено, единственным неизвестным в этом уравнении является γ добавить , что можно, таким образом, определить. Из-за наличия трансцендентных членов значение γ add лучше всего вычислять графически или численно.
Для примера возьмем обычный автомобильный аккумулятор при комнатной температуре (T = 25 °C = 298,15 K). Мы предполагаем, что на момент изготовления электролит в аккумуляторе содержит 1 кг воды с молярной концентрацией серной кислоты bh3SO4o = 6 моль/кг. Это означает, что nh3Oo = 55,51 моль и nh3SO4o = 6 моль. Таким образом, n¯ = 55,51 + 6 = 61,51 моль, как следует из уравнения (29). Оставив электролит без присадок, зарядим батарею и найдем, что bh3SO4 = 7,25 моль/кг — это наибольшая концентрация серной кислоты, которую батарея может поддерживать в условиях разомкнутой цепи без образования кислорода на своем положительном электроде (эта концентрация соответствует напряжению 2,16 В — или 12,96 В для шестиэлементной батареи — по имеющимся в литературе данным [19]). Как видно, заряд и разряд батареи происходят при постоянном n¯. Таким образом, с учетом уравнения (28) находим, что приведенное выше значение bh3SO4 = 7,25 моль/кг означает nh3SO4 = 7,10 моль и nh3O = 54,41 моль в электролите батареи. Вводя в уравнение (35) значения γh3O и γh3SO4, соответствующие этому значению bh3SO4, доступные из литературы и приведенные в Приложении, и учитывая, что R = 8,3143 Дж·К -1 ·моль -1 и Mh3O = 18,015 × 10 -3 кг·моль -1 , вычисляем, что для рассматриваемого аккумулятора ψmax″ = -20,25 Дж·кг -1 .
Оставив электролит без присадок, зарядим батарею и найдем, что bh3SO4 = 7,25 моль/кг — это наибольшая концентрация серной кислоты, которую батарея может поддерживать в условиях разомкнутой цепи без образования кислорода на своем положительном электроде (эта концентрация соответствует напряжению 2,16 В — или 12,96 В для шестиэлементной батареи — по имеющимся в литературе данным [19]). Как видно, заряд и разряд батареи происходят при постоянном n¯. Таким образом, с учетом уравнения (28) находим, что приведенное выше значение bh3SO4 = 7,25 моль/кг означает nh3SO4 = 7,10 моль и nh3O = 54,41 моль в электролите батареи. Вводя в уравнение (35) значения γh3O и γh3SO4, соответствующие этому значению bh3SO4, доступные из литературы и приведенные в Приложении, и учитывая, что R = 8,3143 Дж·К -1 ·моль -1 и Mh3O = 18,015 × 10 -3 кг·моль -1 , вычисляем, что для рассматриваемого аккумулятора ψmax″ = -20,25 Дж·кг -1 .
Для определения γ добавить , добавляем произвольное количество рассматриваемой добавки в электролит аккумулятора. Пусть n добавляет, например, = 5 моль. Эксплуатируя модифицированную таким образом батарею, мы находим, что предел разомкнутой цепи для выделения кислорода на положительном электроде наступает, когда заряд батареи соответствует количеству серной кислоты, скажем, nh3SO4 = 6,74 моль. Подставляя это значение nh3SO4 в уравнение (35), мы вычисляем, что γ добавить = 0,64, что можно проверить из того же уравнения, если мы установим n добавить = 5 моль, n¯ = 61,51 моль и ψmax″ = -20,25 Дж·кг -1 .
Пусть n добавляет, например, = 5 моль. Эксплуатируя модифицированную таким образом батарею, мы находим, что предел разомкнутой цепи для выделения кислорода на положительном электроде наступает, когда заряд батареи соответствует количеству серной кислоты, скажем, nh3SO4 = 6,74 моль. Подставляя это значение nh3SO4 в уравнение (35), мы вычисляем, что γ добавить = 0,64, что можно проверить из того же уравнения, если мы установим n добавить = 5 моль, n¯ = 61,51 моль и ψmax″ = -20,25 Дж·кг -1 .
Наконец, подставляя эти значения n¯, ψmax″ и γ , добавляя в уравнение (35) и используя выражения γh3O и γh3SO4, приведенные в Приложении, мы получаем аналитическое выражение предельной кривой рассматриваемого аккумулятора. Эта кривая представлена на рис. 2. Из этого же рисунка находим, что Δnh3SO4o = 5,48 моль и Δnh3SO4∗ = 6,14 моль. Отсюда следует, что η max = 0,12 согласно уравнению (34). Таким образом, рассматриваемая в данном примере добавка к электролиту может увеличить энергоемкость батареи до 12 %.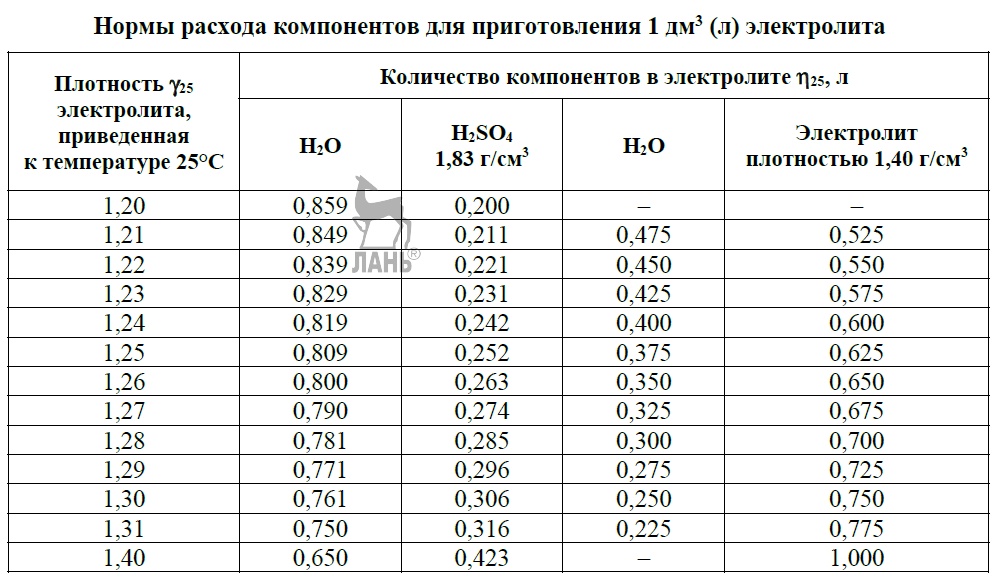 Как показано на рисунке, количество добавки, необходимое для получения максимальной емкости накопления энергии, составляет nadd∗ = 1,48 моль. Соответствующая номинальная молярность добавки равна badd* = 1,34 моль/кг согласно уравнению (33).
Как показано на рисунке, количество добавки, необходимое для получения максимальной емкости накопления энергии, составляет nadd∗ = 1,48 моль. Соответствующая номинальная молярность добавки равна badd* = 1,34 моль/кг согласно уравнению (33).
Различные добавки могут по-разному влиять на батарею. Например, для того же аккумулятора, рассмотренного в приведенном выше примере, добавка с γ добавить = 0,3 может увеличить емкость батареи на 25%. Это можно легко проверить из уравнения (35), построив предельную кривую для γ add = 0,3 и тех же значений n¯ и ψmax″, которые приведены выше. В этом случае количество добавки, создающей максимальную энергоаккумулирующую способность, будет nadd* = 3,23 моль, что означает badd* = 2,91 моль/кг.
В приведенном выше анализе мы рассматривали γ add как константу, пренебрегая, таким образом, любой возможной зависимостью γ добавить по концентрации присадки. Это может быть приемлемым, если концентрация добавки умеренно низкая (как это имеет место во многих приложениях) или если мы ограничиваем наше внимание достаточно небольшим участком предельной кривой. Если требуется большая точность, описанную выше процедуру для определения γ add можно повторить несколько раз для необходимого количества различных значений n add . Полученные таким образом значения γ add можно использовать для определения функции γ добавить (n добавить ), который можно заменить на γ добавить в уравнение (35), если аппроксимация γ добавить = const. оказывается неадекватным.
Если требуется большая точность, описанную выше процедуру для определения γ add можно повторить несколько раз для необходимого количества различных значений n add . Полученные таким образом значения γ add можно использовать для определения функции γ добавить (n добавить ), который можно заменить на γ добавить в уравнение (35), если аппроксимация γ добавить = const. оказывается неадекватным.
Вместо того, чтобы заряжать аккумулятор до предела выделения кислорода, представленного точкой A° на рисунке 1, мы могли бы, в принципе, определить ψmax″, разрядив аккумулятор без добавок до точки B° на том же рисунке. Это точка предельной поверхности батареи, в которой начинается сульфатация отрицательного электрода. Как только определена концентрация серной кислоты, соответствующая этому нижнему пределу, можно определить предельную кривую, как описано выше. Обе процедуры должны давать одно и то же значение ψmax″, поскольку и A°, и B° принадлежат одной и той же кривой ψ″=ψmax″. Однако ссылка на предел выделения кислорода представляется более практичной, так как сульфатирование — довольно медленное явление.
Однако ссылка на предел выделения кислорода представляется более практичной, так как сульфатирование — довольно медленное явление.
6. Выводы
Известно, что на энергоемкость свинцово-кислотного аккумулятора может влиять наличие добавок в его электролите. Понятие эквивалентной добавки, определенное в данной работе, помогает анализировать влияние химически инертных добавок и смесей таких добавок на энергоемкость батареи. Это может быть применено для определения целой области концентраций электролита, называемой допустимым диапазоном батареи, в пределах которой не происходит необратимых изменений в батарее во время заряда или разряда. Границей этой области является предельная кривая батареи. Это соответствует концентрациям серной кислоты и, следовательно, диапазону напряжений холостого хода, превышение которых не может привести к необратимым изменениям в аккумуляторе. Предельная кривая батареи может быть построена из нескольких экспериментов, в которых батарея заряжается (или разряжается) при различных концентрациях добавок. Это дает полезную информацию об эффективности добавки для увеличения энергоемкости батареи и о наилучшей концентрации добавки для этой цели. Практические последствия выбора наилучшей добавки для использования очевидны. Однако следует иметь в виду, что добавка также может вызывать нежелательные побочные эффекты, которые не рассматриваются в настоящей работе и требуют надлежащего изучения, прежде чем любое улучшение энергоемкости батареи в результате добавки может считаться практически целесообразным.
Это дает полезную информацию об эффективности добавки для увеличения энергоемкости батареи и о наилучшей концентрации добавки для этой цели. Практические последствия выбора наилучшей добавки для использования очевидны. Однако следует иметь в виду, что добавка также может вызывать нежелательные побочные эффекты, которые не рассматриваются в настоящей работе и требуют надлежащего изучения, прежде чем любое улучшение энергоемкости батареи в результате добавки может считаться практически целесообразным.
Конфликт интересов
Автор заявляет об отсутствии конфликта интересов.
Приложение. Коэффициенты активности воды и серной кислоты в растворе
При выражении в молялях концентрация растворенного вещества не зависит от присутствия других растворенных веществ в том же растворе. Более того, если концентрация растворенных веществ достаточно мала, на коэффициент активности каждого растворенного вещества лишь незначительно влияет присутствие других растворенных веществ в том же растворе. По этой причине из-за отсутствия более точных данных о влиянии аддиктивных веществ на коэффициенты активности электролита коэффициент активности серной кислоты (γh3SO4) принимается равным γh3SO4o=γh3SO4o(bh3SO4), что и предполагает отсутствие добавок. Другими словами:
По этой причине из-за отсутствия более точных данных о влиянии аддиктивных веществ на коэффициенты активности электролита коэффициент активности серной кислоты (γh3SO4) принимается равным γh3SO4o=γh3SO4o(bh3SO4), что и предполагает отсутствие добавок. Другими словами:
где функция γh3SO4(nh3O,nh3SO4) получается из γh3SO4o(bh3SO4) после подстановки уравнения (4).
С другой стороны, коэффициент активности растворителя зависит от его мольного соотношения. В рассматриваемом случае растворителем является вода, и ее мольное соотношение xh3O зависит от количества серной кислоты и добавок, содержащихся в электролите, что видно из уравнения (3). Однако анализ настоящей статьи касается нереакционноспособных добавок при сравнительно низкой концентрации. В этих условиях можно ожидать, что влияние добавок на коэффициент активности растворителя γh3O будет иметь второстепенное значение. По этой причине, а также ввиду уже упомянутой скудости экспериментальных данных, значения γh3O электролита с добавками принимаются совпадающими со значениями электролита без добавок, γh3Oo=γh3Oo(xh3Oo). Введенное здесь количество xh3Oo представляет собой мольную долю растворителя, когда n добавить = 0. То есть:
Введенное здесь количество xh3Oo представляет собой мольную долю растворителя, когда n добавить = 0. То есть:
Это предположение о γh3O означает, следовательно:
Экспериментальные значения, полученные функциями γh3SO4o(bh3SO4) и γh3Oo(xh3Oo) для широкого диапазона концентраций, описаны во многих статьях и книгах. Для критического обзора этих экспериментальных данных читатель может обратиться к [23,24]. На основе этих данных предполагается, что уравнение (A1) аппроксимируется выражением:
представлено графически на следующем рисунке A1.
Рисунок A1. График уравнения (A4), показывающий зависимость γh3SO4 от моляльности серной кислоты в водных растворах. Экспериментальные значения ( ) γh3SO4o взяты из работы Буллока [24].
Рисунок A1. График уравнения (A4), показывающий зависимость γh3SO4 от моляльности серной кислоты в водных растворах. Экспериментальные значения ( ) γh3SO4o взяты из работы Буллока [24].
Экспериментальные значения ( ) γh3SO4o взяты из работы Буллока [24].
Что касается растворителя, следующая полиномиальная аппроксимация дает хорошее приближение к хорошо установленным экспериментальным данным ([23,24]) относительно активности воды в водных растворах серной кислоты при 0,4 Это уравнение представлено на рис. A2 вместе со значениями γh3Oo, полученными из данных, представленных в [24]. Уравнения (A4) и (A5) использовались для определения предельной кривой батареи в примере, представленном в Разделе 5. Рисунок A2. Кривая уравнения (A5), показывающая зависимость γh3O от xh3O для водных растворов серной кислоты. Значения ( ) γh3Oo рассчитаны на основе экспериментальных данных, приведенных в обзоре Bullock [24]. Рисунок A2. Кривая уравнения (A5), показывающая зависимость γh3O от xh3O для водных растворов серной кислоты. Значения ( ) γh3Oo рассчитаны на основе экспериментальных данных, приведенных в обзоре Bullock [24]. Рисунок 1. Типичная предельная кривая для свинцово-кислотного аккумулятора, содержащего нереагирующую добавку в электролите. Кривая получена из уравнения (31). Электролит не претерпевает необратимых изменений, если его содержание находится в допустимых для аккумулятора пределах (заштриховано на рисунке). Рисунок 1. Типичная предельная кривая для свинцово-кислотного аккумулятора, содержащего нереагирующую добавку в электролите. Кривая получена из уравнения (31). Электролит не претерпевает необратимых изменений, если его содержание находится в допустимых для аккумулятора пределах (заштриховано на рисунке). Рисунок 2. Практический пример предельной кривой батареи. Диаграмма относится к 1 кг растворителя электролита (вода). Таким образом, значения, представленные на осях, также могут быть прочитаны как молярные концентрации. Рисунок 2. Практический пример предельной кривой батареи. Диаграмма относится к 1 кг растворителя электролита (вода). © 2016 автор; лицензиат MDPI, Базель, Швейцария. Эта статья находится в открытом доступе и распространяется на условиях лицензии Creative Commons Attribution (CC-BY) (http://creativecommons.org/licenses/by/4.0/). Последнее обновление: 24 июня 2022 г. Эллис Гибсон (бакалавр машиностроения) Батарея VRLA, также известная как герметичная свинцово-кислотная батарея (SLA), представляет собой тип свинцово-кислотной батареи. Электролит батареи VRLA представляет собой смесь серной кислоты и дистиллированной воды. Аккумуляторы VRLA используются в различных приложениях, включая резервное питание для систем ИБП, систем сигнализации и аварийного освещения. Приготовление раствора электролита для свинцово-кислотных аккумуляторов — простой процесс. Во-первых, вам нужно будет получить серную кислоту и дистиллированную воду. Давайте копнем и посмотрим, что внутри. # Содержание При приготовлении раствора электролита для аккумулятора важно использовать дистиллированную воду. Это связано с тем, что другие типы воды могут содержать примеси, которые могут повлиять на работу аккумулятора. Чтобы приготовить раствор, просто наполните стакан наполовину дистиллированной водой. Кроме того, свинцово-кислотный аккумулятор — это тип аккумулятора, в котором в качестве электролита используется серная кислота и вода. Батарея также обеспечивает ионы сульфата, необходимые для высвобождения молекул кислорода в раствор. Чтобы сделать свинцово-кислотную батарею, наполните стакан водой наполовину. Затем добавьте в воду серную кислоту, пока она не заполнится. Изготовление аккумуляторной кислоты в домашних условиях опасно и не рекомендуется. Аккумуляторная кислота является сильно коррозионным и токсичным веществом, с которым следует обращаться с особой осторожностью. Если вам необходимо сделать аккумуляторную кислоту самостоятельно, вам необходимо принять несколько мер предосторожности. Во-первых, вам нужно будет приобрести серную кислоту, которая является основным компонентом аккумуляторной кислоты. Серную кислоту можно найти в большинстве хозяйственных магазинов. Во-вторых, вам нужно будет разбавить серную кислоту водой. Отношение серной кислоты к воде будет варьироваться в зависимости от силы кислоты, но хорошей отправной точкой будет 1 часть кислоты на 10 частей воды. Как только кислота будет разбавлена, ее можно добавить в контейнер, который будет служить вашей батареей. Наконец, вам нужно будет подключить положительные и отрицательные клеммы аккумулятора к источнику питания, например к автомобильному аккумулятору. Как видите, изготовление аккумуляторной кислоты в домашних условиях — сложный и опасный процесс. Не рекомендуется никому, кроме опытных химиков. Если вам необходимо сделать аккумуляторную кислоту самостоятельно, обязательно примите все необходимые меры предосторожности. Электролит представляет собой смесь воды и серной кислоты и используется в большинстве обычных батарей. Эта смесь создает проводящий раствор, который помогает облегчить поток электронов между анодом и катодом батареи. Электролит также играет важную роль в поддержании стабильности общей химической реакции внутри батареи. Кроме того, внутри батарей находится жидкость, называемая электролитом. Это смесь серной кислоты и воды. Когда речь идет о кислоте аккумуляторной батареи вашего автомобиля, важно точное соотношение воды и серной кислоты. Кроме того, отношение воды к серной кислоте в аккумуляторе с электролитом составляет примерно 80% к 20%. Это означает, что на каждые 80 частей воды приходится 20 частей серной кислоты. Если вы ищете руководство о том, как сделать аккумуляторный электролит самостоятельно, вы попали по адресу. В этой статье мы объясним, что такое электролит, как он работает и как сделать его самостоятельно в домашних условиях. Что такое электролит? Электролит представляет собой жидкость или гель, который содержит ионы (заряженные частицы) и может проводить электричество. Когда батарея подключена к электрической цепи, электролит позволяет электронам течь между положительным и отрицательным электродами, создавая электрический ток. Как работает электролит? Электролит в аккумуляторе обычно состоит из смеси воды и кислот или оснований. Когда батарея подключена к электрической цепи, электролит позволяет электронам течь между положительным и отрицательным электродами, создавая электрический ток. Электролит также помогает предотвратить коррозию электродов. Как сделать аккумуляторный электролит в домашних условиях? Есть несколько способов приготовить аккумуляторный электролит в домашних условиях. Один из способов — смешать равные части воды и уксуса. Другой способ — смешать равные части воды и пищевой соды. Если вы хотите приготовить более концентрированный электролит, вы можете смешать 1 часть воды и 2 части уксуса или пищевой соды. После того, как вы смешаете ингредиенты, просто залейте электролит в аккумулятор, и все готово! Желаемый коэффициент смешивания электролита батареи представляет собой относительную пропорцию положительного и отрицательного электролитов в растворе. Серная кислота, свинцовая кислота и никель-кадмий являются наиболее распространенными электролитами, используемыми для аккумуляторной кислоты. У каждого есть свой набор преимуществ и недостатков, которые делают его более или менее идеальным для различных приложений. Приготовить аккумуляторную кислоту в домашних условиях на самом деле довольно просто. Все, что вам нужно, это немного серной кислоты и воды. Серная кислота вступает в реакцию с водой с образованием соляной кислоты, которая является активным ингредиентом аккумуляторной кислоты. Концентрация кислоты будет зависеть от того, сколько серной кислоты вы используете. Если вы хотите получить более сильную кислоту, вы можете добавить больше серной кислоты. Если вы хотите сделать более слабую кислоту, вы можете добавить больше воды. Только будьте осторожны, чтобы не добавить слишком много воды, так как это может разбавить кислоту и сделать ее менее эффективной. После того, как вы сделали аккумулятор кислотой, вы можете использовать его для очистки металлических предметов или травления стекла. Вы также можете использовать его, чтобы сделать самодельные батареи. Просто соедините два металлических предмета куском проволоки и окуните их в кислоту. Это создаст химическую реакцию, которая будет генерировать электричество. Аккуратно обращайтесь с аккумуляторной кислотой, так как это может быть опасно. Этот вопрос нам часто задают здесь, в Battery Joe, и это хороший вопрос! Процентное содержание воды в аккумуляторном электролите является важным фактором, определяющим состояние аккумулятора. Электролит в свинцово-кислотном аккумуляторе состоит из воды и серной кислоты. Серная кислота придает аккумулятору энергию, а вода помогает удерживать кислоту от коррозии внутренних компонентов аккумулятора. Процентное содержание воды в аккумуляторном электролите обычно составляет около 33%. Это означает, что на каждые 100 мл электролита приходится 33 мл воды. Процентное содержание воды в электролите аккумулятора может варьироваться в зависимости от типа аккумулятора и условий его использования. Если процентное содержание воды в электролите вашего аккумулятора слишком низкое, это может привести к повреждению внутренних компонентов аккумулятора серной кислотой. Вот почему важно регулярно проверять уровень воды в электролите аккумулятора и при необходимости доливать его. Если вы не знаете, как проверить уровень воды в электролите аккумулятора, или если вам неудобно делать это самостоятельно, обратитесь к квалифицированному специалисту в магазин аккумуляторов, например, в Battery Joe. Мы можем проверить уровень воды в электролите вашего аккумулятора и долить его для вас. Если вы ищете способ сделать аккумуляторную кислоту с английской солью, вы пришли в нужное место. В этой статье мы покажем вам, как сделать аккумуляторную кислоту, используя английскую соль и несколько других простых ингредиентов. Первое, что вам нужно сделать, это собрать ингредиенты. Вам понадобится: — Английская соль
-Вода
-Контейнер Когда у вас есть ингредиенты, пора начинать. Первое, что вам нужно сделать, это растворить соль Эпсома в воде. Вы можете сделать это, добавив английскую соль в емкость с водой и помешивая, пока она полностью не растворится. Когда соль Эпсома растворится, вам нужно будет добавить в контейнер немного воды. Это поможет разбавить аккумуляторную кислоту и сделать ее менее опасной в обращении. После добавления воды пришло время добавить в аккумулятор раствор английской соли. Сделать это можно, аккуратно залив раствор в аккумулятор. Убедитесь, что вы не пролили раствор на себя, так как это может быть вредно, если он вступит в контакт с вашей кожей. После того, как раствор английской соли окажется в аккумуляторе, нужно оставить его на несколько часов. Это позволит аккумуляторной кислоте образоваться. По прошествии нескольких часов вы можете проверить кислотность аккумулятора. Когда аккумуляторная кислота готова, вы можете использовать ее для различных целей. Вы можете использовать его для очистки клемм аккумулятора, или вы можете использовать его, чтобы сделать аккумуляторную кислоту самостоятельно. Если вы делаете аккумуляторную кислоту самостоятельно, вам нужно добавить в раствор немного воды. Это поможет разбавить кислоту и сделать ее менее опасной в обращении. После того, как вы добавите воду, вы можете вылить аккумуляторную кислоту в контейнер. Убедитесь, что вы пометили контейнер, чтобы вы знали, что это такое. Затем вы можете хранить аккумуляторную кислоту в прохладном, сухом месте. Теперь, когда вы знаете, как сделать аккумуляторную кислоту из английской соли, вы можете использовать ее для самых разных целей. Просто убедитесь, что вы обращаетесь с ним осторожно и всегда храните его в безопасном месте. Нам часто задают этот вопрос, и мы с радостью на него ответим! Есть несколько разных мест, где вы можете приобрести комплект для заправки аккумуляторной кислоты, но мы рекомендуем обратиться в местный хозяйственный магазин. Это потому, что у них будут необходимые расходные материалы для правильной зарядки вашей батареи. Прежде чем купить комплект, вам нужно знать размер вашей батареи. Получив эту информацию, вы сможете приобрести соответствующий комплект для ваших нужд. Мы также рекомендуем перед началом работы прочитать инструкцию, прилагаемую к набору, так как это поможет вам избежать несчастных случаев. Получив комплект, просто следуйте инструкциям, чтобы зарядить батарею. После того, как вы закончите, не забудьте правильно утилизировать аккумуляторную кислоту. Мы надеемся, что эта статья помогла ответить на ваш вопрос. Когда дело доходит до приготовления раствора электролита, необходимо помнить о нескольких вещах. Если у вас нет правильных пропорций воды и порошка электролита, ваш раствор будет либо слишком слабым, либо слишком сильным. Если он слишком слаб, он не сможет правильно проводить электричество. Если он слишком сильный, он может повредить ваше оборудование. Чтобы получить правильные пропорции, вам понадобится мерный стакан или весы. Как только у вас будут правильные пропорции, хорошо перемешайте раствор, чтобы порошок электролита полностью растворился. Если вы используете мерный стакан, сначала добавьте воду, а затем медленно добавляйте порошок электролита при перемешивании. Если вы используете весы, сначала добавьте порошок электролита, а затем медленно добавляйте воду при перемешивании. После смешивания раствор можно сразу же использовать или хранить в прохладном темном месте. Для изготовления батареи можно использовать множество материалов, в том числе: — Литий
-Никель
-Кадмий
-Вести
-Цинк Каждый из этих материалов обладает различными свойствами, которые делают его пригодным для использования в батареях. Например, литий — очень легкий металл, поэтому его часто используют в небольших батареях, например, в ноутбуках и сотовых телефонах. Никель дешевле лития, поэтому его часто используют в более крупных батареях, например, в электромобилях. Если из вашей батареи протекает кислота, важно очистить ее и нейтрализовать пролитую жидкость. Но чем можно заменить аккумуляторную кислоту? Есть несколько вариантов, в зависимости от того, что у вас есть под рукой. Уксус, пищевая сода и лимонный сок являются кислотными веществами, которые могут нейтрализовать кислоту аккумулятора. Если у вас нет ничего из этого под рукой, вы всегда можете просто купить аккумуляторную кислоту в хозяйственном магазине. Этот вопрос часто задают люди, интересующиеся аккумуляторами. Ответ на этот вопрос заключается в том, что соотношение кислоты и воды в аккумуляторе составляет 1:1. Это означает, что на каждую часть кислоты приходится одна часть воды. Это соотношение важно, потому что оно помогает поддерживать правильную работу батареи. Возможно, вы удивитесь, узнав, что аккумуляторная кислота на самом деле производится из множества различных химических веществ. Наиболее распространенным типом аккумуляторной кислоты является серная кислота, которая производится путем соединения диоксида серы и воды. Другие типы аккумуляторной кислоты включают свинцово-кислотные, никель-кадмиевые и литий-ионные. Серная кислота является наиболее распространенным типом аккумуляторной кислоты, поскольку она обладает высокой коррозионной активностью и может использоваться в самых разных областях. Свинцово-кислотные аккумуляторы являются наиболее распространенным типом аккумуляторов, используемых в легковых и грузовых автомобилях. Никель-кадмиевые батареи используются в некоторых портативных устройствах, таких как сотовые телефоны и ноутбуки. Литий-ионные аккумуляторы используются во многих электронных устройствах, включая цифровые камеры и смартфоны. Процесс производства аккумуляторной кислоты относительно прост. Во-первых, производится диоксид серы. Это можно сделать, сжигая серу или извлекая ее из минералов, содержащих серу. Затем к диоксиду серы добавляется вода для получения серной кислоты. Концентрация серной кислоты может варьироваться в зависимости от области применения. Аккумуляторная кислота является сильно коррозионным веществом, которое может нанести серьезный вред коже и глазам. Если аккумулятор вашего ноутбука не держит заряд так, как раньше, возможно, пришло время позаботиться о нем с любовью. Восстановление аккумулятора — это процесс восстановления его первоначальной емкости. Вам понадобится: 1. Ноутбук со съемным аккумулятором 2. Крестообразная отвертка 3. Плоская отвертка 4. Плоскогубцы 5. Баллончик со сжатым воздухом 6. Чистая, сухая салфетка ткань 7. Вольтметр 8. Комплект для восстановления аккумулятора (дополнительно) Шаг 1. Извлеките аккумулятор Прежде чем начать, убедитесь, что ноутбук выключен и отсоединен от сети. Затем извлеките аккумулятор из ноутбука. Большинство ноутбуков имеют защелку, которую можно нажать, чтобы освободить аккумулятор. Шаг 2. Очистите контакты аккумулятора После извлечения аккумулятора сдуйте пыль или грязь с контактов аккумулятора баллончиком со сжатым воздухом. Шаг 3. Используйте вольтметр для проверки батареи Используйте вольтметр для проверки напряжения батареи. Большинство аккумуляторов для ноутбуков имеют напряжение от 11 до 14 вольт. Если напряжение вашей батареи ниже 11 вольт, ее необходимо заменить. Шаг 4: Восстановите батарею (дополнительно) Если напряжение вашей батареи выше 11 В, вы можете восстановить ее с помощью комплекта для восстановления батареи. В этот комплект входит специальное зарядное устройство, которое будет медленно заряжать и разряжать аккумулятор, помогая восстановить его первоначальную емкость. Шаг 5. Соберите ноутбук После восстановления аккумулятора соберите ноутбук и замените аккумулятор. Аккумулятор VRLA, также известный как свинцово-кислотный аккумулятор с регулируемым клапаном, представляет собой тип свинцово-кислотного аккумулятора с клапаном, который регулирует поток электролита между положительным и отрицательным электродами. Для приготовления раствора электролита для свинцово-кислотного аккумулятора вам потребуются: – Свинцово-кислотный аккумулятор – Дистиллированная вода – Белый уксус – Пищевая сода – Воронка – Резиновые защитные очки
Список литературы
 Р. Влияние кислых ионных жидкостей в качестве добавки к электролиту на электрохимическое и коррозионное поведение свинцово-кислотных аккумуляторов. J. Твердотельная электрохимия. 2011 , 15, 421–430. [Google Scholar] [CrossRef]
Р. Влияние кислых ионных жидкостей в качестве добавки к электролиту на электрохимическое и коррозионное поведение свинцово-кислотных аккумуляторов. J. Твердотельная электрохимия. 2011 , 15, 421–430. [Google Scholar] [CrossRef] ; Research Studies Press: Baldock, UK, 2003. [Google Scholar]
; Research Studies Press: Baldock, UK, 2003. [Google Scholar] [Google Scholar] [CrossRef]
[Google Scholar] [CrossRef] Таким образом, значения, представленные на осях, также могут быть прочитаны как молярные концентрации.
Таким образом, значения, представленные на осях, также могут быть прочитаны как молярные концентрации. Как сделать раствор электролита свинцово-кислотной батареи? [Обновлено в 2022 г.]
 Затем вам нужно будет смешать два ингредиента в соотношении одна часть серной кислоты к двум частям дистиллированной воды. Как только смесь будет готова, вам нужно будет залить ее в элементы аккумулятора.
Затем вам нужно будет смешать два ингредиента в соотношении одна часть серной кислоты к двум частям дистиллированной воды. Как только смесь будет готова, вам нужно будет залить ее в элементы аккумулятора.
 Это замкнет цепь и позволит кислоте течь через батарею, создавая электричество.
Это замкнет цепь и позволит кислоте течь через батарею, создавая электричество. Если отношение слишком высокое, батарея перегреется, а если отношение слишком низкое, батарея замерзнет. Идеальное соотношение составляет около 80% воды и 20% серной кислоты. Это позволит поддерживать аккумулятор в оптимальном состоянии, когда он не перегревается и не замерзает.
Если отношение слишком высокое, батарея перегреется, а если отношение слишком низкое, батарея замерзнет. Идеальное соотношение составляет около 80% воды и 20% серной кислоты. Это позволит поддерживать аккумулятор в оптимальном состоянии, когда он не перегревается и не замерзает.
 Это соотношение важно для работы батареи, поскольку оно определяет величину тока, который может протекать через раствор. Если отношение слишком низкое, батарея не сможет генерировать достаточно энергии, чтобы быть полезной. Если соотношение слишком велико, батарея будет менее эффективной и не прослужит так долго. Идеальное соотношение зависит от типа батареи и приложения, для которого она будет использоваться.
Это соотношение важно для работы батареи, поскольку оно определяет величину тока, который может протекать через раствор. Если отношение слишком низкое, батарея не сможет генерировать достаточно энергии, чтобы быть полезной. Если соотношение слишком велико, батарея будет менее эффективной и не прослужит так долго. Идеальное соотношение зависит от типа батареи и приложения, для которого она будет использоваться. Просто смешайте два ингредиента вместе в контейнере, и у вас будет аккумуляторная кислота.
Просто смешайте два ингредиента вместе в контейнере, и у вас будет аккумуляторная кислота. Если вы попадете на кожу, это может вызвать ожоги. Если вы вдыхаете пары, это может повредить ваши легкие. И если вы проглотите его, это может быть фатальным. Так что будьте осторожны и руководствуйтесь здравым смыслом при обращении с этим мощным химическим веществом.
Если вы попадете на кожу, это может вызвать ожоги. Если вы вдыхаете пары, это может повредить ваши легкие. И если вы проглотите его, это может быть фатальным. Так что будьте осторожны и руководствуйтесь здравым смыслом при обращении с этим мощным химическим веществом. Например, батареи глубокого цикла обычно имеют более высокий процент воды в электролите, чем стартерные батареи.
Например, батареи глубокого цикла обычно имеют более высокий процент воды в электролите, чем стартерные батареи.
 Если это темный цвет, он готов к использованию. Если он все еще светлый, вы можете оставить его еще на несколько часов.
Если это темный цвет, он готов к использованию. Если он все еще светлый, вы можете оставить его еще на несколько часов.
 Во-первых, вы должны убедиться, что у вас есть правильные пропорции воды и электролитного порошка. Во-вторых, вам нужно убедиться, что вы хорошо перемешали раствор, чтобы порошок электролита полностью растворился.
Во-первых, вы должны убедиться, что у вас есть правильные пропорции воды и электролитного порошка. Во-вторых, вам нужно убедиться, что вы хорошо перемешали раствор, чтобы порошок электролита полностью растворился. Если вы собираетесь хранить его, обязательно поместите его в герметичный контейнер.
Если вы собираетесь хранить его, обязательно поместите его в герметичный контейнер. Вы также можете использовать слабое основание, например, магнезиальное молоко, чтобы нейтрализовать кислоту.
Вы также можете использовать слабое основание, например, магнезиальное молоко, чтобы нейтрализовать кислоту.
 Важно с осторожностью обращаться с аккумуляторной кислотой и носить надлежащее защитное снаряжение при работе с ней.
Важно с осторожностью обращаться с аккумуляторной кислотой и носить надлежащее защитное снаряжение при работе с ней. Контакты — это металлические пластины на аккумуляторе, которые соприкасаются с ноутбуком.
Контакты — это металлические пластины на аккумуляторе, которые соприкасаются с ноутбуком. Клапан позволяет герметизировать батарею, что предотвращает утечку газообразного водорода. Аккумуляторы VRLA используются в различных приложениях, включая системы резервного питания, системы бесперебойного питания и электромобили.
Клапан позволяет герметизировать батарею, что предотвращает утечку газообразного водорода. Аккумуляторы VRLA используются в различных приложениях, включая системы резервного питания, системы бесперебойного питания и электромобили.10 – 9 защитных перчаток
60
– емкость для раствора
1. Наденьте резиновые перчатки и защитные очки.
2. Добавьте в дистиллированную воду одну столовую ложку пищевой соды.
3. Добавьте в дистиллированную воду одну столовую ложку белого уксуса.
4. Перемешивайте раствор, пока пищевая сода и уксус полностью не растворятся.
5. Залейте раствор в свинцово-кислотный аккумулятор.
6. Закройте аккумулятор.
7.

 .. +35
.. +35 е. с добавкой едкого лития
е. с добавкой едкого лития