Катализаторы. Каталитические реакции: примеры
Одно из наиболее эффективных воздействий на химические реакции – это применение катализатора. Катализаторы – это вещества, ускоряющие химические реакции. Присутствие катализаторов изменяет скорость реакции в тысячи и даже миллионы раз. Катализаторы активно участвуют в химической реакции, но в отличие от реагентов в конце ее остаются неизменными.
– это вещества, которые изменяют скорость протекания реакции, но сами не расходуются в ходе реакции и не входят в состав конечных продуктов.
Важной характеристикой каталитической реакции (катализа) является однородность или неоднородность катализатора и реагирующих веществ. Различают гомогенные и гетерогенные каталитические процессы. При гомогенном (однородном) катализе между реагирующими веществами и катализатором отсутствует поверхность раздела. В данном случае катализ осуществляется через образование неустойчивых промежуточных продуктов.
Например, вещество A должно вступить в реакцию с веществом B.
A + Кат. = A ∙ Кат.
A ∙ Кат. + B = AB ∙ Кат.
Кат.
A + B = AB
Процессы, в которых катализатор и катализируемые вещества находятся в разных агрегатных состояниях, относятся к гетерогенному (неоднородному) катализу. При адсорбции на поверхности катализатора газообразных или жидких реагентов ослабляются химические связи, возрастает способность этих веществ к взаимодействию.
Ускоряющее действие катализатора заключается в понижении энергии активации основной реакции. Каждый из промежуточных процессов с участием катализатора протекает с меньшей энергией активации, чем некатализируемая реакция. Катализ открывает иной пут протекания химической реакции от исходных веществ к продуктам реакции.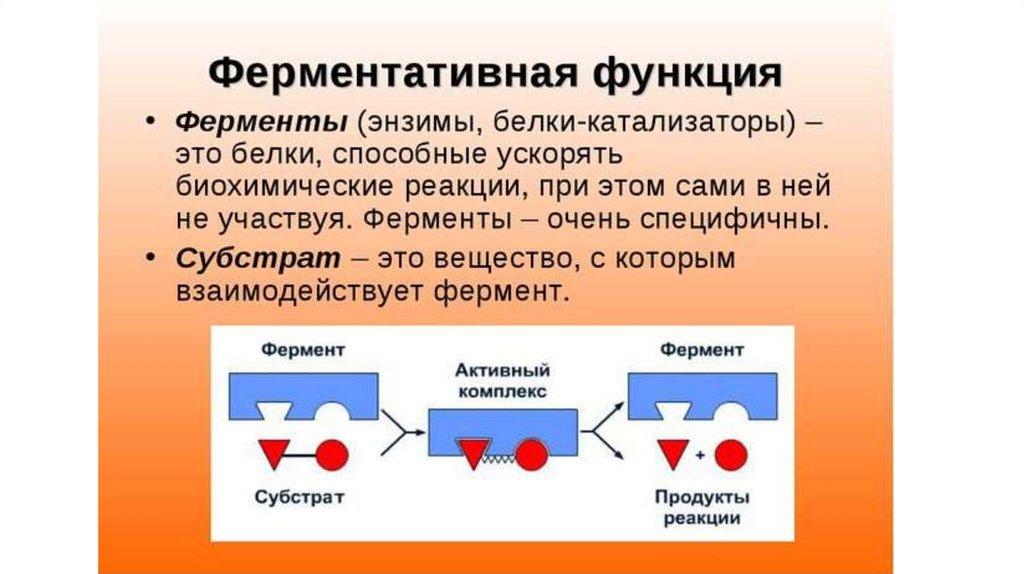
Опыт показывает, что катализаторы строго специфичны для конкретных реакций. Например, в реакции:
N 2 +3H 2 = Fe 2NH 3
Катализатором является металлическое железо, а в реакции окисления оксида серы(IV) в оксид серы(VI) катализатор – оксид ванадия(V) V 2 O 5 . Часто в качестве катализаторов используют платину, никель, палладий, оксид алюминия. Для ускорения процесса разложения пероксида водорода в качестве катализатора применяют оксид марганца(IV). Если в стакан с раствором пероксида водорода добавить немного оксида марганца(IV), сразу происходит бурное вспенивание жидкости в результате выделения кислорода.
Катализатором реакции взаимодействия алюминия и йода является обычная вода. Если к смеси алюминия и йода прилить воду, то вещества в смеси бурно реагируют.
Существуют вещества, способные замедлять химическую реакцию – осуществлять так называемый отрицательный катализ. Их называют ингибиторами. Такие вещества применяют при необходимости замедлит некоторые процессы, например коррозию металлов, окисление сульфидов при хранении и др.
Вам необходимо включить JavaScript, чтобы проголосовать
Катализаторы обеспечивают более быстрый исход любой химической реакции. Реагируя с исходными веществами реакции, катализатор образует с ними промежуточное соединение, после чего это соединение подвергается преобразованию и в итоге распадается на необходимый конечный продукт реакции, а также на неподвергшийся изменениям катализатор. После распада и образования необходимого продукта катализатор снова вступает в реакцию с исходными реагентами, образуя все большее количество исходного вещества. Данный цикл может повторяться миллионы раз, и если извлечь катализатор из группы реагентов, реакция может длиться в сотни и тысячи раз медленнее.
Катализаторы гетерогенными и гомогенными. Гетерогенные катализаторы в ходе химической реакции образуют самостоятельную фазу, которая отделена разделяющей границей от фазы исходных реагентов. Гомогенные катализаторы, напротив, являются частью одной и той же фазы с исходными реагентами.
Существуют катализаторы органического происхождения, которые участвуют в брожении и созревании, они называются ферментами. Без их непосредственного участия человечество не смогло бы получать большую часть спиртных напитков, молочнокислых продуктов, продуктов из теста, а также мед и . Без участия ферментов был бы невозможен обмен веществ у живых организмов.
Требования к веществам катализаторам
Катализаторы, которые широко применяются в промышленном производстве, должны обладать целым рядом свойств, необходимых для успешного завершения реакции. Катализаторы должны быть высокоактивными, селективными, механически прочными и термоустойчивыми. Они должны обладать продолжительным действием, легкой регенерацией, устойчивостью к каталитическим ядам, гидродинамическими свойствами, а также небольшой ценой.
Современное применение промышленных катализаторов
В нынешнем высокотехнологическом производстве катализаторы применяются при крекинге нефтепродуктов, получении ароматических углеводородов и высокооктанового , получении чистого водорода, кислорода или инертных газов, синтезе аммиака, получении и серной кислоты без дополнительных затрат.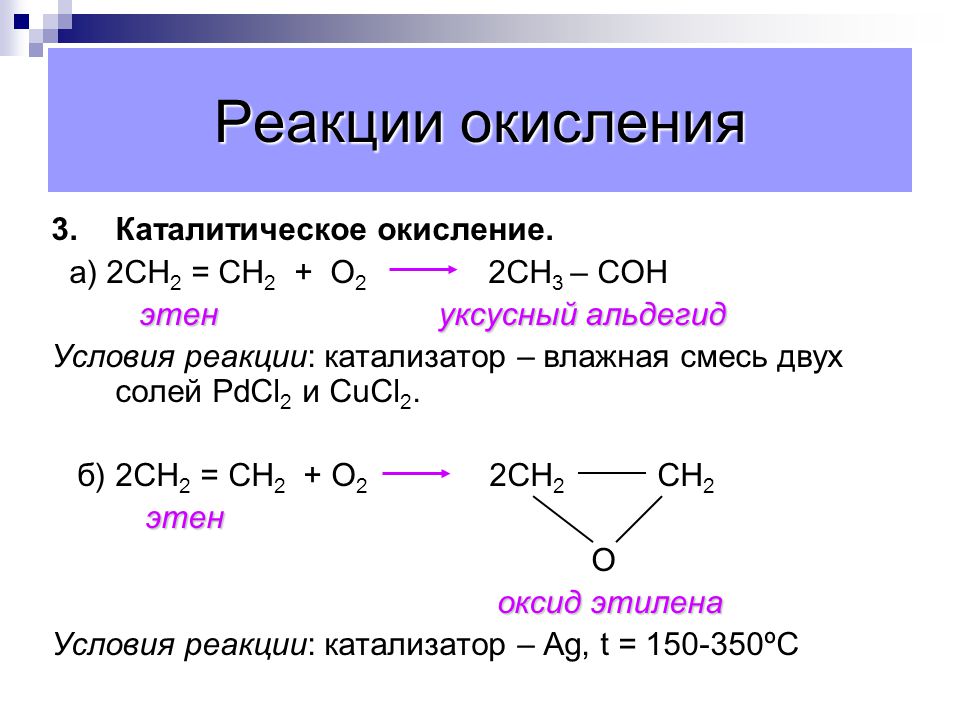
Катализаторы подразделяются на гомогенные и гетерогенные . Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный — образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества . Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Реакции
одного и того же типа могут протекать
как с гомогенными, так и с гетерогенными
катализаторами. Так, наряду с растворами
кислот применяются имеющие кислотные
свойства твёрдые Al 2 O 3 ,
TiO 2 ,
ThO 2 ,
алюмосиликаты, цеолиты. Гетерогенные
катализаторы с основными свойствами:
CaO, BaO, MgO .
Гетерогенные катализаторы имеют, как правило, сильно развитую поверхность, для чего их распределяют на инертном носителе (силикагель, оксид алюминия, активированный уголь и др.).
Для каждого типа реакций эффективны только определённые катализаторы. Кроме уже упомянутых кислотно-основных , существуют катализаторы
Много реакций осуществлено при помощи катализаторов, которые действуют через координацию реагентов у атома или иона переходного металла (Ti, Rh, Ni). Такой катализ называется координационным .
Если катализатор обладает хиральными свойствами, то из оптически неактивного субстрата получается оптически активный продукт.
В
современной науке и технике часто
применяют системы
из нескольких катализаторов ,
каждый из которых ускоряет разные стадии
реакции . Катализатор также может увеличивать
скорость одной из стадий каталитического
цикла, осуществляемого другим
катализатором. Здесь имеет место «катализ
катализа», или катализ
второго уровня
Катализатор также может увеличивать
скорость одной из стадий каталитического
цикла, осуществляемого другим
катализатором. Здесь имеет место «катализ
катализа», или катализ
второго уровня
В биохимических реакциях роль катализаторов играют ферменты.
Катализаторы следует отличать от инициаторов. Например, перекиси распадаются на свободные радикалы, которые могут инициировать радикальные цепные реакции. Инициаторы расходуются в процессе реакции, поэтому их нельзя считать катализаторами.
механизм катализа : 1)мех. стадийный(изменение пути реакции) 2)ассоциактивный 3)ферментативный 4) микрогетерогенный
Спецефичность катализа заключается в том, что в присутствии катализатора изменяется путь, по которому проходит суммарная реакция, образуются другие переходные состояния с иными энергиями активации, а поэтому изменяется и скорость хим. реакции.
переработка
древесины требует больших затрат в
производстве, поэтому используют
катализаторы, которые ускоряют процесс
химического превращения, увеличивают
выход продукта и уменьшают выброс
вредных веществ.
28. Растворы. Процессы при образовании растворов. Идеальные и реальные растворы. Гидраты и сольваты.
Растворы — гомогенные (однородные) системы, то есть каждый из компонентов распределён в массе другого в виде молекул, атомов или ионов
Процесс взаимодействия растворителя и растворённого вещества называется сольватацией (если растворителем является вода — гидратацией ).
Энергетической характеристикой растворения является теплота образования раствора , рассматриваемая как алгебраическая сумма тепловых эффектов всех эндо- и экзотермических стадий процесса. Наиболее значительными среди них являются: – поглощающие тепло процессы — разрушение кристаллической решётки, разрывы химических связей в молекулах; – выделяющие тепло процессы — образование продуктов взаимодействия растворённого вещества с растворителем (гидраты) и др.
СОЛЬВАТЫ,
продукты присоединения растворителя
к растворенным веществам.
Гидраты — продукты присоединения воды к неорганическим и органическим веществам
Катализ – это процесс изменения скорости химической реакции при помощи катализаторов – , принимающих участие в химической реакции, но в состав конечных продуктов не входящих и в результате реакции не расходующихся.
Одни катализаторы ускоряют реакцию (положительный катализ ), другие – замедляют (отрицательный катализ ). Отрицательный катализ называют ингибированием , а катализаторы, понижающие скорость химической реакции – ингибиторами .
Различают гомогенный и гетерогенный катализ.
Гомогенный катализ.При гомогенном (однородном) катализе реагирующие вещества и катализатор находятся в одинаковом и между ними отсутствует поверхность раздела. Пример гомогенного катализа – реакция окисления SO 2 и SO 3 в присутствии катализатора NO (реагирующие вещества и катализатор являются газами).
Гетерогенный катализ.
В случае гетерогенного (неоднородного) катализа реагирующие вещества и катализатор находятся в различных агрегатных состояниях и между ними существует поверхность (граница) раздела. Обычно катализатор – твердое вещество, а реагирующие вещества – жидкости или газы. Пример гетерогенного катализа – окисление NN 3 до NO в присутствии Pt (катализатор – твердое вещество).
Механизм действия катализаторов
Действие положительных катализаторов сводится к понижению энергии активации реакции Е а(исх) , действие ингибиторов – противоположное.
Так, для реакции 2 HI = H 2 + I 2 Е а(исх) =184 кДж/моль. Когда же эта реакция протекает в присутствии катализатора Au или Pt , то Е а(исх) =104 кДж/моль, соответственно.
Механизм действия катализатора при гомогенном катализе объясняется образованием промежуточных соединений между катализатором и одним из реагирующих веществ. Далее промежуточное соединение реагирует со вторым исходным веществом, в результате чего образуется продукт реакции и катализатор в первоначальном виде. Так как скорость обоих промежуточных процессов значительно больше скорости прямого процесса, то реакция с участием катализатора протекает значительно быстрее, чем без него.
Далее промежуточное соединение реагирует со вторым исходным веществом, в результате чего образуется продукт реакции и катализатор в первоначальном виде. Так как скорость обоих промежуточных процессов значительно больше скорости прямого процесса, то реакция с участием катализатора протекает значительно быстрее, чем без него.
Например, реакция:
SO 2 +1/2 O 2 = SO 3 протекает очень медленно, а если использовать катализатор NO
то реакции NO +1/2О 2 = NO 2 и NO 2 + SO 2 = SO 3 + NO протекают быстро.
Механизм действия катализатора при гетерогенном катализе иной. В этом случае реакция протекает вследствие адсорбции молекул реагирующих веществ поверхностью катализатора (поверхность катализатора неоднородна: на ней имеются так называемые активные центры , на которых и адсорбируются частицы реагирующих веществ.). Увеличение скорости химической реакции достигается, в основном, за счет понижения энергии активации адсорбированных молекул, а также, отчасти, за счет увеличения концентрации реагирующих веществ в местах, где произошла адсорбция.
Каталитические яды и промоторы.
Некоторые вещества снижают или полностью уничтожают активность катализатора, такие вещества называют каталитическими ядами . Например, небольшие примеси серы (0,1%) полностью прекращает каталитическое действие металлического катализатора (губчатого железа), использующегося при синтезе аммиака. Вещества, повышающие активность катализатора, называют промоторами. Например, каталитическая активность губчатого железа значительно возрастает при добавлении примерно 2% метаалюмината калия KAlO 2 .
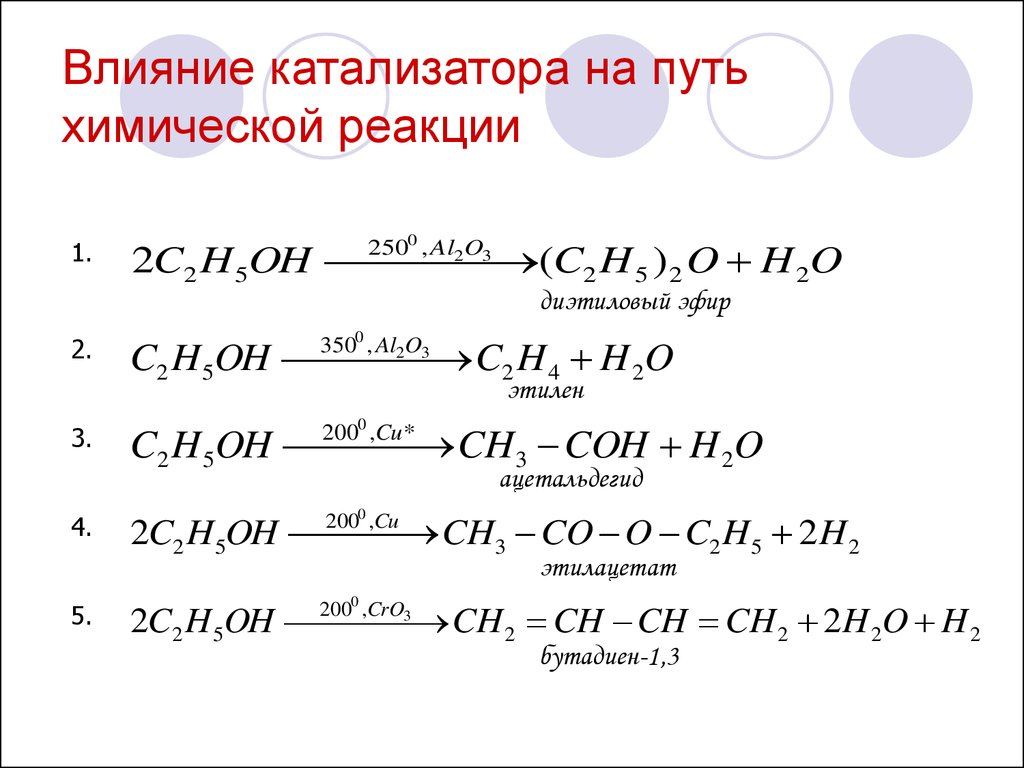
Применение катализаторовДействие катализатора избирательно и специфично. Это означает, что, применяя различные катализаторы, из одних и тех же веществ можно получить различные продукты. Это особенно характерно для реакций органических веществ. Например, в присутствии катализатора AlO 3 происходит дегидратация этилового спирта, в присутствии Cu – дегидрирование:
Биологические катализаторы, принимающие участие в сложных химических превращениях, протекающих в организме, называются ферментами.
Катализаторы широко используются в производстве серной кислоты, аммиака, каучука, пластмасс и др. веществ.
Скорости химических реакций могут резко увеличиваться в присутствии различных веществ, не являющихся реагентами и не входящих в состав продуктов реакции. Это замечательное явление получило название катализ (от греч. «katalysis» — разрушение). Вещество, при наличии которого в смеси увеличивается скорость реакции, называется катализатором. Его количество до и после реакции остается неизменным. Катализаторы не представляют собой какой-то особый класс веществ. В разных реакциях каталитическое действие могут проявить металлы, оксиды, кислоты, соли, комплексные соединения. Химические реакции в живых клетках протекают под контролем каталитических белков, называемых ферментами. Катализ следует рассматривать как истинно химический фактор увеличения скоростей химических реакций, так как катализатор непосредственно участвует в реакции. Катализ часто оказывается более мощным и менее рискованным средством ускорения реакции, чем повышение температуры. Это ярко проявляется на примере химических реакций в живых организмах. Реакции, например гидролиз белков, которые в лабораториях приходится проводить при длительном нагревании до температуры кипения, в процессе пищеварения протекают без нагревания при температуре тела.
Это ярко проявляется на примере химических реакций в живых организмах. Реакции, например гидролиз белков, которые в лабораториях приходится проводить при длительном нагревании до температуры кипения, в процессе пищеварения протекают без нагревания при температуре тела.
Впервые явление катализа наблюдал французский химик Л. Ж. Тенар (1777-1857) в 1818 г. Он обнаружил, что оксиды некоторых металлов при внесении в раствор перекиси водорода вызывают ее разложение. Такой опыт легко воспроизвести, внеся кристаллы перманганата калия в 3%-ный раствор перекиси водорода. Соль КМп0 4 превращается в Мп0 2 , и из раствора под действием оксида быстро выделяется кислород:
Непосредственно действие катализатора на скорость реакции связано с понижением энергии активации. При обычной температуре понижение? а на 20 кДж/моль увеличивает константу скорости приблизительно в 3000 раз. Понижение Е Л может быть и значительно более сильным. Однако понижение энергии активации является внешним проявлением действия катализатора. Реакция характеризуется определенным значением E. v которое может измениться только при изменении самой реакции. Давая те же самые продукты, реакция при участии добавленного вещества идет по иному пути, через другие стадии и с другой энергией активации. Если на этом новом пути энергия активации оказывается ниже и реакция соответственно идет быстрее, то мы говорим, что эго вещество является катализатором.
Реакция характеризуется определенным значением E. v которое может измениться только при изменении самой реакции. Давая те же самые продукты, реакция при участии добавленного вещества идет по иному пути, через другие стадии и с другой энергией активации. Если на этом новом пути энергия активации оказывается ниже и реакция соответственно идет быстрее, то мы говорим, что эго вещество является катализатором.
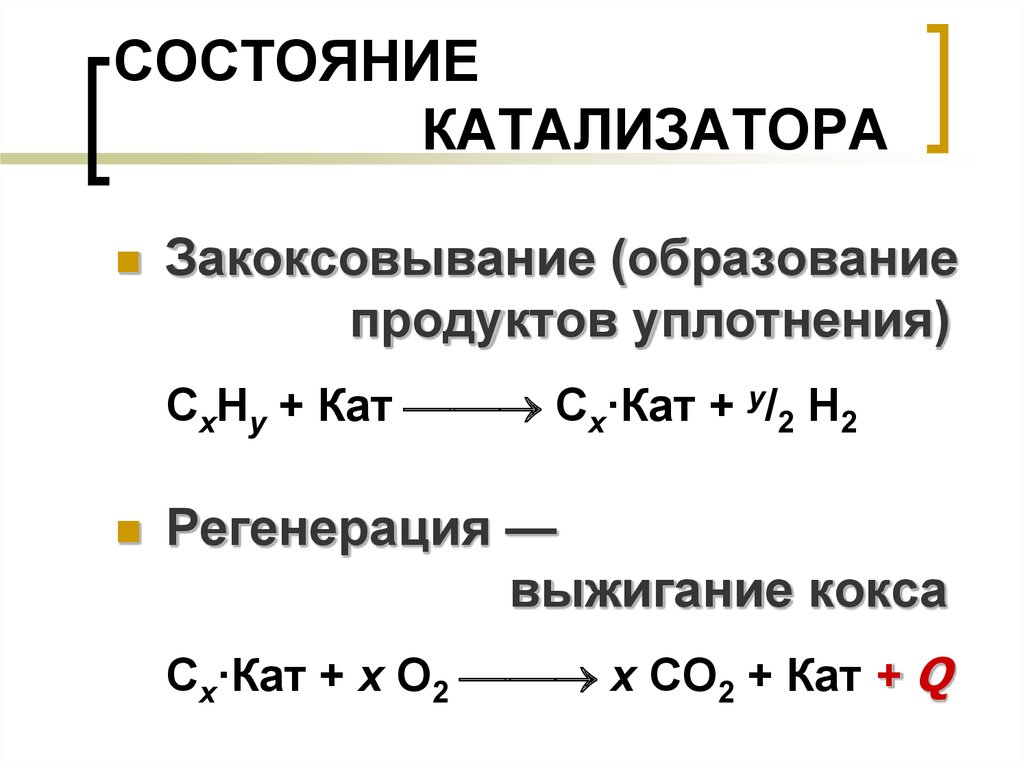
Катализатор взаимодействует с одним из реагентов, образуя некоторое промежуточное соединение. На одной из последующих стадий реакции катализатор регенерируется — выходит из реакции в первоначальном виде. Реагенты, участвуя в каталитической реакции, продолжают взаимодействовать между собой и по медленному пути без участия катализатора. Поэтому каталитические реакции относятся к разновидности сложных реакций, называемых последовательно-параллельными. На рис. 11.8 показана зависимость константы скорости от концентрации катализатора. График зависимости не проходит через ноль, так как при отсутствии катализатора протекание реакции не прекращается.
Рис. 11.8.
наблюдаемая константа k выражается суммой k u + & к с(К)
Пример 11.5. При температуре -500 °С реакция окисления оксида серы(1У)
являющаяся одной из стадий промышленного получения серной кислоты, идет очень медленно. Дальнейшее повышение температуры неприемлемо, так как равновесие смещается влево (реакция экзотермическая) и выход продукта слишком сильно понижается. Но эта реакция ускоряется различными катализаторами, одним из которых может быть оксид азота(П). Сначала катализатор реагирует с кислородом:
а потом передает атом кислорода оксиду серы(1У):
Так образуется конечный продукт реакции и регенерируется катализатор. Для реакции открылась возможность течения по новому пути, на котором константы скорости значительно возросли:
На приведенной схеме показаны оба пути процесса окисления S0 2 . При отсутствии катализатора реакция идет только по медленному пути, а в присутствии катализатора- по обоим.
Различают два вида катализа — гомогенный и гетерогенный. В первом случае катализатор и реагенты образуют гомогенную систему в виде газовой смеси или раствора. Пример окисления оксида серы — это гомогенный катализ. Скорость гомогенной каталитической реакции зависит как от концентраций реагентов, так и от концентрации катализатора.
В первом случае катализатор и реагенты образуют гомогенную систему в виде газовой смеси или раствора. Пример окисления оксида серы — это гомогенный катализ. Скорость гомогенной каталитической реакции зависит как от концентраций реагентов, так и от концентрации катализатора.
При гетерогенном катализе катализатор представляет собой твердое вещество в чистом виде или нанесенное на носитель. Например, платина в качестве катализатора может быть закреплена на асбесте, оксиде алюминия и т.д. Молекулы реагента адсорбируются (поглощаются) из газа или раствора на особых точках поверхности катализатора — активных центрах и при этом активируются. После химического превращения образовавшиеся молекулы продукта десорбируются с поверхности катализатора. На активных центрах повторяются акты превращения частиц. Кроме прочих факторов, скорость гетерогенной каталитической реакции зависит от площади поверхности каталитического материала.
Гетерогенный катализ особенно широко применяется в промышленности.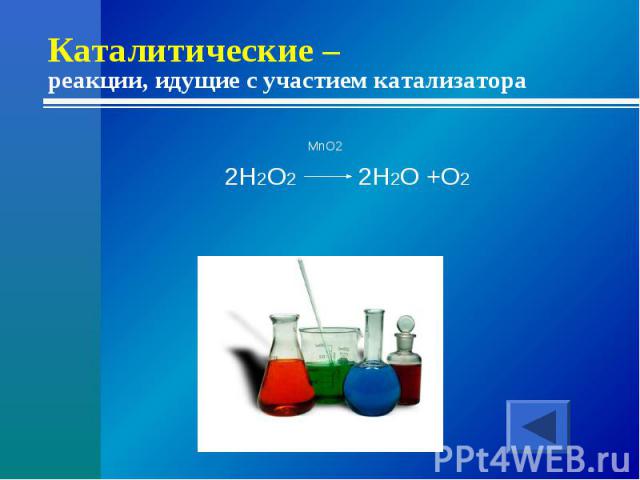 Это объясняется легкостью осуществления непрерывного каталитического процесса при прохождении смеси реагентов через контактный аппарат с катализатором.
Это объясняется легкостью осуществления непрерывного каталитического процесса при прохождении смеси реагентов через контактный аппарат с катализатором.
Катализаторы действуют избирательно, ускоряя вполне определенный вид реакций или даже отдельную реакцию и не влияя на другие. Это позволяет использовать катализаторы не только для ускорения реакций, но и для целенаправленного превращения исходных веществ в желаемые продукты. Метан и вода при 450 °С на катализаторе Fe 2 0 3 превращаются в углекислый газ и водород:
Те же вещества при 850 °С на поверхности никеля реагируют с образованием оксида углерода(П) и водорода:
Катализ относится к тем областям химии, в которых пока невозможно делать точные теоретические прогнозы. Все промышленные катализаторы для переработки нефтяных продуктов, природного газа, производства аммиака и многие другие разработаны на основе трудоемких и длительных экспериментальных исследований.
Умение управлять скоростями химических процессов имеет неоценимое значение в хозяйственной деятельности человека.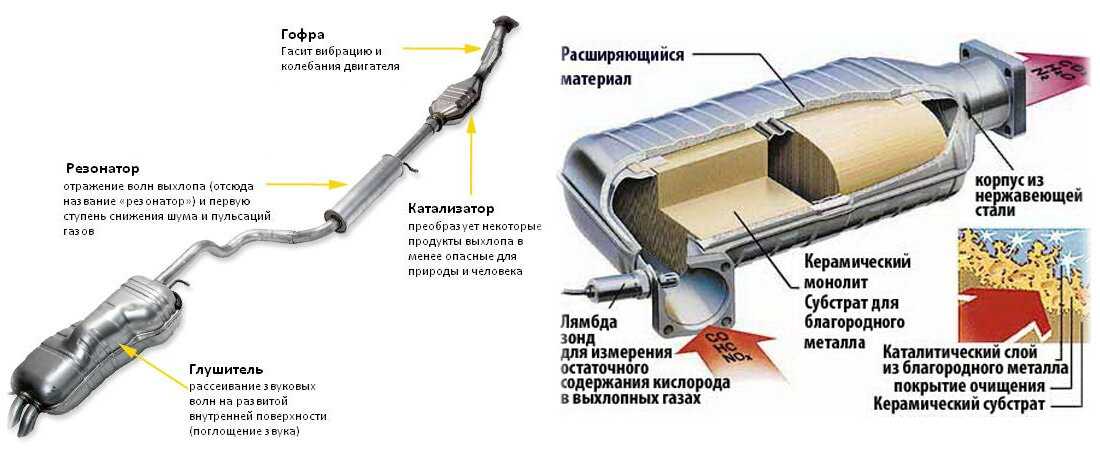 При промышленном получении химических продуктов обычно необходимо увеличивать скорости технологических химических процессов, а при хранении продукции требуется уменьшать скорость разложения или воздействия кислорода, воды и т.д. Известны вещества, которые могут замедлять химические реакции. Они называются ингибиторами , или отрицательными катализаторами. Ингибиторы принципиально отличаются от настоящих катализаторов тем, что реагируют с активными частицами (свободными радикалами), которые по тем или иным причинам возникают в веществе или окружающей его среде и вызывают ценные реакции разложения и окисления. Ингибиторы постепенно расходуются, прекращая свое защитное действие. Наиболее важной разновидностью ингибиторов являются антиоксиданты, предохраняющие различные материалы от воздействия кислорода.
При промышленном получении химических продуктов обычно необходимо увеличивать скорости технологических химических процессов, а при хранении продукции требуется уменьшать скорость разложения или воздействия кислорода, воды и т.д. Известны вещества, которые могут замедлять химические реакции. Они называются ингибиторами , или отрицательными катализаторами. Ингибиторы принципиально отличаются от настоящих катализаторов тем, что реагируют с активными частицами (свободными радикалами), которые по тем или иным причинам возникают в веществе или окружающей его среде и вызывают ценные реакции разложения и окисления. Ингибиторы постепенно расходуются, прекращая свое защитное действие. Наиболее важной разновидностью ингибиторов являются антиоксиданты, предохраняющие различные материалы от воздействия кислорода.
Следует напомнить и о том, чего нельзя добиться с помощью катализаторов. Они способны ускорять только самопроизвольные реакции. Если реакция самопроизвольно не идет, то катализатор не сможет ее ускорить. Например, никакой катализатор не может вызвать разложение воды на водород и кислород. Этот процесс можно осуществить только электролизом, затрачивая при этом электрическую работу.
Например, никакой катализатор не может вызвать разложение воды на водород и кислород. Этот процесс можно осуществить только электролизом, затрачивая при этом электрическую работу.
Катализаторы могут активизировать и нежелательные процессы. В последние десятилетия наблюдается постепенное разрушение озонового слоя атмосферы на высоте 20-25 км. Предполагается, что в распаде озона участвуют некоторые вещества, например галогенированные углеводороды, выбрасываемые в атмосферу промышленными предприятиями, а также используемые в бытовых целях.
Катализ и катализаторы. Каталитические реакции: примеры
Катамлиз- избирательное ускорение одного из возможных термодинамически разрешенных направлений химической реакции под действием катализатора(ов), который многократно вступает в промежуточное химическое взаимодействие с участниками реакции и восстанавливает свой химический состав после каждого цикла промежуточных химических взаимодействий. Термин «катализ» был введён в 1835 году шведским учёным Йёнсом Якобом Берцелиусом.
Явление катализа распространено в природе (большинство процессов, происходящих в живых организмах, являются каталитическими) и широко используется в технике (в нефтепереработке и нефтехимии, в производстве серной кислоты,аммиака, азотной кислоты и др.). Большая часть всех промышленных реакций — каталитические.
Катализаторами называются вещества, изменяющие скорость химических реакций.
Одни катализаторы сильно ускоряют реакцию — положительный катализ, или просто катализ, другие — замедляют -отрицательный катализ. Примерами положительного катализа могут служить получение серной кислоты, окисление аммиака в азотную кислоту с помощью платинового катализатора и др.
По влиянию на скорость реакции катализ многие источники делят на положительный (скорость реакции растет) и отрицательный (скорость реакции падает). В последнем случае происходит процесс ингибирования, который нельзя считать «отрицательным катализом», поскольку ингибитор в ходе реакции расходуется.
Катализ бывает гомогенным и гетерогенным (контактным). В гомогенном катализе катализатор состоит в той же фазе, что и реактивы реакции, в то время, как гетерогенные катализаторы отличаются фазой.
Гомогенный катализ.
Примером гомогенного катализа является разложение пероксида водорода в присутствии ионов йода. Реакция протекает в две стадии:
H 2 О2 + I > h3О + IO, h3О2 + IO > h3О + О2 + I
При гомогенном катализе действие катализатора связано с тем, что он вступает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, это приводит к снижению энергии активации.
Гетерогенный катализ.
При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела — катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практике катализатор обычно наносят на твердый пористый носитель.
Механизм гетерогенного катализа сложнее, чем у гомогенного. Механизм гетерогенного катализа включает пять стадий, причем все они обратимы.
Механизм гетерогенного катализа включает пять стадий, причем все они обратимы.
- 1. Диффузия реагирующих веществ к поверхности твердого вещества
- 2. Физическая адсорбция на активных центрах поверхности твердого вещества реагирующих молекул и затем хемосорбция их
- 3. Химическая реакция между реагирующими молекулами
- 4. Десорбция продуктов с поверхности катализатора
- 5. Диффузия продукта с поверхности катализатора в общий поток
Примером гетерогенного катализа является окисление SO 2 в SO 3 на катализаторе V 2 O 5 при производстве серной кислоты(контактный метод).
Большинство каталитических реакций осуществляется на пористых катализаторах, внутренняя поверхность которых состоит из пор, каналов разных размеров и длины. Эти поры могут быть изолированными или связанными друг с другом. Основным фактором, определяющим скорость и характер движения газов в порах катализатора, является размер пор. Скорость свободного движения молекул может достигать 1000 м / с, а торможение движения в порах связано с соударениями между молекулами газа и со стенками пор.
Большинство каталитических реакций неизбирательны, что налагает известные ограничения на кинетические методы анализа.
В большинстве каталитических реакций участвуют несколько различных типов атомов и молекул. Определение механизма реакции и природы сил, действующих между этими атомами и молекулами и между ними и поверхностью, является, естественно, сложной задачей, но она может быть упрощена путем изучения адсорбционного поведения одного типа атомов или молекул. Такие исследования показали, что при адсорбции некоторых молекул на определенных адсорбентах связь в молекуле разрывается и возникают две связи с адсорбентом; при этом адсорбированная молекула переходит в два адсорбированных атома. Этот процесс представляет собой поверхностную химическую реакцию, а образовавшиеся адсорбированные атомы принято называть хемосор-бированными атомами. Если при достаточно низких температурах такая реакция не происходит и адсорбированные молекулы не распадаются на два адсорбированных атома, то такие молекулы называют физически адсорбированными.
Катализатор – вещество, изменяющее скорость химической реакции, но при этом не расходующееся. Катализаторы бывают ускоряющимися и замедляющимися.
Катализ – явление изменения скорости реакции в присутствии катализаторов.
Каталитические реакции – реакции, протекающие с участием катализаторов.
Если катализатором является один из продуктов реакции, то реакцию называют автокаталитической , а само явление – автокатализом.
Ингибитор – катализатор, замедляющий реакцию.
Примером положительных катализаторов может служить вода при взаимодействии порошка алюминия с йодом.
Ферменты – биологические катализаторы белковой природы.
Ферменты присутствуют во всех живых клетках. Принято разделять ферменты на простые и сложные, или однокомпонентные или двухкомпонентные. Простые ферменты состоят только из белка, сложные из белка и небелковой части, которую называют коферментом.
Ферменты отличаются высокой каталитической активностью и избирательностью. По каталитической активности они значительно превосходят неорганические катализаторы. Например, 1 моль каталазы при 0 градусов разлагает за одну секунду 200 000 молей Н 2 О 2 , а 1 моль платины при 20 градусах разлагает за одну секунду от 10 до 80 молей перекиси водорода.
Такие ускорения реакции связаны с тем, что ферменты резко снижают энергетические барьеры на реакционном пути. Например, энергия активации для реакции распада Н 2 О 2 под действием иона железа (II) и молекул каталазы соответственно равна 42 и 7,1 кДж/моль; для гидролиза мочевины кислотой и уреазой – соответственно 103 и 28 кДж/моль.
Ферменты по сравнению с неорганическими катализаторами весьма специфичны. Например, амилаза, содержащаяся в слюне, легко и быстро расщепляет крахмал, но не катализирует процесс распада сахара. Уреаза исключительно эффективно катализирует гидролиз мочевины, но не оказывает никакого воздействия на ее производные. Такая особенность ферментов позволяет живым организмам, имея соответствующий набор ферментов, активно откликаться на воздействия извне. Например, замечено, что в стрессовых ситуациях наш организм проявляет удивительные возможности. Описан факт, когда слабая женщина подняла за бампер легковой автомобиль и удерживала его, пока подоспевшие люди освобождали попавшего под него ребенка; человек, преследуемый разъяренным животным, легко преодолевает препятствия, непреодолимые для него в обычном состоянии; на ответственных соревнованиях спортсмены теряют в весе по несколько килограммов за период выступления.
Такая особенность ферментов позволяет живым организмам, имея соответствующий набор ферментов, активно откликаться на воздействия извне. Например, замечено, что в стрессовых ситуациях наш организм проявляет удивительные возможности. Описан факт, когда слабая женщина подняла за бампер легковой автомобиль и удерживала его, пока подоспевшие люди освобождали попавшего под него ребенка; человек, преследуемый разъяренным животным, легко преодолевает препятствия, непреодолимые для него в обычном состоянии; на ответственных соревнованиях спортсмены теряют в весе по несколько килограммов за период выступления.
Все сказанное о замечательных свойствах ферментов объясняется тем, что избирательность действия (селективность) и активность взаимосвязаны: чем выше селективность, тем выше ее активность. Ферменты обладают уникальной селективностью, поэтому и активность их наивысшая.
Скорости химических реакций могут резко увеличиваться в присутствии различных веществ, не являющихся реагентами и не входящих в состав продуктов реакции. Это замечательное явление получило название катализ (от греч. «katalysis» — разрушение). Вещество, при наличии которого в смеси увеличивается скорость реакции, называется катализатором. Его количество до и после реакции остается неизменным. Катализаторы не представляют собой какой-то особый класс веществ. В разных реакциях каталитическое действие могут проявить металлы, оксиды, кислоты, соли, комплексные соединения. Химические реакции в живых клетках протекают под контролем каталитических белков, называемых ферментами. Катализ следует рассматривать как истинно химический фактор увеличения скоростей химических реакций, так как катализатор непосредственно участвует в реакции. Катализ часто оказывается более мощным и менее рискованным средством ускорения реакции, чем повышение температуры. Это ярко проявляется на примере химических реакций в живых организмах. Реакции, например гидролиз белков, которые в лабораториях приходится проводить при длительном нагревании до температуры кипения, в процессе пищеварения протекают без нагревания при температуре тела.
Это замечательное явление получило название катализ (от греч. «katalysis» — разрушение). Вещество, при наличии которого в смеси увеличивается скорость реакции, называется катализатором. Его количество до и после реакции остается неизменным. Катализаторы не представляют собой какой-то особый класс веществ. В разных реакциях каталитическое действие могут проявить металлы, оксиды, кислоты, соли, комплексные соединения. Химические реакции в живых клетках протекают под контролем каталитических белков, называемых ферментами. Катализ следует рассматривать как истинно химический фактор увеличения скоростей химических реакций, так как катализатор непосредственно участвует в реакции. Катализ часто оказывается более мощным и менее рискованным средством ускорения реакции, чем повышение температуры. Это ярко проявляется на примере химических реакций в живых организмах. Реакции, например гидролиз белков, которые в лабораториях приходится проводить при длительном нагревании до температуры кипения, в процессе пищеварения протекают без нагревания при температуре тела.
Впервые явление катализа наблюдал французский химик Л. Ж. Тенар (1777-1857) в 1818 г. Он обнаружил, что оксиды некоторых металлов при внесении в раствор перекиси водорода вызывают ее разложение. Такой опыт легко воспроизвести, внеся кристаллы перманганата калия в 3%-ный раствор перекиси водорода. Соль КМп0 4 превращается в Мп0 2 , и из раствора под действием оксида быстро выделяется кислород:
Непосредственно действие катализатора на скорость реакции связано с понижением энергии активации. При обычной температуре понижение? а на 20 кДж/моль увеличивает константу скорости приблизительно в 3000 раз. Понижение Е Л может быть и значительно более сильным. Однако понижение энергии активации является внешним проявлением действия катализатора. Реакция характеризуется определенным значением E. v которое может измениться только при изменении самой реакции. Давая те же самые продукты, реакция при участии добавленного вещества идет по иному пути, через другие стадии и с другой энергией активации. Если на этом новом пути энергия активации оказывается ниже и реакция соответственно идет быстрее, то мы говорим, что эго вещество является катализатором.
Если на этом новом пути энергия активации оказывается ниже и реакция соответственно идет быстрее, то мы говорим, что эго вещество является катализатором.
Катализатор взаимодействует с одним из реагентов, образуя некоторое промежуточное соединение. На одной из последующих стадий реакции катализатор регенерируется — выходит из реакции в первоначальном виде. Реагенты, участвуя в каталитической реакции, продолжают взаимодействовать между собой и по медленному пути без участия катализатора. Поэтому каталитические реакции относятся к разновидности сложных реакций, называемых последовательно-параллельными. На рис. 11.8 показана зависимость константы скорости от концентрации катализатора. График зависимости не проходит через ноль, так как при отсутствии катализатора протекание реакции не прекращается.
Рис. 11.8.
наблюдаемая константа k выражается суммой k u + & к с(К)
Пример 11.5. При температуре -500 °С реакция окисления оксида серы(1У)
являющаяся одной из стадий промышленного получения серной кислоты, идет очень медленно. Дальнейшее повышение температуры неприемлемо, так как равновесие смещается влево (реакция экзотермическая) и выход продукта слишком сильно понижается. Но эта реакция ускоряется различными катализаторами, одним из которых может быть оксид азота(П). Сначала катализатор реагирует с кислородом:
Дальнейшее повышение температуры неприемлемо, так как равновесие смещается влево (реакция экзотермическая) и выход продукта слишком сильно понижается. Но эта реакция ускоряется различными катализаторами, одним из которых может быть оксид азота(П). Сначала катализатор реагирует с кислородом:
а потом передает атом кислорода оксиду серы(1У):
Так образуется конечный продукт реакции и регенерируется катализатор. Для реакции открылась возможность течения по новому пути, на котором константы скорости значительно возросли:
На приведенной схеме показаны оба пути процесса окисления S0 2 . При отсутствии катализатора реакция идет только по медленному пути, а в присутствии катализатора- по обоим.
Различают два вида катализа — гомогенный и гетерогенный. В первом случае катализатор и реагенты образуют гомогенную систему в виде газовой смеси или раствора. Пример окисления оксида серы — это гомогенный катализ. Скорость гомогенной каталитической реакции зависит как от концентраций реагентов, так и от концентрации катализатора.
При гетерогенном катализе катализатор представляет собой твердое вещество в чистом виде или нанесенное на носитель. Например, платина в качестве катализатора может быть закреплена на асбесте, оксиде алюминия и т.д. Молекулы реагента адсорбируются (поглощаются) из газа или раствора на особых точках поверхности катализатора — активных центрах и при этом активируются. После химического превращения образовавшиеся молекулы продукта десорбируются с поверхности катализатора. На активных центрах повторяются акты превращения частиц. Кроме прочих факторов, скорость гетерогенной каталитической реакции зависит от площади поверхности каталитического материала.
Гетерогенный катализ особенно широко применяется в промышленности. Это объясняется легкостью осуществления непрерывного каталитического процесса при прохождении смеси реагентов через контактный аппарат с катализатором.
Катализаторы действуют избирательно, ускоряя вполне определенный вид реакций или даже отдельную реакцию и не влияя на другие.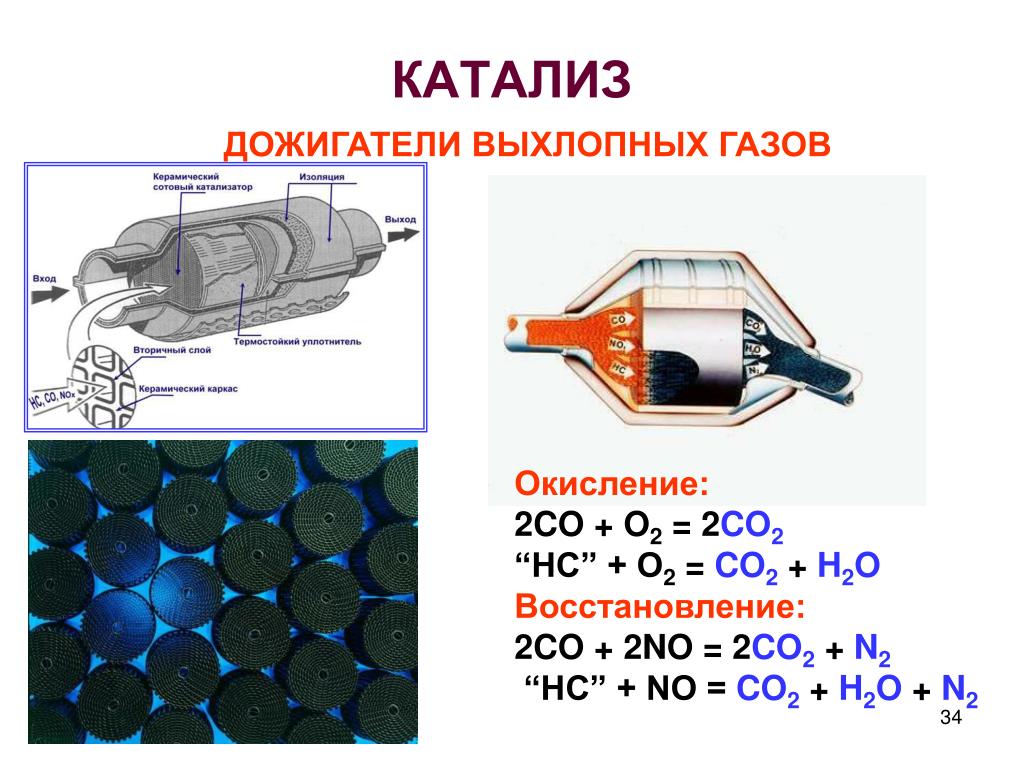 Это позволяет использовать катализаторы не только для ускорения реакций, но и для целенаправленного превращения исходных веществ в желаемые продукты. Метан и вода при 450 °С на катализаторе Fe 2 0 3 превращаются в углекислый газ и водород:
Это позволяет использовать катализаторы не только для ускорения реакций, но и для целенаправленного превращения исходных веществ в желаемые продукты. Метан и вода при 450 °С на катализаторе Fe 2 0 3 превращаются в углекислый газ и водород:
Те же вещества при 850 °С на поверхности никеля реагируют с образованием оксида углерода(П) и водорода:
Катализ относится к тем областям химии, в которых пока невозможно делать точные теоретические прогнозы. Все промышленные катализаторы для переработки нефтяных продуктов, природного газа, производства аммиака и многие другие разработаны на основе трудоемких и длительных экспериментальных исследований.
Умение управлять скоростями химических процессов имеет неоценимое значение в хозяйственной деятельности человека. При промышленном получении химических продуктов обычно необходимо увеличивать скорости технологических химических процессов, а при хранении продукции требуется уменьшать скорость разложения или воздействия кислорода, воды и т. д. Известны вещества, которые могут замедлять химические реакции. Они называются ингибиторами , или отрицательными катализаторами. Ингибиторы принципиально отличаются от настоящих катализаторов тем, что реагируют с активными частицами (свободными радикалами), которые по тем или иным причинам возникают в веществе или окружающей его среде и вызывают ценные реакции разложения и окисления. Ингибиторы постепенно расходуются, прекращая свое защитное действие. Наиболее важной разновидностью ингибиторов являются антиоксиданты, предохраняющие различные материалы от воздействия кислорода.
д. Известны вещества, которые могут замедлять химические реакции. Они называются ингибиторами , или отрицательными катализаторами. Ингибиторы принципиально отличаются от настоящих катализаторов тем, что реагируют с активными частицами (свободными радикалами), которые по тем или иным причинам возникают в веществе или окружающей его среде и вызывают ценные реакции разложения и окисления. Ингибиторы постепенно расходуются, прекращая свое защитное действие. Наиболее важной разновидностью ингибиторов являются антиоксиданты, предохраняющие различные материалы от воздействия кислорода.
Следует напомнить и о том, чего нельзя добиться с помощью катализаторов. Они способны ускорять только самопроизвольные реакции. Если реакция самопроизвольно не идет, то катализатор не сможет ее ускорить. Например, никакой катализатор не может вызвать разложение воды на водород и кислород. Этот процесс можно осуществить только электролизом, затрачивая при этом электрическую работу.
Катализаторы могут активизировать и нежелательные процессы. В последние десятилетия наблюдается постепенное разрушение озонового слоя атмосферы на высоте 20-25 км. Предполагается, что в распаде озона участвуют некоторые вещества, например галогенированные углеводороды, выбрасываемые в атмосферу промышленными предприятиями, а также используемые в бытовых целях.
В последние десятилетия наблюдается постепенное разрушение озонового слоя атмосферы на высоте 20-25 км. Предполагается, что в распаде озона участвуют некоторые вещества, например галогенированные углеводороды, выбрасываемые в атмосферу промышленными предприятиями, а также используемые в бытовых целях.
Ката́лиз (греч. κατάλυσις восходит к καταλύειν — разрушение) — избирательное ускорение одного из возможных термодинамически разрешенных направлений химической реакции под действием катализатора(ов), который многократно вступает в промежуточное химическое взаимодействие с участниками реакции и восстанавливает свой химический состав после каждого цикла промежуточных химических взаимодействий. Термин «катализ» был введён в 1835 году шведским учёным Йёнсом Якобом Берцелиусом.Явление катализа распространено в природе (большинство процессов, происходящих в живых организмах, являются каталитическими) и широко используется в технике (в нефтепереработке и нефтехимии, в производстве серной кислоты, аммиака, азотной кислоты и др. ). Большая часть всех промышленных реакций — каталитические.Случай, когда катализатором является один из продуктов реакции или её исходных веществ, называют автокатализом.Катализатор изменяет механизм реакции на энергетически более выгодный, то есть снижает энергию активации. Катализатор образует с молекулой одного из реагентов промежуточное соединение, в котором ослаблены химические связи. Это облегчает его реакцию со вторым реагентом. Важно отметить, что катализаторы ускоряютобратимые реакции как в прямом, так и в обратном направлениях. Поэтому они не смещают химическое равновесие [
). Большая часть всех промышленных реакций — каталитические.Случай, когда катализатором является один из продуктов реакции или её исходных веществ, называют автокатализом.Катализатор изменяет механизм реакции на энергетически более выгодный, то есть снижает энергию активации. Катализатор образует с молекулой одного из реагентов промежуточное соединение, в котором ослаблены химические связи. Это облегчает его реакцию со вторым реагентом. Важно отметить, что катализаторы ускоряютобратимые реакции как в прямом, так и в обратном направлениях. Поэтому они не смещают химическое равновесие [
Применение катализа в промышленности
Гидрирование [править | править вики-текст]
Большое число каталитических реакций связано с активацией атома водорода и какой-либо другой молекулы, приводящей к их химическому взаимодействию. Этот процесс называется гидрированием и лежит в основе многих этапов переработки нефти и получения жидкого топлива из угля (процесс Бергиуса). Производство авиационного бензина и моторного топлива из угля было развито в Германии во время Второй мировой войны, поскольку в этой стране нет нефтяных месторождений. Процесс Бергиуса заключается в непосредственном присоединении водорода к углю. Уголь нагревают под давлением в присутствии водорода и получают жидкий продукт, который затем перерабатывают в авиационный бензин и моторное топливо. В качестве катализатора используют оксид железа, а также катализаторы на основе олова и молибдена. Во время войны на 12 заводах Германии с помощью процесса Бергиуса получали примерно 1400 т жидкого топлива в сутки. Другой процесс, Фишера — Тропша, состоит из двух стадий. Вначале уголь газифицируют, то есть проводят реакцию его с водяным паром и кислородом и получают смесь водорода и оксидов углерода. Эту смесь превращают в жидкое топливо с помощью катализаторов, содержащих железо или кобальт. С окончанием войны производство синтетического топлива из угля в Германии было прекращено. В результате повышения цен на нефть, последовавшего за нефтяным эмбарго в 1973-1974, были предприняты энергичные усилия по разработке экономически выгодного способа получения бензина из угля.
Процесс Бергиуса заключается в непосредственном присоединении водорода к углю. Уголь нагревают под давлением в присутствии водорода и получают жидкий продукт, который затем перерабатывают в авиационный бензин и моторное топливо. В качестве катализатора используют оксид железа, а также катализаторы на основе олова и молибдена. Во время войны на 12 заводах Германии с помощью процесса Бергиуса получали примерно 1400 т жидкого топлива в сутки. Другой процесс, Фишера — Тропша, состоит из двух стадий. Вначале уголь газифицируют, то есть проводят реакцию его с водяным паром и кислородом и получают смесь водорода и оксидов углерода. Эту смесь превращают в жидкое топливо с помощью катализаторов, содержащих железо или кобальт. С окончанием войны производство синтетического топлива из угля в Германии было прекращено. В результате повышения цен на нефть, последовавшего за нефтяным эмбарго в 1973-1974, были предприняты энергичные усилия по разработке экономически выгодного способа получения бензина из угля. Так, прямое ожижение угля можно проводить более эффективно, используя двухстадийный процесс, в котором сначала уголь контактирует с алюмокобальтомолибденовым катализатором при относительно низкой, а затем при более высокой температуре. Стоимость такого синтетического бензина выше, чем получаемого из нефти.
Так, прямое ожижение угля можно проводить более эффективно, используя двухстадийный процесс, в котором сначала уголь контактирует с алюмокобальтомолибденовым катализатором при относительно низкой, а затем при более высокой температуре. Стоимость такого синтетического бензина выше, чем получаемого из нефти.
Кислотный катализ [править | править вики-текст]
Каталитическая активность большого класса катализаторов обусловливается их кислотными свойствами. Согласно Й. Брёнстеду и Т. Лоури, кислота — это соединение, способное отдавать протон. Сильные кислоты легко отдают свои протоны основаниям. Концепция кислотности получила дальнейшее развитие в работах Г. Льюиса, который дал определение кислоты как вещества, способного принимать электронную пару от вещества-донора с образованием ковалентной связи за счет обобществления этой электронной пары. Эти идеи вместе с представлениями о реакциях с образованием карбений-ионов помогли понять механизм разнообразных каталитических реакций, особенно тех, в которых участвуют углеводороды.
По влиянию на скорость реакции катализ многие источники делят на положительный (скорость реакции растет) и отрицательный (скорость реакции падает). В последнем случае происходит процесс ингибирования, который нельзя считать «отрицательным катализом», поскольку ингибитор в ходе реакции расходуется.
Катализ бывает гомогенным и гетерогенным (контактным). В гомогенном катализе катализатор состоит в той же фазе, что и реактивы реакции, в то время, как гетерогенные катализаторы отличаются фазой.
Гомогенный катализ [править | править вики-текст]
Примером гомогенного катализа является разложение пероксида водорода в присутствии ионов йода. Реакция протекает в две стадии:
H 2 О 2 + I → H 2 О + IO
H 2 О 2 + IO → H 2 О + О 2 + I
При гомогенном катализе действие катализатора связано с тем, что он вступает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, это приводит к снижению энергии активации.
Гетерогенный катализ [править | править вики-текст]
При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела — катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практике катализатор обычно наносят на твердый пористый носитель.
Механизм гетерогенного катализа сложнее, чем у гомогенного. Механизм гетерогенного катализа включает пять стадий, причем все они обратимы.
1. Диффузия реагирующих веществ к поверхности твердого вещества
2. Физическая адсорбция на активных центрах поверхности твердого вещества реагирующих молекул и затем хемосорбция их
3. Химическая реакция между реагирующими молекулами
4. Десорбция продуктов с поверхности катализатора
5. Диффузия продукта с поверхности катализатора в общий поток
Примером гетерогенного катализа является окисление SO 2 в SO 3 на катализаторе V 2 O 5 при производстве серной кислоты (контактный метод).
Течение реакции именно на поверхности катализатора можно продемонстрировать на опыте, в котором пластинку из платины нагревают в пламени газовой горелки, затем пламя тушат и пускают на пластинку струю газа из горелки, при этом пластинка снова раскаляется докрасна — окисление метана происходит на поверхности металла .
Скорость химических реакций может существенно возрасти под действием веществ, которые называют катализаторами .
Явление изменения скорости реакции при наличии катализаторов называют катализом, а реакции с их участием – каталитическими.
Катализатор – это простое или сложное вещество, которое принимает участие в химической реакции и изменяет ее скорость, но в конце остается в химически неизменном состоянии. Если скорость химической реакции под действием катализатора возрастает, то такой катализ называют позитивным, а если уменьшается – то негативным.
Каталитические свойства проявляют переходные металлы и их соединения – оксиды, гидроксиды, сульфиды, амины, аминокислоты и др. Они способны не только значительно ускорять реакции, но и изменять их механизм. Например, при взаимодействии оксида углерода (П) и водорода, в зависимости от природы катализатора, образуются разные продукты – метан или метанол.
Они способны не только значительно ускорять реакции, но и изменять их механизм. Например, при взаимодействии оксида углерода (П) и водорода, в зависимости от природы катализатора, образуются разные продукты – метан или метанол.
В процессе окисления метана кислородом воздуха при наличии разных катализаторов можно получить метанол, формальдегид или муравьиную кислоту.
Катализаторы широко используют в производстве аммиака, серной, азотной, уксусной кислот, каучука, в процессах крекинга нефти, синтеза некоторых лекарственных препаратов и тому подобное. Реакции полимеризации, гидрирования и дегидрирования, получение спиртов, альдегидов, карбоновых кислот с достаточной для технических потребностей скоростью происходят только при наличии катализаторов.
Вещества, которые замедляют скорость химических реакций, называют ингибиторами .
Ингибиторы также широко используют в технике. Их название связано с тем химическим или биохимическим процессом, который они замедляют. В частности, вещества, которые уменьшают скорость коррозии металла, называют ингибиторами коррозии , а вещества, которые тормозят любые процессы окисления разных субстратов молекулярным кислородом, — антиоксидантами.
В частности, вещества, которые уменьшают скорость коррозии металла, называют ингибиторами коррозии , а вещества, которые тормозят любые процессы окисления разных субстратов молекулярным кислородом, — антиоксидантами.
Катализаторы оценивают по определенным критериям, среди которых к наиболее важным принадлежат: активность, специфичность, стойкость к старению и отравлениям.
Активность определяют по отношению скоростей каталитической и некаталитической реакций. Катализатор тем активнее, чем больше он снижает величину энергии активации реакции.
Специфичность (выборочность) заключается в способности катализатора увеличивать скорость только одной реакции.
На активность катализаторов значительно влияют примеси. Одни из них могут усиливать, а другие – замедлять действие катализаторов. Вещества, которые сами не имеют каталитических свойств, но усиливают действие катализаторов, называют промоторами, или активаторами.
Известно также негативное действие некоторых химических веществ на активность катализаторов, так называемых каталитических ядов.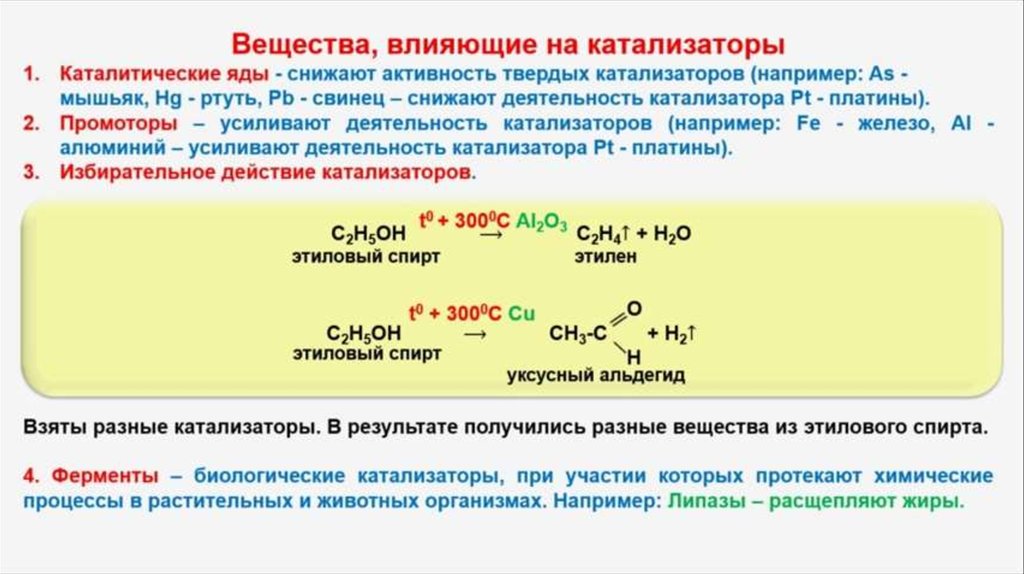 Эти соединения частично, или полностью снижают активность катализаторов.
Эти соединения частично, или полностью снижают активность катализаторов.
Одним из важных видов каталитических процессов является ферментный катализ , который происходит под действием катализаторов белковой природы: так называемых ферментов, или энзимов.
Ферменты как биологические катализаторы
Все химические процессы в условиях физиологичной среды организма (гидролиз, протолиз, фосфорелирование, комплексообразование, окислительно-восстановительные реакции) могут происходить только при участии катализаторов, которые называют ферментами, или энзимами.
Ферменты – это вещества белковой природы, которые производятся клетками живых организмов и значительно увеличивают скорость биохимических процессов.
Сейчас известно более 1800 ферментов, из которых много выделено в чистом кристаллическом виде. Считают, что в клетке содержится около 10 тыс. молекул разных ферментов, которые ускоряют свыше 2 тыс. реакций. Четвертая часть изученных в настоящее время ферментов содержат ионы разных металлов и поэтому их называют металлоферментами.
И ферменты, и неорганические катализаторы подчиняются общим законам катализа и характеризуются рядом общих признаков, то есть они:
катализируют только те реакции, которые являются энергетически возможными;
не изменяют направления хода реакций;
уменьшают энергию активации реакций, тем самым ускоряя их;
не расходуются в процессе реакции.
Однако ферменты характеризуются и особенными признаками, которые дают возможность отличить их от обычных неорганических катализаторов. Эти отличия связаны с особенностями строения ферментов, которые являются сложными макромолекулами белковой природы.
примеров катализаторов | YourDictionary
DESCRIPTION
пример катализатора в лаборатории с химическими веществами
ИСТОЧНИК
D-Keine / E+ / Getty Images
Термин «катализатор» указывает на вещество, которое начинает, ускоряет или облегчает химическую реакцию. Кажется, что вы найдете катализаторы только в химической лаборатории, но вы можете быть удивлены, обнаружив примеры катализаторов в своей повседневной жизни! Продолжайте читать, чтобы узнать, что такое катализатор, и увидеть примеры химических катализаторов, а также примеры катализаторов в нехимическом контексте.- перманганат калия — Перекись водорода разлагается на воду и газообразный кислород. Две молекулы перекиси водорода дадут две молекулы воды и одну молекулу кислорода.
 Для ускорения этого процесса можно использовать катализатор перманганат калия. Добавление перманганата калия к перекиси водорода вызовет реакцию с выделением большого количества тепла, и будет выделяться водяной пар.
Для ускорения этого процесса можно использовать катализатор перманганат калия. Добавление перманганата калия к перекиси водорода вызовет реакцию с выделением большого количества тепла, и будет выделяться водяной пар. - платина — Каталитический нейтрализатор в автомобиле содержит платину, которая служит катализатором для превращения ядовитого монооксида углерода в диоксид углерода.
- палладий — Если вы зажжете спичку в комнате с газообразным водородом и газообразным кислородом, произойдет взрыв, и большая часть водорода и кислорода объединится, чтобы создать молекулы воды.
- железо — При производстве аммиака железо является полезным катализатором. Эта реакция, известная как процесс Габера, превращает азот и водород в аммиак. Железо ускоряет разрыв связей азота, делая его более реактивным.
- оксид ванадия — Серной кислоте требуется диоксид серы, чтобы стать триоксидом серы.
 Когда вы пропускаете диоксид серы над оксидом ванадия, он окисляется — то есть добавляет молекулу кислорода — диоксид серы в триоксид серы.
Когда вы пропускаете диоксид серы над оксидом ванадия, он окисляется — то есть добавляет молекулу кислорода — диоксид серы в триоксид серы. - пролин — Пролин представляет собой встречающуюся в природе аминокислоту, которая также может подвергаться биосинтезу. Он действует как катализатор во многих биологических процессах, включая альдольную конденсацию, которая создает углерод-углеродные связи для новых органических соединений.
- диастаза — Когда вы едите что-то, что содержит крахмал, ферменты диастазы являются катализаторами пищеварения.
 Они появляются в слюне и расщепляют крахмал до мальтозы, которую организм переваривает в желудке.
Они появляются в слюне и расщепляют крахмал до мальтозы, которую организм переваривает в желудке. - лактаза — У большинства людей в тонком кишечнике есть ферменты лактазы, которые начинают химическое расщепление лактозы из молока и молочных продуктов. Люди с непереносимостью лактозы не вырабатывают достаточного количества этого фермента и не могут полностью переваривать молочные продукты.
- ДНК-полимераза — Когда ДНК реплицируется, она должна точно копировать генетическую последовательность. Фермент ДНК-полимераза катализирует синтез ДНК каждый раз, когда клетка делится. Он работает с другими ферментами, включая геликазу и праймазу, чтобы полностью копировать ДНК снова и снова.
- Щелочная фосфатаза (ЩФ) Щелочная фосфатаза, обнаруженная в печени, пищеварительной системе и костях, является катализатором расщепления белков. Он также помогает в реакциях, связанных с пищеварением и ростом костей.
 Слишком много щелочной фосфатазы в крови может указывать на проблемы с печенью или костями, а может быть просто из-за нормального процесса беременности и грудного вскармливания.
Слишком много щелочной фосфатазы в крови может указывать на проблемы с печенью или костями, а может быть просто из-за нормального процесса беременности и грудного вскармливания. - отношения — Когда Антония знакомит двух своих друзей, которые затем начинают встречаться, она становится катализатором их отношений.
- юридические изменения — член семьи Сьюзан незаконно заключен в тюрьму. Она пишет письма своим законодателям, организует акции протеста и общается со СМИ. Вскоре член ее семьи освобождается, а законы меняются, чтобы не допустить незаконного тюремного заключения кого-то еще. Сьюзан была катализатором перемен.

- спорт — Элла сидит на скамейке во время баскетбольного матча. Стартовые игроки устают и отстают по очкам. Тренер Эллы вводит ее в игру. Ее энергия помогает ей забить несколько мячей, и команда побеждает. Элла стала катализатором победы в игре.
- социальные изменения — Барри и его друзья видят, как издеваются над младшим ребенком. Они заступаются за ребенка и создают группу против издевательств, которая занимается проблемами хулиганов на детской площадке. Вскоре в их школе стало гораздо меньше издевательств, что делает их катализатором перемен.
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3832
- Джим Кларк
- Школа Труро в Корнуолле

Примеры химических катализаторов
Химический катализатор — это вещество, которое вызывает химическую реакцию, отличную от той, которая происходила бы без этого катализатора. Например, катализатор может вызвать реакцию между реагентами с большей скоростью или при более низкой температуре, чем это было бы возможно без катализатора. Существует два основных типа катализаторов: неорганические катализаторы , и органические катализаторы .
Примеры неорганических катализаторов
Неорганические катализаторы представляют собой соединения, не встречающиеся в биологических процессах. К ним относятся элементарные металлы и другие неорганические вещества. Эти катализаторы ускоряют химические реакции, но не изменяют своей структуры в процессе. Примеры неорганических катализаторов в химических реакциях включают:
Примеры органических катализаторов
Органические катализаторы известны как «органокатализаторы». Они состоят из неметаллических элементов, таких как углерод, водород и сера. Биокатализаторы, такие как белки и ферменты, представляют собой еще один тип органических катализаторов, участвующих в биологических химических процессах. Подобно неорганическим катализаторам, они все еще существуют в своей первоначальной форме после завершения реакции.
Нехимические катализаторы
Когда термин «катализатор» используется вне химии, он относится к чему-то, что вызывает социальные изменения или реакции. Это образное определение основано на определении химического катализатора, запускающего большую реакцию. Некоторые примеры образных катализаторов:
Катализаторы вокруг нас
Эти примеры катализаторов показывают, как одно действие или один человек, как в химии, так и в жизни, может стать началом больших перемен. Важно помнить, что катализатор только запускает реакцию, и что для настоящих изменений необходимо больше реагентов. Взгляните на эти повседневные примеры химических реакций, чтобы узнать больше о том, как химия влияет на вашу повседневную жизнь.
5. Примеры других каталитических реакций в органической химии
На этой странице представлены некоторые остатки примеров катализаторов, используемых в органической химии. Он включает образование эпоксиэтана из этилена и несколько реакций из химии бензола — реакции Фриделя-Крафтса и галогенирование.
Производство эпоксиэтана из этилена
Эпоксиэтан получают реакцией этилена с ограниченным количеством кислорода в присутствии серебряного катализатора при температуре около 250-300°С и давлении менее 15 атмосфер. Поскольку твердое серебро катализирует газовую реакцию, это пример гетерогенного катализа.
Поскольку твердое серебро катализирует газовую реакцию, это пример гетерогенного катализа.
Реакция является экзотермической, и необходимо тщательно контролировать температуру, чтобы предотвратить дальнейшее окисление этилена до углекислого газа и воды.
Галогенирование бензола
Бензол реагирует с хлором или бромом в присутствии катализатора. Катализатором является либо хлорид алюминия (или бромид алюминия, если вы взаимодействуете с бензолом с бромом), либо железо.
Строго говоря, железо не является катализатором, потому что оно постоянно меняется в ходе реакции. Он реагирует с некоторым количеством хлора или брома с образованием хлорида железа (III), FeCl 3 , или бромида железа (III), FeBr 3 .
Эти соединения действуют как катализатор и ведут себя в этих реакциях точно так же, как хлорид алюминия.
Реакция с хлором
Реакция между бензолом и хлором в присутствии хлорида алюминия или железа дает хлорбензол.
или:
Реакция с бромом
Реакция между бензолом и бромом в присутствии бромида алюминия или железа дает бромбензол. Железо обычно используется, потому что оно дешевле и более доступно.
или:
Алкилирование бензола по Фриделю-Крафтсу
Алкилирование включает замену атома водорода в бензольном кольце на алкильную группу, такую как метил или этил. Это еще один пример использования хлорида алюминия в качестве катализатора. Бензол обрабатывают хлоралканом (например, хлорметаном или хлорэтаном) в присутствии хлорида алюминия в качестве катализатора. Уравнение показывает реакцию с использованием метильной группы, но таким же образом можно использовать любую другую алкильную группу.
Замена метильной группы дает метилбензол, ранее известный как толуол.
или:
Ацилирование бензола по Фриделю-Крафтсу
Ацильная группа представляет собой алкильную группу, присоединенную к двойной связи углерод-кислород.
