Катализатор | это… Что такое Катализатор?
У этого термина существуют и другие значения, см. Катализатор (значения).
Схема протекания реакции с катализатором
Катализа́тор — химическое вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции[1]. Количество катализатора, в отличие от реагентов, после реакции не изменяется. Важно понимать, что катализатор не участвует в реакции. Они обеспечивают более быстрый путь для реакции, катализатор реагирует с исходным веществом, получившееся промежуточное соединение подвергается превращениям и в конце расщепляется на продукт и катализатор. Затем катализатор снова реагирует с исходным веществом, и этот каталитический цикл многократно повторяется.
Содержание
|
Катализаторы в химии
Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный — образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества [1]. Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный — образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества [1]. Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Реакции одного и того же типа могут протекать как с гомогенными, так и с гетерогенными катализаторами. Так, наряду с растворами кислот применяются имеющие кислотные свойства твёрдые Al2O3, TiO2, ThO2, алюмосиликаты, цеолиты. Гетерогенные катализаторы с основными свойствами: CaO, BaO, MgO [1].
Гетерогенные катализаторы имеют, как правило, сильно развитую поверхность, для чего их распределяют на инертном носителе (силикагель, оксид алюминия, активированный уголь и др.).
Для каждого типа реакций эффективны только определённые катализаторы. Кроме уже упомянутых кислотно-основных, существуют катализаторы окисления-восстановления; для них характерно присутствие переходного металла или его соединения (Со+3, V2O5+MoO3). В этом случае катализ осуществляется путём изменения степени окисления переходного металла.
В этом случае катализ осуществляется путём изменения степени окисления переходного металла.
Много реакций осуществлено при помощи катализаторов, которые действуют через координацию реагентов у атома или иона переходного металла (Ti, Rh, Ni). Такой катализ называется координационным.
Если катализатор обладает хиральными свойствами, то из оптически неактивного субстрата получается оптически активный продукт.
В современной науке и технике часто применяют системы из нескольких катализаторов, каждый из которых ускоряет разные стадии реакции [2][3]. Катализатор также может увеличивать скорость одной из стадий каталитического цикла, осуществляемого другим катализатором. Здесь имеет место «катализ катализа», или катализ второго уровня (Имянитов).
В биохимических реакциях роль катализаторов играют ферменты.
Катализаторы следует отличать от инициаторов. Например, перекиси распадаются на свободные радикалы, которые могут инициировать радикальные цепные реакции. Инициаторы расходуются в процессе реакции, поэтому их нельзя считать катализаторами.
Инициаторы расходуются в процессе реакции, поэтому их нельзя считать катализаторами.
Ингибиторы иногда ошибочно считают отрицательными катализаторами. Но ингибиторы, например, цепных радикальных реакций, реагируют со свободными радикалами и, в отличие от катализаторов, не сохраняются. Другие ингибиторы (каталитические яды) связываются с катализатором и его дезактивируют, здесь имеет место подавление катализа, а не отрицательный катализ. Отрицательный катализ в принципе невозможен: он обеспечивал бы для реакции более медленный путь, но реакция, естественно, пойдёт по более быстрому, в данном случае, не катализированному, пути.
Катализаторы в автомобилях
Основная статья: Каталитический конвертер
Задачей автомобильного катализатора является снижение количества вредных веществ в выхлопных газах. Среди них:
- окись углерода (СО) — ядовитый газ без цвета и запаха
- углеводороды, также известные как летучие органические соединения — один из главных компонентов смога, образуется за счёт неполного сгорания топлива
- оксиды азота (NO и NO2, которые часто объединяют под обозначением NOx) — также являются компонентом смога, а также кислотных дождей, оказывают влияние на слизистую человека.
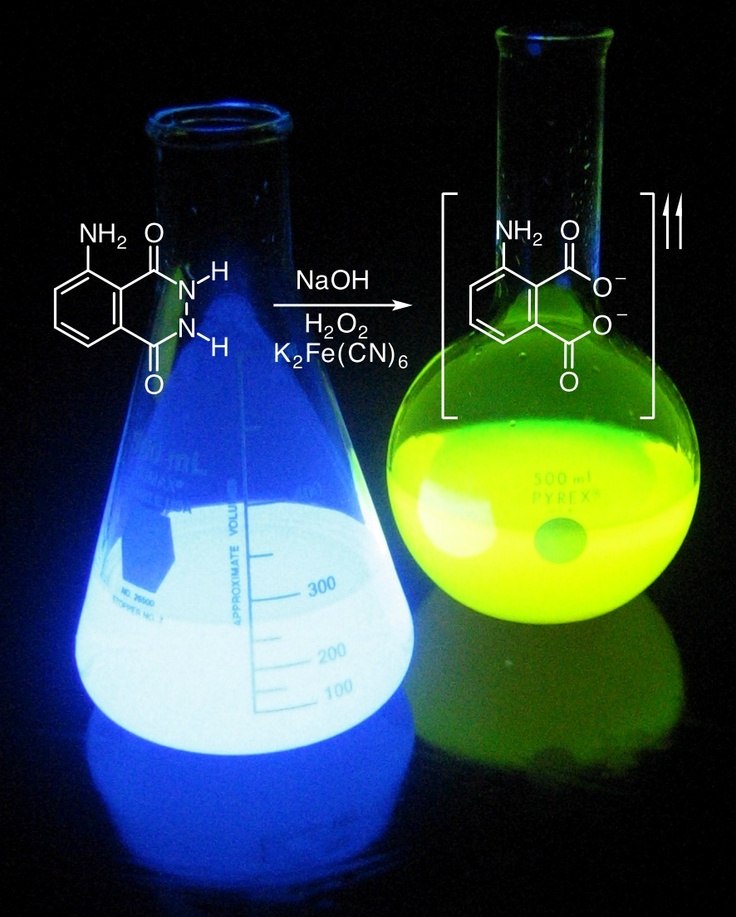 [4]
[4]
Источники
- ↑ 1 2 3 Химическая энциклопедия. — М.: Советская энциклопедия, 1990. — Т. 2. — С. 335, 337. — ISBN 5-85270-035-5.
- ↑ Имянитов Н. С. Системы из нескольких катализаторов в металлокомплексном катализе. // Координационная химия. 1984. — Т. 10. — № 11 — С. 1443—1454. — ISSN 0132-344X.
- ↑ Temkin O.N., Braylovskiy S. M. / The mechanism of catalysis in homogeneous polyfunctional catalytic systems. // Fundamental Research in Homogeneous Catalysis. — Ed. by A.E. Shilov. — New York etc: Gordon and Breach Science Publishers, 1986. — Vol. Two. — P.621- 633.
- ↑ Автомобильный катализатор и его роль в выхлопной системе. AutoRelease.ru. Архивировано из первоисточника 25 августа 2011.
См. также
- Ингибитор
- Ферментативный ингибитор
- Активатор (катализ)
- Энергия активации
- Катализ
Ссылки
Катализатор | это.
 .. Что такое Катализатор?
.. Что такое Катализатор?У этого термина существуют и другие значения, см. Катализатор (значения).
Схема протекания реакции с катализатором
Катализа́тор — химическое вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции[1]. Количество катализатора, в отличие от реагентов, после реакции не изменяется. Важно понимать, что катализатор не участвует в реакции. Они обеспечивают более быстрый путь для реакции, катализатор реагирует с исходным веществом, получившееся промежуточное соединение подвергается превращениям и в конце расщепляется на продукт и катализатор. Затем катализатор снова реагирует с исходным веществом, и этот каталитический цикл многократно повторяется.
Содержание
|
Катализаторы в химии
Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный — образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества [1]. Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный — образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества [1]. Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Реакции одного и того же типа могут протекать как с гомогенными, так и с гетерогенными катализаторами. Так, наряду с растворами кислот применяются имеющие кислотные свойства твёрдые Al2O3, TiO2, ThO2, алюмосиликаты, цеолиты. Гетерогенные катализаторы с основными свойствами: CaO, BaO, MgO [1].
Гетерогенные катализаторы имеют, как правило, сильно развитую поверхность, для чего их распределяют на инертном носителе (силикагель, оксид алюминия, активированный уголь и др.).
Для каждого типа реакций эффективны только определённые катализаторы. Кроме уже упомянутых кислотно-основных, существуют катализаторы окисления-восстановления; для них характерно присутствие переходного металла или его соединения (Со+3, V2O5+MoO3). В этом случае катализ осуществляется путём изменения степени окисления переходного металла.
В этом случае катализ осуществляется путём изменения степени окисления переходного металла.
Много реакций осуществлено при помощи катализаторов, которые действуют через координацию реагентов у атома или иона переходного металла (Ti, Rh, Ni). Такой катализ называется координационным.
Если катализатор обладает хиральными свойствами, то из оптически неактивного субстрата получается оптически активный продукт.
В современной науке и технике часто применяют системы из нескольких катализаторов, каждый из которых ускоряет разные стадии реакции [2][3]. Катализатор также может увеличивать скорость одной из стадий каталитического цикла, осуществляемого другим катализатором. Здесь имеет место «катализ катализа», или катализ второго уровня (Имянитов).
В биохимических реакциях роль катализаторов играют ферменты.
Катализаторы следует отличать от инициаторов. Например, перекиси распадаются на свободные радикалы, которые могут инициировать радикальные цепные реакции. Инициаторы расходуются в процессе реакции, поэтому их нельзя считать катализаторами.
Инициаторы расходуются в процессе реакции, поэтому их нельзя считать катализаторами.
Ингибиторы иногда ошибочно считают отрицательными катализаторами. Но ингибиторы, например, цепных радикальных реакций, реагируют со свободными радикалами и, в отличие от катализаторов, не сохраняются. Другие ингибиторы (каталитические яды) связываются с катализатором и его дезактивируют, здесь имеет место подавление катализа, а не отрицательный катализ. Отрицательный катализ в принципе невозможен: он обеспечивал бы для реакции более медленный путь, но реакция, естественно, пойдёт по более быстрому, в данном случае, не катализированному, пути.
Катализаторы в автомобилях
Основная статья: Каталитический конвертер
Задачей автомобильного катализатора является снижение количества вредных веществ в выхлопных газах. Среди них:
- окись углерода (СО) — ядовитый газ без цвета и запаха
- углеводороды, также известные как летучие органические соединения — один из главных компонентов смога, образуется за счёт неполного сгорания топлива
- оксиды азота (NO и NO2, которые часто объединяют под обозначением NOx) — также являются компонентом смога, а также кислотных дождей, оказывают влияние на слизистую человека.
 [4]
[4]
Источники
- ↑ 1 2 3 Химическая энциклопедия. — М.: Советская энциклопедия, 1990. — Т. 2. — С. 335, 337. — ISBN 5-85270-035-5.
- ↑ Имянитов Н. С. Системы из нескольких катализаторов в металлокомплексном катализе. // Координационная химия. 1984. — Т. 10. — № 11 — С. 1443—1454. — ISSN 0132-344X.
- ↑ Temkin O.N., Braylovskiy S. M. / The mechanism of catalysis in homogeneous polyfunctional catalytic systems. // Fundamental Research in Homogeneous Catalysis. — Ed. by A.E. Shilov. — New York etc: Gordon and Breach Science Publishers, 1986. — Vol. Two. — P.621- 633.
- ↑ Автомобильный катализатор и его роль в выхлопной системе. AutoRelease.ru. Архивировано из первоисточника 25 августа 2011.
См. также
- Ингибитор
- Ферментативный ингибитор
- Активатор (катализ)
- Энергия активации
- Катализ
Ссылки
14.
 7: Катализ — Химия LibreTexts
7: Катализ — Химия LibreTexts- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 25181
Цели обучения
- Понять, как катализаторы увеличивают скорость реакции и селективность химических реакций.
Катализаторы — это вещества, которые увеличивают скорость химической реакции, не расходуясь в процессе. Катализатор, таким образом, не входит в общую стехиометрию реакции, которую он катализирует, но он должен присутствовать хотя бы в одной из элементарных реакций механизма катализируемой реакции. Катализированный путь имеет более низкую E a , но чистое изменение энергии в результате реакции (разница между энергией реагентов и энергией продуктов) не зависит от присутствия катализатора ( Рисунок \(\PageIndex{1}\)). Тем не менее, из-за его более низкой E a , скорость катализируемой реакции выше, чем скорость некаталитической реакции при той же температуре. Поскольку катализатор снижает высоту энергетического барьера, его присутствие увеличивает скорость как прямой, так и обратной реакции на одинаковую величину. В этом разделе мы рассмотрим три основных класса катализаторов: гетерогенные катализаторы, гомогенные катализаторы и ферменты.
Тем не менее, из-за его более низкой E a , скорость катализируемой реакции выше, чем скорость некаталитической реакции при той же температуре. Поскольку катализатор снижает высоту энергетического барьера, его присутствие увеличивает скорость как прямой, так и обратной реакции на одинаковую величину. В этом разделе мы рассмотрим три основных класса катализаторов: гетерогенные катализаторы, гомогенные катализаторы и ферменты.
Катализатор влияет на E a , а не на Δ E .
Гетерогенный катализ
В гетерогенном катализе катализатор находится в другой фазе, чем реагенты. По крайней мере, один из реагентов взаимодействует с твердой поверхностью в физическом процессе, называемом адсорбцией, таким образом, что химическая связь в реагенте становится слабой, а затем разрывается. Яды — это вещества, которые необратимо связываются с катализаторами, препятствуя адсорбции реагентов и, таким образом, снижая или разрушая эффективность катализатора.
Примером гетерогенного катализа является взаимодействие газообразного водорода с поверхностью металла, такого как Ni, Pd или Pt. Как показано в части (а) на рисунке \(\PageIndex{2}\), связи водород-водород разрываются и образуются отдельные адсорбированные атомы водорода на поверхности металла. Поскольку адсорбированные атомы могут перемещаться по поверхности, два атома водорода могут столкнуться и образовать молекулу газообразного водорода, которая затем может покинуть поверхность в обратном процессе, называемом десорбцией. Адсорбированные атомы H на поверхности металла значительно более реакционноспособны, чем молекула водорода. Поскольку относительно прочная связь H–H (энергия диссоциации = 432 кДж/моль) уже разорвана, энергетический барьер для большинства реакций H
Адсорбированные атомы H на поверхности металла значительно более реакционноспособны, чем молекула водорода. Поскольку относительно прочная связь H–H (энергия диссоциации = 432 кДж/моль) уже разорвана, энергетический барьер для большинства реакций H
На рисунке \(\PageIndex{2}\) показан процесс, называемый гидрированием , в котором атомы водорода добавляются к двойной связи алкена, такого как этилен, с получением продукта, содержащего одинарные связи C–C, в в данном случае этан.
Несколько важных примеров промышленных гетерогенных каталитических реакций приведены в таблице \(\PageIndex{1}\). Хотя механизмы этих реакций значительно сложнее, чем описанная здесь простая реакция гидрирования, все они включают адсорбцию реагентов на твердой каталитической поверхности, химическую реакцию адсорбированных частиц (иногда через ряд промежуточных частиц) и, наконец, десорбцию. продуктов с поверхности.
| Коммерческий процесс | Катализатор | Начальная реакция | Конечный коммерческий продукт |
|---|---|---|---|
| контактный процесс | В 2 О 5 или Pt | 2SO 2 + O 2 → 2SO 3 | H 2 SO 4 |
| Процесс Габера | Fe, K 2 O, Al 2 O 3 | N 2 + 3H 2 → 2NH 3 | НХ 3 |
| Процесс Оствальда | Pt и Rh | 4NH 3 + 5O 2 → 4NO + 6H 2 O | HNO 3 |
| реакция конверсии вода–газ | Fe, Cr 2 O 3 или Cu | CO + H 2 O → CO 2 + H 2 | H 2 для NH 3 , CH 3 OH и другие виды топлива |
| паровой риформинг | Ni | CH 4 + H 2 O → CO + 3H 2 | Ч 2 |
| синтез метанола | ZnO и Cr 2 O 3 | CO + 2H 2 → CH 3 OH | CH 3 ОН |
| Процесс Сохио | фосфомолибдат висмута | \(\ mathrm{CH}_2\textrm{=CHCH}_3+\mathrm{NH_3}+\mathrm{\frac{3}{2}O_2}\стрелка вправо\mathrm{CH_2}\textrm{=CHCN}+\ матрм{3H_2O}\) | \(\ underset{\textrm{акрилонитрил}}{\mathrm{CH_2}\textrm{=CHCN}}\) |
| каталитическое гидрирование | Ni, Pd или Pt | RCH=CHR’ + h3 → RCH 2 -CH 2 R’ | частично гидрогенизированные масла для маргарина и т. д. д. |
Гомогенный катализ
В гомогенном катализе катализатор находится в той же фазе, что и реагент(ы). Количество столкновений между реагентами и катализатором максимально, потому что катализатор равномерно распределен по всей реакционной смеси. Многие гомогенные катализаторы в промышленности представляют собой соединения переходных металлов (таблица \(\PageIndex{2}\)), но извлечение этих дорогостоящих катализаторов из раствора представляет собой серьезную проблему. В качестве дополнительного препятствия для их широкого коммерческого использования многие гомогенные катализаторы можно использовать только при относительно низких температурах, и даже в этом случае они имеют тенденцию к медленному разложению в растворе. Несмотря на эти проблемы, в последние годы был разработан ряд коммерчески жизнеспособных процессов. Полиэтилен высокой плотности и полипропилен получают методом гомогенного катализа.
| Коммерческий процесс | Катализатор | Реагенты | Конечный продукт |
|---|---|---|---|
| Юнион Карбайд | [Rh(CO) 2 I 2 ] − | СО + СН 3 ОХ | CH 3 CO 2 H |
| гидропероксидный процесс | Комплексы Mo(VI) | CH 3 CH=CH 2 + R–O–O–H | |
| гидроформилирование | Rh/PR 3 комплексы | RCH=CH 2 + CO + H 2 | РЧ 2 CH 2 CH |
| адипонитриловый процесс | Ni/PR 3 комплексы | 2HCN + CH 2 =CHCH=CH 2 | NCCH 2 CH 2 CH 2 CH 2 CN используется для синтеза нейлона |
| полимеризация олефинов | (RC 5 H 5 ) 2 ZrCl 2 | CH 2 =CH 2 | –(CH 2 CH 2 –) n : полиэтилен высокой плотности |
Ферменты
Ферменты, катализаторы, встречающиеся в естественных условиях в живых организмах, представляют собой почти все белковые молекулы с типичной молекулярной массой 20 000–100 000 а. е.м. Некоторые из них представляют собой гомогенные катализаторы, которые реагируют в водном растворе внутри клеточного компартмента организма. Другие представляют собой гетерогенные катализаторы, встроенные в мембраны, которые отделяют клетки и клеточные компартменты от их окружения. Реагент в реакции, катализируемой ферментом, называется подложка .
е.м. Некоторые из них представляют собой гомогенные катализаторы, которые реагируют в водном растворе внутри клеточного компартмента организма. Другие представляют собой гетерогенные катализаторы, встроенные в мембраны, которые отделяют клетки и клеточные компартменты от их окружения. Реагент в реакции, катализируемой ферментом, называется подложка .
Поскольку ферменты могут многократно увеличивать скорость реакции (до 10 17 раз по сравнению с некатализируемой скоростью) и имеют тенденцию быть очень специфичными, обычно производя только один продукт с количественным выходом, они находятся в центре активных исследований. В то же время получение ферментов обычно дорого, они часто перестают функционировать при температурах выше 37 °С, имеют ограниченную стабильность в растворе и настолько высокую специфичность, что ограничиваются превращением одного конкретного набора реагентов в один конкретный продукт. . Это означает, что для химически сходных реакций должны быть разработаны отдельные процессы с использованием разных ферментов, что требует много времени и средств. До настоящего времени ферменты нашли лишь ограниченное промышленное применение, хотя они используются в качестве ингредиентов в моющих средствах для стирки, чистящих средствах для контактных линз и размягчителях мяса. Ферменты в этих приложениях, как правило, представляют собой протеазы, которые способны расщеплять амидные связи, удерживающие вместе аминокислоты в белках. Размягчители мяса, например, содержат протеазу, называемую папаином, которую выделяют из сока папайи. Он расщепляет некоторые из длинных волокнистых белковых молекул, которые делают недорогие куски говядины жесткими, в результате чего получается более нежный кусок мяса. Некоторые насекомые, такие как жук-бомбардировщик, содержат фермент, способный катализировать разложение перекиси водорода до воды (рис. \(\PageIndex{3}\)).
До настоящего времени ферменты нашли лишь ограниченное промышленное применение, хотя они используются в качестве ингредиентов в моющих средствах для стирки, чистящих средствах для контактных линз и размягчителях мяса. Ферменты в этих приложениях, как правило, представляют собой протеазы, которые способны расщеплять амидные связи, удерживающие вместе аминокислоты в белках. Размягчители мяса, например, содержат протеазу, называемую папаином, которую выделяют из сока папайи. Он расщепляет некоторые из длинных волокнистых белковых молекул, которые делают недорогие куски говядины жесткими, в результате чего получается более нежный кусок мяса. Некоторые насекомые, такие как жук-бомбардировщик, содержат фермент, способный катализировать разложение перекиси водорода до воды (рис. \(\PageIndex{3}\)).
Ингибиторы ферментов вызывают снижение скорости реакции, катализируемой ферментом, путем связывания с определенной частью фермента и, таким образом, замедления или предотвращения реакции. Таким образом, необратимые ингибиторы являются эквивалентом ядов в гетерогенном катализе. Одним из старейших и наиболее широко используемых коммерческих ингибиторов ферментов является аспирин, который избирательно ингибирует один из ферментов, участвующих в синтезе молекул, вызывающих воспаление. Дизайн и синтез родственных молекул, которые являются более эффективными, селективными и менее токсичными, чем аспирин, являются важными задачами биомедицинских исследований.
Таким образом, необратимые ингибиторы являются эквивалентом ядов в гетерогенном катализе. Одним из старейших и наиболее широко используемых коммерческих ингибиторов ферментов является аспирин, который избирательно ингибирует один из ферментов, участвующих в синтезе молекул, вызывающих воспаление. Дизайн и синтез родственных молекул, которые являются более эффективными, селективными и менее токсичными, чем аспирин, являются важными задачами биомедицинских исследований.
Резюме
Катализаторы участвуют в химической реакции и увеличивают ее скорость. Они не входят в итоговое уравнение реакции и не расходуются в ходе реакции. Катализаторы позволяют реакции протекать по пути, который имеет более низкую энергию активации, чем некатализируемая реакция. В гетерогенном катализе катализаторы обеспечивают поверхность, с которой реагенты связываются в процессе адсорбции. В гомогенном катализе катализаторы находятся в одной фазе с реагентами. Ферменты — это биологические катализаторы, которые вызывают значительное увеличение скорости реакции и, как правило, специфичны для определенных реагентов и продуктов. Реагент в реакции, катализируемой ферментом, называется субстратом. Ингибиторы ферментов вызывают снижение скорости реакции, катализируемой ферментом.
Реагент в реакции, катализируемой ферментом, называется субстратом. Ингибиторы ферментов вызывают снижение скорости реакции, катализируемой ферментом.
14.7: Catalysis распространяется под лицензией CC BY-NC-SA 3.0, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 3,0
- Показать страницу TOC
- № на стр.
- Теги
- фермент
- гетерогенный катализ
- Гомогенный катализ
- подложка
Определение катализатора.
 Химический словарь
Химический словарьЧто такое катализатор?
Катализатор – это вещество, ускоряющее химическую реакцию, но не расходующееся в ходе реакции; следовательно, катализатор может быть восстановлен химически неизмененным в конце реакции, которую он использовал для ускорения, или катализировать .
Обсуждение
Чтобы химические вещества вступили в реакцию, их связи должны быть перестроены, потому что связи в продуктах отличаются от связей в реагентах. Самый медленный этап перестройки связи приводит к тому, что называется переходным состоянием. — химическое вещество, которое не является ни реагентом, ни продуктом, но является промежуточным звеном между ними.
Реагент ⇄ Переходное состояние ⇄ Продукт
Энергия необходима для формирования переходного состояния. Эта энергия называется энергией активации или E a .
Чтение приведенной ниже диаграммы слева направо показывает ход реакции, когда реагенты проходят через переходное состояние и становятся продуктами.
Преодоление барьера
Энергию активации можно рассматривать как барьер для химической реакции, барьер, который необходимо преодолеть. Если барьер высокий, лишь немногие молекулы обладают достаточной кинетической энергией, чтобы столкнуться, сформировать переходное состояние и пересечь барьер. Реагенты с энергией ниже Е и не могут пройти через переходное состояние, чтобы вступить в реакцию и стать продуктами.
Катализатор работает, обеспечивая другой путь, с более низким E a , для реакции. Катализаторы снижают энергетический барьер. Другой путь позволяет легче перегруппировывать связи, необходимые для превращения реагентов в продукты, с меньшими затратами энергии. В любой заданный интервал времени присутствие катализатора позволяет большей части реагентов набирать достаточную энергию, чтобы пройти через переходное состояние и стать продуктами.
Пример 1: процесс Габера
Процесс Габера, который используется для получения аммиака из водорода и азота, катализируется железом, которое обеспечивает атомные позиции, на которых реагентные связи могут легче перестраиваться с образованием переходного состояния.
N 2 (газ) + 3H 2 (газ) ⇌ 2NH 3 (газ)
Пример 2: Ферменты
В нашем организме и других живых существах ферменты используются для ускорения биохимические реакции. Фермент — это тип катализатора.
Сложная жизнь была бы невозможна без ферментов, обеспечивающих протекание реакций с подходящей скоростью.
Формы ферментов вместе с местами на ферменте, которые связываются с реагентами, обеспечивают альтернативный путь реакции, позволяя определенным молекулам собираться вместе, чтобы сформировать переходное состояние с уменьшенным энергетическим барьером активации.
На приведенной ниже схеме фермент с длинной цепью обеспечивает места для соединения молекул реагентов с образованием переходного состояния с низкой энергией активации.
Катализаторы не могут сдвинуть положение химического равновесия — и прямая, и обратная реакции ускоряются, так что константа равновесия K eq остается неизменной.

