Виды катализаторов — Demi Motors
Существует следующие виды катализаторов: керамический, металлический, сажевый и промышленный. Есть два типа катализаторов для бензиновых двигателей — из керамики и металла. Современные катализаторы соответствуют европейским стандартам для чистоты оксидов и нейтрализации азота, оксида углерода и углеводородов. Для дизельных двигателей установлен кусок под названием сажевый фильтр.
Выхлопная система транспортного средства должна содержать следующую обязательную часть в качестве катализатора, который играет важную роль — перерабатывает токсичные выбросы из экологически чистого материала. Благодаря своей структуре, с точки зрения внешнего вида, как соты, и тонким слоем драгоценных металлов, это устройство преобразует топливный газ, такой, который является безопасным для человека и окружающей среды.
Места установки устройств также различаются. Некоторые катализаторы автомобили размещаются непосредственно перед или в выхлопной трубе, которая является полезной, если он выходит из строя — это проще заменить новой. Нейтрализатор может быть размещен в выпускном коллекторе, и в этом случае оно должно стать более требуемой рабочей температурой. Устройство имеет следующую структуру: металлический корпус с трубками с обеих сторон.
Нейтрализатор может быть размещен в выпускном коллекторе, и в этом случае оно должно стать более требуемой рабочей температурой. Устройство имеет следующую структуру: металлический корпус с трубками с обеих сторон.
В случае, если один помещен — три монолитных блоков, с большим количеством ветвей в форме, которые напоминают соты. Эта структура обеспечивает максимальную рабочую площадь поверхности, на которой газа реагирует непосредственно с каталитическим слоем. Между блоками и металлическим корпусом является изолированным корпус, который обеспечивает защиту от механических повреждений.
Керамические катализаторы
Внутренний блок внутри металлического корпуса такого типа выполнен из керамики. Соты правильной формы — через. В новом катализаторе видно при просмотре их в свете. В течение долгого времени, клетка может быть засорены несгоревшие частицы, остающиеся на некачественного топлива. Керамическая клетка довольно хрупок, боится сильных ударов, воды. Таким образом, водители, которые хотели бы выбрать nevidremontovani дорогу должны быть осторожными. Преимущество керамических устройств является то, что они гораздо дешевле и, следовательно, общие. Почти все бензиновые автомобили такие. Жизни этого типа катализатора составляет около 120 000 километров.
Преимущество керамических устройств является то, что они гораздо дешевле и, следовательно, общие. Почти все бензиновые автомобили такие. Жизни этого типа катализатора составляет около 120 000 километров.
Металлические катализаторы
Сложные технологии производства, высокая стоимость, однако малое потребление топлива и долгосрочное использование металлических катализаторов отличаются. Этот тип преобразователя может выдерживать значительные механические нагрузки и температурные колебания. Он может быть использован в транспортных средствах с высокой мощностью, поскольку стенки обеспечивают низкое аэродинамическое сопротивление.
Надежный, прочный, водонепроницаемый они гораздо дороже, чем керамика. Конструктивные выглядит как спиральной структуры, клетки, которые имеют неправильную форму. Опустить его топливную плохую работу консервной при очень высоких температурах и использовании до конца жизни, но не боятся ударов — он достаточно силен, чтобы противостоять им.
Сажевый фильтр Diesel
Поскольку принцип дизельного двигателя отличается от бензина, а затем очищает выхлопные газы немного другое устройство, чем катализатор — набор фильтров частиц здесь. Он не нейтрализует токсические выбросы, но ловит частицы сажи и предотвращает его выброс в атмосферу. Его структура — квадратные блоки ячеек, открытых и закрытых, перемежаются в шахматном порядке. Внутри имеет поры, что частицы сажи захвата, она сильно влияет на его работу, если это будет много — мощность падает, поэтому важно, чтобы очистить или сделать регенерацию. Это дешевле, чем металлического катализатора, и легко разрушается механическим воздействиям, а также керамики. Некоторые автомобили совместим катализатор и фильтр в одном устройстве.
Он не нейтрализует токсические выбросы, но ловит частицы сажи и предотвращает его выброс в атмосферу. Его структура — квадратные блоки ячеек, открытых и закрытых, перемежаются в шахматном порядке. Внутри имеет поры, что частицы сажи захвата, она сильно влияет на его работу, если это будет много — мощность падает, поэтому важно, чтобы очистить или сделать регенерацию. Это дешевле, чем металлического катализатора, и легко разрушается механическим воздействиям, а также керамики. Некоторые автомобили совместим катализатор и фильтр в одном устройстве.
Каждое устройство выполняет свою функцию для транспортного средства и окружающей среды. Если вам нужно купить катализатор в Demi Motors, то лучших цен вам не найти. Мы здесь, чтобы помочь! Свяжитесь с нами — мы предлагаем подробные консультации от экспертов и широкий спектр устройств!
Виды катализаторов
Во-первых нейтрализаторы различаются по типу носителя, на который непосредственно наносится каталитический слой. Это может быть керамический блок, в виде сот, или блок, выполненый из металлической ленты. Керамические катализаторы более распространены, чем металлические, и менее дорогие. Основной недостаток керамического катализатора — его хрупкость. Достаточно даже несильного удара об камень на дороге, что бы рассыпавшиеся соты своим дребезгом подсказали автовладельцу, что его ждут очередные финансовые затраты на ремонт своего автомобиля. То же самое может произойти, если на полностью прогретом автомобиле заехать в лужу и вода попадёт на раскалённый катализатор. Ещё одной причиной разрушения керамики могут быть неполадки в системе зажигания. Когда при попытке пуска двигателя сразу не происходит воспламенение топлива в камере сгорания, то несгоревший бензин скапливается в ближайшей ёмкости выпускного тракта, а это почти всегда и есть катализатор, и когда, наконец, мотор заводится, то этот скопившийся бензин взрывается, а соты, естественно, рассыпаются. Металлический блок более надёжен и может длительное время выдерживать различные механические нагрузки. Но и керамический и металлический катализаторы одинаково боятся следующих вещей: некачественный или этилированый бензин, попадающие в камеру сгорания масло или антифриз, «левые» технические жидкости, используемые в целях промывки топливной системы, переобогащённая топливная смесь, долгая работа двигателя на холостом ходу.
Керамические катализаторы более распространены, чем металлические, и менее дорогие. Основной недостаток керамического катализатора — его хрупкость. Достаточно даже несильного удара об камень на дороге, что бы рассыпавшиеся соты своим дребезгом подсказали автовладельцу, что его ждут очередные финансовые затраты на ремонт своего автомобиля. То же самое может произойти, если на полностью прогретом автомобиле заехать в лужу и вода попадёт на раскалённый катализатор. Ещё одной причиной разрушения керамики могут быть неполадки в системе зажигания. Когда при попытке пуска двигателя сразу не происходит воспламенение топлива в камере сгорания, то несгоревший бензин скапливается в ближайшей ёмкости выпускного тракта, а это почти всегда и есть катализатор, и когда, наконец, мотор заводится, то этот скопившийся бензин взрывается, а соты, естественно, рассыпаются. Металлический блок более надёжен и может длительное время выдерживать различные механические нагрузки. Но и керамический и металлический катализаторы одинаково боятся следующих вещей: некачественный или этилированый бензин, попадающие в камеру сгорания масло или антифриз, «левые» технические жидкости, используемые в целях промывки топливной системы, переобогащённая топливная смесь, долгая работа двигателя на холостом ходу. В результате воздействия вышеназваных факторов , помимо потери способности катализатора дожигать вредные примеси, происходит засорение каналов, что приводит к уменьшению их общего проходного сечения, потере мощности и к перегреву самого нейтрализатора, корпус которого может раскаляться даже до красного цвета. Известны случаи, когда от раскалённого катализатора расплавлялась аллюминевая теплозащита и загоралось антикоррозийное покрытие днища. Внутреняя температура неисправного катализатора настолько велика, что керамика может сплавляться и полностью забивать собой проход для выхлопных газов. Ремонт двигателя после этого почти обеспечен. Ещё один неприятный момент — это керамическая пыль. Керамический блок стареющего катализатора, невзирая на его внешнюю целостность и сохранность своих основных свойств, понемногу разрушается, и появляющаяся при этом керамическая пыль попадает в камеру сгорания, а иногда, при разборе двигателя для ремонта, в цилиндрах находят и небольшие кусочки керамики.
В результате воздействия вышеназваных факторов , помимо потери способности катализатора дожигать вредные примеси, происходит засорение каналов, что приводит к уменьшению их общего проходного сечения, потере мощности и к перегреву самого нейтрализатора, корпус которого может раскаляться даже до красного цвета. Известны случаи, когда от раскалённого катализатора расплавлялась аллюминевая теплозащита и загоралось антикоррозийное покрытие днища. Внутреняя температура неисправного катализатора настолько велика, что керамика может сплавляться и полностью забивать собой проход для выхлопных газов. Ремонт двигателя после этого почти обеспечен. Ещё один неприятный момент — это керамическая пыль. Керамический блок стареющего катализатора, невзирая на его внешнюю целостность и сохранность своих основных свойств, понемногу разрушается, и появляющаяся при этом керамическая пыль попадает в камеру сгорания, а иногда, при разборе двигателя для ремонта, в цилиндрах находят и небольшие кусочки керамики. Нахождение в камере сгорания керамической пыли приводит к преждевременному износу стенок цилиндров и, соответственно, к более раннему ремонту двигателя. Такие вот неприятности могут быть от детали, которая вроде бы отрицательно себя никак не проявляет. Не зря в Европе катализаторы меняют через 100000 км. пробега, невзирая на то, рабочий он или нет.
Нахождение в камере сгорания керамической пыли приводит к преждевременному износу стенок цилиндров и, соответственно, к более раннему ремонту двигателя. Такие вот неприятности могут быть от детали, которая вроде бы отрицательно себя никак не проявляет. Не зря в Европе катализаторы меняют через 100000 км. пробега, невзирая на то, рабочий он или нет.
Места расположения катализаторов — второй отличительный признак, важный для автовладельца. У большинства автомобилей каталитический конвертер расположен или сразу за приёмной трубой глушителя или совместно с ней, составляя одну деталь. Другой вариант расположения нейтрализатора это когда он находится непосредственно в выпускном коллекторе или же сразу за ним, перед приёмной трубой. На автомобилях конца 90х годов и начала 21 века, катализатор, как правило, находится в коллекторе — такая конструкция облегчает выполнение экологических норм ЕВРО 4. Близкое расположение катализатора к камере сгорания обеспечивает более быстрый его прогрев до рабочей температуры и лучше сохраняет от внешних воздействий и резких перепадов температуры, но сам коллектор очень часто от этого страдает. Треснутый коллектор — одно из последствий перегрева катализатора, а стоимость коллектора с катализатором обычно намного выше, чем стоимость простого. Поэтому владельцы автомобилей с таким расположением катализатора вынуждены, в случае его выхода из строя, платить больше и за деталь и за работу по её установке.
Треснутый коллектор — одно из последствий перегрева катализатора, а стоимость коллектора с катализатором обычно намного выше, чем стоимость простого. Поэтому владельцы автомобилей с таким расположением катализатора вынуждены, в случае его выхода из строя, платить больше и за деталь и за работу по её установке.
Обзор различных типов катализаторов.
Введение. удобрения), фармацевтика, нефть (в нефтепереработке, производстве биотоплива, топливных элементах и т. д.), полимеры (пластики, клеи), электроника и очистка окружающей среды (ограничение выбросов вредных газов от автомобилей и стационарных источников, удаление CO и запахи из воздуха помещений, и очистка грунтовых вод). Согласно недавно опубликованному отчету, озаглавленному «Рынок катализаторов — размер мировой отрасли, доля, рост, тенденции и прогноз на 2012–2018 годы», мировая рыночная стоимость катализатора составила 190,2 миллиарда долларов США в год в 2014 году и, как ожидается, достигнет 24,1 миллиарда долларов США к 2018 году. Использование технологии катализаторов хорошо известно с древних времен, хотя концепция катализа в то время не была ясной. Это включает образование спирта из сахара путем брожения, синтез мыла путем гидролиза животного жира с использованием едкого кали, превращение спирта в эфир, катализируемое серной кислотой. В 1836 году шведский химик Берзиллиус ввел термин «катализ», а Оствальд в 1895 году научно объяснил его так: «катализатор ускоряет химическую реакцию, не влияя на положение равновесия». В 1909, Оствальд был удостоен благородной премии за свою новаторскую работу в этой области.
Использование технологии катализаторов хорошо известно с древних времен, хотя концепция катализа в то время не была ясной. Это включает образование спирта из сахара путем брожения, синтез мыла путем гидролиза животного жира с использованием едкого кали, превращение спирта в эфир, катализируемое серной кислотой. В 1836 году шведский химик Берзиллиус ввел термин «катализ», а Оствальд в 1895 году научно объяснил его так: «катализатор ускоряет химическую реакцию, не влияя на положение равновесия». В 1909, Оствальд был удостоен благородной премии за свою новаторскую работу в этой области.
Типы катализаторов
Катализаторы в основном делятся на четыре типа. Это (1) гомогенные, (2) гетерогенные (твердые), (3) гетерогенизированные гомогенные катализаторы и (4) биокатализаторы.
1) Гомогенный катализатор: При гомогенном катализе реакционная смесь и катализатор находятся в одной фазе. Как катализатор, так и реагенты проявляют высокую гомогенность, что приводит к сильному взаимодействию между ними, что приводит к высокой реакционной способности и селективности реакции в мягких условиях реакции. Некоторыми примерами гомогенных катализаторов являются кислоты Бренстеда и Льюиса, переходные металлы, металлоорганические комплексы, органокатализаторы. Некоторые известные химические процессы, происходящие посредством гомогенного катализа, включают карбонилирование, окисление, гидроцианирование, метатезис и гидрирование.
Некоторыми примерами гомогенных катализаторов являются кислоты Бренстеда и Льюиса, переходные металлы, металлоорганические комплексы, органокатализаторы. Некоторые известные химические процессы, происходящие посредством гомогенного катализа, включают карбонилирование, окисление, гидроцианирование, метатезис и гидрирование.
2) Гетерогенный катализатор: При гетерогенном катализе катализаторы находятся в другой фазе, чем реакционная смесь. Некоторыми типичными процессами, в которых используются гетерогенные катализаторы, являются процесс Габера-Боша для синтеза аммиака, процесс Фишера-Тропша для получения различных углеводородов. Гетерогенные катализаторы преобладают в основных промышленных процессах из-за легкого разделения продукта и извлечения катализатора. Гетерогенные катализаторы могут быть использованы в виде мелкодисперсных частиц, порошков, гранул. Эти катализаторы могут быть нанесены на твердый носитель (катализаторы на носителе) или использованы в массе (катализаторы без носителя).
Катализатор на носителе играет ключевую роль в промышленной революции. Поскольку гетерогенный катализ является поверхностным явлением, эффективность катализаторов зависит от открытой площади поверхности. Площадь открытой поверхности увеличивается с уменьшением размера частиц, но более мелкие частицы имеют тенденцию к агрегации, что приводит к дезактивации катализатора. Прикрепление каталитического активного центра к твердой подложке предотвращает агломерацию каталитических частиц и, следовательно, улучшает каталитическую эффективность. Для промышленного применения твердые подложки считаются обладающими высокой химической, механической и термической стабильностью. Кроме того, он должен быть инертным и иметь высокое отношение поверхности к объему. Обычно используемыми органическими твердыми носителями могут быть полимеры (например, полистирол), сополимеры (например, стирол-дивинилбензол) и неорганические носители, такие как диоксид кремния, цеолиты, оксид алюминия, активированный уголь, диоксид титана, графен.
Катализаторы без носителя занимают большую часть промышленного катализа. Сюда входят металлы, сплавы металлов, оксиды металлов, сульфиды металлов, цеолиты и т.д.
3) Гетерогенизированные гомогенные катализаторы : Гетерогенные катализаторы, в отличие от их гомогенных аналогов, гораздо труднее разработать на практике. Одной из причин является их сложность, которая препятствует их анализу на молекулярном уровне и развитию через отношения структура-реактивность. Кроме того, традиционные гетерогенные катализаторы (оксиды металлов или металлы на носителе) обладают меньшей селективностью и реакционной способностью. Чтобы преодолеть эти проблемы, гомогенный катализатор прививают на твердые носители для получения их гетерогенных аналогов. В настоящее время гомогенные катализаторы на твердом носителе широко известны и успешно используются в академических и промышленных исследованиях. Цель этого подхода состоит в том, чтобы совместить положительные черты как гомогенного (селективность и реакционная способность), так и гетерогенного катализатора (воспроизводимость), и это может быть достигнуто за счет иммобилизации катализаторов, таких как металлокомплексы, металлоорганические соединения, на твердой поверхности либо путем физической сорбции, либо хемосорбция. Установлено, что ковалентная прививка каталитически активных частиц на твердые поверхности является наиболее предпочтительным подходом для создания гетерогенного гомогенного катализатора.
Установлено, что ковалентная прививка каталитически активных частиц на твердые поверхности является наиболее предпочтительным подходом для создания гетерогенного гомогенного катализатора.
4) Биокатализаторы: Природные белки (ферменты) или нуклеиновые кислоты (РНК или рибозимы и ДНК), используемые для катализа специфических химических реакций вне живых клеток, называются биокатализом. Ферменты получают из тканей животных, растений и микробов (дрожжей, бактерий или грибков). Высокая селективность, высокая эффективность, экологичность и мягкие условия реакции являются движущей силой их широкомасштабного использования и превращения биокатализаторов в альтернативу обычным промышленным катализаторам. Значительный прогресс в области белковой инженерии и молекулярной эволюции произвел революцию в мире биокатализа для промышленного синтеза тонких химикатов, активных ингредиентов (АФИ), биотоплива (например, липазы для производства биодизельного топлива из растительного масла), молочной промышленности (например, протеазы). , липаза для удаления лактозы, ренин для приготовления сыра), хлебопекарная промышленность (например, амилаза для мягкости и объема хлеба, глюкозооксидаза для укрепления теста), производство моющих средств (например, протеиназа, липаза, амилаза, используемые для удаления пятен белков, жиров, крахмала, соответственно) кожевенная промышленность (например, протеаза для расчесывания и намотки), бумажная промышленность, текстильная промышленность (например, амилаза для удаления крахмала из тканых материалов). Иммобилизация ферментов на твердых носителях превращает ферменты в гетерогенный твердый катализатор, что повышает активность, стабильность и увеличивает срок службы катализатора, который можно повторно использовать во многих циклах.
, липаза для удаления лактозы, ренин для приготовления сыра), хлебопекарная промышленность (например, амилаза для мягкости и объема хлеба, глюкозооксидаза для укрепления теста), производство моющих средств (например, протеиназа, липаза, амилаза, используемые для удаления пятен белков, жиров, крахмала, соответственно) кожевенная промышленность (например, протеаза для расчесывания и намотки), бумажная промышленность, текстильная промышленность (например, амилаза для удаления крахмала из тканых материалов). Иммобилизация ферментов на твердых носителях превращает ферменты в гетерогенный твердый катализатор, что повышает активность, стабильность и увеличивает срок службы катализатора, который можно повторно использовать во многих циклах.
Таблица 1: Сравнение различных типов катализаторов
Перспективы катализа
В последние годы в области катализа произошли значительные изменения и достижения. С постоянно растущим спросом на невозобновляемые природные ресурсы, чистый воздух, химикаты и фармацевтические препараты катализаторы останутся в авангарде химических исследований и разработок. Катализаторы позволили нам синтезировать сложные молекулы за меньшее количество стадий, а также успешно используются на нефтеперерабатывающих заводах для производства топлива с низким содержанием серы. Катализаторы также сыграли важную роль в снижении выбросов CO, NOx, несгоревших углеводородов от транспортных средств, работающих на бензине, дизельном топливе и реактивном топливе. Тем не менее, существует много проблем, связанных с широко используемыми каталитическими системами, включая стоимость, доступность, токсичность многих драгоценных металлов, используемых в качестве катализаторов, и необходимость дорогих и сложных лигандов для достижения желаемых превращений. Ученые и химики сосредоточены на разработке катализаторов с высокой селективностью, реакционной способностью, стабильностью, низкой загрузкой катализатора и высоким числом оборотов. Последние разработки в области нанотехнологий открывают новые возможности для разработки и синтеза наноструктурированных катализаторов с большой площадью поверхности и открытыми активными центрами, что в конечном итоге приводит к высокой каталитической активности.
Катализаторы позволили нам синтезировать сложные молекулы за меньшее количество стадий, а также успешно используются на нефтеперерабатывающих заводах для производства топлива с низким содержанием серы. Катализаторы также сыграли важную роль в снижении выбросов CO, NOx, несгоревших углеводородов от транспортных средств, работающих на бензине, дизельном топливе и реактивном топливе. Тем не менее, существует много проблем, связанных с широко используемыми каталитическими системами, включая стоимость, доступность, токсичность многих драгоценных металлов, используемых в качестве катализаторов, и необходимость дорогих и сложных лигандов для достижения желаемых превращений. Ученые и химики сосредоточены на разработке катализаторов с высокой селективностью, реакционной способностью, стабильностью, низкой загрузкой катализатора и высоким числом оборотов. Последние разработки в области нанотехнологий открывают новые возможности для разработки и синтеза наноструктурированных катализаторов с большой площадью поверхности и открытыми активными центрами, что в конечном итоге приводит к высокой каталитической активности. Концепция объединения органокатализаторов и катализаторов на основе переходных металлов недавно привлекла внимание в связи с ее использованием в органическом синтезе, где металлическая часть обеспечивает высокую активность, а органокатализаторная часть обеспечивает высокую селективность. Хотя с использованием металлоорганического катализа были успешно осуществлены различные органические превращения, которые были недостижимы с использованием только одного типа катализатора. Многое еще остается нераскрытым, начиная от тонкого проектирования и сочетания основных строительных единиц и заканчивая демонстрацией их применения в различных областях катализа.
Концепция объединения органокатализаторов и катализаторов на основе переходных металлов недавно привлекла внимание в связи с ее использованием в органическом синтезе, где металлическая часть обеспечивает высокую активность, а органокатализаторная часть обеспечивает высокую селективность. Хотя с использованием металлоорганического катализа были успешно осуществлены различные органические превращения, которые были недостижимы с использованием только одного типа катализатора. Многое еще остается нераскрытым, начиная от тонкого проектирования и сочетания основных строительных единиц и заканчивая демонстрацией их применения в различных областях катализа.
Различные типы катализаторов | Наука
Обновлено 1 декабря 2018 г.
Кевин Бек
В химии катализатор — это вещество, которое ускоряет скорость реакции, не расходуясь при этом само. Любая реакция, в которой используется катализатор, называется катализом . Будьте осторожны с этим различием при чтении материала по химии; катализатор (множественное число «катализаторы») — это физическое вещество, а катализ (множественное число «катализаторы») — это процесс.
Обзор каждого из классов катализаторов является полезной отправной точкой для изучения аналитической химии и понимания того, что происходит на молекулярном уровне, когда вы смешиваете вещества вместе и происходит реакция. Катализаторы и связанные с ними каталитические реакции бывают трех основных типов: гомогенные катализаторы, гетерогенные катализаторы и биокатализаторы (обычно называемые ферментами). Менее распространенные, но все же важные виды каталитической активности включают фотокатализ, экологический катализ и зеленые каталитические процессы.
Общие характеристики катализаторов
Большинство твердых катализаторов представляют собой металлы (например, платина или никель) или полуметаллы (например, кремний, бор и алюминий), присоединенные к таким элементам, как кислород и сера. Катализаторы, которые находятся в жидкой или газовой фазе, скорее всего, состоят из одного элемента, хотя они могут быть объединены с растворителями и другими материалами, а твердые катализаторы могут быть рассеяны в твердой или жидкой матрице, известной как носитель катализатора.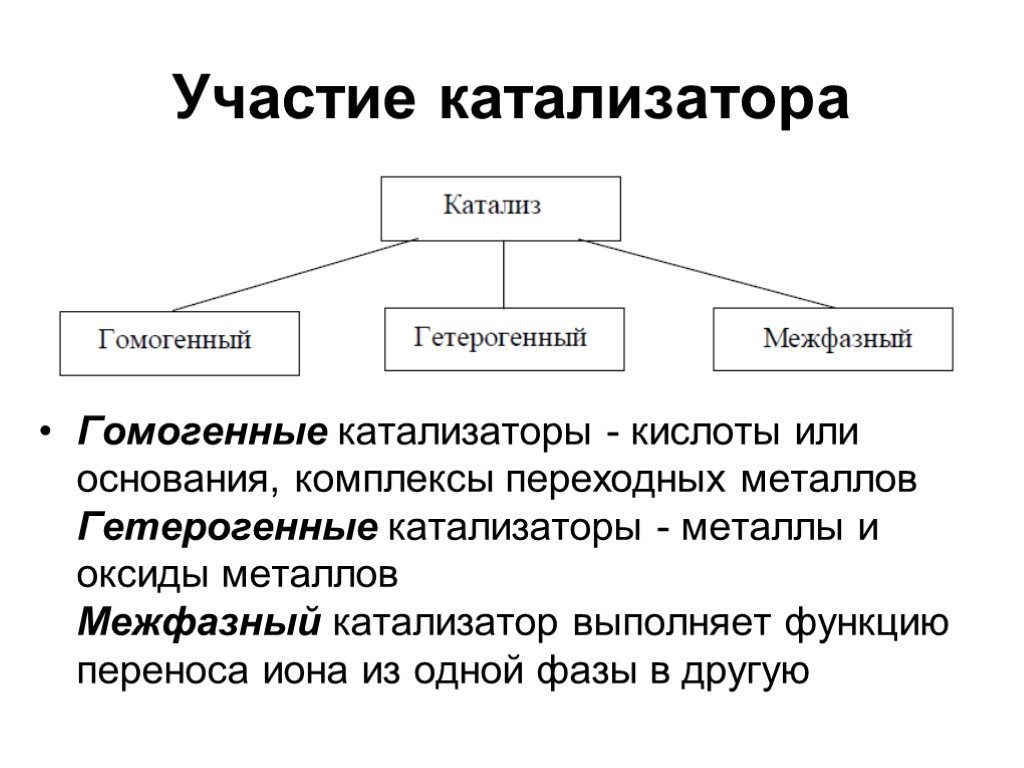
Катализаторы ускоряют реакции, снижая энергия активации E a реакции, которая протекала бы без катализатора, но гораздо медленнее. Такие реакции имеют продукт или продукты с более низкой полной энергией, чем у реагента или реагентов; если бы это было не так, эти реакции не происходили бы без подвода внешней энергии. Но чтобы перейти из более высокого энергетического состояния в более низкое энергетическое состояние, продукты должны сначала «преодолеть горб», которым является E a . Катализаторы, по сути, сглаживают неровности на пути энергии реакции, облегчая реагентам переход к энергии «вниз по склону» реакции, просто снижая высоту «вершины холма».
Химические системы содержат примеры положительных и отрицательных катализаторов, причем первые имеют тенденцию увеличивать скорость реакции, а отрицательные катализаторы служат для ее замедления. Оба могут быть выгодными, в зависимости от конкретного желаемого результата.
Catalyst Chemistry
Катализаторы выполняют свою работу путем временного связывания или иной химической модификации одного из реагентов и изменения его физической конформации или трехмерной формы таким образом, чтобы облегчить трансформацию реагента или реагентов в один из продуктов. Представьте, что у вас есть собака, которая валялась в грязи и нуждается в чистке, прежде чем она сможет войти внутрь. Грязь в конце концов сошла бы с собаки сама собой, но если бы вы могли сделать что-то, что подтолкнуло бы собаку в направлении поливочной машины во дворе, чтобы грязь быстро смылась с ее шерсти, вы бы фактически послужили «катализатором». «реакция грязной собаки на чистую собаку».
Представьте, что у вас есть собака, которая валялась в грязи и нуждается в чистке, прежде чем она сможет войти внутрь. Грязь в конце концов сошла бы с собаки сама собой, но если бы вы могли сделать что-то, что подтолкнуло бы собаку в направлении поливочной машины во дворе, чтобы грязь быстро смылась с ее шерсти, вы бы фактически послужили «катализатором». «реакция грязной собаки на чистую собаку».
Чаще всего из реагента и катализатора образуется промежуточный продукт, не показанный ни в одном обычном обзоре реакции, и когда этот комплекс превращается в один или несколько конечных продуктов, катализатор регенерируется, как будто ничего никогда не происходило с вообще что-то из этого. Как вы вскоре увидите, этот процесс может происходить по-разному.
Гомогенный катализ
Реакция считается гомогенно катализируемой , когда катализатор и реагент(ы) находятся в одном и том же физическом состоянии или фазе. Чаще всего это происходит с газообразными парами катализатор-реагент. Типы гомогенных катализаторов включают органические кислоты, в которых донорный атом водорода заменен металлом, ряд соединений, смешивающих углеродные и металлические элементы в той или иной форме, и карбонильные соединения, присоединенные к кобальту или железу.
Типы гомогенных катализаторов включают органические кислоты, в которых донорный атом водорода заменен металлом, ряд соединений, смешивающих углеродные и металлические элементы в той или иной форме, и карбонильные соединения, присоединенные к кобальту или железу.
Примером этого типа катализа с участием жидкостей является превращение ионов персульфата и йодида в сульфат-ион и йод:
S 2 O 8 2- + 2 I — 0 → 2 SO 4 2- + I 2
Этой реакции будет трудно протекать самостоятельно, несмотря на благоприятную энергетику, потому что оба реагента заряжены отрицательно и, следовательно, их электростатические свойства противоположны их химическим свойствам. Но если к смеси добавить ионы железа, несущие положительный заряд, железо «отвлечет» отрицательные заряды, и реакция пойдет быстрее.
Природный газообразный гомогенный катализ представляет собой преобразование газообразного кислорода, или O 2 , в атмосфере в озон, или O 3 , где радикалы кислорода (O — ) являются промежуточными продуктами. Здесь ультрафиолетовый свет солнца является истинным катализатором, но каждое присутствующее физическое соединение находится в одном и том же (газовом) состоянии.
Здесь ультрафиолетовый свет солнца является истинным катализатором, но каждое присутствующее физическое соединение находится в одном и том же (газовом) состоянии.
Гетерогенный катализ
Реакция считается гетерогенно катализируемой , когда катализатор и реагент(ы) находятся в разных фазах, а реакция происходит на границе раздела между ними (чаще всего на границе газ-твердое тело). Некоторые из наиболее распространенных гетерогенных катализаторов включают неорганические, то есть не содержащие углерод, твердые вещества, такие как элементарные металлы, сульфиды и соли металлов, а также небольшое количество органических веществ, в том числе гидропероксиды и ионообменники.
Цеолиты представляют собой важный класс гетерогенных катализаторов. Это кристаллические твердые вещества, состоящие из повторяющихся звеньев SiO 4 . Элементы четырех из этих соединенных молекул связаны друг с другом, образуя различные кольцевые и каркасные структуры. Присутствие атома алюминия в кристалле создает дисбаланс заряда, который компенсируется протоном (то есть ионом водорода).
Присутствие атома алюминия в кристалле создает дисбаланс заряда, который компенсируется протоном (то есть ионом водорода).
Ферменты
Ферменты — это белки, которые действуют как катализаторы в живых системах. Эти ферменты имеют компоненты, называемые сайтами связывания субстрата или активными центрами, к которым присоединяются молекулы, участвующие в катализируемой реакции. Составными частями всех белков являются аминокислоты, и каждая из этих отдельных кислот имеет неравномерное распределение заряда от одного конца до другого. Это свойство является основной причиной того, что ферменты обладают каталитическими способностями.
Активный центр фермента подходит к нужной части субстрата (реагента) как ключ, входящий в замок. Обратите внимание, что описанные ранее катализаторы часто катализируют множество разнородных реакций и поэтому не обладают той степенью химической специфичности, которой обладают ферменты.
В целом, чем больше субстрата и фермента, тем быстрее протекает реакция.
S → P
, чтобы показать превращение субстрата в продукт, вы можете изобразить это как:
E + S → ES → E + P
, где средний термин представляет собой комплекс фермент-субстрат (ES).
Ферменты, хотя и относятся к категории катализаторов, отличной от перечисленных выше, могут быть либо гомогенными, либо гетерогенными.
Ферменты оптимально функционируют в узком диапазоне температур, что имеет смысл, учитывая, что в обычных условиях температура вашего тела не колеблется более чем на несколько градусов. Экстремальная жара разрушает многие ферменты и заставляет их терять свою специфическую трехмерную форму.
