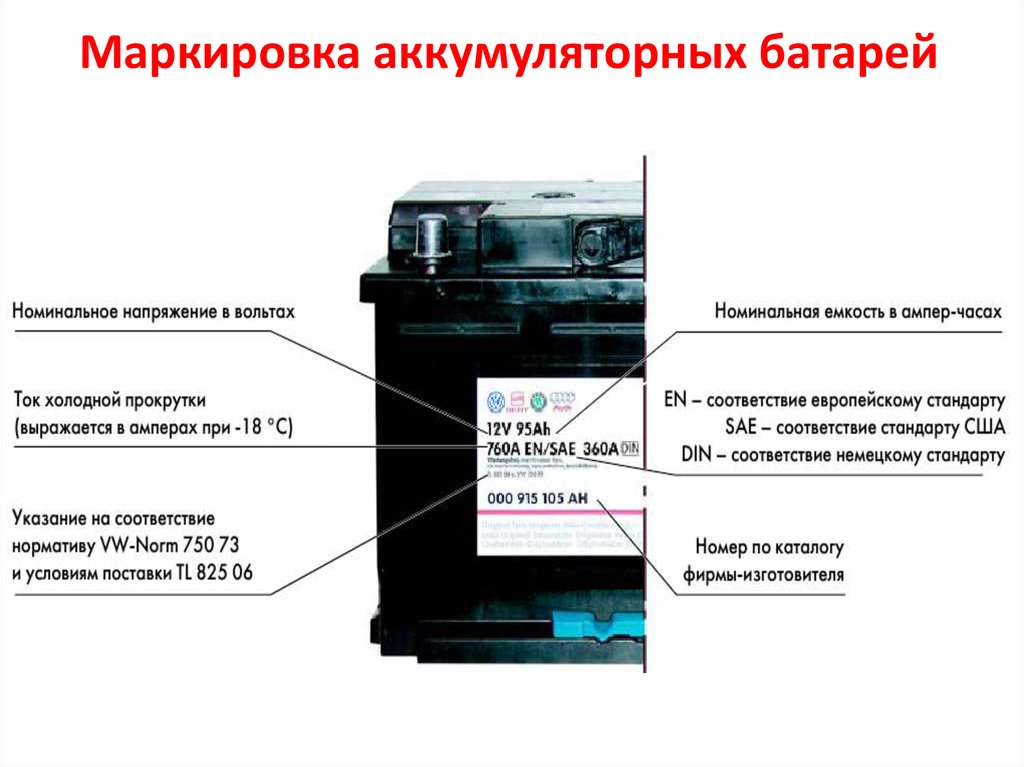
Кислотные аккумуляторы: конструкция, характеристики
Главная » АКБ
На чтение 5 мин Просмотров 665
Аккумулятор — источник питания, в котором при разряде энергия химической реакции преобразовывается в электрическую, а при заряде — наоборот. Главное отличие от обычной батареи – это возможность восстановления энергии методом повторной зарядки. Для заряда нужно подключить постоянный ток в направлении, обратном разряду.
Кислотные аккумуляторы были изобретены в 19 веке, но до сих пор являются самыми востребованными в мире благодаря невысокой стоимости и высокой степени эффективности. Устройство состоит из корпуса, двух разнополярных электродов, помещенных в электролит – раствор кислоты, от этого получено название – кислотные батареи (АКБ — Аккумуляторные Кислотные Батареи).
Содержание
- Как работают?
- Конструкция
- Основные характеристики, параметры
- Разновидности
- Применение
- Зарядка и общие рекомендации
Как работают?
Основой работы аккумулятора является электрохимический процесс взаимодействия свинца и диоксида свинца в водном растворе серной кислоты. При включении нагрузки на электроды происходит химическая реакция диоксида свинца с серной кислотой H2SO4, а также реакция окисления свинца до сульфата свинца. В процессе разряда на катоде («-») идет восстановление диоксида свинца, на аноде («+») — окисление свинца. Во время зарядки происходят обратные химические реакции и электролиз воды с выделением кислорода на аноде, водорода на катоде.
Реакции взаимодействия, протекающие в аккумуляторе, можно описать двумя формулами:
- PbO 2 + Pb + 2H2SO4 → 2PbSO4 + 2H2O – разряд.

- 2PbSO4 + 2H2O → PbO2 + Pb + 2H2SO4 — заряд.
При разрядке идет процесс образования сульфата свинца в активных массах анода и катода, расходование серной кислоты H2SO4 и снижение плотности электролита. Во время зарядки происходят обратные реакции, идет образование серной кислоты, повышается плотность электролита. Окончание процесса заряда характеризуется завершением преобразования веществ на электродах, прекращением изменения электролита. Если продолжать зарядку, то возникает нежелательная реакция разложения воды (электролиз), идет выделение кислородных и водородных пузырьков в электролите, происходит иллюзия закипания. Если это произошло, необходимо добавить в аккумулятор дистиллированной воды для восстановления ее в электролите.
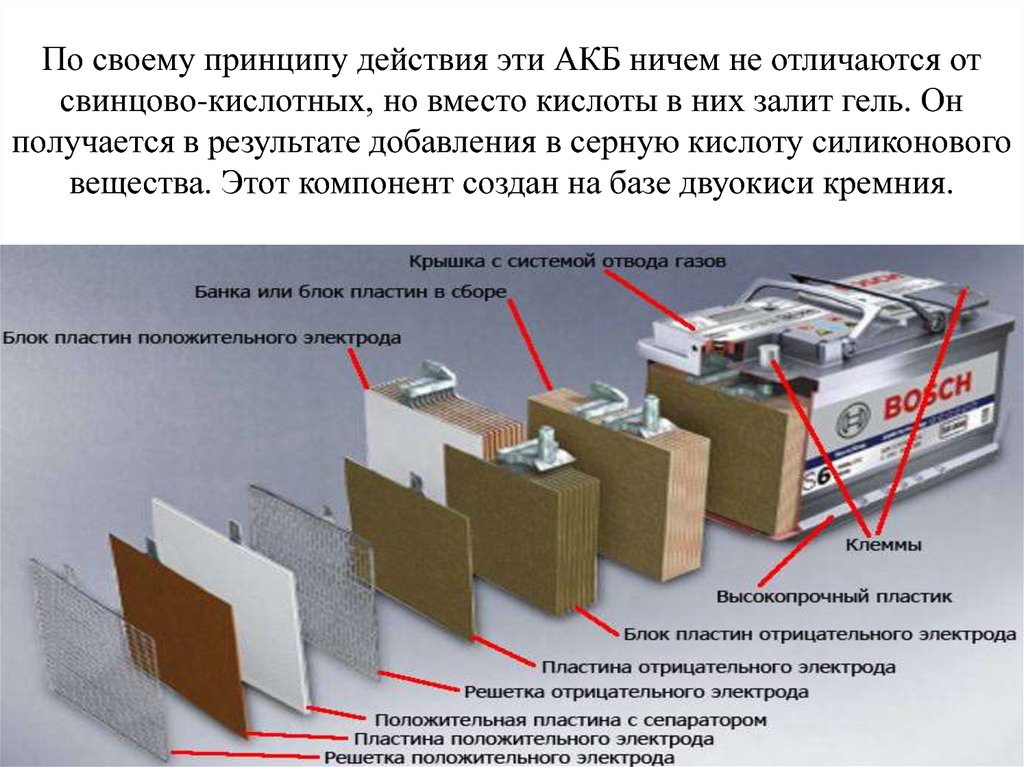
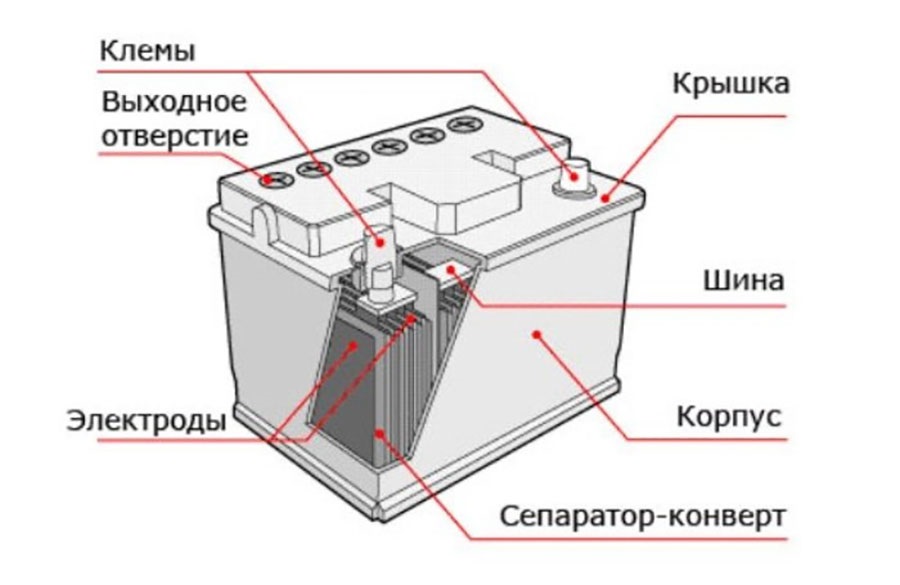
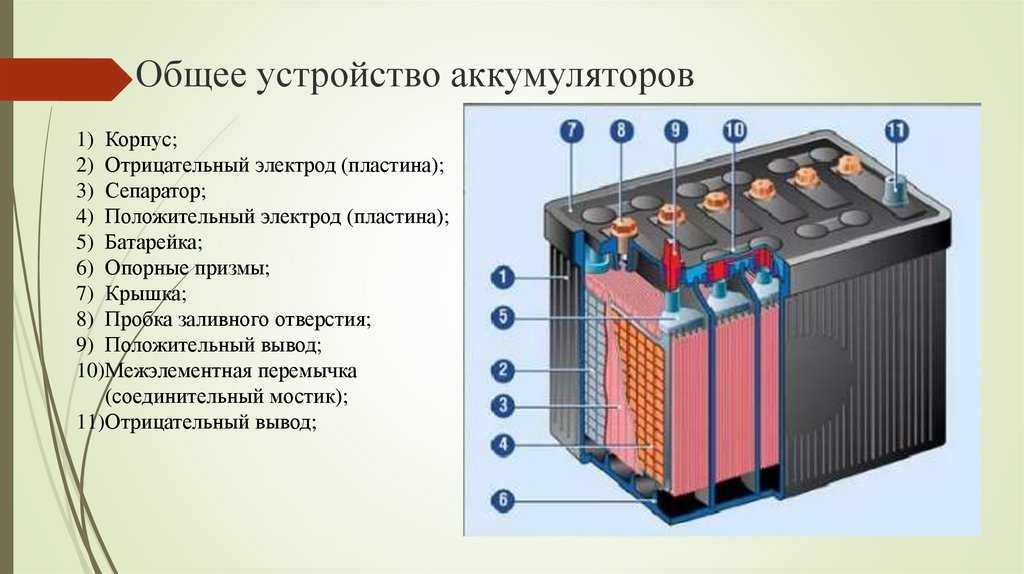
Конструкция
Кислотные батареи уже более ста лет не меняются по своему основному внутреннему устройству.
В конструкцию аккумуляторных батарей входят:
- Электроды – в виде плоских решеток из свинца, в ячейки запрессован порошок диоксид свинца (PbO2) на аноде, порошок металлического свинца (Pb) — на катоде.

- Сепаратор — пористый диэлектрик, разделяет между собой электроды, препятствуя замыканию.
- Электролит — разбавленная водой (дистиллированной) серная кислота H2SO4, в нее помещены электроды и сепаратор. Максимальная электропроводность достигается при температуре 20оС, концентрации серной кислоты – 35 %, что означает плотность электролита 1,26 г/см³. Внутренне сопротивление при этом минимально, потери внутри устройства существенно малы. В местах с низкотемпературным климатом возможно повышение плотности раствора до 1,29 г/см³ – 1,31 г/см³. Увеличение концентрации кислотного раствора препятствует замерзанию электролита, образованию льда внутри корпуса, который может повредить электроды и разорвать аккумулятор.
Основные характеристики, параметры
- Емкость (номинальная) — количество электрической энергии, которое могут дать кислотные батареи, измерение происходит в момент разряда, при нагрузке маленьким током потребления, единицы измерения— А*ч.

- Стартерный ток – показывает способность АКБ отдавать большие токи при температуре — 18оС на протяжении половины минуты.
- Емкость(резервная) — показывает временной промежуток, на протяжении которого кислотные батареи отдают ток 25 А до величины напряжения 10,5 В.
- Нижнее значение напряжения разряженной АКБ — 1,75 — 1,8 V.
- Температурный рабочий диапазон — – 40ос — + 40оС.
Разновидности
По режиму работы кислотные батареи можно разделить на три группы:
- Циклический — принцип работы происходит по циклу – полный разряд — полный заряд, периодически отключается от источника питания. Считается наиболее жестким режимом, количество циклов стопроцентной разрядки ограничено.
- Буферный — широко используемый режим, щадящий для АКБ, при нем не допускается полного разряда, характерно постоянное подключение к источнику питания.
- Смешанный — комбинация буферного и циклических режимов, но большая часть времени работы проходит в буферном.

Самые распространенные кислотные батареи, представленные на рынке, можно разделить на виды:
| Вид | Обслуживание | Описание | Вольтаж, V |
| Lead-Acid | Обслуживаемые | Автомобильные АКБ, бывают: малосурьмянистые, сурьмянистые, кислотно-кальциевые, гибридные. | 612 |
| AGM VRLA | Не требуют обслуживания | Сепараторы изготовлены из стекловолокна, циклический и буферный режим работы. | 24612 |
| VRLA | Не требуют обслуживания | Герметичный корпус, бывают кальциевые, не выделяют газов, используются в буферном режиме. | 24612 |
| GEL VLRA | Не требуют обслуживания | В качестве электролита — селикагель, что продлевает срок службы АКБ, буферный режим эксплуатации. | 24612243648 |
| OPzV | Не требуют обслуживания | Электроды трубчатой конструкции, устойчивы к полному разряду, срок службы — около 22 лет. | 2 |
Применение
- Автотранспорт — кислотные батареи используются как стартерные батареи.
- Компьютерная техника — источники бесперебойного питания (ИБП) позволяют сохранить информацию в случае аварийного отключения электричества.
- Промышленное производство — кислотные батареи используются как источники резервного питания.
Зарядка и общие рекомендации
- Зарядку необходимо проводить при температуре 20оС.
- Ток заряда не должен превышать 10 % номинального значения емкости АКБ.
- Для использования в транспортных средствах кислотные батареи при низких температурах, лучше применять с системой внутреннего электроподогрева, т. к. емкость устройства теряется на 1% при снижении температуры на 1оС.
- Не рекомендуется хранить кислотные батареи при температуре выше 30оС, либо разряженными, предварительно АКБ должны быть полностью заряжены.
- Хранение зимой лучше организовать на холоде, т. к. процесс саморазряда будет минимален, и на плюсовую клемму необходимо предварительно нанести солидол.
- Перед использованием, кислотные батареи нужно занести в помещение с температурой 20оС на 8-10 часов для приведения в рабочее состояние.
Batareykaa.ru
window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-277958-196’, blockId: ‘R-A-277958-196’ })})»+»ipt>»; cachedBlocksArray[80628] = «window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-277958-191’, blockId: ‘R-A-277958-191’ })})»+»ipt>»; cachedBlocksArray[80625] = «window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-277958-69’, blockId: ‘R-A-277958-69’ })})»+»ipt>»; cachedBlocksArray[80615] = «window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-277958-48’, blockId: ‘R-A-277958-48’ })})»+»ipt>»; cachedBlocksArray[80614] = «window.
Узнаём какая кислота в аккумуляторе
Автомобильные аккумуляторы извлекают электрическую энергию из химической реакции, протекающей внутри него. по сути АКБ конвертируют энергию из электрической в химическую в процессе заряда и наоборот, когда выдают необходимый ток.
по сути АКБ конвертируют энергию из электрической в химическую в процессе заряда и наоборот, когда выдают необходимый ток.
Для качественного протекания этих процессов требуются ингредиенты достаточной чистоты. Особенно это касается серной кислоты, вместе с дистиллированной водой являющейся тем, из чего состоит электролит в аккумуляторе.
Содержание статьи
- Серная кислота в аккумуляторе
- Состав кислотного электролита
- Поднятие плотности в АКБ
- Полезное видео
- Какой электролит заливать?
- Заключение
Серная кислота в аккумуляторе
По сути то, что залито в аккумулятор — это разбавленная серная кислота. В основе работы любого свинцово-кислотного аккумулятора лежит химический процесс, высвобождающий электрический заряд. Молекулы серной кислоты расщепляют посредством электролитической диссоциации свинцовые электроды, создавая положительно и отрицательно заряженные ионы.
Собираясь на положительных и отрицательных электродах батареи, ионы создают на клеммах АКБ необходимый заряд. Со временем часть молекул связывается без возможности возобновить свою работу в банках, что снижает плотность электролита. Поэтому так важно следить за концентрацией аккумуляторной кислоты.
Со временем часть молекул связывается без возможности возобновить свою работу в банках, что снижает плотность электролита. Поэтому так важно следить за концентрацией аккумуляторной кислоты.
Процесс носит название электролитической диссоциации. При нём ионы с положительным зарядом(катионы) — устремляются к плюсовому электроду. К отрицательному электроду направляются анионы — отрицательно заряженные ионы.
Окислителем выступает диоксид свинца, который в результате взаимодействия с молекулами кислоты восстанавливается, отдавая отрицательный заряд на электроды. Растворы серной кислоты слабо проводят электрический ток, однако хорошо справляется с ионным обменом.
При разрядке АКБ положительные ионы свинца устремляются через электролит с губчатого свинца – восстановителя. Здесь происходит превращение в двухвалентный свинец из четырехвалентного, таким образом, оставляя заряд 2 электронов с каждого иона.
На аноде — PbO2 + SO42− + 4H+ + 2e− -> PbSO4 + 2H2O — окисление свинца.
На катоде — Pb + SO42− − 2e− ->PbSO4
Во время зарядки идут обратные реакции — свинец движется в сторону пластин.
Оба электрода покрываются слоем сульфата, который образовывается из отрицательных кислотных остатков и положительных двухвалентных ионов свинца. Это называется сульфатацией, которая для пластин аккумулятора весьма опасна и грозит быстрым износом. Выделяемые газы в процессе восстановительно-окислительных реакций считаются побочным эффектом, однако они могут серьёзно повлиять на работоспособность всей батареи.
В процессе разрядки батареи к отрицательно заряженному электроду устремляются электроны, где они производят нейтрализацию ионов свинца. В зависимости от уровня заряда батареи плотность электролита может иметь разное значение.
Измерения делаются при комнатной температуре + 25 °С. Использование кислоты происходит в 1,6 раз больше положительными электродами. Поэтому рост объема электролита наблюдается при разрядке батареи и уменьшение – при зарядке.
Состав кислотного электролита
Свинцово — кислотные аккумуляторы для автомобилей наиболее распространенные на сегодня. Электролит в аккумуляторе автомобиля это 33-38 % раствор серной кислоты в дистиллированной воде. Плотность такого раствора примерно равна 1.27 г/л. Существует несколько стандартов качества кислоты, но нас интересует только характеристики кислоты для АКБ.Согласно ГОСТ 667 73 аккумуляторная кислота должна обладать следующими физико-химическими показателями.
Для высшего сорта массовые части:
- моногидрата – 92-94 %;
- железа – до 0,005 %;
- после прокаливания остатка – 0,02 %;
- окислов азота – 0,00003 %;
- хлористых соединений – 0,0002 %;
- марганца – до 0,00005 %;
- всех тяжелых металлов, пересчет на Рb – 0,01 %;
- меди – 0,0005 %;
- восстановителей для KМnO – до 4,5 %.
Прозрачность раствора определяется при комнатной температуре жидкости с помощью специального теста. Согласно ГОСТ 667 73 кислота аккумуляторная должна быть определенной прозрачности, что при установке на поле с шахматными клетками и подсвечивании его электрической лампой должно давать четкие очертания ячеек. Представленные данные — это эталонные показатели, и на практике то что заливают в аккумулятор всегда ниже качеством и больше загрязнено.
Согласно ГОСТ 667 73 кислота аккумуляторная должна быть определенной прозрачности, что при установке на поле с шахматными клетками и подсвечивании его электрической лампой должно давать четкие очертания ячеек. Представленные данные — это эталонные показатели, и на практике то что заливают в аккумулятор всегда ниже качеством и больше загрязнено.
Поднятие плотности в АКБ
Повышение плотности электролита происходит как следствие повышения температуры и гидролиза в батарее. Для выравнивания этого показателя требуется постоянное добавление определенного количества дистиллята. При меньшей концентрации аккумуляторной кислоты в электролите, следует ее поднимать, если датчик показывает значение ниже 1,275 г на куб. см.
Важно! Кислота является агрессивной средой для тканей человека, одежды. Поэтому при работах с открытой батареей следует позаботиться о мерах защиты: надеть защитные очки и резиновые перчатки. Не помешает прорезиненный фартук или старая одежда.
Кислотность электролита поднимается двумя путями: внесением концентрированной кислоты с помощью постепенного разбавления или полная замена электролита новым.
В первом случае следует провести такие действия для каждой банки:
- Откачать по возможности максимальное количество электролитической жидкости с помощью резиновой груши или колбы;
- Внести в банку половину ее объема электролита с плотностью от 1,275 до 1,29 г на куб. см;
- Для перемешивания электролита на выводы подается нагрузка небольшой мощности, например при подключении обычной лампочки для автомобилей, или выдерживание на протяжении нескольких часов;
- При замере плотности следует определить нужный уровень. Если не было изменений, то в половину оставшегося объема следует внести еще электролит;
- Повторное перемешивание с замером;
С помощью подобных манипуляций следует довести до нужной плотности концентрацию серной кислоты в электролите.
При показателе индикатором значения плотности ниже 1,2 г на куб. см, требуется полная замена электролитической жидкости, поскольку подобным способом поднятие ее невозможно. Такой уровень в заряженном состоянии наводит на мысль о целесообразности операции.
см, требуется полная замена электролитической жидкости, поскольку подобным способом поднятие ее невозможно. Такой уровень в заряженном состоянии наводит на мысль о целесообразности операции.
Если батарее менее года, то процедура может увенчаться успехом, более старые элементы питания, скорее всего, реанимацию не переживут.
Полезное видео
Видеоинструкция по обслуживанию аккумулятора
Какой электролит заливать?
Для приготовления нового электролита требуется концентрированная кислота для аккумуляторов, которая продается с плотностью 1,835 – 1,84 г на куб. см. Разбавляется жидкость чистой дистиллированной водой, поскольку содержащиеся соли металлов в обычной проточной воде пагубно влияют на электроды АКБ.
Важно! Внесение дистиллята в кислоту строго запрещено. В результате таких действий возникает сильный нагрев, бурная реакция с разбрызгиванием вещества.
Поэтому добавлять следует кислоты в дистиллированную воду тонкой струйкой.
Для того чтобы развести аккумуляторную жидкость, следует проделать такие операции:
- По возможности использовать защитную одежду: защитные очки, химически устойчивую одежду и резиновые перчатки.
- Подготовить все ингредиенты и инструменты: кислоту, дистиллированную воду, ареометр, химически стойкую посуду,
- Рассчитать количество кислоты и дистиллированной воды для необходимого результата. В среднем в АКБ залито 2,6-3,7 литра раствора, но лучше разведение производить с расчетом на объем 4 литра;
- В устойчивую к кислотным воздействиям емкость наливается нужный объем дистиллята;
- Постепенно разбавляется дистиллированная вода кислотой с постоянным перемешиванием, чтобы плотные слои разводились равномерно, а не опускались на дно емкости;
- Ареометром замеряется плотность полученного раствора;
- При наличии показателя, близкого к требуемому значению, раствор должен настояться несколько часов для лучшего перемешивания.
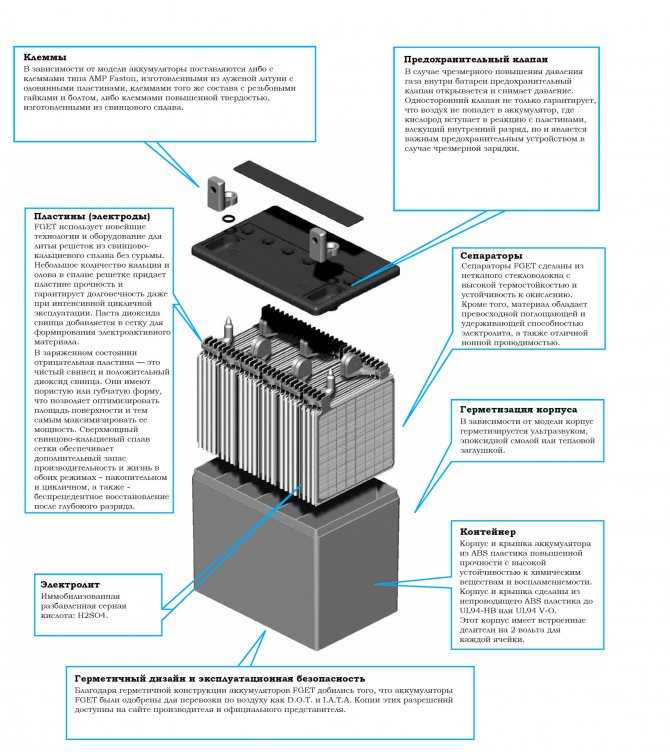
Таблица плотностей электролита и соотношения дистиллята и кислоты
При получении слишком концентрированной жидкости, следует провести разбавление ее дистиллятом. При смешивании дистиллированной воды и аккумуляторной кислоты в процессе реакций выделяется тепло, которое будет опасным для электродов. Поэтому заливать в банки следует только остывший раствор.
Заключение
Срок службы аккумуляторной батареи ограничивается ее техническими характеристиками. Однако неправильное использование и хранение может существенно снизить этот показатель. Чтобы АКБ не изнашивалась стремительно, нужно следить за плотностью электролита и его уровнем.
В результате химических процессов повышение плотности раствора происходит из-за высокой температуры и естественных реакций окисления и восстановления. Поэтому следует доливать дистиллят. Сильное падение плотности требует полноценной замены электролитической жидкости. Важно соблюдать меры предосторожности при работе с емкостью, а также следовать четким инструкциям.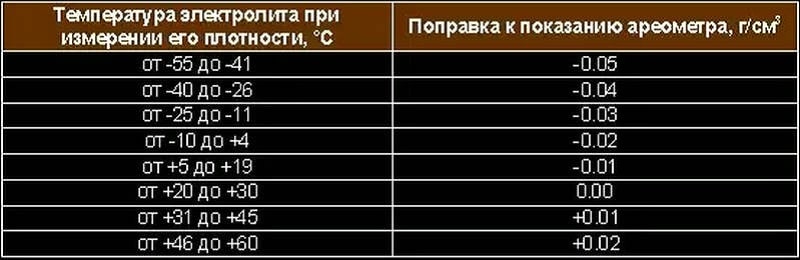
Химическая формула аккумуляторной кислоты (Изучите кислоты)
Химическая формула аккумуляторной кислоты – h3SO4. Эта серная кислота является сильным электролитом и используется в свинцово-кислотных батареях. При смешивании с водой образует кислый раствор, вызывающий коррозию металла.
Аккумуляторная кислота — коррозионное вещество, которое используется в свинцово-кислотных батареях. Он состоит из смеси воды и серной кислоты. Химическая формула аккумуляторной кислоты – h3SO4.
Это вещество обладает высокой коррозионной активностью и может вызвать серьезное повреждение кожи и глаз при контакте с ними. Важно быть очень осторожным при обращении с аккумуляторной кислотой и носить надлежащее защитное снаряжение, если вы собираетесь работать с ней.
Какие химические вещества содержатся в аккумуляторной кислоте?
Большинство бытовых батарей имеют кислотную основу. Кислота обычно представляет собой серную кислоту, но также может быть соляной, фосфорной или азотной кислотами. Концентрация раствора кислоты зависит от типа батареи; автомобильные аккумуляторы имеют более разбавленный раствор, чем большинство бытовых аккумуляторов.
Концентрация раствора кислоты зависит от типа батареи; автомобильные аккумуляторы имеют более разбавленный раствор, чем большинство бытовых аккумуляторов.
Электролит в свинцово-кислотном аккумуляторе состоит примерно из 30-40 процентов серной кислоты и 60-70 процентов воды. В полностью заряженной ячейке вся серная кислота израсходована и остается только вода. Когда во время разряда на пластинах образуются кристаллы сульфата свинца, некоторое количество серной кислоты высвобождается обратно в электролит.
Вот почему важно доливать в свинцово-кислотные аккумуляторы дистиллированную воду (не водопроводную), чтобы поддерживать надлежащий уровень серной кислоты в электролите. Соляная (соляная) кислота используется в некоторых автомобильных аккумуляторах, хотя и не так часто, как раньше. Фосфорная кислота использовалась в экспериментальных цинково-воздушных аккумуляторных батареях.
Концентрированная азотная кислота использовалась в качестве электролита в ранних никель-кадмиевых (NiCd) батареях и до сих пор используется в некоторых типах герметичных никель-кадмиевых перезаряжаемых батарей, предназначенных для устройств с высокой мощностью, таких как электромобили и беспроводные электроинструменты. .
.
Что такое химическая формула аккумуляторных кислот?
Аккумуляторные кислоты обычно имеют серную или свинцовую основу. Химическая формула серной кислоты – h3SO4, а химическая формула свинцовой кислоты – PbO2.
Что такое кислота в аккумуляторе?
Батареи — это устройства, которые накапливают энергию и обеспечивают ток при необходимости. Первая батарея была изобретена в 1799 году Алессандро Вольта, и с тех пор они стали неотъемлемой частью нашей жизни. Аккумуляторы питают все, от наших телефонов до наших автомобилей.
Кислота в аккумуляторе — это серная кислота. Эта кислота вызывает коррозию и может вызвать ожоги при попадании на кожу. Концентрация кислоты в аккумуляторе зависит от типа аккумулятора, но обычно составляет около 30-40%.
Серная кислота используется в батареях, поскольку она способна накапливать большое количество энергии. Когда батарея используется, серная кислота вступает в реакцию со свинцовыми пластинами внутри батареи, образуя сульфат свинца и воду. Эта реакция высвобождает электроны, которые текут по цепи и питают любое устройство, подключенное к батарее.
Эта реакция высвобождает электроны, которые текут по цепи и питают любое устройство, подключенное к батарее.
Когда батарея не используется, сульфат свинца распадается на ионы свинца и сульфата. Затем серная кислота поглотила эти ионы, вернув его в исходное состояние. Этот процесс можно повторять снова и снова, что позволяет многократно использовать батареи.
Каково химическое название батареи?
Батареи — это устройства, которые накапливают химическую энергию и преобразуют ее в электрическую энергию. Наиболее распространенным типом батареи является свинцово-кислотная батарея, которая состоит из электродов из диоксида свинца (PbO2) и губчатого свинца (Pb) в электролите из серной кислоты (h3SO4). Когда свинцово-кислотная батарея разряжается, электрод PbO2 вступает в реакцию с электролитом h3SO4 с образованием PbSO4 и воды.
Электрод Pb не реагирует при нормальных условиях. При зарядке происходят обратные реакции, превращающие PbSO4 и воду обратно в PbO2 и h3SO4.
Аккумуляторная кислота PH
Когда дело доходит до аккумуляторной кислоты, есть несколько вещей, которые вы должны знать :
| Номер один | Во-первых, аккумуляторная кислота очень коррозионно-активна и может нанести серьезный вред аккумуляторной кислоте. кожа и глаза. |
| Номер два | Во-вторых, аккумуляторная кислота легко воспламеняется, поэтому важно соблюдать осторожность при обращении с ней. |
| Номер три | Наконец, аккумуляторная кислота ядовита при проглатывании, поэтому важно держать ее подальше от детей и домашних животных. При контакте с аккумуляторной кислотой промойте пораженный участок водой не менее 15 минут. Если вы попали в глаза, немедленно обратитесь за медицинской помощью. |
| Номер четыре | Если вы проглотили аккумуляторную кислоту, немедленно позвоните в токсикологический центр или в отделение неотложной помощи. Аккумуляторная кислота опасна, поэтому обращайтесь с ней осторожно! Аккумуляторная кислота опасна, поэтому обращайтесь с ней осторожно! |
Также опасно при вдыхании или проглатывании.
Аккумуляторная кислота Жидкость
Когда большинство людей думают о аккумуляторной кислоте, они представляют коррозионную серную кислоту, содержащуюся в автомобильных аккумуляторах. Однако аккумуляторная кислота также может относиться к любому кислотному раствору, используемому в аккумуляторе. Это могут быть свинцово-кислотные, никель-кадмиевые, никель-металлогидридные и литий-ионные растворы.
Серная кислота является наиболее распространенным типом аккумуляторной кислоты. Он очень агрессивен и может вызвать серьезные ожоги при попадании на кожу. При попадании внутрь может привести к летальному исходу.
Серная кислота
Серная кислота используется в свинцово-кислотных батареях, обычно используемых в автомобилях и других транспортных средствах. В свинцово-кислотных батареях используется химическая реакция между свинцом и серной кислотой для создания электрического тока. Свинцовые пластины в батарее покрыты слоем активного материала, который вступает в реакцию с серной кислотой, создавая электроны. Эти электроны проходят через цепь для питания любого устройства, подключенного к батарее.
Никель-кадмиевые
Никель-кадмиевые (NiCd) батареи используют аналогичную химическую реакцию между никелем и кадмием для выработки электричества. NiCd аккумуляторы часто используются в небольших устройствах, таких как портативные радиоприемники или игрушки, потому что они легкие и имеют длительный срок хранения.
Тем не менее, никель-кадмиевые аккумуляторы постепенно выводятся из употребления из-за их воздействия на окружающую среду: кадмий является токсичным металлом, который может загрязнять почву и воду, когда он вымывается со свалок, где утилизируются никель-кадмиевые аккумуляторы. Никель-металлогидридные (NiMH) батареи работают так же, как никель-кадмиевые, но в их электродах используются другие металлы — обычно никель и железо. Они более экологичны, чем NiCd аккумуляторы, так как не содержат кадмия.
Никель-металлогидридные (NiMH) батареи работают так же, как никель-кадмиевые, но в их электродах используются другие металлы — обычно никель и железо. Они более экологичны, чем NiCd аккумуляторы, так как не содержат кадмия.
Однако они, как правило, менее эффективны, чем литий-ионные батареи, и имеют более короткий срок службы.
Заправка аккумуляторной кислоты
Если аккумулятор вашего автомобиля разряжен, у вас может возникнуть соблазн просто купить новый. Но, приложив немного времени и усилий, вы легко сможете самостоятельно заправить аккумуляторной кислотой. Вот что вам понадобится:
- Защитные очки
- Резиновые перчатки
- Воронка
- Аккумуляторная кислота (ее можно приобрести в большинстве магазинов автозапчастей)
- Дистиллированная вода
Теперь следуйте пошаговой инструкции:
Первый шаг
Аккумуляторная кислота вызывает коррозию и может вызвать серьезное повреждение кожи и глаз, поэтому важно соблюдать меры предосторожности при обращении с ней.
Второй этап
Используйте воронку, чтобы залить аккумуляторную кислоту в ячейку, пока она не достигнет линии заполнения. Будьте осторожны, чтобы не переполнить!
Заключительный этап
Когда все ячейки будут заполнены, долейте дистиллированную воду, пока уровень жидкости не достигнет верхней части пластин батареи. Дистиллированная вода необходима, потому что обычная водопроводная вода содержит минералы, которые могут повредить элементы батареи. В батареях также есть различные минералы.
Ваша батарея снова заряжена и готова к работе.
Аккумуляторная кислота против дистиллированной воды
Когда речь идет о кислоте и дистиллированной воде, существует несколько ключевых различий, о которых вы должны знать:
| Аккумулятор | Distiled Water | 203.
Во-первых, аккумуляторная кислота гораздо более агрессивна, чем дистиллированная вода. Это означает, что он может нанести серьезный ущерб любым поверхностям, с которыми соприкасается, включая вашу кожу. Это означает, что он может нанести серьезный ущерб любым поверхностям, с которыми соприкасается, включая вашу кожу. | Дистиллированная вода, напротив, не столь агрессивна и не вызывает немедленного повреждения кожи. Однако со временем многократное воздействие дистиллированной воды может привести к сухости и раздражению. |
| Аккумуляторная кислота имеет уровень pH около 1. | В то время как дистиллированная вода имеет уровень pH 7. |
| Это означает, что аккумуляторная кислота чрезвычайно кислая. | Хотя дистиллированная вода слабокислая |
Какой из них выбрать?
Если вам нужно убрать небольшую утечку аккумуляторной кислоты, то лучше всего использовать дистиллированную воду. Только не забудьте после этого тщательно промыть участок пресной водой. Однако предположим, что вы имеете дело с более крупным разливом или вам нужно очистить что-то, сильно загрязненное аккумуляторной кислотой. В этом случае лучше всего обратиться за помощью к профессиональной бригаде химзащиты.
В этом случае лучше всего обратиться за помощью к профессиональной бригаде химзащиты.
Аккумуляторная кислота на коже
Если аккумуляторная кислота попала на кожу, важно действовать быстро.
Аккумуляторная кислота обладает высокой коррозионной активностью и может вызвать серьезные ожоги. Вот что вам следует делать:
1. Промывайте пораженный участок прохладной водой в течение не менее 15 минут.
2. Наложите на пораженный участок стерильную повязку или чистую ткань.
3. Обратитесь за медицинской помощью, если ощущение жжения не проходит или вы видите какие-либо признаки инфекции, такие как покраснение, отек или выделение гноя.
Как сделать аккумуляторную кислоту
Большинство людей считают аккумуляторную кислоту опасным и вызывающим коррозию веществом. Однако знаете ли вы, что вы можете сделать аккумуляторную кислоту в домашних условиях?
Вот как :

 смеси до тех пор, пока она не достигнет концентрации около 70%.
смеси до тех пор, пока она не достигнет концентрации около 70%.
 Когда аккумулятор заряжается, сульфат свинца снова превращается в свинец и серную кислоту. Этот процесс повторяется до тех пор, пока в батарее остается достаточно энергии.
Когда аккумулятор заряжается, сульфат свинца снова превращается в свинец и серную кислоту. Этот процесс повторяется до тех пор, пока в батарее остается достаточно энергии. : Методы NMAM или OSHA.
: Методы NMAM или OSHA.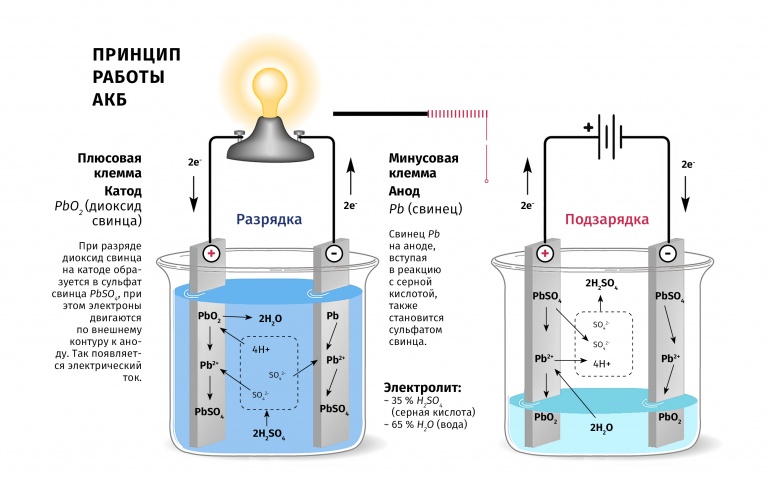 коды защиты)
коды защиты)