Теория работы свинцово-кислотного аккумулятора 🔋
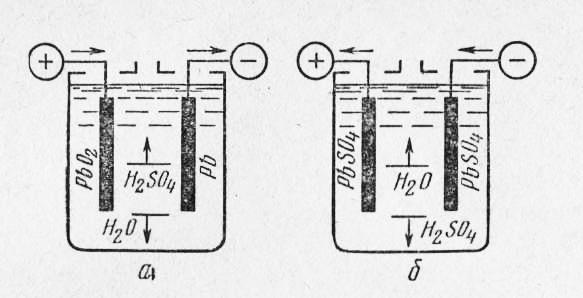
В свинцово-кислотном аккумуляторе основные продукты реакции, происходящие между положительным и отрицательным электродами аккумулятора в водном растворе серной кислоты, подчиняются так называемой теории двойной сульфатации в соответствии с уравнением:
⇐ заряд Pb + PbO2 + 2H2SO4 ⇐ ⇒ 2PbSO4 + 2H2 O (1) разряд ⇒
Этому соотношению подчиняется взаимодействие активных веществ в аккумуляторе во время разряда, заряда, подзаряда, а также во время бездействия (холостого хода).
Основные соотношения между реагентами при бездействии (при разомкнутой внешней цепи аккумулятора) определяются следующими реакциями:
– на отрицательном электроде:
2H+ + 2e- ⇒ H2↑ анодная полуреакция
Pb + SO42- ⇒ PbSO4 + 2e- катодная полуреакция
Pb + H2 SO4 ⇒ PbSO4 + H2↑ общая реакция (2)
– на положительном электроде:
PbO2 + 4H+ + SO42- + 2e- ⇒ PbSO4 + 2H2 O катодная полуреакция
H2 O ⇒ 1/2 O2 ↑ + 2H+ + 2e- анодная полуреакция
PbO2 + H2 SO4 + H2O ⇒ PbSO4 + 2H2 O + 1/2 O2↑
общая реакция (3)
Приведенные уравнения реакций на отрицательном и положительном электродах показывают, что даже при разомкнутой внешней цепи аккумулятора в нем происходит образование сульфата свинца на обоих электродах, снижение плотности электролита, а также разложение воды с выделением газообразных водорода и кислорода, что приводит, таким образом, к снижению емкости аккумулятора, т. е. к саморазряду. Объем продуктов этих реакций зависит от концентрации серной кислоты (плотности электролита), температуры, состава сплава решеток и активной массы электродов, возраста аккумулятора и других причин.
е. к саморазряду. Объем продуктов этих реакций зависит от концентрации серной кислоты (плотности электролита), температуры, состава сплава решеток и активной массы электродов, возраста аккумулятора и других причин.
При подключении к аккумулятору нагрузки токообразующий процесс подчиняется уравнению (1) для фазы разряда. На отрицательном электроде (на границе раздела свинец – сульфат свинца) происходит образование электронов, поступающих во внешнюю цепь:
Pb ⇒ Pb2+ + 2e-
На положительном электроде на границе раздела окись свинца -сульфат свинца происходит поглощение электронов, поступающих через замкнутую внешнюю цепь, и образование воды:
PbO2 + 4H+ + 2e- ⇒ Pb2+ + 2H2 O
Анионы свинца , связываясь с кислотным остатком, образуют на обоих электродах сульфат свинца, покрывающий поверхность активных масс пластин. По мере разряда концентрация серной кислоты в электролите убывает.
По мере разряда концентрация серной кислоты в электролите убывает.
₽21 690
В корзину
₽17 190
В корзину
₽15 990
В корзину
При подключении аккумулятору зарядного устройства токообразующий процесс проходит согласно уравнению (1) для фазы заряда.
На отрицательном электроде анионы свинца, образованные из сульфата свинца при растворении в электролите, связываются с электронами, поступающими из внешней цепи, образуя чистый (губчатый) свинец:
Pb2+ + 2e- ⇒ Pb
На положительном электроде процесс протекает согласно реакции (4) с образованием на электроде окиси свинца и отдачи во внешнюю цепь электронов:
Pb2+ + 2H2 O ⇒ PbO2 + 4H+ + 2e- (4)
По мере заряда увеличивается напряжение поляризации аккумулятора, и, когда оно превысит величину перенапряжения по кислороду, на положительном электроде начинает выделяться кислород:
2OH– ⇒ 1/2 O2↑ + H2 O + 2e-
Когда напряжение поляризации превысит величину перенапряжения по водороду, на положительном электроде начинается образование водорода:
2H+
Таким образом, при заряде наряду с образованием на электродах исходных продуктов (свинца и окиси свинца) происходит повышение плотности электролита за счет восстановления серной кислоты, а на последней стадии заряда при повышенном напряжении часть подводимого электричества идет на разложение воды:
H2 O ⇒ H2↑ + 1/2 O2↑
Из других побочных реакций на положительном электроде при заряде следует обратить внимание на образование озона и на окисление (коррозию) решетки, что оказывает решающее влияние на сокращение срока службы аккумулятора.
С уважением,
коллектив Бэттери Сервис
Свинцово кислотный аккумулятор — принцип работы, как правильно заряжать
Свинцово-кислотный аккумулятор – один из самых надёжных АКБ, разработанный ещё в XIX веке, но до сих пор используемый во многих областях. В его основе лежит химическая реакция с переносом электронов от анода к катоду. Аккумулятор со временем портится при разрядке-подзарядке, так что данный процесс должен выполняться по всем правилам, чтобы продлить жизнь батареи.
Устройство и принцип работы свинцово-кислотного аккумулятора
Данный тип стационарного АКБ довольно тяжёлый, так как состоит из плотно параллельно упакованных плёнок свинца и оксида свинца. И те и другие в аккумуляторе расположены очень густо. Свинцовые пластины тёмно-серого цвета с синим оттенком, оксидно-свинцовые – тёмно-коричневые с рыжим оттенком.
Обе пластины находятся в серной кислоте, из-за чего в названии АКБ есть соответствующее слово. При включении аккумулятора ток протекает от оксидно-свинцового катода к свинцовому аноду. При этом свинец выделяет электроны, которые оксид свинца принимает.
При этом свинец выделяет электроны, которые оксид свинца принимает.
В результате изменения заряда двух пластин они вступают в реакцию с серной кислотой вокруг и превращаются в сульфаты свинца.
Pb + HSO4– => PbSO4 + H+ + 2e–
PbO2 + HSO4– + 3H+ + 2e– => PbSO4 + 2h3O
Пара пластин производит 2 вольта, поэтому, чтобы увеличить количество вольт, которое может дать аккумулятор, пластины соединяют параллельно во множество пар слоёв. Они упаковываются плотно в банку, чтобы уменьшить объём батареи. Но так как электроны должны передаваться через терминалы, то пары пластин разъединяются специальными изоляционными плёнками.
При этом аккумулятор может иметь либо высокую плотность энергии, либо мощности. То есть аккумулятор или сохраняет большое количество энергии и отдаёт её в течение длительного времени, или он отдаёт огромный заряд очень быстро. В автомобилях используется второй вариант, так как надо отдать более 400 ампер, чтобы завести двигатель.
При глубокой разрядке батареи на пластинах образуется налёт сульфата свинца.
Типы и особенности свинцово-кислотных АКБ
Идеальных аккумуляторов не существует, в инженерных конструкциях часто приходится жертвовать желаемыми характеристиками, чтобы получить необходимые параметры. Для каждой цели создан свой тип устройства.
В первую очередь АКБ делят на герметичные и негерметичные батареи. Вторые требуют постоянного контроля над уровнем электролита и состоянием катодов и анодов, могут работать лишь в определённых положениях. Аккумулятор герметичный свинцово-кислотный используется чаще, так как не нуждается в особом уходе.
Кроме того, все батареи можно разделить на следующие группы:
- Стартерные. Выдают большое количество энергии за одно мгновение, из-за чего обладают большим саморазрядом. Отлично подходят для того, чтобы заводить автомобили.

- Буферные батареи. Предназначены для краткосрочного хранения небольшого количества энергии, работают в постоянном режиме подзарядки.
- Аккумуляторы для бесперебойной аппаратуры. Устанавливаются в офисах для аварийного завершения работ.
- Аккумуляторы длительного электроснабжения. Большие тяжёлые батареи, которые выдают достаточно много энергии длительное время. Используются в реанимационных отделениях на случай отключения электричества.
- Гелевые аккумуляторы. Хорошо переносят циклы заряжения-разряжения. Благодаря этому могут использоваться в сильных морозах. Среди них отдельно можно выделить солнечные батареи, которые рассчитаны на многократные циклы.
Если требуется дольше сохранять энергию, но можно уменьшить мощность, то пластины делаются толще, но короче и уже (меньше по площади поверхности), а расстояние между ними увеличивается. Из-за чего уменьшается соотношение поверхности и массы, в итоге электроэнергия отдаётся медленнее.
Из-за чего уменьшается соотношение поверхности и массы, в итоге электроэнергия отдаётся медленнее.
Кроме того, на свойства аккумулятора влияют характеристики электролита и другие параметры. Гелевые электролиты хуже реагируют со свинцовыми и оксидно-свинцовыми плитами, а также делают конструкцию защищённой от вытекания. Повышает срок эксплуатации использование свинцово-кальциевых сплавов.
Области применения свинцово-кислотных аккумуляторов
Свинцово-кислотные аккумуляторы используются повсеместно, так как свинец и его оксид отвечают наиболее важным требованиям:
- элементы часто встречаются в природе и довольно легко добываются;
- они в паре способны накапливать и отдавать энергию лучше, чем все другие элементы;
- аккумуляторы из них просты и дешевы в производстве;
- долгий срок службы, возможность многократной перезарядки;
- простое обслуживание, что особенно характерно для герметичных конструкций.
Из-за этого батареи применяются в следующих областях:
- сигнализационные системы;
- стартёры в автомобилях;
- системы пожарной безопасности;
- системы аварийной подачи электроэнергии на телевидении, в реанимационных отделениях;
- электрические весы и кассовые аппараты;
- системы бесперебойного электроснабжения или аварийного отключения в компьютерной технике или их сетях;
- детские игрушки;
- в лёгких самолётах.
Тем не менее, имеются некоторые минусы:
- аккумуляторы чувствительны с холоду;
- отходы из них опасны для экологии;
- количество циклов довольно ограничено;
- есть лимиты у выдаваемой мощности.
Как правильно заряжать свинцово-кислотные аккумуляторы
Принцип зарядки состоит в том, что нужно изменить направление тока. Из-за этого электролит и материя двух пластин восстанавливает свой прежний химический состав. Данный процесс именуется циклом, и он может быть многократным. Но чтобы не повредить и продлить срок службы батареи, надо знать, как правильно заряжать свинцово-кислотный аккумулятор.
Важно! Для процедуры потребуется источник тока и устройство, которым можно регулировать силу тока и напряжение.
Прежде всего, нужно знать параметры аккумулятора, которые можно посмотреть на самой коробке устройства. Производители часто указывают информацию на английском языке. Обозначается всё это следующим образом:
| На английском | На русском |
| 12V | 12 вольт |
7. 2Ah 2Ah | 7.2 ампер-часов |
Также производитель может указывать напрямую, каким током можно заряжать аккумулятор:
| На английском | На русском |
| Standby use – 13.5-13,8V | Если вы используете батарею, как резервный источник электричества – 13,5-13,8 вольт |
| Cycle use – 14.4V | Если вы его применяете в качестве стартёра, то есть циклическое использование – 14.4 вольт |
| 2.16A MAX | При любой зарядке ток не должен превышать 2.16 ампера |
А что если производитель не указал, каким током заряжать аккумулятор? В этом случае можно пользоваться простым правилом – напряжение не должно превышать 10% от его номинальной ёмкости. То есть если у батареи указан параметр 7.2Ah, то заряжать надо при 0.72A.
После того как разобрались с основными параметрами, нужно сделать прибор, которым можно зарядить аккумулятор. Для этого потребуется крепкая коробка (лучше пластиковая) с отверстиями для вентиляции, блок питания от ноутбука, плата для регулировки тока и напряжения.
Собрав конструкцию, можно переходить непосредственно к главной процедуре. Для начала на неподключенном к аккумулятору устройстве нужно выставить напряжение, которым надо заряжать АКБ. Далее необходимо убавить силу тока до минимума, в результате чего сразу же упадёт напряжение. После этого подключаем устройство к аккумулятору (плюс к плюсу, минус к минусу).
В этот момент вольтамперметр будет показывать напряжение, которое есть на батарее. Включаем устройство в розетку и поднимаем силу тока до необходимой величины (метод её расчёта описан выше). В этот момент возможно незначительное снижение напряжения, говорящее о том, что ток уходит на прогрев электролита и преодоление сопротивления аккумулятора. Это нормально.
К концу зарядки аккумулятора сила тока на вольтамперметре будет практически равна нулю.
Что такое свинцово-кислотная батарея? Строительство, работа, разгрузка и перезарядка
Определение: Аккумулятор, в котором используется губчатый свинец и перекись свинца для преобразования химической энергии в электрическую, такой тип аккумулятора называется свинцово-кислотным аккумулятором.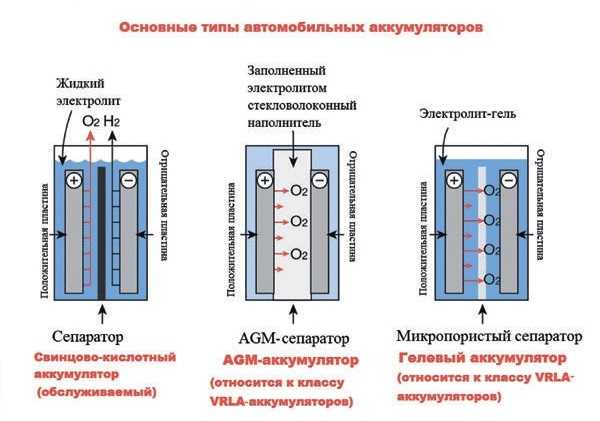 Свинцово-кислотные батареи чаще всего используются на электростанциях и подстанциях, потому что они имеют более высокое напряжение и более низкую стоимость.
Свинцово-кислотные батареи чаще всего используются на электростанциях и подстанциях, потому что они имеют более высокое напряжение и более низкую стоимость.
Конструкция свинцово-кислотного аккумулятора
Различные части свинцово-кислотного аккумулятора показаны ниже. Контейнер и пластины являются основной частью свинцово-кислотного аккумулятора. Контейнер хранит химическую энергию, которая с помощью пластин преобразуется в электрическую энергию.
1. Контейнер – Контейнер свинцово-кислотного аккумулятора изготовлен из стекла, облицованного свинцом дерева, эбонита, твердой резины из битумного компаунда, керамических материалов или формованных пластиков и установлен сверху во избежание вытекания электролита. . На дне контейнера есть четыре ребра, на двух из которых опирается положительная пластина, а на другие — отрицательные.
Призма служит опорой для пластин и одновременно предохраняет их от короткого замыкания. Материал, из которого изготовлены контейнеры аккумуляторов, должен быть стойким к серной кислоте, не должен деформироваться, быть пористым, содержать примеси, повредить электролит.
2. Пластина – Пластина свинцово-кислотного элемента имеет различную конструкцию, и все они представляют собой некоторую форму сетки, состоящей из свинца и активного материала. Сетка необходима для проведения электрического тока и для равномерного распределения тока по активному материалу. Если ток распределяется неравномерно, то активный материал ослабнет и выпадет.
Решетки изготовлены из сплава свинца и сурьмы. Обычно их делают с поперечным ребром, пересекающим места под прямым углом или по диагонали. Сетка для положительных и отрицательных пластин имеет одинаковую конструкцию, но сетки для отрицательных пластин сделаны легче, поскольку они не так важны для равномерного проведения тока.
Пластины аккумулятора бывают двух типов. Они представляют собой формованные пластины или плантные пластины и вклеенные или пластинчатые пластины.
Пластины Plante в основном используются для стационарных батарей, так как они тяжелее по весу и дороже, чем вклеенные пластины. Но пластины более долговечны и менее подвержены потере активного материала при быстрой зарядке и разрядке. Пластина плантеса имеет малую грузоподъемность.
Но пластины более долговечны и менее подвержены потере активного материала при быстрой зарядке и разрядке. Пластина плантеса имеет малую грузоподъемность.
Процесс Фора больше подходит для изготовления отрицательных, чем положительных пластин. Отрицательный активный материал довольно прочен и сравнительно слабо изменяется при зарядке и разрядке.
3. Активный материал – Материал в элементе, который принимает активное участие в химической реакции (поглощение или выделение электрической энергии) во время зарядки или разрядки, называется активным материалом элемента. Активными элементами свинцовой кислоты являются
- Перекись свинца (PbO 2 ) – Образует положительный активный материал. PbO 2 имеют цвет темного шоколада.
- Губчатый свинец – Его форма представляет собой отрицательный активный материал. Он серого цвета.
- Разбавленная серная кислота (H 2 SO 4 ) – Используется в качестве электролита.
 Он содержит 31% серной кислоты.
Он содержит 31% серной кислоты.
Перекись свинца и губчатый свинец, которые образуют отрицательный и положительный активные материалы, имеют небольшую механическую прочность и поэтому могут использоваться отдельно.
4. Сепараторы – Сепараторы представляют собой тонкие листы непроводящего материала, изготовленные из химически обработанного свинцового дерева, пористой резины или матов из стекловолокна, которые помещаются между плюсом и минусом, чтобы изолировать их друг от друга. Сепараторы имеют вертикальные канавки с одной стороны и гладкие с другой стороны.
5. Клеммы аккумулятора – Аккумулятор имеет две клеммы: положительную и отрицательную. Положительная клемма диаметром 17,5 мм в верхней части немного больше, чем отрицательная клемма диаметром 16 мм.
Принцип работы свинцово-кислотного аккумулятора
При растворении серной кислоты ее молекулы распадаются на положительные ионы водорода (2H + ) и сульфатные отрицательные ионы (SO 4 — ) и свободно перемещаются. Если два электрода погружены в растворы и подключены к источнику постоянного тока, то ионы водорода заряжаются положительно и перемещаются к электродам и подключаются к отрицательной клемме источника питания. ТАК 4 — отрицательно заряженные ионы двигались к электродам, подключенным к положительному выводу питающей магистрали (т. е. к аноду).
Если два электрода погружены в растворы и подключены к источнику постоянного тока, то ионы водорода заряжаются положительно и перемещаются к электродам и подключаются к отрицательной клемме источника питания. ТАК 4 — отрицательно заряженные ионы двигались к электродам, подключенным к положительному выводу питающей магистрали (т. е. к аноду).
Каждый ион водорода забирает один электрон с катода, а каждый сульфат-ион забирает два отрицательных иона с анода и вступает в реакцию с водой с образованием серной и водородной кислоты.
Кислород, полученный из приведенного выше уравнения, реагирует с оксидом свинца и образует пероксид свинца (PbO 2 .) Таким образом, во время зарядки свинцовый катод остается свинцом, а свинцовый анод превращается в пероксид свинца шоколадного цвета.
Если источник питания постоянного тока отключен и вольтметр подключен между электродами, он покажет разность потенциалов между ними. Если провод соединяет электроды, то ток будет течь от положительной пластины к отрицательной через внешнюю цепь, т. е. ячейка способна поставлять электрическую энергию.
е. ячейка способна поставлять электрическую энергию.
Химическое действие во время разрядки
Когда элемент полностью разряжен, анод изготавливается из пероксида свинца (PbO 2 ), а катод из металлического губчатого свинца (Pb). Когда электроды соединены через сопротивление, ячейка разряжается, и электроны текут в направлении, противоположном направлению заряда.
Ионы водорода движутся к аноду и, достигая анодов, получают один электрон от анода и становятся атомом водорода. Атом водорода вступает в контакт с PbO 2 , поэтому он атакует и образует сульфат свинца (PbSO 4 ), беловатого цвета и воду в соответствии с химическим уравнением.
Каждый сульфат-ион (SO 4 — ) движется к катоду и, достигая его, отдает два электрона, становится радикалом SO 4 , атакует катод из металлического свинца и образует сульфат свинца беловатого цвета в соответствии с химическим уравнением .
Химическое действие во время перезарядки
Для перезарядки анод и катод подключаются к положительной и отрицательной клемме сети постоянного тока. Молекулы серной кислоты распадаются на ионы 2Н + и SO 4 — . Ионы водорода, будучи положительно заряженными, движутся к катодам, получают оттуда два электрона и образуют атом водорода. Атом водорода реагирует с катодом сульфата свинца с образованием свинца и серной кислоты в соответствии с химическим уравнением.
Молекулы серной кислоты распадаются на ионы 2Н + и SO 4 — . Ионы водорода, будучи положительно заряженными, движутся к катодам, получают оттуда два электрона и образуют атом водорода. Атом водорода реагирует с катодом сульфата свинца с образованием свинца и серной кислоты в соответствии с химическим уравнением.
SO 4 — ион движется к аноду, отдает два своих дополнительных электрона, становится радикалом SO 4 , реагирует с сульфатом свинца анодом и образует пероксид свинца и сернокислоту свинца по химическому уравнению. Зарядка и разрядка представлены одним обратимым уравнением, приведенным ниже.
Уравнение должно читаться вниз для разряда и вверх для перезарядки.
10 главных различий между свинцово-кислотными батареями и литий-ионными батареями
До изобретения литий-ионных аккумуляторов в 1970-х годах во многих областях преимущественно использовались свинцово-кислотные аккумуляторы.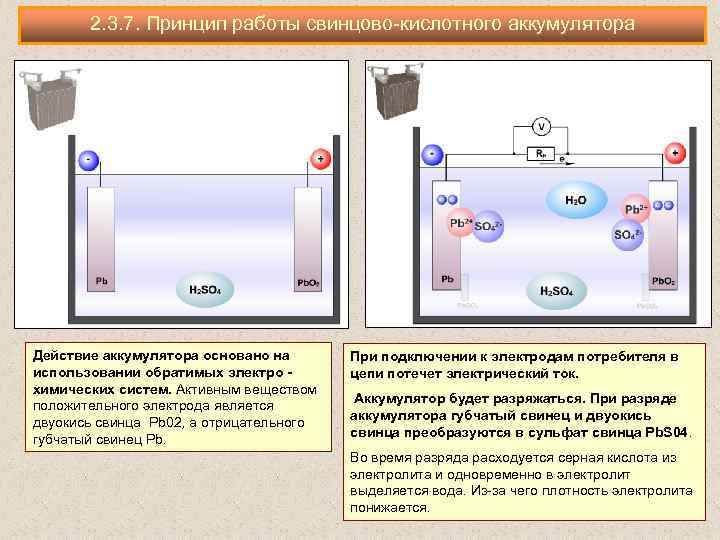 Литий-ионные аккумуляторы начали доминировать на рынке свинцово-кислотных аккумуляторов, поскольку они еще более долговечны. Ожидается, что рынок литий-ионных аккумуляторов будет показывать 17,23% среднегодового темпа роста в период с 2022 по 2027 год. В этой статье давайте сравним характеристики свинцово-кислотного аккумулятора и литий-ионного аккумулятора.
Литий-ионные аккумуляторы начали доминировать на рынке свинцово-кислотных аккумуляторов, поскольку они еще более долговечны. Ожидается, что рынок литий-ионных аккумуляторов будет показывать 17,23% среднегодового темпа роста в период с 2022 по 2027 год. В этой статье давайте сравним характеристики свинцово-кислотного аккумулятора и литий-ионного аккумулятора.
1. Используемые материалы
И литий-ионные, и свинцово-кислотные аккумуляторы работают по одному и тому же принципу. Основное различие заключается в материале, используемом в качестве катода, анода и электролита. В свинцово-кислотном аккумуляторе в качестве анода используется свинец, а в качестве катода — оксид свинца. В литий-ионных батареях в качестве анода используется углерод, а в качестве катода — оксид лития. В свинцово-кислотных батареях в качестве электролита используется серная кислота, а в литий-ионных батареях в качестве электролита используется литиевая соль.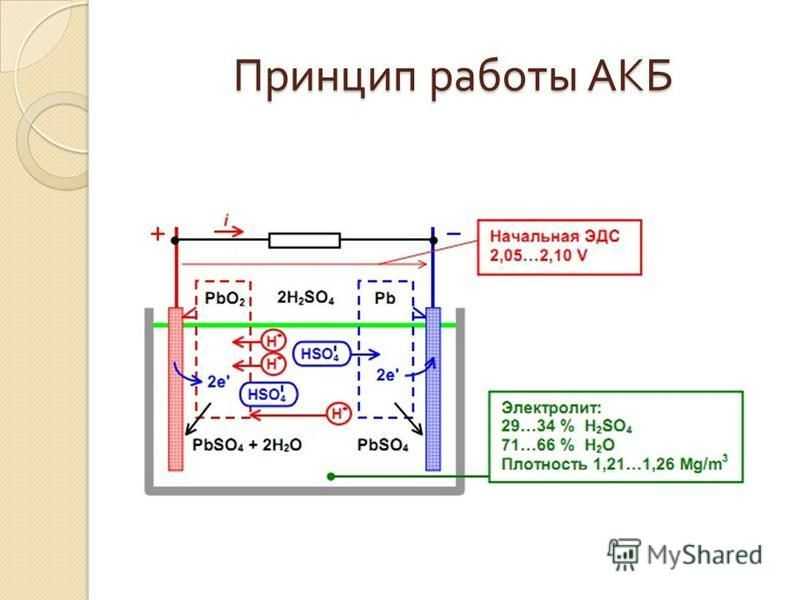 При разрядке ионы перетекают от анода к катоду через электролит, а при зарядке происходит обратная реакция.
При разрядке ионы перетекают от анода к катоду через электролит, а при зарядке происходит обратная реакция.
2. Стоимость
Свинцово-кислотные аккумуляторы дешевле и проще в установке по сравнению с ионно-литиевыми аккумуляторами. Цена литий-ионного аккумулятора в два раза выше свинцово-кислотного аккумулятора той же емкости. Однако, если сравнивать срок службы аккумуляторов, литий-ионный работает дольше, чем свинцово-кислотный. Следовательно, свинцово-кислотные батареи дешевле литий-ионных только для краткосрочного применения.
3. Емкость аккумулятора
Емкость батареи — это количество энергии, хранящейся в батарее на единицу объема. Это прямой индикатор активного материала, хранящегося внутри батареи. Литиевые аккумуляторы имеют большую емкость по сравнению со свинцово-кислотными аккумуляторами.
4. Плотность энергии или удельная энергия
Плотность энергии является важным фактором при определении типа батареи, необходимой для конкретного применения. Он указывает соотношение между емкостью батареи и весом батареи.
Он указывает соотношение между емкостью батареи и весом батареи.
Плотность энергии = (Номинальное напряжение батареи (В) x Номинальная емкость батареи (Ач)) ÷ Вес батареи.
Литиевые батареи имеют более высокую удельную энергию по сравнению со свинцово-кислотными батареями. Следовательно, литий-ионные аккумуляторы используются в приложениях для электромобилей.
5. Вес и размер
Значение плотности энергии и емкости литиевых батарей выше, чем у свинцово-кислотных батарей. Поэтому вес и размер литиевых аккумуляторов намного меньше по сравнению со свинцово-кислотными аккумуляторами той же емкости.
6. Глубина разряда (DOD)
Глубина разряда указывает максимальную энергию полностью заряженной батареи, которую можно использовать без подзарядки. Если глубина разряда батареи составляет 50 %, вы можете использовать до 50 % емкости батареи и перезаряжать ее. Если вы использовали его более чем на 50%, это повлияет на жизненный цикл батареи.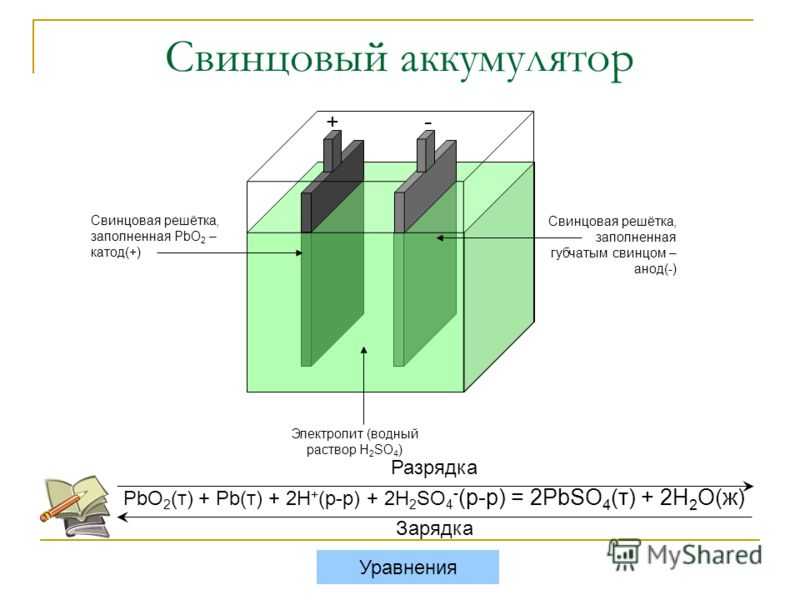 Глубина разряда составляет 50% для свинцово-кислотных аккумуляторов и 80% для литиевых аккумуляторов соответственно. Это означает, что вы можете использовать литий-ионный аккумулятор в течение более длительного периода времени без подзарядки. Современный литий-ионный аккумулятор, который производится сегодня, еще более эффективен, с глубиной разряда 100%.
Глубина разряда составляет 50% для свинцово-кислотных аккумуляторов и 80% для литиевых аккумуляторов соответственно. Это означает, что вы можете использовать литий-ионный аккумулятор в течение более длительного периода времени без подзарядки. Современный литий-ионный аккумулятор, который производится сегодня, еще более эффективен, с глубиной разряда 100%.
7. Долговечность
Срок службы батареи определяется временем, в течение которого она может работать. Свинцово-кислотные аккумуляторы могут работать до 2 лет при правильном обслуживании, т. е. подзарядке после 50% использования аккумулятора. Если он полностью слит или выше 80%, он может выдержать только 350 циклов или один год. Вместо этого литий-ионный аккумулятор имеет гарантийный срок 10 лет и может выдерживать 10 000 циклов.
8. Срок службы
Срок службы — это количество циклов зарядки и разрядки, которые батарея может выдержать без ущерба для своих характеристик. Обычно литий-ионные аккумуляторы имеют срок службы 5000 циклов, и полная разрядка не влияет на срок службы. В то время как свинцово-кислотный аккумулятор работает от 300 до 500 циклов. Полный разряд аккумулятора существенно влияет на его жизненный цикл.
Обычно литий-ионные аккумуляторы имеют срок службы 5000 циклов, и полная разрядка не влияет на срок службы. В то время как свинцово-кислотный аккумулятор работает от 300 до 500 циклов. Полный разряд аккумулятора существенно влияет на его жизненный цикл.
9. Время зарядки
Литий-ионные аккумуляторы заряжаются намного быстрее, чем свинцово-кислотные. Если для зарядки свинцово-кислотного аккумулятора требуется восемь часов, то для зарядки литий-ионного аккумулятора потребуется менее двух часов, при условии, что они оба имеют одинаковую емкость. Литий-ионные аккумуляторы заряжаются в восемь раз быстрее, чем свинцово-кислотные аккумуляторы. Это одна из причин, почему литий-ионные батареи используются в большинстве электромобилей.
10. Безопасность
Существует множество причин отказов батарей. Вы обязаны соблюдать осторожность при использовании аккумуляторов высокого напряжения. Как в свинцово-кислотных, так и в литий-ионных батареях перезарядка может привести к взрыву.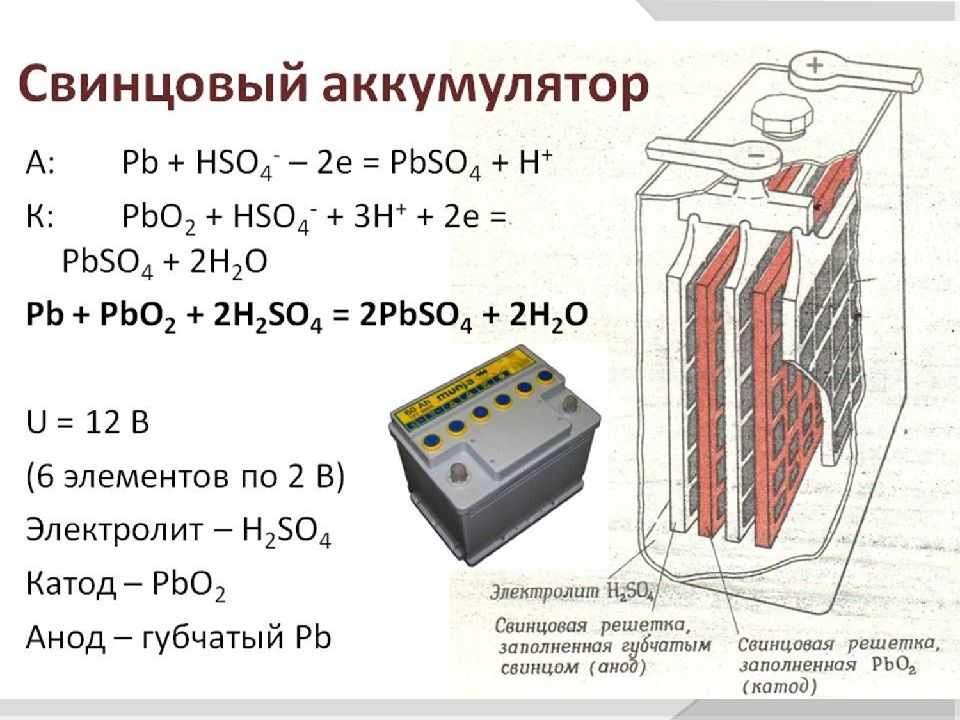
Серная кислота в свинцово-кислотном аккумуляторе обладает высокой коррозионной активностью, и существует вероятность утечки. При перезарядке могут выделяться газообразные водород и кислород, что приводит к взрыву. В литий-ионных батареях высока вероятность теплового разгона. Тепловой разгон — это состояние, когда тепло, выделяемое внутри батареи, превышает тепло, рассеиваемое в окружающую среду. Тепловой разгон также может вызвать взрыв батареи. Инженер BMS несет ответственность за создание надежных систем аккумуляторных батарей, чтобы снизить риск сбоев. CATL, Panasonic Corporation, Clarios и Bharat Power Solutions являются одними из ключевых игроков в производстве аккумуляторов. В зависимости от использования их рынок подразделяется на автомобильный, аэрокосмический, энергосберегающий, солнечный, военный, оборонный и другие. В каждом секторе есть набор рекомендаций, которым необходимо следовать при производстве аккумуляторов для обеспечения безопасности.
Чтобы сравнить преимущества свинцово-кислотных и литий-ионных аккумуляторов, необходимо сначала определиться с применением.
