Физики «усовершенствовали» теорию концентрированного электролита
Американские физики построили модель, с помощью которой можно быстро и точно оценить проводимость раствора с высокой концентрацией ионов. Для этого ученые «усовершенствовали» уравнение Нернста — Эйнштейна, включив в него кластеры ионов как отдельные большие частицы. Работу модели исследователи проверили на идеальном и реалистичном примере, в обоих случаях предсказанное значение проводимости отличалось от точного не более чем на четверть. Статья опубликована в Physical Review Letters, кратко о ней сообщает Physics, препринт работы выложен на сайте arXiv.org.
Эффективность работы аккумуляторной батареи зависит от того, насколько хорошо ее электролит проводит электрический ток. В частности, именно из-за падения проводимости электролита при низких температурах снижается эффективная емкость и максимальный ток отдачи аккумулятора. Казалось бы, это препятствие можно преодолеть, повышая концентрацию ионов (чем больше переносчиков заряда, тем меньше сопротивление и тем выше проводимость раствора). К сожалению, на практике этот наивный способ не работает: при высокой концентрации ионы взаимодействуют между собой и объединяются в группы по несколько частиц, то есть число переносчиков заряда и проводимость снова начинает снижаться. Следовательно, должна существовать оптимальная концентрация ионов, при которой проводимость электролита максимальна.
К сожалению, на практике этот наивный способ не работает: при высокой концентрации ионы взаимодействуют между собой и объединяются в группы по несколько частиц, то есть число переносчиков заряда и проводимость снова начинает снижаться. Следовательно, должна существовать оптимальная концентрация ионов, при которой проводимость электролита максимальна.
Хуже того, в настоящее время физики не могут теоретически объяснить этот эффект, хотя отчетливо наблюдают его на практике. С одной стороны, точный подход Эйнштейна, который учитывает попарные взаимодействия между всеми частицами в рамках теории линейного отклика, имеет слишком большую вычислительную сложность, а потому применить его на практике не удается. С другой стороны, уравнение Нернста — Эйнштейна, которое получается при усреднении корреляционных функций по всем частицам системы, позволяет делать осмысленные предсказания, но не ухватывает взаимодействие между ионами. Поэтому оно работает только для сильно разбавленных растворов с малой концентрацией ионов. В то же время, если бы физики умели оценивать проводимость растворов с произвольной концентрацией ионов, они могли бы быстро просканировать базы известных соединений и выбрать из них электролит с оптимальными параметрами. Пока же ученым приходится искать такое вещество наобум.
В то же время, если бы физики умели оценивать проводимость растворов с произвольной концентрацией ионов, они могли бы быстро просканировать базы известных соединений и выбрать из них электролит с оптимальными параметрами. Пока же ученым приходится искать такое вещество наобум.
Физики Артур Франс-Ланорд (Arthur France-Lanord) и Джефри Гроссман (Jeffrey Grossman) «усовершенствовали» уравнение Нернста — Эйнштейна, адаптировав его для растворов с высокой концентрацией ионов. Для этого ученые предложили усреднять корреляционные функции не по всем частицам, а по всем кластерам, в которые может входить как одна, так и несколько частиц. Все такие кластеры удобно описывать матрицей, на пересечении i-ой и j-ой строк которой стоит число кластеров, содержащих i ионов и j катионов. При этом коэффициент диффузии, который входит в уравнение Нернста — Эйнштейна, также заменяется матрицей, построенной из коэффициентов диффузии кластера соответствующего размера. С одной стороны, вычислительная сложность нового метода гораздо меньше, чем у подхода Эйнштейна.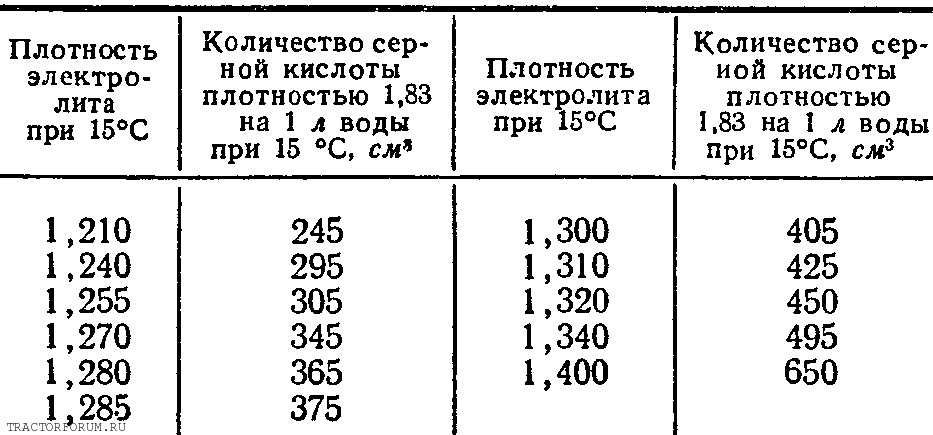 С другой стороны, усреднение точно учитывает взаимодействие частиц в рамках одного кластера, хотя и «теряет» силы, действующие между соседними кластерами. Поэтому ученые назвали новый подход «кластерным подходом Нернста — Эйнштейна».
С другой стороны, усреднение точно учитывает взаимодействие частиц в рамках одного кластера, хотя и «теряет» силы, действующие между соседними кластерами. Поэтому ученые назвали новый подход «кластерным подходом Нернста — Эйнштейна».
Чтобы оценить погрешность построенной модели, ученые проверили ее на примере идеального электролита, состоящего из трех типов частиц — растворителей, катионов и анионов. Для простоты физики пренебрегали электрическим притягиванием и отталкиванием частиц, то есть считали, то они взаимодействуют только за счет потенциала Леннард-Джонса. Чтобы воспроизвести реалистичную ситуацию, исследователи взяли систему из 2000 растворителей, 365 катионов и 365 анионов, поместили ее в кубическую коробку со стороной 58 ангстрем, нагрели до температуры 300 кельвинов и проследили за установлением теплового равновесия с помощью метода Монте-Карло. В результате ученые получили 90 независимых конфигураций с разными числами кластеров. Наконец, исследователи рассчитали проводимость полученного раствора для одной из нетривиальных конфигураций.
Как и ожидалось, подход Нернста — Эйнштейна предсказал неверное значение проводимости, завысив его почти в два раза. Точный подход Эйнштейна, напротив, предсказывал правильное значение проводимости, но очень медленно сходился (за 200 тысяч итераций его статистическая погрешность не упала ниже 16 процентов). В то же время, «промежуточная» модель объединяла преимущества обоих подходов: быстро сходилась (статистическая погрешность менее трех процентов) и предсказывала правильное значение проводимости (систематическая погрешность порядка трех процентов).
Затем физики также проверили новую модель на реалистичном примере — растворе соли LiTFSI в полиэтиленгликоле (PEO)9. Чтобы смоделировать ситуацию с сильной связью ионов, ученые рассмотрели систему со 150 молекулами соли и 200 полимерными цепочками. В этом случае ученые уже не пренебрегали электростатическими силами. Так же, как и в идеальном случае, исследователи смоделировали равновесные распределения молекул при температуре 363 кельвина, а потом рассчитали проводимость раствора для наиболее вероятной нетривиальной конфигурации. Важно, что проводимость такой системы уже была экспериментально измерена в позапрошлом году, что позволило физикам сравнить теоретическое предсказание с реальностью.
Важно, что проводимость такой системы уже была экспериментально измерена в позапрошлом году, что позволило физикам сравнить теоретическое предсказание с реальностью.
Так же, как и в идеальном случае, подход Нернста — Эйнштейна существенно завышал проводимость раствора, а точный подход Эйнштейна очень медленно сходился (авторы статьи отмечают, что они не увидели даже признаков сходимости). Тем не менее, «кластерный подход Нернста — Эйнштейна» в этом случае работал замечательно: быстро сходился и предсказывал проводимость, которая отличалась от истинного значения не более чем на четверть. Таким образом, авторы заключают, что предложенный ими метод не только позволяет понять физику растворов с высокой концентрацией ионов, но и получить правдоподобные оценки для их проводимости.
Хотя аккумуляторы уже сейчас представляют собой надежный и удобный источник энергии, ученые постоянно стараются улучить их свойства. Например, в марте прошлого года китайские химики разработали электролит, который позволяет литий-ионному аккумулятору работать при температуре −70 градусов Цельсия. В апреле того же года другая группа исследователей повысила безопасность литий-ионного аккумулятора, добавив в его электролит наностержни из бората магния. Кроме того, параллельно ученые разрабатывают альтернативные конструкции аккумуляторов, например, натрий-ионные или литий-воздушные батареи. Про такие перспективные конструкции можно прочитать в материале «Химия и ток».
В апреле того же года другая группа исследователей повысила безопасность литий-ионного аккумулятора, добавив в его электролит наностержни из бората магния. Кроме того, параллельно ученые разрабатывают альтернативные конструкции аккумуляторов, например, натрий-ионные или литий-воздушные батареи. Про такие перспективные конструкции можно прочитать в материале «Химия и ток».
Дмитрий Трунин
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Концентрация раствора электролита | Задачи 545
Задача 545.
Чему равна концентрация раствора уксусной кислоты, рН которого равен 5,2?
Решение:
KD(CH3COOH) = 1,8 . 10-5.
Согласно условию задачи -lg[H+] = 5,2. Следовательно, -lg[H+] = 5,2 = 6,8. По таблице логарифмов находим:
[H+] = 6,31 .10-5 моль/л.
Концентрации ионов [H+] и ионов [CH3COO—] в растворе CH3COOH равны:
CH3COOH ⇔ CH3COO— + H+
Обозначим искомую концентрацию уксусной кислоты через x и найдём его значение из выражения константы диссоциации, получим:
Ответ: CM = 2,2
Задача 546.
Вычислить значения (OH—) и p(OH) в 0,2 н. растворе NaОН, считая f(OH—) = 0,80.
Решение:
Для электролитов, состоящих из однозарядных ионов, значение ионной силы раствора численно равно концентрации раствора, в данном случае: I(NaOH) = 0,20. При ионной силе равной 0,2 и при коэффициенте активности иона равному 0,80 можно рассчитать значения активностей ионов по формуле (ион) = fCM, получим:
(OH—) = 0,80 . 0,20 = 0,16 моль/л.
Теперь рассчитаем значение p(OH—):
p(OH—) = -(OH—) = -lg1,6 . 10-1 = 1 — lg1,6 = 0,8.
Ответ: p(OH-) = 0,8, (OH—) = 1,6 .
10-1 моль/л.Задача 547.
Используя данные табл. 7 приложения, найти p(H+) 0,005 н. раствора НСI, содержащего, кроме того, 0,015 моль/л NаС1.
Решение:
Для электролитов, состоящих из однозарядных ионов, значение ионной силы раствора численно равно концентрации раствора, в данном случае: I = 0,005 + 0,015 = 0,02.
При этой ионной силе коэффициент активности однозарядного иона равен 0,90. Активную концентрацию иона водорода рассчитаем по формуле (ион) = fCM, где f — коэффициент активности иона, СМ – концентрация раствора, получим:
(H+) = 0,02 .0,9 = 1,8 . 10-2 моль/л.
Теперь находим значение p(H+):
p(H+) = -(H+) = -lg1,8
Ответ: p(H+) = 1,75.
Задачи 548.
Степень диссоциации слабой одноосновной кислоты в 0,2 н. растворе равна 0,03. Вычислить значения [H+], [OH—] и pOH для этого раствора.
Решение:
Находим концентрацию ионов водорода:
[H+] = . CM = 0,2 . 0,03 = 6 .10-3 моль/л.
Концентрацию гидроксид-ионов находим из соотношения:
pH2O = [H+] . [OH—] = 10-14; [OH—] = (10-14)/(6 . 10-3) = 1,7 . 10-12.
Отсюда
pОН = lg[OH—] = -lg1,7 . 10-12 = 12 — lg1,7 = 12 — 0,23 = 11,77.
10-12 = 12 — lg1,7 = 12 — 0,23 = 11,77.
Ответ: [H+] = 6 . 10-3 моль/л; [OH—] = 1,7 . 10-12; pОН = 11,77.
Концентрационная поляризация и инициирование металлических дендритов в изолированных электролитных микроканалах
Ёнджу Ли, и Бинъюань Ма и и Пэн Бай * аб
Принадлежности автора
* Соответствующие авторы
Электронная почта: pbai@wustl.
 edu
eduб Институт материаловедения и инженерии Вашингтонского университета в Сент-Луисе, Брукингс Драйв, 1, Сент-Луис, Миссури, 63130, США
Аннотация
Проникновение металлического лития через смоченный жидким электролитом пористый сепаратор и твердые электролиты является серьезной проблемой безопасности перезаряжаемых металлических батарей следующего поколения. Часто обнаруживалось, что проникновения происходят только через несколько изолированных каналов, о чем свидетельствуют «черные пятна» на обеих сторонах сепаратора или электролита, которые демонстрируют сильно локализованный ионный поток или плотность тока. Прогнозирование времени проникновения было затруднено из-за скрытой и неясной динамики этих каналов проникновения. Здесь, используя стеклянные капиллярные ячейки, мы впервые исследуем неожиданно чувствительное влияние геометрии канала на концентрационную поляризацию и процессы инициации дендритов. Характерное время полного истощения концентрации соли на поверхности продвигающегося электрода,
Прогнозирование времени проникновения было затруднено из-за скрытой и неясной динамики этих каналов проникновения. Здесь, используя стеклянные капиллярные ячейки, мы впервые исследуем неожиданно чувствительное влияние геометрии канала на концентрационную поляризацию и процессы инициации дендритов. Характерное время полного истощения концентрации соли на поверхности продвигающегося электрода, 
8.10.9C: Слабые и сильные электролиты
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 20111
- Стивен Лоуэр
- Университет Саймона Фрейзера
Серьезное изучение растворов электролитов началось во второй половине 19 века, в основном в Германии, и до того, как были хорошо изучены детали диссоциации и ионизации. Эти исследования показали, что все эквивалентные электропроводности электролитов уменьшаются с концентрацией (или, точнее, с квадратным корнем из концентрации), но они делают это несколькими различными способами, которые различаются их поведением при очень малых концентрациях.
Вы заметите, что графики зависимости проводимости от √ c начинаются с c =0. Измерить электропроводность электролита при исчезающе малых концентрациях (не говоря уже о нулевых!), конечно, невозможно, но для сильных и средних электролитов можно экстраполировать ряд наблюдений к нулю. Полученные значения известны как предельные эквивалентные проводимости или иногда как «эквивалентные проводимости при бесконечном разбавлении», обозначаемые Λ°.
- Сильные электролиты
- Эти системы с хорошим поведением включают многие простые соли, такие как NaCl, а также все сильные кислоты.
Графики Λ по сравнению с √c близко соответствуют линейной зависимости - Λ = Λ° – б √ в
- Промежуточные электролиты
- Эти «не очень сильные» соли не могут полностью соответствовать приведенному выше линейному уравнению, но их электропроводность можно экстраполировать до бесконечного разбавления.

- Слабые электролиты
- «Чем меньше, тем лучше» для этих странностей, обладающих замечательной способностью проявлять бесконечную эквивалентную проводимость при бесконечном разбавлении. Хотя Λ° нельзя оценить экстраполяцией, существует умный обходной путь.
Проводимость уменьшается по мере увеличения концентрации
Поскольку переносчиками заряда являются ионы, можно ожидать, что проводимость раствора будет прямо пропорциональна их концентрации в растворе. Таким образом, если электролит полностью диссоциирован, проводимость должна быть прямо пропорциональна концентрации электролита. Но это идеальное поведение никогда не наблюдается; вместо этого проводимость электролитов всех видов уменьшается по мере увеличения концентрации.
Неидеальность электролитических растворов также отражается на их коллигативных свойствах, особенно понижении температуры замерзания и осмотического давления. Основной причиной этого является наличие ионной атмосферы, которая была введена выше. В той мере, в какой ионы, имеющие противоположные знаки заряда, с большей вероятностью будут располагаться ближе друг к другу, можно ожидать, что их заряды частично компенсируются, уменьшая их тенденцию к миграции в ответ на приложенный градиент потенциала.
В той мере, в какой ионы, имеющие противоположные знаки заряда, с большей вероятностью будут располагаться ближе друг к другу, можно ожидать, что их заряды частично компенсируются, уменьшая их тенденцию к миграции в ответ на приложенный градиент потенциала.
Вторичный эффект возникает из-за того, что когда ион мигрирует через раствор, его противоионное облако не поспевает за ним. Вместо этого новые противоионы постоянно приобретаются на переднем фронте движения, в то время как существующие остаются позади на противоположной стороне. Для рассеивания потерянных противоионов требуется некоторое время, поэтому на заднем фронте всегда больше противоионов. Возникающая в результате асимметрия поля противоиона оказывает тормозящее действие на центральный ион, уменьшая скорость его миграции и, таким образом, его вклад в проводимость раствора.
Количественная трактовка этих эффектов была впервые разработана П. Дебаем и В. Хюкелем в начале 1920-х гг. и несколько лет спустя усовершенствована Оствальдом. Эта работа представляет собой одно из основных достижений физической химии в первой половине 20-го века и ставит поведение электролитических растворов на прочную теоретическую основу. Даже в этом случае теория Дебая-Хюккеля не работает для концентраций, превышающих примерно 10 –3 М·л –1 для большинства ионов.
Эта работа представляет собой одно из основных достижений физической химии в первой половине 20-го века и ставит поведение электролитических растворов на прочную теоретическую основу. Даже в этом случае теория Дебая-Хюккеля не работает для концентраций, превышающих примерно 10 –3 М·л –1 для большинства ионов.
Не все электролиты полностью диссоциируют в растворе
графиков для сильных электролитов в значительной степени объясняется эффектами, обсуждаемыми непосредственно выше. Существование промежуточных электролитов послужило первым указанием на то, что многие соли не полностью ионизированы в воде; вскоре это было подтверждено измерениями их коллигативных свойств.
Кривизна графиков для промежуточных электролитов является простым следствием эффекта Ле Шателье, который предсказывает, что равновесие 9–_{(aq)}\]
будет смещаться влево по мере увеличения концентрации «свободных» ионов. В более разбавленных растворах реальные концентрации этих ионов меньше, но их относительное содержание по отношению к недиссоциированной форме больше. Когда раствор приближается к нулевой концентрации, практически все \(MX_{(aq)}\) диссоциируют, и проводимость достигает своего предельного значения.
В более разбавленных растворах реальные концентрации этих ионов меньше, но их относительное содержание по отношению к недиссоциированной форме больше. Когда раствор приближается к нулевой концентрации, практически все \(MX_{(aq)}\) диссоциируют, и проводимость достигает своего предельного значения.
Слабые электролиты диссоциируют только при очень сильном разбавлении
| плавиковая кислота | ВЧ | К a = 10 –3,2 |
| уксусная кислота | СН 3 СООН | К а = 10 –6,3 |
| ион бикарбоната | HCO 3 – | К а = 10 –10,3 |
| аммиак | НХ 3 | К б = 10 –4,7 |
Диссоциация, конечно, зависит от степени. Константы равновесия для диссоциации соли промежуточного электролита MX обычно находятся в диапазоне 1-200. Это контрастирует с большим количеством слабых кислот (а также слабых оснований), чьи константы диссоциации обычно находятся в диапазоне от 10 –3 до менее 10 –10 .
Константы равновесия для диссоциации соли промежуточного электролита MX обычно находятся в диапазоне 1-200. Это контрастирует с большим количеством слабых кислот (а также слабых оснований), чьи константы диссоциации обычно находятся в диапазоне от 10 –3 до менее 10 –10 .
Эти слабые электролиты, как и промежуточные, полностью диссоциируют на пределе нулевой концентрации; если масштаб показанного выше графика слабого электролита (синий) увеличить на много порядков, кривая будет напоминать кривую для промежуточного электролита над ней, и значение Λ° можно будет найти путем экстраполяции. Но при таком сильном разбавлении проводимость была бы настолько незначительной, что ее маскировала бы проводимость самой воды (то есть H + и ионы ОН – в равновесии с массивной концентрацией воды 55,6 М л –1 ), что делает значения Λ в этой области практически неизмеримыми.
Эта страница под названием 8.
