ПАРАМЕТРЫ СОСТОЯНИЯ | это… Что такое ПАРАМЕТРЫ СОСТОЯНИЯ?
ТолкованиеПеревод
- ПАРАМЕТРЫ СОСТОЯНИЯ
- ПАРАМЕТРЫ СОСТОЯНИЯ
-
(термодинамические параметры), физ. величины, характеризующие состояние термодинамич. системы: темп-pa, давление, уд. объём, намагниченность, электрич. поляризация и др. Различают э к с т е н с и в н ы е П. с., пропорц. массе системы, и и н т е н с и в н ы е П. с., не зависящие от массы системы. К экстенсивным П. с. относятся объём, внутренняя энергия, энтропия, энтальпия, Гиббса энергия, Гельмгольца энергия (свободная энергия), к интенсивным — давление, темп-pa, концентрация, магн. индукция и др. Не все П. с. независимы, так что равновесное состояние системы можно однозначно определить, установив значения огранич. числа П. с.
 (см. УРАВНЕНИЕ СОСТОЯНИЯ, ГИББСА ПРАВИЛО ФАЗ).
(см. УРАВНЕНИЕ СОСТОЯНИЯ, ГИББСА ПРАВИЛО ФАЗ).
Физический энциклопедический словарь. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1983.
- ПАРАМЕТРЫ СОСТОЯНИЯ
-
(термодинамическиепараметры) — физ. величины, характеризующие равновесное состояние термодинамич. плотность, давление, намагниченность, электрич. внутренняя энергия U, энтропия S, энтальпия Н, Гельмголъцаэнергия, или свободная энергия F, Гиббса энергия G), и интенсивныеП. с., не зависящие от массы системы (темп-pa Т, давление Р,концептрация с, хим. потенциал ).В состоянии термодинамич. равновесия П. с. не зависят от времени и пространств. Термодииамич. состояние определяется заданиемсовокупности независимых П. с. Однако не все П. с. являются независимыми. Уравнениесостояния выражает зависимые П.
с. через независимые; напр., давлениеявляется ф-цией темп-ры и объёма Р = P(V, Т). Объём является внешнимП. с., т. к. определяется положением внеш. тел (стенки сосуда, положениепоршня). Темп-pa зависит только от внутр. состояния системы и наз. внутреннимП. с. В общем случае Р= Р(а1,…, а п, Т), где а i — внеш. П. с.
Элементарная работа термодинамич. системы определяется П. с., напр. для жидкости или газа = PdV, а в общем случае где Х i = Х i (а1,…, а п, Т) — обобщённые силы, являющиеся также П. с. Каждому набору независимыхП. с. соответствуют определ. потенциалы термодинамические (характеристическиефункции), определяющие все термодинамич. свойства системы и зависящиелишь от выбранных параметров; напр., внутр. энергия Для многокомпонентных систем нужно учитыватьещё дополнит. П. с.: концентрации компонент с i или иххим. потенциалы .Для многофазных систем каждая фаза описывается своим парциальным термодинамич. Гиббса правило фаз).
Для многокомпонентных систем нужно учитыватьещё дополнит. П. с.: концентрации компонент с i или иххим. потенциалы .Для многофазных систем каждая фаза описывается своим парциальным термодинамич. Гиббса правило фаз).Д. Н. Зубарев.
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1988.
.
Игры ⚽ Нужен реферат?
- ПАРАМЕТРИЧЕСКИЙ РЕЗОНАНС
- ПАРАПРОЦЕСС
Полезное
Определение параметров состояния рабочего тела и эксергии в характерных точках цикла
Другие предметы \ Термодинамика
Страницы работы
7 страниц (Word-файл)
Посмотреть все страницы
Скачать файл
Содержание работы
Дан двигатель внутреннего
сгорания.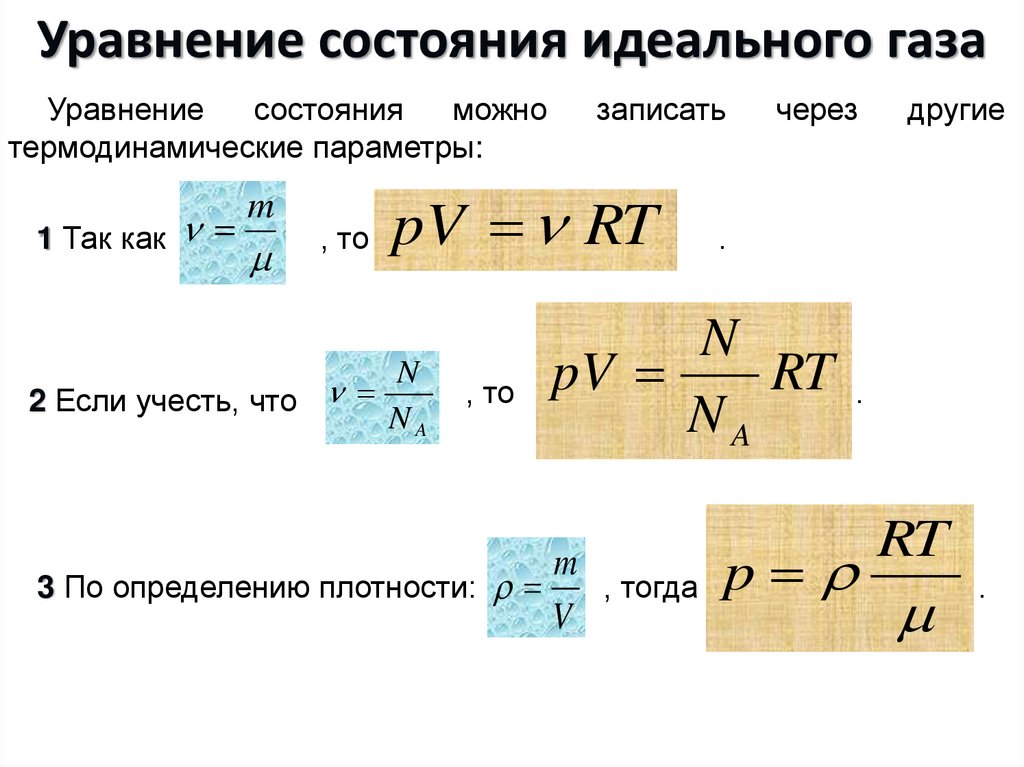 Рабочее тело обладает свойствами идеального газа N2.
заданы начальные параметры состояния газа и основные характеристики цикла: Р1=0,095
МПа, t1 = 20 oC, ε = V1/V2 = 5,5, λ = Р3/Р2 = 1,6, ρ
= V4/V3 =
1,55, ηoi = 0,88, n = 1,25.
Рабочее тело обладает свойствами идеального газа N2.
заданы начальные параметры состояния газа и основные характеристики цикла: Р1=0,095
МПа, t1 = 20 oC, ε = V1/V2 = 5,5, λ = Р3/Р2 = 1,6, ρ
= V4/V3 =
1,55, ηoi = 0,88, n = 1,25.
I. Определить параметры состояния рабочего тела и эксергию в характерных точках цикла.
Параметры состояния в характерных точках цикла Таблица 1
Параметры | р | Т | v | u | h | so | s | ех |
Размерность Точки | МПа | К | м3/кг | кДж/кг | кДж/кг | кДж/кгК | кДж/кгК | кДж/кг |
1 | 0,095 | 293 | 0,916 | 217,08 | 304,09 | 6,8184 | 0 | -4,0996 |
2 | 1,021 | 574 | 0,167 | 428,614 | 599,03 | 7,52285 | 0 | 291,0668 |
3 | 1,633 | 918 | 0,167 | 708,075 | 980,585 | 8,0421 | 0,37977 | 565,1384 |
4 | 1,633 | 1424 | 0,259 | 1163,789 | 1586,476 | 8,56637 | 0,90404 | 1022,6808 |
5 | 0,337 | 1039 | 0,916 | 812,924 | 1121,346 | 8,18608 | 0,99244 | 532,5053 |
1. Из уравнения состояния найдем v1:
Из уравнения состояния найдем v1:
, где R = 297 Дж/кгК
2. Из коэффициента сжатия газа ε найдем v2
найдем термодинамическую функцию θ02 через известные объемы газа
находим по таблице Ривкина Т2 = 574 К и из уравнения состояния находим р2:
3. Так как процесс 2-3 изохорный, т.е. v = const, то v2 = v3. Из степени повышения давления λ найдем р3:
Из уравнения состояния найдем Т3:
4. Так как процесс 3-4 изобарный,
т.е. р = const, то р3 = р
Из уравнения состояния найдем Т4:
5. Так как процесс 5-1 изохорный, т.е. v = const, то v5 = v1; n = 1,25
6. Найдем энтропию
s1 = 0, по условию задачи
s2 = s1 + ∆s1-2 = 0 + 0 = 0 кДж/кгК
s3 = s2 + ∆s2-3 = 0 + 0,37977 = 0,37977 кДж/кгК
s4 = s3 + ∆s3-4 = 0,37977 + 0,52427 = 0,90404 кДж/кгК
s5 = s4 + ∆s4-5 = 0,90404 + 0,0884 = 0,99244 кДж/кгК
7. Найдем эксергию
Найдем эксергию
ро = 0,1 МПа, To = 283 К, ho = 293,7 кДж/кг, soо = 6,7824 кДж/кгК
эксергию будем считать как эксергию потока:
ex =
кДж/кгК
кДж/кгК
кДж/кгК
кДж/кгК
кДж/кгК
ex1 = кДж/кг
ex2 = кДж/кг
ex3 = кДж/кг
ex4 = кДж/кг
ex5 = кДж/кг
II. Определить изменение внутренней энергии, энтальпии и энтропии, работу расширения (сжатия), полезную работу и подведенную (отведенную) теплоту в каждом процессе и в целом за цикл.
Характеристики процессов Таблица 2
Характеристики | ∆u | ∆h | ∆s | lрасш | q | |
Размерность Процессы | кДж/кг | кДж/кг | кДж/кгК | кДж/кг | кДж/кг | кДж/кг |
1-2-адиабатный | 211,534 | 294,94 | 0 | -211,534 | -294,94 | 0 |
2-3-изохорный | 279,461 | 381,555 | 0,37997 | 0 | -102,204 | 279,461 |
3-4-изобарный | 455,714 | 605,891 | 0,52247 | 150,282 | 0 | 605,891 |
4-5-политропный | -350,865 | -465,13 | 0,0884 | 457,38 | 571,725 | 106,595 |
5-1-изохорный | -595,84 | -817,256 | -0,9916 | 0 | 221,672 | -595,84 |
За цикл | 0 | 0 | -0,00076 | 396,128 | 396,253 | 396,107 |
1. Найдем изменение внутренней энергии
Найдем изменение внутренней энергии
1-2: ∆u = u2 — u1 = 428,6142 — 217,08 = 211,534 кДж/кг
2-3: ∆u = u3 — u2 = 708,075 — 428,614 = 279,461 кДж/кг
3-4: ∆u = u4 — u3 = 1163,789 — 708,075 = 455,714 кДж/кг
4-5: ∆u = u5 — u4 = 812,924 — 1163,789 = -350,865 кДж/кг
5-1: ∆u = u1 — u5 = 217,08 — 812,924 = -595,84 кДж/кг
∆uц = ∆u1-2 + ∆u2-3 + ∆u3-4 + ∆u4-5 + ∆u5-1 = 211,534 + 279,461 + 455,714 — 350,865 — 595,84 =
= 0 кДж/кг
2. Найдем изменение энтальпии
1-2: ∆h = h2 — h1 = 599,03 — 304,09 = 294,93 кДж/кг
2-3: ∆h = h3 — h2 = 9810,585 — 599,03 = 381,555 кДж/кг
3-4: ∆h = h4 — h3 = 1596,476 — 980,585 = 605,891 кДж/кг
4-5: ∆h = h5 — h4 = 1121,346 — 1586,476 = -465,13 кДж/кг
5-1: ∆h = h1 — h5 = 304,09 — 1121,346 = -817,256 кДж/кг
∆hц= ∆h1-2 + ∆h2-3 + ∆h3-4 + ∆h4-5 + ∆h5-1 = 294,94 + 381,555 + 605,891 — 465,13 — 817,256 =
= 0 кДж/кг
3. Найдем изменение энтропии
Найдем изменение энтропии
1-2: ∆S = 0, т.к. процесс адиабатный
2-3: кДж/кгК
3-4: кДж/кгК
4-5: кДж/кгК
5-1: кДж/кгК
∆Sц = ∆S1-2 + ∆S2-3 + ∆S3-4 + ∆S4-5 + ∆S5-1 = 0 + 0,37977 + 0,52427 + 0,884 — 0,9916 =
= -0,00076 кДж/кгК
4.Найдем работу расширения
1-2: lрасш = -∆u = u1 — u2 = 217,08 — 428,614 = -211,534 кДж/кг
2-3: lрасш = 0 кДж/кг, т.к. процесс изохорный
3-4: lрасш = кДж/кг
4-5: lрасш =
n = 1,25-показатель политропы
lрасш = кДж/кг
5-1: lрасш = 0 кДж/кг, т.к. процесс изохорный
lрасшц = lрасш1-2 + lрасш2-3 + lрасш3-4 + lрасш4-5 + lрасш5-1 = -211,534 + 0 + 150,282 + 457,38 + 0=
= 396,128 кДж/кг
5. Найдем полезную работу
Найдем полезную работу
1-2: lпол = -∆h = h1 — h2 = 304,09 — 599,03 = -294,94 кДж/кг
2-3: lпол = кДж/кг
3-4: lпол = 0 кДж/кг, т.к. процесс изобарный
4-5: lпол = кДж/кг
5-1: lпол = кДж/кг
lполц = lпол1-2 + lпол2-3 + lпол3-4 + lпол4-5 + lпол5-1 = -294,94 — 102,204 + 0 + 571,725 + 221,672 =
= 396,253 кДж/кг
Похожие материалы
Информация о работе
Скачать файл
Выбери свой ВУЗ
- АлтГТУ 419
- АлтГУ 113
- АмПГУ 296
- АГТУ 267
- БИТТУ 794
- БГТУ «Военмех» 1191
- БГМУ 172
- БГТУ 603
- БГУ 155
- БГУИР 391
- БелГУТ 4908
- БГЭУ 963
- БНТУ 1070
- БТЭУ ПК 689
- БрГУ 179
- ВНТУ 120
- ВГУЭС 426
- ВлГУ 645
- ВМедА 611
- ВолгГТУ 235
- ВНУ им.
 Даля 166
Даля 166 - ВЗФЭИ 245
- ВятГСХА 101
- ВятГГУ 139
- ВятГУ 559
- ГГДСК 171
- ГомГМК 501
- ГГМУ 1966
- ГГТУ им. Сухого 4467
- ГГУ им. Скорины 1590
- ГМА им. Макарова 299
- ДГПУ 159
- ДальГАУ 279
- ДВГГУ 134
- ДВГМУ 408
- ДВГТУ 936
- ДВГУПС 305
- ДВФУ 949
- ДонГТУ 498
- ДИТМ МНТУ 109
- ИвГМА 488
- ИГХТУ 131
- ИжГТУ 145
- КемГППК 171
- КемГУ 508
- КГМТУ 270
- КировАТ 147
- КГКСЭП 407
- КГТА им.
 Дегтярева 174
Дегтярева 174 - КнАГТУ 2910
- КрасГАУ 345
- КрасГМУ 629
- КГПУ им. Астафьева 133
- КГТУ (СФУ) 567
- КГТЭИ (СФУ) 112
- КПК №2 177
- КубГТУ 138
- КубГУ 109
- КузГПА 182
- КузГТУ 789
- МГТУ им. Носова 369
- МГЭУ им. Сахарова 232
- МГЭК 249
- МГПУ 165
- МАИ 144
- МАДИ 151
- МГИУ 1179
- МГОУ 121
- МГСУ 331
- МГУ 273
- МГУКИ 101
- МГУПИ 225
- МГУПС (МИИТ) 637
- МГУТУ 122
- МТУСИ 179
- ХАИ 656
- ТПУ 455
- НИУ МЭИ 640
- НМСУ «Горный» 1701
- ХПИ 1534
- НТУУ «КПИ» 213
- НУК им.
 Макарова 543
Макарова 543 - НВ 1001
- НГАВТ 362
- НГАУ 411
- НГАСУ 817
- НГМУ 665
- НГПУ 214
- НГТУ 4610
- НГУ 1993
- НГУЭУ 499
- НИИ 201
- ОмГТУ 302
- ОмГУПС 230
- СПбПК №4 115
- ПГУПС 2489
- ПГПУ им. Короленко 296
- ПНТУ им. Кондратюка 120
- РАНХиГС 190
- РОАТ МИИТ 608
- РТА 245
- РГГМУ 117
- РГПУ им.
 Герцена 123
Герцена 123 - РГППУ 142
- РГСУ 162
- «МАТИ» — РГТУ 121
- РГУНиГ 260
- РЭУ им. Плеханова 123
- РГАТУ им. Соловьёва 219
- РязГМУ 125
- РГРТУ 666
- СамГТУ 131
- СПбГАСУ 315
- ИНЖЭКОН 328
- СПбГИПСР 136
- СПбГЛТУ им. Кирова 227
- СПбГМТУ 143
- СПбГПМУ 146
- СПбГПУ 1599
- СПбГТИ (ТУ) 293
- СПбГТУРП 236
- СПбГУ 578
- ГУАП 524
- СПбГУНиПТ 291
- СПбГУПТД 438
- СПбГУСЭ 226
- СПбГУТ 194
- СПГУТД 151
- СПбГУЭФ 145
- СПбГЭТУ «ЛЭТИ» 379
- ПИМаш 247
- НИУ ИТМО 531
- СГТУ им.
 Гагарина 114
Гагарина 114 - СахГУ 278
- СЗТУ 484
- СибАГС 249
- СибГАУ 462
- СибГИУ 1654
- СибГТУ 946
- СГУПС 1473
- СибГУТИ 2083
- СибУПК 377
- СФУ 2424
- СНАУ 567
- СумГУ 768
- ТРТУ 149
- ТОГУ 551
- ТГЭУ 325
- ТГУ (Томск) 276
- ТГПУ 181
- ТулГУ 553
- УкрГАЖТ 234
- УлГТУ 536
- УИПКПРО 123
- УрГПУ 195
- УГТУ-УПИ 758
- УГНТУ 570
- УГТУ 134
- ХГАЭП 138
- ХГАФК 110
- ХНАГХ 407
- ХНУВД 512
- ХНУ им.
 Каразина 305
Каразина 305 - ХНУРЭ 325
- ХНЭУ 495
- ЦПУ 157
- ЧитГУ 220
- ЮУрГУ 309
Термодинамика | Законы, определения и уравнения
- Ключевые люди:
- Макс Планк Джеймс Клерк Максвелл Гилберт Н. Льюис Дж. Уиллард Гиббс Илья Пригожин
- Похожие темы:
- нагревать законы термодинамики энергия Транспортное уравнение Больцмана система
Просмотреть весь соответствующий контент →
Популярные вопросы
Что такое термодинамика?
Термодинамика изучает отношения между теплом, работой, температурой и энергией. Законы термодинамики описывают, как изменяется энергия в системе и может ли система выполнять полезную работу над окружающей средой.
Является ли термодинамика физикой?
Да, термодинамика — это раздел физики, изучающий изменение энергии в системе. Ключевое понимание термодинамики заключается в том, что тепло — это форма энергии, соответствующая механической работе (то есть действующая на объект сила на расстоянии).
Сводка
Прочтите краткий обзор этой темы
термодинамика , наука о взаимосвязи между теплом, работой, температурой и энергией. В широком смысле термодинамика имеет дело с переносом энергии из одного места в другое и из одной формы в другую. Ключевое понятие состоит в том, что теплота — это форма энергии, соответствующая определенному количеству механической работы.
Тепло не было официально признано формой энергии примерно до 179 г.8, когда граф Румфорд (сэр Бенджамин Томпсон), британский военный инженер, заметил, что при сверлении пушечных стволов может выделяться неограниченное количество тепла и что количество выделяемого тепла пропорционально работе, выполняемой при повороте тупого сверлильного инструмента. . Наблюдение Румфордом пропорциональности между произведенным теплом и выполненной работой лежит в основе термодинамики. Другим пионером был французский военный инженер Сади Карно, который в 1824 г. ввел понятие теплового цикла и принцип обратимости. высокотемпературный теплообмен как его движущая сила. Позже в том же столетии эти идеи были развиты Рудольфом Клаузиусом, немецким математиком и физиком, в первый и второй законы термодинамики соответственно.
. Наблюдение Румфордом пропорциональности между произведенным теплом и выполненной работой лежит в основе термодинамики. Другим пионером был французский военный инженер Сади Карно, который в 1824 г. ввел понятие теплового цикла и принцип обратимости. высокотемпературный теплообмен как его движущая сила. Позже в том же столетии эти идеи были развиты Рудольфом Клаузиусом, немецким математиком и физиком, в первый и второй законы термодинамики соответственно.
Наиболее важные законы термодинамики:
Нулевой закон термодинамики. Когда две системы находятся в тепловом равновесии с третьей системой, первые две системы находятся в тепловом равновесии друг с другом. Это свойство делает целесообразным использование термометров в качестве «третьей системы» и для определения температурной шкалы.
Первый закон термодинамики или закон сохранения энергии. Изменение внутренней энергии системы равно разнице между теплом, переданным системе из окружающей среды, и работой, совершенной системой над окружающей средой.

Второй закон термодинамики. Теплота не перетекает самопроизвольно из более холодной области в более горячую, или, что то же самое, теплота при данной температуре не может быть полностью преобразована в работу. Следовательно, энтропия замкнутой системы, или тепловая энергия на единицу температуры, со временем увеличивается до некоторого максимального значения. Таким образом, все закрытые системы стремятся к равновесному состоянию, в котором энтропия максимальна и нет энергии для выполнения полезной работы.
Третий закон термодинамики. Энтропия идеального кристалла элемента в его наиболее стабильной форме стремится к нулю, когда температура приближается к абсолютному нулю. Это позволяет установить абсолютную шкалу энтропии, которая со статистической точки зрения определяет степень случайности или беспорядка в системе.
Хотя термодинамика быстро развивалась в 19 веке в связи с необходимостью оптимизации характеристик паровых двигателей, широкая общность законов термодинамики делает их применимыми ко всем физическим и биологическим системам. В частности, законы термодинамики дают полное описание всех изменений энергетического состояния любой системы и ее способности совершать полезную работу над своим окружением.
В частности, законы термодинамики дают полное описание всех изменений энергетического состояния любой системы и ее способности совершать полезную работу над своим окружением.
Эта статья посвящена классической термодинамике, которая не включает рассмотрение отдельных атомов или молекул. Такие проблемы находятся в центре внимания раздела термодинамики, известного как статистическая термодинамика или статистическая механика, которая выражает макроскопические термодинамические свойства с точки зрения поведения отдельных частиц и их взаимодействий. Она уходит своими корнями во вторую половину XIX века, когда стали общепринятыми атомарные и молекулярные теории материи.
Фундаментальные понятия
Термодинамические состояния
Применение термодинамических принципов начинается с определения системы, которая в некотором смысле отличается от своего окружения. Например, системой может быть образец газа внутри цилиндра с подвижным поршнем, целая паровая машина, марафонец, планета Земля, нейтронная звезда, черная дыра или даже вся Вселенная. В общем, системы могут свободно обмениваться теплом, работой и другими формами энергии со своим окружением.
В общем, системы могут свободно обмениваться теплом, работой и другими формами энергии со своим окружением.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Состояние системы в любой момент времени называется ее термодинамическим состоянием. Для газа в цилиндре с подвижным поршнем состояние системы определяется по температуре, давлению и объему газа. Эти свойства являются характеристическими параметрами, которые имеют определенные значения в каждом состоянии и не зависят от того, каким образом система пришла в это состояние. Другими словами, любое изменение значения свойства зависит только от начального и конечного состояний системы, а не от пути, пройденного системой из одного состояния в другое. Такие свойства называются функциями состояния. Напротив, работа, совершаемая при движении поршня и расширении газа, и тепло, поглощаемое газом из окружающей среды, зависят от подробного способа, которым происходит расширение.
Поведение сложной термодинамической системы, такой как атмосфера Земли, можно понять, если сначала применить принципы состояний и свойств к ее составным частям — в данном случае к воде, водяному пару и различным газам, составляющим атмосферу. Изолируя образцы материала, состояния и свойства которых можно контролировать и манипулировать ими, можно изучать свойства и их взаимосвязи по мере изменения системы от состояния к состоянию.
Определение уравнения состояния (EOS)
Печать
В предположении состояния равновесия для полного определения состояния системы необходимы три свойства: давление (P), объем (V) и температура (T). Следовательно, мы должны быть в состоянии сформулировать уравнение, связывающее эти 3 переменные, в форме f(P,T,V)=0.
Уравнение состояния (EOS) представляет собой функциональную связь между переменными состояния — обычно полным набором таких переменных. Большинство УС написано, чтобы выразить функциональные отношения между P, T и V. Верно также и то, что большинство УС по-прежнему являются эмпирическими или полуэмпирическими. Отсюда определение:
Верно также и то, что большинство УС по-прежнему являются эмпирическими или полуэмпирическими. Отсюда определение:
Уравнение состояния (УС) представляет собой полуэмпирическую функциональную зависимость между давлением, объемом и температурой чистого вещества. Мы также можем применить EOS к смеси, вызвав соответствующие правила смешивания.
Было предпринято несколько попыток вывести теоретически обоснованное EOS; но, вообще говоря, больших успехов на этом пути достигнуто не было. В результате мы используем то, что известно как полуэмпирический EOS. Большинство используемых сегодня уравнений состояния носят полуэмпирический характер, потому что они подгоняются под доступные данные. Кроме того, уравнения состояния обычно разрабатывают для чистых веществ. Их применение к смесям требует дополнительной переменной (состава) и, следовательно, соответствующего правила смешивания.
Функциональная форма EOS может быть выражена следующим образом:
f(P,V,T,ak=1,np)=0Это уравнение отображается неправильно из-за несовместимого браузера.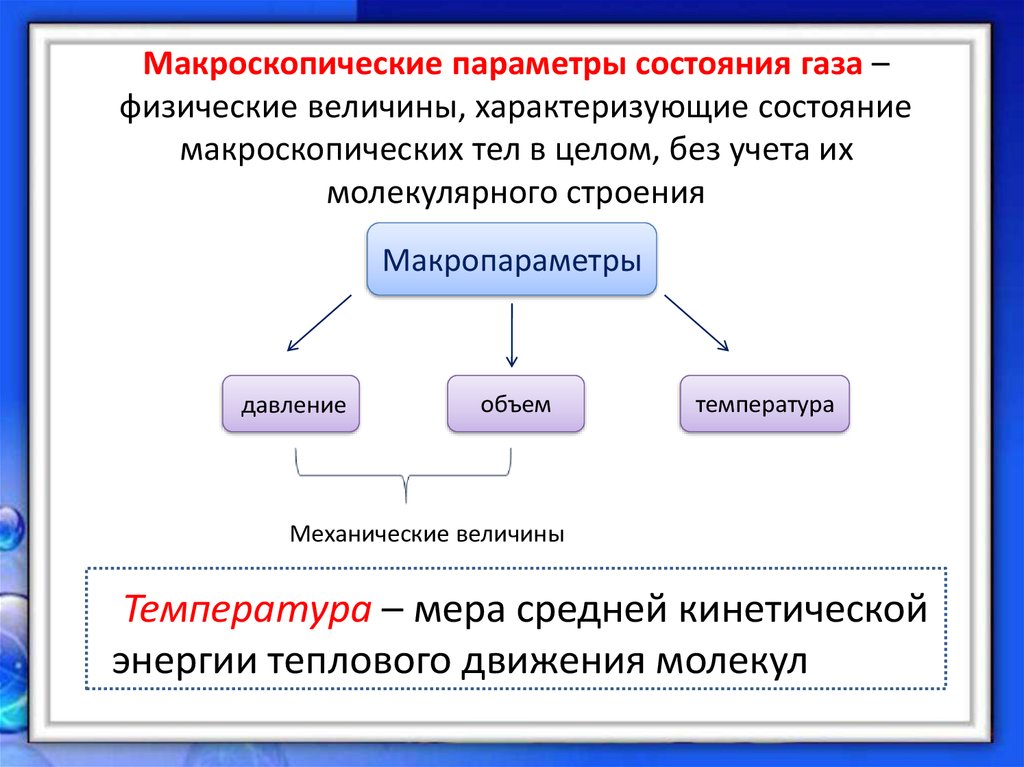 Список совместимых браузеров см. в разделе «Технические требования» в руководстве.
(7.4)
Список совместимых браузеров см. в разделе «Технические требования» в руководстве.
(7.4)
, где a k = параметры уравнения состояния.
Как мы уже говорили ранее, большинство применяемых УС сегодня являются полуэмпирическими, в том смысле, что они имеют некоторую теоретическую основу, но их параметры (a k ) должны быть скорректированы. Количество параметров (n p ) определяет категорию/сложность EOS. Например, 1-параметрические УС — это те, для которых n p = 1, а 2-параметрические УС — те, для которых n p = 2. Чем выше «n p », тем сложнее УС. . Кроме того, в общих чертах, чем сложнее EOS, тем она точнее. Тем не менее, это не всегда так; в некоторых случаях довольно простой EOS может сделать очень хорошую работу.
Со времен закона идеального газа (EOS идеального газа) было предложено большое количество уравнений состояния для описания поведения реального газа. Однако многие из них не прошли проверку временем.

 (см. УРАВНЕНИЕ СОСТОЯНИЯ, ГИББСА ПРАВИЛО ФАЗ).
(см. УРАВНЕНИЕ СОСТОЯНИЯ, ГИББСА ПРАВИЛО ФАЗ).