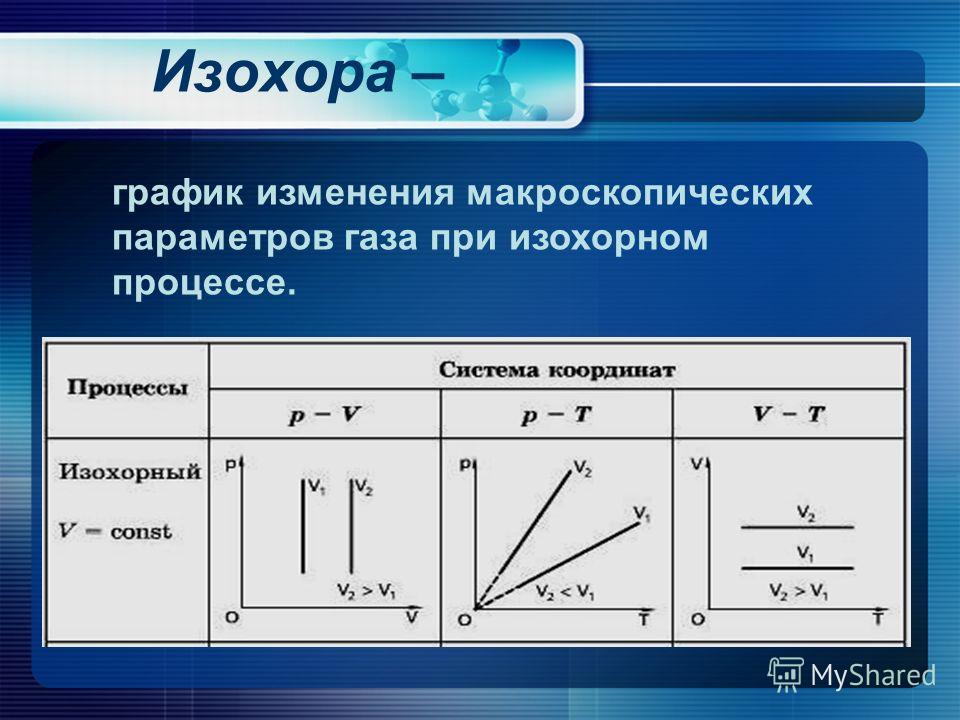
Параметры газа в нормальном состоянии
Параметрами газа называют (параметры состояния) совокупность физических величин, которые определяют макроскопические свойства системы (плотность $\rho ,$ энергия E, температура T, давление p и т.д.).
Параметры состояния не всегда имеют определенные значения. К примеру, подогреваемое с одной стороны и охлаждаемое с другой стороны тело имеет различную температуру в разных точках этого тела. Параметры газа связаны между собой. Поэтому однозначное определение состояния системы возможно с помощью ограниченного количества значений параметров. Основными параметрами состояния являются: давление, температура, удельный (или молярный) объем $V_{\mu }$.
Что такое внешние параметры
Существуют внешние и внутренние параметры состояния газа.
Пример внешнего параметра для газа является объем, который зависит от стенок сосуда.
К внутренним параметрам, можно отнести температуру.
Что такое давление
Давлением $(p)\ $называют физическую величину, равную:
\[p={\mathop{lim}_{\triangle S\to 0} \frac{\triangle F_n}{\triangle S}=\frac{dF_n}{dS},\ \left(1\right)\ }\]
где $F_n$ — проекция силы на нормаль к участку тела $\triangle S$, $\triangle S$- площадь тела. {-1}$.
{-1}$.
Молярная масса и молярный объем
Молярной массой химически однородного вещества называют величину:
\[\mu =\frac{m}{\nu }(6),\]
где m — масса, $\nu $ — число молей вещества. Молярным объемом называют величину:
\[V_{\mu }=\mu V_u=\frac{\mu }{\rho }\left(7\right).\]
Иногда вместо массы газа рассматривают число его молекул (N) в заданном объеме:
\[N=N_A\frac{m}{\mu }\left(8\right).\]
Температурой (t, или T) называют физическую величину, характеризующую степень нагретости тела. Различают несколько видов температуры (в зависимости от используемой шкалы измерения).
Внутренние параметры газа, который находится в равновесном состоянии, зависят только от ее внешних параметров и температуры:
\[y_k=f\left(x_{1,},x_{2,},\dots ,\ x_n,\ T\right)\left(9\right),\]
где $y_k$- внутренний параметр, $x_{1,},x_{2,},\dots ,\ x_n$- внешние параметры.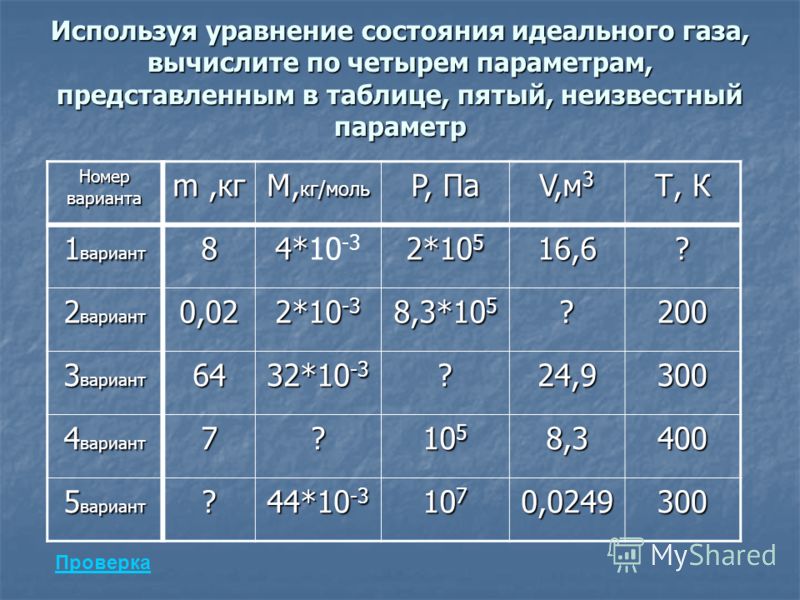 oC$.
oC$.
К основным параметрам газа так же относят внутреннюю энергию U газа. Для газа, на который не действуют внешние силы, находящийся в состоянии макроскопического равновесия внутренняя энергия представляет собой полную энергию системы. Внутренняя энергия включает в себя энергию теплового (хаотического) движения частиц и энергию их взаимодействия. Она однозначно определяет состояние газа как системы. Изменение внутренней энергии не зависит от способа перехода системы из одного состояния в другое, а зависит только от конечного и начального состояния газа (т.е.U — функция состояния):
\[\triangle U=U_2-U_{1\ }(11)\]
Внутренняя энергия газа является аддитивной, то есть полная внутренняя энергия системы есть сумма внутренних энергий ее макрочастей. При невысоких температурах часто внутреннюю энергию идеального газа принимают равной суммарной кинетической энергии его молекул. Внутренняя энергия идеального газа зависит от термодинамической температуры T газа:
\[U=\int\nolimits^T_0{C_VdT}+U_0=m\left(\int\nolimits^T_0{c_VdT}+u_0\right)\left(12\right),\]
где $C_V$- теплоемкость газа при изохорном процессе, $c_V=\frac{C_V}{m}$ — удельная теплоемкость, $U_0$- внутренняя энергия газа при T=0K, $u_0=\frac{U_0}{m}. {»}}_0=S\left(p,0\right).$ Энтропия смеси равна сумме энтропий компонент.
{»}}_0=S\left(p,0\right).$ Энтропия смеси равна сумме энтропий компонент.
Идеальный газ. Параметры состояния газа
Похожие презентации:
Влияния состава и размера зерна аустенита на температуру фазового превращения и физико-механические свойства сплавов
Газовая хроматография
Геофизические исследования скважин
Искусственные алмазы
Трансформаторы тока и напряжения
Транзисторы
Воздушные и кабельные линии электропередач
Создание транспортно-энергетического модуля на основе ядерной энергодвигательной установки мегаваттного класса
Магнитные аномалии
Нанотехнологии
Идеальный газ.
Параметры состояния газа
Древние считали газ неуловимой формой
тела, представляющего собой нечто среднее
между веществом и духом. Новые взгляды на
газ потрясли мир в XVIIв. Первому из
исследованных газов – воздуху – были
приданы свойства вещества
Параметры состояния – определенные
величины, описывающие состояние
газа
Давление
газа
Макроскопические
параметры –
параметры ,
характеризующие газ в
целом как физическое тело
Микроскопические
параметры
Объем
Характеристики самих
молекул газа (масса,
размеры, скорость,
импульс, энергия частиц)
Температура
Макроскопические – параметры,
которые можно измерить с помощью
приборов.
Микроскопические – параметры,
которые измеряются косвенным путем.
Идеальный газ – газ, молекулы которого
представляют собой материальные точки, а их
взаимодействие носит характер абсолютно
упругого удара
Идеальный газ –
физическая модель
реального газа
Модели идеального газа
соответствует реальный газ
находящийся под низким
давлением и при высокой
температуре
Воздух при нормальных условиях можно приближенно считать
идеальным газом
Идеальный газ
(модель)
Реальный газ
1. Совокупность большого числа
молекул, размерами которых можно
пренебречь (принимают молекулы за
материальные точки).
2. Молекулы находятся на больших
расстояниях друг от друга и движутся
хаотически
( все направления движения молекул
равноправны ) .
3. Молекулы взаимодействуют по
законам упругих столкновений ,
силами притяжения между
молекулами пренебрегают.
4. Скорости молекул разнообразны, но
при определенной температуре
средняя скорость молекул остается
постоянной.
5. Все соударения молекул являются
абсолютно упругими
являются точечными
образованиями, диаметры
молекул лишь в десятки раз
меньше расстояний между
молекулами.
2. Молекулы не взаимодействуют
по законам упругих
столкновений.
Свойства идеального газа
1. Суммарный
объем молекул по
сравнению с объемом, занимаемым
газом, пренебрежимо мал.
2. Молекулы представляют собой упругие
шарики
3. Внутренняя энергия газа определяется
лишь кинетической энергией.
Макропараметры идеального
газа
— Давление
— Температура
— Объем
Давление идеального газа
В 1845 г в Английскую академию наук была
представлена работа Ватерстона. В ней было показано,
что давление газа на стенки сосуда обусловлено
ударами молекул. Работа была отклонена и осталась
неопубликованной еще полстолетия
Давление газа – суммарная сила ударов молекул
газа о единицу площади поверхности сосуда, в
котором газ находится
Fдав
p
S
Н
p 2 Па
м
Установление связи между микро- и
макропараметрами
N – число молекул газа
— средняя квадратичная скорость
хаотически движущихся частиц
2 — средний квадрат скорости
1
молекул, движущихся
N — число
вдоль каждой из трех осей туда и
3
обратно
1
N
6
— число молекул, движущихся в
направлении оси ОХ к стенке
Изменение импульса для
каждой молекулы
m0 m0 2m0
По III закону Ньютона сама стенка S
после удара получит импульс 2m
Импульс стенки при ударе
N nV nSl ;
1
всех 6 N
0
молекул
2
m0 N
6
l t ;
N n S t
Изменение импульса стенки p F t
1
1
F t m0 N m0 2 n tS;
3
3
1
F
2
F m0 nS ; p
3
S
1
2
p m0 n
3
Основное уравнение МКТ идеального газа.

Масса
Давление
газа [Па]
Средний квадрат
скорости движения
молекул [м/с]
Концентрация
3
молекул [ м ]
Основное уравнение кинетической теории
идеального газа или уравнение Клаузиуса
1
2
p m0 n
3
p
2
3
m0
2
2
n
2
p 3 nЕк
N
n ;
V
1
N 1m 2 1
p m0 2
2
3
V 3V
3
1
p
3
2
Закон Дальтона
Давление смеси газов равно сумме
их парциальных давлений
p p1 p2 p3 … pN
Парциальное давление
газа – давление,
которое бы оказывал газ на
стенки сосуда,
находясь в нем один
Если в сосуде содержится несколько газов, то каждый газ
занимает объем, равный объему сосуда, и все газы имеют
одинаковую температуру
English Русский Правила
6.3: Сочетание газовых законов: уравнение идеального газа и общее уравнение газа
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 24195
Цели обучения
- Использовать закон идеального газа для описания поведения газа.
В этом модуле описываются взаимосвязи между давлением, температурой, объемом и количеством газа, а также то, как эти взаимосвязи можно комбинировать, чтобы получить общее выражение, описывающее поведение газа.
Вывод закона идеального газа
Любой набор взаимосвязей между одной величиной (например, V) и несколькими другими переменными (\(P\), \(T\) и \(n\)) можно объединить в одно выражение, описывающее все отношения одновременно. Три отдельных выражения следующие:
- Закон Бойля
\[V \propto \dfrac{1}{P} \;\; \text{@ константы n и T}\]
- Закон Шарля
\[V \propto T \;\; \text{@ константы n и P}\]
- Закон Авогадро
\[V \propto n \;\; \text{@ константы T и P}\]
Объединение этих трех выражений дает
\[V \propto \dfrac{nT}{P} \tag{6.3.1}\]
, что показывает, что объем газ пропорционален числу молей и температуре и обратно пропорционален давлению. Это выражение также можно записать в виде
Это выражение также можно записать в виде
\[V= {\rm Cons.} \left( \dfrac{nT}{P} \right) \tag{6.3.2}\]
По соглашению константа пропорциональности в уравнении 6.3.1 называется газовая постоянная, которая обозначается буквой \(R\). Подстановка R в уравнение 6.3.2 дает
\[ V = \dfrac{Rnt}{P} = \dfrac{nRT}{P} \tag{6.3.3}\]
Очистка дробей путем умножения обеих частей Уравнение 6.3.4 на \(P\) дает
\[PV = nRT \tag{6.3.4}\]
Это уравнение известно как закон идеального газа .
Идеальный газ определяется как гипотетическое газообразное вещество, поведение которого не зависит от сил притяжения и отталкивания и может быть полностью описано законом идеального газа. В действительности идеального газа не существует, но идеальный газ — это полезная концептуальная модель, которая позволяет нам понять, как газы реагируют на изменяющиеся условия. Как мы увидим, при многих условиях поведение большинства реальных газов очень близко к поведению идеального газа.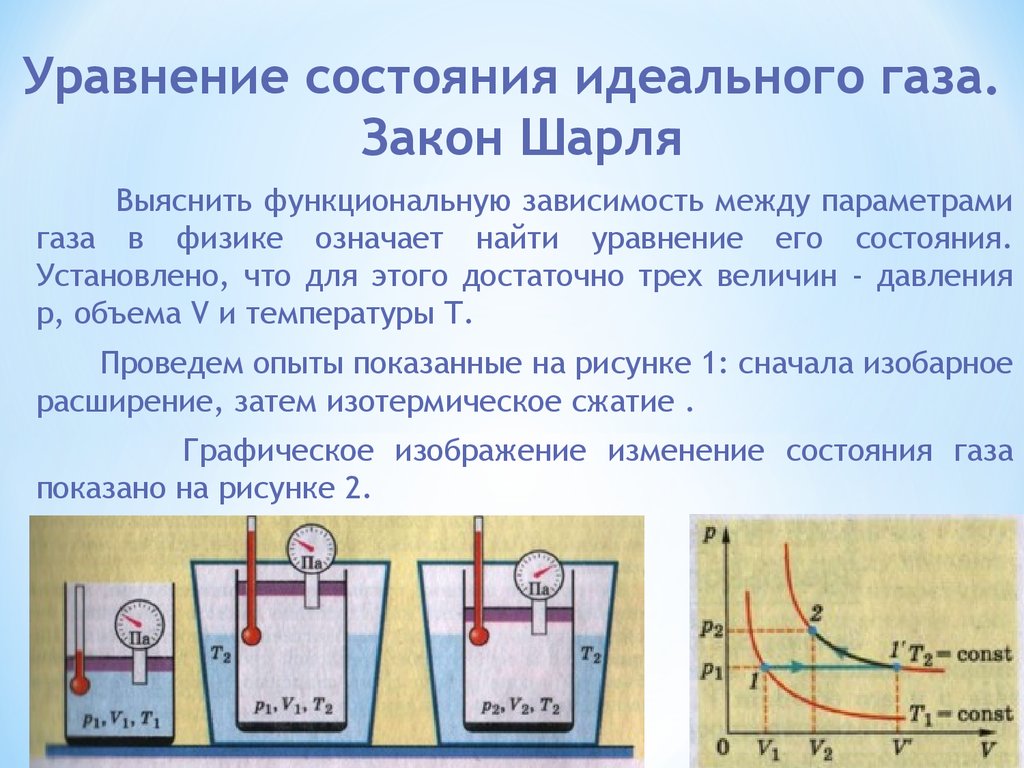 Таким образом, закон идеального газа можно использовать для предсказания поведения реальных газов в большинстве условий. Закон идеального газа плохо работает при очень низких температурах или очень высоких давлениях, когда чаще всего наблюдаются отклонения от идеального поведения.
Таким образом, закон идеального газа можно использовать для предсказания поведения реальных газов в большинстве условий. Закон идеального газа плохо работает при очень низких температурах или очень высоких давлениях, когда чаще всего наблюдаются отклонения от идеального поведения.
Примечание
Значительные отклонения от поведения идеального газа обычно возникают при низких температурах и очень высоких давлениях.
Однако, прежде чем мы сможем использовать закон идеального газа, нам нужно знать значение газовой постоянной R. Его форма зависит от единиц, используемых для других величин в выражении. Если V выражено в литрах (л), P в атмосферах (атм), T в кельвинах (K) и n в молях (моль), то
\[R = 0,08206 \dfrac{\rm L\cdot atm} {\rm K\cdot моль} \tag{6.3.5}\] 95\;Pa\]
Обратите внимание, что в этой части STP определяется иначе. Старое определение основывалось на стандартном давлении 1 атм.
Мы можем рассчитать объем 1000 моль идеального газа при стандартных условиях, используя вариант закона идеального газа, приведенный в уравнении 6.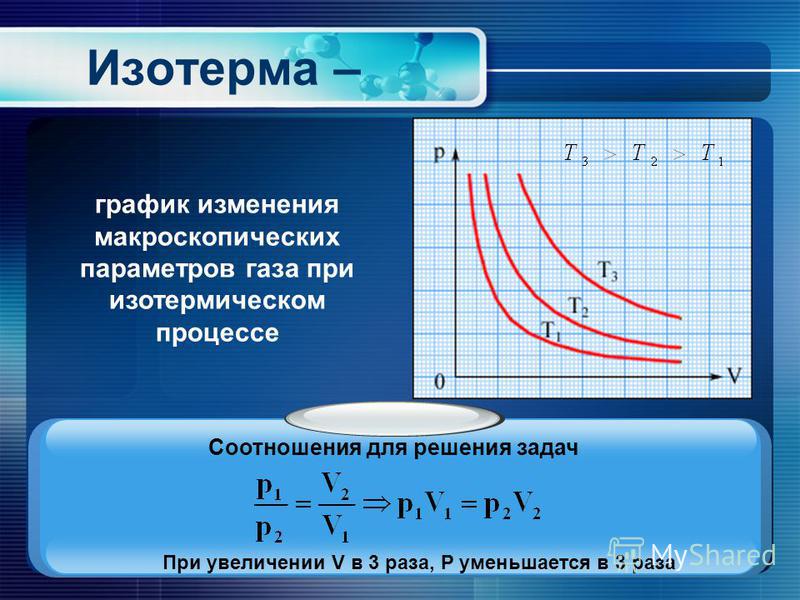 3.4:
3.4:
\[V=\dfrac{nRT}{P}\tag{6.3 .7}\]
Таким образом, объем 1 моля идеального газа равен 22,71 л при СТП и 22,41 л при 0°C и 1 атм , что примерно эквивалентно объему трех баскетбольных мячей. Молярные объемы нескольких реальных газов при 0°C и 1 атм приведены в таблице 10.3, из которой видно, что отклонения от поведения идеального газа довольно малы. Таким образом, закон идеального газа хорошо аппроксимирует поведение реальных газов при 0°C и 1 атм. Соотношения, описанные в разделе 10.3 как законы Бойля, Шарля и Авогадро, являются просто частными случаями закона идеального газа, в котором два из четырех параметров (P, V, T и n) остаются фиксированными.
| Газ | Молярный объем (л) |
|---|---|
| Он |  434 434 |
| Ар | 22.397 |
| Н 2 | 22.433 |
| Н 2 | 22.402 |
| О 2 | 22.397 |
| СО 2 | 22.260 |
| НХ 3 | 22.079 |
Применение закона идеального газа
Закон идеального газа позволяет нам рассчитать значение четвертой переменной для газовой пробы, если мы знаем значения любых трех из четырех переменных ( P , V , T и n ). Это также позволяет нам предсказать конечное состояние образца газа (т. е. его конечную температуру, давление, объем и количество) после любых изменений условий, если параметры ( P , V , T и n ) указаны для начального состояния . Некоторые приложения проиллюстрированы в следующих примерах. Подход, используемый повсюду, заключается в том, чтобы всегда начинать с одного и того же уравнения — закона идеального газа — и затем определять, какие величины даны, а какие необходимо рассчитать. Начнем с простых случаев, когда нам даны три из четырех параметров, необходимых для полного физического описания газообразного образца.
Это также позволяет нам предсказать конечное состояние образца газа (т. е. его конечную температуру, давление, объем и количество) после любых изменений условий, если параметры ( P , V , T и n ) указаны для начального состояния . Некоторые приложения проиллюстрированы в следующих примерах. Подход, используемый повсюду, заключается в том, чтобы всегда начинать с одного и того же уравнения — закона идеального газа — и затем определять, какие величины даны, а какие необходимо рассчитать. Начнем с простых случаев, когда нам даны три из четырех параметров, необходимых для полного физического описания газообразного образца.
Пример \(\PageIndex{1}\)
Воздушный шар, который Чарльз использовал для своего первого полета в 1783 году, был уничтожен, но мы можем оценить его объем в 31 150 л (1100 футов 3 ), учитывая записанные размеры в это время. Если температура на уровне земли была 86°F (30°C) и атмосферное давление 745 мм ртутного столба, сколько молей газообразного водорода потребовалось, чтобы заполнить воздушный шар?
Дано: объем, температура и давление
Запрошено: количество газа
Стратегия:
- Решите закон идеального газа для неизвестного количества, в данном случае n .
- Убедитесь, что все величины даны в единицах, совместимых с единицами газовой постоянной. При необходимости переведите их в соответствующие единицы, вставьте в полученное уравнение, а затем рассчитайте необходимое количество молей газообразного водорода.
Решение:
A Нам дают значения для P , T и V и просят вычислить n . Если мы решим закон идеального газа (уравнение 6.3.4) для n , то получим \]
B P и T даны в единицах, несовместимых с единицами газовой постоянной [ R = 0,08206 (л•атм)/(К•моль)]. Поэтому мы должны перевести температуру в кельвины, а давление в атмосферы: 93\;mol\]
Упражнение \(\PageIndex{1}\)
Предположим, что «пустой» аэрозольный баллончик из-под краски имеет объем 0,406 л и содержит 0,025 моль газа-вытеснителя, такого как CO 2 . Каково давление газа при 25°С?
Ответ: 1,5 атм
В примере \(\PageIndex{1}\) нам дали три из четырех параметров, необходимых для описания газа при определенных условиях, и нас попросили рассчитать четвертый . Мы также можем использовать закон идеального газа, чтобы вычислить эффект заменяет в любом из указанных условий любого из других параметров, как показано в примере \(\PageIndex{5}\).
Мы также можем использовать закон идеального газа, чтобы вычислить эффект заменяет в любом из указанных условий любого из других параметров, как показано в примере \(\PageIndex{5}\).
Закон идеального газа: https://youtu.be/rHGs23368mE
Общее уравнение газа
Когда газ описывается при двух различных условиях, уравнение идеального газа должно применяться дважды — к начальному условию и конечное условие. Это:
\[\begin{array}{cc}\text{Исходное состояние}(i) & \text{Окончательное условие} (f)\\P_iV_i=n_iRT_i & P_fV_f=n_fRT_f\end{массив}\]
Оба уравнения можно преобразовать, чтобы получить:
\[R=\dfrac{P_iV_i}{n_iT_i} \hspace{1cm} R=\dfrac{P_fV_f}{n_fT_f}\]
Оба уравнения равны друг другу другой, поскольку каждый из них равен одной и той же константе \(R\). Таким образом, мы имеем:
\[\dfrac{P_iV_i}{n_iT_i}=\dfrac{P_fV_f}{n_fT_f}\tag{6. 3.8}\]
3.8}\]
Уравнение называется общим уравнением газа . Уравнение особенно полезно, когда одно или два свойства газа остаются постоянными между двумя условиями. В таких случаях уравнение можно упростить, исключив эти постоянные свойства газа.
Пример \(\PageIndex{2}\)
Предположим, что Чарльз изменил свои планы и совершил свой первый полет не в августе, а в холодный январский день, когда температура у земли была -10°C ( 14°F). Насколько большой воздушный шар ему понадобился бы, чтобы содержать то же количество газообразного водорода при том же давлении, что и в примере \(\PageIndex{1}\)?
Дано: температура, давление, количество и объем в августе; температура в январе
Просили: объем в январе
Стратегия:
- Используйте результаты примера \(\PageIndex{1}\) для августа в качестве начальных условий, а затем рассчитайте изменение объема из-за изменения температуры с 30 °С до -10°С.
 Начните с построения таблицы, показывающей начальные и конечные условия.
Начните с построения таблицы, показывающей начальные и конечные условия. - Упростите общее уравнение газа, исключив величины, которые остаются постоянными между начальным и конечным условиями, в данном случае \(P\) и \(n\).
- Найдите неизвестный параметр.
Решение:
A Чтобы точно увидеть, какие параметры изменились, а какие остались постоянными, подготовьте таблицу начальных и конечных условий:
Начальное (август)| Финал (январь) | |
| \(T_i=30\)°С = 303 К | \(T_f=\)−10°C = 263 K |
| \(P_i=\)0,980 атм | \(P_f=\)0,980 атм |
| \(n_i=\)1,23 × 103 моль | \(n_f=\)1,23 × 103 моль |
| \(V_i=31150\) Л | \(V_f=?\) |
B И \(n\), и \(P\) в обоих случаях одинаковы (\(n_i=n_f,P_i=P_f\)). Следовательно, уравнение можно упростить до:
Следовательно, уравнение можно упростить до:
\[\dfrac{V_i}{T_i}=\dfrac{V_f}{T_f}\]
Это соотношение впервые было отмечено Чарльзом. 94\;L\]
Важно проверить свой ответ, чтобы убедиться, что он имеет смысл, на тот случай, если вы случайно инвертировали величину или умножили, а не разделили. При этом температура газа снижается. Поскольку мы знаем, что объем газа уменьшается с понижением температуры, конечный объем должен быть меньше начального объема, поэтому ответ имеет смысл. Мы могли бы рассчитать новый объем, подставив все заданные числа в закон идеального газа, но, как правило, гораздо проще и быстрее сосредоточиться только на изменяющихся величинах.
Упражнение \(\PageIndex{2}\)
На вечеринке в лаборатории наполненный гелием воздушный шар объемом 2,00 л при температуре 22°C опускают в большой контейнер с жидким азотом (T = −196°C). ). Каков конечный объем газа в баллоне?
Ответ : 0,52 л
Пример \(\PageIndex{1}\) иллюстрирует взаимосвязь, первоначально обнаруженную Чарльзом. Мы могли бы проработать аналогичные примеры, иллюстрирующие обратную зависимость между давлением и объемом, отмеченную Бойлем (9).0186 PV = константа) и соотношение между объемом и количеством, наблюдаемое Авогадро ( V / n = константа). Мы, однако, не будем этого делать, потому что важнее отметить, что исторически важные газовые законы являются лишь частными случаями идеального газового закона, в котором две величины изменяются, а две другие остаются постоянными. Метод, использованный в примере \(\PageIndex{1}\), может быть применен в любом таком случае, как мы демонстрируем в примере \(\PageIndex{2}\) (который также показывает, почему нагрев закрытого контейнера с газом (например, картридж с бутановой зажигалкой или аэрозольный баллончик) может привести к взрыву).
Мы могли бы проработать аналогичные примеры, иллюстрирующие обратную зависимость между давлением и объемом, отмеченную Бойлем (9).0186 PV = константа) и соотношение между объемом и количеством, наблюдаемое Авогадро ( V / n = константа). Мы, однако, не будем этого делать, потому что важнее отметить, что исторически важные газовые законы являются лишь частными случаями идеального газового закона, в котором две величины изменяются, а две другие остаются постоянными. Метод, использованный в примере \(\PageIndex{1}\), может быть применен в любом таком случае, как мы демонстрируем в примере \(\PageIndex{2}\) (который также показывает, почему нагрев закрытого контейнера с газом (например, картридж с бутановой зажигалкой или аэрозольный баллончик) может привести к взрыву).
Пример \(\PageIndex{3}\)
На аэрозольных баллончиках имеется четкая маркировка с предупреждением, например: «Не сжигайте пустой контейнер». Предположим, что вы не заметили этого предупреждения и бросили «пустой» аэрозольный баллончик в упражнении 5 (0,025 моль в 0,406 л, первоначально при 25°C и внутреннем давлении 1,5 атм) в огонь при 750°C. Какое давление было бы внутри банки (если бы она не взорвалась)?
Какое давление было бы внутри банки (если бы она не взорвалась)?
Дано: начальный объем, количество, температура и давление; конечная температура
Запрос: конечное давление
Стратегия:
Следуйте стратегии, описанной в примере \(\PageIndex{5}\).
Решение:
Подготовьте таблицу, чтобы определить, какие параметры изменяются, а какие остаются постоянными:
| Исходный | Окончательный |
| \(V_i=0,406\;\rm L\) | \(V_f=0,406\;\rm L\) | 9\цирк С=1023\;К\)
| \(P_i=1.5\;\rm атм\) | \(P_f=?\) |
И \(V\), и \(n\) в обоих случаях одинаковы (\(V_i=V_f,n_i=n_f\)). Следовательно, уравнение можно упростить до:
\[P_iT_i=P_fT_f\]
Решая уравнение для \(P_f\), мы получаем:
\[P_f=P_i\times\dfrac{T_i}{T_f} =\rm1. 5\;atm\times\dfrac{1023\;K}{298\;K}=5.1\;atm\]
5\;atm\times\dfrac{1023\;K}{298\;K}=5.1\;atm\]
Этого давления более чем достаточно, чтобы разорвать контейнер из тонкого листового металла и вызвать взрыв !
Упражнение \(\PageIndex{3}\)
Предположим, что огнетушитель, заполненный CO 2 до давления 20,0 атм при 21°C на заводе, случайно оставлен на солнце в закрытом автомобиле. в Тусоне, штат Аризона, в июле. Температура внутри автомобиля поднимается до 160°F (71,1°C). Какое внутреннее давление в огнетушителе?
Ответ : 23,4 атм
В примере \(\PageIndex{1}\) и примере \(\PageIndex{2}\) два из четырех параметров ( P , V , T и n ) были фиксированными, в то время как одному разрешалось изменяться, и нас интересовало влияние на значение четвертого. В самом деле, мы часто сталкиваемся со случаями, когда две переменные P , V и T могут изменяться для данной пробы газа (следовательно, n постоянно), и нас интересует изменение в значении третьего в новых условиях.
Пример \(\PageIndex{4}\)
В примере \(\PageIndex{1}\) мы видели, что Чарльз использовал воздушный шар объемом 31 150 л для своего начального подъема и что воздушный шар содержал 1,23 × 10 3 моль газа H 2 первоначально при 30°С и 745 мм рт.ст. Предположим, что Гей-Люссак также использовал этот воздушный шар для своего рекордного подъема на высоту 23 000 футов, и что давление и температура на этой высоте составляли 312 мм ртутного столба и -30°C соответственно. До какого объема должен был бы расшириться воздушный шар, чтобы удержать такое же количество газообразного водорода на большей высоте?
Дано: начальное давление, температура, количество и объем; конечное давление и температура
Требуемый запрос: конечный объем
Стратегия:
Следуйте стратегии, описанной в примере \(\PageIndex{5}\).
Решение:
Начните с создания таблицы двух наборов условий:

 Что мы ожидаем преобладать? Давление падает более чем в два раза, а абсолютная температура падает всего примерно на 20%. Поскольку объем пробы газа прямо пропорционален как T , так и 1/ P , переменная , которая больше всего изменится , окажет наибольшее влияние на V . В этом случае преобладает эффект уменьшения давления, и мы ожидаем, что объем газа увеличится, как мы и обнаружили в нашем расчете.
Что мы ожидаем преобладать? Давление падает более чем в два раза, а абсолютная температура падает всего примерно на 20%. Поскольку объем пробы газа прямо пропорционален как T , так и 1/ P , переменная , которая больше всего изменится , окажет наибольшее влияние на V . В этом случае преобладает эффект уменьшения давления, и мы ожидаем, что объем газа увеличится, как мы и обнаружили в нашем расчете. )
) ст.\times\dfrac{1\;атм}{760\;мм рт.ст.}=0,987\;атм\]
ст.\times\dfrac{1\;атм}{760\;мм рт.ст.}=0,987\;атм\] Этот метод особенно удобен для идентификации газа, образовавшегося в результате реакции, и его несложно осуществить. Колбу или стеклянную колбу известного объема тщательно высушивают, вакуумируют, запечатывают и взвешивают пустыми. Затем он заполняется образцом газа при известной температуре и давлении и повторно взвешивается. Разница в массе между двумя показаниями и есть масса газа. Объем колбы обычно определяют путем взвешивания пустой колбы и наполненной жидкостью известной плотности, например водой. Использование измерений плотности для расчета молярных масс показано в примере \(\PageIndex{6}\).
Этот метод особенно удобен для идентификации газа, образовавшегося в результате реакции, и его несложно осуществить. Колбу или стеклянную колбу известного объема тщательно высушивают, вакуумируют, запечатывают и взвешивают пустыми. Затем он заполняется образцом газа при известной температуре и давлении и повторно взвешивается. Разница в массе между двумя показаниями и есть масса газа. Объем колбы обычно определяют путем взвешивания пустой колбы и наполненной жидкостью известной плотности, например водой. Использование измерений плотности для расчета молярных масс показано в примере \(\PageIndex{6}\). 3.12 для определения молярной массы газа, а затем рассчитайте плотность газа на основе предоставленной информации.
3.12 для определения молярной массы газа, а затем рассчитайте плотность газа на основе предоставленной информации. Красно-коричневый цвет смога также обусловлен присутствием газа NO 2 .
Красно-коричневый цвет смога также обусловлен присутствием газа NO 2 . Константа пропорциональности, R , называется газовой постоянной и имеет значение 0,08206 (л•атм)/(К•моль), 8,3145 Дж/(К•моль) или 1,9872 кал/(К•моль) , в зависимости от используемых единиц измерения. Закон идеального газа описывает поведение идеального газа , гипотетического вещества, поведение которого можно количественно объяснить законом идеального газа и кинетической молекулярной теорией газов. Стандартная температура и давление (STP) : 0°C и 1 атм. Объем 1 моль идеального газа при СТП равен 22,41 л, стандартный молярный объем . Все эмпирические газовые соотношения являются частными случаями закона идеального газа, в котором два из четырех параметров остаются постоянными. Закон идеального газа позволяет вычислить значение четвертой величины ( P , V , T или n ), необходимой для описания газовой пробы, когда известны остальные, а также предсказать значение этих величин.
Константа пропорциональности, R , называется газовой постоянной и имеет значение 0,08206 (л•атм)/(К•моль), 8,3145 Дж/(К•моль) или 1,9872 кал/(К•моль) , в зависимости от используемых единиц измерения. Закон идеального газа описывает поведение идеального газа , гипотетического вещества, поведение которого можно количественно объяснить законом идеального газа и кинетической молекулярной теорией газов. Стандартная температура и давление (STP) : 0°C и 1 атм. Объем 1 моль идеального газа при СТП равен 22,41 л, стандартный молярный объем . Все эмпирические газовые соотношения являются частными случаями закона идеального газа, в котором два из четырех параметров остаются постоянными. Закон идеального газа позволяет вычислить значение четвертой величины ( P , V , T или n ), необходимой для описания газовой пробы, когда известны остальные, а также предсказать значение этих величин. количества после изменения условий, если исходные условия (значения P , V , T и n ). Закон идеального газа можно использовать и для вычисления плотности газа, если известна его молярная масса, или, наоборот, молярной массы неизвестной пробы газа, если измерена его плотность.
количества после изменения условий, если исходные условия (значения P , V , T и n ). Закон идеального газа можно использовать и для вычисления плотности газа, если известна его молярная масса, или, наоборот, молярной массы неизвестной пробы газа, если измерена его плотность. Том
Том  Когда громкость увеличивается, эта стена выдвигается. Когда объем уменьшается, стена скользит внутрь. Представьте, что уплотнение подвижной стенки идеально, так что газ не выходит.
Когда громкость увеличивается, эта стена выдвигается. Когда объем уменьшается, стена скользит внутрь. Представьте, что уплотнение подвижной стенки идеально, так что газ не выходит.
 Эта концепция очень важна для понимания поведения газа. Твердо держите это в уме. Эта идея о том, что молекулы газа ударяются о стену, будет часто использоваться. Когда обсуждается обобщенная переменная давления, используется символ P.
Эта концепция очень важна для понимания поведения газа. Твердо держите это в уме. Эта идея о том, что молекулы газа ударяются о стену, будет часто использоваться. Когда обсуждается обобщенная переменная давления, используется символ P. Вот они снова:
Вот они снова: