Свойства жидкостей. Основные физические свойства жидкости
Свойства жидкостей. Основные физические свойства жидкости
Известно, что все, что окружает человека, включая его самого, — это тело, состоящее из субстанций. Они, в свою очередь, состоят из молекул, последние из атомов, и происходят из еще более мелких структур. Однако окружающее разнообразие настолько велико, что трудно даже представить какую-то общность. Это правда. Существуют миллионы соединений, каждое из которых уникально по свойствам, структуре и выполняемой роли. Всего выделяют несколько фазовых состояний, по которым могут быть связаны все вещества.
Содержание
- 1 Агрегатные состояния веществ
- 2 Классификация жидких тел
- 3 Свойства жидкостей: форма и объем
- 4 Вязкость
- 5 Теплоемкость
- 6 Поверхностное натяжение
- 7 Текучесть
- 8 Зависимость свойств от температуры
- 9 Сосуществование с другими фазами веществ
- 10 Сжимаемость
- 11 Испарение и конденсация жидкостей
- 12 Механические свойства жидкости
- 13 Неньютоновские жидкости и их свойства
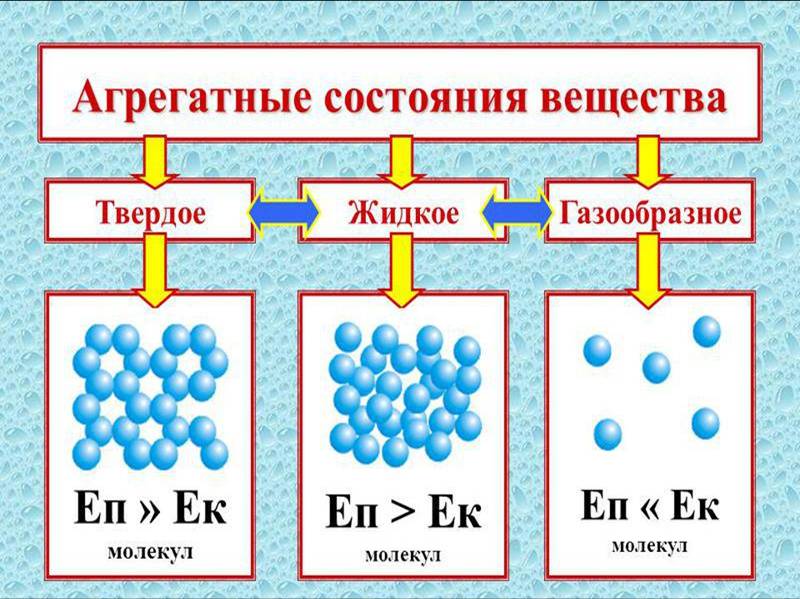
Агрегатные состояния веществ
Всего существует четыре варианта агрегатного состояния подключений.
- Газ.
- Твердые тела.
- Жидкости.
- Плазма — это сильно разреженный ионизированный газ.
В этой статье мы рассмотрим свойства жидкостей, их структурные характеристики и возможные параметры производительности.
Классификация жидких тел
Это разделение основано на свойствах жидкостей, их структуре и химической структуре, а также на типах взаимодействий между частицами, составляющими соединение.
- Такие жидкости, состоящие из атомов, удерживаемых вместе силами Ван-дер-Ваальса. Примеры — жидкие газы (аргон, метан и другие).
- Такие вещества, которые состоят из двух одинаковых атомов. Примеры: газ в сжиженном виде — водород, азот, кислород и другие.
- Жидкие металлы — это ртуть.
- Вещества, состоящие из элементов, связанных ковалентными полярными связями. Примеры: соляная кислота, йодоводород, сероводород и другие.
- Соединения, в которых присутствуют водородные связи. Примеры: вода, спирты, аммиак в растворе.
Также существуют особые структуры, такие как жидкие кристаллы, неньютоновские жидкости, которые обладают особыми свойствами.
Мы рассмотрим основные свойства жидкости, которые отличают ее от всех других агрегатных состояний. В первую очередь, это то, что принято называть физическими.
Свойства жидкостей: форма и объем
Всего можно выделить около 15 характеристик, которые дают возможность описать, какие вещества находятся в рассмотрении и какова их ценность, характеристики.
Самое первое физическое свойство жидкости, которое приходит на ум, когда говорят об этом агрегатном состоянии, — это способность изменять форму и занимать определенный объем. Так, например, если говорить о форме жидких веществ, принято считать ее отсутствующей. Однако это не так.
Под действием известной силы тяжести капли вещества претерпевают определенную деформацию, поэтому их форма нарушается и становится неопределенной. Однако, если вы поместите каплю в условиях, когда гравитация не действует или сильно ограничена, она примет идеальную форму шара. Поэтому, получив задание: «Назвать свойства жидкостей», человек, считающий себя достаточно сведущим в физике, должен упомянуть об этом факте.
Поэтому, получив задание: «Назвать свойства жидкостей», человек, считающий себя достаточно сведущим в физике, должен упомянуть об этом факте.
Что касается объема, то здесь следует отметить общие свойства газов и жидкостей. И те, и другие способны занимать весь объем пространства, в котором они находятся, ограниченный только стенками корабля.
Вязкость
Физические свойства жидкости очень разные. Но единственный — это вязкость. Что это такое и как определяется? Основными параметрами, от которых зависит рассматриваемое значение, являются:
- градиент скорости движения.
- режущее усилие;
Зависимость этих величин линейная. Если объяснить более простыми словами, вязкость, как и объем, — это такие общие для жидкостей и газов свойства, которые предполагают неограниченное движение независимо от внешних воздействующих сил. То есть, если вода вытекает из корабля, она будет продолжать течь под любым воздействием (гравитация, трение и другие параметры).
В этом отличие от неньютоновских жидкостей, которые более вязкие и могут оставлять отверстия при движении, заполняясь со временем.
От чего будет зависеть этот показатель?
- От температуры. С повышением температуры вязкость одних жидкостей увеличивается, а других, наоборот, уменьшается. Это зависит от конкретного соединения и его химической структуры.
- От давления. Увеличение вызывает увеличение индекса вязкости.
- От химического состава вещества. Вязкость изменяется при наличии примесей и посторонних компонентов в пробе чистого вещества.
Теплоемкость
Этот термин определяет способность вещества поглощать определенное количество тепла, повышая его температуру на один градус Цельсия. Для этого показателя существует несколько составов. У одних теплоемкость больше, у других — меньше.
Так, например, вода — отличный аккумулятор тепла, что позволяет широко использовать ее для систем отопления, приготовления пищи и других нужд. В целом показатель теплоемкости строго индивидуален для каждой отдельной жидкости.
В целом показатель теплоемкости строго индивидуален для каждой отдельной жидкости.
Поверхностное натяжение
Часто, получив задание: «Назвать свойства жидкостей», сразу запоминают поверхностное натяжение. Ведь детей с ними знакомят на уроках физики, химии и биологии. И каждый испытуемый со своей стороны объясняет этот важный параметр.
Классическое определение поверхностного натяжения следующее: это интерфейс. То есть в момент, когда жидкость заняла определенный объем, она граничит снаружи с газовой средой: воздухом, паром или каким-либо другим веществом. Следовательно, разделение фаз происходит в точке контакта.
В этом случае молекулы стремятся окружить себя как можно большим количеством частиц и, следовательно, как бы приводят к сжатию жидкости как целого. В результате поверхность выглядит удлиненной. Это свойство также может объяснить сферическую форму жидких капель в отсутствие силы тяжести. Действительно, именно такая форма идеальна с точки зрения энергии молекулы.
- капли жидкости в невесомости.
- кипящая вода;
- пузырь;
Некоторые насекомые приспособились «ходить» по поверхности воды именно благодаря поверхностному натяжению. Примеры: водяные ястребы, водяные жуки, некоторые личинки.
Текучесть
Есть общие свойства жидкостей и твердых тел. Один из них — плавность. Единственная разница в том, что для первых он неограничен. В чем суть этого параметра?
Если к жидкому телу приложить внешнее воздействие, оно разделится на части и отделит их друг от друга, то есть переполнится. В этом случае каждая часть снова заполнит весь объем сосуда. Для твердых тел это свойство ограничено и зависит от внешних условий.
Зависимость свойств от температуры
К ним относятся три параметра, характеризующие рассматриваемые нами вещества:
- кипячение.
- охлаждение;
- перегрев;
Свойства перегрева и переохлаждения жидкостей напрямую связаны с критическими температурами кипения и замерзания (точки) соответственно. Перегретой называется жидкость, которая превысила порог критической точки нагрева при воздействии температуры, но не показала внешних признаков кипения.
Перегретой называется жидкость, которая превысила порог критической точки нагрева при воздействии температуры, но не показала внешних признаков кипения.
Переохлажденной, соответственно, называют жидкость, перешедшую порог критической точки перехода в другую фазу под воздействием низких температур, но не ставшую твердой.
И в первом, и во втором случае есть условия для проявления таких свойств.
- Отсутствие механических воздействий на систему (движение, вибрация).
- Равномерная температура, без резких скачков и перепадов.
Интересным фактом является то, что если в перегретую жидкость (например, воду) бросить посторонний предмет, она мгновенно закипит. Его можно получить при нагревании под воздействием излучения (в микроволновой печи).
Сосуществование с другими фазами веществ
Есть два варианта этого параметра.
- Жидкость — это газ. Такие системы наиболее распространены, так как существуют в природе повсеместно. Испарение воды — часть естественного цикла.
 В этом случае образующийся пар существует одновременно с жидкой водой. Если говорить о замкнутой системе, там тоже происходит испарение. Просто пар очень быстро насыщается, и вся система в целом достигает равновесия: жидкость — насыщенный пар.
В этом случае образующийся пар существует одновременно с жидкой водой. Если говорить о замкнутой системе, там тоже происходит испарение. Просто пар очень быстро насыщается, и вся система в целом достигает равновесия: жидкость — насыщенный пар. - Жидкость — твердая. Особенно на таких системах отмечается еще одно свойство — смачиваемость. Когда вода и твердое вещество взаимодействуют, последнее может быть полностью влажным, частично или полностью отталкивая воду. Есть соединения, которые растворяются в воде быстро и практически бесконечно. Есть такие, кто вообще на это не способен (некоторые металлы, алмазы и другие).
В целом, изучение взаимодействия жидкостей с соединениями в других агрегатных состояниях — это дисциплина гидроаэромеханики.
Сжимаемость
Основные свойства жидкости были бы неполными, если бы не упоминалась сжимаемость. Конечно, этот параметр больше характерен для газовых систем. Однако те, которые мы рассматриваем, также могут поддаться сжатию при определенных условиях.
Основное отличие — скорость процесса и его равномерность. Если газ можно сжимать быстро и при низком давлении, жидкости сжимаются неравномерно, в течение достаточно длительного времени и при специально выбранных условиях.
Испарение и конденсация жидкостей
Это два других свойства жидкости. Физика дает им следующие объяснения:
- Испарение — это процесс, характеризующий постепенный переход вещества из жидкого состояния в твердое агрегатное состояние. Это происходит под воздействием тепловых воздействий на систему. Молекулы начинают движение и, изменяя свою кристаллическую решетку, переходят в газообразное состояние. Процесс может продолжаться до тех пор, пока вся жидкость не превратится в пар (для открытых систем). Или до установления равновесия (для закрытых сосудов).
- Конденсация — процесс, противоположный указанному выше. Здесь пар превращается в молекулы жидкости. Это происходит до тех пор, пока не установится равновесие или полный фазовый переход.
 Пар выбрасывает в жидкость больше частиц, чем в нее.
Пар выбрасывает в жидкость больше частиц, чем в нее.
Типичными примерами этих двух процессов в природе являются испарение воды с поверхности Мирового океана, ее конденсация в верхних слоях атмосферы, а затем осадки.
Механические свойства жидкости
Эти свойства изучаются такой наукой, как гидромеханика. В частности — его раздел, теория механики жидкости и газа. К основным механическим параметрам, характеризующим агрегатное состояние рассматриваемых веществ, относятся:
- вязкость.
- конкретный вес;
- плотность;
Под плотностью жидкого тела понимается его масса, которая содержится в единице объема. Этот показатель варьируется для разных соединений. По этому показателю уже есть экспериментально рассчитанные и измеренные данные, которые заносятся в специальные таблицы.
Удельным весом считается масса единицы объема жидкости. Этот показатель сильно зависит от температуры (при повышении его вес уменьшается).
Зачем изучать механические свойства жидкостей? Эти знания важны для понимания процессов, происходящих в природе в организме человека. Даже при создании технических средств, различных изделий. В конце концов, жидкие вещества — одна из самых распространенных агрегатных форм на нашей планете.
Даже при создании технических средств, различных изделий. В конце концов, жидкие вещества — одна из самых распространенных агрегатных форм на нашей планете.
Неньютоновские жидкости и их свойства
Свойства газов, жидкостей, твердых тел являются объектом изучения в физике, а также в некоторых смежных дисциплинах. Однако, помимо традиционных жидких веществ, существуют еще так называемые неньютоновские вещества, которые также изучаются этой наукой. Что они собой представляют и почему получили такое название?
Чтобы понять, что такое такие соединения, приведем самые распространенные бытовые примеры:
- раствор крахмала в воде и так далее.
- «резинка для рук», или жевательная резинка для рук;
- «слизь», в которую играют дети;
- обычная строительная краска;
То есть это жидкости, вязкость которых подчиняется градиенту скорости. Чем быстрее удар, тем выше индекс вязкости. Поэтому при сильном ударе ручной резины о пол она превращается в полностью твердое вещество, которое может расколоться.
Если оставить его в покое, за считанные минуты он буквально растечется в липкую лужу. Неньютоновские жидкости — это уникальные по своим свойствам вещества, которые нашли применение не только в технических целях, но и в культурной и повседневной жизни.
Поделиться:
- Предыдущая записьЗначение и происхождение фразеологизма «злоба дня». Употребление в СМИ и литературе
- Следующая записьОдноклеточные водоросли: особенности строения. Представители одноклеточных водорослей
×
Рекомендуем посмотреть
Adblock
detector
Свойства жидкостей: физика
Все тела, которые окружают человека, состоят из различных веществ и имеют различные свойства и характеристики. Все объекты материального мира построены по единым правилам. Они состоят из атомов, молекул и иных мелких образований на микроуровне. Все соединения не имеют общих показателей, так как они исчисляются миллионами. Поэтому и свойства у них также различны. Все вещества имеют четыре основных агрегатных состояния:
Все соединения не имеют общих показателей, так как они исчисляются миллионами. Поэтому и свойства у них также различны. Все вещества имеют четыре основных агрегатных состояния:
- газообразное;
- твердое;
- в виде жидкости;
- в виде плазмы.
При рассмотрении жидкости необходимо понять, что они также обладают собственными свойствами, характеристиками, а также особенностями строения. При классификации различных жидкостей за основу взяты их основные свойства, структура и химическое строение. Также имеют принципиальное значение типы взаимодействия между различными частицами и их составляющими компонентами.
Рисунок 1. Главные свойства жидкостей. Автор24 — интернет-биржа студенческих работ
Выделяют ряд основных видов жидкостей. Среди них преобладают те, которые состоят из атомов, где основной сдерживающей силой является сила Ван-дер-Ваальса. Подобные жидкие газы можно разглядеть в метане, аргоне и некоторых других веществах. Подобные жидкости состоят из пары одинаковых атомов. Также выделяют вещества, которые состоят из связанных между собой ковалентных связей, а также те, где присутствуют элементы водородной связи. Также есть интересные варианты особенных структур жидкости. Они выражаются в виде:
Подобные жидкости состоят из пары одинаковых атомов. Также выделяют вещества, которые состоят из связанных между собой ковалентных связей, а также те, где присутствуют элементы водородной связи. Также есть интересные варианты особенных структур жидкости. Они выражаются в виде:
- жидких кристаллов;
- неньютоновской жидкости.
Физические свойства жидкости
Рисунок 2. Физические свойства жидкостей. Автор24 — интернет-биржа студенческих работ
Обычно выделяют физические свойства жидкости при рассмотрении характерных черт того или иного вещества. Они отличают их от определенного агрегатного состояния. В настоящее время выделяется достаточно большое количество основных характеристик. Они позволяют с большой степенью точности сделать описание рассматриваемых веществ.
Среди таких физических свойств жидкости выделяют:
- маленькая возможность изменения собственного объема при изменении температуры и давления;
- обладание свойством текучести.

Любая жидкость может легко менять свою форму и распределяться по определенному объему. Форма жидкости зависит от собственных характеристик и воздействия внешних факторов. Сила тяжести позволяет деформировать молекулы жидкости до определенного состояния. Их форма становится неопределенной. При помещении жидкости в такие условия, где силы притяжения ограничены или почти полностью отсутствуют, она примет совершенно новые определенные формы. Жидкости принимает форму идеального шара. Подобный эффект можно наблюдать на орбите Земли на борту Международной космической станции.
При рассмотрении объема жидкости общие признаки соответствия свойств можно разглядеть и у газов. Газы и жидкости могут занимать весь объем пространства, где они находятся в определенное время. Он может быть ограничен лишь стенками сосуда или помещения.
Вязкость
Рисунок 3. Вязкость жидкости. Автор24 — интернет-биржа студенческих работ
Одним из уникальных свойств жидкости является вязкость. При ее рассмотрении активно пользуются рядом основных параметров, которые заключаются в градиенте скорости движения и касательном напряжении. У этих величин есть линейная зависимость, которая отображается в ряде формул и основополагающих правилах. Вязкость подразумевает создание неограниченного движения вещества независимо от воздействия внешних факторов и сил.
При ее рассмотрении активно пользуются рядом основных параметров, которые заключаются в градиенте скорости движения и касательном напряжении. У этих величин есть линейная зависимость, которая отображается в ряде формул и основополагающих правилах. Вязкость подразумевает создание неограниченного движения вещества независимо от воздействия внешних факторов и сил.
Пример 1
В пример можно привести свойство воды при вытекании из сосуда. Жидкость будет продолжать осуществлять этот процесс, несмотря на все приложенные внешние воздействия, которые мешают так или иначе это сделать. К таким воздействиям относят обычно силу трения, силу тяжести и иные факторы.
Для неньютоновских жидкостей действуют иные параметры. Подобный тип жидкостей обладает большой степенью вязкости, поэтому оставляют за движением след. Этот показатель полностью зависит от приложенной температуры. При увеличении температуры вязкость некоторых веществ будет уменьшаться или увеличиваться. Эти действия зависят от химического строения жидкости.
Теплоемкость и поверхностное натяжение
Жидкости обладают способностями по поглощению веществами определенного количества тепла. Это им необходимо для того, чтобы повысить собственную температуру вещества. От веществ с разной степенью соединений и других показателей зависят способности по теплоемкости. Некоторые могут обладать более мощной теплоемкостью по сравнению с другими жидкостями. Одними из самых успешных теплоемких веществ является вода. Она накапливает в своих молекулах определенное количество тепла и сохраняет его некоторое время. Поэтому именно воду принято активно использовать в качестве элемента системы отопления, а также для приготовления пищи и иных нужд человека.
Поверхностное натяжение достигается в тот момент, когда жидкость занимает определенный объем. Она снаружи может граничить с другой средой, например, воздухом или другим веществом. В месте соприкосновения этих веществ создается так называемое разделение фаз. Также это явление принято считать поверхностным натяжением. Молекулы жидкости стремятся в этом положении окружить себя такими же частицами и сжимают жидкость еще больше. Поэтому визуально поверхность жидкого тела словно натягивается. Такое же явление начинает возникать при отсутствии признаков иных внешних факторов, так как идеальной формой жидкости является шар.
Молекулы жидкости стремятся в этом положении окружить себя такими же частицами и сжимают жидкость еще больше. Поэтому визуально поверхность жидкого тела словно натягивается. Такое же явление начинает возникать при отсутствии признаков иных внешних факторов, так как идеальной формой жидкости является шар.
Текучесть и сжимаемость
Для твердых и жидких тел выделяют ряд общих свойств. Одним из них стала текучесть. Для жидкостей она носит неограниченный характер. Оно возникает при воздействии внешних усилий к исследуемому объекту. В этом случае существует несколько вариантов развития событий. Жидкости в зависимости от степени и интенсивности воздействия может разделиться на два объекта или может начать перетекать. Новые части точно также заполнят объем сосуда, поскольку каждая из них не теряет первоначальных свойств.
Также жидкости чутко реагируют на воздействие различной температуры. Самая большая метаморфоза происходит при изменении агрегатного состояния вещества. Это достигается в процессе нагрева, охлаждения или кипения.
Сжимаемость характерна больше для газообразной жидкости. Они могут поддаваться сжатию при возникновении определенных условий. Одной из особенностей этого свойства является скорость всего процесса, а также его равномерность.
Помимо этого, жидкости могут испаряться и вновь конденсироваться. При испарении процесс характеризуется постепенным переходом вещества из жидкого агрегатного состояния в твердое. Конденсация обозначает обратный процесс по отношению к испарению.
Свойства жидкостей. Основные физические свойства жидкости
Известно, что все, что окружает человека, включая и его самого, — это тела, состоящие из веществ. Те, в свою очередь, построены из молекул, последние из атомов, а они — из еще более мелких структур. Однако окружающее разнообразие столь велико, что сложно представить даже какую-то общность. Так и есть. Соединения исчисляются миллионами, каждое из них уникально по свойствам, строению и выполняемой роли. Всего выделяют несколько фазовых состояний, по которым можно соотнести все вещества.
Агрегатные состояния веществ
Можно назвать четыре варианта агрегатного состояния соединений.
- Газы.
- Твердые вещества.
- Жидкости.
- Плазма — сильно разреженные ионизированные газы.
В данной статье мы рассмотрим свойства жидкостей, особенности их строения и возможные параметры характеристик.
Классификация жидких тел
В основу данного деления положены свойства жидкостей, их структура и химическое строение, а также типы взаимодействий между составляющими соединения частицами.
- Такие жидкости, которые состоят из атомов, удерживающихся между собой силами Ван-дер-Ваальса. Примерами могут служить жидкие газы (аргон, метан и другие).
- Такие вещества, которые состоят из двух одинаковых атомов. Примеры: газы в сжиженном виде — водород, азот, кислород и другие.
- Жидкие металлы — ртуть.
- Вещества, состоящие из элементов, связанных ковалентными полярными связями. Примеры: хлороводород, йодоводород, сероводород и прочие.

- Соединения, в которых присутствуют водородные связи. Примеры: вода, спирты, аммиак в растворе.
Существуют и особенные структуры — типа жидких кристаллов, неньютоновских жидкостей, которые обладают особыми свойствами.
Мы же рассмотрим основные свойства жидкости, которые отличают ее от всех других агрегатных состояний. В первую очередь это такие, которые принято называть физическими.
Свойства жидкостей: форма и объем
Всего можно выделить около 15 характеристик, которые позволяют описать, что же представляют собой рассматриваемые вещества и в чем заключается их ценность, особенности.
Самые первые физические свойства жидкости, которые приходят на ум при упоминании этого агрегатного состояния, это способность менять форму и занимать определенный объем. Так, например, если говорить о форме жидких веществ, то общепринято считать ее отсутствующей. Однако это не так.
Под действием всем известной силы тяжести капли вещества подвергаются некоей деформации, поэтому их форма нарушается и становится неопределенной. Однако если поместить каплю в условия, при которых гравитация не действует или сильно ограничена, то она примет идеальную форму шара. Таким образом, получив задание: «Назовите свойства жидкостей» человек, считающий себя достаточно сведущим в физике, должен упомянуть об этом факте.
Однако если поместить каплю в условия, при которых гравитация не действует или сильно ограничена, то она примет идеальную форму шара. Таким образом, получив задание: «Назовите свойства жидкостей» человек, считающий себя достаточно сведущим в физике, должен упомянуть об этом факте.
Что касается объема, то здесь следует заметить общие свойства газов и жидкостей. И те и другие способны занимать весь объем пространства, в котором находятся, ограничиваясь лишь стенками сосуда.
Вязкость
Физические свойства жидкости весьма разнообразны. Но уникальным является такое из них, как вязкость. Что это такое и чем определяется? Главные параметры, от которых зависит рассматриваемая величина, это:
- касательное напряжение;
- градиент скорости движения.
Зависимость указанных величин линейная. Если же объяснить более простыми словам, то вязкость, как и объем, — это такие свойства жидкостей и газов, которые являются для них общими и подразумевают неограниченное движение независимо от внешних сил воздействия.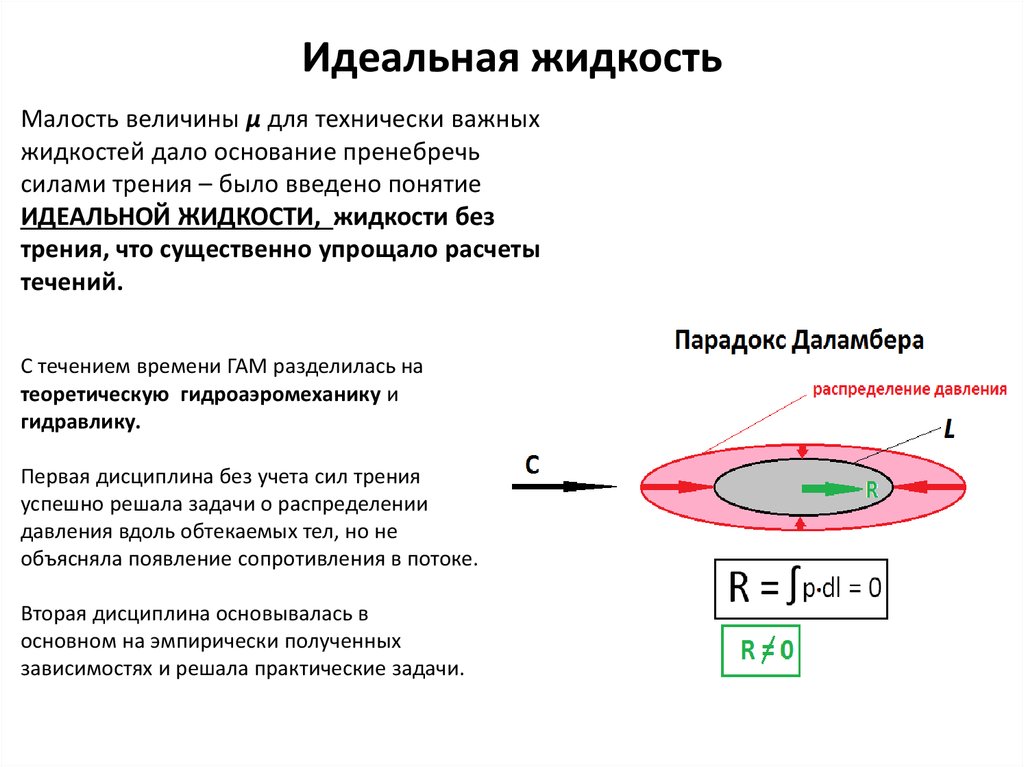 То есть если вода вытекает из сосуда, она будет продолжать это делать при любых воздействиях (сила тяжести, трения и прочих параметрах).
То есть если вода вытекает из сосуда, она будет продолжать это делать при любых воздействиях (сила тяжести, трения и прочих параметрах).
В этом состоит отличие от неньютоновских жидкостей, которые обладают большей вязкостью и могут оставлять вслед за движением дыры, заполняющиеся со временем.
От чего же будет зависеть данный показатель?
- От температуры. С увеличением температуры вязкость одних жидкостей увеличивается, а других, наоборот, уменьшается. Это зависит от конкретного соединения и его химического строения.
- От давления. Повышение вызывает увеличение показателя вязкости.
- От химического состава вещества. Вязкость изменяется при наличии примесей и посторонних компонентов в навеске чистого вещества.
Теплоемкость
Этот термин определяет способность вещества поглощать определенное количество тепла для увеличения собственной температуры на один градус по Цельсию. Существуют разные соединения по данному показателю.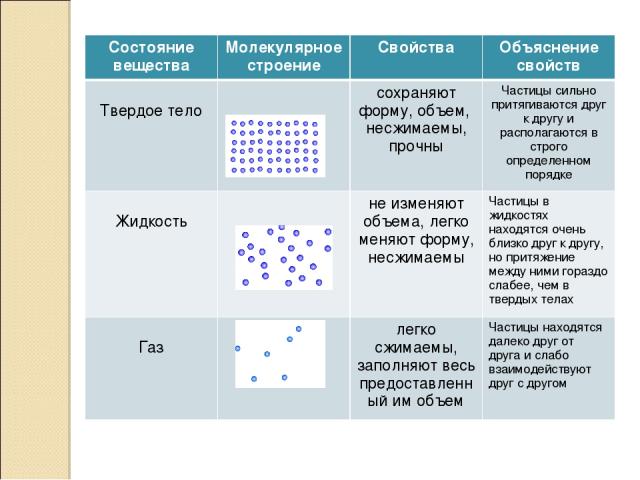 Одни обладают большей, другие меньшей теплоемкостью.
Одни обладают большей, другие меньшей теплоемкостью.
Так, например, вода — очень хороший теплонакопитель, что позволяет ее широко использовать для систем отопления, приготовления пищи и прочих нужд. В целом, показатель теплоемкости строго индивидуален для каждой отдельно взятой жидкости.
Поверхностное натяжение
Часто, получив задание: «Назовите свойства жидкостей» сразу вспоминают о поверхностном натяжении. Ведь с ним детей знакомят на уроках физики, химии и биологии. И каждый предмет объясняет этот важный параметр со своей стороны.
Классическое определение поверхностного натяжения следующее: это граница раздела фаз. То есть в то время, когда жидкость заняла определенный объем, она снаружи граничит с газовой средой — воздухом, паром или еще каким-либо веществом. Таким образом, на месте соприкосновения возникает разделение фаз.
При этом молекулы стремятся окружить себя как можно большим числом частиц и, таким образом, приводят как бы к сжиманию жидкости в целом. Следовательно, поверхность словно натягивается. Этим же свойством можно объяснить и шарообразную форму капель жидкости при отсутствии воздействия сил тяжести. Ведь именно такая форма идеальна с точки зрения энергии молекулы. Примеры:
Следовательно, поверхность словно натягивается. Этим же свойством можно объяснить и шарообразную форму капель жидкости при отсутствии воздействия сил тяжести. Ведь именно такая форма идеальна с точки зрения энергии молекулы. Примеры:
- мыльные пузыри;
- кипящая вода;
- капли жидкости в невесомости.
Некоторые насекомые приспособились к «хождению» по поверхности воды именно благодаря поверхностному натяжению. Примеры: водомерки, водоплавающие жуки, некоторые личинки.
Текучесть
Есть общие свойства жидкостей и твердых тел. Одно из них — текучесть. Вся разница в том, что для первых она неограниченна. В чем заключается суть этого параметра?
Если приложить внешнее воздействие к жидкому телу, то оно разделится на части и отделит их друг от друга, то есть перетечет. При этом каждая часть снова заполнит весь объем сосуда. Для твердых тел это свойство ограниченно и зависит от внешних условий.
Зависимость свойств от температуры
К таковым можно отнести три параметра, характеризующие рассматриваемые нами вещества:
- перегрев;
- охлаждение;
- кипение.

Такие свойства жидкостей, как перегревание и переохлаждение, напрямую связаны с критическими температурами (точками) кипения и замерзания соответственно. Перегревшейся называют жидкость, которая преодолела порог критической точки нагревания при воздействии температуры, однако внешних признаков кипения не подала.
Переохлажденной, соответственно, называют жидкость, которая преодолела порог критической точки перехода в другую фазу под воздействием низких температур, однако твердой не стала.
Как в первом, так и во втором случае есть условия для проявления таких свойств.
- Отсутствие механических воздействий на систему (движение, вибрация).
- Равномерная температура, без резких скачков и перепадов.
Интересен факт, что если в перегретую жидкость (например, воду) бросить посторонний предмет, то она мгновенно вскипит. Получить же ее можно нагреванием под воздействием излучения (в микроволновой печи).
Сосуществование с другими фазами веществ
Можно выделить два варианта по данному параметру.
- Жидкость — газ. Такие системы являются наиболее широко распространенными, поскольку существуют в природе повсеместно. Ведь испарение воды — часть естественного круговорота. При этом образующийся пар существует одновременно с жидкой водой. Если же говорить о замкнутой системе, то и там происходит испарение. Просто пар становится насыщенным очень быстро и вся система в целом приходит к равновесию: жидкость — насыщенный пар.
- Жидкость — твердые вещества. Особенно на таких системах заметно еще одно свойство — смачиваемость. При взаимодействии воды и твердого вещества последнее может смачиваться полностью, частично или вообще отталкивать воду. Существуют соединения, которые растворяются в воде быстро и практически неограниченно. Есть и те, что вообще к этому не способны (некоторые металлы, алмаз и прочие).
В целом изучением взаимодействия жидкостей с соединениями в других агрегатных состояниях занимается дисциплина гидроаэромеханика.
Сжимаемость
Основные свойства жидкости были бы неполными, если бы мы не упомянули о сжимаемости. Конечно, этот параметр больше характерен для газовых систем. Однако и рассматриваемые нами также могут поддаваться сжатию при определенных условиях.
Конечно, этот параметр больше характерен для газовых систем. Однако и рассматриваемые нами также могут поддаваться сжатию при определенных условиях.
Главное отличие — это скорость процесса и его равномерность. Если газ можно сжать быстро и под небольшим давлением, то жидкости сжимаются неравномерно, достаточно долго и при специально подобранных условиях.
Испарение и конденсация жидкостей
Это еще два свойства жидкости. Физика дает им следующие объяснения:
- Испарение — это процесс, который характеризует постепенный переход вещества из жидкого агрегатного состояния в твердое. Происходит это под действием тепловых воздействий на систему. Молекулы приходят в движение и, меняя свою кристаллическую решетку, переходят в газообразное состояние. Процесс может происходить до тех пор, пока вся жидкость не перейдет в пар (для открытых систем). Или же до установления равновесия (для замкнутых сосудов).
- Конденсация — процесс, противоположный выше обозначенному.
 Здесь пар переходит в молекулы жидкости. Так происходит до установления равновесия или полного фазового перехода. Пар отдает в жидкость большее количество частиц, чем она ему.
Здесь пар переходит в молекулы жидкости. Так происходит до установления равновесия или полного фазового перехода. Пар отдает в жидкость большее количество частиц, чем она ему.
Типичные примеры этих двух процессов в природе — испарение воды с поверхности Мирового океана, конденсация ее в верхних слоях атмосферы, а затем выпадение в виде осадков.
Механические свойства жидкости
Данные свойства являются предметом изучения такой науки, как гидромеханика. Конкретно — ее раздела, теории механики жидкости и газа. К основным механическим параметрам, характеризующим рассматриваемое агрегатное состояние веществ, относятся:
- плотность;
- удельный вес;
- вязкость.
Под плотностью жидкого тела понимают его массу, которая содержится в одной единице объема. Данный показатель для разных соединений варьируется. Существуют уже рассчитанные и измеренные экспериментальным путем данные по этому показателю, которые занесены в специальные таблицы.
Удельным весом принято считать вес одной единицы объема жидкости. Данный показатель сильно зависит от температуры (при повышении ее вес снижается).
Данный показатель сильно зависит от температуры (при повышении ее вес снижается).
Для чего следует изучать механические свойства жидкостей? Данные знания являются важными для понимания процессов, происходящих в природе, внутри человеческого организма. Также при создании технических средств, различной продукции. Ведь жидкие вещества — одна из самых распространенных агрегатных форм на нашей планете.
Неньютоновские жидкости и их свойства
Свойства газов, жидкостей, твердых тел — это объект изучения физики, а также некоторых смежных с ней дисциплин. Однако помимо традиционных жидких веществ, существуют еще и так называемые неньютоновские, их тоже изучает эта наука. Что они собой представляют и почему получили такое название?
Для понимания того, что собой представляют подобные соединения, приведем самые распространенные бытовые примеры:
- «лизун», которым играют дети;
- «хенд гам», или жвачка для рук;
- обычная строительная краска;
- раствор крахмала в воде и прочее.

То есть это такие жидкости, вязкость которых подчиняется градиенту скорости. Чем быстрее воздействие, тем выше показатель вязкости. Поэтому при резком ударе хенд гама об пол он превращается в совершенно твердое вещество, способное расколоться на части.
Если же оставить его в покое, то буквально через несколько минут он растечется липкой лужицей. Неньютоновские жидкости — достаточно уникальные по свойствам вещества, которые нашли применение не только в технических целях, но и в культурно-бытовых.
Каковы свойства жидкости? (Видео)
Привет и добро пожаловать в этот обзор свойств жидкостей ! Сначала мы обсудим макроскопические свойства, то есть то, что мы можем наблюдать глазами, а затем попытаемся объяснить эти свойства с молекулярной точки зрения. Так что, надеюсь, к концу видео, наряду с более формальными знаниями о свойствах жидкости, вы сможете сделать обоснованное предположение о том, как жидкость будет себя вести, просто основываясь на молекулярной структуре. Давайте начнем!
Давайте начнем!
Хорошей новостью на эту тему является то, что вы уже много знаете о жидкостях. Вы взаимодействуете с ними каждый день, поэтому многие их свойства должны быть вам знакомы. На самом деле, почему бы вам не остановиться на секунду, поставить видео на паузу и не записать две физические характеристики жидкостей. Если вы застряли, подумайте, чем они похожи и чем отличаются от твердых тел и газов.
Вот две относительно простые характеристики, которые мы можем распознать:
Один. Жидкости принимают форму сосуда. Другими словами, когда вы наливаете воду в чашку, она заполняет пространство и принимает форму этой чашки.
Но, во-вторых, жидкости не расширяются, чтобы заполнить сосуд. У них есть определенный объем, а значит, у них есть и поверхность.
Вы могли также подумать о липкости жидкости или ее способности течь; такими свойствами будут адгезия и вязкость. Все отличные идеи и прочее мы рассмотрим через минуту.
Но давайте рассмотрим первые два пункта и воспользуемся ими, чтобы сравнить жидкости с газами и твердыми телами. Жидкость часто является промежуточной фазой между ними и, таким образом, имеет общие характеристики с обоими. Как и твердые тела, жидкости не сжимаемы, то есть мы не можем сделать их еще меньше. Это потому, что они находятся в конденсированной фазе, где молекулы настолько близко друг к другу, что нет места, чтобы подтолкнуть их ближе. Но, как и газы, жидкости текучи и принимают форму своего сосуда (но, опять же, не расширяются, чтобы заполнить сосуд).
Жидкость часто является промежуточной фазой между ними и, таким образом, имеет общие характеристики с обоими. Как и твердые тела, жидкости не сжимаемы, то есть мы не можем сделать их еще меньше. Это потому, что они находятся в конденсированной фазе, где молекулы настолько близко друг к другу, что нет места, чтобы подтолкнуть их ближе. Но, как и газы, жидкости текучи и принимают форму своего сосуда (но, опять же, не расширяются, чтобы заполнить сосуд).
Мы можем получить базовое молекулярное представление о свойствах жидкости с помощью этой простой диаграммы, показывающей микроскопическое изображение каждой фазы. Обратите внимание, что молекулы в жидкости плотно упакованы, а не в организованной решетке, как в твердом теле. Это потому, что в систему было добавлено достаточно энергии, чтобы разрушить силы, удерживающие молекулы в твердом теле неподвижно. Это позволяет молекулам двигаться вокруг друг друга, постоянно разрывая и образуя взаимодействия. Помните, что хотя это и конденсированная фаза, молекулы все время движутся! Однако большинству молекул в жидкости не хватает кинетической энергии, чтобы полностью отделиться друг от друга и раствориться в газе. Вы можете думать о жидкостях (и фазах в целом) как о балансе между межмолекулярными силами, удерживающими молекулы вместе, и кинетической энергией молекул, пытающихся их разделить. Точное поведение каждой жидкости во многом определяется типом и силой этих межмолекулярных сил.
Вы можете думать о жидкостях (и фазах в целом) как о балансе между межмолекулярными силами, удерживающими молекулы вместе, и кинетической энергией молекул, пытающихся их разделить. Точное поведение каждой жидкости во многом определяется типом и силой этих межмолекулярных сил.
Давайте вернемся к другим свойствам, о которых мы упоминали во время мозгового штурма, — когезии, адгезии, поверхностному натяжению и вязкости. Мы можем получить интуитивное и глубокое понимание этих свойств, если рассмотрим межмолекулярные силы.
Во-первых, запомните, межмолекулярные силы — это несвязывающие силы, которые притягивают отдельные молекулы друг к другу. Обычно они намного слабее ионных, ковалентных или металлических связей, но вместе они ответственны за конденсированные фазы молекулярных соединений. Другими словами, если бы их не существовало, каждое молекулярное соединение было бы газом при стандартных давлениях и температурах. И у нас нет времени, чтобы сделать полный обзор каждого типа межмолекулярного взаимодействия, поэтому я просто кратко назову их. Существуют ионно-дипольные, водородные связи, диполь-дипольные, ионно-индуцированный диполь, диполь-индуцированный диполь и лондоновские дисперсионные силы, от самых сильных до самых слабых.
Существуют ионно-дипольные, водородные связи, диполь-дипольные, ионно-индуцированный диполь, диполь-индуцированный диполь и лондоновские дисперсионные силы, от самых сильных до самых слабых.
Поведение жидкости часто напрямую связано с типом и силой межмолекулярных сил.
Нам нужно понять две вещи об этих силах: насколько сильны межмолекулярные силы внутри жидкости (их сцепление ) и насколько сильны межмолекулярные силы между жидкостью и их поверхностью (их адгезия ).
Часто когезия и адгезия связаны. Например, вода обладает сильными силами сцепления из-за сложной сети водородных связей, но это также означает, что молекулы воды могут иметь сильные силы сцепления, если они могут водородно связываться с поверхностью. Теперь давайте воспользуемся этим знанием, чтобы понять поверхностное натяжение.
Возможно, вы наблюдали явление, связанное с поверхностным натяжением, даже если не знали об этом. Вы когда-нибудь переполняли стакан воды и замечали купол, формирующийся над верхней частью стакана?
Почему это происходит? Кажется, что это противоречит физике.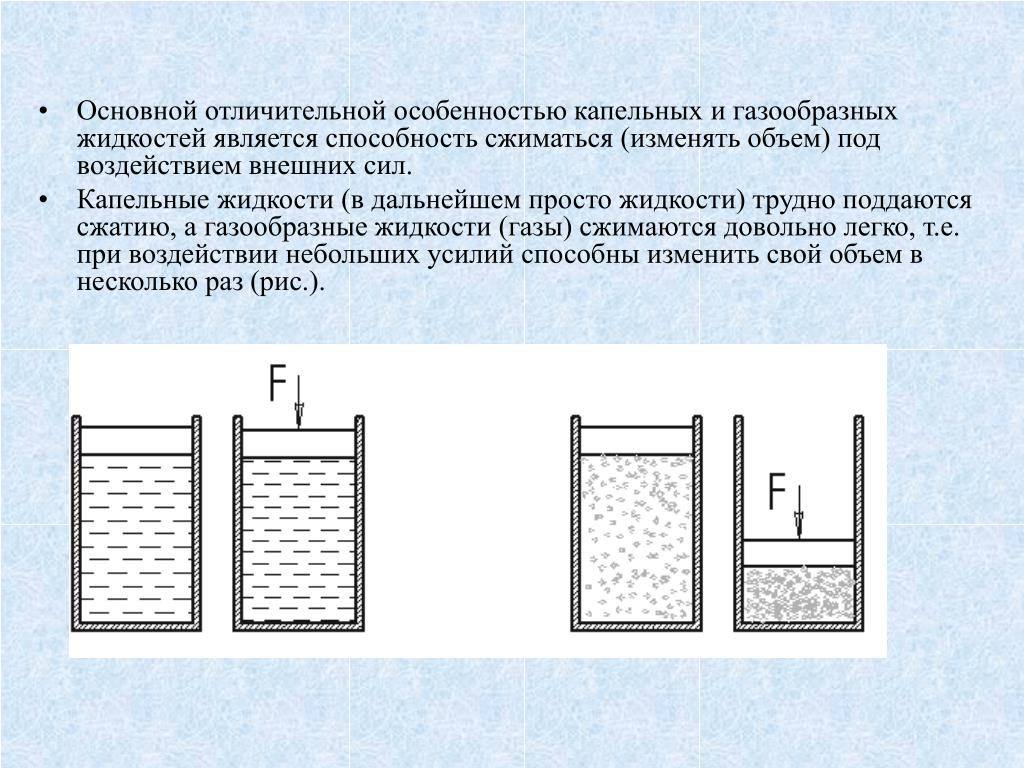 Давайте увеличим масштаб и посмотрим на это с точки зрения молекулы.
Давайте увеличим масштаб и посмотрим на это с точки зрения молекулы.
Молекулы воды на поверхности находятся в невыгодном положении — они могут взаимодействовать только с другими молекулами под ними, тогда как внутренняя молекула может взаимодействовать с другими молекулами во всех направлениях. Следовательно, поверхность имеет наименьшее количество молекул и наименьшую возможную площадь, что создает на поверхности натянутую «пленку». Вот почему вода образует сферические капли на восковой поверхности — молекулы предпочитают взаимодействовать друг с другом, а не с поверхностными молекулами. Сила сцепления больше, чем сила сцепления.
Напротив, межмолекулярные силы в масле слишком слабы, чтобы удерживать каплю — эти молекулы скорее взаимодействуют с поверхностью, поэтому масло растекается. Другими словами, силы сцепления сильнее, чем силы сцепления.
Мы также можем применить это, чтобы понять формирование мениска. Молекулы воды сильно притягиваются к молекулам стекла и поднимаются вверх по поверхности до тех пор, пока гравитация не сравняется с этой силой.
Однако не все жидкости подходят для этого. Некоторые лежат плашмя, потому что сила сцепления недостаточно сильна, чтобы преодолеть гравитацию. На самом деле это то, что происходит, когда вода находится в пластиковой пробирке.
А некоторые образуют выпуклый мениск , где силы сцепления настолько сильнее сил сцепления, что молекулы образуют сферическую вершину. Это происходит с жидкой ртутью в барометре или старом термометре, потому что когезионные силы представляют собой прочные металлические связи.
И, наконец, рассмотрим вязкость . Если вы не знакомы с этим словом, то в основном это толщина жидкости или, говоря более технически, сопротивление жидкости течению. Чем больше вязкость, тем медленнее течет. Например, масло и мед имеют гораздо более высокую вязкость, чем вода или ацетон (распространенный ингредиент жидкости для снятия лака). Почему? Что ж, давайте подумаем, как мы можем связать это макроскопическое свойство с их межмолекулярными силами и физическими свойствами.
Можно представить, что вязкость на молекулярном уровне коррелирует с тем, насколько когезивной является жидкость, но с дополнительным учетом. Мы также должны думать о размере и форме молекул. Группа небольших молекул со слабым взаимодействием не слипается, поэтому они не будут сопротивляться потоку. Но длинные, тонкие, более липкие молекулы спутываются друг с другом, поэтому они сопротивляются движению в разные стороны. В более широком масштабе представьте себе попытку высыпать сваренные спагетти из кастрюли. Лапша липкая и спутанная, поэтому не выпадает из кастрюли. Вы можете думать о молекулах масла и меда аналогичным образом. В качестве примечания, это всего лишь качественное понимание вязкости. Количественный подход требует гидродинамики и техники.
Давайте закончим кратким обзором.
Жидкости являются промежуточной фазой между твердыми телами и газами. Молекулы плотно упакованы, как твердые тела, но обладают достаточной энергией для движения, что позволяет им течь подобно газу и принимать форму своих сосудов.
Мы можем понять свойства жидкости, если знаем о типе и величине их межмолекулярных сил. Мы можем даже предсказать их поведение, если у нас будет достаточно информации об относительной силе их когезионных и адгезионных сил, что также требует знания поверхностных молекул и их межмолекулярных сил.
Теперь, прежде чем мы начнем, давайте ответим на несколько контрольных вопросов, чтобы узнать, что вы помните.
1. Какое из следующих свойств НЕ является свойством жидкости?
- Жидкости расширяются, чтобы заполнить сосуд
- Жидкости имеют определенный объем
- Жидкости имеют поверхность
- Жидкости несжимаемы
Правильный ответ A! Жидкости ДЕЙСТВИТЕЛЬНО принимают форму своего сосуда, но НЕ расширяются, чтобы заполнить свой сосуд.
2. Верно или неверно: сцепление показывает, насколько сильны межмолекулярные силы между жидкостью и их поверхностью.
Правильный ответ — Неверно! Это описание адгезии.
3. К какому типу мениска приводят сильные адгезионные силы?
К какому типу мениска приводят сильные адгезионные силы?
- Вогнутая
- Плоская
- Выпуклая
- Психоделическая
Правильный ответ — А! Молекулы воды сильно притягиваются к молекулам стекла и поднимаются вверх по поверхности до тех пор, пока гравитация не сравняется с этой силой.
На этом обзоре все! Спасибо за просмотр и удачной учебы!
жидкость | Химия, свойства и факты
жидкость
Посмотреть все носители
- Ключевые люди:
- Перси Уильямс Бриджмен Йоханнес Дидерик ван дер Ваальс Исидор Траубе
- Похожие темы:
- жидкокристаллический решение поглощение чистая жидкость волатильность
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
жидкость , в физике одно из трех основных состояний вещества, промежуточное между газом и кристаллическим твердым телом.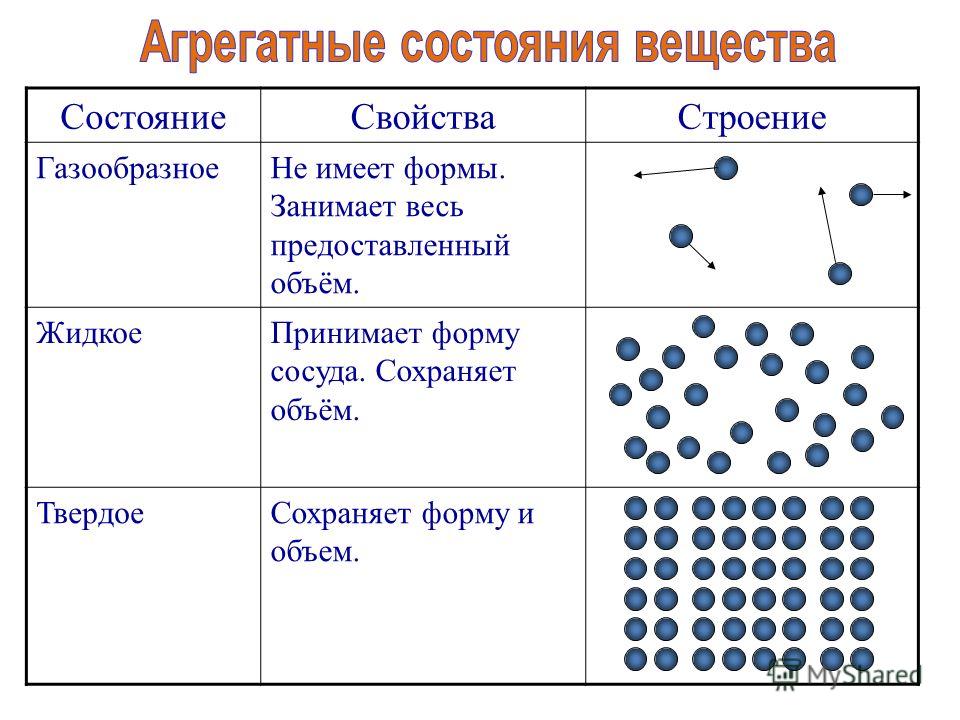
Физические свойства жидкостей
Наиболее очевидными физическими свойствами жидкости являются сохранение объема и ее соответствие форме сосуда. Когда жидкое вещество наливается в сосуд, оно принимает форму сосуда, и, пока вещество находится в жидком состоянии, оно останется внутри сосуда. Кроме того, когда жидкость переливается из одного сосуда в другой, она сохраняет свой объем (пока не происходит испарения или изменения температуры), но не форму. Эти свойства служат удобными критериями для отличия жидкого состояния от твердого и газообразного состояний. Газы, например, расширяются, чтобы заполнить свой сосуд, так что занимаемый ими объем равен объему сосуда. Твердые тела сохраняют свою форму и объем при перемещении из одного контейнера в другой.
Жидкости можно разделить на две основные категории: чистые жидкости и смеси жидкостей. На Земле вода — самая распространенная жидкость, хотя большая часть воды, с которой соприкасаются организмы, находится не в чистом виде, а в смеси, в которой растворены различные вещества. К таким смесям относятся те жидкости, которые необходимы для жизни, например кровь, напитки и морская вода. Морская вода представляет собой жидкую смесь, в которой растворены различные соли. Хотя в чистом виде эти соли представляют собой твердые тела, в океанах они являются частью жидкой фазы. Так, жидкие смеси содержат вещества, которые в чистом виде сами могут быть жидкостями, твердыми телами и даже газами.
К таким смесям относятся те жидкости, которые необходимы для жизни, например кровь, напитки и морская вода. Морская вода представляет собой жидкую смесь, в которой растворены различные соли. Хотя в чистом виде эти соли представляют собой твердые тела, в океанах они являются частью жидкой фазы. Так, жидкие смеси содержат вещества, которые в чистом виде сами могут быть жидкостями, твердыми телами и даже газами.
Жидкое состояние иногда описывают просто как состояние, находящееся между твердым и газообразным состояниями, и для простых молекул это различие однозначно. Однако четкое различие между жидким, газообразным и твердым состояниями имеет место только для тех веществ, молекулы которых состоят из небольшого числа атомов. Когда число превышает примерно 20, жидкость часто может быть охлаждена ниже истинной точки плавления с образованием стекла, которое обладает многими механическими свойствами твердого тела, но не имеет кристаллического порядка. Если число атомов в молекуле превышает примерно 100–200, классификация на твердые, жидкие и газообразные перестает быть полезной. При низких температурах такими веществами обычно являются стекла или аморфные тела, и их жесткость падает с повышением температуры, т. е. они не имеют фиксированных температур плавления; однако некоторые из них могут образовывать настоящие жидкости. Для этих больших молекул газообразное состояние недостижимо, потому что они химически разлагаются до того, как температура станет достаточно высокой для испарения жидкости. Так ведут себя синтетические и натуральные высокомолекулярные полимеры (например, нейлон и каучук).
При низких температурах такими веществами обычно являются стекла или аморфные тела, и их жесткость падает с повышением температуры, т. е. они не имеют фиксированных температур плавления; однако некоторые из них могут образовывать настоящие жидкости. Для этих больших молекул газообразное состояние недостижимо, потому что они химически разлагаются до того, как температура станет достаточно высокой для испарения жидкости. Так ведут себя синтетические и натуральные высокомолекулярные полимеры (например, нейлон и каучук).
Викторина «Британника»
Наука: правда или вымысел?
Вас увлекает физика? Устали от геологии? С помощью этих вопросов отделите научный факт от вымысла.
Если молекулы большие, жесткие и примерно плоские или линейные, как в ацетате холестерила или p -азоксианизоле, твердое вещество может плавиться в анизотропную жидкость (т. е. такую, которая неоднородна во всех направлениях), в которой молекулы могут свободно перемещаться, но с большим трудом вращаются. Такое состояние называется жидким кристаллом, и анизотропия вызывает изменения показателя преломления (мера изменения направления света при переходе из одной среды в другую) в зависимости от направления падающего света и, следовательно, приводит к необычным оптическим последствия. Жидкие кристаллы нашли широкое применение в устройствах для измерения температуры, дисплеях часов и калькуляторов. Однако никакие неорганические соединения и только около 5 процентов известных органических соединений не образуют жидких кристаллов. Теория нормальных жидкостей есть поэтому преимущественно теория поведения веществ, состоящих из простых молекул.
Такое состояние называется жидким кристаллом, и анизотропия вызывает изменения показателя преломления (мера изменения направления света при переходе из одной среды в другую) в зависимости от направления падающего света и, следовательно, приводит к необычным оптическим последствия. Жидкие кристаллы нашли широкое применение в устройствах для измерения температуры, дисплеях часов и калькуляторов. Однако никакие неорганические соединения и только около 5 процентов известных органических соединений не образуют жидких кристаллов. Теория нормальных жидкостей есть поэтому преимущественно теория поведения веществ, состоящих из простых молекул.
Жидкость лишена как сильной пространственной упорядоченности твердого тела, хотя она имеет высокую плотность твердых тел, так и отсутствия упорядоченности газа, являющегося следствием малой плотности газов, т. е. молекулы газа относительно свободны друг от друга. влияние. Сочетание высокой плотности и частичного порядка в жидкостях привело к трудностям в разработке количественно приемлемых теорий жидкостей. Понимание жидкого состояния, как и всех состояний материи, пришло с кинетической молекулярной теорией, утверждавшей, что материя состоит из частиц, находящихся в постоянном движении и что это движение есть проявление тепловой энергии. Чем больше тепловая энергия частицы, тем быстрее она двигалась.
Понимание жидкого состояния, как и всех состояний материи, пришло с кинетической молекулярной теорией, утверждавшей, что материя состоит из частиц, находящихся в постоянном движении и что это движение есть проявление тепловой энергии. Чем больше тепловая энергия частицы, тем быстрее она двигалась.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Переходы между состояниями материи
В самых общих чертах частицы, из которых состоит материя, включают молекулы, атомы, ионы и электроны. В газе эти частицы находятся достаточно далеко друг от друга и движутся достаточно быстро, чтобы избежать влияния друг друга, которое может быть разного рода, например, притяжения или отталкивания из-за электрических зарядов и специфических сил притяжения, в которых участвуют электроны, вращающиеся вокруг атома. ядра. Движение частиц прямолинейно, и возникающие в результате столкновения происходят без потери энергии, хотя между сталкивающимися частицами может происходить обмен энергиями. Когда газ охлаждается, его частицы движутся медленнее, а те из них, которые достаточно медленны, чтобы задерживаться рядом друг с другом, сливаются, потому что сила притяжения преодолевает их пониженную кинетическую энергию и, по определению, тепловую энергию. Каждая частица, когда она соединяется с другими в жидком состоянии, отдает некоторое количество тепла, называемое скрытой теплотой сжижения, но каждая частица продолжает двигаться с той же скоростью внутри жидкости, пока температура остается на уровне точки конденсации. Расстояния, которые частицы могут пройти в жидкости без столкновений, порядка диаметров молекул. По мере охлаждения жидкости частицы движутся еще медленнее, пока при температуре замерзания энергия притяжения не создает настолько высокую плотность, что жидкость замерзает в твердом состоянии. Однако они продолжают вибрировать с той же скоростью, пока температура остается на уровне точки замерзания, и их скрытая теплота плавления высвобождается в процессе замерзания.
Когда газ охлаждается, его частицы движутся медленнее, а те из них, которые достаточно медленны, чтобы задерживаться рядом друг с другом, сливаются, потому что сила притяжения преодолевает их пониженную кинетическую энергию и, по определению, тепловую энергию. Каждая частица, когда она соединяется с другими в жидком состоянии, отдает некоторое количество тепла, называемое скрытой теплотой сжижения, но каждая частица продолжает двигаться с той же скоростью внутри жидкости, пока температура остается на уровне точки конденсации. Расстояния, которые частицы могут пройти в жидкости без столкновений, порядка диаметров молекул. По мере охлаждения жидкости частицы движутся еще медленнее, пока при температуре замерзания энергия притяжения не создает настолько высокую плотность, что жидкость замерзает в твердом состоянии. Однако они продолжают вибрировать с той же скоростью, пока температура остается на уровне точки замерзания, и их скрытая теплота плавления высвобождается в процессе замерзания. Нагрев твердого тела обеспечивает частицы теплотой плавления, необходимой для того, чтобы они могли избежать влияния друг друга, достаточного для перемещения в жидком состоянии. Дальнейший нагрев обеспечивает жидкие частицы своей теплотой испарения, что позволяет им полностью отделяться друг от друга и переходить в парообразное или газообразное состояние.
Нагрев твердого тела обеспечивает частицы теплотой плавления, необходимой для того, чтобы они могли избежать влияния друг друга, достаточного для перемещения в жидком состоянии. Дальнейший нагрев обеспечивает жидкие частицы своей теплотой испарения, что позволяет им полностью отделяться друг от друга и переходить в парообразное или газообразное состояние.
Этот резко упрощенный взгляд на состояния материи игнорирует многие усложняющие факторы, самым важным из которых является тот факт, что никакие две частицы не должны двигаться с одинаковой скоростью в газе, жидкости или твердом теле, и связанный с этим факт, что даже в твердом теле некоторые частицы могли приобрести энергию, необходимую для существования в виде частиц газа, в то время как даже в газе некоторые частицы могут быть практически неподвижными в течение короткого времени. Необходимо учитывать среднюю кинетическую энергию частиц, а также тот факт, что движение носит случайный характер. На границе между жидкостью и газом и между жидкостью и твердым телом всегда происходит обмен частицами: медленные молекулы газа конденсируются на поверхности жидкости, а быстрые молекулы жидкости уходят в газ. Равновесие достигается в любой замкнутой системе, так что количество обменов в любом направлении одинаково. Поскольку кинетическая энергия частиц в жидком состоянии может быть определена только в статистических терминах (т. е. можно найти все возможные значения), обсуждение жидкого (а также газообразного) состояния на молекулярном уровне включает формулировки в терминах вероятности функции.
Равновесие достигается в любой замкнутой системе, так что количество обменов в любом направлении одинаково. Поскольку кинетическая энергия частиц в жидком состоянии может быть определена только в статистических терминах (т. е. можно найти все возможные значения), обсуждение жидкого (а также газообразного) состояния на молекулярном уровне включает формулировки в терминах вероятности функции.
Свойства жидкостей | Химия
- Закладка
- Глоссарий терминов
Вода льется из крана. Мед вытекает из бутылочки. Бензин вытекает из насоса. Это всего лишь три примера очень разнообразного состояния материи: жидкости. Одним из ключевых определяющих свойств жидкостей является их способность течь. Однако, помимо этой особенности, поведение различных жидкостей варьируется в широком диапазоне. Некоторые жидкости текут относительно легко, например вода или масло, в то время как другие, например мед или патока, текут довольно медленно. Некоторые скользкие, а некоторые липкие. Откуда берутся эти разные модели поведения?
Откуда берутся эти разные модели поведения?
Когда дело доходит до взаимодействия между различными жидкостями, некоторые из них хорошо смешиваются: вспомните Ширли Темпл, сделанный из имбирного эля и гренадина. Другие, однако, кажется, вообще не смешиваются. Рассмотрим разливы нефти, когда нефть плавает липким радужным слоем на поверхности воды. Вы также можете заметить подобное явление в некоторых заправках для салатов, которые разделяются на масляный слой, лежащий поверх слоя уксуса, который в основном состоит из воды. Почему эти жидкости плохо смешиваются?
Такое различное поведение возникает в основном из-за различных типов межмолекулярных сил, присутствующих в жидкостях. В этом модуле мы сначала обсудим жидкости в контексте двух других основных состояний материи, твердых тел и газов. Затем мы рассмотрим краткий обзор межмолекулярных сил и, наконец, исследуем, как межмолекулярные силы определяют поведение жидкостей.
Жидкости, твердые вещества и газы
Жидкости текут, потому что межмолекулярные силы между молекулами достаточно слабы, чтобы позволить молекулам двигаться относительно друг друга. Межмолекулярные силы — это силы между соседними молекулами. (Их не следует путать с внутримолекулярными силами, такими как ковалентные и ионные связи, которые являются силами, действующими внутри отдельных молекул, чтобы удерживать атомы вместе.) Эти силы являются притягивающими, когда отрицательный заряд взаимодействует с соседним положительным зарядом, и отталкивающими, когда соседние заряды одинаковы, либо оба положительные, либо оба отрицательные. В жидкостях межмолекулярные силы могут перемещаться между молекулами и позволять им двигаться относительно друг друга и течь. (См. рисунок 1 для иллюстрации различных межмолекулярных сил и взаимодействий.)
Межмолекулярные силы — это силы между соседними молекулами. (Их не следует путать с внутримолекулярными силами, такими как ковалентные и ионные связи, которые являются силами, действующими внутри отдельных молекул, чтобы удерживать атомы вместе.) Эти силы являются притягивающими, когда отрицательный заряд взаимодействует с соседним положительным зарядом, и отталкивающими, когда соседние заряды одинаковы, либо оба положительные, либо оба отрицательные. В жидкостях межмолекулярные силы могут перемещаться между молекулами и позволять им двигаться относительно друг друга и течь. (См. рисунок 1 для иллюстрации различных межмолекулярных сил и взаимодействий.)
 На панели B показан образец жидкости с несколькими молекулами, притягивающимися и отталкивающимися за счет их диполь-дипольных взаимодействий. изображение ©
Калифорнийский университет в Дэвисе ChemWiki
На панели B показан образец жидкости с несколькими молекулами, притягивающимися и отталкивающимися за счет их диполь-дипольных взаимодействий. изображение ©
Калифорнийский университет в Дэвисе ChemWikiСравните это с твердым телом, в котором межмолекулярные силы настолько сильны, что допускают очень мало движений. Хотя молекулы могут вибрировать в твердом теле, они, по сути, заперты в жесткой структуре, как описано в модуле «Свойства твердых тел». На другом конце спектра находятся газы, в которых молекулы находятся так далеко друг от друга, что межмолекулярные силы фактически отсутствуют, и молекулы могут совершенно свободно двигаться и течь независимо друг от друга.
На молекулярном уровне жидкости обладают некоторыми свойствами газов и некоторыми свойствами твердых тел. Во-первых, жидкости разделяют способность течь с газами. И жидкая, и газовая фазы являются текучими, а это означает, что межмолекулярные силы позволяют молекулам перемещаться. На обоих этих этапах материалы не имеют фиксированной формы, а вместо этого формируются контейнерами, в которых они находятся.
Твердые тела не являются жидкими, но жидкости имеют с ними другое важное свойство. Жидкости и твердые тела удерживаются вместе сильными межмолекулярными силами и намного более плотны, чем газы, что приводит к их описанию как фазы «конденсированного вещества», поскольку они оба относительно несжимаемы. (На рис. 2 показаны различия между газами, жидкостями и твердыми телами на атомарном уровне.)
Рисунок 2 : Три состояния вещества на атомарном уровне: твердое, жидкое и газообразное. изображение © Йелод Большинство веществ могут перемещаться между твердой, жидкой и газообразной фазами при изменении температуры. Рассмотрим молекулу H 2 0: она принимает форму льда, кристаллического твердого вещества, при температуре ниже 0°C; вода, жидкость, от 0° до 100°С; и водяной пар, или пар, газ, выше 100°С. Эти переходы происходят потому, что температура влияет на межмолекулярное притяжение между молекулами. Когда Н 2 0 превращается из жидкости в газ, например, повышение температуры приводит к увеличению кинетической энергии молекул, так что в конечном итоге она преодолевает межмолекулярные силы, и молекулы могут свободно перемещаться в газовой фазе. Однако внутримолекулярные силы, удерживающие молекулу H 2 0 вместе, не изменились; H 2 0 остается H 2 0, независимо от состояния вещества. Подробнее о фазовых переходах можно прочитать в модуле «Состояния материи».
Однако внутримолекулярные силы, удерживающие молекулу H 2 0 вместе, не изменились; H 2 0 остается H 2 0, независимо от состояния вещества. Подробнее о фазовых переходах можно прочитать в модуле «Состояния материи».
Теперь, когда мы обсудили сходство жидкостей с твердыми телами и газами и отличия от них, мы можем сосредоточиться на широком мире жидкостей. Однако сначала нам нужно кратко представить различные типы межмолекулярных сил, которые определяют поведение жидкостей и других состояний материи.
Проверка понимания
Межмолекулярные силы
- а. Силы, которые удерживают атомы вместе внутри молекулы.
- б. силы между различными молекулами.
Межмолекулярные силы
Как мы описали ранее, межмолекулярные силы представляют собой силы притяжения или отталкивания между молекулами, отличные от внутримолекулярных сил, удерживающих молекулы вместе. Однако внутримолекулярные силы играют роль в определении типов межмолекулярных сил, которые могут образовываться. Межмолекулярные силы бывают разных видов, но общая идея для всех них одинакова: заряд в одной молекуле взаимодействует с зарядом в другой молекуле. В зависимости от того, какие внутримолекулярные силы, такие как полярные ковалентные связи или неполярные ковалентные связи, присутствуют, заряды могут иметь различную постоянство и силу, допуская различные типы межмолекулярных сил.
Однако внутримолекулярные силы играют роль в определении типов межмолекулярных сил, которые могут образовываться. Межмолекулярные силы бывают разных видов, но общая идея для всех них одинакова: заряд в одной молекуле взаимодействует с зарядом в другой молекуле. В зависимости от того, какие внутримолекулярные силы, такие как полярные ковалентные связи или неполярные ковалентные связи, присутствуют, заряды могут иметь различную постоянство и силу, допуская различные типы межмолекулярных сил.
Итак, откуда берутся эти заряды? В некоторых случаях молекулы удерживаются вместе полярными ковалентными связями, что означает, что электроны неравномерно распределены между связанными атомами. (Этот тип связи более подробно описан в модуле «Химическая связь».) Это неравномерное распределение приводит к частичному заряду: атом с большим сродством к электрону, то есть более электроотрицательный атом, имеет частичный отрицательный заряд, а атом с меньшим сродством к электрону менее электроотрицательный атом имеет частичный положительный заряд. Это неравномерное распределение электронов называется диполем. Когда две молекулы с полярными ковалентными связями находятся рядом друг с другом, они могут образовывать благоприятные взаимодействия, если частичные заряды выровнены соответствующим образом, как показано на рисунке 3, образуя диполь-дипольное взаимодействие.
Это неравномерное распределение электронов называется диполем. Когда две молекулы с полярными ковалентными связями находятся рядом друг с другом, они могут образовывать благоприятные взаимодействия, если частичные заряды выровнены соответствующим образом, как показано на рисунке 3, образуя диполь-дипольное взаимодействие.
Водородные связи представляют собой особенно сильный тип диполь-дипольного взаимодействия. (Обратите внимание, что, хотя они и называются «связями», они не являются ковалентными или ионными связями; они представляют собой сильное межмолекулярное взаимодействие. ) Водородные связи возникают, когда атом водорода ковалентно связан с одним из нескольких неметаллов с высокой электроотрицательностью, включая кислород, азот и фтор, создавая сильный диполь. Водородная связь представляет собой взаимодействие водорода одной из этих молекул и более электроотрицательного атома другой молекулы. Водородные связи присутствуют в воде и очень важны, и они более подробно описаны в нашем модуле «Вода: свойства и поведение».
) Водородные связи возникают, когда атом водорода ковалентно связан с одним из нескольких неметаллов с высокой электроотрицательностью, включая кислород, азот и фтор, создавая сильный диполь. Водородная связь представляет собой взаимодействие водорода одной из этих молекул и более электроотрицательного атома другой молекулы. Водородные связи присутствуют в воде и очень важны, и они более подробно описаны в нашем модуле «Вода: свойства и поведение».
Водородные связи и диполь-дипольные взаимодействия требуют полярных связей, но между любыми молекулами, полярными или нет, может образовываться межмолекулярная сила другого типа, называемая Лондонской дисперсионной силой. Основная идея заключается в том, что электроны в любой молекуле постоянно перемещаются, и иногда, просто случайно, электроны могут в конечном итоге распределяться неравномерно, создавая временный частичный отрицательный заряд на части молекулы с большим количеством электронов. Этот частичный отрицательный заряд уравновешивается частичным положительным зарядом равной величины со стороны молекулы с меньшим количеством электронов, при этом положительный заряд исходит от протонов в ядре (рис. 4). Эти временные частичные заряды в соседних молекулах могут взаимодействовать почти так же, как взаимодействуют постоянные диполи. Общая сила лондонских дисперсионных сил зависит от размера молекул: более крупные молекулы могут иметь более крупные временные диполи, что приводит к более сильным лондонским дисперсионным силам.
4). Эти временные частичные заряды в соседних молекулах могут взаимодействовать почти так же, как взаимодействуют постоянные диполи. Общая сила лондонских дисперсионных сил зависит от размера молекул: более крупные молекулы могут иметь более крупные временные диполи, что приводит к более сильным лондонским дисперсионным силам.
Теперь вы можете спросить, если молекулы могут создавать временные частичные заряды, которые взаимодействуют друг с другом, эти временные заряды также должны быть способны взаимодействовать с постоянными диполями, верно? И вы были бы правы. Эти взаимодействия очень изобретательно называются дипольными взаимодействиями, индуцированными диполями. Частичный заряд полярной молекулы взаимодействует с электронами в неполярной молекуле и «заставляет» их двигаться так, что они больше не распределяются равномерно, создавая индуцированный диполь, который может благоприятно взаимодействовать с постоянным диполем полярной молекулы (рис. 5).
5).
Как вы могли догадаться, лондоновские дисперсионные силы и индуцированные диполем дипольные взаимодействия обычно слабее, чем диполь-дипольные взаимодействия. Эти силы, как и водородные связи, представляют собой силы Ван-дер-Ваальса, которые являются общим термином для сил притяжения между незаряженными молекулами.
Межмолекулярные силы — это гораздо больше, чем то, что мы рассмотрели здесь, но с этим кратким введением мы готовы вернуться к главному событию: жидкостям и тому, как межмолекулярные силы определяют их свойства и поведение.
Контрольная точка понимания
Какие взаимодействия сильнее?
- а. Диполь-дипольные взаимодействия
- б.
 Дипольные дипольные взаимодействия
Дипольные дипольные взаимодействия
Свойства жидкостей
Сцепление
Если вы когда-либо использовали масло для приготовления пищи или работы с автомобилем, вы знаете, что оно приятное и скользкое. Вероятно, поэтому вы использовали его: он предотвращает прилипание кусочков жаркого друг к другу или к сковороде, а также помогает поршням двигателя и другим движущимся частям легко скользить.
Одна из причин, по которой масла хороши для этих целей, заключается в том, что они обладают низкой когезией: молекулы жидкости не особенно сильно взаимодействуют друг с другом, поскольку межмолекулярные силы слабы. Основные межмолекулярные силы, присутствующие в большинстве масел и многих других органических жидкостях — жидкостях, состоящих преимущественно из атомов углерода и водорода, также называемых неполярными жидкостями, — это лондоновские дисперсионные силы, которые для малых молекул являются самым слабым типом межмолекулярных сил. Эти слабые силы приводят к низкой сплоченности. Молекулы не взаимодействуют сильно друг с другом, поэтому они могут скользить друг мимо друга.
Эти слабые силы приводят к низкой сплоченности. Молекулы не взаимодействуют сильно друг с другом, поэтому они могут скользить друг мимо друга.
На другом конце спектра сплоченности рассмотрим каплю росы на листе ранним утром (рис. 6). Как такое может существовать, если, как объяснялось ранее, жидкости текут и принимают форму удерживающего их сосуда? Как описано выше и в модуле «Вода», молекулы воды удерживаются вместе сильными водородными связями. Эти сильные силы приводят к высокому сцеплению: молекулы воды взаимодействуют друг с другом сильнее, чем с воздухом или самим листом. (Взаимодействие воды с листом является примером прилипания или взаимодействия жидкости с чем-то другим, кроме самого себя; мы обсудим прилипание в следующем разделе.) Из-за высокой когезии воды молекулы образуют сферическую форму. максимизировать их взаимодействие друг с другом.
Рисунок 6 : Капли росы на листе. изображение © Кэмерон Уитмен/iStockphoto Это высокое сцепление также создает поверхностное натяжение. Возможно, вы замечали насекомых, гуляющих по воде в пруду под открытым небом (рис. 7), или видели небольшой предмет, например скрепку, лежащую на поверхности воды вместо того, чтобы тонуть; это два примера поверхностного натяжения воды в действии. Поверхностное натяжение возникает из-за сильных сил сцепления некоторых жидкостей. Эти силы достаточно сильны, чтобы поддерживаться, даже когда они испытывают внешние силы, такие как вес насекомого, идущего по его поверхности.
Возможно, вы замечали насекомых, гуляющих по воде в пруду под открытым небом (рис. 7), или видели небольшой предмет, например скрепку, лежащую на поверхности воды вместо того, чтобы тонуть; это два примера поверхностного натяжения воды в действии. Поверхностное натяжение возникает из-за сильных сил сцепления некоторых жидкостей. Эти силы достаточно сильны, чтобы поддерживаться, даже когда они испытывают внешние силы, такие как вес насекомого, идущего по его поверхности.
Адгезия
Адгезия – это тенденция соединения взаимодействовать с другим соединением. (Помните, что, напротив, когезия — это склонность соединения взаимодействовать с самим собой.) Адгезия помогает объяснить, как жидкости взаимодействуют со своими сосудами и с другими жидкостями.
Одним из примеров взаимодействия с высокой адгезией является взаимодействие между водой и стеклом. И вода, и стекло удерживаются вместе полярными связями. Следовательно, два материала также могут образовывать благоприятные полярные взаимодействия друг с другом, что приводит к высокой адгезии. Возможно, вы даже видели эти силы притяжения в действии в лаборатории. Например, когда вода находится в стеклянном градуированном цилиндре, вода стекает по стенкам стакана, создавая вогнутую кривую наверху, называемую мениском, как показано на рисунке ниже. С другой стороны, вода в градуированных цилиндрах, изготовленных из некоторых типов неполярного пластика, образует плоский мениск, поскольку между водой и пластиком нет ни притягивающих, ни отталкивающих сил сцепления. (См. рис. 8 для сравнения полярных и неполярных градуированных цилиндров.)
И вода, и стекло удерживаются вместе полярными связями. Следовательно, два материала также могут образовывать благоприятные полярные взаимодействия друг с другом, что приводит к высокой адгезии. Возможно, вы даже видели эти силы притяжения в действии в лаборатории. Например, когда вода находится в стеклянном градуированном цилиндре, вода стекает по стенкам стакана, создавая вогнутую кривую наверху, называемую мениском, как показано на рисунке ниже. С другой стороны, вода в градуированных цилиндрах, изготовленных из некоторых типов неполярного пластика, образует плоский мениск, поскольку между водой и пластиком нет ни притягивающих, ни отталкивающих сил сцепления. (См. рис. 8 для сравнения полярных и неполярных градуированных цилиндров.)
Проверка понимания
Когда межмолекулярные силы в жидкости слабы, жидкость имеет низкую
- а.
 сплоченность.
сплоченность. - б.адгезия.
Вязкость
В начале модуля мы сказали, что одной из определяющих характеристик жидкостей является их способность течь. Но среди жидкостей существует огромный диапазон того, насколько легко это происходит. Подумайте о том, с какой легкостью вы можете налить себе стакан воды, по сравнению с относительной сложностью заливки густого, медленно движущегося моторного масла в двигатель. Разница заключается в их вязкости или сопротивлении течению. Моторное масло достаточно вязкое; вода, не очень. Но почему?
Прежде чем мы углубимся в различия между водой и моторным маслом, давайте сравним воду с другой жидкостью: пентаном (C 5 H 12 ). Хотя мы не думаем о воде как о вязкой жидкости, на самом деле она на более вязкая, чем пентан. Помните, молекулы воды образуют прочные водородные связи друг с другом. С другой стороны, пентан, состоящий только из атомов водорода и углерода, неполярен, поэтому единственным типом межмолекулярных сил, которые он может образовывать, являются относительно слабые лондоновские дисперсионные силы. Более слабые межмолекулярные силы означают, что молекулы могут легче двигаться мимо друг друга или течь, следовательно, вязкость ниже.
С другой стороны, пентан, состоящий только из атомов водорода и углерода, неполярен, поэтому единственным типом межмолекулярных сил, которые он может образовывать, являются относительно слабые лондоновские дисперсионные силы. Более слабые межмолекулярные силы означают, что молекулы могут легче двигаться мимо друг друга или течь, следовательно, вязкость ниже.
Но и вода, и пентан представляют собой относительно небольшие молекулы. Когда мы смотрим на жидкости, состоящие из более крупных молекул, размер также играет роль. Например, сравните пентан с моторным маслом, которое представляет собой сложную смесь больших углеводородов, намного больших по размеру, чем маленький пентан, а некоторые из них имеют десятки или даже сотни атомов углерода в цепи. Если вы когда-нибудь заливали моторное масло в двигатель, то знаете, что оно довольно вязкое. Обе жидкости неполярны и поэтому имеют относительно слабые межмолекулярные силы; разница в размере. Большие, гибкие углеводороды моторного масла могут буквально запутаться со своими соседями, что замедляет поток. Это почти как кастрюля спагетти: если вы не приготовите ее правильно, вы можете получить комок запутанной лапши, которую очень трудно подавать, потому что все они слиплись — в некотором смысле, это вязкая капля пасты. . Более короткая лапша или меньшие молекулы не так сильно спутываются, поэтому они, как правило, менее вязкие (рис. 9).).
Это почти как кастрюля спагетти: если вы не приготовите ее правильно, вы можете получить комок запутанной лапши, которую очень трудно подавать, потому что все они слиплись — в некотором смысле, это вязкая капля пасты. . Более короткая лапша или меньшие молекулы не так сильно спутываются, поэтому они, как правило, менее вязкие (рис. 9).).
Возвращаясь к нашему первоначальному сравнению моторного масла с водой, хотя вода обладает такими сильными межмолекулярными силами, гораздо больший размер молекул в моторном масле делает масло более вязким.
Есть еще одна деталь: температура. Подогрев жидкости делает ее менее вязкой, как вы, возможно, заметили, если когда-либо испытывали, насколько легче полить кленовым сиропом блины, когда сироп подогрет, чем когда он холодный. Дело в том, что температура влияет на оба фактора, в первую очередь определяющие вязкость. Во-первых, повышение температуры увеличивает кинетическую энергию молекул, что позволяет им легче преодолевать межмолекулярные силы. Это также заставляет молекулы двигаться больше, поэтому те большие молекулы, которые запутались, когда они были холодными, становятся более динамичными и способны скользить друг мимо друга, позволяя жидкости течь легче.
Дело в том, что температура влияет на оба фактора, в первую очередь определяющие вязкость. Во-первых, повышение температуры увеличивает кинетическую энергию молекул, что позволяет им легче преодолевать межмолекулярные силы. Это также заставляет молекулы двигаться больше, поэтому те большие молекулы, которые запутались, когда они были холодными, становятся более динамичными и способны скользить друг мимо друга, позволяя жидкости течь легче.
Контрольная точка понимания
Моторное масло выливается медленнее, чем пентановый растворитель, поскольку моторное масло состоит из
- полярные молекулы.
- b.более крупные молекулы.
Сложные жидкости
Когда вы думаете о воде, вы можете подумать о ее химической формуле H 2 O. Эта формула описывает чистую жидкость, состоящую только из молекул H 2 O, без каких-либо других компонентов.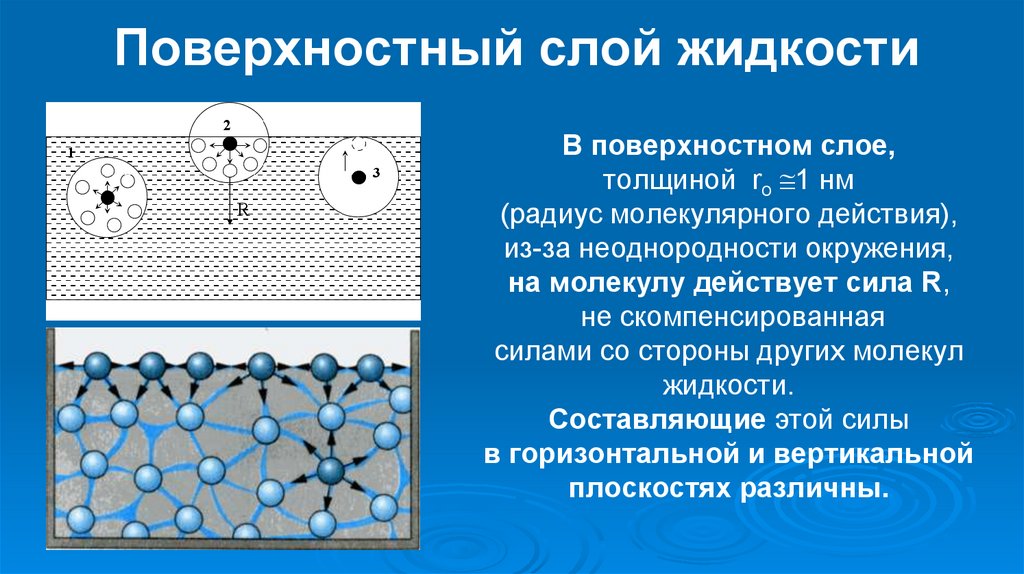 Реальность, однако, такова, что подавляющее большинство жидкостей, с которыми мы сталкиваемся, представляют собой сложные смеси многих соединений.
Реальность, однако, такова, что подавляющее большинство жидкостей, с которыми мы сталкиваемся, представляют собой сложные смеси многих соединений.
Растворы состоят из жидкого растворителя, в котором растворено одно или несколько растворенных веществ. Растворенные вещества могут быть твердыми, жидкими и газообразными. Существует множество распространенных растворов, в которых в качестве растворителя используется вода, включая соленую воду и практически любые ароматизированные напитки. Углекислый газ (СО 2 ) газ — обычное газообразное растворенное вещество в газированных напитках, а этанол — жидкое растворенное вещество в любом алкогольном напитке. Хотя растворы представляют собой смеси нескольких соединений, свойства, обсуждавшиеся в предыдущем разделе, по-прежнему применимы.
Не все растворенные вещества растворяются во всех растворителях. Вы можете растворить огромное количество некоторых растворенных веществ в некоторых жидкостях, а другие растворенные вещества лишь незначительно растворимы в любом растворителе. Основное объяснение растворимости состоит в том, что «подобное растворяется в подобном». Неполярные растворенные вещества обычно лучше растворяются в неполярных жидкостях, а полярные растворенные вещества лучше растворяются в полярных жидкостях. Например, масляные (и, следовательно, неполярные) краски требуют для очистки неполярного растворителя, такого как скипидар; они не растворяются в полярной воде. С другой стороны, поваренная соль или сахар, оба полярные твердые вещества, легко растворяются в воде при высоких концентрациях.
Основное объяснение растворимости состоит в том, что «подобное растворяется в подобном». Неполярные растворенные вещества обычно лучше растворяются в неполярных жидкостях, а полярные растворенные вещества лучше растворяются в полярных жидкостях. Например, масляные (и, следовательно, неполярные) краски требуют для очистки неполярного растворителя, такого как скипидар; они не растворяются в полярной воде. С другой стороны, поваренная соль или сахар, оба полярные твердые вещества, легко растворяются в воде при высоких концентрациях.
Более сложные растворы включают эмульсии, коллоиды и суспензии. Вкратце, эмульсия — это хорошо диспергированная смесь двух или более жидкостей, которые обычно не смешиваются. Майонез, например, представляет собой эмульсию масла, яичного желтка и уксуса или лимонного сока, которую готовят очень энергичным смешиванием.
Коллоиды и суспензии состоят из нерастворимых в жидкости частиц. В коллоиде мельчайшие нерастворимые частицы распределены в жидкости и не отделяются. А суспензия, с другой стороны, представляет собой жидкость, содержащую более крупные нерастворимые частицы, которые со временем отделятся. Молоко является полезным примером различия между этими двумя. Свежее молоко представляет собой суспензию. Это сложная смесь компонентов, которые обычно не смешиваются — вода, жиры, белки, углеводы и многое другое — и если оставить их в покое, жировые шарики отделяются от водной части смеси. (Помните разделение уксуса и масла в заправке для салата? Процесс разделения молока аналогичен, маслянистый жир отделяется от воды.) С другой стороны, молоко в большинстве продуктовых магазинов представляет собой коллоид. Компоненты не разделяются благодаря процессу, называемому гомогенизацией, который разбивает шарики жира на достаточно мелкие частицы, чтобы они могли оставаться во взвешенном состоянии в жидкости.
А суспензия, с другой стороны, представляет собой жидкость, содержащую более крупные нерастворимые частицы, которые со временем отделятся. Молоко является полезным примером различия между этими двумя. Свежее молоко представляет собой суспензию. Это сложная смесь компонентов, которые обычно не смешиваются — вода, жиры, белки, углеводы и многое другое — и если оставить их в покое, жировые шарики отделяются от водной части смеси. (Помните разделение уксуса и масла в заправке для салата? Процесс разделения молока аналогичен, маслянистый жир отделяется от воды.) С другой стороны, молоко в большинстве продуктовых магазинов представляет собой коллоид. Компоненты не разделяются благодаря процессу, называемому гомогенизацией, который разбивает шарики жира на достаточно мелкие частицы, чтобы они могли оставаться во взвешенном состоянии в жидкости.
Проверка понимания
Какое утверждение о растворенных веществах верно?
- а. Растворенные вещества всегда жидкие.

- б. Растворенные вещества могут быть твердыми, жидкими или газообразными.
Помимо простых жидкостей
Мы обсудили множество различных жидкостей с различной когезией, адгезией и вязкостью, а также другими свойствами. Но помимо этого и без того большого разнообразия есть некоторые вещества, стирающие грань между жидким и твердым. Например, в детстве вы, возможно, играли с ублеком, смесью воды и крахмала, которая получила свое название из книги доктора Сьюза. Ублек — это слизистая субстанция, которая может течь между пальцами, если вы осторожно держите ее в руках, но становится твердой и твердой, почти твердой, если ее сжать.
В качестве более технического примера рассмотрим материал, используемый в ЖК-дисплеях телевизоров и других электронных экранах. ЖК-дисплей означает жидкокристаллический дисплей. Это не означает, что в дисплеях используются как жидкости, так и кристаллы; это означает, что они используют материал, который одновременно является и жидким, и кристаллическим. Это может показаться противоречием — кристаллы — это твердые тела, а не жидкости, скажете вы, — но такие материалы существуют.
Это не означает, что в дисплеях используются как жидкости, так и кристаллы; это означает, что они используют материал, который одновременно является и жидким, и кристаллическим. Это может показаться противоречием — кристаллы — это твердые тела, а не жидкости, скажете вы, — но такие материалы существуют.
Первым обнаруженным жидким кристаллом был модифицированный вариант холестерина, названный холестерилбензоатом. Он твердый при комнатной температуре и плавится при температуре около 150°C, но потом все становится странным. При температуре около 180°C он снова меняет фазу, но уже не из жидкости в газ; она переходит от мутной жидкости к прозрачной жидкости. Австрийский ботаник и химик Фридрих Рейницер наблюдал это необычное поведение в 1888 году и обсуждал его со своим коллегой, немецким физиком Отто Леманном. Затем Леманн взял на себя расследование, изучая холестеринбензоат и другие соединения с аналогичным поведением при двойном плавлении. Когда он посмотрел на мутную фазу под своим микроскопом, он обнаружил, что материал выглядит кристаллическим, что является отличительной чертой твердых тел. Но фаза тоже текла, как жидкость. В 1904 он ввел термин «жидкий кристалл» для описания этой фазы со свойствами между свойствами обычной жидкости и кристаллического твердого тела. Жидкие кристаллы играют важную роль в биологии, особенно в мембранах, которые должны быть жидкими, но также должны сохранять правильную структуру.
Но фаза тоже текла, как жидкость. В 1904 он ввел термин «жидкий кристалл» для описания этой фазы со свойствами между свойствами обычной жидкости и кристаллического твердого тела. Жидкие кристаллы играют важную роль в биологии, особенно в мембранах, которые должны быть жидкими, но также должны сохранять правильную структуру.
Существуют также некоторые жидкости, которые настолько вязкие, что вы не будете обвинены в том, что думаете, что они твердые, например смола, вещество, полученное из растений и нефти. Он кажется почти твердым и разбивается при ударе молотком, но если оставить его под действием силы тяжести, он будет течь очень, очень медленно. Несколько лабораторий по всему миру проводят так называемые эксперименты с каплями смолы, в которых они оставляют немного смолы в воронке и ждут, пока она стечет; между каждой каплей проходит около 10 лет (рис. 10).
Рис. 10 : Эксперимент «Падение смолы» в Университете Квинсленда (батарея показана для сравнения размеров). изображение ©
Джон Мейнстоун и Амада44
изображение ©
Джон Мейнстоун и Амада44Эти примеры поведения веществ, которые, кажется, бросают вызов традиционным определениям фаз материи, иллюстрируют внутреннюю сложность науки и мира природы, даже когда дело доходит до чего-то такого, казалось бы, простого, как определение того, является ли вещество жидкостью или твердый. В этом модуле мы сосредоточились на определении и объяснении основных свойств жидкостей, что дает вам основу для размышлений о состояниях материи во всей их сложности. В других модулях мы обсуждаем твердую и газовую фазы, чтобы помочь вам сопоставить различные физические свойства этих состояний.
Резюме
Что касается различных жидкостей, то одни хорошо смешиваются, а другие нет; одни льются быстро, а другие текут медленно. Этот модуль обеспечивает основу для рассмотрения состояний материи во всей их сложности. Он объясняет основные свойства жидкостей и исследует, как межмолекулярные силы определяют их поведение. Определены понятия когезии, адгезии и вязкости.
