Виды и периодичность ТО – Основные средства
С. Овсянников, главный конструктор ОАО «ТВЭКС»
Понятие «техническое обслуживание» на слуху у каждого, кто работает с техникой. Однако о его видах и периодичности многие забывают, удивляясь при этом снижению качества работы. Часто работяга экскаватор эксплуатируется без проблем и регулярного обслуживания и год, и два. Хорошо это или плохо? Вопрос кажется странным. Конечно, работа свыше установленного гарантийного срока службы – это плюс для потребителя. Но если при этом не выполняется регулярное и правильное техническое обслуживание, со временем такая работа неизбежно приведет к поломкам и простоям.
В процессе эксплуатации происходит износ, деформация или разрушение отдельных деталей, нарушаются регулировки, изменяются зазоры сопряжений, ослабевает крепление деталей. В результате снижаются точность выполнения операций и производительность, сокращается срок службы машины. Потери из-за невыполненной работы и затраты на ремонт многократно превысят стоимость ТО.
При анализе рекламаций иногда складывается впечатление, что потребители в большинстве случаев проводят только сезонное ТО – без него на российских просторах со значительными перепадами температур не обойтись. И в этом заключается грубая ошибка. Ведь именно своевременное выполнение ВСЕХ видов технического обслуживания снижает риск неожиданного отказа техники.
Виды ТО и их периодичность, а также состав и порядок выполнения работ приводятся в эксплуатационной документации к каждой машине. Их следует строго соблюдать. Хочу обратить внимание читателей на то, что первые 100 моточасов в эксплуатационных условиях экскаватор должен работать под особым наблюдением механика. Периодичность ТО учитывается в моточасах работы двигателя экскаватора. Учет наработки рекомендуется фиксировать в журнале – так проще спланировать обслуживание.
- ежесменное техническое обслуживание (ЕО) перед началом или после рабочей смены;
- плановое техническое обслуживание (ПТО) через определенное, установленное заводами-изготовителями количество моточасов;
- сезонное техническое обслуживание (СО) два раза в год при подготовке машины к летнему или зимнему периоду эксплуатации.
Остановимся на каждом из ТО подробнее.
Ежесменное техническое обслуживание является обязательным. Каждый раз перед началом работ рекомендуется: осмотреть двигатель, компрессор, насосную установку, гидромоторы, распределители и фильтры; проверить уровень масла и рабочей жидкости (РЖ) в баке гидросистемы, в редукторах и долить до нормы; проверить надежность крепления узлов и деталей; смазать шарнирные соединения согласно схеме смазки; осмотреть и очистить аккумуляторные батареи; при работающем двигателе проверить показания контрольных приборов, работу звукового сигнала и освещения, тормозов колес, органов управления экскаватором; на холостом ходу проверить работу гидроцилиндров, осмотреть соединения трубопроводов, устранить наружные утечки рабочих жидкостей, а также выполнить другие проверочные работы, предусмотренные инструкцией по эксплуатации. В конце смены следует проверить герметичность соединений трубопроводов; опустить ковш на грунт, установив рычаги управления в нейтральное положение, и заглушить двигатель.
Самое главное при выполнении ЕО – счищать грязь, которая покрывает детали, мешая их тщательному осмотру. Именно поэтому регулярная очистка узлов и деталей экскаватора не только придает ему опрятный вид, но и увеличивает срок службы.
Кажется, слишком много операций, и многие экскаваторщики их не выполняют. Но реально работа занимает ненамного больше времени, чем понадобится на чтение этой статьи. А средства в результате регулярного выполнения ЕО экономятся значительные.
Плановые технические обслуживания (ПТО) различаются периодичностью выполнения и составом работ. Каждому виду ПТО присваивается порядковый номер (ТО-1, ТО-2). В перечень работ ПТО обязательно входит проверка и регулировка предохранительных клапанов. Порядок настройки описан в руководстве по эксплуатации. Эта работа должна выполняться квалифицированными работниками с применением технических средств контроля давления и расхода РЖ.
Рекомендуется через каждые 100 моточасов работы экскаватора брать пробу 0,5…1 л рабочей жидкости из гидробака. РЖ не должна содержать загрязняющих жидких примесей (воды, кислот и щелочей) и механических частиц. Отрицательно влияют на работу гидропривода воздух и другие газы, содержащиеся в жидкости либо в растворенном виде, либо в виде механической смеси. Большое содержание воздуха и газов в масле приводит к пенообразованию. Содержание в РЖ даже небольшого количества воды (около 1%) также ускоряет образование пены.
РЖ не должна содержать загрязняющих жидких примесей (воды, кислот и щелочей) и механических частиц. Отрицательно влияют на работу гидропривода воздух и другие газы, содержащиеся в жидкости либо в растворенном виде, либо в виде механической смеси. Большое содержание воздуха и газов в масле приводит к пенообразованию. Содержание в РЖ даже небольшого количества воды (около 1%) также ускоряет образование пены.
Одними из важных условий надежной работы гидропривода являются своевременная очистка фильтров и замена фильтроэлементов. Эту работу желательно проводить через каждые 260 моточасов. При замене надо смочить фильтроэлементы в РЖ и затем заполнить ею весь корпус фильтра.
Выбор сроков проведения сезонного обслуживания зависит от температуры окружающей среды. При установившейся весенней температуре +5 °С и выше машины готовят к весенне-летнему периоду эксплуатации, при температуре ниже +5 °С осенью – к осенне-зимнему периоду. При СО проводят полную замену РЖ в гидросистеме на соответствующие зимние или летние сорта. Рабочая жидкость должна быть совместима с материалами, из которых изготовлены детали гидравлических узлов и механизмов.
Рабочая жидкость должна быть совместима с материалами, из которых изготовлены детали гидравлических узлов и механизмов.
Для предохранения от загрязнения РЖ необходимо доставлять к месту эксплуатации без перелива из одной тары в другую. Гидросистему следует заправлять только с помощью насоса через фильтр тонкой очистки. Температура застывания зимних рабочих жидкостей должна быть на 20…30 °С ниже ожидаемой температуры окружающей среды. Кроме того, необходимо заправлять экскаватор топливом, сорт которого также соответствует сезону эксплуатации.
Конечно, не следует оставлять без внимания и условия работы экскаваторщика. Необходимо проверять работу системы вентиляции (кондиционирования) кабины при переходе на летний режим эксплуатации и работу системы отопления кабины при переходе на зимний режим.
Экскаватор, прошедший техническое обслуживание, должен отвечать следующим требованиям: механизмы отрегулированы и смазаны; все подвижные части, механизмы и сборочные единицы работают плавно, без заеданий, рывков и стуков; температура нагрева рабочей жидкости при работе не превышает +75 °С; приборы освещения исправны и отрегулированы; соединения трубопроводов герметичны.
Главное правило: только убедившись, что экскаватор находится в исправном состоянии, можно начинать его эксплуатацию. Соблюдая его, потребитель увеличит срок службы своей техники на многие годы. Именно безукоризненное следование этому простому и разумному закону отличает профессионального экскаваторщика.
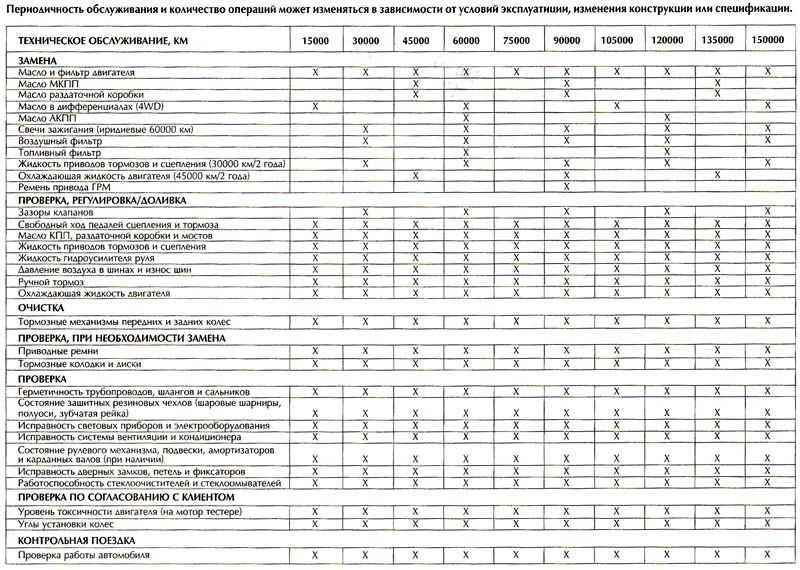
Нормы периодичности ТО-1 и ТО-2 по маркам автомобилей |
Периодичность ТО-1 и ТО-2, установленная второй частью Положения о ТО и ремонте заводами-изготовителями для конкретных марок автомобилей, прицепов и полуприцепов для первой категории эксплуатации и умеренного климатического района, приведена в таблице 1.
Таблица 1.
| Автотранспортные средства | Периодичность ТО, км | |
| ТО-1 | ТО-2 | |
| ВАЗ-2110 | 5000 | 20000 |
| ГАЗ-3110, 3102 | 5000 | 20000 |
| УАЗ-31512 | 4000 | 16000 |
| ГАЗ-3302, 2705, 2752 | 10000 | 20000 |
| УАЗ-3741, 3962, 3303, 3909 | 4000 | 16000 |
| УАЗ-2206 | 4000 | 16000 |
| ГАЗ-32213 | 10000 | 20000 |
| ЛАЗ-4207 | 5000 | 20000 |
| ЛИАЗ-5256 | 5000 | 20000 |
| ГАЗ-3307,3309 | 5000 | 20000 |
| ГАЗ-66-11 | 5000 | 20000 |
| ЗИЛ-5301 | 4000 | 16000 |
| ЗИЛ-431410,433100 | 4000 | 16000 |
| Урал-4320, 5557 | 4000 | 16000 |
| КАМАЗ-5320, 53212, 55102, 5410, 54112 | 4000 | 12000 |
| КРАЗ-6510 | 4000 | 16000 |
| ЗИЛ-131 Н | 4000 | 16000 |
| МАЗ-5551 | 5000 | 20000 |
| МАЗ-53371, 533360 | 8000 | 24000 |
| МАЗ-5432, 6422 | 5000 | |
| МАЗ-54322, 54323 | 8000 | 24000 |
| МАЗ-64227, 64229 | 8000 | 24000 |
| ГКБ-8350 (прицеп для КАМАЗ-5320) | 4000 | 12000 |
| ГКБ-8352 (прицеп для КАМАЗ-53212) | 4000 | 12000 |
| ОДАЗ-9370 (полуприцеп к КАМАЗ-5410) | 4000 | 12000 |
| ГКБ-9385 (полуприцеп к КАМАЗ-54112) | 4000 | 12000 |
1. Для автомобилей КАМАЗ корректировка периодичностей ТО-1 и ТО-2 производится только в зависимости от категории условий эксплуатации.Примечания:
Для автомобилей КАМАЗ корректировка периодичностей ТО-1 и ТО-2 производится только в зависимости от категории условий эксплуатации.Примечания:
2. Периодичности ТО-1 и ТО-2 для полуприцепов МАЗ-9397 и МАЗ-9398 соответствуют периодичностям ТО-1 и ТО-2 седельных тягачей, с которыми они работают.
Периодичность ТО-1 и ТО-2 в км для автотранспортных средств, не вошедших в таблицу 2 (более ранних выпусков),
регламентируются Положением о ТО и ремонте (1 часть) и приведена в таблице 2.Таблица 2.
| АТС | ТО-1 | ТО-2 |
| Легковые автомобили | 4000 | 16000 |
| Автобусы | 3500 | 14000 |
| Грузовые и автобусы на базе грузовых автомобилей | 3000 | 12000 |
| Прицепы и полуприцепы | По периодичности тягачей | По периодичности тягачей |
Периодические тенденции — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 618
Периодические тренды — это определенные закономерности, присутствующие в периодической таблице, которые иллюстрируют различные аспекты определенного элемента, включая его размер и его электронные свойства. Основные периодические тенденции включают: электроотрицательность, энергию ионизации, сродство к электрону, атомный радиус, температуру плавления и металлический характер. Периодические тренды, возникающие в результате расположения периодической таблицы, предоставляют химикам бесценный инструмент для быстрого предсказания свойств элемента. Эти тенденции существуют из-за схожей атомной структуры элементов в пределах их соответствующих групповых семейств или периодов, а также из-за периодического характера элементов.
Основные периодические тенденции включают: электроотрицательность, энергию ионизации, сродство к электрону, атомный радиус, температуру плавления и металлический характер. Периодические тренды, возникающие в результате расположения периодической таблицы, предоставляют химикам бесценный инструмент для быстрого предсказания свойств элемента. Эти тенденции существуют из-за схожей атомной структуры элементов в пределах их соответствующих групповых семейств или периодов, а также из-за периодического характера элементов.
Тенденции электроотрицательности
Электроотрицательность можно понимать как химическое свойство, описывающее способность атома притягивать и связывать электроны. Поскольку электроотрицательность является качественным свойством, стандартного метода расчета электроотрицательности не существует. Однако наиболее распространенной шкалой для количественной оценки электроотрицательности является шкала Полинга (таблица A2), названная в честь химика Линуса Полинга. Числа, присвоенные шкалой Полинга, безразмерны из-за качественного характера электроотрицательности. Значения электроотрицательности для каждого элемента можно найти в определенных периодических таблицах. Пример приведен ниже.
Числа, присвоенные шкалой Полинга, безразмерны из-за качественного характера электроотрицательности. Значения электроотрицательности для каждого элемента можно найти в определенных периодических таблицах. Пример приведен ниже.
Электроотрицательность измеряет тенденцию атома притягивать и образовывать связи с электронами. Это свойство существует благодаря электронной конфигурации атомов. Большинство атомов следуют правилу октета (имея валентную или внешнюю оболочку, состоящую из 8 электронов). Поскольку элементы в левой части периодической таблицы имеют менее чем наполовину заполненную валентную оболочку, энергия, необходимая для приобретения электронов, значительно выше по сравнению с энергией, необходимой для потери электронов. В результате элементы в левой части периодической таблицы обычно теряют электроны при образовании связей. И наоборот, элементы в правой части периодической таблицы более энергоэффективны в получении электронов для создания полной валентной оболочки из 8 электронов. Природа электроотрицательности эффективно описывается следующим образом: чем больше атом склонен приобретать электроны, тем больше вероятность того, что атом будет притягивать электроны к себе.
Природа электроотрицательности эффективно описывается следующим образом: чем больше атом склонен приобретать электроны, тем больше вероятность того, что атом будет притягивать электроны к себе.
- Слева направо по периоду элементов электроотрицательность увеличивается. Если валентная оболочка атома заполнена менее чем наполовину, для потери электрона требуется меньше энергии, чем для его приобретения. И наоборот, если валентная оболочка заполнена более чем наполовину, легче втянуть электрон в валентную оболочку, чем отдать его.
- Сверху вниз по группе электроотрицательность уменьшается. Это происходит потому, что атомный номер увеличивается вниз по группе, и, таким образом, увеличивается расстояние между валентными электронами и ядром, или увеличивается атомный радиус.
- Важные исключения из вышеуказанных правил включают инертные газы, лантаноиды и актиноиды. Благородные газы обладают полной валентной оболочкой и обычно не притягивают электроны.
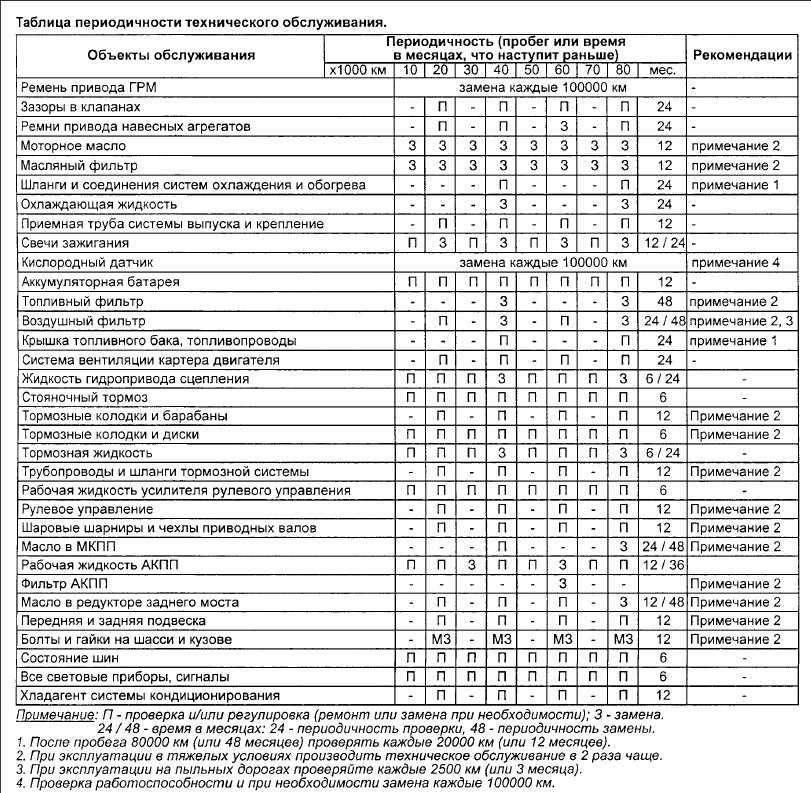 Лантаниды и актиноиды обладают более сложным химическим составом, который обычно не следует каким-либо тенденциям. Следовательно, благородные газы, лантаноиды и актиноиды не имеют значений электроотрицательности.
Лантаниды и актиноиды обладают более сложным химическим составом, который обычно не следует каким-либо тенденциям. Следовательно, благородные газы, лантаноиды и актиноиды не имеют значений электроотрицательности. - Что касается переходных металлов, хотя они имеют значения электроотрицательности, между ними мало различий по периоду и вверх и вниз по группе. Это потому, что их металлические свойства влияют на их способность притягивать электроны так же легко, как и другие элементы.
В соответствии с этими двумя общими тенденциями наиболее электроотрицательным элементом является фтор с 3,98 единицами Полинга.
Рисунок \(\PageIndex{2}\): Периодическая таблица, показывающая тренд электроотрицательностиТенденции энергии ионизации
Энергия ионизации – это энергия, необходимая для отрыва электрона от нейтрального атома в его газовой фазе. Концептуально энергия ионизации противоположна электроотрицательности. Чем ниже эта энергия, тем легче атом становится катионом. Следовательно, чем выше эта энергия, тем менее вероятно, что атом станет катионом. Как правило, элементы в правой части периодической таблицы имеют более высокую энергию ионизации, потому что их валентная оболочка почти заполнена. Элементы в левой части периодической таблицы имеют низкую энергию ионизации из-за их готовности терять электроны и становиться катионами. Таким образом, энергия ионизации увеличивается слева направо в таблице Менделеева.
Чем ниже эта энергия, тем легче атом становится катионом. Следовательно, чем выше эта энергия, тем менее вероятно, что атом станет катионом. Как правило, элементы в правой части периодической таблицы имеют более высокую энергию ионизации, потому что их валентная оболочка почти заполнена. Элементы в левой части периодической таблицы имеют низкую энергию ионизации из-за их готовности терять электроны и становиться катионами. Таким образом, энергия ионизации увеличивается слева направо в таблице Менделеева.
Другим фактором, влияющим на энергию ионизации, является экранирование электронов . Электронное экранирование описывает способность внутренних электронов атома экранировать его положительно заряженное ядро от его валентных электронов. При движении вправо от точки увеличивается число электронов и увеличивается сила экранирования. В результате электронам валентной оболочки легче ионизироваться, и, таким образом, энергия ионизации уменьшается вниз по группе.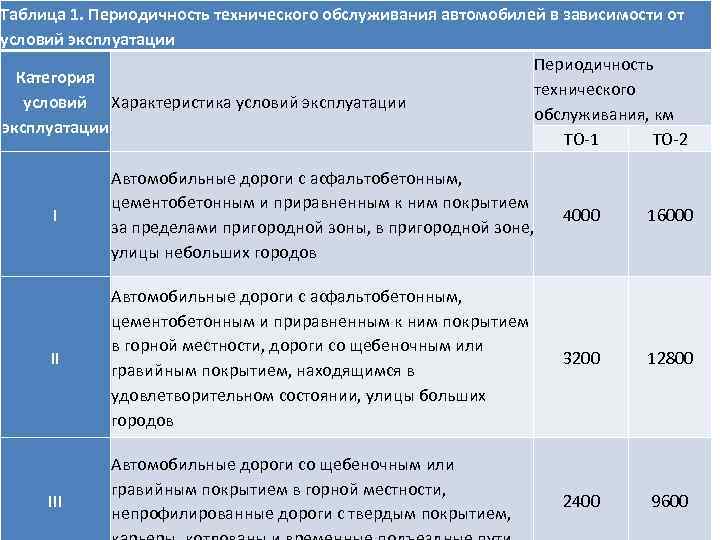 Электронное экранирование также известно как скрининг .
Электронное экранирование также известно как скрининг .
Тренды
- Энергия ионизации элементов в периоде обычно увеличивается слева направо. Это связано со стабильностью валентной оболочки.
- Энергия ионизации элементов внутри группы обычно уменьшается сверху вниз. Это происходит из-за электронного экранирования.
- Благородные газы обладают очень высокой энергией ионизации из-за их полных валентных оболочек, как показано на графике. Обратите внимание, что у гелия самая высокая энергия ионизации среди всех элементов.
Некоторые элементы имеют несколько энергий ионизации; эти различные энергии называются первой энергией ионизации, второй энергией ионизации, третьей энергией ионизации и т. д. Первая энергия ионизации — это энергия, необходимая для удаления электрона с самой внешней или наивысшей энергией, вторая энергия ионизации — это энергия, необходимая для удалить любой последующий высокоэнергетический электрон из газообразного катиона и т. д. Ниже приведены химические уравнения, описывающие первую и вторую энергии ионизации: 9- \]
д. Ниже приведены химические уравнения, описывающие первую и вторую энергии ионизации: 9- \]
Как правило, любые последующие энергии ионизации (2-я, 3-я и т. д.) следуют той же периодической тенденции, что и первая энергия ионизации.
Рисунок \(\PageIndex{4}\): периодическая таблица, показывающая тренд энергии ионизацииЭнергия ионизации уменьшается по мере увеличения атомного радиуса. На это наблюдение влияют \(n\) (главное квантовое число) и \(Z_{eff}\) (основанное на атомном номере и показывающее, сколько протонов видно в атоме) на энергию ионизации (I). Связь задается следующим уравнением: 92} \]
- Через период \(Z_{eff}\) увеличивается на , а n (главное квантовое число) остается тем же самым , поэтому энергия ионизации увеличивается на .
- Вниз по группе \(n\) увеличивает и \(Z_{eff}\) немного увеличивает ; энергия ионизации уменьшается .
Тенденции сродства к электрону
Как следует из названия, сродство к электрону — это способность атома принимать электрон.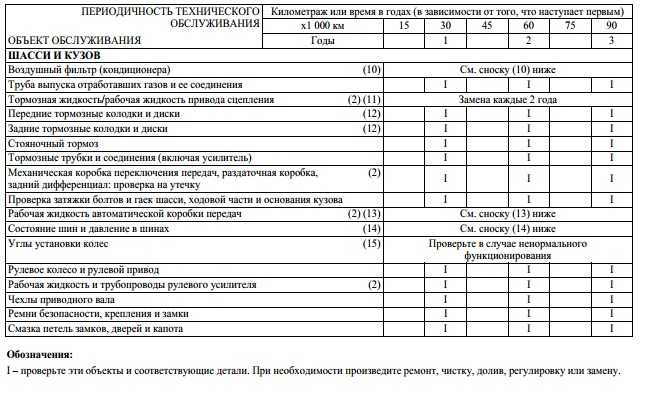 В отличие от электроотрицательности, сродство к электрону является количественным измерением изменения энергии, которое происходит, когда электрон присоединяется к нейтральному атому газа. Чем отрицательнее значение сродства к электрону, тем выше сродство атома к электронам.
В отличие от электроотрицательности, сродство к электрону является количественным измерением изменения энергии, которое происходит, когда электрон присоединяется к нейтральному атому газа. Чем отрицательнее значение сродства к электрону, тем выше сродство атома к электронам.
Сродство к электрону обычно уменьшается вниз по группе элементов, потому что каждый атом больше, чем атом над ним (это тренд атомного радиуса, обсуждаемый ниже). Это означает, что добавленный электрон находится дальше от ядра атома по сравнению с его положением в меньшем атоме. При большем расстоянии между отрицательно заряженным электроном и положительно заряженным ядром сила притяжения относительно слабее. Следовательно, сродство к электрону уменьшается. Двигаясь слева направо по периоду, атомы становятся меньше по мере того, как силы притяжения становятся сильнее. Это заставляет электрон двигаться ближе к ядру, тем самым увеличивая сродство к электрону слева направо по периоду.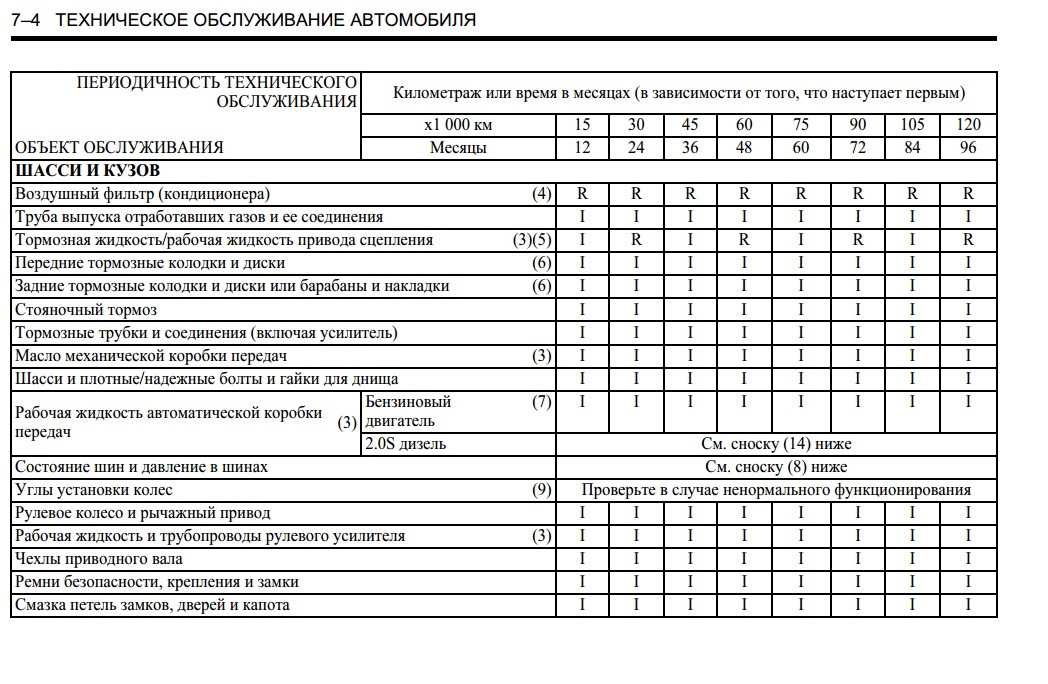
- Сродство к электрону увеличивается слева направо в пределах периода. Это связано с уменьшением атомного радиуса.
- Сродство к электрону уменьшается сверху вниз внутри группы. Это связано с увеличением атомного радиуса.
Тенденции атомного радиуса
Атомный радиус равен половине расстояния между ядрами двух атомов (точно так же, как радиус равен половине диаметра круга). Однако эта идея усложняется тем фактом, что не все атомы обычно связаны друг с другом одинаковым образом. Одни связаны ковалентными связями в молекулах, другие притягиваются друг к другу в ионных кристаллах, третьи удерживаются в металлических кристаллах. Тем не менее подавляющее большинство элементов могут образовывать ковалентные молекулы, в которых два одинаковых атома удерживаются вместе одинарной ковалентной связью. Ковалентные радиусы этих молекул часто называют атомными радиусами. Это расстояние измеряется в пикометрах. Модели атомного радиуса наблюдаются во всей периодической таблице.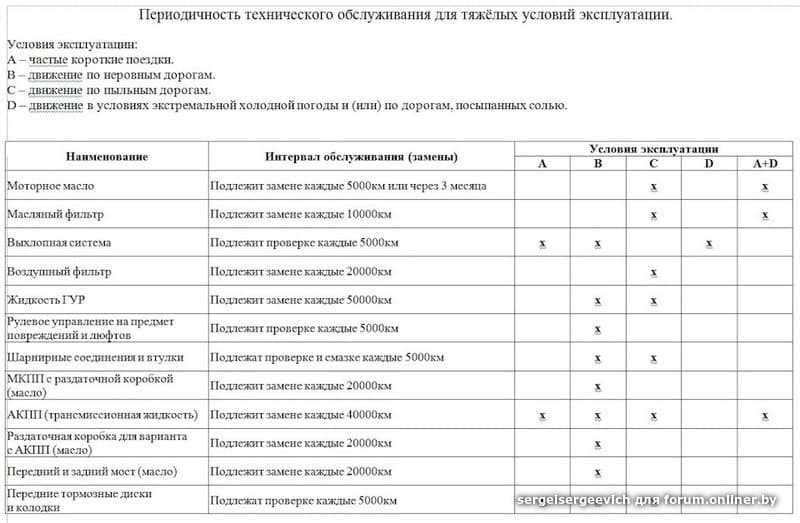
Размер атома постепенно уменьшается слева направо по периоду элементов. Это связано с тем, что в пределах периода или семейства элементов все электроны добавляются к одной и той же оболочке. Однако в то же время к ядру добавляются протоны, что делает его более положительно заряженным. Эффект увеличения числа протонов больше, чем эффект увеличения числа электронов; следовательно, существует большее ядерное притяжение. Это означает, что ядро сильнее притягивает электроны, притягивая оболочку атома ближе к ядру. Валентные электроны удерживаются ближе к ядру атома. В результате атомный радиус уменьшается.
Рисунок \(\PageIndex{6}\): Периодическая таблица, показывающая тренд атомного радиуса D собственная группа, атомный радиус увеличивается. Валентные электроны занимают более высокие уровни из-за увеличения квантового числа (n). В результате валентные электроны удаляются от ядра по мере увеличения «n». Экранирование электронов предотвращает притяжение этих внешних электронов к ядру; таким образом, они удерживаются слабо, и результирующий атомный радиус велик.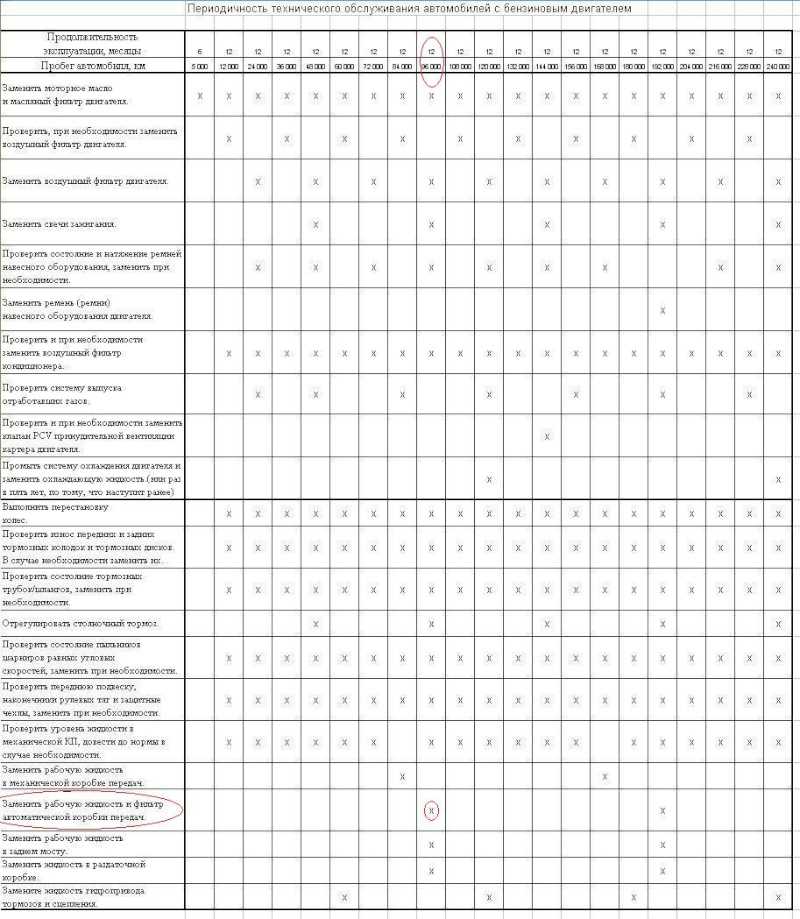
- Атомный радиус уменьшает слева направо в течение периода. Это вызвано увеличением числа протонов и электронов за период. Один протон имеет больший эффект, чем один электрон; таким образом, электроны притягиваются к ядру, что приводит к меньшему радиусу.
- Атомный радиус увеличивается сверху вниз внутри группы. Это происходит из-за электронного экранирования.
Тенденции изменения температуры плавления
Температура плавления — это количество энергии, необходимое для разрыва связи (связей) для превращения твердой фазы вещества в жидкость. Как правило, чем прочнее связь между атомами элемента, тем больше энергии требуется для разрыва этой связи. Поскольку температура прямо пропорциональна энергии, высокая энергия диссоциации связи коррелирует с высокой температурой. Точки плавления различны и обычно не образуют различимой тенденции в периодической таблице. Однако из рисунка \(\PageIndex{7}\) можно сделать определенные выводы.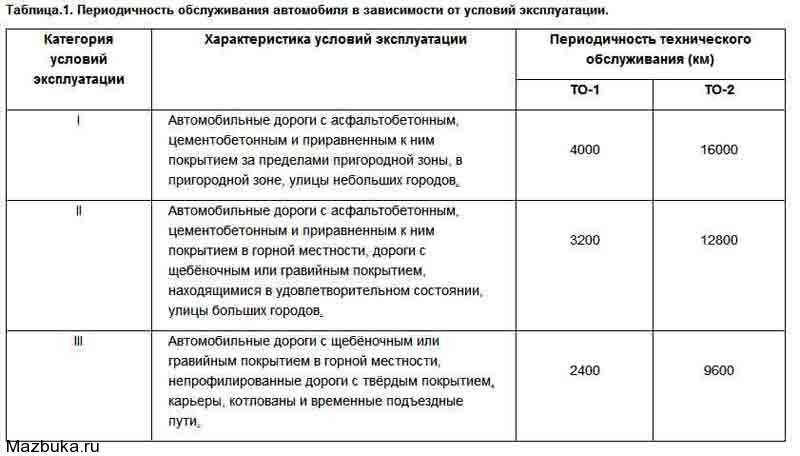
- Металлы обычно имеют высокую температуру плавления .
- Большинство неметаллов имеют низких температур плавления .
- Неметалл углерод обладает самой высокой температурой плавления среди всех элементов . Полуметаллический бор также обладает высокой температурой плавления.
Тенденции металлического характера
Металлический характер элемента можно определить как легкость, с которой атом может потерять электрон. Справа налево по периоду металлический характер усиливается, потому что притяжение между валентным электроном и ядром слабее, что облегчает потерю электронов. Металлический характер усиливается по мере продвижения вниз по группе, потому что увеличивается размер атома. Когда размер атома увеличивается, внешние оболочки удаляются. Главное квантовое число увеличивается, а средняя электронная плотность перемещается дальше от ядра.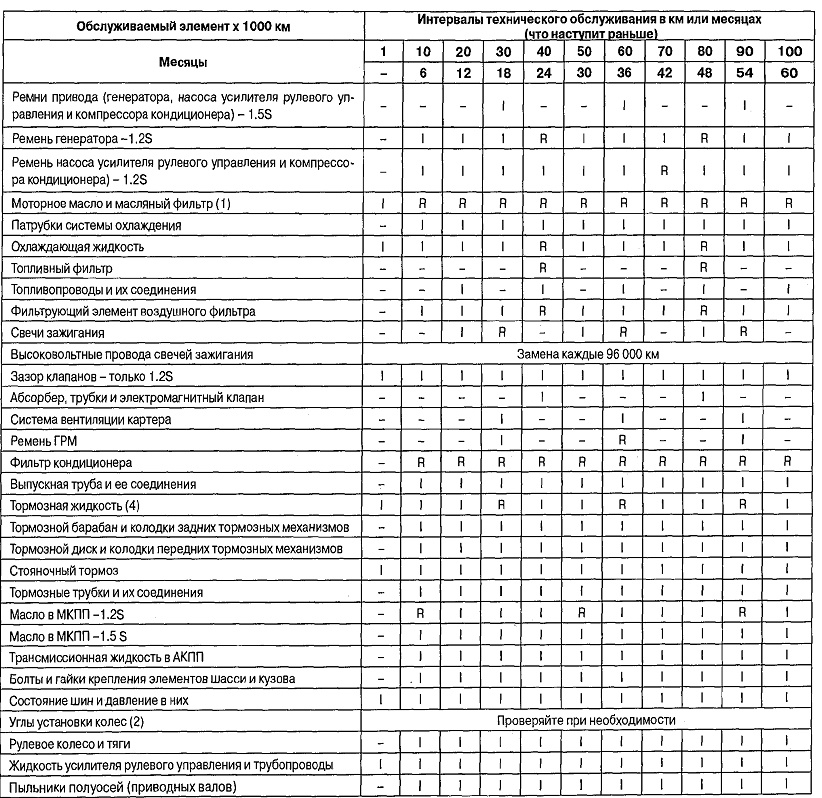 Электроны валентной оболочки имеют меньшее притяжение к ядру и, как следствие, могут легче терять электроны. Это вызывает усиление металлического характера.
Электроны валентной оболочки имеют меньшее притяжение к ядру и, как следствие, могут легче терять электроны. Это вызывает усиление металлического характера.
- Металлические характеристики уменьшаются слева направо по периоду. Это вызвано уменьшением радиуса (вызванным Z eff , как указано выше) атома, что позволяет внешним электронам легче ионизироваться.
- Металлические характеристики увеличиваются вниз по группе. Электронное экранирование вызывает увеличение атомного радиуса, поэтому внешние электроны ионизируются легче, чем электроны в более мелких атомах.
- Металлический характер относится к способности терять электроны, а неметаллический характер относится к способности приобретать электроны.
Еще один простой способ запомнить тенденцию металлического характера состоит в том, что при движении влево и вниз к нижнему левому углу периодической таблицы металлический характер увеличивается в направлении групп 1 и 2, или групп щелочных и щелочноземельных металлов . Точно так же, двигаясь вверх и вправо к правому верхнему углу таблицы Менделеева, металлический характер уменьшается, потому что вы проходите по правой стороне лестницы, которая указывает на неметаллов . К ним относятся Группа 8, благородные газы и другие распространенные газы, такие как кислород и азот.
Точно так же, двигаясь вверх и вправо к правому верхнему углу таблицы Менделеева, металлический характер уменьшается, потому что вы проходите по правой стороне лестницы, которая указывает на неметаллов . К ним относятся Группа 8, благородные газы и другие распространенные газы, такие как кислород и азот.
- Другими словами:
- Переместиться влево по периоду и вниз по группе: увеличить металлический характер (в сторону щелочных и щелочных металлов)
- Перемещение вправо по периоду и вверх по группе: уменьшение металлического характера (в направлении неметаллов, таких как благородные газы)
Задачи
Следующая серия задач проверяет общее понимание вышеупомянутого материала.
1. Основываясь на периодических трендах энергии ионизации, какой элемент имеет наибольшую энергию ионизации?
- Фтор (F)
- Азот (N)
- Гелий (Не)
2. ) Азот имеет больший атомный радиус, чем кислород.
) Азот имеет больший атомный радиус, чем кислород.
- А.) Правда
- Б.) Ложь
3.) Что имеет более металлический характер, свинец (Pb) или олово (Sn)?
4.) Какой элемент имеет более высокую температуру плавления: хлор (Cl) или бром (Br)?
5.) Какой элемент более электроотрицательный, сера (S) или селен (Se)?
6) Почему значение электроотрицательности большинства благородных газов равно нулю?
7) Расположите эти атомы в порядке уменьшения эффективного заряда ядра на валентные электроны: Si, Al, Mg, S
8) Перепишите следующий список в порядке уменьшения сродства к электрону: фтор (F), фосфор (P) , сера (S), бор (B).
9) Атом с атомным радиусом меньше, чем у серы (S), это __________.
- А.) Кислород (О)
- B.) Хлор (Cl)
- С.) Кальций (Ca)
- D.) Литий (Li)
- E.) Ничего из вышеперечисленного
10) Неметалл имеет меньший ионный радиус по сравнению с металлом того же периода.
- А.) Верно Б.) Ложно
Решения
1. Ответ: C.) Гелий (He)
Пояснение: Гелий (He) имеет самую высокую энергию ионизации, потому что, как и другие благородные газы, валентная оболочка гелия заполнена. Следовательно, гелий стабилен и с трудом теряет или приобретает электроны.
2. Ответ: A.) Верно
Объяснение: Радиус атома увеличивается справа налево в периодической таблице. Следовательно, азот больше кислорода.
3. Ответ: Свинец (Pb)
Объяснение: Свинец и олово находятся в одном столбце. Металлический характер увеличивается вниз по столбцу. Свинец находится под оловом, поэтому свинец имеет более металлический характер.
4. Ответ: Бром (Br)
Пояснение: В неметаллах температура плавления увеличивается вниз по столбцу. Поскольку хлор и бром находятся в одной колонке, бром имеет более высокую температуру плавления.
5. Ответ: Сера (S)
Пояснение: Обратите внимание, что сера и селен находятся в одной колонке. Электроотрицательность увеличивается вверх по столбцу. Это указывает на то, что сера более электроотрицательна, чем селен.
Электроотрицательность увеличивается вверх по столбцу. Это указывает на то, что сера более электроотрицательна, чем селен.
6. Ответ: Большинство благородных газов имеют полные валентные оболочки.
Пояснение: Из-за полной валентной электронной оболочки инертные газы чрезвычайно стабильны и с трудом теряют или приобретают электроны.
7. Ответ: S > Si > Al > Mg.
Пояснение: Электроны над закрытой оболочкой защищены закрытой оболочкой. S имеет 6 электронов над закрытой оболочкой, поэтому каждый чувствует притяжение 6 протонов в ядре.
8. Ответ: Фтор (F)>Сера (S)>Фосфор (P)>Бор (B)
Пояснение: Сродство к электрону обычно увеличивается слева направо и снизу вверх.
9. Ответ: C.) Кислород (O)
Объяснение: Периодические тренды показывают, что атомный радиус увеличивается вверх по группе и слева направо по периоду. Поэтому кислород имеет меньший атомный радиус серы.
10. Ответ: B.) Неверно
Объяснение: Причина этого заключается в том, что металл обычно теряет электрон, превращаясь в ион, а неметалл приобретает электрон. Это приводит к меньшему ионному радиусу для иона металла и большему ионному радиусу для иона неметалла.
Это приводит к меньшему ионному радиусу для иона металла и большему ионному радиусу для иона неметалла.
Ссылки
- Пинто, Габриэль. «Использование мячей различных видов спорта для моделирования изменения размеров атомов». J. Chem. Образовательный 1998 75 725.{cke_protected}{C}
- Куреши, Пушкин М.; Камунпури, С. Икбал М. «Сольватация ионов: проблема ионных радиусов». J. Chem. Образовательный 1991 , 68 , 109.
- Смит, Дерек В. «Энтальпии атомизации металлических элементарных веществ с использованием полуколичественной теории ионных твердых тел: простая модель для рационализации периодических тенденций». J. Chem. Образовательный 1993 , 70 , 368.
- Руссо, Стив и Майк Сильвер. Введение в химию. Сан-Франциско: Пирсон, 2007. .
- Петруччи, Ральф Х. и др. Общая химия: принципы и современные приложения. 9-е изд.
 Нью-Джерси: Пирсон, 2007. .
Нью-Джерси: Пирсон, 2007. . - Аткинс, Питер и др. al, Physical Chemistry , 7 th Edition, 2002, W.H Freeman and Company, New York, pg. 390.
- Альберти, Роберт А. и др. ал, Physical Chemistry , 3 rd Edition, 2001, John Wiley & Sons, Inc, pg. 380.
- Котс, Джон К. и др. al, Chemistry & Chemical Reactivity , 5 th Edition, 2003, Thomson Learning Inc, pg. 305-309.
Periodic Trends распространяется под лицензией CC BY-NC-SA 4.0, авторами, ремиксами и/или кураторами являются Света Рамиредди, Бинъяо Чжэн, Эмили Нгуен и Эмили Нгуен.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- нет на странице
- Теги
- Атомный радиус
- автор @ Бинъяо Чжэн
- автор @ Эмили Нгуен
- автор @ Света Рамиредди
- Электронное сродство
- электроотрицательность
- Тенденции электроотрицательности
- Энергия ионизации
- температура плавления
- металлический символ
- периодический закон
- периодическая таблица
- Периодические тренды
- Тренды
периодическая таблица | Определение, элементы, группы, сборы, тенденции и факты
таблица Менделеева
Просмотреть все СМИ
- Ключевые люди:
- Дмитрий Менделеев Лотар Мейер Поль-Эмиль Лекок де Буабодран
- Похожие темы:
- химический элемент атом группа периодический закон период
Просмотреть весь связанный контент →
Популярные вопросы
Что такое периодическая таблица?
Периодическая таблица представляет собой табличный массив химических элементов, упорядоченных по атомному номеру, от элемента с наименьшим атомным номером, водорода, до элемента с наибольшим атомным номером, оганесона. Атомный номер элемента — это число протонов в ядре атома этого элемента. У водорода 1 протон, у оганесона 118.
Атомный номер элемента — это число протонов в ядре атома этого элемента. У водорода 1 протон, у оганесона 118.
Что общего у групп периодической таблицы?
Группы периодической таблицы отображаются в виде вертикальных столбцов, пронумерованных от 1 до 18. Элементы в группе имеют очень похожие химические свойства, которые возникают из-за количества присутствующих валентных электронов, то есть количества электронов в внешняя оболочка атома.
Откуда взялась периодическая таблица?
Расположение элементов в периодической таблице определяется электронной конфигурацией элементов. Из-за принципа запрета Паули не более двух электронов могут занимать одну и ту же орбиталь. Первый ряд периодической таблицы состоит всего из двух элементов, водорода и гелия. Чем больше у атомов электронов, тем больше у них орбит, доступных для заполнения, и, таким образом, строки содержат больше элементов в нижней части таблицы.
Почему таблица Менделеева делится?
Периодическая таблица имеет две строки внизу, которые обычно отделены от основной части таблицы. Эти ряды содержат элементы лантаноидного и актиноидного рядов, обычно от 57 до 71 (от лантана до лютеция) и от 89 до 103 (актиний до лоуренсия) соответственно. Для этого нет никаких научных оснований. Это просто сделано для того, чтобы сделать таблицу более компактной.
Эти ряды содержат элементы лантаноидного и актиноидного рядов, обычно от 57 до 71 (от лантана до лютеция) и от 89 до 103 (актиний до лоуренсия) соответственно. Для этого нет никаких научных оснований. Это просто сделано для того, чтобы сделать таблицу более компактной.
Сводка
Прочтите краткий обзор этой темы
периодическая таблица , полностью периодическая таблица элементов , в химии систематизированный массив всех химических элементов в порядке возрастания атомного номера, т. е. общее количество протонов в атомном ядре. Когда химические элементы расположены таким образом, в их свойствах возникает повторяющаяся закономерность, называемая «периодическим законом», при которой элементы в одном столбце (группе) обладают сходными свойствами. Первоначальное открытие, которое сделал Д.И. Менделеев в середине 19ХХ века, сыграл неоценимую роль в развитии химии.
Изучите периодический закон химии, чтобы понять свойства элементов и то, как они соотносятся друг с другом
Просмотреть все видео к этой статье До второго десятилетия 20-го века фактически не признавалось, что порядок элементов в периодической системе таков их атомных номеров, целые числа которых равны положительным электрическим зарядам атомных ядер, выраженным в электронных единицах. В последующие годы был достигнут большой прогресс в объяснении периодического закона с точки зрения электронной структуры атомов и молекул. Это разъяснение повысило ценность закона, который сегодня используется так же часто, как и в начале 20-го века, когда он выражал единственную известную взаимосвязь между элементами.
В последующие годы был достигнут большой прогресс в объяснении периодического закона с точки зрения электронной структуры атомов и молекул. Это разъяснение повысило ценность закона, который сегодня используется так же часто, как и в начале 20-го века, когда он выражал единственную известную взаимосвязь между элементами.
История периодического закона
Узнайте, как устроена таблица Менделеева
Просмотреть все видео к этой статье В первые годы 19 века наблюдалось бурное развитие аналитической химии — искусства различать различные химические вещества — и, как следствие, накопление обширных знаний о химических и физических свойствах как элементов, так и соединений. Это быстрое распространение химических знаний вскоре потребовало классификации, ибо на классификации химических знаний основана не только систематизированная литература по химии, но и лабораторное искусство, с помощью которого химия передается как живая наука от одного поколения химиков к другому. Отношения между соединениями обнаруживались легче, чем между элементами; так получилось, что классификация элементов на много лет отставала от классификации соединений. Фактически, среди химиков не было достигнуто общего согласия относительно классификации элементов в течение почти полувека после того, как системы классификации соединений стали общеупотребительными.
Фактически, среди химиков не было достигнуто общего согласия относительно классификации элементов в течение почти полувека после того, как системы классификации соединений стали общеупотребительными.
Дж.В. Доберейнер в 1817 году показал, что совокупный вес, то есть атомный вес, стронция находится посередине между весами кальция и бария, а несколько лет спустя он показал, что существуют и другие подобные «триады» (хлор, бром и йод [галогены] и литий, натрий и калий [щелочные металлы]). Ж.-Б.-А. Дюма, Л. Гмелин, Э. Ленссен, Макс фон Петтенкофер и Дж. П. Кук расширили предположения Доберейнера между 1827 и 1858 гг., показав, что подобные отношения простираются дальше, чем триады элементов: фтор добавляется к галогенам, а магний — к щелочноземельным. металлы, в то время как кислород, сера, селен и теллур были отнесены к одному семейству, а азот, фосфор, мышьяк, сурьма и висмут — к другому семейству элементов.
Britannica Quiz
36 вопросов из самых популярных научных викторин Britannica
Насколько хорошо вы знаете астрономию? Как насчет квантовой механики? Эта викторина проведет вас через 36 самых сложных вопросов из самых популярных викторин Britannica о естественных науках. Только лучшие викторины закончат его.
Только лучшие викторины закончат его.
Позднее были предприняты попытки показать, что атомные массы элементов могут быть выражены арифметической функцией, и в 1862 г. А.-Э.-Б. де Шанкуртуа предложил классификацию элементов, основанную на новых значениях атомных весов, данных системой Станислао Канниццаро 1858 года. Де Шанкуртуа нанес атомные веса на поверхность цилиндра с окружностью 16 единиц, что соответствует приблизительному атомному весу кислород. Получившаяся винтовая кривая перенесла тесно связанные элементы в соответствующие точки цилиндра, расположенные выше или ниже друг друга, и, следовательно, он предположил, что «свойства элементов — это свойства чисел» — замечательное предсказание в свете современных знаний.
Классификация элементов
В 1864 г. Я.А.Р. Ньюлендс предложил классифицировать элементы в порядке увеличения атомного веса, при этом элементам присваивались порядковые номера от единицы и вверх, и они были разделены на семь групп, обладающих свойствами, тесно связанными с первыми семью из известных тогда элементов: водород, литий, бериллий, бор, углерод.