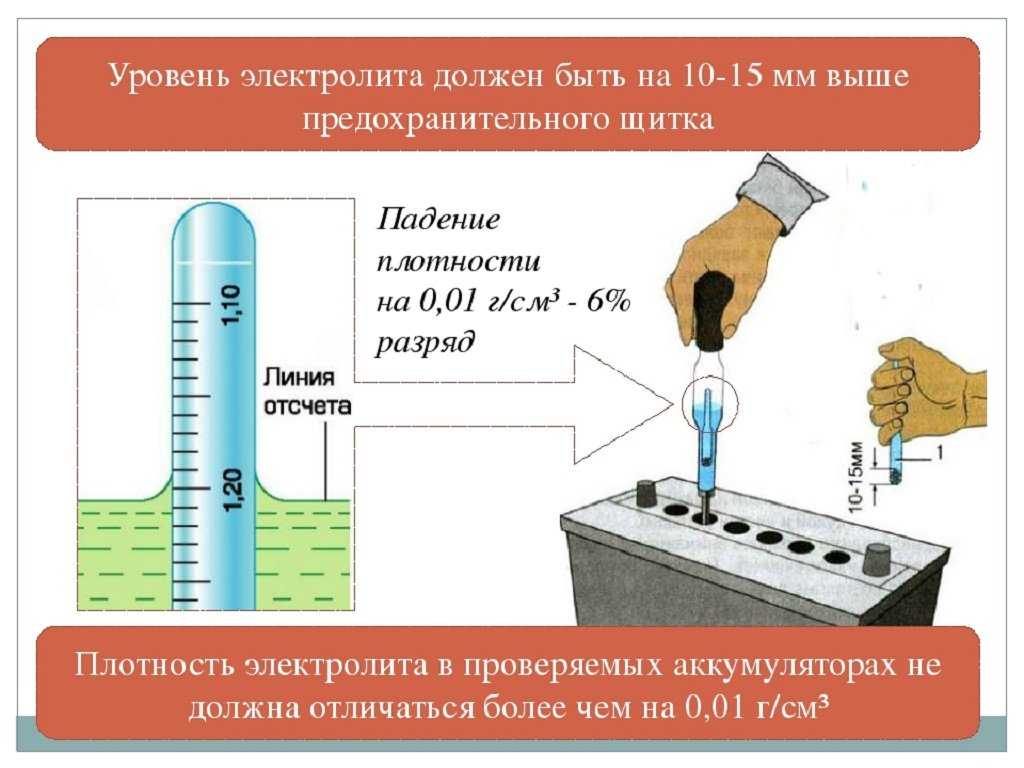
|
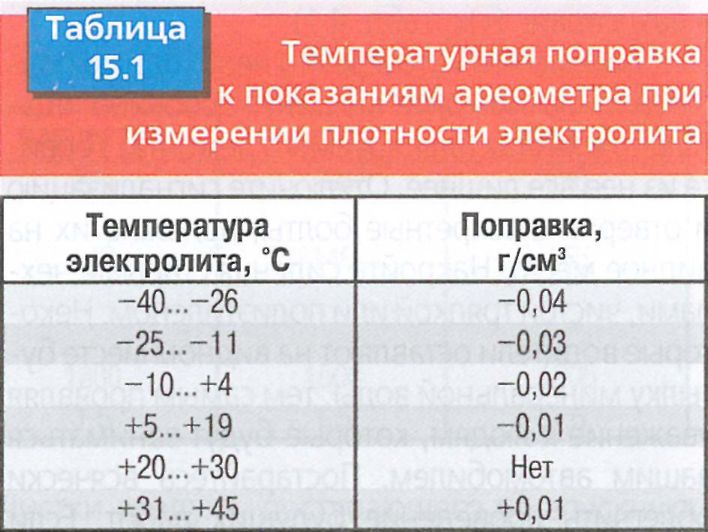
При первичной заливке электролита в аккумулятор стартерной батареи автомобиля в условиях частного автосервиса следует придерживаться следующих правил: Нельзя приготавливать электролит для аккумуляторной батареи из концентрированной серной кислоты в неприспособленном для этого помещении. В крайнем случае можно приготавливать электролит на открытом воздухе с соблюдением всех мер предосторожности. Приготовление электролита реализуется вливанием серной кислоты в дистиллированную воду. Обратное вливание является грубейшим нарушением технической безопасности, так как может иметь место интенсивное вскипание и разбрызгивание кислоты. Приготавливать и заливать электролит в аккумуляторную батарею следует при температуре 15… 25°С. Плотность электролита, измеренная при приготовлении и заливке, приводится к температуре 25°С по формуле γ25 = γТ + 0,0007 (Т -25), где γ Сначала приготавливают электролит с плотностью γ25 =1,40 г/см3, для чего в 650 объемных частей дистиллированной воды вливают 423 части концентрированной 94%-ной аккумуляторной серной кислоты. Использование технической серной кислоты недопустимо. При растворении серной кислоты в воде выделяется большое количество теплоты. Заливать в аккуумуляторную батарею можно только остывший электролит (15 Э Нормы расхода компонентов для приготовления 1 дм3 (л) электролита приведены в таблице:
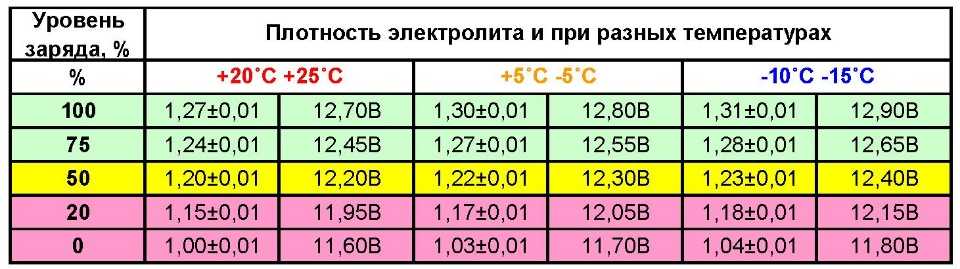
При заливке электролита в аккумулятор приведенная плотность γ25 электролита обязательно указывается в сопроводительном документе на батарею; это необходимо для определения степени разряженности в дальнейшем. Плотность электролита при первичной заливке должна соответствовать климатической зоне эксплуатации автомобильного аккумулятора, а для влажных и холодных регионов также и времени года (смотрите таблицу ниже).
Для предполярных и полярных широт необходимо учитывать возможность замерзания электролита
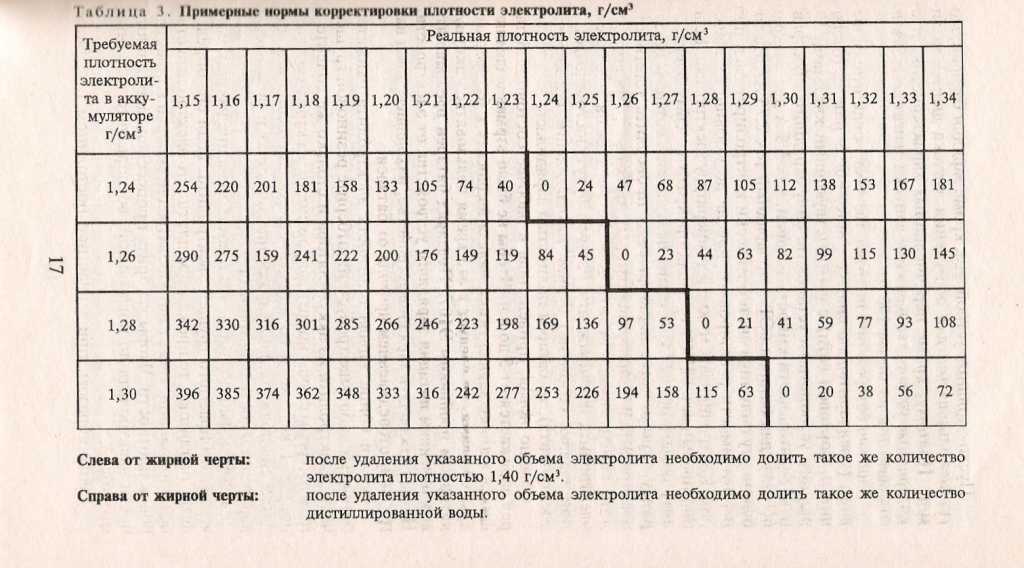
Из таблицы видно, что увеличение плотности электролита выше значения 1,31 г/см3 приводит к повышению температуры замерзания. Для точной подгонки плотности электролита при его заливке в батарею необходимо иметь дистиллированную воду и электролит с повышенной плотностью 1,4 г/см3. Если приготовленный электролит имеет плотность ниже требуемой, то в него доливается не аккумуляторная кислота, а электролит с повышенной плотностью. При необходимости понизить плотность в электролит доливают дистиллированную воду. Для удобства составления электролита с требуемой плотностью приведена таблица: | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Плотность электролита Калькулятор | Вычислить Плотность электролита
✖Электрический ток — это временная скорость прохождения заряда через площадь поперечного сечения.ⓘ Электрический ток [I] | AbampereАмперАттоамперБайотсантиамперСГС ЭМБлок ЭС СГСДециамперДекаампереEMU текущегоESU текущегоExaampereФемтоамперГигаамперГилбертгектоамперкилоамперМегаампермикроамперМиллиампернаноамперПетаамперПикоамперStatampereтераамперЙоктоампереЙоттаампереZeptoampereZettaampere | +10% -10% | |
✖Сопротивление зазора между заготовкой и инструментом. | AbohmEMU сопротивленияESU сопротивленияExaohmГигаомкилооммегаоммикроомМиллиомНаномомПетаомПланка сопротивлениеКвантованная Hall СопротивлениеВзаимный СименсStatohmВольт на АмперYottaohmZettaohm | +10% -10% | |
✖Объемная скорость потока – это объем жидкости, проходящий в единицу времени.ⓘ Объемный расход [Q] | акр-фут / деньакр-фут / часакр-фут / годБаррель (США) в деньБаррель в часБаррель в минутуБаррель в секундуКубический сантиметр в деньКубический сантиметр в часКубический сантиметр в минутуКубический сантиметр в секундуКубический фут в часКубический фут в минутуКубический фут в секундуКубический дюйм в часКубический дюйм в минутуКубический дюйм в секундуКубический метр в суткиКубический метр в часКубический метр в минутуКубический метр в секундуКубический миллиметр в минутуКубический миллиметр в секундуКубический ярд в часКубический ярд в минутуКубический ярд в секундуГаллон (UK) / деньГаллон (UK) / часгаллона(UK)/ минГаллон (UK) / секунда Галлон (US) / деньгаллона (US) / часГаллона (US) / минГаллон (US) / секСто кубических футов в суткиСто кубических футов в часСто кубических футов в минутуКилобаррель в деньЛитр / деньЛитр / часЛ / минЛитр / секунда Миллилитр / деньМиллилитр / часМиллилитр в минутуМиллилитр в секундуУнция в часУнция в минутуУнция в секундуУнция (Великобритания) в часУнция (Великобритания) в минутуУнция (Великобритания) в секундуФунт в деньФунт в час | +10% -10% | |
✖Удельная теплоемкость электролита – это количество тепла, необходимое для повышения температуры единицы массы данного вещества на заданную величину. | Btu (IT) за фунт на градус ЦельсияБТЕ (ИТ) на фунт на градус ФаренгейтаБТЕ (ИТ) на фунт на градус РенкинаBtu (th) на фунт на градус ФаренгейтаБТЕ (терм.) на фунт на градус РенкинаКалория (IT) на грамм на градус ЦельсияКалория (IT) на грамм на градус ФаренгейтаКалория (th) на грамм на градус ЦельсияCHU за фунт на градус ЦельсияДжоуль на грамм на градус ЦельсияДжоуль на килограмм на градус ЦельсияДжоуль на килограмм на KКилокалория (ИТ) на килограмм на градус ЦельсияКилокалория (IT) на килограмм на KКилокалория (th) на килограмм на градус ЦельсияКилокалория (th) на килограмм на KКилограмм-сила-метр на килограмм на кельвинКилоджоуль на килограмм на градус ЦельсияКилоджоуль на килограмм на KФунт-сила-фут на фунт на градус Ренкина | +10% -10% | |
✖Температура кипения электролита – это температура, при которой жидкость начинает кипеть и превращается в пар.ⓘ Температура кипения электролита [θboiling] | ЦельсияДелильФаренгейтКельвинНьютонРанкинтемпература по реомюруРомерТройной точки воды | +10% -10% | |
✖Температура окружающего воздуха – это температура, при которой начинается процесс трамбовки. | ЦельсияДелильФаренгейтКельвинНьютонРанкинтемпература по реомюруРомерТройной точки воды | +10% -10% |
|
✖Плотность электролита показывает плотность электролита в определенной области. Это берется как масса на единицу объема данного объекта.ⓘ Плотность электролита [ρelectrolyte] |
сантиграмм / литрдециграмм/ литрдекаграмм / литрПлотность Землифемтограмм/ литрЗерно на кубический футЗерно на галлон (Великобритания)Зерно на галлон (США)Грамм на кубический сантиметрГрамм на кубический метрГрамм на кубический миллиметрГрамм на литрГрамм на миллилитргектограмм / литрКилограмм на кубический сантиметрКилограмм на кубический дециметрКилограмм на кубический метрКилограмм на литрмегаграмм / литрмикрограмм / литрМиллиграмм на кубический сантиметрМиллиграмм на кубический метрМиллиграмм на кубический миллиметрМиллиграмм на литрнанограмм / литрУнция на кубический футУнция на кубический дюймУнция на галлон (Великобритания)Унция на галлон (США)пикограмм / литрПланковская плотностьФунт на кубический футФунт на кубический дюймФунт на кубический ярдФунт на галлон (Великобритания)Фунт на галлон (США)Слаг на кубический футСлаг на кубический дюймСлаг на кубический ярдТонна (длинная) на кубический ярдТонна (короткая) на кубический ярд |
⎘ копия |
👎
Формула
сбросить
👍
Плотность электролита Решение
ШАГ 0: Сводка предварительного расчета
ШАГ 1.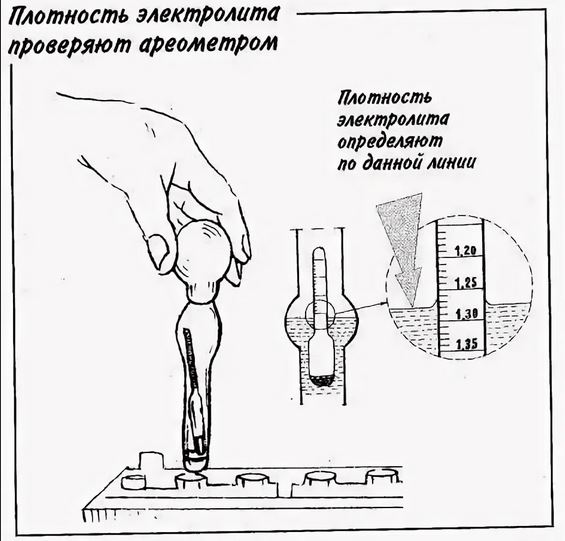 Преобразование входов в базовый блок
Преобразование входов в базовый блок
Электрический ток: 1000 Ампер —> 1000 Ампер Конверсия не требуется
Сопротивление зазора между заготовкой и инструментом: 0.012 ом —> 0.012 ом Конверсия не требуется
Объемный расход: 47.9 Кубический сантиметр в секунду —> 4.79E-05 Кубический метр в секунду (Проверьте преобразование здесь)
Удельная теплоемкость электролита: 4.18 Килоджоуль на килограмм на K —> 4180 Джоуль на килограмм на K (Проверьте преобразование здесь)
Температура кипения электролита: 368.15 Кельвин —> 368.15 Кельвин Конверсия не требуется
Температура окружающего воздуха: 308.15 Кельвин —> 308.15 Кельвин Конверсия не требуется
ШАГ 2: Оцените формулу
ШАГ 3: Преобразуйте результат в единицу вывода
998.891230733886 Килограмм на кубический метр —> Конверсия не требуется
< 10+ Сопротивление разрыву Калькуляторы
Требуемый ток в ECM
Электрический ток = sqrt((Объемный расход*Плотность электролита*Удельная теплоемкость электролита*(Температура кипения электролита-Температура окружающего воздуха))/Сопротивление зазора между заготовкой и инструментом) Идти
Удельная теплоемкость электролита от объемного расхода
Удельная теплоемкость электролита = (Электрический ток^2*Сопротивление зазора между заготовкой и инструментом)/(Плотность электролита*Объемный расход*(Температура кипения электролита-Температура окружающего воздуха)) Идти
Расход электролитов через сопротивление зазора ECM
Объемный расход = (Электрический ток^2*Сопротивление зазора между заготовкой и инструментом)/(Плотность электролита*Удельная теплоемкость электролита*(Температура кипения электролита-Температура окружающего воздуха)) Идти
Плотность электролита
Плотность электролита = (Электрический ток^2*Сопротивление зазора между заготовкой и инструментом)/(Объемный расход*Удельная теплоемкость электролита*(Температура кипения электролита-Температура окружающего воздуха)) Идти
Температура кипения электролита при электрохимической обработке металлов
Температура кипения электролита = Температура окружающего воздуха+(Электрический ток^2*Сопротивление зазора между заготовкой и инструментом)/(Плотность электролита*Удельная теплоемкость электролита*Объемный расход) Идти
Сопротивление зазора от расхода электролита
Сопротивление зазора между заготовкой и инструментом = (Объемный расход*Плотность электролита*Удельная теплоемкость электролита*(Температура кипения электролита-Температура окружающего воздуха))/Электрический ток^2 Идти
Сопротивление зазору между работой и инструментом
Сопротивление зазора между заготовкой и инструментом = (Удельное сопротивление электролита*Зазор между инструментом и рабочей поверхностью)/Площадь поперечного сечения зазора Идти
Удельное сопротивление электролита
Удельное сопротивление электролита = (Сопротивление зазора между заготовкой и инструментом*Площадь поперечного сечения зазора)/Зазор между инструментом и рабочей поверхностью Идти
Ширина равновесного зазора
Зазор между инструментом и рабочей поверхностью = (Сопротивление зазора между заготовкой и инструментом*Площадь поперечного сечения зазора)/Удельное сопротивление электролита Идти
Площадь сечения зазора
Площадь поперечного сечения зазора = (Удельное сопротивление электролита*Зазор между инструментом и рабочей поверхностью)/Сопротивление зазора между заготовкой и инструментом Идти
Плотность электролита формула
Плотность электролита = (Электрический ток^2*Сопротивление зазора между заготовкой и инструментом)/(Объемный расход*Удельная теплоемкость электролита*(Температура кипения электролита-Температура окружающего воздуха))
ρelectrolyte = (I^2*R)/(Q*celectrolyte*(θboiling-θambient))
Что такое закон электролиза Фарадея I.

Первый закон электролиза Фарадея гласит, что химическое изменение, производимое во время электролиза, пропорционально пропускаемому току и электрохимической эквивалентности материала анода.
Share
Copied!
Метод расчета плотности смешанных растворов сильных электролитов
Метод расчета плотности смешанных растворов сильных электролитов
Скачать PDF
Скачать PDF
- Опубликовано:
- Кулов Н.Н. 1 и
- Очкин А.
 В. 2
В. 2
Теоретические основы химической технологии том 54 , страницы 1223–1228 (2020)Процитировать эту статью
78 доступов
1 Цитаты
Сведения о показателях
Abstract
Предложен метод расчета плотности растворов сильных электролитов с использованием произведения кажущегося молярного объема электролита на его моляльность. Этот метод можно использовать для расчета плотности растворов смешанных электролитов, например, при определении активности по уравнению Гиббса–Дюгема. По литературным данным о плотностях растворов при 20°С кажущиеся молярные объемы NaCl, NaNO 3 , KCl, KNO 3 , SrCl 2 и показана высокая точность расчетов.
Этот метод можно использовать для расчета плотности растворов смешанных электролитов, например, при определении активности по уравнению Гиббса–Дюгема. По литературным данным о плотностях растворов при 20°С кажущиеся молярные объемы NaCl, NaNO 3 , KCl, KNO 3 , SrCl 2 и показана высокая точность расчетов.
ВВЕДЕНИЕ
Смешанные водные растворы электролитов часто используются в технике и лабораторной практике. Одним из примеров является расчет равновесия при переработке отработавшего топлива ядерных реакторов. В этом случае водную фазу в первом приближении можно считать смесью азотной кислоты и нитрата уранила. Описание этой системы дано в [1], где указаны плотности смешанных растворов. Моделирование этой системы рассмотрено в [2–4] с использованием расчетной плотности растворов. Однако следует учитывать, что помимо уранилнитрата и азотной кислоты в водной фазе присутствуют продукты деления, а также продукт коррозии – трехвалентное железо. При расчете плотностей смешанных растворов концентрации указанных выше продуктов не учитывались, так как метод учета сопутствующих веществ при малой их концентрации еще недостаточно разработан. 9{3}}} {{{M}_{1}}}}} \право. \kern-0em} {{{M}_{1}}}}} \right)d\ln {{a}_{w}} + \Sigma {{m}_{i}}d\ln {{ a}_{i}} = 0.$$
При расчете плотностей смешанных растворов концентрации указанных выше продуктов не учитывались, так как метод учета сопутствующих веществ при малой их концентрации еще недостаточно разработан. 9{3}}} {{{M}_{1}}}}} \право. \kern-0em} {{{M}_{1}}}}} \right)d\ln {{a}_{w}} + \Sigma {{m}_{i}}d\ln {{ a}_{i}} = 0.$$
(2)
При расчете молярной концентрации m i по молярной концентрации c i обычно применяют следующее уравнение:
$${{m}_{i}} = {{{{c}_{i}}} \mathord{\left/ {\vphantom {{{{c}_{i}}} {[d }}} \Правильно. \kern-0em} {[d}}—0,001\Sigma ({{c}_{j}}{{M}_{j}})].$$
(3)
Таким образом, для расчета равновесия по уравнению Гиббса–Дюгема необходимо знать плотности смешанных растворов.
Целью данной работы является создание методики расчета плотностей растворов на примере хлоридов и нитратов натрия, калия и стронция, для которых предполагается их полная диссоциация. Поскольку плотности водных растворов при малых концентрациях солей мало отличаются от плотности воды, то, в первую очередь, необходимо выбрать базу данных, на основе которой можно установить исходную закономерность. Поскольку можно было ожидать, что плотности растворов будут зависеть от активности воды, такую зависимость необходимо было учитывать.
Поскольку можно было ожидать, что плотности растворов будут зависеть от активности воды, такую зависимость необходимо было учитывать.
Следует также отметить, что определение плотностей растворов также имеет практическое значение. Например, концентрация компонентов часто определяется плотностью растворов. Наиболее известные произведения Д.И. Менделеева, изучавшего систему вода–этиловый спирт, впоследствии была использована при создании в России государственного винокурения [5]. Позже Академия наук Советского Союза издала сборник трудов Д.И. Менделеева о решениях [6]. В частности, в данной работе было предложено использовать уравнение для определения плотности растворов солей
$$d = {{d}_{0}} + {m \mathord{\left/ {\vphantom {m {(A + Bm)}}} \right. \kern-0em} {(A + Bm)}}.$$
(4)
Для растворов нитрата натрия, плотности которых приведены в табл. 1, мы попытались проверить это уравнение. Среднеквадратичное отклонение экспериментальных значений плотности от расчетных оказалось порядка 1%.
Состав солевых растворов также определяется плотностью. А.Б. Здановский и др. опубликовал справочник [7], а также работу [8], в которой содержится закономерность, известная в литературе как правило Здановского 9{*}} {({{\nu }_{1}}{{m}_{1}} + {{\nu }_{2}}{{m}_{2}})}}} \ Правильно. \kern-0em} {({{\nu }_{1}}{{m}_{1}} + {{\nu }_{2}}{{m}_{2}})}}. $$
(6б)
Уравнения Микулина были обобщены на системы с большим числом компонент [10, 11]. Во всех этих случаях для расчета молярных концентраций необходимо определять плотности смешанных растворов.
РАСЧЕТЫ И ОБСУЖДЕНИЕ
Теоретические основы методики определения плотности смешанных растворов сформулированы в [12]. В его основе лежит представление об аддитивности молярных объемов воды и электролита в соответствии с уравнением 9{{0,5}}.$$
(8)
Значение параметра k рассчитано по теории Дебая–Хюккеля. Однако в случае расчетов при высоких концентрациях этот параметр заменяется эмпирическим коэффициентом.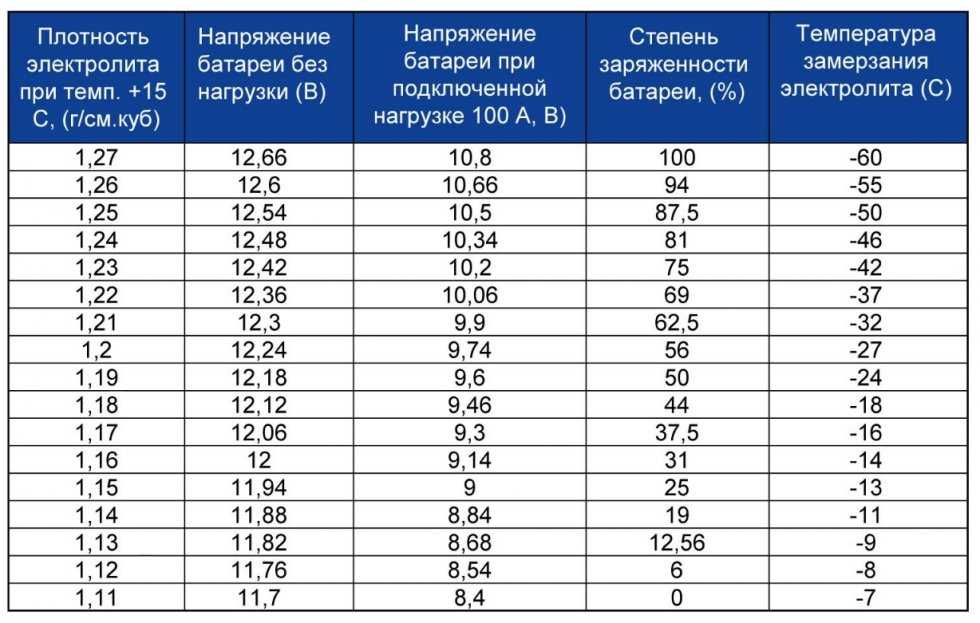 Этот коэффициент не будет использоваться в наших расчетах.
Этот коэффициент не будет использоваться в наших расчетах.
В качестве основной базы в нашей работе мы взяли данные о плотностях водных растворов из справочника [13], в котором плотности растворов пяти солей взяты при 20°С при плотности воды 0,9982 г/см 3 . Результаты расчетов представлены в табл. 1. Значения активности воды a w при 25°C взяты из [14].
Таблица 1. Расчет плотности водных растворов при 20°CПолноразмерная таблица
Метод расчета плотности основан на формуле. (7), расчет которого включает несколько операций. Сначала рассчитайте объем раствора, содержащего 1000 г воды, и соответствующую молярную концентрацию соли:
$$V = {{(1000 + мМ)} \mathord{\left/ {\vphantom {{(1000 + мМ)} d}} \right. \kern-0em} d}.$$
(9)
Вычисляется кажущийся объем соли V s :
$${{V}_{{\text{s}}}} = {{(V-{{V}_{0}})} \mathord{\left/ {\vphantom {{(V-{{V}_{0}})} m}} \right.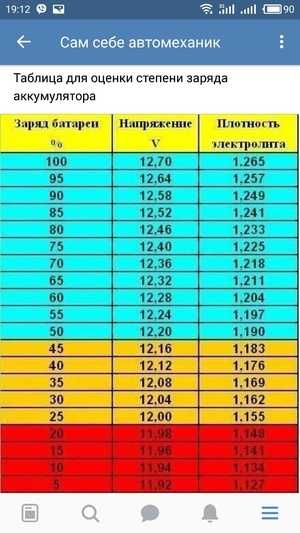 \kern-0em} м}.$$
\kern-0em} м}.$$
(10)
Среднее значение В с0 вычисляется по следующему уравнению: }}0}}} = {{V}_{{\text{s}}}}{{a}_{{\text{w}}}}.$$
(11)
Далее значение плотности d c вычисляется по следующей формуле:
$${{d}_{{\text{c}}}} = {{(1000 + mM )} \mathord{\left/ {\vphantom {{(1000 + мМ)} {[1001,8}}} \right. \kern-0em} {[1001.8}} + ({{{{V}_{{{\text{s}}0}}}} \mathord{\left/ {\vphantom {{{{V}_{ {{\text{s}}0}}}} {{{a}_{{\text{w}}}}}}} \right.\kern-0em} {{{a}_{{\text {w}}}}}})m].$$
(12)
Расчетные значения d c приведены в табл. 1. Оптимизация значений V s0 по минимальной сумме квадратов отклонений d – d c . Данные табл. 1 свидетельствуют о том, что значения V s0 остаются постоянными примерно до 20 мас. %, а отклонения расчетных значений плотностей от экспериментальных невелики, а среднее отклонение близко к 0,05 %. . Это приводит к двум выводам. Во-первых, это указывает на принципиальную применимость данной методики для расчета плотностей растворов и дает хорошие результаты для растворов хлоридов и нитратов щелочных и щелочноземельных металлов. Линейная зависимость плотности раствора от молярной концентрации в соответствии с уравнением (12) позволяет рассчитать плотности смешанных растворов при различных разбавлениях. В частности, эту процедуру можно применять для расчета плотности смешанных растворов по уравнению Гиббса–Дюгема в форме (2).
. Это приводит к двум выводам. Во-первых, это указывает на принципиальную применимость данной методики для расчета плотностей растворов и дает хорошие результаты для растворов хлоридов и нитратов щелочных и щелочноземельных металлов. Линейная зависимость плотности раствора от молярной концентрации в соответствии с уравнением (12) позволяет рассчитать плотности смешанных растворов при различных разбавлениях. В частности, эту процедуру можно применять для расчета плотности смешанных растворов по уравнению Гиббса–Дюгема в форме (2).
В этом случае уравнение. (12) следует заменить обобщенным уравнением
$$\begin{gathered} {{d}_{{\text{c}}}} = {{\left( {1000 + \Sigma {{m}_ {i}}{{M}_{i}}} \right)} \mathord{\left/ {\vphantom {{\left( {1000 + \Sigma {{m}_{i}}{{M} _{i}}} \right)} {[1001.8}}} \right. \kern-0em} {[1001.8}} \\ + \,\,\sum \left( {{{{{V}_{{{\text{s}}0i}}}} \mathord{\left/ {\vphantom {{{{V}_{{{\text{s}}0i}}}} {{{a}_{{\text{w}}}}}}} \right.\kern-0em } {{{a}_{{\text{w}}}}}}} \right) + {{m}_{i}}]. \\ \end{собрано} $$ 9{n}}. $$
\\ \end{собрано} $$ 9{n}}. $$
(14)
Значения коэффициента B 1 , B 2 , K и N приведены в Таблице 2.
Таблица 2. COEFFICIC. в уравнении (13)Полная таблица
Также было интересно сравнить значения V s0 со значениями φ 0 из работы [12]. Как следует из приведенных в табл. 3 значений отношений V s0 /φ 0 , разница между этими значениями не превышает 5–10 %. 9{ — }.\)
Таблица 3. Сравнение величин V s0 со значениями φ 0 [12]Полная таблица
ВЫВОДЫ Предложен метод расчета плотности
растворов сильных электролитов с помощью произведения кажущегося молярного объема электролита на его моляльность. Этот метод можно использовать для расчета плотности растворов смешанных электролитов, например, при определении активности по уравнению Гиббса–Дюгема.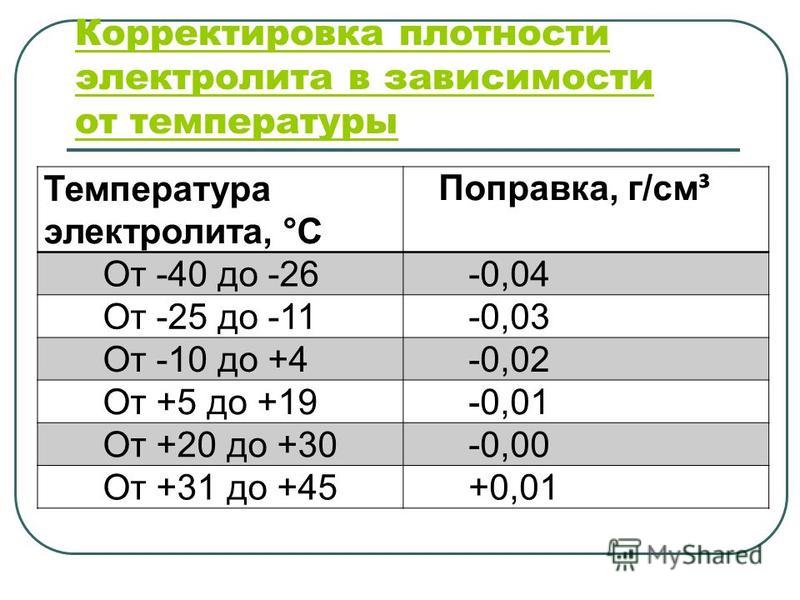 При этом условием применения метода является полная диссоциация электролита. По литературным данным о плотностях растворов при 20°С кажущиеся молярные объемы NaCl, NaNO 3 , KCl, KNO 3 и SrCl 2 рассчитаны с высокой точностью.
При этом условием применения метода является полная диссоциация электролита. По литературным данным о плотностях растворов при 20°С кажущиеся молярные объемы NaCl, NaNO 3 , KCl, KNO 3 и SrCl 2 рассчитаны с высокой точностью.
ОБОЗНАЧЕНИЯ
| А , Б | эмпирические коэффициенты в уравнении |
| и | термодинамическая активность |
| б 1 , б 2 , к , н | коэффициенты в уравнении (13) |
| с | молярная концентрация, моль/л |
| д | плотность смешанного раствора, г/см 3 |
| к | параметр, рассчитанный в теории Дебая – Хюккеля |
| М | молярная масса |
| м | молярная концентрация |
| Н | число молей в уравнении |
| п | количество молей компонента или количество экспериментов |
| с | стандартное отклонение экспериментальных данных |
| В | объем раствора, мл |
| х | мольная доля |
| г | молярный коэффициент активности |
| γ | молярный коэффициент активности |
| дельта | среднеквадратичное относительное отклонение расчетных данных от экспериментальных, % |
| ν | стехиометрический коэффициент |
| ∑ | сумма квадратов отклонений экспериментальных данных от расчетных |
| ф | кажущийся молярный объем, мл |
ПОДПИСКИ И НАДСТРИПЫ
| подписок | |
| 0 | нулевое значение параметра |
| 1, 2 | количество компонентов в уравнении |
| из | расчетные значения |
| я , дж , к | названия компонентов при перечислении в формулах |
| с | соль (электролит) |
| Надстрочные индексы | |
| 0 | значение параметра для бесконечного разбавления |
| к, н | экспоненты в уравнении (13) |
| * | значения моляльности м и моляльного коэффициента активности γ в изопиестическом растворе |
ЛИТЕРАТУРА
Дэвис В.
 , Лоусон П.С., ДеБрюин Х.Дж. и Мрочек Дж. Активность трех компонентов в системе вода-азотная кислота-гексагидрат нитрата уранила при 25°, J. Phys. хим. , 1965, том. 69, с. 1904.
, Лоусон П.С., ДеБрюин Х.Дж. и Мрочек Дж. Активность трех компонентов в системе вода-азотная кислота-гексагидрат нитрата уранила при 25°, J. Phys. хим. , 1965, том. 69, с. 1904.Артикул КАС Google ученый
Очкин А., Гладилов Д., Нехаевский С., Меркушкин А. Коэффициенты активности нитрата уранила и азотной кислоты в смесях, Procedia Chem., 2016, vol. 21, стр. 87–92.
Артикул Google ученый
Очкин А.В., Меркушкин А.О., Нехаевский С.Ю., Тюпина Е.А. Расчет активности уранилнитрата и азотной кислоты в H 2 O–HNO 3 –UO 2 (NO 3 ) 2 –система ТБФ–разбавитель по правилу Здановского, Радиохимия, 2016, т. 1, с. 58, стр. 280–286. https://doi.org/10.1134/S1066362216030097
Статья КАС Google ученый
Очкин А.
 В., Меркушкин А.О., Нехаевский С.Ю., Гладилов Д.Ю. Моделирование активности нитрата уранила и азотной кислоты в смешанных растворах // Радиохимия. 60, стр. 534–540. https://doi.org/10.1134/S1066362218050107
В., Меркушкин А.О., Нехаевский С.Ю., Гладилов Д.Ю. Моделирование активности нитрата уранила и азотной кислоты в смешанных растворах // Радиохимия. 60, стр. 534–540. https://doi.org/10.1134/S1066362218050107Артикул КАС Google ученый
Менделеев Д. И. Перегонка, в Энциклопедический словарь . СПб.: Брокгауз Ф. А. и Ефрон И. А., 1902, т. 1, с. 11, с. 466.
Менделеев Д.И., Растворы (Решения), Москва: Акад. Наук СССР, 1959.
Google ученый
Здановский А.Б., Ляховская Е.И., Шлеймович Р.Е., Справочник по растворимости солевых систем . Л.: Госхимиздат, 1953.
Здановский А.Б. Зависимости в изменении свойств смешанных растворов. Галургий, Академия наук СССР (Труды Соляной лаборатории Всесоюзного института по изучению солей АН СССР), Москва: Акад.
 Наук СССР, 1936, т. 1, с. 6.
Наук СССР, 1936, т. 1, с. 6.Микулин Г.И. Вознесенская И.Е. Теория смешанных растворов электролитов, подчиняющихся правилу Здановского: I. Растворы двух солей с общим ионом. Вопросы физической химии растворов электролитов . Микулин Г.И. ред., Л.: Химия, 1968. С. 304–329.
Google ученый
Микулин Г.И. К., Вознесенская И.Е. Теория смешанных растворов электролитов, подчиняющихся правилу Здановского. II. Растворы трех солей с общим ионом Вопросы физической химии растворов электролитов / Под ред. Микулина Г.И. Л.: Химия, 1968, с. 330.
Google ученый
Микулин Г.И. К., Вознесенская И.Е. Теория смешанных растворов электролитов, подчиняющихся правилу Здановского. III. Четырехкомпонентные водные взаимные системы, Вопросы физ.-химии растворов электролитов , Микулин Г.И., ред.
 , Л.: Химия, 1968, с. 346.
, Л.: Химия, 1968, с. 346.Google ученый
Микулин Г.И. О некоторых методах расчета плотности и теплоемкости смешанных растворов электролитов // Вопросы физической химии растворов электролитов . Под ред. Микулина Г.И. : Химия, 1968, с. 401.
Google ученый
Handbook of Chemistry and Physics, Lide, DR, Ed., Boca Raton, Fla.: CRC, 2005.
Google ученый
Вознесенская И.Е. Таблицы активности воды в растворах сильных электролитов при 25°С // Вопросы физической химии растворов электролитов . Под ред. Микулина Г.И. Л.: Химия, 1968. стр. 361–400.
Google ученый
Скачать ссылки
Финансирование
Исследование выполнено при финансовой поддержке Российского научного фонда (проект № 18-13-00475).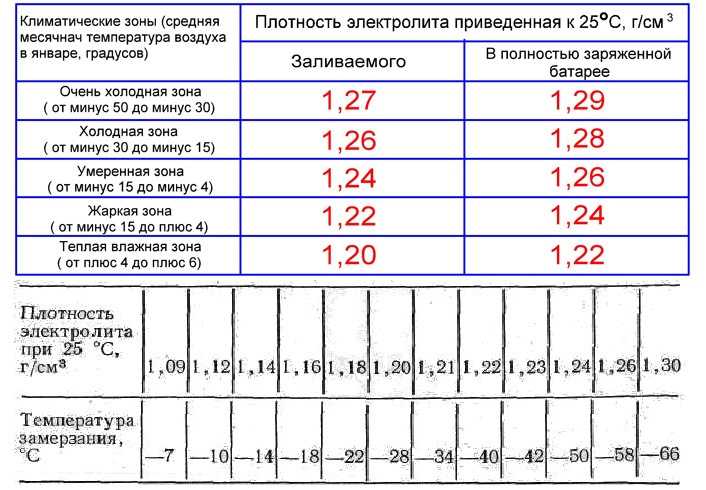




 ⓘ Сопротивление зазора между заготовкой и инструментом [R]
ⓘ Сопротивление зазора между заготовкой и инструментом [R] ⓘ Удельная теплоемкость электролита [celectrolyte]
ⓘ Удельная теплоемкость электролита [celectrolyte]