Испарение и конденсация(уч.10кл.Стр.286-289,290-291)
Условия перехода из газообразной фазы в жидкую через потенциальную и кинетическую энергию молекул
Физический смысл перехода. Формула через энергию и температуру
Определение пара
Определение критической температуры
Зависимость критической температуры от потенциальной энергии молекул газа
Влияние давления на переход газ-жидкость
Сжижение пара при изотермическом сжатии (на примере поршня)
Определение конденсации
Определение испарения
Определение насыщенного пара
График изотермы сжижения пара и физический смысл ее участков
Физика процесса испарения (уч.10кл.стр.290)
Понятие удельной теплоты испарения. Определение. Формула
Физика процесса конденсации.
Количество теплоты получаемое при конденсации
Процесс перехода вещества из жидкого состояния в газообразное состояние называется парообразованием, обратный процесс превращения вещества из газообразного состояния в жидкое называют конденсацией

Испаряются и твердые тела, но очень медленно. Например, нафталин.
Существуют два вида парообразования — испарение и кипение.
Рассмотрим сначала испарение жидкости.
Явление превращения жидкости в пар называется парообразованием.
Парообразование, происходящее с поверхности жидкости, называется испарением.
Испарением называют процесс парообразования, происходящий с открытой поверхности жидкости при любой температуре.
С точки зрения молекулярно-кинетической теории эти процессы объясняются следующим образом. Молекулы жидкости, участвуя в тепловом движении, непрерывно сталкиваются между собой. Это приводит к тому, что некоторые из них приобретают кинетическую энергию, достаточную для преодоления молекулярного притяжения. Такие молекулы, находясь у поверхности жидкости, вылетают из неё, образуя над жидкостью пар (газ).
Испарение происходит тем быстрее, чем выше ее температура.
Скорость испарения зависит от площади поверхности жидкости
Одновременно с
переходом молекул из жидкости в пар
происходит и обратный процесс.
Эти два процесса вылета молекул жидкости и их обратное возвращение в жидкость происходят одновременно.
Если число вылетающих молекул больше числа возвращающихся, то происходит уменьшение массы жидкости — жидкость испаряется, если же наоборот, то количество жидкости увеличивается — наблюдается конденсация пара.
Возможен случай, когда массы жидкости и пара, находящегося над ней, не меняются. Это возможно, когда число молекул, покидающих жидкость, равно числу молекул, возвращающихся в неё.
Такое состояние называется динамическим равновесием, а пар, находящийся в динамическом равновесии со своей жидкостью, называют насыщенным.
Если же между паром и жидкостью нет динамического равновесия, то он называется
Пар, находящийся в динамическом равновесии со своей жидкостью, называется насыщенным паром.
Пар, не находящийся в динамическом равновесии со своей жидкостью, называется ненасыщенным паром.
Насыщенный пар
при данной температуре имеет определённую
плотность, называемую равновесной.
Это обусловливает неизменность равновесной плотности, а следовательно, и давления насыщенного пара от его объёма при неизменной температуре, поскольку уменьшение или увеличение объёма этого пара приводит к конденсации пара или к испарению жидкости соответственно.
Изотерма насыщенного пара при некоторой температуре в координатной плоскости Р, V представляет собой прямую, параллельную оси V.
При динамическом равновесии масса жидкости в закрытом сосуде не изменяется, хотя жидкость продолжает испаряться.
При ветре, который уносит молекулы жидкости, испарение происходит быстрее, так как меньше молекул возвращается обратно в жидкость.
С повышением
температуры термодинамической
системы жидкость — насыщенный пар число
молекул, покидающих жидкость за
некоторое время, превышает количество
молекул, возвращающихся из пара в
жидкость. Это продолжается до тех пор,
пока возрастание плотности пара не
приводит к установлению динамического
равновесия при более высокой температуре. При этом увеличивается и давление
насыщенных паров. Таким образом, давление
насыщенных паров зависит только от
температуры.
При этом увеличивается и давление
насыщенных паров. Таким образом, давление
насыщенных паров зависит только от
температуры.
Столь быстрое возрастание давления насыщенного пара обусловлено тем, что с повышением температуры происходит рост не только кинетической энергии поступательного движения молекул, но и их концентрации, т.е. числа молекул в единице объема
При испарении жидкость покидают наиболее быстрые молекулы, вследствие чего средняя кинетическая энергия поступательного движения оставшихся молекул уменьшается, а следовательно, и температура жидкости понижается. Поэтому, чтобы температура испаряющейся жидкости оставалась постоянной, к ней надо непрерывно подводить определённое количество теплоты.
Количество теплоты, которое необходимо сообщить единице массы жидкости, для превращения её в пар при неизменной температуре называется удельной теплотой парообразования.
Удельная теплота
парообразования зависит от температуры
жидкости, уменьшаясь с её повышением.
При конденсации количество теплоты, затраченное на испарение жидкости, выделяется.
Конденсация – процесс превращения из газообразного состояния в жидкое.
Рассмотрим условия фазового перехода газ – жидкость.
У идеального газа средняя потенциальная энергия взаимодействия частиц много меньше средней кинетической энергии.
│Ep│<< kT
(Модуль использован потому, что для сил притяжения потенциальная энергия отрицательна)
Для образования жидкости из газа средняя потенциальная энергия притяжения молекул должна превышать их среднюю кинетическую энергию
│Ep│≥ kT
Физический смысл этого неравенства в том, что переход из газообразного в жидкое состояние возможен лишь при температуре, меньше некоторой критической температуры:
T < Tкр =
Критическая температура – максимальная температура, при которой пар превращается в жидкость.
Пар
– газообразное состояние вещества при
температуре ниже критической.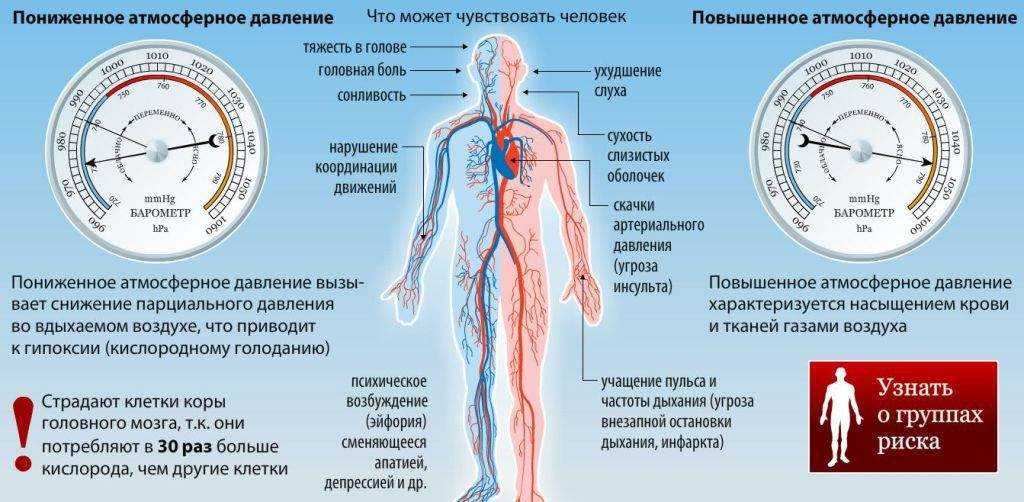
Газ при T>Tкр нельзя перевести в жидкое состояние.
Критическая температура зависит от потенциальной энергии взаимодействия молекул и потому различна для разных газов
С ростом внешнего давления при сжатии газа уменьшается среднее расстояние между частицами, возрастает сила притяжения между ними и соответственно средняя потенциальная энергия взаимодействия.
Рассмотрим сжижение пара при изотермическом сжатии при T<Tкр
Конденсация – переход пара из газообразного состояния в жидкое
Масса жидкости при конденсации при данном объеме постоянна благодаря равновесию двух встречных процессов: конденсации пара и испарению молекул жидкости.
Испарение – парообразование со свободной поверхности жидкости
Интенсивность
процесса испарения увеличивается с
возрастанием температуры жидкости.
Поэтому динамическое равновесие между
испарением и конденсацией при повышении
температуры устанавливается при больших
концентрациях молекул газа.
Насыщенный пар – пар, находящийся в термодинамическом равновесии со своей жидкостью.
Термодинамическое равновесие – число молекул пара, конденсирующихся за определенный промежуток времени, равно числу молекул жидкости, испаряющихся за это же время.
Концентрация частиц n постоянна, так как при уменьшении объема V в равной степени уменьшается полное количество частиц N из-за конденсации молекул пара.
Поэтому давление насыщенного пара p = nkT , когда в цилиндре сосуществуют пар и жидкость, остается постоянным (при изотермическом сжатии T = const)
После полной конденсации пара возможно незначительное сжатие жидкости. При этом давление резко возрастает из-за малой сжимаемости жидкости.
Изотерма при температуре выше критической T>Tкр совпадает с изотермой идеального газа.
Давление
идеального газа при постоянной
концентрации молекул возрастает прямо
пропорционально абсолютной температуре.
Так как в насыщенном паре при возрастании температуры концентрация молекул увеличивается, давление насыщенного пара с повышением температуры возрастает быстрее, чем давление идеального газа с постоянной концентрацией молекул.
То есть давление насыщенного пара растет не только вследствие повышения температуры жидкости, но и вследствие увеличения концентрации молекул пара.
Главное различие в поведении идеального газа и насыщенного пара состоит в том, что при изменении температуры пара в закрытом сосуде (или при изменении объема при постоянной температуре) меняется масса пара.
Энергетические процессы испарения и конденсации
Молекула испаряется с поверхности жидкости, если ее кинетическая энергия больше потенциальной энергии притяжения к другим молекулам:
Ek>│Ep│Испарение
– процесс, при котором с поверхности
жидкости или твердого тела вылетают
молекулы, кинетическая энергия которых
превышает потенциальную энергию
взаимодействия молекул.
Испарение жидкости может происходить при любой температуре.
Испарение сопровождается охлаждением жидкости, так как жидкость покидают молекулы, имеющие большую кинетическую энергию, и внутренняя энергия жидкости понижается.
Внутренняя энергия испаряющейся жидкости уменьшается. Если нет притока энергии к жидкости извне, то испаряющаяся жидкость охлаждается.
Вылетевшие молекулы начинают беспорядочно двигаться в тепловом движении газа; они могут или навсегда удалиться от поверхности жидкости, или снова вернуться в жидкость. Такой процесс называется конденсацией.
При
увеличении температуры число испаряющихся
молекул возрастает (Е
Так как жидкость покидают самые быстрые молекулы, то средняя кинетическая энергия молекул жидкости, а следовательно и ее температура уменьшается.
Количество теплоты, необходимое для испарения жидкости при постоянной температуре, пропорционально числу испаряющихся молекул или их суммарной массе:
Qn = rm
r – удельная теплота испарения (парообразования)
Удельная
теплота испарения (парообразования) r – количество теплоты, необходимое для
испарения (парообразования) 1 кг жидкости
при постоянной температуре.
Единица измерения – Дж/кг
При парообразовании подводимое количество теплоты расходуется на разрыв межмолекулярных связей.
Количество теплоты, получаемое жидкостью при конденсации, равно количеству теплоты, теряемому при испарении.(при термодинамическом равновесии)
Вещество в газообразном состоянии, находящееся в динамическом равновесии с жидкостью, называется насыщенным паром.
Пар, находящийся при давлении ниже давления насыщенного пара называется ненасыщенным.
При сжатии насыщенного пара концентрация молекул пара увеличивается, равновесие между процессами испарения и конденсации нарушается и часть пара превращается в жидкость.
При расширении насыщенного пара концентрация его молекул уменьшается и часть жидкости превращается в пар. Таким образом, концентрация насыщенного пара остается постоянной независимо от объема.
Так
как давление газа пропорционально
концентрации и температуре (p = knT),
давление насыщенного пара при постоянной
температуре не зависит от объема.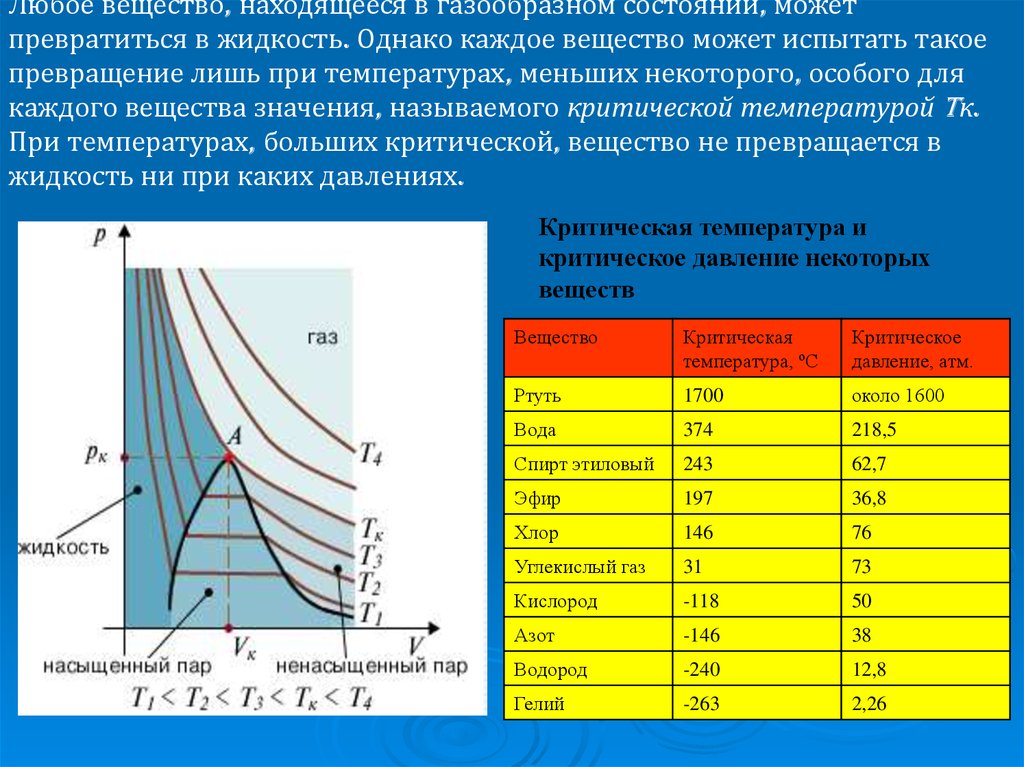
Явление превращения пара в жидкость называется конденсацией.
(лат. конденсаре – сгущать)
Конденсация сопровождается выделением энергии.
Конденсация объясняет, например, образование облаков в верхних, более холодных, слоях воздуха.
Насыщенный и ненасыщенный пар — определение, свойства, формулы
Фазовые переходы: изменение агрегатных состояний вещества
Прежде чем говорить о насыщенном паре, нужно освежить знания об агрегатных состояниях и фазовых переходах между ними. Если вы забыли, какие бывают агрегатные состояния, то можете сбегать в нашу статью про них.
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества.
Вот какие бывают фазовые переходы:
Переход из твердого состояния в жидкое — плавление;
Переход из жидкого состояния в твердое — кристаллизация;
Переход из газообразного состояния в жидкое — конденсация;
Переход из жидкого состояния в газообразное — парообразование;
Переход из твердого состояния в газообразное, минуя жидкое — сублимация;
Переход из газообразного состояния в твердое, минуя жидкое — десублимация.

На схеме — названия всех фазовых переходов:
Фазовые переходы — важная штука. Все живое не Земле существует лишь благодаря тому, что вода умеет превращаться в лед или пар. С кристаллизацией, плавлением, парообразованием и конденсацией связаны многие процессы в металлургии и микроэлектронике.Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Парообразование
Итак, парообразование — это переход из жидкого состояния в газообразное.
При парообразовании всегда происходит поглощение энергии: к веществу необходимо подводить теплоту, чтобы оно испарялось. Из-за этого внутренняя энергия вещества увеличивается.
У процесса парообразования есть две разновидности: испарение и кипение.
Испарение — это превращение или переход жидкости в газ (пар) со свободной поверхности жидкости.
 Если поверхность жидкости открыта и с нее начинается переход вещества из жидкого состояния в газообразное, это будет называться испарением.
Если поверхность жидкости открыта и с нее начинается переход вещества из жидкого состояния в газообразное, это будет называться испарением.Кипение — процесс интенсивного парообразования, который происходит в жидкости при определенной температуре.
Например, мы заварили себе горячий чай. Над чашкой мы увидим пар, так как вода только что поучаствовала в процессе кипения.
Подождите-ка, мы ведь только что сказали, что кипение и испарение — разные вещи. 🤔 Это действительно так, но при этом оба процесса могут происходить параллельно.
Испарение может происходить и без кипения, просто тогда оно не будет для нас заметно. Например, вода в озере испаряется, хотя мы этого и не замечаем. Кипение по сути своей — это интенсивное испарение, которое вызвали внешними условиями — доведя вещество до температуры кипения.
Физика объясняет испарение тем, что жидкость обычно несколько холоднее окружающего воздуха, и из-за разницы температур происходит испарение.
Если нет каких-то внешних воздействий, испарение жидкостей происходит крайне медленно. Молекулы покидают жидкость из-за явления диффузии.
Направление тепловых потоков при испарении может идти в разной последовательности и комбинациях:
|
Подытожим, чтобы не запутаться, в чем главная разница между испарением и кипением:
Испарение | Кипение |
|---|---|
Температура кипения
При температуре кипения давление насыщенного пара становится равным внешнему давлению на жидкость — чаще всего это атмосферное давление.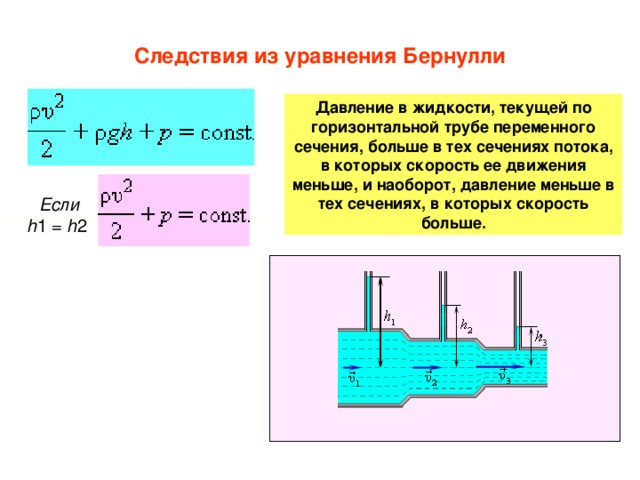 Значит, чем больше внешнее давление, тем при более высокой температуре начнется кипение.
Значит, чем больше внешнее давление, тем при более высокой температуре начнется кипение.
При нормальном атмосферном давлении, которое приблизительно равно 100 кПа, температура кипения воды равна 100°C. Поэтому можно сразу сказать, что давление насыщенного водяного пара при температуре 100 градусов по Цельсию равно 100 кПа. Это значение пригодится при решении задач.
Чем выше мы поднимаемся, тем меньше становится атмосферное давление, потому что масса атмосферы над нами уменьшается. Так, например, на вершине Эльбруса атмосферное давление составляет 5 × 104 Па — в два раза меньше, чем нормальное атмосферное давление. Поэтому и температура кипения на вершине Эльбруса будет ниже, чем на уровне моря. Вода там закипит при температуре 82°C.
Температура кипения при нормальном атмосферном давлении — это строго определенная величина для каждой жидкости.
t, °C | Вещество |
|---|---|
-253 -183 35 78 100 357 3050 4200 5657 | водород кислород эфир спирт вода ртуть железо графит вольфрам |
Испарение и конденсация
Молекулы в жидкости непрерывно и хаотично движутся. Это значит, что направление движения отдельно взятых молекул — это случайные направления. При этом жидкость сохраняет свой объем. Также молекулы силами притяжения притягиваются друг к другу, из-за чего не могут покинуть Омск жидкость.
Это значит, что направление движения отдельно взятых молекул — это случайные направления. При этом жидкость сохраняет свой объем. Также молекулы силами притяжения притягиваются друг к другу, из-за чего не могут покинуть Омск жидкость.
Значения скоростей молекул случайны. Из-за этого среди всех молекул обязательно есть те, что движутся очень быстро. Если такая молекула окажется вблизи поверхности раздела жидкости и окружающей среды, то ее кинетическая энергия может достигнуть большого значения, и молекула покинет жидкость.
Собственно, именно так происходит процесс испарения (мы говорили о нем выше, когда речь шла о фазовых переходах). Когда испарившихся молекул становится много, образуется пар.
Обратный процесс тоже возможен: вырвавшиеся за пределы жидкости молекулы вернутся в жидкость. Это конденсация, о ней мы тоже говорили.
Если открыть сосуд с жидкостью, то испарившиеся молекулы будут покидать пространство над жидкостью и не возвращаться обратно. Количество жидкости таким образом будет уменьшаться. То есть жидкость испаряется, а пар обратно не конденсируется (потому что молекулы этого пара удаляются от жидкости) — так происходит высыхание.
Количество жидкости таким образом будет уменьшаться. То есть жидкость испаряется, а пар обратно не конденсируется (потому что молекулы этого пара удаляются от жидкости) — так происходит высыхание.
Испарение может происходить с разной скоростью. Чем больше силы притяжения молекул друг к другу, тем меньшее число молекул в единицу времени окажется в состоянии преодолеть эти силы притяжения и вылететь наружу, и тем меньше скорость испарения.
Быстро испаряются такие жидкости, как эфир, ацетон, спирт. Из-за этого свойства их иногда называют летучими жидкостями. Медленнее — вода. Намного медленнее воды испаряются масло и ртуть.
Курсы подготовки к ОГЭ по физике помогут снять стресс перед экзаменом и получить высокий балл.
Определение насыщенного пара
Оставим стакан воды на столе и будем замерять уровень воды в нем каждый день. Если записать эти измерения и сравнить их, станет очевидно: уровень воды стал меньше, то есть вода испарилась.
Теперь давайте накроем стакан сверху. Молекулы пара уже не смогут покидать пространство над жидкостью, по мере испарения их количество начнет расти, а значит, будет расти и количество молекул, которые конденсируются в единицу времени.
Сначала количество конденсирующихся молекул за единицу времени будет меньше количества испаряющихся молекул. Но по мере роста концентрации пара (то есть увеличении количества молекул в единице объема пара) поток конденсирующихся молекул вырастет. Это приведет к состоянию, которое называется динамическим равновесием.
Пар, находящейся в динамическом равновесии, называют насыщенным.
Представьте себе огромный бизнес-центр с не менее огромными дверями. У сотрудников бизнес-центра разный график работы, поэтому люди одновременно заходят в здание и выходят из него в произвольном количестве. Допустим, в 6 часов вечера 100 человек заходят в здание, чтобы попасть на деловую встречу, а другие 100 человек уже закончили работать и идут домой. Количество заходящих в бизнес-центр и выходящих из него будет одинаковым — это и есть состояние насыщения.
Количество заходящих в бизнес-центр и выходящих из него будет одинаковым — это и есть состояние насыщения.
Значение давления насыщенного пара и его плотности являются максимальными при заданном значении температуры. Если это не так, то пар ненасыщенный. |
Свойства насыщенного пара
При постоянной температуре плотность насыщенного пара не зависит от его объема.
Представьте, что объем сосуда с насыщенным паром уменьшили, не изменив температуры.
Количество молекул, переходящих от пара к жидкости, превысит количество испаряющихся молекул, но при этом часть пара сконденсируется, а оставшийся пар снова придет в динамическое равновесие. В итоге плотность этого пара будет равна начальной плотности.
Давление насыщенного пара не зависит от его объема.

Это связано с тем, что давление и плотность связаны через уравнение Менделеева-Клапейрона, и следует из первого свойства насыщенного пара.
Кстати, уравнение Менделеева-Клапейрона справедливо для насыщенного пара. При этом нужно быть внимательным с частными случаями. Так, например, закон Бойля-Мариотта для насыщенного пара не выполняется.
Уравнение Менделеева-Клапейрона
pV = νRT
p — давление газа [Па]
V — объем [м3]
ν — количество вещества [моль]
T — температура [К]
R — универсальная газовая постоянная
R = 8,31 м2 × кг × с-2 × К-1 × моль-1
При неизменном объеме плотность насыщенного пара растет с повышением температуры и уменьшается с понижением температуры.

В начальный момент испарения динамическое равновесие будет нарушено (некоторая часть жидкости испарится дополнительно). Плотность пара будет расти, пока динамическое равновесие не восстановится.
Давление и температура насыщенного пара растут быстрее, чем по линейному закону, который справедлив для идеального газа.
В случае идеального газа рост давления обусловлен только ростом температуры, а в случае с насыщенном паром имеют значение два фактора: температура и масса пара.
В случае нагревания насыщенного пара молекулы начинают ударяться чаще, так как их в целом стало больше, потому что пара стало больше.
Главное отличие насыщенного пара от идеального газа: пар сам по себе не является замкнутой системой, а находится в постоянном контакте с жидкостью.
Решение задач по теме «Насыщенный пар»
Применим свойства насыщенного пара при решении задач.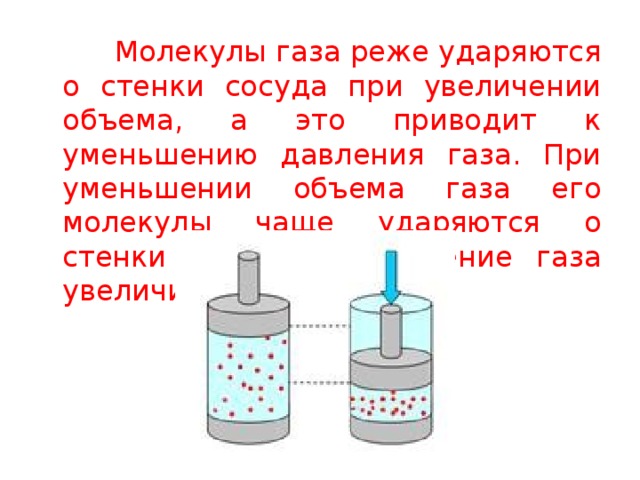
Задачка раз
В цилиндрическом сосуде под поршнем длительное время находятся вода и ее пар. Поршень начинают вдвигать в сосуд. При этом температура воды и пара остается неизменной. Как будет меняться при этом масса жидкости в сосуде? Ответ поясните.
Решение
Так как пар и вода находятся в контакте длительное время, пар является насыщенным. При уменьшении объема сосуда давление насыщенного пара не меняется. Из уравнения Менделеева-Клапейрона следует, что для того, чтобы давление пара не менялось, его количество вещества (а значит и масса) должно уменьшаться.
pV = νRT
В этом процессе происходит конденсация, часть молекул пара переходят в жидкость, поэтому масса жидкости увеличивается.
Ответ
Масса жидкости увеличивается.

Задачка два
Какова плотность насыщенного пара при температуре 100°С?
Решение
При нормальном давлении (p = 105 Па) 100°С — это температура кипения воды. Значит, давление насыщенного пара при этой температуре равно атмосферному давлению.
Найдем связь между давлением и плотностью через уравнение Менделеева-Клапейрона.
Подставим значение давления в уравнение состояния идеального газа, предварительно переведя температуру в Кельвины: T = 100 + 273 = 373 K
Почему давление и температура увеличиваются при сжатии газа?
Энергия, добавляемая в виде работы при сжатии газа, приводит к повышению давления и температуры. Узнайте больше об этом в этой статье.
В то время как повышение температуры из-за подвода тепла прямо правдоподобно из повседневного опыта, повышение температуры из-за механического подвода энергии в виде работы (сжатия) понять труднее. Однако для газов, в частности, этому есть очень ясное объяснение. Для этого мы сначала рассмотрим аналогию теннисного мяча, ударяемого ракеткой. Когда ракетка ударяет по мячу, кинетическая энергия, очевидно, добавляется к мячу. Теннисный мяч теперь летит обратно с большей скоростью.
Однако для газов, в частности, этому есть очень ясное объяснение. Для этого мы сначала рассмотрим аналогию теннисного мяча, ударяемого ракеткой. Когда ракетка ударяет по мячу, кинетическая энергия, очевидно, добавляется к мячу. Теннисный мяч теперь летит обратно с большей скоростью.
Аналогичным образом можно рассмотреть сжатие газа. Поршень представляет собой ракетку, а молекулы газа — теннисные мячи. Поршень, приближающийся к молекулам во время сжатия, увеличивает импульс молекул и, следовательно, кинетическую энергию. Молекулы становятся быстрее, и, следовательно, температура повышается! Связь между средней кинетической энергией частиц и результирующим давлением объясняется более подробно в статье «Давление и температура».
Анимация: Увеличение кинетической энергии молекул газа за счет сжатия поршнемРисунок: Увеличение кинетической энергии молекул за счет сжатия Скорость, с которой поршень сжимает объем газа, относительно не имеет значения для процесса повышения температуры.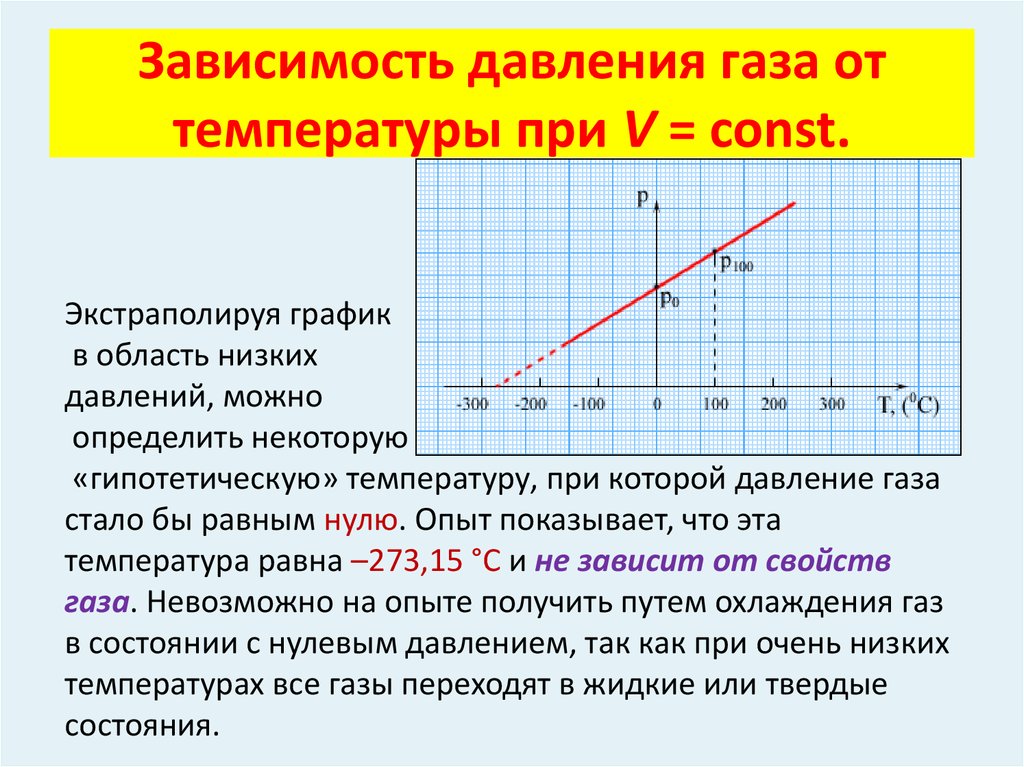 Если поршень движется медленно, отдельные столкновения могут быть не такими сильными, но они происходят чаще, потому что через определенное время молекулы снова сталкиваются с движущимся поршнем. С другой стороны, если поршень движется быстро, столкновений с поверхностью поршня меньше, но они более мощные.
Если поршень движется медленно, отдельные столкновения могут быть не такими сильными, но они происходят чаще, потому что через определенное время молекулы снова сталкиваются с движущимся поршнем. С другой стороны, если поршень движется быстро, столкновений с поверхностью поршня меньше, но они более мощные.
На практике скорость сжатия газа имеет значение, поскольку повышение температуры при относительно низкой степени сжатия может быть компенсировано тепловым потоком через стенки цилиндра. Таким образом, конечная температура после сжатия не будет такой высокой из-за выделения энергии в виде тепла. Если, с другой стороны, сжатие происходит очень быстро, вряд ли какое-либо тепло может выделяться в окружающую среду через стенки цилиндра за короткое время (адиабатическая система). Конечная температура после сжатия будет выше.
Можно продемонстрировать повышение температуры во время (адиабатического) сжатия с помощью следующего эксперимента. Цилиндр закрыт поршнем. Внутрь цилиндра помещается кусок ваты. Если поршень резко толкнуть вниз, работа, добавляемая при сжатии, вызывает такое повышение температуры, что вата воспламеняется. Дизельные двигатели работают по этому принципу так называемого самовоспламенения . Вместо ваты воспламеняется бензино-воздушная смесь.
Если поршень резко толкнуть вниз, работа, добавляемая при сжатии, вызывает такое повышение температуры, что вата воспламеняется. Дизельные двигатели работают по этому принципу так называемого самовоспламенения . Вместо ваты воспламеняется бензино-воздушная смесь.
термодинамика — Вода в резервуаре находится под давлением 50-100 PSI? но воду нельзя сжать
Задай вопрос
спросил
Изменено 5 лет, 9 месяцев назад
Просмотрено 5к раз
$\begingroup$
Искал про принцип работы бытового водонагревателя (ГВС) и не мог понять следующее:
учитывая тот факт, что воду (и все другие жидкости) нельзя сжимать (практически), как они могут утверждать, что бак представляет собой «бак из тяжелого металла, вмещающий от 40 до 60 галлонов (от 151 до 227 литров) горячей воды при температуре примерно от 50 до 100 фунтов на квадратный дюйм (PSI) , в пределах диапазона давления типичной бытовой системы водоснабжения».
Имеют в виду, что вода выбрасывается из трубы под давлением 50-100 PSI? Как можно повысить давление воды (или любой другой жидкости)? Если я помещу мембрану в герметичный резервуар, который отделяет воду от воздуха, а затем сожму воздух, скажем, до 50 фунтов на квадратный дюйм, то можно сказать, что вода находится под давлением до 50 фунтов на квадратный дюйм? (и это означает, что если я открою клапан со стороны воды в резервуаре, они вылетят при давлении 50 фунтов на квадратный дюйм? не могли бы вы напомнить мне, как найти их скорость? это исходит из Бернулли?)
- термодинамика
- давление
- вода
$\endgroup$
2
$\begingroup$
Давление и сжатие это разные вещи. Давление — это давление (сила на единицу площади), а сжатие — это изменение объема .
Вы можете приложить одинаковое давление к воздушному шару и кирпичу, и воздушный шар сожмет гораздо больше, чем кирпич. Давление «внутри» воздушного шара и кирпича в конечном итоге будет равно давлению, которое вы прикладываете снаружи. Давления должны уравновешиваться по второму закону Ньютона, иначе сжатие не прекратилось бы.
Имеют в виду, что вода выбрасывается из трубы под давлением 50-100 фунтов на квадратный дюйм?
Да.
Как можно повысить давление воды (или любой другой жидкости)?
Пытаясь накачать больше воды внутрь, из-за чего стенки резервуара чуть-чуть сгибаются, заставляя их сильнее вдавливаться внутрь. Это более сильное нажатие на стенки увеличивает давление. Точно так же, как надувать воздух в воздушный шар, пока он не расширится; «стенка» воздушного шара изгибается и расширяется, но она отжимается и пытается вытолкнуть воздух, если может.
Если я помещу мембрану в герметичный резервуар, который отделяет воду от воздуха, а затем сожму воздух, скажем, до 50 фунтов на квадратный дюйм, то можно сказать, что вода находится под давлением до 50 фунтов на квадратный дюйм?
Да. Опять же, ответ — второй закон Ньютона: если ничего не движется, все силы должны уравновешиваться. Вода должна давить на мембрану так же сильно, как и воздух, поскольку мембрана не двигается.
Опять же, ответ — второй закон Ньютона: если ничего не движется, все силы должны уравновешиваться. Вода должна давить на мембрану так же сильно, как и воздух, поскольку мембрана не двигается.
не могли бы вы напомнить мне, как найти их скорость? это от Бернулли?
Бернулли полезен, да. Многое легко найти в гугле (а то это к новому вопросу).
$\endgroup$
$\begingroup$
Они означают, что если бы вы измеряли давление на стенках резервуара (не открывая резервуар или что-то в этом роде), он показал бы 50-100 фунтов на квадратный дюйм.
Вы можете создать давление на жидкость, применяя к ней силу, когда она ограничена. Так как эта сила не может хорошо идти на сжатие, она просто выталкивает во всех направлениях, увеличивая давление.
Изучение гидростатики должно дать вам гораздо больше информации по этому вопросу.
$\endgroup$
$\begingroup$
Я думаю, что некоторые комментаторы слишком много читают в вопросе, ОП просто хочет понять, что написано о танке. Быстрый гугл показывает, что давление бытовой воды составляет около 80 фунтов на квадратный дюйм. Резервуар предназначен для хранения воды под давлением от 50 до 100 фунтов на квадратный дюйм плюс коэффициент безопасности (обычно 4, но водонагреватели опасны, поэтому он, вероятно, выше).
Быстрый гугл показывает, что давление бытовой воды составляет около 80 фунтов на квадратный дюйм. Резервуар предназначен для хранения воды под давлением от 50 до 100 фунтов на квадратный дюйм плюс коэффициент безопасности (обычно 4, но водонагреватели опасны, поэтому он, вероятно, выше).
Давление воды обеспечивается постоянным напором водонапорных башен или насосов. Когда вода не течет в насосе, предназначенном для одного дома, они устанавливают бак-дозатор, подобный упомянутой вами мембране. Насос сжимает воздух в баке-дозаторе и включается при обнаружении падения давления.
Ваш последний вопрос «(и это означает, что если я открою клапан на водной стороне резервуара, они будут стрелять при 50 фунтов на квадратный дюйм? Можете ли вы напомнить мне, как найти их скорость? Это исходит от Бернулли?)» сбивает с толку. Давление считывается с помощью манометра, и существует множество конструкций, скорость может быть получена из диаметра трубы, расхода и давления, но я не могу вспомнить (без Google), приписывают ли Бернулли это уравнение.
