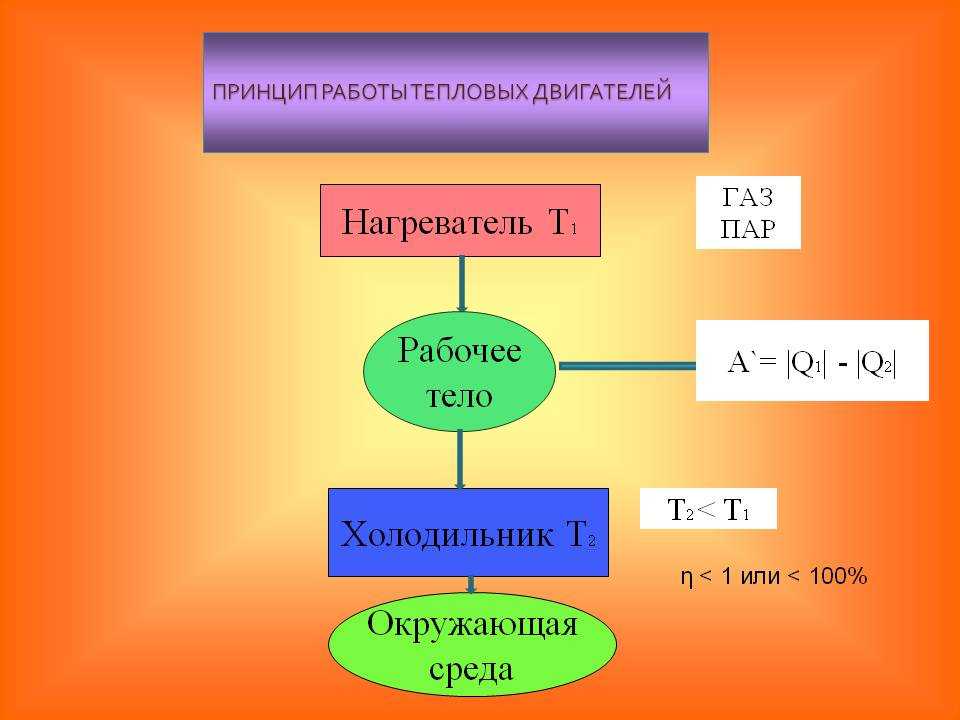
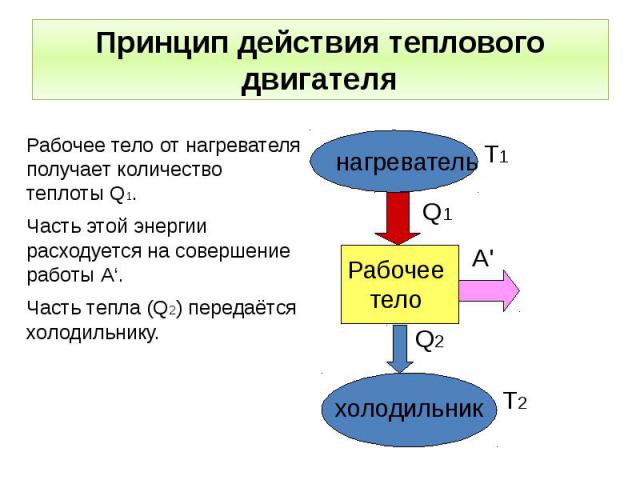
1.1 Рабочее тело
Рабочим телом в термодинамике называют некоторое промежуточное тело, при помощи которого осуществляется трансформация тепловой энергии в механическую в тепловых двигателях.
Рассмотрим в общих чертах процесс преобразования тепловой энергии в механическую в основных типах тепловых двигателей – паротурбинных установках (ПТУ) и двигателях внутреннего сгорания (ДВС).
В
любой паротурбинной установке теплота
от продуктов сгорания передается кипящей
воде, которая превращается в пар,
перегревается в пароперегревателе и
поступает на рабочую часть турбины.
Температура и давление пара перед
турбиной гораздо выше, чем эти параметры
окружающей среды, поэтому пар способен
совершить работу, которую он и совершает
в процессе адиабатного расширения на
проточной части турбины. При этом
давление и температура пара понижаются
и отработавший пар поступает в конденсатор,
где он конденсируется, отдавая свою
теплоту парообразования.
При работе ДВС рабочее тело получается в результате горения горючей смеси, подаваемой в пространство цилиндра между его крышкой и поршнем. Т.к. температура и давление рабочего тела больше температуры и давления окружающей среды, оно способно совершить работу, поэтому рабочее тело расширяется, передвигая поршень. Эта часть энергии непосредственно испольуется для работы и обратного движения поршня, которое происходит за счет части энергии, переданной через кривошипно-шатунный механизм маховику.
В
обоих примерах рабочим телом служил
газ или пар. В качестве рабочего тела
можно использовать твердое, жидкое, или
газообразное вещество, но наиболее
эффективно тепло переходит в работу в
телах, резко меняющих свой объем при
изменении температуры.
Аналитическое исследование законов трансформации теплоты в работу с учетом реальных свойств рабочего тела (упругой жидкости) весьма затруднительно, так как при этом нужно учитывать силы взаимодействия между молекулами, их собственный объем и наличие их ассоциированных комплексов. Для упрощения исследования вводится понятие идеального рабочего тела – идеального газа.
Идеальным газом называется упругая жидкость, у которой отсутствуют силы сцепления между молекулами, а сами молекулы представляют собой материальные точки (лишенные объема), обладающие свойствами абсолютно упругих шаров.
Оказывается, что все технические газы (и воздух в том числе) по своим свойствам достаточно близки к идеальному газу, так как они сильно перегреты – расстояние между молекулами огромно и силы взаимодействия между ними ничтожны.
Менее перегретые упругие жидкости уже не обладают свойствами идеального газа и поэтому называются газами реальными.
Термодинамической
системой называется совокупность материальных
тел, находящихся в энергетическом
взаимодействии между собой и окружающей
средой, например: газ в цилиндре с
поршнем.
Если термодинамическая система не обменивается энергией с окружающей средой и не взаимодействует с ней, ее называют изолированной системой.
Система, состоящая из одной фазы вещества, называется гомогенной.
Система, состоящая из нескольких гомогенных частей, имеющих поверхности раздела, называется гетерогенной.
В термодинамическую систему входят отдельные тела, которые по своей роли делятся на источники теплоты (горячие источники ГИ), приемники теплоты (холодные источники ХИ) и рабочие тела. Такая термодинамическая система является объектом изучения технической термодинамики.
Рабочее тело и основные параметры, определяющие его состояние
Категория:
Передвижные электростанции
Публикация:
Рабочее тело и основные параметры, определяющие его состояние
Читать далее:
Уравнение состояния идеального газа
Рабочее тело и основные параметры, определяющие его состояние
Для преобразования тепла в механическую энергию необходим носитель энергии, называемый рабочим телом. В тепловых двигателях в качестве рабочих тел служат газы и пары. В частности, водяной пар как рабочее тело широко используется в паровых машинах и турбинах.
В тепловых двигателях в качестве рабочих тел служат газы и пары. В частности, водяной пар как рабочее тело широко используется в паровых машинах и турбинах.
Различные тела находятся в естественных условиях только в одном агрегатном состоянии, так, воздух — в виде газа, спирт — в виде жидкости и железо — в виде твердого тела. Однако при определенных условиях их можно превратить в любое из указанных состояний (твердое, жидкое или газообразное).
В твердом теле молекулы значительно уплотнены, расстояния между ними малы и они так связаны силами взаимного притяжения, что каждая молекула может только колебаться в определенных пределах.
Рекламные предложения на основе ваших интересов:
Дополнительные материалы по теме:
В жидкости расстояния между молекуламиТораздо больше, чем в твердом теле, а силы сцепления значительно меньше, вследствие чего молекулы могут свободно перемещаться. Поэтому жидкость не имеет определенной формы и почти не оказывает сопротивления изменению формы, она имеет только определенный объем.
В газообразном теле молекулы находятся на еще большем расстоянии друг от друга, поэтому силы сцепления их будут незначительны. С повышением давления или понижением температуры силы сцепления между молекулами газа увеличиваются.
В отличие от жидкости газообразное тело не имеет определенного объема и всегда стремится занять как можно большее пространство.
Для упрощения теоретических исследований процессов, происходящих в реальных газах, вводят условное понятие об идеальном газе и определяют параметры (свойства) сначала идеальных газов, а затем, в-ведя соответствующие поправки и коэффициенты, изучают реальные газы.
Идеальным газом (в природе такого газа нет) называют газ, в котором молекулы не имеют объема и между ними отсутствуют силы сцепления.
Реальным газом называют всякий имеющийся в действительности газ, молекулы которого занимают определенный объем и между ними действуют силы сцепления.
При низких давлениях и высоких температурах реальные газы по своим свойствам приближаются к идеальным.
Состояние рабочего тела определяется величинами, которые называются термодинамическими параметрами тела.
Основными термодинамическими параметрами тела являются удельный объем v, температура Т и давление р.
Различают абсолютное Рабе, атмосферное (барометрическое) Рагм и избыточное давления. Давление выше атмосферного из«меряется манометром, а ниже атмосферного (разрежение) — вакуумметром. Манометр показывает разность между абсолютным и атмосферным давлениями, т.е. избыточное давление.
Вакуумметр показывает разность между атмосферным давление и давлением Рабе разреженного газа. Высота h’ подъема жидкости в левой части трубки (рис. 1, б) вакуумметра показывает, на какую величину давление в баллоне меньше атмосферного.
Рис. 1. Схемы устройства жидкостных приборов для измерения давления: а — манометра, б — вакуумметра
На свойстве тел изменять объем при нагревании основано действие жидкостных термометров (до 300°С). Высокие температуры (1000-2000 °С) измеряют термоэлектрическими приборами, которые при помощи гальванометров определяют электродвижущую силу двух разнородных металлов (термопары), образующуюся при нагревании тел.
15.1: Первый закон термодинамики
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1594
- OpenStax
- OpenStax
Цели обучения
К концу этого раздела вы сможете:
- Дать определение первому закону термодинамики.
- Опишите, как сохранение энергии связано с первым законом термодинамики.
- Определить случаи применения первого закона термодинамики в повседневных ситуациях, включая биологический метаболизм.
- Рассчитать изменения внутренней энергии системы после учета теплопередачи и выполненной работы.

Если нас интересует, как теплопередача преобразуется в работу, то важен принцип сохранения энергии. первый закон термодинамики применяет принцип сохранения энергии к системам, в которых передача тепла и выполнение работы являются методами передачи энергии в систему и из нее.
Рисунок \(\PageIndex{1}\): Этот кипящий чайник представляет энергию в движении. Вода в чайнике превращается в водяной пар, потому что тепло передается от плиты к чайнику. По мере того, как вся система нагревается, совершается работа — от испарения воды до свиста чайника. (кредит: Джина Гамильтон) Первый закон термодинамики гласит, что изменение внутренней энергии системы равно чистому переносу тепла в систему за вычетом чистой работы, выполненной системой. В форме уравнения первый закон термодинамики равен.\[\Delta U = Q — W. \label{first}\]
Здесь \(\Delta U\) есть изменение внутренней энергии \(U\) системы.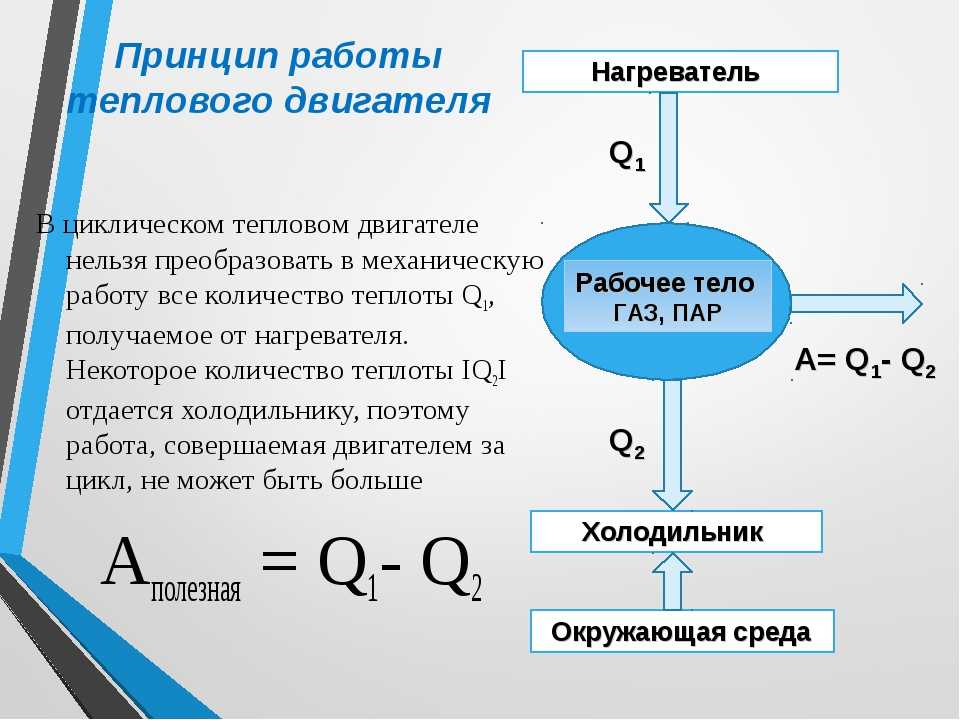 \(Q\) — чистого тепла, переданного в систему — то есть \(Q\) представляет собой сумму всего теплопереноса в систему и из нее. \(W\) — это чистая работа, проделанная системой , то есть \(W\) — это сумма всей работы, проделанной системой или над ней. Мы используем следующие соглашения о знаках: если \(Q\) положительна, то в систему имеет место чистый теплообмен; если \(W\) положительно, то система совершает чистую работу. Таким образом, положительный \(Q\) добавляет энергию системе, а положительный \(W\) забирает энергию у системы. Таким образом, \(\Delta U = Q — W\). Обратите также внимание, что если в систему передается больше тепла, чем совершается работа, разница сохраняется в виде внутренней энергии. Хорошим примером этого являются тепловые двигатели — в них происходит передача тепла, чтобы они могли совершать работу (рис. \(\PageIndex{2}\)). Теперь мы рассмотрим \(Q, \, W\) и \(\Delta U\) дальше.
\(Q\) — чистого тепла, переданного в систему — то есть \(Q\) представляет собой сумму всего теплопереноса в систему и из нее. \(W\) — это чистая работа, проделанная системой , то есть \(W\) — это сумма всей работы, проделанной системой или над ней. Мы используем следующие соглашения о знаках: если \(Q\) положительна, то в систему имеет место чистый теплообмен; если \(W\) положительно, то система совершает чистую работу. Таким образом, положительный \(Q\) добавляет энергию системе, а положительный \(W\) забирает энергию у системы. Таким образом, \(\Delta U = Q — W\). Обратите также внимание, что если в систему передается больше тепла, чем совершается работа, разница сохраняется в виде внутренней энергии. Хорошим примером этого являются тепловые двигатели — в них происходит передача тепла, чтобы они могли совершать работу (рис. \(\PageIndex{2}\)). Теперь мы рассмотрим \(Q, \, W\) и \(\Delta U\) дальше.
 \(Q\) представляет собой чистую теплопередачу — это сумма всех теплопередач в систему и из нее. \(Q\) положителен для чистой передачи тепла в систему. \(W\) — это полная работа, выполненная системой. \(W\) положительна, когда система совершает больше работы, чем над ней. Изменение внутренней энергии системы \(\Delta U\) связано с выделением тепла и работой согласно первому закону термодинамики (уравнение \ref{first}).
\(Q\) представляет собой чистую теплопередачу — это сумма всех теплопередач в систему и из нее. \(Q\) положителен для чистой передачи тепла в систему. \(W\) — это полная работа, выполненная системой. \(W\) положительна, когда система совершает больше работы, чем над ней. Изменение внутренней энергии системы \(\Delta U\) связано с выделением тепла и работой согласно первому закону термодинамики (уравнение \ref{first}).ЗАКОН ТЕРМОДИНАМИКИ И ЗАКОН СОХРАНЕНИЯ ЭНЕРГИИ
Первый закон термодинамики на самом деле является законом сохранения энергии, сформулированным в форме, наиболее полезной в термодинамике. Первый закон устанавливает связь между теплопередачей, выполненной работой и изменением внутренней энергии системы.
Теплота
Q и Работа Вт Теплопередача \(Q\) и выполнение работы \(Вт\) — это два повседневных способа подачи энергии в систему или получения энергии из нее. Процессы совсем другие. Теплопередача, менее организованный процесс, обусловлена разницей температур. Работа, вполне организованный процесс, включает в себя действие макроскопической силы на расстоянии. Тем не менее, теплота и работа могут давать одинаковые результаты. Например, и то, и другое может вызвать повышение температуры. Передача тепла в систему, например, когда солнце нагревает воздух в велосипедной шине, может повысить его температуру, и, таким образом, над системой может совершаться работа, например, когда велосипедист накачивает воздух в шину. После того, как произошло повышение температуры, невозможно сказать, было ли оно вызвано теплопередачей или совершением работы. Эта неопределенность является важным моментом. Теплопередача и работа — это энергия в пути — ни одна из них не хранится как таковая в системе. Однако и то, и другое может изменить внутреннюю энергию \(U\) системы. Внутренняя энергия — это форма энергии, совершенно отличная от теплоты или работы.
Работа, вполне организованный процесс, включает в себя действие макроскопической силы на расстоянии. Тем не менее, теплота и работа могут давать одинаковые результаты. Например, и то, и другое может вызвать повышение температуры. Передача тепла в систему, например, когда солнце нагревает воздух в велосипедной шине, может повысить его температуру, и, таким образом, над системой может совершаться работа, например, когда велосипедист накачивает воздух в шину. После того, как произошло повышение температуры, невозможно сказать, было ли оно вызвано теплопередачей или совершением работы. Эта неопределенность является важным моментом. Теплопередача и работа — это энергия в пути — ни одна из них не хранится как таковая в системе. Однако и то, и другое может изменить внутреннюю энергию \(U\) системы. Внутренняя энергия — это форма энергии, совершенно отличная от теплоты или работы.
Внутренняя энергия
U Мы можем думать о внутренней энергии системы двумя разными, но непротиворечивыми способами. Первый — это атомно-молекулярный взгляд, который исследует систему в атомном и молекулярном масштабе. внутренняя энергия \(U\) системы есть сумма кинетической и потенциальной энергий ее атомов и молекул. Напомним, что кинетическая плюс потенциальная энергия называется механической энергией. Таким образом, внутренняя энергия представляет собой сумму атомной и молекулярной механической энергии. Поскольку невозможно уследить за всеми отдельными атомами и молекулами, мы должны иметь дело со средними значениями и распределениями. Второй способ представления внутренней энергии системы — ее макроскопические характеристики, которые очень похожи на средние атомные и молекулярные значения.
Первый — это атомно-молекулярный взгляд, который исследует систему в атомном и молекулярном масштабе. внутренняя энергия \(U\) системы есть сумма кинетической и потенциальной энергий ее атомов и молекул. Напомним, что кинетическая плюс потенциальная энергия называется механической энергией. Таким образом, внутренняя энергия представляет собой сумму атомной и молекулярной механической энергии. Поскольку невозможно уследить за всеми отдельными атомами и молекулами, мы должны иметь дело со средними значениями и распределениями. Второй способ представления внутренней энергии системы — ее макроскопические характеристики, которые очень похожи на средние атомные и молекулярные значения.
Макроскопически мы определяем изменение внутренней энергии \(\Delta U\) как соответствующее первому закону термодинамики (уравнение \ref{first}): \[\Delta U = Q — W \nonumber\]
Многие детальные эксперименты подтвердили, что \(\Delta U = Q — W\), где \(\Delta U\) — изменение полной кинетической и потенциальной энергии всех атомов и молекул в системе.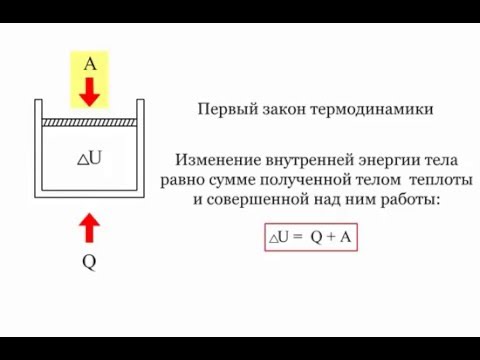 Экспериментально установлено также, что внутренняя энергия \(U\) системы зависит только от состояния системы и не как дошло до этого состояния . В частности, установлено, что \(U\) является функцией нескольких макроскопических величин (например, давления, объема и температуры), не зависящих от прошлой истории, например, от того, происходил ли теплообмен или совершалась работа. Эта независимость означает, что если мы знаем состояние системы, мы можем вычислить изменения ее внутренней энергии \(U\) по нескольким макроскопическим переменным.
Экспериментально установлено также, что внутренняя энергия \(U\) системы зависит только от состояния системы и не как дошло до этого состояния . В частности, установлено, что \(U\) является функцией нескольких макроскопических величин (например, давления, объема и температуры), не зависящих от прошлой истории, например, от того, происходил ли теплообмен или совершалась работа. Эта независимость означает, что если мы знаем состояние системы, мы можем вычислить изменения ее внутренней энергии \(U\) по нескольким макроскопическим переменным.
МАКРОСКОПИЧЕСКОЕ и МИКРОСКОПИЧЕСКОЕ
В термодинамике мы часто используем макроскопическую картину при расчетах поведения системы, в то время как атомарная и молекулярная картина дает основные объяснения в терминах средних значений и распределений. Мы еще увидим это в следующих разделах этой главы. Например, в теме энтропии расчеты будут производиться с использованием атомарно-молекулярного представления.
Чтобы получить лучшее представление о внутренней энергии системы, давайте рассмотрим систему, переходящую из состояния 1 в состояние 2. Система имеет внутреннюю энергию \(U_1\) в состоянии 1, и у нее есть внутренняя энергия энергия \(U_2\) в состоянии 2, независимо от того, как она попала в любое состояние. Таким образом, изменение внутренней энергии
Система имеет внутреннюю энергию \(U_1\) в состоянии 1, и у нее есть внутренняя энергия энергия \(U_2\) в состоянии 2, независимо от того, как она попала в любое состояние. Таким образом, изменение внутренней энергии
\[\Delta U = U_2 — U_1\]
не зависит от того, что вызвало это изменение. Другими словами, \(\delta U\) не зависит от пути . Под путем мы подразумеваем способ добраться из начальной точки в конечную. Почему важна эта независимость? И \(Q\), и \(W\) зависит от пути , но \(\Delta U\) не зависит (уравнение \ref{first}). Эта независимость от пути означает, что внутреннюю энергию \(U\) легче учитывать, чем теплопередачу или выполненную работу.
Пример \(\PageIndex{1}\): расчет изменения внутренней энергии — одно и то же изменение \(U\) вызывается двумя различными процессами система совершает работу 10,00 Дж. Затем из системы передается 25,00 Дж тепла, а над системой совершается работа 4,00 Дж. Каково чистое изменение внутренней энергии системы?
 (а) Всего в системе происходит теплопередача 15,00 Дж, а работа совершает всего 6,00 Дж. Изменение внутренней энергии равно \(\дельта U = Q — W = 9,00 \, Дж\). (b) Теплопередача удаляет из системы 150,00 Дж, а работа прибавляет 159 Дж.0,00 Дж в него, производя увеличение внутренней энергии на 9,00 Дж. Если система начинается в одном и том же состоянии в (а) и (б), она в конечном итоге окажется в одном и том же конечном состоянии в любом случае — ее конечное состояние связано с внутренней энергией, а не с тем, как эта энергия была приобретена.
(а) Всего в системе происходит теплопередача 15,00 Дж, а работа совершает всего 6,00 Дж. Изменение внутренней энергии равно \(\дельта U = Q — W = 9,00 \, Дж\). (b) Теплопередача удаляет из системы 150,00 Дж, а работа прибавляет 159 Дж.0,00 Дж в него, производя увеличение внутренней энергии на 9,00 Дж. Если система начинается в одном и том же состоянии в (а) и (б), она в конечном итоге окажется в одном и том же конечном состоянии в любом случае — ее конечное состояние связано с внутренней энергией, а не с тем, как эта энергия была приобретена.Стратегия
В части (a) мы должны сначала найти чистую теплопередачу и чистую работу, выполненную на основе данной информации. Затем первый закон термодинамики (уравнение \ref{first}).
можно использовать для определения изменения внутренней энергии. В части (b) даны чистая теплопередача и проделанная работа, поэтому уравнение можно использовать напрямую.
Решение для (a)
Чистая теплопередача – это теплопередача в систему за вычетом теплопередачи из системы, или
\[ \begin{align*} Q &= 40. 00 \, J — 25.00 \, J \\[5pt] &= 15.00 \, J \end{align*}\]
00 \, J — 25.00 \, J \\[5pt] &= 15.00 \, J \end{align*}\]
Аналогично, общая работа равна работе, выполненной системой, за вычетом работы, выполненной системой, или
\[ \begin{align*} W &= 10.00 \, J — 4.00 \, J \\[5pt] &= 6.00 \, J. \end{align*}\]
Обсуждение (а)
Независимо от того, смотрите ли вы на общий процесс или разбиваете его на этапы, изменение внутренней энергии одинаково.
Решение для (b)
Здесь чистая теплопередача и полная работа непосредственно равны \(Q = -150,00 \, Дж\) и \(W = -159,00 \, Дж\), так что
\[ \begin{align*} \Delta U &= Q — W = -150.00 — (-159.00) \\[5pt] &= 9.00 \, J. \end{align*}\]
Обсуждение на (b)
Совершенно другой процесс в части (b) дает те же 9Изменение внутренней энергии на 0,00 Дж, как в части (а). Обратите внимание, что изменение в системе в обеих частях связано с \(\Дельта U\), а не с отдельными задействованными \(Q\) или \(W\). Система оказывается в том же состоянии как в (a), так и в (b). Части (а) и (б) представляют два разных пути, по которым система должна следовать между одними и теми же начальной и конечной точками, и изменение внутренней энергии для каждого одинаково — оно не зависит от пути.
Система оказывается в том же состоянии как в (a), так и в (b). Части (а) и (б) представляют два разных пути, по которым система должна следовать между одними и теми же начальной и конечной точками, и изменение внутренней энергии для каждого одинаково — оно не зависит от пути.
Метаболизм человека и первый закон термодинамики
Метаболизм человека – это преобразование пищи в теплопередачу, работу и накопление жира. Метаболизм — интересный пример действия первого закона термодинамики. Теперь мы еще раз взглянем на эти темы через первый закон термодинамики. Рассматривая тело как интересующую нас систему, мы можем использовать первый закон для изучения теплопередачи, выполнения работы и внутренней энергии в различных видах деятельности, от сна до тяжелых упражнений. Каковы некоторые из основных характеристик теплообмена, совершения работы и энергии в организме? Во-первых, температура тела обычно поддерживается постоянной за счет передачи тепла в окружающую среду. Это означает, что \(Q\) отрицательно. Другой факт заключается в том, что тело обычно воздействует на внешний мир. Это означает, что \(W\) положительно. В таких ситуациях тело теряет внутреннюю энергию, так как \(\Delta U = Q — W\) отрицательна.
Это означает, что \(Q\) отрицательно. Другой факт заключается в том, что тело обычно воздействует на внешний мир. Это означает, что \(W\) положительно. В таких ситуациях тело теряет внутреннюю энергию, так как \(\Delta U = Q — W\) отрицательна.
Теперь рассмотрим последствия еды. Прием пищи увеличивает внутреннюю энергию тела за счет добавления химической потенциальной энергии (это неромантичный взгляд на хороший стейк). Тело усваивает всю пищу, которую мы потребляем. По сути, обмен веществ представляет собой процесс окисления, при котором высвобождается химическая потенциальная энергия пищи. Это означает, что потребление пищи осуществляется в форме работы. Энергия пищи сообщается в специальной единице, известной как калория. Эта энергия измеряется путем сжигания пищи в калориметре, так определяются единицы измерения.
В химии и биохимии одна калория (обозначается строчными буквами как с) определяется как энергия (или теплопередача), необходимая для повышения температуры одного грамма чистой воды на один градус Цельсия. Диетологи и люди, следящие за весом, обычно используют диетических калорий, которые часто называют калориями ( пишется с большой буквы C). Одна пищевая калория — это энергия, необходимая для повышения температуры одного килограммов воды на один градус Цельсия. Это означает, что для химика одна диетическая калория равна одной килокалории, и нужно быть осторожным, чтобы не путать их.
Диетологи и люди, следящие за весом, обычно используют диетических калорий, которые часто называют калориями ( пишется с большой буквы C). Одна пищевая калория — это энергия, необходимая для повышения температуры одного килограммов воды на один градус Цельсия. Это означает, что для химика одна диетическая калория равна одной килокалории, и нужно быть осторожным, чтобы не путать их.
Опять же, рассмотрим внутреннюю энергию, потерянную телом. Эта внутренняя энергия может быть использована в трех направлениях: для теплопередачи, для выполнения работы и для накопления жира (крошечная часть также идет на восстановление и рост клеток). Теплообмен и совершение работы забирают внутреннюю энергию из организма, а пища возвращает ее. Если вы едите только нужное количество пищи, то ваша средняя внутренняя энергия остается постоянной. Все, что вы теряете при теплопередаче и выполнении работы, заменяется пищей, так что в долгосрочной перспективе \(\Delta U = 0\). Если вы постоянно переедаете, то \(\Дельта U\) всегда положительна, и ваше тело откладывает эту дополнительную внутреннюю энергию в виде жира. Обратное верно, если вы едите слишком мало. Если значение \(\Delta U\) отрицательное в течение нескольких дней, то организм метаболизирует собственный жир для поддержания температуры тела и выполнения работы, требующей энергии от тела. Этот процесс заключается в том, как диета приводит к потере веса.
Если вы постоянно переедаете, то \(\Дельта U\) всегда положительна, и ваше тело откладывает эту дополнительную внутреннюю энергию в виде жира. Обратное верно, если вы едите слишком мало. Если значение \(\Delta U\) отрицательное в течение нескольких дней, то организм метаболизирует собственный жир для поддержания температуры тела и выполнения работы, требующей энергии от тела. Этот процесс заключается в том, как диета приводит к потере веса.
Жизнь не всегда так проста, как знает каждый, кто сидит на диете. Организм накапливает жир или усваивает его, только если потребление энергии изменяется в течение нескольких дней. После того, как вы сели на основную диету, следующая будет менее успешной, потому что ваше тело меняет реакцию на низкое потребление энергии. Ваш основной уровень метаболизма (BMR) — это скорость, с которой пища преобразуется в теплопередачу и совершается работа, когда тело находится в полном покое. Организм регулирует скорость основного обмена, чтобы частично компенсировать переедание или недоедание. Тело снизит скорость метаболизма, а не устранит собственный жир, чтобы заменить потерянное потребление пищи. Вы будете легче остывать и чувствовать себя менее энергичным в результате более низкой скорости обмена веществ, и вы не будете терять вес так быстро, как раньше. Упражнения помогают похудеть, потому что они производят как теплопередачу от вашего тела, так и работу, а также повышают скорость метаболизма, даже когда вы находитесь в состоянии покоя. Снижению веса способствует также довольно низкая эффективность преобразования внутренней энергии тела в работу, так что потери внутренней энергии в результате выполнения работы намного больше, чем выполненная работа. Следует, однако, отметить, что живые системы не в тепловом равновесии.
Тело снизит скорость метаболизма, а не устранит собственный жир, чтобы заменить потерянное потребление пищи. Вы будете легче остывать и чувствовать себя менее энергичным в результате более низкой скорости обмена веществ, и вы не будете терять вес так быстро, как раньше. Упражнения помогают похудеть, потому что они производят как теплопередачу от вашего тела, так и работу, а также повышают скорость метаболизма, даже когда вы находитесь в состоянии покоя. Снижению веса способствует также довольно низкая эффективность преобразования внутренней энергии тела в работу, так что потери внутренней энергии в результате выполнения работы намного больше, чем выполненная работа. Следует, однако, отметить, что живые системы не в тепловом равновесии.
Тело дает нам отличный показатель того, что многие термодинамические процессы являются необратимыми . Необратимый процесс может идти в одном направлении, но не в обратном, при заданном наборе условий. Например, хотя жировые отложения могут быть преобразованы для выполнения работы и передачи тепла, работа, совершаемая над телом, и перенос тепла в него не могут быть преобразованы в жировые отложения.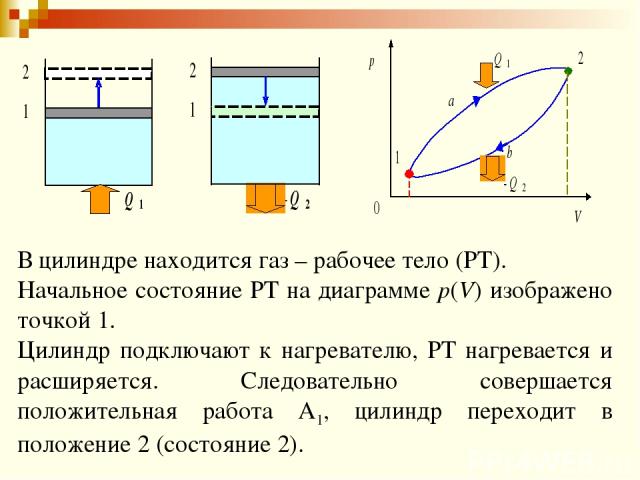 В противном случае мы могли бы пропустить обед, загорая или спускаясь по лестнице. Другим примером необратимого термодинамического процесса является фотосинтез. Этот процесс представляет собой поглощение растениями одной формы энергии — света — и преобразование ее в химическую потенциальную энергию. Оба применения первого закона термодинамики проиллюстрированы на рисунке \(\PageIndex{4}\). Одним из больших преимуществ законов сохранения, таких как первый закон термодинамики, является то, что они точно описывают начальную и конечную точки сложных процессов, таких как метаболизм и фотосинтез, без учета промежуточных осложнений.
В противном случае мы могли бы пропустить обед, загорая или спускаясь по лестнице. Другим примером необратимого термодинамического процесса является фотосинтез. Этот процесс представляет собой поглощение растениями одной формы энергии — света — и преобразование ее в химическую потенциальную энергию. Оба применения первого закона термодинамики проиллюстрированы на рисунке \(\PageIndex{4}\). Одним из больших преимуществ законов сохранения, таких как первый закон термодинамики, является то, что они точно описывают начальную и конечную точки сложных процессов, таких как метаболизм и фотосинтез, без учета промежуточных осложнений.
 Этот процесс называется фотосинтезом.
Этот процесс называется фотосинтезом.Резюме
В таблице представлена сводка терминов, относящихся к первому закону термодинамики.
| Срок | Определение |
|---|---|
| \(У\) | Внутренняя энергия — сумма кинетической и потенциальной энергий атомов и молекул системы. Можно разделить на множество подкатегорий, таких как тепловая и химическая энергия. Зависит только от состояния системы (например, от ее \(P\), \(V\) и \(T\), а не от того, как энергия поступила в систему. Изменение внутренней энергии не зависит от пути9.0221 |
| \(Q\) | Тепло — энергия, передаваемая из-за разницы температур. Характеризуется беспорядочным движением молекул. Сильно зависит от пути. Вход \(Q\) в систему положителен. |
| \(Вт\) | Работа — энергия, переданная силой, движущейся на расстояние. Организованный, упорядоченный процесс. Зависит от пути. \(W\), совершаемая системой (либо против внешней силы, либо для увеличения объема системы), положительна. |
- Первый закон термодинамики записывается как \(\Delta U = Q — W\), где \(\Delta U\) — изменение внутренней энергии системы, \(Q\) — чистая теплопередача (сумма всей теплопередачи в систему и из системы), а \(W\) — чистая выполненная работа (сумма всей работы, выполненной системой или системой).
- И \(Q\), и \(W\) представляют собой транзитную энергию; только \(\Delta U\) представляет собой независимую величину, которую можно сохранить.
- Внутренняя энергия \(U\) системы зависит только от состояния системы, а не от того, как она достигла этого состояния.
- Обмен веществ живых организмов и фотосинтез растений являются специализированными видами теплообмена, совершения работы и внутренней энергии систем.

Глоссарий
- первый закон термодинамики
- утверждает, что изменение внутренней энергии системы равно чистому переносу тепла в система минус чистая работа, выполненная система
- внутренняя энергия
- сумма кинетической и потенциальной энергий атомов и молекул системы
- метаболизм человека
- преобразование пищи в теплопередачу, работу и накопленный жир
Эта страница под названием 15.1: Первый закон термодинамики распространяется под лицензией CC BY 4.0 и была создана, изменена и/или курирована OpenStax с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- ОпенСтакс
- Лицензия
- СС BY
- Версия лицензии
- 4,0
- Программа OER или Publisher
- ОпенСтакс
- Показать оглавление
- нет
- Теги
- первый закон термодинамики
- метаболизм человека
- внутренняя энергия
- источник@https://openstax.
 org/details/books/college-physics
org/details/books/college-physics
1-й закон термодинамики — химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1920
Чтобы понять и выполнить любой термодинамический расчет, мы должны сначала понять основные законы и концепции термодинамики. Например, работа и теплота являются взаимосвязанными понятиями. Теплота — это передача тепловой энергии между двумя телами, находящимися при разных температурах и не равная тепловой энергии. Работа — это сила, используемая для передачи энергии между системой и ее окружением и необходимая для создания тепла и передачи тепловой энергии. И работа, и тепло вместе позволяют системам обмениваться энергией. Отношения между двумя понятиями можно проанализировать с помощью темы термодинамики, которая является научным исследованием взаимодействия тепла и других видов энергии.
И работа, и тепло вместе позволяют системам обмениваться энергией. Отношения между двумя понятиями можно проанализировать с помощью темы термодинамики, которая является научным исследованием взаимодействия тепла и других видов энергии.
Введение
Чтобы понять взаимосвязь между работой и теплотой, нам нужно понять третий связующий фактор: изменение внутренней энергии. Энергия не может быть создана или уничтожена, но ее можно преобразовать или передать. Внутренняя энергия относится ко всей энергии в данной системе, включая кинетическую энергию молекул и энергию, запасенную во всех химических связях между молекулами. При взаимодействии тепла, работы и внутренней энергии происходят передачи и преобразования энергии каждый раз, когда в систему вносятся изменения. Однако во время этих передач не создается и не теряется чистая энергия.
Закон термодинамики
Первый закон термодинамики гласит, что энергия может быть преобразована из одной формы в другую при взаимодействии тепла, работы и внутренней энергии, но она не может быть создана или уничтожена ни при каких обстоятельствах. Математически это представляется как
Математически это представляется как
\[ \Delta U=q + w \label{1}\]
где
- \(ΔU\) — полное изменение внутренней энергии системы,
- \(q\) — это теплообмен между системой и ее окружением, а
- \(w\) — это работа, проделанная системой или над ней.
Работа также равна отрицательному внешнему давлению на систему, умноженному на изменение объема:
\[ w=-p \Delta V \label{2}\]
давление в системе, а \(ΔV\) — изменение объема. Это специально называется работой «давление-объем».
Внутренняя энергия системы будет уменьшаться, если система отдает тепло или совершает работу. Следовательно, внутренняя энергия системы увеличивается при увеличении тепла (это можно сделать путем добавления тепла в систему). Внутренняя энергия также увеличилась бы, если бы над системой совершалась работа. Любая работа или тепло, поступающие в систему или выходящие из нее, изменяют внутреннюю энергию. Однако, поскольку энергия никогда не создается и не уничтожается (таким образом, первый закон термодинамики), изменение внутренней энергии всегда равно нулю. Если энергия теряется системой, то она поглощается окружающей средой. Если энергия поглощается системой, то эта энергия выделяется окружающей средой:
Если энергия теряется системой, то она поглощается окружающей средой. Если энергия поглощается системой, то эта энергия выделяется окружающей средой:
\[\Delta U_{система} = -\Delta U_{окружение} \]
где ΔU система — полная внутренняя энергия в системе, а ΔU окружение — полная энергия окружения.
| Процесс | Знак плавки (q) | Знак работы (w) |
|---|---|---|
| Работа, выполненная системой | Н/Д | — |
| Работа над системой | Н/Д | + |
| Тепло, выделяемое системой — экзотермическое (поглощенное окружающей средой) | — | Н/Д |
Рисунок выше является наглядным примером первого закона термодинамики. Синие кубы представляют систему, а желтые кружки представляют окружение вокруг системы. Если энергия теряется кубической системой, то она приобретается окружающей средой. Энергия никогда не создается и не уничтожается. Поскольку площадь куба подсказки уменьшилась, визуальная площадь желтого круга увеличилась. Это символизирует, как энергия, потерянная системой, приобретается окружающей средой. Влияние различных условий и изменений на систему помогает определить увеличение или уменьшение внутренней энергии, тепла и работы.
Синие кубы представляют систему, а желтые кружки представляют окружение вокруг системы. Если энергия теряется кубической системой, то она приобретается окружающей средой. Энергия никогда не создается и не уничтожается. Поскольку площадь куба подсказки уменьшилась, визуальная площадь желтого круга увеличилась. Это символизирует, как энергия, потерянная системой, приобретается окружающей средой. Влияние различных условий и изменений на систему помогает определить увеличение или уменьшение внутренней энергии, тепла и работы.
| Процесс | Изменение внутренней энергии | Теплопередача тепловой энергии (q) | Работа (w=-PΔV) | Пример |
|---|---|---|---|---|
| q=0 Адиабатический | + | 0 | + | Изолированная система, в которую не поступает и не уходит тепло, аналогична пенополистиролу |
| ΔV=0 Постоянный объем | + | + | 0 | Жесткая, изолированная от давления система, похожая на бомбовый калориметр |
| Постоянное давление | + или — | энтальпия (ΔH) | -ПΔВ | Большинство процессов происходят при постоянном внешнем давлении |
| ΔT=0 Изотермический | 0 | + | — | Нет изменения температуры, как в термостате |
Пример \(\PageIndex{1}\)
Газ в системе имеет постоянное давление. Окружающая среда вокруг системы теряет 62 Дж тепла и совершает над системой 474 Дж работы. Чему равна внутренняя энергия системы?
Окружающая среда вокруг системы теряет 62 Дж тепла и совершает над системой 474 Дж работы. Чему равна внутренняя энергия системы?
Решение
Чтобы найти внутреннюю энергию ΔU, мы должны рассмотреть взаимосвязь между системой и окружающей средой. Поскольку Первый закон термодинамики гласит, что энергия не создается и не уничтожается, мы знаем, что все, что теряется в окружающей среде, приобретается системой. Окружающая область теряет тепло и действует на систему. Следовательно, q и w положительны в уравнении ΔU=q+w, потому что система получает тепло и совершает работу над собой.
\[\begin{align} ΔU &= (62\,J) + (474\,J) \\[4pt] &= 536\,J \end{align}\]
Пример \(\PageIndex {2}\)
Система имеет постоянный объем (ΔV=0) и тепло вокруг системы увеличивается на 45 Дж.
- Какой знак теплоты (q) для системы?
- Чему равно ΔU?
- Чему равна внутренняя энергия системы в джоулях?
Решение
Так как система имеет постоянный объем (ΔV=0), член -PΔV=0 и работа равна нулю. Таким образом, в уравнении ΔU=q+w w=0 и ΔU=q. Внутренняя энергия равна теплоте системы. Окружающее тепло увеличивается, поэтому тепло системы уменьшается, потому что тепло не создается и не разрушается. Следовательно, тепло отводится от системы, что делает ее экзотермической и отрицательной. Значение внутренней энергии будет отрицательным значением тепла, поглощаемого окружающей средой.
Таким образом, в уравнении ΔU=q+w w=0 и ΔU=q. Внутренняя энергия равна теплоте системы. Окружающее тепло увеличивается, поэтому тепло системы уменьшается, потому что тепло не создается и не разрушается. Следовательно, тепло отводится от системы, что делает ее экзотермической и отрицательной. Значение внутренней энергии будет отрицательным значением тепла, поглощаемого окружающей средой.
- отрицательный (q<0)
- ΔU=q + (-PΔV) = q+ 0 = q
- ΔU = -45 Дж
Внешние связи
- Хэмби, Марси. «Понимание языка: решение проблем и первый закон термодинамики». Дж. Хим. Образовательный 1990 : 67, 923.
Ссылки
- Чанг, Рэймонд. Химия: Девятое издание
- Петруччи, Харвуд, Херринг, Мадура. Общая химия: Девятое издание
Авторы и авторство
- Лорен Бойл (UCD)
Первый закон термодинамики распространяется по незадекларированной лицензии, автором, ремиксом и/или куратором является LibreTexts.
