Диагностика и ремонт датчика положения дроссельной заслонки / Блог им. Girman / OpenECU
В представленной статье будет рассмотрено устройство датчика положения дроссельной заслонки, диагностика и симптомы неисправностей ДПДЗ, а так же его ремонт.
Устройство датчика положения дроссельной заслонки
Итак, если Вы задались вопросом, каким образом устроен датчик положения дроссельной заслонки, то стоит сначала рассмотреть принцип его работы.
Датчик положения дроссельной заслонки относится к типу датчиков резистивного типа. Данное название обуславливает принцип его работы, а именно, если разобрать данный датчик, то внутри мы обнаружим подвижной элемент в виде ползунка, который скользит по дорожке в виде дуги или подковы. К одному из концов данной дорожки подается питающее напряжение, другой конец дорожки соединен с массой, а с подвижного ползунка снимается выходной сигнал.
Неисправность датчика положения дроссельной заслонки:
Какие же неисправности датчика положения дроссельной заслонки чаще всего встречаются на практике? Если отбросить неисправности связанные с перетертыми проводами, подходящими к датчику и т.
На датчик подается напряжение 5В с ЭБУ автомобиля, однако при измерении напряжения Вы увидите, что на датчике напряжение варьируется от 0,3-0,5 В в одном положении и до 3,7-4,8 В в полностью открытом положении дросселя. Это сделано для того, чтобы ЭБУ могло идентифицировать неисправность в цепи датчика, будь то КЗ или обрыв.
В отдельных моделях автомобилях могут применяться датчики положения дроссельной заслонки с инверсной выходной характеристикой, то есть напряжение при закрытом дросселе будет максимальным, а по мере открытия дросселя оно будет падать.

Так же следует обратить внимание, что на автомобилях, где положение дроссельной заслонки задаётся при помощи электропривода ( в народе известная, как «электронная педаль») в указанных моделях положение дроссельной заслонки определяется при помощи не одного, а сразу двух потенциометров которые объединены в одном устройстве. При этом не имеет значения задает ли электронная педаль положение только в режиме холостого хода или во всем диапазоне. Один из двух потенциометров имеет инверсную выходную характеристику, а второй прямую выходную характеристику. На подобных системах, так же можно встретить концевой микро-выключатель который срабатывает в момент, когда педаль акселератора полностью отпущена водителем.
Как обнаружить неисправность датчика положения дроссельной заслонки без разборки датчика и снятия его с автомобиля:
— неисправность датчика положения дроссельной заслонки можно легко определить при помощи сканера, мотортестера или простого мультиметра.
 В данной статье мы рассмотрим пример обнаружения неисправности при помощи сканера.
В данной статье мы рассмотрим пример обнаружения неисправности при помощи сканера.Итак, зайдите в сканере в режим снятия параметров в режиме реального времени, после чего перейдите в раздел снимающий показания положения дроссельной заслонки в процентном соотношении или вольтаж на датчике, после этого начните медленно открывать дроссельную заслонку и следите за выходными сигналами со сканера. Наиболее удобно снимать данные показания в режиме осциллограммы, если конечно Ваш сканер поддерживает данную функцию. Данные с датчика должны расти медленно без скачков и резких падений. В случае если нарастание сигнала имеет резкие провалы или рост, то это свидетельствует об износе резистивного слоя на дорожках датчика.
Не обращайте внимания на незначительные изменения осциллограммы, это может быть обусловлено дрожью Вашей руки. Так же следует отметить, что при низкой скорости обмена между сканером и ЭБУ автомобиля возможен пропуск дефектного слоя резистивной дорожки, если он совсем короткий, но данный факт скорее исключение, чем правило.

При снятии датчика с автомобиля так же не будет лишним осуществить промывку дроссельного узла, отложения на стенках которого, так же могут мешать нормальной работе датчика.
Ремонт датчика положения дроссельной заслонки
Восстановить изношенный резистивный слой на дорожках, в бытовых условиях невозможно, поэтому единственным способом ремонта без замены датчика или дорожек является возможность в некоторых датчиках смещения резистивных дорожек относительно ползунка. Для этого в датчике предусмотрен специальный винт который фиксирует то или иное положение дорожек относительно ползунка, поэтому допустим при сильном износе начала резистивного слоя дорожки мы можем, ослабив винт, сместить его в область недоступную ползунку и таким образом избежать замены датчика положения дроссельной заслонки.
Симптомы неисправности датчика положения дроссельной заслонки
В случае износа резистивного слоя, в зависимости от места износа автомобиль может вести себя различными способами.
 Может наблюдаться нестабильная работа автомобиля на холостом ходу, автомобиль может попросту глохнуть на холостом ходу, либо при нажатии на педаль акселератора могут наблюдаться провалы в движении либо наоборот рывки и перегазовки.
Может наблюдаться нестабильная работа автомобиля на холостом ходу, автомобиль может попросту глохнуть на холостом ходу, либо при нажатии на педаль акселератора могут наблюдаться провалы в движении либо наоборот рывки и перегазовки.Так же в отдельных случаях при замене оригинального датчика положения дроссельной заслонки на некачественный аналог может наблюдаться зависимость работы датчика от температуры, то есть по мере нагревания корпуса ДПДЗ выходное значение будет меняться. К примеру, на холодном двигателе датчик имеет выходное напряжение около 500 мВ, ЭБУ сохраняет данное значение, как положение закрытого дросселя и приступает к стабилизации оборотов холостого хода. После нагревания корпуса датчика, выходное значение меняется на 560 мВ, ЭБУ не понимает, что это напряжение холостого хода т.к. он сохранил 500 мВ и не стабилизирует холостой ход.

Установить наличие данной неисправности датчика положения дроссельной заслонки можно путем измерения выходного значения на холодном двигателе (не работавшем не менее 2,5 часов) и на прогретом двигателе. Если значение сильно различаются имеет место быть данный дефект и датчик необходимо менять на более качественный.
Статья взята с сайта http://елм327.рф
Дпдз ВАЗ 2110 ремонт — фото, описание на VAZ-2110.net
8. Ослабив крестовой отверткой червячный хомут рукава подвода воздуха к кор…
Датчик дроссельной заслонки на ВАЗ 2110, model: 2112-1148200, производство:…
Теперь непосредственно о том как почистить дроссельную заслонку ВАЗ 2110.
Чистка дроссельной заслонки ВАЗ 2110 — инструкция.
Педаль газа связана с механическим приводом дроссельной заслонки через трос…
Форум клуба ВАЗ 2113, ВАЗ 2114, ВАЗ 2115 — Показать сообщение отдельно — ДП…
Форум клуба ВАЗ 2113, ВАЗ 2114, ВАЗ 2115 — Показать сообщение отдельно — Па…
замена датчика.
Рекомендации по техническому обслуживанию.
Р0122 двигатель переходит на резервный режим Положение. работы дроссельной заслонки…
Датчики ВАЗ.
11. Если при замене дроссельного патрубка на новом патрубке не установлены датчик…
Замена датчика положения дроссельной заслонки ваз 2114, 2115, 2110.
Крестообразной отверткой отворачиваем два винта крепления датчика к дроссел…
Дроссельная заслонка ваз 2110 схема.
Принцип работы ДПДЗ. заслонки впускного коллектора.
показания датчика дроссельной заслонки.
Водяной насос ваз 2109 ремонт.
Как проверить датчик положения дроссельной заслонки Ваз 2110 своими руками?…
Датчик дроссельной заслонки GM 06682 ВАЗ 2110-2112 онлайн.
Что такое датчик положения дроссельной заслонки.
Датчик положения дроссельной заслонки ВАЗ 2110.
Фотоальбом датчик положения коленвала ваз 2110 Niva, ЭСУД автомобилей Lada …
ДПДЗ ВАЗ 2114 неисправности, диагностика и замена.
Фото демонтажа датчика дроссельной заслонки Лады Калины, v-lada.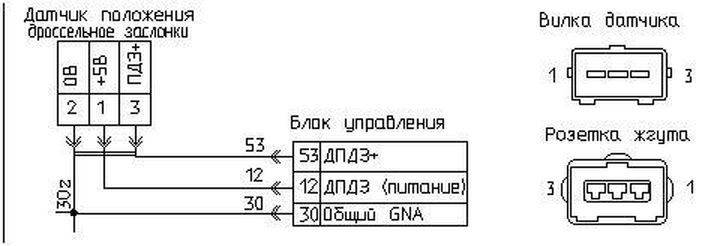 ru.
ru.
Будучи установленный на автомобиле ВАЗ 2110 (который оборудован системой вп…
Снятие датчика положения дроссельной заслонки.
Фото датчика положения дроссельной заслонки ВАЗ 2110, 2114.ru. дроссель…
Напряжение питания на выводе «А» колодки должно быть около 5 В. Е…
Устраняем проблему с холостыми оборотами на ВАЗ-2110 за 10 минут.
Бесконтактный датчик положения дроссельной заслонки на Ланосе.
винты крепления регулятора холостого хода к корпусу дроссельной заслонки.
Работа с датчиком положения дроссельной заслонки.
Датчик дроссельной заслонки ВАЗ 2110.
7.2.22. Снятие датчика положения дроссельной заслонки.
Замена датчика положения дроссельной заслонки и чистка самого дросселя.
разъем датчика положения дроссельной заслонки ВАЗ 2112.
Датчик положения дроссельной заслонки GM 06682 на ВАЗ 2110, ВАЗ 2112,…
Проверка и замена датчика положения дроссельной заслонки.
Проверка цепи и датчика положения дроссельной заслонки.
Проверка датчика положения дроссельной заслонки мультиметром.
Датчики положения дроссельной заслонки.
Диагностика датчика положения дроссельной заслонки осуществляется следующим…
Опасности Delta P (перепада давления) при дайвинге
Опасности Delta P (перепада давления) при дайвинге Опасности при дайвинге, вызванные перепадом давления, возникают, когда вода перемещается из области высокого давления в область более низкого давления. Риска нет, когда нет потока воды, но как только поток начинается, прилагаемые силы обычно очень значительны.
Существует множество ситуаций, когда возникает поток воды, это может быть связано с открытием клапана, попаданием в пустоту или запуском насоса. Когда поток проходит через отверстие, любой дайвер, приближающийся к стороне высокого давления, может быть втянут и пойман в ловушку. В таких условиях часто возникают серьезные или смертельные травмы. Разница в высоте между двумя водоемами на разных уровнях создает всасывающую силу через любое отверстие или отверстие в преграде между ними. Чем больше разница в высоте или чем больше отверстие в барьере, тем больше и опаснее сила всасывания. Тем не менее, очень значительные силы всасывания могут также создаваться при небольшой разнице уровней воды и относительно большом открытии, это может быть смертельным даже на малых глубинах 3 метра и менее.
Перед началом водолазных работ необходимо провести соответствующие процедуры оценки рисков. Перед любыми водолазными операциями, в которых выявлена потенциальная опасность Delta P, должны быть введены в действие процедуры изоляции и блокировки / маркировки. Всегда предпочтительнее иметь двойную изоляцию, где это возможно.
Всегда предпочтительнее иметь двойную изоляцию, где это возможно.
Особое внимание всегда следует уделять следующим местам:
• Насосы, заборники, клапаны и дренажи.
• Плотины, шлюзы, ворота и водосливы.
• Трещины/пустоты в трубах или шлангах.
• Гребные винты, подруливающие устройства на судах и вокруг них.
• Большое оборудование для подводного перемещения.
• Риск выхода из строя установки или оборудования.
• Затопленные трубы или пустые конструкции, загерметизированные при атмосферном давлении или давлении выше или ниже давления окружающей воды.
Расчет силы от перепада давления
Сила = Давление x Площадь
Сила (сила в килограммах) = Разница уровней x Плотность воды x Площадь
Плотность воды = 1025 кг/м 3 для морской воды
или 1000 кг/м 3 для пресной воды
Область = π x (диаметр/2) = 3,5 x 1025 x π x (0,3/2) = 254 кгс
Отношение скорости воды к расстоянию до опасного места Дайверы подвергаются опасности из-за потока воды, всасывания или турбулентности. Область быстро движущейся воды вокруг этих входов (будь то в результате работы или отказа оборудования и оборудования) называется зоной опасности перепада давления (DPDZ). Дайверы обычно не могут обнаружить вокруг себя опасные перепады давления, когда они погружены в воду, а как только они это сделают, будет уже слишком поздно.
Область быстро движущейся воды вокруг этих входов (будь то в результате работы или отказа оборудования и оборудования) называется зоной опасности перепада давления (DPDZ). Дайверы обычно не могут обнаружить вокруг себя опасные перепады давления, когда они погружены в воду, а как только они это сделают, будет уже слишком поздно.
Как показано на рисунке выше, дайвер, который движется от точки a к b , не почувствует изменения расхода воды, но при перемещении на то же расстояние, 300 мм, от b к c дайвер испытает экспоненциальное увеличение скорости потока и будет втянут.
В приведенных ниже таблицах приведены значения силы и расхода в трубах разного диаметра на разной глубине.
Сила перепада давления в трубе (кгс) Скорость потока воды в трубе (м/с) Морфогенез 1. Амано М., М. Ито, К. Кимура, Ю. Фуката, К. Чихара, Т. Накано, Ю. Мацуура и К. Кайбути. 1996. Фосфорилирование и активация миозина Rho-ассоциированной киназой (Rho-киназой). Дж. Биол. хим. 271 : 20246-20249. [PubMed] [Google Scholar]
Накано, Ю. Мацуура и К. Кайбути. 1996. Фосфорилирование и активация миозина Rho-ассоциированной киназой (Rho-киназой). Дж. Биол. хим. 271 : 20246-20249. [PubMed] [Google Scholar]
2. Аша Х., Н. Д. де Руйтер, М. Г. Ван и И. К. Харихаран. 1999. ГТФаза Rap1 функционирует как регулятор морфогенеза in vivo. EMBO J. 18 : 605-615. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Baena-López, L.A., A. Baonza и A. Garcia-Bellido. 2005. Ориентация клеточных делений определяет форму органов дрозофилы. Курс. биол. 15 : 1640-1644. [PubMed] [Академия Google]
4. Боттнер Б., П. Харджес, С. Ишимару, М. Хеке, Х. К. Фан, Ю. Цинь, Л. Ван Элст и У. Галл. 2003. Гомолог AF-6 canoe действует как эффектор Rap1 во время дорсального закрытия эмбриона дрозофилы. Генетика 165 : 159-169. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Бос, Дж. Л. 2005. Связь Rap с клеточной адгезией. Курс. мнение Клеточная биол. 17 : 123-128. [PubMed] [Google Scholar]
Бос, Дж. Л. 2005. Связь Rap с клеточной адгезией. Курс. мнение Клеточная биол. 17 : 123-128. [PubMed] [Google Scholar]
6. Бос, Дж. Л., К. де Брюйн, Дж. Энсеринк, Б. Куйперий, С. Рангараджан, Х. Реманн, Дж. Ридл, Дж. де Рой, Ф. ван Мансфельд и Ф. Зварткруйс. 2003. Роль Rap1 в интегрин-опосредованной клеточной адгезии. Биохим. соц. Транс. 31 : 83-86. [PubMed] [Google Scholar]
7. Bosgraaf, L., and PJ van Haastert. 2006. Регуляция миозина II у Dictyostelium. Евро. Дж. Клеточная биология. 85 : 969-979. [PubMed] [Google Scholar]
8. Брага В.М., Яп А.С. 2005. Проблемы изобилия: эпителиальные соединения и передача сигналов малых ГТФаз. Курс. мнение Клеточная биол. 17 : 466-474. [PubMed] [Google Scholar]
9. Брэнд, А. Х. и Н. Перримон. 1993. Направленная экспрессия генов как средство изменения клеточных судеб и создания доминантных фенотипов. Развитие 118 : 401-415. [PubMed] [Google Scholar]
Развитие 118 : 401-415. [PubMed] [Google Scholar]
10. Чоу Т. Б. и Н. Перримон. 1996. Аутосомный метод FLP-DFS для создания мозаик зародышевой линии у Drosophila melanogaster. Генетика 144 : 1673-1679. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11. Dawes-Hoang, R.E., K.M. Parmar, A.E. Christiansen, C.B. Phelps, A.H. Brand и E.F. Wieschaus. 2005. Складчатая гаструляция, изменение формы клеток и контроль локализации миозина. Развитие 132 : 4165-4178. [PubMed] [Google Scholar]
12. de Rooij, J., N. M. Boenink, M. van Triest, R. H. Cool, A. Wittinghofer, and J. L. Bos. 1999. PDZ-GEF1, фактор обмена гуаниновых нуклеотидов, специфичный для Rap1 и Rap2. Дж. Биол. хим. 274 : 38125-38130. [PubMed] [Google Scholar]
13. Франке Дж. Д., Р. А. Монтегю и Д. П. Кихарт. 2005. Немышечный миозин II генерирует силы, которые передают напряжение и вызывают сокращение во многих тканях во время дорсального закрытия. Курс. биол. 15 : 2208-2221. [PubMed] [Google Scholar]
Курс. биол. 15 : 2208-2221. [PubMed] [Google Scholar]
14. Гарсия-Беллидо, А., и Э. Б. Льюис. 1976. Автономная клеточная дифференцировка гомеотических bithorax мутантов Drosophila melanogaster. Дев. биол. 48 : 400-410. [PubMed] [Google Scholar]
15. Гарсия-Беллидо, А., П. Риполл и Г. Мората. 1976. Компартментализация дорсального мезоторакального диска дрозофилы. Дев. биол. 48 : 132-147. [PubMed] [Google Scholar]
16. Гибсон М.С. и Н. Перримон. 2003. Апикобазальная поляризация: эпителиальная форма и функция. Курс. мнение Клеточная биол. 15 : 747-752. [PubMed] [Google Scholar]
17. Хайго, С. Л., Дж. Д. Хильдебранд, Р. М. Харланд и Дж. Б. Уоллингфорд. 2003. Shroom вызывает апикальное сужение и необходим для формирования шарнирной точки во время закрытия нервной трубки. Курс. биол. 13 : 2125-2137. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
18. Halsell, S. R., B. I. Chu, and D. P. Kiehart. 2000. Генетический анализ демонстрирует прямую связь между передачей сигналов rho и немышечной функцией миозина во время морфогенеза Drosophila. Генетика 155 : 1253-1265. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Харихаран И. К., Р. В. Картью и Г. М. Рубин. 1991. Мутация Drosophila roughened: активация гомолога rap нарушает развитие глаз и препятствует детерминации клеток. Сотовый 67 : 717-722. [PubMed] [Google Scholar]
20. Hildebrand, JD 2005. Shroom регулирует форму эпителиальных клеток посредством апикального расположения актомиозиновой сети. Дж. Клеточные науки. 118 : 5191-5203. [PubMed] [Google Scholar]
21. Хильдебранд, Дж. Д., и П. Сориано. 1999. Shroom, актин-связывающий белок, содержащий домен PDZ, необходим для морфогенеза нервной трубки у мышей. Ячейка 99 : 485-497. [PubMed] [Google Scholar]
Ячейка 99 : 485-497. [PubMed] [Google Scholar]
22. Huelsmann, S., C. Hepper, D. Marchese, C. Knoll, and R. Reuter. 2006. Головокружение PDZ-GEF регулирует форму клеток мигрирующих макрофагов посредством Rap1 и интегринов у эмбрионов дрозофилы. Развитие 133 : 2915-2924. [PubMed] [Google Scholar]
23. Jamora, C., and E. Fuchs. 2002. Межклеточная адгезия, передача сигналов и цитоскелет. Нац. Клеточная биол. 4 : Е101-Е108. [PubMed] [Академия Google]
24. Чон, Т.Дж., Д.Дж. Ли, С. Мерло, Г. Уикс и Р.А. Фиртел. 2007. Rap1 контролирует клеточную адгезию и подвижность клеток посредством регуляции миозина II. Дж. Клеточная биология. 176 : 1021-1033. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Кальчмидт, Дж. А., Н. Лоуренс, В. Морель, Т. Балайо, Б. Г. Фернандес, А. Пелисье, А. Хасинто и А. Мартинес Ариас. 2002. Планарная полярность и динамика актина в эпидермисе дрозофилы. Нац. Клеточная биол. 4 : 937-944. [PubMed] [Google Scholar]
Планарная полярность и динамика актина в эпидермисе дрозофилы. Нац. Клеточная биол. 4 : 937-944. [PubMed] [Google Scholar]
26. Кавадзири А., Н. Ито, М. Фуката, М. Накагава, М. Ямага, А. Ивамацу и К. Кайбути. 2000. Идентификация нового белка, взаимодействующего с бета-катенином. Биохим. Биофиз. Рез. коммун. 273 : 712-717. [PubMed] [Google Scholar]
27. Келлер Р., Л. А. Дэвидсон и Д. Р. Шук. 2003. Как мы устроены: биомеханика гаструляции. Дифференциация 71 : 171-205. [PubMed] [Академия Google]
28. Kiehart, DP 1990. Молекулярно-генетическое исследование функции тяжелой цепи миозина. Сотовый 60 : 347-350. [PubMed] [Google Scholar]
29. Кихарт Д. П., К. Г. Гэлбрейт, К. А. Эдвардс, У. Л. Риколл и Р. А. Монтегю. 2000. Множественные силы способствуют морфогенезу клеточного листа для закрытия спины у Drosophila. Дж. Клеточная биология. 149 : 471-490. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дж. Клеточная биология. 149 : 471-490. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Кимура К., М. Ито, М. Амано, К. Чихара, Ю. Фуката, М. Накафуку, Б. Ямамори, Дж. Фэн, Т. Накано, К. Окава, А. Ивамацу и К. Кайбути. 1996. Регуляция миозинфосфатазы с помощью Rho и Rho-ассоциированной киназы (Rho-киназы). Наука 273 : 245-248. [PubMed] [Google Scholar]
31. Нокс А. Л. и Н. Х. Браун. 2002. Регуляция Rap1 GTPase позиционирования соединения адгезивов и клеточной адгезии. Наука 295 : 1285-1288. [PubMed] [Google Scholar]
32. Kooistra, M. R., N. Dube, and J. L. Bos. 2007. Rap1: ключевой регулятор образования межклеточных соединений. Дж. Клеточные науки. 120 : 17-22. [PubMed] [Google Scholar]
33. Кеппен М., Б. Г. Фернандес, Л. Карвалью, А. Хасинто и С. П. Гейзенберг. 2006. Скоординированные изменения формы клеток контролируют движение эпителия у рыбок данио и дрозофилы. Развитие 133 : 2671-2681. [PubMed] [Google Scholar]
Развитие 133 : 2671-2681. [PubMed] [Google Scholar]
34. Кругманн С., Р. Уильямс, Л. Стивенс и П. Т. Хокинс. 2004. ARAP3 представляет собой GAP, регулируемый PI3K и rap для RhoA. Курс. биол. 14 : 1380-1384. [PubMed] [Академия Google]
35. Ли, Дж. Х., К. С. Чо, Дж. Ли, Д. Ким, С. Б. Ли, Дж. Ю, Г. Х. Ча и Дж. Чанг. 2002. Drosophila PDZ-GEF, фактор обмена гуаниновых нуклеотидов на Rap1 GTPase, обнаруживает новый вышестоящий регуляторный механизм в сигнальном пути митоген-активируемой протеинкиназы. Мол. Клетка. биол. 22 : 7658-7666. [Бесплатная статья PMC] [PubMed] [Google Scholar]
36. Lee, YS, and RW Carthew. 2003. Создание лучшего вектора РНК-интерференции для дрозофилы: использование интронных спейсеров. Методы 30 : 322-329. [PubMed] [Google Scholar]
37. Luo, L., YJ Liao, LY Jan, and YN Jan. 1994. Различные морфогенетические функции сходных малых GTPases: Drosophila Drac1 участвует в разрастании аксонов и слиянии миобластов. Гены Дев. 8 : 1787-1802. [PubMed] [Google Scholar]
Гены Дев. 8 : 1787-1802. [PubMed] [Google Scholar]
38. Major, RJ, and KD Irvine. 2006. Локализация и потребность в миозине II на границе дорсально-вентрального отдела крыла дрозофилы. Дев. Дин. 235 : 3051-3058. [PubMed] [Google Scholar]
39. Мартин П. и С. М. Паркхерст. 2004. Параллели между восстановлением тканей и морфогенезом эмбриона. Развитие 131 : 3021-3034. [PubMed] [Google Scholar]
40. Мино А., Т. Оцука, Э. Иноуэ и Ю. Такай. 2000. Мембран-ассоциированная гуанилаткиназа с инвертированной ориентацией (MAGI)-1/мозговой ингибитор ангиогенеза 1-ассоциированный белок (BAP1) в качестве каркасной молекулы для Rap small G-белка GDP/GTP обменного белка в плотных соединениях. Гены Клетки 5 : 1009-1016. [PubMed] [Google Scholar]
41. Мишра С., Смолик С.М., Форте М.А., Сторк П.Дж. 2005. Независимая от Ras активация передачи сигналов ERK через тирозинкиназу рецептора туловища опосредуется Rap1.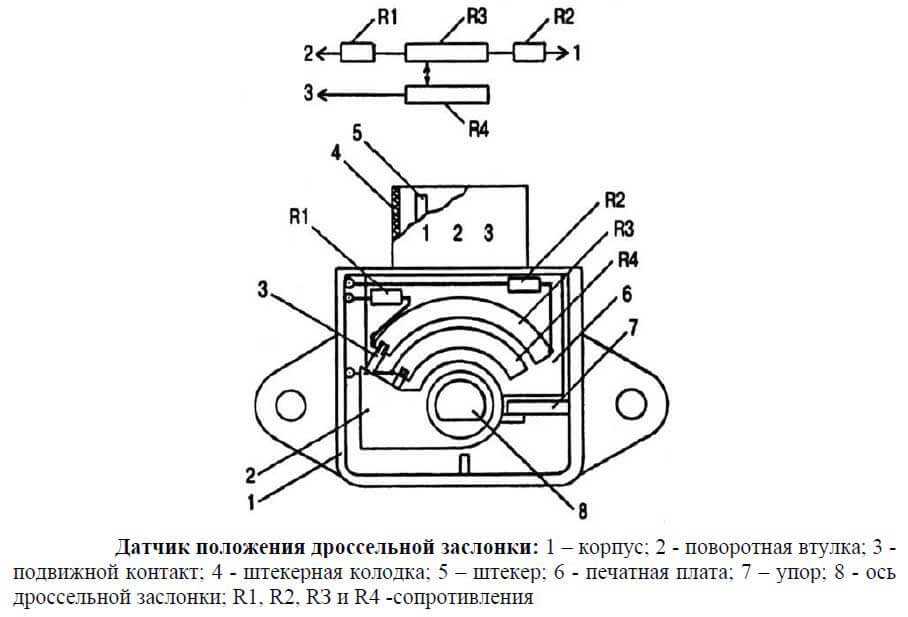 Курс. биол. 15 : 366-370. [PubMed] [Google Scholar]
Курс. биол. 15 : 366-370. [PubMed] [Google Scholar]
42. Мората Г. и П. Риполл. 1975. Минуты: мутанты дрозофилы, автономно влияющие на скорость деления клеток. Дев. биол. 42 : 211-221. [PubMed] [Академия Google]
43. Николаиду К.К. и К. Барретт. 2004. Сигнальный путь Rho GTPase повторно используется в укладке эпителия и потенциально выбирает результат активации Rho. Курс. биол. 14 : 1822-1826. [PubMed] [Google Scholar]
44. Палади М. и У. Тепасс. 2004. Функция Rho GTPases в эмбриональной миграции клеток крови у дрозофилы. Дж. Клеточные науки. 117 : 6313-6326. [PubMed] [Google Scholar]
45. Патель, П. Х., Н. Тапар, Л. Гуо, М. Мартинес, Дж. Марис, К. Л. Гау, Дж. А. Ленгьел и Ф. Таманой. 2003. Drosophila Rheb GTPase необходима для прогрессирования клеточного цикла и роста клеток. Дж. Клеточные науки. 116 : 3601-3610. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
46. Пеллис-ван Беркель В., М. Х. Верхейен, Э. Куппен, М. Асахина, Дж. де Рой, Г. Янсен, Р. Х. Пластерк, Дж. Л. Бос и Ф. Дж. Зварткруйс. 2005. Требование Caenorhabditis elegans RapGEF pxf-1 и rap-1 к целостности эпителия. Мол. биол. Сотовый 16 : 106-116. [Бесплатная статья PMC] [PubMed] [Google Scholar]
47. Савада Ю., Тамада М., Дубин-Талер Б.Дж., Чернявская О., Сакаи Р., Танака С. и Шитц М.П. 2006. Определение силы путем механического удлинения субстрата киназ семейства Src p130Cas. Сотовый 127 : 1015-1026. [Бесплатная статья PMC] [PubMed] [Google Scholar]
48. Spradling, AC, and GM Rubin. 1982. Транспозиция клонированных Р-элементов в хромосомы зародышевой линии дрозофилы. Science 218 : 341-347. [PubMed] [Академия Google]
49. Steimle, P.A., S. Yumura, G.P. Cote, Q.G. Medley, M.V. Polyakov, B. Leppert, and T. T. Egelhoff. 2001. Привлечение киназы тяжелой цепи миозина к богатым актином выпячиваниям Dictyostelium. Курс. биол. 11 : 708-713. [PubMed] [Google Scholar]
T. Egelhoff. 2001. Привлечение киназы тяжелой цепи миозина к богатым актином выпячиваниям Dictyostelium. Курс. биол. 11 : 708-713. [PubMed] [Google Scholar]
50. Такахаши К., Т. Мацуо, Т. Кацубэ, Р. Уэда и Д. Ямамото. 1998. Прямое связывание между двумя доменными белками PDZ Canoe и ZO-1 и их роль в регуляции N-концевого киназного пути jun в морфогенезе дрозофилы. мех. Дев. 78 : 97-111. [PubMed] [Google Scholar]
51. Тамада М., Т. Д. Перес, У. Дж. Нельсон и М. П. Шитц. 2007. Два различных режима сборки и динамики миозина во время закрытия эпителиальной раны. Дж. Клеточная биология. 176 : 27-33. [Бесплатная статья PMC] [PubMed] [Google Scholar]
52. Тамада М., М. П. Шитц и Ю. Савада. 2004. Активация сигнального каскада растяжением цитоскелета. Дев. Сотовый 7 : 709-718. [PubMed] [Академия Google]
53. Tepass, U. 1996. Крошки, компонент апикальной мембраны, необходимы для образования прилипателей zonula в первичном эпителии дрозофилы. Дев. биол. 177 : 217-225. [PubMed] [Google Scholar]
1996. Крошки, компонент апикальной мембраны, необходимы для образования прилипателей zonula в первичном эпителии дрозофилы. Дев. биол. 177 : 217-225. [PubMed] [Google Scholar]
54. Van Aelst, L. 1998. Двухгибридный анализ взаимодействий Ras-Raf. Методы Мол. биол. 84 : 201-222. [PubMed] [Google Scholar]
55. Verdier, V., GC Chen, and J. Settleman. 2006. Rho-киназа регулирует морфогенез тканей через немышечный миозин и LIM-киназу во время развития дрозофилы. BMC Dev. биол. 6 : 38. [Бесплатная статья PMC] [PubMed] [Google Scholar]
56. Уоллингфорд, Дж. Б., С. Э. Фрейзер и Р. М. Харланд. 2002. Конвергентное удлинение: молекулярный контроль движения поляризованных клеток во время эмбрионального развития. Дев. Сотовый 2 : 695-706. [PubMed] [Google Scholar]
57. Wang, H., S.R. Singh, Z. Zheng, S.W. Oh, X. Chen, K. Edwards, and S. X. Hou. 2006. Передача сигналов Rap-GEF контролирует прикрепление стволовых клеток к своей нише посредством регуляции DE-кадгерин-опосредованной клеточной адгезии в семенниках дрозофилы. Дев. Ячейка 10 : 117-126. [PubMed] [Google Scholar]
Edwards, and S. X. Hou. 2006. Передача сигналов Rap-GEF контролирует прикрепление стволовых клеток к своей нише посредством регуляции DE-кадгерин-опосредованной клеточной адгезии в семенниках дрозофилы. Дев. Ячейка 10 : 117-126. [PubMed] [Google Scholar]
58. Wei, S.Y., LM Escudero, F. Yu, LH Chang, LY Chen, YH Ho, CM Lin, C.S. Chou, W. Chia, J. Modolell, and JC Hsu. 2005. Эхиноид является компонентом слипчивых соединений, который взаимодействует с DE-кадгерином, опосредуя клеточную адгезию. Дев. Клетка. 8 : 493-504. [PubMed] [Google Scholar]
59. Winter, C.G., B. Wang, A. Ballew, A. Royou, R. Karess, JD Axelrod и L. Luo. 2001. Drosophila Rho-associated kinase (Drok) связывает Frizzled-опосредованную передачу сигналов планарной клеточной полярности с актиновым цитоскелетом. Сотовый 105 : 81-91. [PubMed] [Google Scholar]
60. Сюй Т. и Г. М. Рубин. 1993.
