какая должна быть, как проверить, как поднять плотность
Какая плотность электролита должна быть в аккумуляторе
Добраться до электролита, измерить плотность и отрегулировать показатель можно только в обслуживаемых аккумуляторах. Они изготавливаются по технологии WET или иначе мокрых банок. Представляют собой пластиковый корпус, поделенный на 6 отсеков (банок). В отсеках находятся пакеты пластин, залитые электролитом. Каждая банка это отдельный маленький аккумулятор напряжением 2,1 вольт, соединённые последовательно. Поэтому на крайних контактах в сумме получается 12,5 – 12,6 В. Сверху отсеки закрыты крышкой с пробками. Через эти пробки можно контролировать состояние электролита. Внешне всё выглядит как пластиковая коробка с ручкой, пробками и двумя контактами плюс и минус.
Залитые свинцово – кислотные батареи до сих пор остаются самыми распространёнными АКБ (аккумуляторными батареями). Их используют в легковых и гольф автомобилях, газонокосилках и другой садовой технике, грузовиках и на водном транспорте.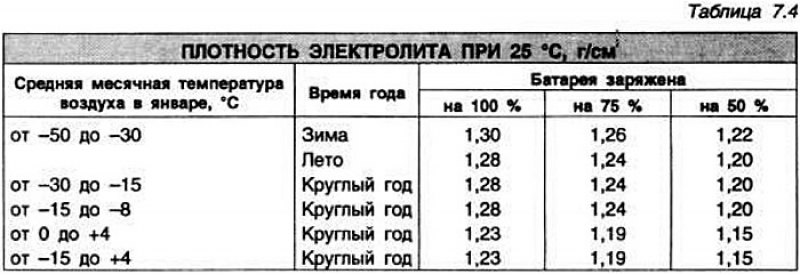
Показатель плотности измеряют в весе одного кубического сантиметра раствора. В продаже имеется электролит для заливки плотностью — 1,28 г/см3 и так называемый, корректирующий — 1,33. Для изготовления электролита плотностью 1,28 при температуре 25 °С смешивают 0,285 мл кислоты с 0,781 лм дистиллированной воды.
Оптимальная плотность очень важна для стабильной и долговечной работы аккумулятора. Она зависит от уровня заряда и температуры окружающей среды при измерении. Достоверные данные можно получить только на полностью заряженной батарее с температурой электролита 25 °С.
Немаловажным фактором являются условия эксплуатации. Для жаркого и холодного климата используют батареи с различной плотностью. В условия Крайнего Севера при сильных морозах она должна быть 1,3 и снижаться до 1,23 в жарком климате при высокой температуре.
Как проверить плотность электролита аккумулятора
Обслуживаемые АКБ требуют повышенного внимания. Они склонны к выкипанию и разбрызгиванию электролита. Плотность в банках может разнонаправленно меняться. Поэтому замеры необходимо проводить через каждые 15 – 20 тыс. км пробега или весной и осенью.
Для измерения необходим ареометр, очки, резиновые или силиконовые перчатки и старая одежда. Электролит очень агрессивен. В зависимости от чувствительности, при попадании на кожу его можно не почувствовать. А вот глаза и слизистые оболочки нужно беречь. Попадание на одежду на первый взгляд незаметно. Но даже небольшие капли проявят себя. После стирки обнаружатся большие и маленькие дырки на любимых джинсах, рубашке или куртке.
Ареометр – единственный прибор для измерения плотности электролита. Состоит из стеклянной колбы с помещенным внутрь денсиметром. Сверху находится резиновая груша. Денсиметр, это запаянная стеклянная трубка с металлическими шариками в нижней части и утончённым верхом. В утонченной части расположена шкала.
Для измерения нужно открутить пробки. Нажать на грушу и поместить в заливное отверстие кончик ареометра. Отпустить грушу и набрать электролит до всплывания денсиметра. Он не должен касаться донышка и стенок колбы. Ареометр нужно держать в вертикальном положении. Денсиметр будет плавать, на плотность укажет шкала на уровне электролита. Предварительный замер укажет на состояние аккумулятора. Обычно крайние банки разряжены сильнее и плотность в них меньше средних. После замера надо проверить уровень электролита, если необходимо долить дистиллированную воду.
Состояние батареи можно оценить только полностью зарядив её. Заряжаем АКБ и даём отдохнуть пару часов. Зарядка сопровождается кипением и повышением температуры электролита.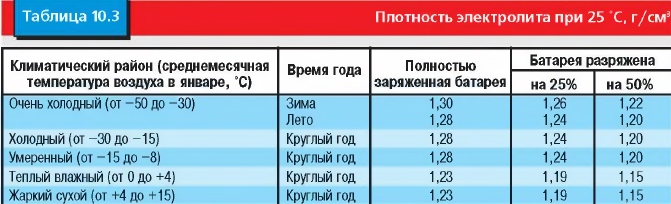 Для достоверного замера газы должны выйти, температура упасть. После остывания можно проводить измерение. В зависимости от этих результатов можно сделать выводы о состоянии АКБ.
Для достоверного замера газы должны выйти, температура упасть. После остывания можно проводить измерение. В зависимости от этих результатов можно сделать выводы о состоянии АКБ.
Таблица плотности электролита в аккумуляторе
Состояние можно оценить сопоставив плотность и напряжение аккумулятора, это делают руководствуясь данными таблицы:
Плотность электролита, г/см3 | Напряжение без нагрузки, В | Напряжение под нагрузкой 100 А, В | Уровень заряда, % |
1,11 | 11,7 | 8,4 | 0 |
1,12 | 11,75 | 8,5 | 6 |
1,13 | 11,8 | 8,6 | 12 |
1,14 | 11,85 | 8,8 | 19 |
1,15 | 11,9 | 9 | 25 |
1,16 | 12 | 9,2 | 31 |
1,17 | 12 | 9,3 | 37 |
1,18 | 12,1 | 9,4 | 44 |
1,19 | 12,2 | 9,6 | 50 |
1,2 | 12,25 | 9,7 | 56 |
1,21 | 12,3 | 9,9 | 62 |
1,22 | 12,35 | 10 | 69 |
1,23 | 12,4 | 10,2 | 75 |
1,24 | 12,47 | 10,3 | 81 |
1,25 | 12,5 | 10,5 | 87 |
1,26 | 12,6 | 10,6 | 94 |
1,27 | Не менее 12,66 | 10,8 | 100 |
Не всегда возможно создать идеальные условия для зарядки и измерения плотности электролита.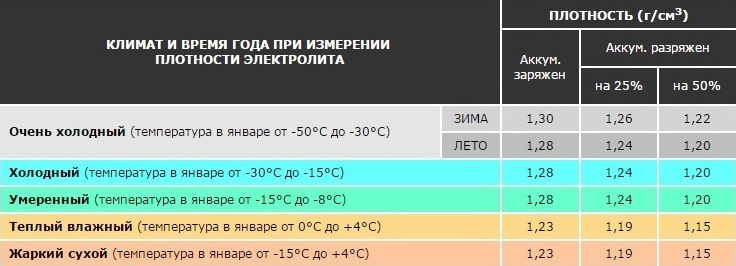 В большинстве случаев применяют поправки. Для этого пользуются таблицей приведения полученных измерений.
В большинстве случаев применяют поправки. Для этого пользуются таблицей приведения полученных измерений.
Температура электролита от и до, °С | Температурная поправка, г/см |
+ 47 + 50 | + 0,02 |
+ 33 + 46 | + 0,01 |
+ 18 + 32 | 0 |
+ 4 + 17 | — 0,01 |
+ 3 – 10 | — 0,02 |
– 11 – 25 | — 0,03 |
– 26 – 39 | -0,04 |
– 40 – 50 | -0,05 |
На что влияет плотность электролита в аккумуляторе
Отрицательно влияют на аккумулятор колебания плотности в обе стороны.
При повышенной бурный химический процесс ведет к выкипанию воды и разрушению пластин. Необходимо постоянно доливать дистиллированную воду.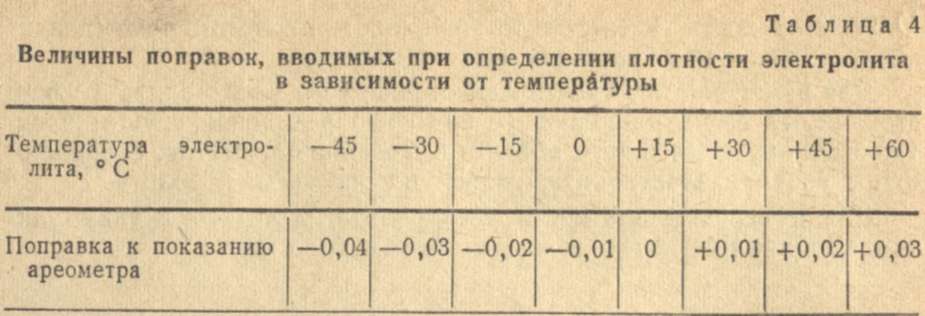 Срок эксплуатации АКБ резко снижается.
Срок эксплуатации АКБ резко снижается.
Низкая затрудняет пуск двигателя, а при отрицательной температуре электролит может попросту замерзнуть. В теплый период года затруднения можно не заметить, но зимой стартер не сможет прокрутить двигатель. Электролит плотностью 1,11 замерзает при температуре всег лишь — 10 °С. Аккумулятор с пониженной плотностью полностью не заряжается, что провоцирует сульфатацию пластин.
Соблюсти баланс помогает утвердившаяся практика использования электролита различной плотности в зависимости от климата:
- Очень холодный и в условиях Крайнего Севера 1,3
- Умеренный климат — большая часть РФ от 1,26 до 1,27
- Южные районы страны от 1,23 до 1,25
- Минимально возможное значение 1,23 г/см3
Как следствие, ненормированная плотность приводит к преждевременной сдаче аккумулятора в утиль.
Как поднять плотность электролита
Первое, что необходимо сделать — попробовать поднять плотность полностью зарядив аккумулятор. Открыть пробки, при необходимости долить дистиллированной воды и подключить зарядное устройство. Полная зарядка может привести к следующим результатам:
Открыть пробки, при необходимости долить дистиллированной воды и подключить зарядное устройство. Полная зарядка может привести к следующим результатам:
- Плотность во всех банках одинакова.
- Во всех ниже нормы.
- Различается более на 0,1 г/см3 и более.
В первом случае каких либо действий не требуется.
Во втором случае потребуется специфическая зарядка. На поверхности свинцовых пластин уже хорошо потрудившихся аккумуляторов откладывается сульфат свинца. В таком состоянии батарею невозможно зарядить полностью. Её необходимо разрядить и провести зарядку импульсным устройством автоматически переключив его на Десульфатацию.
Обычным устройством это сделать труднее и процесс длится дольше. Для этого на 2 часа установить ток зарядки в 1/10 от ёмкости АКБ. Например для аккумулятора 65 Ач, ток зарядки выставить 6,5 А. После этого снизить ток до 2 А и заряжать 8 – 12 часов. Дать отстояться батарее до комнатной температуры измерить плотность.
Десульфатация обычно проводится в два – три цикла. Отрицательный результат говорит о том, что с АКБ придётся расстаться. Можно ещё попробовать полностью слить электролит, промыть дистиллированной водой и залить новый. Но этого обычно хватает ненадолго.
В третьем случае, когда плотность в банках разница более чем на 0,1 надо попробовать провести десульфатацию. Не помогло – откорректировать. Для этого приобрести корректирующий электролит плотностью 1,33 – 1,4 и дистиллированную воду. В банках с ненормальной плотностью откачать по 20 мл электролита. Для повышения добавить корректирующий, для снижения дистиллят. Зарядить 30 минут, дать отстояться ещё полчаса и замерить. Скорее всего к успеху приведут несколько корректировок.
Усилия ни к чему не приведут, а аккумулятор окажется непригоден при буром цвете электролита. В этом случае можно не предпринимать никаких действий.
Не сильно изношенным аккумуляторам десульфатация и корректировка значительно продлевает жизнь. Если усилия не увенчались успехом, то с батарей нужно расстаться немедленно и без сожаления. Иначе непредвиденный отказ станет неприятным сюрпризом.
Если усилия не увенчались успехом, то с батарей нужно расстаться немедленно и без сожаления. Иначе непредвиденный отказ станет неприятным сюрпризом.
Срок службы АКБ при условии соблюдения элементарных правил до пяти лет. В автомобиле нужно контролировать напряжение, не допускать чрезмерного и нулевого заряда батареи. Периодически заряжать и следить за плотностью электролита. При таком отношении аккумулятор служит долго и безотказно.
Справочные таблицы по автомобильным аккумуляторам, электролитам
Приведены полезные справочные таблицы по автомобильным аккумуляторам, электролитам, будут полезны для тех кто использует и обслуживает свинцовые аккумуляторные батареи.
Таблица 1. Удельное сопротивление электролита в зависимости от плотности и температуры.
| Температура, градусов С | Удельное сопротивление ом»см Минимальное удельное сопри плотности г/см3 противление, ом*см | ||||
| 1,105 | 1,184 | 1,265 | 1,353 | ||
| +30 | 1,596 | 1,180 | 1,140 | 1,312 | 1,129 (1,236) |
| +25 | 1,689 | 1,261 | 1,231 | 1,422 | 1,213 (1,233) |
| +20 | 1,800 | 1,357 | 1,334 | 1,549 | 1,310 (1,228) |
| +10 | 2,090 | 1,606 | 1,602 | 1,885 | 1,562 (1,222) |
| 0 | 2,510 | 1,961 | 1,998 | 2,371 | 1,928 (1,213) |
| -10 | — | 2,500 | 2,600 | 3,100 | 2,480 (1,206) |
| -20 | — | 3,350 | 3,570 | 4,310 | 3,340 (1,198) |
| -30 | — | — | 5,290 | 6,350 | — |
| -40 | — | — | 8,390 | 9,890 | — |
Примечание. В столбце Минимальное удельное сопротивление в скобках указана плотность электролита, имеющего минимальное сопротивление при данном значении температуры.
В столбце Минимальное удельное сопротивление в скобках указана плотность электролита, имеющего минимальное сопротивление при данном значении температуры.
Таблица 2. Температура замерзания электролита разной плотности.
| Плотность электролита, приведенная к температуру+15 аС, | Температура замерзания электролита, °С | Плотность электролита, приведенная к температуру +15 *С, | Температура замерзания электролита, °С |
| 1,050 | -3,0 | 1,250 | -50,0 |
| 1,075 | -5,0 | 1,260 | -54,0 |
| 1,100 | -7,0 | 1,270 | -58,0 |
| 1,125 | -10,0 | 1,275 | -59,0 |
| 1,150 | -14,0 | 1,280 | -68,0 |
| 1,175 | -19,0 | 1,300 | -68,0 |
| 1,200 | -25,0 | 1,310 | -66,0 |
| 1,225 | -37,0 | 1,400 | -49,0 |
| 1,230 | -39,0 | 1г550 | -38,0 |
| 1,240 | -45,0 | 1,800 | +6,0 |
Таблица 3. Приготовление электролита заданной плотности по объему и массе серной кислоты.
Приготовление электролита заданной плотности по объему и массе серной кислоты.
| Р, г/см3 | Количество серной кислоты | Р, г/см3 | Количество серной кислоты | ||
| мл | г | мл | г | ||
| 1,21 | 23,0 | 39,7 | 1,31 | 40,3 | 67,5 |
| 1,22 | 24,4 | 42,1 | 1,32 | 42,2 | 70,7 |
| 1,23 | 25,9 | 44,5 | 1,33 | 44,3 | 73,9 |
| 1,24 | 27,6 | 47,1 | 1,34 | 46,6 | 77,3 |
| 1,25 | 29,2 | 49,7 | 1,35 | 48,7 | 80,8 |
| 1,26 | 30,9 | 52,4 | 1,36 | 51,3 | 84,5 |
| 1,27 | 32,6 | 52,7 | 1,37 | 53,6 | 88,3 |
| 1,28 | 34,4 | 58,4 | 1,38 | 56,0 | 91,9 |
| 1,29 | 36,2 | 61,3 | 1,39 | 58,7 | 96,1 |
| 1,30 | 38,1 | 64,2 | 1,40 | 61,3 | 100. 0 0 |
Примечания. 1. Таблица составлена для плотности электролита, приведенной к температуре +15 °С. 2. Для получения электролита заданной плотности к исходному количеству 100 мл (при приготовлении электролита по объему) или 100 г (при приготовлении электролита по массе) дистилированной воды должно быть добавлено указанное в соответвующем столбце таблицы количество (в мл или в г) серной кислоты плотностью 1,840 г/см .
Таблица 4. Максимально допустимое содержание некоторых примесей.
| Вещество | Примеси | |||
| марганец, мышьяк | Железо | Хлористые соединения | Оксиды азота | |
| Серная кислота: марки А | 0,00005 | 0,005 | 0,0005 | 0,00005 |
| марки Б | 0,0001 | 0,012 | 0,0001 | |
| Дистиллированная вода | — | 0,5 | 5,5 | — |
| Электролит | 0,001 | 0,1 | 0,001 | — |
Примечания. 1. Содержание примесей указано для серной кислоты -в %, для дистиллированной воды и электролита — в мг/л. 2. Содержание меди в серной кислоте и дистиллированной воде не допускается. Допускается наличие меди в электролите в количестве не более 0,01 мг/л.
1. Содержание примесей указано для серной кислоты -в %, для дистиллированной воды и электролита — в мг/л. 2. Содержание меди в серной кислоте и дистиллированной воде не допускается. Допускается наличие меди в электролите в количестве не более 0,01 мг/л.
Таблица 5. Корректировка плотности электролита.
| Имеющаяся плотность электролита 1,25 Г/см3 | Требуемая плотность | |||||||||||
| 1,25 Г/см3 | 1,27 Г/см3 | 1,29 Г/смЗ | 1,31 Г/смЗ | |||||||||
| -Э | +КЭ | +В | -Э | +КЭ | +В | -Э | +КЭ | +В | -Э | +КЭ | +В | |
| 1.24 | 61 | 62 | — | 173 | 175 | — | 252 | 256 | — | — | — | — |
| 1,25 | — | — | — | 118 | 119 | — | 215 | 219 | — | — | — | — |
| 1,26 | 39 | — | 40 | 65 | 66 | — | 177 | 180 | — | 290 | 294 | — |
| 1,27 | 78 | — | 80 | — | — | — | 122 | 124 | — | 246 | 249 | — |
| 1,28 | 117 | — | 120 | 40 | — | 42 | 63 | 64 | — | 198 | 201 | — |
| 1,29 | 157 | — | 161 | 75 | — | 78 | — | — | — | 143 | 145 | — |
| 1,30 | — | — | — | 109 | — | 113 | 36 | — | 37 | 79 | 81 | — |
| 1,31 | — | — | — | 143 | — | 148 | 72 | — | 76 | — | — | — |
Примечание. Таблица составлена в расчете на 1 л электролита. В столбцах таблицы применены следующие обозначения: -Э — отобрать электролита; + КЭ — долить концентрированного электролита с плотностью 1,4 г/см3; +В — долить дистиллированной воды; Объемы даны в см3.
Таблица составлена в расчете на 1 л электролита. В столбцах таблицы применены следующие обозначения: -Э — отобрать электролита; + КЭ — долить концентрированного электролита с плотностью 1,4 г/см3; +В — долить дистиллированной воды; Объемы даны в см3.
Литература: В. Ю. Грачев — Как продлить срок службы аккумулятора.
Плотность электролита в аккумуляторе — способы повышения плотности электролита
Аккумуляторная батарея – один из основных элементов автомобиля, отвечающих за пуск двигателя. Значение аккумулятора сложно переоценить, ведь без него невозможно завести мотор, а, значит, машина своим ходом передвигаться не сможет. Именно поэтому АКБ требует к себе особого внимания, исключающего возникновение неприятных ситуаций в виде невозможности совершить запланированную поездку. При этом стоит отметить, что для поддержания работоспособности это важного источника питания не требуется предпринимать каких-то сверхусилий, а достаточно выполнять лишь небольшой комплекс профилактических мер.
Свинцовая аккумуляторная батарея представляет собой гальванический элемент, внутри которого химическая энергия в результате протекающих реакций преобразуется в электрическую. Этот процесс невозможен без электролита – раствора кислоты, обеспечивающего движение заряженных частиц между погруженными в него электродами. Как правило, электролит представляет собой водный раствор серной кислоты определенной плотности. Именно такой параметр как плотность электролита оказывает значительное влияние на работоспособность аккумулятора, поэтому периодически его нужно контролировать.
Измерение плотности электролита в аккумуляторе
Измерить плотность залитого в свинцовый аккумулятор электролита не так уж сложно, однако есть определенные нюансы, связанные с особенностями устройства и принципом работы АКБ. Перечислим некоторые важные моменты, которые надо учесть:
- Осуществить процедуру измерения плотности получится только в случае с так называемым обслуживаемым аккумулятором, который предоставляет доступ к банкам (секциям) с электролитом посредством закрытых крышками заливных отверстий.
 Как раз через эти отверстия (обычно их число равно шести, как и количество секций) и осуществляется забор состава для замера плотности.
Как раз через эти отверстия (обычно их число равно шести, как и количество секций) и осуществляется забор состава для замера плотности. - В процессе своей работы автомобильная аккумуляторная батарея постоянно заряжается и разряжается. Разряд происходит при прокручивании стартера, а заряд – при уже заведенном двигателе от генератора. В зависимости от степени заряженности меняется и плотность электролита. Значения могут колебаться в пределах 0.15-0.16 г/см3. Важно отметить, что автомобильный генератор не способен полностью зарядить аккумуляторную батарею. При штатной работе на машине потенциал АКБ используется только на 80-90%. Полный заряд может обеспечить только внешнее зарядное устройство, к которому обязательно придется прибегнуть перед осуществлением замера плотности электролита.
- Плотность электролита зависит от его температуры. Обычно замер производится при температуре +25 °С, в противном случае делаются поправки.
Допустим, все вышеперечисленные условия приняты во внимание, и есть возможность приступить непосредственно к замеру плотности. Для этого понадобится специальный прибор – денсиметр, который состоит из ареометра, резиновой груши и стеклянной трубки с наконечником. Прибор вводится в банку аккумулятора через заливное отверстие, а затем осуществляется засасывание электролита с помощью резиновой груши. Оно происходит до тех пор, пока ареометр не всплывет. Показания считываются после того, как прекратятся колебания ареометра и появится возможность определения точного значения. Отсчет показаний производится по шкале, при этом взгляд должен находиться на уровне поверхности жидкости.
Для этого понадобится специальный прибор – денсиметр, который состоит из ареометра, резиновой груши и стеклянной трубки с наконечником. Прибор вводится в банку аккумулятора через заливное отверстие, а затем осуществляется засасывание электролита с помощью резиновой груши. Оно происходит до тех пор, пока ареометр не всплывет. Показания считываются после того, как прекратятся колебания ареометра и появится возможность определения точного значения. Отсчет показаний производится по шкале, при этом взгляд должен находиться на уровне поверхности жидкости.
Полученное значение должно входить в диапазон 1.25-1.27 г/см3, если автомобиль эксплуатируется в средней полосе. В холодной климатической зоне (средняя месячная температура января ниже -15 °С) показатель должен находиться в интервале 1.27-1.29 г/см3. Проверять плотность электролита на соответствие этим числам нужно в каждой из шести банок аккумулятора. Показания не должны отличаться более чем на 0.01 г/см3, иначе потребуется их корректировка.
Как мы уже говорили, плотность электролита изменяется в зависимости от температуры. Это значит, что зимой и летом жидкость в одном и том же полностью исправном аккумуляторе будет иметь разную плотность. О том, насколько будут разниться показания, дает представление приведенная ниже таблица.
| Температура электролита, °С | Поправка к показанию денсиметра, г/см3 | Температура электролита, °С | Поправка к показанию денсиметра, г/см3 |
|---|---|---|---|
| -55…-41 | -0.05 | +5…+19 | -0.01 |
| -40…-26 | -0.04 | +20…+30 | 0 |
| -25…-11 | -0.03 | +31…+45 | +0.01 |
| -10…+4 | -0.02 | +46…+60 | +0.02 |
Зависимость температуры замерзания электролита от его плотности демонстрирует еще одна таблица. На основе этих данных можно установить оптимальную плотность электролита для конкретных климатических условий. Нижняя граница подобранного интервала должна гарантировать, что электролит не замерзнет даже при самых сильных холодах и обеспечит требуемое для прокручивания стартера усилие. В то же время чрезмерно завышать плотность тоже нельзя, так как на положительных электродах аккумулятора начинают ускоряться коррозионные процессы, приводящие к сульфатации пластин.
| Плотность электролита при 25 °С, г/см3 | Температура замерзания, °С | Плотность электролита при 25 °С, г/см3 | Температура замерзания, °С |
|---|---|---|---|
| 1.09 | -7 | 1.22 | -40 |
| 1.10 | -8 | 1.23 | -42 |
| 1.11 | -9 | 1.24 | -50 |
| 1.12 | -10 | 1.25 | -54 |
| 1.13 | -12 | 1.26 | -58 |
| 1.14 | -14 | 1.27 | -68 |
| 1.15 | -16 | 1.28 | -74 |
| 1.16 | -18 | 1.29 | -68 |
| 1.17 | -20 | 1.30 | -66 |
| 1.18 | -22 | 1.31 | -64 |
| 1.19 | -25 | 1.32 | -57 |
| 1.20 | -28 | 1.33 | -54 |
| 1.21 | -34 | 1.40 | -37 |
Причины изменения плотности электролита
Зафиксированные в результате измерения плотности значения не всегда соответствуют требуемым показателям. Расхождения могут касаться как отдельных банок аккумулятора, так и всех вместе. Если плотность завышена, то нужно обратить в первую очередь внимание на уровень электролита. Низкий уровень в большинстве случае является последствием электролиза, приводящего к разложению входящей в состав электролита воды на водород и кислород. Этот процесс выражается в появлении на поверхности жидкости пузырьков, что обычно происходит при зарядке аккумулятора. Частое «кипение» может приводить к снижению концентрации воды, и этот вопрос решается ее простым добавлением. Доливать в аккумулятор стоит только дистиллированную воду, контролируя при этом уровень электролита. Подробнее о корректировке плотности электролита поговорим ниже.
Если с повышенной плотностью все ясно, то с пониженной ситуация несколько сложнее. В теории, одной из причин понижения плотности, может быть то, что по какой-то причине в электролите уменьшилась доля серной кислоты. Однако на практике это маловероятно, так как сама по себе она обладает высокой температурой кипения, исключающей испарение даже при интенсивном нагреве, который происходит, например, при зарядке аккумуляторной батареи. Более распространенной причиной снижения плотности электролита является так называемая сульфатация пластин, заключающаяся в образовании на электродах сульфата свинца (PbSO4). На самом деле, это естественный процесс, происходящий при каждом разряде АКБ. Но дело в том, что при нормальном режиме работы после разряда аккумулятора обязательно происходит его заряд (на автомобиле аккумулятор постоянно подзаряжается от генератора). Заряд сопровождается обратным преобразованием сульфата свинца в свинец (на катоде) и двуокись свинца (на аноде) – в те активные вещества, которые составляют основу электродов и непосредственно участвуют в химическом процессе внутри аккумуляторной батареи. Если АКБ находится длительное время в разряженном состоянии, сульфат свинца кристаллизуется, безвозвратно теряя способность участвовать в химических реакциях. Это очень неприятный процесс, в результате которого аккумулятор уже не получится зарядить полностью даже при использовании внешнего зарядного устройства ввиду того, что не вся площадь пластин задействована в работе. Так как аккумулятор не заряжается до конца, то и плотность электролита не восстанавливается до своих исходных значений. По сути, здесь уже идет разговор об устранении нарушений в нормальном функционировании аккумулятора.
Частичную сульфатацию пластин можно устранить с помощью контрольно-тренировочных циклов, заключающихся в заряде и последующем разряде батареи до определенного уровня. Большинство современных зарядных устройств имеют такую функцию, поэтому имеет смысл ей воспользоваться, особенно если аккумулятор по какой-то причине долго находился в разряженном состоянии. Процедура десульфатации весьма длительная и может занять до нескольких дней. Если она не принесла результата, то крайней мерой является увеличение плотности с помощью добавления корректирующего электролита (плотность около 1.40 г/см3). Такой способ можно рассматривать только как временное решение проблемы, потому что причина как таковая не устраняется.
Как поднять плотность электролита
Понизить или повысить плотность электролита в аккумуляторе можно путем откачивания его определенного количества, и долива взамен дистиллированной воды или электролита с повышенной плотностью (корректирующего). Данная процедура требует больших временных затрат, так как цикл откачки-долива может повторяться несколько раз, пока не будет достигнуто требуемое значение. После каждой корректировки необходимо поставить аккумулятор на зарядку (минимум на 30 минут), а затем дать ему постоять (0.5-2 часа). Эти действия необходимы для лучшего перемешивания электролита и выравнивания плотности в банках.
В процессе поднятия (или понижения) плотности электролита не стоит забывать и о контроле его уровня. Он осуществляется стеклянной трубкой с двумя отверстиями по краям. Один край погружается в электролит до тех пор, пока не упрется в предохранительную сетку. Далее верхний конец закрывается пальцем, а сама трубка осторожно поднимается вместе со столбиком жидкости внутри. Высота этого столбика указывает на расстояние от верхней кромки пластин до поверхности залитого электролита. Оно должно составлять 10-15 мм. Если аккумулятор имеет индикатор (тубус) или прозрачный корпус с нанесенными метками минимума и максимума, то контролировать уровень значительно проще.
Не стоит забывать, что все операции с электролитом необходимо выполнять осторожно, используя защитные перчатки и очки.
Как измерить плотность электролита – видео
Приготовление электролита для аккумуляторных батарей
Какова зависимость плотности электролита от климатической зоны?
Электролит приготовляется путём разведения аккумуляторной серной кислотыплотностью 1,83-1,84 г/см3 (ГОСТ 667–73) в дистиллированной воде с допустимыми примесями.
Химическая чистота электролита оказывает существенное влияние наработоспособность и срок службы батарей. Загрязнение электролита такими вредными примесями, как железо, марганец, хлор и другие, приводит к повышенному саморазряду батарей, снижению отдаваемой ёмкости, разрушению электродов ипреждевременному выходу батареи из строя. Поэтому для приготовления электролита запрещается применять техническую серную кислоту и загрязненную (недистиллированную) воду. При приготовлении электролита, приведении батарей в рабочее состояние и техническом обслуживании батарей в процессе эксплуатациинеобходимо пользоваться только специальной посудой (стойкой к действию серной кислоты) и соблюдать чистоту.
В исключительных случаях при отсутствии дистиллированной воды для приготовления электролита допускается использование снеговой или дождевой воды, предварительно профильтрованной через чистое полотно для очистки от механических загрязнений. Нельзя собирать воду с железных крыш и в железные сосуды.
Электролит следует готовить в стойкой к действию серной кислоты посуде (эбонитовой, фаянсовой, керамической и т.п.), соблюдая при этом особую осторожность и правила техники безопасности. Применение железной, медной или цинковой посуды категорически запрещается!
Аккумуляторные батареи в зависимости от климатической зоны заливаются электролитом, имеющим плотность, указанную в графе 4 таблицы №1: «Плотность электролита при приведении аккумуляторных батарей в рабочее состояние с учётом климатических зон». Электролит требуемой плотности может быть приготовлен непосредственно из кислоты плотностью 1,83-1,84 г/см3 и дистиллированной воды. Однако при непрерывном вливании кислоты в воду происходит сильный разогрев раствора (80-90°C) и требуется длительное время для его остывания. Поэтому для приготовления электролита требуемой плотности более удобно применять раствор кислоты промежуточной плотности 1,40 г/см3, так как в этом случае значительносокращается время охлаждения электролита.
Раствор серной кислоты плотностью 1,40 г/см3, приведённой к 25°C, должен готовиться заранее и после охлаждения храниться в стеклянной или полиэтиленовой посуде.
Количество воды, кислоты или её раствора плотностью 1,40 г/см3, необходимое для приготовления 1 л электролита, указано в таблице №2: «Количество дистиллированной воды, кислоты или её раствора плотностью 1,40 г/см3, необходимое для приготовления 1 л электролита требуемой плотности при температуре 25°C».
Таблица №1:
Плотность электролита при приведении аккумуляторных батарей
в рабочее состояние с учётом климатических зон
| Климатические зоны и районы | Средняя месячная температура воздуха в январе, °C | Время года | Плотность электролита, приведённая к 25°C, г/см3 | |
| заливаемого | полностью заряженной батареи | |||
| 1 | 2 | 3 | 4 | 5 |
| очень холодная | от –50 до –30 | зима | 1,28 | 1,30 |
| лето | 1,24 | 1,26 | ||
| холодная | от –30 до –15 | круглый год | 1,26 | 1,28 |
| умеренная | от –15 до –4 | круглый год | 1,24 | 1,26 |
| тёплая и влажная | от +4 до + 6 | круглый год | 1,20 | 1,22 |
| жаркая | от –15 до +4 | круглый год | 1,22 | 1,24 |
Расчёт проводится в такой последовательности: определяется общий объём электролита для заливки нужного числа батарей, затем подсчитывается количество дистиллированной воды и раствора кислоты плотностью 1,40 г/см3, нужное для приготовления электролита заданной плотности для заливки всех батарей.
Таблица №2:
Количество дистиллированной воды, кислоты или её раствора
плотностью 1,40 г/см3, необходимое для приготовления 1 л электролита
требуемой плотности при температуре 25°C
| Требуемая плотность электролита, г/см3 | Количество воды, л | Количество серной кислоты плотностью 1,83 г/см3 | Количество воды, л | Количество раствора серной кислоты плотностью 1,40 г/см3, л |
|
| л | кг | ||||
| 1,20 | 0,859 | 0,200 | 0,365 | 0,547 | 0,476 |
| 1,21 | 0,849 | 0,211 | 0,385 | 0,519 | 0,500 |
| 1,22 | 0,839 | 0,221 | 0,405 | 0,491 | 0,524 |
| 1,23 | 0,829 | 0,231 | 0,424 | 0,465 | 0,549 |
| 1,24 | 0,819 | 0,242 | 0,444 | 0,438 | 0,572 |
| 1,25 | 0,809 | 0,253 | 0,464 | 0,410 | 0,601 |
| 1,26 | 0,800 | 0,263 | 0,484 | 0,382 | 0,624 |
| 1,27 | 0,791 | 0,274 | 0,503 | 0,357 | 0,652 |
| 1,28 | 0,781 | 0,285 | 0,523 | 0,329 | 0,679 |
| 1,29 | 0,772 | 0,295 | 0,541 | 0,302 | 0,705 |
| 1,31 | 0,749 | 0,319 | 0,585 | 0,246 | 0,760 |
1). Если требуется приготовить электролита больше или меньше одного литра, необходимо взять количество воды и кислоты или раствора, кратное или долевое к указанному в таблице. Например, для приготовления 5 л электролита количество воды и кислоты, приведённое в таблице, нужно умножить на 5, а для приготовления 0,5 л – умножить на 0,5.
2). Аккумуляторная серная кислота учитывается на складах и выдаётся потребителям не в литрах, а в килограммах, поэтому при составлении заявки и получении кислоты со склада надо знать потребное её количество в килограммах. Можно также определить нужное количество кислоты в килограммах, умножив рассчитанное её количество в литрах на 1,83.
При возникновении сомнений относительно температуры замерзания электролита обратитесь к таблице №3
Таблица №3:
Температура замерзания электролита
| Плотность электролита при 25°C, г/см3 |
Температура замерзания, °C |
Плотность электролита при 25°C, г/см3 |
Температура замерзания, °C |
| 1,09 | –7 | 1,22 | –40 |
| 1,10 | –8 | 1,23 | –42 |
| 1,11 | –9 | 1,24 | –50 |
| 1,12 | –10 | 1,25 | –54 |
| 1,13 | –12 | 1,26 | –58 |
| 1,14 | –14 | 1,27 | –68 |
| 1,15 | –16 | 1,28 | –74 |
| 1,16 | –18 | 1,29 | –68 |
| 1,17 | –20 | 1,30 | –66 |
| 1,18 | –22 | 1,31 | –64 |
| 1,19 | –25 | 1,32 | –57 |
| 1,20 | –28 | 1,33 | –54 |
| 1,21 | –34 | 1,40 | –37 |
Заливка батарей электролитом
Температура электролита, заливаемого в аккумуляторные батареи, должна быть не выше 30°C и не ниже 15°C. Непосредственно перед заливкой электролита вывёртывают вентиляционные пробки и удаляют детали или элементы пробки, герметизирующие вентиляционные отверстия. Если в горловине под пробкой имеется герметизирующий диск, его необходимо удалить. Затем постепенно, небольшой струёй заливают электролит до тех пор, пока поверхность электролита не коснётся нижнего торца тубуса горловины крышки.
Завышенная плотность электролита приводит к снижению срока службы аккумулятора.Заниженная плотность электролита приводит к снижению ЭДС и затруднению пуска двигателя, а также к повышению опасности замерзания электролита в зимний период эксплуатации.
Сколько должна быть плотность электролита
Анализ электролита из аккумулятора и замер его плотности помогает владельцу автомобиля судить о его химическом состоаянии. Плотность кислотосодержащей жидкости внутри банок АКБ зависит от очень многих факторов, поэтому важно уметь правильно определять значение этого параметра в зависимости от условий эксплуатации автомобиля.
Что такое плотность электролита
Плотностью любого физического тела или жидкости считается, как отношение массы вещества к занимаемому объёму. Этот параметр для жидкости, заливаемый в банки свинцового аккумулятора, выражается в граммах на кубический сантиметр.
Определить плотность вещества визуально не представляется возможным поэтому для измерения этого параметра используют специальное устройство.
Чем можно померить плотность электролита
Замерить концентрацию электролита можно с помощью медицинского шприца объёмом 10 см3 и точных цифровых весов. Работа выполняется следующим образом:
- Пустой шприц без иглы кладётся на весы и показания измерительного прибора записываются в блокнот.
- На шприц одевается тонкая резиновая трубка, которая опускается в одну из банок аккумулятора.
- В шприц набирается ровно 10 мл кислотосодержащей жидкости.
- Шприц, без резиновой трубки, кладётся на весы и результат измерения снова записывается.
- Производятся несложные арифметические вычисления:
- Из массы шприца с электролитом вычитается масса пустого медицинского изделия.
- Получившееся значение делится на 10.
В результате получится точное значение плотности в одной банке. Таким образом нужно измерить этот показатель во всех банках.
Каждый раз осуществлять измерение таким образом невыгодно ни по затраченному времени, ни по удобству выполнения процедуры. Намного удобнее и проще произвести измерение плотности кислотосодержащей жидкости аккумулятора с помощью ареометра.
Он состоит из специальной колбы с находящимся внутри поплавком. Внутренняя деталь поплавка имеет свинцовую огрузку поэтому при закачивании в ёмкость жидкости, эта деталь устанавливается строго в вертикальном положении. На поверхности поплавка имеется градуированная шкала, по которой можно узнать точное значение плотности электролита аккумулятора.
Почему может повыситься или понизиться плотность электролита
Изменение концентрации электролита может произойти по следующим причинам:
- При изменении уровня заряженности батареи (прямая корреляция).
- При негерметичном корпусе аккумулятора. Если в нем есть трещины или пробки плохо прикручены, то будет уходить жидкость и при доливке дистиллированной воды плотность будет снижаться.
- Добавление электролита вместо дистиллированной воды, при испарении жидкости в летнее время (увеличение плотности).
- Неправильно приготовленный электролит. Наиболее часто такая ситуация может возникнуть при самостоятельном добавлении кислоты в воду.
- Интенсивное испарение воды из банок в летний период.
Как правило, установить причину изменения концентрации электролита в домашних условиях не составляет большого труда, но чтобы правильно определить величину такого отклонения, необходимо знать, какое значение является эталонным.
Какая плотность электролита в аккумуляторе должна быть
Технические требования по плотности электролита могут существенно отличаться для кислотных аккумуляторов, эксплуатируемых в различных климатических условиях.
Какая должна быть плотность электролита зимой
Необходимость в поддержании концентрации серной кислоты в электролите на более высоком уровне обусловлено опасностью замерзания жидкости при низких температурах воздуха. Полностью заряженный аккумулятор должен обладать плотностью смеси 1,27 – 1,28 г/см3. Тогда он легко переносит морозы до минус 70 градусов.
При падении плотности до 1,20 г/см3 жидкость гарантированно превратиться в лёд уже при температуре минус 30 градусов. В результате кристаллизации, жидкость значительно увеличивается в объёме, поэтому при эксплуатации машины в зимний период необходимо тщательно следить за тем, чтобы аккумулятор был полностью заряжен. Невыполнение этого требования приведёт к разрушению внутренних пластин устройства, что станет причиной полной неработоспособности аккумуляторной батареи.
| Плотность электролита (г/см3) | Степень заряженности (%) | Замерзание электролита © |
|---|---|---|
| 1,27 | 100 | -60 |
| 1,26 | 94 | -55 |
| 1,25 | 87,5 | -50 |
| 1,24 | 81 | -46 |
| 1,23 | 75 | -42 |
| 1,22 | 69 | -37 |
| 1,21 | 62,5 | -32 |
| 1,2 | 56 | -27 |
| 1,19 | 50 | -24 |
| 1,18 | 44 | -18 |
| 1,17 | 37,5 | -16 |
| 1,16 | 31 | -14 |
| 1,15 | 25 | -13 |
| 1,14 | 19 | -11 |
| 1,13 | 12,56 | -9 |
| 1,12 | 6 | -8 |
| 1,11 | 0,0 | -7 |
Какая должна быть плотность электролита летом
Летом исключается вероятность образования льда внутри банок аккумулятора, но в обслуживаемых аккумуляторных батареях плотность может произвольно повышаться за счёт испарения воды.
Эксплуатация АКБ с повышенной концентрацией электролита приводит к существенному снижению эксплуатационного срока батареи, вследствие более агрессивного воздействия кислотосодержащей жидкости на сепараторы. Чтобы избежать подобных негативных последствий, в обслуживаемых моделях, следует производить регулярный контроль уровня электролита в летний период и при необходимости разбавлять смесь дистиллированной водой.
Как проверить плотность аккумулятора
Если плотность электролита необходимо замерять регулярно, то без ареометра не обойтись. Осуществляется процедура замера следующим образом:
- Выкручиваются пробки аккумуляторной батареи.
- Узкая часть вводится в банку.
- Груша, находящаяся в верхней части прибора, сжимается. Затем необходимо отпустить резиновую верхнюю часть, чтобы образовавшееся отрицательное давление способствовало наполнению резервуара измерительного прибора кислотосодержащей жидкостью.
Определяется концентрация электролита по его уровню на градуированной шкале поплавка. Таким несложным методом производится измерение в каждой банке аккумуляторной батареи.
Как измерить плотность в необслуживаемом аккумуляторе
Необслуживаемые аккумуляторы не имеют в своей конструкции закрываемых технологических отверстий. Это означает, что производителем не была предусмотрена возможность самостоятельного измерения плотности электролита в течение всего срока службы АКБ.
Для умельцев такая особенность конструкции необслуживаемого аккумулятора не является непреодолимой преградой на пути улучшения состояния устройства, в работе которого наблюдаются значительные отклонения от нормы. Они превращают необслуживаемую модель аккумулятора в обслуживаемую при помощи дрели, которым в середине каждой банки делаются отверстия значительные отверстия.
В отверстиях метчиком нарезается резьба, а для изготовления пробки используется пластиковый прут подходящего диметра, на котором с помощью плашки делается определённого диаметра и шага резьба. Получившуюся пластиковую шпильку разрезают на 6 отрезков длинной по 3 – 4 см. Самодельные пробки вкручиваются в сделанные ранее отверстия и далее батарея эксплуатируется как обслуживаемая.
Есть другой популярные метод. Скраю, в крышке просвердивают 6 маленьких отверстий, через которые можно будет получить полноценный доступ к жидкости в каждой банке аккумулятора.
Замерив электролит таким образом, герметичность элемента питания можно восстановить при помощи силиконового герметика. Чтобы при проведении герметизации вещество не попало внутрь аккумулятора, рекомендуется с помощью самодельного проволочного крючка попытаться выпрямить часть пластмассы, которая была продавлена в процессе изготовления отверстия.
При механическом повреждении корпуса аккумулятор слетает с гарантией, и в случае допущения ошибки она может выйти из строя. Мусор провалившийся в банки также может снизить продолжительность жизни батареи.
Как поднять плотность в аккумуляторе
Падает плотность электролита, обычно, при добавлении дистиллированной воды в аккумуляторную батарею, имеющую негерметичный корпус. В этом случае обычно наблюдается разная концентрация в банках. Если плотность в аккумуляторе невозможно выровнять во всех банках до приемлемого значения зарядным устройством, то производят замещения части кислотосодержащей жидкости свежим заводским электролитом. Корректировка плотности электролита выполняется в такой последовательности:
- Из проблемной банки с помощью груши удаляется максимально возможное количество электролита.
- В банку заливается свежая кислотосодержащая смесь.
Если в результате подобных действий в банках не происходит достаточного увеличения плотности, то процедуру следует повторить.
Как понизить плотность АКБ
Работа аккумулятора с повышенной плотностью электролита может негативно отразиться на его работоспособности, поэтому при наличии в банке электролита, концентрация которого выше 1,28 проводят процедуру позволяющую снизить концентрацию серной кислоты.
Процесс понижения плотности производится таким же образом, как и при выполнении процедуры повышения концентрации раствора, но вместо электролита в аккумулятор добавляется дистиллированная вода. То есть, вначале из проблемной банки удаляется часть электролита, а затем объём восполняется химически чистой водой.
Плотность электролита в аккумуляторе очень важный параметр у всех кислотных АКБ, и каждый автовладелец должен знать: какая плотность должна быть, как её проверить, а самое главное, как правильно поднять плотность аккумулятора (удельный вес кислоты) в каждой из банок со свинцовыми пластинами заполненных раствором h3SO4.
Проверка плотности – это один из пунктов процесса обслуживания аккумуляторной батареи, включающий так же проверку уровня электролита и замер напряжения АКБ. В свинцовых аккумуляторах плотность измеряется в г/см3. Она пропорциональна концентрации раствора, а обратно зависима, относительно температуры жидкости (чем выше температура, тем ниже плотность).
По плотности электролита можно определить состояние батареи. Так что если батарея не держит заряд, то следует проверить состояние её жидкости в каждой его банке.
Плотность электролита влияет на емкость аккумулятора, и срок его службы.
Проверяется денсиметром (ареометр) при температуре +25°С. В случае, если температура отличается от требуемой, в показания вносятся поправки, как показано в таблице.
Итак, немного разобрались, что это такое, и что нужно регулярно делать проверку. А на какие цифры ориентироваться, сколько хорошо, а сколько плохо, какой должна быть плотность электролита аккумулятора?
Какая плотность должна быть в аккумуляторе
Выдерживать оптимальный показатель плотности электролита очень важно для аккумулятора и стоит знать, что необходимые значения зависят от климатической зоны. Поэтому плотность аккумулятора должна быть установлена исходя из совокупности требований и условий эксплуатации. К примеру, при умеренном климате плотность электролита должна находиться на уровне 1,25-1,27 г/см3 ±0,01 г/см3. В холодной зоне, с зимами до -30 градусов на 0,01 г/см3 больше, а в жаркой субтропической — на 0,01 г/см3 меньше. В тех регионах, где зима особо сурова (до -50 °С), дабы аккумулятор не замерз, приходится повышать плотность от 1,27 до 1,29 г/см3.
Много автовладельцев задаются вопросом: «Какой должна быть плотность электролита в аккумуляторе зимой, а какой летом, или же нет разницы, и круглый год показатели нужно держать на одном уровне?» Поэтому, разберемся с вопросом более подробно, а поможет это сделать, таблица плотности электролита в аккумуляторе с разделением на климатические зоны.
Также нужно помнить, что, как правило, аккумуляторная батарея, находясь на автомобиле, заряжена не более чем на 80-90 % её номинальной ёмкости, поэтому плотность электролита будет немного ниже, чем при полном заряде. Так что, требуемое значение, выбирается чуть-чуть повыше, от того, которое указано в таблице плотности, дабы при снижении температуры воздуха до максимального уровня, АКБ гарантированно оставался работоспособным и не замерз в зимний период. Но, касаясь летнего сезона, повышенная плотность может и грозить закипанием.
Таблица плотности электролита в аккумуляторе
Таблица плотности составляется относительно среднемесячной температуры в январе-месяце, так что климатические зоны с холодным воздухом до -30 °C и умеренные с температурой не ниже -15 не требуют понижения или повышения концентрации кислоты. Круглый год (зимой и летом) плотность электролита в аккумуляторе не стоит изменять, а лишь проверять и следить, чтобы она не отклонялась от номинального значения, а вот в очень холодных зонах, где столбик термометра часто на отметке ниже -30 градусов (в плоть до -50), корректировка допускается.
Плотность электролита в аккумуляторе зимой
Плотность электролита в аккумуляторе зимой должна составлять 1,27 (для регионов с зимней температурой ниже -35 не менее 1.28 г/см3). Если будет значение ниже, то это приводит к снижению электродвижущей силы и трудного запуска двигателя в морозы, вплоть до замерзания электролита.
Когда в зимнее время плотность в аккумуляторной батареи понижена, то не стоит сразу бежать за корректирующим раствором дабы её поднять, гораздо лучше позаботится о другом – качественном заряде АКБ при помощи зарядного устройства.
Получасовые поездки от дому к работе и обратно не позволяют электролиту прогрется, и, следовательно, хорошо зарядится, ведь аккумулятор принимает заряд лишь после прогрева. Так что разряженность изо дня в день увеличивается, и в результате падает и плотность.
Для новой и исправной АКБ нормальный интервал изменения плотности электролита (полный разряд – полный заряд) составляет 0,15-0,16 г/см3.
Помните, что эксплуатация разряженного аккумулятора при минусовой температуре приводит к замерзанию электролита и разрушению свинцовых пластин!
По таблице зависимости температуры замерзания электролита от его плотности, можно узнать минусовой порог столбика термометра, при котором образовывается лед в вашем аккумуляторе.
Как видите, при заряженности на 100% аккумуляторная батарея замерзнет при -70 °С. При 40% заряде замерзает уже при -25 °С. 10% не только не дадут возможности запустить двигатель в морозный день, но и напрочь замерзнет в 10 градусный мороз.
Когда плотность электролита не известна, то степень разряженности батареи проверяют нагрузочной вилкой. Разность напряжения в элементах одной батареи не должна превышать 0,2В.
Показания вольтметра нагрузочной вилки, B
Степень разряженности батареи, %
Если АКБ разрядилась более чем на 50% зимой и более чем на 25% летом, её необходимо подзарядить.
Плотность электролита в аккумуляторе летом
Летом аккумулятор страдает от обезвоживания, поэтому учитывая то, что повышенная плотность плохо влияет на свинцовые пластины, лучше если она будет на 0,02 г/см3 ниже требуемого значения (особенно касается южных регионов).
В летнее время температура под капотом, где зачастую находится аккумулятор, значительно повышена. Такие условия способствуют испарению воды из кислоты и активности протекания электрохимических процессов в АКБ, обеспечивая высокую токоотдачу даже при минимально допустимом значении плотности электролита (1,22 г/см3 для теплой влажной климатической зоны). Так что, когда уровень электролита постепенно падает, то повышается его плотность, что ускоряет процессы коррозионного разрушения электродов. Именно поэтому так важно контролировать уровень жидкости в аккумуляторной батарее и при его понижении добавить дистиллированной воды, а если этого не сделать, то грозит перезаряд и сульфация.
Если аккумулятор разрядился по невнимательности водителя или другим причинам, следует попробовать вернуть ему его рабочее состояние при помощи зарядного устройства. Но перед тем как заряжать АКБ, смотрят на уровень и по надобности доливают дистиллированную воду, которая могла испариться в процессе работы.
Через некоторое время плотность электролита в аккумуляторе, из-за постоянного разбавления его дистиллятом, снижается, и опускается ниже требуемого значения. Тогда эксплуатация батареи становится невозможной, так что возникает необходимость повысить плотность электролита в аккумуляторе. Но для того, чтобы узнать насколько повышать, нужно знать как проверять эту самую плотность.
Как проверить плотность аккумулятора
Дабы обеспечить правильную работу аккумуляторной батареи, плотность электролита следует проверять каждые 15-20 тыс. км пробега. Измерение плотности в аккумуляторе осуществляется при помощи такого прибора как денсиметр. Устройство этого прибора состоит из стеклянной трубки, внутри которой ареометр, а на концах — резиновый наконечник с одной стороны и груша с другой. Чтобы произвести проверку, нужно будет: открыть пробку банки аккумулятора, погрузить его в раствор, и грушей втянуть небольшое количество электролита. Плавающий ареометр со шкалой покажет всю необходимую информацию. Более детально как правильно проверить плотность аккумулятора рассмотрим чуть ниже, поскольку есть еще такой вид АКБ, как необслуживаемые, и в них процедура несколько отличается — вам не понадобится абсолютно никаких приборов.
Индикатор плотности на необслуживаемой АКБ
Плотность необслуживаемого аккумулятора отображается цветовым индикатором в специальном окошке. Зеленый индикатор свидетельствует, что все в норме (степень заряженности в пределах 65 — 100%), если плотность упала и требуется подзарядка, то индикатор будет черный. Когда в окошке отображается белая или красная лампочка, то нужен срочный долив дистиллированной воды. Но, впрочем, точная информация о значении того или иного цвета в окошке, находится на наклейке аккумуляторной батареи.
Теперь продолжаем далее разбираться, как проверять плотность электролита обычного кислотного аккумулятора в домашних условия.
Проверка плотности электролита в аккумуляторе
Итак, чтобы можно было правильно проверить плотность электролита в аккумуляторной батарее, первым делом проверяем уровень и при необходимости его корректируем. Затем заряжаем аккум и только тогда приступаем к проверке, но не сразу, а после пары часов покоя, поскольку сразу после зарядки или долива воды будут недостоверные данные.
Следует помнить, что плотность напрямую зависит от температуры воздуха, поэтому сверяйтесь с таблицей поправок, рассматриваемой выше. Сделав забор жидкости из банки аккумулятора, держите прибор на уровне глаз – ареометр должен находиться в состоянии покоя, плавать в жидкости, не касаясь стенок. Замер производится в каждом отсеке, а все показатели записываются.
Таблица определения заряженности аккумулятора по плотности электролита.
Безотказная работа аккумулятора зависит от многих факторов. Это напряжение бортовой сети, режим эксплуатации автомобиля и окружающая среда. Но дело ещё и в самой батарее – напряжении на клеммах и плотности электролита. Если вы хотите контролировать состояние своего аккумулятора, то нужно научиться основам его обслуживания. Умение и правильная регулировка плотности электролита – залог стабильной и длительной работы аккумулятора.
Какая плотность электролита должна быть в аккумуляторе
Добраться до электролита, измерить плотность и отрегулировать показатель можно только в обслуживаемых аккумуляторах. Они изготавливаются по технологии WET или иначе мокрых банок. Представляют собой пластиковый корпус, поделенный на 6 отсеков (банок). В отсеках находятся пакеты пластин, залитые электролитом. Каждая банка это отдельный маленький аккумулятор напряжением 2,1 вольт, соединённые последовательно. Поэтому на крайних контактах в сумме получается 12,5 – 12,6 В. Сверху отсеки закрыты крышкой с пробками. Через эти пробки можно контролировать состояние электролита. Внешне всё выглядит как пластиковая коробка с ручкой, пробками и двумя контактами плюс и минус.
Залитые свинцово – кислотные батареи до сих пор остаются самыми распространёнными АКБ (аккумуляторными батареями). Их используют в легковых и гольф автомобилях, газонокосилках и другой садовой технике, грузовиках и на водном транспорте. Имеют две отличительные особенности – низкую цену и необходимость обслуживания. В составе электролита никаких секретов нет, это водный раствор обыкновенной серной кислоты h3SO4.
Показатель плотности измеряют в весе одного кубического сантиметра раствора. В продаже имеется электролит для заливки плотностью — 1,28 г/см 3 и так называемый, корректирующий — 1,33. Для изготовления электролита плотностью 1,28 при температуре 25 °С смешивают 0,285 мл кислоты с 0,781 лм дистиллированной воды.
Оптимальная плотность очень важна для стабильной и долговечной работы аккумулятора. Она зависит от уровня заряда и температуры окружающей среды при измерении. Достоверные данные можно получить только на полностью заряженной батарее с температурой электролита 25 °С.
Немаловажным фактором являются условия эксплуатации. Для жаркого и холодного климата используют батареи с различной плотностью. В условия Крайнего Севера при сильных морозах она должна быть 1,3 и снижаться до 1,23 в жарком климате при высокой температуре. Это связано с поведением электролита при различных температурах. На морозе он должен не замерзнуть и не закипеть в жару. Для эксплуатации в средних климатических условиях допускается плотность 1,27 полностью заряженной АКБ. На разряженной показатель снижается до 1,11 и ниже.
Как проверить плотность электролита аккумулятора
Обслуживаемые АКБ требуют повышенного внимания. Они склонны к выкипанию и разбрызгиванию электролита. Плотность в банках может разнонаправленно меняться. Поэтому замеры необходимо проводить через каждые 15 – 20 тыс. км пробега или весной и осенью.
Для измерения необходим ареометр, очки, резиновые или силиконовые перчатки и старая одежда. Электролит очень агрессивен. В зависимости от чувствительности, при попадании на кожу его можно не почувствовать. А вот глаза и слизистые оболочки нужно беречь. Попадание на одежду на первый взгляд незаметно. Но даже небольшие капли проявят себя. После стирки обнаружатся большие и маленькие дырки на любимых джинсах, рубашке или куртке.
Ареометр – единственный прибор для измерения плотности электролита. Состоит из стеклянной колбы с помещенным внутрь денсиметром. Сверху находится резиновая груша. Денсиметр, это запаянная стеклянная трубка с металлическими шариками в нижней части и утончённым верхом. В утонченной части расположена шкала.
Для измерения нужно открутить пробки. Нажать на грушу и поместить в заливное отверстие кончик ареометра. Отпустить грушу и набрать электролит до всплывания денсиметра. Он не должен касаться донышка и стенок колбы. Ареометр нужно держать в вертикальном положении. Денсиметр будет плавать, на плотность укажет шкала на уровне электролита. Предварительный замер укажет на состояние аккумулятора. Обычно крайние банки разряжены сильнее и плотность в них меньше средних. После замера надо проверить уровень электролита, если необходимо долить дистиллированную воду.
Состояние батареи можно оценить только полностью зарядив её. Заряжаем АКБ и даём отдохнуть пару часов. Зарядка сопровождается кипением и повышением температуры электролита. Для достоверного замера газы должны выйти, температура упасть. После остывания можно проводить измерение. В зависимости от этих результатов можно сделать выводы о состоянии АКБ.
Таблица плотности электролита в аккумуляторе
Состояние можно оценить сопоставив плотность и напряжение аккумулятора, это делают руководствуясь данными таблицы:
Плотность электролита, г/см 3
Напряжение без нагрузки, В
Напряжение под нагрузкой 100 А, В
Не всегда возможно создать идеальные условия для зарядки и измерения плотности электролита. В большинстве случаев применяют поправки. Для этого пользуются таблицей приведения полученных измерений.
Температура электролита от и до, °С
Температурная поправка, г/см 3
На что влияет плотность электролита в аккумуляторе
Отрицательно влияют на аккумулятор колебания плотности в обе стороны.
При повышенной бурный химический процесс ведет к выкипанию воды и разрушению пластин. Необходимо постоянно доливать дистиллированную воду. Срок эксплуатации АКБ резко снижается.
Низкая затрудняет пуск двигателя, а при отрицательной температуре электролит может попросту замерзнуть. В теплый период года затруднения можно не заметить, но зимой стартер не сможет прокрутить двигатель. Электролит плотностью 1,11 замерзает при температуре всег лишь — 10 °С. Аккумулятор с пониженной плотностью полностью не заряжается, что провоцирует сульфатацию пластин.
Соблюсти баланс помогает утвердившаяся практика использования электролита различной плотности в зависимости от климата:
- Очень холодный и в условиях Крайнего Севера 1,3
- Умеренный климат — большая часть РФ от 1,26 до 1,27
- Южные районы страны от 1,23 до 1,25
- Минимально возможное значение 1,23 г/см 3
Как следствие, ненормированная плотность приводит к преждевременной сдаче аккумулятора в утиль.
Как поднять плотность электролита
Первое, что необходимо сделать — попробовать поднять плотность полностью зарядив аккумулятор. Открыть пробки, при необходимости долить дистиллированной воды и подключить зарядное устройство. Полная зарядка может привести к следующим результатам:
- Плотность во всех банках одинакова.
- Во всех ниже нормы.
- Различается более на 0,1 г/см 3 и более.
В первом случае каких либо действий не требуется.
Во втором случае потребуется специфическая зарядка. На поверхности свинцовых пластин уже хорошо потрудившихся аккумуляторов откладывается сульфат свинца. В таком состоянии батарею невозможно зарядить полностью. Её необходимо разрядить и провести зарядку импульсным устройством автоматически переключив его на Десульфатацию.
Обычным устройством это сделать труднее и процесс длится дольше. Для этого на 2 часа установить ток зарядки в 1/10 от ёмкости АКБ. Например для аккумулятора 65 Ач, ток зарядки выставить 6,5 А. После этого снизить ток до 2 А и заряжать 8 – 12 часов. Дать отстояться батарее до комнатной температуры измерить плотность. Если не пришла в норму, опять разрядить и провести ступенчатую зарядку.
Десульфатация обычно проводится в два – три цикла. Отрицательный результат говорит о том, что с АКБ придётся расстаться. Можно ещё попробовать полностью слить электролит, промыть дистиллированной водой и залить новый. Но этого обычно хватает ненадолго.
В третьем случае, когда плотность в банках разница более чем на 0,1 надо попробовать провести десульфатацию. Не помогло – откорректировать. Для этого приобрести корректирующий электролит плотностью 1,33 – 1,4 и дистиллированную воду. В банках с ненормальной плотностью откачать по 20 мл электролита. Для повышения добавить корректирующий, для снижения дистиллят. Зарядить 30 минут, дать отстояться ещё полчаса и замерить. Скорее всего к успеху приведут несколько корректировок.
Усилия ни к чему не приведут, а аккумулятор окажется непригоден при буром цвете электролита. В этом случае можно не предпринимать никаких действий.
Не сильно изношенным аккумуляторам десульфатация и корректировка значительно продлевает жизнь. Если усилия не увенчались успехом, то с батарей нужно расстаться немедленно и без сожаления. Иначе непредвиденный отказ станет неприятным сюрпризом.
Срок службы АКБ при условии соблюдения элементарных правил до пяти лет. В автомобиле нужно контролировать напряжение, не допускать чрезмерного и нулевого заряда батареи. Периодически заряжать и следить за плотностью электролита. При таком отношении аккумулятор служит долго и безотказно.
как измерить ее в батарее, почему она бывает высокой
Практически каждый автомобилист знает, насколько важно держать аккумуляторную батарею своего автомобиля в порядке. От ее состояния зависит не только возможность пуска двигателя, но и нормальная работа всего электрооборудования машины. К сожалению, далеко не всем известно, что исправность и «боеготовность» батареи зависит не только от своевременной и качественной ее зарядки, но и от нормальной плотности электролита в аккумуляторе.
Устройство и принцип работы АКБ
Для того чтобы качественно провести обслуживание аккумулятора и обеспечить правильную его работу, необходимо хотя бы приблизительно представлять, что у него внутри и как все это работает. Поэтому, прежде чем перейти к вопросам об электролите, необходимо понять, как устроен автомобильный аккумулятор и по какому принципу он работает.
Конструкция батареи
Практически все свинцово–кислотные батареи имеют одинаковую конструкцию. Состоят они из отдельных секций (банок), каждая из которых имеет набор положительных и отрицательных пластин. Первые называются катодными и выполнены из металлического свинца. Вторые, анодные, сделаны из диоксида свинца. Пластины собраны в пакет и помещены в кислотостойкую емкость, в которую впоследствии заливается рабочая жидкость – водный раствор серной кислоты или так называемый электролит.
Устройство секции свинцово-кислотного аккумулятора:
- 1 – крышка банки;
- 2 – корпус банки;
- 3 – ребристый отстойник;
- 4 – пластины, собранные в пакет;
- 5 – отрицательный (анодный) вывод;
- 6 – отрицательный (анодные) пластины;
- 7 – диэлектрическая прокладка – сепаратор;
- 8 – положительный (катодный) вывод;
- 9 – положительные (катодные) пластины.
Готовые секции, соединенные последовательно, и являются аккумуляторной батареей. В шестивольтовых АКБ таких секций три, в 12-ти вольтовых – шесть.
Как это работает
Итак, конструкция АКБ достаточно проста, но каким образом на ее выводах появляется напряжение? Действительно, если взять батарею прямо из магазина и подключить к ней вольтметр, то прибор покажет «0». Отсутствие тока обусловлено тем, что электролит не заливается в батарею сразу после изготовления, и в стоящем на магазинной полке аккумуляторе пластины сухие. Рабочая жидкость заливается в АКБ уже после покупки.
Самое время выяснить, для чего нужен электролит. Поскольку положительные и отрицательные пластины имеют различный химический состав, между ними, погруженными в кислотный раствор, возникает разность потенциалов (примерно 2 В на секцию, чем и обусловлено количество секций в батарее). При подключении к клеммам АКБ нагрузки между пластинами, благодаря высокой электропроводности электролита, начинает течь ток. Одновременно начинается химический процесс преобразования диоксида свинца в сульфат свинца с участием серной кислоты. Как только количество диоксида и серной кислоты упадет до определенного уровня, процесс прекратится, и батарея перестанет вырабатывать ток – разрядится.
В процессе разрядки серная кислота и диоксид свинца расходуются на образование сульфата свинца
Но аккумуляторы, в отличие от гальванических элементов (батареек), могут восстанавливать свои химические свойства. Если подключить АКБ к источнику постоянного тока, то под его действием сульфат начнет разлагаться на диоксид свинца и серную кислоту. Батарея начнет заряжаться, преобразуя электрическую энергию в химическую. Как только количество диоксида и кислоты достигнет исходных величин, батарею можно считать заряженной.
Химические процессы, возникающие в батарее при ее разрядке и зарядке
Серная кислота, входящая в состав электролита, играет одну из основных ролей в работе АКБ. Именно от ее свойств будет зависеть качественная и долговременная работа батареи в целом.
Понятие плотности электролита
Вполне понятно, что количество серной кислоты и диоксида свинца в батарее должно быть сбалансированным – ведь они расходуются вместе. Поскольку количество диоксида свинца определяется производителем, автомобилисту после покупки аккумулятора остается лишь заправить АКБ необходимым количеством кислоты. Емкость секций батареи тоже фиксирована, поэтому в нее больше нормы не зальешь.
Остается единственный вариант – разбавить кислоту нейтральной к свинцу жидкостью, что и делается. Разбавляется кислота обычной водой, но дистиллированной, чтобы соли, содержащиеся в обычной воде, не нарушили чистоту раствора и не вывели АКБ из строя. Обычно автолюбитель покупает уже готовый электролит нужной плотности в автомагазине, хотя приготовить его можно и самостоятельно.
Процентное отношение воды к кислоте в полностью заряженном аккумуляторе составляет 70/30. Но при составлении электролита и его измерениях намного удобнее пользоваться единицами плотности – г/см. куб. или кг/м. куб. Удельный вес воды и кислоты различен, а значит, по общей плотности раствора можно судить о процентном соотношении его составляющих – концентрации.
Оптимальная концентрация кислоты
Пониженная концентрация, как правило, приводит к ускоренной сульфатации пластин – образованию на них нерастворимого сульфата свинца, который уже не может разложиться на кислоту и диоксид. В результате емкость батареи катастрофически падает, КПД уменьшается, а внутреннее сопротивление увеличивается (сульфат – диэлектрик).
Даже полностью заряженная, но сульфатированная батарея, выдающая, казалось бы, нормальное напряжение, садится после первого пуска, а то и вообще не в состоянии провернуть стартер. Кроме того, электролит с низкой плотностью замерзает при более высоких температурах, а значит, на стоянке даже при легком морозе батарею попросту разорвет льдом.
Чрезмерно высокая плотность электролита в аккумуляторной батарее не менее опасна, поскольку излишняя кислотность сокращает ресурс батареи в разы, буквально съедая пластины. Конечно, аккумулятор, залитый одной кислотой, будет крутить «как зверь», но сколько проживет такая АКБ? Сутки, может неделю. Если повезет – месяц.
А теперь пора вернуться к оптимальной плотности. В сети можно увидеть множество таблиц «рекомендованной» плотности, в зависимости от климатических условий. Если тепло – пониже, если мороз – повыше. Чем грозят эти «повыше» и «пониже», было описано в предыдущих абзацах. Поэтому не стоит изобретать велосипед, поскольку все эксперименты уже провели производители АКБ, а рекомендованная плотность приводится в сопроводительной документации.
С новым, сухим (сухозаряженным) аккумулятором все просто – в него заливается электролит комнатной температуры с плотностью 1.28 г/см. куб. Через час концентрация упадет до 1.26 – 1.27 г/см. куб., и батарея готова к работе. Далее, в процессе заряда/разряда аккумулятора и в зависимости от температуры окружающей среды, плотность раствора будет все время колебаться. Больше разряд – ниже плотность, идет заряд – плотность повышается. В нормально функционирующей АКБ отношение плотности к степени заряда и напряжению на клеммах выражается следующими показателями:
- 1.265 кг/м. куб. — 12.6 … 12.7 В — полностью заряжена;
- 1.225 кг/м. куб. — 12.3 … 12.4 В — 75%;
- 1.190 кг/м. куб. — 12.0 … 12.1 В — 50%;
- 1.115 кг/м. куб. — 11.8 … 11.9 В — 25%;
- 1.120 кг/м. куб. — 11.6 … 11.7 В — разряжена;
- ниже 1.120 кг/м. куб. — ниже 11.6 В — глубокий разряд.
Стоит обратить внимание на то, что все параметры батареи, включая плотность и напряжение, сильно зависят от температуры. Поэтому значения справедливы только при 26.7 градусах Цельсия. Если нужно провести измерения при другой температуре окружающей среды, то дополнительно придется воспользоваться таблицей плотности электролита от температуры, которую несложно найти в сети.
Выяснив зависимость плотности от выходного напряжения батареи, а значит, и от степени ее заряда, контролировать концентрацию электролита несложно. Достаточно замерить напряжение на клеммах отключенного аккумулятора любым вольтметром, затем измерить плотность и проверить их соответствие.
Проверка плотности рабочей жидкости
Для измерения плотности жидкостей существуют специальные приборы – ареометры или плотномеры. Есть такой и для автомобильных аккумуляторов. Выполнен он в виде большого шприца, внутри которого расположен поплавок со специально отградуированной шкалой.
Поплавок автоареометра комплектуется специальным «шприцем» для работы в узкогорлых секциях аккумуляторов.
Для того чтобы измерить плотность в аккумуляторе, со всех его секций сворачиваются пробки. Далее грушу ареометра сжимают, а его иглу погружают в секцию. Отпустив грушу, набирают в шприц электролит. При этом поплавок прибора всплывает. Плотность жидкости считывают со шкалы по тому уровню, до которого всплыл поплавок.
Поплавок всплыл до уровня 1.200. Плотность электролита – 1.2 г/см. куб.
После измерения грушу вновь сжимают, а после слива электролита обратно в батарею ареометр промывают проточной водой и сушат. Не следует забывать, что каждая секция – отдельная, независимая часть АКБ, поэтому плотность нужно измерить в каждой.
Когда и чем доливают аккумулятор
Необходимость доливки рабочей жидкости в батарею возникает нечасто, но она бывает необходимв. Что, сколько и в каких случаях нужно доливать? Всего таких случаев два: низкий уровень электролита и ненормальная кислотность рабочей жидкости.
Низкий уровень в секциях
Эта ситуация возникает часто, поскольку в процессе работы батареи вода испаряется или, как принято говорить, выкипает. При этом уровень раствора в секциях уменьшается, и края пластин оказываются сухими. Определить это можно визуально, просто свинтив пробки с секций и заглянув в заливные горловины. Нормальный уровень жидкости в секции должен быть примерно на 1 см выше уровня среза пластин. В некоторых АКБ даже имеется специальная метка, отштампованная на корпусе. Если уровень низкий, то ситуация хоть и серьезна, но устранить ее легко. Для этой операции понадобятся:
- медицинский шприц без иглы или автомобильный ареометр;
- дистиллированная вода;
- средства защиты (очки и резиновые перчатки).
Дистиллированная вода набирается в шприц и заливается в соответствующие секции, до нужного уровня. После доливки жидкости в аккумулятор его ставят на зарядку. В этом плане автоареометр намного предпочтительней, поскольку, долив воду, тут же можно проконтролировать плотность раствора.
Следует соблюдать осторожность: нельзя работать с кислотой, если глаза не защищены.
Ненормальная кислотность
Если изначально батарея была заправлена как положено, то чрезмерно большая плотность электролита в аккумуляторе может появиться только в случае, если выкипела вода или измерения проводились при сильном морозе (с понижением температуры плотность повышается, и это нормально). В первом случае достаточно просто долить воду, во втором – произвести перерасчет или, что проще и правильнее, заняться измерениями в отапливаемом помещении.
А вот падение концентрации кислоты – ситуация реальная. Обычно это происходит из-за неправильной эксплуатации АКБ или ввиду ее «преклонного возраста». Причина – появление нерастворимого сульфата, который при своем образовании использовал кислоту, но уже не разлагается при зарядке, а значит, вернуть ее обратно в раствор не может. Ситуация не особо радостная, но восстановить плотность необходимо хотя бы для того, чтобы дотянуть до покупки новой батареи.
Прежде чем принять решение о доливке кислоты, необходимо еще раз убедиться в том, что плотность действительно ниже положенной при текущем состоянии АКБ. Если решение принято, то понадобятся ареометр, перчатки, очки и корректирующий электролит плотностью 1.35 — 1.40 г/см. куб. (в продаже есть и такой).
Корректирующий электролит для доливки в автомобильный аккумулятор
В крайнем случае подойдет и стандартный 1.28 г/см. куб., но, возможно, придется отобрать лишнюю жидкость из секции в отдельную емкость, чтобы освободить место для более «крепкого».
Методика доливки та же, что и воды, но при этом плотность в банке постоянно контролируется тем же ареометром.
Категорически запрещается поднимать концентрацию раствора доливкой чистой серной кислоты. Во-первых, это очень опасно, во-вторых, даже нескольких грамм концентрированной кислоты достаточно, чтобы кардинально изменить плотность раствора в секции, а значит, выставить нужную плотность пол-литровым ареометром исключительно сложно.
Инструкция по заряду аккумуляторной батареи
30 октября
Предлагаем Вам краткую инструкцию по заряду обслуживаемой свинцово-кислотного стартерного аккумулятора.
Данную процедуру лучше всего производить в конце лета, начало осени.
Соблюдайте последовательность, очередность не нарушать!
- Отсоедините «минусовую» клемму а потом «плюсовую» клемму с аккумулятора. Занесите аккумулятор в помещение с температурой +18гр.с. и дождитесь пока температура аккумуляторной батареи будет такой же как и в помещении. Именно при такой температуре производится замер плотности электролита и заряд аккумуляторной батареи.
- Заряд должен производится в хорошо проветриваемом помещении в дали от источников открытого огня, нагревательных приборов, открытых линий электропередач, вне доступа детей.
- Вскройте все банки у аккумуляторной батареи, проверьте уровень, он должен быть выше на 10-15мм верхнего уровня пластин, или по меткам Min-Max на аккумуляторе.
- В случае если аккумулятор у Вас не переворачивался, не опрокидывался и не было течи электролита, но в банках видны пластины не скрытые электролитов, долейте воды, что бы она слегка скрыла пластины.
- Поставьте аккумулятор на заряд. Сила зарядного тока для стартерных АКБ должна составлять не более 10% её ёмкости. Пример: аккумулятор 75ач. т.е. максимальный ток заряда 7,5ампер. Меньше можно, больше нельзя.
- Аккумуляторная батарея считается полностью заряженной, если на протяжении последних двух часов заряд плотность электролита и напряжение на клеммах не изменяется. В данном случае аккумулятор набрал максимально возможную для его состояния ёмкость.
- По завершению заряда еще раз проверьте уровень и плотность электролита, желательно довести его до отметки Maх или 15мм выше верхнего уровня пластин, дисциллированной водой. Нормальная плотность для средних широт должна составлять 1,27, для южных регионов допускается 1,25-1,24, для северных 1,30-1,32.
- Следует помнить в случае если после заряда плотность электролита низкая, значит аккумулятор потерял емкость. Как определить остаточную ёмкость?- каждая сотка падения плотности -6% ёмкости. Допустим, нормальная плотность 1,27 после заряда, доведения до уровня дисциллированной водой плотность стала 1,23, падение составило 0,04. Сотку умножаем на коэффициент падения. 4*6%= 24%. Мы имеем остаточную ёмкость 76% от первоначальной ёмкости аккумулятора. Если остаточная ёмкость 60% и менее, аккумулятор считается не работоспособным. Доведение плотности электролита с помощью концентрированной аккумуляторной кислоты к увеличению ёмкости не приведет.
- После все процедур, плотно установите крышки банок на место, очистите контакты аккумулятора и клеммы автомобиля от отложений и окиси, протрите аккумулятор слабым раствором воды и пищевой соды, установите на место.
- Не наносите смазки, такие как, солидол на клеммы перед установкой, помните, данная смазка является диэлектриком и не пропускает электрический ток. Лучше всего нанести специальную токопроводящую смазку на клеммы после монтажа и затяжки клемм на выводах аккумулятора или не наносить никакх смазок, если специальных у Вас нет. При установке сначала подключите клемму «плюс», только потом «минус».
- Вы должны знать, что по мере разряда, снижения ёмкости аккумулятора, падает плотность электролита, а значит уменьшается температура застывания. Таблица представлена ниже.
- Ни в коем случае не повышайте плотность выше чем рекомендовано для вашего региона, высока плотность приведет к разрушению пластин и преждевременному выходу из строя аккумулятора.
Надеемся, что данная информация была для Вас полезна.
‹ Вернуться к разделуКонцентрация электролита — обзор
2.3.4 Гидратация в концентрированных растворах
По мере увеличения концентрации электролита количество молекул воды во вторичной гидратной сфере уменьшается. Следовательно, происходит усиление связи между катионом металла и гидратными водами во внутренней сфере (Choppin, Jensen, 2006). Основываясь на ЯМР-исследованиях трехвалентных актинидов и лантаноидов, Чоппин пришел к выводу, что комплексообразование внутренней сферы перхлорат-ионами не происходит ниже примерно 8-10 М (Choppin, Labonne-Wall, 1997).Множественные равновесия для системы уранилхлорида (UO 2 Cl 2 (H 2 O) 2 , UO 2 Cl 3 (H 2 O) — и UO 2 Cl 4 2– ) использовались для отделения урана от его дочерних продуктов или других металлов. Поскольку Th 4 + не образует анионных хлоридных комплексов, он удерживается на катионообменной смоле, в то время как анионные хлоридные комплексы UO 2 2 + проходят через колонку в элюате.В качестве альтернативы такие анионные комплексы можно удерживать на анионообменной колонке.
Число гидратации Eu (III) остается относительно постоянным в соляной кислоте примерно до 6–8 M, выше которой концентрация уменьшается. То же самое верно и для числа гидратации Cm (III) в HCl, которое начинает снижаться примерно при 5 M HCl. Эта разница между (Eu 3 + и Cm 3 + ) отражает большее комплексообразование трехвалентного иона актинида с относительно мягким анионом Cl —.Разница в комплексообразовании хлоридов использовалась для обеспечения эффективного отделения трехвалентных актинидов от трехвалентных актинидов в концентрированных растворах HCl путем пропускания через колонки с катионообменной смолой с 1950-х годов (Diamond et al., 1954).
Нитратные комплексы для четырехвалентных актинидов, например Th 4 + и Pu 4 + , чрезвычайно важны в процессах разделения и очистки актинидов. Нитрат-ионы начинают образовывать комплексы внутренней сферы при более низких концентрациях, чем хлорид-анионы; это наблюдение подтверждается уменьшением числа гидратации катиона даже при относительно более низких концентрациях (Choppin, Jensen, 2006).Однако, поскольку атомы кислорода нитрата являются твердыми донорами, нет никаких доказательств какого-либо ковалентного усиления его связывания, как это видно с анионами хлорида для трехвалентных катионов актинидов по сравнению с катионами лантанидов (Choppin, Jensen, 2006). В процессах разделения и очистки чрезвычайно важны нитратные комплексы актинидов. Раствор нитрат-азотной кислоты является наиболее распространенной водной средой в процессах разделения ядер. В случае нейтральных экстрагентов, таких как трибутилфосфат (TBP), карбамоилметилфосфиноксид (CMPO) или дипиколинамиды (DPA), он обеспечивает нитратные единицы, необходимые для компенсации заряда катионов актинидов для обеспечения экстракции.Комплексообразование нитрата с шестивалентными ионами актинида происходит очень слабо, и определение констант образования для разновидностей водного раствора нитрата является чрезвычайно трудным. В водных условиях с высокими концентрациями азотной кислоты комплексы формы AnO 2 (NO 3 ) (H 2 O) x + , AnO 2 (NO 3 ) 2 (H 2 O) 2 и AnO 2 (NO 3 ) 3 — (An = U, Np, Pu), вероятно, будут присутствовать.Лимитирующим веществом в ряду нитратов является комплекс гексанитрато, An (NO 3 ) 6 2– (Matonic et al., 2002). Известно комплексообразование пятивалентных ионов Pa и Np нитратом; однако доступны ограниченные термодинамические и структурные данные. Предполагаемая стехиометрия для видов Np (V) — NpO 2 (NO 3 ) (H 2 O) x . Для протактиния, который легко гидролизуется, были предложены смешанные гидроксо / нитрато- или оксо / нитрато-комплексы.
Фториды и хлориды являются наиболее изученными актино-галогенидными системами, и они очень важны для процессов пирообработки и электрорафинирования.
Карбоновые кислоты прочно связаны с ионами актинидов. Первичный способ связывания простых карбоновых кислот — бидентатный, тогда как в комплексах поликарбоновых кислот карбоксилаты имеют тенденцию к монодентатной координации с ионом металла. Сродство низковалентных актиноидов к этим лигандам увеличивается с увеличением дентальности лиганда, например, этилендиаминтетраацетата (ЭДТА) >>> ацетата.Для An 4 + лиганд EDTA является гексадентатным с конформацией скручивания (спиральная конформация, охватывающая ион металла, а не инкапсулирующая ион металла в центральной полости, как триподальные или макробициклические лиганды). Диэтилентриамин-N, N, N ‘, N ″, N ″ -пентаацетат (DTPA) имеет еще более высокое сродство к ионам An 3 + и An 4 + .
Монокарборановый кластер как стабильный электролит кальциевой батареи, не содержащий фтора
Во-первых, атомные отношения Ca, Cs и B в CMC были определены с помощью ICP-MS и ICP-OES (Таблица S1).Поскольку соотношение Cs / Ca было менее 1/10 000, соль Cs почти полностью превращалась в соль Ca. Кроме того, соотношение Са / В составляло 1 / 21,96, что близко к теоретически определенному соотношению 1/22 в КМЦ (Ca [CB 11 H 12 ] 2 ). Чтобы охарактеризовать [CB 11 H 12 ] — анион и H 2 O в CMC, измерения спектроскопии комбинационного рассеяния и измерения ЯМР были оценены для CMC и CMC‧nH 2 O (рис. 1a, b) . Спектры комбинационного рассеяния света CMC и CMC‧nH 2 O демонстрируют различные моды деформационных колебаний [CB 11 H 12 ] — ниже 1200 см -1 .Кроме того, пик комбинационного рассеяния при 3050 см −1 был приписан моде C – H-валентного колебания аниона [CB 11 H 12 ] – (рис. 1c) 34 . Пик комбинационного рассеяния, наблюдаемый при 3600 см -1 для CMC · nH 2 O, приписываемый режиму O – H H 2 O 35 , не был обнаружен для CMC, что указывает на то, что гидратированная вода может быть в основном удаляется из КМЦ простым нагреванием, аналогичным удалению комплексного гидрида Са клозо-типа CaB 12 H 12 30, 32 .Эти результаты согласуются со спектрами ЯМР 11 B и 1 H 28, 36 . Для детального исследования содержания воды в CMC и CMC‧nH 2 O метод титрования Карла-Фишера был применен для двух электролитов, приготовленных из 5 мл DME / THF (содержание воды менее 10 ppm) с 20 мг КМЦ или КМЦ‧nH 2 О. Содержание воды в КМЦ в ДМЭ / ТГФ было измерено как 15 ч. / млн, в то время как содержание воды в КМЦ‧nH 2 О в ДМЭ / ТГФ было измерено как 1178 ч. / млн.Разница в 5 частей на миллион в содержании воды не повлияет на работу батареи; это различие может быть компенсировано добавлением молекулярных сит в электролит CMC. После расчета содержания воды CMC · nH 2 O можно выразить как CMC · 6H 2 O, что согласуется с потерей веса, вызванной термообработкой, определенной термогравиметрическим анализом (рис. S1).
Рисунок 1( a ) Рамановские спектры монокарборана кальция (CMC) (оранжевый) и CMC · nH 2 O (синий).( b ) 11 B и 1 H Спектры ядерного магнитного резонанса (ЯМР) CMC (оранжевый) и CMC · nH 2 O (синий). ( c ) Геометрия аниона [CB 11 H 12 ] — (черные, зеленые и синие сферы обозначают атомы C, B и H соответственно). ( d ) Фотографии КМЦ, диспергированной / растворенной в 1,2-диметоксиэтане (ДМЭ), тетрагидрофуране (ТГФ) и смеси ДМЭ / ТГФ. ( e ) Диаграмма растворимости CMC в смесях DME / THF с различными соотношениями растворителей.( f ) Взаимосвязь между проводимостью и растворимостью CMC (подробности см. В таблице S2 и на рис. S2). Термическая стабильность показана на рис. S4. Электропроводность твердофазной КМЦ была измерена с помощью EIS и показана на рис. S5. Электролиты
Ca были приготовлены растворением CMC в слабо координирующих растворителях, что позволило диссоциации солей Ca 37,38,39 . В качестве слабо координирующих растворителей были выбраны ТГФ, ДМЭ и смесь ДМЭ / ТГФ (1: 1, об. / Об.), А растворимость КМЦ была оценена методом ICP-OES с использованием насыщенных растворов.На рис. 1d показаны фотографии 5 мг КМЦ, растворенных или диспергированных в 1 мл растворителя. Интересно, что хотя растворимость КМЦ в ДМЭ и ТГФ была очень низкой (<0,0033 и 0,0026 М соответственно), в ДМЭ / ТГФ она была высокой (> 0,75 М). Исследование поведения растворимости КМЦ в бинарных смесях ТГФ и ДМЭ было проведено при комнатной температуре, где на рис. 1д показана диаграмма растворимости КМЦ в смешанных растворителях ДМЭ / ТГФ с различным соотношением. Наибольшая растворимость на диаграмме наблюдается при соотношении растворителей приблизительно 1/1 (об. / Об.).Об аналогичном улучшении растворимости сообщалось при использовании смешанных растворителей для нескольких солей, содержащих комплексные гидридные анионы кластерного типа, таких как Mg (CB 11 H 12 ) 2 , Li 2 B 10 Cl 10 и Li 2 B 12 Cl 12 29, 40 . Одна из возможностей улучшенной растворимости, наблюдаемой в настоящем исследовании, заключается в том, что смешанные растворители могут быть функционализированы монокарборановым кластерным анионом одним или несколькими фрагментами 41 .Механизм и роль смешанного растворителя могут быть выяснены с помощью расчетов квантовой химии и рентгеновской спектроскопии поглощения электролита 42, 43 , которые предоставят информацию о координационной структуре, окружающей катион Ca 2+ и [CB 11 H 12 ] — анион; мы планируем провести такие исследования в наших будущих исследованиях. Эти проводимости были определены с использованием симметричной ячейки с Au-электродом с константой ячейки, полученной путем калибровки ячейки с использованием 0.08% KCl и использовались для расчета электропроводности электролита. Расчетная проводимость 0,5 M CMC / DME / THF (4,0 мСм см -1 ) была больше, чем у CMC / DME (0,073 мСм см -1 ) и CMC / THF (0,036 мСм см -1 ). и того же порядка, что и у ранее описанного электролита Ca [B (hfip) 4 ] 2 (рис. 1f, S2, S3 и таблица S2) 13 .
Электрохимические исследования проводились с использованием 0,5 М КМЦ / ДМЭ / ТГФ. Гальваническое покрытие / удаление Ca проводили посредством CV при 20 мВ с -1 с трехэлектродной установкой с использованием металлического Ca в качестве электрода сравнения и противоэлектрода и металла Au в качестве рабочего электрода.Типичное поведение металлического покрытия / снятия изоляции наблюдалось при катодном / анодном сканировании (рис. 2а). Осаждение кальция началось при –220 мВ при катодном сканировании, а при анодном сканировании ток начал возрастать при ∼ 80 мВ, что указывает на удаление нанесенного покрытия из Ca. После кондиционирования в течение трех циклов (рис. S6) нанесение покрытия / снятие покрытия продолжалось с меньшим перенапряжением и улучшенной обратимостью. Более того, кулоновский КПД увеличился до прибл. 88% в течение первых нескольких циклов, а затем оставались стабильными в течение 30-го цикла (рис.2б). Недостаточная кулоновская эффективность, по-видимому, является результатом частично разложившегося электролита CMC / DME / THF на Au-электроде и образования мертвого Ca, который электрически изолирован от электрода. Это будет обсуждаться в другом разделе этого документа вместе с результатами SEM / EDS. Даже если рабочий электрод Au заменить электродом из другого металла (например, Pt, Cu и SUS), все равно будут получены низкие перенапряжение, обратимость и умеренная кулоновская эффективность (рис.S7). С другой стороны, при использовании электролитов 0,1 М КМЦ в диглиме и 0,1 М КМЦ в триглиме не наблюдалось поведения покрытия / удаления Ca (рис. S8). Учитывая влияние типа эфирного растворителя и координации анионов на Са, некомпетентность этих электролитов возникает из-за того, что координация Са с диглимом и триглимом более сильная, чем координация Са с ДМЭ и ТГФ 37 .
Рисунок 2( a ) Циклические вольтамперограммы осаждения / снятия покрытия Ca после циклов кондиционирования при 20 мВ с -1 с трехэлектродной установкой с использованием Au в качестве рабочего электрода и Ca в качестве электрода сравнения и противоэлектрода в комнате температура.Циклические вольтамперограммы для начальных трех циклов в качестве процессов кондиционирования показаны на рис. S6. ( b ) Кулоновский КПД, определенный из циклических вольтамперограмм. На вставке: баланс заряда за циклы 4–10.
Чтобы предоставить прямые доказательства ионной проводимости Ca через электролит CMC / DME / THF, мы собрали Ca | CMC / DME / THF | Au ячейка и нанесенный Ca на Au электрод при комнатной температуре. В разобранной ячейке отложения выглядели как черный порошок на Au-электроде, который был промыт DME / THF (рис.3а). Черный порошок на Au-электроде и сепараторе был удален и собран для измерения XRD, которое показало, что преобладающим продуктом является металлический Ca в форме α-Ca и β-Ca, а также небольшое количество CaH 2 (рис. . S9). Эти широкие пики с низкой интенсивностью указывают на небольшой размер и низкую кристалличность всех нанесенных материалов. Затем морфология отложений на Au-электродах в электролите CMC / DME / THF была исследована с помощью SEM и EDS и показала однородно диспергированные сферические частицы (рис.3b, c и S10). Отложения сферических частиц имеют форму, аналогичную форме отложений Ca, приготовленных в электролите Ca (BH 4 ) 2 –LiBH 4 –THF 44 . Профиль EDS показывает, что отложения в основном состоят из Ca, O и C со следовыми количествами B (рис. 3b). Большое количество O образовалось из высокореактивных свежих отложений Ca, которые ненадолго подвергались воздействию воздуха перед наблюдением EDS (рис. 3c). Умеренные количества C и B, вероятно, были вызваны восстановлением электролита при низких потенциалах или остаточной КМЦ.Массовая доля Са в типичной частице была рассчитана как 84%, если исключить вклад содержания Au. Соответственно, мы сделали вывод, что носителем заряда в этой системе является Ca.
Рис. 3( a ) Оптическое изображение Au-электрода после процесса покрытия Ca. ( b ) Профиль энергодисперсионной рентгеновской спектроскопии (EDS) в желтом квадрате. ( c ) Изображение, полученное с помощью сканирующей электронной микроскопии (СЭМ) отложений Ca на Au-электроде после осаждения Ca в Au | CMC / DME / THF | Клетки Ca и карты EDS для Ca, Au, O и B.
Кроме того, черные отложения также наблюдались на сепараторе стекла после отслаивания его от электрода Au (Рис. S11). Отложения собирали из стеклянного сепаратора для анализа SEM и EDS, наклеивая углеродную ленту на стекло и затем снимая ее. Полученные изображения показывают, что отложения содержат металлический Ca и их размер относительно больше, чем на Au-электроде (Рис. S12). Плохая адгезия к Au-электроду указывает на то, что они легко теряют контакт с электродом, что приводит к образованию мертвого Ca.Это образование мертвого Ca и восстановление электролита при низких потенциалах может вызвать недостаточную кулоновскую эффективность во время процессов покрытия / удаления кальция.
Чтобы исследовать анодную стабильность системы электролита CMC / DME / THF, дальнейшие измерения CV были выполнены с использованием Au-электродов с различными диапазонами напряжения (рис. 4). Плотность тока увеличивалась при потенциале примерно 4 В с последующим подавлением дальнейшего пробоя электролита и отсутствием значительной катодной плотности тока во время обратной развертки потенциала даже при более высоком напряжении ~ 7 В.Этот результат согласуется с поведением, наблюдаемым в электролитах, содержащих анионы карборана с катионами магния и тетраэтиламмония, а не в электролитах, содержащих анионы BH 4 17, 45 .
Рисунок 4Циклические вольтамперограммы при 1 мВ с −1 с различными диапазонами напряжения выше 5 В (синий), 6 В (оранжевый), 7 В (зеленый) и 8 В (фиолетовый). Стрелки указывают направление движения во время вольтамперометрии. (d) Циклические характеристики Ca | CMC / DME / THF | Ячейка Ca при плотности тока 0.02 мА см −2 .
Наконец, чтобы исследовать возможность использования электролита CMC, мы провели исследовательский тест с использованием Ca – S батареи, которая является очень многообещающей системой из-за ее высокой теоретической плотности энергии 3202 Втч л -1 46 . Батарея Ca – S, а именно. Ca | CMC / DME / THF | S / C был протестирован с плотностью тока 167,2 мА g -1 (0,1 C на S) при комнатной температуре (рис. 5a). Начальная разрядная и зарядная емкости катода S / C составляли до 805 и 750 мАч g −1 соответственно.Кроме того, он показал плоское плато напряжения ~ 2,4 В относительно Ca 2+ / Ca, соответствующее окислительно-восстановительным реакциям серы с Ca (вставка на рис. 5a) 47, 48 . Чтобы получить информацию о реакции конверсии катода S / C с Ca, измерения XPS были выполнены на исходном электроде и электроде после разряда. Спектры S 2p исходного катода S / C демонстрируют спин-орбитальный дублет для элементарного S с пиками S 2p 3/2 и S 2p 1/2 при 164.0 и 165,2 эВ соответственно (рис. 5б вверху). После того, как электрод разряжен до 0,5 В, спектры сигнала S 2p можно деконволюционировать на три дублетных пика. Помимо пиков элементарной S, новые пики при 160,3 эВ и 162,2 эВ, приписываемые концевому атому серы в полисульфидах CaS x (2 ≤ x <8) и сульфида кальция (CaS), соответственно, отражают эффективное превращение S в сульфиды (нижняя часть рис. 5б). Этот результат демонстрирует практическую применимость электролита CMC для батарей Ca – S при комнатной температуре с металлическим анодом из Ca.
Рисунок 5( a ) Электрохимические характеристики Ca – S батарей с электролитом CMC / DME / THF в диапазоне напряжений от 0,5 до 3,2 В; на вставке показаны дифференциальные емкости (dQ / dV), полученные из соответствующей кривой заряда-разряда. ( b ) Спектры S 2p рентгеновской фотоэлектронной спектроскопии S / C электродов в исходном (вверху) и разряженном (внизу) состояниях.
Таким образом, мы разработали высокостабильный и эффективный кальциевый электролит, не содержащий фтора, на основе монокарборан-аниона, а именно.электролит CMC для кальциевых батарей комнатной температуры. Соли КМЦ были успешно получены с помощью простых процессов катионообмена и нагревания, что указывает на то, что синтетический метод с использованием водного раствора масштабируемый и очень многообещающий с точки зрения применения. Соль КМЦ демонстрирует низкую растворимость в ТГФ и ДМЭ, но высокую растворимость в смешанном растворителе ДМЭ / ТГФ (1/1, об. / Об.). Электролит CMC при 0,5 M показал наиболее многообещающие электрохимические характеристики, а именно высокую проводимость, широкий диапазон напряжений и обратимое покрытие / удаление Ca с высокой кулоновской эффективностью.В технико-экономическом обосновании мы использовали электролит CMC в батарее Ca – S, демонстрирующей обратимые возможности разряда и заряда, а также высокую емкость 805 мАч g –1 , демонстрируя, что электролит CMC совместим с батареей Ca – S система. Разработка многообещающего кандидата в электролит на основе сложных гидридов, совместимых с батареями с кальцием, создаст в будущем возможности для изучения других родственных сложных гидридных соединений, таких как соли кальция 26, 49,50,51,52 . Кроме того, отсутствие фтора и образования CaF 2 в этих материалах, по сути, проложит путь для достижения высокой циклируемости в батареях с кальцием.Эти открытия будут способствовать разработке практических электролитов для перезаряжаемых кальциевых батарей, работающих при комнатной температуре.
Влияние модуля электролита на локальную плотность тока на кончике дендрита на литий-металлическом электроде
Интерес к переносу ионов металлическими литиевыми электродами возрастает из-за того, что в настоящее время уделяется особое внимание увеличению плотности энергии перезаряжаемых литиевых батарей. 1 Теоретически замена графитового электрода металлическим литием в литий-ионной батарее приведет к увеличению плотности гравиметрической энергии на 40%. 2 Химический состав аккумуляторов с плотностью энергии, значительно превышающей химический состав литий-ионных аккумуляторов, таких как литий-сера и литий-воздушный, зависят от наличия перезаряжаемого металлического литиевого анода. Электроосаждение металлических пленок также является неотъемлемой частью производства и использования широкого спектра устройств, от бытовой электроники до накопителей энергии. 3–5 Обычно как в аккумуляторных батареях, так и при электрохимической обработке металлы электроосаждены из жидких электролитов. 6–8 Однако последние достижения в области полимерных и керамических электролитов позволили осаждение (и удаление) металлов из электролитов с высоким модулем упругости. 9–11 Эти жесткие электролитические материалы влияют на механизм электроосаждения металлов. В частности, известно, что жесткие полимерные электролиты подавляют рост дендритов в батареях, содержащих анод из металлического лития. 12,13 Подавление роста выступающих металлических структур лития, таких как дендриты и глобулы, необходимо для безопасного и надежного использования аккумуляторных батарей с высокой плотностью энергии с металлическими анодами. 14,15
Многочисленные экспериментальные исследования были посвящены вопросу роста дендритов в литиевых батареях. 8,16–25 Хотя увеличение плотности тока вблизи дендрита или глобулы, возможно, является наиболее важной движущей силой в этом процессе, это увеличение до сих пор ускользало от экспериментального исследования. Насколько нам известно, в предыдущих исследованиях элементов, содержащих электроды из металлического лития, сообщалось только о средней плотности тока. 26–28 В этом исследовании мы используем рентгеновскую микротомографию с временным разрешением для количественной оценки топологии металлического литиевого электрода и локальной плотности тока по всему электроду симметричной литий-литиевой ячейки с твердым блок-сополимерным электролитом в качестве электролита. функция заряда прошла.Мы, естественно, сосредотачиваем свое внимание на областях внутри клетки в непосредственной близости от растущих глобул. Наши эксперименты также позволяют определить локальную деформацию в твердом полимерном электролите, что, в свою очередь, позволяет оценить локальное напряжение. Мы представляем данные о взаимодействии между локальным напряжением и осаждением лития в окрестности вершины выступа.
Обычно при моделировании роста дендрита лития предполагается, что площадь проекции или поперечное сечение дендрита на границе между электродом и электролитом остается постоянным, поскольку он распространяется через электролит, как удлиняющаяся игла. 29–31 В случае роста глобулы через твердый электролит, мы показываем, что эта проектируемая площадь увеличивается по мере распространения глобулы через электролит. Это увеличение площади притупляет наконечник, значительно замедляя вертикальный рост глобул лития. Следовательно, увеличение модуля упругости электролита не только подавляет рост глобул за счет замедления кинетики осаждения на кончике глобулы, но также приводит к увеличению радиуса кривизны на кончике, что приводит к более медленному росту за счет делокализации тока.
Эта статья является частью серии исследований циклирования литий-литиевых элементов с помощью рентгеновской микротомографии. После первоначального обнаружения образования глобул лития в циклических клетках с помощью рентгеновской микроскопии ex situ было проведено множество экспериментов для определения влияния таких параметров, как температура и время зарядки, на морфологию глобул в клетках с использованием твердой блок-сополимерной электролитной мембраны. 13,32,33 Затем были разработаны клетки, которые вписывались в канал рентгеновской микротомографии для определения характеристик роста глобул с остановкой движения.Качественное описание этих результатов было опубликовано ранее. 2 Настоящее исследование направлено на количественную оценку кинетики осаждения лития на глобуле и вблизи нее по мере ее прохождения через твердый полимерный электролит.
Полистирол- b -поли (этиленоксид) синтезировали анионной полимеризацией, как описано ранее. 34,35 Молекулярная масса блок-сополимера составляла 240–260 кг / моль с объемной долей поли (этиленоксида) 0,5 и дисперсностью 1.26. После синтеза полимер сушили вымораживанием и хранили в перчаточном боксе, заполненном аргоном, где уровни кислорода и воды контролировались и оставались ниже 5 частей на миллион.
Чтобы приготовить электролитную мембрану, блок-сополимер растворяли в N-метил-2-пирролидоне (NMP) с литиевой бис (трифторметановой) сульфонамидной солью (LiTFSI) в концентрации 0,085 Li + для остатков этиленоксида. Раствор выливали на плоскую поверхность, покрытую никелевой фольгой, и распределяли в пленку с помощью ракельного ножа.Пленке давали высохнуть на плоской поверхности при 60 ° C в течение ночи. На этом этапе пленка была снята с никелевой фольги пинцетом. Отдельно стоящей пленке давали высохнуть в течение дополнительных 24 часов при 90 ° C под вакуумом в передней камере перчаточного ящика. После высыхания отдельно стоящую пленку из твердого полимерного электролита толщиной 30 мкм оборачивали никелевой фольгой и хранили в герметичном контейнере внутри перчаточного бокса. Фольга металлического лития чистотой 99,9% была приобретена у FMC Lithium. Рулон фольги толщиной 150 мкм хранился в эксикаторе внутри перчаточного бокса.
Симметричные образцы литий-полимерный электролит-литий для покадровой рентгеновской микротомографии были собраны следующим образом. Сначала использовали круглый металлический пуансон диаметром 13 мм, чтобы вырезать кусок электролита из отдельно стоящей пленки полимерного электролита. Три слоя металлической литиевой фольги были уложены друг на друга на чистом куске никелевой фольги, чтобы создать литиевый электрод толщиной 450 мкм с никелевой фольгой. Круглый металлический пуансон диаметром 11 мм использовался для штамповки двух литиевых электродов из пакета лития на никелевой фольге.Два литиевых электрода помещали по обе стороны от мембраны из полимерного электролита. Прокладка из нержавеющей стали толщиной 0,57 мм была помещена на одну сторону образца, а прокладка из нержавеющей стали толщиной 0,35 мм была установлена на другой стороне образца. Эти прокладки удерживали образец в плоском состоянии, что было важно для визуализации. Алюминиевые язычки токосъемника помещали с обеих сторон образца, и образец герметично закрывали в алюминиевом пакете, облицованном нейлоном и полипропиленом.
Этот толстый литиевый электрод с никелевой фольгой был полезен для покадровой рентгеновской микротомографии, поскольку литий создавал область с низким поглощением рентгеновских лучей вокруг границы раздела литий-полимер.Если материалы, которые сильно поглощают рентгеновское излучение с энергией 22 кэВ, такие как никель или нержавеющая сталь, находятся на пути рентгеновского луча, они имеют тенденцию вызывать значительные артефакты в реконструированных объемах, скрывая интересующие особенности литий-полимерного интерфейс. Толстые литиевые электроды отодвинули эти хорошо поглощающие материалы от интересующей области, что позволило получить четкие реконструированные объемы. Алюминиевые вкладыши были достаточно прозрачными для рентгеновских лучей, чтобы получать изображения хорошего качества, даже несмотря на то, что они блокировали путь луча.Язычки не контактировали напрямую с литиевой фольгой, поскольку известно, что алюминий реагирует с литием. Прокладки из нержавеющей стали, расположенные между образцом, имели разную толщину, так что при вакуумной герметизации граница раздела литий-полимер располагалась немного выше центральной плоскости образца, где избыток материала мешочка от вакуумного уплотнения мог добавлять шум к результирующим томографическим изображениям. Собрана серия из шести образцов этого типа.
Один из образцов подвергался циклическому контролю до отказа из-за короткого замыкания, используя следующую процедуру.Пропускали ток 0,175 мА / см 2 лития в течение четырех часов с последующим 45-минутным отдыхом. Затем пропускали ток -0,175 мА / см 2 в течение четырех часов с последующим 45-минутным отдыхом. Эту процедуру цикла повторяли до тех пор, пока образец не вышел из строя из-за короткого замыкания после 32 циклов. Затем цикл других пяти образцов был выполнен таким же образом, но был остановлен после 17 циклов. Намерение состояло в том, чтобы приблизить образцы к разряду, чтобы уменьшить время прохождения луча, необходимое для того, чтобы увидеть, как образец выходит из строя из-за короткого замыкания.
На этом этапе один из пяти образцов был визуализирован с помощью микротомографии с жесткими рентгеновскими лучами, а затем поляризован в течение дополнительных 4,5 часов. Эту поляризацию, при которой заряд проходил в одном направлении в течение 4,5 часов, повторяли четырнадцать раз с рентгеновскими микротомографическими изображениями, полученными с шагом в 4,5 часа. Затем образец поляризовали в течение 31 часа перед следующим изображением. Наконец, образец был поляризован в течение дополнительных 114 часов, когда он, наконец, вышел из строя из-за короткого замыкания и был отображен. Вся электрохимическая поляризация и циклы выполнялись, пока образец выдерживался при 90 ° C в печи.Из-за ограниченного доступа к прибору томографа покадровая съемка была выполнена только на одном образце. Литиевые глобулы аналогичного размера и формы были замечены в посмертных экспериментах с двумя дополнительными образцами, которые были циклированы и поляризованы таким же образом.
Образец удаляли из оборудования для электрохимического циклирования и охлаждали до комнатной температуры перед каждым сеансом визуализации. Визуализацию выполняли на канале жесткой рентгеновской микротомографии в Advanced Light Source (Beamline 8.3.2). Параметры, используемые для изображения образца, приведены в дополнительной таблице 1. Самые большие глобулы были обнаружены в окончательных реконструированных объемах и были отслежены до исходного изображения, где они еще не начали формироваться. Программа обработки изображений Avizo использовалась для измерения высоты, объема и площади глобул.
Большие реконструированные объемы были обрезаны, чтобы они содержали только глобулу, закоротившую ячейку. Последовательность обрезанных реконструированных объемов была преобразована в двоичную форму для последующего анализа в Matlab.Положение нижней границы раздела литий-полимер рассчитывалось в Matlab относительно фиксированного эталона, нижней части электрода. Плотность тока i jk в пикселе с индексами j , k была рассчитана с использованием объема нанесенного лития V jk в этом пикселе:
, где ρ — плотность металлического лития, F — постоянная Фарадея, M Li — молекулярная масса металлического лития, a — площадь пикселя в см 2 и t — время.Этот расчет предполагает, что весь заряд, нанесенный на литиевый анод, нанесен в виде металлического лития. Предполагалось, что образование SEI происходит во время циклов кондиционирования.
Данные томографии непосредственно показали смещение полимерного электролита на границе раздела электродов. Эти измерения использовались для определения локальных напряжений вблизи глобулы лития следующим образом. Во-первых, поскольку глобула приблизительно осесимметрична, была построена гладкая осесимметричная поверхность, как описано в дополнительной информации, чтобы приблизительно представить границу между глобулой и электролитом для каждого из отображаемых состояний.Затем сглаженной поверхности придавали параболическую форму, так что наклон кривой на вершине глобулы был нулевым, что соответствовало томографическим изображениям.
Для каждой поверхности была определена цилиндрическая система координат с осью z , совпадающей с осью симметрии поверхности. Переменная r была определена как перпендикулярное расстояние к оси z . За исключением непосредственной близости от глобулы, поверхности лития представляют собой примерно параллельные плоскости, поэтому начало координат было принято за пересечение оси z с плоскостью, из которой растет глобула.Положительное направление z было определено как направление роста глобулы.
Поскольку система является осесимметричной, а механический отклик электролита представляет интерес, необходимо было решить только смещение электролита в пределах любой плоскости r — z .
Области электролита вблизи глобул испытали сильные смещения. Напряжения были рассчитаны с использованием формулировки большой деформации. Численная реализация полностью соответствует частям работы, подробно описанной в предыдущей статье. 36 Обзор математической формулировки настоящей модели описан ниже, а дополнительные детали реализации представлены в дополнительном материале.
Уравнение импульса
Поскольку инерция незначительна в экспериментальных условиях, смещение электролита описывается уравнением механического равновесия, выраженным в пространственном описании как:
Нижний индекс x указывает, что дифференциация выполняется относительно текущих позиций; в моделях с конечной деформацией, в которых материал может испытывать значительные смещения, необходимо четко определить значение положения.Тензор напряжений Коши, σ , моделируется с использованием закона линейной упругости Гука:
, где модуль Юнга E был определен из экспериментальных реологических измерений, ν — коэффициент Пуассона, I — тензор идентичности и tr E — след тензора деформации Альманси E . Модуль сдвига для этого полимера был измерен ранее и составляет примерно 1 × 10 6 Па в пределе низкой скорости деформации. 13 Это значение модуля сдвига было преобразовано в модуль Юнга с учетом коэффициента Пуассона 0,33. В этой модели конечной деформации E можно вычислить как
, где градиент деформации F определяется как
Нижний индекс x 0 также указывает, что дифференцирование должно выполняться относительно начальных положений, а x относится к текущему положению материала.
Отметим, что использование закона Гука в качестве определяющего уравнения может привести к завышению прогнозов напряжений при больших перемещениях; однако в настоящее время отсутствуют определяющие уравнения, специально адаптированные для описания этого материала электролита.
Граничные условия
Смоделированная область электролита простирается в направлении z от одного литиевого электрода к другому. Простая проверка данных томографии не дает всей необходимой информации о смещении границ, поскольку область электролита не содержит идентифицируемых маркеров, поэтому необходимо сделать некоторые предположения.Предполагается, что электролит остается прочно прикрепленным к обеим литиевым поверхностям, так что смещения вдоль верхней границы раздела нет. Предполагается, что смещение вдоль нижней границы раздела (включая границу с глобулой) происходит только в направлении z . Кроме того, поскольку это осесимметричная система, на оси нет смещения в направлении — , а в осевом направлении на управляющей поверхности, совпадающей с осью, имеется нулевое напряжение.
На внешней радиальной поверхности первоначально цилиндрического контрольного объема накладывается граничное условие простого смещения, как показано на рисунке 1. Электролит закреплен на верхней и нижней границах раздела, поэтому внешняя поверхность первоначально цилиндрического контрольного объема может быть описывается кривой, описывающей смещение как функцию z. Истинное смещение внешней радиальной поверхности можно описать с помощью ряда синусов Фурье. Для простоты предполагается, что вертикального смещения нет, и что горизонтальное смещение этой внешней поверхности (первоначально при r = R) определяется выражением
На рис. 1 представлена схема расчетной области в исходном и деформированном состоянии.
Приблизить Уменьшить Сбросить размер изображения
Рисунок 1. Схема расчетной области в начальном и деформированном состояниях. Верхняя и нижняя поверхности остаются неподвижными, за исключением области глобулы. Внешний край домена смещается наружу, чтобы компенсировать проникновение глобулы и ограниченную сжимаемость электролита.
В этой форме используется только первый непостоянный член синусоидального ряда Фурье.Здесь z = Z — вертикальное положение верхней поверхности лития. Величина A была определена из оценки общего изменения объема, испытываемого электролитом в пределах контрольного объема, и рассчитана путем решения следующего квадратного уравнения в A :
Вывод этого уравнения приведен в дополнительной информации. При этом моделировании для полимерного электролита были приняты коэффициент Пуассона 0,33 и модуль сдвига 1 × 10 6 Па.
В нашем подходе локальная плотность тока рассчитывалась на основе различий между последовательными изображениями, в то время как напряжение рассчитывалось только на основе отдельного изображения. Количество заряда, прошедшего перед первым из двух изображений, используемых для расчета плотности тока, указано в подписях к рисункам. Например, когда для серии данных плотности тока сообщается, что пройденный заряд составляет 0 Кл / см 2 , эта плотность тока была получена путем анализа изображений, на которых количество заряда, нанесенного до изображений, составляло 0 Кл / см 2 и 8.27 С / см 2 .
Теоретически, модуль электролита должен быть примерно в два раза больше, чем у металлического лития, чтобы полностью подавить рост дендритов лития. 37 Металлический литий имеет модуль сдвига при комнатной температуре около 4 × 10 9 Па. 38 Полистирол- b -поли (этиленоксид) с молекулярной массой 240–260 кг / моль имеет модуль сдвига, который на 2–3 порядка ниже, чем при примерно 10 6 –10 7 Па при 90 ° C. 13 Гомополимер поли (этиленоксида) с молекулярной массой 360 кг / моль имеет модуль сдвига около 10 5 Па. 12 Отношение модуля сдвига электролита к металлическому литию составляет приблизительно 0,0003 для нашего полистирол — b — полиэтиленоксидная мембрана и 0,00003 для поли (этиленоксидного) гомополимера. Учитывая, что эти отношения намного меньше двух, даже усиленная мембрана из блок-сополимера-электролита слишком мягкая, чтобы полностью подавить рост дендритов в соответствии с теоретическими моделями.
На рис. 2а показана зависимость высоты глобулярного выступа от времени для двух самых быстрорастущих глобул лития, измеренных в нашем исследовании, названных глобула 1 и глобула 2. На рис. 2b показана рентгеновская микротомограмма глобулы лития после ее прокола. электролита и вызвал отказ элемента из-за короткого замыкания. Темно-серая фаза на изображении — это металлический литий, а светло-серая фаза — полимерный электролит. В основании глобулы лития видна примесная частица. Эта частица изначально находилась на границе раздела литий-полимер, как показано на рисунке 3.Белая стрелка указывает высоту части глобулы, которая выступает в блок-сополимерный электролит и в верхний литиевый электрод. Кроме того, в исследовании, проведенном Rosso et al., Отслеживали высоту выступа глобулы по мере ее роста через гомополимер поли (этиленоксида) 300 кг / моль. показан для сравнения. 23 В обоих исследованиях плотность приложенного тока составляла 0,175 мА / см 2 , а отклик по напряжению составлял около 0,07 В. Основное различие между двумя исследованиями заключается в толщине образца.В исследовании Rosso толщина электролита составляла 1,2 мм, в то время как толщина электролита в нашем исследовании составляла 30 мкм. Можно было бы ожидать, что более сильный градиент концентрации соли образуется в более толстом электролите с аналогичными транспортными свойствами для данной плотности тока. Влияние этой разницы толщин на морфологию глобул неизвестно.
Приблизить Уменьшить Сбросить размер изображения
Рис. 2. a Скорость роста глобул лития через полиэтиленоксид, усиленный сополимеризацией с полистиролом (SEO), сравнивается со скоростью роста дендрита лития через традиционный гомополимерный электролит на основе поли (этиленоксида). как сообщает Россо, М.и др. . в 2006 г. Высота выступа определяется высотой части литиевой глобулы, выступающей в слой полимерного электролита, как показано двойной белой стрелкой на b. Частица примеси видна в основании глобулы, как показано нижней белой стрелкой. b Рентгеновская томограмма, показывающая, что глобула 2 пробивает электролитную мембрану SEO. Темно-серая фаза представляет собой металлический литий, а светло-серая фаза — полимерный электролит.
Приблизить Уменьшить Сбросить размер изображения
Рисунок 3. Верхний ряд: рентгеновские томограммы плоскости yz в симметричном литий-полимерном электролит-литиевом элементе, показывающие рост глобулы лития. Темно-серая фаза представляет собой металлический литий, а светло-серая фаза — полимерный электролит. Маленькое светло-серое пятно в основании глобулы — это примесная частица, которая изначально присутствовала в литиевой фольге. Средний ряд: соответствующая плоскость xy, показывающая поверхность раздела между нижним литиевым электродом и полимерным электролитом. Круглая структура в центре изображения — это растущая глобула лития.Нижний ряд: 3D-изображения из рентгеновских микротомографических изображений, показывающие рост глобулы лития. Светло-серая область — это литиевый электрод, на котором осажден литий. Голубая область — это мембрана из твердого полимерного электролита. Светло-красная структура в основании глобулы — это примесная частица, которая изначально находилась в фольге металлического лития. Серая глобула лития для наглядности обведена проволочной сеткой. Белые стрелки указывают на частицу примеси, которая изначально присутствовала на границе раздела литий-полимер.Перед каждым изображением проходит заряд 0 C / см 2 b 8,27 C / см 2 c 16,53 C / см 2 d 35,82 C / см 2 e 54,72 C / см 2 .
Из данных, показанных на рисунке 2, очевидно, что скорость роста выступов лития значительно ниже в усиленном полистиролом блок-сополимерном электролите. Самая быстрорастущая глобула лития, измеренная в этом эксперименте, выступала в электролит полистирол-b -поли (этиленоксид) со скоростью 0.37 мкм / ч. В случае гомополимера поли (этиленоксида) глобула росла со скоростью 11 мкм / час, что на порядок быстрее, чем в блок-сополимере. Удивительно, что изменение модуля упругости электролита с 10 5 до 10 7 Па оказывает такое большое влияние на осаждение лития, поскольку оба значения значительно ниже модуля упругости металлического лития. Следующая серия рисунков поможет нам понять это явление.
На рис. 3 показаны рентгеновские томограммы и трехмерные изображения глобулы 2 на пяти стадиях во время ее роста через блок-сополимерный электролит.Исходное изображение, показанное в части 3а, показывает частицу примеси на нижней границе раздела литий-полимер. Шаровидная структура, видимая на последующих изображениях, еще не начала формироваться. Следующие изображения, показанные в частях 3b, 3c, 3d и 3e, показывают то же место в образце после 8,27 ° C / см 2 , 16,53 ° C / см 2 , 35,82 ° C / см 2 и 54,72 ° C / см 2 лития осаждалось на весь нижний литиевый электрод, как измеряли по показаниям потенциостата. В верхнем ряду показана плоскость yz через растущую глобулу лития.Изображения выравниваются по нижней части литиевого электрода, так что абсолютное положение изображения остается неизменным от кадра к кадру. Полимерный электролит поднимается по мере отделения лития от верхнего электрода и его осаждения на нижнем электроде. Частица примеси, которая изначально находилась на границе раздела литий-полимер на рис. 3а, остается в основании глобулы лития по мере ее роста. Яркая полоса, идущая в направлении y от границы раздела полимерного электролита через глобулу лития, является артефактом изображения, вызванным длинной и яркой границей раздела литий-полимер.Центральный ряд показывает плоскость xy через границу раздела между нижним литиевым электродом и полимерным электролитом для той же литиевой глобулы. Изображения в плоскостях zy, xy и yz получаются путем визуализации ортосрезов через стопку реконструированных рентгеновских микротомографических изображений. В нижнем ряду показан 3D-рендеринг растущей глобулы лития. Нижний серый слой — это нижний металлический литиевый электрод в литий-полимерно-литиевой симметричной ячейке. На объемных изображениях голубой слой представляет собой блок-сополимерную электролитную мембрану.Верхний литиевый электрод не был включен в рендеринг для ясности. Темно-серая глобула, образующаяся в центре изображений, заполнена литием. Нижний литиевый электрод становился толще, поскольку литий отделялся от верхнего электрода и осаждался на нижнем электроде. Глобула лития выросла в электролит по мере осаждения лития. В конце концов, глобула лития пробила электролитную мембрану, вызвав короткое замыкание.
На рис. 4 показаны высота, объем и площадь глобулы как функция толщины лития, осажденного вблизи глобулы, t Li .Абсцисса на рисунке 4 представляет толщину лития, нанесенного примерно на 5–10 мкм от края глобулы, измеренную по изображениям рентгеновской микротомографии. Высота глобулы, измеренная от основания эллипсоидальной глобулы до кончика, увеличивается лишь немного быстрее, чем окружающий литиевый электрод. Положительное отклонение от линии y = x на рис. 4a соответствует высоте кончика глобулы, выступающей в электролит. Остальная часть глобулы оказывается захороненной плоскими отложениями лития, окружающими глобулу.
Приблизить Уменьшить Сбросить размер изображения
Рис. 4. Высота (a), объем (b) и площадь (c) двух наиболее быстро растущих глобул лития показаны как функция от количества осажденного лития. Обратите внимание, что все эти количества, включая количество осажденного лития, измеряются непосредственно с помощью рентгеновских микротомографических изображений. На вставленных изображениях показано, что определяется как высота, объем и площадь глобулы.Разница между высотой глобулы, показанной в a и линией y = x, представляет собой высоту глобулярного выступа в мембране полимерного электролита.
Поскольку изображения рентгеновской микротомографии дают трехмерную информацию о внутренней части образца, можно измерить объем глобулы как функцию осажденного лития, t Li . Объем глобулы, V г , увеличивается квадратично как функция т Li (кривая на рисунке 4b представляет V г = 33 т 2 Li + 915 т Li — 4437).Можно также измерить площадь глобулы на плоской границе раздела нижнего литиевого электрода и электролита. Любопытно, что из рисунка 4c видно, что глобула увеличивалась не только по высоте, но и по площади. Глобула быстро расширялась на начальных стадиях роста, затем начала выравниваться, достигнув площади около 4000–5000 мкм 2 .
Поскольку метод визуализации рентгеновской микротомографии позволяет измерять толщину лития, нанесенного в каждой точке нижнего литиевого электрода, можно использовать закон Фарадея для расчета количества заряда, нанесенного в каждой точке на поверхности нижнего литиевого электрода.С помощью двух последовательных изображений можно отобразить количество заряда, нанесенного на данный пиксель на поверхность лития. Разделение этого значения на временной интервал между изображениями дает локальную плотность тока (уравнение 1). На рисунке 5 показаны карты плотности тока для четырех различных стадий роста глобулы лития 2. Карты, показанные в верхнем ряду, дают топографию границы раздела между нижним литиевым электродом и полимерным электролитом. В центре карт видна вершина глобулы лития.Цвет соответствует плотности тока. Общая средняя плотность тока, обеспечиваемая потенциостатом, составляла 0,175 мА / см 2 . Плотность тока 0 мА / см 2 отображается черным на цветовой шкале, а 0,175 мА / см 2 отображается темно-синим. Обратите внимание, что на ранних стадиях роста глобулы большая часть текущей карты темно-синего цвета. Это указывает на количественное соответствие между локальным током, определенным с помощью рентгеновской микротомографии, и током, подаваемым потенциостатом.
Приблизить Уменьшить Сбросить размер изображения
Рисунок 5. Локальная плотность тока нанесена на карту для четырех стадий роста глобулы лития 2. a На начальных стадиях возмущение на границе раздела литий / электролит приводило к плотности тока выше средней на вершине маленькой глобулы. Эту плотность тока измеряли между моментами времени 0 C / см 2 и 8,27 C / см 2 . b По мере роста глобулы ток делокализовался от кончика глобулы. Эта карта была измерена между временными точками 8,27 C / см 2 и 16.53 С / см 2 . c Эта делокализация была более выраженной между 16,53 C / см 2 и 35,82 C / см 2 . d Поскольку площадь глобулы увеличивалась на поздних стадиях роста глобулы, текущая концентрация, вызванная глобулами, значительно снижалась. Эта карта была измерена между временными точками 35,82 C / см 2 и 54,72 C / см 2 .
На рисунке 5а плотность тока была сосредоточена на вершине выступающей глобулы лития. Ожидается, что эта текущая концентрация на кончике выступа основана на традиционных теориях роста дендритов. 29,30 Однако по мере роста глобулы плотность тока делокализовалась от кончика выступа к периметру. Это дает ясную картину расширения глобулы лития. В конце концов глобула стала достаточно широкой, так что плотность тока на глобуле лития была лишь немного выше, чем на окружающем ее плоском электроде.
Мы предполагаем, что эффект делокализации тока, показанный на рисунках 5b и 5c, вызван механической жесткостью полимерного электролита.Поскольку блок-сополимерный электролит является жестким, существует штраф за событие восстановления иона лития на кончике глобулы, где полимер сильно деформирован. Чтобы количественно оценить этот эффект, мы используем ранее измеренные значения модулей в сочетании с визуализацией рентгеновской микротомографии, представленной в этом исследовании, для расчета и картирования напряжения в полимере. 13
На рис. 6 показана карта вертикальной составляющей вектора напряжения на первоначально горизонтальных управляющих поверхностях в полимерном электролите из растущей глобулы лития.Вектор напряжения основан на начальной площади и силе относительно фиксированного количества материала. Одномерный профиль глобулы представляет собой бесцветную область в левой нижней части графика. Кончик глобулы находится в радиальном положении 0 мкм. Этот вектор напряжения, выраженный в Па, показан цветом на графике. Карты напряжений были рассчитаны на основе формы глобулы после осаждения лития 8,27 Кл / см 2 , 16,53 Кл / см 2 , 35,82 Кл / см 2 и 54,72 Кл / см 2 лития на нижний литий. электрод, как показано на рисунках 6a – 6d.График на рисунке 6d показывает максимальные сжимающие и растягивающие напряжения в полимере в зависимости от пройденного заряда. На ранних стадиях роста глобула росла в основном в высоту, и, следовательно, как сжимающее напряжение на вершине глобулы, так и растягивающее напряжение по периметру глобулы существенно увеличивались между 8,27 Кл / см 2 и 16,53 Кл / см 2 , как показано на рисунке 5e. Эти напряжения ослабляются по мере расширения глобулы на промежуточных стадиях роста. Максимальное сжимающее напряжение возникало на конечном расстоянии над наконечником, а не на наконечнике.Это следствие сильного растяжения электролита.
Приблизить Уменьшить Сбросить размер изображения
Рис. 6. Карты напряжений в полимерном электролите из-за сжатия растущей глобулы лития. Напряжения основаны на модуле упругости электролита 10 6 Па. Полимерный электролит испытывал напряжения сжатия на вершине глобулы лития и напряжения растяжения по периметру.a 8,27 C / см 2 b 16,53 C / см 2 c 35,82 C / см 2 d 54,72 C / см 2 e Максимальные сжимающие (черные кружки) и растягивающие (серые квадраты) напряжения показаны как функция пройденного заряда.
Карты плотности тока, показанные на рисунке 5, были усреднены в радиальном направлении вокруг вершины глобулы, и полученные кривые показаны на рисунке 7a. Пиковая плотность тока смещается от вершины глобулы к периметру по мере роста глобулы. При прохождении заряда было меньше 16.53 Кл / см 2 , плотность тока в радиальных положениях между 20 и 80 мкм от центра глобулы составляла около 0,175 мА / см 2 , как и ожидалось на основе настройки потенциостата. На более поздних стадиях осаждения плотность тока в радиальных положениях между 50 и 80 мкм от центра глобулы увеличивалась до значения 0,3 мА / см 2 . Причина увеличения средней плотности тока неизвестна. Однако стоит отметить, что толщина литиевого слоя, нанесенного на основе настройки потенциостата в этом переходе, составляет 48 мкм, что существенно больше толщины электролита.Небольшие дефекты ячейки могут влиять на локальные плотности тока в этом режиме.
Приблизить Уменьшить Сбросить размер изображения
Рис. 7. a Кривые, показывающие плотность тока как функцию радиального расстояния от кончика глобулы для пяти стадий роста глобулы. b Напряжение на границе раздела литий-полимер как функция радиального расстояния от кончика глобулы. Обратите внимание, что радиальное положение, в котором напряжение становится отрицательным, совпадает с максимальной плотностью тока для последующего временного шага, показанного в части a.На вставке в увеличенном масштабе показаны напряжения около нуля МПа. На этом графике очевидны отрицательные или растягивающие напряжения. c Параболическая подгонка к глобуле лития, используемая для моделирования напряжения в блок-сополимерном электролите (линии) и соответствующих данных о толщине электролита на рентгеновских томограммах (маркеры).
Вертикальная составляющая вектора напряжения на границе раздела литий-полимер представлена как функция радиального положения на рисунке 7b. Напряжение на границе раздела существенно увеличилось по мере того, как глобула значительно выросла в высоту.Эти напряжения в электролите ослабляются по мере расширения глобулы на промежуточных и поздних стадиях роста. На более поздних стадиях напряжение на границе раздела достигло максимума в радиальном положении 6 мкм. Это происходит из-за делокализации максимума напряжения от наконечника, как описано выше. На рис. 7с показано усредненное в радиальном направлении расстояние между электродами, извлеченное из рентгеновских микротомографических изображений, и соответствующие параболические посадки, используемые для моделирования напряжений в полимере. На рисунке 7b напряжение опускается ниже нуля в радиальных положениях, которые совпадают с краем глобулы, как показано на рисунке 7c.Кроме того, радиальные положения, которые имеют пиковую плотность тока, показанную на рисунке 7a, совпадают с радиальными положениями, которые показывают отрицательные или растягивающие напряжения на рисунке 7b. На последней стадии роста глобулы пройденный заряд равен 54,72 Кл / см 2 , напряжения по периметру глобулы были сжимающими и соответствующего пика плотности тока больше не было (рис. 7а).
Основываясь на теории, разработанной Ньюманом и Монро, можно было бы ожидать, что кинетика осаждения лития будет замедляться в областях напряжения сжатия и ускоряться в областях напряжения растяжения. 37 Мы видим, что глобула расширяется, поскольку литий предпочтительно осаждается по периметру глобулы. По мере того как глобула продолжает расти, напряжения на кончике глобулы немного ослабляются, вероятно, из-за уплощения кончика глобулы. Важно отметить, что можно было ожидать, что геометрический эффект концентрации тока на кончике глобулы будет уменьшаться по мере того, как кончик глобулы уплощается. 30
На рисунке 8a мы построили график зависимости локальной плотности тока от местного напряжения. Плотность тока не показывает сильной зависимости от напряжения на этом графике.На ранних стадиях, как и ожидалось, плотность тока уменьшается с увеличением напряжения. Однако на более поздних стадиях роста плотность тока, по-видимому, увеличивается с увеличением напряжения. Важным параметром, который следует учитывать в этом случае, является радиус кривизны растущей глобулы. Глобула расширяется по мере роста, уменьшая движущую силу для роста глобулы, поскольку ток имеет тенденцию концентрироваться в областях с малым радиусом кривизны. Следовательно, важно нормализовать плотность тока для этого изменяющегося радиуса кривизны литиевого электрода.Плотность заряда C на поверхности проводника, как известно, приблизительно пропорциональна четвертому корню из гауссовой кривизны, K , поверхности в электростатической системе. 39,40
Приблизить Уменьшить Сбросить размер изображения
Рис. 8. a Плотность тока не коррелирует напрямую с напряжением на границе раздела литий-полимер. b Радиус кривизны металлического лития на глобуле показан как функция расстояния от кончика глобулы.Он минимален на кончике глобулы и увеличивается с увеличением радиального положения. c Нормализованная плотность тока в заданном радиальном положении отображается в зависимости от соответствующего напряжения в этом положении. d Нормированная плотность тока как функция энергии деформации в заданном радиальном положении.
Кривизна по Гауссу для сферы равна:
, где R — радиус сферы или радиус кривизны. Следовательно, в простейшей модели можно было бы ожидать, что локальная плотность тока в данном радиальном положении, i r , будет пропорциональна плотности заряда, или
, где R r — радиус кривизны в радиальном положении r .Кроме того, можно было бы ожидать, что плотность тока будет обратно пропорциональна расстоянию между электродами, t p , из-за омических потерь. Чтобы учесть эти факторы, мы нормируем локальную плотность тока следующим образом:
Мы предположили, что плотность заряда на поверхности электрода в нашей динамической системе аналогична плотности заряда в электростатической системе. В случае симметричного литий-полимерного элемента электроны движутся через металлический литий значительно быстрее, чем скорость, с которой ионы лития переносятся к поверхности электрода, из-за большого несоответствия электронной проводимости Li (10 7 См / см) и ионной проводимости электролита (10 −4 См / см).Поэтому разумно предположить, что распределение электронов в литиевом электроде определяется электростатикой. В электростатических системах электронный заряд имеет тенденцию концентрироваться на острых краях или областях с малым радиусом кривизны на электронно проводящих материалах в электрическом поле. 39–41 Поскольку плотность тока, используемая в этом исследовании, намного ниже предельного тока ( i L = 12 мА / см 2 ), более высокая концентрация электронов должна привести к увеличению скорости восстановления ионов лития. на кончике глобулы.
Радиус кривизны рассчитывается по параболической подгонке к границе раздела литий-полимер. На рисунке 8b показан радиус кривизны как функция радиального положения. Нормализованная плотность тока показана как функция напряжения на четырех различных стадиях роста глобул на рисунке 8c. Во всех случаях нормализованная плотность тока уменьшалась по мере увеличения напряжения, что означает, что измеренная плотность тока была ниже, чем геометрические эффекты могли учесть в областях с высоким локальным напряжением.Это согласуется с теорией, которая предполагает, что сжимающие напряжения на границе раздела литий-полимер должны замедлять кинетику осаждения лития. Плотность энергии деформации определяется как:
где σ — напряжение, а — деформация. На рис. 8г показана нормализованная плотность тока как функция плотности энергии деформации. Плотность энергии деформации в электролите, по сути, является величиной, которая, как можно было бы ожидать, повлияет на плотность тока. Если плотность энергии деформации высока, существует большой энергетический штраф за восстановление иона лития в этом месте.Нормализованная плотность тока быстро уменьшалась по мере увеличения плотности энергии деформации, а затем выходила на плато при плотности энергии деформации около 1 пДж / мкм 3 .
Таким образом, существует несколько эффектов компаундирования, которые влияют на кинетику осаждения лития на растущую глобулу лития в мембране из твердого полимерного электролита. Во-первых, по мере увеличения модуля электролита увеличивается энергетический штраф за электроосаждение лития на кончике глобулы. Кроме того, существует энергетическая движущая сила для осаждения по периметру глобулы.Комбинация этих эффектов приводит к расширению глобулы лития, что, следовательно, снижает эффект концентрации тока на кончике глобулы.
Рост глобул лития через блок-сополимерный электролит полистирол — b — поли (этиленоксид) контролировали в симметричной литий — полимер — литиевой ячейке с помощью жесткой рентгеновской микротомографии. Изменение высоты глобулы, объема и площади проекции измеряли в зависимости от количества лития, осажденного в области, локальной для растущей глобулы.Локальная плотность тока была нанесена на карту вблизи растущей глобулы путем измерения количества заряда, нанесенного в каждом месте, как функции времени заряда. Карты плотности тока подчеркивают делокализацию плотности тока от вершины глобулы на ранних стадиях роста к периметру глобулы. На поздних стадиях роста глобула значительно расширилась, что привело к минимальной концентрации тока на глобуле лития.
Профили напряжений в мембране полимерного электролита были рассчитаны на основе деформации полимера из-за образования глобул и модуля полимера на основе ранее опубликованных реологических измерений. 13 Профили напряжения показали область напряжения сжатия на вершине глобулы и напряжения растяжения на периметре глобулы. Учитывая этот профиль напряжения, можно было бы ожидать замедленной кинетики осаждения на вершине глобулы и более быстрого осаждения по периметру. Это согласуется с экспериментальными картами плотности тока. Кроме того, по мере расширения глобулы можно было ожидать уменьшения геометрического эффекта концентрации тока, вызванного кривизной растущей глобулы. Это также согласуется с минимальной концентрацией тока, показанной на картах плотности тока на поздних стадиях.Следовательно, по мере того, как глобулы лития росли в жесткую мембрану из полимерного электролита, напряжения в электролите не только подавляли вертикальный рост глобулы за счет замедления кинетики осаждения на вершине, но также приводили к делокализации тока по периметру глобулы и последующему расширению глобулы. дальнейшее замедление его роста в вертикальном направлении.
Список символов
| a | Площадь пикселя (см 2 ) |
| А | Изменение объема электролита в контрольном объеме (м 3 ) |
| С | Плотность заряда |
| E | Модуль Юнга (Па) |
| Ф | Постоянная Фарадея (Кл / моль) |
| Ф. | Градиент деформации |
| I | Тензор идентичности |
| i jk | Плотность тока в пикселе j, k (мА / см 2 ) |
| i L | Предельный ток (мА / см 2 ) |
| i норма | Нормированная плотность тока (мА / см 2 * мкм 3/2 ) |
| i r | Плотность тока в радиальном положении r (мА / см 2 ) |
| К | гауссова кривизна |
| M Li | Молекулярная масса металлического лития (г / моль) |
| r | Радиальное положение (мкм) |
| R | Исходное радиальное положение (мкм) |
| R | Радиус закругления |
| R R | Радиус закругления в радиальном положении r |
| т | Время (с) |
| т Li | Толщина нанесенного лития (мкм) |
| т п | Расстояние между литиевыми электродами (мкм) |
| U | Плотность энергии деформации (пДж / мкм 3 ) |
| V г | Объем глобулы лития (мкм 3 ) |
| V jk | Объем лития, нанесенного на пиксель j, k (см 3 ) |
Греческий
| Штамм | |
| ν | Коэффициент Пуассона |
| ρ | Плотность металлического лития (г / см 3 ) |
| σ | Напряжение (МПа) |
| σ | Тензор напряжений Коши |
Первичное финансирование работы было предоставлено Программой электронной микроскопии мягкого вещества Управления науки, Управления фундаментальных энергетических наук, материаловедения и инженерного отдела США.S. Министерство энергетики по контракту № DE-AC02-05Ch21231 (KC11BN). Эксперименты с жесткой рентгеновской микротомографией проводились в усовершенствованном источнике света, который поддерживается директором отдела науки Управления фундаментальных энергетических наук Министерства энергетики США по контракту № DE-AC02-05Ch21231. Кэтрин Дж. Гарри была поддержана исследовательской стипендией Национального научного фонда. Венката Сринивасана и Кеннета Хига поддержал помощник министра по энергоэффективности и возобновляемым источникам энергии Управления автомобильных технологий США.S. Министерство энергетики по контракту № DE-AC02-05Ch21231 в рамках Программы перспективных исследований аккумуляторных материалов (BMR). Мы также хотели бы поблагодарить профессора Брайана МакКлоски и профессора Джона Ньюмана за полезные технические обсуждения и советы.
Амбиполярный цинк-полийодидный электролит для водной проточной окислительно-восстановительной батареи с высокой плотностью энергии
Abstract
Проточные окислительно-восстановительные батареи привлекают широкое внимание для электрохимического накопления энергии из-за их уникальной архитектуры и преимуществ, но прогресс пока ограничен их низкая плотность энергии (~ 25 Вт · ч · л −1 ).Здесь мы сообщаем о проточной водной цинк-полииодидной батарее с высокой плотностью энергии. Используя высокорастворимую окислительно-восстановительную пару йодид / трииодид, продемонстрирована плотность энергии разряда 167 Вт · ч · l -1 с почти нейтральным 5,0 M электролитом ZnI 2 . Исследование ядерного магнитного резонанса и моделирование на основе теории функционала плотности вместе с данными испытаний на поток показывают, что добавление спирта (этанола) вызывает образование лиганда между кислородом на гидроксильной группе и ионами цинка, что расширяет температурное окно стабильного электролита до от — От 20 до 50 ° C, улучшая дендрит цинка.Благодаря высокой плотности энергии и своей безвредной природе, не содержащей сильных кислот и коррозионных компонентов, проточные цинк-полийодидные батареи являются многообещающим кандидатом для различных приложений хранения энергии.
В отличие от традиционных батарей, проточные системы электрохимического накопления энергии разделяют накопление энергии и выработку энергии, сохраняя электроактивные частицы в протекающих извне электролитах (то есть анолите и католите), поддерживая окислительно-восстановительные реакции на поверхности электрода. внутри стека1,2.Эта уникальная архитектура позволяет проточным окислительно-восстановительным батареям (RFB) независимо масштабировать мощность и / или энергию — характерное преимущество наряду с высокой безопасностью, необходимой энергетической отрасли для периодической интеграции возобновляемых источников энергии и других сетевых услуг3. Плотность энергии ( E , в зависимости от состава и объемов электролита (то есть активных материалов)) RFB обычно измеряется как количество энергии, запасенной на единицу объема электролита, и может быть описана концентрацией активного окислительно-восстановительного потенциала. ( C a ) и напряжение ( В) в форме уравнения (1):
, где N — количество электронов, участвующих в окислительно-восстановительной реакции, F — постоянная Фарадея ( 26.8 Ач моль -1 ) и n — количество объемов электролита, участвующих в окислительно-восстановительных реакциях. Улучшение E требует максимизации C a и V при минимизации n.
Несмотря на постоянный прогресс3,4, плотность энергии традиционных водных RFB значительно ниже, чем у бюджетных литий-ионных батарей, таких как батареи с катодами LiFePO 4 (> 223 Втч l на основе -1 ). на уровне ячейки5).Традиционные водные RFB, такие как полностью ванадиевые (ванадиевая окислительно-восстановительная батарея, VRB) и системы Fe / Cr, как правило, ограничены значением <25 Вт · ч l -1 как низким значением V из-за электролиза воды, так и низким значением C. a из-за относительно низкой растворимости активных частиц6,7,8. Хотя обычно считается, что плотность энергии не является критическим критерием производительности для стационарных применений, низкая плотность энергии проточных батарей, тем не менее, в значительной степени исключила себя из других рынков хранения энергии.Следовательно, повышение плотности энергии является необходимостью для использования проточной батареи для приложений, отличных от стационарного накопления энергии. Хотя был достигнут прогресс в достижении высокого значения V (> 2,0 В) с помощью различных неводных конструкций RFB3, например, на основе полностью органических активных материалов9 и окислительно-восстановительных неинноцентных лигандов10, концентрация окислительно-восстановительных частиц в настоящее время составляет ограничивается примерно 0,1 M или менее, что приводит к плотности энергии <10 Вт · ч · l -1 , даже для более высоких напряжений элемента.
Для разработки проточной батареи с высокой плотностью энергии значение n в уравнении (1) необходимо минимизировать до 1. Традиционные системы RFB, такие как VRB и Fe / Cr RFB, используют различные катионные окислительно-восстановительные пары в анодные и катодные полуэлементы. Значение n в этих системах равно 2 с учетом задействования двух объемов жидкого электролита с обеих сторон. По-видимому, привлекательны гибридные проточные батареи, в которых один полуэлемент имеет окислительно-восстановительную реакцию с участием не полностью растворимых окислительно-восстановительных компонентов (например, металлический электрод).Хотя наличие металлического электрода ограничивает полную диссоциацию энергии и мощности в гибридной проточной батарее, с этой конструкцией можно достичь высокой плотности энергии в сочетании с электролитом, обладающим амбиполярными характеристиками, поскольку значение n может быть снижено до 1. В таких электролитах катионные и анионные ионы из одного растворимого соединения являются энергонесущими окислительно-восстановительными активными частицами, что устраняет необходимость в неактивных противоионах, таких как Cl — и SO 4 2- обычно используется в системах VRB и Fe / Cr RFB, при этом позволяя проточной системе использовать незначительное количество электролита в одной из полуэлементов.Кроме того, при заданном напряжении ячейки ( В, ) необходимо максимизировать C a для достижения высокой плотности энергии. Таким образом, бифункциональные электролиты, в которых, по меньшей мере, одна из активных разновидностей действует как носитель заряда, особенно привлекательны из-за снижения потребности в высококонцентрированном поддерживающем электролите, который может отрицательно повлиять на максимальную концентрацию, достижимую для активных разновидностей. Традиционные водные проточные батареи Zn / Br (ZBB) 3 и недавно разработанные неводные Li – S и Li – йодные RFB11,12,13 следуют вышеуказанным стратегиям проектирования.Однако плотность энергии систем ZBB и Li – S снижается из-за ограниченных достижимых максимальных концентраций растворимых окислительно-восстановительных частиц (ZBB составляет ~ 65 Вт · ч l -1 (ссылки 6, 8), в то время как Li-S RFB составляет ~ 108 Вт · ч l −1 , демонстрируемый статической ячейкой на основе растворимых фаз Li 2 S y 12). В системе ZBB, хотя известно, что ZnBr 2 обладает высокой растворимостью14, заряженные частицы брома (Br 2 ) нерастворимы в водном растворе, что существенно ограничивает достижимую плотность энергии в системе ZBB15 в дополнение к высокой коррозионной активности. опасные для здоровья вещества окислительно-восстановительной пары Br — / Br 2 .С другой стороны, Li – S и Li – йодные RFB сталкиваются с многочисленными проблемами, такими как высокая стоимость, легковоспламеняющиеся компоненты, сложность масштабирования и низкая проводимость неводного электролита и так далее. Поэтому очень важно идентифицировать новые окислительно-восстановительные частицы с высокой растворимостью и экологичностью, чтобы обеспечить высокую безопасность водной проточной батареи с высокой плотностью энергии.
На основании вышеизложенного, мы демонстрируем, что цинк-полийодидный электролит обладает желаемыми амбиполярными и бифункциональными характеристиками, а также высокой растворимостью и доброкачественной природой, что позволяет создать водный гибрид RFB с высокой плотностью энергии.Благодаря высокой растворимости окислительно-восстановительных соединений I — / I x —, цинк-полийодидная проточная батарея (ZIB) имеет теоретическую плотность энергии ~ 322 Вт · ч · л -1 при пределе растворимости ZnI 2 в воде (4500 г л −1 , 7,0 М). Мы демонстрируем здесь плотность энергии разряда 166,7 Вт · ч · l −1 с 5,0 M электролитами ZnI 2 , что почти в семь раз больше, чем у существующих водных RFB (VRB: ~ 25 Вт · ч · l −1 ) и приближается к плотности энергии. недорогих LiFePO 4 катодных литий-ионных аккумуляторов.Учитывая значительное присутствие неактивных материалов в ионно-литиевых батареях (40–50 вес.% (Ссылка 16)), проточная батарея с высокой плотностью энергии является еще более привлекательной, поскольку она не содержит неактивных и дорогостоящих компонентов, таких как вкладки. , фольга для токосъемников, корпуса и связующие для электродов и т. д. Система ZIB поддерживает привлекательную архитектуру конструкций проточных батарей с такими благоприятными характеристиками, как высокая безопасность и отсутствие опасных материалов / сильных кислот.
Результаты
Схема водных Zn – I проточных батарей
Схема предлагаемого ZIB представлена на рис.Катионообменная мембрана (CEM) (Nafion) зажата между двумя электродами из нетронутого графитового войлока (GF), в то время как растворы йодида цинка прокачиваются через обе полуячейки. Хотя окислительно-восстановительная пара Zn / йод ранее предлагалась для первичной батареи17, ее применение во вторичных RFB на жидкой основе невозможно из-за чрезвычайно низкой растворимости I 2 . Однако растворимость I 2 значительно увеличивается в присутствии иодида из-за образования полииодид-ионов18:
Zn – I RFB и его электрохимических характеристик.( a ) Схематическое изображение предлагаемой системы ZIB. ( b ) CV 0,085 M ZnI 2 на стеклоуглеродном электроде при скорости сканирования 50 мВ с -1 . ( c ) Типичные кривые заряда-разряда при 1,5 M ZnI 2 при плотности тока 20 мА · см −2 . ( d ) Плотность энергии заряда и разряда как функция концентрации I —. На вставке приведена зависимость концентрации от плотности энергии для нескольких современных химических реактивов RFB на водной основе для сравнения3,6,7,8.
Сообщается, что ионы трииодида являются преобладающими видами в водном растворе из-за низкой стабильности других полииодидов более высокого порядка18,19. Предполагается, что преобладающая окислительно-восстановительная реакция в системе протекает между I 3 — / I —, как показано в уравнении (3) из-за высокой скорости переноса заряда реакции восстановления I 3 —19. , 20. Потенциально возможен ряд других окислительно-восстановительных реакций18,20. Однако существуют значительные потенциальные разделения за пределами редокс-пары I 3 — / I — .Таким образом, Zn-полииодид RFB создается на основе следующих окислительно-восстановительных реакций:
Водный электролит с обеих сторон состоит из соли ZnI 2 , растворенной в воде. Во время процесса заряда металлический цинк наносится на отрицательный электрод гальваническим способом, в то время как полииодид-ионы образуются в растворе на положительной стороне. При разряде происходят обратные процессы. Бифункциональные ионы цинка действуют как носители заряда, переносимые через мембрану, и как активные частицы в отрицательной полуячейке.
Электрохимические характеристики водных проточных батарей Zn – I
Циклическая вольтамперограмма 0,085 М электролита ZnI 2 на стеклоуглеродном рабочем электроде в диапазоне от -1,6 до 1,0 В (по сравнению с Ag / AgCl) при скорости сканирования 50 мВ с -1 показывает две пары пиков окислительно-восстановительной реакции (), соответствующих окислительно-восстановительной реакции Zn / Zn 2+ при отрицательном результате и I 3 — / I — при отрицательном результате. положительные полуэлементы соответственно. Из-за почти нейтральной природы растворов (значения pH: 3-4 при 0% -ном состоянии заряда, SOC) и низкого потенциала окислительно-восстановительной пары I 3 — / I — (0.536 В относительно SHE), ни H 2 , ни O 2 не наблюдается во всем диапазоне сканирования.
Оценка ячейки проводилась при постоянной плотности тока 20 мА · см -2 . Эксперимент по заряду / разрядке разработан с учетом как верхнего предела напряжения, так и емкости, что позволяет всем иодид-ионам на катодной стороне окисляться до трииодид-ионов, избегая при этом образования избытка I 2 (для предотвращения осаждения).Электрохимические характеристики системы ZIB в зависимости от концентраций ZnI 2 показаны на рисунке (Плотности тока составляют 20 для 0,5–3,5 M электролитов ZnI 2 и 5 мА · см –2 для 0,5–3,5 M и 5,0 M ZnI 2 электролита соответственно.) И профили напряжения показаны на дополнительном рис. 1. представляет собой типичную кривую напряжения заряда-разряда для электролита 1,5 M ZnI 2 при плотности тока 20 мА · см −2 . Как видно из Дополнительного Рис.1 видно, что напряжение холостого хода уменьшается с 1,430 до 1,270 В с увеличением концентрации ZnI 2 с 0,5 до 3,5 М, в то время как кулоновский КПД (КЭ) остается почти постоянным на уровне ~ 99%, что указывает на высокую катионную селективность мембрана, используемая в проточной ячейке. В качестве CEM мембрана Nafion, используемая в данном исследовании, способствует высоким значениям CE из-за пренебрежимо малого кроссовера активных частиц I — или I 3 — из-за их анионной природы и большого ионного радиуса.Незначительный кроссовер анионов подтверждается анализом рентгеновской фотоэлектронной спектроскопии использованной мембраны Nafion в ZIB (дополнительный рис. 2; дополнительные методы), который не показывает никаких доказательств I, в то время как было идентифицировано большое количество Zn. В традиционных RFB, таких как VRB и Fe / Cr RFB, в качестве носителей заряда часто используются протоны, обычно вводимые через различные кислоты в фоновых электролитах. Когда используется CEM, одновременный перенос активных катионных ионов (таких как ионы V и Fe) вместе с протонами приводит к проблемной проблеме кроссовера, часто наблюдаемой в этих системах, что приводит к низкому CE (<96%) и энергии потери от последующих реакций саморазряда после кроссовера.В амбиполярной и бифункциональной конструкции ZIB ионы цинка используются как в качестве окислительно-восстановительных активных частиц, так и в качестве носителей заряда, устраняя конкуренцию транспорта между ними. Вместе с высокой селективностью мембраны Nafion в отношении йодид / трииодид-анионов ZIB обеспечивает значительно улучшенный показатель CE. Кроме того, значения энергоэффективности (EE) снижаются с 90,9 до 76,0% при увеличении концентрации ZnI 2 с 0,5 до 3,5 M, что в основном объясняется снижением эффективности по напряжению (VE) из-за повышения сопротивления электролита, возникающего от увеличения концентрации электролитов.Электрохимические характеристики, включая значения CE, VE и EE, проточной ячейки ZIB с 3,5 M электролитом ZnI 2 , циклически повторяющимся при различных плотностях тока заряда / разряда, показаны на дополнительном рисунке 3a и в дополнительной таблице 1. С учетом прерывистого режима работы. Для многих приложений хранения энергии в масштабе энергосистемы низкий саморазряд важен для высокой производительности. Таким образом, испытание отложенного разряда проводится на 2,5 M электролите ZnI 2 после различных периодов отдыха после полной зарядки.Как показано на дополнительном рис. 3b, кривые напряжения разряда (отдых после полной зарядки в течение 30 с и 1 день) перекрываются друг с другом, что свидетельствует о превосходной стабильности системы ZIB и полииодид-ионов даже в полностью заряженном состоянии.
Таблица 1
Зависимость характеристик ZIB от концентрации ZnI 2 .
