Характеристики ТДТ-40. Обзор трелевочного трактора, скиддера ТДТ-40
Разместите заявку на покупку техники или запчастей для спецтехники!
отправить заявкуВаша заявка отправлена.
Источник фото: spez-tech.comФото ТДТ-40
Решение о разработке нового трактора, более мощного и надежного, было принято в начале 50-х годов прошлого столетия. Серийное производство машины, спроектированной специалистами Минского тракторного завода, стартовало в 1956 году. И уже к концу первого года было собрано 3 430 экземпляров. В 1957 году выпуск модели был также налажен на Онежском тракторном заводе. Производство продолжалось до конца 60-х годов, когда трактор был замещен более современным ТДТ-55.
Интересным является тот факт, что в 1969 году техническая документация на производство ТДТ-40 была передана Китаю. Позже на основе модели был разработана модернизированная версия, новый трелевочный трактор китайской сборки получил название J-65a.
Двигатель ТДТ-40
Изначально трактор комплектовали двигателем Д-40Т. Тип дизеля: четырехтактный бескомпрессорный вихрекамерный. Пусковой двигатель приводился в действие ручным способом — для этого использовался шнур, наматываемый на маховик. Двигатель закрывался капотом со съемными боковинами.
Тип дизеля: четырехтактный бескомпрессорный вихрекамерный. Пусковой двигатель приводился в действие ручным способом — для этого использовался шнур, наматываемый на маховик. Двигатель закрывался капотом со съемными боковинами.
Источник фото: techmonuments.livejournal.comФото ТДТ-40
Уже в первый год производства специально для данного трактора был сконструирован новый 60-сильный дизельный двигатель Д-50, который был мощнее предыдущей модели на 10 л.с. Кроме этого, мотор был компактнее и меньше весил (на 350 кг).
Приведем характеристики двигателя Д-40Т.
Марка двигателя | Д-40Т |
Номинальная мощность | 40 л.с. |
Максимальная мощность | 45 л.с. |
Число оборотов в минуту | 1 500 об/мин |
Пусковой двигатель, марка | ПД-10М |
Масса, грузоподъемность
Конструктивная масса трактора составляет 6 500 кг, грузоподъемность достигает 2 500 кг. Отметим также, что значение удельного давления на почву находится на уровне 0,45 кгс/кв.см.
Отметим также, что значение удельного давления на почву находится на уровне 0,45 кгс/кв.см.
Габариты ТДТ-40
Габаритная длина при поднятом погрузочном щите | 4 500 мм |
Габаритная ширина по гусеницам | 1 830 мм |
Габаритная ширина по ручкам кабины | 2 014 мм |
Габаритная высота | 2 430 мм |
Дорожный просвет | 540 мм |
Ширина колеи | 1 480 мм |
База | 2 040 мм |
Технические характеристики
Главное предназначение ТДТ-40 — формирование воза, погрузка на щит трактора и транспортировка хлыстов из лесосеки. Для этого машина комплектовалась лебедкой и специальным погрузочным устройством. Трактор был эффективен при эксплуатации в условиях бездорожья, находил широкое применение на лесоповалах, на сплавных и транспортных работах. В том числе трактор мог передвигаться по лесосекам с пнями, поваленными деревьями и т.д.
В том числе трактор мог передвигаться по лесосекам с пнями, поваленными деревьями и т.д.
Источник фото: nacekomie.ruГрузоподъемность трактора ТДТ-40 составляет 2,5 т
Трактор ТДТ-40 имел рамную конструкцию. Двигатель и кабина располагались в передней части, задние колеса были ведущими. Подвеска являлась балансирной с листовыми рессорами (присутствовало два главных балансира и четыре каретки). Для уменьшения риска повреждения ходовой части при избыточном натяжении гусеницы, направляющие колеса имели амортизирующее устройство. Если же говорить о гусеницах, то они были мелкозвенчатыми с литыми стальными звеньями (последние изготавливались из углеродистой стали и при производстве для больше прочности проходили термообработку).
Для работы в темное время суток, на корпусе были установлены четыре фары — по две спереди и сзади.
Число передач вперед/назад | 5/1 |
Скорость при движении вперед | 2,16 — 11,65 км/ч |
Скорость при движении назад | 2,90 км/ч |
Тяговое усилие лебедки | 4 350 кг |
Объем древесины, вывозимой трактором за один рейс | 4-6 куб. м м |
Модификации
В 1961 году была представлена модификация, получившая индекс ТДТ-40М и пользовавшаяся даже больше популярностью, чем первоначальная версия. Машину можно назвать переходным «звеном» между ТДТ-40 и запущенным позже в производство ТДТ-55. В числе изменений — более мощный двигатель (модели Д-48Т) и наличие гидравлического устройства для сбрасывания погрузочного щита. Новый четырехцилиндровый четырехтактный мотор имел функцию вихрекамерного смесеобразования и развивал до 48 л.с. при 1 600 об/мин. Удельный расход топлива — 205 г/л. с. ч. Запуск осуществлялся от пускового двигателя ПД-10М.
Кроме этого, трактор обладал улучшенными динамическими свойствами (этого удалось добиться благодаря смещению центра тяжести вперед) и оснащался усиленной рамой.
Аналоги
Сравнимыми по техническим характеристикам моделями конкурентов являются: Кировец КТ-12, Онежец ТДТ-55, Онежец ТДТ-55А, Онежец 300БС, Онежец ТЛТ-100.
Видео
Видео — с канала «серов тв»
ТДТ-40, ТДТ-40М гусеничный чокерный трелёвочный трактор — Каталог К.В.Х.
В 1951 году Кировский завод начал передавать производство трелевочных тракторов Минскому тракторному заводу (МТЗ). В 1951 году МТЗ выпускает первые 460 штук. Уже в 1953 году МТЗ изготавливает 6070 тракторов, в 1954 г. — 5950, в 1955 г. — 5440.
В период 1953-1954 гг. Минский тракторный завод осуществил модернизацию трактора КТ-12, значительно повысив его гарантийный срок службы. Если у KT-12 гарантийный срок службы составлял 1000 часов, то у модернизированной машины, получившей марку КТ-12А, он был увеличен до 1500 часов. КТ-12А Минский тракторный завод начал выпускать в 1955 году.
Однако проведенная модернизация трактора КТ-12 не устранила основных его недостатков: вздыбливания, недостаточной мощности двигателя и неприспособленности для трелевки хлыстов комлями вперед. В целях повышения производительности, улучшений его динамических и эксплуатационных показателей конструкторы Минского тракторного завода под руководством главного конструктора лауреата Сталинской премии И.
 Скорость заднего хода – 2,9 км/час. Всего у трактора пять передач переднего хода и одна заднего. Габаритные параметры ТДТ-40, мм: 4500 х 1830 х 2430. Колея – 1480 мм, ширина траков гусениц – 340 мм, дорожный просвет – 540 мм. При массе трактора в 6450 кг удельное давление на грунт составляло 0,46 кг/см2.
Скорость заднего хода – 2,9 км/час. Всего у трактора пять передач переднего хода и одна заднего. Габаритные параметры ТДТ-40, мм: 4500 х 1830 х 2430. Колея – 1480 мм, ширина траков гусениц – 340 мм, дорожный просвет – 540 мм. При массе трактора в 6450 кг удельное давление на грунт составляло 0,46 кг/см2. По решению Министерства тракторного и сельскохозяйственного машиностроения СССР с мая 1956 года на МТЗ началось серийное производство дизельных тракторов ТДТ-40. К концу года их число достигло 3430.
Постановлением правительства СССР от 30 января 1956 года для производства тракторов ТДТ-40 Министерству тракторного и сельскохозяйственного машиностроения СССР был передан Онежский машиностроительный завод в Петрозаводске. До этого он находился в ведении Министерства лесной промышленности СССР и в основном занимался капитальным ремонтом тракторов КТ-12, а также их переоборудование в ТДТ-40. В 1957 году, без прекращения производства ТДТ-40 на МТЗ, началось освоение трактора на Онежском тракторном заводе.
В период с 1956 по 1959 гг. происходила замена тракторов КТ-12А путем переоборудования их вначале в тракторы КДТ-36, а затем в КДТ-40 и ТДТ-40. Вместо газогенераторного двигателя на трактор устанавливались дизельные двигатели соответственно Д-36 (36 л. с.) и Д-40Т (42 л. с.). Помимо замены двигателя для устранения «вздыбливания» при движении с возом в модернизированном тракторе двигатель с коробкой перемены передач, лебедка передвигались вперед по ходу машины на 210 мм. Благодаря этому, центр тяжести машины сместился вперед на 75 мм, что существенно повысило устойчивость при трелевке. Кроме этого, при переоборудовании заменялись главные и малые балансиры, натяжное устройство, усиливалась рама, устанавливался более прочный щит и т. д.
За 1956 год — первый год производства на ОТЗ тракторов ТДТ-40 — завод изготовил 477 машин. 25 июня 1957 г. на заводе был собран тысячный трактор, а с 1960 г. предприятие уже производило более 4000 тракторов в год. Однако ТДТ-40, ведущий свое родство от КТ-12 унаследовал много «врожденных» недостатков от своего прототипа. В результате модернизации, проведенной в достаточно сжатые сроки была создана обновленная модель трелевочного трактора, получившая наименование ТДТ-40М. В 1961 г. на ОТЗ развернули производство новой модели и начиная со следующего, 1962 г. старая версия трактора уже больше не выпускалась. Выросли и объемы производства, так в 1963 г. завод выпустил 6509, а в 1964 г. 7103 трактора ТДТ-40М.
предприятие уже производило более 4000 тракторов в год. Однако ТДТ-40, ведущий свое родство от КТ-12 унаследовал много «врожденных» недостатков от своего прототипа. В результате модернизации, проведенной в достаточно сжатые сроки была создана обновленная модель трелевочного трактора, получившая наименование ТДТ-40М. В 1961 г. на ОТЗ развернули производство новой модели и начиная со следующего, 1962 г. старая версия трактора уже больше не выпускалась. Выросли и объемы производства, так в 1963 г. завод выпустил 6509, а в 1964 г. 7103 трактора ТДТ-40М.
Этот трактор впоследствии стал самым массовым трактором на лесоразработках в период 1960-х г., в основном по причине простой и надежной конструкции трактора. Кроме основных функций по выволакиванию пакета древесины, с помощью трелевочных тракторов стало возможным осуществлять крупнопакетную погрузку древесины на автомобили-лесовозы методом накатывания обвязанных тросом пачек древесины на коники машины по наклонным балкам. Кроме этого, применялся метод подъема и погрузки пакета древесины на лесовозы тросами, пропущенными через блоки на вкопанных самодельных стрелах. Все эти операции выполнялись при помощи тракторных лебедок.
Все эти операции выполнялись при помощи тракторных лебедок.
Основой всему у трактора ТДТ-40М служит рама, состоящая из двух лонжеронов, поперечных связей в виде трубы, угольников и закрывающего всю конструкцию днища. Спереди на раме имелся мощный буфер из трубы прямоугольного сечения и буксирные крюки. Компоновка и расположение агрегатов осталось прежними. Однако двигатель был установлен другой, марки Д-48Т, унифицированный с общепринятым двигателем Д-48Л сельскохозяйственных тракторов МТЗ и ЛТЗ. Благодаря увеличенной мощности двигателя до 48 л.с. (при 1500 об/мин) у трактора ТДТ-40М увеличилась рейсовая нагрузка почти на 20% (объем вывозимой древесины с 4-6 м3 увеличился до 5-8 м3). Пусковым устройством служил широко распространенный пусковой одноцилиндровый двигатель ПД-10М. Для устранения склонности трактора к вздыбливанию при сборке и транспортировке пакетов древесины на модернизированной машине сместили центр тяжести ближе к переду путем конструктивного перемещения ходовой системы относительно рамы на 130 мм.
Другим значительным внедрением стала гидрообъемная система с насосом НШ-46У, предназначенная для приведения в движение погрузочного щита, что значительно облегчило труд тракториста и обеспечило безударную погрузку пакета деревьев на трактор. Кроме основной задачи гидравлическая система позволяла использовать трактор на других лесотехнических работах. Для этого необходимо было демонтировать погрузочный щит и установить вместо него необходимое гидроуправляемое оборудование. Для монтажа передней гидрофицированной навески так же были предусмотрены монтажные места.
Кабина на тракторе ТДТ-40М устанавливалась все та же, что была и у предшествующих моделей – закрытого типа, двухместная, деревометаллическая. Передняя стенка кабины с резким наклоном, в нижней части с вырезом под капот. Из двух передних окон одно, левое, открывающееся; в открытом положении его можно фиксировать при помощи пружинных стопоров, а в закрытом — специальной защелкой. Снаружи на передней стенке смонтированы две фары. Боковые стенки с дверными проемами. На дверях установлены съемные окна с листовым целлулоидом(!). Как правило, трактор эксплуатировали всегда без них. В задней стенке так же имелось одно окно по середине, и оно тоже открывалось. Снаружи это окно защищала сетка из толстых прутков. Задние фары при помощи кронштейнов монтировались так же на задней стенке, в ее верхней части. Внутри кабины, прямо по середине, установлен капот двигателя, состоящий из верхнего листа и двух съемных боковин. Продолжение капота выходит за пределы кабины и заканчивается облицовкой радиатора. По разные стороны капота установлены два кресла. Под правым сиденьем размещался инструментальный ящик для хранения инструмента, принадлежностей и мелких деталей.
Боковые стенки с дверными проемами. На дверях установлены съемные окна с листовым целлулоидом(!). Как правило, трактор эксплуатировали всегда без них. В задней стенке так же имелось одно окно по середине, и оно тоже открывалось. Снаружи это окно защищала сетка из толстых прутков. Задние фары при помощи кронштейнов монтировались так же на задней стенке, в ее верхней части. Внутри кабины, прямо по середине, установлен капот двигателя, состоящий из верхнего листа и двух съемных боковин. Продолжение капота выходит за пределы кабины и заканчивается облицовкой радиатора. По разные стороны капота установлены два кресла. Под правым сиденьем размещался инструментальный ящик для хранения инструмента, принадлежностей и мелких деталей.
Ходовая часть трактора, состоящая из подвески, гусеничной ленты, опорных катков и натяжного ведомого колеса работала исключительно в неблагоприятных условиях, воспринимая вес самого трактора и вес перевозимых им грузов. Поэтому, все детали и узлы ходовой части изготовлялись с солидным запасом прочности.
 К головкам балансиров крепятся набранные из девяти листов четыре рессоры. Амортизаторы так же крепятся к головкам балансиров. В некоторой мере они предохраняют рессоры от перегрузок и вступают в работу, когда упругий ход рессоры уже весь выбран. Ходовые опорные катки трактора посажены на ступицы кареток, представляющих собой малый балансир.
К головкам балансиров крепятся набранные из девяти листов четыре рессоры. Амортизаторы так же крепятся к головкам балансиров. В некоторой мере они предохраняют рессоры от перегрузок и вступают в работу, когда упругий ход рессоры уже весь выбран. Ходовые опорные катки трактора посажены на ступицы кареток, представляющих собой малый балансир. Силовая передача (трансмиссия) трактора относительно простой конструкции, включающая в себя муфту сцепления, коробку перемены передач, карданный вал и блок заднего моста с ведущими звездочками. Фрикционная муфта сцепления установлена постоянно замкнутая, двухдисковая. Пятиступенчатая коробка перемены передач, кроме того, что выполняет функции по изменению тяговых качеств трактора и его скорости, так же служит для отбора мощности на лебедку. Она позволяет получить пять скоростей движения вперед – от 2,34 на первой передаче до 10,35 км/час на пятой, а так же одну заднюю скорость – 2,18 км/час. При этом, тяговые усилия трактора при номинальной мощности дизеля варьировались от 4400 кгс на первой передаче до 480 кгс на пятой.
Рабочее технологическое оборудование трактора осталось то же – лебедка и погрузочный щит. Однако, лебедка устанавливалась другая, новой конструкции, с увеличенным тяговым усилием до 5100 кГ. Данная реверсируемая лебедка с редуктором червячного типа приводилась в движение от вала отбора мощности коробки передач через цепную передачу. Емкость барабана лебедки – 40 метров троса диаметром 17 мм. Скорость вращения барабана – до 30 об/мин. Благодаря нововведениям в конструкцию лебедки, практически удалось устранить влияние тягового усилия троса и деформации рамы на работу червячной пары редуктора. Погрузочное устройство – откидной сварной щит шириной 1700 мм.
Однако, лебедка устанавливалась другая, новой конструкции, с увеличенным тяговым усилием до 5100 кГ. Данная реверсируемая лебедка с редуктором червячного типа приводилась в движение от вала отбора мощности коробки передач через цепную передачу. Емкость барабана лебедки – 40 метров троса диаметром 17 мм. Скорость вращения барабана – до 30 об/мин. Благодаря нововведениям в конструкцию лебедки, практически удалось устранить влияние тягового усилия троса и деформации рамы на работу червячной пары редуктора. Погрузочное устройство – откидной сварной щит шириной 1700 мм.
Электрооборудование, установленное на тракторе, отличалась простотой и малым количеством потребителей – всего четыре фары ФГ-12-Б1, звуковой сигнал С-44, плафон ПК201А освещения кабины, две лампы ЛК-73 подсветки щитка приборов и переносная лампа. Следует отметить одну особенность – все фары, кроме левой задней, крепились неподвижно. Это позволяло машинисту изменять ее положение, тем самым регулировать зону освещения рабочей зоны позади трактора. Источниками электроэнергии являлись генератор Г-12-К и аккумуляторная батарея 6СТ-42. Напряжение в бортовой сети трактора 12 вольт.
Источниками электроэнергии являлись генератор Г-12-К и аккумуляторная батарея 6СТ-42. Напряжение в бортовой сети трактора 12 вольт.
Основные геометрические и весовые характеристики трактора остались прежними, как и у предыдущей модели – трактора ТДТ-40. Основное отличие стало лишь в размере продольной базы (расстоянием между осями крайних опорных катков) – она увеличилась с 2040 до 2400 мм. Благодаря этому центр тяжести машины несколько сместился вперед, и это положительно отразилось на динамике трактора, уменьшилась склонность к вздыбливанию во время погрузки деревьев на щит, и обеспечило более равномерное распределение нагрузки по опорным каткам.
В процессе производства трелевочных тракторов ТДТ-40М становилось ясно, что в его конструкции, хотя и сильно устаревающей, имелись некие резервы для, хотя бы частичной, модернизации и совершенствования. Отталкиваясь от этого факта, конструкторы ОТЗ попытались создать, взяв за основу хорошо отработанную конструкцию ТДТ-40М, новые машины, опробовав на них все новые решения, необходимые для создания и серийного освоения принципиально нового семейства тракторов ТДТ-55. В итоге, были сконструированы стартовые модели для освоения ТДТ-55 — лесопромышленные и лесохозяйственные тракторы новых марок: Т-401, Т-402, Т-49, Т-47, Т-47А и ДСТ.
В итоге, были сконструированы стартовые модели для освоения ТДТ-55 — лесопромышленные и лесохозяйственные тракторы новых марок: Т-401, Т-402, Т-49, Т-47, Т-47А и ДСТ.
В 1962 г. прошли государственные испытания трактора ТДТ-55 и он был рекомендован к серийному производству. В ходе испытаний было установлено, что новый трактор по своим параметрам резко отличается от серийного ТДТ-40М и имеет производительность на 20% больше. Однако поначалу машина, выпуск которой начался осенью 1965 г., изготавливалась на малом конвейере сборочного цеха опытно-промышленными партиями. В 1965 г. был произведен 101 ТДТ-55, в 1966-1967 гг. еще 700 и только в 1968 г. трактор пошел в серийное производство. При этом необходимо заметить, что достаточно долгое время новая модель выпускалась параллельно с ТДТ-40М, последние экземпляры которого покинули заводские цеха только в 1976 г. Такое, на первый взгляд странное положение дел, объяснялось особенностями советской плановой экономики — плановые органы не разрешали снижать суммарное количество выпускаемых машин, поэтому и было принято решение организовать выпуск тракторов на двух конвейерах. На главном конвейере выпускался ТДТ-40М, а на малом – ТДТ-55. Максимальный выпуск ТДТ-40М пришелся на 1966 год – 8184 трактора. ТДТ-55 было собрано 200 штук. В дальнейшем завод наращивал выпуск пятьдесятпяток, уменьшая количество ТДТ-40М, при этом суммарный выпуск тракторов из года в год возрастал. Позднее сборка ТДТ-55 была переведена на главный конвейер, а старый трактор стали собирать на малом.
На главном конвейере выпускался ТДТ-40М, а на малом – ТДТ-55. Максимальный выпуск ТДТ-40М пришелся на 1966 год – 8184 трактора. ТДТ-55 было собрано 200 штук. В дальнейшем завод наращивал выпуск пятьдесятпяток, уменьшая количество ТДТ-40М, при этом суммарный выпуск тракторов из года в год возрастал. Позднее сборка ТДТ-55 была переведена на главный конвейер, а старый трактор стали собирать на малом.
Новая машина, созданная на ОТЗ, больше 35 лет не сходила с главного конвейера завода. За эти годы на базе ТДТ-55 было создано более 50 модификаций, применяемых в самых различных отраслях. В общей сложности было изготовлено более 200 000 тракторов этой модели.
Весной 1963 года Онежский тракторный завод отметил маленький юбилей – с конвейера завода сошел 25-тысячный трактор. За период с 1957 по 1963 г.г. тракторы ТДТ-40 и ТДТ-40М демонстрировались на ВДНХ и выставках-ярмарках в ГДР, Югославии, Болгарии, Кубе, Чехословакии, Польше, а также в Нидерландах, Великобритании, Японии, Бразилии, Австралии. С каждым годом расширялся и экспорт машин – в середине 60-х в зарубежье отправлялось более пятисот тракторов ТДТ-40М ежегодно.
С каждым годом расширялся и экспорт машин – в середине 60-х в зарубежье отправлялось более пятисот тракторов ТДТ-40М ежегодно.
В 1954-1955 годах на вооружение лесозаготовителей стала поступать новая, более мощная техника —
01Января1954
— тракторы ТДТ-40 и ТДТ-60, лесовозные машины ЗИЛ-151, МАЗ-200 и МАЗ-501. Вальщики леса получили новую бензомоторную пилу.
Первые “сороковки ” (ТДТ-40) поступили в Вандыш в 1956 году:
ТДТ-40, Шилов Александр, Урдомский лесопункт.
ТДТ-40, с деревянной волокушей на р. Вычегда
Рисунок ТДТ-40.
Технические данные:
Трактор ТДТ-40
Изготовитель:
Минский тракторный завод — с мая 1955 по 1958 год
Онежский тракторный завод — с 1957 по 1961 год
На Минском тракторном заводе было выпущено 12977 тракторов марки ТДТ-40.
Гусеничный трактор ТДТ-40 класса 2 т предназначен для вывозки деревьев от места валки их в лесу, а также для сплавных, транспортных и других работ.
Трактор обладает высокой проходимостью и хорошей маневренностью и может передвигаться по лесосеке при наличии пней, поваленных деревьев, при тяжелых дорожных условиях и плохих грунтах. Наличие на тракторе лебедки и специального погрузочного устройства позволяет формировать воз, грузить его на щит трактора и разгружать.
Трактор ТДТ-40 рамной конструкции, с передним расположением двигателя и задним расположением ведущих колес.
Рама трактора состоит из двух лонжеронов, поперечных связей и днища. На передней части рамы расположена кабина. Впереди кабины установлены радиаторы охлаждения воды и масла. Масляный радиатор укреплен на стойке водяного радиатора и находится впереди его; водяной — крепится к кронштейнам рамы трактора. За радиатором установлен дизельный двигатель. Крепление двигателя — в трех точках: спереди к поперечине рамы, а задними опорами — к двум приваренным угольникам. Двигатель закрыт капотом со съемными боковинами. К фланцу картера маховика двигателя прикреплена коробка передач.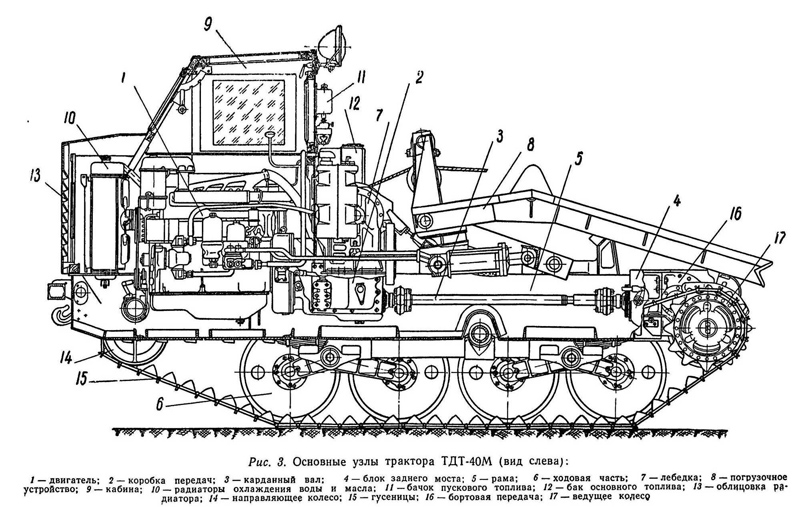 Над ней на раме установлена лебедка, червячный редуктор, который приводится во вращение цепной передачей от коробки передач. За лебедкой расположено погрузочное устройство, состоящее из щита, его передней рамы, блока и торсионов.
Над ней на раме установлена лебедка, червячный редуктор, который приводится во вращение цепной передачей от коробки передач. За лебедкой расположено погрузочное устройство, состоящее из щита, его передней рамы, блока и торсионов.
Блок заднего моста, включающий главную передачу, муфты поворота и тормоза с механизмом управления, а также конечные передачи, крепится к заднему торцу рамы трактора. Передача усилия от коробки передач к валу главной передачи заднего моста осуществляется через карданный вал. На фланцы ведомых валов конечных передач насажены ведущие колеса с двумя съемными венцами на каждом.
Рама трактора своими четырьмя кронштейнами опирается на рессоры подвески. Подвеска трактора балансирная, с листовыми рессорами и включает два главных балансира и четыре каретки с двумя опорными катками каждая.
Направляющие колеса установлены на кривошипах, с помощью которых происходит регулирование натяжения гусениц.
Направляющие колеса имеют амортизирующее устройство, благодаря которому устраняется опасность повреждения деталей ходовой части при чрезмерном натяжении гусеницы. Гусеницы трактора мелкозвенчатые, с литыми стальными звеньями из углеродистой стали, упрочненными термообработкой.
Гусеницы трактора мелкозвенчатые, с литыми стальными звеньями из углеродистой стали, упрочненными термообработкой.
Трактор имеет четыре фары: две спереди и две сзади, что обеспечивает работу трактора в ночное время.
Благодаря значительному дорожному просвету, балансирно-рессорной подвеске и мелкозвенчатым гусеницам трактор обладает хорошей маневренностью и высокой проходимостью в различных условиях работы.
Схема ТДТ-40.
Трактор ТДТ-40М
Изготовитель — Онежский тракторный завод
Выпускался с 1961 по 1966 год
Гусеничный трактор ТДТ-40М класса 2 т создан на базе трактора ТДТ-40, предназначен для трелевки мелкого и среднего леса. В отличие от трактора ТДТ-40 он может использоваться и на других лесохозяйственных работах.
Для этого необходимо заменить погрузочное устройство передней и задней гидроуправляемыми навесками, для монтажа которых предусмотрены установочные места. В гидравлической системе для этих же целей установлен трехзолотниковый распределитель.
На тракторе ТДТ-40М установлен более мощный двигатель Д-48Т, применено гидравлическое устройство для сбрасывания и амортизации погрузочного щита, что обеспечиваег безударную погрузку деревьев на щит и облегчает труд тракториста. Центр тяжести трактора смещен вперед, вследствие чего уменьшается подъем передней части трактора при погрузке пачки деревьев на щит и обеспечивается лучшее распределение нагрузки по опорным каткам, а также повышаются динамические свойства трактора. Значительной модернизации подверглись ходовая часть и лебедка.
Трактор Т-402
Трактор Т-402 создан на базе трактора ТДТ-40М и предназначается для трелевки деревьев с лесосеки, а также для сплавных, транспортных и других работ. Трактор Т-402 является базовой моделью для преобразования в лесохозяйственную, дорожно-строительную и другие модификации. На тракторе установлены двигатель в 55 л.с. и коробка с измененным передаточным отношением, что обеспечивает улучшение тяговой характеристики трактора.
Наряду со смещением подвески назад часть узлов (двигатель, кабина, коробка передач, лебедка, погрузочное устройство) передвинуты вперед, вследствие чего еще больше улучшены динамические качества трактора.
Трактор оборудован металлической кабиной с вентиляцией. Облегчение запуска двигателя при низких температурах обеспечивается подогревателем двигателя и топлива.
Технические характеристики тракторов:
ТДТ-40 | ТДТ-40М | Т-402 | |
| Тип трактора. | гусеничный, трелевочный | гусеничный, трелевочный | гусеничный, трелевочный |
| Класс тяги, кН | 20 | 20 | 20 |
| Грузоподъемность, кг | 2500 | 2500 | |
| Вес трактора конструктивный, кг | 6500 | 6500 | 6600 |
| Габаритные размеры, мм: | |||
. .длина при поднятом погрузочном щите .длина при поднятом погрузочном щите | 4500 | 4500 | 4760 |
| ..ширина (по гусеницам) | 1830 | 1830 | 1970 |
| ..высота | 2430 | 2430 | 2500 |
| Дорожный просвет, мм | 540 | 540 | 540 |
| Ширина колеи, мм | 1480 | 1480 | 1480 |
| База, мм | 2400 | 2400 | 2040 |
| Удельное давление на почву, кгс/см² | 0,45 | 0,45 | |
| Число передач: | |||
. .вперед .вперед | 5 | 5 | 5 |
| ..назад | 1 | 1 | 1 |
| Диапазон скоростей, км/ч: | |||
| ..вперед | 2,16 — 11,65 | 2,30 — 11,24 | 2,16 — 9,55 |
| ..назад | 2,90 | 3,10 | 2,00 |
| Тяговое усилие лебедки, кг | 4350 | 5100 | 5600 |
| Объем древесины, вывозимой трактором за один рейс, м³ | 4 — 6 | 5 — 7 | 5 — 7 |
| Марка двигателя | Д-40Т | Д-48Т | СМД-8М |
| Тип двигателя…… | 4-цилиндровый рядный четырехтактный, с воспламенением от сжатия, бескомпрессорный, вихрекамерный | 4-цилиндровый рядный четырехтактный, с воспламенением от сжатия, бескомпрессорный, вихрекамерный | 4-цилиндровый рядный четырехтактный, бескомпрессорный, с воспламенением от сжатия |
Номинальная мощность, л. с. с. | 40 | 48 | |
| Максимальная мощность, л.с. | 45 | 50 | 55 |
| Число оборотов в минуту | 1500 | 1600 | 1500 |
| Пусковой двигатель | ПД-10М | ПД-10М | ПД-10М с электростартером |
Трелевочный трактор ТДТ-60:
Изготовитель — Алтайский тракторный завод
Трактор серийно выпускался — с 1957 по 1962 год
Первоначально трактор имел марку «ТДТ-54″. Для повышения производительности применили дизельный двигатель Д-54 мощностью 54 л.с. После того как трелевочный трактор ТДТ-54 получил «добро» государственной комиссии на серийное производство был произведен детальный анализ каждого узла. В результате было решено провести модернизацию большинства его узлов. Дизель Д-54 был форсирован до мощности 60 л.с. (Д-60) и как следствие трактор получил новое наименование ТДТ-60. Четыре его опытных образца в 1956 году прошли все контрольные государственные испытания в производственных условиях в Вахтанском леспромхозе Горьковской области.
В результате было решено провести модернизацию большинства его узлов. Дизель Д-54 был форсирован до мощности 60 л.с. (Д-60) и как следствие трактор получил новое наименование ТДТ-60. Четыре его опытных образца в 1956 году прошли все контрольные государственные испытания в производственных условиях в Вахтанском леспромхозе Горьковской области.
Трактор был разработан на Минском тракторном заводе. Но на серийное производство в 1957 году его поставили на Алтайском тракторном заводе. Трактор ТДТ-60 предназначен для трелевки леса, а также может быть использован для погрузочно-разгрузочных работ на лесозаготовительных предприятиях.
Технические характеристики ТДТ-60:
ТДТ-60 | |
| Тип трактора | гусеничный, трелевочный |
| Номинальное тяговое усилие, кгс | 3000 |
| Масса трактора конструктивная, кг | 11000 |
| Число передач: | |
. .вперед .вперед | 5 |
| ..назад | 1 |
| Диапазон скоростей, км/ч: | |
| ..вперед | 2,14 — 7,64 |
| ..назад | 2,57 |
| Колея, мм | 1910 |
| База, мм | 2720 |
| Дорожный просвет, мм | 550 |
| Удельное давление на почву, кгс/см2 | 0,417 |
| Габаритные размеры, мм | |
| длина | 5505 |
| ширина | 2370 |
| высота | 2700 |
| Марка двигателя | Д-60Т |
| Тип двигателя. | 4-цилиндровый рядный, четырехтактный, бескомпрессорный, с воспламенением от сжатия |
Номинальная мощность при 1500 об/мин, л. с. с. | 60 |
| Число оборотов коленчатого вала, об/мин | 1500 |
| Удельный расход топлива двигателя, г/э. л. с. ч. | 210 |
| Диаметр цилиндра, мм | 125 |
| Ход поршня, мм | 152 |
| Порядок работы цилиндров | 1-3-4-2 |
| Рабочий объем цилиндров, л | 7,45 |
| Степень сжатия | 19 |
| Масса двигателя, кг | 1150 |
| Емкость топливного бака, л | 110 |
| Пуск двигателя | пусковой двигатель ПД-10У-1 |
ЗИС-151 и ТДТ-60.
ЗИС-151 — грузовой автомобиль повышенной проходимости. Производился в Советском Союзе в 1948 — 1958 годах на Московском автозаводе имени Сталина. 26 июня 1956 года завод получил имя И.А.Лихачева, и автомобиль был переименован в ЗИЛ-151. Был первым отечественным автомобилем серийного производства с тремя ведущими мостами. Отличался от ЗИЛ-157 двускатной ошиновкой задних колес (у ЗИЛ-157 односкатная ошиновка задних колес), неотапливаемой кабиной и др.
Производился в Советском Союзе в 1948 — 1958 годах на Московском автозаводе имени Сталина. 26 июня 1956 года завод получил имя И.А.Лихачева, и автомобиль был переименован в ЗИЛ-151. Был первым отечественным автомобилем серийного производства с тремя ведущими мостами. Отличался от ЗИЛ-157 двускатной ошиновкой задних колес (у ЗИЛ-157 односкатная ошиновка задних колес), неотапливаемой кабиной и др.
Технические характеристики ЗИС-151:
| Колёсная формула | 6×6 |
| Число и рабочий объём цилиндров двигателя, куб. см | 6 — 5560 |
| Мощность двигателя, л.с и частота вращения коленчатого вала, об/мин | 92 — 2600. |
| Число передач | 5×2 |
| Длина, мм | 6930 (у ЗИС-151А — 7245мм) |
| Ширина, мм | 2320 |
| Высота, мм | 2310 (по кабине) |
База, мм. | 3665 (переднего и среднего моста) |
| База задней тележки, мм | 1120 |
| Колея, мм | 1720 |
| Дорожный просвет, мм | 260 |
| Грузоподъёмность, кг | 4500 (по грунтовым дорогам — 2500) |
| Снаряжённая масса, кг | 5580 (у ЗИС-151А — 5880кг) |
| Скорость, км/час | 55 |
| Эксплуатационный расход топлива, л/100 км | 42 |
| Размер шин | 8,25 — 20 |
Вывозка леса хлыстами автомобилем МАЗ-200 В-Лупьинского леспромхоза.
МАЗ-200.
Технические данные МАЗ-200:
| название модификации | МАЗ 200 (4х2) |
| Года выпуска | 1947-66 |
| Геометрия: | |
| Тип кузова | Грузовик |
| количество дверей | 2 |
| расположение руля | слева |
| колёсная база | 4 520 мм |
| дорожный просвет | 290 мм |
| габариты / длина | 7 620 мм |
| габариты / ширина | 1 950 мм |
| габариты / высота | 2 430 мм |
| масса / снаряженная | — |
| масса / полная | — |
| количество мест | 3 |
| Двигатель: | |
| название | ЯАЗ М204А |
| расположение | спереди |
| ориентация | продольно |
| Система питания | карбюратор |
| Цилиндры/клапаны | V4 |
| Диаметр цилиндров | 108 мм |
| Ход поршня | 127 мм |
| Степень сжатия | 17,00 |
| Объем | 4 650 см³ |
| Турбонаддув | нет |
| Мощность | 120 л. с. при 2000 об/мин с. при 2000 об/мин |
| Крутящий момент | 460 Нм при 1200-1400 об/мин |
| Марка топлива | дизель |
| Трансмиссия: | |
| привод | задний |
| сцепление | Двухдисковое, сухое |
| коробка передач | МКПП 5 передач |
| Подвеска и рулевое управление: | |
| тип передней подвески. | 2 продольных полуэллиптических рессоры с гидравлическимиамортизаторами двустороннего действия |
| тип задней подвески. | 2 продольных полуэллиптических рессорыс дополнительными рессорами |
| тип рулевого управления | Червяк и сектор передаточное число — 21,5 |
| Скоростные характеристика: | |
| максимальная скорость | 65,0 км/ч |
| тормоза передние | — |
| тормоза задние | — |
| Эксплуатационные характеристики: | |
| объем топливного бака / основной | 225 л |
| расход топлива / смешанный режим | 32,0 л/100 км |
МАЗ-501.
Технические данные МАЗ-501:
| Колесная формула | 4х4 |
| Число мест | 3 |
| Длина, мм | 6780 |
| Ширина, мм | 2638 |
| Высота, мм | 2650 |
| Колесная база, мм | 4520 |
| Колея передних/задних колес, мм | 1950 / 1920 |
| Дорожный просвет, мм | 290 |
| Радиус поворота, м | 11,0 |
| Снаряженная масса, кг | 7600 |
| Грузоподъемность, кг | 5000 |
| Масса буксируемого прицепа/ полуприцепа, кг | 15000 |
| Полная масса, кг | 12825 |
| Двигатель (тип) | ЯАЗ-204 |
Рабочий объем, см. куб. куб. | 4650 |
| Мощность двигателя, л.с. (об/мин) | 110 (2000) |
| Крутящий момент, кГм (об/мин) | 47 (1200…1400) |
| Максимальная скорость, км/ч | 45,0 |
| Запас топлива, л | 225 |
| Расход топлива на 100 км, л | 60,0 |
Часть 12. Промышленные тракторы
Часть 12
Находившиеся долгое время в массовом производстве трелевочные тракторы ТДТ-40 и ТДТ-40М Онежского тракторного завода с наступлением 1960-х годов просто-напросто перестали отвечать требованиям, предъявляемым к трелевочным тракторам того периода. Поэтому, в качестве замены, коллективом Головной конструкторской организации ОТЗ был разработан принципиально новый трактор ТДТ-55, который, после прохождения государственных испытаний в 1962 году, к 1964 году был принят к производству. Данная машина проектировалась для более эффективного использования на трелевке среднемерного леса с максимальным объемом хлыста 0,6 м3. Работы по проекту новой модели трактора начали вестись еще с конца 1950-х годов, а точнее в 1957-58 гг., с проекта машины Т-49, ставшей стартовой моделью для освоения ТДТ-55. Так же, была поставлена задача, по возможности, максимально расширить диапазон применения нового трактора. Однако, освоение массового производства новой машины проходило крайне медленно – первые опытно-промышленные партии ТДТ-55 появились на малом конвейере лишь осенью 1965 года, а массовый серийный выпуск был налажен еще позже, в ноябре 1968 года, параллельно с продолжавшимся производством трактора ТДТ-40М. Хотя, изначально, начало освоения серийного выпуска ТДТ-55 планировалось в период 1962-63 гг. Между тем, стоит напомнить, что в процессе освоения серийного производства трактора, в самом начале 1966 года был уже собран трактор ТДТ-55 с номером 100. В ходе предварительных испытаний было установлено, что новый трактор по своим параметрам резко отличается от серийного ТДТ-40М и имеет производительность на 20% больше.
Данная машина проектировалась для более эффективного использования на трелевке среднемерного леса с максимальным объемом хлыста 0,6 м3. Работы по проекту новой модели трактора начали вестись еще с конца 1950-х годов, а точнее в 1957-58 гг., с проекта машины Т-49, ставшей стартовой моделью для освоения ТДТ-55. Так же, была поставлена задача, по возможности, максимально расширить диапазон применения нового трактора. Однако, освоение массового производства новой машины проходило крайне медленно – первые опытно-промышленные партии ТДТ-55 появились на малом конвейере лишь осенью 1965 года, а массовый серийный выпуск был налажен еще позже, в ноябре 1968 года, параллельно с продолжавшимся производством трактора ТДТ-40М. Хотя, изначально, начало освоения серийного выпуска ТДТ-55 планировалось в период 1962-63 гг. Между тем, стоит напомнить, что в процессе освоения серийного производства трактора, в самом начале 1966 года был уже собран трактор ТДТ-55 с номером 100. В ходе предварительных испытаний было установлено, что новый трактор по своим параметрам резко отличается от серийного ТДТ-40М и имеет производительность на 20% больше.
Новая модель трелевочного трактора производства ОТЗ при сохранении сложившейся для данного типа тракторов компоновки, тем не менее, являлась новой ступенью в развитии. Ведь, не смотря на явную, местами максимальную, унификацию с предыдущими моделями, ТДТ-55 все же отличался наличием множества новых решений и совершенством конструкции, а значит, максимально соответствовал предъявляемым требованиям эксплуатации. В первую очередь, что бросается в глаза при осмотре трактора, это одноместная, оригинальной конструкции, кабина водителя-тракториста. Эта кабина цельнометаллической конструкции была полностью изолирована и отделена от дизельного двигателя, что явно положительно сказалось на состоянии рабочего места. Попытки создания нормальных условий труда тракториста при традиционной для трелевочных тракторов конструкции кабины, когда она фактически является одновременно и капотом для двигателя, крайне сложная задача. Работы, проведенные ГКО ОТЗ и отделом техники безопасности ЦНИИМЭ, показали, что полностью или хотя бы по возможности максимально избавиться от шума, вибраций, загазованности и ненормального температурного режима внутри кабины в этом случае практически не возможно. В связи с этим, конструкции кабины и капота были выполнены в виде двух независимых между собой элементов. Однако, для доступа к двигателю, внутренняя перегородка, отделяющая кабину от подкапотного пространства, могла открываться. Хороший обзор фронта работ изнутри кабины обеспечивала сравнительно большая круговая площадь остекления. А для удобства работы бульдозерным отвалом и более качественного выполнения работ в кабине служило нижнее фронтальное окно. К слову сказать, функциональность этого окна была не на высоте – его просто-напросто загораживал блок приборов. Основное переднее окно трактора оснащено стеклоочистителем с электроприводом, а привод заднего стеклоочистителя сделали ручным. Органы управления в кабине ТДТ-55 расположены гораздо удобнее, чем на ТДТ-40М. Рычаги управления бортовыми фрикционами и педаль сцепления оснащены гидросервоприводом, что снизило усилия, прилагаемые трактористом к ним примерно до 30-40 Н. Ко всему прочему, для удобства тракториста, его сиденье имело регулировки.
В связи с этим, конструкции кабины и капота были выполнены в виде двух независимых между собой элементов. Однако, для доступа к двигателю, внутренняя перегородка, отделяющая кабину от подкапотного пространства, могла открываться. Хороший обзор фронта работ изнутри кабины обеспечивала сравнительно большая круговая площадь остекления. А для удобства работы бульдозерным отвалом и более качественного выполнения работ в кабине служило нижнее фронтальное окно. К слову сказать, функциональность этого окна была не на высоте – его просто-напросто загораживал блок приборов. Основное переднее окно трактора оснащено стеклоочистителем с электроприводом, а привод заднего стеклоочистителя сделали ручным. Органы управления в кабине ТДТ-55 расположены гораздо удобнее, чем на ТДТ-40М. Рычаги управления бортовыми фрикционами и педаль сцепления оснащены гидросервоприводом, что снизило усилия, прилагаемые трактористом к ним примерно до 30-40 Н. Ко всему прочему, для удобства тракториста, его сиденье имело регулировки. В дополнение, к прочим атрибутам сравнительного комфорта можно было бы отнести такие вещи как обогрев кабины зимой и вентиляция летом и такие мелочи, как аптечка, термос, вещевой ящичек. Все выше перечисленные мероприятия позволили при минимальных затратах обеспечить условия труда для тракториста вполне соответствующие принятым санитарным нормам. Пожалуй, из этого становится ясно, почему с появлением трактора ТДТ-55, многие трактористы, особенно из молодых, наотрез отказывались работать на тракторах предыдущих моделей. Действительно, трактор ТДТ-55 являл собой в тот период ярко выраженную передовую конструкцию и ушел довольно далеко от своих предшественников. Кратко рассмотрим конструкцию этого трактора…
В дополнение, к прочим атрибутам сравнительного комфорта можно было бы отнести такие вещи как обогрев кабины зимой и вентиляция летом и такие мелочи, как аптечка, термос, вещевой ящичек. Все выше перечисленные мероприятия позволили при минимальных затратах обеспечить условия труда для тракториста вполне соответствующие принятым санитарным нормам. Пожалуй, из этого становится ясно, почему с появлением трактора ТДТ-55, многие трактористы, особенно из молодых, наотрез отказывались работать на тракторах предыдущих моделей. Действительно, трактор ТДТ-55 являл собой в тот период ярко выраженную передовую конструкцию и ушел довольно далеко от своих предшественников. Кратко рассмотрим конструкцию этого трактора…
Трактор ТДТ-55
Трактор ТДТ-55А
Начнем, как всегда, с несущей рамы. Спору нет – рама тяжелых машин всегда испытывает значительные, в том числе и знакопеременные нагрузки, поэтому к ее прочности и долговечности предъявляются особые требования. Поэтому, при разработке трактора ТДТ-55, этому вопросу было уделено достаточно внимания, ведь от этого зависела долговечность почти всей машины. Для лучшей жесткости раму ТДТ-55 изготовили сварной конструкции, из двух продольных лонжеронов (швеллер № 40), трех поперечных труб ходовой системы и листов днища. Подвеска трактора однорядная, балансирно-рессорная и состоит из четырех кареток (по две на каждую сторону), посредством рычагов соединенных с рамой. Верхний конец каждого рычага шарнирно соединен с рамой, а нижний – с кареткой. Кроме того, нижний конец рычага опирается на пяту цилиндрической пружины, служащей упругим элементом подвески. Крепление пружины производилось непосредственно к раме трактора. Каждая каретка, в свою очередь, представляет собой совокупность двух ходовых катков смонтированных на балансире. Отметим, что на первых экземплярах трактора стояли сплошные катки аналогичные каткам трактора ТДТ-40М, однако в массовую серию были запущены тракторы с катками другой, более сложной конфигурации, с пятью окнами и ребрами жесткости, уже опробованные на тракторах Т-49. Интересной особенностью являлось то, что односторонняя связь рычагов с пружинами позволяет рычагам в определенных условиях отрываться от пяты пружин.
Для лучшей жесткости раму ТДТ-55 изготовили сварной конструкции, из двух продольных лонжеронов (швеллер № 40), трех поперечных труб ходовой системы и листов днища. Подвеска трактора однорядная, балансирно-рессорная и состоит из четырех кареток (по две на каждую сторону), посредством рычагов соединенных с рамой. Верхний конец каждого рычага шарнирно соединен с рамой, а нижний – с кареткой. Кроме того, нижний конец рычага опирается на пяту цилиндрической пружины, служащей упругим элементом подвески. Крепление пружины производилось непосредственно к раме трактора. Каждая каретка, в свою очередь, представляет собой совокупность двух ходовых катков смонтированных на балансире. Отметим, что на первых экземплярах трактора стояли сплошные катки аналогичные каткам трактора ТДТ-40М, однако в массовую серию были запущены тракторы с катками другой, более сложной конфигурации, с пятью окнами и ребрами жесткости, уже опробованные на тракторах Т-49. Интересной особенностью являлось то, что односторонняя связь рычагов с пружинами позволяет рычагам в определенных условиях отрываться от пяты пружин. При этом, ходовые катки остаются прижатыми к беговой дорожке гусеницы под действием силы тяжести кареток. Данное конструктивное решение резко снизило случаи схода гусеничных лент. К тому же, значительно возросла проходимость трактора и плавность его хода. Направляющее колесо, одновременно выполняющее роль натяжного, установлено на оси кривошипа. На кривошип воздействует натяжное амортизирующее устройство, представляющее собой цилиндрическую пружину сжатия. Рычажно-шарнирная система позволила получить большой, доходящий до 120 мм, упругий ход натяжного колеса и снизить тем самым нагрузку на гусеничную цепь: попадание посторонних предметов между катками и гусеницами увеличивает натяжение последних, что вызывает движение направляющих колеса назад. При этом пружина сжимается, а после преодоления препятствия или устранения инородных предметов, направляющее колесо под действием пружины возвращается назад. Гусеничная лента шириной 420 мм состоит из 69 звеньев каждая, с шагом звена 134 мм. За счет увеличения ширины гусениц относительно трактора ТДТ-40М увеличилась и площадь опоры, поэтому трактор ТДТ-55 отличается отменной проходимостью.
При этом, ходовые катки остаются прижатыми к беговой дорожке гусеницы под действием силы тяжести кареток. Данное конструктивное решение резко снизило случаи схода гусеничных лент. К тому же, значительно возросла проходимость трактора и плавность его хода. Направляющее колесо, одновременно выполняющее роль натяжного, установлено на оси кривошипа. На кривошип воздействует натяжное амортизирующее устройство, представляющее собой цилиндрическую пружину сжатия. Рычажно-шарнирная система позволила получить большой, доходящий до 120 мм, упругий ход натяжного колеса и снизить тем самым нагрузку на гусеничную цепь: попадание посторонних предметов между катками и гусеницами увеличивает натяжение последних, что вызывает движение направляющих колеса назад. При этом пружина сжимается, а после преодоления препятствия или устранения инородных предметов, направляющее колесо под действием пружины возвращается назад. Гусеничная лента шириной 420 мм состоит из 69 звеньев каждая, с шагом звена 134 мм. За счет увеличения ширины гусениц относительно трактора ТДТ-40М увеличилась и площадь опоры, поэтому трактор ТДТ-55 отличается отменной проходимостью. Так же, как и на тракторах предыдущих моделей, пальцы, соединяющие траки, были сделаны ограниченными к смещению в осевом направлении лишь с одной стороны, за счет шляпки, упирающейся в проушину трака. В случае выпадения пальцев в противоположном направлении они буду возвращаться в исходное положение устройством заталкивателя.
Так же, как и на тракторах предыдущих моделей, пальцы, соединяющие траки, были сделаны ограниченными к смещению в осевом направлении лишь с одной стороны, за счет шляпки, упирающейся в проушину трака. В случае выпадения пальцев в противоположном направлении они буду возвращаться в исходное положение устройством заталкивателя.
«Сердце» трактора ТДТ-55 – четырехцилиндровый дизельный двигатель СМД-14Б производства Харьковского моторостроительного завода «Серп и молот». Данный двигатель относится к среднеоборотным транспортным дизелям и имеет номинальную мощность 62 л.с. при 1500 об/мин. Дизели семейства СМД-14 хорошо известны эксплуатационникам и широко распространены, зарекомендовав себя как простые и неприхотливые энергоустановки. Их можно встретить на самоходных и стационарных установках практически во всех отраслях, однако самое массовое применение эти моторы нашли в тракторостроении и, в первую очередь, были предназначены для установки на гусеничных тракторах Т-74 и ДТ-75. В свою очередь, для более оптимального эксплуатационного режима на новых тракторах ТДТ-55 были смонтированы модифицированные дизели СМД-14Б, отличающиеся от базового мотора расположением отдельных узлов и механизмов: водяного насоса, масляного фильтра и системы пуска. Располагается этот дизель на ТДТ-55 ровно по середине рамы, спереди, по правую сторону от машиниста и закрыт капотом. Капот состоит из трех секций. Левая секция открывается из кабины, открывая доступ машиниста к двигателю сверху и слева, а так же к заливным горловинам радиатора и подогревателя и к бачкам пускового двигателя. На правой части рамы расположены топливный и гидравлический бак, гидрораспределитель, инструментальный ящик, нагнетатель и место для ведра. Доступ к ним открывается после откидывания правой секции капота, который может фиксироваться в верхнем открытом положении.
Располагается этот дизель на ТДТ-55 ровно по середине рамы, спереди, по правую сторону от машиниста и закрыт капотом. Капот состоит из трех секций. Левая секция открывается из кабины, открывая доступ машиниста к двигателю сверху и слева, а так же к заливным горловинам радиатора и подогревателя и к бачкам пускового двигателя. На правой части рамы расположены топливный и гидравлический бак, гидрораспределитель, инструментальный ящик, нагнетатель и место для ведра. Доступ к ним открывается после откидывания правой секции капота, который может фиксироваться в верхнем открытом положении.
Дальнейшим путем в развитии трактора ТДТ-55 стали работы по постепенному повышению его мощности, с плановым выходом к 1980-м годам примерно на 120-130 л.с. Весьма, кстати, спорное решение… Ведь многими исследованиями было неоднократно доказано, что повышение мощности трелевочного трактора не гарантирует значительного повышения его производительности. Как правило, пропорциональной положительной зависимости не наблюдалось. И, тем не менее, следующей ступенью развития онежских тракторов стал модернизированный трактор ТДТ-55А с двигателем повышенной до 75 л. с. мощностью. Его выпуск был начат в 1974 году. Перед этим, на заводе были проведены большие работы по части внедрения передовых технологий и борьбе за качество выпускаемой продукции. Благодаря этому, число отказов тракторов ТДТ-55 последних выпусков уменьшилось более чем в 2 раза, а поступление рекламаций в 1,4 раза! Все это позволило увеличить гарантийный срок на выпускаемые тракторы с 12 до 18 месяцев. А на проходивших тематических выставках в Москве и ГДР тракторы ОТЗ были отмечены золотыми медалями.
И, тем не менее, следующей ступенью развития онежских тракторов стал модернизированный трактор ТДТ-55А с двигателем повышенной до 75 л. с. мощностью. Его выпуск был начат в 1974 году. Перед этим, на заводе были проведены большие работы по части внедрения передовых технологий и борьбе за качество выпускаемой продукции. Благодаря этому, число отказов тракторов ТДТ-55 последних выпусков уменьшилось более чем в 2 раза, а поступление рекламаций в 1,4 раза! Все это позволило увеличить гарантийный срок на выпускаемые тракторы с 12 до 18 месяцев. А на проходивших тематических выставках в Москве и ГДР тракторы ОТЗ были отмечены золотыми медалями.
This file was created
with BookDesigner program
23.05.2013
Петрозаводск, Трактор ТДТ-40: techmonuments — LiveJournal
Этот уникальный памятник, единственный в своем роде, расположен у проходной (теперь уже бывшего) Онежского тракторного завода в городе Петрозаводске.
Гусеничный трактор ТДТ-40 выпускался на Минском тракторном заводе — с мая 1955 по 1958 год. Всего в Минске было выпущено почти 13 тыс. данных машин.
С 1957 по 1961 трактор выпускается на на Онежском тракторном заводе,
Трактор был предназначен для вывозки деревьев от места валки их в лесу, а также для сплавных, транспортных и других работ.
Трактор обладал высокой проходимостью и хорошей маневренностью и мог передвигаться по лесосеке при наличии пней, поваленных деревьев, при тяжелых дорожных условиях и плохих грунтах. Наличие на тракторе лебедки и специального погрузочного устройства позволяло формировать воз, грузить его на щит трактора и разгружать.
Здесь энтузиасты собрали информацию и неплохую галерею о данном тракторе: http://www.techstory.ru/trr/tdt40_tech.htm , позвольте не буду копипастить.
Далее фото 2013 года:
На фронтоне административного корпуса гордо красуется «Аренда»:
Для сравнения фото 2011, как видите на заднем плане — это пока ещё Онежский тракторный. Памятник в более плачевном состоянии:
Памятник в более плачевном состоянии:
Показалось любопытным (извиняюсь за вики): Данный трактор был в 1976 году изображён на вьетнамской купюре достоинством в 10 донгов.
P.S. Написал, что памятник уникальный, и, понял после чтения вышеуказанного сайта, что оказался неправ. Оказывается, Трактор ТДТ-40М установлен также на постаменте в г. Нюксенице Вологодской обл: http://wikimapia.org/20626555/ru/%D0%93%D1%83%D1%81%D0%B5%D0%BD%D0%B8%D1%87%D0%BD%D1%8B%D0%B9-%D1%82%D1%80%D0%B0%D0%BA%D1%82%D0%BE%D1%80-%D0%A2%D0%94%D0%A2-40 .
УПД: Нашел еще и третий памятник ТДТ-40, в Архангельской области: http://wikimapia.org/#lang=ru&lat=61.749874&lon=48.538181&z=15&m=b&show=/20968807/ru/%D0%9F%D0%B0%D0%BC%D1%8
Альбом рабочих чертежей деталей трактора ТДТ-40 [Текст]
Поиск по определенным полям
Чтобы сузить результаты поисковой выдачи, можно уточнить запрос, указав поля, по которым производить поиск.
 Список полей представлен выше. Например:
Список полей представлен выше. Например:author:иванов
Можно искать по нескольким полям одновременно:author:иванов title:исследование
Логически операторы
По умолчанию используется оператор AND.
Оператор AND означает, что документ должен соответствовать всем элементам в группе:
исследование разработка
author:иванов title:разработка
оператор OR означает, что документ должен соответствовать одному из значений в группе:исследование OR разработка
author:иванов OR title:разработка
оператор NOT исключает документы, содержащие данный элемент:исследование NOT разработка
author:иванов NOT title:разработка
Тип поиска
При написании запроса можно указывать способ, по которому фраза будет искаться.
 Поддерживается четыре метода: поиск с учетом морфологии, без морфологии, поиск префикса, поиск фразы.
Поддерживается четыре метода: поиск с учетом морфологии, без морфологии, поиск префикса, поиск фразы. По-умолчанию, поиск производится с учетом морфологии.
Для поиска без морфологии, перед словами в фразе достаточно поставить знак «доллар»:
$исследование $развития
Для поиска префикса нужно поставить звездочку после запроса:исследование*
Для поиска фразы нужно заключить запрос в двойные кавычки:«исследование и разработка«
Поиск по синонимам
Для включения в результаты поиска синонимов слова нужно поставить решётку «#» перед словом или перед выражением в скобках.
В применении к одному слову для него будет найдено до трёх синонимов.
В применении к выражению в скобках к каждому слову будет добавлен синоним, если он был найден.

Не сочетается с поиском без морфологии, поиском по префиксу или поиском по фразе.
#исследование
Группировка
Для того, чтобы сгруппировать поисковые фразы нужно использовать скобки. Это позволяет управлять булевой логикой запроса.
Например, нужно составить запрос: найти документы у которых автор Иванов или Петров, и заглавие содержит слова исследование или разработка:
author:(иванов OR петров) title:(исследование OR разработка)
Приблизительный поиск слова
Для приблизительного поиска нужно поставить тильду «~» в конце слова из фразы. Например:
бром~
При поиске будут найдены такие слова, как «бром», «ром», «пром» и т.д.Можно дополнительно указать максимальное количество возможных правок: 0, 1 или 2.
 4 разработка По умолчанию, уровень равен 1. Допустимые значения — положительное вещественное число.
4 разработка По умолчанию, уровень равен 1. Допустимые значения — положительное вещественное число.Поиск в интервале
Для указания интервала, в котором должно находиться значение какого-то поля, следует указать в скобках граничные значения, разделенные оператором TO.
Будет произведена лексикографическая сортировка.
author:[Иванов TO Петров]
Будут возвращены результаты с автором, начиная от Иванова и заканчивая Петровым, Иванов и Петров будут включены в результат.author:{Иванов TO Петров}
Такой запрос вернёт результаты с автором, начиная от Иванова и заканчивая Петровым, но Иванов и Петров не будут включены в результат.Для того, чтобы включить значение в интервал, используйте квадратные скобки. Для исключения значения используйте фигурные скобки.

| Страницы >>> [19] [18] [17] [16] [15] [14] [13] [12] [11] [10] [9] [8] [7] [6] [5] [4] [3] [2] [1] | ||
| Файл | Краткое описание | Размер |
| 9.22 Mb | |
| 30.9 Mb | |
| 69.4 Mb | |
| 25.2 Mb | |
| 3.33 Mb | |
| 20.4 Mb | |
| 6.46 Mb | |
| 75.2 Mb | |
| 55.3 Mb | |
| 6.65 Mb | |
| 10.9 Mb | |
| 107 Mb | |
| 2.71 Mb | |
| 12.2 Mb | |
| 25.8 Mb | |
| 50.2 Mb | |
| 21.1 Mb | |
| 68. 8 Mb 8 Mb | |
| 22.8 Mb | |
| 22.5 Mb | |
| Страницы >>> [19] [18] [17] [16] [15] [14] [13] [12] [11] [10] [9] [8] [7] [6] [5] [4] [3] [2] [1] | ||
| ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| EAN | * | |||||||||||||||||||||||||
| M |
| ||||||||||||||||||||||||
| O |
| ||||||||||||||||||||||||
| A | ||||||||||||||||||||||||||
| R | ||||||||||||||||||||||||||
| N | ||||||||||||||||||||||||||
| O | ||||||||||||||||||||||||||
| D |
| ||||||||||||||||||||||||
| D | |||||||||||||||||||||||||
| O | ||||||||||||||||||||||||||
| А |
| |||||||||||||||||||||||||
| O | |||||||||||||||||||||||||
| D | |||||||||||||||||||||||||
| O | ||||||||||||||||||||||||||
| O |
| ||||||||||||||||||||||||
| N | |||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| O | ||||||||||||||||||||||||||
| O | |||||||||||||||||||||||||
| O | |||||||||||||||||||||||||
| D |
| ||||||||||||||||||||||||
| R |
| ||||||||||||||||||||||||
| O | |||||||||||||||||||||||||
| N | |||||||||||||||||||||||||
| ||||||||||||||||||||||||||
Анти-терминальная дезоксинуклеотидилтрансфераза (TdT) FITC
Альт Ф.В., Балтимор Д.Присоединение сегментов гена тяжелой цепи иммуноглобулина: последствия от хромосомы с доказательством трех слияний D-JH. Proc Natl Acad Sci USA. 1982; 79: 4118-4122. (Биология).
Альт Ф. В., Олц Э.М., Янг Ф., Горман Дж., Такчиоли Дж., Чен Дж.Рекомбинация VDJ. Иммунол сегодня. 1992; 13 (8): 306-314. (Биология).
В., Олц Э.М., Янг Ф., Горман Дж., Такчиоли Дж., Чен Дж.Рекомбинация VDJ. Иммунол сегодня. 1992; 13 (8): 306-314. (Биология).
Балтимор Д. Является ли терминальная дезоксинуклеотидилтрансфераза соматическим мутагеном в лимфоцитах?Природа. 1974; 409-411. (Биология).
Bearman RM, Winberg CD, Maslow WC, et al. Терминальная активность дезоксинуклеотидилтрансферазы в неопластических и неопухолевых гематопоэтических клетках.Am J Clin Pathol. 1981; 75: 794-802. (Биология).
Терминальная активность дезоксинуклеотидилтрансферазы в неопластических и неопухолевых гематопоэтических клетках.Am J Clin Pathol. 1981; 75: 794-802. (Биология).
Bollum FJ. Терминальная дезоксинуклеотидилтрансфераза как маркер кроветворных клеток.Кровь. 1979; 54: 1203-1215. (Биология).
Бонати А. , Занелли П., Феррари С. и др. Перестройка и экспрессия гена β-цепи рецептора Т-клеток в онтогенезе тимуса человека.Кровь. 1992; 79: 1472-1483. (Биология).
, Занелли П., Феррари С. и др. Перестройка и экспрессия гена β-цепи рецептора Т-клеток в онтогенезе тимуса человека.Кровь. 1992; 79: 1472-1483. (Биология).
Центры по контролю за заболеваниями. Обновление: универсальные меры предосторожности для предотвращения передачи вируса иммунодефицита человека, вируса гепатита B и других патогенов, передающихся с кровью, в медицинских учреждениях.MMWR. 1988; 37: 377-388. (Биология).
Clevers H, Alarcón B, Wileman T, Terhorst C. Комплекс рецепторов Т-клеток / CD3: динамический белковый ансамбль.Annual Rev Immunol. 1988; 6: 629. (Биология).
Комплекс рецепторов Т-клеток / CD3: динамический белковый ансамбль.Annual Rev Immunol. 1988; 6: 629. (Биология).
Клиническое применение проточной цитометрии: обеспечение качества и иммунофенотипирование лимфоцитов: утвержденное руководство.Документ NCCLS h52-A. 1998. (Биология).
Консенсусный протокол для иммунофенотипирования с помощью проточной цитометрии злокачественных опухолей кроветворения. Роте Г., Шмитц Г. Лейкемия. 1996; 10: 877-895. (Биология).
Роте Г., Шмитц Г. Лейкемия. 1996; 10: 877-895. (Биология).
Дезидерио С.В., Янкопулос Г.Д., Паскинд М. и др. Встраивание N-участков в гены тяжелых цепей соответствует экспрессии терминальной дезокситрансферазы в B-клетках.Природа. 1984; 311: 752-755. (Биология).
Фуллер С. А., Филлипс А., Коулман М.С. Аффинная очистка и уточненная структурная характеристика терминальной дезоксирибонуклеотидилтрансферазы.Biochem J. 1985; 231: 105-113. (Биология).
А., Филлипс А., Коулман М.С. Аффинная очистка и уточненная структурная характеристика терминальной дезоксирибонуклеотидилтрансферазы.Biochem J. 1985; 231: 105-113. (Биология).
Хорватинович JM, Спаркс SD, Боровиц MJ. Обнаружение терминальной дезоксинуклеотидилтрансферазы методом проточной цитометрии: трехцветный метод. Цитометрия. 1994; 18: 228-230. (Биология).
Обнаружение терминальной дезоксинуклеотидилтрансферазы методом проточной цитометрии: трехцветный метод. Цитометрия. 1994; 18: 228-230. (Биология).
Джексон А.Л., Уорнер Н.Л.Роуз Н.Р., Фридман Х., Фэи Дж.Л., изд. Руководство по клинической лабораторной иммунологии, третье издание. Вашингтон, округ Колумбия: Американское общество микробиологии; 1986: 226-235.
Комори Т. , Окада А., Стюарт В., Альт Ф.Отсутствие N-участков в вариабельных областях антигенных рецепторов TdT-дефицитных лимфоцитов. Наука. 1993; 261: 1171-1175. (Биология).
, Окада А., Стюарт В., Альт Ф.Отсутствие N-участков в вариабельных областях антигенных рецепторов TdT-дефицитных лимфоцитов. Наука. 1993; 261: 1171-1175. (Биология).
Kung PC, Long JC, McCaffrey RP, Ratliff RL, Harrison TA, Baltimore D.Терминальная дезоксинуклеотидилтрансфераза в диагностике лейкемии и злокачественной лимфомы. Am J Med. 1978; 64 (5): 788-794. (Биология).
Ландау Н. Р., Шац Д.Г., Роза М., Балтимор Д.Повышенная частота вставки N-области в линию мышиных пре-B-клеток, инфицированных ретровирусным экспрессирующим вектором терминальной дезоксинуклеотидилтрансферазы. Mol Cell Biol. 1987; 7: 3237-3243. (Биология).
Р., Шац Д.Г., Роза М., Балтимор Д.Повышенная частота вставки N-области в линию мышиных пре-B-клеток, инфицированных ретровирусным экспрессирующим вектором терминальной дезоксинуклеотидилтрансферазы. Mol Cell Biol. 1987; 7: 3237-3243. (Биология).
Маккаффри Р., Харрисон Т.А., Паркман Р., Балтимор Д.Терминальная активность дезоксинуклеотидилтрансферазы в лейкозных клетках человека и в нормальных тимоцитах человека. N Engl J Med. 1975; 292 (15): 775-780. (Биология).
Маккаффри Р. , Смолер Д. Ф., Балтимор Д.Терминальная дезоксинуклеотидилтрансфераза в случае острого лимфобластного лейкоза у детей. Proc Natl Acad Sci U S. A. 1973; 70: 521-525. (Биология).
, Смолер Д. Ф., Балтимор Д.Терминальная дезоксинуклеотидилтрансфераза в случае острого лимфобластного лейкоза у детей. Proc Natl Acad Sci U S. A. 1973; 70: 521-525. (Биология).
Мюлек С.Д., Маккенна Р.В., Гейл П.Ф., Брунинг Р.Д.Терминальная дезоксинуклеотидилтрансфераза (TdT) -позитивные клетки в костном мозге при отсутствии гематологических злокачественных новообразований. Am J Clin Pathol. 1983; 79: 277-284. (Биология).
Мерфи С. , Джаффе Э.С.Терминальная трансферазная активность и лимфобластные новообразования. N Engl J Med. 1984; 311: 1373-1375. (Биология).
Документ NCCLS.2001. (Биология).
Paietta E, Meenan B, Heavey C, Thomas D. Обнаружение терминальной трансферазы при остром миелоидном лейкозе с помощью проточной цитометрии. Цитометрия. 1994; 16: 256-261. (Биология).
Рома А.О., Куток Ю.Л., Шахин Г., Дорфман Д.М. Новый, быстрый, многопараметрический подход к проточно-цитометрическому анализу внутриядерной терминальной дезоксинуклеотидилтрансферазы.Am J Clin Pathol. 1999; 112: 343-348. (Биология).
Stelzer GT, Marti G, Hurley A, McCoy PJ, Lovett EJ, Schwartz A. Консенсусные рекомендации США и Канады по иммунофенотипическому анализу гематологических новообразований с помощью проточной цитометрии: стандартизация и валидация лабораторных процедур. Цитометрия. 1997; 30: 214-230. (Биология).
Консенсусные рекомендации США и Канады по иммунофенотипическому анализу гематологических новообразований с помощью проточной цитометрии: стандартизация и валидация лабораторных процедур. Цитометрия. 1997; 30: 214-230. (Биология).
Вальдманн Т.А.Расположение генов иммуноглобулинов и Т-клеточных рецепторов при лимфопролиферативных заболеваниях человека. Adv Immunol. 1987; 40: 247-321. (Биология).
Weiss LM, Bindl JM, Picozzi VJ, Link MP, Warnke RA. Лимфобластная лимфома: иммунофенотипическое исследование 26 случаев по сравнению с Т-клеточным острым лимфобластным лейкозом. Кровь. 1986; 67 (2): 474-478. (Биология).
Лимфобластная лимфома: иммунофенотипическое исследование 26 случаев по сравнению с Т-клеточным острым лимфобластным лейкозом. Кровь. 1986; 67 (2): 474-478. (Биология).
Europe PMC
Abstract
Точные транспортные характеристики вакуолярного переносчика дикарбоксилата tDT из Arabidopsis неуловимы.Чтобы преодолеть это ограничение, мы объединили ряд экспериментальных подходов, включающих создание / анализ сверхэкспрессоров tDT , кормление 13 CO 2 и количественное определение обогащения 13 C, функциональную характеристику tDT в протеолипосомах и электрофизиологические исследования вакуоли. Растения с нокаутом tdt показали пониженную концентрацию малата и повышенную концентрацию цитрата в листьях во время дневного ритма свет-темнота и после наступления засухи по сравнению с дикими типами. Интересно, что в последних двух условиях сверхэкспрессоры tDT демонстрировали уровни малата и цитрата, противоположные нокаутным растениям tdt . Высокоочищенный белок tDT транспортирует малат и цитрат в режиме антипорта 1: 1. Очевидное сродство к малату снижалось с уменьшением pH, тогда как сродство к цитрату увеличивалось. Это наблюдение показывает, что tDT отдает предпочтение дианионным субстратам, что подтверждается электрофизиологическим анализом интактных вакуолей. tDT также принимает в качестве субстратов фумарат и сукцинат, но не α-кетоглутарат, глюконат, сульфат или фосфат.Взяв tDT в качестве примера, мы продемонстрировали, что возможно восстановить переносчик вакуолярного метаболита функционально в протеолипосомах. Показанные, до сих пор неизвестные противообменные свойства tDT теперь объясняют часто наблюдаемые взаимные изменения концентрации малата и цитрата в листьях различных видов растений. tDT из Arabidopsis является первым членом хорошо известной и широко распространенной группы белков-носителей SLC13, проявляющих антипортный способ транспорта.
Интересно, что в последних двух условиях сверхэкспрессоры tDT демонстрировали уровни малата и цитрата, противоположные нокаутным растениям tdt . Высокоочищенный белок tDT транспортирует малат и цитрат в режиме антипорта 1: 1. Очевидное сродство к малату снижалось с уменьшением pH, тогда как сродство к цитрату увеличивалось. Это наблюдение показывает, что tDT отдает предпочтение дианионным субстратам, что подтверждается электрофизиологическим анализом интактных вакуолей. tDT также принимает в качестве субстратов фумарат и сукцинат, но не α-кетоглутарат, глюконат, сульфат или фосфат.Взяв tDT в качестве примера, мы продемонстрировали, что возможно восстановить переносчик вакуолярного метаболита функционально в протеолипосомах. Показанные, до сих пор неизвестные противообменные свойства tDT теперь объясняют часто наблюдаемые взаимные изменения концентрации малата и цитрата в листьях различных видов растений. tDT из Arabidopsis является первым членом хорошо известной и широко распространенной группы белков-носителей SLC13, проявляющих антипортный способ транспорта.
Ключевые слова: вакуоль, органелла, Arabidopsis thaliana, переносчик, цикл трикарбоновой кислоты (цикл Кребса), арабидопсис, цитрат, дикарбоксилатный носитель, малат, вакуолярный переносчик
Введение
Карбоксилаты, такие как карбоксилаты , и фумарат, являются основными составляющими клеточных процессов практически в каждой живой системе. У растений эти соединения участвуют в нескольких важных метаболических путях и служат промежуточными звеньями энергетического метаболизма; в качестве предшественников метаболитов, таких как аминокислоты, сахара и нуклеотиды; в качестве хелаторов для металлических питательных веществ и токсичных тяжелых металлов; как противоионы для катионов; как растворенные вещества, необходимые для регуляции тургора клеток; или как сигнальные молекулы (1, –4).Малат, как наиболее распространенный карбоксилат, обладает двумя значениями p K и : pH 3,1 и 5,1 соответственно, что делает это растворенное вещество, кроме того, важным элементом «системы pH-стат» в растительных клетках (5). . Малат известен как промежуточное звено митохондриального метаболизма, но он также обнаруживается в цитозоле, хлоропластах, пероксисомах, вакуолях и апопластах (6). Таким образом, присутствие малата в большинстве клеточных доменов и его центральная функция во многих биохимических путях требует строго контролируемого гомеостаза.
. Малат известен как промежуточное звено митохондриального метаболизма, но он также обнаруживается в цитозоле, хлоропластах, пероксисомах, вакуолях и апопластах (6). Таким образом, присутствие малата в большинстве клеточных доменов и его центральная функция во многих биохимических путях требует строго контролируемого гомеостаза.
Вакуоль служит буфером и отделением для хранения малата, что позволяет этому метаболиту выделяться в выбранных условиях, поддерживая тем самым цитозольные концентрации на оптимальном уровне (7). Однако, поскольку содержимое малата листа демонстрирует заметные суточные колебания (8), вакуумное накопление должно быть динамическим процессом. Соответственно, регулирование импорта и экспорта малата необходимо для адаптации его клеточной доступности к меняющимся клеточным потребностям.
Транспорт малата через вакуолярную мембрану опосредуется различными транспортными системами, что позволяет этой органической кислоте накапливаться даже при резких градиентах концентрации (7). Эксперименты по прямому поглощению и электрофизиологические исследования либо на везикулах, обогащенных тонопластами, либо на интактных вакуолях из разных видов растений указывают на присутствие как переносчиков малата, так и белков выпрямляющих малатных каналов (9, –14).
Эксперименты по прямому поглощению и электрофизиологические исследования либо на везикулах, обогащенных тонопластами, либо на интактных вакуолях из разных видов растений указывают на присутствие как переносчиков малата, так и белков выпрямляющих малатных каналов (9, –14).
Транспортер дикарбоксилата тонопласта (tDT) 2 из Arabidopsis был первым вакуолярным носителем малата, идентифицированным на молекулярном уровне (8). В Arabidopsis не существует гомологов гена tDT , и присутствие этого носителя, скорее всего, ограничено вакуолярной мембраной (8) и растительной группой белка tDT в так называемом семействе SLC13.В отличие от tDT, все белки SLC13 в клетках животных располагаются на плазматической мембране и катализируют связанный с натрием импорт различных карбоксилатов (15, 16).
Поглощение вакуолярного малата tDT может частично дополняться расположенным в тонопласте мембранным белком ALMT9, обнаруженным в Arabidopsis (11, 17). Последний является членом семейства активируемых алюминием переносчиков малата, поскольку первые члены этой группы белков были идентифицированы в плазматической мембране клеток корня, где они вносят вклад в экстрарадикальное хелатирование токсичного алюминия (18).Электрофизиологические исследования показали, что ALMT9 принимает в качестве белка канального типа как малат, так и фумарат в качестве субстратов и проявляет выпрямляющие внутрь токи карбоксилата (11). Более подробные исследования показали, что ALMT9, вероятно, также функционирует как активируемый малатом хлоридный канал и что его физиологическая роль, вероятно, заключается в поглощении вакуолярного Cl — (19, 20), а в недавней публикации было обнаружено, что член ALMT в томат играет центральную роль в накоплении плодов малата (17).
Неожиданно, по сравнению с растениями дикого типа, мутанты с потерей функции tDT из Arabidopsis не проявляли морфологических изменений, задержки развития или нарушения движения устьиц при воздействии различных условий роста (21). Однако у мутанта обнаружены метаболические изменения, ясно указывающие на активность транспорта малата in vivo. Эти различия включают снижение уровня малата в листьях, учащенное дыхание, изменение дыхательного коэффициента и изменения митохондриальных метаболитов.Кроме того, у мутантных растений была нарушена способность справляться с кислотным стрессом (8, 21, –23). Эти результаты предполагают, что вакуолярные ALMT могут частично компенсировать потерю tDT и что соответствующие мутанты могут адаптировать свой метаболизм к ситуации, когда малат менее эффективно переносится в вакуоль, в основном за счет увеличения потребления малата.
Однако у мутанта обнаружены метаболические изменения, ясно указывающие на активность транспорта малата in vivo. Эти различия включают снижение уровня малата в листьях, учащенное дыхание, изменение дыхательного коэффициента и изменения митохондриальных метаболитов.Кроме того, у мутантных растений была нарушена способность справляться с кислотным стрессом (8, 21, –23). Эти результаты предполагают, что вакуолярные ALMT могут частично компенсировать потерю tDT и что соответствующие мутанты могут адаптировать свой метаболизм к ситуации, когда малат менее эффективно переносится в вакуоль, в основном за счет увеличения потребления малата.
Чтобы далее описать физиологическое влияние tDT на гомеостаз малата растений и идентифицировать до сих пор неразрешенный способ транспорта, катализируемый tDT, мы использовали ряд экспериментальных подходов.После рассмотрения всех полученных данных мы описываем пока неизвестный малат / цитратный антипорт, катализируемый tDT, нетипичный для всех других проанализированных белков SLC13. Это неожиданное транспортное свойство tDT позволяет нам теперь объяснить часто наблюдаемый гомеостаз клеточного карбоксилата у высших растений.
Это неожиданное транспортное свойство tDT позволяет нам теперь объяснить часто наблюдаемый гомеостаз клеточного карбоксилата у высших растений.
Результаты
Генерация линий сверхэкспрессоров tDT
В предыдущей публикации (8) были описаны две независимые нокаутные линии tDT (сокращенно tdt1 и — 2 ), которые демонстрируют схожие физиологические и метаболические различия, когда по сравнению с дикими типами.
Для настоящего исследования мы хотели дополнительно получить мутантов-сверхэкспрессоров tDT (линии oex). Для этого кДНК tDT из Arabidopsis была установлена под контроль промотора вируса мозаики 35S-цветной капусты. Чтобы предотвратить предполагаемую совместную супрессию, искусственный ген tDT был введен в генетический фон нокаутной линии tdt1 (8). Из 10 независимых линий tDT oex мы выделили общую мРНК и провели Нозерн-блот-анализ.Все выбранные линии oex продемонстрировали существенное накопление транскриптов tDT (фиг. S1 A ). Линии oex 15 и 24 (, помеченные как ) были проанализированы с помощью количественной ОТ-ПЦР и показали 60- и 40-кратное повышение уровней мРНК tDT , соответственно, по сравнению с содержанием мРНК tDT , присутствующим в WT (рис. S1. В ).
S1 A ). Линии oex 15 и 24 (, помеченные как ) были проанализированы с помощью количественной ОТ-ПЦР и показали 60- и 40-кратное повышение уровней мРНК tDT , соответственно, по сравнению с содержанием мРНК tDT , присутствующим в WT (рис. S1. В ).
Сверхэкспрессоры tDT и растения с нокаутом tDT демонстрируют реципрокные суточные уровни малата и цитрата
Для анализа влияния измененной активности tDT на содержание карбоксилатов мы выращивали растения WT, мутанты oex15 и oex24 и растения tdt1 для 5 недель на почве и количественное определение уровней карбоксилата в листьях в течение цикла день / ночь (10 часов света и 14 часов темноты; A и B ).
Содержание малата и цитрата в листьях Arabidopsis . Показано содержание малата ( A ) и цитрата ( B ) в растениях дикого типа ( черные кружки, ), tDt1 ( белых квадрата, ) и tDT растений-сверхэкспрессоров oex15 ( белых треугольника ). ) и oex24 ( черных бриллианта ). Растения выращивали в стандартных условиях в течение 5 недель. Образцы отбирали в суточном ритме в заданные моменты времени. Черные полосы , периоды тьмы. Каждая точка данных представляет собой среднее значение четырех биологических повторов ± S.E. ( планки ошибок ).
) и oex24 ( черных бриллианта ). Растения выращивали в стандартных условиях в течение 5 недель. Образцы отбирали в суточном ритме в заданные моменты времени. Черные полосы , периоды тьмы. Каждая точка данных представляет собой среднее значение четырех биологических повторов ± S.E. ( планки ошибок ).
WT-растения содержали 6,2 мкмоль малата / гFw в конце ночи и накапливали эту органическую кислоту линейно в течение всей световой фазы, достигая 18,8 мкмоль малата / гFw ( A ). В следующий темный период концентрация малата снизилась и достигла после 14 часов темноты значения, аналогичного началу света ( A ). tdt1 растения содержат только 2,0 мкмоль малата / гFw в конце ночи и накапливают только 8,9 мкмоль малата / гFw в конце дня, что соответствует ~ 50% от значения, наблюдаемого для WT ( A ). Во время ночной фазы содержание малата в листьях tdt1 уменьшилось до значения, аналогичного концентрации в начале освещения ( A ). Напротив, обе линии tDT oex содержали значительно повышенные уровни малата по сравнению с двумя другими генотипами.В конце ночной фазы oex15 и oex24 содержали 19,6 и 24,4 мкмоль малата / гFw, соответственно, и накапливали малат линейно в течение всей дневной фазы, достигая в обеих линиях 45,3 мкмоль малата / гFw ( A ). Подобно другим генотипам, уровни малата снижались почти линейно в течение ночи и достигали 20 и 24 мкмоль / гFw в листьях oex15 и oex24 соответственно ( A ).
Напротив, обе линии tDT oex содержали значительно повышенные уровни малата по сравнению с двумя другими генотипами.В конце ночной фазы oex15 и oex24 содержали 19,6 и 24,4 мкмоль малата / гFw, соответственно, и накапливали малат линейно в течение всей дневной фазы, достигая в обеих линиях 45,3 мкмоль малата / гFw ( A ). Подобно другим генотипам, уровни малата снижались почти линейно в течение ночи и достигали 20 и 24 мкмоль / гFw в листьях oex15 и oex24 соответственно ( A ).
У диких животных суточные уровни цитрата реципрокны к изменениям в малате в течение всего дня.В начале световой фазы растения WT содержали около 50 мкмоль / гFw цитрата, и это содержание быстро снижалось в течение первых 3 часов света, приближаясь к 30,2 мкмоль / гFw ( B ). После этого уровни цитрата еще больше снизились, что привело к концентрации 28,0 мкмоль / гFw в конце световой фазы ( A ). В течение ночи концентрация цитрата увеличивалась и достигла уровня, близкого к значению, присутствующему в начале эксперимента, а именно 50,5 мкмоль / гFw ( A ). В отличие от этого, изменения цитрата в tdt1 были гораздо менее выраженными ( B ). В начале световой фазы tdt1 растений содержали уровни цитрата, близкие к значениям, присутствующим в листьях дикого типа, тогда как потребление цитрата в течение дня было незначительным, что привело к 43,1 мкмоль цитрата / гFw ( B ). Этот уровень цитрата увеличился лишь незначительно в течение 14 часов темноты и достиг значения около 50 мкмоль / гFw, что аналогично значению в начале анализа ( B ).В отличие от растений WT или tdt1 , листья двух линий 15 и 24 tDT oex содержали гораздо меньше цитрата. Линии oex 15 и 24 начинались с 20,6 и 23,5 мкмоль цитрата / gFw, соответственно, в начале световой фазы, и эта низкая концентрация снижалась далее в течение дня, приводя к только 10 мкмоль цитрата / gFw в обеих линиях растений ( В ). В течение следующей ночной фазы содержание цитрата в обеих линиях oex увеличивалось почти линейно и достигало значений, близких к значениям в начале анализа ( B ).
В отличие от этого, изменения цитрата в tdt1 были гораздо менее выраженными ( B ). В начале световой фазы tdt1 растений содержали уровни цитрата, близкие к значениям, присутствующим в листьях дикого типа, тогда как потребление цитрата в течение дня было незначительным, что привело к 43,1 мкмоль цитрата / гFw ( B ). Этот уровень цитрата увеличился лишь незначительно в течение 14 часов темноты и достиг значения около 50 мкмоль / гFw, что аналогично значению в начале анализа ( B ).В отличие от растений WT или tdt1 , листья двух линий 15 и 24 tDT oex содержали гораздо меньше цитрата. Линии oex 15 и 24 начинались с 20,6 и 23,5 мкмоль цитрата / gFw, соответственно, в начале световой фазы, и эта низкая концентрация снижалась далее в течение дня, приводя к только 10 мкмоль цитрата / gFw в обеих линиях растений ( В ). В течение следующей ночной фазы содержание цитрата в обеих линиях oex увеличивалось почти линейно и достигало значений, близких к значениям в начале анализа ( B ).
В целом начало стресса засухи провоцирует повышение уровня карбоновых кислот в растениях (24). Таким образом, чтобы выяснить, ограничиваются ли различия в содержании карбоксилатов между отдельными генотипами суточной динамикой, мы дополнительно проверили влияние засухи на эти метаболиты. Для этого мы выращивали все линии растений в течение 3 недель на почве до наступления засухи, вызванной забором воды в течение 14 дней, тогда как контрольные растения дополнительно поливали. В конце легкой фазы 14-дневного стресса, вызванного засухой, были взяты образцы и количественно определены карбоксилаты.У растений WT засуха вызвала существенное увеличение концентрации малата в листьях с 15,1 мкмоль / гFw у поливных растений до 45,5 мкмоль / гFw. В линии tdt1 почти не наблюдалось вызванного засухой увеличения содержания малата, тогда как обе линии сверхэкспрессора tDT начинали уже с более высоких уровней малата по сравнению с WT, а именно 41,6 и 31,0 мкмоль малата / гFw, соответственно ( А ). Напротив, у растений WT засуха вызвала снижение содержания цитрата, поскольку поливные листья WT содержали 22.4 мкмоль цитрата / gFw, тогда как воздействие засухи привело к менее чем 10 мкмоль цитрата / gFw ( B ). Растения с потерей функции tdt1 содержали более высокие уровни цитрата, чем соответствующие растения дикого типа (около 43,3 мкмоль цитрата / гFw в контроле), и, как и в случае с изменениями малата, изменения цитрата, вызванные засухой, не были значительными для этого генотипа растения ( В ). Обе линии сверхэкспрессоров tDT содержали значительно меньше цитрата, чем растения WT или tdt1 как в контрольных условиях, так и в условиях засухи ( B ).Низкие уровни цитрата у мутантов oex, всего около 10 мкмоль цитрата / gFw, не были существенно снижены обработкой от засухи, что указывает на то, что в этом случае можно было наблюдать только умеренную корреляцию между обратными концентрациями малата и цитрата ( B ). .
Напротив, у растений WT засуха вызвала снижение содержания цитрата, поскольку поливные листья WT содержали 22.4 мкмоль цитрата / gFw, тогда как воздействие засухи привело к менее чем 10 мкмоль цитрата / gFw ( B ). Растения с потерей функции tdt1 содержали более высокие уровни цитрата, чем соответствующие растения дикого типа (около 43,3 мкмоль цитрата / гFw в контроле), и, как и в случае с изменениями малата, изменения цитрата, вызванные засухой, не были значительными для этого генотипа растения ( В ). Обе линии сверхэкспрессоров tDT содержали значительно меньше цитрата, чем растения WT или tdt1 как в контрольных условиях, так и в условиях засухи ( B ).Низкие уровни цитрата у мутантов oex, всего около 10 мкмоль цитрата / gFw, не были существенно снижены обработкой от засухи, что указывает на то, что в этом случае можно было наблюдать только умеренную корреляцию между обратными концентрациями малата и цитрата ( B ). . Этот результат, вероятно, связан с тем, что цитрат, обнаруживаемый в растениях oex, в основном цитозольный, и, следовательно, дальнейшего существенного снижения не наблюдалось.
Этот результат, вероятно, связан с тем, что цитрат, обнаруживаемый в растениях oex, в основном цитозольный, и, следовательно, дальнейшего существенного снижения не наблюдалось.
Изменение содержания цитрата и малата в листьях Arabidopsis после 14 дней засухи. WT, нокаут ( tdt1 ) и растения-сверхэкспрессоры tDT ( Oex15 и Oex24 ) выращивали в стандартных условиях в течение 3 недель. После этого применялась засуха путем удержания воды в течение 14 дней ( белый ). A , уровни малата; B , уровни цитрата. Контрольные растения все еще поливали ( темно-серый, ). Образцы собирали в конце темного периода. Каждая точка данных представляет собой среднее значение 14 биологических повторов ± S.E. ( планка ошибок ). Звездочки указывают на статистически значимые различия, проанализированные с помощью теста Стьюдента t (*, p ≤ 0,05; **, p ≤ 0,01; ***, p ≤ 0,001).
tDT демонстрирует заметную зависимость транспорта карбоксилатов от pH.
Протеолипосомы, содержащие чистый белок-носитель, представляют собой отличный инструмент для изучения общих транспортных свойств. Однако до сих пор не было сообщений о восстановлении очищенного переносчика вакуолярных метаболитов в липосомах.Таким образом, отсутствует подходящий протокол восстановления.
С этой целью мы гетерологично экспрессировали tDT в Escherichia coli и воссоздали очищенный рекомбинантный белок tDT в липосомах, что дополнительно позволило нам определить состав растворенного вещества в просвете. После рекомбинантного синтеза белка tDT, меченного His (His-tDT), мы обогатили слитый белок с помощью металло-хелатной аффинной хроматографии, что привело к очищенному носителю с кажущейся молекулярной массой около 50 кДа (рис.S2 A ). Используя антитело, специфичное к His-метке, мы подтвердили, что размер очищенного белка (фиг. S2 A ) соответствует рекомбинантному переносчику (фиг. S2 B ).
Липосомы, содержащие восстановленный белок His-tDT (скорее всего, восстановленный в ориентации 1: 1), импортировали как цитрат, так и малат, и транспорт обоих метаболитов стимулировался предварительной загрузкой везикул либо малатом, либо цитратом ( A ) . При внешнем pH 7.8, импорт малата [ 14 C] в предварительно загруженные протеолипосомы был максимальным ( A , слева ), тогда как снижение внешнего pH до 7,0 или 6,2 спровоцировало ступенчатое снижение скорости транспорта ( A , средний и правый ). Подобно поглощению малата, уровни поглощения цитрата, опосредованного tDT, были чрезвычайно низкими в ненагруженных протеолипосомах (среда tgl; отсутствие дополнительных карбоксилатов; B ). Однако предварительная загрузка протеолипосом цитратом или малатом существенно стимулировала поглощение [ 14 C] цитрата ( B , слева ).В отличие от транспорта малата, транспорт цитрата с помощью tDT был немного увеличен за счет снижения внешнего pH с 7,8 до 7 ( B , средний ) и сильно стимулировался дальнейшим подкислением до pH 6,2 ( B , правая панель ). ).
Зависимость от времени tDT-опосредованного поглощения малата и цитрата протеолипосомами. Протеолипосомы инкубировали с 50 мкм 14 C-меченный цитрат или малат, соответственно, в течение указанного времени.Концентрация предварительно загруженных карбоксилатов составляла 5 мм. Поглощение останавливали путем отделения внешних карбоксилатов от протеолипосом с помощью анионообменной хроматографии. A , зависимость от времени поглощения малата протеолипосомами, нагруженными малатом ( кружка ), загруженными цитратом ( квадрата ) или ненагруженными ( треугольника ). B , зависимость поглощения цитрата от времени в протеолипосомах, нагруженных малатом ( круга ), загруженных цитратом ( квадрата ) или ненагруженных ( треугольника ).PH просвета всегда устанавливали равным 7. Каждая точка данных представляет собой среднее значение по меньшей мере пяти независимых экспериментов ± S.E. ( планки ошибок ).
Изменения внешнего pH влияют на сродство tDT к малату и цитрату взаимно
Чтобы выяснить, влияет ли внешний pH на сродство к субстрату, мы провели дополнительные эксперименты по поглощению при изменении внешних концентраций карбоксилата и при различных уровнях pH (, A и В ).Скорость импорта малата, опосредованного tDT, была снижена за счет внешнего подкисления с pH 7,8 до pH 6,2, что привело к снижению видимого сродства к субстрату в диапазоне от примерно 200 мкм при pH 7,8 до примерно 490 мкм при pH 6,2 ( A ( слева до справа панель ) и). Напротив, внешнее подкисление привело к увеличению скорости транспорта цитрата белком tDT и к более высокому очевидному сродству к цитрату в диапазоне от K m до 364 мкм при pH 7.От 8 до 303 мкм при pH 7 и 158 мкм при pH 6,2 (( A и B ) и).
Зависимость от концентрации 14 C-меченного поглощения малата или цитрата tDT-содержащими протеолипосомами. A , поглощение 14 C-меченного малата протеолипосомами, предварительно загруженными 5 мм малатом. B , поглощение 14 C-меченного цитрата протеолипосомами, предварительно загруженными 5 мМ цитратом. Уровни pH в просвете протеолипосом доводили до pH 7.0. Субстраты из внешнего участка поставлялись с pH в диапазоне от щелочного (pH ex 7,8) до нейтрального (pH ex 7,0) до кислого (pH ex 6,2). Каждая точка данных представляет собой среднее значение по крайней мере пяти отдельных повторов ± S.E. ( планки ошибок ).
Таблица 1
Кажущееся K m значений и V макс. значений импорта малата и цитрата в предварительно загруженные протеолипосомы tDT
| pH (внешний / внутренний цитрат | ) Поглощение малата предзагружено) Поглощение цитрата (предзагружено малатом) | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| K м | V макс.| μ m | нмоль / мг белка h | μ m | нмоль / мг белка h | 7.8 / 7,0 | 197,8 ± 12,59 | 16,2 ± 0,64 | 363,7 ± 30,51 | 6,2 ± 0,37 | 7,0 / 7,0 | 443,0 ± 46,20 | 9,5 ± 0,68 9000 ± 0,3 | 9 9,5 ± 0,68 9000 ± 0,3 | 9 9,5 ± 0,68 9000 ± 5 | 9 | 6,2 / 7,0 | 488,9 ± 46,76 | 7,7 ± 0,51 | 158,0 ± 10,37 | 9,2 ± 0,40 | | |
Носитель AttDT принимает различные карбоновые кислоты, карбоксилатные антиподы66 и карбоксилатные антитела. Чтобы проверить, принимает ли tDT субстраты, отличные от малата и цитрата, мы проанализировали относительную эффективность предварительной загрузки протеолипосом с рядом предполагаемых растворенных веществ () при pH 7.8 и 6.2. Из всех испытанных растворенных веществ малат и цитрат были наиболее эффективными в качестве субстратов противообмена (,
A и B ). Подобно наблюдению выше, поглощение малата было выше при щелочном pH 7,8 по сравнению с кислым pH 6,2, тогда как поглощение цитрата было обратным (, A и B ). Поглощение как малата, так и цитрата стимулировалось предварительной загрузкой протеолипосом фумаратом и сукцинатом, тогда как фосфат и сульфат не служили в качестве растворенных веществ, стимулирующих транспорт, расположенных в просвете (, A и B ).Кроме того, поскольку незагруженные протеолипосомы импортировали малат и сукцинат только со скоростью, аналогичной транспорту, индуцированному фосфатом или сульфатом (, A и B ), мы заключаем, кроме того, что tDT не принимает глюконат (присутствует в концентрации 30 мм в tgl-буферной среде) в качестве субстрата.Влияние различных внутренних субстратов на 14 C-меченный импорт малата или цитрата в протеолипосомы tDT и противообменную стехиометрию. Протеолипосомы инкубировали с 50 мкМ 14 C-меченный цитрат или малат, соответственно, и поглощение было остановлено через 5 мин путем отделения внешних карбоксилатов от протеолипосом с помощью анионообменной хроматографии. A , поглощение 14 C-меченного малата предварительно загруженными протеолипосомами при внешних значениях pH 7,8 ( темно-серый ) или 6,2 ( светло-серый ). Вставка , сравнение импорта [ 14 C] цитрата и экспорта [ 14 C] малата. [ 14 C] Импорт цитрата (50 мкм) ( темно-серый столбик ) измеряли на протеолипосомах, предварительно загруженных 50 мкм немеченым малатом и экспортом [ 14 C] малата (концентрация в просвете 50 мкм; светло-серый столбик ) ) измеряли при внешней концентрации цитрата 50 мкМ.Транспорт оставляли на 2 мин и останавливали анионообменной хроматографией. Нормы указаны в пмоль / мг белка. B , поглощение 14 C-меченого цитрата предварительно загруженными протеолипосомами при внешних значениях pH 7,8 ( темно-серый ) или 6,2 ( светло-серый ). Концентрация загруженных подложек составляла 5 мм. Уровень pH в просвете всегда был равен 7. Каждая точка данных представляет собой среднее значение по крайней мере пяти независимых экспериментов ± S.E. ( планки ошибок ). Звездочки указывают на статистически значимые различия, проанализированные с помощью теста Стьюдента t (*, p ≤ 0.05; **, p ≤ 0,01; ***, р ≤ 0,001).
Чтобы получить информацию о том, является ли наблюдаемый стимулирующий эффект люминальных карбоксилатов на tDT-опосредованный транспорт механизмом антипорта или процессом трансстимуляции (25), мы провели эксперименты по контробмену, аналогичные нашим предыдущим экспериментам с восстановленным АТФ / АДФ-обменник NTT из бактерий (26). С этой целью мы предварительно загрузили протеолипосомы с нерадиоактивным или радиоактивно меченным малатом (каждая в концентрации 50 мкм) и количественно оценили поглощение радиоактивного или нерадиоактивного цитрата соответственно ( A , вставка ).Сравнивая экспорт и импорт радиоактивности, мы выявили способ переноса в противоположную сторону при стехиометрии примерно 1: 1 ( A , вставка ).
Пока неизвестен заряд карбоксилатного субстрата, переносимого tDT. Чтобы восполнить этот пробел в знаниях, мы провели импортные исследования, направленные на изменение внешнего pH и количественное определение поглощения цитрата при значениях pH от 7 до 4 (). Как и ожидалось, скорости поглощения цитрата были самыми низкими при нейтральном pH (3 нмоль / мг белка h -1 ) и увеличивались при подкислении среды.При pH 4,6 наблюдалось максимальное поглощение цитрата около 60 нмоль / мг белка h -1 , которое быстро снижалось при небольшом дальнейшем подкислении до pH 4, где только 33 нмоль цитрата / мг белка h -1 был импортирован (). Эта зависимость транспорта цитрата от pH коррелирует с распределением отдельных цитрат-анионов в средах с различным pH (). Наибольшая концентрация цитрата 2- присутствует при pH 5,3 и быстро снижается по мере дальнейшего подкисления. При pH 4 только 15% цитрата находится в форме дианиона (2-), а 78% — в форме 1-.Эти данные позволили нам предположить, что цитрат 2- является преимущественно транспортируемым субстратом.
Поглощение 14 C-радиоактивно меченного цитрата протеолипосомами при различных условиях pH и наличии разных цитрат-ионов в зависимости от pH. Захват цитрата протеолипосомами, предварительно загруженными малатом 50 мкм ( черные ромбы ), сравнивали с распределением цитрат-ионов при различных условиях pH. pH в просвете протеолипосом доводили до pH 7.0. Поглощение 14 C-меченного цитрата определяли количественно при различных значениях pH в диапазоне от 4,0 до 7,0. Каждая точка данных представляет собой среднее значение трех отдельных повторов ± S.E. Расчет распределения цитрат-ионов проводили с использованием CurTiPot – pH и кривых кислотно – основного титрования: Программное обеспечение для анализа и моделирования, версия 4.2.0: цитрат H 3 ( красные кружки ), цитрат 1– H 2 ( желтых квадрата ), цитрат 2- H ( синих треугольника ), цитрат 3- ( фиолетовых треугольника ).
Чтобы проверить гипотезу о том, что tDT обменивает двухвалентные заряженные карбоновые кислоты, мы провели электрофизиологические исследования на изолированных вакуолях от растений tdt1 или линии oex 15 (рис. S3). Токи, индуцированные субстратом, измерялись в так называемой конфигурации «целая вакуоль», что позволяло измерять потоки по всей поверхности вакуоля. Вакуоли с нокаутом tdt и репрезентативной сверхэкспрессорной линией 15 первоначально измеряли в присутствии симметричных концентраций цитрата, а затем раствор ванны заменяли на малат (рис.S3, A и B ). Однако присутствие обеих предполагаемых подложек по обе стороны от мембраны не меняло плотности тока. I -V кривые плотности тока в диапазоне напряжений не различались ни между tdt1 и oex15 , ни между разными подложками (рис. S3 C ). Последние результаты показывают, что обмен цитрат / малат, предположительно продолжающийся через тонопласт из сверхэкспрессорных вакуолей, не является электрогенным.
Арабидопсис мутанты tDT демонстрируют измененные скорости мечения карбоновых кислот из вновь ассимилированного CO
2Приведенные выше данные привели нас к предположению, что tDT опосредует обмен малата и цитрата через вакуолярную мембрану. Соответственно, мы также провели мечение 13 CO 2 WT, tdt1 и tDT листьев розетки сверхэкспрессора в условиях окружающей среды, что позволяет количественно определить включение 13 C в соединения первичного метаболизм углерода (27), здесь особое внимание уделяется малату и цитрату.Из-за технических ограничений невозможно разделить изотопомеры цитрата и изоцитрата. Однако не наблюдалось обогащения цитратом / изоцитратом даже после 40 минут маркировки. Следовательно, здесь представлено только включение 13 CO 2 в малат.
Учитывая, что размер пула малата меньше у мутантов tdt1 и выше у линий сверхэкспрессоров по сравнению с WT (и), мы ожидали, что мечение 13 C будет быстрее у мутантов tdt1 и медленнее у выбранных oex. растение.Фактически, можно было наблюдать, что включение 13 CO 2 в малат у мутантов tdt1 было быстрее, чем у растений WT, тогда как в сверхэкспрессорной линии 15 малат метился с меньшей эффективностью, чем наблюдалось на растениях WT (). Этот эффект наблюдался уже через 3 мин и был более выраженным через 10, 20 и 40 мин.
13 Обогащение C (в процентах) малатом. Розеточные листья WT ( белые полосы ), нокаут ( серые полосы ) и растения-сверхэкспрессоры tDT ( черные полосы ) были помечены 13 CO 2 для 0, 3, 10, 20 , и 40 мин.Каждая точка данных представляет собой среднее значение трех биологических повторов ± стандартное отклонение. ( планки ошибок ). Из-за технических трудностей здесь представлены только две реплики для WT, помеченные на 20 мин, и один образец для линии tdt1 , помеченный на 20 мин. Значимые отличия от значений, полученных в WT по критерию Стьюдента t , обозначены звездочками (*, p <0,05; **, p <0,01).
Обсуждение
Активность AttDT ограничивает накопление вакуолярного малата в листьях Arabidopsis
И малат, и цитрат занимают центральное место в сети первичного метаболизма растений и обнаруживаются в апопласте, а также в нескольких клеточных компартментах, таких как цитозоль, митохондрии, пероксисомы, глиоксисомы, хлоропласты и вакуоли (3, 28, 29).Последняя органелла может занимать до 90% объема клетки, в результате чего вакуоль отвечает за динамическое хранение малата. Следовательно, эта органелла имеет центральное значение для поддержания цитозольного гомеостаза малата, что является предпосылкой для интеграции всех путей, в которых участвует эта карбоновая кислота. Соответственно, мы должны понимать, как осуществляется и регулируется импорт и экспорт малата через вакуолярную мембрану.
Как сообщалось ранее, отсутствие активности tDT приводит к снижению поглощения малата в вакуолях Arabidopsis , а также к снижению уровней малата в соответствующих листьях растений (8).Наряду с этими изменениями наблюдалось увеличение общей концентрации цитрата в листьях нокаут-мутантов tdt (8, 21). Однако повышение уровня цитрата у этих мутантов пока нельзя объяснить на основании ранее расшифрованных транспортных свойств tDT (8, 21).
Метаболическое профилирование линий сверхэкспрессоров tDT показало, что это изменение активности tDT соответствует значительно более высокому содержанию малата в листьях, а также снижению уровней цитрата в течение всего суточного цикла и после наступления стресса засухи по сравнению с растениями WT ( а также ).Поскольку вызванное засухой накопление малата и сопутствующая мобилизация цитрата отсутствуют у мутантов tdt1 , тогда как это явление заметно выражено в обеих сверхэкспрессорных линиях tdt (, A и B ), мы заключаем, что белок tDT является отвечает за взаимные изменения малат / цитрат в листьях Arabidopsis . Интересно, что накопление малата, вызванное засухой, не ограничивается Arabidopsis , но также наблюдается у других видов (30).Соответственно, стимулирующее действие малата на экспрессию гена tdt (14) полностью соответствует наблюдаемому влиянию измененной активности tDT на накопление малата (, A и B ). Более того, наблюдение, что соотношение малат / цитрат в листьях мутантов-сверхэкспрессоров tDT всегда выше, чем у растений WT (и), дополнительно подтверждает вывод о том, что активность tDT является ограничивающим фактором для этого реципрокного изменения уровней этих карбоксилатов у диких типов.
Эти выводы также предсказывают, что низкие уровни малата, присутствующие в листьях мутантного мутанта tDT (и), приводят к относительному увеличению уровней цитозольного малата. Измерения метаболитов у WT и растений с нокаутом tdt1 показали, что отсутствие tDT приводит к накоплению цитозольного малата (21, 23). Таким образом, тот факт, что сравнительно низкий общий пул малата у растений с нокаутом tDT быстрее метится вновь ассимилированными 13 CO 2 (), служит независимым доказательством того, что мутанты tdt1 демонстрируют накопление малата в цитозоле. .Более того, наблюдение, что большой общий пул малата в сверхэкспрессорных растениях tDT метится медленнее после введения 13 CO 2 () независимо, подтверждает мнение о том, что активность tDT является ограничивающим фактором для накопления вакуолярного малата. Кроме того, корреляция вызванного холодом увеличения концентрации малата (31) с сопутствующим повышением уровня белка tDT (32) также указывает на превосходную функцию tDT в накоплении малата в листьях.
tDT демонстрирует расширенный спектр субстратов и транспортирует карбоксилаты в дианионной (2-) форме
Уже предполагалось, что tDT способен как импортировать, так и экспортировать малат в вакуолях (8, 21), хотя транспортный режим tDT отсутствует. до сих пор было выдвинуто, чтобы объяснить это явление. Интересно, что ни тип транспорта, катализируемого tDT, ни его субстратный спектр до сих пор подробно не анализировались.
Согласно данным, полученным в этом исследовании, теперь мы должны расширить спектр субстратов tDT за счет цитрата, поскольку трансмембранное перемещение этого трикарбоксилата с помощью tDT было недвусмысленно задокументировано на протеолипосомах, содержащих функционально восстановленный белок tDT (и).Помимо малата и цитрата, tDT, очевидно, принимает другие карбоксилаты, такие как сукцинат и фумарат, но не растворенные вещества, такие как сульфат, фосфат или глюконат (). Таким образом, наша задокументированная транспортная активность фумарата с помощью tDT () согласуется с предыдущим наблюдением, согласно которому листья растений с нокаутом tdt демонстрируют не только пониженные уровни малата, но и меньшее количество фумарата (21). Фактически, способность tDT принимать различные карбоксилаты в качестве транспортных молекул напоминает широкую субстратную специфичность ближайшего гомолога tDT из клеток млекопитающих, а именно NaDC1 (33), который участвует в активированной натрием реабсорбции большого количества Промежуточные продукты цикла Кребса (34).
В то время как несколько членов гомологов tDT в животных системах, а именно белки SLC13, также переносят сульфат (16), мы продемонстрировали, что tDT из Arabidopsis не принимает сульфат или его структурно родственный фосфат в качестве субстратов (). Эта неспособность tDT принимать сульфат и фосфат в качестве субстратов, однако, согласуется с присутствием специфических носителей PO 4 2- и SO 4 2- в вакуолярной мембране (35, 36). Представляется вероятным, что функциям последних носителей в контроле клеточного гомеостаза фосфатов и сульфатов будет препятствовать одновременное присутствие дополнительного карбоксилата / SO 4 2- или карбоксилата / PO 4 2- транспортная способность через тонопласт.
Изменения pH среды влияют как на кажущееся сродство к субстрату, так и на скорость транспорта малат / цитрат tDT (и). Для интерпретации этих эффектов мы должны учитывать, что pH среды определяет относительное содержание различных протонированных форм карбоксилатов (). Малат в основном присутствует в виде дианиона (малат 2-) при всех испытанных значениях pH, имея большую часть более 90% при pH 6,2 (или даже выше при pH 7,0 и 7,8; см. CurTiPot в разделе «Экспериментальные процедуры». ).Напротив, суммарный заряд цитрат-иона сильно зависит от pH, и большая часть этого трикарбоксилата переходит из формы 3- в форму 2- даже в диапазоне pH от 7,0 до 6,2 (см.), Диапазон, аналогичный диапазону Градиент pH через вакуолярную мембрану (2, 37). Интересно, что максимальное поглощение цитрата было измерено при pH 4,6, тогда как дальнейшее подкисление до pH 4,0 спровоцировало снижение транспорта цитрата, предположительно из-за образования цитрата 1- (). Соответственно, цитрат 2-, вероятно, является наиболее эффективным субстратом для tDT.Поскольку цитозольный pH находится около pH 7,5 и поскольку вакуоль демонстрирует кислый pH, заманчиво предположить, что неизвестный до сих пор вакуумный импортер цитрата предпочитает трехвалентную анионную форму и что in vivo основная роль AttDT заключается в высвобождении цитрат из вакуоли в обмен на другой дикарбоксилат, который при цитозольном pH присутствует в виде дианионов.
Электрофизиологические исследования изолированных вакуолей (рис. S3) дополнительно подтверждают предположение, что tDT предпочитает двухвалентные карбоксилаты в качестве субстратов.Этот вывод основан на том факте, что, хотя WT и сверхэкспрессорные вакуоли проявляют активность tDT (8) (и), на изолированных вакуолях не обнаруживаются токи, индуцированные электрогенным малатом (Рис. S3). Интересно, что предпочтение tDT из Arabidopsis акцептировать карбоксилаты в двухвалентной анионной форме согласуется с основными транспортными свойствами соответствующего животного специфического белка SLC13 (15, 16, 33), который по структуре является ближайшим к tDT-гомологичным переносчиком. Интересно, что в то время как tDT транспортирует свои субстраты в режиме противообмена (), все остальные члены SLC13, проанализированные до сих пор, характеризуются как симпортеры натрия / карбоксилата (15, 34).И зависимость от pH, и электрофизиологические эксперименты показывают, что цитрат транспортируется в своей дианионной форме. Следовательно, путем обмена карбоксилатов, несущих два отрицательных заряда, между цитозолем и вакуолью, белок tDT действует как электронейтральный переносчик. Эксперименты, изучающие только обмены между малатом и цитратом, не исключают направленного транспорта (, например, малат в и цитрат из вакуоли или наоборот), потому что белок был восстановлен в ориентации 1: 1.Однако тот факт, что малат может быть заменен малатом, а цитрат может быть заменен цитратом (), указывает на то, что на одной стороне транспортера нет определенного предпочтения субстрата.
Противообменные свойства tDT объясняют взаимные изменения малата / цитрата в листьях растений
По следующим причинам мы предполагаем, что tDT катализирует стехиометрический встречный обмен малата и цитрата через вакуолярную мембрану. Во-первых, нокаутные и сверхэкспрессорные мутанты tDT показали заметные и всегда взаимные изменения концентрации малата и цитрата в листьях (и).Во-вторых, протеолипосомная система недвусмысленно продемонстрировала гомо- и гетеро-обратный обмен цитрата и малата с помощью tDT (и рис. S3). В-третьих, обмен малат / цитрат между протеолипосомами, несущими tDT, происходит в стехиометрии почти 1: 1 ( A , вставка).
В то время как гомообмен малата на малат или цитрата на цитрат не изменяет клеточный гомеостаз карбоксилата, любой гетерообмен, однако, может влиять на внутриклеточную компартментацию соответствующих субстратов.Учитывая, что tDT опосредует обратный обмен малата на цитрат, а цитрат накапливается в мутанте tdt , мы должны предсказать, что повышенные концентрации цитрата в вакуолях в нокаутных линиях tDT (и) обусловлены присутствием других белков, транспортирующих цитрат в вакуолярном пространстве. мембрана. Фактически, для цитрата были предложены, по крайней мере, три различных системы импорта цитрата, которые до сих пор не были идентифицированы на молекулярном уровне, включающие (i) анионный канал, транспортирующий цитрат (38), (ii) АТФ-зависимый переносчик цитрата с неизвестной молекулярной идентичностью (39) и (iii) белок-носитель, также с неизвестной молекулярной структурой, принимающий как ди-, так и трикарбоксилаты в качестве субстратов (38, 40).Таким образом, наши результаты предполагают, что требуется поглощение цитрата в вакуоль, и это движущая сила для поглощения других карбоксилатов, таких как малат и фумарат.
Таким образом, общая способность tDT катализировать гетерообмен малата и цитрата теперь вызывает вопрос о функции in vivo этого носителя. Интересно, что аналогично нашим результатам для Arabidopsis (, A и B ), суточные реципрокные изменения уровней малата и цитрата также наблюдались в листьях табака (41).Поскольку малат находится в точке разветвления впечатляющего числа метаболических путей и клеточных реакций, таких как биосинтез аминокислот, биосинтез жирных кислот, гомеостаз металлов и питательных веществ (3, 29), концентрация малата в цитозоле в клетках листа, очевидно, хорошо контролируется. и независимо сообщалось, что они низкие ночью и высокие днем (42, 43). Этот типичный суточный график содержания малата и цитрата недавно даже привел к разработке детальной модели метаболического «цикла диэль», предсказывающей, что цитрат должен синтезироваться и храниться в ночное время, чтобы служить углеродным топливом для чистого синтеза аминокислот, обычно происходящего. в фазе следующего дня (44).
Однако, принимая, что малат и цитрат являются тесно связанными метаболитами в очень активном митохондриальном цикле Кребса (малат является прямым предшественником синтеза цитрата), на первый взгляд трудно представить, как снижение уровня малата может привести к повышению уровня цитрата, наоборот. Это означает, что, хотя взаимные изменения концентраций малата и цитрата в листьях высших растений наблюдались часто, никаких функциональных объяснений этому явлению пока не предоставлено (45).Однако из-за способности tDT к обратному обмену (- и рис. S3) все взаимные изменения малата / цитрата в листьях высших растений теперь могут быть элегантно объяснены (, например, в случаях увеличения выработки малата в течение дня, эта дикарбоновая кислота попадает в вакуоль за счет люминального цитрата, тогда как в случае ночного потребления малата в цитозоле цитрат импортируется).
Интерпретация метаболических изменений, наблюдаемых у мутантов с модифицированной активностью митохондриальных ферментов, привела к предположению, что строгое поддержание определенных клеточных уровней малата имеет решающее значение для физиологии и развития растений (29, 46).Однако мутанты Arabidopsis tDT демонстрируют заметно измененные концентрации малата и цитрата (и; см. Также ссылку 8) и, более того, соответствующие изменения в относительных уровнях цитозольного малата (; см. Также ссылку 21) без существенных фенотипических особенностей, когда по сравнению с дикими типами. Очевидно, помимо нарушения регуляции цитозольной системы pH-stat у нокаутных линий tDT (21), Arabidopsis , по-видимому, способен справиться с этими замечательными изменениями малата и может компенсировать отсутствие tDT за счет увеличения производства энергии, на что указывает стимуляция дыхания у этого мутанта (21).После подробного описания транспортных свойств tDT, соответствующие эксперименты, в которых мутанты tDT будут установлены в выбранных сложных условиях, могут быть соответственно оптимизированы.
Экспериментальные процедуры
Растительный материал и условия роста
Дикий тип и трансгенные растения Arabidopsis ( Arabidopsis thaliana , экотип Wassilewskija) культивировали в камере для выращивания на стандартной удобренной почве (ED-73) в условиях короткого дня ( 10 часов света / 14 часов темноты) при 21 ° C и 125 мкмоль квантов m −2 с −1 .Свет обеспечивали светодиодные светильники серии B (Valoya, Хельсинки, Финляндия). Для маркировки 13 CO 2 растения выращивали в индивидуальных горшках диаметром 6 см с водо- / газопроницаемой пластиковой пленкой (Aquafol®, Herrmann Meyer, Rellingen, Германия) между розеткой и почвой, в ростовая камера в условиях короткого дня (8 часов света / 16 часов темноты) при 22/20 ° C день / ночь и 120 мкмоль квантов m −2 s −1 .
Мутанты с потерей функции ( tdt1 ) уже описаны (8, 21). At линии сверхэкспрессоров tDT (oex) были созданы путем трансформации растений tdt1 с использованием метода окунания в цветочек (47). Десять сильных линий сверхэкспрессоров tDT были идентифицированы с помощью Нозерн-блоттинга. Линии oex 15 и 24 были дополнительно охарактеризованы с помощью количественной ПЦР в реальном времени. Стресс засухи вызывали последующим отказом от воды в течение 14 дней после выращивания растений в течение 3 недель в стандартных условиях.
Нозерн-блот-анализ
Общую РНК выделяли из замороженных образцов ткани с использованием набора для экстракции РНК Purescript® (Gentra Systems) в соответствии с инструкциями производителя.Определение количества мРНК проводили, как описано ранее (8).
Количественная ПЦР в реальном времени
РНК дикого типа, tdt1 и две линии сверхэкспрессоров экстрагировали из замороженных листьев растений с использованием набора NucleoSpin RNA plant kit (Macherey-Nagel, Düren, Германия) и синтеза кДНК iScript. Набор (Bio-Rad, Мюнхен, Германия) использовали для синтеза кДНК согласно инструкциям производителя. Количественная ПЦР в реальном времени была проведена, как описано (48).Праймеры для количественной оценки At tDT были tDT-rt-fwd (5′-ccgtcgaacactacaacatcc-3 ‘) и tDT-rt-rev (5′-gctgttgtggcgcagatgc-3′). Для нормализации транскрипта в качестве контрольного гена использовали убиквитин10 ( At4g05320 ).
Количественное определение угольных кислот на основе ионной хроматографии
Для выделения угольных кислот растительный материал измельчали в жидком N 2 , и 1 мл бидистиллированной воды добавляли к 100 мг, тщательно перемешивали и нагревали в течение 15 мин при 95 ° C.После центрифугирования (15 мин, 20000 × г ) супернатант использовали для количественного определения ионной хроматографии. Для разделения растворимых угольных кислот использовали колонку Metrosep-organic acid 250 (Metrohm, Filderstadt, Германия) с 0,15 м H 2 SO 4 в качестве растворителя.
Рекомбинантный синтез, очистка tDT IMAC и его функциональное восстановление в протеолипосомах
Клетки E. coli BLR (DE3) pLysS (Merck Biosciences, Дармштадт, Германия), содержащие pET16b- при tDT, выращивали при 37 ° C. в среде Terrific Broth, как описано (49).При A 600 0,5–0,6 инициирование экспрессии РНК-полимеразы Т7 было индуцировано добавлением изопропил-β-d-тиогалактопиранозида (1 мМ). Клетки собирали через 4 часа после индукции центрифугированием (5000 × г , 10 мин, 20 ° C), ресуспендировали в буферной среде (1 мМ ЭДТА, 15% глицерин, 10 мМ Трис, pH 7,0) и немедленно замораживали в жидкости. № 2 . Чтобы вызвать автолиз эндогенным лизоцимом, замороженные клетки оттаивали при 37 ° C и обрабатывали щепоткой ДНКазы и РНКазы.Чтобы избежать протеолитической активности, добавляли фенилметансульфонилфторид (1 мМ). Лизис клеток поддерживался обработкой ультразвуком. Во время первого этапа центрифугирования (20000 × g , 15 мин, 4 ° C) клеточный дебрис удаляли и мембраны собирали из супернатанта центрифугированием (100000 × g , 30 мин, 4 ° C). Последующую очистку tDT от этих мембран проводили при 4 ° C. Мембраны ресуспендировали в буферной среде B (10 мМ NaCl, 5 мМ имидазол, 50 мМ Na 2 HPO 4 , pH 7.9), содержащий 0,5% DDM (Glycon Biomedicals), и перемешивали в течение 1 часа, чтобы обеспечить солюбилизацию собственных белков. После центрифугирования солюбилизированных мембран (100000 × г , 30 мин, 4 ° C) супернатант инкубировали в течение 2 часов с Ni-NTA-агарозой (Qiagen) для проведения IMAC.
Суспензию Ni-NTA переносили на хроматографическую колонку и промывали 10 объемами слоя Ni-NTA-агарозы с буферной средой B, содержащей 0,5% DDM, а затем 6 объемами колонки буферной среды W (10 мМ NaCl , 60 мМ имидазол, 50 мМ Na 2 HPO 4 , pH 7.9, 0,5% ДДМ). Затем рекомбинантный tDT элюировали соответствующим количеством буферной среды E (10 мМ NaCl, 500 мМ имидазол, 50 мМ Na 2 HPO 4 , pH 7,9, 0,5% DDM) для получения концентрации белка 0,4–0,5. мг / мл.
Сразу после очистки tDT 50 мкл элюата смешивали с гомогенной эмульсией 400 мкл 1-α-фосфатидилхолина (125 мг / мл; тип IV-S, Sigma) в буферной среде TG1 (100 мМ Tricine, 30 мМ глюконат калия, pH 7,0). Для загрузки добавляли 50 мкл указанных угольных кислот до достижения указанных концентраций.После интенсивного встряхивания смесь (500 мкл) замораживали в жидком N 2 . Протеолипосомы размораживали на льду и обрабатывали ультразвуком в течение 20 с (Sonifier 250, Branson) при самом низком уровне выхода и 50% рабочем цикле. Протеолипосомы (500 мкл) наносили на колонку NAP-5 (GE Healthcare), уравновешенную TG2 (10 мМ трицин, 150 мМ глюконат калия, pH 7,0) для удаления внешних органических кислот. Протеолипосомы элюировали из колонки 1 мл TG2.
Исследования поглощения малата и цитрата протеолипосомами
100 мкл протеолипосом добавляли к 100 мкл TG2, содержащего 14 C-меченный малат или цитрат, соответственно, при указанных концентрациях и значениях pH.Для измерений транспорта протеолипосомы инкубировали при 30 ° C, и поглощение прекращали в указанные периоды времени путем удаления остаточных органических кислот с помощью анионообменной хроматографии (Dowex 1 × 8 Cl — , 200–400 меш) (50 ). Липосомы элюировали из хроматографической колонки добавлением 1,5 мл трицина (200 мМ, pH 7,0). Радиоактивность элюата количественно определяли сцинтилляционным счетом (Canberra-Packard).
Анализ стехиометрии транспорта малата / цитрата через протеолипосомную мембрану
Протеолипосомы загружали (см. Выше) 50 мкл 14 C-меченного или немеченого малата (50 мкм), соответственно.Добавляли немеченый цитрат или 14 C-меченный цитрат, и поглощение радиоактивно меченого цитрата противопоставляли высвобождению радиоактивно меченного малата.
Расчет распределения цитрат-иона и малат-иона при различных значениях pH
Расчет распределения цитрат-иона и малат-иона при различных значениях pH был выполнен с помощью бесплатной программы анализа CurTiPot (версия 4.2; IGR Gutz, University of Sao Paulo, Бразилия).
13 CO 2 исследования по меткеМечение проводили на 5-недельных растениях, как описано (27).Эксперимент начинали через 2 ч после появления света, а последнее помеченное растение собирали за 1 ч до наступления темноты. Отдельные растения в горшках быстро перемещали в камеру для маркировки под световым полем и гасили через 0, 3, 10, 20 и 40 мин после начала маркировки случайным образом в течение 2 дней. Было получено три биологических повтора для каждого условия мечения (из-за технических трудностей здесь только два повтора для WT, меченных в течение 20 минут, и один образец для линии tdt1 , меченных в течение 20 минут).Метаболизм останавливали непосредственно в камере путем наливания большого объема жидкости N 2 на розетку через воронку. Весь замороженный растительный материал над пластиковой пленкой собирали и хранили при -80 ° C, а затем измельчали в жидком N 2 . Для количественного определения ЖХ-МС / МС метаболиты экстрагировали из 15 мг (свежая масса) замороженного растительного порошка (27). Экстракты были проанализированы, а данные обработаны, как описано ранее (27).
Электрофизиологические исследования изолированных вакуолей Arabidopsis
Для патч-зажима листья розетки переваривали в расщепляющем растворе (10 мМ MES, pH 5.3, скорректированный КОН, 1 мМ CaCl 2 , 500 мМ сорбита, 0,3% (мас. / Об.) Целлюлазы «Onozuka R-10» (Serva, Гейдельберг, Германия), 0,03% (мас. / Об.) Пектолиазы Y-23 (Kyowa Chemical Industry Co., Осака, Япония) в течение 35 мин при 30 ° C. Протопласты лизировали в стандартном растворе на бане (100 мМ лимонной кислоты, pH доведен BisTris пропаном до pH 7,5, осмотическое содержание доведено до 500 мосмоль / кг с помощью сорбита) для высвобождения вакуолей. Тонкостенные боросиликатные капилляры изнутри покрывали Sigmacoat® (Sigma-Aldrich) и получали сопротивление 3 ± 1 мегаом.Наконечники пипеток были покрыты силиконом (Sylgard® 184 Silicone Elastomer Kit, Dow Corning, Wiesbaden, Germany) для уменьшения емкости пипеток. Раствор для пипетки содержал 100 мМ лимонной кислоты, 10 мМ HCl, 2 мМ CaCl 2 , и его pH доводили до 7,5 BisTris, а осмотическое содержание доводили до 550 мосмоль / кг с помощью сорбита. Пипетки устанавливали на головной каскад усилителя HEKA, подключенный к USB-усилителю HEKA EPC 10 (HEKA Elektronik Dr. Schulze GmbH, Ламбрехт, Германия). Электродом сравнения служил 3 м KCl, 0.1% агарозный мостик. Были установлены уплотнения более 2 гигаомов, и после обкатки была установлена конфигурация всей вакуоли. Вакуолярный просвет давали уравновеситься с раствором пипетки в течение 5–10 мин. Вакуоли перфузировали стандартным раствором ванны, который содержал либо 100 мМ лимонной кислоты, либо 100 мМ яблочной кислоты. Во всех экспериментах измеренный потенциал жидкого перехода был ниже 1 мВ, поэтому поправка не применялась. Интервал выборки составлял 1 кГц, токи фильтровались при 0.3 кГц (Patchmaster, HEKA).
Поликлональные антитела кролика к TdT
Для in vitro диагностики (IVD) для использования в США
| 0,1 мл концентрата | 338A-74 | ||
| 0,5 мл концентрата | 338A-75 | ||
| 1 мл концентрата | 338A-76 | ||
| 1 мл предварительного разбавления | 338A- | 7 мл предварительно разбавленный | 338A-78 |
Для in vitro диагностики (IVD) для использования в Канаде
| 0.1 мл концентрата | 338A-74 |
| 0,5 мл концентрата | 338A-75 |
| 1 мл концентрата | 338A-76 |
| 1 мл предварительно разбавленного | 338A-77 |
| 8 предварительное разбавление | 338A-78 |
Для in vitro диагностики (IVD) для использования в Европе
| 0.1 мл концентрата | 338A-74 |
| 0,5 мл концентрата | 338A-75 |
| 1 мл концентрата | 338A-76 |
| 1 мл предварительно разбавленного | 338A-77 |
| 8 предварительное разбавление | 338A-78 |
Только для исследовательских целей (RUO) в Японии
| 0.1 мл концентрата | 338A-74-RUO |
| 0,5 мл концентрата | 338A-75-RUO |
| 1 мл концентрата | 338A-76-RUO |
| 1 мл предварительного разбавления | 338A -RUO |
| 7 мл предварительного разбавления | 338A-78-RUO |
Чтобы запросить информацию об этом продукте в других странах, нажмите кнопку ниже.
Запросить дополнительную информацию
032864 — B6.Cg-Gt (ROSA) 26Sor / J
мышей Ai65F (инвентарный номер 032864; также называемый Ai65F (RCF-tdT), RCF-tdTomato или FSF-tdTomato) были получены в 2018 году путем разведения мышей Ai65D (инвентарный номер021875) с Cre-делетерным штаммом C57BL / 6J-конгенной зародышевой линии для удаления STOP-кассеты с флангом loxP , а затем дополнительные спаривания с инбредными мышами C57BL / 6J удалили Cre-аллель. Конкретные подробности приведены ниже.
Аллель Ai65 (RCFL-tdT) Δneo (также называемый Ai65 (RCFL-tdT) -D, Ai65Δneo или Ai65D) был создан в лаборатории доктора Хункуи Цзэна (Институт изучения мозга Аллена) для вставки следующего в локус Gt (ROSA) 26Sor на хромосоме 6 (от 5 ‘до 3’): энхансер CMV-IE / бета-актин цыпленка / гибридный промотор бета-глобина кролика (от pCAGGS), frt -фланкированный Кассета STOP (с короткой открытой рамкой считывания, за которой следуют остановки трансляции во всех трех рамках считывания, синтетическая последовательность полиА, последовательность полиА из гена гормона роста человека и последовательность полиА из гена ТК вируса простого герпеса), loxP -фланкированная STOP-кассета (со стоп-кодонами во всех трех рамках считывания, связанных с тремя повторами сигнала полиА SV40), последовательность, кодирующая флуоресцентный белок tdTomato (неолигомеризующийся вариант флуоресцентного белка DsRed с линкером из 12 остатков, сливающим две копии белка [тандемный димер]), гепатит сурка vi rus посттранскрипционный регуляторный элемент (WPRE; для повышения стабильности транскрипта мРНК), сигнал polyA бычьего гормона роста и сайт AttL .В 2013 году мышей Ai65D были отправлены в репозиторий лаборатории Джексона под номером 021875. По прибытии некоторые из них были скрещены как минимум в двух дополнительных поколениях с инбредными мышами C57BL / 6J (инвентарный номер 000664).
В 2018 году мышей Ai65D (в общей сложности подвергнутых обратному скрещиванию не менее четырех поколений на C57BL / 6J) были отобраны и скрещены с конгенными мышами Sox2-Cre C57BL / 6J (инвентарный номер 008454) для удаления зародышевой линии loxP — боковая кассета СТОП. Полученные мыши с аллелем Ai65F (Rosa :: CAG :: frt -STOP- frt :: loxP :: tdTomato :: WPRE :: bGHpA :: AttL ) были выведены как минимум в одном дополнительном поколении для Инбредные мыши C57BL / 6J (и аллель Sox2-Cre был удален; см. Примечание SNP ниже).C57BL / 6J-конгенная колония Ai65F имеет инвентарный номер 032864.
В 2021 году будет проведен панельный анализ 48 SNP (однонуклеотидный полиморфизм) с 43 маркерами, покрывающими все 19 хромосом и X-хромосому, а также 5 маркеров, которые различают между субштаммами C57BL / 6J и C57BL / 6N, было выполнено на повторно полученной живой колонии в хранилище лаборатории Джексона. Было обнаружено, что один из 5 маркеров, которые определяют C57BL / 6J от C57BL / 6N, рецессивную мутацию rd8 , связанную с дегенерацией сетчатки на хромосоме 1 в локусе Crb1 , является сегрегационным.Эти данные предполагают, что мыши, отправленные в хранилище лаборатории Джексона, имели смешанный генетический фон C57BL / 6N; C57BL / 6J.
% PDF-1.4
%
286 0 объект
>
эндобдж
xref
286 116
0000000016 00000 н.
0000003600 00000 н.
0000003836 00000 н.
0000003965 00000 н.
0000004023 00000 н.
0000004348 00000 п.
0000004563 00000 н.
0000004712 00000 н.
0000004927 00000 н.
0000005075 00000 н.
0000005290 00000 н.
0000005440 00000 н.
0000005613 00000 н.
0000005759 00000 п.
0000005932 00000 н.
0000006078 00000 н.
0000006251 00000 н.
0000006398 00000 п.
0000006571 00000 н.
0000006719 00000 н.
0000006892 00000 н.
0000007038 00000 п.
0000007178 00000 н.
0000007326 00000 н.
0000007465 00000 н.
0000007613 00000 н.
0000007778 00000 н.
0000007927 00000 н.
0000008315 00000 н.
0000008726 00000 н.
0000009258 00000 н.
0000009361 00000 п.
0000009755 00000 н.
0000009792 00000 н.
0000011766 00000 п.
0000013590 00000 п.
0000013792 00000 п.
0000014182 00000 п.
0000014488 00000 н.
0000014902 00000 п.
0000015074 00000 п.
0000015454 00000 п.
0000015632 00000 п.
0000017463 00000 п.
0000017771 00000 п.
0000018373 00000 п.
0000018703 00000 п.
0000019208 00000 п.
0000019443 00000 п.
0000019855 00000 п.
0000021791 00000 п.
0000021993 00000 п.
0000022408 00000 п.
0000022586 00000 п.
0000022766 00000 п.
0000023005 00000 п.
0000023074 00000 п.
0000023628 00000 п.
0000025496 00000 п.
0000025658 00000 п.
0000027646 00000 н.
0000029671 00000 п.
0000031127 00000 п.
0000031156 00000 п.
0000095624 00000 п.
0000099261 00000 п.
0000100914 00000 н.
0000104906 00000 н.
0000105361 00000 п.
0000107711 00000 п.
0000113803 00000 н.
0000114133 00000 п.
0000114330 00000 н.
0000117054 00000 н.
0000117354 00000 н.
0000117412 00000 н.
0000117865 00000 н.
0000118064 00000 н.
0000118471 00000 н.
0000119014 00000 н.
0000119141 00000 н.
0000142387 00000 н.
0000142426 00000 н.
0000142973 00000 н.
0000143107 00000 н.
0000165385 00000 н.
0000165424 00000 н.
0000165922 00000 н.
0000166019 00000 н.
0000166554 00000 н.
0000166675 00000 н.
0000180170 00000 н.
0000180209 00000 н.
0000186928 00000 н.
0000187509 00000 н.
0000187562 00000 н.
0000187998 00000 н.
0000198725 00000 н.
0000198797 00000 н.
0000199104 00000 н.
0000199220 00000 н.
0000199340 00000 н.
0000199483 00000 н.
0000199643 00000 н.
0000199796 00000 н.
0000199950 00000 н.
0000200234 00000 н.
0000200460 00000 н.
0000200642 00000 н.
0000200764 00000 н.
0000200904 00000 н.
0000201041 00000 н.
0000201314 00000 н.
0000201505 00000 н.
0000201952 00000 н.
0000002616 00000 н.
трейлер
] / Назад 4493228 >>
startxref
0
%% EOF
401 0 объект
> поток
h ޔ RMlEffSG! Me1 && ɮήw ^ 8
! UiKv’Ʈ ݸ% RӔG @m% *! 8zĕR7zf} {O3:) n4Fъ $ h: 7 / «
xGW} ovI2b_4’Nz) f’iA, NLj2ehVi`ph①Rp% * @ E5iJYNR! C1 * O j R 隑 T &, ZRH & X GAV5L9XMOXѰ * H ٌ «媕 㵔 6ˉy} AsR02 = 0 ټ» rJ-5lIMMRh # Q = o!; 3! LϜlrB} 789cZRΒIGR * ̘ = (н8E [) dHQɲlMƺ ‘Jm # [vicdSQHk zr = p ~ 3aI [k ק $ ZƩ_ {IqdYgP ڰ 2 YOϓ-bfGrh-NvK
Картирование разрывов цепи ДНК по всему геному
Abstract
Определение повреждения клеточной ДНК до сих пор ограничивалось глобальной оценкой целостности генома, тогда как картирование на уровне нуклеотидов ограничивалось конкретными локусами с использованием конкретных праймеров.Следовательно, могут быть изучены только ограниченные последовательности ДНК, а новые области геномной нестабильности вряд ли могут быть обнаружены. Используя хорошо охарактеризованную модель дрожжей, мы описываем простую стратегию картирования разрывов цепи ДНК по всему геному без ущерба для разрешения на уровне нуклеотидов. Этот метод, названный «иммунопреципитацией поврежденной ДНК» (dDIP), использует иммунопреципитацию и опосредованное дезоксинуклеотидилтрансферазой мечение концов dUTP-биотином (TUNEL) для захвата ДНК на участках разрыва. При использовании в сочетании с микрочипами или технологиями секвенирования следующего поколения, dDIP позволит исследователям картировать разрывы цепей ДНК по всему геному, а также другие типы повреждений ДНК и установить четкое профилирование измененных генов и / или межгенных последовательностей в различных экспериментальных данных. условия.Этот метод картирования может найти несколько применений, например, при изучении старения, скрининге генотоксических лекарств, рака, мейоза, радиации и окислительных повреждений ДНК.
Образец цитирования: Leduc F, Faucher D, Bikond Nkoma G, Grégoire M-C, Arguin M, Wellinger RJ, et al. (2011) Полногеномное картирование разрывов цепей ДНК. PLoS ONE 6 (2): e17353. https://doi.org/10.1371/journal.pone.0017353
Редактор: Мартин Маринус, Медицинская школа Массачусетского университета, Соединенные Штаты Америки
Поступила: 9 ноября 2010 г .; Одобрена: 30 января 2011 г .; Опубликован: 25 февраля 2011 г.
Авторские права: © 2011 Boissonneault et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Финансируется Канадскими институтами исследований в области здравоохранения (грант № MOP-93781) компании G.B. (http://www.cihr-irsc.gc.ca/). Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Доступные в настоящее время методы оценки повреждения ДНК включают электрофоретические методы, такие как гель-электрофорез в импульсном поле (PFGE) [1] или электрофорез отдельных клеток (анализ комет) [2] для глобальной оценки фрагментации ДНК. Опосредованная лигированием полимеразная цепная реакция (LM-PCR) также обычно используется для количественного выявления повреждений ДНК в клетках млекопитающих, поскольку она сочетает разрешение на уровне нуклеотидов с чувствительностью ПЦР [3], но ограничивается использованием праймеров, специфичных для последовательности.Все вышеупомянутые подходы страдают одним важным ограничением, поскольку они не позволяют картировать разрывы цепей ДНК в масштабе всего генома и не могут идентифицировать новые чувствительные сайты или горячие точки, содержащие такие сайты разрыва. Следовательно, воспроизводимый метод полногеномного картирования разрывов цепей ДНК был бы полезен для одновременного изучения их глобального распределения и отслеживания любых изменений в профиле повреждений в различных экспериментальных условиях. Здесь мы предоставляем подробное описание простой стратегии, называемой «иммунопреципитация поврежденной ДНК» или «dDIP».В этом методе используется иммунопреципитация модифицированных биотином нуклеотидов, добавленных терминальной дезоксинуклеотидилтрансферазой (TdT) в участки повреждения ДНК (см. , рисунок 1, ). Хотя аналогичный подход был использован недавно для картирования транслокаций опухолей, зависимых от ядерных рецепторов [4], мы впервые описываем его общегеномное применение в результате разработки и оптимизации этого метода нашей группой за последние три года. Из-за его потенциального широкого использования в исследованиях генома мы предоставляем важные экспериментальные детали и ключевые результаты для надежного захвата и обогащения поврежденных последовательностей ДНК в виде разрывов цепей.
Рисунок 1. Протокол иммунопреципитации поврежденной ДНК.
разрывов ДНК концевых меток путем включения биотин-dNTP на 3’OH концах терминальной трансферазой. Меченая ДНК далее расщепляется на фрагменты подходящего размера для иммунопреципитации. Фрагменты ДНК иммунопреципитируются антителами против биотина и магнитными шариками, покрытыми белком G. Обогащенные фрагменты ДНК могут быть идентифицированы и количественно определены с помощью кПЦР, микрочипов или секвенирования следующего поколения (NGS).
https://doi.org/10.1371/journal.pone.0017353.g001
Материалы и методы
Химические вещества
Все химические вещества были приобретены у Sigma-Aldrich (Сент-Луис, Миссури), если не указано иное.
Приготовление плазмид и маркировка концов
Чтобы продемонстрировать специфический захват и чувствительность разрывов цепи ДНК in vitro , мы использовали плазмидную модель (pcDNA3, Invitrogen, Burlington, ON, Canada) ( Рисунок 2, ).Сначала трансформированный pcDNA3 DH5α E. coli выращивали в течение ночи и плазмиду очищали с использованием набора Qiagen Plasmid Midi Kit (Qiagen Inc., Mississauga, ON, Canada). Целостность плазмиды проверяли электрофорезом в 0,8% агарозном геле (Promega corp., Мэдисон, Висконсин). Выход и чистоту определяли спектрометрическим методом (Ultrospec 2100 pro, GE Healthcare, Piscataway, NJ). Уникальный двухцепочечный разрыв был создан с использованием эндонуклеазы PciI (New England Biolabs, Ipswich, MA) путем переваривания одного мкг плазмиды с 10 ед. Фермента в конечном объеме 20 мкл в течение 1 ч при 37 ° C в рекомендованном буфере. (NEB3).Термическую инактивацию PciI получали повышением температуры реакции до 80 ° C в течение 20 мин. Этот препарат называют «переваренным» (Dig). Непереваренную плазмиду pcDNA3 использовали в качестве отрицательного контроля и обозначили как «N».
Рис. 2. Обогащение последовательностей ДНК вблизи уникального сайта рестрикции PciI, присутствующего в плазмиде pcDNA3.
( a ) Пошаговый рабочий процесс dDIP для модели плазмиды in vitro ( b ) Качественное определение обогащения с помощью мультиплексной ПЦР с использованием уменьшения числа копий плазмидной ДНК, как указано.Un, несвязанный; ИП, иммунопреципитация.
https://doi.org/10.1371/journal.pone.0017353.g002
Затем плазмидную ДНК метили концевым мечениями концевых концов dUTP-биотина, опосредованным дезоксинуклеотидилтрансферазой (TUNEL), с использованием рекомбинантной концевой трансферазы (Roche Applied Science , Laval, QC, Канада) и в соответствии со стандартным протоколом хвостохранилища от поставщика. Вкратце, 4 мкг линеаризованной (Dig) и непереваренной (N) плазмиды pcDNA3 инкубировали в реакционной смеси TUNEL, содержащей 5 мМ CoCl 2 ,0.20 мМ биотин-16-dUTP, 0,5 мМ dATP и 1600 ед. TdT (Roche Applied Science) при 37 ° C в течение 1 ч в конечном объеме 80 мкл. Отрицательный контроль получали с использованием плазмид pcDNA3, расщепленных PciI, путем исключения в реакции TdT (обозначенного как Dig-). Немодифицированный dATP был добавлен к смеси для мечения для увеличения количества модифицированных биотином нуклеотидов на 3′-OH концах ДНК. TdT предпочитает dATP в качестве субстрата и может добавлять до 5 раз больше dATP, чем другие нуклеотиды при идентичной концентрации. Следовательно, мы включили dATP в смесь для мечения, чтобы увеличить длину мечения концов и, следовательно, количество нуклеотидов, модифицированных биотином, добавляемых к концам каждого разрыва ДНК.Это резко увеличивает эффективность иммунопреципитации с более сложным геномным фоном, таким как E. coli и S. cerevisiae . Качество концевого мечения было продемонстрировано поли (А) хвостами с использованием немодифицированного dATP. Реакцию концевого мечения останавливали добавлением 8 мкл 200 мМ EDTA, pH 8. Для удаления TdT образцы осаждали, добавляя 8 мкл 5 M LiCl и 300 мкл холодного абсолютного этанола, и выдерживали при –20 ° C. на 2 часа. ДНК осаждали центрифугированием при 4 ° C при 13000 об / мин в течение 15 минут на центрифуге IEC Micromax с настольной крышкой.Затем супернатант отбрасывали и заменяли 200 мкл ледяного 70% этанола. После второго центрифугирования в течение 10 минут при 4 ° C супернатант удаляли и осадки ДНК сушили на воздухе в течение 10 минут. Осаждение ДНК было предпочтительнее фенол-хлороформной экстракции или коммерчески доступных аффинных колонок с ДНК, поскольку при экстракции фенолом / хлороформом биотинилированная ДНК разделяется на органический слой, тогда как аффинные колонки обычно непригодны для очень больших фрагментов ДНК или одноцепочечной ДНК (из-за концевых участков). маркировка), что приведет к значительным потерям во время очистки.
Фрагментация плазмидной ДНК
Для получения фрагментов подходящего размера для иммунопреципитации образцы ДНК расщепляли до фрагментов размером от 4 до 720 п.н. эндонуклеазой NlaIII в буфере NEB4 с добавлением 100 мкг / мл бычьего сывороточного альбумина (БСА) в течение 1–3 ч при 37 ° C с последующей термоинактивацией при 65 ° C в течение 20 мин. Меченые фрагменты ДНК хранили при -20 ° C до иммунопреципитации. Сначала мы иммунопреципитировали от 6 фмоль до 0,6 амоля плазмиды (что составляет примерно от 33000 до ≈10 копий pcDNA3) и, наконец, с помощью количественной оценки ПЦР в реальном времени (qPCR), 1 мкг, 0.1 мкг и 0,01 мкг (от 0,278 пмоль до 2,78 фмоль) ДНК иммунопреципитировали в двух экземплярах.
Штамм дрожжей
DFY046.
Этот штамм дрожжей DFY046 ( Mat a leu2-3,112 trp1-1 ura3-1 can1-100 ade2-1 his3-11,15 RAD5 bar1DELTA :: KMX ) происходит из фона S288c, в котором BAR1 Ген, кодирующий дрожжевую протеазу, был заменен на KMX с использованием классической методики делеции ПЦР [5]. Сайт расщепления HO 5′-AGTTTCAGCTTTCCGCAACAGTATAATTTTATAAA-3 ‘был интегрирован на 45 нуклеотидов ниже стартового кодона гена PHO5 с использованием метода сплайсинга путем перекрывающейся ПЦР (SOE-PCR) [6].Полученный в результате фрагмент ДНК, содержащий сайт расщепления HO, клонировали в сайты рестрикции XhoI-XbaI (New England Biolabs) плазмиды YIp-PHO5 (полученной от доктора Люка Годро, Université de Sherbrooke). Полученная плазмида YIp-PHO5-HO была линеаризована с помощью SalI (New England Biolabs) и интегрирована в геномный локус PHO5 штамма bar1 Δ :: HIS3 . Наконец, клетки, утратившие плазмидный остов, содержащий кассету URA3 , отбирали путем роста на среде 5-FOA.Все этапы интеграции и извлечения были подтверждены с помощью ПЦР и саузерн-блоттинга. Плазмида YcpHOcut4 [7] была трансформирована в этот штамм DFY046.
Рост и индукция эндонуклеазой HO
Дрожжевые клетки выращивали в течение ночи в среде Yc-Ura, содержащей 2% глицерина и 2% молочной кислоты, pH 6. Культуры разбавляли до 1 × 10 6 клеток / мл в 100 мл Yc-Ura + рафинозы и выращивали до тех пор, пока они не стали достигают экспоненциальной фазы (≈1 × 10 7 клеток / мл). Затем клетки блокировали в фазе G1 клеточного цикла путем добавления 0.5 мкг / мл α-фактора спаривания (Bioshop Canada inc., Берлингтон, Онтарио, Канада) и инкубировали в течение 3 часов. Культуры были разделены на аликвоты по 50 мл, и глюкоза (конечная концентрация 2%) была добавлена к контрольному неиндуцированному образцу, обозначенному как N, и галактоза (конечная концентрация 2%) к экспериментальной культуре, обозначенной как I (индуцированная). Клетки инкубировали в течение 90 мин перед экстракцией ДНК с использованием набора Qiagen genomic-tips 100 / G (Qiagen Inc.). Концентрацию геномной ДНК сначала определяли спектрометрическим методом, а затем проверяли электрофорезом при 0.6% агарозный гель.
Мечение концов дрожжевой ДНК
Чтобы продемонстрировать специфический захват разрывов цепи ДНК, индуцированных in vivo , ДНК дрожжей метили по концам с помощью TUNEL, как описано выше, с модификациями. Каждую реакцию мечения конца проводили с использованием того же соотношения ДНК / смесь для мечения и увеличивали в зависимости от эксперимента. Таким образом, 0,5 мкг геномной ДНК инкубировали в реакционной смеси TUNEL при 37 ° C в течение 40 мин в конечном объеме 20 мкл реакционного буфера TdT, 5 мМ CoCl 2 ,0.10 мМ биотин-14-дАТФ (Invitrogen), 0,25 мМ дАТФ и 200 ед. TdT. В качестве отрицательного контроля для мечения концов ДНК DFY046 ДНК инкубировали без TdT в реакционной смеси и обозначали I- или N- при использовании НО-индуцированной и неиндуцированной ДНК соответственно.
После концевого мечения образцы осаждали, как описано выше, и растворяли в буфере NEB4 с добавлением BSA для переваривания Bsp1286I (New England Biolabs). Рестрикционное расщепление проводили при 37 ° C в течение 3 часов с последующей термической инактивацией при 65 ° C в течение 20 минут.Иммунопреципитацию 0,5 мкг геномной ДНК проводили в трех повторностях, за исключением эксперимента по иммунопреципитации теломер.
Иммунокомплекс и иммунопреципитация
Для иммунопреципитации меченой ДНК в качестве иммунокомплекса использовали козьи антитела против биотина (Abcam inc., Кембридж, Массачусетс), связанные с покрытыми белком G магнитными шариками (Dynabeads Protein G, Invitrogen). Мы использовали соотношение 0,5–1 мкг меченой ДНК на 50 мкл иммунокомплекса (исходный объем гранул) и при необходимости увеличили это соотношение ДНК / иммунокомплекс.Необходимый объем шариков объединяли и трижды промывали 1 мл 0,1 М натрийцитратного буфера, pH 5. Затем шарики инкубировали в течение 3-5 часов при комнатной температуре с использованием ротатора Mini Labroller (Labnet International Inc., Эдисон, США). NJ) в цитратном буфере, содержащем 1,5 мкг козьих антител против биотина на 50 мкл исходного объема гранул. Затем шарики трижды промывали 1 мл цитратного буфера и ресуспендировали в 150 мкл цитратного буфера для каждой иммунопреципитации. Сто пятьдесят мкл комплекса иммунопреципитации (шарики + антитело) добавляли в стерильный 0.Пробирка для ПЦР 2 мл. Пробирки помещали на магнитный блок (MPC®-9600, Dynal, Осло, Норвегия) для магнитного захвата, и супернатант отбрасывали. Меченые образцы ДНК разбавляли цитратным буфером до конечного объема 50 мкл, добавляли к шарикам и медленно встряхивали. Для определения эффективности иммунопреципитации одну реакцию иммунопреципитации выдерживали при –20 ° C до количественного определения количественной ПЦР для использования в качестве эталонной ДНК перед IP (ДНК , вход ). Меченую ДНК инкубировали в течение ночи при 4 ° C с иммунокомплексом с использованием вращающегося колеса.Затем образцы помещали на магнитный блок на 2 мин и удаляли супернатант. Осадки промывали один раз 150 мкл буфера с низким содержанием соли (0,1% SDS, 1% Triton X-100, 2 мМ EDTA, 20 мМ Tris-HCl, pH 8,1, 150 мМ NaCl), затем буфером с высоким содержанием соли ( 0,1% SDS, 1% Triton X-100, 2 мМ EDTA, 20 мМ Tris-HCl, pH 8, 500 мМ NaCl) с последующей третьей стадией промывки в буфере LiCl (0,25 M LiCl, 1% NP-40, 1% дезоксихолевая кислота, 1 мМ ЭДТА, 10 мМ Трис, pH 8). Наконец, осадок дважды промывали буфером ТЕ (1 мМ EDTA, 10 мМ Tris-HCl, pH 8).Для элюирования захваченной ДНК гранулы инкубировали при 90 ° C в течение 20 минут в 150-200 мкл предварительно нагретого TE-буфера (10 мМ трис, pH 8, 1 мМ EDTA) на сухой бане (AccuBlock, Labnet International, Inc. ., Woodbridge, NJ) при частом перемешивании. После инкубации образцы быстро помещали на магнитный блок, а супернатант переносили в стерильный 1,5 мл Эппендорф (обозначаемый как ДНК IP ) и хранили при -20 ° C до анализа.
Иммунопреципитация теломер дрожжей
Чтобы соответствовать уровням обнаружения, наблюдаемым при саузерн-блоттинге, мы иммунопреципитировали 5 мкг неиндуцированной дрожжевой ДНК, предварительно расщепленной с соотношением 10 ед. На мкг ДНК с помощью XhoI и PstI (New England Biolabs).Эти эндонуклеазы имеют участки разреза в консервативном элементе проксимального Y ‘повтора теломер, высвобождая концевой рестрикционный фрагмент (TRF) ≈1,2 т.п.н. и ≈1,0 т.п.н., соответственно, который включает концевые повторы TG1-3 в 0,35 т.п.н. [8]. DDIP выполняли, как описано выше, со следующими модификациями. Реакции мечения концов были увеличены, и 1,5 мл пробирки Эппендорфа были использованы для размещения больших объемов. Затем использовался блок захвата DynaMag TM 2 (Invitrogen) для выделения магнитных шариков.Конечную элюцию проводили в 200 мкл буфера ТЕ, чтобы сконцентрировать иммунопреципитированную ДНК.
Иммунопреципитация меченой плазмидной ДНК в геномном контексте
E. coli в агарозных пробкахМы адаптировали протокол быстрого бактериального гель-электрофореза в импульсном поле (PFGE) [9] для иммобилизации DH5α E. coli и выделения содержимого ДНК с минимальным повреждением ДНК из-за обращения. Пятьдесят мкл культивированных в течение ночи клеток DH5 альфа E. coli , трансформированных плазмидой pcDNA3, залили в 1% агарозу с низкой температурой плавления в буфере ТЕ путем смешивания равного объема бактериальной культуры и 2% агарозы с низкой температурой плавления в ТЕ (поддерживаемое при 37 ° С). ° C после плавления) и переносили в отливку на 100 мкл.После затвердевания при комнатной температуре или 4 ° C в течение 10-15 мин пробки вынимали из формы и переносили в 10 мл лизирующего буфера (50 мМ Трис, 50 мМ ЭДТА, 1% N-лаурилсаркозин, 0,1 мг / мл. протеиназа К, pH 8) в конической колбе Nalgene на 125 мл и инкубировали в течение 2 ч на водяной бане со встряхиванием (230 об / мин при 54 ° C). Заглушки промывали трижды при 54 ° C в течение 10 минут 5–10 мл воды на водяной бане со встряхиванием, и на этот раз повторили те же этапы промывки с использованием буфера ТЕ. Три пробки переносили в 2-мл пробирки Эппендорфа и предварительно инкубировали в 300 мкл NEB3 (соотношение 100 мкл на пробку, New England Biolabs) с добавлением 10 мкг / мл РНКазы A в течение 30 мин при 37 ° C на водяной бане. .Буфер реакции удаляли, заменяли свежим буфером, содержащим 30 ед. PciI на пробку, и пробирки инкубировали в течение 4 ч при 37 ° C на водяной бане. Расщепление плазмиды подтверждали электрофорезом в агарозном геле (данные не показаны).
Пробки промывали три раза 1 мл ТЕ и предварительно инкубировали в 300 мкл (100 мкл на пробку) смеси TUNEL (1X реакционный буфер TdT, 5 мМ CoCl 2 ) в течение 30 мин при комнатной температуре. Затем смесь TUNEL удаляли и заменяли свежей смесью, содержащей 2400 Ед TdT (800 Ед на пробку) и 6 нмоль биотин-16-dUTP (2 нмоль на пробку), и пробирки Эппендорфа инкубировали в течение ночи при 4 ° C на вращающееся колесо.Пробирки помещали в водяную баню на 3 ч при 37 ° C. Затем пробки трижды промывали 1 мл ТЕ и расщепляли 1,5 ед. Β-агаразы I согласно производителю (New England Biolabs). ДНК осаждали в 100% этаноле в течение ночи при –20 ° C с добавлением 1 мкл гликогена (Roche Applied Sciences) в качестве носителя, центрифугировали при 13 k об / мин при 4 ° C в течение 20 мин, промывали 70% этанолом, воздух сушили в течение 15 мин и ресуспендировали в 30 мкл буфера NEB4 с добавлением 100 мкг / мл BSA и 30 ед. Nla III.ДНК расщепляли в течение 1 часа при 37 ° C, а термическую инактивацию оставляли на 20 минут при 65 ° C. Затем выполняли dDIP, как описано выше. С помощью мультиплексной ПЦР тестировали три объема иммунопреципитированной ДНК: 1 мкл, 5 мкл и 10 мкл (из 30 мкл). Наилучшие результаты были получены с 5 мкл.
Качественная оценка эффективности иммунопреципитации методом мультиплексной ПЦР
Специфический захват TUNEL-меченного фрагмента (α и β) оценивали с помощью мультиплексной ПЦР-амплификации (Qiagen Multiplex PCR Kit, Qiagen Inc.) с использованием термоциклера Tgradient (Biometra, Goettingen, Germany) с последующим обнаружением с помощью электрофореза в агарозе и окрашивания бромидом этидия ( см. Рисунок 2b ). В качестве отрицательного контроля, то есть фрагмента плазмиды, который не был помечен TUNEL, мы использовали внутренний фрагмент, обозначенный ε (575 п.н., положения с 1243 по 1817), чтобы проверить специфический захват этих меченых фрагментов. Мы следовали универсальному протоколу мультиплексного цикла, предложенному производителем: начальная активация при 95 ° C в течение 15 мин, 30 циклов денатурации при 94 ° C в течение 30 с, отжиг при 60 ° C в течение 90 с и удлинение при 72 ° C в течение 60 секунд. с, с последующим окончательным удлинением при 72 ° C в течение 10 мин.Меченую ДНК (перед иммунопреципитацией) использовали в качестве матрицы для положительного контроля ПЦР, а отрицательный контроль ПЦР получали путем пропуска ДНК. Для экспериментов с использованием примерно 300 и 10 копий плазмиды pcDNA3 в качестве исходного материала продукты ПЦР концентрировали пять раз (от 50 мкл до 9–10 мкл) с помощью набора для очистки MinElute PCR Purification Kit (Qiagen Inc.) перед электрофорезом на агарозе. Гель агарозы окрашивали SYBR Gold (Invitrogen) после электрофореза для повышения чувствительности.
Количественное определение иммунопреципитированной ДНК с помощью ПЦР в реальном времени
Количественное определение иммунопреципитированной ДНК проводили с помощью кПЦР с использованием либо Rotor-Gene RG-3000A, либо Rotor-Gene RG-3000 (Corbett Research, Concorde, NSW, Australia) и набора FastStart SYBR Green Master (Roche Applied Sciences).Последовательность праймеров, ожидаемый размер ампликонов и температуры отжига суммированы в таблице S1 . Для каждого ампликона количественно определяли 2 мкл образца ДНК в четырех повторностях в общей сложности 10 мкл смеси для ПЦР, содержащей 0,3 мкМ праймеров, в течение от 30 до 45 циклов по 15 с при 94 ° C, 30 с при 55 ° C до 60 °. C и 30 с при 72 ° C. Выход иммунопреципитации выражали относительно входящей ДНК согласно% IP = (ДНК IP / ДНК вход ) x 100, где% IP — процент иммунопреципитации, ДНК IP — количество копий после иммунопреципитации, измеренное с помощью qPCR. и ввод ДНК — это общее количество копий до иммунопреципитации, измеренное с помощью qPCR.
Саузерн-блоты
Саузерн-блоттинг выполняли, как описано ранее [10]. Вкратце, 5 мкг ДНК переваривали BamHI и PvuII (локус MAT), PstI (локус PHO5) или BglII (плазмида YcpHOCut4), разделяли на 0,6% агарозном геле и ДНК переносили на мембрану в щелочных условиях. Ник-транслируемые ДНК-зонды получали стандартными процедурами с использованием следующих праймеров и инкубировали с мембранами: для локуса MAT, 5′-ATTCTTAGCATCATTCTTTGTTC-3 ‘и 5′-TCCAATCTGTGCACAATGAAG-3’, для локуса PHO5-HO, 5 ‘ -TCCGTGATGACGATGATTTG-3 ‘и 5′-GTCAGTACCGGCTACTCTCT-3′ и для плазмиды YcpHOcut4 5’-ATGTTGAAGGAACAGCTGGG-3 ‘и 5′-GACCAATTAGACAATGGGAC-3’.Степень расщепления ДНК определяли денситометрией и выражали как отношение разрезанной ДНК к разрезанной ДНК + неразрезанной ДНК x 100.
Для анализа длины теломер 5 мкг геномной ДНК переваривали рестрикционными ферментами XhoI или PstI, затем ДНК анализировали саузерн-блоттингом, как описано ранее [8], с использованием зонда, покрывающего часть теломерного Y ‘-фрагмента (5 ‘-GGCCATTACTAGAAGAA-3’ и 5’GGTACCCTCGTGTTATCTGCAGCG-3 ‘). Для оценки эффективности иммунопреципитации теломер методом dDIP: 1.На гель наносили 5 мкг, 2 мкг и 2,5 мкг расщепленной ДНК перед иммунопреципитацией, что составляет 30%, 40% и 50% введенной ДНК соответственно.
Программное обеспечение
Использовались следующие программы: Enzyme X (версия 3, Mek & Tosj), AmplifX (версия 1.4.4, Nicolas Julien), Doc-ItLS Image Analysis Software (UVP, Upland, CA) и Roto-gene 6 (версия 6.1. , Corbett Research).
Результаты
Обогащение последовательностей ДНК вблизи уникального сайта рестрикции PciI на плазмиде pcDNA3
Чтобы продемонстрировать специфичность и чувствительность захвата разрывов цепи ДНК, мы сначала использовали плазмиду в качестве модели, представляющей простую определенную горячую точку ( Рисунок 2 и 3 ).Чтобы моделировать DSB, pcDNA3 расщепляли в уникальном сайте рестрикции эндонуклеазой PciI. Концы ДНК метили путем включения модифицированных биотином нуклеотидов (dUTP или dATP) на 3’OH концах с помощью TdT. Меченую ДНК дополнительно расщепляли на фрагменты размером от 4 до 720 п.н. эндонуклеазой NlaIII, которая будет генерировать зонды подходящего размера при применении к геномному контексту. Сначала мы проверили наличие специфических фрагментов α и β, фланкирующих сайт рестрикции PciI, а также фрагмента ε, в качестве внутреннего отрицательного контроля, с использованием мультиплексной ПЦР-амплификации, как показано на рис. 2 .Результаты показывают специфический захват фрагментов α и β, тогда как фрагмент ε не присутствует во фракции IP и остается в несвязанной фракции. Специфический захват был успешно достигнут всего с 10 копиями pcDNA3, демонстрируя чувствительность метода захвата.
Фигура 3. Количественная оценка с помощью кПЦР иммунопреципитированных последовательностей ДНК, фланкирующих сайт рестрикции PciI плазмиды pcDNA3.
Столбцы представляют собой среднее значение двух независимых IP, а планки ошибок соответствуют стандартному отклонению для измерений количественной ПЦР в трех повторностях.Dig +, расщепленная PciI pcDNA3, конец которой мечен dATP, биотин-dATP и TdT; Dig-, PciI-расщепленная pcDNA3, инкубированная с dATP и биотин-dATP без TdT; N +, интактная pcDNA3, конец которой мечен dATP, биотин-dATP и TdT.
https://doi.org/10.1371/journal.pone.0017353.g003
Чтобы установить эффективность иммунопреципитации, уменьшающееся количество плазмидной ДНК (1 мкг, 0,1 мкг и 0,01 мкг на IP) подвергали иммунопреципитации, элюировали и количественно определяется методом количественной ПЦР. Были измерены четыре ампликона (, рис. 3, ): два из них, ампликоны B и C, нацелены на последовательности ДНК, фланкирующие сайт рестрикции PciI, в то время как два других ампликона, A и D, соответствуют последовательностям ДНК в непосредственной близости от PciI. сайт рестрикции, но разделены одним или тремя сайтами рестрикции NlaIII и поэтому служат в качестве контроля специфичности.Ампликоны B и C были специфически обогащены при каждой концентрации тестируемой плазмиды, хотя и с различным выходом в диапазоне от 42% до 30% от общей ДНК для ампликона B и от 54,4% до 20,4% для ампликона C. Очень мало последовательностей ДНК, соответствующих ампликонам A и D были иммунопреципитированы в условиях Dig +: от 0,6 до 0,8% для ампликона A и от 1% до 1,7% для ампликона D. Это можно частично объяснить неполным перевариванием NlaIII. Предполагая, что большая часть плазмид pcDNA3 была переварена PciI, что представляет собой двухцепочечный разрыв почти в 100% плазмид, мы получили эффективность захвата между 20.4% и 54,4% по сравнению с 0–0,2% для двух отрицательных контролей, представляющих неспецифический захват ДНК иммунокомплексом (Dig-) и фоновые разрывы ДНК в результате очистки и манипуляций ДНК (N +).
В качестве первого применения метода dDIP в геномном контексте мы применили ту же стратегию на фоне прокариотического генома. Ночная культура E. coli DH5α, трансформированная pcDNA3, была помещена в 1% низкоплавкую агарозу для минимизации фрагментации ДНК из-за манипуляций до мечения концов ДНК.После лизиса и расщепления белка ДНК расщепляли в агарозных пробках с использованием PciI и метили с помощью TUNEL. После переваривания пробок β-агаразой общая ДНК (геномная и плазмидная) осаждалась и дополнительно переваривалась NlaIII. Наличие специфических фрагментов плазмиды оценивали с помощью мультиплексной ПЦР-амплификации (см. , фиг. 4, ). Что касается эксперимента, описанного выше с очищенной плазмидой, снова был продемонстрирован специфический захват фрагментов α и β с ограниченным фоном из фрагмента ε.
Фигура 4. Мультиплексный ПЦР-анализ захваченных последовательностей ДНК в непосредственной близости от уникального сайта рестрикции PciI на плазмиде pcDNA3, трансформированной в DH5α E.coli и заключенной в пробки из 1% агарозы.
https://doi.org/10.1371/journal.pone.0017353.g004
Специфическое обогащение трех известных сайтов HO в геноме
S. cerevisiaeМы стремились определить, может ли быть достигнут специфический захват разрывов цепи ДНК с помощью dDIP в контексте всего эукариотического генома.Поэтому мы использовали дрожжи S. cerevisiae в качестве модели разрывов геномной ДНК in vivo (см. Обзор [11]). Специфический захват последовательностей ДНК вблизи участков НО-специфического расщепления был продемонстрирован с использованием штамма DFY046 в трех различных геномных контекстах: во-первых, с использованием встроенного участка НО длиной 60 п.н. в гене PHO5 дрожжей; во-вторых, используя естественный сайт HO в локусе типа спаривания (MAT) и, наконец, используя сайт HO длиной 123 п.н. в трансформированной плазмиде, несущей ген эндонуклеазы HO, индуцируемой галактозой [7].Специфическое обогащение последовательностей ДНК вокруг двухцепочечных разрывов оценивали с помощью кПЦР. Ампликоны, фланкирующие места разрыва, обозначены буквами от A до P (см. , таблица S1, и , рисунок 5, ). После индукции экспрессии эндонуклеазы HO путем добавления галактозы в среду создается DSB, обеспечивающая идеальную экспериментальную модель, на основе которой может быть установлена способность метода dDIP специфически захватывать горячие точки генома. Поэтому ожидается захват меченого рестрикционного фрагмента, несущего сайт HO, но не соседних фрагментов, не содержащих такой сайт.Обогащение фрагментов, несущих HO-индуцированный DSB, можно затем сравнить с этими соседними сайтами, свободными от HO. Отрицательные контроли включают неспецифическое связывание с иммунокомплексом в индуцированном, но не меченном концом состоянии (I-), а также фоновое повреждение ДНК из-за экстракции и разрывы ДНК, не связанные с эндонуклеазой HO (N +). Наконец, обогащение иммунопреципитированных последовательностей ДНК, содержащих три сайта HO, может быть выражено относительно эффективности разрезания общей активности HO, как определено с помощью саузерн-блоттинга.
Фигура 5. Обогащение последовательностей ДНК вблизи трех индуцированных DSB, расщепленных индуцированной эндонуклеазой HO в дрожжах S. cerevisiae .
( a ) Саузерн-блот-анализ эффективности расщепления сайта HO в рекомбинантном локусе PHO5-HO (b ) Иммунопреципитация последовательностей ДНК, фланкирующих сайт разреза HO в PHO5-HO, расщепленных Bsp1286I и количественно оцененных с помощью qPCR. ( c ) Саузерн-блот-анализ эффективности расщепления сайта HO в локусе типа спаривания.( d ) Иммунопреципитация последовательностей ДНК, фланкирующих сайт разреза НО локуса типа спаривания, расщепленных Bsp1286I и количественно оцененных с помощью qPCR. ( e ) Саузерн-блот-анализ эффективности расщепления сайта HO в локусе YcpHOcut4 ( f ) Иммунопреципитация последовательностей ДНК, фланкирующих сайт разреза HO плазмиды YcpHOcut4, расщепленных Bsp1286I и количественно оцененных с помощью qPCR. Планки погрешностей представляют собой стандартное отклонение для 3 независимых IP. I +, ДНК из НО-индуцированных клеток, меченных по концам dATP, биотин-dATP и TdT; I-, ДНК из НО-индуцированных клеток, меченных по концам dATP, биотин-dATP без TdT; N +, ДНК из неиндуцированных клеток, меченных по концам dATP, биотин-dATP и TdT.
https://doi.org/10.1371/journal.pone.0017353.g005
После индукции галактозы и синтеза эндонуклеазы HO все три сайта расщепления HO были эффективно захвачены методом dDIP, что резко контрастирует с фактическим отсутствием иммунопреципитированных последовательностей ДНК. представлены ампликонами, лежащими вне сайтов расщепления HO ( Рисунок 5b, d, f ). Последние представляют собой последовательности, которые были отделены от начального сайта разрыва, меченного TdT, путем последующего рестрикционного расщепления с использованием частого режущего фермента Bsp1286I.Точно так же фоновое повреждение ДНК, обнаруженное иммунопреципитатами N +, остается практически невыявленным для трех тестируемых локусов.
В локусе PHO5-HO две последовательности ДНК, непосредственно фланкирующие сайт индуцированного расщепления HO и представленные ампликонами от F до I, были захвачены со средней эффективностью 10,3% по отношению к общей ДНК (до иммунопреципитации), что представляет собой 10-кратное обогащение по сравнению с ампликоны E и J, не содержащие сайт HO (, фиг. 5b, ). Аналогичные наблюдения были сделаны для локуса MAT, где ампликоны, несущие сайты HO (L, M), были обогащены в той же степени по сравнению с немеченым фрагментом, представленным ампликоном K ( Рисунок 5d ).Наконец, мы наблюдали соответствующее обогащение последовательностей ДНК, фланкирующих внехромосомный сайт расщепления НО плазмиды YcpHOcut4 ( Рисунок 5f, ). В этом случае ампликон O, соответствующий фрагменту, примыкающему к разрыву, при индукции был обогащен примерно в 32 раза по сравнению с фрагментом N и P. На отсутствие неспецифического связывания ДНК с иммунокомплексом указывает почти полное отсутствие обнаруживали ампликоны во всех индуцированных, но не меченных концом иммунопреципитатах на протяжении всего эксперимента.
Учитывая ограниченную степень расщепления HO, продемонстрированную саузерн-блотами, как видно на рис. 5 , 42% доступных концов ДНК в сайтах разрыва были иммунопреципитированы в локусе PHO5-HO, тогда как 52% и 43% были иммунопреципитированы в MAT. локус и локус YcHOcut4 соответственно.
Обогащение теломер дрожжей
Теломеры представляют собой естественные двухцепочечные разрывы ДНК и поэтому должны быть захвачены методом dDIP. Присутствие теломер в иммунопреципитатах меченой неиндуцированной ДНК DFY046 определяли с использованием двух эндонуклеаз, которые, как известно, разрезают один раз в консервативных элементах проксимального Y ‘повтора теломер.Как показано на фиг. , фиг. 6, и , фиг. S1, , мы получили аналогичную эффективность иммунопреципитации, как показано для сайтов HO, представляющих от 40 до 50% доступных концов теломер. Иммунопреципитированные теломерные последовательности выглядят как мазок из-за мечения конца TdT и сдвига геля, вызванного добавлением гаптена биотина. Не было обнаружено теломер ДНК на N-дорожке, измеряющей неспецифическое связывание с иммунокомплексом.
Фигура 6. Обогащение теломерной ДНК дрожжей с помощью dDIP, оцененное с помощью саузерн-блоттинга.
Выделенную дрожжевую ДНК сначала расщепляли XhoI или PstI, двумя ферментами, однократно разрезающими консервативный элемент повторения Y ‘проксимального теломер, давая концевой рестрикционный фрагмент ≈1,2 т.п.н. и ≈1,0 т.п.н. соответственно. Зонд, покрывающий часть теломерного Y ‘-фрагмента, включая концевые повторы TG1-3 0,35 т.п.н., использовали для выявления захвата теломерной ДНК. Для оценки эффективности иммунопреципитации теломер методом dDIP на гель наносили 30%, 40% и 50% введенной ДНК перед иммунопреципитацией.N +, ДНК из неиндуцированных клеток, меченных по концам dATP, биотин-dATP и TdT. N-, ДНК из неиндуцированных клеток, меченных по концам dATP, биотин-dATP без TdT.
https://doi.org/10.1371/journal.pone.0017353.g006
Обсуждение
Мы предоставили технические детали для специфического и чувствительного захвата последовательностей ДНК при разрывах цепи и показали его применение в геномном контексте in vivo . Мы одновременно обогатили последовательности ДНК, фланкирующие три различных индуцированных DSB в дрожжах S.cerevisiae как модель множественных горячих точек генома. Кроме того, мы продемонстрировали, что dDIP можно использовать для обогащения теломер с высокой эффективностью.
В сочетании с технологиями микрочипов или подходами к высокопроизводительному секвенированию следующего поколения, dDIP можно использовать для картирования распределения разрывов цепей ДНК в масштабе всего генома без предварительного знания чувствительных локусов. В одном эксперименте картирование разрывов ДНК по всему геному может быть достигнуто с разрешением на уровне нуклеотидов в сочетании с методами секвенирования следующего поколения.В самом деле, благодаря хвостовой активности TdT, можно достичь разрешения нуклеотидов с помощью специфичных для праймеров методов, таких как LM-PCR, и таким образом установить точное положение сайтов разрыва сразу для всех меченых последовательностей. В сочетании с ПЦР в реальном времени можно точно определить обогащение известных конкретных локусов, как показано в этой работе.
Другие родственные методы иммунопреципитации ДНК, такие как иммунопреципитация хроматина (ChIP), обычно демонстрируют низкую эффективность захвата, часто вплоть до 1% входящего потока комплексов белок / ДНК и редко выше 20%.Как показано в настоящей статье, эффективность иммунопреципитации около 40-50% доступных концов ДНК была достигнута с помощью метода dDIP, который предполагает лучшую эффективность, наиболее подходящую для улавливания редких событий повреждения. Ожидается, что dDIP будет намного более точным, чем ChIP, с использованием антител против белков репарации ДНК или посттрансляционных модификаций гистонов, поскольку они часто маскируются в месте повреждения ДНК (из-за образования комплекса) или обнаруживаются связанными с сайтами разрыва в течение коротких периодов времени. .Кроме того, эти факторы могут охватывать большие расстояния от участков разрыва. Одним из таких примеров является биомаркер DSB γh3AFX, активная форма гистонового варианта h3AFX (семейство гистонов h3A, член X), который, как известно, распространяется на расстояние до одной мегабазы от места разрыва в клетках млекопитающих [12]. Таким образом, dDIP позволяет точно отображать DSB с гораздо большим разрешением.
Мы также показали, что ДНК, экстрагированная коммерчески доступными наборами, хотя и не оптимальна из-за неспецифического повреждения ДНК из-за процесса экстракции, подходит для чувствительного обогащения повреждений ДНК, поскольку 5 × 10 7 гаплоидных копий дрожжей генома достаточно.В идеале разрывы ДНК должны быть помечены перед экстракцией геномной ДНК, чтобы снизить фоновые уровни повреждений ДНК, вызванных манипуляциями. Когда это не может быть достигнуто, как в случае геномной ДНК дрожжей S. cerevisiae , описанной в этой работе, следует использовать наборы, которые очищают большие фрагменты ДНК (50–100 т.п.н.). Следовательно, повреждение ДНК из любого источника может быть картировано при условии, что целостность ДНК сохраняется во время экстракции.
Длина последовательностей ДНК может быть адаптирована для соответствия экспериментальным целям, поскольку в этой работе были успешно протестированы более крупные фрагменты ДНК (до 9400 п.н.) (данные не показаны).Как показано в этой статье, уменьшение размера фрагментов может быть достигнуто ферментативно, путем частого разрезания рестрикционного фермента, а также физически, путем обработки ультразвуком или распыления (см. Текст S1 и Рисунок S2 для примера обработки ультразвуком PHO5- НО локус) . В этой работе предпочтение было отдано ферментативной фрагментации геномной ДНК, поскольку она обеспечивала определенные границы, за пределами которых можно было установить специфичность при фактическом отсутствии захвата.
Недавно, одновременно с нашими усилиями по дальнейшему усовершенствованию этого метода перед публикацией, были предложены новые подходы для картирования полногеномных областей, гиперчувствительных к ДНКseI, и разрывов ДНК.Один из таких методов, известный как ДНКаза-ChIP, был использован для картирования открытых участков хроматина с использованием непрямого подхода, при котором несвязанная ДНК расщеплялась ДНКазой и лигировалась с биотинилированным линкером [13], [14], [15]. Другой подход, очень похожий на тот, что описан в настоящем отчете, был использован для картирования зависимых от ядерного рецептора транслокаций опухоли с помощью рецептора андрогена, хотя важные технические соображения, изложенные в настоящей статье для повышения эффективности, не были представлены [4]. Например, мы продемонстрировали высокую эффективность метода dDIP, в основном обеспечиваемую мощным, но универсальным мечение концов ДНК TdT на концах и улучшенным хвостовиком этих разрывов путем добавления немодифицированного dATP в смесь для мечения для увеличения количества биотиновых остатков. модифицированных нуклеотидов и для обеспечения оптимального расстояния между гаптенами [16], что приводит к повышению эффективности захвата антителом против биотина.Мы уверены, что эти улучшения по сравнению с ранее описанными подходами могут увеличить шансы на обнаружение редких событий и более надежную идентификацию участков разрыва ДНК.
Конечная трансфераза может эффективно добавлять модифицированные нуклеотиды к любому свободному 3’OH-концу ДНК, например к 3′-выступу, тупому или 5′-выступающему концам двухцепочечного разрыва, с предпочтением 3′-выступающих концов, но также и одноцепочечных концов. разрывы цепей и одноцепочечная ДНК (оцДНК). В этой статье мы сознательно выбрали субоптимальный субстрат для плазмидной модели in vitro , поскольку эндонуклеаза PciI генерирует четырехнуклеотидный 5′-выступ без изменения эффективности мечения концов или иммунопреципитации.У TdT может быть больше трудностей с добавлением первых нуклеотидов к одноцепочечному разрыву, 5′-выступу или тупому концу, чем к 3′-выступающему концу, но это может не составлять сильного смещения, учитывая длинные хвосты, которые мы генерируем с использованием смеси dATP. и модифицированный биотином дАТФ. Мы также достигли аналогичного выхода захвата вблизи однонитевого разрыва по сравнению с двухцепочечным разрывом, как продемонстрировано с помощью плазмидной модели (см. , текст S1 , , рисунок S3, и , таблица, S2, ).Кроме того, мы получили аналогичные результаты с самонаводящейся эндонуклеазой HO, которая создает двухнуклеотидные 3′-выступающие концы, предпочтительный субстрат для TdT. Таким образом, мы экспериментально продемонстрировали, что последовательности ДНК с одноцепочечными разрывами или любым типом двухцепочечных разрывов могут быть обогащены dDIP.
Метод dDIP может применяться в различных исследованиях, направленных на оценку целостности генома как при нормальных, так и при патологических процессах. Разрывы цепи ДНК необходимы для нормальных процессов, таких как мейотическая рекомбинация [17], развитие лимфоцитов [18], дифференцировка клеток [19], транскрипция [20], и были связаны с ремоделированием хроматина сперматид, как продемонстрировала наша группа [21].Они также возникают в ответ на экзогенный стресс, такой как окисление, радиация, лекарства и загрязнители окружающей среды, или в дегенеративных процессах. Иммунопреципитация поврежденной ДНК также может быть очень универсальным методом, поскольку она может картировать несколько типов повреждений ДНК из-за небольшого количества ДНК (менее 1 мкг) в различных геномных и экспериментальных контекстах, при условии, что эти поражения могут быть преобразованы в цепь ДНК. перерывы. Наши клетки обладают несколькими ферментами, которые могут преобразовывать или удалять все виды повреждений ДНК, чтобы обеспечить целостность генома.Неизбежно, что эти механизмы должны проходить через стадии, которые создают 3’OH-конец, так как это важно для активности полимераз и лигаз, участвующих в репарации ДНК. Следовательно, помимо одно- и двухцепочечных разрывов, dDIP может обогащать другие типы повреждений ДНК, которые запускают репарацию in vivo . Кроме того, эти повреждения ДНК могут быть преобразованы in vitro в 3’OH-концы с помощью коммерчески доступных ферментов. Например, димеры циклобутан-пиримидина, вызванные УФ-облучением, могут быть превращены эндонуклеазой V Т4 в разрыв цепи с атипическим нуклеотидом (3′-фосфо-конец) [22], который может быть удален экзонуклеазной активностью ДНК-полимеразы, позволяя захватывать ее. пользователя dDIP.
Таким образом, важные экспериментальные детали, представленные в этой статье, направлены на обеспечение воспроизводимого метода захвата разрывов цепи ДНК. Это простой, быстрый и экономичный подход, применимый к масштабу всего генома. Этот новый метод должен оказаться очень полезным для изучения нескольких типов клеточных процессов, где профилирование повреждений будет наиболее необходимо.
Дополнительная информация
Рисунок S1.
Агарозный гель с обогащенной теломерной ДНК, окрашенный бромидом этидия, перед саузерн-блот-анализом.Экстрагированную дрожжевую ДНК сначала расщепляли XhoI или PstI, двумя ферментами, однократно разрезающими консервативный элемент проксимального повтора Y ‘теломер, давая, соответственно, концевой рестрикционный фрагмент ≈1,2 т.п.н. и ≈1,0 т.п.н. Чтобы дать представление об эффективности теломерной иммунопреципитации с помощью метода dDIP, на гель наносили 1,5 мкг, 2 мкг и 2,5 мкг расщепленной ДНК перед иммунопреципитацией, что составляет 30%, 40% и 50% соответственно от исходной ДНК.
https://doi.org/10.1371/journal.pone.0017353.s001
(TIF)
Рисунок S2.
Сравнение ферментативной фрагментации геномной ДНК дрожжей и обработки ультразвуком, измеренное по обогащению последовательностей ДНК вокруг сайта PHO5-HO. I +, ДНК из НО-индуцированных клеток, меченных по концам dATP, биотин-dATP и TdT; I-, ДНК из клеток, индуцированных НО, и немеченая из-за отсутствия TdT.
https://doi.org/10.1371/journal.pone.0017353.s002
(TIF)
Рисунок S3.
Обогащение последовательностей ДНК вблизи одноцепочечных разрывов плазмиды pcDNA3.( a ) Агарозный гель, окрашенный бромидом этидия, различных этапов рабочего процесса для обогащения разорванных последовательностей ДНК с использованием модели плазмиды in vitro pcDNA3. Дорожки 1–3; ДНК плазмиды pcDNA3 после лигазной реакции до мечения конца. Дорожки 4–6; Расщепленная NciI и меченная концом плазмидная ДНК pcDNA3 перед иммунопреципитацией. Красные стрелки указывают на два фрагмента, несущие один или два однонитевых разрыва. Лестница ДНК; GeneRuler ™ 1 kb Plus ДНК-лестница (Fermentas). ( b ) Количественная оценка с помощью кПЦР иммунопреципитированных последовательностей ДНК, фланкирующих Nt.Сайты рестрикции BspQI в pcDNA3. Столбцы представляют собой среднее значение двух независимых IP, а столбцы ошибок соответствуют стандартному отклонению для измерений количественной ПЦР в четырех повторностях. Плазмида Nt-, pcDNA3, не расщепленная Nt.BspQI; Плазмида Nt +, pcDNA3, расщепленная Nt.BspQI; Nt + lig, плазмида pcDNA3, расщепленная Nt.BspQI и лигированная.
https://doi.org/10.1371/journal.pone.0017353.s003
(TIF)
Таблица S2.
Обогащение последовательностей ДНК вблизи одноцепочечных разрывов плазмиды pcDNA3.Процент обогащения на основе двух независимых иммунопреципитации (среднее ± стандартное отклонение%). Плазмида Nt-, pcDNA3, не расщепленная Nt.BspQI; Плазмида Nt +, pcDNA3, расщепленная Nt.BspQI; Nt + lig, плазмида pcDNA3, расщепленная Nt.BspQI, но с последующей реакцией ДНК-лигазы Т4.
https://doi.org/10.1371/journal.pone.0017353.s005
(DOC)
Вклад авторов
Задумал и спроектировал эксперименты: FL DF RJW GB. Проведены эксперименты: ФЛ ДФ ГБН М-ЦГ МА.Проанализированы данные: ФЛ ГБ. Предоставленные реагенты / материалы / инструменты анализа: RJW GB. Написал рукопись: FL DF GB.
Ссылки
- 1. Градзка И., Иваненко Т. (2005) Нерадиоактивный анализ на основе PFGE для низких уровней двухцепочечных разрывов ДНК в клетках млекопитающих. Ремонт ДНК (Amst) 4: 1129–1139.
- 2. Коллинз А. (2004) Кометный анализ повреждений и репарации ДНК: принципы, применения и ограничения. Мол Биотехнология 26: 249–261.
- 3.Pfeifer G, Denissenko M, Tang M (1998) Подходы к анализу аддуктов на основе ПЦР. Toxicol Lett 102-103: 447–451.
- 4. Лин С, Ян Л., Танаса Б., Хатт К., Джу Би-Джи и др. (2009) Хромосомная близость, вызванная ядерным рецептором, и разрывы ДНК лежат в основе специфических транслокаций при раке. Cell 139: 1069–1083.
- 5. Brachmann CB, Davies A, Cost GJ, Caputo E, Li J, et al. (1998) Дизайнерские штаммы с делециями, полученные из Saccharomyces cerevisiae S288C: полезный набор штаммов и плазмид для опосредованного ПЦР разрушения генов и других применений.Дрожжи 14: 115–132.
- 6. Heckman KL, Pease LR (2007) Сплайсинг генов и мутагенез с помощью ПЦР-управляемого удлинения перекрытия. Nat Protoc 2: 924–932.
- 7. Raghuraman MK, Brewer BJ, Fangman WL (1994) Активация начала репликации дрожжей около двухцепочечного разрыва ДНК. Genes Dev 8: 554–562.
- 8. Wellinger RJ, Wolf AJ, Zakian VA (1993) Активация происхождения и образование однонитевых хвостов TG1-3 происходят последовательно в поздней S-фазе на линейной плазмиде дрожжей.Mol Cell Biol 13: 4057-4065.
- 9. Gautom RK (1997) Протокол быстрого гель-электрофореза в импульсном поле для типирования Escherichia coli O157: H7 и других грамотрицательных организмов за 1 день. J Clin Microbiol 35: 2977–2980.
- 10. Maniatis T, Sambrook J, Fritsch EF (1982) Молекулярное клонирование: лабораторное руководство. Нью-Йорк: Колд-Спринг-Харбор, штат Нью-Йорк: Лаборатория Колд-Спринг-Харбор. 545 с.
- 11. Haber JE (1998) Переключение генов типа спаривания у Saccharomyces cerevisiae.Анну Преподобный Женет 32: 561–599.
- 12. Lowndes N, Toh G (2005) Восстановление ДНК: важность фосфорилирования гистона h3AX. Curr Biol 15: R99 – R102.
- 13. Бойл А., Дэвис С., Шульха Х., Мельцер П., Маргулис Э. и др. (2008) Картирование и характеристика открытого хроматина в геноме с высоким разрешением. Ячейка 132: 311–322.
- 14. Crawford GE, Davis S, Scacheri PC, Renaud G, Halawi MJ и др. (2006) DNase-chip: метод высокого разрешения для идентификации сайтов гиперчувствительности к ДНКазе I с использованием мозаичных микрочипов.Нат Методы 3: 503–509.
- 15. Shibata Y, Crawford G (2009) Отображение регулирующих элементов с помощью чипа гиперчувствительности DNaseI (DNase-Chip). Методы молекулярной биологии (Клифтон.
- 16. Schmitz GG, Walter T, Seibl R, Kessler C (1991) Нерадиоактивное мечение олигонуклеотидов in vitro с помощью гаптен дигоксигенина путем связывания с терминальной трансферазой. Анальная биохимия 192: 222–231.
- 17. Фернандес-Капетилло О., Махадеваайя С.К., Селеста А., Романиенко П.Дж., Камерини-Отеро Р.Д. и др.(2003) h3AX необходим для ремоделирования хроматина и инактивации половых хромосом в мейозе самцов мышей. Dev Cell 4: 497–508.
- 18. Verkaik NS, Esveldt-van Lange RE, van Heemst D, Bruggenwirth HT, Hoeijmakers JH, et al. (2002) Различные типы V (D) J-рекомбинации и дефекты концевого соединения в мутантных клетках млекопитающих с репарацией двухцепочечных разрывов ДНК. Eur J Immunol 32: 701–709.
- 19. Fernando P, Kelly JF, Balazsi K, Slack RS, Megeney LA (2002) Активность каспазы 3 необходима для дифференцировки скелетных мышц.Proc Natl Acad Sci U S A 99: 11025–11030.
- 20. Ju BG, Lunyak VV, Perissi V, Garcia-Bassets I, Rose DW и др. (2006) Опосредованный топоизомеразой IIbeta разрыв дцДНК, необходимый для регулируемой транскрипции. Science 312: 1798–1802.
- 21. Leduc F, Maquennehan V, Nkoma GB, Boissonneault G (2008) Ответ на повреждение ДНК во время ремоделирования хроматина в удлиненных сперматидах мышей.


 Р. Дадыко, И.И. Драйчик. Вагоностроение. Справочное пособие. Издание 2-е, дополненное и переработанное. Москва: Государственное научно-техническое издательство машиностроительной литературы, 1954 год.
Р. Дадыко, И.И. Драйчик. Вагоностроение. Справочное пособие. Издание 2-е, дополненное и переработанное. Москва: Государственное научно-техническое издательство машиностроительной литературы, 1954 год.





 Читайте ее внимательно, особенно инструкции по смааке, системе охлаждения, уходу за батареей и пр.; выполнение их абсолютно необходимо для экономической и удовлетворительной работы машины.
Читайте ее внимательно, особенно инструкции по смааке, системе охлаждения, уходу за батареей и пр.; выполнение их абсолютно необходимо для экономической и удовлетворительной работы машины.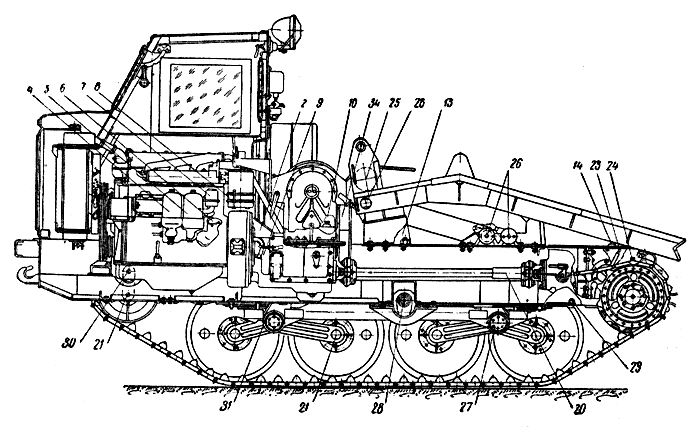 Г.Беккер. Портальные автомобили. Москва: «Машиностроение», 1971 год.
Г.Беккер. Портальные автомобили. Москва: «Машиностроение», 1971 год. Москва: Государственное научно-техническое издательство машиностроительной литературы, 1962 год.
Москва: Государственное научно-техническое издательство машиностроительной литературы, 1962 год.



 При использовании обязательно указывать основной вид транспорта вагона в этом сегменте.
При использовании обязательно указывать основной вид транспорта вагона в этом сегменте.