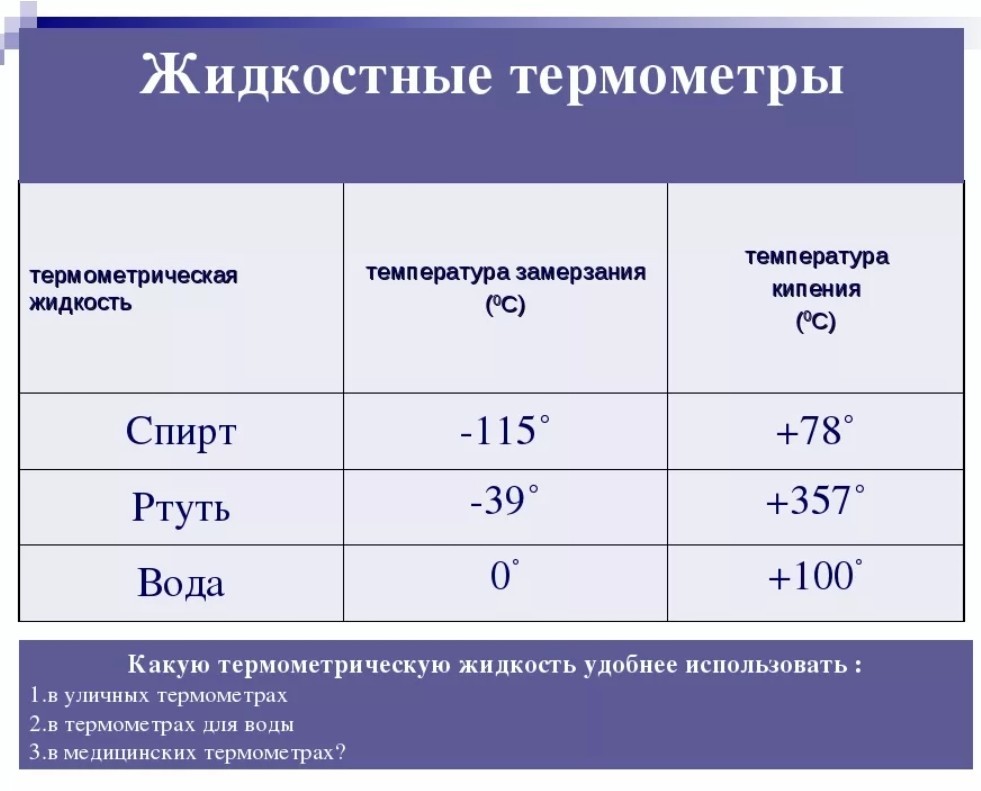
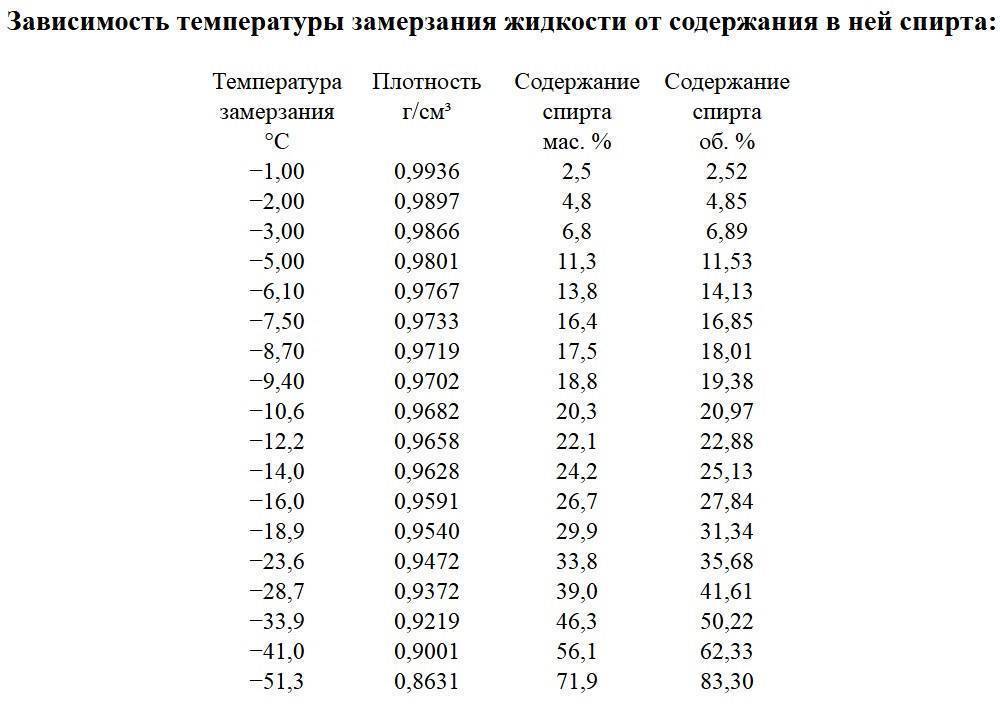
Температура замерзания спирта
Свойства спиртных напитков всегда интересовали человека, ведь из-за особого состава они непохожи на все остальные жидкости, предназначенные для питья. Для того чтобы понять это, даже не нужно было знать формулы веществ. Как пример, историки знают об особенно холодных зимах в Европе по сохранившимся документам, где указано, что в погребах даже замерзало вино. Какова температура замерзания спирта и содержащих его напитков, тогда не было известно. В наши дни наука продвинулась вперёд и этот вопрос можно прояснить.
Содержание
- Этиловый спирт
- Как замерзает этиловый спирт
- Спиртовые растворы
- Другие разновидности спирта
Этиловый спирт
Так как в алкогольных напитках (и прошлых столетий, и современных) содержится именно этиловый спирт, его свойства наиболее интересны не только химикам и физикам, но и всем остальным людям. Зная соотношение спирта и воды в напитке, можно рассчитать, при какой температуре он превратится в лёд и возможно ли это в бытовых условиях.
Этанол – он же этиловый, винный спирт, метилкарбинол или же просто спирт – в стандартных условиях представляет собой бесцветную прозрачную жидкость. Он горюч и выделяет летучие пары. Вкус и запах продукта примерно представляют себе все. Одноатомный насыщенный спирт со знакомой со школьной скамьи формулой C2H5(OH) используется не только в производстве алкоголя, но и как топливо, растворитель, компонент дезинфицирующих средств и лекарств, в парфюмерии, пищевой и химической промышленности. В медицине применяется раствор спирта 96-ти или 70%, который должен быть предварительно очищен.
Как замерзает этиловый спирт
Замерзание – это тот момент, когда вещество меняет агрегатную форму, переходя из жидкой формы в твёрдую, кристаллическую. На этот процесс оказывают влияние состав и молекулярные свойства вещества, наличие в нём примесей, уровень атмосферного давления в момент охлаждения и другие факторы.
Что касается этилового спирта, то достигнуть этого состояния в естественных природных условиях на планете Земля ему не суждено: абсолютная температура замерзания спирта равна -117°C.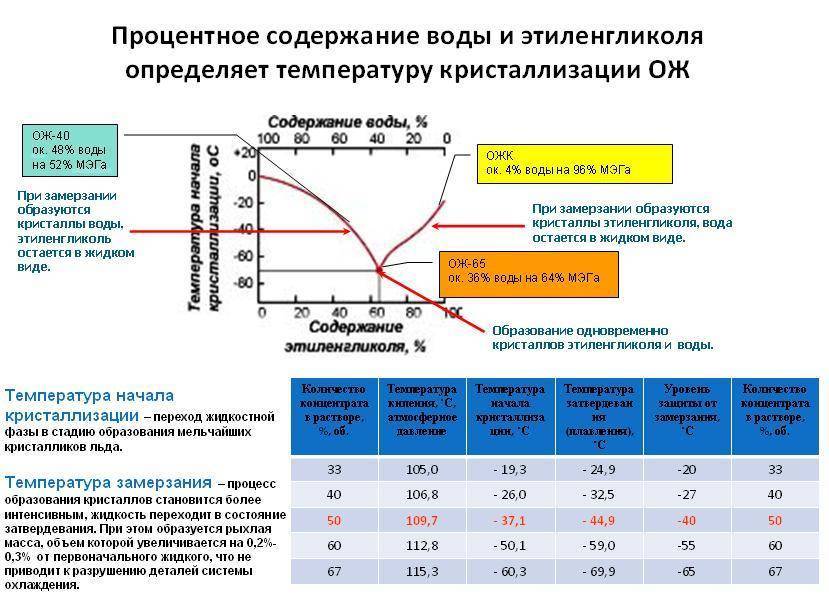 По другим данным это показатель составляет -114 или 115°C. Вот какой продукт не боится никаких морозов, может, поэтому прочно ассоциируется с согреванием.
По другим данным это показатель составляет -114 или 115°C. Вот какой продукт не боится никаких морозов, может, поэтому прочно ассоциируется с согреванием.
Спиртовые растворы
Спиртосодержащие напитки тоже устойчивы к холоду, но заморозить их всё же возможно – как вино из европейских погребов, которое фактом своего замерзания ясно говорило об экстремальных для тех широт и времени температурах. Всё дело в воде и других добавках, которые делают из чистого спирта раствор, разбавляя его концентрацию.
Раствор, в котором спирта в 2 раза меньше, чем воды, замерзает при -17°C. Если соотношение спирта и воды составляет 1:3, то его температура замерзания будет уже -11 градусов ниже нуля.
Водка представляет собой 40%-ный раствор спирта, то есть в ней 6 частей воды и 4 части спирта. Она замерзает при 25–29° ниже нуля. Если же напиток превратился в лёд при более высокой температуре, например, -20 градусах, это уже серьёзный повод усомниться в его качестве и составе. Водка, разбавленная пополам с водой, переходит в твёрдое состояние уже при -7,5°C.
При этом водка замерзает постепенно, но не так, как вода. Сначала она становится вязкой, желеобразной, а потом индевеет отдельными пластинами. Это связано с тем, что по мере замерзания в растворе увеличивается концентрация этанола, процесс отвердевания протекает неравномерно. Загустевшая водка не имеет характерного вкуса и запаха, за счёт чего пьётся легко, а потому очень просто увлечься экспериментом, перебрать с её количеством и получить серьёзное отравление.
Пиво относится к слабоалкогольным напиткам, так как содержит мало этанола. И замерзает оно уже при -2 градусах, о чём знают все, кто хоть раз забывал пиво в морозилке, надеясь охладить его быстрее. Пить такой напиток не опасно, однако он может потерять во вкусовых качествах. То же самое относится и ко всем слабо- и среднеалкогольным напиткам: вину, вермуту, коктейлям.
Интересно, что сильное охлаждение играет существенную роль в приготовления ряда алкогольных напитков. Некоторые разновидности бренди и метаксу по технологии специально подвергают выдержке при -6°C в течение нескольких месяцев.
Другие разновидности спирта
Изопропиловый спирт используют в качестве заменителя этанола в косметике, парфюмерии, для производства растворителя, антифриза, для сварки оптических волокон и так далее. Замерзает при -90°C. 70%-ный изопропанол применяется в качестве антисептика, пропитывающего медицинские салфетки. Его температура замерзания выше, примерно -29 градусов.
Метиловый спирт (метанол, древесный спирт, метилгидрат) имеет формулу CH₃OH. Сильный растворитель, в основном используется для производства формальдегида. Метанол – опаснейший яд, причём даже в малых количествах. 60%-ный раствор метилового спирта замерзает при температуре -75,7°C, 20%-ный – при -15°C, 10%-ный – при 5,6°C.
Нашатырный спирт – это водный раствор гидроксида аммония. Известен своим резким запахом и способностью приводить в чувство при обморочном состоянии. Также его применяют для того, чтобы вызвать рвоту при отравлении алкоголем: нужно выпить раствор нашатыря, 5-10 капель на 100 мл воды. Чаще всего в медицинских и бытовых целях нам помогает 10% раствор аммиачной воды, который обладает свойством замерзать уже при -12 градусах по Цельсию. 25%-ный раствор затвердевает при температуре -56°C.
Чаще всего в медицинских и бытовых целях нам помогает 10% раствор аммиачной воды, который обладает свойством замерзать уже при -12 градусах по Цельсию. 25%-ный раствор затвердевает при температуре -56°C.
Температура кипения и температура замерзания (кристаллизации) раствора
Температура замерзания (кристаллизации) жидкости– это температура, при которой давление насыщенного пара жидкости равно давлению насыщенного пара кристаллов.
Так как согласно закону Ф. Рауля, давление насыщенного пара над раствором нелетучего вещества ниже давления пара над чистым растворителем, следовательно, при одном и том же внешнем давлении температура кипения раствора выше температуры кипения чистого растворителя, а температура замерзания раствора ниже температуры замерзания чистого растворителя.
Количественно эта
зависимость установлена законом Ф.
Рауля«Повышение температуры кипения
или понижение температуры замерзания
идеального раствора прямо пропорционально
моляльной концентрации растворенного
вещества».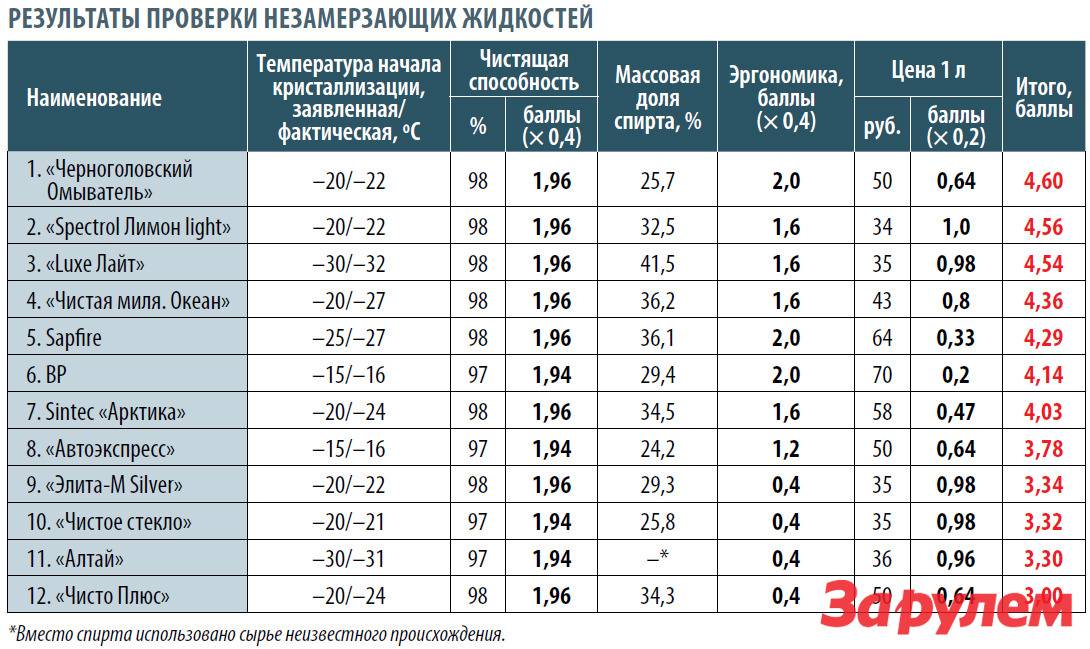
∆Ткип.=
Е*См, ∆Т
См– моляльная концентрация раствора, мол/Кг,
Е – эбулеоскопическая постоянная, град/мол,
К – криоскопическая постоянная, град/мол.
Е и К показывают повышение температуры кипения и понижение температуры замерзания раствора, в котором в 1 кг растворителя растворен 1 моль вещества.
Пример 1: для воды Е = 0,52 град/мол, К = 1,86 град/мол.
Так при растворении в 1000 г воды 342 г сахара (С12Н22О11) или 46 г этилового спирта (С2Н5ОН) температура замерзания каждого раствора понизится на 1,860.
Например: определить
температуру замерзания 40 % масс. водного
растворителя глицерина (С3Н8О3).
100 г раствора состоит из 40 г глицерина
и 60 г воды.
∆Тзам.= 1,86*7,24 = 13,50
Ответ: температура замерзания 40 % водного раствора глицерина – 13,50С.
Пример 2: раствор, содержащий 11,04 г глицерина в 800 г воды, кристаллизуется при – 0,2790С. Вычислите мольную массу глицерина.
Решение: температура кристаллизации чистой воды 00С, следовательно, понижение температуры кристаллизации Δt= 0- (-0,2790) = 0,2790. Масса глицеринаm(г), приходящаяся на 1000 г воды,
m= 11,04*1000/800 = 13,8
подставляем значение mв уравнение
,
тогда мольная масса глицерина
М = 1,86*13,8/0,279 = 92
г/моль.
В измерениях температур кипения и замерзания растворов основаны эбуллиоскопические и криоскопические методы определения молекулярных масс веществ. При этом используют формулу:
К – криоскопическая или эбулеоскопическая константа;
mи М– соответственно масса растворенного вещества и его мольная масса;
m1– масса растворителя.
Одни вещества в растворенном или расплавленном состоянии проводят эдектрический ток (электролиты), другие в тех же условиях эл. ток не проводят (не электролиты).
Свойства растворов относятся к коллигативным свойствам, т.е. к таким свойствам, которые зависят от концентрации частиц в растворе. Значение коллигативных свойств растворов, получающихся при растворении электролитов, аномально высоки.
Например: При
растворении 1 моля хлорида натрия в 100
г воды понижение температуры замерзания
раствора составляла не 1,86°, а 3,36°, т. е.
примерно в 2 раза больше теории.
е.
примерно в 2 раза больше теории.
Полученные экспериментальные данные приводят к выводу о распаде (диссоциации) молекул электролита в растворе на более мелкие частицы (ионы). Теория электролитической диссоциации создана С. Аррениусом. Основные положения этой теории:
1) при растворении электролитов происходит диссоциация их молекул на заряженные частицы — ионы;
2) при диссоциации устанавливается термодинамическое равновесие между образовавшимися ионами и молекулами;
3) величина заряда иона совпадает с валентностью атома элемента или кислотного остатка, а число положительных зарядов равно числу отрицательных зарядов;
4) в целом раствор нейтрален. Растворы электролитов проводят электрический ток — «проводники второго рода».
Согласно современной
теории растворов диссоциация
происходит в результате взаимодействия растворенного
вещества с молекулами растворителя. Хорошо диссоциируют молекулы с ионной
и ковалентной полярной связью. Неполярные
и малополярные молекулы не диссоциируют
или диссоциируют очень мало. На диссоциацию
электролитов в значительной степени
влияет полярность растворителя. Чем
выше полярность растворителя, тем выше
степень диссоциации электролита.
Хорошо диссоциируют молекулы с ионной
и ковалентной полярной связью. Неполярные
и малополярные молекулы не диссоциируют
или диссоциируют очень мало. На диссоциацию
электролитов в значительной степени
влияет полярность растворителя. Чем
выше полярность растворителя, тем выше
степень диссоциации электролита.
Диссоциация кислот НСl = Н+ + Сl—
Н2SO4 = 2Н+ + SO2-4СНзСООН ↔ СНзСОО—
С точки зрения электрической диссоциации кислотами называются электролиты, образующие в водных растворах ионы водорода (Н+).
Диссоциация оснований NaOH=Na+ +OH—
Ва(ОН)2 = Ва2+ + 2ОН—
NН4ОН ↔ NН+4 + ОН—
Основаниями называются электролиты, диссоциирующие в водном растворе с
образованием гидроксид-ионов
(ОН).
Диссоциация солей NaCl = Na+ +Cl—
NiSO4 = Ni2+ + SO2-4
K3PO4=ЗK++POЗ—4
Жидкости — температуры замерзания и плавления
Для чистых соединений могут быть даны следующие определения:
- Температура плавления — температура, при которой твердое вещество превращается в жидкость
- превращается в твердое вещество
- Точки плавления и замерзания меняются в зависимости от давления, но обычно они даны при 1 атм.
- Чистое вещество имеет одинаковые температуры замерзания и плавления (на практике можно наблюдать небольшую разницу между этими величинами).
- Для смесей соединений (таких как нефть) существуют диапазоны температур плавления и замерзания в зависимости от процента расплавленной или замороженной смеси.

- Для смеси начальная точка плавления близка к точке плавления самого легкого соединения в смеси, а начальная точка замерзания близка к точке замерзания (или точке плавления) самого тяжелого соединения в смеси.
- Поскольку точка плавления увеличивается с увеличением молекулярной массы, для нефтяных смесей начальная точка замерзания выше, чем начальная точка плавления.
Точки замерзания и плавления некоторых распространенных жидкостей при 1 атм:
См. также Физические данные для углеводородов, Температуры плавления углеводородов, спиртов и кислот, Физические данные для спиртов и карбоновых кислот, Физические данные для сероорганических соединений, Физические данные для органических соединений азота и температуры плавления и кипения, плотности и растворимости в воде для неорганических соединений
| Жидкость | Температура замерзания и плавления (K) |
|---|---|
| Acetic acid | 290 |
| Acetone | 179 |
| Alcohol, allyl | 144 |
| Alcohol, ethyl (ethanol) | 158. 6 6 |
| Спирт изобутиловый | 165 |
| Спирт метиловый (метанол) | 175,5 |
| Спирт, 4 пропил 1006 4 8 100400048 | |
| Aniline | 267 |
| Anisole | 235.5 |
| Benzene | 278.7 |
| Benzonitrile | 260.3 |
| Bromine | 265.95 |
| Bromobenzene | 242.4 |
| Бутан | 135 |
| Камфора | 452 |
| Углекислый газ | 194.5 |
| Carbon Disulfide | 161.2 |
| Carbon Tetrachloride (Tetrachloromethane) | 250.4 |
| Castor Oil | 263.2 |
| Chlorobenzene | 227.8 |
| Chloroform (Trichloromethane) | 209,6 |
| 3-хлорпропен (аллилхлорид) | 138,5 |
| Циклогексан | 280 |
| Decane | 243. 5 5 |
| Dodecane | 247.2 |
| Ether | 157 |
| Ethyl acetat | 189.4 |
| Ethylene bromide | 283 |
| Ethylene Glycol | 260.2 |
| Муравьиная кислота | 281 |
| Хладагент трихлорфторметан R-11 | 162 |
| Dichlorodifluoromethane refrigerant R-12 | 115 |
| Glycerine | 290.8 |
| n-Heptane | 182.5 |
| Hexane | 178 |
| Iodine | 386.6 |
| Isopentane (2-метилбутан) | 113,1 |
| Льняное масло | 253 |
| Ртуть | 234,13 |
| Methylcyclopentane | 130.5 |
| Naphtalene | 353 |
| Nitrobenzene | 278. 7 7 |
| Nitrogen | 63.14 |
| n-Octane | 216.4 |
| Pentane | 143.3 |
| Фенол | 316,2 |
| Пропилен | 87,9 |
| Пропиленгликоль | 213 |
| Toluene | 178 |
| Turpentine | 214 |
| Water, Fresh | 273 |
| Water, Sea | 270.6 |
T C = T K — 273,16 [°C]
T F = T C * 1,8 + 32 [°F]
- Преобразователь температуры, температура кипения 9002 Температура замерзания 9002 Температура замерзания0001
Точка плавления, точка замерзания, Точка кипения
Точка плавления и точка замерзания Точка кипения Температура плавления и замерзания Точка
Чистые, кристаллические твердые вещества имеют характерную температуру плавления , температура, при которой твердое тело плавится и становится жидкостью.
 Переход между твердым телом
а жидкость настолько острая для небольших образцов чистого вещества, что точки плавления могут
измеряться с точностью до 0,1 o C. Температура плавления твердого кислорода, например,
-218.4 o C.
Переход между твердым телом
а жидкость настолько острая для небольших образцов чистого вещества, что точки плавления могут
измеряться с точностью до 0,1 o C. Температура плавления твердого кислорода, например,
-218.4 o C.Жидкости имеют характерную температуру, при которой они превращаются в твердые тела, известную как их точка замерзания . Теоретически температура плавления твердого тела должна быть то же, что температура замерзания жидкости. На практике небольшие различия между этими количества можно наблюдать.
Трудно, если вообще возможно, нагреть твердое тело выше его точки плавления, потому что тепло, поступающее в твердое тело при его температуре плавления, используется для превращения твердого тела в жидкость. Однако некоторые жидкости можно охладить до температуры ниже точки их замерзания. точки, не образуя твердого тела. Когда это сделано, говорят, что жидкость равна переохлажденный .
Пример переохлажденной жидкости можно получить путем нагревания твердого ацетата натрия.
 тригидрат (NaCH 3 CO 2 3 H 2 O). Когда это твердое вещество плавится,
ацетат натрия растворяется в воде, которая была захвачена кристаллом, с образованием раствора.
Когда раствор остынет до комнатной температуры, он должен затвердеть. Но это часто не так. Если
к жидкости добавляют небольшой кристалл тригидрата ацетата натрия, однако содержимое
колбы затвердевают в течение нескольких секунд.
тригидрат (NaCH 3 CO 2 3 H 2 O). Когда это твердое вещество плавится,
ацетат натрия растворяется в воде, которая была захвачена кристаллом, с образованием раствора.
Когда раствор остынет до комнатной температуры, он должен затвердеть. Но это часто не так. Если
к жидкости добавляют небольшой кристалл тригидрата ацетата натрия, однако содержимое
колбы затвердевают в течение нескольких секунд.Жидкость может стать переохлажденной, потому что частицы в твердом теле упакованы в регулярная структура, характерная для данного конкретного вещества. Что-нибудь из этого твердые вещества образуются очень легко; другие нет. Некоторым нужна пылинка или затравочный кристалл, действовать как место, на котором может расти кристалл. Для образования кристаллов натрия тригидрат ацетата, ионы Na + , ионы CH 3 CO 2 — , и молекулы воды должны собраться вместе в правильной ориентации. Это трудно для эти частицы самоорганизуются, но затравочный кристалл может обеспечить основу для которые могут вырасти при правильном расположении ионов и молекул воды.
Поскольку трудно нагреть твердые вещества до температуры выше их температуры плавления, и Поскольку чистые твердые вещества склонны плавиться в очень небольшом диапазоне температур, температуры плавления часто используется для идентификации соединений. Мы можем различить три известных сахара. как глюкоза ( МП = 150 o C), фруктоза ( МП = 103-105 o С), и сахарозы ( т.п. = 185-186 o С), для Например, путем определения температуры плавления небольшого образца.
Измерения температуры плавления твердого вещества также могут предоставить информацию о чистота вещества. Чистые кристаллические твердые вещества плавятся в очень узком диапазоне температур. температуры, тогда как смеси плавятся в широком диапазоне температур. Смеси также склонны плавятся при температурах ниже температуры плавления чистых твердых веществ.
Температура кипения
Когда жидкость нагревается, она в конце концов достигает температуры, при которой пар давление настолько велико, что внутри тела жидкости образуются пузырьки.
 Эта температура
называется температура кипения . Как только жидкость начнет кипеть,
температура остается постоянной до тех пор, пока вся жидкость не превратится в газ.
Эта температура
называется температура кипения . Как только жидкость начнет кипеть,
температура остается постоянной до тех пор, пока вся жидкость не превратится в газ.Нормальная температура кипения воды составляет 100 o C. Но если вы попытаетесь сварить яйцо в кипящей воды во время кемпинга в Скалистых горах на высоте 10 000 футов, вы обнаружат, что яйцо готовится дольше, потому что вода кипит только при 90 90 405 o 90 406 C на этой возвышенности.
Теоретически вы не сможете нагреть жидкость до температуры выше нормальной точка кипения. Однако до того, как микроволновые печи стали популярными, использовались скороварки. чтобы сократить время приготовления пищи. В обычной скороварке вода может оставаться в жидком состоянии при температурах до 120 o C, и пища готовится в почти треть нормального времени.
Объяснить, почему вода кипит при температуре 90 o C в горах и 120 o C в скороварке, хотя нормальная температура кипения воды 100 o C, мы нужно понять, почему жидкость кипит.
 По определению жидкость кипит, когда пар
Давление газа, выходящего из жидкости, равно давлению, действующему на
жидкости окружающей средой, как показано на рисунке ниже.
По определению жидкость кипит, когда пар
Давление газа, выходящего из жидкости, равно давлению, действующему на
жидкости окружающей средой, как показано на рисунке ниже.Жидкости кипят, когда давление их паров равно давлению, оказываемому на жидкость своим окружением. Нормальная температура кипения воды составляет 100 o C, потому что это температура при котором давление паров воды равно 760 мм рт.ст., или 1 атм. В обычных условиях, когда давление атмосферы примерно 760 мм рт.ст., вода кипит при 100 или С. На высоте 10 000 футов над уровнем моря атмосферное давление составляет всего 526 мм ртутного столба. На этих высотах вода закипает при давлении ее паров 526 мм рт.ст., что происходит при температуре из 90 o C.
Скороварки оснащены клапаном, который позволяет газу выходить, когда давление внутри горшка превышает некоторое фиксированное значение.