Задачи по теме «Теплоемкость идеального газа»
Решение задач дело полезное, но не всегда интересное. Чтобы вы справлялись с решением задач по теме «Теплоемкость идеального газа» быстрее, приведем здесь несколько примеров и вопросов с объяснениями.
Подписывайтесь на наш телеграм-канал, чтобы получать полезную и интересную рассылку.
Задачи по теме «Теплоемкость идеального газа» с решениями
Повторение и практика – залог успеха в любом деле. И решение задач не исключение. Поэтому не забываем держать под рукой памятку по задачам и полезные формулы
Задача №1. Определить удельную теплоемкость идеального газа
Условие
Определить молярную массу M двухатомного газа и его удельные теплоемкости, если известно, что разность cр — cv удельных теплоемкостей этого газа равна 260 Дж/(кг*К)
Решение
По определению:
Значит, газ из задачи – кислород. Если кто не понял, как это определяется, учитесь пользоваться таблицей Менделеева.
Считаем удельные теплоемкости:
Ответ: 32 г/моль; 649 Дж/кг*К; 909 Дж/кг*К.
Задача №2. Удельная теплоемкость
Условие
Плотность некоторого газа при нормальных условиях ρ = 1,25 кг/м3. Отношение удельных теплоемкостей γ = 1,4. Определить удельные теплоемкости cv и сp этого газа.
Решение
Исходя из отношения удельных теплоемкостей, можно сделать вывод, что газ – двухатомный, i=5. При постоянном объеме удельная теплоемкость равна:
Молярную массу можно найти из уравнения Клапейрона-Менделеева:
Отсюда:
Ответ: 742 Дж/кг*К; 1039 Дж/кг*К.
Задача №3. Молярная теплоемкость
Условие
Вычислить молярные теплоемкости газа, зная, что его молярная масса М = 4∙10 3 кг/моль и отношение удельных теплоемкостей ср/сv = 1,67.
Решение
Удельные теплоемкости равны:
Можно найти:
Ответ: 12,4 Дж/моль*К; 20,71 Дж/моль*К
Задача №4.
 Теплоемкость при изопроцессах
Теплоемкость при изопроцессахУсловие
На рисунке изображен изотермический процесс с газом постоянной массы. Сравните теплоемкость в процессе АВ с теплоемкостью этой же массы газа в изохорном процессе.
Решение
Теплоемкость при изохорном процессе является постоянной величиной. При изотермическом процесса она равна бесконечности. Значит, теплоемкость в процессе АВ больше.
Ответ: Теплоемкость в процессе АВ больше.
Задача №5. Теплоемкость при политропическом процессе
Условие
Найдите молярную теплоемкость идеального газа при политропическом процессе pVn = const, если показатель адиабаты газа равен γ. При каких значениях показателя политропы n теплоемкость газа будет отрицательной?
Решение
Запишем первое начало термодинамики, выражения для работы и изменения внутренней энергии в политропическом процессе соответственно:
Если количество вещества и изменение температуры принять равными единице, это выражение будет равно молярной теплоемкости (по определению теплоемкости):
Ответ: см. выражение выше.
выражение выше.
Вопросы по теме «Теплоемкость идеального газа»
Вопрос 1. Что такое теплоемкость идеального газа?
Ответ. Когда газу сообщается определенное количество теплоты, меняется его температура.
Отношение количества теплоты, сообщенного газу, к изменению его температуры, называется теплоемкостью идеального газа.
Вопрос 2. Что такое молярная и удельная теплоемкость идеального газа?
Ответ.
Удельная теплоемкость – теплоемкость единичной массы вещества.
Вопрос 3. Как определяется теплоемкость газа при изопроцессах?
Ответ.
При изотермическом процессе T=const. Теплоемкость равна плюс/минус бесконечности.
При адиабатном процессе нет теплообмена с окружающей средой, теплоемкость равна нулю.
При изохорном процессе газ не совершает работы, а теплоемкость равна:
Здесь i – количество степеней свободы молекул газа. Для одноатомных газов i=3, для двухатомных i=5.
При изобарном процессе теплоемкость определяется соотношением Мейера:
Вопрос 4. Как еще связаны теплоемкости при постоянном давлении и постоянном объеме?
Ответ. Отношение теплоемкостей при постоянном давлении и постоянном объеме обозначается греческой буквой «гамма» и называется показателем адиабаты.
Вопрос 5. Как называются процессы, в которых теплоемкость газа остается неизменной?
Ответ. Такие процессы называются политропными. Адиабатный процесс – частный случай политропного процесса.
Теплоемкость реального газа не равна теплоемкости идеального газа и может сильно отличаться.
Нужна помощь в решении задач и выполнении других заданий? Специальный студенческий сервис готов оказать ее!
Удельная теплоемкость при постоянном объеме Калькулятор
✖Изменение теплоты определяется как изменение энтальпии реакции. | АттоджоульМиллиарда баррелей нефтяного эквивалентаБританская тепловая единица (IT)Британская тепловая единица (th)Калорийность (ИТ)Калорийность (питательная)Калорийность (тыс.)сантиджоульCHUдекаджоульДециджоульДин СантиметрЭлектрон-вольтЭргЭкзаджоульФемтоджоульфут-фунтГигагерцГигаджоульГигатонна тротилаГигаватт-часГрамм-сила-сантиметрграмм-сила-метрХартри энергия гектоджоульГерцЛошадиная сила (метрическая) ЧассилочасДюйм-фунтДжоульКельвинКилокалория (IT)Килокалория (й)килоэлектрон вольтКилограммКилограмм тротилаКилограмм-сила-сантиметрКилограмм-сила-метркилоджоульKilopond Meterкиловатт-часкиловатт-секундаМБТУ (ИТ)Мега БТЕ (ИТ)Мегаэлектрон-ВольтмегаджоульМегатонна тротиламегаватт-часмикроджоульМиллиджоульММБТУ (ИТ)наноджоульНьютон-метрУнция-сила-дюймПетаджоульПикоджоульПланка Энергияфунт-сила футафунт силы дюймпостоянная РидбергаТерагерцТераджоультермтерм (EC)Therm (США)Тон (взрывчатые вещества)Тон-час (Охлаждение)Тонна нефтяного эквивалентаБлок Единая атомная массаВатт-часДжоуль | +10% -10% | |
✖Количество молей – это количество газа в молях. | +10% -10% | ||
✖Изменение температуры – это процесс, при котором изменяется степень нагретости тела (или среды).ⓘ Изменение температуры [ΔT] | ЦельсияДелильФаренгейтКельвинНьютонРанкинтемпература по реомюруРомерТройной точки воды | +10% -10% |
|
✖Молярная удельная теплоемкость при постоянном объеме (газа) – это количество теплоты, необходимое для повышения температуры 1 моль газа на 1 °C при постоянном объеме.ⓘ Удельная теплоемкость при постоянном объеме [C |
Джоуль на градус Цельсия на декамольДжоуль на градус Цельсия на мольДжоуль на градус Фаренгейта на мольДжоуль на кельвин на мольДжоуль на Реомюра на моль |
⎘ копия |
👎
Формула
сбросить
👍
Удельная теплоемкость при постоянном объеме Решение
ШАГ 0: Сводка предварительного расчета
ШАГ 1. Преобразование входов в базовый блок
Преобразование входов в базовый блок
Изменение тепла: 107 Джоуль —> 107 Джоуль Конверсия не требуется
Количество молей: 2 —> Конверсия не требуется
Изменение температуры: 21 Кельвин —> 21 Кельвин Конверсия не требуется
ШАГ 2: Оцените формулу
ШАГ 3: Преобразуйте результат в единицу вывода
2.54761904761905 Джоуль на кельвин на моль —> Конверсия не требуется
< 14 Тепловые параметры Калькуляторы
Удельная теплоемкость газовой смеси
Идти Удельная теплоемкость газовой смеси = ((Количество молей газа 1*Удельная теплоемкость газа 1 при постоянном объеме)+(Количество молей газа 2*Удельная теплоемкость газа 2 при постоянном объеме))/(Количество молей газа 1+Количество молей газа 2)
Термическое напряжение материала
Идти Тепловая нагрузка = (Модуль для младших*Коэффициент линейного теплового расширения*Изменение температуры)/(Начальная длина)
Изменение потенциальной энергии
Идти Изменение потенциальной энергии = масса*[g]*(Высота объекта в точке 2-Высота объекта в точке 1)
Коэффициент удельной теплоемкости
Идти Коэффициент удельной теплоемкости = Молярная удельная теплоемкость при постоянном давлении/Молярная удельная теплоемкость при постоянном объеме
Удельная теплоемкость при постоянном объеме
Идти Молярная удельная теплоемкость при постоянном объеме = Изменение тепла/(Количество молей*Изменение температуры)
Удельная энтальпия насыщенной смеси
Идти Энтальпия насыщенной смеси = Удельная энтальпия жидкости+(Качество пара*Скрытая теплота парообразования)
Тепловое расширение
Идти Коэффициент линейного теплового расширения = (1*Изменение длины)/(Начальная длина*Изменение температуры)
Изменение кинетической энергии
Идти Изменение кинетической энергии = масса*(Конечная скорость в точке 2^2-Конечная скорость в точке 1^2)/2
Общая энергия системы
Идти Полная энергия системы = (Потенциальная энергия)+(Кинетическая энергия)+(Внутренняя энергия)
Коэффициент удельной теплоемкости
Идти Динамический коэффициент теплоемкости = Теплоемкость при постоянном давлении/Постоянный объем теплоемкости
Удельная теплоемкость
Идти Удельная теплоемкость = Нагревать*(масса*Изменение температуры)
фактор явного тепла
Идти Фактор явного тепла = 1/(1+(Скрытая теплота/Явное тепло))
Теплоемкость
Идти Теплоемкость = (масса)*(Удельная теплоемкость)
Скрытая теплота
Идти Скрытая теплота = Нагревать/масса
Удельная теплоемкость при постоянном объеме формула
Молярная удельная теплоемкость при постоянном объеме = Изменение тепла/(Количество молей*Изменение температуры)
Cv molar = ΔQ/(Nmoles*ΔT)
Определите удельную теплоемкость?
Удельная теплоемкость — это количество тепла на единицу массы, необходимое для повышения температуры на один градус Цельсия. Связь между теплотой и изменением температуры обычно выражается в виде Q = mcΔt, где c — удельная теплоемкость. Это соотношение не применяется, если происходит фазовый переход, потому что тепло, добавляемое или отводимое во время фазового перехода, не изменяет температуру.
Связь между теплотой и изменением температуры обычно выражается в виде Q = mcΔt, где c — удельная теплоемкость. Это соотношение не применяется, если происходит фазовый переход, потому что тепло, добавляемое или отводимое во время фазового перехода, не изменяет температуру.
Share
Copied!
определение, C, Cp и Cv
Дата последнего обновления: 23 марта 2023 г. изменение температуры называется теплоемкостью. С точки зрения фактического количества рассматриваемого материала, чаще всего в молях, оно обычно указывается в калориях на градус (молекулярная масса в граммах). Удельная теплоемкость – это теплоемкость в калориях на грамм. Калорийность определяется удельной теплоемкостью воды, которая определяется как одна калория на градус Цельсия.
Теплоемкость – это отношение тепла, поглощаемого материалом, к изменению температуры. Следовательно, изменение температуры тела прямо пропорционально теплоте, переданной данному телу.
Что такое теплоемкость C, C
p и C v ?Определение молярной теплоемкости (C)
Общее количество энергии в виде тепла, необходимое для повышения температуры 1 моля любого вещества на 1 единицу, называется молярной теплоемкостью (C) этого вещества. . Он также существенно зависит от природы, размера и состава вещества в системе.
q = n C ∆T
Где,
q — теплота, подведенная или необходимая для изменения температуры (∆T) на 1 моль любого данного вещества,
n — количество в молях,
Константа C известна как молярная теплоемкость тела данного вещества.
\[C_{p}\]
В системе C p — количество тепловой энергии, выделяемой или поглощаемой единицей массы вещества при изменении температуры при постоянном давлении. Другими словами, при постоянном давлении это передача тепловой энергии между системой и окружающей средой. Итак, С p представляет собой молярную теплоемкость, C, при постоянном давлении. Изменение температуры всегда вызывает изменение энтальпии системы.
Другими словами, при постоянном давлении это передача тепловой энергии между системой и окружающей средой. Итак, С p представляет собой молярную теплоемкость, C, при постоянном давлении. Изменение температуры всегда вызывает изменение энтальпии системы.
Энтальпия (∆H) – это тепловая энергия, поглощаемая или выделяемая системой. Кроме того, изменение энтальпии происходит при изменении фазы или состояния вещества.
Например, когда твердое тело переходит в жидкую форму (т. е. превращается из льда в воду), изменение энтальпии называется теплотой плавления. Когда жидкость переходит в газообразную форму (то есть из воды в водяной пар), изменение энтальпии называется тепловым испарением.
Система поглощает или выделяет теплоту без изменения давления в этом веществе, тогда ее удельная теплоемкость при постоянном давлении C p может быть записана как:
\[C_{p} = [\frac{dH}{ dT}]_{p}\] — (1)
где Cp представляет удельную теплоемкость при постоянном давлении; dH — изменение энтальпии; dT – изменение температуры.
\[C_{v}\]
При небольшом изменении температуры вещества C v представляет собой количество тепловой энергии, поглощаемой/выделяемой на единицу массы вещества, объем которого не изменяется. Другими словами, С v — это передача тепловой энергии между системой и окружающей средой без изменения объема этой системы. C v представляет собой молярную теплоемкость C при постоянном объеме. При постоянном объеме объем вещества не изменяется, поэтому изменение объема равно нулю.
Поскольку этот термин относится к внутренней энергии системы, которая является суммой потенциальной и кинетической энергии этой системы. Система поглощает или выделяет теплоту без изменения объема этого вещества, тогда его удельная теплоемкость при постоянном объеме C v может быть:
\[C_{v} = [\frac{dU}{dT}]_{v}\] — (2)
Где
C v представляет удельная теплоемкость при постоянном объеме;
dU — малое изменение внутренней энергии системы;
dT — изменение температуры системы.

Связь между C p и C v
Согласно первому закону термодинамики:
\[\Delta Q = \Delta U + \Delta W\], где \[\Delta Q\] — количество теплоты, переданной системе, U — изменение внутренней энергии, а W — работа. сделанный.
Мы можем написать,
\[\Delta Q = \Delta U + P\Delta V as \Delta W = P\Delta V\]
Так как \[\Delta Q = \Delta n C_{p}\ Delta T \, и \, \Delta U = \Delta n_{v}C \Delta T\]
Следовательно,
\[n C_{p} \Delta T = n C_{v} \Delta T + P \Delta V\] —— (3)
Как мы видим, что PV = nRT
При T1 по Кельвину: \[PV_{1} = nRT_{1}\] ———— (a)
При T2 по Кельвину: \[PV_{2} = nRT_{2 }\] ———— (b)
Вычитание уравнения (a) из (b):
\[PV_{2} — PV_{1} = nRT_{2} — nRT_{1}\]
\[P(V_{2} — V_{1}) = nR (T_{2} — T_{1})\]
Где,
\[V_{2} — V_{1} = \Delta V\] и \[T_{2} — T_{1} = \Delta T\]
Следовательно,
\[P \Delta V = nR \Delta T\]
Подстановка значение \[P \Delta V\] в уравнении (3), получаем,
\[n C_{p} \Delta T = n C_{v} \Delta T + nR \Delta T\]
\[n C_{p}\Delta T = n\Delta T (C_{v} + R)\]
\[C_{p} = C_{v} + R\]
Или
\[C_{p} — C_{v} = R\]
Можно дать следующее соотношение рассматривая идеальное газовое поведение газа.
\[C_{p} — C_{v} = R\]
Где R называется универсальной газовой постоянной.
Коэффициент теплоемкости
В термодинамике — коэффициент теплоемкости или коэффициент удельной теплоемкости (C p :C v ) также известен как показатель адиабаты. Это отношение двух удельных теплоемкостей, C p и C v , определяется по формуле:
Теплоемкость при постоянном давлении (C p )/ Теплоемкость при постоянном объеме (C v )
Коэффициент изоэнтропического расширения — это другое название коэффициента теплоемкости, который также обозначается для идеального газа как γ (гамма). Следовательно, соотношение между C p и C v представляет собой коэффициент удельной теплоемкости γ.
Итак,
\[\gamma = \frac{C_{p}}{C_{v}}\]
Необходимо изучить коэффициент теплоемкости для применения в обратимых процессах термодинамики, особенно там, где идеальны участвуют газы.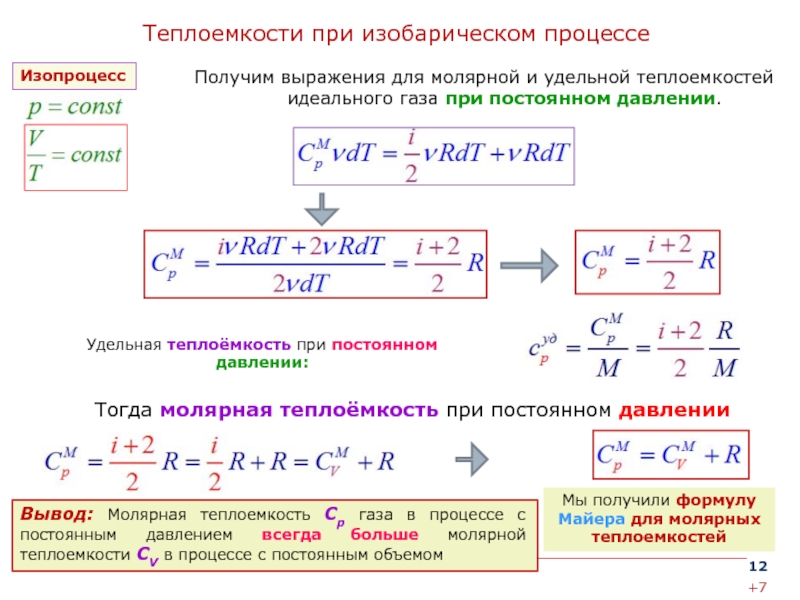
Например, для изучения связи со степенями свободы,
Коэффициент теплоемкости (гамма, γ) идеального газа можно связать со степенями свободы ( f ) молекул газа формулой:
\ [\gamma = 1 + 2f\] или \[f = 2\gamma — 1\]
Удельная теплоемкость газа при постоянном объеме в терминах степени свободы ‘f’ определяется как:
\[C_{v} = (\frac{f}{2})R\]
Кроме того,
\[C_{p} — C_{v} = R\]
Следовательно,
\[C_{p} = (\frac{f}{2})R + R = R(1 + \frac{ f}{2})\]
Теперь отношение удельных теплоемкостей γ задается как:
\[\gamma = \frac{C_{p}}{C_{v}} = \frac{R(1 + \frac{f}{2})}{(\frac{f}{2})R}\]
\[= \frac{(2 + f)}{f}\]
Или \[\ гамма = \frac{C_{p}}{C_{v}}\] 9{2}\]
где m — масса молекулы, v (\[V_{x}\],\[V_{y}\] и \[V_{z}\]) — импульс молекула вместе с осью x, осью y и осью z.
Закон равнораспределения дает,
\[E = \frac{1}{2}k_{B} T + \frac{1}{2}k_{B} T + \frac{1}{2} k_{B} T\]
Здесь \[K_{B}\] — средняя поступательная кинетическая энергия, а T — температура.
Энергия на молекулу газа определяется как,
\[U = \frac{3}{2}k_{B}T\]
\[= \frac{3}{2} RT\]
Таким образом, \[\frac{dU}{dT} = R\]
Но, \[\frac{dU}{dT} = C_{v}\]
Таким образом, \[C_{v} = \frac{3}{2} R\]
Теперь \[C_{p} — C_{v} = R\]
Тогда \[C_{p} = R + C_{v}\]
Это дает \[\gamma = \frac{C_{p}}{C_{v}} = \frac{{\frac{5}{2}R}}{{\frac{3}{2}R }} =\frac{5}{3} = 0,67\]
Для двухатомного газа (например, H 2 , O 2 и N 2 ) он имеет 5 степеней свободы ( 3 как поступательные и 2 как вращательные степени свободы при комнатной температуре, тогда как, за исключением высоких температур, колебательная степень свободы не задействована).
Почему C
p больше, чем C v ?Значения, указанные C p и C v , являются удельной теплоемкостью идеального газа. Они показывают количество теплоты, которое может увеличить температуру единицы массы на 1°C.
Согласно первому закону термодинамики,
\[\Delta Q = \Delta U + \Delta W\]
Где,
\[\Delta Q\] — количество теплоты, переданной системе , \[\Delta U\] — изменение внутренней энергии, а W — проделанная работа.
Итак, при постоянном давлении теплота поглощается не только для увеличения внутренней энергии (функция температуры), но и для совершения работы. Принимая во внимание, что при постоянном объеме тепло поглощается только для повышения внутренней энергии, а не для совершения какой-либо работы над системой, как (для замкнутой системы): \[W = P \Delta V\], где W — работа сделанный. Здесь \[\Delta V = 0\]. (Замкнутая система также является одним из важнейших условий постоянного объема). Следовательно, удельная теплоемкость при постоянном давлении больше, чем удельная теплоемкость при постоянном объеме, т. е. \[C_{p} > C_{v}\].
Следовательно, удельная теплоемкость при постоянном давлении больше, чем удельная теплоемкость при постоянном объеме, т. е. \[C_{p} > C_{v}\].


 1 моль газа весит столько же, сколько его молекулярная масса.ⓘ Количество молей [Nmoles]
1 моль газа весит столько же, сколько его молекулярная масса.ⓘ Количество молей [Nmoles] Мы можем
умножьте конкретную переменную на количество вещества в любой момент времени
для определения фактического значения переменной потока.
Из наших исследований
теплопередача,
мы знаем, что количество теплоты, переданное между двумя телами, равно
пропорционально
температура
разница между предметами и
теплоемкость объектов. теплоемкость это
постоянная, показывающая, сколько тепла добавляется на единицу повышения температуры.
Значение константы различно для разных материалов и зависит
на процессе. Теплоемкость не является переменной состояния .
Мы можем
умножьте конкретную переменную на количество вещества в любой момент времени
для определения фактического значения переменной потока.
Из наших исследований
теплопередача,
мы знаем, что количество теплоты, переданное между двумя телами, равно
пропорционально
температура
разница между предметами и
теплоемкость объектов. теплоемкость это
постоянная, показывающая, сколько тепла добавляется на единицу повышения температуры.
Значение константы различно для разных материалов и зависит
на процессе. Теплоемкость не является переменной состояния . Таким образом, «дельта h» означает изменение «h» из состояния 1 в состояние 2 во время процесса.
Затем для процесса постоянного давления уравнение энтальпии принимает следующий вид:
Таким образом, «дельта h» означает изменение «h» из состояния 1 в состояние 2 во время процесса.
Затем для процесса постоянного давления уравнение энтальпии принимает следующий вид:
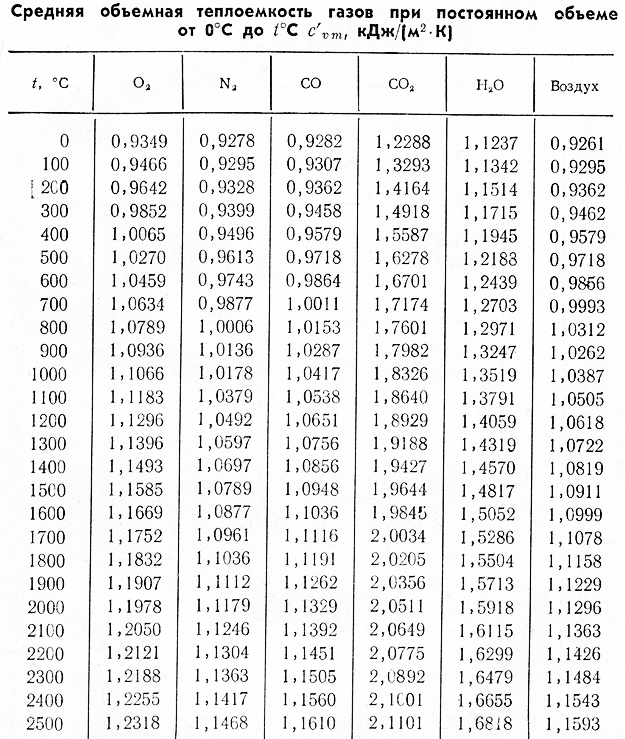 Несмотря на то, что изменение температуры для этого процесса одинаково и постоянная
процесс давления, значение удельной теплоемкости различно.
Несмотря на то, что изменение температуры для этого процесса одинаково и постоянная
процесс давления, значение удельной теплоемкости различно.