Уровень электролита в аккумуляторе автомобиля: как проверить и откорректировать
Начнем с того, что подавляющее большинство АКБ на автомобилях являются свинцово-кислотными. Это значит, что между пластинами из свинца залит кислотный раствор (раствор из серной кислоты и дистиллированной воды, более известный как электролит).
При этом важно понимать, что уровень электролита в аккумуляторе автомобиля напрямую влияет на работоспособность и срок службы батареи. Еще следует отметить, что в процессе эксплуатации самой АКБ указанный уровень электролита может изменяться.Далее мы рассмотрим, когда и почему нужно проверять уровень электролита, какой уровень электролита в аккумуляторе должен быть по норме, а также как его откорректировать при такой необходимости.
Содержание статьи
Как проверить уровень электролита в АКБ
Начнем с того, что электролит состоит из воды и серной кислоты. Так вот, в процессе эксплуатации вода имеет свойство испаряться. Еще во время зарядки аккумулятора электролит частично распадается на водород и кислород.
Еще во время зарядки аккумулятора электролит частично распадается на водород и кислород.
Все эти процессы приводят к тому, что уровень снижается. Именно по этой причине нужна проверка электролита. При этом важно знать, как проверить уровень электролита в аккумуляторе. Давайте разбираться.
Итак, АКБ на большинстве машин стоит под капотом, однако есть модели, где батарея находится в салоне или в багажнике. Также на некоторых авто может стоять сразу две АКБ. В любом случае, перед проверкой уровня, лучше снять батарею с авто.
Далее необходимо очистить аккумулятор от грязи, пыли и мусора. Особенно это важно сделать в области расположения крышек банок, а также клемм. Если мусор попадет в заливные отверстия после откручивания пробок, это может вывести аккумулятор из строя.
Для удаления грязи можно нанести на корпус АКБ средство для очистки стекол, после чего протереть ветошью. Что касается выводов и клемм, их нужно очистить от налета и ржавчины. Сделать это можно мелкой наждачной бумагой.
- Далее нужно убедиться, что АКБ обслуживаемая. Понять это можно по наличию пробок. Если это так, можно откручивать пробки заливных отверстий.Как правило, пробок может быть от двух до шести. Для выкручивания их достаточно поддеть пластиковым шпателем или отверткой, после чего открутить против часовой стрелки.
Еще добавим, что если АКБ необслуживаемая (нет пробок), тогда такой аккумулятор подлежит только замене. Конечно, можно кустарным способом насверлить отверстий в корпусе и потом их запаять, но на практике делать это настоятельно не рекомендуется.
После откручивания кромки заливных отверстий также может потребоваться очистить от грязи. Главное, все делать аккуратно, чтобы грязь, частицы ветоши или очиститель не попали внутрь аккумулятора.
- Завершив все работы, можно оценить состояние и проверить уровень электролита в АКБ.
 Для этого нужно знать, какой уровень должен быть в аккумуляторе, как должен выглядеть нормальный электролит и т.д.
Для этого нужно знать, какой уровень должен быть в аккумуляторе, как должен выглядеть нормальный электролит и т.д.
Для проверки достаточно заглянуть в заливные отверстия, оценивая уровень в каждой «банке» АКБ. Оптимально, когда количество одинаковое в каждом отсеке. Также допускается небольшое отклонение, особенно если ранее уже проводился долив.
В случае, когда уровни явно отличаются, необходимо сначала убедиться, что аккумулятор не течет, корпус сохранил целостность, не видно мест утечки электролита и т.д. Еще потеки могут возникать в том случае, если аккумулятор «кипит». В подобной ситуации следует проверять генератор.
Так или иначе, если АКБ целая по корпусу, тогда нужно долить дистиллированную воду до максимально допустимого уровня. Через пару недель уровень нужно проверить повторно.
- Что касается самого уровня, низкий уровень электролита является таким, когда жидкость не покрывает пластины полностью. Важно как можно скорее восстановить уровень, так как открытые пластины разрушаются очень быстро.
 Если уровень ниже нормы на 10 мм, следует доливать воду.
Если уровень ниже нормы на 10 мм, следует доливать воду.
Если же отмечается большое его снижение (больше чем на 15 мм ниже верхней кромки пластины), даже после долива воды все равно неизбежно снизится производительность АКБ. Если же пластины сухие больше чем на 3 см, это является основанием для замены АКБ.
Нормальный уровень электролита выше пластин на 10 мм или ниже горловины заливного отверстия на 3-4 мм. В этом случае доливать воду не нужно, а сам уровень проверяется через 60-80 дней.
Еще добавим, что высокий уровень электролита является таким, когда электролит доходит до горловины заливного отверстия. Чтобы избежать перелива, нужно знать, что горловины имеют 2 выемки, которые при заливке жидкости образуют мениск.
Другими словами, жидкость получает выгиб, похожий на глаз, возле края горловины. Это и есть завышенный уровень в аккумуляторе. Получается, мениск будет заметен тогда, когда жидкость дошла до края горловины. Если же мениска не видно, значит уровень немного ниже.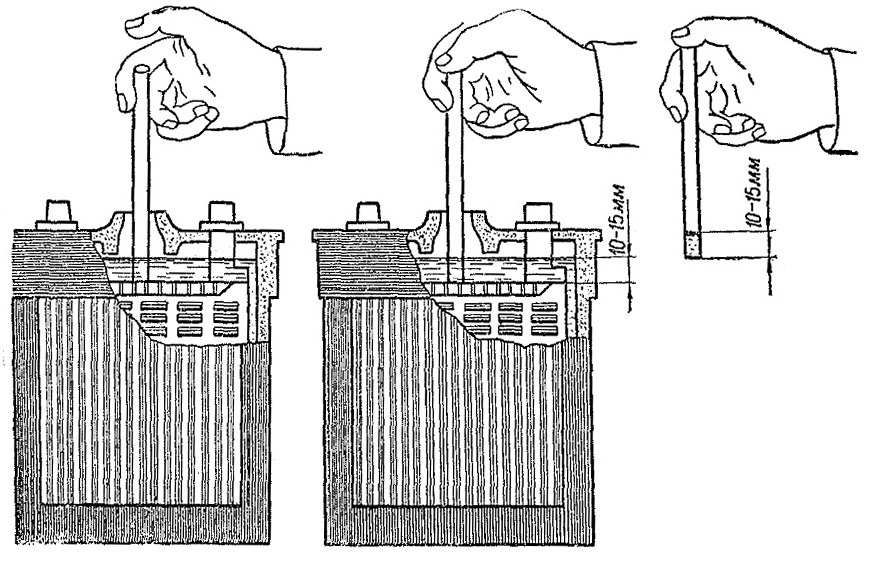 Для точного определения нужно подсвечивать каждую банку АКБ фонариком.
Для точного определения нужно подсвечивать каждую банку АКБ фонариком.
Завершающим этапом будет закручивание пробок, после чего АКБ ставится на зарядку или обратно на автомобиль (в зависимости от степени разряда). На этом можно считать проверку уровня завершенной.
Как доливать воду в аккумулятор
Первое, нужно знать, что работа с АКБ требует соблюдения правил безопасности. Дело в том, что электролит в аккумуляторе содержит серную кислоту. Важно полностью защитить глаза, кожу и т.д.
Оптимально иметь защитные очки, имеющие дополнительную защиту глаз сбоку, а также особые перчатки из неопрена (а не обычные резиновые). Если же электролит попал на кожу, нужно сразу промыть это место большим количеством воды с мылом.
Идем далее. Помните, в банки АКБ заливают только дистиллированную воду, а не кислоту или электролит! Основная задача — полностью покрыть пластины аккумулятора. Далее следует зарядить батарею при помощи ЗУ. Не рекомендуется доливать воду до максимума, вполне достаточно поднять уровень до нижнего края горловины.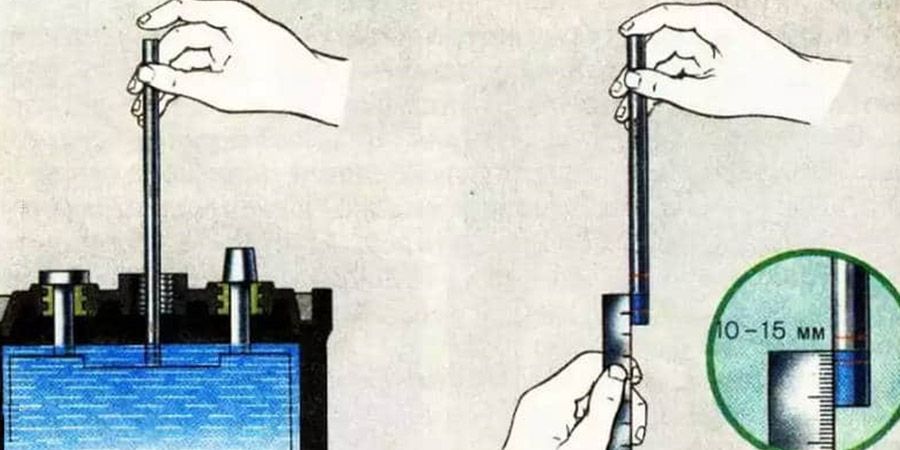 Для залива достаточно иметь чистую воронку, спринцовку и т.п.
Для залива достаточно иметь чистую воронку, спринцовку и т.п.Не используйте для долива обычную водопроводную воду, кипяченую воду и т.п. Использование такой воды приведет к тому, что срок службы аккумулятора сократится. Причина — минералы, мелкие частицы и химические компоненты.
Учтите, во время зарядки сильно разряженного аккумулятора уровень электролита будет выше, чем тот, который был выставлен до зарядки. При доливе воды важно оставлять место для поднимающейся жидкости. Также нагрев АКБ после установки на авто может привести к тому, что уровень электролита будет выше ожидаемого.
Полезные советы
Отметим, что после любых манипуляций следует регулярно осматривать и проверять аккумулятор. Если АКБ «кипит», видны потеки по корпусу и т.д., следует еще раз проверить уровень электролита, а также отдельно проверять генератор и реле-регулятор.
Что касается долива, нельзя лить кислоту или готовый электролит. Заливать нужно только воду. Также важно измерить плотность электролита в аккумуляторе до и после зарядки батареи, так как высокое содержание кислоты еще больше сократит срок службы АКБ.
Запрещается выкручивать пробки АКБ на автомобиле с заведенным двигателем! Это может привести к тому, что электролит выплеснется из банок, попадет на детали автомобиля, в глаза или на кожу. В свою очередь, это может стать причиной разрушения деталей или серьезных травм для человека.
Напоследок отметим, что аккумулятор нужно держать чистым. Следует удалять отложения на корпусе, так как они пропитываются кислотными испарениями. Также грязь приводит к ускоренной коррозии находящихся поблизости деталей из металла.
Подведем итоги
С учетом приведенной выше информации становится понятно, что уровень электролита в автомобильном аккумуляторе необходимо контролировать и поддерживать в процессе эксплуатации. Это значит, что если батарея обслуживаемая, есть возможность как проверки, так и корректировки. Для этого следует заранее изучить, как проверить электролит в аккумуляторе.
Для этого следует заранее изучить, как проверить электролит в аккумуляторе.
На самом деле, следуя указанным выше инструкциям, проверить уровень электролита в аккумуляторе сможет любой автовладелец в условиях обычного гаража. Также не составит большого труда повысить уровень электролита в «банках» АКБ при такой необходимости. Главное, учитывать все рассмотренные выше нюансы, а также соблюдать все правила и рекомендации в плане безопасности при обслуживании аккумулятора автомобиля.
Уровень электролита в автомобильном аккумуляторе: как проверить?
Снова приветствую вас друзья на моем блоге, посвященном атрибуту настоящего мужчины – автомобилю. Лето давно покинуло наши края, на носу зима! А это означает, что самое время каждому автолюбителю к ней готовится. Если вдруг, это будет ваша первая стужа за баранкой, хочу вас уверить, что к ней нужно припасти не только зимнее шины. Отопительная система само-собой, но самое главное, чтоб электрика работала стабильно, а это уже зависит от источника питания. В теплое время года уровень электролита в автомобильном аккумуляторе то и дело снижается. Поэтому если вы проигнорировали процедуру доливки тогда, самое время к ней приступить сейчас! Так давайте сегодня, и обсудим практически единственный процесс обслуживания авто батареи, а с ней и все сопутствующие нюансы!
Если вдруг, это будет ваша первая стужа за баранкой, хочу вас уверить, что к ней нужно припасти не только зимнее шины. Отопительная система само-собой, но самое главное, чтоб электрика работала стабильно, а это уже зависит от источника питания. В теплое время года уровень электролита в автомобильном аккумуляторе то и дело снижается. Поэтому если вы проигнорировали процедуру доливки тогда, самое время к ней приступить сейчас! Так давайте сегодня, и обсудим практически единственный процесс обслуживания авто батареи, а с ней и все сопутствующие нюансы!
Источник энергии аккумулятора – электролит
Новички в автомобильной сфере часто приходят в недоумение, они знаю, что жидкость в батареи – это опасная для человека кислота. «Но ведь заливается в нее обычная дистиллированная вода, как так происходит» – спрашивают они? Все очень просто друзья, если вы входите в эту группу любознателей, я поясню. Дело вот в чем, рассуждай так, от глаз ускользает один нюанс, при покупке источника питание – в нем уже есть жидкость, то бишь электролит. Состоит он всего из двух компонентов:
Состоит он всего из двух компонентов:
- Серная кислота;
- Дистиллированная вода.
По сути свойства у дистиллированной воды такие же, как и у обычной, да она состоит исключительно из водорода и кислорода, но все также испаряется. Из этого следует, что заводской микс из описанных компонентов со временем теряет одного из них (Н
На заметку! За отсутствие в своем составе не только органических веществ, но и неорганических, дистиллированную воду в народе прозвали – мертвой…
Плотность электролита в аккумуляторе автомобиля должна находиться в диапазоне от 1.07 до 1.30 г/см3 при температуре +15 градусов. В обратном случае качество выдаваемой энергии от батареи заметно снизится, проработает такой агрегат недолго! Если вы вовремя установили неисправность быть может ремонт аккумулятора автомобиля еще возможен, обо всем этом я с вами уже говорил в прошлых публикациях.
Доливка – что, к чему
Так вот, это только кажется, что просто подлил водички и дело сделано, но тут без определенных знаний не обойтись, конечно если есть желание сделать все по фен Шую. Какой должен быть точный уровень жидкости внутри аккумулятора знает не каждый автолюбитель, а это ведь играет ключевую роль в долговечности агрегата. Мы привыкли лить на глаз, в таком случае могут быть проблемы:
- Ниже уровня – высыхание внутренних пластин, которое приводит к существенной потери мощности батареи, а со временем и вовсе к ее поломке.
- Выше – испорченный кислотой корпус и соответственно быстрая саморазрядка аккумулятора, в худшем случае «накроется» регулятор напряжения.
Запомнить, какой должен быть уровень, некоторым оказывается вовсе не просто. Да господи, товарищи, этого делать и ненужно! Каждый современный аккумулятор имеет соответствующие метки. Просто будьте внимательны и самое главное вовремя определите надобность доливки, то есть – следите за индикатором.
В большинстве случаев красный цвет на нем свидетельствует о недостатке жидкости в источнике питания, незаряженный (как зарядить АКБ узнаете здесь) – белый, норма – зелёный.
3 основных способа определения уровня электролита
Ваш покорный слуга насчитал целых три простых метода, которые помогут установить фактический уровень электролита в автомобильном аккумуляторе, обсудим их.
Способ №1
Магический глаз – глазок, присутствует практически на всех современных АКБ, причем как отечественных (Исток, Титан, Зверь), так и буржуйских типа Multu. Зачастую определить цвет является не такой уж простой затее, чтобы у вас все вышло, просто легонько постучите по «глазу» и вы, увидите оттенок намного четче благодаря появившимся пузырькам.
Способ №2
Встроенная шкала – присутствует далеко не на всех батареях, но на некоторых моделях тех же Мутлу или Акома, встретить такой атрибут можно. Как пользоваться думаю рассказывать не нужно, все как на обычной канистре.
Способ №3
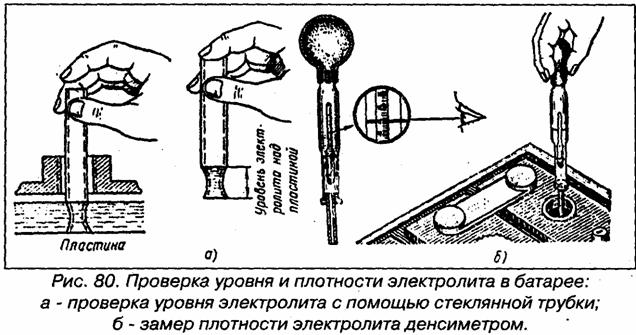
Креативный – если ни один вышеописанный метод вам не подходит, тогда есть еще один довольно хитрый способ. Чтобы с его помощью установить уровень, вам потребуется стеклянная трубочка небольшой высоты. Опустив одну ее сторону в любую банку (до конца!), другую закрываем пальцем и извлекаем из батареи. Если в трубочке высота жидкости составляет 10-15 мм, все в порядке, доливка не требуется!
Как правильно повысить плотность электролита
Вот такой аккумулятор как на фото, был, когда-то и у меня такой, марки Titan или Тюмень и не вспомнить уже. Так вот, с помощью ареометра я установил, что плотность жидкости в некоторых банках низкая. Разумеется, решил выровнять это значение, Первое, что узнал – нужно проверять плотность электролита в каждой банке и неважно зима за окном или лето. Оптимальным значением считается 1.25-1.29 г/см3, а разница показателей во всех банках не должна разница более чем в 0.1%.
Вооружившись спринцовкой из каждой емкости, я выкачал раствор, измерил объем и добавил аналогичное количество свежего электролита. Далее, по стандарту хорошенько прокачал АКБ для лучшего смешивания нового со старым раствором. В моем случае, показатели плотности выровнялись, если же у вас не так, повторяйте все снова, до тех пор, пока не установится оптимальное значение.
Далее, по стандарту хорошенько прокачал АКБ для лучшего смешивания нового со старым раствором. В моем случае, показатели плотности выровнялись, если же у вас не так, повторяйте все снова, до тех пор, пока не установится оптимальное значение.
Обратите внимание: если плотность упала намного ниже критических 1.18 г/см3, электролит следует заменить кислотой высокой плотности, процедуру проводить по той же схеме.
Подробно как повысить плотность электролита в автомобильном аккумуляторе рассказывается в видео под статьей, из него вы узнаете, как правильно выполнить процедуру. Скажу одно, понадобится зарядка! Оптимальный вариант – импульсные зарядные устройства, сегодня их можно купить весьма недорого. У меня же на этом все, стабильного вам заряда батареи зимой и летом, под нагрузкой и без нее! До скорого!
Проверка и замер плотности в АКБ » НаДомкрат
В принципе, аккумулятор – это вещь простая. Не требующая хлопотного обслуживания, но только в том случае, если вы эксплуатируете свое авто стандартно. Долгие поездки по трассе, частое зажигание, перепады температуры – все это влияет на уровень электролита в аккумуляторе, и его необходимо периодически проверять.
Работа АКБ
Работа аккумулятора (или сокращенно АКБ) будет отлаженной, если помнить о времени его службы. Сейчас делают такие АКБ, которые изживают себя и требуют замены. По идее, единственное, что важно – это периодически заряжать его и следить за уровнем электролита. Сроки службы АКБ продлеваются в том случае, если само устройство это предполагает. Например, за аккумуляторе находятся пробочки отсеков электролитосодержащих емкостей, что позволяет его туда долить. Если пробок нет, то на устройстве есть специальный индикатор, который оповещает о состоянии АКБ – тусклый зеленый или вовсе белый его цвет говорят о том, что девайс умер.
Электролит – это жидкость, создающая особую среду, которая накапливает и раздает электроэнергию посредством химических реакций. По сути, это раствор Н2SO4 в Н2О (концентрат серной кислоты в дистиллированной воде).
По сути, это раствор Н2SO4 в Н2О (концентрат серной кислоты в дистиллированной воде).
Сама кислота (максимально концентрированная) – достаточно плотное вещество, 1,84 г/см³, электролит – это 1,40 г/см³. когда серная кислота взаимодействует с водой, то выделяется много тепла. Если взять некачественную серную кислоту, можно запороть АКБ.
Важно знать, что плотность смеси серной кислоты и воды в аккумуляторе должна варьироваться от 1,07 до 1,30 г/см³! Если плотность выше или ниже допустимых границ – АКБ будет работать некачественно и не долго. Температура такой жидкости +15°С.
Причины нарушений в аккумуляторе:
- АКБ может закипеть; если температура резко повысится, одна из составляющих электролита – вода – просто испариться.
- Генератор может барахлить, напряжение будет прыгать, чем поспособствует неправильной циркуляции электроэнергии в устройстве зарядки авто.
- АКБ может разрядиться, особенно, в случае долгого простоя машины.

Проверка уровня электролита в АКБ – это очень важная процедура. Потому как слишком низкий его уровень высушит внутренние пластины, ячейки соединяться и аккумулятор накроется. А если уровень слишком высокий, то выходы на генератор могут окислиться и вывести из строя всю систему разом и надолго.
Проверка уровня электролита в аккумуляторе
Определить концентрат необходимой жидкости можно двумя способами:
- По пробкам ячеек,
- На глаз (по магическому глазу).
Глазок АКБ
Если говорить о магическом глазе – то это не совсем точная диагностика, требующая дополнительной проверки. Нужно аккуратненько постучать по нему (по этому глазу) и посмотреть, как поднимутся пузырьки воздуха. Вы увидите индикатор цвета четче, и тут же используете ваши аналитические способности: Зеленый – норма, Белый – требуется подзарядка, Красный – пора долить воды, кислота повысилась. Бывают и другие расцветки, но эти самые распространенные в РФ.
Хорошо, если на корпусе зарядного устройства есть шкала с минимумом и максимумом. Тогда вы просто смотрите на уровень раствора и решаете, что делать.
Последний способ проверки пригодиться для уточнения первого и отсутствия возможности проверить вторым: берем стеклянную трубочку, отворачиваем одну из пробок на корпусе зарядки авто, толкаем внутрь до щитка предохранителя, затыкаем пробирку пальцем, вытаскиваем наружу. В трубке будет электролит, если он от 10 до 15 миллиметров – все в порядке.
Замер уровня электролита трубочкой
Какой уровень электролита должен быть в автомобильном аккумуляторе?
Ареометр
Как уже было сказано, допустимая норма этого важного раствора колеблется в переделах 12 и 15 миллиметрами. Лишний электролит можно выцедить при помощи подручных средств – обычного медицинского шприца или спринцовки. Не хватает – льем воду. Только не надо доливать водой из-под крана! Вы сразу загубите свое зарядное. Вода, во-первых, должна быть обязательно дистиллированной, а, во-вторых, ее температура должна быть в пределе от +15 до +25°С. Заливать воду следует в специальное отверстие – заливное горлышко – до предела нижнего торца тубуса. Залили – поставьте на зарядку часа на три-четыре, а после советуем проверить плотность получившейся жидкости, чтобы уровень серной кислоты соответствовал допустимой норме. Допустимая норма – это 1,27-1,29 г/см3. Измеряется прибором под названием ареометр.
Заливать воду следует в специальное отверстие – заливное горлышко – до предела нижнего торца тубуса. Залили – поставьте на зарядку часа на три-четыре, а после советуем проверить плотность получившейся жидкости, чтобы уровень серной кислоты соответствовал допустимой норме. Допустимая норма – это 1,27-1,29 г/см3. Измеряется прибором под названием ареометр.
Вопрос, как измерить уровень электролита в аккумуляторе, не является первым и важным. На ряду с ним стоит второй, касающийся его плотности. Если вы недолили воды – дело за малым, просто долейте еще, а в случае излишней разбавки понадобится корректирующий
Как проверить электролит в аккумуляторе?
При обучении вождению будущих автомобилистов учат не только тому, как управлять автомобилем, но и из чего он состоит. Чтобы ваш «железный конь» работал как часы, нужно иметь хотя бы минимум знаний по обслуживанию и ремонту автомобиля. Сегодня мы поговорим о том, как проверить электролит в аккумуляторе.
Сегодня мы поговорим о том, как проверить электролит в аккумуляторе.
На что влияет уровень электролита?
Автоинструкторы считают, что аккумулятор не требует технического обслуживания, но только в том случае, если он используется при стандартных условиях. Это правильное мнение, но при длительных поездках и при воздействии высоких температур специалисты советуют время от времени контролировать уровень электролита, находящегося в аккумуляторе. Если, конечно, у вас обслуживаемая батарея.
В первую очередь отметим, что электролит состоит из кислоты и дистиллированной воды, то есть вода способна испаряться, например, при высоких температурах.
Если уровень электролита очень низкий, то из-за высыхания внутренних пластинок он теряет свою мощность. А это в последствии приведет к плотному соединению ячеек.
И, наоборот, в случае слишком высокого уровня электролита, излишняя кислота повредит (причем довольно сильно) внешнюю часть аккумулятора. Другие причины неполадок из-за ненадлежащего уровня электролита это:
Другие причины неполадок из-за ненадлежащего уровня электролита это:
- саморазрядка, то есть при длительной стоянке машины или из-за высокого потребления тока;
- поломка регулятора напряжения, который стоит в генераторе.
Так что надлежащий уровень электролита — это залог нормального функционирования аккумулятора и машины в целом.
Процедура проверки электролита аккумулятора
Проверить электролит можно двумя способами. Первый — это по максимальной и минимальной отметке, то есть уровень жидкости можно увидеть невооруженным глазом, так как корпус аккумулятора с отметками, как правило, прозрачный. Если уровень находится между отметкой MAX и MIN, то всё в порядке.
Если этих отметок нет, то существует второй способ. Для начала нужно подготовить стеклянную трубочку, где внутренний диаметр не превышает 5 мм.
Далее откручиваем крышку на аккумуляторе и опускаем трубку внутрь, пока она не упрется в предохранительный щиток.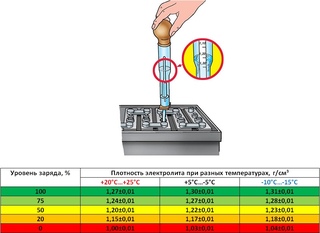 Наружное отверстие закрывается пальцем. Затем вытаскиваем трубку. Уровень электролита в ней и есть замеряемый уровень.
Наружное отверстие закрывается пальцем. Затем вытаскиваем трубку. Уровень электролита в ней и есть замеряемый уровень.
Оптимальное значение электролита в аккумуляторе
Считается, что нормальное значение электролита в аккумуляторе должно быть между 10 и 15 миллиметрами. Если полученное значение находится в данном диапазоне, то ваш аккумулятор в порядке и делать с ним ничего не нужно.
Но если значение превышает допустимое, то есть имеется лишняя жидкость, ее можно удалить с помощью груши или шприца. В случае нехватки электролита доливается дистиллированная вода.
Помните, что воду из-под крана заливать нельзя, в противном случае аккумулятор просто разрядится. Температура дистиллированной воды должна быть 15-25 градусов.
Кстати, при работе с электролитом соблюдайте повышенные меры безопасности. Во время осмотра аккумулятора всегда надевайте резиновые перчатки, чтобы кислота не попала на кожу рук из-за чего можно получить ожог. Если же жидкость все же пролилась на незащищенные руки, то как можно быстрее смойте ее проточной водой.
Если же жидкость все же пролилась на незащищенные руки, то как можно быстрее смойте ее проточной водой.
Видеоматериал о том, как проверить уровень и плотность электролита в аккумуляторе:
Удачи за рулем и счастливого пути!
В статье использовано изображение с сайта autotuningnews.ru
Условия эксплуатации автоаккумуляторов
1. Указание мер безопасности.
1.1. Заряд батареи производите в помещении, оборудованном приточно-вытяжной вентиляцией.
1.2. Во время заряда и обслуживания аккумуляторных батарей запрещается курить и пользоваться открытым пламенем.
1.3. Для приготовления электролита применяйте стойкую к действию серной кислоты посуду (керамическую, эбонитовую, освинцованную), в которую заливайте сначала воду, а затем при непрерывном помешивании серную кислоту. Вливать воду в концентрированную серную кислоту запрещается во избежание несчастного случая.
Вливать воду в концентрированную серную кислоту запрещается во избежание несчастного случая.
1.4. При приготовлении электролита и заливке батарей надевайте очки, резиновые перчатки, резиновые сапоги, фартук или костюм из кислотостойкого материала.
1.5. При случайном попадании брызг серной кислоты на кожу немедленно, до оказания медицинской помощи, осторожно снимите кислоту ватой, промойте пораженные места обильной струей воды и затем 5% раствором кальцинированной соды или аммиака.
1.6. При работе с металлическим инструментом не допускайте коротких замыканий одновременным прикосновением к разнополярным выводам аккумулятора.
2. Приведение в рабочее состояние сухозаряженных аккумуляторов.
2.1. Снять блок пробок.
2.2. Залить батарею электролитом.
2.3. Залить каждый элемент до требуемого уровня электролитом (метки уровня указаны на тыльной стороне АКБ), имеющим плотность при температуре 25 С: (1,28+-0,01) г/см3 для батарей «нормального исполнения», (1,23+-0,01) г/см3 для батарей «тропического исполнения».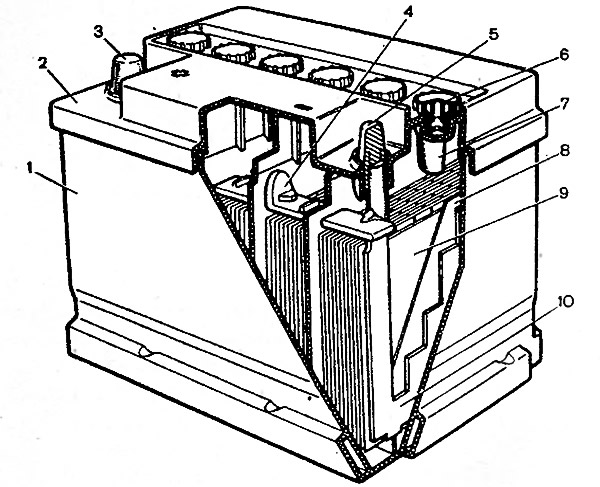
2.4. Электролит для заливки батарей готовьте из серной кислоты (ГОСТ667-73 сорт высший или первый) и дистиллированной воды (ГОСТ 6709-72). Плотность электролита измеряйте ареометром аккумуляторным ГОСТ 18481-81.
2.5. Температура электролита должна быть не выше 30 С. Не рекомендуется заливать батареи электролитом ниже 15 С.
Примечание: при повышении температуры на 1 С, плотность электролита уменьшается на 0,0007 г/куб.см, а при понижении температуры плотность увеличивается. Исходной считается температура 25 С.
Операции приведения в рабочее состояние должны производиться при температуре 25 +/- 10 С.
После заливки электролита через 20 минут проверить напряжение батареи без нагрузки. Если напряжение не менее 12.5 вольт, АКБ готова к работе. Если напряжение менее 12.5 вольт, но более 10.5 вольт АКБ необходимо подзарядить до напряжения, указанного изготовителем. При напряжении менее 10,5 вольт аккумулятор бракуется.
3. Заряд батареи.
3.1. Присоединить батарею к источнику постоянного тока, соединяя положительный полюсной вывод с положительным зажимом источника и аналогично, отрицательный полюсной вывод с отрицательным зажимом источника тока.
3.2. Заряжать током равным 10 % номинальной емкости батареи (5,5 А для 6СТ55, 6,6 А для 6СТ66 и т.д.).
3.3. Время зарядки ориентировочно до начала газовыделения. Плотность электролита после зарядки должна быть 1.27+/-0,01 г/куб.см, напряжение на клеммах не ниже 12,6 вольт.
4. Приведение в рабочее состояние залитых батарей.
Измерить плотность и напряжение, которые должны быть не ниже 1,27 г/куб. см и 12,6 вольт соответственно.
Если напряжение и плотность не соответствуют указанным в п. 3.3., АКБ необходимо зарядить до плотности 1.27 г/куб.см.
4.1. Снять блок пробок.
4.2. Заряд АКБ производить согласно пункту 2.5.
5. Техническое обслуживание.
Не реже одного раза в две недели:
5.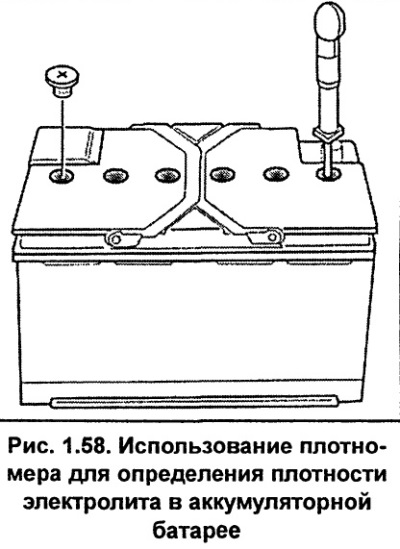 1. Проверяйте надежность крепления батареи в гнезде и плотность контакта наконечников проводов с выводами батареи, при необходимости снимите оксидную пленку с выводов.
1. Проверяйте надежность крепления батареи в гнезде и плотность контакта наконечников проводов с выводами батареи, при необходимости снимите оксидную пленку с выводов.
5.2. Чистите батарею от пыли и грязи. Попавший на поверхность батареи электролит вытирайте ветошью, смоченной в растворе аммиака или кальцинированной соды (10%). Прочистите вентиляционные отверстия.
5.3. При падении уровня электролита ниже отметки min на корпусе батареи доводите его до нормы дистиллированной водой непосредственно перед запуском двигателя для быстрого перемешивания с электролитом.
5.4. В зимнее время, особенно при температуре воздуха ниже -30 С, а также в случаях ненадежного запуска двигателя, периодически проверяйте плотность электролита. Не оставляйте на морозе частично разряженную батарею. При эксплуатации батареи при температуре ниже 30 С, плотность электролита в ней должна быть 1.30 г/куб.см.
5.5. Периодически следите за тем, как происходит зарядка батареи во время работы двигателя автомобиля.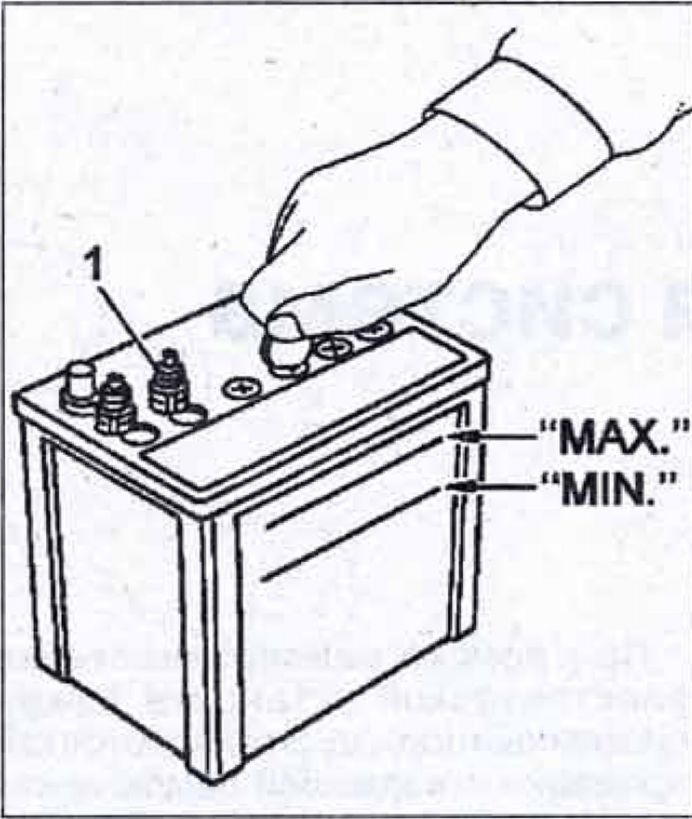
Примечание: Неисправности в реле-регуляторе двигателя автомобиля влияют на качество и работоспособность батареи. Если напряжение генератора будет чрезмерно, высоким может произойти перезаряд батареи. Признаками этого являются: преждевременное разрушение аккумуляторных пластин (электродов) и, как следствие, быстрое уменьшение фактической емкости батареи и сокращение срока ее службы. При перезарядке резко снижается уровень электролита. Недостаточное напряжение генератора, особенно при эксплуатации при низких температурах, может привести к недозарядке батареи и ухудшению ее стартерных свойств. Напряжение, поступающее от генератора двигателя на аккумуляторную батарею должно быть 13,8-14,4 В.
5.6. Доливать электролит в батарею разрешается только в случае, если произошло его выплескивание из АКБ.
5.7. Пуск стартера производить короткими включениями, но не более чем на 15 секунд. Езда при помощи стартера не допускается.
5. 8. При перерывах в эксплуатации батареи свыше одного месяца производить подзарядку АКБ.
8. При перерывах в эксплуатации батареи свыше одного месяца производить подзарядку АКБ.
5.9. Батареи, временно снятые с машин хранить только в заряженном состоянии. Благоприятная температура хранения — от 0 С до — 10 С, но не ниже — 30 С.
5.10. Если батарея находится в периоде «бездействия» при положительных температурах необходимо заряжать ее раз в месяц, при отрицательных, только в случае, если падение плотности электролита более чем на 0,04 г/куб.см. В таком состоянии батареи могут находиться при положительных температурах не более 9 месяцев.
Особенности заряда кальциевых аккумуляторов
07.02.2020Что стоит знать о кальциевых аккумуляторах
Некоторые автолюбители считают, что пластины Са/Са аккумуляторов произведены из кальция, а не из традиционного свинца. Однако на самом деле это не так. Если бы пластины автомобильных аккумуляторов были изготовлены из кальция, то электрохимической реакции заряда — разряда от батареи мы бы просто не увидели.
Принцип действия, а также электрохимические реакции у кальциевых аккумулятором абсолютно идентичны традиционным свинцовым. Разница между ними — в наличии кальция, который в нормальных условиях не позволяет закипеть аккумулятору, а также способствует защите свинца от коррозии. (Под нормальными условиями подразумевается эксплуатация аккумулятора в автомобиле, где он заряжается под напряжением примерно в 14,4 — 15 В, и, соответственно, не закипает).
Также, за счет добавления кальция, свинцовые пластины становятся более прочными, что положительно влияет на срок службы. Благодаря технологии Са/Са, стало возможным делать более тонкие пластины (относительно пластин в свинцовых аккумуляторах). За счет этого увеличились площади поверхностей пластин, что, в свою очередь повлияло на рост так называемых пусковых токов.
За счет этого увеличились площади поверхностей пластин, что, в свою очередь повлияло на рост так называемых пусковых токов.
Итог: аккумуляторы изготовленные по технологии Са/Са и Pb/Cа рассчитаны на эксплуатацию в автомобилях с напряжением бортовой сети до 15 В. При этом аккумулятор нормально заряжается, не кипит, ток саморазряда ниже, по сравнению с традиционными АКБ.
Кипение аккумулятора и повреждение пластин происходит при более высоких напряжениях, которых на исправном автомобиле не возникает.
Из свойств кальциевых аккумуляторов следует вывод — они проще в обслуживании и дольше сохраняют заряд.
Как правильно заряжать аккумулятор Са/Са
- Если аккумулятор в вашем автомобиле не заряжается до конца (причины могут быть различными: низкие температуры на улице, короткие и нечастые поездки, проблемные генератор и т. д.), необходимо заряжать его с помощью обычного зарядного устройства
- Напряжение заряда должно быть в диапазоне 14,4-15В
- Ток заряда должен составлять не более 10 % от емкости вашего аккумулятора
- Алгоритм заряда «CC/CV» стандартный для свинцово кислотных аккумуляторов; заряд постоянным током до порогового напряжения, затем заряд постоянным напряжением с понижением тока заряда.

- Категорически противопоказано «кипячение» кальциевым АКБ. Так как в лучшем случае оно приводит к снижению технических характеристик прибора, а в худшем — к выходу устройства из строя.
- Чтобы добиться более «плотного» заряда, лучшего растворения сульфатов и увеличения ресурса, необходимо производить заряд аккумулятора с наименьшим значением тока.
Сейчас на рынке появилось множество подделок. Чтобы отличить качественную АКБ от подделки, а также понять оригинальное устройство перед нами или нет — нужно обратить внимание на маркировку. На корпусе аккумулятора должны быть указаны следующие характеристики:
- стартовый ток
- значение напряжения
- значение номинальной емкости
- дата выпуска данного устройства
- подробная информация о производителе
Преимущества кальциевых аккумуляторов
- Длительный срок эксплуатации. При правильной эксплуатации срок службы кальциевого аккумулятора, в среднем, составляет около пяти лет.
- Низкий уровень саморазряда. В сравнении с малосурьмянистыми разновидностями аккумуляторов, характеристика кальциевых аккумуляторов ниже почти на 70 процентов.
- Повышенная прочность пластин АКБ. Что позволяет пластинам быть устойчивым к вибрациям.
- Снижение интенсивности коррозионных процессов. Это увеличивает срок службы АКБ.
- Кальциевые аккумуляторы оснащены защитой от перезаряда. Характерно свойство выдерживать напряжение до 14,8 В.
- Большинство кальциевых аккумуляторов (около 90 процентов) — необслуживаемые.
- Возможно изготовление пластин меньшей толщины. У производителей есть возможность выпускать аккумуляторы с увеличенным количеством пластин, что влияет на мощность — она становится больше.
- Прекрасный вариант для начинающих автомобилистов.
 Как мы уже говорили, в большинстве случаев, автомобильный аккумулятор Са/Са является необслуживаемым. Что позволяет водителю не проводить дополнительные действия, такие как измерение уровня и плотности электролита.
Как мы уже говорили, в большинстве случаев, автомобильный аккумулятор Са/Са является необслуживаемым. Что позволяет водителю не проводить дополнительные действия, такие как измерение уровня и плотности электролита.
Аккумуляторы такого вида идеально подходят для установки в автомобили с полностью исправным электрооборудованием. Желательно, чтобы в транспортном средстве присутствовали системы, которые самостоятельно могут отключать музыку, габаритные огни, свет, в том случае, когда автомобилист забыл сделать это сам.
Недостатки кальциевых АКБ.
К сожалению, в нашей жизни не существует идеальных вещей. Поэтому и кальциевые аккумуляторы также имеют некоторый ряд недостатков.
- Чувствительность к глубоким разрядам. Это главное отличие кальциевых батарей от их гибридных и сурьмянистых аналогов. Кальциевые аккумуляторы крайне не рекомендуется разряжать ниже напряжения в 12 В. Всего лишь при одном глубоком разряде такая АКБ потеряет пятую часть своей емкости.
 При однократном полном разряде батарея лишается половины емкости, в то время как устройство, которое пережило 9 -10 разрядов, становится абсолютно непригодным к эксплуатации.
При однократном полном разряде батарея лишается половины емкости, в то время как устройство, которое пережило 9 -10 разрядов, становится абсолютно непригодным к эксплуатации. - Достаточно высокая стоимость. Что обусловлено дорогим, а также сложным процессом производства.
- Не подходит для режима передвижений в «городском стиле». Длительные простои, в случае, если автомобилем пользуются нечасто и на короткие дистанции, негативно, и даже губительно влияют на кальциевые аккумуляторы.
Заметим, что кальциевые аккумуляторные батареи подходят только для использования в автомобилях. Советуем воздержаться от установки таких устройств в катер или лодку (там они могут подвергнуться глубокому разряду).
Неправильно — «правильная» зарядка кальциевых АКБ
Предположим, что у нас есть кальциевая АКБ. Подаем на нее стандартные 14,4 В и дожидаемся, пока ток, потребляемый батареей, не понизится до 0,1 А (вспоминаем, что это один из признаков, что аккумулятор зарядился). Далее отключаем зарядное устройство и измеряем плотность электролита. Плотность, при заряженном аккумуляторе, должна быть 1,27, однако при измерении мы не видим этой цифры. Что же делать? В интернет многие советуют в таком случае заряжать кальциевые АКБ напряжением 16,1 — 16,5 В. Давайте разберемся, что же будет, если мы последуем этим советам.
Далее отключаем зарядное устройство и измеряем плотность электролита. Плотность, при заряженном аккумуляторе, должна быть 1,27, однако при измерении мы не видим этой цифры. Что же делать? В интернет многие советуют в таком случае заряжать кальциевые АКБ напряжением 16,1 — 16,5 В. Давайте разберемся, что же будет, если мы последуем этим советам.
При зарядке таким напряжением, плотность все же повысится, как мы и хотели. Однако подав такое напряжение мы спровоцировали то самое кипение, с которым борется производитель.
В современных батареях реагирует преимущественно тот электролит, который находится в конвертах. Однако тот, который мы втянули ареометром, находится за пределами зоны электрохимической реакции, из чего делаем вывод, что плотность этого электролита совершенно не должна повышаться в одно время с зарядом батарее.
При подаче на клеммы 16 В — электролит на конвертах начинает «кипеть», благодаря чему он начал интенсивно смешиваться с тем, что находится над пластинами. Это и есть единственная причина того, что после повторного замера мы увидели плотность 1,27. Хотя эта плотность и так уже была достигнута внутри конвертов. В то время как мы кипятили АКБ, пластины деградировали, теряя часть свинца.
Это и есть единственная причина того, что после повторного замера мы увидели плотность 1,27. Хотя эта плотность и так уже была достигнута внутри конвертов. В то время как мы кипятили АКБ, пластины деградировали, теряя часть свинца.
Предположим, мы все-таки зарядили кальциевую батарею методом из интернета и установили ее на автомобиль. Что же произойдет дальше? После первого запуска заряд, который был накоплен «кипячением», тратится на работу стартера. А далее АКБ подзаряжается под напряжением 14,5 В.
Подводя итоги
Чтобы правильно выбрать АКБ, которая подходит для вашего конкретного автомобиля, необходимо учитывать следующие параметры:
- совместимость аккумулятора с Вашей моделью транспортного средства
- условия и интенсивность эксплуатации
 orionspb.ru/
orionspb.ru/ Кальциевые аккумуляторы больше подходят автомобилистам, которые ездят часто и на дальние расстояния, а также предпочитают высокое качество езды. При своевременной подзарядке устройство будет эксплуатироваться в течение долгого времени — в течение срока, заявленного производителем и даже дольше.
Видео на тему:
Больше нет утечки взрывоопасных электролитов в аккумуляторах
Это изображение упругого поведения цилиндрического монолита гелевого электролита на основе 2 мас. % PVA-CN в 1 M LiPF6 в 1: 2 (об.) EC: EMC в качестве основного жидкого электролита. Кредит: UNIST (Phys.org) — исследовательская группа из Ульсанского национального института науки и технологий (UNIST), Южная Корея, обнаружила новый физический электролит на органогеле с двумя уникальными характеристиками: необратимое термическое гелеобразование и высокое значение числа переноса Li +. .
.
Недавний пожар на Боинге 787 на земле в Бостоне, США, был вызван отказом аккумуляторной батареи, в результате которого произошел выброс легковоспламеняющихся электролитов, тепловое повреждение и дым. Если бы они использовали более безопасный электролит, риск был бы снижен.
Электролиты — важные компоненты суперконденсаторов, батарей и топливных элементов. Наиболее широко используемый электролит представляет собой жидкий тип электролита, поскольку его общая ионная проводимость и величина чисел переноса лучше, чем у твердотельных электролитов.Однако проблемы безопасности, вызванные его утечкой и взрывоопасным характером, вызвали широкую потребность в исследованиях по разработке твердого электролита.
Для замены жидких электролитов срочно необходима разработка твердотельных электролитов, защищенных от взрыва, вызванного высокой температурой и перезарядкой. Твердый электролит делает батареи более безопасными, а также позволяет использовать электродные материалы с более высокой энергией.
Наиболее важным параметром электролитов, используемых в электрохимических ячейках, является ионная проводимость.Использование твердотельных электролитов было ограничено из-за низкой ионной проводимости, вызванной их неподвижной матрицей, независимо от их собственных достоинств, таких как отсутствие утечек, нелетучие, механическая прочность и технологическая гибкость.
Еще один параметр, который следует учитывать, — это перенос количества ионов. Электролиты характеризуются своей ионной проводимостью. Желательно, чтобы общие ионные свойства были обусловлены преобладающим вкладом представляющих интерес ионов. Однако высокие значения числа катионного переноса, достигаемые твердыми или гелевыми электролитами, привели к низкой ионной проводимости, что привело к ухудшению рабочих характеристик элемента.
Коллектив проф. Хюн-Кон Сонг и Ноеджунг Пак из UNIST представили полимерный электролит на органогеле, характеризующийся высокой ионной проводимостью на уровне жидкого электролита с высоким числом катионного переноса для литий-ионных аккумуляторов (LIB).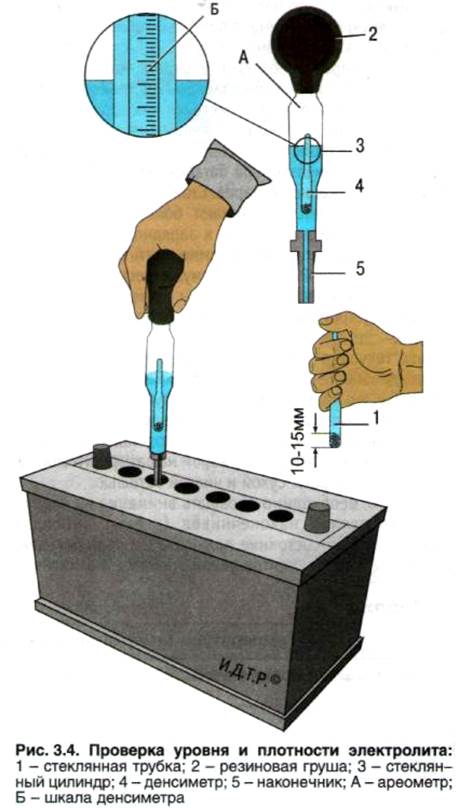
Исследовательская группа приобрела два требуемых свойства одновременно в полимерно-гелевых электролитах: проводимость на уровне жидкого электролита с высоким числом переноса. Цианоэтилполивиниловый спирт (PVA-CN) играл ключевую роль в высокопроводящем гелевом электролите, в то время как другая циано-смола, Cyanoethlyle pullulan (Pullulan-CN), использовалась в качестве контроля, представляющего жидкий электролит, содержащий цианоцепи.Жидкий электролит, содержащий ПВС-ХН, подвергался термическому гелеобразованию даже без каких-либо химических сшивающих агентов или инициаторов полимеризации.
Хён-Кон Сон и Ноэджунг Пак, профессора Междисциплинарной школы зеленой энергии, UNIST, Южная Корея, возглавили эту работу. Среди соавторов: Ён-Су Ким, Юн-Гё Чо и Дори Одхуу из UNIST.
«Мы считаем, что этот новый тип электролитического геля обеспечивает нам гибкость конструкции устройств, а также повышает безопасность и стабильность электрохимических устройств», — сказал проф. Песня.
Песня.
В Южной Корее появились новости о гибких батареях, повторяющих форму
Дополнительная информация: Научные отчеты 3, Номер статьи: 1917 doi: 10.1038 / srep01917 Предоставлено Ульсанский национальный институт науки и технологий
Ссылка :
Больше никаких утечек взрывоопасных электролитов в батареях (2013, 27 июня)
получено 22 декабря 2020
с https: // физ. org / news / 2013-06-утечка-взрывчатые-электролиты-батареи.html
org / news / 2013-06-утечка-взрывчатые-электролиты-батареи.html
Этот документ защищен авторским правом. За исключением честных сделок с целью частного изучения или исследования, нет часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в информационных целях.
границ | Новые твердые электролиты для литий-ионных аккумуляторов: перспективы исследований электронной микроскопии
Введение
В связи с исчерпанием ископаемых видов топлива в последние годы большое внимание уделяется высокопроизводительным накопителям энергии (Quartarone and Mustarelli, 2011; Bruce et al., 2012). Хотя литий-ионный аккумулятор (LIB) является очень многообещающим альтернативным источником энергии, проблемы с безопасностью и недостаточная плотность энергии препятствовали его применению в тяжелых условиях, например, в электромобилях и накопителях энергии в сети (Quartarone and Mustarelli, 2011; Bruce и др. , 2012). К счастью, эти проблемы можно решить путем интеграции новых твердых электролитов (Quartarone and Mustarelli, 2011; Takada, 2013; Wang et al., 2015). С одной стороны, эти твердые материалы обычно негорючие и не имеют утечки, что позволяет обойти проблемы безопасности, связанные с традиционными органическими жидкими электролитами.Это необходимое условие для крупномасштабного применения. С другой стороны, также можно эффективно улучшить плотность энергии. Гораздо большее электрохимическое окно позволяет использовать современные электродные материалы, несовместимые с обычными жидкими электролитами. Кроме того, исключая необходимость в громоздких предохранительных механизмах, можно значительно уменьшить размер батареи. Благодаря этим преимуществам твердые электролиты в последние годы вызывают огромный интерес.
, 2012). К счастью, эти проблемы можно решить путем интеграции новых твердых электролитов (Quartarone and Mustarelli, 2011; Takada, 2013; Wang et al., 2015). С одной стороны, эти твердые материалы обычно негорючие и не имеют утечки, что позволяет обойти проблемы безопасности, связанные с традиционными органическими жидкими электролитами.Это необходимое условие для крупномасштабного применения. С другой стороны, также можно эффективно улучшить плотность энергии. Гораздо большее электрохимическое окно позволяет использовать современные электродные материалы, несовместимые с обычными жидкими электролитами. Кроме того, исключая необходимость в громоздких предохранительных механизмах, можно значительно уменьшить размер батареи. Благодаря этим преимуществам твердые электролиты в последние годы вызывают огромный интерес.
Однако, прежде чем твердые электролиты можно будет использовать в коммерческих батареях, необходимо решить две большие проблемы.Во-первых, их ионная проводимость, как правило, низкая, что предотвращает быструю зарядку и разрядку (Takada, 2013; Wang et al. , 2015). Во-вторых, сложно сформировать стабильную проводящую поверхность раздела между твердым электролитом и электродом (Zhu et al., 2015 и 2016; Richards et al., 2016). Преодоление первой проблемы требует механистического понимания взаимодействия между миграцией Li и атомной структурой материала. Для решения второй задачи сначала необходимо систематически установить корреляцию между структурой интерфейса / химией и ионным транспортом.Очевидно, что обе задачи требуют структурного и химического анализа со сверхвысоким пространственным разрешением.
, 2015). Во-вторых, сложно сформировать стабильную проводящую поверхность раздела между твердым электролитом и электродом (Zhu et al., 2015 и 2016; Richards et al., 2016). Преодоление первой проблемы требует механистического понимания взаимодействия между миграцией Li и атомной структурой материала. Для решения второй задачи сначала необходимо систематически установить корреляцию между структурой интерфейса / химией и ионным транспортом.Очевидно, что обе задачи требуют структурного и химического анализа со сверхвысоким пространственным разрешением.
Просвечивающая электронная микроскопия (ПЭМ), в первую очередь сканирующая просвечивающая электронная микроскопия с коррекцией аберраций (STEM), является идеальным инструментом для получения критически важных данных на атомном уровне. Он не только способен непосредственно визуализировать атомные конфигурации, но также может прояснять химическую информацию с пространственным разрешением суб-ангстрема с использованием спектроскопии потерь энергии электронов (EELS) и энергодисперсионной рентгеновской спектроскопии (EDS) (Pennycook, 1992; Muller et al. al., 2008; Chi et al., 2011; Ябуучи и др., 2011; Wu et al., 2015). Однако исследования твердых электролитов методом STEM создают многочисленные проблемы, поскольку высокая подвижность Li и плохая электронная проводимость делают эти материалы очень уязвимыми для повреждений электронным облучением (Egerton et al., 2004). К счастью, благодаря значительно улучшенным возможностям визуализации и подготовки образцов для ПЭМ, в последние годы эта проблема значительно уменьшилась. Некоторые светочувствительные материалы, которые ранее не могли быть изучены, теперь могут быть проанализированы в атомном масштабе (Ma et al., 2015), и многие из этих исследований внесли значительный вклад в исследования твердых электролитов.
al., 2008; Chi et al., 2011; Ябуучи и др., 2011; Wu et al., 2015). Однако исследования твердых электролитов методом STEM создают многочисленные проблемы, поскольку высокая подвижность Li и плохая электронная проводимость делают эти материалы очень уязвимыми для повреждений электронным облучением (Egerton et al., 2004). К счастью, благодаря значительно улучшенным возможностям визуализации и подготовки образцов для ПЭМ, в последние годы эта проблема значительно уменьшилась. Некоторые светочувствительные материалы, которые ранее не могли быть изучены, теперь могут быть проанализированы в атомном масштабе (Ma et al., 2015), и многие из этих исследований внесли значительный вклад в исследования твердых электролитов.
В настоящем мини-обзоре будут рассмотрены исследования с помощью электронной микроскопии трех важных факторов, определяющих поведение твердых электролитов: (1) влияние атомной конфигурации внутри зерна на ионную проводимость, (2) влияние границ зерен и (3) поведение твердого тела. границы раздела электролит – электрод. На основе этого будут обсуждены возможности, проблемы и перспективы будущих исследований.
границы раздела электролит – электрод. На основе этого будут обсуждены возможности, проблемы и перспективы будущих исследований.
Влияние внутренней атомной конфигурации зерна на ионную проводимость
Миграция Li внутри кристаллической решетки продиктована атомным каркасом, который формирует каналы для транспорта Li. Для объяснения ионного переноса внутри решетки требуется точное понимание атомной структуры. Обладая сверхвысоким пространственным разрешением и чувствительностью к тонким различиям в дифракции, (S) ПЭМ не только дополняет исследования рассеяния рентгеновских лучей и нейтронов, но также предоставляет уникальные возможности для понимания на атомном уровне.Недавние микроскопические исследования в основном были сосредоточены на двух системах: Li 7 La 3 Zr 2 O 12 (LLZO) и Li 3 x La 2 / 3− x TiO 3 (LLTO).
Li 7 La 3 Zr 2 O 12 в настоящее время является наиболее многообещающим оксидным твердым электролитом благодаря сосуществованию превосходной стабильности по отношению к металлическому Li и относительно высокой проводимости (Муруган и др., 2007; Кассен, 2010). Он кристаллизуется в структуре граната с двумя полиморфами (Cussen, 2010): кубической фазой с относительно высокой проводимостью (c-LLZO) и менее проводящей тетрагональной фазой (t-LLZO). Различение этих двух фаз имеет решающее значение для правильной интерпретации поведения ионного транспорта. Исследование прецессионной дифракции электронов (PED) Buschmann et al. (2011) успешно разграничили эти две фазы, избежав влияния двойной дифракции. Этот результат дополнительно подтвердил, что легирование алюминием имеет решающее значение для стабилизации кубической фазы.В сочетании с дифракцией нейтронов было обнаружено, что позиции Li в c-LLZO, в отличие от тех, что в t-LLZO, частично заполнены. Высокая концентрация вакансий в c-LLZO приводит к более высокой подвижности Li и превосходной проводимости. Помимо исследования PED, Buschmann et al. также пытались выполнить ПЭМ с высоким разрешением (ПЭМВР), но подробный анализ был невозможен из-за повреждения электронным пучком. Недавно эта проблема была успешно решена Ma et al. (2015). Тщательный выбор условий получения изображений и подготовки образцов позволил провести высококачественный анализ TEM / EELS с атомным разрешением (S) (рисунки 1A, B).Исследования Ма показали, что c-LLZO сохраняет свою кубическую кристаллическую структуру даже в водной среде с pH> 7. Такая высокая структурная стабильность указывает на то, что c-LLZO предлагает надежную атомную основу для транспорта Li. Учитывая высокую ионную проводимость, совместимость с литием и желаемую структурную стабильность по отношению к водным растворам с широким диапазоном значений pH, LLZO является многообещающим кандидатом в качестве сепаратора в новых водных литиевых батареях.
Высокая концентрация вакансий в c-LLZO приводит к более высокой подвижности Li и превосходной проводимости. Помимо исследования PED, Buschmann et al. также пытались выполнить ПЭМ с высоким разрешением (ПЭМВР), но подробный анализ был невозможен из-за повреждения электронным пучком. Недавно эта проблема была успешно решена Ma et al. (2015). Тщательный выбор условий получения изображений и подготовки образцов позволил провести высококачественный анализ TEM / EELS с атомным разрешением (S) (рисунки 1A, B).Исследования Ма показали, что c-LLZO сохраняет свою кубическую кристаллическую структуру даже в водной среде с pH> 7. Такая высокая структурная стабильность указывает на то, что c-LLZO предлагает надежную атомную основу для транспорта Li. Учитывая высокую ионную проводимость, совместимость с литием и желаемую структурную стабильность по отношению к водным растворам с широким диапазоном значений pH, LLZO является многообещающим кандидатом в качестве сепаратора в новых водных литиевых батареях.
Рисунок 1.(A) Атомная структура чувствительного к электронному лучу твердого электролита LLZO успешно визуализирована с помощью STEM-изображения в кольцевом темном поле с большим углом (HAADF). (B) Данные EELS LLZO после обмена Li + / H + с различными водными растворами. Содержание Li можно точно контролировать. Воспроизведено с разрешения (Ma et al., 2015).
Другой системой, которая широко исследовалась с помощью электронной микроскопии, является LLTO, имеющая структуру типа перовскита (Stramare et al., 2003). Изменяя состав и / или условия обработки, можно получить несколько полиморфов с разной ионной проводимостью. Несмотря на это, большинство из них демонстрируют чередующееся наложение между слоями A-сайта с высоким содержанием La и бедным по La, и миграции Li благоприятствуют слои с низким содержанием La. Наибольшая объемная проводимость составляет 10 −3 См · см −1 , что приближается к проводимости обычных жидких электролитов (10 −2 См · см −1 ) (Takada, 2013). Следовательно, глубокое понимание происхождения таких исключительных характеристик имеет решающее значение для разработки твердых электролитов с высокой проводимостью.Исследования (S) TEM внесли важный вклад в это дело. Воспользовавшись чувствительностью STEM-изображения кольцевого светлого поля (ABF) к легким элементам, таким как Li, Gao et al. (2013) непосредственно визуализировали вариацию положений Li в разных полиморфах LLTO. Было обнаружено, что Li находится у окна O4 для состава с низким содержанием Li La 0,62 Li 0,16 TiO 3 , но рядом с позицией A для состава с высоким содержанием Li La 0,56 Li 0,33 TiO 3 .Содержание Li, валентное состояние катионов и геометрия кислородных октаэдров в слоях, богатых La и бедных La, также были выявлены с помощью EELS. Кроме того, были исследованы доменные структуры, связанные с упорядочением между слоями, богатыми La и бедными La (Gao et al., 2014). Было обнаружено, что с La, блокирующим пути Li, доменные границы препятствуют ионному транспорту.
Следовательно, глубокое понимание происхождения таких исключительных характеристик имеет решающее значение для разработки твердых электролитов с высокой проводимостью.Исследования (S) TEM внесли важный вклад в это дело. Воспользовавшись чувствительностью STEM-изображения кольцевого светлого поля (ABF) к легким элементам, таким как Li, Gao et al. (2013) непосредственно визуализировали вариацию положений Li в разных полиморфах LLTO. Было обнаружено, что Li находится у окна O4 для состава с низким содержанием Li La 0,62 Li 0,16 TiO 3 , но рядом с позицией A для состава с высоким содержанием Li La 0,56 Li 0,33 TiO 3 .Содержание Li, валентное состояние катионов и геометрия кислородных октаэдров в слоях, богатых La и бедных La, также были выявлены с помощью EELS. Кроме того, были исследованы доменные структуры, связанные с упорядочением между слоями, богатыми La и бедными La (Gao et al., 2014). Было обнаружено, что с La, блокирующим пути Li, доменные границы препятствуют ионному транспорту. Помимо этого, также могут быть визуализированы структурные особенности, которые нельзя легко обнаружить дифракционными методами. Как упоминалось выше, транспорт Li в LLTO зависит от бедных La слоями.Однако ни одно из предыдущих дифракционных исследований не выявило таких важных особенностей в наиболее проводящем полиморфе, закаленном при 1350 ° C La 0,56 Li 0,33 TiO 3 (Stramare et al., 2003). В результате механизм его ионного транспорта долгие годы оставался неясным. Недавно исследование STEM с атомным разрешением напрямую визуализировало ранее не замеченные пути ближнего упорядочения Li в этом материале (Ma et al., 2016). Длина когерентности упорядочения оказалась на мезоскопическом масштабе (менее 10 нм), что не позволило обнаружить его большинством дифракционных методов.В сочетании с моделированием молекулярной динамики (МД) это наблюдение показало, что такая неуловимая мезоскопическая структура может наиболее эффективно максимизировать количество путей переноса лития, приводя к высокой проводимости.
Помимо этого, также могут быть визуализированы структурные особенности, которые нельзя легко обнаружить дифракционными методами. Как упоминалось выше, транспорт Li в LLTO зависит от бедных La слоями.Однако ни одно из предыдущих дифракционных исследований не выявило таких важных особенностей в наиболее проводящем полиморфе, закаленном при 1350 ° C La 0,56 Li 0,33 TiO 3 (Stramare et al., 2003). В результате механизм его ионного транспорта долгие годы оставался неясным. Недавно исследование STEM с атомным разрешением напрямую визуализировало ранее не замеченные пути ближнего упорядочения Li в этом материале (Ma et al., 2016). Длина когерентности упорядочения оказалась на мезоскопическом масштабе (менее 10 нм), что не позволило обнаружить его большинством дифракционных методов.В сочетании с моделированием молекулярной динамики (МД) это наблюдение показало, что такая неуловимая мезоскопическая структура может наиболее эффективно максимизировать количество путей переноса лития, приводя к высокой проводимости. Это открытие не только примирило давно существовавшее несоответствие структуры и свойств, но также указывало на новый взгляд на улучшение ионной проводимости.
Это открытие не только примирило давно существовавшее несоответствие структуры и свойств, но также указывало на новый взгляд на улучшение ионной проводимости.
Хотя ПЭМ с атомным разрешением (S) очень помог фундаментальному пониманию ионного транспорта, текущие исследования ограничиваются оксидами.Для сравнения, сульфидные твердые электролиты, несмотря на их более высокую проводимость (Takada, 2013), редко исследуются. Микроскопические исследования этих материалов чрезвычайно сложны из-за (1) уязвимости слабых связей Li – S для электронов и (2) их чувствительности к окружающей атмосфере. Если эти проблемы могут быть устранены, (S) ТЕА будет играть еще более важную роль в исследовании твердых электролитов.
Воздействие границ зерен
Хотя исследования твердых электролитов в основном сосредоточены на внутренней части зерен, границы зерен часто являются узким местом.Хотя объемная проводимость многих твердых электролитов уже сравнима с проводимостью обычных жидких электролитов, их большое сопротивление границ зерен обычно снижает общую проводимость на порядки (Takada, 2013). Из-за отсутствия надлежащего понимания механизма проводимости Li по границам зерен целенаправленная оптимизация пока невозможна.
Из-за отсутствия надлежащего понимания механизма проводимости Li по границам зерен целенаправленная оптимизация пока невозможна.
Границы зерен в твердых телах часто ограничиваются очень маленьким масштабом длины с шириной всего в несколько элементарных ячеек.Таким образом, STEM с его разрешением ниже ангстрема кажется идеальным инструментом для их изучения. Ma et al. (2014) успешно использовали STEM / EELS с атомным разрешением, чтобы раскрыть атомарное происхождение сопротивления границ крупных зерен в LLTO. Наблюдалось, что большинство границ зерен демонстрируют более темный контраст Z-, чем соседние зерна, что позволяет предположить, что средний атомный номер на границе зерен ниже. Дальнейший анализ в атомном масштабе показал, что атомная конфигурация границ зерен значительно отличается от конфигурации внутри зерен (рис. 2A, B).Вместо структуры перовскита ABO 3 такие реконструированные границы зерен, по существу, представляют собой бинарный слой Ti – O, запрещающий избыток носителя заряда Li + . Следовательно, они действуют как внутренние барьеры для транспорта лития. Эта тема также исследовалась HRTEM и EDS. Кроме того, Gellert et al. (2012) изучали границы зерен в литий-алюминиевом фосфате титана (LATP). В зависимости от взаимной ориентации между соседними зернами наблюдались два типа границ зерен.Если ориентации аналогичны, будет присутствовать толстая граница кристаллического зерна. Считалось, что его высокая степень кристалличности обеспечивает относительно легкий перенос ионов. Если ориентации сильно различаются, образуется более тонкий, но аморфный слой, который, как полагают, обладает высоким сопротивлением.
Следовательно, они действуют как внутренние барьеры для транспорта лития. Эта тема также исследовалась HRTEM и EDS. Кроме того, Gellert et al. (2012) изучали границы зерен в литий-алюминиевом фосфате титана (LATP). В зависимости от взаимной ориентации между соседними зернами наблюдались два типа границ зерен.Если ориентации аналогичны, будет присутствовать толстая граница кристаллического зерна. Считалось, что его высокая степень кристалличности обеспечивает относительно легкий перенос ионов. Если ориентации сильно различаются, образуется более тонкий, но аморфный слой, который, как полагают, обладает высоким сопротивлением.
Рис. 2. (A) Изображение HAADF-STEM с атомным разрешением границы зерен в LLTO. (B) Атомная модель границы зерен LLTO с дефицитом лития, основанная на всестороннем исследовании STEM / EELS.Воспроизведено с разрешения (Ma et al., 2014).
В отличие от двух материалов, рассмотренных выше, LLZO демонстрирует сопротивление границ зерен, сравнимое с сопротивлением внутренней части зерна (Муруган и др. , 2007). Однако происхождение этого доброкачественного поведения остается неизвестным. Несколько исследовательских групп пытались изучить границы зерен LLZO с помощью электронной микроскопии, но результаты противоречивы. Kumazaki et al. (2011) наблюдали аморфный Li – Al – Si – O и нанокристаллический LiAlSiO 4 на границах зерен LLZO.Напротив, чистые границы зерен, свободные от каких-либо изменений второй фазы или состава, сообщили Wolfenstine et al. (2012). Для окончательного объяснения необходимы систематические исследования с более высоким пространственным разрешением.
, 2007). Однако происхождение этого доброкачественного поведения остается неизвестным. Несколько исследовательских групп пытались изучить границы зерен LLZO с помощью электронной микроскопии, но результаты противоречивы. Kumazaki et al. (2011) наблюдали аморфный Li – Al – Si – O и нанокристаллический LiAlSiO 4 на границах зерен LLZO.Напротив, чистые границы зерен, свободные от каких-либо изменений второй фазы или состава, сообщили Wolfenstine et al. (2012). Для окончательного объяснения необходимы систематические исследования с более высоким пространственным разрешением.
Эти исследования демонстрируют, что границы зерен, несмотря на их сильно локализованный характер, можно эффективно исследовать с помощью (S) ПЭМ в сочетании с локальными аналитическими методами, такими как EELS и EDS. Однако текущие усилия в этой области очень ограничены.Прежде чем можно будет осуществить систематическое понимание и рациональную оптимизацию переноса Li на границах зерен, необходимы дальнейшие углубленные исследования.
Поведение границ раздела электролит-электрод
Стабильная и проводящая граница раздела электрод / электролит является предпосылкой для длительной эксплуатации батарей на основе твердого электролита (Zhu et al., 2015 и 2016; Richards et al., 2016). Тем не менее, из-за отсутствия механистического понимания, которое могло бы направить рациональное улучшение, все еще очень сложно сформировать такие интерфейсы.В качестве первого шага к этой цели необходимо прямое экспериментальное наблюдение за интерфейсами.
Хотя до настоящего времени не сообщалось об исследованиях электронной микроскопии с атомным разрешением, границы раздела между катодными материалами и несколькими твердыми электролитами были исследованы с помощью наноэлектронной дифракции (NED), STEM и EDS. Kim et al. (2011) исследовали межфазную стабильность между LLZO и LiCoO 2 (LCO). Тонкая пленка LCO была выращена на полированной поверхности керамики LLZO методом импульсного лазерного осаждения при 937 К. Наблюдения с помощью просвечивающей электронной микроскопии показали наличие межфазного реакционного слоя толщиной ~ 50 нм. Измерения профиля линии EDS и NED, полученные вблизи границы раздела, показали, что этот реакционный слой состоит из La 2 CoO 4 , который, как полагают, препятствует диффузии Li. Кроме того, граница раздела между LCO и прототипным сульфидным электролитом Li 2 S – P 2 S 5 была исследована Сакудой и др. (2009). Интерфейс был просто сформирован механическим шлифованием.После зарядки образовался межфазный слой, связанный с взаимной диффузией Co, P и S, и этот слой вызвал большое сопротивление. Аналогичное поведение наблюдалось между LiMn 2 O 4 и Li 2 S – P 2 S 5 (Китаура и др., 2010). Наблюдали межфазный слой, возникающий в результате диффузии Mn в твердый электролит, и полагали, что он дает большое сопротивление. Эти исследования с помощью электронной микроскопии предполагают, что реакционный слой может часто образовываться между твердым электролитом и катодом из-за взаимной диффузии.
Наблюдения с помощью просвечивающей электронной микроскопии показали наличие межфазного реакционного слоя толщиной ~ 50 нм. Измерения профиля линии EDS и NED, полученные вблизи границы раздела, показали, что этот реакционный слой состоит из La 2 CoO 4 , который, как полагают, препятствует диффузии Li. Кроме того, граница раздела между LCO и прототипным сульфидным электролитом Li 2 S – P 2 S 5 была исследована Сакудой и др. (2009). Интерфейс был просто сформирован механическим шлифованием.После зарядки образовался межфазный слой, связанный с взаимной диффузией Co, P и S, и этот слой вызвал большое сопротивление. Аналогичное поведение наблюдалось между LiMn 2 O 4 и Li 2 S – P 2 S 5 (Китаура и др., 2010). Наблюдали межфазный слой, возникающий в результате диффузии Mn в твердый электролит, и полагали, что он дает большое сопротивление. Эти исследования с помощью электронной микроскопии предполагают, что реакционный слой может часто образовываться между твердым электролитом и катодом из-за взаимной диффузии.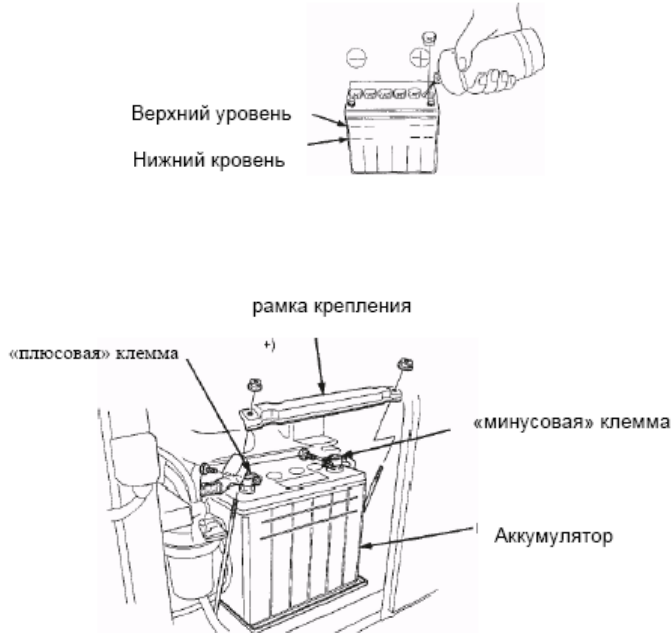 В отличие от границы раздела твердого электролита (SEI) в обычных LIB, реакционные слои на границе раздела твердый электролит / электрод обычно скорее вредны, чем полезны, поскольку они обычно препятствуют ионному переносу (Qian et al., 2015).
В отличие от границы раздела твердого электролита (SEI) в обычных LIB, реакционные слои на границе раздела твердый электролит / электрод обычно скорее вредны, чем полезны, поскольку они обычно препятствуют ионному переносу (Qian et al., 2015).
Помимо этих экспериментально наблюдаемых реакционных слоев, часто предполагалось сильно локализованное межфазное разложение на границах раздела твердого электролита и электродов, хотя они демонстрируют определенную степень стабильности в электрохимических измерениях (Zhu et al., 2015 и 2016; Richards et al., 2016). Однако большинство таких предположений основано на теоретических расчетах. Экспериментальная проверка является довольно сложной задачей из-за чрезвычайно малого масштаба предполагаемой толщины и высокой летучести / нестабильности металлического Li (Wenzel et al., 2015, 2016). (S) ПЭМ, который может исследовать локальные особенности с чрезвычайно высоким пространственным разрешением вплоть до уровня суб-ангстремов, предоставляет прекрасные возможности для исследования этих интригующих межфазных взаимодействий.
Итоги и перспективы
В этом мини-обзоре мы обсудили недавний прогресс в исследованиях (S) ТЕМ твердых электролитов для литиевых батарей. С успехом в решении проблем, вызванных повреждением электронным пучком, сообщается о все большем и большем количестве исследований, которые ранее не могли быть выполнены. Эти исследования прояснили несколько давних заблуждений относительно взаимосвязи структура-свойство, предоставили первые экспериментальные сведения о большом сопротивлении границ зерен и внесли вклад в понимание реакционного слоя на катоде / SEI.
Тем не менее, проблемы остаются. Для ионного транспорта внутри зерна сульфидные электролиты, которые часто демонстрируют более высокую проводимость, чем оксиды, требуют тщательного изучения в атомном масштабе. Их уязвимость для электронного пучка из-за слабых связей Li с S в структуре и ограниченной электронной проводимости значительно ограничивает надежные измерения их атомной и электронной структуры в ПЭМ. Чтобы понять роль границ зерен в твердых электролитах, необходимо изучить широкий спектр материалов, чтобы установить систематическое понимание.В частности, особого внимания заслуживают материалы с доброкачественными границами зерен, так как они могут вдохновлять на создание материалов с проводящими границами зерен. Для границы раздела твердый электролит / электрод одной из наиболее актуальных задач является проверка сильно локализованных межфазных реакционных слоев, которые недавно были предложены теоретическими работами. Кроме того, оставалось исследовать изменение этих поверхностей раздела в зависимости от состава, условий обработки и цикличности. Следует подчеркнуть, что недавно разработанные методы ПЭМ in situ, , такие как in situ, нагрев и in situ, электрохимический цикл с желаемым пространственным разрешением, значительно облегчат эти исследования (Gu et al., 2013; Chi et al., 2015; Zeng et al., 2015). Их способность проводить структурный / химический анализ с высоким разрешением в режиме реального времени позволит получить уникальную информацию, которую невозможно получить другим способом.
 В связи с недавними замечательными разработками в области приборов для микроскопии, таких как быстрые камеры и детекторы, низковольтные ПЭМ и многофункциональные столики для образцов, эти проблемы должны быть преодолены в ближайшем будущем, и ожидается, что электронная микроскопия будет играть все более важную роль в исследование литий-ионных твердых электролитов.
В связи с недавними замечательными разработками в области приборов для микроскопии, таких как быстрые камеры и детекторы, низковольтные ПЭМ и многофункциональные столики для образцов, эти проблемы должны быть преодолены в ближайшем будущем, и ожидается, что электронная микроскопия будет играть все более важную роль в исследование литий-ионных твердых электролитов.
Авторские взносы
Все перечисленные авторы внесли существенный, прямой и интеллектуальный вклад в работу и одобрили ее к публикации.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Финансирование
Эта работа спонсировалась Министерством энергетики США (DOE), Управлением науки, Управлением фундаментальных энергетических наук, Отделом материаловедения и инженерии.Характеристика материалов была проведена в рамках предложения пользователя в Центре науки о нанофазных материалах, который является пользовательским учреждением Управления науки Министерства энергетики США.
Список литературы
Брюс, П. Г., Фрейнбергер, С. А., Хардвик, Л. Дж., И Тараскон, Ж.-М. (2012). Li-O 2 и Li-S аккумуляторы с высоким накопителем энергии. Nat. Mater. 11, 19–29. DOI: 10.1038 / nmat3191
CrossRef Полный текст | Google Scholar
Бушманн, Х., Dolle, J., Berendts, S., Kuhn, A., Bottke, P., Wilkening, M., et al. (2011). Структура и динамика быстрого литий-ионного проводника «Li 7 La 3 Zr 2 O 12 ». Phys. Chem. Chem. Phys. 13, 19378–19392. DOI: 10.1039 / c1cp22108f
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Chi, M. F., Mizoguchi, T., Martin, L. W., Bradley, J. P., Ikeno, H., Ramesh, R., et al. (2011). Атомная и электронная структура интерфейса SrVO 3 -LaAlO 3 . J. Appl. Phys. 110, 046104. doi: 10.1063 / 1.3601870
CrossRef Полный текст | Google Scholar
Chi, M. F., Wang, C., Lei, Y. K., Wang, G. F., Li, D. G., More, K. L., et al. (2015). Огранка поверхности и поведение элементарной диффузии на атомном уровне для наночастиц сплава во время отжига in situ и . Nat. Commun. 6, 8925. DOI: 10.1038 / ncomms9925
F., Wang, C., Lei, Y. K., Wang, G. F., Li, D. G., More, K. L., et al. (2015). Огранка поверхности и поведение элементарной диффузии на атомном уровне для наночастиц сплава во время отжига in situ и . Nat. Commun. 6, 8925. DOI: 10.1038 / ncomms9925
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Куссен, Э.Дж. (2010). Структура и ионная проводимость литиевых гранатов. J. Mater. Chem. 20, 5167–5173. DOI: 10.1039 / b925553b
CrossRef Полный текст | Google Scholar
Гао, Х., Фишер, К.А.Дж., Кимура, Т., Икухара, Ю.Х., Кувабара, А., Мориваке, Х., и др. (2014). Структуры доменных границ в титанатах лития лантана. J. Mater. Chem. А 2, 843–852. DOI: 10.1039 / C3TA13726K
CrossRef Полный текст | Google Scholar
Гао, X., Фишер, К.А.Дж., Кимура, Т., Икухара, Ю.Х., Мориваке, Х., Кувабара, А. и др. (2013). Распределение атома лития и вакансии в позиции A в титанате лития лантана. Chem. Mater. 25, 1607–1614. DOI: 10,1021 / см3041357
Chem. Mater. 25, 1607–1614. DOI: 10,1021 / см3041357
CrossRef Полный текст | Google Scholar
Геллерт, М., Грис, К. И., Яда, К., Роскиано, Ф., Фольц, К., и Ролинг, Б. (2012). Границы зерен в литий-алюминиевой титан-фосфатной стеклокерамике с быстрой ионно-литиевой проводимостью: микроструктура и свойства нелинейного переноса ионов. J. Phys. Chem. С 116, 22675–22678. DOI: 10.1021 / jp305309r
CrossRef Полный текст | Google Scholar
Гу, М., Родитель, Л. Р., Мехди, Б. Л., Юноцич, Р. Р., МакДауэлл, М. Т., Саччи, Р. Л. и др. (2013). Демонстрация электрохимической жидкой ячейки для наблюдения с помощью просвечивающей электронной микроскопии литиирования / делитирования анодов батарей с Si-нанопроволокой. Nano Lett. 13, 6106–6112. DOI: 10.1021 / nl403402q
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ким, К.Х., Ирияма, Ю., Ямамото, К., Кумазаки, С., Асака, Т. , Танабе, К. и др. (2011). Характеристика границы раздела между LiCoO 2 и Li 7 La 3 Zr 2 O 12 в полностью твердотельной перезаряжаемой литиевой батарее. J. Источники энергии 196, 764–767. DOI: 10.1016 / j.jpowsour.2010.07.073
, Танабе, К. и др. (2011). Характеристика границы раздела между LiCoO 2 и Li 7 La 3 Zr 2 O 12 в полностью твердотельной перезаряжаемой литиевой батарее. J. Источники энергии 196, 764–767. DOI: 10.1016 / j.jpowsour.2010.07.073
CrossRef Полный текст | Google Scholar
Китаура, Х., Хаяси, А., Таданага, К., и Тацумисаго, М. (2010). Полностью твердотельные литиевые вторичные батареи с использованием электрода LiMn 2 O 4 и твердого электролита Li 2 S-P 2 S 5 . J. Electrochem. Soc. 157, A407 – A411. DOI: 10.1149 / 1.3298441
CrossRef Полный текст | Google Scholar
Кумадзаки С., Ирияма Ю., Ким К.-Х., Муруган Р., Танабе К., Ямамото К. и др. (2011). Высокая проводимость по ионам лития Li 7 La 3 Zr 2 O 12 за счет включения как Al, так и Si. Электрохим. Commun. 13, 509–512. DOI: 10.1016 / j.elecom.2011.02.035
Электрохим. Commun. 13, 509–512. DOI: 10.1016 / j.elecom.2011.02.035
CrossRef Полный текст | Google Scholar
млн лет назад, C., Chen, K., Liang, C.D., Nan, C.W., Ishikawa, R., More, K., et al. (2014). Атомно-масштабная природа большого сопротивления границ зерен в перовскитных литий-ионных твердых электролитах. Energy Environ. Sci. 7, 1638–1642. DOI: 10.1039 / c4ee00382a
CrossRef Полный текст | Google Scholar
Ma, C., Cheng, Y., Chen, K., Li, J., Sumpter, B., Nan, C.-W., et al. (2016). Мезоскопический каркас обеспечивает легкий перенос ионов в твердых электролитах для литиевых батарей. Adv. Energy Mater. DOI: 10.1002 / aenm.201600053
CrossRef Полный текст | Google Scholar
Ма, К., Рангасами, Э., Лян, К. Д., Сакамото, Дж., Мор, К. Л., и Чи, М. Ф. (2015). Превосходная стабильность литий-ионного твердого электролита при обратимом обмене Li + / H + в водных растворах. Angew. Chem. Int. Эд. 54, 129–133. DOI: 10.1002 / anie.201410930
Angew. Chem. Int. Эд. 54, 129–133. DOI: 10.1002 / anie.201410930
CrossRef Полный текст | Google Scholar
Мюллер, Д.A., Kourkoutis, L.F., Murfitt, M., Song, J.H., Hwang, H.Y., Silcox, J., et al. (2008). Химическое изображение состава и связи в атомном масштабе с помощью микроскопии с коррекцией аберраций. Наука 319, 1073–1076. DOI: 10.1126 / science.1148820
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Муруган, Р., Тангадураи, В., и Веппнер, В. (2007). Быстрая литий-ионная проводимость в гранатах типа Li 7 La 3 Zr 2 O 12 . Angew. Chem. Int. Эд. 46, 7778–7781. DOI: 10.1002 / anie.200701144
CrossRef Полный текст | Google Scholar
Пенникук, С. Дж. (1992). Z-контрастная просвечивающая электронная микроскопия — прямая атомная визуализация материалов. Ann. Rev. Mater. Sci. 22, 171–195. DOI: 10. 1146 / annurev.ms.22.080192.001131
1146 / annurev.ms.22.080192.001131
CrossRef Полный текст | Google Scholar
Цянь, Д., Ма, К., Мор, К. Л., Мэн, Ю. С. и Чи, М. (2015). Расширенная аналитическая электронная микроскопия для литий-ионных аккумуляторов. NPG Asia Mater. 7, е193. DOI: 10.1038 / am.2015.50
CrossRef Полный текст | Google Scholar
Quartarone, E., and Mustarelli, P. (2011). Электролиты для твердотельных литиевых аккумуляторных батарей: последние достижения и перспективы. Chem. Soc. Ред. 40, 2525–2540. DOI: 10.1039 / c0cs00081g
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ричардс, В. Д., Миара, Л. Дж., Ван, Ю., Ким, Дж. К., и Седер, Г.(2016). Стабильность интерфейса в твердотельных аккумуляторах. Chem. Mater. 28, 266–273. DOI: 10.1021 / acs.chemmater.5b04082
CrossRef Полный текст | Google Scholar
Сакуда А., Хаяси А. и Тацумисаго М. (2009). Наблюдение на границе раздела между электродом LiCoO 2 и твердыми электролитами Li 2 S-P 2 S 5 полностью твердотельных литиевых вторичных батарей с использованием просвечивающей электронной микроскопии. Chem. Mater. 22, 949–956. DOI: 10,1021 / см
Наблюдение на границе раздела между электродом LiCoO 2 и твердыми электролитами Li 2 S-P 2 S 5 полностью твердотельных литиевых вторичных батарей с использованием просвечивающей электронной микроскопии. Chem. Mater. 22, 949–956. DOI: 10,1021 / см
CrossRef Полный текст | Google Scholar
Stramare, S., Thangadurai, V., and Weppner, W. (2003). Титанаты лития-лантана: обзор. Chem. Mater. 15, 3974–3990. DOI: 10,1021 / см0300516
CrossRef Полный текст | Google Scholar
Такада, К. (2013). Развитие и перспективы твердотельных литиевых батарей. Acta Mater. 61, 759–770. DOI: 10.1016 / j.actamat.2012.10.034
CrossRef Полный текст | Google Scholar
Wang, Y., Richards, W. D., Ong, S. P., Miara, L. J., Kim, J. C., Mo, Y., et al. (2015). Принципы проектирования твердотельных литиевых суперионных проводников. Nat. Mater. 14, 1026–1031. DOI: 10.1038 / nmat4369
14, 1026–1031. DOI: 10.1038 / nmat4369
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Венцель, С., Лейхтвейс, Т., Крюгер, Д., Санн, Дж., И Янек, Дж. (2015). Межфазное образование на литиевых твердых электролитах — подход in situ к изучению межфазных реакций с помощью фотоэлектронной спектроскопии. Ионика твердого тела 278, 98–105. DOI: 10.1016 / j.ssi.2015.06.001
CrossRef Полный текст | Google Scholar
Венцель, С., Вебер, Д. А., Лейхтвейс, Т., Буше, М. Р., Санн, Дж., И Янек, Дж. (2016). Межфазное образование и деградация кинетики переноса заряда между анодом из металлического лития и высококристаллическим твердым электролитом Li 7 P 3 S 11 . Ионика твердого тела 286, 24–33. DOI: 10.1016 / j.ssi.2015.11.034
CrossRef Полный текст | Google Scholar
Вольфенстайн, Дж., Сакамото, Дж., И Аллен, Дж. Л. (2012). Электронно-микроскопические исследования горячепрессованного замещенного алюминия Li 7 La 3 Zr 2 O 12 .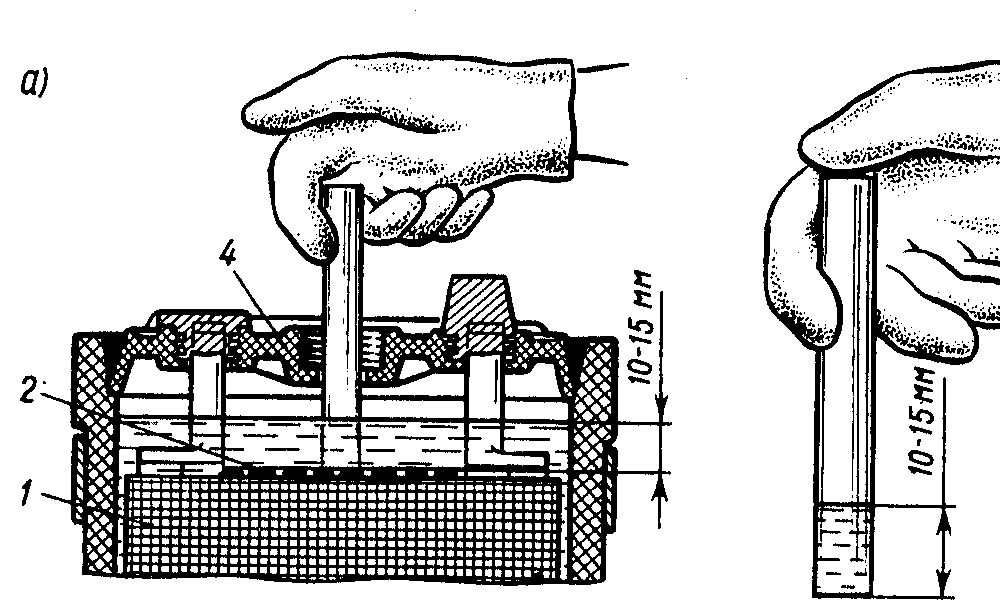 J. Sci. Mater. 47, 4428–4431. DOI: 10.1007 / s10853-012-6300-y
J. Sci. Mater. 47, 4428–4431. DOI: 10.1007 / s10853-012-6300-y
CrossRef Полный текст | Google Scholar
Ву, Ю., Ма, К., Янг, Дж. Х., Ли, З. К., Аллард, Л. Ф., Лян, К. Д., и другие. (2015). Исследование инициирования спада напряжения в слоистых катодных материалах с высоким содержанием лития на атомном уровне. J. Mater. Chem. А 3, 5385–5391. DOI: 10.1039 / C4TA06856D
CrossRef Полный текст | Google Scholar
Ябуучи, Н., Йошии, К., Мён, С. Т., Накаи, И., и Комаба, С. (2011). Детальные исследования материала электродов большой емкости для аккумуляторных батарей, Li 2 MnO 3 -LiCo 1 / 3Ni 1 / 3Mn 1 / 3O 2 . J. Am. Chem. Soc. 133, 4404–4419. DOI: 10.1021 / ja108588y
CrossRef Полный текст | Google Scholar
Zeng, Z. Y., Zhang, X. W., Bustillo, K., Niu, K. Y., Gammer, C., Xu, J., et al. (2015). In situ Исследование литирования и делитирования нанолистов MoS 2 с помощью просвечивающей электронной микроскопии электрохимических жидких ячеек. Nano Lett. 15, 5214–5220. DOI: 10.1021 / acs.nanolett.5b02483
In situ Исследование литирования и делитирования нанолистов MoS 2 с помощью просвечивающей электронной микроскопии электрохимических жидких ячеек. Nano Lett. 15, 5214–5220. DOI: 10.1021 / acs.nanolett.5b02483
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжу, Ю., Хе, X., и Мо, Y. (2015). Источник выдающейся стабильности литиевых твердых электролитов: выводы термодинамического анализа, основанные на расчетах из первых принципов. ACS Appl. Mater. Интерфейсы 7, 23685–23693. DOI: 10.1021 / acsami.5b07517
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжу, Ю., Хэ, X., и Мо, Ю. (2016). Изучение первых принципов электрохимической и химической стабильности границ раздела твердый электролит-электрод в полностью твердотельных литий-ионных батареях. J. Mater. Chem. А . 4, 3253–3266. DOI: 10.1039 / C5TA08574H
CrossRef Полный текст | Google Scholar
Не содержащий хлоридов электролит и органический катод повысили плотность энергии и стабильность — ScienceDaily
Исследователи из Хьюстонского университета и Американского научно-исследовательского института Toyota обнаружили многообещающую новую версию высокоэнергетических магниевых батарей с потенциальными применениями, начиная от электрических автомобили для аккумуляторов для систем возобновляемой энергии.
Батарея, о которой было сообщено 21 декабря в Джоулях , является первой батареей, которая, как сообщается, работает с ограниченным количеством электролитов при использовании органического электрода, изменение, по словам исследователей, позволяет ей накапливать и разряжать гораздо больше энергии, чем предыдущие магниевые батареи. Они использовали электролит, не содержащий хлоридов, что стало еще одним изменением от традиционного электролита, используемого в магниевых батареях, что позволило сделать открытие.
Янь Яо, доцент кафедры электротехники и вычислительной техники в UH, сказал, что исследователи смогли подтвердить, что хлорид в обычно используемом электролите способствует снижению производительности.«Проблема, которую мы пытались решить, — это воздействие хлорида», — сказал он. «Это повсеместно используется».
Яо, который также является главным исследователем Техасского центра сверхпроводимости в UH, и его команда использовали электролит, не содержащий хлоридов, для испытания катодов из органических хиноновых полимеров с анодом из металла магния, сообщив, что они выдавали до 243 ватт-часов на килограмм. , с мощностью до 3,4 киловатт на килограмм. Батарея оставалась стабильной через 2500 циклов.
, с мощностью до 3,4 киловатт на килограмм. Батарея оставалась стабильной через 2500 циклов.
Ученые потратили десятилетия на поиск высокоэнергетической магниевой батареи, надеясь воспользоваться естественными преимуществами магния перед литием, элементом, используемым в стандартных литий-ионных батареях.Магний гораздо более распространен и, следовательно, менее дорог, и он не склонен к нарушениям своей внутренней структуры, известным как дендриты, которые могут вызвать взрыв и возгорание литиевых батарей.
Но магниевые батареи не будут конкурентоспособными с коммерческой точки зрения, пока они не смогут накапливать и разряжать большое количество энергии. Яо сказал, что предыдущие материалы для катодов и электролитов были камнем преткновения.
Катод — это электрод, от которого течет ток в батарее, а электролиты — это среда, через которую протекает ионный заряд между катодом и анодом.
Среди других исследователей проекта — первые авторы Хуэй Донг, докторант UH, и Янлян Леонард Лян, доцент-исследователь UH; Оскар Тутусаус и Рана Мохтади из Исследовательского института Toyota в Северной Америке; и докторанты UH Е Чжан и Фан Хао.
«Благодаря () оптимальной комбинации катодов из органического карбонильного полимера и электролитов, способных накапливать магний, мы можем продемонстрировать высокую удельную энергию, мощность и стабильность при циклических нагрузках, которые редко встречаются в Mg-батареях», — пишут они.
Лян отметил, что до настоящего времени лучшим катодом для магниевых батарей был сульфид молибдена в фазе Шевреля, разработанный почти 20 лет назад. По его словам, у них нет ни мощности, ни емкости для хранения энергии, чтобы конкурировать с литиевыми батареями.
Но недавние отчеты показывают, что органические катодные материалы могут обеспечивать высокую емкость хранения при комнатной температуре. «Нам было любопытно, почему», — сказал Лян.
Донг сказал, что оба испытанных катода из органического полимера обеспечивали более высокое напряжение, чем фазовый катод Шевреля.
Яо сказал, что дальнейшие исследования будут направлены на дальнейшее улучшение удельной емкости и напряжения батарей, чтобы они могли конкурировать с литиевыми батареями.
«Магния гораздо больше и он безопаснее», — сказал он. «Люди надеются, что магниевая батарея может снизить риски литиевых батарей».
Яо получил премию Хьюстонского университета за выдающиеся достижения в области исследований и был назван высоко цитируемым исследователем, выбранным Clarivate Analytics на основании «исключительной исследовательской эффективности, которая входит в 1% лучших по цитируемости в Web of Science» в 2018 году.
История Источник:
Материалы предоставлены Университетом Хьюстона . Оригинал написан Джинни Кевер. Примечание. Содержимое можно редактировать по стилю и длине.
.

