Мутный электролит в аккумуляторе: причина, что делать
Диагностика и ремонт15 апреля 2018
Ресурс качественной аккумуляторной батареи от надежного производителя составляет не менее 5 лет. Но нередко случается ситуация, когда проблемы с автомобильным источником питания возникают значительно раньше указанного срока. Становятся заметны признаки ускоренного износа аккумулятора – существенно упала емкость, потемнел электролит, снизилась плотность кислотного раствора. Каковы причины подобных изменений и что нужно сделать для восстановления, рассказывается в данном материале.
Почему темнеет рабочая жидкость батареи?
Аккумуляторный электролит представляет собой смесь дистиллированной воды с концентрированной серной кислотой. Изначальный цвет обеих жидкостей – прозрачный, таковым он остается и после перемешивания. Находясь внутри исправного источника питания, раствор не меняет природный окрас и продолжает оставаться прозрачным.
Справка. Если заглянуть в работоспособный обслуживаемый аккумулятор через одну из открытых пробок, можно увидеть свинцовые пластины – чистый электролит вполне позволяет это сделать.
Когда раствор серной кислоты мутнеет либо становится черным, налицо неисправность аккумулятора, связанная с нарушением структуры пластин. К сожалению, подавляющее большинство автолюбителей обращают внимание на цвет жидкости после проявления более осязаемых признаков – неожиданной разрядки батареи, выкипания и так далее.
Если электролит в аккумуляторе приобрел мутный оттенок или почернел, нужно рассматривать следующие причины:
- началось осыпание свинцового наполнителя с пластин, на ранней стадии жидкость мутнеет, а затем чернеет;
- внутрь обслуживаемого источника питания попала грязь, вызвавшая появление мутного осадка;
- владелец авто случайно долил в банки обычную воду, некачественный дистиллят либо электролит неизвестного происхождения;
- перегрев батареи;
- пластины получали чрезмерное напряжение зарядки в течение длительного периода (так называемая перезарядка).

Грязь в аккумуляторной батарее – довольно редкая причина, вызывающая потемнение раствора. Нужно сильно постараться, чтобы занести посторонние частицы в электролитическую жидкость. На необслуживаемых изделиях попадание грязи практически исключено.
Помутнение вследствие доливки неправильного раствора, перегрева либо перезарядки встречается гораздо чаще. В первом случае химическая реакция провоцирует выпадения осадка из посторонних включений, который плавает в электролите и создает помутнение. Перегрев может возникать из-за неисправности автомобильного генератора и регулятора напряжения, а также при зарядке аккумулятора мощным самодельным устройством.
Справка. Максимально допустимая температура электролитической жидкости в процессе работы батареи – 40 °С. При нагреве свыше указанной величины раствор начинает терять химические свойства и мутнеет.
Последствия помутнения
Если сернокислый аккумуляторный раствор изменил цвет, а владелец автомобиля не принял надлежащих мер по устранению неполадки, наступят такие последствия:
- Черный электролит – явный признак разрушения пластин, потемнение дает осыпавшийся свинец.
 В данном случае аккумулятор не подлежит восстановлению – батарею придется менять.
В данном случае аккумулятор не подлежит восстановлению – батарею придется менять. - Мутный электролит – результат попадания посторонних примесей либо начальная стадия осыпания свинца. Разрушительный процесс можно остановить, если заменить рабочую жидкость и устранить источник проблемы.
Почернение раствора возникает как в одной секции источника питания, так и во всех банках одновременно. Результат одинаков: химическая реакция на осыпавшихся пластинах существенно ослабевает и емкость аккумулятора снижается. Вдобавок плавающие частицы свинца провоцируют замыкание между пластинами, быстро приводя батарею в непригодное состояние.
Прежде чем менять темный электролит, отыщите причину помутнения жидкости и устраните ее. Раствор теряет прозрачность из-за следующих неполадок:
- На клеммы поступает напряжение, превышающее норму, – 15 вольт. Батарея нагревается, вода из раствора выкипает, верхняя часть банки оголяется. Проблема наверняка кроется в генераторе либо электронном регуляторе напряжения зарядки.

- Замораживание источника питания. Если разряженный аккумулятор хранить на морозе, плотность электролита уменьшается, доля воды в растворе замерзает. Лед способен разрушить не только банки, но и корпус изделия.
- Жидкость мутнеет после глубокого разряда. Например, вы на несколько дней оставили автомобиль в гараже со включенными фарами головного света. Шанс восстановления есть, но батарею придется долго заряжать малыми токами.
Как правило, неизменно мутная жидкость указывает на добавление обычной воды или поддельного электролита. Сероватый оттенок раствору придают кристаллы серной кислоты – это признак глубокого разряда. В обоих случаях нужно пытаться восстановить работоспособность источника питания.
Замена мутной жидкости
Первым делом попытайтесь избавиться от мути простейшим способом – зарядить аккумулятор автоматическим устройством с функцией десульфатации пластин и периодического отключения. Если напряжение на клеммах не упало ниже 12,7 В, а процесс разрушения еще не начался, подзарядка может помочь и вернуть раствору прозрачность.
Черный электролит в аккумуляторе менять, скорее всего, бесполезно. Ради личного успокоения стоит предпринять такую попытку, но нужно учитывать один момент: наполовину осыпавшиеся пластины никогда не примут заряд в нужном количестве. Емкость батареи останется невысокой.
Что делать с мутным электролитом, если зарядка не дала результата:
- Очистите корпус батареи снаружи, дабы исключить попадание грязи внутрь рабочих секций.
- Опорожните источник питания, открутив пробки всех банок. В необслуживаемом изделии надо вытащить встроенный ареометр (иначе – глазок, индикатор исправности), поддев за края двумя отвертками.
- Тщательно промойте внутренности аккумулятора дистиллированной водой. Постарайтесь максимально выполоскать осадок из банок и слейте промывочную жидкость.
- Купите в магазине новый электролит плотностью 1,31–1,34 г/см3 и приготовьте рабочую жидкость, доведя плотность до 1,27–1,29 г/см3 путем добавления небольшого количества дистиллята.

- Залейте электролитический раствор в секции батареи и поставьте ее на зарядку током 2 А, периодически замеряя напряжение. На момент измерения автоматическое зарядное устройство необходимо отключать от электросети.
В большинстве случаев описанная процедура помогает избавиться от помутнения при условии, что в дальнейшем аккумулятор будет эксплуатироваться правильно, а электрическое оборудование машины находится в исправном состоянии.
Более качественная промывка с удалением различных примесей выполняется химическим раствором аммиака и вещества под названием «Трилон Б». На 1 литр дистиллята добавляется 50 мл аммиака и 20 мл «Трилона», после чего раствор медленно заливается в аккумулятор. Когда завершится реакция, жидкость сливается, делается повторная промывка дистиллированной водой и заполнение банок свежим электролитом.
По окончании зарядки не забудьте проконтролировать плотность раствора и его уровень
. Жидкость должна полностью покрывать пластины каждой секции, а плотность – остаться на уровне 1,27–1,29 г/см3. Если через несколько часов показатель изменится в меньшую сторону (без подключения нагрузки), аккумуляторную батарею придется заменить.
Если через несколько часов показатель изменится в меньшую сторону (без подключения нагрузки), аккумуляторную батарею придется заменить.При зарядке аккумулятора помутнел электролит: как решить проблему
Электролит — основной элемент в устройстве аккумулятора. Жидкость выполняет функцию накопления энергии. Без смеси устройство не будет функционировать. Состояние электролита способно рассказать о степени изношенности батареи. Если поломки отсутствуют, то субстанция чистая, прозрачного цвета. Если при зарядке аккумулятора помутнел электролит, то это плохой знак. Это говорит о поломке АКБ (аккумуляторной батареи).
Редко когда удается спасти АКБ, если цвет электролита черный. Однако несколько способов существует.
Каким должен быть «здоровый» электролит
Как написано выше, аккумуляторная батарея в хорошем состоянии имеет чистую, прозрачную рабочую жидкость.
Никакие темные участки, затемнения не допускаются.
Работающий раствор — это смесь из серной кислоты и дистиллированной воды. Оба компонента имеют прозрачный цвет. Соответственно, правильный работающий раствор такой же. В другом случае батарея уже в плохом состоянии или неисправна.
Если при зарядке аккумулятора помутнела рабочая субстанция, то это, как и в случае с почернением, серьезные проблемы. Помутнения иногда появляются в определенных банках. Не обязательно во всех.
Мутный электролит в аккумуляторе при зарядке
Если электролит приобрел мутный цвет, нужно диагностировать причину.
Причина, почему в автомобильном аккумуляторе мутный электролит, чаще всего одна. Проявляется в тех батареях, которые за время эксплуатации не обслуживаются, не проверяется.
Случается, что автовладелец постоянно обслуживает АКБ, но рабочая смесь все равно чернеет. Тогда причин почернения электролита в аккумуляторе больше. Бывают как серьезные, так незначительные причины.
Незначительные причины:
- Самое обычное загрязнение раствора. Такие случаи — редкость, но иногда такое происходит. Чтобы избежать попадания грязи в банку, рекомендуется время от времени обслуживать АКБ.
- Электролит — это смесь из серной кислоты и дистиллята, то есть дистиллированной воды. Однако некоторые люди, не знающие об этом, заливают туда простую воду из-под крана или любую другую воду. При разряде АКБ в банке появляются примеси. Они являются причиной помутнения. Вывод такой: в банках допускается только дистиллированная жидкость.
- Дешевая, некачественная субстанция. Некоторые недобросовестные производители делают вещество из неочищенных материалов. Зачастую их продукция стоит гораздо меньше в отличие от изделий компаний-конкурентов.
Эти проблемы незначительны. Чтобы избежать их, будьте внимательными, выбирайте только качественные батареи.
Серьезные причины:
- Перегрев аккумуляторной батареи часто приводит к поломке.
 Это происходит чаще всего при перезарядке АКБ. Даже незначительный перегрев на несколько градусов бывает причиной того, почему почернел, помутнел электролит в аккумуляторе. Суть в том, что при температуре 38 градусов и выше цвет жидкости значительно изменяется, потому что высокая температура запускает процесс сульфитации пластин. Процесс не мгновенный, но наносит непоправимый вред батарее.
Это происходит чаще всего при перезарядке АКБ. Даже незначительный перегрев на несколько градусов бывает причиной того, почему почернел, помутнел электролит в аккумуляторе. Суть в том, что при температуре 38 градусов и выше цвет жидкости значительно изменяется, потому что высокая температура запускает процесс сульфитации пластин. Процесс не мгновенный, но наносит непоправимый вред батарее. - Глубокий разряд аккумулятора, так же как в предыдущем случае, провоцирует разрушение пластин, изменяя цвет рабочей смеси.
- Заморозка батареи. Это происходит часто. Главной причиной этого является глубокая разрядка. Суть в том, что плотность серной кислоты значительно снижается, а вода замерзает. Внутри образуется лед, который и разрушает пластины. Иногда повреждается корпус АКБ.
Если подумать, то все серьезные причины объединяет одно явление — повреждение пластин. Это очень серьезно. При их осыпании выделяется смесь изотопов или свинец. Это радиоактивный элемент.
При выделении осадок окрашивает рабочее вещество в черный цвет, провоцируя выпадение осадков, делающих жидкость мутной. Если владелец не заглядывал время от времени в аккумулятор, то АКБ не обслуженная, а если почернели определенные банки, то проблема в пластинах.
Если владелец не заглядывал время от времени в аккумулятор, то АКБ не обслуженная, а если почернели определенные банки, то проблема в пластинах.
Кстати, еще одна причина разрушения пластин — механическое воздействие.
Как решить проблему
Прежде всего осматривается раствор во всех банках. Субстанция бывает черной, мутной или даже серой.
Следующий шаг — определение, в каких банках проблема — во всех или в определенных. После диагностики решается сама проблема.
Раствор помутнел во всех банках
Существуют две причины. Первая — использование некачественного раствора. Чтобы решить проблему, нужно всего лишь заменить жидкость на качественную. Для этого вылейте старую, залейте новую рабочую жидкость.
Если проблема не решилась, то виновата вторая причина — не дистиллированная вода.
Раствор снова заменяется, только с использованием дистиллята.
Раствор серого цвета во всех банках
Самая частая причина — глубокая разрядка. Серый цвет — признак выпадения осадков в виде кристаллов солей. Если после зарядки раствор не стал чистым, прозрачным, то нужно его заменить на новый.
Серый цвет — признак выпадения осадков в виде кристаллов солей. Если после зарядки раствор не стал чистым, прозрачным, то нужно его заменить на новый.
Электролит помутнел, почернел в определенных банках
Если жидкость стала черного цвета в одной банке, а с остальными все хорошо, то проблема решается манипулированием только с поврежденной.
Сначала диагностируется точная проблема. Для этого желательно с помощью тестера узнать, какое напряжение выдает эта баночка. Допустимое напряжение — 2—2,1 В. Часто при таких симптомах напряжение либо слабое, либо полностью отсутствует.
Это означает одно — повреждение и осыпание пластин. Причины, почему это происходит, описаны выше.
Цвет меняется из-за выпадения свинца. Свинец придает веществу черный цвет. В этом случае уже мало что поможет. Придется идти в магазин и покупать новый аккумулятор.
Вредные советы
В интернете полно советчиков, которые дают нелепые решения проблем, и гуляет несколько мифов. Ни в коем случае нельзя их придерживаться, потому что такие советы способны добить АКБ.
Вот некоторые из них:
- Использовать снег вместо дистиллята. Снег не является дистиллированной водой. Добавление его в электролит вызывает поломку.
- При выпадении осадков свинца вылейте электролит, промойте банку водой и залейте новое вещество. Это практиковалось в прошлом веке. Современные банки АКБ имеют плотно расположенные электроды, на которых натянуты пакеты-отделители. Из таких баночек откачать жидкость с осадком свинца невозможно. Кусочки не пройдут через электроды.
- Некоторые сайты продают так называемые модификаторы. По заявлению производителей, средства с легкостью очищают электролит, и продлевают жизнь батареи. Но эти аппараты — то же самое, что и технологии, уменьшающие расход топлива. Они не работают.
Вывод
Мораль такая, что если раствор мутный или серый во всех баночках, то АКБ лечится. Для этого воспользуйтесь советами, описанными выше. Однако если почернела одна баночка, то, скорее всего, придется купить новую АКБ.
При выявлении поломки желательно обратиться к опытному мастеру, который сможет правильно провести диагностику и решить проблему.
Замерз электролит в аккумуляторе: что делать чтобы разморозить
Подготовка автомобиля к наступлению холодов предполагает целый ряд процедур, которые направлены на обеспечение нормальной функциональности всех узлов и агрегатов в условиях низких температур.
Как правило, водители заливают в двигатель моторное масло с меньшей вязкостью для уверенного запуска ДВС, меняют фильтры топлива, масла и воздуха, проверяют качество антифриза и тосола в системе охлаждения, устанавливают новые свечи зажигания, диагностируют высоковольтные бронепровода, заряжают АКБ и т.п.
Что касается аккумулятора, кроме зарядки данный элемент перед зимой требует отдельного повышенного внимания. Причина заключается в том, что с похолоданием многие водители сталкиваются с проблемой, когда в аккумуляторе замерз электролит. Более того, даже покупка «свежей» АКБ не дает полной уверенности.
Дело в том, что были отмечены случаи, когда замерз электролит в новом аккумуляторе. При визуальном осмотре новой или бывшей в использовании АКБ в подобной ситуации хорошо видно, что стенки батареи заметно вздуваются, а также полностью пропадает электропитание в бортовой сети.
При визуальном осмотре новой или бывшей в использовании АКБ в подобной ситуации хорошо видно, что стенки батареи заметно вздуваются, а также полностью пропадает электропитание в бортовой сети.
Далее мы поговорим о том, что делать, если замерз электролит в аккумуляторе, возможно ли вернуть работоспособность батарее, что способствует замерзанию электролита и как с этим бороться. Также мы дадим несколько полезных советов, которые помогут в дальнейшем избежать распространенных ошибок, которые связаны с эксплуатацией автомобильных аккумуляторных батарей.
Содержание статьи
Почему в аккумуляторе замерз электролит: основные причины
Если одни водители эксплуатируют так называемые необслуживаемые АКБ и меняют их после появления первых признаков старения, по времени или сразу при выходе из строя, другие автолюбители предпочитают обслуживать свой аккумулятор самостоятельно и не спешат с ним расстаться.
Вполне очевидно, что возможность обслужить АКБ в некоторых случаях дает определенные преимущества. Чаще всего именно владельцы обслуживаемых батарей интересуются, при какой температуре замерзает электролит в аккумуляторе, а также как предотвратить такое замерзание.
Чаще всего именно владельцы обслуживаемых батарей интересуются, при какой температуре замерзает электролит в аккумуляторе, а также как предотвратить такое замерзание.
Сразу отметим, что дать точный ответ на поставленный вопрос довольно затруднительно применительно к практической эксплуатации. Как правило, усредненный температурный режим использования аккумулятора в автомобиле находится в рамках от — 45 до + 65 градусов по Цельсию.
В тех регионах, где температура зимой опускается ниже, необходимо дополнительно повышать плотность электролита. Это делается путем добавления в «банки» АКБ дополнительного количества кислоты. Для лучшего понимания, давайте взглянем на сводную таблицу.
Как видно, таблица замерзания электролита в аккумуляторе наглядно демонстрирует зависимость порога замерзания от плотности электролита. При этом нужно также учитывать тот факт, что в процессе эксплуатации батарея подвержена саморазряду.
Во время самостоятельного разряда в аккумуляторе протекает процесс электролитической диссоциации. Если не вдаваться в подробности, при таком процессе серная кислота оказывает определенное воздействие на свинец в пластинах АКБ. Результатом такого воздействия становится реакция, во время которой происходит активное выделение углекислого газа и сульфата аммония.
Если не вдаваться в подробности, при таком процессе серная кислота оказывает определенное воздействие на свинец в пластинах АКБ. Результатом такого воздействия становится реакция, во время которой происходит активное выделение углекислого газа и сульфата аммония.
Если проще, в АКБ уменьшается количество кислоты и увеличивается содержание воды. Именно вода в аккумуляторе склонна к замерзанию, то есть снижение плотности электролита приводит к увеличению порога замерзания. Получается, если батарея замерзла, тогда или произошел сильный разряд, или же плотность электролита снизилась.
Если электролит в АКБ замерз: как разморозить и зарядить автомобильный аккумулятор
Прежде всего, понадобиться произвести тщательный осмотр корпуса батареи. Это можно сделать прямо на машине. Не допускается наличие трещин и других дефектов. Также рекомендуется просветить корпус фонариком, так как образование льда внутри АКБ приводит не только к разлому пластмассовых наружных стенок, но и повреждениям внутренних перестенков.
- Если никаких повреждений не обнаружено, тогда батарею можно снять с автомашины, после чего следует перенести ее в отапливаемое помещение. Рекомендуется поставить батарею в пластиковую/металлическую емкость, в крайнем случае, можно подложить под АКБ полиэтиленовую пленку или использовать другое непромокаемое покрытие. Далее батарею оставляют на некоторое время.
Обратите внимание, запрещено заряжать аккумулятор до того момента, пока внутри будет лед, а также пока общая температура электролита не повысится до положительного (плюсового) значения. Игнорирование данного правила может привести к замыканию при попытках зарядки промерзшей АКБ.
- После того, как батарея полностью разморозится, следует произвести повторный осмотр на наличие течей. Именно по этой причине выше рекомендовалось поставить АКБ в емкость или подложить под аккумулятор пленку. Дело в том, что вытекание кислотосодержащего электролита может привести к порче напольного покрытия и других предметов, ожогам в результате попадания на кожу и т.
 п.
п.
Итак, если вздувшиеся стенки после разморозки пришли в нормальное состояние, тогда внимательно осматриваем батарею. Достаточно часто утечки происходят через микротрещины, которые становятся заметными уже после размораживания. Обнаружение потеков или следов жидкости на корпусе батареи является поводом к тому, чтобы произвести дополнительную проверку.
Иногда это может оказаться не электролит, а просто вода или другие технические жидкости, которые ранее попали на АКБ снаружи в подкапотном пространстве. Также многие ошибочно принимают вытекающий электролит за конденсат, который образуется при размораживании.
Для точного определения можно воспользоваться специальным индикатором (продаются в специализированных магазинах). Если бумага индикатора после контакта с жидкостью на корпусе АКБ покраснела, тогда очевидны утечки кислоты. Другими словами, образование льда привело к повреждениям корпуса, после чего происходит утечка электролита, в составе которого находится кислота.
Отсутствие реакции индикатора будет свидетельствовать о том, что на корпусе действитльно собрался конеднсат или ранее попала вода/технические жидкости, но электролит не вытекает изнутри.
- Если утечки незначительные и сам источник точно обнаружен, тогда можно пойти двумя путями: сразу поменять аккумулятор на новый или попытаться его отремонтировать. Под ремонтом следует понимать полный слив электролита, после чего производят пайку корпуса при помощи паяльника.
Добавим, что шансы избавиться от трещины не велики, так как эффективно устранить дефект можно только в том случае, когда трещина находится сбоку и затрагивает только одну «банку». Если же растрескивание корпуса произошло в нижней части или в углах, тогда высока вероятность того, что после ремонта АКБ снова потечет.
При этом важно понимать, что вытекание электролита в ряде случаев быстро приводит в негодность элементы кузова автомобиля под капотом в местах установки батареи, после чего требуется дорогостоящий кузовной ремонт. По этой причине эксплуатировать даже незначительно подтекающий аккумулятор крайне не рекомендуется.
По этой причине эксплуатировать даже незначительно подтекающий аккумулятор крайне не рекомендуется.
- Только убедившись в том, что АКБ не имеет повреждений, можно переходить к зарядке. Что касается выставления тока заряда на зарядном устройстве (ЗУ), необходимо придерживаться показателя 1/10 в А.ч. от той емкости, которая является номинальной для конкретной батареи.
В этом случае АКБ будет заряжаться около 10 часов. Данный способ является самым простым. При этом оптимальными условиями для заряда можно считать подачу на батарею разных токов. На начальном этапе зарядка производится импульсными высокими токами, что позволяет эффективно заряжать аккумулятор с учетом процесса сульфатации пластин.
После этого основное накопление заряда происходит при подаче пониженных токов. Завершающим этапом становится дозарядка низкими прерывающимися токами, что позволяет накопить максимум заряда и восстановить пластины. Возможность такой зарядки зачастую определяется функционалом зарядного устройства. Лучшим решением является использование автоматического ЗУ.
Лучшим решением является использование автоматического ЗУ.
В любом случае, основной задачей (независимо от возможностей устройства и выбранного способа) является максимально полный заряд аккумулятора. Далее необходимо проверить плотность электролита, а также его прозрачность. Для измерения плотности используется ареометр. Прозрачность оценивается визуально. Если заметно, что электролит мутный, тогда это укажет на осыпание пластин.
- Полностью заряженную батарею с прозрачным электролитом можно будет установить на автомобиль для дальнейшей эксплуатации. Если же электролит помутнел, тогда такой аккумулятор лучше заменить. Дело в том, что заливка свежего электролита и повышение его плотности все равно не позволит обеспечить АКБ нормальную работоспособность, так как происходит потеря емкости, батарея не выдаст нужного пускового тока.
Советы и рекомендации
С учетом приведенной выше информации становится понятно, что в большинстве случаев главной причиной замерзания электролита в АКБ является его недозаряд. Также важно следить за тем, чтобы в процессе зарядки батареи от ЗУ не происходило перезаряда батареи.
Также важно следить за тем, чтобы в процессе зарядки батареи от ЗУ не происходило перезаряда батареи.
Как правило, на автомобиле замерзает разряженный аккумулятор. Ускоренный разряд АКБ происходит как по естественным причинам (похолодание), так и в результате растущих нагрузок в зимний период. В это время двигатель труднее заводится от стартера (масло вязнет в картере, топливо хуже испаряется), активно используются различные подогревы стекол и сидений, дольше работают фары, габариты и т.д.
При этом зимой поездки могут быть короткими, то есть АКБ попросту не успевает восстановить потраченный заряд от генератора. Чтобы не произошло сильного разряда батареи, требуется следить за плотностью электролита. Проверять плотность нужно в каждой «банке» по отдельности. Параллельно необходимо проверять и эффективность работы генератора.
Для этого нужно замерять напряжение, которые генератор выдает на АКБ, следить за нормальной работой реле-регулятора и т.д. Если были обнаружены причины, по которым происходит недозаряд, их необходимо устранить, после чего также производится полная зарядка АКБ при помощи ЗУ.
Если температуры в регионе сильно упали, тогда для предотвращения саморазряда аккумулятора бывает достаточно снять АКБ, после чего на время ночной стоянки батарея переносится в отапливаемое помещение. Когда такой возможности нет, батарею оставляют на машине, при этом производится отключение массы.
Единственное, нужно учитывать, что после отключения питания во многих случаях происходит полное обесточивание автомобильной охранной сигнализации.
Что в итоге
- Как видно, нормально заряженный аккумулятор с приемлемой плотностью электролита не замерзает даже при сильных морозах.
- При этом замерзание электролита в аккумуляторе не всегда означает, что АКБ полностью вышла из строя.
- Для обслуживаемых аккумуляторов имеется возможность повысить плотность водно-кислотного раствора или полностью его заменить, после чего поднять заряд до максимума.

- Во время зарядки необходимо правильно заряжать аккумулятор от ЗУ, чтобы избежать его недозаряда или слишком сильной перезарядки.
- Для дополнительной защиты, а также в целях улучшения запуска ДВС после зимней стоянки, можно дополнительно использовать специальные обогреватели аккумуляторов (термокейсы).
Читайте также
Мутный электролит в аккумуляторе: причины и решение проблемы
Для работы аккумуляторной батареи, в ее резервуаре обязательно должен быть электролитный раствор. Он обеспечивает проводимость заряда, а также отвечает за бесперебойную работу устройства. По состоянию раствора также можно судить о функционале батареи, поэтому любому автолюбителю необходимо знать, что означает мутный электролит в аккумуляторе.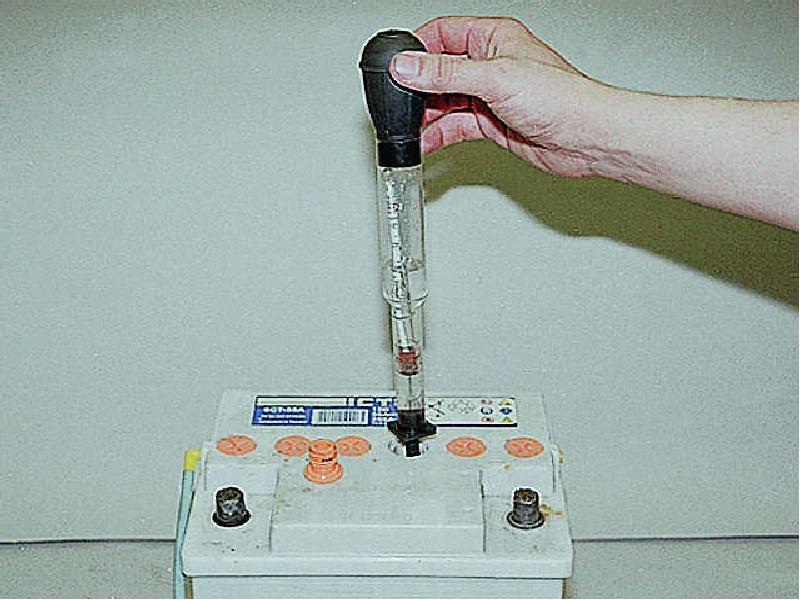
Причины помутнения раствора
Электролит представляет собой смесь дистиллированной воды и серной кислоты. Такая среда обеспечивает идеальное прохождение разряда. В новой и исправной батарее не должно быть никаких примесей и помутнения, ведь это свидетельствует о заводском браке. В случае если вы увидели темный электролит в аккумуляторе, которым уже пользовались, причин этому может быть несколько.
Что влияет на чистоту раствора:
- Самая простая и вместе с тем маловероятная причина — попадание внутрь грязи. Это может происходить при неквалифицированном обслуживании, либо разгерметизации емкости, что повлечет за собой целый ряд других проблем.
- Долив в аккумулятор неподходящей жидкости. Необходимо использовать исключительно дистиллированную воду, обычная водопроводная не подойдет. Со временем в ней будет образовываться налет, что нарушит чистоту раствора. Помимо этого, необходимо убедится в качестве приобретенной жидкости и уж тем более не использовать подручные средства в виде минералки или снега.

- Выход из строя необслуживаемой батареи. Чаще всего темнеет электролит в аккумуляторе именно по этой причине. Дело в том, что такие устройства рассчитаны на определенный срок службы, поэтому при отработке могут «сигналить» мутным электролитом, даже еще продолжая некоторое время работать. С заменой затягивать не стоит, ведь помимо потемнения раствора могут нарушиться и основные функции устройства.
- Перемерзание электролитного раствора. Несмотря на то, что жидкость в аккумуляторе имеет низкую точку замерзания, на сильном морозе может случиться и это. Появление льда внутри батареи может повредить внутреннюю поверхность корпуса и пластины, что также может проявиться в виде осадка и помутнения.
- Если при зарядке аккумулятора электролит потемнел, возможно, речь идет о перегреве АКБ. Сильный нагрев батареи, особенно в летнее время, губительно сказывается на ее дальнейшей работе. Уже при 37-40 градусах жидкость может потемнеть и дать осадок, поэтому следует избегать перезарядки аккумулятора и превышении рекомендованного периода зарядки.

- Аккумулятор сильно «сел». Такие состояния также губительны для нормальной работы батареи. Не стоит допускать полного разряда, ведь в этом случае электролит также может изменить прозрачность.
Значение имеет также и то, в каких объемах произошло потемнение раствора. Если речь идет об одной секции, проблему решить довольно просто. В случае если раствор потемнел сразу во всех отсеках, также будут наблюдаться сбои в работе, либо полный отказ АКБ.
Что делать если помутнел электролит в аккумуляторе
В такой ситуации необходимо четко сформулировать тактику дальнейших действий. К сожалению, опыт бывалых автомобилистов в современных моделях неприменим. Именно поэтому трудоемкий процесс слива аккумуляторов, промывка и заправка свежим электролитом не принесет должного эффекта. В этом случае накипь и осадок может скапливаться между поверхностями внутренних пластин, впоследствии вступая в реакцию с работающими элементами. В зависимости от того, какой цвет имеет раствор, можно выделить несколько правил устранения этой ситуации.
Что необходимо сделать:
- Мутный раствор во всех секция АКБ означает использование некачественного электролита. В такой ситуации самым правильным будет выкачка жидкости и ее полное обновление. В необслуживаемых АКБ сделать это будет невозможным. Даже если по совету бывалых автовладельцев, просверлить отверстие и провести манипуляцию, обеспечить дальнейшую герметизацию батареи будет намного сложней.
- Серый раствор во всех секциях может появляться при разрядке батареи. Происходит это при кристаллизации соляной кислоты и выпадению сульфатов. Если после подзарядки жидкость снова стала прозрачной, проблема решена.
- Черный раствор электролита свидетельствует о более серьезной проблеме — разрушению пластин. Сняв показатели напряжения можно в этом окончательно убедиться. Если почернела только одна секция — ее необходимо заменить. Если проблема коснулась всех отделений АКБ, придется приобрести новый. «Реанимационные» методы обычно не имеют большого успеха и продляют жизнь батареи на непродолжительный период.

В качестве профилактики потемнения раствора электролита необходимо следовать несложным правилам эксплуатации АКБ.
Можно сформулировать несколько тезисов:
- Батарея нуждается в бережной эксплуатации. Не стоит допускать перезарядки и полного разряда АКБ. Также нельзя использовать самодельные и некачественные зарядные устройства, которые больше «калечат» аккумулятор, воздействуя высокими температурами и напряжением.
- Все секции должны быть надежно закреплены, чтобы избежать травмирования внутренних пластин во время разгона и торможения.
- Для дозаливки обслуживаемых АКБ обязательно использовать дистиллированную воду хорошего качества. Все другие жидкости, а также сомнительные по составу растворы не подойдут.
- Своевременная замена необслуживаемых АКБ. После окончания срока службы и потемнения электролитного раствора, такие батареи обязательно необходимо заменить.
Неисправности аккумуляторной батареи в авто случаются не так уж и часто. Наиболее распространенным «симптомом» неполадок считается помутнение электролитного раствора. Чаще всего это происходит при неправильном обслуживании и использовании некачественного электролита. К другим причинам можно отнести неправильный режим подзарядки, либо перегрев батареи. Почему при зарядке аккумулятора электролит мутнеет и как исправить ситуацию, расскажет наша информация.
Наиболее распространенным «симптомом» неполадок считается помутнение электролитного раствора. Чаще всего это происходит при неправильном обслуживании и использовании некачественного электролита. К другим причинам можно отнести неправильный режим подзарядки, либо перегрев батареи. Почему при зарядке аккумулятора электролит мутнеет и как исправить ситуацию, расскажет наша информация.
Замерз электролит в аккумуляторе: причины, последствия, что делать
Содержание статьи
С наступлением зимы автовладелец может обнаружить, что морозным утром автомобиль не заводится, а дальнейшее исследование покажет, что в аккумуляторе замерз электролит. Такое может случиться и не в самый сильный мороз, хотя при минимальной плотности с завода 1,27 г/см³ замерзание электролита происходит при температуре около -68 С°, а такие условия встречаются редко. Чтобы не попасть в такую ситуацию, необходимо знать причины, по которым электролит может замерзнуть в аккумуляторной батарее.
Снижение плотности электролита
Проблеме замерзания электролита подвержены свинцово-кислотные аккумуляторные батареи, которые устанавливают на большинство современных автомобилей с двигателем внутреннего сгорания. В них используется жидкий электролит, вода в котором и превращается в лед при низких температурах.
В них используется жидкий электролит, вода в котором и превращается в лед при низких температурах.
В новом аккумуляторе плотность электролита находится в пределах 1,27-1,30 г/см³, чего вполне достаточно для наших климатических условий. Зависимость температуры замерзания от плотности электролита можно увидеть в таблице:
Из таблицы видно, что с увеличением плотности снижается температура, при которой электролит замерзает. Но данная зависимость не является пропорциональной, поскольку при избыточной плотности 1,40 г/см³, температура замерзания скачкообразно повышается. При этом среда в аккумуляторе становится более агрессивной, а это приводит к его ускоренному износу.
Откуда же берется низкая плотность электролита в АКБ? Большинство автолюбителей винят в этом производителя, поэтому пытаются сдать аккумулятор назад, требуя гарантийной замены. Но такие случаи встречаются редко и чаще всего проблема неправильном обслуживании аккумулятора.
Дело в том, что продавец предлагает полностью заряженный аккумулятор, а это значит, что плотность его электролита находится в допустимых пределах, и он не может замерзнуть на обычных морозах. Но при его разрядке часть кислотного компонента оседает на пластинах в виде сульфатов, соответственно, плотность электролита уменьшается, а это приводит к повышению температуры, при которой он может замерзнуть.
Но при его разрядке часть кислотного компонента оседает на пластинах в виде сульфатов, соответственно, плотность электролита уменьшается, а это приводит к повышению температуры, при которой он может замерзнуть.
При этом прослеживается простая закономерность, если у электролита снижена плотность, значит, АКБ разряжена и его нужно зарядить. Большой ошибкой при этом будет доливка электролита, поскольку, повысив морозостойкость, мы никак не улучшаем электротехнические свойства батареи.
Отсюда делаем вывод: если в аккумуляторной батарее появился лед, значит, она была разряжена и ее нужно немедленно зарядить.
Важно знать, что, если АКБ слегка разряжается в теплое время года и плотность электролита при этом снижается, обнаружить это без замера плотности невозможно, поскольку она спокойно запускает двигатель, справляясь со своей непосредственной задачей. При наступлении же морозов батарея может замерзнуть в лед.
Как не допустить замерзание электролита
Чтобы не стать жертвой замерзшего аккумулятора, необходимо провести определенные операции, которые позволят отследить его состояние. Прежде всего, периодически нужно проверять заряд аккумулятора при помощи мультиметра. Заряженный аккумулятор будет выдавать приблизительно 12,6-12,7 вольт при заглушенном моторе.
Прежде всего, периодически нужно проверять заряд аккумулятора при помощи мультиметра. Заряженный аккумулятор будет выдавать приблизительно 12,6-12,7 вольт при заглушенном моторе.
При выходе из автомобиля недопустимо оставлять включенными габариты и нужно закрывать двери авто, поскольку горящая лампочка-индикатор, сигнализирующая о незапертой двери может разрядить аккумулятор в течение нескольких суток при длительной стоянке, и этом случае при сильных морозах в аккумуляторе может образоваться лед.
Чтобы не допустить преждевременной разрядки, перед зимой аккумулятор необходимо обслужить. Первое — тщательно вымыть его корпус, поскольку осевшая пыль и грязь проводит электрический ток, а это уменьшает заряд. Если есть доступ к банкам аккумулятора, нужно проверить плотность электролита. Далее нужно полностью зарядить АКБ, после чего установить его в автомобиль.
Если в результате неправильной эксплуатации в АКБ образовался лед, подкуривать его нельзя. Батарею нужно снять с машины, отогреть в теплом помещении и полностью зарядить. Известно, что при замерзании жидкость расширяется, поэтому лед, образовавшийся в банках, может разорвать корпус аккумулятора, замкнуть или повредить цепи внутри. Поскольку такие поломки не относятся к гарантийным случаям, такую батарею никто заменять не будет.
Батарею нужно снять с машины, отогреть в теплом помещении и полностью зарядить. Известно, что при замерзании жидкость расширяется, поэтому лед, образовавшийся в банках, может разорвать корпус аккумулятора, замкнуть или повредить цепи внутри. Поскольку такие поломки не относятся к гарантийным случаям, такую батарею никто заменять не будет.
После проведения поточного обслуживания и установки аккумулятора, необходимо проверить утечку тока, что позволит избежать преждевременной разрядки. Не нужно допускать длительных простоев автомобиля, даже если планируется длительная стоянка, автомобиль желательно заводить и прогревать, чтобы аккумулятор подзаряжался. Если это невозможно, специалисты советуют отключить минусовую клемму АКБ, чтобы разорвать цепь аккумулятора и воспрепятствовать его разрядке. Если планируется оставить автомобиль на всю зиму, аккумуляторную батарею нужно снять, зарядить и поместить в сухое прохладное место, например, в погреб.
Видео: Замерз аккумулятор автомобиля. Почему? Что делать? Просто о сложном
Почему? Что делать? Просто о сложном
Заключение
Чтобы не допустить ситуации, когда электролит замерзает в банках аккумулятора, достаточно тщательно следить за его состоянием. Даже лучшие аккумуляторы не смогут выдержать неправильной эксплуатации, работать без дополнительного ухода и подзарядки при необходимости. Важно периодически тестировать состояние установленной на машину АКБ, что позволит существенно продлить срок ее эксплуатации и избежать ненужных финансовых трат.
Как действовать дальше, при процессе заряжения одна банка не кипит? | Описания, разъяснения | Статьи
Вот, автомобильный источник питания набрал необходимый для него заряд, далее банки или отсеки (как кому удобно) принимаются кипеть под прямым влиянием электрического тока приступает выделяться газ, как правило, это водород (H) и кислород (0). Если зарядка АКБ прошла хорошо, то кипеть обязаны все банки автомобильного источники питания—однако бывает происходит такое, что пять банок— выделяют пузырьки, а если одна банка не хочет бурлить? По каким причинам такое случается?Данный процесс при заряжении можно видеть на обслуживаемых источниках питания, как раз там вы можете без проблем и просто отвинтить и смотреть за кипением банки. Тем не менее, по каким причинам случается процесс бурления?
Тем не менее, по каким причинам случается процесс бурления?
ПО КАКИМ ПРИЧИНАМ ОДНА БАНКА АККУМУЛЯТОРА НЕ КИПИТ?
- Не кипит, ибо банка замкнула, попал инородный предмет, или же посыпались пластины, собственно вследствие этого не происходит заряд.
- Произошла полная разбалансировка заряда. Такая штука тоже случается, однако редко. Скажем— пять банок заряжены и бурлят, а по какой-нибудь непонятному основанию шестая банка еще не до конца зарядилась.
- Элементарно у источника питания подходит к концу срок его функционирования. Последняя банка обкрошилась целиком и полностью, и безусловно электролит в ней мутный.
Что после такого дальше делать, выбрасывать аккумуляторную батарею? Не спешите, ибо в 40% случаев его можно возобновить.
КАК ДЕЙСТВОВАТЬ ДАЛЬШЕ?
- Возобновить банку аккумуляторной батареи —для начала необходимо из нее вынуть инородный предмет.
 Порой хватит только ее хорошенько «промыть», как привило в таких случаях необходимы кардинальные выходы из сложившейся ситуации. Если там поистине малая частица, какая «коротит» пластины, то нормально функционирование действительно возобновится почти на девяносто процентов. Потом можно совершать зарядку лишь одной банки автомобильной аккумуляторной батареи.
Порой хватит только ее хорошенько «промыть», как привило в таких случаях необходимы кардинальные выходы из сложившейся ситуации. Если там поистине малая частица, какая «коротит» пластины, то нормально функционирование действительно возобновится почти на девяносто процентов. Потом можно совершать зарядку лишь одной банки автомобильной аккумуляторной батареи. - С процессом заряжения тоже все элементарно. Вам необходимо «посадить» все банки аккумуляторной батареи в «ноль», как правило это производится нагрузкой, скажем, можно вешать на клеммы лампу из фары. Приблизительно за 24 часа аккумуляторная батарея автомобиля целиком разрядится. После этого вам необходимо поставить источник питания на зарядку, на этот момент энергию обязаны впитывать все банки, то есть бурлить будут уже все шесть банок.
- Если вы разобрали мутный отсек, вытащили пакет пластин, а они рассыпались у вас на руках – то здесь уже ничего не сделать, это полное разрушение.
 Скорее всего, в остальных банках такая же картина. Так что тут только покупка «новой» АКБ!
Скорее всего, в остальных банках такая же картина. Так что тут только покупка «новой» АКБ!
Вообще не всем и не всегда удается возродить аккумуляторную батарею, к тому же и промывка не помогает, только лишь бывалые мастера смогут вам это сделать. Первый пункт в этом списке наиболее сложный, доведется резать корпус вашего источника питания, а это ведь не шутки, ибо во всех аккумуляторных батареях имеется кислота (непременно защищайте руки) – если возрождение прошло хорошо, тогда необходимо герметично запаять корпус.
Если у вас не бурлит один отсек, то:
- Необходимо понаблюдать за электролитом – в прозрачном источнике питания (из белого пластика) будет заметно сквозь стенки, если источник питания темного цвета, тогда необходимо чем-то «затянуть» (безупречно был бы ареометр) и вылить, скажем в стакан.
- Если жидкость бесцветная – то, наверное, либо ее замкнуло, либо она не дозаряжена.

Вскрываем верхний корпус – вынимаем пластины из аккумуляторной батареи и глядим, если есть замыкание выпускаем его отдаем пластины назад, заливаем электролитом, запаиваем корпус.
ЧИТАЙТЕ ТАКЖЕ
Power в вашем кармане: как работает аккумулятор | EAGLE
Трудно представить себе мир без батареек. Попрощайтесь со смартфоном, который таскаете в кармане. Или ноутбук, который вы берете с собой куда угодно. О, а та машина, которую ты водишь? Боюсь, вам нужно научиться заводить его вручную, когда батарейки здесь уже нет. Эти маленькие химические супергерои играют огромную и жизненно важную роль в нашей современной жизни, но многие из нас принимают их как должное. Мы просто предполагаем, что они подключаются и обеспечивают питание для более важных целей, но как именно все это работает? К счастью, вы дизайнер электроники, поэтому вам нужно знать немного больше.Возможно, вы просто размещаете держатель батареи на своей печатной плате, но это помогает узнать, что делает эта батарея и почему.
Что такое аккумулятор?
Это может показаться риторическим вопросом, но что такое батарея? Конечно, мы знаем, что он обеспечивает питание, когда мы подключаем его к цепи, но в этом металлическом контейнере могут быть маленькие инженерные гномы, работающие за кулисами! Вы можете думать о батареях как о небольших капсулах с химическим потенциалом. Если оставить его в покое, химическое вещество внутри батареи ничего не делает, но когда вы подключаете его к цепи, эти химические вещества оживают, превращая химическую энергию в электрическую для питания всех ваших самых любимых электронных устройств.
Этот процесс преобразования химической энергии в электрическую может выделяться в течение нескольких дней, месяцев или лет, в зависимости от того, какой тип батареи вы выберете и сколько химикатов в ней. Например, вы можете заменять батарею в часах только раз в пять лет, а батареи AA в контроллере Xbox, возможно, придется менять каждый месяц. Чтобы понять, как устроена батарея изнутри, полезно начать с общей анатомии и строения этих маленьких химических супергероев.
Внешняя структура
Начиная с внешней стороны, любая батарея, независимо от формы и размера, всегда будет иметь две клеммы, одну положительную (+) и одну отрицательную (-). В обычных сухих батареях типа AA или AAA эти две клеммы находятся на каждом конце устройства. Но на чем-то более крупном, например, автомобильном аккумуляторе, положительная и отрицательная клеммы расположены на верхней части устройства.
Обычная батарея на 9 В с положительной и отрицательной клеммами на одной стороне.(Источник изображения)
Независимо от того, где расположены клеммы аккумулятора, результат всегда один и тот же. Вы соединяете две клеммы вместе в цепь, чтобы выполнить определенную задачу, называемую нагрузка . Нагрузкой может быть что угодно, от питания смартфона до вращения мотора.
Внутренняя работа
Внутри батареи происходит передача энергии. Здесь вы всегда найдете три основных компонента, независимо от того, на какую батарею вы смотрите:
- Электроды .
 Сначала вы найдете пару электродов. Одним из них является анод , , положительно заряженный электрод, который подключается к отрицательному выводу батареи. Другой — это катод , , отрицательно заряженный электрод, который подключается к положительному выводу.
Сначала вы найдете пару электродов. Одним из них является анод , , положительно заряженный электрод, который подключается к отрицательному выводу батареи. Другой — это катод , , отрицательно заряженный электрод, который подключается к положительному выводу. - Разделитель . Эти два электрода всегда следует держать отдельно друг от друга, иначе при включении в цепь произойдет короткое замыкание батареи. Вот где пригодится сепаратор ; он не позволяет электронам течь прямо от анода к катоду.
- Электролит . Наконец, все батареи имеют своего рода химическую пасту или жидкую начинку с ионизированным элементом. У этих ионов много дополнительных электронов. Электролит — это, в конечном счете, то, что позволяет электрическому заряду течь между катодом и анодом. Без электролита в батарее не произошло бы никакого волшебства.
Здесь вы можете увидеть внутреннюю структуру типичной сухой аккумуляторной батареи. (Источник изображения)
Как работает аккумулятор?
Мы уже знаем, что батарея преобразует химическую энергию в электрическую для питания наших электронных устройств. Но как именно работает этот преобразующий процесс? Опять же, независимо от того, с какой батареей вы работаете, первичная электрохимическая реакция всегда одинакова.
Но как именно работает этот преобразующий процесс? Опять же, независимо от того, с какой батареей вы работаете, первичная электрохимическая реакция всегда одинакова.
Во-первых, вы должны подключить аккумулятор к цепи, имеющей нагрузку, или к той работе, которую должна выполнять батарея. После соединения двух клемм батареи между анодом, катодом и электролитом начинает происходить множество электрохимических реакций.
Первое, что происходит, это то, что анод подвергается процессу, называемому реакцией окисления .Это причудливый способ сказать, что на аноде накапливается куча избыточных электронов из-за смеси ионов в электролитной пасте. Если что-то и нужно знать об электронах, так это то, что они ненавидят находиться рядом друг с другом, когда их слишком много, и поэтому они будут искать новое место, чтобы называть их своим домом. Они могут просто пройти прямо к катоду, но их путь блокирует разделитель, поэтому им придется пройти долгий путь по цепи.
В то время как на аноде происходит реакция окисления, на другой стороне батареи происходит реакция восстановления на катоде посредством обмена ионами и свободными электронами. Здесь катод сокращает количество электронов, создавая свободное пространство для электронов на аноде.
Здесь катод сокращает количество электронов, создавая свободное пространство для электронов на аноде.
В реакциях окисления и восстановления электроны перемещаются от анода к катоду, чтобы найти баланс. (Источник изображения)
Итак, теперь у вас есть две противоположные переменные. У вас слишком много электронов на аноде и недостаточно электронов на катоде. Что просходит? Когда вы подключаете эту батарею к цепи, избыточные электроны на аноде будут проходить по цепи, питая все ваши компоненты, пока они, наконец, не достигнут катода.Этот процесс происходит снова и снова, и все благодаря электрохимическому процессу, который приводит в движение электролит. В конце концов, электролитная паста закончится, и когда это произойдет, химическая реакция прекратится, и ваша батарея разрядится.
Чтобы любая батарея преобразовывала химическую энергию в электрическую, анод и катод должны быть сделаны из двух проводящих металлов. Почему это? Один металл в батарее должен быть готов накапливать избыточные электроны, а другой — для их уменьшения. Если бы вы использовали два металла одного и того же типа, они бы оба выполняли одно и то же действие, и электрохимический процесс никогда не сработал бы.
Если бы вы использовали два металла одного и того же типа, они бы оба выполняли одно и то же действие, и электрохимический процесс никогда не сработал бы.
Используя два разных металла, например цинк в аноде и диоксид марганца в катоде, вы можете гарантировать, что существует сила, толкающая и тянущая электроны от одного вывода к другому. Весь этот процесс называется электроотрицательностью .
Вы можете увидеть, как все это сочетается, на практическом примере, таком как фонарик:
- Когда вы вставляете батарею в фонарик, вы замыкаете цепь, и химическая энергия внутри батареи начинает преобразовываться в электрическую.
- Внутри батареи избыточные электроны накапливаются на аноде в результате окисления, а электроны на катоде восстанавливаются.
- Электронам теперь нужно куда-то идти, поэтому они выбирают путь наименьшего сопротивления через вашу цепь для питания вашего фонарика, от анода до катода.
Батареи будут вести себя одинаково в любом устройстве. Всегда будет разница в электрическом заряде между положительным и отрицательным полюсами, что заставляет электроны течь и генерировать электричество.Без этой разницы в заряде электроны уже были бы в покое и балансе, так зачем им заставлять цепь работать?
Всегда будет разница в электрическом заряде между положительным и отрицательным полюсами, что заставляет электроны течь и генерировать электричество.Без этой разницы в заряде электроны уже были бы в покое и балансе, так зачем им заставлять цепь работать?
Когда используется более одной батареи
Ваш простой фонарик может работать от одной батареи, но большинству устройств требуется более одного химического супергероя, чтобы получить электрическую энергию. От смартфонов до электромобилей вы обычно найдете аккумуляторы, расположенные одним из двух способов: Parallel или Serial . Вот разница между ними:
Параллельно
При параллельном подключении нескольких батарей вы получаете одинаковое общее напряжение, но увеличиваете ток.Этот повышенный уровень тока измеряется в ампер-часах или миллиампер-часах. Например, аккумуляторная батарея, измеренная на 500 миллиампер-часов, может производить 500 миллиампер тока на нагрузку в течение часа.
Батареи, включенные параллельно, увеличивают ток. (Источник изображения)
(Источник изображения)
Серийный
При последовательном подключении нескольких батарей вы получаете тот же общий ток, но теперь ваше напряжение будет выше. Например, автомобильный аккумулятор имеет шесть отдельных аккумуляторных ячеек, каждая из которых на 2 вольта.В сумме этот автомобильный аккумулятор работает от 12 вольт.
Батареи, включенные последовательно, увеличивают свое напряжение. (Источник изображения)
Типы аккумуляторов
В мире аккумуляторов существует множество разновидностей на выбор в зависимости от ваших конкретных потребностей. Вместо того, чтобы просто заваливать вас огромным списком, имеет смысл разбить батареи на две основные категории: Primary и Secondary .
Первичные батареи
Первичные батареи или первичные элементы — это типичные одноразовые батареи, которые работают один раз, пока не разрядятся, а затем выбрасываются.Эти батареи предлагают мгновенный источник энергии в вашем кармане и включают:
Цинк-углерод
Этот первичный элемент представляет собой одноразовую батарею для повседневного использования, которая, вероятно, лежит у вас дома. Этот недорогой аккумулятор питает повседневные электронные устройства, от фонарика до пульта дистанционного управления. В угольно-цинковой батарее положительный электрод сделан из углерода, окруженного порошкообразным углеродом и оксидом марганца. Отрицательный электрод изготовлен из сплава цинка, а электролит состоит из пасты хлорида аммония.
Этот недорогой аккумулятор питает повседневные электронные устройства, от фонарика до пульта дистанционного управления. В угольно-цинковой батарее положительный электрод сделан из углерода, окруженного порошкообразным углеродом и оксидом марганца. Отрицательный электрод изготовлен из сплава цинка, а электролит состоит из пасты хлорида аммония.
Типичная угольно-цинковая батарея различных размеров. (Источник изображения)
Щелочной
Трудно отличить щелочную батарею от угольно-цинковой, но щелочные батареи могут накапливать и производить больше энергии и часто могут оставаться заряженными годами. В щелочной батарее вы найдете положительный электрод из оксида марганца, отрицательный электрод из цинка и электролит, состоящий из щелочного раствора гидроксида калия.
Щелочные батарейки выглядят как цинковые, но обладают большей мощностью. (Источник изображения)
Литий
Обычно эти литиевые батарейки размером с кнопку используются в часах и слуховых аппаратах, но они содержат тот же набор химических веществ, что и щелочные батарейки. Верхняя сторона литиевого элемента, отрицательный электрод, сделана из цинка или лития. Нижняя сторона, или положительный электрод, сделана из оксида марганца, оксида серебра или оксида меди.
Верхняя сторона литиевого элемента, отрицательный электрод, сделана из цинка или лития. Нижняя сторона, или положительный электрод, сделана из оксида марганца, оксида серебра или оксида меди.
Эти литиевые батареи могут питать часы годами. (Источник изображения)
Вторичные батареи
В отличие от первичных батарей, которые могут вырабатывать электроэнергию только до тех пор, пока не иссякнет ее химическая энергия, аккумуляторные вторичные батареи могут обратить вспять процесс их старения. Эти батареи направляют всю реакцию электрохимического процесса в обратном направлении, стреляя электронами от катода к аноду, пока элемент батареи не будет полностью восстановлен. Типы вторичных батарей:
Свинцово-кислотный
Это аккумулятор, который вы найдете в вашем автомобиле, и он состоит из шести отдельных аккумуляторных ячеек, каждая из которых вырабатывает 2 вольта, что дает вам 12-вольтовый аккумулятор, подключенный параллельно.Каждый элемент свинцово-кислотной батареи имеет положительный электрод из диоксида свинца, отрицательный электрод из металлического свинца и электролит из серной кислоты.
Свинцово-кислотные аккумуляторы делают всю тяжелую работу по питанию вашего автомобиля. (Источник изображения)
Никель-кадмиевый
Nicad, или Ni-Cd, был традиционной технологией перезаряжаемых батарей, которая использовалась до 1990-х годов и часто использовалась как альтернатива утилизации 1,5-вольтовых батарей. Хотя эти аккумуляторные батареи дешевы и их можно перезаряжать сотни раз, они также имеют небольшую проблему с памятью.Как же так? Если вы не разрядите аккумулятор Nicad полностью перед его повторной зарядкой, со временем у вас будет меньше заряда.
Аккумуляторы Nicad склонны к потере памяти. (Источник изображения)
Никель-металлогидрид
Аккумуляторы NiMH работают так же, как аккумуляторы Nicad, но менее подвержены проблемам с памятью. Эта батарея в значительной степени заняла место Nicad после 1990-х годов, главным образом потому, что она менее токсична, чем батарея Nicad, и не требует полной разрядки перед зарядкой.
Вся мощь аккумулятора Nicad без забот о потере памяти. (Источник изображения)
Литий-ионный
Большинство основных электронных устройств в наши дни используют литий-ионные батареи, в том числе ваши смартфоны, ноутбуки, планшеты и т. Д. Литий имеет массу преимуществ по сравнению с батареями Nicad и NiMH, в том числе более экологичен, работает при более высоких напряжениях и дважды хранится. столько же энергии. Кроме того, вы можете заряжать и разряжать литий-ионный аккумулятор без каких-либо проблем с памятью.
Вы когда-нибудь разбирали свой мобильный телефон? Это литиевая батарея, которую вы найдете внутри. (Источник изображения)
Кто изобрел батарею?
Большинство приписывают изобретение Алессандро Вольта в 1791 году, но слышали ли вы когда-нибудь о Багдадской батарее?
Еще в 1938 году археолог Вильгельм Кениг обнаружил несколько странно выглядящих глиняных горшков во время раскопок в Багдаде, Ирак. Горшки датируются примерно 200 г. до н. Э. и содержал железный стержень, окруженный медью.При тестировании внутри были обнаружены следы кислой жидкости, и, если что-то нужно знать об аккумуляторах, у нас есть два разных металла, смешанных с химическим электролитом. Была ли это первая древняя батарея? Были произведены современные копии, и эти багдадские батареи действительно производят электрический заряд.
до н. Э. и содержал железный стержень, окруженный медью.При тестировании внутри были обнаружены следы кислой жидкости, и, если что-то нужно знать об аккумуляторах, у нас есть два разных металла, смешанных с химическим электролитом. Была ли это первая древняя батарея? Были произведены современные копии, и эти багдадские батареи действительно производят электрический заряд.
Багдадская батарея была первой древней батареей? (Источник изображения)
Но что касается 1792 года, багдадских батарей просто не существовало, и поэтому наша история начинается с итальянского врача Луиджи Гальвани, экспериментирующего с ногой мертвой лягушки.Вставив два разных металла в лапу лягушки, он смог произвести то, что он назвал «животным электричеством», когда лапа лягушки подпрыгнула. Однако в то время Гальвани не знал, что лягушка не испускает какое-то первичное электричество. Скорее, он должен был благодарить строительные блоки современной батареи.
Чтобы доказать это, итальянский физик Алессандро Вольта поставил эксперимент, в котором он сложил слои цинка и серебра друг на друга, которые были разделены пропитанным рассолом картоном.Эта гальваническая батарея, которая сейчас считается первой современной батареей, способна производить постоянный ток.
Гальваническая батарея по замыслу Алессандро Вольта.
Что здесь общего между экспериментами Гальвани и Вольта? Оба использовали основные принципы батарей, используя два разных металла и электролит. Гальвани использовал два разных металлических скальпеля, а лапа лягушки действовала как своего рода химический электролит. В гальванической батарее Вольта рассол действовал как электролит между двумя разными проводящими металлами, цинком и серебром.
После его новаторского эксперимента Алессандро Вольта приписывают изобретение первой батареи, а остальное хорошо… история. Сегодня мы усовершенствовали этот базовый набор принципов для питания всех наших электронных устройств.
Как ухаживать за свинцово-кислотными аккумуляторами
Знаете ли вы основную причину выхода свинцово-кислотных аккумуляторов из строя и потери емкости? Сульфатирование аккумулятора. Это причина этих проблем в 80% случаев. Но с правильными инструментами для обслуживания батарей и небольшими затратами времени вы вернете свои батареи к жизни и обеспечите их надежную работу.Узнайте все, что вам нужно знать об обслуживании аккумулятора.
Стартерные батареи, полутяговые батареи, тяговые батареи и даже стационарные батареи — все они нуждаются в техническом обслуживании, чтобы полностью раскрыть свой потенциал. Регулярно выполняйте три основные задачи технического обслуживания, которые мы здесь описываем, чтобы оптимизировать производительность и надежность ваших свинцово-кислотных аккумуляторов.
Добавьте дистиллированную воду в свинцово-кислотную батарею
Жидкость в свинцово-кислотном аккумуляторе называется электролитом.На самом деле это смесь серной кислоты и воды. Когда аккумулятор заряжается, электролит нагревается, и часть воды испаряется. Во время процесса, называемого электролизом, вода распадается на газообразные водород и кислород, которые рассеиваются. Результат? Уровень электролита в батарее со временем снижается.
Если уровень электролита слишком низкий, пластины аккумуляторных элементов обнажатся и будут повреждены. Кроме того, серная кислота будет более концентрированной. Это означает, что вам необходимо заменить электролит.Вот как вы это делаете.
1. Проверьте уровень воды в аккумуляторе с помощью индикатора уровня.
Как узнать, когда нужно добавить воды в аккумулятор? Это один из самых частых вопросов, которые нам задают. Вы можете постоянно проверять свою батарею или каждую батарею в каждой машине в вашем парке, но это ужасно трудоемко, и есть более простые подходы. Индикаторы специально разработаны для проверки уровня воды в аккумуляторе. Они уведомят вас, когда вам нужно зарядить аккумулятор.
Доступны разные системы. Один из них — Smartblinky. Вы устанавливаете его за вилкой аккумулятора. Есть ли зеленый свет? Ваш уровень электролита в порядке. Когда индикатор загорится красным, значит, пора добавить воды в аккумуляторные батареи.
Вы добавляете воду в аккумулятор до или после зарядки? Перед зарядкой всегда убедитесь, что электролит покрывает пластины аккумулятора. Если пластины закрыты, зарядите аккумулятор и при необходимости долейте. Это связано с тем, что электролит расширяется во время зарядки и, скорее всего, выльется через край, если вы уже долили его перед зарядкой.
2. Убедитесь, что у вас всегда под рукой есть дистиллированная вода.
Никогда не заливайте в аккумулятор обычную воду. Это повредит вашу батарею. Вам нужно использовать дистиллированную воду. Она также известна как деионизированная вода и деминерализованная вода. В основном это вода, прошедшая фильтрацию для удаления металлов и минералов, которые могут мешать процессам в вашей батарее.
Купите дистиллированную воду в строительном магазине или у специалиста по автомобильным запчастям. Также легко сделать самому. Вам нужна простая водопроводная вода и устройство для деминерализации, такое как Hydropure.Самые простые из этих устройств наполнены смолой. Вы впускаете водопроводную воду, смола отфильтровывает металлы и минералы из воды, и у вас остается деионизированная, деминерализованная, дистиллированная вода, которая подходит для использования с вашей батареей.
3. Установить автоматическую систему заливки воды в аккумуляторную батарею
Сколько дистиллированной воды вы добавляете в аккумулятор? Это еще один вопрос, который нам часто задают. Ответ варьируется от одной батареи к другой. Это одна из причин, по которой мы рекомендуем использовать систему наполнения аккумулятора водой.
В системе заливки воды в аккумуляторной батарее используются крышки заливных горловин с поплавками, которые соединяются друг с другом с помощью водяных шлангов. Они предохраняют аккумулятор от переполнения. И они экономят ваше время. Все, что вам нужно сделать, это налить в шланг дистиллированную воду. Все остальное сделает система розлива.
Свинцово-кислотная батарея выравнивания
Вторая задача при обслуживании аккумулятора — зарядка. Очень важно, чтобы батареи заряжались равномерно.
Чем больше вы используете аккумулятор, тем больше может колебаться емкость разных элементов.Одна ячейка может быть полностью заряжена, а другая — наполовину. В этом случае аккумулятор заряжается не полностью.
Мы советуем использовать уравнительное зарядное устройство аккумулятора для выполнения выравнивающего заряда. Выравнивание заряда батареи — это простой процесс, который предотвращает это. Зарядное устройство для аккумулятора обеспечивает более низкий ток в течение более длительного периода времени. В то время как типичный цикл зарядки длится около восьми часов, стабилизация занимает около одиннадцати часов. Поскольку он также требует более длительного времени охлаждения, чем обычный цикл зарядки, лучше всего выполнять выравнивающий заряд в выходные дни, чтобы у вас было достаточно времени для зарядки и охлаждения аккумулятора перед тем, как снова его использовать.
Что делать, если ваша батарея уже страдает от сульфатации? К счастью, сульфатирование можно контролировать и даже уменьшить. Просто пошлите через батарею большие кратковременные токи. Этот процесс называется восстановлением батареи.
Держите аккумулятор в чистоте
И последнее, но не менее важное: очень важно содержать аккумулятор в чистоте.
Известно, что кислота, грязь и пыль в аккумуляторной батарее вызывают токи утечки, которые приводят к разрядке аккумуляторной батареи и ее дисбалансу.Чистая батарея необходима. Как лучше это сделать? Используйте пароочиститель батареи, например AQ steam или AQ steam pro.
У вас есть вопросы по любой из этих задач по обслуживанию аккумуляторных батарей? Вы хотите знать, какие продукты лучше всего подходят для обслуживания свинцово-кислотных аккумуляторов? Вы найдете ответы — и все остальное, что вам нужно знать — в нашем профессиональном руководстве по обслуживанию аккумуляторов. Нажмите на кнопку, чтобы посмотреть его в Интернете.
Загрузите нашу инструкцию по обслуживанию аккумуляторов
Новый химический состав твердотельных батарей со стеклянным электролитом обеспечивает в 3 раза большую емкость
Этот сайт может получать партнерские комиссии за ссылки на этой странице.Условия эксплуатации.Обычно это довольно твердое предположение, что любая «революционная химия батарей», о которой только что стало известно, рухнет и сгорит — иногда буквально. Может быть, в этой штуке в качестве катализатора используется какой-то невероятно дорогой металл, или она должна быть переохлаждена, чтобы вести себя хорошо, или вам нужно тщательно следить за выделением газа, чтобы штука не взорвалась.Теперь в городе появилась новая химия аккумуляторов, и она исходит от Джона Б. Гуденафа (на фото ниже): того же парня, который придумал катод из оксида кобальта, который питает химию литий-ионных аккумуляторов, которые мы знаем и любим. Гуденаф предсказывает, что новая химия будет иметь удельную энергию в три раза выше, чем у литий-ионных элементов.
Литий-ионные аккумуляторы в последнее время были в новостях, потому что вещи, в которые их вставляет Samsung, обычно взрываются. У них даже были стиральные машины, которые, видимо, взорвались из-за сочувственного замешательства.Так что, вероятно, будет разумно отложить суждение до тех пор, пока что-то не будет произведено в больших масштабах. Другие химические составы аккумуляторов появлялись раньше и терпели неудачу. Литиевые батареи , воздух — отличный пример очень интересного химического состава батарей, который мы не можем использовать, потому что его разработка тормозится техническими проблемами, которые мы пока не можем решить.
Этот новый химический состав имеет одно важное отличие от литий-ионной модели: он использует натрий вместо лития. Натрий и литий — щелочные металлы с одинаковым зарядом +1.Но натрия намного больше, чем лития, что может сделать новый химический состав батарей менее дорогим, чем литий-ионные элементы.
Потом взрыв. Литий-ионные аккумуляторы страдают от образования металлических «дендритов» лития, которые «распространяются как кудзу» между анодом и катодом, что вызывает неконтролируемую реакцию и замыкает элемент. Взрыв. Чтобы избежать этого, в новой химии батарей Гуденаф в качестве электролита используется матрица из отожженного стекла. Это дает несколько возможных преимуществ по сравнению с большинством жидких электролитов, а именно то, что он не будет брызгать на вас ужасной жидкостью из аккумулятора, если корпус каким-либо образом поврежден.Стеклянные маты также препятствуют образованию дендритов, потому что анод никогда не вступает в реакцию с матами.
Я большой поклонник стеклянных матов, потому что они обладают чрезвычайно блестящими физическими свойствами. Гуденаф и его коллеги использовали листы стекловолокна в качестве матрицы электролита и покрыли их металлическим натрием (или литием) в качестве анода. Затем их конструкция заполнила оставшиеся полости углеродом. Контактная поверхность между металлическим анодом и стеклянным матом настолько плотная, что фактически считается смачиваемой.
Гуденаф делает ставку на то, что химия новой батареи будет достаточно хорошей. [Я ждал этого. -Ред] . По его словам, «безопасный, недорогой, полностью твердотельный элемент с огромной емкостью, обеспечивающий большую плотность энергии и длительный срок службы, подходящий для питания полностью электрического дорожного транспортного средства или для хранения электроэнергии от ветра или солнца. энергия ».
Батареи и элементы
Введение
В самом простом виде аккумулятор можно рассматривать как насос, который обеспечивает энергию для перемещения заряда по цепи.
Для создания разности потенциалов или электродвижущей силы (ЭДС) требуется запас энергии. Один из таких методов — аккумулятор или элемент. Термин «батарея» обычно используется для обозначения любого устройства, преобразующего химическую энергию в электрическую. Однако, строго говоря, термин «батарея» используется, когда несколько электрических элементов соединены вместе, чтобы обеспечить источник разности потенциалов в цепи. Если это всего лишь один химический источник, он называется клеткой.
История
Рисунок 1.Эксперимент на ноге лягушки Гальвани
В 1791 году Гальвани заметил, что цепь, созданная из двух разных металлов, при прикосновении к концам лапы мертвой лягушки вызывает ее подергивание. Два металла создавали электрический ток в ноге лягушки, заставляя мышцы сокращаться. Ранние батареи были усовершенствованием этого метода преобразования химической энергии в электрическую.
Первая батарея была изобретена в 1793 году Алессандро Вольта. Так же, как два разных металла, соприкасающихся с влажной кожей лягушки, вызывают электрический ток, ранние батареи увеличивали напряжение, которое можно было получить, сложив стопку дисков из серебра и цинка, зажатых между бумагой, пропитанной соленой водой. решение, как показано на рисунке 2.В честь Вольты мы используем вольт как единицу измерения разности потенциалов и ЭДС.
Рисунок 2. Батарея ячеек Вольта.
Работа от аккумулятора
Почему это производит электричество? Поток тока можно понимать как поток ионов от металла с большей реакционной способностью к металлу с меньшей реакционной способностью. Ионы, перемещающиеся от одного электрода к другому, создают электрический заряд, который нейтрализуется потоком электронов по проводу.
Прежде чем рассматривать реакцию двух металлов, подумайте, что происходит, когда мы помещаем единственный металлический электрод в электролит.Некоторые из атомов металла в электролите переходят в раствор в виде ионов, а оставшиеся электроны создают отрицательный заряд на металле. Разделение ионов и электронов приводит к разделению заряда. Однако это накопление заряда не может продолжаться бесконечно, потому что по мере накопления отрицательного заряда в металле для положительных ионов металла становится все труднее переходить в раствор. Подобное накопление положительного заряда в электролите также предотвращает накопление заряда. Эта степень накопления заряда зависит от металла и представляет собой работу, необходимую для отделения электронов от ионов.Это известно как принцип электронейтральности
.Точно так же, если медную пластину поместить в водный раствор сульфата меди (II), медь также потеряет ионы. Эти реакции часто записывают как Cu | Cu +2 это реакция полуячейки.
Цинк склонен терять ионы больше, чем медь. Когда две ячейки соединяются вместе (с использованием медной проволоки для соединения электродов и пористого барьера, который позволяет ионам проходить, известного как солевой мостик, соединяющего электролиты, накопление электронов на цинке будет проходить через провод на медь.
Ионы меди в электролите приобретают электроны и становятся атомами меди.
Таким образом, реакцию можно записать,
Zn | Zn 2+ | | Cu 2+ | Cu
Рисунок 3. Ячейка Данила
Для продолжения реакции необходимо снять заряд. Это может быть достигнуто путем сочетания второй реакции, в которой электроны в металле превращают ионы в электролите в металл. В качестве более конкретного примера рассмотрим цинковый электрод в электролите из раствора сульфата меди (II).
Потеря электронов цинком известна как окисление. Zn (s) → Zn 2+ + 2 e — . (1)
Провод, соединяющий цинковый электрод с медным электродом, позволяет электронам течь к медному электроду. Ионы меди в растворе сульфата меди захватывают электроны и становятся атомами меди на медном электроде. Захват электронов ионами известен как уменьшение
.Cu +2 + 2e — → Cu (т). (2)
Тогда чистые реакции будут:
Zn + Cu 2+ → Cu (тв) + Zn 2+
Когда два электрода соединяются проволокой, накопленный заряд может течь, и электроны объединяются.В самых простых типах аккумуляторов есть два проводника, изготовленные из разных материалов, которые частично находятся в растворе, что позволяет электронам и ионам свободно течь, известная как электролит.
На медном электроде (катоде) кислота растворяет металлическую медь с образованием газообразного водорода H + . Реакция будет продолжаться до тех пор, пока не закончится запас цинка. Электроны с их отрицательным зарядом притягиваются к медному электроду, что вызывает протекание тока. Одна из проблем этой ячейки заключается в том, что через короткое время ток перестает течь, потому что водородные пузыри блокируют ток.
Элементы, в которых используются водные (содержащие воду) электролиты, ограничены по напряжению до менее 2 В, потому что кислород и водород в воде диссоциируют в присутствии напряжений, превышающих это напряжение. Литиевые батареи (см. Ниже), в которых используются неводные электролиты, не имеют этой проблемы и доступны с напряжением от 2,7 до 3,7 В. Однако использование неводных электролитов приводит к тому, что эти элементы имеют относительно высокий внутренний импеданс.
Серия действий
В серии активности металл отдает электроны любому другому металлу, находящемуся ниже его в серии активности.Элементы, которые получают электроны, называются отрицательными железами. Элементы, которые теряют электроны, называются положительными ионами. Любой более активный металл отдаст электроны менее активному металлу. Это поможет защитить менее активный металл от коррозии. Например, стальные корабли часто имеют цинковые стержни, прикрепленные к бортам корабля. Поскольку сталь корродирует кислородом воды и воздуха, цинк отдает электроны стали и защищает ее от коррозии.
Батареи в цепях
Как и любой другой электрический компонент, отдельные элементы можно размещать последовательно или параллельно.Последовательно их напряжение суммируется, чтобы создать батарею с более высоким напряжением, но ток остается таким же, как в одной ячейке. Параллельно батареи имеют одинаковое напряжение, но ток суммируется, чтобы создать батарею с более высоким током.
Батареи и внутреннее сопротивление
Рисунок 4. Реальный элемент с внутренним сопротивлением.
Настоящая батарея имеет внутреннее сопротивление, r , которое снижает напряжение при подключении элемента к нагрузке. Если вы попытаетесь пропустить через батарею слишком большой ток, внутреннее сопротивление преобразует собственную химическую потенциальную энергию батареи в тепловую.Аккумулятор нагревается, и электроны покидают отрицательный электрод с относительно небольшой энергией.
Рис. 5. Ячейка с внутренним сопротивлением последовательно с нагрузкой, R .
ЭДС батареи задается формулой E и представляет собой напряжение, когда батарея разомкнута. Если бы батарея не имела внутреннего сопротивления, ток, протекающий в цепи, определялся бы законом Ома, I = E / R , где R — сопротивление нагрузки.
Внутреннее сопротивление добавляет к общему сопротивлению цепи. Если мы назовем новое общее сопротивление ячейки и нагрузки, R экв = r + R
Тогда ток равен I = E / R eq = E / ( r + R ). (3)
Поскольку R eq больше, чем R , ток, протекающий в цепи, уменьшается. Поэтому, если мы делаем ячейку, мы хотим, чтобы внутреннее сопротивление было как можно меньше.
Какое напряжение на резисторе R ? Ясно, что это не то же самое, что ЭДС из-за внутреннего сопротивления. Мы знаем, что ЭДС E = Ir + IR . Мы также знаем, что напряжение на резисторе R составляет IR . Преобразуя эти два уравнения, мы находим напряжение в виде E , r и R .
В = E — Ir (4).
Это уравнение также показывает, что если мы потребляем большой ток из цепи, мы видим, что напряжение снижается.Хорошим примером этого является заведение автомобиля с включенными фарами. Когда ключ зажигания поворачивается, электрический стартер-двигатель потребляет большой ток, прежде чем он начнет вращаться. Ток для этого вырабатывается автомобильным аккумулятором, который также питает фары. В этот момент напряжение, подаваемое на фары, снижается, и огни тускнеют, когда автомобиль заводится. Они быстро снова загораются после того, как двигатель переворачивается, поскольку стартер требует меньшего тока. (Когда автомобиль заводится, стартер не потребляет ток, потому что он отключается от двигателя.)
| Металл | Металлический ион | Реакционная способность | |
|---|---|---|---|
| Литий | Li + | Наиболее реактивный | |
| Калий | K 3 + | 9047 Calium 904||
| Натрий | K + | ||
| Магний | Mg 2+ | ||
| 904 904 904 904 904 904 904 Алюминий | Mn 2+ | ||
| Цинк | Zn 2+ | ||
| Хром | Cr 2+ , Cr 3+ 904 904 904 904 904 904 904 Железо 2+ , Fe 3+ | ||
| Свинец | Pb 2+ 9047 5 | ||
| Медь | Cu 2+ | ||
| Меркурий | Hg 2+ | ||
| Серебро4 | 9047 9047 9047 Золото | Au + , Au 3+ | Наименее реактивная |
| Платина | Pt 2+ |
Таблица 1.Серия по реактивности металлов от наиболее реактивной до наименее реактивной.
Мощность и КПД
Выходная мощность батареи равна P E = I 2 R (5)
Но из уравнения (3), I = E / R экв = E / ( r + R ), следовательно, P = E 2 R / ( р. + р. ) 2 (6)
Аналогичным образом мощность, выделяемая аккумулятором в виде тепла из-за внутреннего сопротивления, составляет P r = I 2 r = E 2
Как сделать аккумулятор в 7 Steps
От смартфонов до электромобилей и даже Tesla Powerwall — от аккумуляторных батарей до нашей современной жизни.Но вы когда-нибудь задумывались, что находится внутри этих устройств, которые позволяют нам отправлять смайлики, ездить по городу и многое другое? Если это так, посетите Advanced Battery Facility в Pacific Northwest National Laboratory (PNNL), одну из немногих экспериментальных лабораторий по производству аккумуляторов, открытых для публики.
Этот объект позволяет ученым тестировать все виды новых материалов, включая литий, серу, натрий и магний, чтобы продлить срок службы батарей и сохранить больше сока.Эти испытания помогают ученым из национальных лабораторий, университетов и промышленности найти более мощные и безопасные замены для самой распространенной на сегодняшний день перезаряжаемой батареи — литий-ионной батареи.
В Advanced Battery Facility ученые тестируют новые материалы, собирая из них экспериментальные батареи размером с сотовый телефон, которые называются «ячейками мешочка», потому что они заключены в герметичный пластиковый мешок. Как и в полноразмерных батареях, каждая ячейка-пакет состоит из трех основных частей: двух электродов и электролита, разделяющего их.
Когда аккумулятор накапливает, а затем высвобождает электричество, крошечные заряженные частицы перемещаются вперед и назад между каждым электродом, попутно проходя через электролит. Этот процесс дает нам электричество, необходимое для просмотра видеороликов о кошках на наших телефонах, путешествий по городу на электромобилях и даже для хранения возобновляемой энергии, когда солнце не светит или ветер не дует.
Так как же собрать все эти детали? Вот семь наиболее важных шагов в процессе, который занимает около двух недель:
- Электродная суспензия: Порошки, содержащие активные вещества в электродах, такие как литий, смешиваются в большой емкости со связующими материалами, которые действуют как клей для создания того, что ученые называют суспензией или липким тестом.
- Покрытие электрода: Затем суспензия распределяется на очень длинный (до нескольких сотен футов) кусок фольги, который медленно скатывается при высокой температуре (до 300 градусов по Фаренгейту), превращая электрод в твердое тело.
- Штамповка электродов: Обожженный электродный рулон разрезается на более мелкие кусочки, которые помещаются под сверхострую прямоугольную матрицу. Резким движением матрица быстро надавливает на электродный лист и вырезает отдельный элемент электродной батареи.
- Укладка электродов: Автоматическая машина использует всасывание для захвата и освобождения листов вырезанного электродного материала и обертывания изолирующим слоем между каждым листом. В результате получается пакет электродов размером с кредитную карту, который выплевывается из машины поворотом металлической руки.
- Изготовление пакетов: Специальный влагостойкий барьерный материал прессуется для создания прямоугольных форм. Пакет электродов вставляется в полученную форму для создания ячейки мешочка.
- Впрыск электролита: Жидкий электролит впрыскивается в открытый аккумуляторный отсек.
- Герметизация батареи: Пропитанный электролитом батарейный отсек герметично закрывается и помещается в вакуумную камеру, которая удаляет излишки воздуха изнутри сумки.
Пакеты-элементы затем подвергаются испытаниям, непрерывно заряжаются и разряжаются в камерах с контролируемой окружающей средой, имитирующих экстремальные температуры от 20 до -140 градусов по Фаренгейту.
Если тестовый пакет-ячейка будет работать хорошо, его уникальное сочетание различных материалов может позволить всем нам продлить нашу жизнь дольше и лучше. Когда обнаруживается многообещающая смесь аккумуляторов, Национальные лаборатории работают с частными компаниями над лицензированием технологии, которую компании развивают в продукт, который можно вывести на рынок, чтобы все мы могли купить и извлечь из этого выгоду.
Примечание редактора. Этот пост представляет собой сокращенную версию статьи, написанной Тихоокеанской северо-западной национальной лабораторией, одной из 17 национальных лабораторий Министерства энергетики.Узнайте больше о работе PNNL по хранению энергии на батареях для электромобилей и электросети.
Электролитическая ячейка | устройство | Britannica
Электролитическая ячейка , любое устройство, в котором электрическая энергия преобразуется в химическую энергию или наоборот. Такая ячейка обычно состоит из двух металлических или электронных проводников (электродов), расположенных отдельно друг от друга и находящихся в контакте с электролитом ( q.v. ), обычно растворенным или конденсированным ионным соединением.При подключении электродов к источнику постоянного электрического тока один из них заряжается отрицательно, а другой — положительно. Положительные ионы в электролите мигрируют к отрицательному электроду (катоду) и там объединяются с одним или несколькими электронами, теряя часть или весь свой заряд и становясь новыми ионами, имеющими более низкий заряд или нейтральными атомами или молекулами; в то же время отрицательные ионы мигрируют к положительному электроду (аноду) и переносят на него один или несколько электронов, также становясь новыми ионами или нейтральными частицами.Общий эффект этих двух процессов — это перенос электронов от отрицательных ионов к положительным ионам, химическая реакция ( см. реакция окисления-восстановления). Примером может служить электролиз хлорида натрия (поваренная соль) с образованием металлического натрия и газообразного хлора; энергия, необходимая для протекания реакции, обеспечивается за счет электрического тока. Другие распространенные применения электролиза включают электроосаждение для рафинирования или нанесения покрытия на металлы и производство каустической соды.
В случае веществ, которые генерируют энергию, а не потребляют ее, когда они реагируют друг с другом, часть или вся эта энергия может быть преобразована в электричество, если реакция может быть разделена на окисление и восстановление, которое может быть выполнено. происходить на отдельных электродах. В свинцово-кислотной аккумуляторной батарее, например, диоксид свинца, металлический свинец и серная кислота реагируют с образованием сульфата свинца и воды; отдельными процессами являются окисление свинца до сульфата свинца на одном электроде и восстановление диоксида свинца до сульфата свинца на другом, в то время как электрический заряд переносится через электролит за счет миграции ионов водорода.Эти процессы создают движущую силу (напряжение или электрический потенциал), которая заставляет электричество течь через внешнюю цепь, соединяющую два электрода. В элементах и батареях используются многие другие химические комбинации.
Другие элементы для выработки электричества средствами, отличными от движения проводника в магнитном поле, включают солнечные элементы, в которых поток электронов между полупроводниками возникает в результате поглощения света, и топливные элементы, в которых непрерывная подача жидкого или газообразного окислителя , такой как кислород, удаляет электроны с катода, поскольку восстановитель, такой как водород, подает электроны на анод.
