Типы автотранспортных предприятий
Категория:
Техническое обслуживание автомобилей
Публикация:
Типы автотранспортных предприятий
Читать далее:
Типы автотранспортных предприятий
Предприятия автомобильного транспорта подразделяются на автотранспортные, автообслуживающие и авторемонтные.
Автотранспортные предприятия осуществляют перевозку грузов или пассажиров, а также все производственные функции по техническому обслуживанию, ремонту, хранению и снабжению подвижного состава.
По своему назначению АТП делятся на грузовые, пассажирские (легковые и автобусные), смешанные и специальные (скорой медицинской помощи, пожарные, коммунального обслуживания и т. п.).
Рекламные предложения на основе ваших интересов:
По организации производственной деятельности АТП подразделяются на: комплексные, осуществляющие транспортную работу, все виды технического обслуживания (ТО), текущего ремонта (TP) и хранение подвижного состава; кооперированные, деятельность которых осуществляется с учетом централизации транспортной работы, а также централизации (частичной или полной) работ ТО и ТР.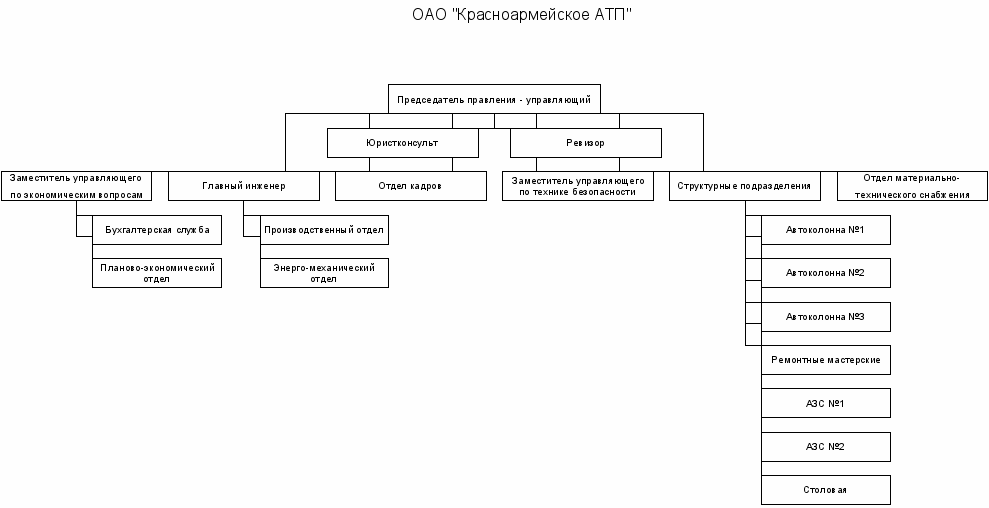
На основном предприятии выполняются наиболее трудоемкие и сложные виды технического обслуживания: второе техническое обслуживание (ТО-2), диагностирование и текущий ремонт (TP) всего подвижного состава, а также все виды технического обслуживания (ТО), TP и хранение той части подвижного состава, который базируется на основном предприятии. В филиалах, помимо хранения подвижного состава, выполняются техническое обслуживание в объеме ежедневного технического обслуживания (ЕО), первого технического обслуживания (ТО-1) и несложный текущий ремонт.
Размещение подобных кооперированных предприятий с филиалами способствуют приближению подвижного состава к потребителям, сокращению нулевых пробегов, а также ликвидации малоэффективных мелких предприятий.
К автообслуживающим предприятиям относятся базы централизованного обслуживания, станции технического обслуживания, гаражи-стоянки (гостиницы для автотуристов—мотели, кемпинги), пассажирские автостанции и автовокзалы, грузовые автостанции и топливозаправочные станции.
Базы централизованного технического обслуживания (БЦТО) предназначены для централизованного выполнения сложного вида технического обслуживания и крупного текущего ремонта подвижного состава, эксплуатируемого небольшими некомплексными АТП, расположенными вблизи БЦТО.
Размеры базы измеряются числом приписанных к ней автомобилей, которое должно примерно составлять 1000—2000 автомобилей. В зависимости от типа приписанного подвижного состава базы могут быть предназначены для грузовых автомобилей, автобусов и легковых автомобилей.
Станции технического обслуживания предназначены для обслуживания автомобилей индивидуальных владельцев, выполнения отдельных работ и всего объема (по видам) ТО и ремонта автомобилей, а также снабжения их запасными частями, принадлежностями и эксплуатационными материалами.
Они подразделяются на городские и придорожные.
Гаражи-стоянки (ГС) являются предприятиями для хранения автомобилей. Иногда на них выполняют техническое обслуживание автомобилей индивидуальных владельцев. К этому типу предприятий относятся автогостиницы (мотели) и кемпинги — гаражи-стоянки для временного хранения автомобилей туристов.
Пассажирские автостанции и автовокзалы предназначены для обслуживания междугородных и межрайонных автобусных и таксомоторных сообщений. Автостанции сооружают в городах, населенных пунктах, а также на отдельных участках дорог с относительно малой интенсивностью движения автобусов. Автовокзалы, как правило, сооружаются в крупных городах, где концентрируются конечные пункты междугородных автобусных сообщений.
Автовокзал представляет собой комплекс сооружений, обеспечивающих обслуживание пассажиров и автобусных бригад. Для пассажиров устраивают посадочные площадки, залы ожидания, билетные кассы, камеры хранения, буфеты, гостиницы, рестораны, комнаты матери и ребенка и другие бытовые помещения. Для автобусных бригад предусматривают комнаты отдыха и служебные помещения. На автовокзалах обслуживают и транзитных пассажиров по смешанным перевозкам (автобусы — железная дорога — водный транспорт). Автовокзалы делятся на классы в зависимости от их пропускной способности.
Грузовые автостанции предназначаются для сбора, хранения, комплектования и экспедирования грузов. Размер станций определяется грузооборотом и вместимостью складов.
Автозаправочные станции являются предприятиями по снабжению автомобилей эксплуатационными материалами, преимущественно топливом, а также маслами, консистентными смазками, антифризом, водой и иногда воздухом для шин.
АЗС подразделяют на городские и придорожные. Обычно АЗС специализируются по роду топлива: бензиновые, дизельные, газобаллонные.
Авторемонтные предприятия являются также специализированными предприятиями, производящими ремонт (восстановление) автомобилей и агрегатов. К ним относятся авторемонтные и агрегатно-ремонтные заводы, авторемонтные мастерские, шиноремонтные мастерские или заводы, аккумуляторные зарядно-ре-монтные станции и специализированные цехи.
Рекламные предложения:
Читать далее: Структура пассажирских и грузовых автотранспортных предприятий
Категория: — Техническое обслуживание автомобилей
Главная → Справочник → Статьи → Форум
|
Наименование |
Модель, тип, ГОСТ или ТУ |
Краткая техническая характеристика |
Разработчик конструкции |
Завод-изготовитель |
|
1. |
||||
|
1.1. Прибор для проверки рулевых управлений |
K-187 |
Переносной, ручной пределы измерения динамометра 0-800Н (0-80кгс) угломера 0-15° |
НИИАТ |
Казанский ОЭЗ «Автоспецоборудование» |
|
1.2. Манометр шинный |
ГОСТ 9921-81 |
Ручной ц.д. 0,2кгс/см2 Предел измерения давления 0,3-0,9 МПа (3,0÷9,0кгс/см 2) |
|
Завод
«Автоэлектроприбор» г. |
|
1.3. Молоток с длинной ручкой |
ГОСТ 2310-70 |
Масса 500 г, длина ручки 600 мм |
|
Минавтопром СССР |
|
1.4.Секундомер |
СМ-60 |
Ц.д. 0,1 сек. 60 с, 60 мин. |
|
2-й часовой з-д г. Москва |
|
1.5. Линейка для замера топлива |
— |
Длина
500 мм ц. |
|
Собственного изготовления |
|
1.6. Штангенциркуль |
ШЦ-1-125-0.1 |
Предел измерений 0-125мм ц.д. 1,0 мм. |
|
з-д «Красный инструментальщик» г. Киров |
|
1.7. Манометр шинный |
МД-14-39122001 |
Предел измерений давления 0,05÷0,3МПа (0,5÷3кгс/см2) ц.д. 0,01МПа |
Входит в комплект инструмента ав-ля |
Минавтопром СССР ЛиАЗ |
|
1. |
300 ГОСТ 427-75 |
Цена деления 1,0 мм предел измерения 0-300 мм |
|
Ленинградское объединение «Комплекс» |
|
2. Оборудование и приборы используемые после TO-1 |
||||
|
2.1. Подъемник канавный передвижной |
П-227 |
Грузоподъемностью 10 кН передвижной, гидравлический, одноплунжерный с ручным приводом |
Грозненский ОЭЗ «Автоспецоборудование» |
|
|
2. |
П-113 |
Гидравлический, одноплунжерный с ручным приводом, грузоподъемностью 40 кН |
Грозненский ОЭЗ «Автоспецоборудование» |
|
|
2.3. Прибор для проверки рулевых управлений |
К-187 |
Переносной, ручной |
НИИАТ |
Казанский ОЭЗ «Автоспецоборудование» |
|
2.4. Деселерометр |
1155M |
Ручной, инерционного действия маятниковый. |
ЦПКТБ «Автоспецоборудование» |
Новгородское ПО «Автоспецоборудование» |
|
2.5. Прибор для определения люфтов трансмиссий |
К-428А |
Переносной с замером окружных люфтов, масса 2,8 кг |
Ленфилиал НИИАТ |
Казанский ОЭЗ «Автоспецоборудование» |
|
2.6. Манометр шинный |
ГОСТ 9921-81 |
Ручной ц. |
|
З-д «Автоэлектроприбор» г.Рига |
|
2.7. Манометр шинный |
МД-14-3912200-Г |
Предел измерения давления 0,5÷0,3МПа (0,5÷3 кгс/см2) ц.д. 0,01 МПа |
Входит в комплект инструмента ав-ля |
Минавтопром СССР ЛиАЗ |
|
2.8. Линейка измерительная металлическая |
300 ГОСТ 427-75 |
Ц. |
|
Ленинградское объединение «Комплекс» |
|
2.9. Молоток с длинной ручкой |
ГОСТ 2310-70 |
Масса 500 г длина ручки 600 мм |
|
|
|
2.10. Уровнемерная трубка (из комплекта приборов Э-401) |
— |
Стеклянная Ø=5мм l=200 мм |
Новгородское п/о «Автоспецоборудование» |
|
|
2. |
ШЦ-1-125-0,1 |
Предел измерения 0-125 мм ц.д. 1,0 мм |
|
3-д «Красный инструментальщик» г.Киров |
|
2.12. Кружка с мыльной эмульсией, кисть |
|
|
|
Покупное |
|
3. Оборудование и приборы, используемые после ТО-2 |
||||
|
3. |
К-468 |
Комплект состоит: — с максимальным крутящим моментом 150 Н.м (15 кгс.м) — с максимальным крутящим моментом 300 Н.м (30 кгс.м) — ключа для настройки; В комплект входят также семь сменных головок |
ЦПКТБ «Автоспецоборудование» |
Казанский ОЭЗ «Автоспецоборудование» |
|
3.2. Haбор щупов №2 |
ГОСТ 882-75 |
Предел толщины 0,02÷0,5мм |
|
|
|
3.3. Компрессометр для карбюраторных двигателей регистрирующий |
К-181 |
Переносной, с фиксацией максимального давления на бумажном бланке, степень точности показаний 0,035 МПа (0,35 кгс/см2) |
ЦПКТБ «Автоспецоборудование» |
Казанский ОЭЗ «Автоспецоборудование» |
|
3.4. Прибор для проверки натяжения приводных ремней |
К-403 |
Переносной, диапазон измерения: силы, прикладываемой к ремню 20-40Н (2-4 кгс) прогиба ремня до 30 мм |
НИИАТ |
Казанский ОЭЗ «Автоспецоборудование» |
|
3. |
К-428А |
Переносной с замером окружных люфтов, масса 2,8 кг |
Ленфилиал НИИАТ |
То же |
|
3.6. Прибор для проверки рулевых управлений |
К-187 |
Переносной, ручной, пределы измерений динамометра 0-800Н (0-80 кгс) угломера 0-15° |
НИИАТ |
–»– |
|
3.7. Прибор для проверки переднего моста автомобиля |
T-1 |
Ручной,
с измерительным индикатором часового типа ц. |
НИИАТ |
Казанский ОЭЗ «Автоспецоборудование» |
|
3.8. Линейка измерительная металлическая |
300 ГОСТ 427-75 |
Ц.д. 1,0 мм, предел измерения 0-300 мм |
|
Ленинградское объединение «Комплекс» |
|
3.9. Прибор для проверки бензонасосов на автомобилях |
527Б |
Переносной, пределы измерения по шкале манометра 0-0,1 МПа (0-1 кгс/см2) |
НИИАТ |
Чистопольский завод «Автоспецоборудование» |
|
3. |
П-227 |
Грузоподъемность 10 кН передвижной, гидравлический, одноплунжерный, с ручным приводом |
Грозненский опытно-экспериментальный завод «Автоспецоборудование» |
|
|
3.11. Стенд для контроля и регулировки углов установки колес легковых автомобилей |
К-111 |
Стационарный, электрический. Точность измерения по электрооптической системе ±15мин. |
НИИАТ «Автоспецоборудование» |
Казанский ОЭЗ «Автоспецоборудование» |
|
или |
стационарные, с оптической измерительной системой |
ЦПКТБ «Автоспецоборудование» |
Казанский ОЭЗ «Автоспецоборудование» |
|
|
3. |
2182 |
Универсальная реечная, ручная, телескопическая, ход подвижной трубки 170 мм |
Казанский опытно-экспериментальный завод «Автоспецоборудование» |
|
|
3.13. Деселерометр |
1155M |
Ручной, инерционного действия, маятниковый. Предел измерения 0-8 м/сек2 |
ЦПКТБ «Автоспецоборудование» |
Новгородское производственное объединение «Автоспецоборудование» |
|
3. |
К-121 |
Стационарный, электромеханический, точность балансирования 15г |
Новгородское п/о АСО |
Йошкар-Олинский з-д нестандартного оборудования |
|
или |
передвижной, электромеханический (без снятия колес), точность балансировки 15г |
То же |
То же |
|
|
3.15. Прибор для проверки фар автомобиля |
К-303 |
Передвижной, оптический с фотометрическим
устройством. Точность установки фары, мин.: по вертикали ±20 по горизонтали ±90 |
ЦПКТБ «Автоспецоборудование» |
Новгородское производственное объединение «Автоспецоборудование « |
|
3.16. Комплект приборов и инструмента для технического обслуживания аккумуляторных батарей |
Э-401 |
Переносной |
Новгородское производственное объединение «Автоспецоборудование» |
|
|
3.17. Манометр шинный |
ГОСТ 9921-81 |
Ручной ц. Предел измерения давления 0,3-0,9 МПа (3,0-9,0 кгс/см2) |
|
З-д «Автоэлектроприбор» г.Рига |
|
3.18. Штангенциркуль |
ШЦ-125-0,1 |
Предел измерения 0-125 мм ц.д. 1,0 мм |
|
З-д «Красный инструментальщик» г.Киров |
|
3.19. Прибор для проверки свободного и полного хода педалей |
К-446 |
Переносной, ручной, точность измерения 2,5 мм, масса 0,5 кг, входят в комплект оборудование |
НИИАТ |
Новгородское производственное объединение «Автоспецоборудование» |
|
3. |
К-183 |
Ручной с фиксацией давления |
Казанский ОЭЗ РАСО |
|
|
3.21. Подъемник канавный передвижной |
П-113 |
Гидравлический, одноплунжерный, с ручным приводом Грузоподъемность 400 кгс |
Грозненский опытно-экспериментальный завод «Автоспецоборудование» |
|
|
3.22. Газоанализатор |
К-456 |
Для определения содержания СО в отработавших гагах |
Новгородское п/о РАСО (в настоящее время не выпускается) |
|
|
или |
То же |
Смоленское п/о Аналитприбор |
||
|
|
или |
Для определения процентного СО в пределах от 0-10% цена деления 0,1% |
|
ВНР |
|
или |
Для определения процентного СО в пределах от 0-10%, цена деления 0,1% |
|
ГДР |
|
|
3. |
ИДА-106 |
Для определения дымности отработавших газов дизельных двигателей |
|
Кировоканский з-д. «Автоматика» |
|
3.24. Секундомер |
СМ60 |
Ц.д.
0,1 сек. |
|
2-й часовой з-д г.Москва |
|
3.25. |
1131 |
В набор входят три манометра со специальными наконечниками |
ЦПКТБ «Автоспецоборудование» |
Загорский завод «Автоспецоборудование» |
|
3.26. Манометр шинный |
МД-14-3912200-Г |
Предел измерения давления 0,05÷0,3МПа (0,5÷3 кгс/см2) ц.д. 0,01 МПа |
Входит в комплект инструмента автомобиля |
Минавтопром СССР ЛиАЗ |
|
3. |
Тип 2 СКМ-5 модель 468 |
Стационарный, 2-х стоечный, электромеханический |
Грозненский ОЭЗ «Автоспецоборудование» |
|
|
3.28. Молоток с длинной ручкой |
ГОСТ 2310-70 |
Масса 150 г длина ручки 600 мм |
|
|
|
3.29. Кружка с мыльной эмульсией, кисть |
|
|
|
Покупное |
|
3. |
С-401 |
Стационарная. |
ЦПКТБ «Автоспецоборудование» |
Бежецкий завод «Автоспецоборудование» |
|
4. Диагностическое оборудование и приборы для Д-1 |
||||
|
4.1. Стенд для контроля и регулировки управляемых колес легковых автомобилей |
К-111 |
Стационарный, электрический, точность измерения ±15мин. |
ЦПКТБ «Автоспецоборудование» |
Казанский ОЭЗ «Автоспецоборудование» |
|
4. |
К 208 М |
Стационарный, роликовый с принудительным приводом колес автомобиля. Колея проверяемого автомобиля 1100-1800 мм. Нагрузка на ось 2000 кгс; |
Новгородское производственное объединение «Автоспецоборудование» |
|
|
4.3. Стенд для проверки тормозов автомобилей |
СПТ2-К259 |
Нагрузка
на ось 60 кН |
Челябинский политехнический институт |
Челябинский авторемонтный завод Минавтотранс РСФСР |
|
или |
5612×2272×680 |
То жe |
То же |
|
|
4. |
СХК-2 |
Имитируемая скорость 7 км/час. |
|
Киевский завод «Автотехника» |
|
4.5. Стенд для проверки тормозов |
КИ 4998 |
Допустимая нагрузка на ось 40 кН (4,0 тс) |
ГОСНИТИ |
Береговский ОЭЗ Госкомсельхозтехника УССР |
|
4. |
П-113 |
Гидравлический, одноплунжерный, с ручным приводом Грузоподъемность 40 кН (4,0 тс) |
Грозненский опытно-экспериментальный завод «Автоспецоборудование» |
|
|
4.7. Воздухораздаточная колонка |
С-401 |
Стационарная Давление подводимого воздуха 0,5-0,8 МПа (5-8 кгс/см2) |
ЦПКТБ «Автоспецоборудование» |
Бежецкий завод «Автоспецоборудование» |
|
4. |
К-303 |
Передвижной, оптический с фотометрическим устройством Точность установки фары, мин,: по вертикали ±20 по горизонтали ±90 |
ЦПКТБ «Автоспецоборудование» |
Новгородское производственное объединение «Автоспецоборудование» |
|
4.9. Линейка для проверки схождения передних колес |
2182 |
Универсальная, реечная, телескопическая, ход подвижной трубки 170 мм |
Казанский ОЭЗ » Автоспецоборудование» |
|
|
4. |
К 187 |
Переносной, ручной. Пределы измерения угломера 0-15° |
НИИАТ |
Казанский опытно-экспериментальный завод «Автоспецоборудование» |
|
4.11. Установка для проверки рулевых управлений с гидроусилителем |
ЦПКТБ K-465 |
Передвижная, гидравлическая |
ЦПКТБ «Автоспецоборудование» |
Загорский з-д РАСО |
|
4. |
К-456 |
Для определения содержания СО в отработавших газах |
Новгородское д/о РАСО (в настоящее время не выпускается) |
|
|
или |
То же |
|
Смоленское п/о «Аналитприбор» |
|
|
или |
Для определения процентного СО в пределах от 0-10% цена деления 0,1% |
|
ВНP |
|
|
или |
То же |
|
ГДР |
|
|
4. |
ИДА-106 |
Для определения дымности отработавших газов дизельных двигателей |
|
Кировокамский з-д «Автоматика» |
|
4.14. Манометр шинный |
ГОСТ 9921-81 |
Ручной ц.д. 0,2кгс/см2 Предел измерения давления 0,3÷0,9 МПа (3,0÷9,0 кгс/см2) |
|
3-д «Автоэлектроприбор» г.Рига Минавтопром СССР |
|
4. |
— |
Стеклянная Ø=5 мм l=200 мм |
Новгородское производственное объединение «Автоспецоборудование» |
|
|
4.16. Прибор для проверки натяжения приводных ремней |
К-403 |
Переносной, диапазон измерения: силы прикладываемой к ремню 20-40Н (2-4 кгс.) |
НИИАТ |
Казанский ОЭЗ «Автоспецоборудование» |
|
4. |
К-446 |
Переносной, ручной, точность измерения 2,5 мм, масса 0,5 кг, входят в комплект оборудования комплекса K-455М |
НИИАТ |
Новгородское п/о «Автоспецоборудование» |
|
4.18. Прибор для определения люфтов в трансмиссии |
К-428А |
Переносной с замером окружных люфтов, масса 2,8 кг |
Ленфилиал НИИАТ |
Казанский ОЭЗ «Автоспецоборудование» |
|
4. |
Т-1 |
Ручной с измерительным индикатором часового типа ц.д. 0,01 мм |
НИИАТ |
То же |
|
4.20. Подъемник канавный |
П-227 |
Передвижной, гидравлический, одноплунжерный, с ручным приводом Грузоподъемность 10 кН |
Грозненский ОЭЗ «Автоспецоборудование» |
|
|
4.21. Линейка измерительная металлическая |
300 ГОСТ 427-75 |
Ц. |
|
Ленинградское объединение «Комплекс» |
|
4.22. Подъемник канавный |
Тип 2 СКМ-5 модель 468 |
Стационарный, 2-х стоечный, электромеханический |
Грозненский ОЭЗ «Автоспецоборудование» |
|
|
4.23. Манометр шинный |
МД-14-3912200-Г |
Предел измерения давления 0,05÷0,3 МПа (0,5÷3кгс/см2) ц.д. 0,01МПа |
Входит в комплект инструмента автомобиля |
Минавтопром СССР ЛиАЗ |
|
4. |
СМ-60 |
Ц.д. 0,1 сек. 60с., 60 мин. |
|
2-й часовой з-д г .Москва |
|
5. Диагностическое оборудование и приборы для Д-2 |
||||
|
5.1. Стенд для контроля и регулировки управляемых колес легковых автомобилей |
К-111 |
Стационарный, электрический, точность измерения ±15 мин. |
ЦПКТБ «Автоспецоборудование» |
Казанский ОЭЗ «Автоспецоборудование» |
|
или |
Стационарный с оптической измерительной системой |
То же |
То же |
|
|
5. |
К-208М |
Стационарный, роликовый с принудительным приводом колес автомобиля. Колея проверяемого автомобиля 1100-1800 мм, нагрузка на ось 2000 кгс |
Новгородское производственное объединение «Автоспецоборудование» |
|
|
5.3. Стенд для определения тягово-экономических показателей легковых автомобилей |
К-409М |
Входит в комплект К-455М, нагрузка на ось 15кН, (1,5 тс) |
То же |
|
|
5.4. Комплекс диагностического оборудования |
К-455M |
Площадь размещения комплекса 144 (6×24)м2 Суммарная мощность потребителей тока 1,7 квт. |
–»– |
|
|
5.5.Станция диагностики грузовых автомобилей и автобусов с карбюраторными двигателями |
4819B-К-490 |
Мощность
двигателей до 200 кВт (270 л.с.) |
Госавтотранс НИИ проект |
Киевский опытный завод «Автотехника» Минавтотранс УССР |
|
или |
Нагрузка на ось 8,0 т.с, мощность двигателя до 147кВг (200 л.с.) |
Челябинский политехнический институт |
Челябинский авторемонтный з-д Минавтотранс РСФСР |
|
|
5.6.Стенд для проверки тормозов автомобилей |
СПТ2-К259 |
Нагрузка
на ось 60 кН (6,0 тс) |
То же |
То же |
|
или |
5612×2272×680 |
–»– |
–»– |
|
|
5.7.Стенд для проверки установки передних колес |
4872 |
Максимальное боковое усилие 300 Н (30 кгс) погрешность 10 % |
ГОСНИТИ |
Береговский ОЭЗ Госкомсельхозтехника УССР |
|
5.8. Стенд для проверки тяговых качеств |
КИ-8930 (для 3-осных автомобилей) |
Максимальное тяговое усилие 5кН (500кгс) |
|
Береговский ОЭЗ Госкомсельхозтехника УССР |
|
5.9. Стенд для проверки тормозов |
КИ 4998 |
Нагрузка на ось 40кН (4,0 тс) |
|
То же |
|
5.10. Подъемник канавный |
П-227 |
Передвижной, гидравлический, одноплунжерный с ручным приводом. Грузоподъемность 10 кН. |
Грозненский ОЭЗ «Автоспецоборудование» |
|
|
5.11. Подъемник канавный передвижной для грузовых автомобилей |
П-113 |
Передвижной, гидравлический, одноплунжерный, с ручным приводом. Грузоподъемность 40 кН (4,0 тс) |
То же |
То же |
|
5.12. Подъемник канавный |
Тип 2 СКМ5 модель 468 |
Стационарный, двухстоечный, электромеханический |
То же |
То же |
|
5.13. Воздухораздаточная колонка автоматическая |
C-401 |
Стационарная, давление подводимого воздуха 0,5-0,8 МПа (5-8 кгс/см2) |
ЦПКТБ «Автоспецоборудование» |
Бежецкий з-д «Автоспецоборудование» |
|
5.14. Прибор для проверки и регулировки фар |
К-303 |
Передвижной, оптический с фотометрическим устройством |
То же |
Новгородское п/о «Автоспецоборудование» |
|
5.15. Линейка для проверки схождения передних колес |
2182 |
Универсальная, реечная, телескопическая, ход подвижной трубки 170 мм |
Казанский опытно-экспериментальный завод «Автоспецоборудование» |
|
|
5.16. Установка для проверки рулевых управлений с гидроусилителем |
ЦПКТБ |
Передвижная гидравлическая |
ЦПКТБ «Автоспецоборудование» |
Загорский з-д РАСО |
|
5.17. Газоанализатор |
К-456 |
Для определения содержания СО в отработавших газах |
Новгородское п/о РАСО (в настоящее время не выпускается) |
|
|
или |
То же |
Смоленское п/о «Аналитприбор» |
||
|
или |
Для определения, процентного СО в пределах от 0-10% цена деления 0,1% |
|
ВНР |
|
|
или |
То же |
|
ГДР |
|
|
5.18. Измеритель дымности автомобилей |
ИДА-106 |
Для определения дымности отработавших газов дизельных двигателей |
|
Кировоканский з-д «Автоматика» |
|
5.19. Манометр шинный |
ГОСТ 9921-81 |
Ручной цена деления 0,2 кгс/см2 предел измерения давления 0,3-0,9 МПа (3,0-9,0 кгс/см2) |
|
З-д «Автоэлектроприбор» г. Рига Минавтопром СССР |
|
5.20. Комплект приборов и инструмента для технического обслуживания аккумуляторных батарей |
Э-401 |
Переносной 350×280×340 |
Новгородское п/о «Автоспецоборудование» |
|
|
5.21. Прибор для проверки натяжения приводных ремней |
К-403 |
Переносной диапазон измерения силы, прикладываемой к ремню 20-40 Н (2-4 кгс) |
НИИАТ |
Казанский опытно-экспериментальный завод «Автоспецоборудование» |
|
5.22. Прибор для проверки свободного и полного хода педалей |
К-446 |
Переносной, ручной, точность измерения 2,5мм, масса 0,5 кг, входит в комплект оборудования комплекса К-455M |
НИИАТ |
Новгородское п/о «Автоспецоборудование» |
|
5.23. Прибор для определения люфтов трансмиссии |
К-428А |
Переносной с замером окружных люфтов, масса 2,8 кг |
Ленфилиал НИИАТ |
Казанский опытно-экспериментальный з-д «Автоспецоборудование» |
|
5.24. Прибор для проверки переднего моста автомобилей |
T-1 |
Ручной с измерительным индикатором часового типа ц.д. 0,01 мм |
НИИАТ |
Казанский ОЭЗ «Автоспецоборудование» |
|
5.25. Прибор для проверки рулевого управления |
K-187 |
Переносной, ручной, пределы измерения угломера 0-15 град. |
НИИАТ |
То же |
|
5.26. Анализатор двигателя |
К-488 |
Передвижной, электронный 1000×700×1900 |
Опытно-экспериментальный завод Новгородского ПО «Автоспецоборудование» |
|
|
5.27. Прибор для проверки бензонасосов на автомобилях |
527Б |
Переносной. Пределы измерения по шкале манометра 0-0,1 МПА (0-1 кгс/см2) |
НИИАТ |
Чистопольский завод «Автоспецоборудование» |
|
5.28. Прибор для определения технического состояния цилиндропоршневой группы автомобильных двигателей |
К-69М |
Переносной, пневматический |
Новгородское п/о «Автоспецоборудование» |
|
|
5.29. Стетоскоп электронный |
КЭО |
Переносной |
|
Минавтопром СССР |
|
5.30. Компрессометр для карбюраторных двигателей регистрирующий |
K-181 |
Переносной, с фиксацией максимального давления на бумажном бланке |
ЦПКТБ «Автоспецоборудование» |
Казанский ОЭЗ «Автоспецоборудование» |
|
5.31. Компрессометр для дизельных двигателей |
K-183 |
Ручной с фиксацией давления |
Казанский ОЭЗ РАСО |
То же |
|
5.32. Штангенциркуль |
ЩЦ-1-125-01 |
Пределы измерения 0-125 ц.д. 1,0 |
|
Завод «Красный инструментальщик» г. Киров |
|
5.33. Набор щупов №2 |
ГОСТ 882-75 |
Пределы
измерения 0,02-0,5 мм |
|
|
|
5.34. Комплект ключей динамометрических |
К-468 |
Комплект состоит из трех ключей: -с максимальным крутящим моментом 300 Н.м (30 кгс м) -с максимальным крутящим моментом 150 Н.м (15 кгс м) -ключа для настройки в комплект входят также семь сменных головок. |
ЦПКТБ «Автоспецоборудование» |
Казанский ОЭЗ «Автоспецоборудование» |
|
5.35. Секундомер |
СМ-60 |
Ц.д. 0,1 сек. 60с, 60 мин |
|
2-й часовой завод г.Москва |
|
5.36. Линейка измерительная металлическая |
300 ГОСТ 427-75 |
Ц.д. 1,0 мм, предел измерения 0-300 мм |
|
Ленинградское объединение «Комплекс» |
|
5.37. Ломик |
|
|
Входит в комплект инструмента автомобиля |
|
|
5.38. Комплект инструмента автомеханика |
И-132 |
В наборе 38 различных инструментов |
Казанский опытно-экспериментальный з-д «Автоспецоборудование» |
|
|
5.39. Набор манометров для проверки тормозной системы автопоездов |
1131 |
В набор входят 3 манометра со специальными наконечниками |
ЦПКТБ «Автоспецоборудование» |
Загорский завод «Автоспецоборудование» |
|
5.40. Манометр шинный |
МД-14-3912200-Г |
Предел измерения давления 0,05-0,3 МПА (0,5-3 кгс/см2) ц.д. 0,01МПа |
Входит в комплект инструмента автомобиля |
Минавтовром СССР ЛиАЗ |
|
6. Оборудование и приборы, используемые после ремонта на участках |
||||
|
6.1. Стенд обкаточно-тормозной для обкатки двигателей |
КИ-1363 |
Наибольшая тормозная мощность 73,5 kBт, (100 л.с.) |
ГОСНИТИ |
Измаильский ремонтный з-д Госкомсельхозтехника УССР |
|
|
или |
Наибольшая тормозная мощность 110,2 кВт (150 л.с.) |
ГОСНИТИ |
Измаильский ремонтный з-д Госкомсельхозтехиика УССР |
|
или |
Наибольшая тормозная мощность 206 кВт (280 л.с.) |
То же |
То же |
|
|
6.2. Стенд для испытания КПП ГАЗ-24 |
ИК-29 |
Стационарный, габариты, мм: 1460×240×1120 |
ПТБ Главленавтотранс |
Собственного изготовления |
|
6.3. Стенд для обкатки и испытания ГМП автобусов ЛиАЗ-677 |
Ст-14 |
Стационарный, электромеханический, габариты, мм: 3500×900×1250 |
КТБ ЮУТТУ |
То же |
|
6.4. Стенд для испытания коробок передач |
ОН-390 |
Электромеханический с электротормозом: габариты, мм 2500×556×985 |
КТБ Минавтотранс БССР |
То же |
|
6.5. Стенд для проверки пневмооборудования автомобилей |
К-203 |
Стационарный, пневматический. Габариты, мм: 1100×835×1300 |
ЦПКТБ «Автоспецоборудование» |
Загорский з-д «Автоспецоборудование» |
|
6.6. Стенд для контроля рулевых управлений с гидроусилителем |
K-155 |
Стационарный, гидравлический. Габариты, мм: 910×730×1280 |
То же |
То же |
|
6.7. Контрольно-испытательный стенд для проверки генераторов, реле-регулятора и стартеров |
532М |
Стационарный, мощность электродвигателя 4,0 кВт, габариты, мм: 985×360×1605 |
Новгородское п/о «Автоспецоборудование» |
|
|
6.8. Прибор для проверки карбюраторов и топливных насосов бензиновых двигателей |
НИИАТ-5276 |
Настольный, габариты, мм: 365×320×500 масса 20 кг |
НИИАТ |
Киевский з-д нестандартного оборудования Минавтотранс УССР |
|
6.9. Стенд для испытания ТНВД |
Стар 12 или Стар 12Ц |
Стационарный, габариты 1500×700×1900 |
ВНР |
ВНР |
|
или |
Габариты, мм: 1050×500×1780 |
То же |
То же |
|
|
6.10. Прибор для испытания форсунок |
Супер-3 |
Габариты, мм: 390×300×330 |
–»– |
–»– |
|
НЦ-50 |
Габаритны, мм: 520×520 |
ЧССР |
ЧССР |
|
|
6.11. Установка для проверки карбюраторов |
НИАТ-489А |
Стационарная, вакуумная габариты, мм машинной секции 1000×1700×3000 операторской секции 1300×630×3000 |
НИИАТ |
Свирский з-д РАСО |
|
6.12. Комплект приборов и инструмента технического обслуживания аккумуляторных батарей |
Э-401 |
Переносной Комплект состоит (из 15 предметов) |
Новгородское в/о «Автоспецоборудование» |
|
|
6.13. Прибор для проверки якорей генераторов и стартеров |
Э-236 |
Переносной, индукционный Диаметр проверяемых якорей, мм от 25 до 180 |
Новгородское в/о «Автоспецоборудование» |
|
|
6.1. Комплект изделия для очистки и проверки свечей зажигания |
Э-203 |
Тип приспособления настольное, пневматическое, а прибора – настольный, пневмоэлектрический |
То же |
То же |
|
7. Оборудование и приборы, используемые на постах текущего ремонта |
||||
|
7.1. Стенд для контроля и регулировки управляемых колес легковых автомобилей |
К-111 |
Стационарный, электрический, точность измерения ±15 мин |
ЦПКТБ «Автоспецоборудование» |
Казанский ОЭЗ «Автоспецоборудование» |
|
или |
Стационарный с оптической измерительной системой |
То же |
То же |
|
|
7.2. Стенд дли проверки установки передних колёс |
4872 |
Максимальное боковое усилие 300 Н (30 кгс) погрешность 10% |
ГОСНИТИ |
Береговский ОЭЗ Госкомсельхозтехника УССР |
|
7.3. Линейка для проверки схождения передних колес |
2182 |
Универсальная, реечная, телескопическая, ход подвижной трубки 170 мм |
Казанский ОЭЗ «Автоспецоборудование» |
|
|
7.4. Прибор для проверки и регулировки фар |
К-303 |
Передвижной оптический с фотометрическим устройством |
ЦПКТБ «Автоспецоборудование» |
Новгородское п/о «Автоспецоборудование» |
|
7.5. Набор манометров для проверки тормозной системы |
1131 |
В набор входят три манометра со специальными наконечниками. |
То же |
Загорский завод «Автоспецоборудование» |
|
7.6. Установка для проверки рулевых управлений с гидроусилителем |
ЦПКТБ К-465 |
Передвижная гидравлическая |
–»– |
–»– |
|
7.7. Прибор для проверки переднего моста автомобилей |
Т-1 |
Ручной с измерительным индикатором часового типа цена деления 0,01 мм |
НИИАТ |
Казанский ОЭЗ «Автоспецоборудование» |
|
7.8. Прибор для проверки рулевого управления |
K-187 |
Переносной, ручной, пределы измерения угломера 0-15 град. |
НИИАТ |
То же |
|
7.9. Анализатор двигателя |
К-488 |
Передвижной электронный 1000×700×1900 |
ОЭЗ Новгородского п/о «Автоспецоборудование» |
|
|
7.10. Штангенциркуль |
ЩЦ-1-125-01 |
Предел измерения 0-125 т ц.д. 1,0 мм. |
|
3-д «Красный инструментальщик» г.Киров |
|
7.11. Набор щупов №2 |
ГОСТ 882-75 |
Пределы толщины 0,02-0,5 мм., количество пупов 17 |
|
|
|
7.12. Комплект ключей динамометрических |
К-468 |
Комплект состоит из трех ключей: -с максимальным крутящим моментом 300 Н.м (30 кгс м) -с максимальным крутящим моментом 150 Н.м (15 кгс м) -ключа для настройки в комплект входят также семь сменных головок. |
ЦПКТБ «Автоспецоборудование» |
Казанский ОЭЗ «Автоспецоборудование» |
|
7.13. Секундомер |
СМ-60 |
Ц.д. 0,1 сек 60с, 60 мин |
|
2-й часовой завод г. Москва |
|
7.14. Линейка измерительная металлическая |
300 ГОСТ 427-75 |
ц,д. 1,0 мм, предел измерения 0-300 мм |
|
Ленинградское объединение «Комплекс» |
|
7.15. Прибор для проверки натяжения приводных ремней |
К-403 |
Переносной, диапазон измерений силы, прикладываемой к ремню 20-40Н (2-4 кгс) |
НИИАТ |
Казанский ОЭЗ «Автоспецоборудование» |
|
7.16. Ломик |
|
|
Входит в комплект инструмента автомобиля |
|
|
7.17. Манометр шинный |
МД-1А-3912200-Г |
Предел измерения давления 0,05-0,3 МПа (0,5-3 кгс/см2) ц.д. 0,01 МПа |
Входит в комплект инструмента автомобиля |
Минавтопром СССР ЛиАЗ |
|
7.16. Манометр шинный |
ГОСТ ЙШ<-81 |
Ручной ц. деления 0,2 кгс/см2, предел измерения 0,3-0,9 МПа (3,0-9,0 кгс/см2) |
|
3-д «Автоэлектроприбор» г. Рига Минавтопром СССР |
| 1 | Новак Джокович | 11 430 |
| 2 | Даниил Медведев | 9 630 |
| 3 | Стефанос Циципас | 7 995 |
| 4 | Александр Зверев | 6 930 |
| 5 | Рафаэль Надаль | 5 635 |
| 6 | Андрей Рублев | 5 560 |
| 7 | Маттео Берреттини | 4 858 |
| 8 | Доминик Тим | 3 815 |
| 9 | Каспер Рууд | 3 615 |
| 10 | Хуберт Хуркач | 3 378 |
| 11 | Роджер Федерер | 3 285 |
| 12 | Феликс Оже-Альяссим | 3 263 |
| 13 | Диего Шварцман | 2 970 |
| 14 | Денис Шаповалов | 2 903 |
| 15 | Кэмерон Норри | 2 895 |
| 16 | Янник Синнер | 2 895 |
| 17 | Кристиан Гарин | 2 510 |
| 18 | Пабло Каррено | 2 445 |
| 19 | Гаэль Монфис | 2 383 |
| 20 | Роберто Баутиста | 2 270 |
| 21 | Григор Димитров | 2 231 |
| 22 | Аслан Карацев | 2 154 |
| 23 | Даниэль Эванс | 2 144 |
| 24 | Лоренцо Сонего | 2 125 |
| 25 | Райлли Опелка | 2 071 |
| 26 | Алекс Де Минаур | 2 071 |
| 27 | Николоз Басилашвили | 2 066 |
| 28 | Юго Умбер | 2 045 |
| 29 | Джон Изнер | 2 001 |
| 30 | Тэйлор Фритц | 1 810 |
| 31 | Карен Хачанов | 1 718 |
| 32 | Ллойд Харрис | 1 640 |
| 33 | Душан Лайович | 1 556 |
| 34 | Фабио Фоньини | 1 529 |
| 35 | Александр Бублик | 1 516 |
| 36 | Давид Гоффен | 1 516 |
| 37 | Филип Крайинович | 1 472 |
| 38 | Себастьян Корда | 1 469 |
| 39 | Мартон Фучович | 1 459 |
| 40 | Федерико Дельбонис | 1 370 |
| 41 | Марин Чилич | 1 365 |
| 42 | Карлос Алькарас | 1 355 |
| 43 | Илья Ивашко | 1 330 |
| 44 | Алехандро Давидович Фокина | 1 325 |
| 45 | Альберт Рамос | 1 294 |
| 46 | Милош Раонич | 1 289 |
| 47 | Бенуа Пэр | 1 270 |
| 48 | Френсис Тиафо | 1 217 |
| 49 | Кэй Нисикори | 1 210 |
| 50 | Ян-Леннард Штруфф | 1 201 |
| 51 | Адриан Маннарино | 1 144 |
| 52 | Джеймс Дакуорт | 1 139 |
| 53 | Ласло Джере | 1 137 |
| 54 | Томми Пол | 1 128 |
| 55 | Маккензи Макдональд | 1 117 |
| 56 | Сунву Квон | 1 115 |
| 57 | Стэн Вавринка | 1 092 |
| 58 | Маркос Гирон | 1 071 |
| 59 | Кевин Андерсон | 1 034 |
| 60 | Педро Мартинес | 1 031 |
| 61 | Ботик Ван де Зандсхулп | 1 029 |
| 62 | Джон Миллман | 1 023 |
| 63 | Бенджамин Бонци | 1 022 |
| 64 | Доминик Кёпфер | 1 015 |
| 65 | Артур Риндеркнех | 965 |
| 66 | Борна Чорич | 964 |
| 67 | Джанлука Магер | 954 |
| 68 | Федерико Кориа | 950 |
| 69 | Лоренцо Музетти | 948 |
| 70 | Дженсон Бруксби | 947 |
| 71 | Миомир Кечманович | 936 |
| 72 | Джордан Томпсон | 930 |
| 73 | Ришар Гаске | 921 |
| 74 | Алексей Попырин | 912 |
| 75 | Эмиль Руусувуори | 903 |
| 76 | Джауме Мунар | 901 |
| 77 | Иржи Веселы | 897 |
| 78 | Йосихито Нисиока | 885 |
| 79 | Брэндон Накасима | 884 |
| 80 | Роберто Карбаллес | 882 |
| 81 | Факундо Баньис | 877 |
| 82 | Гвидо Пелья | 866 |
| 83 | Стефано Травалья | 850 |
| 84 | Корентен Муте | 848 |
| 85 | Петер Гоёвчик | 847 |
| 86 | Вашек Поспишил | 835 |
| 87 | Жереми Шарди | 829 |
| 88 | Стив Джонсон | 822 |
| 89 | Таллон Грикспур | 812 |
| 90 | Альяж Бедене | 807 |
| 91 | Денис Кудла | 807 |
| 92 | Тьяго Монтейро | 805 |
| 93 | Пабло Андухар | 800 |
| 94 | Сэм Куэрри | 795 |
| 95 | Ник Кирьос | 793 |
| 96 | Теннис Сандгрен | 773 |
| 97 | Пьер-Юж Эрбер | 770 |
| 98 | Андреас Сеппи | 767 |
| 99 | Генри Лааксонен | 762 |
| 100 | Пабло Куэвас | 760 |
| 101 | Микаэль Имер | 757 |
| 102 | Хуан Мануэль Серундоло | 753 |
| 103 | Норберт Гомбос | 750 |
| 104 | Марко Чеккинато | 746 |
| 105 | Уго Гастон | 742 |
| 106 | Даниэль Галан | 735 |
| 107 | Ричардас Беранкис | 733 |
| 108 | Фелисиано Лoпес | 730 |
| 109 | Егор Герасимов | 724 |
| 110 | Даниэль Альтмайер | 722 |
| 111 | Карлос Табернер | 713 |
| 112 | Алекс Молчан | 694 |
| 113 | Кайл Эдмунд | 691 |
| 114 | Деннис Новак | 681 |
| 115 | Филипп Кольшрайбер | 678 |
| 116 | Франсиско Серундоло | 676 |
| 117 | Жиль Симон | 669 |
| 118 | Андрей Мартин | 662 |
| 119 | Камиль Майхрзак | 660 |
| 120 | Раду Албот | 655 |
| 121 | Таро Даниэль | 654 |
| 122 | Бернабе Сапата | 647 |
| 123 | Хольгер Руне | 645 |
| 124 | Себастьян Баез | 631 |
| 125 | Лиам Броуди | 616 |
| 126 | Тьяго Уайлд | 609 |
| 127 | Янник Ханфманн | 594 |
| 128 | Уго Дельен | 584 |
| 129 | Хуан Пабло Варильяс | 581 |
| 130 | Аттила Балаж | 557 |
| 131 | Оскар Отте | 534 |
| 132 | Юрий Родионов | 524 |
| 133 | Фернандо Вердаско | 521 |
| 134 | Алекс Болт | 521 |
| 135 | Сальваторе Карузо | 514 |
| 136 | Йозеф Ковалик | 513 |
| 137 | Дамир Джумхур | 511 |
| 138 | Томас Этчеверри | 511 |
| 139 | Юити Сагита | 509 |
| 140 | Томаш Мачак | 509 |
| 141 | Зденек Коларж | 508 |
| 142 | Никола Милоевич | 506 |
| 143 | Максим Кресси | 494 |
| 144 | Педро Соуса | 483 |
| 145 | Томас Барриос | 472 |
| 146 | Кристофер О’Коннелл | 467 |
| 147 | Михаил Кукушкин | 466 |
| 148 | Митчелл Крюгер | 458 |
| 149 | Евгений Донской | 456 |
| 150 | Кентен Алис | 448 |
| 151 | Эмилио Гомес | 447 |
| 152 | Федерико Гайо | 444 |
| 153 | Марк Полманс | 443 |
| 154 | Антуан Хоан | 439 |
| 155 | Марк-Андреа Хюслер | 439 |
| 156 | Себастьян Офнер | 439 |
| 157 | Джек Сок | 438 |
| 158 | Люка Пуй | 435 |
| 159 | Матс Морайнг | 433 |
| 160 | Роман Сафиуллин | 432 |
| 161 | Джейсон Юнг | 432 |
| 162 | Элиас Имер | 431 |
| 163 | Дмитрий Попко | 430 |
| 164 | Илья Марченко | 429 |
| 165 | Алтуг Челикбилек | 428 |
| 166 | Джем Илькель | 427 |
| 167 | Эрнесто Эскобедо | 422 |
| 168 | Грегур Баррер | 421 |
| 169 | Каспер Жук | 421 |
| 170 | Хуан Лондеро | 420 |
| 171 | Иржи Лехечка | 414 |
| 172 | Энди Маррей | 411 |
| 173 | Жо-Вильфрид Тсонга | 408 |
| 174 | Алехандро Табило | 407 |
| 175 | Макс Пёрселл | 403 |
| 176 | Жоау Соуза | 400 |
| 177 | Бьорн Фратанджело | 400 |
| 178 | Танаси Коккинакис | 394 |
| 179 | Праджнеш Гуннесваран | 393 |
| 180 | Марио Вилелья | 391 |
| 181 | Ясутака Утияма | 390 |
| 182 | Седрик-Марсель Штебе | 390 |
| 183 | Блаж Рола | 390 |
| 184 | Кристофер Юбенкс | 385 |
| 185 | Мохаммед Сафват | 382 |
| 186 | Зизу Бергс | 378 |
| 187 | Фелипе Мелигени | 371 |
| 188 | Уго Гренье | 371 |
| 189 | Димитар Кузманов | 367 |
| 190 | Энцо Коко | 366 |
| 191 | Рамкумар Раманатан | 361 |
| 192 | Александар Вукич | 357 |
| 193 | Ренцо Оливо | 357 |
| 194 | Джей Кларк | 354 |
| 195 | Жеффри Вулф | 349 |
| 196 | Эрнест Гулбис | 348 |
| 197 | Филип Горански | 346 |
| 198 | Максимилиан Мартерер | 342 |
| 199 | Марко Трунхеллити | 341 |
| 200 | Вит Коприва | 340 |
| 201 | Роберто Маркора | 338 |
| 202 | Николас Ярри | 336 |
| 203 | Джанмарко Морони | 336 |
| 204 | Алессандро Джаннези | 335 |
| 205 | Фредерико Силва | 333 |
| 206 | Тиаго Тиранте | 331 |
| 207 | Александр Мюллер | 325 |
| 208 | Констан Лестьенн | 321 |
| 209 | Лукаш Лацко | 319 |
| 210 | Франко Агаменоне | 318 |
| 211 | Лоренцо Джустино | 316 |
| 212 | Киммер Коппеянс | 312 |
| 213 | Джейсон Каблер | 308 |
| 214 | Камило Уго | 307 |
| 215 | Сумит Нагал | 302 |
| 216 | Микаэль Торпегор | 300 |
| 217 | Виктор Троицки | 297 |
| 218 | Андреа Пеллегрино | 297 |
| 219 | Флавио Коболли | 295 |
| 220 | Рубен Бемельманс | 293 |
| 221 | Майкл Ммох | 288 |
| 222 | Гастао Элиаш | 287 |
| 223 | Брэйден Шнур | 283 |
| 224 | Жоау Домингеш | 283 |
| 225 | Жоао Менезес | 283 |
| 226 | Томас Фаббиано | 282 |
| 227 | Сергей Стаховский | 281 |
| 228 | Матиас Бург | 280 |
| 229 | Робин Хасе | 279 |
| 230 | Иво Карлович | 277 |
| 231 | Денис Истомин | 277 |
| 232 | Тай-Сон Квятковски | 275 |
| 233 | Максим Жанвье | 275 |
| 234 | Факундо Мена | 274 |
| 235 | Чжичжэнь Чжан | 270 |
| 236 | Мэттью Эбден | 266 |
| 237 | Тим ван Рийтховен | 265 |
| 238 | Лукаш Клейн | 265 |
| 239 | Йеспер Де Йонг | 263 |
| 240 | Даниэль Мазур | 262 |
| 241 | Го Соэда | 259 |
| 242 | Тобиас Камке | 257 |
| 243 | Мартин Клижан | 254 |
| 244 | Нино Сердарушич | 254 |
| 245 | Борна Гойо | 253 |
| 246 | Йосукэ Ватануки | 252 |
| 247 | Чжуньсин Цзэн | 250 |
| 248 | Улисес Бланч | 249 |
| 249 | Никола Кун | 248 |
| 250 | Джулио Зеппиери | 246 |
| 251 | Виталий Сачко | 246 |
| 252 | Стефан Козлов | 244 |
| 253 | Дуже Айдукович | 242 |
| 254 | Татсума Ито | 239 |
| 255 | Мирза Башич | 237 |
| 256 | Тунлин Ву | 234 |
| 257 | Паоло Лоренци | 232 |
| 258 | Бернард Томич | 231 |
| 259 | Николас Киккер | 231 |
| 260 | Мануэль Гинар | 229 |
| 261 | Стивен Диез | 228 |
| 262 | Доминик Штрикер | 225 |
| 263 | Блаж Кавчич | 223 |
| 264 | Александер Ричард | 223 |
| 265 | Андреа Колларини | 223 |
| 266 | Педро Качин | 223 |
| 267 | Теймураз Габашвили | 223 |
| 268 | Нуну Боржеш | 222 |
| 269 | Тимофей Скатов | 222 |
| 270 | Гуидо Андреоцци | 213 |
| 271 | Маттиас Бахингер | 213 |
| 272 | Тристан Ламасин | 213 |
| 273 | Андреа Арнабольди | 212 |
| 274 | Павел Котов | 212 |
| 275 | Лукаш Росол | 210 |
| 276 | Хуан Пабло Фикович | 209 |
| 277 | Кристиан Харрисон | 208 |
| 278 | Данило Петрович | 207 |
| 279 | Евгений Карловский | 204 |
| 280 | Эван Фюрнесс | 204 |
| 281 | Роберто Сид | 202 |
| 282 | Джек Дрэйпер | 198 |
| 283 | Питер Полански | 196 |
| 284 | Джеффри Бланкано | 194 |
| 285 | Леонардо Майер | 193 |
| 286 | Николас Мейя | 192 |
| 287 | Матеус Пучинелли | 188 |
| 288 | Орландо Луж | 188 |
| 289 | Рикардо Бонадио | 184 |
| 290 | Маттео Виола | 183 |
| 291 | Андрей Кузнецов | 181 |
| 292 | Янник Маден | 181 |
| 293 | Роберто Кирос | 180 |
| 294 | Мариус Копил | 179 |
| 295 | Чжэ Ли | 179 |
| 296 | Хавьер Барранко | 179 |
| 297 | Малек Жазири | 176 |
| 298 | Андреа Вавассори | 176 |
| 299 | Хироки Мория | 176 |
| 300 | Эндрю Харрис | 174 |
Объекты недвижимости — Комитет имущественных отношений Санкт-Петербурга
Информация об объектах, в том числе свободных, включенных в Схему НТО для размещения передвижных средств развозной торговли (специализированные или специально оборудованные для розничной торговли, механические транспортные средства производителей хлебобулочных изделий, молочной, мясной и рыбной продукции).
Копия АТП необходима пользователям помещений для:
а) заключения договора энергоснабжения с энергосбытовой организацией.
Со стороны АО «Петербургская сбытовая компания» работа по заключению договора энергоснабжения с потребителями-арендаторы помещений, собственниками которых является Санкт-Петербург, будет проводиться в первоочередном порядке. В этой связи между АО «ПСК» и ПАО «Ленэнерго» налажено информационное взаимодействие, в рамках которого АО «ПСК» вправе самостоятельно запрашивать сведения о присоединении. (Таким образом, заверять АТП печатью Комитета не требуется).
Также не требуется переоформление АТП непосредственно на арендатора, достаточно предоставления в АО «ПСК» договора аренды/безвозмездного пользования, подтверждающего право владения Объектом.
б) для заключения договора с ПАО «Ленэнерго» о технологическом присоединении дополнительной мощности.
В этом случае АТП подтверждает существующую выделенную на Объект мощность в дополнение к которой пользователь Объекта может присоединить мощность, необходимую для ведения своей деятельности. (Заверение копий также не требуется, так как ПАО «Ленэнерго» обладает оригиналом данного документа.)
Инженерные сооружения
По вопросу возможности аренды сооружения необходимо обращаться к правообладателю.
Сдача в аренду объектов (их частей) возможна в целях обеспечения более эффективной организации основной деятельности учреждения, для которой оно создано, рационального использования такого имущества.
Physiology, Аденозинтрифосфат — StatPearls
Введение
Тело — сложный организм, и поэтому для поддержания его надлежащего функционирования требуется энергия. Аденозинтрифосфат (АТФ) является источником энергии для использования и хранения на клеточном уровне. Структура АТФ представляет собой нуклеозидтрифосфат, состоящий из азотистого основания (аденина), рибозного сахара и трех последовательно связанных фосфатных групп. АТФ обычно называют «энергетической валютой» клетки, поскольку он обеспечивает легко высвобождаемую энергию в связи между второй и третьей фосфатными группами.Помимо обеспечения энергией, расщепление АТФ посредством гидролиза служит широкому спектру функций клетки, включая передачу сигналов и синтез ДНК / РНК. В синтезе АТФ используется энергия, полученная из нескольких катаболических механизмов, включая клеточное дыхание, бета-окисление и кетоз.
Большая часть синтеза АТФ происходит в клеточном дыхании в митохондриальном матриксе: генерируется примерно тридцать две молекулы АТФ на молекулу окисляемой глюкозы. АТФ расходуется для получения энергии в процессах, включая перенос ионов, сокращение мышц, распространение нервных импульсов, фосфорилирование субстрата и химический синтез.Эти, как и другие процессы, создают высокий спрос на АТФ. В результате клетки человеческого тела зависят от гидролиза от 100 до 150 моль АТФ в день для обеспечения правильного функционирования. В следующих разделах АТФ будет подвергаться дальнейшей оценке своей роли как решающей молекулы в повседневном функционировании клетки.
Cellular
АТФ — прекрасная молекула для хранения энергии, которую можно использовать в качестве «валюты» из-за фосфатных групп, которые связываются через фосфодиэфирные связи.Эти связи имеют высокую энергию из-за связанных с ними электроотрицательных зарядов, оказывающих отталкивающую силу между фосфатными группами. Значительное количество энергии остается внутри фосфатно-фосфатных связей. В ходе метаболических процессов АТФ гидролизуется до АДФ или далее до АМФ и свободных неорганических фосфатных групп. Процесс гидролиза АТФ до АДФ является энергетически выгодным, давая энергию Гиббса -7,3 кал / моль [1]. АТФ должен постоянно пополняться, чтобы питать постоянно работающий элемент.Обычная внутриклеточная концентрация АТФ составляет от 1 до 10 мкМ [2]. Существует множество механизмов обратной связи, чтобы гарантировать поддержание постоянного уровня АТФ в клетке. Усиление или ингибирование АТФ-синтазы является обычным регуляторным механизмом. Например, АТФ ингибирует фосфофруктокиназу-1 (PFK1) и пируваткиназу, два ключевых фермента в гликолизе, эффективно действуя как петля отрицательной обратной связи для подавления распада глюкозы при наличии достаточного клеточного АТФ.
И наоборот, АДФ и АМФ могут активировать PFK1 и пируваткиназу, способствуя синтезу АТФ во время высокой потребности в энергии.Другие системы регулируют АТФ, например, в регуляторных механизмах, участвующих в регуляции синтеза АТФ в сердце. Новые эксперименты показали, что десятисекундные всплески, называемые митохондриальными вспышками, могут нарушить производство АТФ в сердце. Во время этих митохондриальных вспышек митохондрии выделяют активные формы кислорода и эффективно приостанавливают синтез АТФ. Подавление продукции АТФ происходит во время митохондриальных вспышек. Во время низкого спроса на энергию, когда клетки сердечной мышцы получали достаточно строительных блоков, необходимых для производства АТФ, митохондриальные вспышки наблюдались чаще.С другой стороны, когда потребность в энергии высока во время быстрого сердечного сокращения, митохондриальные вспышки происходят реже. Эти результаты свидетельствуют о том, что в периоды, когда необходимо значительное количество АТФ, митохондриальные вспышки происходят реже, что позволяет продолжать производство АТФ. И наоборот, в периоды низкой выработки энергии митохондриальные вспышки происходили более регулярно и подавляли выработку АТФ. [3]
Функция
Гидролиз АТФ обеспечивает энергию, необходимую для многих важных процессов в организмах и клетках.К ним относятся внутриклеточная передача сигналов, синтез ДНК и РНК, пуринергическая передача сигналов, синаптическая передача сигналов, активный транспорт и сокращение мышц. Эти темы не являются исчерпывающим списком, но включают некоторые из жизненно важных ролей, которые выполняет ATP.
АТФ в внутриклеточной передаче сигналов
Передача сигналов в значительной степени зависит от АТФ. АТФ может служить субстратом для киназ, самого многочисленного АТФ-связывающего белка. Когда киназа фосфорилирует белок, может активироваться сигнальный каскад, что приводит к модуляции различных внутриклеточных сигнальных путей.[4] Активность киназы жизненно важна для клетки и, следовательно, должна строго регулироваться. Присутствие иона магния помогает регулировать активность киназы. [5] Регуляция осуществляется посредством ионов магния, существующих в клетке в виде комплекса с АТФ, связанного с фосфатно-кислородными центрами. Помимо киназной активности, АТФ может действовать как повсеместный триггер высвобождения внутриклеточного мессенджера. [6] Эти посредники включают гормоны, различные ферменты, липидные медиаторы, нейротрансмиттеры, оксид азота, факторы роста и активные формы кислорода.[6] Пример использования АТФ во внутриклеточной передаче сигналов можно наблюдать в АТФ, действующем как субстрат для аденилатциклазы. Этот процесс в основном происходит в сигнальных путях рецепторов, связанных с G-белками. Связываясь с аденилатциклазой, АТФ превращается в циклический АМФ, который помогает высвобождать кальций из внутриклеточных запасов [7]. ЦАМФ играет и другие роли, включая вторичные мессенджеры в гормональных сигнальных каскадах, активацию протеинкиназ и регулирование функции ионных каналов.
Синтез ДНК / РНК
Для синтеза ДНК и РНК требуется АТФ. АТФ — один из четырех нуклеотидтрифосфатных мономеров, необходимых во время синтеза РНК. В синтезе ДНК используется аналогичный механизм, за исключением того, что в синтезе ДНК АТФ сначала трансформируется путем удаления атома кислорода из сахара с образованием дезоксирибонуклеотида, дАТФ. [8]
Пуринергическая сигнализация
Пуринергическая передача сигналов — это форма внеклеточной паракринной передачи сигналов, которая опосредуется пуриновыми нуклеотидами, включая АТФ.Этот процесс обычно влечет за собой активацию пуринергических рецепторов на близлежащих клетках, тем самым передавая сигналы для регулирования внутриклеточных процессов. АТФ высвобождается из везикулярных хранилищ и регулируется IP3 и другими общими экзоцитотическими регуляторными механизмами. АТФ совместно хранится и совместно высвобождается среди нейротрансмиттеров, что дополнительно подтверждает мнение о том, что АТФ является необходимым медиатором пуринергической нейротрансмиссии как в симпатических, так и в парасимпатических нервах. АТФ может вызывать несколько пуринергических реакций, включая контроль вегетативных функций, взаимодействия нервной глии, боль и контроль тонуса сосудов.[9] [10] [11] [12]
Нейротрансмиссия
Мозг является самым большим потребителем АТФ в организме, потребляя примерно двадцать пять процентов всей доступной энергии. [13] Большое количество энергии тратится на поддержание концентраций ионов для правильной нейрональной передачи сигналов и синаптической передачи. [14] Синаптическая передача — это энергоемкий процесс. На пресинаптическом конце АТФ необходим для установления ионных градиентов, которые доставляют нейротрансмиттеры в пузырьки, и для примирования пузырьков для высвобождения посредством экзоцитоза.[14] Нейрональная передача сигналов зависит от потенциала действия, достигающего пресинаптического конца, сигнализируя о высвобождении загруженных везикул. Этот процесс зависит от АТФ, восстанавливающего концентрацию ионов в аксоне после каждого потенциала действия, позволяя появиться другому сигналу. Активный транспорт отвечает за возврат концентраций ионов натрия и калия к исходным значениям после того, как потенциал действия возникает через Na / K-АТФазу. Во время этого процесса одна молекула АТФ гидролизуется, три иона натрия транспортируются из клетки, а два иона калия транспортируются обратно в клетку, оба из которых движутся против своих градиентов концентрации.
Потенциалы действия, движущиеся вниз по аксону, инициируют высвобождение везикул при достижении пресинаптического терминала. После установления ионных градиентов потенциалы действия затем распространяются вниз по аксону через деполяризацию аксона, посылая сигнал к терминалу. Приблизительно один миллиард ионов натрия необходим для распространения единственного потенциала действия. Нейронам необходимо будет гидролизовать почти один миллиард молекул АТФ, чтобы восстановить концентрацию ионов натрия / калия после каждой деполяризации клетки.[13] Возбуждающие синапсы в основном доминируют в сером веществе мозга. Везикулы, содержащие глутамат, будут выпущены в синаптическую щель для активации постсинаптических возбуждающих глутаминергических рецепторов. Загрузка этих молекул требует большого количества АТФ из-за того, что почти четыре тысячи молекул глутамата хранятся в одной везикуле. [13] Значительные запасы энергии необходимы, чтобы инициировать высвобождение везикулы, управлять глутаматергическими постсинаптическими процессами и рециркулировать везикулу, а также оставшийся глутамат.[13] Таким образом, из-за большого количества энергии, необходимой для упаковки глутамата, митохондрии близки к глутаматергическим пузырькам. [15]
АТФ в сокращении мышц
Сокращение мышц является необходимой функцией повседневной жизни и не может происходить без АТФ. В сокращении мышц АТФ выполняет три основные роли. Первый — это создание силы против прилегающих актиновых нитей через циклическое движение миозиновых поперечных мостиков.Второй — перекачка ионов кальция из миоплазмы через саркоплазматический ретикулум против градиентов их концентрации с использованием активного транспорта. Третья функция, выполняемая АТФ, — это активный транспорт ионов натрия и калия через сарколемму, так что ионы кальция могут высвобождаться при получении входных данных. Гидролиз АТФ управляет каждым из этих процессов. [16]
Механизм
Многие процессы способны производить АТФ в организме в зависимости от текущих метаболических условий.Производство АТФ может происходить в присутствии кислорода в результате клеточного дыхания, бета-окисления, кетоза, катаболизма липидов и белков, а также в анаэробных условиях.
Клеточное дыхание
Клеточное дыхание — это процесс катаболизма глюкозы в ацетил-КоА с образованием высокоэнергетических носителей электронов, которые будут окисляться во время окислительного фосфорилирования с образованием АТФ. Во время гликолиза, первой стадии клеточного дыхания, одна молекула глюкозы распадается на две молекулы пирувата.Во время этого процесса два АТФ продуцируются посредством фосфорилирования субстрата ферментами PFK1 и пируваткиназой. Также происходит образование двух восстановленных молекул-переносчиков электронов НАДН. Затем молекулы пирувата окисляются комплексом пируватдегидрогеназы, образуя молекулу ацетил-КоА. Затем молекула ацетил-КоА полностью окисляется с образованием диоксида углерода и восстановленных переносчиков электронов в цикле лимонной кислоты. По завершении цикла лимонной кислоты общий выход составляет две молекулы диоксида углерода, один эквивалент АТФ, три молекулы NADH и одну молекулу FADh3.Эти высокоэнергетические переносчики электронов затем переносят электроны в цепь переноса электронов, в которой ионы водорода (протоны) переносятся против своего градиента во внутреннее мембранное пространство из митохондриальной матрицы. Затем молекулы АТФ синтезируются в виде протонов, движущихся вниз по электрохимическому градиенту мощности АТФ-синтазы. [9] Количество произведенного АТФ варьируется в зависимости от того, какой электронный носитель отдал протоны. Одна молекула НАДН производит два с половиной АТФ, тогда как одна молекула FADh3 производит полторы молекулы АТФ.[17]
Бета-окисление
Бета-окисление — еще один механизм синтеза АТФ в организмах. Во время бета-окисления цепи жирных кислот постоянно укорачиваются, давая молекулы ацетил-КоА. На протяжении каждого цикла бета-окисления жирная кислота восстанавливается на две длины углерода, образуя одну молекулу ацетил-КоА, которая может окисляться в цикле лимонной кислоты, и по одной молекуле каждого из NADH и FADh3, которые передают свою высокую энергию. электрон в транспортную цепочку.[18]
Кетоз
Кетоз — это реакция, при которой в результате катаболизма кетоновых тел выделяется АТФ. Во время кетоза кетоновые тела подвергаются катаболизму для производства энергии, генерируя двадцать две молекулы АТФ и две молекулы ГТФ на молекулу ацетоацетата, которая окисляется в митохондриях.
Анаэробное дыхание
Когда во время клеточного дыхания кислород недостаточен или недоступен, клетки могут подвергаться анаэробному дыханию. В анаэробных условиях происходит накопление молекул НАДН из-за неспособности окислять НАДН до НАД +, что ограничивает действие ГАФД и потребление глюкозы.Для поддержания гомеостатического уровня НАДН пируват восстанавливается до лактата, что приводит к окислению одной молекулы НАДН в процессе, известном как молочная ферментация. При молочной ферментации две молекулы НАДН, образовавшиеся при гликолизе, окисляются для поддержания резервуара НАД +. Эта реакция производит только две молекулы АТФ на молекулу глюкозы.
Сопутствующее тестирование
Многие методы позволяют рассчитать внутриклеточные уровни АТФ. Общепринятый протокол включает использование люциферазы светлячков, фермента, который вызывает окисление люциферина.[19] Эта реакция поддается количественному определению из-за выхода энергии этой реакции, высвобождающего фотон света, известного как биолюминесценция, который поддается количественному определению.
Клиническая значимость
Роль АТФ в обезболивании
АТФ демонстрирует уменьшение острой периоперационной боли в клинических исследованиях [20]. В этих исследованиях пациенты получали АТФ внутривенно. Внутривенное введение аденозина воздействует на рецептор аденозина A1, инициируя сигнальный каскад, который в конечном итоге способствует обезболивающему эффекту, наблюдаемому при воспалении.Исследования показали, что соединения аденозина уменьшают аллодинию и гипералгезию при введении в умеренных дозах [20]. Активация аденозинового рецептора A1 оказывает эффективное обезболивающее благодаря медленному началу и длительному действию, которое в некоторых случаях может длиться несколько недель [20].
Анестезия
Добавление АТФ дало положительные результаты во время анестезии. Данные показывают, что низкие дозы аденозина уменьшают нейропатическую боль, ишемическую боль и гипералгезию до уровня, сопоставимого с морфином.[21] Аденозин также снизил потребление опиоидов в послеоперационном периоде, что указывает на потенциальную длительную активацию аденозинового рецептора A1.
Кардиология и хирургия
Было продемонстрировано, что АТФ является безопасным и практичным легочным вазодилататором у пациентов, страдающих легочной гипертензией. [21] Точно так же аденозин и АТФ могут использоваться во время операции для индукции гипотензии у пациентов. [21]
Ссылки
- 1.
- Meurer F, Do HT, Sadowski G, Held C.Стандартная энергия Гиббса метаболических реакций: II. Глюкозо-6-фосфатазная реакция и гидролиз АТФ. Biophys Chem. 2017 Апрель; 223: 30-38. [PubMed: 28282626]
- 2.
- Beis I, Newsholme EA. Содержание адениновых нуклеотидов, фосфагенов и некоторых гликолитических промежуточных продуктов в мышцах покоя позвоночных и беспозвоночных. Biochem J. 1975 Oct; 152 (1): 23-32. [Бесплатная статья PMC: PMC1172435] [PubMed: 1212224]
- 3.
- Wang X, Zhang X, Wu D, Huang Z, Hou T, Jian C, Yu P, Lu F, Zhang R, Sun T, Li J , Ци В., Ван И, Гао Ф, Ченг Х.Митохондриальные вспышки регулируют гомеостаз АТФ в сердце. Элиф. 2017 10 июля; 6 [Бесплатная статья PMC: PMC5503511] [PubMed: 28692422]
- 4.
- Мишра Н.С., Тутея Р., Тутея Н. Передача сигналов через сети MAP-киназ в растениях. Arch Biochem Biophys. 01 августа 2006 г .; 452 (1): 55-68. [PubMed: 16806044]
- 5.
- Lin X, Ayrapetov MK, Sun G. Характеристика взаимодействий между активным центром протеинтирозинкиназы и активатором двухвалентного металла. BMC Biochem. 2005 23 ноября; 6:25.[Бесплатная статья PMC: PMC1316873] [PubMed: 16305747]
- 6.
- Циммерманн Х. Внеклеточный АТФ и другие нуклеотиды — повсеместные триггеры высвобождения межклеточного мессенджера. Пуринергический сигнал. 2016 Март; 12 (1): 25-57. [Бесплатная статья PMC: PMC4749530] [PubMed: 26545760]
- 7.
- Каменецкий М., Миддельхауф С., Банк Е.М., Левин Л.Р., Бак Дж., Стигборн С. Молекулярные детали генерации цАМФ в клетках млекопитающих: история двух систем . J Mol Biol. 2006 29 сентября; 362 (4): 623-39. [Бесплатная статья PMC: PMC3662476] [PubMed: 16934836]
- 8.
- Джойс К.М., Стейтц ТА. Полимеразные структуры и функции: вариации на тему? J Bacteriol. 1995 ноя; 177 (22): 6321-9. [Бесплатная статья PMC: PMC177480] [PubMed: 7592405]
- 9.
- Bonora M, Patergnani S, Rimessi A, De Marchi E, Suski JM, Bononi A, Giorgi C, Marchi S, Missiroli S, Poletti F, Wieckowski MR, Пинтон П. Синтез и хранение АТФ. Пуринергический сигнал. 2012 сентябрь; 8 (3): 343-57. [Бесплатная статья PMC: PMC3360099] [PubMed: 22528680]
- 10.
- Cárdenas C, Miller RA, Smith I, Bui T, Molgó J, Müller M, Vais H, Cheung KH, Yang J, Parker I, Thompson CB , Бирнбаум MJ, Hallows KR, Foskett JK.Существенная регуляция биоэнергетики клетки путем конститутивного переноса Ca2 + рецептора InsP3 в митохондрии. Клетка. 23 июля 2010 г .; 142 (2): 270-83. [Бесплатная статья PMC: PMC2911450] [PubMed: 20655468]
- 11.
- Pablo Huidobro-Toro J, Verónica Donoso M. Сопутствующая трансмиссия: координированное действие АТФ и норадреналина и их модуляция нейропептидом Y в сосудистом нейроэффекторе человека переходы. Eur J Pharmacol. 2004 Октябрь 01; 500 (1-3): 27-35. [PubMed: 15464018]
- 12.
- Coco S, Calegari F, Pravettoni E, Pozzi D, Taverna E, Rosa P, Matteoli M, Verderio C.Хранение и высвобождение АТФ из астроцитов в культуре. J Biol Chem. 2003 10 января; 278 (2): 1354-62. [PubMed: 12414798]
- 13.
- Аттвелл Д., Лафлин С.Б. Энергетический баланс для передачи сигналов в сером веществе мозга. J Cereb Blood Flow Metab. 2001 Октябрь; 21 (10): 1133-45. [PubMed: 11598490]
- 14.
- Харрис Дж. Дж., Джоливет Р., Аттвелл Д. Использование и поставка синаптической энергии. Нейрон. 2012 6 сентября; 75 (5): 762-77. [PubMed: 22958818]
- 15.
- Wong-Riley MT. Цитохромоксидаза: эндогенный метаболический маркер нейрональной активности.Trends Neurosci. 1989 Март; 12 (3): 94-101. [PubMed: 2469224]
- 16.
- Barclay CJ. Энергетика сокращения. Compr Physiol. 2015 Апрель; 5 (2): 961-95. [PubMed: 25880520]
- 17.
- Rich PR. Молекулярный аппарат дыхательной цепи Кейлина. Biochem Soc Trans. 2003 декабрь; 31 (Pt 6): 1095-105. [PubMed: 14641005]
- 18.
- Ronnett GV, Kim EK, Landree LE, Tu Y. Метаболизм жирных кислот как мишень для лечения ожирения. Physiol Behav. 2005 19 мая; 85 (1): 25-35.[PubMed: 15878185]
- 19.
- Бровко Л.Ю., Романова Н.А., Угарова Н.Н. Биолюминесцентный анализ бактериального внутриклеточного AMP, ADP и ATP с использованием коиммобилизованного трехферментного реагента (аденилаткиназы, пируваткиназы и люциферазы светлячков). Анальная биохимия. 1 августа 1994 г .; 220 (2): 410-4. [PubMed: 7978286]
- 20.
- Хаяшида М., Фукуда К., Фукунага А. Клиническое применение аденозина и АТФ для контроля боли. Дж. Анест. 2005; 19 (3): 225-35. [PubMed: 16032451]
- 21.
- Agteresch HJ, Dagnelie PC, van den Berg JW, Wilson JH. Аденозинтрифосфат: установленные и потенциальные клинические применения. Наркотики. 1999 август; 58 (2): 211-32. [PubMed: 10473017]
АТФ и АДФ
АТФ и АДФЗачем организму еда
Ваш метаболизм — это совокупность химических реакций, которые происходят в ваших клетках для поддержания жизни. Некоторые из этих реакций используют накопленную энергию для создания вещей, что мы называем анаболизмом, в то время как другие реакции разрушают вещи, высвобождая энергию, которая может быть сохранена для будущего использования, и это называется катаболизмом.Представьте, что гамбургер из белков, жиров и углеводов, который вы едите на ужин, представляет собой набор кубиков лего разных цветов и форм. Чтобы организовать эти блоки в эту сложную структуру, потребовалось много энергии, и разрушение блоков высвобождает эту энергию и освобождает блоки, чтобы их можно было снова собрать в новые вещи. Ваше тело делает именно это, когда вы едите пищу. Вот краткая видеолекция, в которой резюмируется эта концепция.
Живые существа разбивают три основные категории продуктов питания (белки, жиры и углеводы) на составные части, отдельные блоки лего, по двум причинам.1) После того, как пищевые атомы и группы атомов (молекул) расщеплены, они могут быть снова преобразованы в определенные виды вещей, которые нужны организму, такие как кости, мышцы, кожа, волосы, перья, мех, кора, листья и т. Д. и т. д. 2) Разрушение молекул пищи высвобождает энергию, которая удерживала их вместе, и эта высвобожденная энергия временно сохраняется в клетке для процесса восстановления. Для каждого из этих типов пищи требуется свой процесс расщепления, и мы рассмотрим их позже, но цель одна — взять энергию, которая удерживает эти молекулы пищи вместе, и высвободить ее, чтобы ее можно было хранить в форме, которая Ячейку можно использовать позже, чтобы построить то, что ей нужно.У клетки есть особый вид молекулы для хранения этой энергии, и она называется АТФ.
http://en.wikipedia.org/wiki/Adenosine_triphosphate
АТФ (аденозинтрифосфат) — важная молекула, обнаруженная во всех живых существах. Думайте об этом как о «энергетической валюте» клетки. Если клетке необходимо тратить энергию для выполнения задачи, молекула АТФ отщепляет один из трех своих фосфатов, превращаясь в АДФ (аденозиндифосфат) + фосфат. Энергия, удерживающая эту молекулу фосфата, теперь высвобождается и доступна для работы в клетке.Когда клетка имеет дополнительную энергию (полученную от расщепления потребленной пищи или, в случае растений, полученной посредством фотосинтеза), она накапливает эту энергию, повторно присоединяя свободную молекулу фосфата к АДФ, превращая ее обратно в АТФ. Молекула АТФ подобна перезаряжаемой батарее. Когда он полностью заряжен, это АТФ. Когда он израсходован, это АДФ. Однако аккумулятор не выбрасывается, когда он разряжен — он просто снова заряжается.
http://en.wikipedia.org/wiki/Adenosine_diphosphate
ATP ß à ADP + P + энергия
Вот как это выглядит химически.Каждый фосфат представляет собой PO 4 (кислород имеет заряд -2, а их 4, всего -8, а P имеет заряд +5, поэтому чистый заряд фосфатной группы составляет -3. .Если свободные атомы H, которые равны +1, добавляются к атомам O, которые не связаны с двумя вещами, тогда чистый заряд равен нулю.)
ß
АТФ-АДФ
Бывают случаи, когда клетке требуется еще больше энергии, и она расщепляет другой фосфат, поэтому она переходит от АДФ, аденозиддифосфата, к АМФ, аденозинмонофосфата.
АТФ ß à ADP + P + энергия ß à AMP + P + энергия
ß
ADP AMP
В клетке есть и другие молекулы-аккумуляторы энергии, такие как НАД и ФАД, но система АТФ является наиболее распространенной и наиболее важной. Думайте о других как о разных марках перезаряжаемых батарей, которые выполняют одну и ту же работу. Далее мы исследуем некоторые пути, которые организм использует для расщепления продуктов разных типов.
А кислород? Зачем нам это нужно? Что будет, если над свечой поставить стакан? Вы морите огонь кислородом, и пламя гаснет. Если метаболическая реакция носит аэробный характер, ей требуется кислород. Купить почему? Вот аналогия. Подумайте о разжигании костра. Что тебе нужно? Вам нужно топливо (дрова), вам нужно тепло (труднее разжечь огонь, когда холодно), и вам нужен кислород (потому что другое слово для обозначения горения — «окисление», и, как вы могли догадаться, это может произойти только в наличие кислорода).Окисление чего-либо приводит к потере электронов, что означает, что энергия (электроны) высвобождается, когда вы окисляете или сжигаете топливо. Ваша еда — ваше топливо. Вы сжигаете топливо для получения энергии. Кислород нужен для сжигания топлива. Это происходит в митохондриях.
Функция аденозинтрифосфата (АТФ) в клетках
АТФ — основной источник энергии для большинства клеточных процессов. Строительными блоками АТФ являются углерод, азот, водород, кислород и фосфор. Из-за наличия нестабильных высокоэнергетических связей в АТФ он легко гидролизуется в реакциях с выделением большого количества энергии.
Ферментативное удаление фосфатной группы из АТФ с образованием АДФ высвобождает огромное количество энергии, которая используется клеткой в нескольких метаболических процессах, а также в синтезе макромолекул, таких как белки. Удаление второй фосфатной группы из АТФ приводит к дальнейшему высвобождению энергии и образованию аденозинмонофосфата (АМФ).
Когда организм не нуждается в энергии, фосфатная группа добавляется обратно к АМФ и АДФ для образования АТФ — при необходимости он может быть гидролизован позже.Таким образом, АТФ функционирует как надежный источник энергии для клеточных путей.
Функции АТФ в клетках
АТФ находит применение в нескольких клеточных процессах. Некоторые важные функции АТФ в клетке кратко описаны ниже:
Активный транспорт
АТФ играет важную роль в транспортировке макромолекул, таких как белки и липиды, внутрь и из клетки. Гидролиз АТФ обеспечивает необходимую энергию для активных транспортных механизмов, чтобы переносить такие молекулы через градиент концентрации.Транспорт молекул в клетку называется эндоцитозом, в то время как транспорт из клетки известен как экзоцитоз.
Сигнализация ячейки
АТФ выполняет ключевые функции как во внутриклеточной, так и во внеклеточной передаче сигналов. Он легко распознается пуринергическими рецепторами в тканях млекопитающих — его высвобождение из синапсов и аксонов активирует пуринергические рецепторы, которые модулируют уровни кальция и циклического АМФ внутри клетки.
В центральной нервной системе аденозин модулирует нервное развитие, контроль иммунной системы и нейронную / глиальную передачу сигналов.
АТФ также участвует в передаче сигнала — его фосфатные группы используются киназами в реакциях переноса фосфата, которые активируют каскад протеинкиназных реакций.
Техническое обслуживание сооружений
АТФ играет очень важную роль в сохранении структуры клетки, помогая сборке цитоскелетных элементов. Он также снабжает энергией жгутики и хромосомы, чтобы поддерживать их надлежащее функционирование.
Сокращение мышц
АТФ имеет решающее значение для сокращения мышц; он связывается с миозином, чтобы обеспечить энергию и облегчить его связывание с актином, чтобы сформировать поперечный мостик.Затем высвобождаются АДФ и фосфат, и новая молекула АТФ связывается с миозином. Это разрывает мост между миозиновыми и актиновыми филаментами, высвобождая миозин для следующего сокращения.
Синтез ДНК и РНК
Во время синтеза ДНК рибонуклеотидредуктаза (RNR) восстанавливает сахарный остаток из рибонуклеозиддифосфатов с образованием дезоксирибонуклеозиддифосфатов, таких как dADP.
Таким образом, регуляция RNR помогает поддерживать баланс дезоксинуклеотидов (dNTP) в клетке.Низкие концентрации dNTP ингибируют синтез и репарацию ДНК, в то время как высокие уровни обладают мутагенным действием, поскольку ДНК-полимераза имеет тенденцию добавлять неправильный dNTP во время синтеза ДНК.
Аденозин из АТФ является строительным блоком РНК и непосредственно добавляется к молекулам РНК во время синтеза РНК полимеразами РНК. Удаление пирофосфата обеспечивает энергию, необходимую для этой реакции.
Сводка
АТФ — сложная молекула, которая служит энергетическим пакетом для тысяч реакций, протекающих в клетках большинства организмов.Помимо человека, микроорганизмы также полагаются на АТФ для удовлетворения своих энергетических потребностей.
АТФ — это высокоэффективная молекулярная машина с быстрым оборотом энергии, что делает ее пригодной для удовлетворения меняющихся энергетических потребностей организма. Молекула АТФ имеет более 500 атомных единиц массы (AMU).
Даже когда эволюционисты задаются вопросом о жизни до появления сложной молекулы АТФ и альтернатив АТФ, в настоящее время не существует другого источника энергии, который мог бы точно отвечать на энергетические потребности клетки и выполнять ее важные процессы.
Список литературы
- http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2877495/
- http://hyperphysics.phy-astr.gsu.edu/hbase/biology/actran.html
- www.chm.bris.ac.uk/motm/atp/atp1.htm
- http://www.trueorigin.org/atp.php
Дополнительная литература
ATP Synthase — обзор
C F
0 F 1 -ATPaseF 0 F 1 -ATPase играет фундаментальную роль в поддержании гомеостаза pH.Функционально этот мультисубъединичный фермент организован в два отдельных, но физически связанных домена; каталитическая часть (F 1 ) является цитоплазматической и включает субъединицы α, B, γ, δ и ε, в то время как интегральный мембранный домен (F 0 ), включая субъединицы a, b и c, функционирует как мембранный канал для транслокации протонов (Sebald et al. , 1982). Функция цитоплазматического домена состоит в том, чтобы катализировать синтез АТФ, когда протоны перемещаются извне клетки в цитоплазму, через мембраносвязанный домен, или гидролизовать АТФ, когда протоны перемещаются из клетки.
Роль F 0 F 1 -АТФазы в организмах, способных к окислительному фосфорилированию, заключается в аэробном синтезе АТФ в результате прохождения протонов в клетку и в создании протонодвижущей силы (PMF) анаэробно, посредством изгнание протонов. Как следствие последнего механизма, считается, что F 0 F 1 -АТФаза может увеличивать внутриклеточный pH в ситуациях, когда он становится подкисленным. Для многих бактерий данные об активности демонстрируют, что снижение внутриклеточного pH сопровождается индукцией F 0 F 1 -АТФазы (Koebmann et al., 2000; Kuhnert and Quivey, 2003; Kullen and Klaenhammer, 1999), а у ряда видов бактерий, включая Lactobacillus acidophilus (Kullen and Klaenhammer, 1999), S . mutans (Kuhnert et al. , 2004) и S . pneumoniae (Martin-Galiano et al. , 2001) транскрипция оперона F 0 F 1 индуцируется воздействием низкого pH. Присущая кислотостойкость различных бактерий связана как с уровнями F 0 F 1 -АТФазы, так и с оптимумом pH ферментов.Ясно, что организмы, устойчивые к кислотам от природы, обладают F 0 F 1 -АТФаз с более низким оптимумом pH (Sturr and Marquis, 1992; Martin-Galiano et al. , 2001).
Анализ роли F 0 F 1 -АТФазы в устойчивости к кислоте ограничен тем фактом, что эта система необходима для жизни многих видов бактерий (Koebmann et al. , 2000). Нам не удалось создать чистую делецию генов, кодирующих систему в L . monocytogenes (неопубликованные данные). Однако исследования двумерного гель-электрофореза показали, что листериальная субъединица F 0 F 1 -АТФазы индуцируется в результате воздействия слабой кислотной обработки (Phan-Thanh and Mahouin, 1999). Введение DCCD, ингибитора АТФазы, продемонстрировало, что АТФаза участвует в толерантности к кислоте и ATR (Datta and Benjamin, 1997). Кроме того, мы создали мутант с частичной вставкой в F 0 F 1 -ATPase в L . monocytogenes , которые не нарушают физическую форму. Этот мутант продемонстрировал, что F 0 F 1 -АТФаза L . monocytogenes участвует в индукции ATR у этой бактерии (Cotter et al. , 2000).
энергетических путей | 3 первичных энергетических пути в теле
Все мы знаем, что человеческому организму нужна энергия для функционирования, но откуда эта энергия берется? В конечном счете, энергия, которая заставляет нас двигаться, исходит от пищи, которую мы едим.Однако мы не можем использовать энергию непосредственно из пищи — сначала ее нужно преобразовать в аденозинтрифосфат, или АТФ, форму химической энергии, которую можно сразу использовать для всех функций клетки. Тело действительно хранит минимальное количество АТФ в мышцах, но большая часть синтезируется из продуктов, которые мы едим.
Пища состоит из углеводов, жиров и белков, и эти питательные вещества расщепляются на простейшие формы (глюкоза, жирные кислоты и аминокислоты) во время пищеварения. Как только эти питательные вещества расщепляются, они транспортируются через кровь для использования в метаболических путях или сохраняются для дальнейшего использования.
Поскольку мы не храним значительное количество АТФ и нуждаемся в постоянном снабжении, его необходимо постоянно ресинтезировать. Это происходит несколькими способами с использованием одной из трех энергосистем:
- Фосфаген (непосредственный источник)
- Анаэробный (несколько медленный, использует углеводы)
- Аэробика (медленная, использует углеводы или жиры)
Фосфаген
Эта система использует креатинфосфат (CP) и имеет очень высокую скорость производства АТФ.Креатинфосфат используется для восстановления АТФ после его расщепления с целью высвобождения его энергии. Общее количество ЦП и АТФ, хранящихся в мышцах, невелико, поэтому энергия, доступная для мышечного сокращения, ограничена. Однако он доступен мгновенно и необходим в начале активности, а также во время краткосрочных высокоинтенсивных занятий продолжительностью от 1 до 30 секунд, таких как спринт, поднятие тяжестей или метание мяча.
Анаэробный гликолиз
Анаэробный гликолиз не требует кислорода и использует энергию глюкозы для образования АТФ.Этот путь происходит в цитоплазме и расщепляет глюкозу на более простой компонент, называемый пируватом. В качестве промежуточного звена между фосфагеном и аэробной системой анаэробный гликолиз может довольно быстро производить АТФ для использования во время деятельности, требующей больших всплесков энергии в течение несколько более длительных периодов времени (максимум от 30 секунд до трех минут или во время тренировок на выносливость до достижения устойчивого состояния. достигнуто).
Аэробный гликолиз
Этот путь требует кислорода для производства АТФ, потому что углеводы и жиры сжигаются только в присутствии кислорода.Этот путь происходит в митохондриях клетки и используется для деятельности, требующей устойчивого производства энергии. Аэробный гликолиз имеет медленную скорость производства АТФ и преимущественно используется во время более продолжительных и низкоинтенсивных занятий после того, как фосфагеновая и анаэробная системы утомились.
Важно помнить, что все три эти системы способствуют удовлетворению энергетических потребностей организма во время физической активности. Эти системы не работают независимо друг от друга, а доминируют в разное время, в зависимости от продолжительности и интенсивности активности.
Аденозинтрифосфат (АТФ) биологи считают энергетической валютой жизни. Это высокоэнергетическая молекула, которая накапливает энергию, необходимую нам для того, чтобы делать практически все, что мы делаем. Он присутствует в цитоплазме и нуклеоплазме каждой клетки, и практически все физиологические механизмы, требующие энергии для работы, получают его непосредственно из хранимого АТФ. (Гайтон) Поскольку пища в клетках постепенно окисляется, высвободившаяся энергия используется для переформирования АТФ, так что клетка всегда поддерживает запас этой важной молекулы.Карп приводит оценку, согласно которой в организме человека ежедневно образуется более 2 x 10 26 молекул или> 160 кг АТФ! АТФ примечателен своей способностью вступать во многие сопряженные реакции, как реакции с пищей для извлечения энергии, так и реакции других физиологических процессов, обеспечивающие их энергию. В системах животных АТФ может быть синтезирован в процессе гликолиза, при котором происходит чистое производство двух молекул АТФ в цикле. Этот гликолиз является важным этапом анаэробного дыхания.Для аэробного дыхания гликолиз также является источником АТФ, но более продуктивный процесс в крошечных энергетических фабриках, называемых митохондриями, играет важную роль в производстве АТФ. Структура АТФ имеет упорядоченное углеродное соединение в качестве основы, но действительно важной частью является фосфорная часть — трифосфат. Три группы фосфора связаны друг с другом атомами кислорода, и есть также боковые атомы кислорода, связанные с атомами фосфора.В нормальных условиях в организме каждый из этих атомов кислорода имеет отрицательный заряд и поэтому отталкивается друг от друга. Эти сгруппированные отрицательные заряды хотят убежать — убежать друг от друга, поэтому здесь много потенциальной энергии. Если вы удалите только одну из этих фосфатных групп с конца, так что останется только две фосфатные группы, молекула станет намного счастливее. Это преобразование из АТФ в АДФ является чрезвычайно важной реакцией для обеспечения энергией жизненных процессов.Просто разрыва одной связи с сопутствующей перегруппировкой достаточно, чтобы высвободить около 7,3 килокалорий на моль = 30,6 кДж / моль. Это примерно то же самое, что и энергия одного арахиса. Живые существа могут использовать АТФ как батарею. АТФ может приводить в действие необходимые реакции, теряя одну из своих фосфорных групп для образования АДФ, но вы можете использовать энергию пищи в митохондриях, чтобы преобразовать АДФ обратно в АТФ, чтобы энергия снова стала доступной для выполнения необходимой работы. В растениях энергия солнечного света может использоваться для преобразования менее активного соединения обратно в высокоэнергетическую форму.Что касается животных, вы используете энергию своих высокоэнергетических молекул-аккумуляторов, чтобы делать то, что вам нужно, чтобы оставаться в живых, а затем вы «перезаряжаете» их, чтобы вернуть их в высокоэнергетическое состояние. Окисление глюкозы происходит в цикле, называемом циклом TCA или циклом Кребса в эукариотических клетках, чтобы обеспечить энергию для преобразования ADP в ATP. | Индекс Концепции второго закона Ссылка Karp |
АТФ-синтаза типа III представляет собой димер с отклонением симметрии, который вызывает искривление мембраны за счет тетрамеризации
Определение структуры и 9 новых идентифицированных элементов
Чтобы охарактеризовать АТФ-синтазу типа III, мы солюбилизировали митохондриальные мембраны дигитонином, и начальные анализы с использованием градиентной седиментации и PAGE с голубым естественным веществом подтвердили присутствие высокомолекулярных частиц (дополнительный рис.1), что соответствует предыдущим результатам 26 . Комплексы АТФ-синтазы были дополнительно очищены и подвергнуты крио-ЭМ-анализу. Трехмерная классификация частиц АТФ-синтазы выявила две популяции, соответствующие димеру и тетрамеру АТФ-синтазы. Используя маскированные уточнения, разрешение различных областей достигло 2,5–3,1 Å (дополнительные рисунки 2 и 3a – e и дополнительная таблица 1), что позволило моделировать de novo. Уточнение до разрешения 2,7 Å позволило построить димер АТФ-синтазы.Тетрамер был уточнен до разрешения 3,3 Å, а область мембраны, состоящая из взаимодействующих субкомплексов F o , была дополнительно улучшена до разрешения 3,1 Å после маскированного уточнения (дополнительные рисунки 2 и 3f). Две копии модели димера АТФ-синтазы были уточнены в карту F o -тетрамер, сгенерировав составную модель тетрамера АТФ-синтазы. Оба мономера в одном и том же вращательном состоянии ингибируются естественным ингибитором IF 1 .Общая структура димера АТФ-синтазы III типа имеет U-образную форму (рис.1a, b и дополнительный фильм 1), при этом другие типы не обнаружены, что согласуется с предыдущими исследованиями с низким разрешением 14,26 . Комплекс ~ 2 MDa состоит из 81 белковой субъединицы, о 9 из которых ранее не сообщалось, и они присвоены непосредственно из нашей карты плотности крио-ЭМ (дополнительный рисунок 4 и дополнительная таблица 2). Далее мы идентифицировали плотность в центральном стержне, соответствующую субъединице-ε, которая также не была обнаружена в предыдущем масс-спектрометрическом анализе 26 (дополнительные фиг.4 и 9а).
Рис. 1: Структура димера АТФ-синтазы типа III со связанными нативными липидами.a Карта плотности крио-ЭМ с фильтром местного разрешения димера АТФ-синтазы с детергентной лентой. b Составная модель димера АТФ-синтазы с окрашенными метками субъединиц. Черные окна выделяют области для просмотра крупным планом на панелях d и f. c Крио-ЭМ карта плотности для типа III F o — область света, окрашенная как в b . d Увеличенный вид F o -крыльевой субъединицы ATPTT1, показывающий связанный кофактор NAD. e Кардиолипины секвестрированы в подкомплексе F o . CDL m соответствует липидам листочков матрикса, CDL -1 соответствует липидам листочков матрикса. f F o Полость простирается к c-образному кольцу. Карта плотности крио-ЭМ раскрашена субъединицами, смоделированные липиды показаны в виде шариков-палочек. Немоделированные объекты карты плотности липидов окрашены в белый цвет.
Общий размер димера АТФ-синтазы типа III существенно больше, чем у его аналогов.В подкомплексе F o 6 из 7 консервативных субъединиц являются удлиненными, а 13 субъединиц не имеют структурных эквивалентов в других типах АТФ-синтаз (дополнительный рис. 5). Вместе эти специфические элементы добавляют ~ 0,7 МДа к димеру АТФ-синтазы типа III, удваивая его размер по сравнению с бактериальными аналогами. Для консервативных субъединиц мы приняли номенклатуру дрожжей 19 , а специфические субъединицы типа III названы ATPTT1-13 в соответствии с убывающей молекулярной массой, как ранее предлагалось 21,27 (дополнительная таблица 2).
Специфические субъединицы типа III распределены между матриксом, мембраной и областями просвета (рис. 1a, b и дополнительный рис. 5). В частности, имеется расширение в области просвета, где белки F o образуют область просвета размером 64 на 160 Å F o (рис. 1c). Следовательно, поверхность раздела мономеров, обращенных друг к другу, изменяется, и формируется другой тип режима димеризации со сложными взаимодействиями между мономерами (дополнительный рис. 6). Как показано на боковом смещении периферических стеблей и консервативных субъединиц (дополнительный рис.7), он существенно отличается от АТФ-синтаз дрожжей, млекопитающих и водорослей 19,20,28 . Специфические субъединицы на измененной взаимодействующей поверхности стабильно связывают два мономера вместе параллельно друг другу с небольшой индукцией кривизны мембраны. Это отличается от преобладающей широкоугольной V-образной организации ранее описанных митохондриальных АТФ-синтаз, которые вызывают искривление соседней мембраны (дополнительный рис. 7).
Помимо белковых субъединиц, мы также отнесли в подкомплекс F o 30 кардиолипинов, 6 фосфатидилхолинов, 4 фосфатидилэтаноламинов и 2 молекулы кофермента Q (CoQ) (дополнительный рис.8 и дополнительный фильм 1). Шесть кардиолипинов глубоко встроены в субкомплекс F o , изолированы от основной мембраны и вместо этого действуют как структурные компоненты димерной структуры АТФ-синтазы (Fig. 1e). Они связаны в сайтах, эквивалентных матриксу и просветным листочкам кристальной мембраны, и, вероятно, включаются во время сборки подкомплекса F o . Другой участок с высокой концентрацией нативных липидов был обнаружен вокруг канальной полости, проходящей через периферию субкомплекса F o по направлению к с-кольцу (рис.1е). Эта полость F o , вероятно, обеспечивает доступ для больших объемов мембранных липидов к с-кольцу, создавая запечатанный светом матричный протонный полуканал, необходимый для перемещения протонов.
Характеристики вновь идентифицированных субъединиц
Среди 13 специфических субъединиц типа III три просветных ATPTT5, ATPTT8 и ATPTT9 имеют домены типа «спираль-спираль-спираль-спираль-спираль» (CHCHD). ATPTT5 и ATPTT8 содержат CX 9 C / CX 10 C, а ATPTT9 содержит мотивы CX 3 C / CX 5 C (дополнительный рис.9б). На стороне матрикса несколько заметных субъединиц принимают глобулярные складки, особенно ATPTT1-3 и ATPTT11 (Supplementary Fig. 9c).
Крылышко F o зажимает с-кольцо и образовано субъединицей ATPTT1 массой 55 кДа (рис. 1d). Его третичная складка хорошо сочетается с сульфидом митохондрий человека: хинон оксидоредуктазой (дополнительный рис. 9d), которая использует флавинадениндинуклеотид (FAD) для своей активности 29 . Однако в ATPTT1 связывающий карман, образованный двумя складками Россмана, содержит кофактор никотинамидадениндинуклеотид (НАД).Никотинамидная группа НАД находится в непосредственной близости от Cys205 (дополнительный рис. 9e), который потенциально может быть активным сайтом ATPTT1. Человеческий сульфид: хинон оксидоредуктаза является интегральным мембранным белком, и ATPTT1 располагается близко к листку матрикса кристальной мембраны с несколькими соседними липидоподобными плотностными характеристиками, разрешенными на карте плотности крио-ЭМ (дополнительный рис. 9f). Таким образом, ATPTT1 может встречаться с встроенными в мембрану акцепторами электронов, такими как CoQ, аналогично человеческому ферменту 29 .
Дальнейший анализ индивидуальных субъединиц F o показал, что C-концевой домен ATPTT3 принимает глобулярную складку, подобную домену межмембранного пространства субъединицы TIM21 импортирующей транслоказы внутренней мембраны митохондрий (Fig. 1b and Supplementary Fig. 9h). Связанная белковая субъединица ATPTT11 принимает складку ацильного белка-носителя, однако конъюгированный фосфопантетеин не обнаружен (рис. 1b и дополнительный рис. 9i). Неожиданно мы обнаружили молекулу Mg-ATP, связанную как структурный компонент F o на стороне матрикса, служащий центром взаимодействий, соединяющих субъединицы a , k , ATPTT3 и ATPTT4 (дополнительный рис.9к). Насколько нам известно, это первое наблюдение нуклеотидного мостика F o -субъединиц.
Добавление специфических белковых субъединиц типа III влияет на архитектуру и топологию консервативных субъединиц. Например, трансмембранная спираль субъединицы i / j наклонена в почти горизонтальное положение в результате взаимодействия ATPTT7, при этом сохраняется интерфейс с субъединицей 8. Субъединица b вносит свою N-концевую спираль в структуру периферической ножки в дополнение к канонической С-концевой спирали (дополнительный рис.12а). С-концевое удлинение субъединицы k складывается в четырехспиральный пучок прямо под с-образным кольцом, закрывающим его внутреннюю часть (рис. 1c и 4a).
АТФ-синтаза типа III образует димер с отклоненной симметрией с закрепленным IF
1Во время обработки изображений мы заметили, что качество кажущейся двукратной симметричной плотности в центральной области между мономерами не соответствовало общей карте качественный. Эта область имела двулопастную форму, отходящую от заполненной липидами центральной полости на матричной стороне подкомплекса F o .Чтобы улучшить карту, выровненные частицы были подвергнуты трехмерной классификации, в результате чего они были распределены на два основных класса с одинаковым количеством частиц, связанных поворотом на 180 ° (дополнительный рис. 2c и «Методы»).
Дальнейшая обработка позволила идентифицировать вовлеченные белки по плотности боковых цепей и привела к модели трех белковых субъединиц, сгруппированных в этой области. Заметно выделяется ATPTT2, наблюдаемый только в виде единственной копии в димере.Это представляет собой единственную субстехиометрическую субъединицу F o , о которой сообщается в любом димере АТФ-синтазы. ATPTT2 содержит ядро с консервативной последовательностью, принимающее классическую α / β гидролазную складку, хотя и с неактивной каталитической триадой (дополнительный рис. 9g, j). Гомологи ATPTT2 консервативны у инфузорий, указывая на то, что ATPTT2 является подлинной особенностью АТФ-синтазы типа III (дополнительный рис. 10a). Сайт связывания для ATPTT2 имеет форму колыбели с субъединицами f и ATPTT13, выстилающими обращенный к мембране интерфейсом, и субъединицами b , d и ATPTT4, составляющими стороны (рис.2а).
Рис. 2: Связывание ATPTT2 приводит к нарушению симметрии АТФ-синтазы.a Обзор, показывающий расположение субстехиометрического ATPTT2 с его взаимодействующими субъединицами. Увеличенный вид показывает сайт связывания ATPTT2 в форме колыбели (цветные поверхности). b Субъединицы с отклоненной симметрией по отношению к ATPTT2. Нижняя панель: суперпозиции субъединиц двух мономеров имеют различия.
Ассоциация субъединицы ATPTT2 вызывает локальные отклонения от симметрии димера, тогда как основная часть подкомплекса F o подчиняется симметричной архитектуре.Сравнение белковых субъединиц, взаимодействующих с ATPTT2 в субкомплексе F o , показывает конформационные различия между аналогами (рис. 2b и дополнительный ролик 1). Субъединица f (остатки 2–27) обнаруживает несоответствие симметрии, принимая разные складки в двух копиях. ATPTT4 C-концевые остатки 235-268 различаются по структуре с одной копией, оборачивающейся вокруг расширенной C-концевой петли ATPTT2, тогда как вторая копия выступает прочь. ATPTT12 (5–29) распространяется в противоположных направлениях между двумя копиями, поскольку одна копия взаимодействует с C-концевой петлей ATPTT2, обеспечивая направление просвета, тогда как вторая направлена в сторону матрицы.Копии ATPTT13 (21–41) по-разному взаимодействуют с ATPTT2. Таким образом, субстехиометрическое связывание ATPTT2 индуцирует различные конформации в аналогах из двух мономеров, что приводит к общему отклонению симметрии димера АТФ-синтазы типа III.
Кроме того, ATPTT2 развил уникальную функцию в качестве платформы для связывания природного ингибитора IF 1 способом, который ингибирует оба мономера в димере, что ранее не наблюдалось. Обычно IF 1 блокирует вращательное движение через свой N-концевой домен, тогда как C-концевой домен отвечает за его димеризацию 30,31 .В нашей структуре каноническая ингибирующая спираль IF 1 связана с β DP -субъединицей подкомплекса F 1 (дополнительный рис. 11a, b). Он связан с доменом димеризации С-конца через гибкий (немоделированный) линкер (дополнительный рис. 11c). На С-конце две спирали каждой копии IF 1 образуют пучок из четырех спиралей, опосредованный ATPTT2 (рис. 3a). Контакты включают гидрофобные и ионные взаимодействия (рис. 3b, c и дополнительный рис.10б). В целом димер IF 1 типа III отличается от аналога у млекопитающих, который ингибирует мономеры соседних димеров, а не одного и того же димера (рис. 3d, e).
Рис. 3: ATPTT2 закрепляет IF 1 на мембране.a ATPTT2 взаимодействует с С-концевыми доменами IF 1 , которые димеризуются через их спиральные шпильки. Крупным планом показан интерфейс взаимодействия между ATPTT2 и С-концевым димером IF 1 . b IF 1 C-концы взаимодействуют посредством электростатических взаимодействий на периферии, а c образуют плотное гидрофобное ядро. d Димер АТФ-синтазы типа III со связанным интрадимерным IF 1 . Элементы, образующие C-концевой димер, взаимодействуют с ATPTT2 и F 1 , указаны на правой панели. e Тетрамер АТФ-синтазы свиньи типа I (PDB 6J5K) [https://www.rcsb.org/structure/6J5K] со связанным интердимерным IF 1 .
Роль субъединицы-
a и субъединиц типа III в димеризации АТФ-синтазыСообщалось, что конфигурация димера АТФ-синтазы зависит от конкретных субъединиц, образующих гидрофобный клин, который накладывает локальную кривизну на мембрану 16,32, 33,34 .Поскольку предыдущая работа показала, что субъединица и образует димерные контакты 19 , мы соответствующим образом сфокусировали наш анализ. Субъединица и представляет собой трансмембранный белок, критический для транслокации протонов через F o -подкомплекс 35 . В соответствии с предыдущими исследованиями 4,5,19,36 , в нашей структуре он имеет складку из шести спиралей с двумя горизонтальными спиралями H5 a и H6 a , контактирующими с c-кольцом, в то время как остальная часть белок взаимодействует с консервативными субъединицами b , d , f , i / j , k , 8, а неконсервативное взаимодействие с субъединицей b ‘(рис.4a и дополнительный рис. 12b). Однако димерные контакты устанавливаются гетеротипично между остатками 362-364 в петле, соединяющей спирали H5 a и H6 a в одной субъединице — , копия и N-концевое удлинение на другой (рис. 4b).
Фиг. 4: Взаимодействия субъединицы и во всем подкомплексе F o .a Subunit- a каноническое шестиспиральное ядро, окруженное консервативными субъединицами b, d, f, i / j, k и 8.Он образует неканоническое взаимодействие с субъединицей b ‘. С-образное кольцо серое. Окно соответствует области, показанной на крупном плане b . b Субъединица a образует димерный интерфейс с субъединицами a ‘, f ‘, ATPTT5-6 ‘, с фосфатидилэтаноламином, связанным близко к сайту взаимодействия. c Крупный план субъединицы a , демонстрирующий шестиспиральную складку сердцевины (h2-H6 a ) с N- и C-концевыми расширениями a, помеченными a. d Обзор плотности крио-ЭМ подкомплекса F o , показывающий периферическое расположение субъединицы , удлинение N-конца и взаимодействующие субъединицы (окрашенные субъединицы, остальные прозрачные серые). На виде крупным планом показана субъединица , выступающая на N-конце , из спиралей из других F o -субъединиц.
Кроме того, субъединица АТФ-синтазы типа III-а имеет N- и С-концевые удлинения из 170 и 38 аминокислот, соответственно. Общая длина в 446 аминокислот делает эту субъединицу, безусловно, наибольшей — — гомолог , описанный в любой АТФ-синтазе F-типа (рис.4в). N-концевое удлинение сначала складывается в пучок из четырех спиралей, который взаимодействует с субъединицами , /, и ATPTT5-8 на периферии просветной области F o (рис. ось симметрии подкомплекса F o , взаимодействующего с зависимыми от симметрии субъединицами a ‘, ATPTT5’, 7’– 9 ‘, 12’ (дополнительный рис. 12c). Таким образом, субъединица и связывает вместе весь F o -подкомплекс вместе в жесткую структуру и выполняет центральную функцию каркаса окружающих субъединиц, чтобы позиционировать их для взаимодействия.
Дополнительные мотивы димеризации, специфичные для типа III, были идентифицированы в нашей структуре на всем протяжении интерфейса (дополнительный рис. 6). Суммарная площадь поверхности между мономерами превышает 16000 Å 2 , что как минимум в четыре раза больше, чем для других охарактеризованных типов. Мы обнаружили контакты в мембране (субъединицы a , b, и f ), матрице (субъединица f и ATPTT13) и просвете (субъединицы a , f , k , ATPTT5- 9, ATPTT12) (рис.5a и дополнительный рис. 6 и 12d – j). Помимо гомотипических контактов вдоль оси симметрии, он дополнительно поддерживается серией обширных гетеротипических контактов, расположенных на расстоянии до ~ 60 Å от оси димеризации (рис. 5a, b). Гетеротипические контакты включают молекулу кардиолипина, связанную внутри мостиковой субъединицы c-кольца — , k, и ATPTT6 ‘. Гомотипические контакты субъединицы b также включают связанные кардиолипины (рис. 5c), тогда как интерфейс субъединицы f включает только контакты белков (рис.5г). Следовательно, структура димера АТФ-синтазы типа III содержит, безусловно, самый обширный интерфейс димеров, наблюдаемый в любом описанном димере АТФ-синтазы.
Рис. 5: Интерфейсы димеров разбросаны по субкомплексу F o .a Обзор структуры димера АТФ-синтазы с субъединицами F o , участвующими в интерфейсах димера, показанными соответствующими цветами. Окна обозначают области, показанные на панелях b-d крупным планом. b Расширенный C-концевой домен субъединицы k участвует в нескольких взаимодействиях интерфейса димера ниже c-кольца с субъединицами F o ATPTT5-8 ‘.Связанный кардиолипин (CDL, красный) опосредует взаимодействия между субъединицей k и ATPTT6 ‘. c Субъединицы b и b ‘образуют гидрофобный димерный интерфейс с кардиолипинами (CDL, красный). Плотность кардиолипина вырезана на 2,6 Å вокруг атомов на карте, отфильтрованной с локальным разрешением F o -димер. d Субъединицы f и f ‘образуют димерную границу раздела за счет электростатических, полярных и гидрофобных взаимодействий.
АТФ-синтаза типа III собирается в тетрамеры через субъединицу-
a и участки контакта просветаПоскольку АТФ-синтаза типа III образует U-образный димер, который не вызывает кривизну мембраны, мы дополнительно исследовали, как димеры собираются в высшие олигомеры посредством с упором на тетрамерные частицы.Мы использовали замаскированное уточнение, чтобы получить карту с разрешением 3,1 Å области тетрамерной мембраны, состоящей из двух димерных единиц (рис. 6a и дополнительные рис. 2c и 3f). Чтобы интерпретировать границу раздела между двумя димерами, мы приспособили модели димеров и уточнили их в карту плотности тетрамера F o (рис. 6b и дополнительный рис. 13a). Все плотности белка можно объяснить субъединицами моделей димера, и, по-видимому, не требуется дополнительных белковых фрагментов, чтобы удерживать тетрамер вместе.Тетрамерная модель соответствует ранее описанным средним субтомограммам инфузорий АТФ-синтазы 14 (дополнительный рис. 13b), предполагая, что тетрамер является представителем нативной конфигурации АТФ-синтазы типа III.
Рис. 6. Структура тетрамера АТФ-синтазы III типа.a Крио-ЭМ карта плотности АТФ-синтазы F o тетрамера с фильтром местного разрешения. Димер 1 окрашен в серый цвет, а димер 2 — в светло-серый. b Модель тетрамера АТФ-синтазы.Прямоугольники указывают границы взаимодействия белков и липидов. c Димеры АТФ-синтазы, расположенные на расстоянии 140 Å внутри тетрамеров, расположены под углом ~ 11 ° (вид сбоку, слева) и ~ 3 ° (вид сбоку, справа), создавая кривизну мембраны.
В тетрамере димеры АТФ-синтазы расположены на расстоянии 140 Å от центра к центру с углом ~ 11 ° между осями димеров, соединяя подкомплексы F o вместе (Рис. 6c, левая панель). Кроме того, вдоль перпендикулярной оси, параллельной плоскости мембраны, димеры располагаются под углом ~ 3 ° (рис.6в, правая панель). Такое угловое расположение вызывает искривление окружающей мембраны в форме правой спирали, что также очевидно из плотности детергента / мембраны, окружающей тетрамер АТФ-синтазы (дополнительный рис. 13c). Применение многочастичного уточняющего анализа тетрамера АТФ синтазы с использованием двух димеров в качестве тел не выявило отчетливых конформационных состояний, но вместо этого выявило непрерывные движения в сложном ландшафте движений (Supplementary Fig. 14a). Анализ показал, что в собственном движении преобладают комбинации наклонных и вращательных движений одного димера относительно другого (дополнительный рис.14б – г). Это согласуется с предыдущими наблюдениями 14 и отражает потребность в пластичности олигомеров АТФ синтазы типа III во время мембранных канальцев.
Взаимодействия белок-белок, удерживающие два димера вместе, можно разделить на два типа интерфейса: прямые взаимодействия между субъединицами F o в просвете и взаимодействия, опосредованные липидами (рис. 6b). Поверхность просвета регулируется гомотипическими взаимодействиями между субъединицей i / j и ATPTT6, расположенной в соседних F o -подкомплексах.Расширенная субъединица a N-концевой четырехспиральный пучок позиционирует ATPTT6 с горизонтальной α-спиралью для взаимодействия с субъединицей ATPTT6 в другом димере АТФ-синтазы (рис. 7a). Этот люминальный интерфейс определяется электростатическими взаимодействиями между остатками аргинина и глутамата, а также взаимодействиями стэкинга между аргининами (Рис. 7b). Далее на просветной стороне субъединица i / j копий расположены N-концевой субъединицей , удлинением , чтобы сформировать обширный интерфейс, где остатки Asn207 складываются друг против друга, а остатки Ser173, Lys174 и Ser198 находятся в пределах расстояния. обеспечение полярных взаимодействий между основной и боковой цепями (рис.7а, в).
Рис. 7: Тетрамер АТФ-синтазы типа III взаимодействует через определенные белковые и липидно-опосредованные интерфейсы.a Люминесцентный вид тетрамера. N-концевой четырехспиральный пучок субъединицы a (темно-зеленый) позиционирует субъединицу i / j и ATPTT6 для тетрамерных взаимодействий. Область и стрелка в рамке указывают область и направление взгляда, показанные крупным планом в b , c . b субъединицы ATPTT6 в двух димерах образуют электростатические взаимодействия. c Субъединицы — i / j в интерфейсе образуют полярные взаимодействия. d Субъединицы i / j и ATPTT5 взаимодействуют через связанные мембранные липиды в листке матрикса (черные пунктирные линии) и в листке просвета (серые пунктирные линии). Немоделированная плотность липидов показана прозрачным светло-коричневым цветом.
Второй тип интерфейса включает липиды, связанные между двумя димерами. Наиболее заметным является интерфейс, расположенный между копиями субъединицы i / j и ATPTT5 (рис.6б). Разрыв между субъединицами в подкомплексах F o как раз достаточно широк, чтобы вместить три липида между двумя димерами АТФ-синтазы (рис.


 Рига
Рига д. 1,0 мм
д. 1,0 мм 8.
Линейка измерительная металлическая
8.
Линейка измерительная металлическая 2.
Подъемник канавный передвижной
2.
Подъемник канавный передвижной Предел
измерения 0-6 м/сек2
Предел
измерения 0-6 м/сек2 д. 0,2 кгс/см2 Предел измерения давления 0,3-0,9
МПа (3,0÷9,0 кгс/см2)
д. 0,2 кгс/см2 Предел измерения давления 0,3-0,9
МПа (3,0÷9,0 кгс/см2)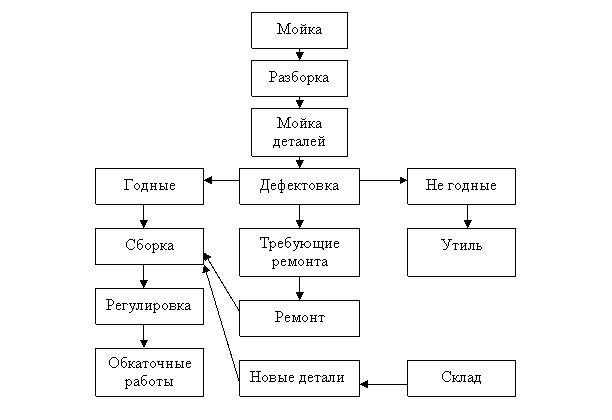 д.
1,0 мм предел измерения 0-300 мм
д.
1,0 мм предел измерения 0-300 мм 11.
Штангенциркуль
11.
Штангенциркуль 1. Комплект ключей динамометрических
1. Комплект ключей динамометрических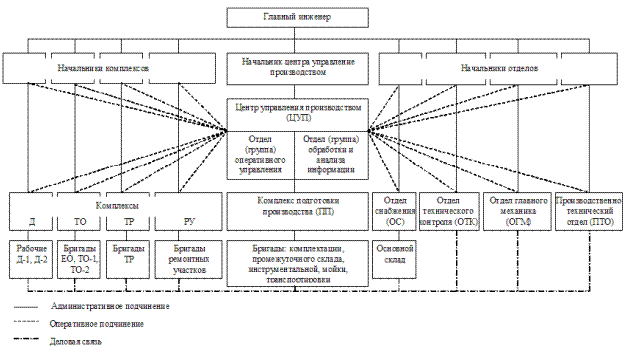
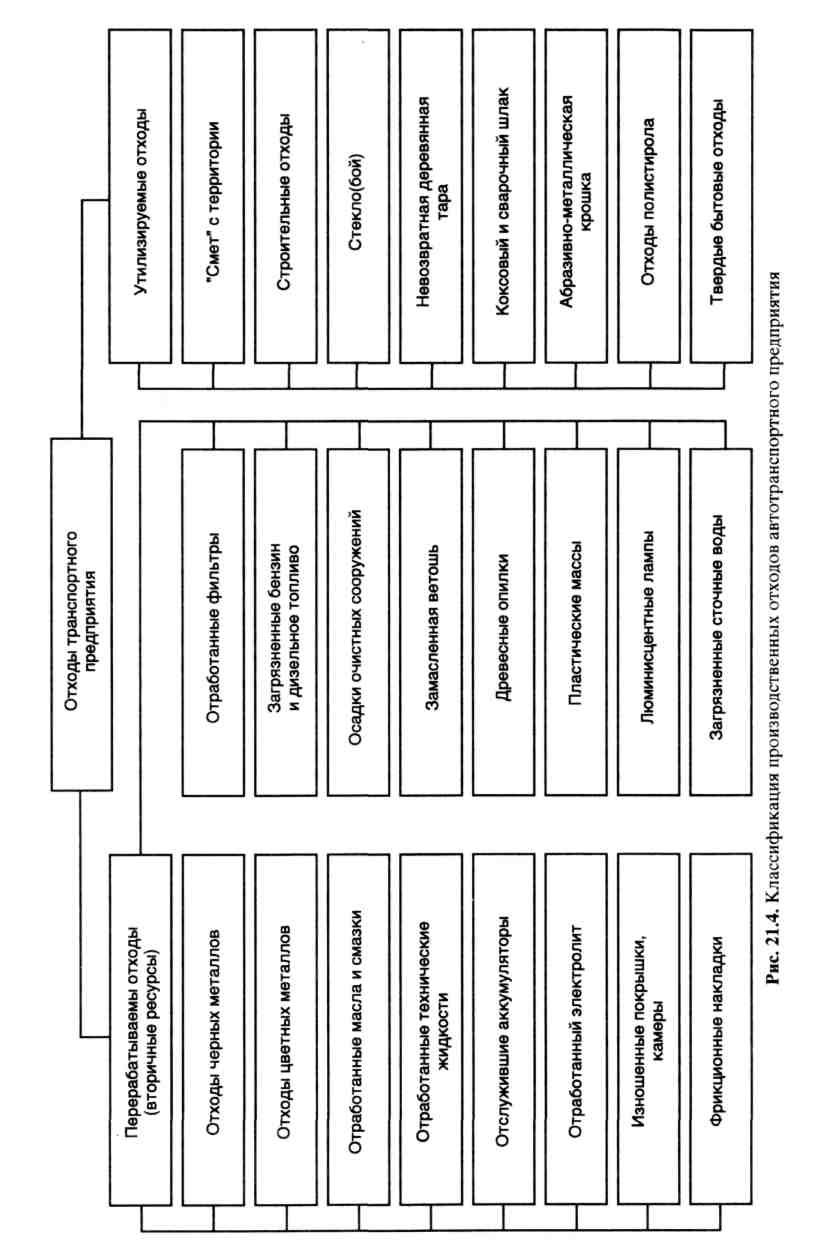 5.
Прибор для определения люфтов трансмиссий
5.
Прибор для определения люфтов трансмиссий д. 0,01 мм
д. 0,01 мм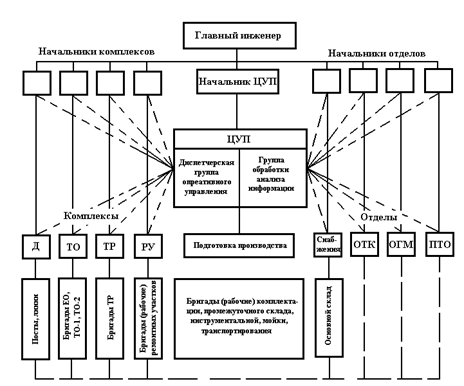 10.
Подъемник канавный передвижной
10.
Подъемник канавный передвижной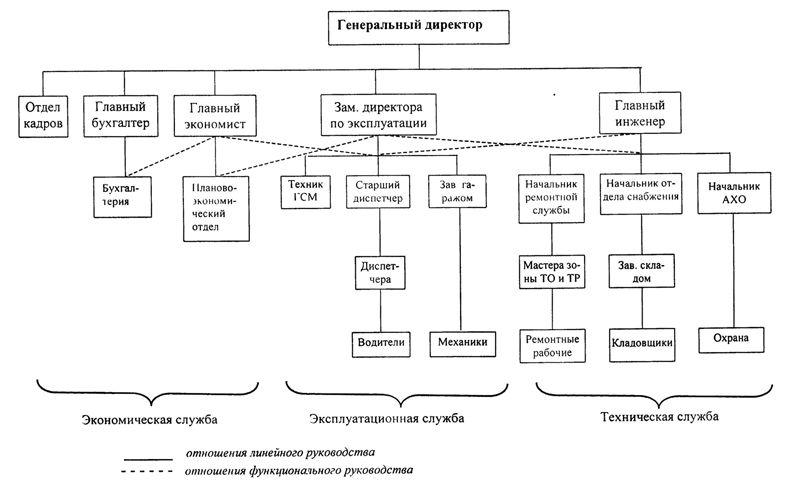 12.
Линейка для проверки схождения колес автомобиля
12.
Линейка для проверки схождения колес автомобиля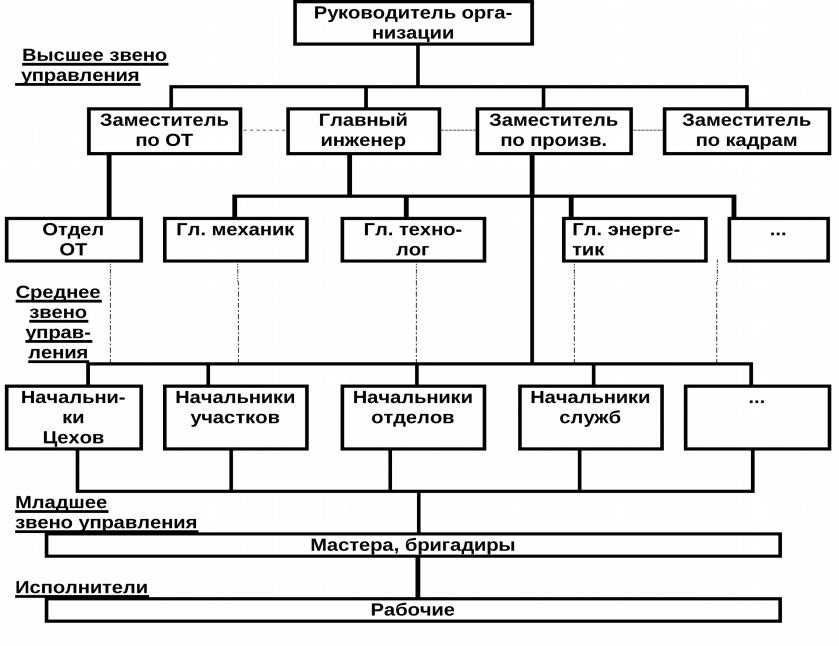 11.
Станок для балансировки колес легковых автомобилей
11.
Станок для балансировки колес легковых автомобилей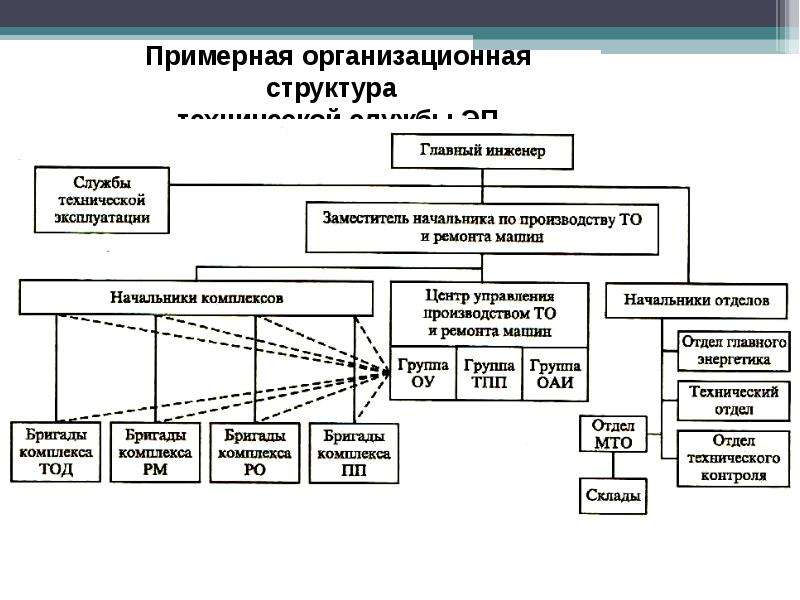
 д. 0,2 кгс/см2
д. 0,2 кгс/см2 20.
Компрессометр для дизельных двигателей
20.
Компрессометр для дизельных двигателей 23.
Измеритель дымности автомобиля
23.
Измеритель дымности автомобиля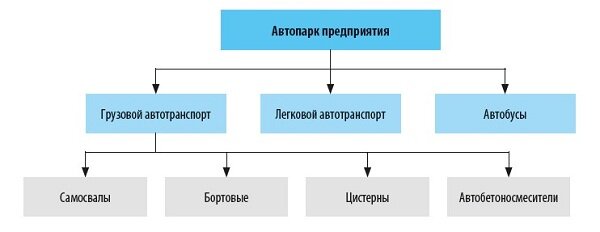 Набор манометров для проверки тормозной системы автопоездов
Набор манометров для проверки тормозной системы автопоездов 27.
Подъемник канавный
27.
Подъемник канавный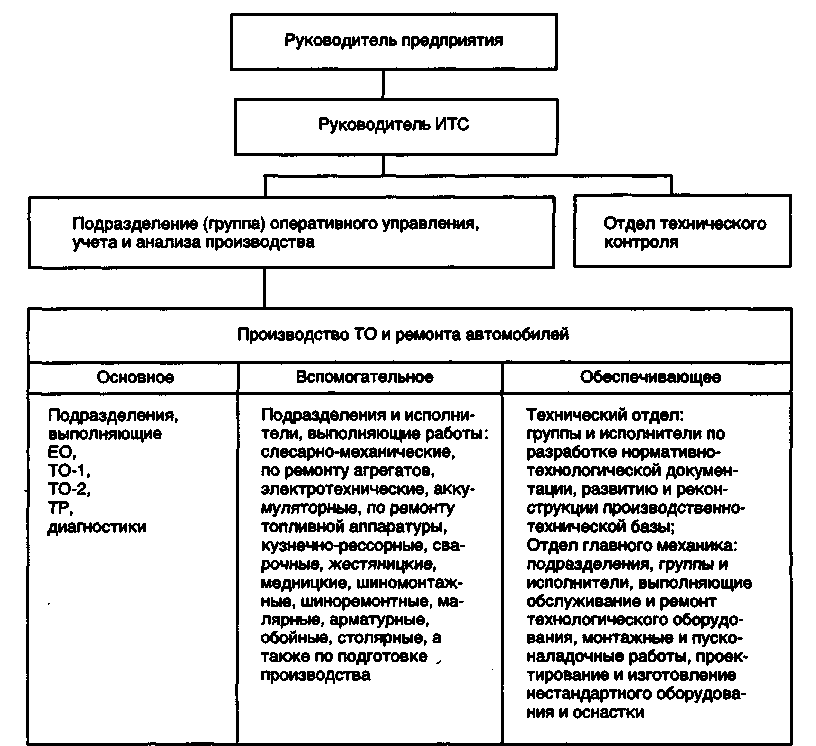 30.
Воздухораздаточная колонка автоматическая
30.
Воздухораздаточная колонка автоматическая 2.
Стенд для проверки тормозов легковых автомобилей
2.
Стенд для проверки тормозов легковых автомобилей 4. Стенд для
проверки установки передних колес
4. Стенд для
проверки установки передних колес 6.
Подъемник канавный передвижной
6.
Подъемник канавный передвижной 8.
Прибор для проверки и регулировки фар
автомобилей
8.
Прибор для проверки и регулировки фар
автомобилей 10.
Прибор для проверки рулевого управления
10.
Прибор для проверки рулевого управления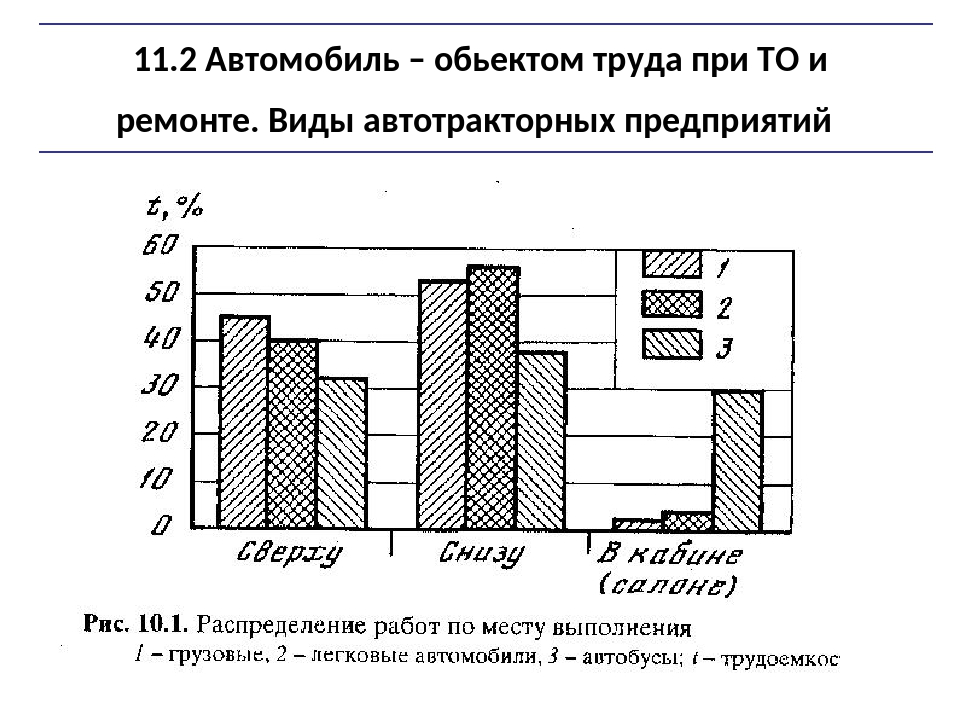 12. Газоанализатор
12. Газоанализатор 13. Измеритель дымности автомобиля
13. Измеритель дымности автомобиля 15.
Уровнемерная трубка (из комплекта приборов Э-401)
15.
Уровнемерная трубка (из комплекта приборов Э-401)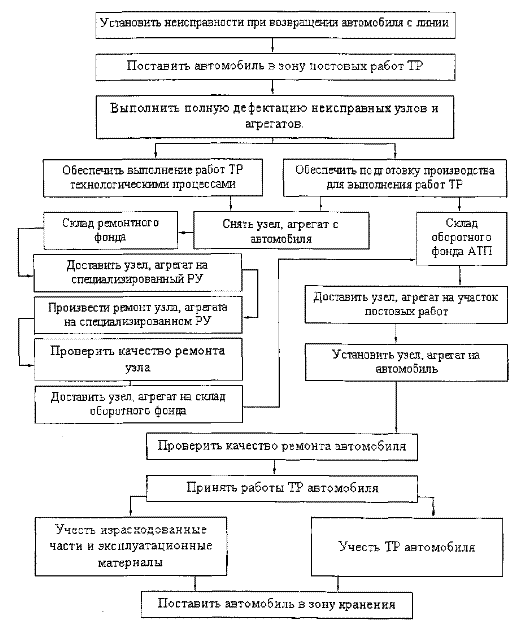 17.
Прибор для проверки свободного и полного хода педалей
17.
Прибор для проверки свободного и полного хода педалей 19.
Прибор для проверки переднего моста автомобилей
19.
Прибор для проверки переднего моста автомобилей д.
1,0мм, предел измерения 0-300 мм
д.
1,0мм, предел измерения 0-300 мм 24. Секундомер
24. Секундомер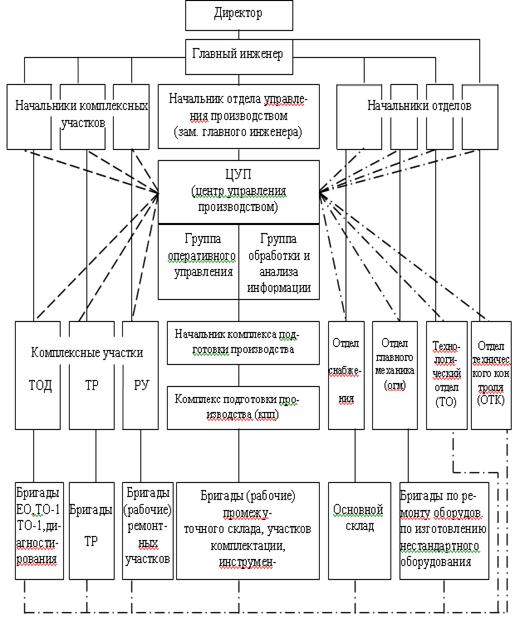 2.
Стенд для проверки тормозов легковых автомобилей
2.
Стенд для проверки тормозов легковых автомобилей